Остеосинтез с наносеребром - RU2557938C2
Код документа: RU2557938C2
Чертежи

























Описание
Область техники, к которой относится изобретение
Настоящее изобретение относится в целом к многофункциональному антибактериальному покрытию, которое состоит из серебра, к имплантатам и/или медицинским инструментам, содержащим такое покрытие, и к способу, а также устройству для получения такого покрытия.
Уровень техники
Известно, что ионы серебра сильно ингибируют рост бактерий и других микроорганизмов. Ионы серебра разрушают важные компоненты клеток микроорганизмов, так чтобы их жизненные функции больше не работали. Серебро проявляет антибактериальную активность широкого спектра и эффективно даже против штаммов, резистентных к антибиотикам. Кроме того, серебро воздействует на многочисленные области внутри бактериальных клеток, уменьшая таким образом вероятность проявления бактериями резистентности любого рода.
В связи с повышением резистентности наиболее патогенных микроорганизмов против обычно используемых антибиотиков в последние годы серебро открыли заново как активное антибактериальное вещество. Действительно, вследствие дезинфицирующей способности серебра его длительное время использовали для гигиенических и медицинских целей.
Например, соединения серебра были основными средствами борьбы против раневой инфекции во время Первой мировой войны до появления антибиотиков. В 1884 году немецкий акушер К.С.Ф.Креде ввел 1%-ный нитрат серебра в качестве глазного раствора для профилактики гонококковой офтальмии у новорожденных, что является, возможно, первым научно зарегистрированным медицинским использованием серебра. Кроме того, крем сульфадиазина серебра представлял собой стандартное антибактериальное средство для лечения тяжелых ожоговых ран и по-прежнему широко используется в ожоговых отделениях.
В настоящее время на рынке доступны многие серебросодержащие продукты, такие как повязки на рану, катетеры и/или опухолевые протезные системы.
Один из известных способов изготовления покрытия основан на способе вакуумного нанесения покрытия, который обеспечивает надежную защиту поверхностей медицинских имплантатов от бактериального инфицирования. Покрытие из чистого серебра наносят способом PVD (физическое осаждение из паровой фазы) с последующим нанесением покрытия из диоксида кремния, осаждаемого способом PECVD (плазмохимическое осаждение из паровой фазы). Толщина покрытия обычно составляет меньше 200 нм.
Осуществление способов PVD и CVD обычно требует применения очень дорогостоящих систем для нанесения покрытий. Кроме того, они являются также энергоемкими вследствие необходимости создания условий высокого вакуума. К тому же, способ PVD является методом «линии прямой видимости», применение которого подразумевает, что на сложные поверхности будет очень трудно наносить покрытие равномерно.
Кроме того, после длительного воздействия серебра или его соединений может развиваться необратимая пигментация кожи и/или глаза, т.е. аргирия или аргироз, обусловленная возможным отложением «избыточного» серебра.
К тому же, повышенными концентрациями серебра могут быть вызваны лейкопении и нервно-мышечные расстройства. В литературе описаны аллергические реакции. Сообщалось, что предшествующие попытки нанесения покрытий при помощи солей серебра или элементарного серебра приводили к случаям значительного повышения концентраций серебра в сыворотке соответствующих пациентов.
Соответственно, цель настоящего изобретения заключается в разработке медицинского изделия, например, выполненного в виде имплантата, содержащего покрытие с улучшенными свойствами.
Предпочтительно, такое покрытие должно быть антибактериальным покрытием, например, на металлических имплантатах.
В частности, должна быть предусмотрена возможность регулирования или адаптации антибактериальной эффективности такого покрытия, например, скорости выщелачивания.
Предпочтительно, таким покрытием на имплантате должно активироваться врастание ткани и/или кости человека.
Изготовление такого покрытия должно быть основано на простой и низкозатратной концепции.
Раскрытие изобретения
Предлагаемое решение задачи неожиданно достигается каждым из объектов соответствующих прилагаемых независимых пунктов формулы изобретения.
Эффективные и/или предпочтительные варианты осуществления или усовершенствования являются объектом соответствующих прилагаемых зависимых пунктов формулы изобретения.
Соответственно, в изобретении предлагается способ обработки поверхности медицинского изделия, в частности металлического медицинского изделия, предпочтительно из небиоразлагаемого материала, включающий следующие стадии:
- получение коллоидно-диспергированной системы,
- обработка медицинского изделия коллоидно-диспергированной системы таким образом, что поверхность медицинского изделия, которое подлежит обработке, погружают в коллоидно-диспергированную систему,
- генерирование, предпочтительно, асимметричной, или симметричной, или сочетания асимметричной и симметричной разности потенциалов цепи переменного тока между медицинским изделием в качестве первого электрода и/или вторым электродом, помещенным в коллоидно-диспергированную систему, для превращения погруженной поверхности в оксидную пленку путем плазменно-электролитического оксидирования, при этом превращенная поверхность частично покрывается островками, образованными коллоидно-диспергированными частицами коллоидно-диспергированной системы.
В изобретении также предлагается медицинское изделие, содержащее,
предпочтительно, небиоразлагаемый металл или металлический сплав с обработанной поверхностью, причем
- обработанная поверхность, по меньшей мере, частично превращена в оксидную пленку посредством плазменно-электролитического оксидирования при использовании коллоидно-диспергированной системы и при этом
- превращенная поверхность частично покрыта островками, образованными коллоидно-диспергированными частицами коллоидно-диспергированной системы.
Пористую оксидную пленку или слой формируют способом плазменного электролитического оксидирования (ПЭО). По способу ПЭО, металлическую основу устанавливают в качестве первого электрода, предпочтительно, как анод, в «электролитической ячейке». Его поверхность превращается в соответствующий оксид металла под воздействием приложенного электрического поля. Оксидная пленка состоит из кристаллических фаз с высокопористой поверхностью и компонентами, полученными как из коллоидно-диспергированной системы, так и из медицинского изделия, например, имплантата, в качестве основы. Это обеспечивается синтезом нанокомпозитных покрытий, образованных частицами оксидов металлов, при осаждении in situ. Частицы наносят на поверхность медицинского изделия при окислении его поверхности. Настоящее изобретение обеспечивает возможность формирования покрытия на любом типе формы медицинского изделия.
Коллоидно-диспергированную систему можно также называть дисперсией. Она представляет собой жидкость, содержащую диспергированные частицы, в частности, коллоидно-диспергированные частицы. Коллоидно-диспергированные частицы характеризуются средним значением диаметра, равным 100 нм или меньше, предпочтительно, равным 50 нм или меньше, наиболее предпочтительно, равным 30 нм или меньше. Указанные частицы называют также наночастицами. Частицы диспергируются, а не растворяются в коллоидно-диспергированной системе.
Предпочтительно, частицы привносят не в виде порошка, обладающего, как правило, широким распределением по размерам. В предпочтительном варианте осуществления изобретения частицы характеризуются узким распределением по размерам с величиной FWHM (полная ширина на половине высоты) <25 нм. Такое распределение по размерам обеспечивает возможность формирования одинаковых островков и повышенную электропроводность дисперсии.
В одном из предпочтительных вариантов осуществления частицы представлены частицами серебра (частицами Ag или наночастицами Ag). Такое наносеребряное покрытие на поверхности медицинского изделия, например, на поверхностях имплантатов, проявляет несколько благоприятных эффектов: снижение бактериальной адгезии и ингибирование роста бактерий. К настоящему времени о механизме резистентности не сообщалось, и он не был обнаружен в отношении воздействия серебра. Поскольку серебро действует скорее как антисептик, чем антибиотик. Такое наносеребряное покрытие обладает замечательными свойствами в аспекте антибактериальной эффективности (даже против мультирезистентных штаммов), адгезии и биосовместимости (в отношении дополнительных эффектов смотрите подробное описание изобретения). Указанный слой, содержащий наносеребро, получают химическим превращением поверхности имплантата, индуцированным посредством плазменного электролитического оксидирования.
В качестве дополнения или альтернативы, данные частицы привносятся апатитовыми частицами, предпочтительно, частицами ГА (гидроксиапатит). Апатит представляет собой, по меньшей мере, один апатит, выбранный из группы, состоящей из гидроксиапатита, Si-замещенного гидроксиапатита, фторапатита и карбонизированных апатитов. По меньшей мере, один атом Са в апатите может быть замещен атомами Mg, Zn, Cu, Na, К и Sr.
Гидроксиапатит улучшает остеокондукцию. Это обеспечивает возможность, например, сильной фиксации имплантата, вставленного в тело человека или животного. Частицы ГА по изобретению также охватывают FA-Si-соединения (Si-замещенный гидроксиапатит). FA-Si-соединение является соединением ГА, в котором, по меньшей мере, одна группа PO43- замещена группой SiO43-. Такое rA-Si-соединение отличается повышенной биосовместимостью.
В качестве следующего дополнения или альтернативы, частицы представлены, по меньшей мере, одним типом частиц, выбранных из группы, состоящей из меди и цинка. Указанный тип частиц также проявляет антибактериальный эффект.
В дополнительном варианте осуществления изобретения, в дисперсии предусмотрена добавка, предпочтительно наноразмерная добавка. Соответственно, частицы содержат добавку, при этом добавка является, по меньшей мере, одним из материалов, выбранным из группы, состоящей из металлов, оксидов, земельных минералов и фосфатов. Некоторые типичные примеры представляют собой оксид магния, фосфат кальция, α-ТКФ (трикальцийфосфат), жидкое натриевое стекло, жидкое калиевое стекло и/или кремний. Жидкое стекло является эффективным в отношении минерализации костей. Добавку растворяют или диспергируют в коллоидно-диспергированной системе. Следует подчеркнуть, что упомянутые выше добавки носят иллюстративный характер и не ограничиваются приведенным перечнем.
Коллоидно-диспергированную систему можно получать на основе жидкости любого рода, в частности, жидкости с низкой или нулевой электропроводностью. В одном из вариантов осуществления изобретения коллоидно-диспергированную систему получают в виде дисперсии на основе воды. Предпочтительно, дисперсионными средами являются чистая или ионообменная вода. Используемая вода практически не содержит электролитов. В предпочтительном варианте осуществления никаких дополнительных электролитов в дистиллированную воду преднамеренно не вводят. Уровень рН используемой воды равен 7 или меньше или уровень рН используемой воды равен 7,4 или меньше.
Частицы как диспергированную фазу дисперсии привносят с концентрацией, равной 100 мг/л или меньше, предпочтительно, равной 20 мг/л или меньше, наиболее предпочтительно, равной 2 мг/л или меньше. В наиболее предпочтительном варианте осуществления концентрация равна 2 мг/л или меньше. Указанное значение является подходящим, в частности, для металлических частиц, в частности, для частиц Ag, с целью исключения цитотоксических эффектов. Кроме того, данные значения подходят, в частности, для металлических частиц, в частности, частиц Ag, для обеспечения адекватной электропроводности в коллоидно-диспергированной системе.
В предпочтительном варианте осуществления изобретения электропроводность в коллоидно-диспергированной системе практически исключительно или исключительно обеспечивается самими коллоидно-диспергированными частицами. Это, в частности, соответствует металлическим частицам, как например, частицам Ag, в частности, в сочетании с эмульгатором. Предпочтительно, частицы, например, наночастицы Ag, являются единственным носителем или наиболее активным носителем электрического заряда в дисперсии. В предпочтительном варианте осуществления частицы или металлические частицы привносятся веществом, образующим островки на оксидной пленке. Один из примеров представляет собой серебро. В качестве дополнения или альтернативы металлические частицы или диспергированные металлические частицы представлены компонентом, который является составляющей частью материала основы. Например, частицы представлены частицами Ti, если основа (представляющая собой медицинское изделие) содержит титан. Загрязнения можно избежать. Растворенный материал, как например, растворенный материал погруженного медицинского изделия, также может вносить вклад в электропроводность коллоидно-диспергированной системы.
В качестве альтернативы или дополнения, в коллоидно-диспергированной системе представлен, по меньшей мере, один электролит. Электролит растворяют в коллоидно-диспергированной системе. В одном из вариантов осуществления изобретения электролит содержит, по меньшей мере, одно вещество, выбранное из группы, состоящей из металлов, оксидов, земельных минералов и фосфатов. В другом варианте осуществления электролит содержит, по меньшей мере, один электролит, выбранный из компонента материала основы. Т.е. электролит адаптирован к материалу основы. Например, электролит представлен ионами Ti, если основа (представляющая собой имплантат) содержит титан. Загрязнения можно избежать. Следует подчеркнуть, что упомянутые выше электролиты носят иллюстративный характер и не ограничиваются приведенным перечнем.
В дополнительном варианте осуществления изобретения в коллоидно-диспергированной системе предусмотрен газ. Вид газа определяется, например, типом барботажа. Конкретно, присутствует такой газ, который оказывает влияние на способ ПЭО и/или принимает участие в способе ПЭО. Газ содержит, по меньшей мере, один вид газа, выбранный из группы, состоящей из N2, Ar, Kr и Хе. Упомянутые благородные газы являются подходящими, в частности, для достижения повышенного уплотнения превращенного слоя.
Превращенная поверхность медицинского изделия, например, превращенная поверхность имплантата, равномерно покрыта оксидным слоем. Предпочтительно, превращенная поверхность непрерывно покрыта оксидным слоем. Оксидная пленка имеет толщину от 1 мкм до 100 мкм, предпочтительно от 10 мкм до 100 мкм, наиболее предпочтительно от 20 мкм до 40 мкм. Для оксидной пленки характерны бугорки и/или плато, отделенные канавками и/или желобками. Такой внешний вид представляет собой типичный признак применения способа ПЭО. Такая структура приводит к образованию поверхности медицинского изделия или поверхности имплантата с большой удельной площадью.
Как уже изложено в предшествующем описании, частицы наносят на поверхность медицинского изделия при окислении данной поверхности. Небольшая доля частиц встраивается также в оксидный слой. Основная доля частиц осаждается на поверхность оксидного слоя, образуя островки.
Между оксидным слоем и слоем осажденных частиц не существует никакой четкой границы раздела фаз. Концентрация частиц в медицинском изделии с превращенной поверхностью, например, в имплантате с превращенной поверхностью, понижается, предпочтительно, непрерывно понижается, с увеличением глубины.
В способе ПЭО островки образуются посредством микродуг, например, внедрением и/или осаждением и/или агломерацией диспергированных частиц. Островки окружены оксидным слоем. Островки имеют средний размер области менее 1000 нм, предпочтительно, менее 300 нм. Островки имеют среднюю толщину от 1 до 1000 нм, предпочтительно от 5 нм до 400 нм. Некоторые островки также могут быть связаны друг с другом. Обычно в островках, в частности, образующих нанозоны, практически отсутствует или имеется только незначительная пористость.
Однако островки представляют собой прерывистый слой или пленку, например, серебра, на оксидной пленке. В одном из вариантов осуществления изобретения поверхность медицинского изделия является нанокомпозитным покрытием TiO-Ag. Соответственно, элементы или соединения Ti, ТiO2, Ag и AgO являются непосредственно «видимыми» и соответственно обнаруживаются на поверхности. Обработанная поверхность характеризуется средней степенью покрытия островками, равной 20% или ниже, предпочтительно равной 10% или ниже.
Химической идентификацией обработанной поверхности в результате получают данные о составе коллоидно-диспергированных частиц, предпочтительно, серебра, от 0,5 до 10% ат., предпочтительно от 1 до 10% ат., наиболее предпочтительно от 2 до 6% ат.
Химической идентификацией наносеребра на титане или его сплавах в результате получают следующие данные о составе:

Контролирование степени покрытия островками можно использовать для регулирования «эффекта» островков. Например, можно регулировать антибактериальную эффективность. Один из параметров антибактериальной эффективности представляет собой скорость выщелачивания, например, ионов серебра.
В определенном варианте осуществления нанесения частиц Ag обработанная поверхность характеризуется скоростью выщелачивания ионов Ag менее 120 нг.см-2.сут-1. Обработка поверхности серебром, соответственно, наносеребром, приводит к проявлению очень высокой антимикробной эффективности с очень маловероятными побочными эффектами. Вследствие высокого отношения поверхности к объему у наночастиц (с размером предпочтительно от 2 до 50 нм), предполагается высокая эффективность даже при малых дозах, что снижает таким образом риск вредного воздействия на клетки.
Напряжение переменного тока или переменное напряжение прилагают к первому электроду и/или второму электроду. Напряжение переменного тока подают с частотой от 0,01 Гц до 1200 Гц.
В предпочтительном варианте осуществления изобретения напряжение переменного тока подают как асимметричное напряжение переменного тока. Асимметричная разность потенциалов цепи переменного тока или асимметричное напряжение переменного тока представляет собой не сбалансированное напряжение переменного тока. Указанное напряжение является переменным напряжением с различными амплитудами отрицательных и положительных составляющих. Следует подчеркнуть, что импульсное напряжение постоянного тока можно также интерпретировать как напряжение переменного тока. Отрицательную составляющую подают с амплитудой, находящейся в диапазоне от -1200 В до -0,1 В. Предпочтительно, отрицательную составляющую подают с амплитудой, находящейся в диапазоне от -350 В до -0,1 В. В одном из вариантов осуществления изобретения отрицательную составляющую подают с амплитудой ниже -180 В или находящейся в диапазоне от -350 В до -180 В. Положительную составляющую подают с амплитудой, находящейся в диапазоне от 0,1 В до 4800 В. Предпочтительно, положительную составляющую подают с амплитудой, находящейся в диапазоне от 0,1 В до 1400 В. В одном из вариантов осуществления положительную составляющую подают с амплитудой выше +250 В или находящейся в диапазоне от +250 В до 1400 В. Конкретно, необходимо регулировать отношение, полученное делением положительной амплитуды на отрицательную. Абсолютная величина отношения находится в диапазоне от значения больше 1 до 4.
В другом варианте осуществления изобретения напряжение переменного тока подают как симметричное напряжение переменного тока. Отрицательную составляющую напряжения переменного тока подают с амплитудой, находящейся в диапазоне от -2400 В до -0,1 В. Предпочтительно, отрицательную составляющую подают с амплитудой, находящейся в диапазоне от -1200 В до -0,1 В. Положительную составляющую напряжения переменного тока подают с амплитудой, находящейся в диапазоне от +0,1 В до +2400 В. Предпочтительно, положительную составляющую подают с амплитудой, находящейся в диапазоне от 0,1 В до 1200 В.
Возможно также сочетание асимметричного и симметричного напряжения переменного тока. Такое распределение напряжения подходит, например, для способа последовательных операций или многостадийного способа с целью изготовления определенного покрытия. На первой стадии для формирования покрытия подают асимметричное или симметричное напряжение. На следующей или второй стадии, конкретно, после прерывания питания, формирование покрытия продолжают при подаче симметричного или асимметричного напряжения, соответственно.
Разность потенциалов подают с величиной, которая является адекватной для осуществления способа ПЭО. Данное напряжение выше пробивного напряжения оксидной пленки, образующейся на поверхности имплантата. Предпочтительно, максимальную разность потенциалов переменного тока подают в диапазоне от 0,1 В до 4800 В. Наиболее предпочтительно, максимальную разность потенциалов переменного тока подают в диапазоне от 100 В до 1400 В. В зависимости от электропроводности коллоидно-диспергированной системы и необязательного дополнительного электролита, приложенная разность потенциалов обусловливает плотность тока от 0,00001 до 500 А/дм2, предпочтительно от 0,00001 до 100 А/дм2. Предпочтительно, приложенное напряжение или распределение напряжения является практически постоянным или неизменным, а плотность тока регулируют в продолжение осуществления способа ПЭО.
Достигают скорости осаждения в диапазоне от 0,01 мкм/с до 1 мкм/с. Соответственно, в связи с предпочтительной толщиной оксидного слоя и/или островков частиц достижимым является время осаждения в диапазоне от 1 с до 1200 с, предпочтительно от 1 с до 300 с, наиболее предпочтительно от 20 с до 260 с.
Для обеспечения возможности существования стабильной дисперсии коллоидно-диспергированную систему подают при температуре от -20°С до +150°С предпочтительно от -20°С до +100°С, наиболее предпочтительно от 0°С до 75°С. Коллоидно-диспергированную систему подвергают циркуляции со скоростью от 0 до 5000 литр/мин, предпочтительно от 0,01 до 500 литр/мин. Этого достигают, например, использованием смесителя или приспособлений для смешивания или перемешивания. В качестве необязательного дополнения в коллоидно-диспергированную систему привносят эмульгирующий реагент или эмульгатор, в частности, для исключения или уменьшения агломерации частиц. Типичный объем коллоидно-диспергированной системы составляет порядка от 0,001 литра до 500 литров, предпочтительно от 0,1 литра до 500 литров, наиболее предпочтительно от 3 до 20 литров. Такие объемы позволяют поддерживать улучшенное распределение электрического поля в диспергированной системе.
Исходная поверхность медицинского изделия без какого-либо полирования является адекватной для получения подходящей равномерно превращенной поверхности и соответствующего стабильного соединения превращенной поверхности с материалом подложки. Исходная поверхность характеризует поверхность до обработки медицинского изделия способом ПЭО. Для достижения улучшенных свойств достаточным является механическое полирование исходной поверхности. Дорогостоящее электрополирование, приводящее к очень гладкой поверхности, не является необходимым.
В изобретении также предлагается устройство для обработки поверхности медицинского изделия, конкретно, металлического медицинского изделия, плазменным электролитическим оксидированием, включающее в себя следующие составные части:
- ванну для размещения коллоидно-диспергированной системы,
- предпочтительно, средство для перемешивания коллоидно-диспергированной системы в ванне,
- средство для крепления медицинского изделия таким образом, что поверхность медицинского изделия, которое подлежит обработке, погружают в коллоидно-диспергированную систему, при этом медицинское изделие является первым электродом,
- средство для создания второго электрода в коллоидно-диспергированной системе, содержащейся в ванне,
- блок питания для генерирования напряжения переменного тока, которое подают на первый и/или второй электроды,
- средство для соединения первого и/или второго электрода с блоком питания, при этом
- средство для соединения первого электрода адаптируют к погруженному медицинскому изделию таким образом, что отношение поперечных сечений находится в пределах от 0,1 до 10. Предпочтительно, отношение поперечных сечений находится в пределах от 0,75 до 4.
Отношение поперечных сечений представляет собой частное от деления поперечного сечения медицинского изделия на поперечное сечение средства для соединения первого электрода. Подходящее отношение конкретно определяют поблизости от границы раздела между медицинским изделием и средством для соединения.
Предпочтительно, средство для соединения первого электрода выполняют для обеспечения практически равномерного распределения электрического поля между первым и вторым электродом, конкретно, поблизости от обрабатываемой поверхности медицинского изделия.
Равномерное распределение электрического поля между первым и вторым электродом является предпочтительным для достижения превращения поверхности с повышенной однородностью. Авторы изобретения неожиданно обнаружили, что на распределение электрического поля между первым и вторым электродом сильное влияние оказывает вариант выполнения средства для соединения первого электрода. Конкретно, распределение электрического поля сильно зависит от конструкции и/или размеров средства для соединения первого электрода.
Требуемого равномерного распределения электрического поля достигают посредством соединения первого электрода, имеющего поперечное сечение, уменьшенное или увеличенное соответствующим образом по отношению к поперечному сечению соединяемого медицинского изделия. В одном из вариантов выполнения средства для соединения первого электрода обладают, предпочтительно круглым, поперечным сечением со средним диаметром, равным 5 мм или меньше, предпочтительно, равным 1,5 мм или меньше. В предпочтительном варианте выполнения средство для соединения первого электрода изготовляют в форме прутка. Данный пруток является металлическим. Пруток выполняют для проведения электрического тока и изготовляют его, например, в виде элемента с резьбой, стержня или жилы провода. Пруток может быть гибким и негибким. Средство для соединения первого электрода прикрепляют к медицинскому изделию как к первому электроду. Средство для соединения первого электрода, в частности, пруток, можно фиксировать сваркой, склеиванием, обжатием и/или свинчиванием. Предпочтительно, средство для соединения первого электрода изготовляют из того же материала, что и присоединяемое медицинское изделие. Следует подчеркнуть, что средство для соединения первого электрода можно также снабжать средством для крепления медицинского изделия. Т.е. средства для крепления медицинского изделия и средства для его соединения представлены только одним компонентом. В одном из вариантов осуществления изобретения средства для соединения первого электрода, по меньшей мере, частично снабжены резьбой.
В дополнительном варианте осуществления изобретения представлены средства для адаптирования электрического поля. Например, средства для адаптирования электрического поля выполнены в виде компонента для исключения краев, а, следовательно, для исключения областей повышенной плотности электрического поля. В одном из вариантов по изобретению средство для адаптирования электрического поля выполняют в форме колпачка. Упомянутый колпачок можно навинчивать на резьбу.
В другом варианте осуществления предусмотрена подача газа в коллоидно-диспергированную систему.
Антибактериальные покрытия по изобретению можно использовать в области травматологии, ортопедии, остеосинтеза и/или эндопротезирования, особенно, при возникновении высокого риска инфицирования. Полезные эффекты такого антибактериального покрытия можно было бы использовать в большом числе существующих в настоящее время имплантатов или продуктов.
Медицинское изделие представляет собой медицинское изделие, которое, по меньшей мере, частично вставлено или помещено в тело человека и/или животного. Медицинское изделие может быть медицинским изделием любого рода.
В одном из вариантов выполнения изобретения медицинское изделие является имплантатом. Имплантат представляет собой зубной имплантат или ортопедический имплантат. Примерами выполнения такого имплантата по изобретению являются пластинки, винты, штифты, стержни и/или все системы, предпочтительно, внешней фиксации. Следует подчеркнуть, что указанные варианты применения носят иллюстративный характер и не ограничиваются приведенным перечнем.
В другом варианте осуществления изобретения медицинское изделие представляет собой медицинский инструмент или приспособление. Примерами выполнения такого медицинского инструмента являются хирургические и/или диагностические инструменты. Один из примеров хирургического инструмента представляет собой скальпель. Один из примеров диагностического инструмента представляет собой эндоскоп. Следует подчеркнуть, что указанные варианты применения носят иллюстративный характер и не ограничиваются приведенным перечнем.
В предпочтительном варианте осуществления имплантаты с превращенной поверхностью по изобретению изготовлены на основе биосовместимых материалов, но предпочтительно, небиоразлагаемых материалов. Они предназначены для долгосрочного применения, например, в течение периода от нескольких дней до месяцев, и/или для квазистационарного применения, как например, для долгосрочной имплантации хирургических имплантатов и/или протезов. Однако настоящее изобретение применимо также и для биоразлагаемых материалов.
Имплантат содержит, по меньшей мере, один металл, выбранный из группы, состоящей из титана, титановых сплавов, хромовых сплавов, кобальтовых сплавов и нержавеющей стали. Сплав содержит, по меньшей мере, 50% масс. названного основного элемента. Некоторыми типичными примерами титановых сплавов являются TiAl6V4, TiAl6Nb7 и/или TiZr. Некоторыми характерными примерами хромовых сплавов являются CrNi и/или CrNiMo. Некоторыми типичными примерами кобальтовых сплавов являются CoCr и/или CoCrMo. Некоторыми характерными примерами нержавеющей стали являются марки 316L и/или 304. Следует подчеркнуть, что упомянутые выше сплавы представляют собой иллюстративные примеры и не ограничиваются приведенным перечнем.
Конкретно, устройство по изобретению адаптируют для выполнения любой из стадий способа по изобретению. В частности, способ по настоящему изобретению осуществим посредством устройства по изобретению. В частности, медицинское изделие по изобретению, например, имплантат, можно изготовить, предпочтительно изготовляют, посредством устройства по изобретению и/или способом по изобретению. Медицинское изделие, например, выполненное в виде имплантата, включает в себя поверхность, состоящую из оксидной пленки, которая частично покрыта островками антимикробного материала, предпочтительно серебра, и/или апатитом, предпочтительно ГА.
Далее настоящее изобретение поясняется более подробно на основе предпочтительных вариантов осуществления и со ссылкой на прилагаемые фигуры. Признаки различных вариантов осуществления можно объединять один с другим. Одинаковые номера позиций на фигурах обозначают одинаковые или аналогичные части.
Краткое описание чертежей
На фигурах показано:
на фиг. 1а схематически изображено устройство для изготовления покрытия по изобретению,
на фиг. 1b схематически показан первый вариант выполнения приспособления для электрического соединения медицинского изделия,
на фиг. 1с схематически показан второй вариант выполнения приспособления для электрического соединения медицинского изделия,
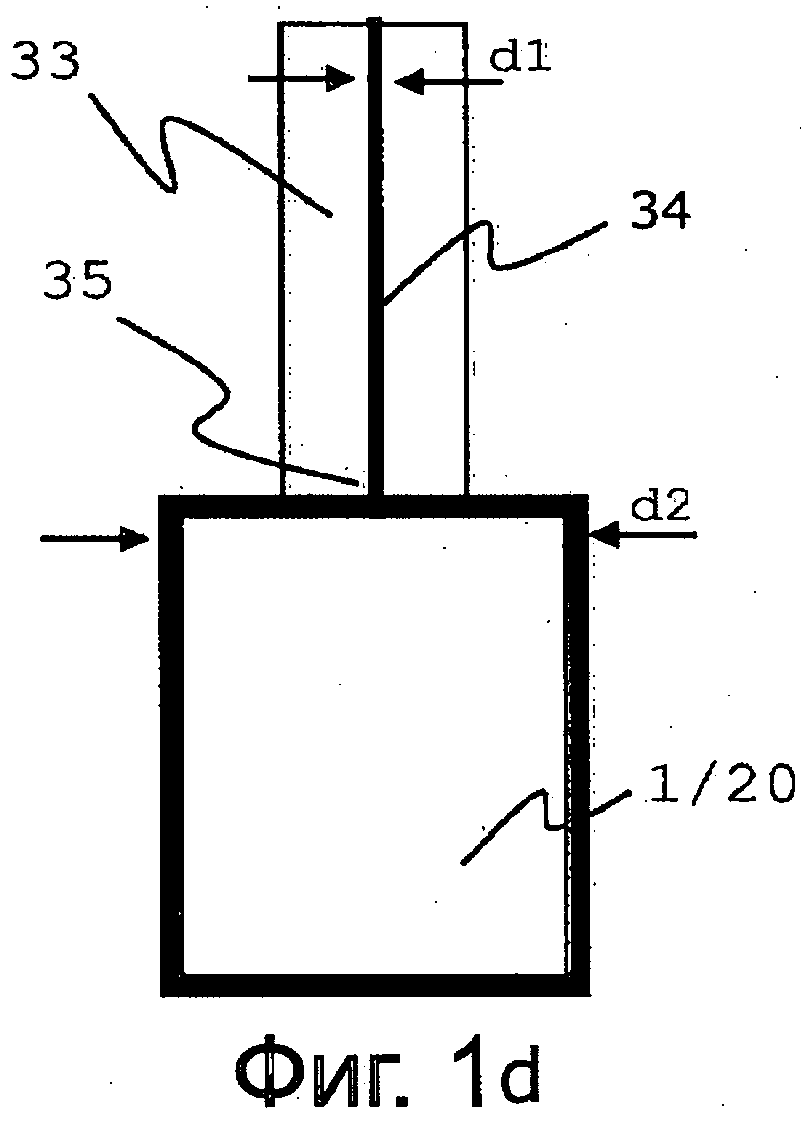
на фиг. 1d схематически показан третий вариант выполнения приспособления для электрического соединения медицинского изделия,
на фиг. 1е схематически отображен один из вариантов осуществления асимметричного распределения напряжения переменного тока
на фиг. If схематически отображен один из вариантов осуществления симметричного распределения напряжения переменного тока и
на фиг. 2а-10 представлены результаты нанесения покрытия Ag-TiO2 по способу изобретения.
Подробно на фигурах показано:
на фиг. 2а-е: снимки наносеребряного покрытия, выполненные с использованием метода стереооптической микроскопии(а), метода СЭМ в режиме топографического контраста (b-с), метода СЭМ с наклонным объективом в режиме топографического контраста(ф, схематический чертеж превращенной поверхности в поперечном сечении (е),
на фиг. 3а-b: (а) снимок наносеребряного покрытия, полученный методом СЭМ в режиме химического контраста, (b) спектр светлой зоны, полученный методом EDX,
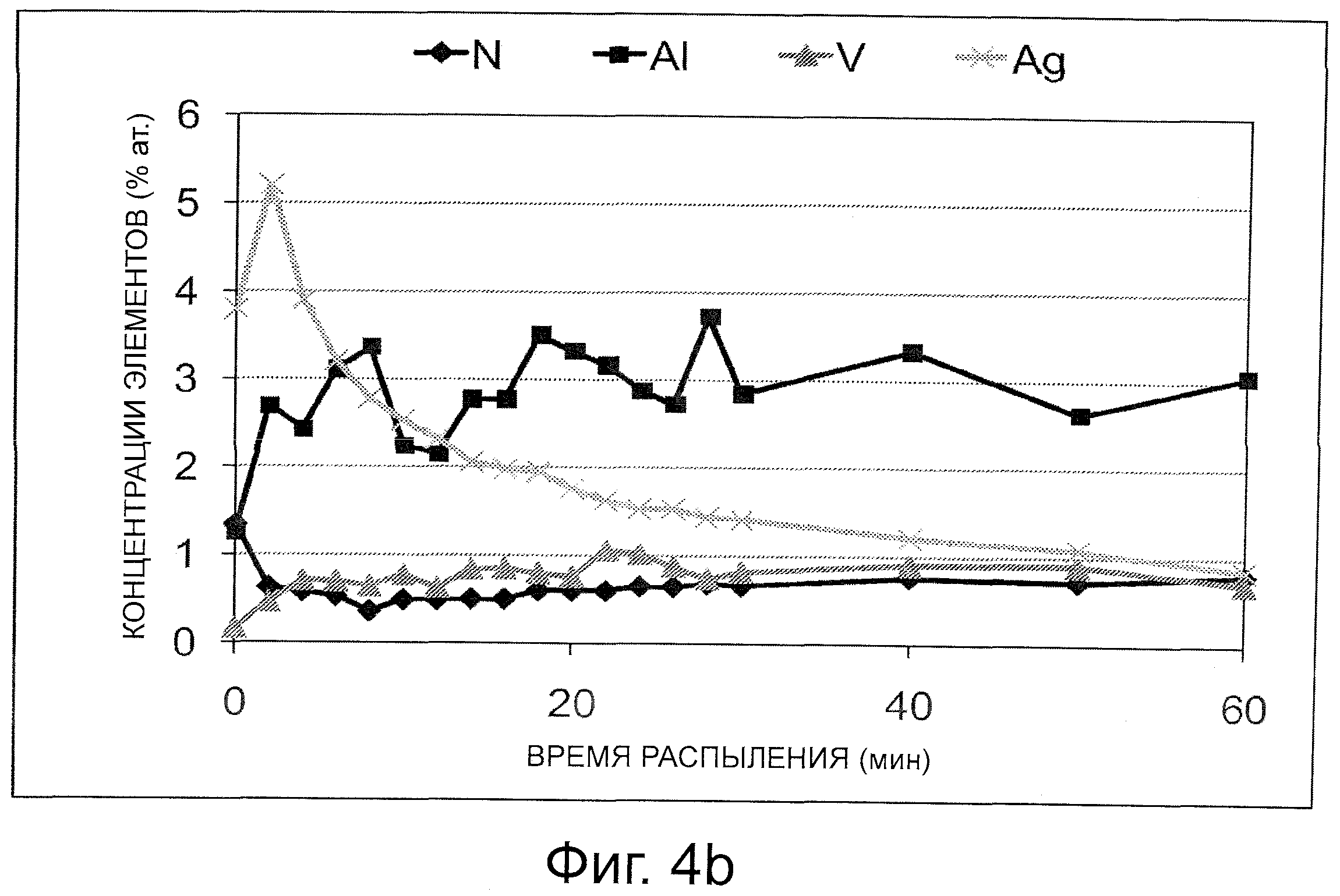
на фиг. 4а-b: анализ профилей распределения элементов по глубине наносеребряного покрытия, полученный методом XPS,
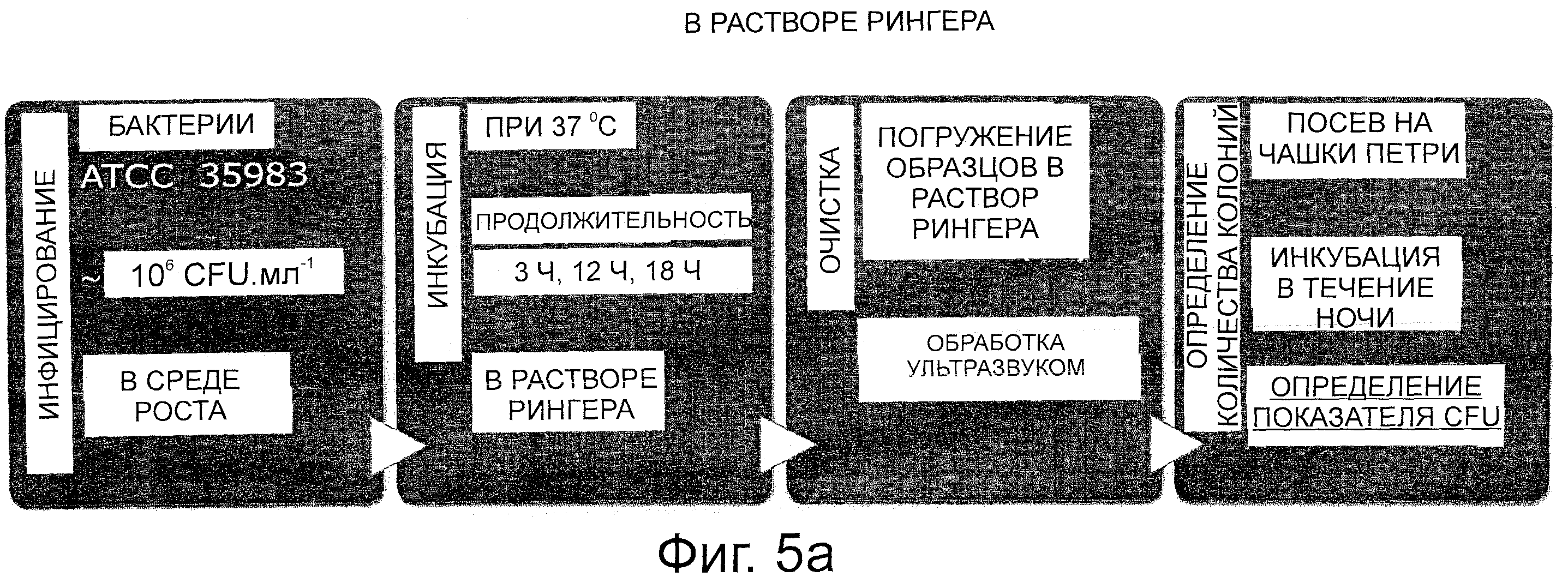
на фиг. 5а; стадии способа приготовления образцов для испытания на образование биопленки,
на фиг. 5b: количество бактерий, обнаруженное на наносеребре, стержнях из Ag и стержнях из сплава Ti после 12 ч инкубации,
на фиг. 6а-6е: стадии способа проведения испытания на быстрое размножение (а), интерпретация кривых роста (b-d), полученные экспериментальные результаты (е),
на фиг. 7: аналитические результаты, полученные методом GF-AAS, в псевдодинамической модели,
на фиг. 8: аналитические результаты, полученные методом GF-AAS, в статической модели,
на фиг. 9а-9b: снимки стержня с покрытием, выполненные с использованием метода стереооптической микроскопии, после испытания на изгиб,
на фиг. 10: снимок клеток ZK20 на наносеребряном покрытии, выполненный с использованием метода СЭМ и
на фиг. 11: дифрактограмма превращенной поверхности Ti с покрытием ГА, полученная методом XRD.
Соответственно, в связи с рисунками более подробно описаны предпочтительные, но носящие иллюстративный характер варианты осуществления изобретения.
Подробное описание изобретения
На фиг. 1 продемонстрировано устройство для изготовления покрытия по изобретению. Дальнейшее подробное описание ориентировано только на имплантат как один из примеров выполнения медицинского изделия. Например, для нанесения покрытия на хирургические имплантаты долгосрочной имплантации была разработана настоящая новая технология, основанная на способе плазменного электролитического оксидирования (ПЭО). ПЭО представляет собой электрохимический способ обработки поверхности для формирования оксидных покрытий на металлах. Поскольку через коллоидно-диспергированную систему 4 или ванну 4 с электролитом пропускают импульсный переменный ток высокого напряжения, образуется контролируемый плазменный разряд и на поверхности основы генерируются искры. Упомянутый плазменный разряд превращает поверхность металла в оксидное покрытие. Данное покрытие в сущности представляет собой продукт химического превращения основы и формируется по направлению и внутрь, и наружу от исходной поверхности металла. Вследствие того, что оно является конверсионным покрытием, а не осажденным (таким как покрытие, формируемое плазменным распылением), данное покрытие характеризуется высокой адгезией к металлу основы (смотрите фиг. 9а и 9b). При помощи указанной технологии можно наносить покрытия на сплавы основы в широком диапазоне.
Диспергированную систему 4 размещают в ванне 5. Имплантат 20 в качестве первого электрода 1 помещают в диспергированную систему 4. В примере осуществления имплантат 20 полностью погружают в жидкость 4, соответственно, в диспергированную систему 4. Второй электрод 2 помещают в виде чашки, также погруженной или помещенной в коллоидно-диспергированную систему 4. Второй электрод 2 «окружает» первый электрод 1.
Температуру диспергированной системы 4 поддерживают или регулируют теплообменником 6 и/или системой 7 нагнетания и/или приспособлением 8 для смешивания. Циркуляцию и/или смешивание диспергированной системы 4 осуществляют приспособлением 8 для смешивания. Приспособление 8 для смешивания оснащено, например, акустическим гидродинамическим генератором. В качестве возможного и показанного на фигуре дополнения можно также предусмотреть линию подачи 9 газа, например, воздуха, к приспособлению 8 для смешивания. Циркуляция жидкости исключает агломерацию наночастиц, содержащихся в диспергированной системе 4.
В дополнительном, не показанном на фигуре варианте осуществления изобретения второй электрод 2 создается самой ванной 5. Это соответствует, например, ванне 5, которая изготовлена из электропроводного материала. В таком варианте осуществления ванна 5 и второй электрод 2 изготовлены как моноблок.
В предпочтительном варианте осуществления изобретения первый электрод 1 размещают приблизительно в центре второго электрода 2 с целью достижения равномерного распределения электрического поля. Конструкция приспособления 3 для соединения первого электрода 1, которым является имплант 20, выбрана таким образом, чтобы поддерживать практически равномерное или адаптированное распределение электрического поля между первым электродом 1 и вторым электродом 2. Для этого поперечное сечение и/или конфигурацию приспособления 3 для соединения имплантата 20 адаптируют к поперечному сечению и/или конфигурации имплантата 20. На фиг. 1b-1d схематично изображены три примера выполнения приспособления 3 для соединения имплантата 20 (электрода 1), показанных на фиг. 1а.
На фиг. lb-1d продемонстрированы возможные варианты выполнения приспособлений 3 для соединения, при этом каждое из них характеризуется поперечным сечением, уменьшенным соответствующим образом по отношению к имплантату 20. Соответственно, отношение поперечных сечений (представляющее собой частное от деления поперечного сечения медицинского изделия на поперечное сечение приспособления для соединения первого электрода) больше 1 и меньше 4. Уменьшенное поперечное сечение приспособления 3 для соединения продемонстрировано диаметрами d1 и d2, при этом d1 На фиг. lb приспособление 3 для соединения первого электрода 1 (соответственно, имплантата 20) выполнено в виде стержня 30. Стержень 30 выполнен в форме, предпочтительно цилиндрического, стержня 30. Стержень 30 выполнен для осуществления электрического контакта, а также для крепления имплантата 20. На фиг. 1 с продемонстрирована конфигурация приспособления для нанесения покрытия на гайку в качестве имплантата 20. Поскольку гайки 20 являются, как правило, очень маленькими, например, равными 1 см или меньше, нанесение покрытия на гайку 20 является довольно «сложным». Приспособление для соединения первого электрода 1 также выполнено в виде стержня 30. Стержень 30 частично выполнен в форме, предпочтительно цилиндрического, стержня 30. Концевой участок стержня 30 выполнен с резьбой 31. Гайку 20 навинчивают на резьбу 31. Колпачок 32 надевают или привинчивают к концевому участку резьбы 31. Зазоры выше и ниже гайки 20 имеют размер около 1 мм. Наложение такого колпачка 32 обеспечивает образование равномерного покрытия и на верхней, и на нижней части передней стороны гайки 20. Колпачок 32 представляет собой приспособление для адаптирования электрического поля. Стержень 30 выполнен для осуществления электрического контакта, а также для крепления имплантата 20. На фиг. 1d приспособление для соединения первого электрода 1 (соответственно, имплантата 20) выполнено в виде жилы 34 провода. Жила 34 только обеспечивает электрический контакт. Она пропущена через держатель 33, который, предпочтительно, является неэлектропроводным. Держатель 33 механически закрепляет имплантат 20. Напряжение переменного тока подают источником питания 10 (смотрите фиг. 1а). Приложение асимметричного импульсного напряжения переменного тока приводит к образованию плотного покрытия. Положительная часть импульса обеспечивает образование превращенной поверхности. В начале процесса роста оксидного слоя превращенная поверхность характеризуется плотной структурой. С увеличением толщины оксидного слоя покрытие становится все более и более пористым. Частицы покрытия получаются все более и более рыхлыми. Указанные рыхлые частицы удаляются в отрицательной части импульса. Соответственно, отрицательная часть импульса является так называемой травильной частью. Асимметричное напряжение переменного тока представляет собой напряжение с различными амплитудами положительной и отрицательной составляющей. В особенности, необходимо регулировать отношение, полученное делением положительной амплитуды на отрицательную. Абсолютное значение отношения находится в пределах от >1 до 4. Для наглядности на фиг. 1e схематично показано асимметричное распределение напряжения переменного тока по амплитудам U1 от +200 В до -50 В. Указанные напряжения прилагают, например, к имплантату 20 в качестве первого электрода 1 (смотрите фиг. 1a). В упомянутом варианте осуществления изобретения напряжение на втором электроде 2 находится, например, на уровне потенциала Земли. Приведенная форма показана как приближающаяся к прямоугольной. Данная форма также может быть, особенно частично, формой синуса или синусом. Для некоторых вариантов применения подходит также и симметричное распределение напряжения переменного тока. Одним из примеров применения является получение покрытия с очень высокой шероховатостью поверхности для улучшенного связывания костной ткани с имплантатом. Для наглядности на фиг. 1f схематично показано симметричное распределение напряжения переменного тока для амплитуд U1 от -200 В до + 200 В. Весьма подходящими частицами являются наносеребряные частицы с размером от значения около 1 до 20 нм, предпочтительно 15 нм. Это приводит к получению повышенной площади удельной поверхности и, следовательно, к большому количеству растворимых ионов серебра. Ионы серебра являются ответственными за удельную активность против широкого спектра бактерий, грибков и дрожжей. Ионы серебра инактивируют крайне необходимые физиологические функции, подобные синтезу клеточных стенок, трансмембранному переносу веществ, воспроизводству нуклеиновых кислот или функциям белков. Все упомянутые воздействия вызывают гибель микроорганизмов в течение короткого периода времени. Вследствие указанных комплексных форм антимикробного действия, очень маловероятно, что у микроорганизмов развивается резистентность к серебру. Помимо антимикробной активности ионов серебра, в новых исследовательских работах показано, что наносеребро проявляет активность, в частности, против вирусов, подобных ВИЧ или вирусам гепатита. На фиг. 1a-11b показаны экспериментальные результаты нанесения покрытия Ag-TiO2 по изобретению. Используемый материал основы или имплантата представляет собой сплав TiAl6V4 ELI. Сплав TiAl6V4 ELI (сверхнизкие дефекты внедрения, стандарт ISO 5832-3) является маркой высшей степени чистоты сплава TiAl6V4. Упомянутая марка характеризуется наиболее низким содержанием кислорода, углерода и железа. Обычно ее применяют в области биомедицины, как например, для изготовления хирургических инструментов и ортопедических имплантатов. Прежде всего, на фиг. 2a-2d приведены результаты определения топографических характеристик (по стандартам ISO/TS 10993-19: 2006). В качестве примера проанализирован винт с покрытием по изобретению. Топографию поверхности покрытия исследовали методом стереооптической микроскопии (фиг. 2а) и сканирующей электронной микроскопии (СЭМ) в режиме топографического контраста (фиг. 2b-2d). Снимки демонстрируют равномерное и однородное покрытие поверхности (фиг. 2а и 2b). При более сильном увеличении обнаруживаются характерные черты покрытий ПЭО: плоские возвышенные плато с несколькими углублениями между ними (фиг. 2с). Среднее углубление характеризуется глубиной 20 мкм (фиг. 2d). Топографические характеристики выявляют плотное покрытие с высокой площадью удельной поверхности. На фиг. 2с и 2d показаны характерные черты поверхности, превращенной способом ПЭО. Для наглядности на фиг. 2е схематично представлена превращенная поверхность в поперечном разрезе. Превращенная поверхность непрерывно покрыта оксидным слоем. Характерная толщина составляет меньше 25 мкм. Для оксидной пленки характерны бугорки и/или плато, отделенные канавками и/или желобками. Поверх оксидного слоя формируются упомянутые островки, образуя прерывистый слой металлического Ag и частично AgO. Островки могут формироваться на плато и в канавках. Островки имеют типичную толщину меньше 100 нм и типичный диаметр, находящийся в пределах от 5 нм до 200 нм. На фиг. 3а и 3b представлены результаты определения физико-химических характеристик (по стандартам ISO/TS 10993-19: 2006). Снимки СЭМ в режиме химического контраста обнаруживают на поверхности покрытия присутствие тяжелого элемента, в частности, сформированного в виде островка (светлые области на фиг. 3b). Методом энергодисперсионной спектрометрии (EDS) подтверждено присутствие серебра (фиг. 3а). Серебро однородно или равномерно распределено по всей поверхности покрытия. Характерные серебросодержащие области гораздо меньше 1 мкм. На фиг. 4а и 4b представлены результаты определения химических параметров (по стандартам ISO 10993-18: 2005). Элементный состав поверхности более точно оценивали методом рентгеновской фотоэлектронной спектроскопии (XPS) при помощи спектрометра PHI 5500 ESCA (монохроматическое излучение AlKα), каждая величина, приведенная ниже, представляет собой среднее значение для трех независимых измерений.
Поверхность покрытия состоит, главным образом, из оксида титана с серебром и углеродом. Обнаружено также очень малое количество азота, хлора и серы в качестве примесей.
Профиль распределения элементов по глубине (распыление пучком ионов Ar с энергией 3 кэВ, площадь области 3,8×4,2 мм) на покрытии определяли методом XPS с целью исследования однородности его состава по глубине; таким образом получили оценку толщины серебросодержащего участка покрытия: <100 нм.
После 2 мин распыления содержание углерода резко уменьшается, выявляя присутствие на поверхности малого количества органической примеси (фиг. 4а). Упомянутую углеродистую примесь на поверхности часто обнаруживают методом XPS и ее присутствие, вероятно, обусловлено перемещением и обработкой образцов до проведения анализа. После 2 мин распыления также имеет место факт определения наиболее высокой концентрации Ag (фиг. 4b).
Впоследствии обнаруживают непрерывное снижение концентрации Ag при наблюдении картины диффузии серебра в оксидный слой. Данное наблюдение также согласуется с результатами, полученными методом СЭМ, которые указывают на то, что серебро присутствует в форме малых частиц, а не в виде непрерывного слоя. Между оксидным слоем и островком Ag не существует никакой четкой границы раздела фаз. Например, в отличие от поверхностей, превращенных в оксид и на которые нанесено покрытие Ag.
Регистрировали также спектры связывания высокого разрешения (результаты не показаны). Спектры связывания О позволяют проводить отнесение главным образом к TiO2 при малом количестве оксидов других металлов (главным образом, Al и Ag). Спектры связывания Ag показывают присутствие оксидов серебра и металлического серебра, хлорид серебра не обнаружен.
Далее показаны результаты оценки антимикробной эффективности покрытия по настоящему изобретению. В случае материалов для остеосинтеза (например, стержней, винтов и т.д.) для хорошей биоинтеграции требуется очень специфическая поверхность, которая в то же время позволяет клеткам ткани человека закрепляться на ней. Упомянутая поверхность предоставляет бактериям возможность заселяться таким образом, что они конкурируют с человеческими клетками за быстрое размножение на ней.
Цель нанесения наносеребряного покрытия заключается в предотвращении проблематичного бактериального роста на поверхности материалов для остеосинтеза, на которые нанесено покрытие. Одна из задач изобретения состоит в определении оптимальной концентрации серебра для нанесения покрытия, которое проявляет высокую антибактериальную активность в отсутствие какого-либо цитотоксического эффекта (по стандарту ISO 10993-5).
Для каждого испытания использовали штамм бактерий: Staphylococcus epidermidis АТСС 35984.
Упомянутый штамм бактерий обладает следующими характеристиками:
- простейший оккупант кожи;
- заселяет поверхности протезов;
- образование биопленки ⇒ защита от иммунной системы пациента ⇒ необходимость применения антибиотиков;
- антибиотикоустойчивые штаммы распространяются по поверхности (фактическая скорость роста MRSE, отнесенная ко всем штаммам Staphylococcus epidermidis в Германии: вычисл. 70%).
В общепринятой литературе не было найдено соответствующего стандарта для оценки ингибирования образования биопленки. Поэтому были разработаны условия специализированного испытания: испытания проводили с использованием штаммов Staphylococcus epidermidis ATCC 35984. Стержни из чистого серебра использовали для положительного контроля, стержни из чистого титанового сплава применяли для отрицательного контроля.
На фиг. 5а отображены стадии приготовления образцов, а на фиг. 5b показаны результаты упомянутого испытания на образование биопленки: при этом количество бактерий, обнаруженное на наносеребре, стержнях из Ag и стержнях из сплава Ti зависит от продолжительности инкубации. Резкое уменьшение количества бактерий наблюдали на покрытии Ag-TiO2 по сравнению с титановым сплавом (снижение >log 3) после 12 ч инкубации. Наносеребряное покрытие показывает даже лучшие результаты, чем чистое серебро (фиг. 5b). После 18 ч инкубации на поверхности покрытия Ag-TiO2 не обнаружили больше никаких бактерий. Одно из объяснений основано на повышенном соотношении поверхность/объем для наносеребряного покрытия.
Существует несколько способов стандартных испытаний для определения антимикробной активности поверхностей с покрытием. В целях отбора используют испытание на быстрое размножение. Как правило, бактерии стремятся прилипать к поверхностям. Указанное стремление нарушается в основном антимикробной и/или гидрофобной функционализацией поверхностей, что приводит к сильному уменьшению адгезии бактерий. В испытании на быстрое размножение данный эффект проявляется при помощи специфической процедуры испытания. Протекание процесса бактериального роста является основанием для оценки антимикробного воздействия на обработанные поверхности по сравнению с необработанными. На фиг. 6а отображены стадии осуществления испытания на быстрое размножение.
Данное испытание проводят на экспоненциально растущих бактериях при помощи доступного для приобретения 96-луночного титрационного микропланшета. Образцы для испытаний в идеале имеют цилиндрическую форму с диаметром 4 мм и длиной 12 мм.
Быстрое размножение бактерий определяют методом измерения оптической плотности при 578 нм в фотометре специальной конструкции с 64-кратным измерением.
Для каждого образца отображают характерную кривую роста (смотрите фиг. 6е). Интерпретация кривых роста продемонстрирована на фиг. 6b-6d: (b) экспоненциальный рост - отсутствие антибактериальной активности, (с) латентная фаза роста - слабая антибактериальная активность и (d) отсутствие определяемого роста - сильная антибактериальная активность.
Образцы (в каждом цикле испытаний были также проверены внутренние виды контроля):
- Отрицательный контроль: стержни из материала HDPE (должны показывать экспоненциальный рост).
- Контроль роста в питательной среде: некоторые лунки титрационного микропланшета заполняли инфицированным питательным раствором для контролирования роста бактерий в оптимальных условиях.
- Контроль стерильности: контрольные лунки и неинфицированные образцы не обнаруживают какого-либо роста бактерий.
- Положительный контроль: стержни из чистого Ag (рост бактерий не должен быть обнаружен).
Антибактериальную эффективность наносеребряного покрытия оценивают сравнением бактериального роста на данной поверхности с ростом на не обработанной поверхности (контрольная проба).
- Контрольные образцы: стержни из сплава TiAl6V4 Eli.
- Образцы с наносеребряным покрытием: стержни из сплава TiAl6V4 Eli с покрытием Ag-TiO2 (5% материала).
Результаты представлены на фиг. 6е. В случае всех контрольных образцов продемонстрированы ожидаемые кривые роста, данное испытание является состоятельным. По сравнению со стержнями из чистого титана, стержни с покрытием из Ag-TiO2 показывают высокую антибактериальную эффективность, которая так же высока, как и у стержней из чистого серебра.
Испытание антимикробной активности и эффективности осуществляют по стандарту JIS Z2801. В стандарте JIS Z 2801 точно определены способы испытания для оценки антимикробной активности и антимикробной эффективности на бактериях, находящихся на поверхности антимикробных продуктов. Величина антимикробной активности показывает разность численности жизнеспособных клеток в логарифмических величинах между антимикробными продуктами и не обработанными продуктами после посева и инкубации бактерий. Таким образом, в отличие от испытания на быстрое размножение, антибактериальную активность можно определить количественно.
Указанный способ испытания применим к продуктам, отличным от текстильных, как например, к пластиковым, металлическим и керамическим продуктам.
После приготовления в образцы для испытаний вносили посевной материал с определенным числом бактерий. Для обеспечения хорошего распределения посевной культуры образец для испытаний покрывают специальной пленкой (фольга РЕ). Образцы для испытаний выдерживают в термостате при 37°С в течение 18 ч. После инкубации бактерии отмывали от питательного раствора. В полученной взвеси отмытых клеток (способ культуры на агаровой пластинке) проводят определение численности жизнеспособных клеток.
Образцы:
- Контрольный образец: диски из сплава TiAl6V4 Eli.
- Образец с наносеребряным покрытием: диски из сплава TiAl6V4 Eli с покрытием из Ag-TiO2 (5% материала).
- Отрицательный контроль: полистироловая поверхность (определенное количество бактерий должно выживать, в противном случае результаты испытания должны быть отвергнуты).
Результаты демонстрируют высокую антимикробную активность наносеребра, со снижением более чем на log 4, по сравнению со сплавом TiAl6V4 Eli.
Дополнительные исследования были направлены на выщелачивание серебра (по стандарту ISO 10993-17: 2002). Замысел данного комплекса работ включает корреляцию между антимикробной активностью и количеством ионов серебра, высвобождаемых с поверхности образца. Предлагается способ анализа следов серебра и его соединений при соответствующей процедуре приготовления образца. Анализ осуществляют методом атомно-абсорбционной спектрометрии с графитовой печью (GF-AAS). Основное внимание было уделено механизмам высвобождения серебра в физиологических условиях. Необходимо предусмотреть схему испытаний, в которой моделируют условия, аналогичные условиям окружающей среды покрытия в ткани пациентов. Таким образом, в качестве выщелачивающего реагента был выбран фосфатный буферный физиологический раствор (PBS).
Процедура испытания состоит в следующем:
Серии А испытаний (псевдодинамическая модель):
- Образцы погружают в 1 мл раствора PBS.
- После осторожного встряхивания в течение 1 суток при 20°С образцы переносят в следующую склянку со свежим раствором PBS.
Серии В испытаний (статическая модель):
- Образцы погружают в 10 мл раствора PBS.
- После определенных промежутков времени осторожного встряхивания при 37°С аликвоту (0,5 мл) переносят в склянку со свежим раствором.
В обеих сериях испытаний аналогичными являются следующие стадии;
- Содержание Ag в растворе PBS анализируют после добавления азотной кислоты.
- Анализ серебра методом атомно-абсорбционной спектрометрии с графитовой печью (GF-AAS).
Испытанные образцы:
- Контрольные образцы: стержни из сплава TiAl6V4 Eli (стержни из Ti).
- Образцы с наносеребряным покрытием: стержни из сплава TiAl6V4 Eli с покрытием Ag-TiO2.
- Положительный контроль: стержни из чистого серебра (стержни из Ag)
Получены следующие результаты:
Серии А испытаний: наносеребряное покрытие характеризуется высвобождением серебра, совершенно аналогичным таковому для стержней из чистого серебра.
На фиг. 7 показаны аналитические данные, полученные методом GF-AAS для определения количества Ag (нг), высвобожденного с поверхности (мм) образца, как функция времени погружения (сутки) в раствор PBS при комнатной температуре. Показанные величины ошибок отображают дисперсию результатов трех независимых анализов. Скорость выщелачивания как функция от времени погружения является практически постоянной.
По истечении 15 суток:
- Скорость суточного высвобождения из чисто серебряного стержня остается постоянной после снижения впервые дни.
- Скорость суточного высвобождения из наносеребряного стержня является постоянной.
- Суммарное количество Ag, выщелоченного в течение 15 суток: 6,3 мкг.
Антибактериальная активность (показанная в испытании на быстрое размножение) соответствует количеству высвобожденных ионов серебра.
Серии В испытаний: Согласно условиям кинетических испытаний авторов изобретения равновесие достигается после 24 часов.

- В данном случае скорость высвобождения серебра в условиях равновесия составляет около 0,4 нг.г-1.мм-2
- При ежедневной замене 10 мл раствора в течение 8 недель можно ожидать суммарной скорости высвобождения серебра около 22,4 нг.г-1.мм-2.
На фиг. 8 показаны результаты анализа методом GF-AAS, полученные для определения количества Ag (нг), высвобожденного с поверхности (мм2) образца при 37°С в растворе PBS, как функции времени (сутки). Аналитические данные представляют собой среднее значение для трех независимых анализов. Скорость выщелачивания как функция от времени погружения является практически постоянной или постоянной.
На фиг. 9а и 9b показаны результаты механического испытания. Представлены снимки стержня с покрытием, выполненные с использованием метода стереооптической микроскопии, после испытания на изгиб. Адгезию покрытия Ag-TiO2 исследовали по стандарту ASTM B571-97. Образцы с покрытием подвергали изгибанию на различные углы и наблюдали за деформированными участками методом стереооптической микроскопии с целью обнаружения какого-либо признака отслаивания или отшелушивания покрытия от основы. Никакого отслаивания или отшелушивания покрытия не обнаружили даже после разрушения основы. Адгезионная прочность покрытия больше когезионной прочности основы, что выявляет полную адгезию согласно применяемому стандарту.
На фиг. 10 приведены экспериментальные результаты по определению биосовместимости: выращивание клеток ZK20 на дисках из материала наносеребро/TiAl6V4.
Культуру клеток выращивали с использованием дисков из материала TiAl6V4 с покрытием и без него в качестве основы. Для данного исследования были выбраны две линии клеток: линия клеток Osteosarcoma (HOS TE85) и первичные мезенхимные стволовые клетки из порошка костей человека (ZK20). Инкубацию образцов осуществляли при 37°С в атмосфере 95% воздуха - 5% СО2. По истечении различных периодов инкубации (дней или недель, в зависимости от линий клеток) образцы подготавливали для анализа методом оптической микроскопии и исследовали жизнеспособность клеток и их быстрое размножение.
Два указанных типа клеток демонстрируют хорошую адгезию и быстрое размножение на двух типах поверхностей (TiAl6V4 и наносеребро). Два данных типа клеток характеризуются склонностью к агломерации на поверхности с наносеребряным покрытием.
После специальной процедуры фиксации, направленной на лизис клеток, по возможности, с наименьшим искажением структуры, образцы анализировали методом электронной микроскопии. Представлен снимок клеток ZK20 на наносеребряном покрытии, выполненный методом СЭМ. Указанный снимок подтверждает хорошую адгезию клеток и быстрое размножение на поверхности с наносеребряным покрытием. Различим даже тип якоря клетки.
Подводя итоги, можно отметить: было показано, что покрытие Ag-TiO2 по изобретению проявляет очень хорошие свойства в аспекте антибактериальной эффективности (даже против мультирезистентных штаммов), адгезии и биосовместимости.
И наконец, на фиг. 11 представлена дифрактограмма Ti-винта с покрытием из материала ГА (гидроксиапатит), полученная методом XRD. Подробно представлено детектированное число одиночных импульсов как функция угла 2 тета.
Параметры для анализа являются следующими:
- Прибор: Bruker D8 GADDS XRD (напряжение: 40 кВ и интенсивность: 40 мА)
- Диапазон измерений: угол тета; 17-93,7°; приращение: 0,02° и время между импульсами: 60 с
- Точка измерения: головка титанового винта.
Образец содержит в основном титан и анатаз (TiO2). Источником происхождения титана и TiO2 является масса поверхности, превращенной соответствующим образом. Обнаружено также очень малое количество вещества ГА. Различия в интенсивностях определенного пика ГА обусловлены предпочтительной ориентацией кристаллитов на поверхности винта. Однако имеются первые указания на то, что на превращенной поверхности возможно определять само вещество ГА, а не только его компоненты.
Малое количество обнаруженного вещества ГА можно объяснить выбранной конфигурацией экспериментальной схемы. Выбранный диапазон углов поворота аналитического пучка обусловливает повышенную чувствительность к составу массы материала (Ti), покрытого слоем TiO2 (толщина в несколько мкм), и пониженную чувствительность к составу поверхностного и приповерхностного слоя материала ГА (толщина в несколько 100 нм или меньше).
Предполагается обнаружение повышенного количества материала ГА в так называемой конфигурации скользящего падения. В указанной конфигурации аналитический пучок направляют под малым углом (например, около 1,5 градусов) к поверхности, подлежащей анализу. Чувствительность к составу поверхностного и приповерхностного слоя в упомянутой конфигурации скользящего падения повышена.
Следует понимать, что изобретение можно осуществлять и в других конкретных формах, не выходя рамки его сущности или главных характеристик. Следовательно, настоящие примеры и варианты осуществления изобретения во всех отношениях необходимо рассматривать как иллюстративные и не ограничительные, и изобретение не должно ограничиваться подробностями, приведенными здесь. Соответственно, признаки описанных выше конкретных вариантов осуществления изобретения можно объединять один с другим. Дополнительно, признаки, описанные в сущности изобретения, можно объединять друг с другом. Кроме того, признаки описанных выше конкретных вариантов осуществления изобретения и признаки, описанные в сущности изобретения, можно объединять друг с другом.
Реферат
Группа изобретений относится области медицины и может быть использовано для получения антибактериального покрытия на медицинских изделиях. Способ обработки поверхности медицинского изделия включает стадии, на которых: получают коллоидно-диспергированную систему, подвергают медицинское изделие обработке коллоидно-диспергированной системой путем погружения, создают разность потенциалов цепи переменного тока между медицинским изделием в качестве первого электрода и/или вторым электродом, помещенным в коллоидно-диспергированную систему, для превращения погруженной поверхности в оксидную пленку посредством плазменного электролитического оксидирования, при этом превращенная поверхность частично покрывается островками, образованными коллоидно-диспергированными частицами коллоидно-диспергированной системы. Напряжение переменного тока подают как асимметричное и/или синусоидальное напряжение переменного тока, причем отношение, полученное делением положительной амплитуды на отрицательную амплитуду, настраивают на абсолютную величину в диапазоне от значения >1 до 4. Группа изобретений относится также к медицинским изделиям, полученным указанным способом, и устройству для осуществления указанного способа. Группа изобретений обеспечивает возможность регулирования степени однородности покрытия на любом типе формы медицинского изделия. 4 н. и 10 з.п. ф-лы, 11 ил.
Формула
получают коллоидно-диспергированную систему,
подвергают медицинское изделие обработке коллоидно-диспергированной системой таким образом, что поверхность медицинского изделия, которое подлежит обработке, погружают в коллоидно-диспергированную систему,
создают разность потенциалов цепи переменного тока между медицинским изделием в качестве первого электрода и/или вторым электродом, помещенным в коллоидно-диспергированную систему, для превращения погруженной поверхности в оксидную пленку посредством плазменного электролитического оксидирования, при этом превращенная поверхность частично покрывается островками, образованными коллоидно-диспергированными частицами коллоидно-диспергированной системы,
причем напряжение переменного тока подают как асимметричное напряжение переменного тока и/или как синусоидальное напряжение переменного тока, при этом
отношение, полученное делением положительной амплитуды на отрицательную амплитуду, настраивают на абсолютную величину в диапазоне от значения >1 до 4.
обработанная поверхность, по меньшей мере, частично превращена в оксидную пленку посредством плазменного электролитического оксидирования при использовании коллоидно-диспергированной системы, причем
превращенная поверхность частично покрыта островками, образованными коллоидно-диспергированными частицами коллоидно-диспергированной системы, при этом превращенная поверхность имеет среднюю величину покрытия островками менее 20% и химически характеризуется содержанием коллоидно-диспергированных частиц от 1 до 10 ат.%.
ванну для размещения коллоидно-диспергированной системы,
средства для смешивания коллоидно-диспергированной системы в ванне,
средства для крепления медицинского изделия таким образом, что поверхность медицинского изделия, которое подлежит обработке, погружается в коллоидно-диспергированную систему, при этом медицинское изделие является первым электродом,
средства для обеспечения второго электрода в коллоидно-диспергированной системе, содержащейся в ванне,
блок питания для генерирования напряжения переменного тока, которое подается на первый и/или второй электрод,
средство для соединения первого электрода и/или второго электрода с блоком питания, при этом
средство для соединения первого электрода адаптировано к погружаемому медицинскому изделию таким образом, что отношение поперечного сечения медицинского изделия к поперечному сечению указанного средства для соединения первого электрода составляет от 0,75 до 4.

Комментарии