Мембрана для регенерации ткани - RU2532345C2
Код документа: RU2532345C2
Чертежи































Описание
ОБЛАСТЬ ТЕХНИКИ
Настоящее изобретение относится к области регенерации ткани, конкретно регенерации кости, с использованием мембраны на основе полимера или конструкции, способной поддерживать адгезию, пролиферацию и дифференциацию клеток.
УРОВЕНЬ ТЕХНИКИ
Несрастание перелома является состоянием прекращения всех восстановительных процессов лечения перелома без срастания кости [1-3]. Несрастание также можно определить как отсутствие прогрессирующего восстановления, которое не наблюдается с помощью рентгенографии в период между 3-м и 6-м месяцами с даты перелома [2, 4]. Несрастание может происходить или в результате плохой механической или биологической среды в области перелома, или вследствие их сочетания [2]. Эта и другие ситуации требуют манипулирования или усиления естественных механизмов лечения для регенерации больших количеств новой кости для достижения хирургических целей [5-7]. Поэтому новая кость для восстановления функции травмированной, поврежденной или утраченной кости является крупной клинической потребностью, и инженерия костной ткани была провозглашена альтернативной стратегией для регенерации кости [8]. Инженерия ткани в применении к кости фокусируется на восстановлении крупных сегментов скелета, включая опорные кости. Кость можно регенерировать посредством следующих стратегий: остеогенез - перенос клеток; остеоиндукция - побуждение клеток к тому, чтобы стать костью; остеопроведение - предоставление каркаса для клеток, формирующих кость; или остеостимуляция - стимуляция лечения и регенерации кости путем развития биологической или механической среды излечивающихся или регенерирующихся тканей.
Было доказано, что полимерная поли (L-лактидная) трубчатая мембрана, охватывающая механически стабильный дефект большого сегмента кости, способствует формированию женской кости и реконструкции дефекта кости [9]. Мошейф и др. (Mosheiff et а1.) разработали модель дефекта критического размера для кролика для проверки лечения утраты кости. В этой модели дефект критического размера должен быть создан в предплечье кролика. Дефект критического размера определен как наименьшая внутри-костная рана, которая не перекрывается скелетом при нормальных обстоятельствах [10, 11]. Используя эту модель, наша группа успешно применила мембраны для направленной регенерации кости (НРК) путем остеопроведения [10, 12].
Гугала и др. (Gugala et al.) продемонстрировали гомогенный рост мезенхимальных стволовых клеток (МСК) на пористых мембранах с формированием трехмерной фиб-риллярной сети [19].
В документе WO 2005/107826 раскрыты формуемые костные импланты, содержащие биосовместимые гранулы (например, биокерамику), биосовместимый полимер и пластификатор. Имплант может формировать открытый пористый каркас или композитную матрицу или может быть введен как жидкий или пластично деформируемый имплант.
В документе WO 2004/084968 раскрыта пористая матрица, подходящая для использования в качестве тканевого каркаса или инъецируемого препарата, предпочтительно изготовленного из разлагаемого сшитого полимера.
РАСКРЫТИЕ ИЗОБРЕТЕНИЯ
Настоящее изобретение основано на данных, что новая мембрана на основе полимера, включающая гидрофобный и гидрофильный полимеры и, кроме того, пластификатор, способна поддерживать адгезию, пролиферацию и дифференциацию клеток, и таким образом может быть использована для усиления регенерации ткани, например, при лечении больших сегментарных дефектов кости. Мембраны согласно изобретению работают как система доставки для клеток и как устройство для направленной регенерации кости, по выбору вместе с активными веществами, которые способствуют росту, адгезии, дифференциации и/или пролиферации клеток. Более конкретно, изобретение основано на имеющихся данных, что мембрана на основе полимера, которая кроме того, включает полиэтиленгликоль (ПЭГ), поддерживала адгезию, дифференциацию и пролиферацию мезенхимальных стволовых клеток (МСК). Соответственно, в одном из его аспектов изобретение предлагает мембрану, включающую по меньшей мере один положительно заряженный синтетический гидрофобный полимер, по меньшей мере один гидрофильный полимер и по меньшей мере один пластификатор; причем упомянутая мембрана гибкая и способна поддерживать по меньшей мере одно из адгезии клеток, пролиферации клеток или дифференциации клеток. Используемый здесь термин "мембрана" относится к тонкой (грубо двумерной) непрерывной гомогенной конструкции, имеющей толщину от 30 до 200 мкм, обычно получаемую путем литья по меньшей мере одного положительно заряженного синтетического гидрофобного полимера, по меньшей мере одного гидрофильного полимера и по меньшей мере одного пластификатора в формы.
Термин "положительно заряженный синтетический гидрофобный полимер" относится к синтетически полученному полимеру, который нерастворим в воде, имеет общий средний положительный (поверхностный) заряд, созданный положительно заряженными или частично положительно заряженными мономерными группами (или замещающими группами на таких мономерах) полимера.
В некоторых вариантах осуществления упомянутый по меньшей мере один гидрофобный полимер является полиакрилатом. В других вариантах осуществления упомянутый по меньшей мере один гидрофобный полимер является сополимером метакрилата с замещением по меньшей мере одной аминогруппой. Термин "аминогруппа" означает включающий любую аминогруппу, такую как, например, NH3, вторичный амин, третичный амин и аммониевую группу. В одном конкретном варианте осуществления упомянутым полимером является амниотический сополимер метакрилата и более предпочтительно амниотический сополимер метакрилата типа А (например, АМСА Eudragit RLTM Degussa, Германия).
Следует понимать, что гидрофобный полимер в соответствии с изобретением также охватывает сополимеры или смесь гидрофобных положительно заряженных полимеров с гидрофобными не положительно заряженными полимерами, например, в которых по меньшей мере 30% гидрофобного полимера имеет положительный заряд. В таких вариантах осуществления смесь гидрофобных полимеров может, кроме того, включать полиэтилен, полиметакрилат, полиамид-нейлон, полиэтиленвинилацетат, нитрат целлюлозы, силиконы, этилцеллюлозу и любое их сочетание. Используемый здесь термин "полимер, имеющий аминогруппу и метакриловую группу" относится к полимерам, а также сополимерам, имеющим метакриловые группы, замещенные аминогруппами, в качестве мономеров. Пример таких полимеров можно найти, например, у Аггелики И. и др. (Aggeliki I. et al) [20]. Термин "гидрофильный полимер" относится к полимерам (включая сополимеры и смеси полимеров), которые растворяются в водных средах, таких как жидкости тела (например, внеклеточная жидкость, тканевая жидкость, плазма, кровь или слюна). Отметим, что такие полимеры создают поры в мембране при воздействии водных сред. В некоторых вариантах осуществления упомянутый по меньшей мере один гидрофильный полимер выбирают из группы, состоящей из гидроксилпропилметилцеллюлозы, гидроксилпропилцеллюлозы, карбоксиметилцеллюлозы, гидроксиэтилцеллюлозы, поливинилового спирта, полисахаридов, альгината натрия, поливинилпирролидона, модифицированного крахмала, полиэтиленгликоля, оксида полиэтилена и желатина.
Термин "пластификатор" относится к соединению, способному придавать мембране гибкость. Пластификатор, используемый в соответствии с настоящим изобретением, не должен быть токсичным к клеткам. В некоторых конкретных вариантах осуществления упомянутый пластификатор не токсичный к стволовым клеткам. В некоторых вариантах осуществления упомянутый по меньшей мере один пластификатор выбирают из группы, состоящей из полиэтиленгликоля, оксида полиэтилена, триэтилцитрата, ацетилтриэтилцитрата, трибутилцитрата, ацетилтрибутилцитрата, триацетина, дибутилсебацината, диэтилфталата, пропиленгликоля, метоксиэтиленгликоля и желатина.
В некоторых вариантах осуществления мембрана согласно изобретению включает по меньшей мере один пластификатор, который растворим в воде. Неограничительный перечень водорастворимых пластификаторов включает: ПЭГ, триэтилцитрат, ацетил-триэтилцитрат, трибутилцитрат, ацетилтрибутилцитрат, триацетин, дибутилсебацинат, диэтилфталат, пропиленгликоль, метоксиэтиленгликоль и желатин. В некоторых вариантах осуществления упомянутый по меньшей мере один пластификатор и по меньшей мере один гидрофильный полимер совместимы со стволовыми клетками.
Как будет продемонстрировано в примерах ниже, ПЭГ доказал нетоксичность к стволовым клеткам. Поэтому в одном конкретном варианте осуществления, в котором мембрана включает стволовые клетки, предпочтительным пластификатором и/или гидрофильным полимером является ПЭГ.
Термин "полиэтиленгликоль (ПЭГ)" относится к полимерам полиэтиленгликоля, которые растворимы в водных средах. В некоторых вариантах осуществления мембраны настоящего изобретения используется ПЭГ в диапазоне 300-20000. В других вариантах осуществления мембраны настоящего изобретения используется ПЭГ 400. В некоторых вариантах осуществления упомянутым гидрофильным полимером является полиэтиленгликоль в диапазоне от 300 до 20000. В других вариантах осуществления упомянутым пластификатором является полиэтиленгликоль в диапазоне в диапазоне от 300 до 20000. В других вариантах осуществления упомянутым гидрофильным полимером и упомянутым пластификатором является полиэтиленгликоль в диапазоне от 300 до 20000.
Без привязки к теории, в таких случаях ПЭГ кажется выполняет в мембране двойную функцию; он способствует гибкости мембраны и приводит к созданию пор при растворении. Как продемонстрировано в Примерах ниже, пористость (количество пор в мембране) увеличивается согласно концентрациям ПЭГ в мембране. Кроме того, повышенная пористость коррелируется с повышенной адгезией клеток. В других вариантах осуществления изобретения упомянутый по меньшей мере один гидрофильный полимер присутствует в концентрации приблизительно от 0,5 мас.% до 30 мас.% от массы мембраны. В других вариантах осуществления упомянутый по меньшей мере один гидрофильный полимер присутствует в концентрации приблизительно от 10 мас.% до 25 мас.% от массы мембраны. В одном конкретном варианте осуществления упомянутый по меньшей мере один гидрофильный полимер выбирают из группы, состоящей из гидроксилпропилметилцеллюлозы, гидроксилпропилцеллюлозы, карбоксиметилцеллюлозы, гидроксиэтилцеллюлозы в концентрации приблизительно от 0,5 мас.% до 20 мас.% от массы мембраны. В еще одном конкретном варианте осуществления упомянутым по меньшей мере одним гидрофильным полимером является ПЭГ в концентрации приблизительно от 1 мас.% до 30 мас.%, или приблизительно от 10 мас.% до 25 мас.%, или приблизительно 15% от массы мембраны.
В еще одном варианте осуществления мембрана настоящего изобретения, кроме того, включает по меньшей мере один тип клеток. В некоторых вариантах осуществления упомянутые клетки выбирают из группы, состоящей из стволовых клеток взрослого человека, стволовых клеток эмбриона, плюрипотентных стволовых клеток, мезенхимальных стволовых клеток, клеток крови пуповины, остеобластов, хондробластов и клеток CD 105+. В других вариантах осуществления упомянутые стволовые клетки являются аутогенными стволовыми клетками взрослого человека. Плюрипотентные мезенхимальные стволовые клетки имеют способность претерпевать коммитирование в несколько последовательностей клеточных поколений, включая остеобласты, адипоциты, хондроциты и миоциты.
В одном варианте осуществления мембрана настоящего изобретения включает АМСА (амниотический сополимер метакрилата типа А), полиэтиленгликоль в диапазоне от 300 до 20000 (в количестве, достаточном для того, чтобы являться и пластификатором, и гидрофильным полимером, способным образовывать поры при контакте с водными жидкостями in situ) и стволовые клетки взрослого человека. Используемый здесь термин "адгезия клеток" или "слипание клеток" относится к связыванию/прикреплению клетки к поверхности при сохранении жизнеспособности. Используемый здесь термин "пролиферация клеток" или "рост клеток" относится к репродукции и увеличению количества клеток, т.е. к делению клеток.
Используемый здесь термин "дифференциация клеток" относится к процессу, в котором менее специализированная клетка становится клеткой более специализированного типа. Например, стволовые клетки взрослого человека делятся и создают полностью дифференцированные дочерние клетки во время восстановления ткани и во время нормального оборота клеток, например, мезенхимальные стволовые клетки могут дифференцироваться в остеобласты.
Мембраны настоящего изобретения способны поддерживать слипание клеток, пролиферацию клеток и/или дифференциацию клеток.
Мембраны согласно настоящему изобретению проявляют такие качества, как способность (i) развивать прямую адгезию и связь с существующей тканью; (ii) способствовать клеточной функции; (iii) создавать каркас или шаблон для формирования новой ткани и (iv) способствовать регенерации ткани и действовать как носитель для биологически активных материалов.
В некоторых вариантах осуществления мембрана настоящего изобретения, кроме того, включает по меньшей мере одно активное вещество, способное содействовать репродукции ткани и/или доставлять фармацевтические преимущества, необходимые в месте имплантации упомянутой мембраны.
В других вариантах осуществления мембрана настоящего изобретения, кроме того, включает по меньшей мере одно активное вещество, причем упомянутое по меньшей мере одно активное вещество выбирают из группы, состоящей из цитокина, гормона, бисфосфоната, каннабиноида, бета-блокатора, вещества, индуцирующего кость, фактора роста, ингибитора редуктазы HMG-CoA (такого как статины), лекарство и антибиотик и любые их сочетания.
В некоторых вариантах осуществления упомянутое активное вещество выбирают из группы, состоящей из статина, эстрогена, андрогена, пропранолола, трансформирующего фактора роста (TGF), морфогенетического белка кости (BMP, такого как, например, ВМР-2 и ВМР-7), инсулиноподобного гормона роста, фибробластного гормона роста (FGF), алендроната, ризендроната и паратиреоидного гормона. В еще одном варианте осуществления упомянутым активным веществом является симвастатин или ловастатин.
Симвастатин принадлежит к статиновому семейству ингибиторов редуктазы А кофермента 3-гидрокси-3-метил-глютарил, которые широко используются в качестве лекарств, снижающих холестерин. Статины могут увеличивать массу тела через анаболические и антикатаболические (антирезорбтивные) механизмы.
В некоторых вариантах осуществления упомянутое вещество находится в препарате с контролируемым высвобождением.
В еще одном конкретном варианте осуществления мембрана включает АМСА, ПЭГ и по меньшей мере одно активное вещество (например, симвастатин). В некоторых вариантах осуществления мембрана настоящего изобретения способна быть пористой после гидратации (например, гидратации, достигнутой при контакте с жидкостями тела в месте имплантации), причем размер пор составляет приблизительно от 0,1 до 5 мкм.
В некоторых вариантах осуществления мембрана настоящего изобретения может иметь по меньшей мере одну пору размером меньше 5 мкм из-за гидратации упомянутого водорастворимого пластификатора. В других вариантах осуществления упомянутый размер поры меньше 2 мкм. В других вариантах осуществления упомянутый размер пор составляет приблизительно от 0,1 до 5 мкм.
Используемый здесь термин "гидратация" относится к воздействию на мембрану настоящего изобретения водного раствора или жидкости тела, например, тканевой жидкости, крови, плазмы, слюны, что приводит к растворению водорастворимого, пластификатора.
В другом аспекте изобретение предлагает использование мембраны настоящего изобретения для изготовления трехмерного полого импланта для регенерации ткани в области поврежденной ткани.
Из-за гибкости мембраны настоящего изобретения можно выполнить трехмерный имплант, используя упомянутую мембрану, без необходимости предварительного литья или формования мембраны или воздействия на нее теплотой. Трехмерная структура, выполненная из упомянутой мембраны, может быть любого типа, подходящего для места имплантации, и может быть, кроме того, отрегулирована на месте имплантации в соответствии с областью, в которой должен использоваться упомянутый имплант. В некоторых вариантах осуществления упомянутый трехмерный полый имплант выбирают из группы, состоящей из трубчатого импланта, цилиндрического импланта, конического импланта или плоского импланта.
В еще одном варианте осуществления упомянутую ткань, регенерируемую при использовании мембраны настоящего изобретения, или изготовленный из нее трехмерный полый имплант выбирают из связки, сухожилия, хряща, межпозвоночного диска, зубной ткани (включая зубы, эмаль, дентин, цемент, пульпу, периодонтальные связки, альвеолярный отросток, ткань десны) и кости.
В еще одном аспекте изобретение предлагает трехмерный полый имплант, включающий по меньшей мере одну мембрану настоящего изобретения. В одном варианте осуществления мембрана настоящего изобретения, содержащаяся внутри трехмерного полого импланта согласно изобретению, определяет поверхность импланта. В еще одном аспекте изобретение предлагает систему доставки клеток, включающую мембрану настоящего изобретения.
В другом аспекте изобретение предлагает поверхность для выращивания клеток, содержащую мембрану настоящего изобретения.
В еще одном из его аспектов изобретение предлагает каркас, в сущности покрытый мембраной настоящего изобретения.
Изобретение также предлагает гранулированный материал, в сущности покрытый мембраной настоящего изобретения. В некоторых вариантах осуществления гранулированный материал состоит из совместимой с костью керамики, например из минералов на основе кальция.
Изобретение, кроме того, предлагает способ содействия регенерации ткани в пораженной области ткани, включающий этапы: предоставления мембраны настоящего изобретения и имплантации упомянутой мембраны рядом с упомянутой областью пораженной ткани. В некоторых вариантах осуществления упомянутая дефектная ткань является результатом состояния, выбираемого из несросшегося перелома, остеопороза, заболевания или состояния периодонта, остеолитического заболевания кости, состояния после пластической хирургии, после ортопедической имплантации, после нейрохирургии, после процедур наращивания альвеолярного отростка, после артродеза позвонков, после перелома позвоночника.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
Чтобы понять изобретение и то, как оно может быть осуществлено на практике, теперь будут описаны варианты осуществления на неограничивающем примере и со ссылками на чертежи, на которых:
Фиг.1A-1F - микроснимки адгезии МСК (мезенхимных стволовых клеток человека) на полистирольной чашке для культивирования ткани и на мембране АМСА. МСК, помеченные CFSE, были посеяны на полистирольной чашке для культивирования ткани (А-С) или на мембране (D-F). Спустя 24 часа клетки, помеченные CFSE, рассмотрели с помощью конфокальной микроскопии. Показаны три представительных изображения для каждого состояния культивирования.
Фиг.2A-2F - снимки со сканирующего электронного микроскопа, показывающие адгезию МСК на мембранах из АМСА/ПЭГ. МСК были посеяны на мембрану АМСА с ПЭГ 400. Спустя 24 часа культивирования клетки зафиксировали, как описано в разделе "Материалы и способы", и выполнили анализ, используя сканирующий электронный микроскоп (СЭМ). Увеличение изображений слева направо: верхняя панель - ×200 (Фиг.2А), ×1000 (Фиг.2 В), ×2000 (Фиг.2С); ×4000 (Фиг.2D), ×5000 (Фиг.2Е), ×6000 (Фиг.2F).
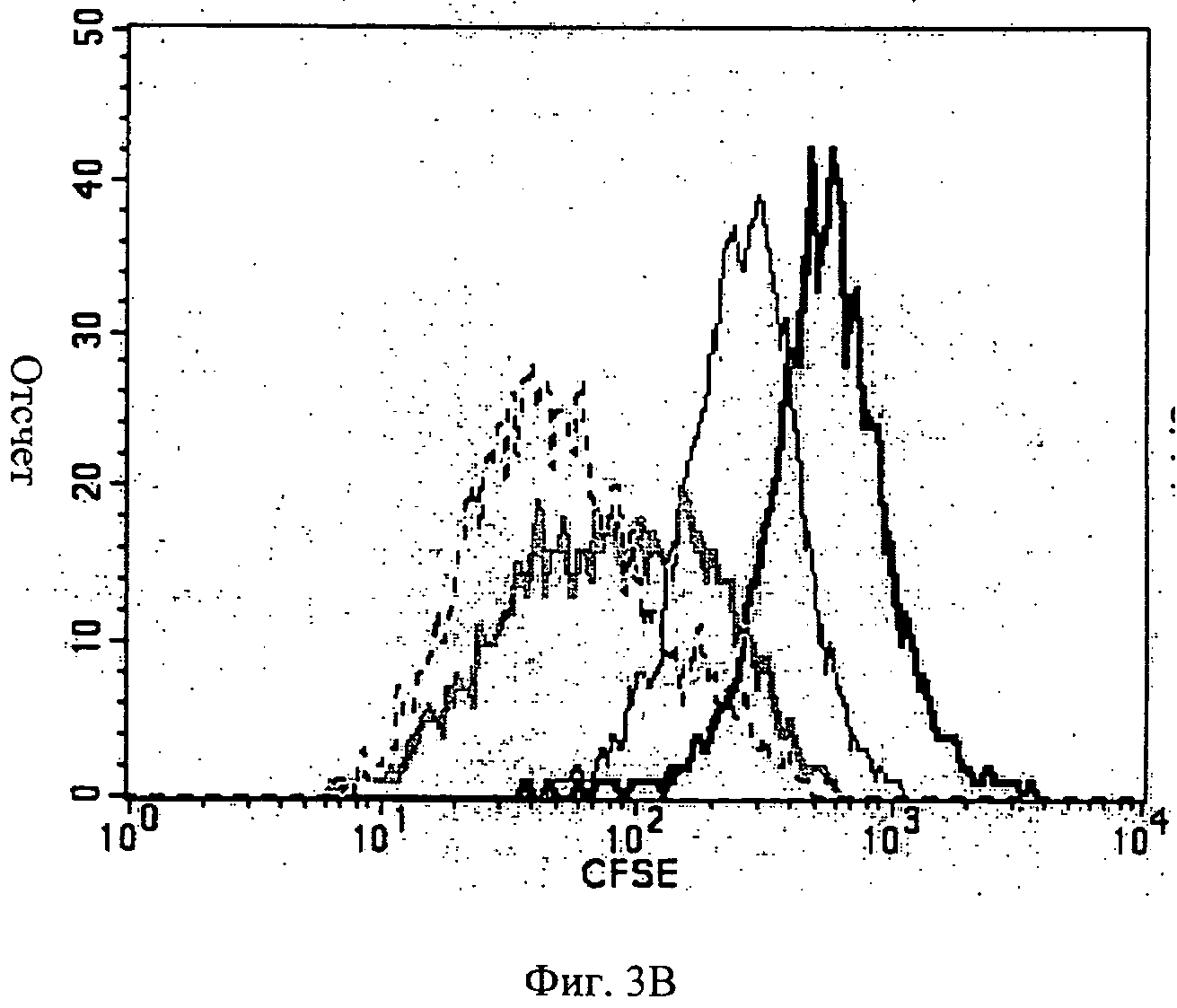
Фиг.3А-3В - показан проточный цитометрический анализ МСК, помеченных CFSE. 1×105 МСК, помеченных CFSE, культивировали или на мембране АМСА с 15% ПЭГ 400 (Фиг.3А), или на полистирольной чашке для культивирования ткани (Фиг.3В) в течение 24, 48, 96 и 144 часов. В указанное время клетки собрали и выполнили проточный цитометрический анализ. Утрата CFSE отражает деление клеток.
Фиг.4 - график, показывающий пролиферацию МСК на мембранах АМСА, изготовленных с разными концентрациями ПЭГ 400. МСК, помеченные CFSE, культивировали и анализировали, как показано на Фиг.3. Данные представлены как средняя интенсивность флуоресценции (СИФ) CFSE по времени для мембран АМСА, содержащих разные концентрации ПЭГ 400, против полистирольной чашки для культивирования ткани (контрольная). Уменьшение в СИФ представляет скорость пролиферации МСК по времени.
Фиг.5А-5С - снимки мембран АМСА со сканирующего электронного микроскопа: мембраны были изготовлены способом литья в растворителе. Мембраны затем проанализировали с использованием СЭМ или погружали в фосфатный буферный физраствор (ФБФ) на 24 часа и затем анализировали под СЭМ. (Фиг.5А): мембрана с 15% ПЭГ 400 перед погружением в ФБФ - пористости не видно; (Фиг.5В): мембрана с 5% ПЭГ после погружения в ФБФ - немного пористая; (Фиг.5С): мембрана с 15% ПЭГ после погружения в ФБФ - пористая. Увеличение: ×5000.
Фиг.6А-6В - дифференциация МСК на мембранах АМСА. 1×105 МСК культивировали или на мембране, или на полистирольной чашке для культивирования ткани. Спустя 3 суток, когда клетки достигли среды сплошной дифференциации, содержащей питательную среду с аскорбиновой кислотой (50 мкг/мл), добавили дексаметазон (10~8 М) и P-глицерофосфат (10 мМ), и клетки получали свежую среду для дифференциации два раза в неделю. На 17-е сутки культивирования клетки зафиксировали 70% этанолом и выполнили окрашивание ализариновым красным. (Фиг.6А): контрольная полистирольная чашка; (Фиг.6В): мембрана АМСА с 15% ПЭГ 400.
Фиг.7 - график, показывающий регенерацию кости по средней области каллуса. Увеличившуюся среднюю область каллуса измеряли в костях с имплантированными мембранами АМСА для сравнения с необработанными контрольными экземплярами.
Фиг.8А-8В - график, показывающий количественный анализ относительных изменений плотности каллуса по времени (Фиг.8А) и изменений области каллуса по времени (Фиг.8В), наблюдавшихся для этилцеллюлозной мембраны и этилцеллюлозной мембраны, контролируемо высвобождавшей симвастатин, у 6 самцов новозеландских кроликов, для которых был создан дефект критического размера (10 мм) в обоих предплечьях. В предплечье ввели этилцеллюлозную (ЭЦ) мембрану, которая содержала симвастатин; в противоположную конечность ввели ЭЦ-мембрану. Калибровку осуществили с использованием программного обеспечения Osirix.
Фиг.9 - микроснимок компьютерной томографии регенерации кости с ЭЦ-мембраной. В этом эксперименте дефект кости был оставлен необработанным. Дефект кости был в состоянии несрастания. Стрелками отмечена область дефекта кости.
Фиг.10 - микроснимок компьютерной томографии регенерации кости с ЭЦ-мембраной, содержащей симвастатин. В этом эксперименте дефект кости был обработан, и показано успешное перекрывание дефекта. Стрелками отмечена область дефекта кости.
Фиг.11А-11В - график, показывающий рост средней области каллуса для мембраны АМСА настоящего изобретения с добавлением и без симвастатина с контролируемым высвобождением. А - результаты через 4 недели после имплантации мембраны АМСА + симвастатин. В - результаты, полученные через 8 недель после имплантации мембраны АМСА + симвастатин
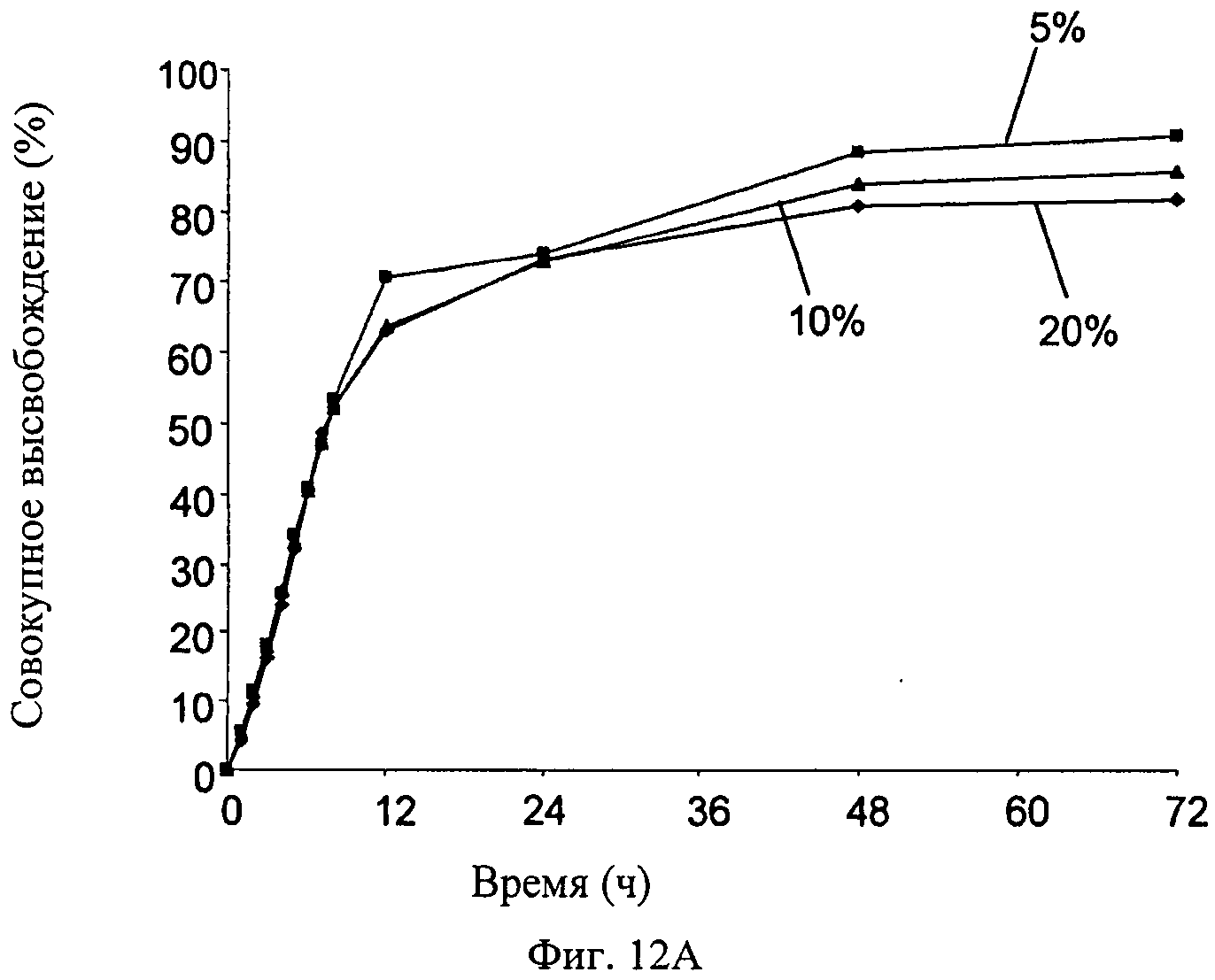
Фиг.12A-12D - график, показывающий влияния различных параметров на высвобождение симвастатина из мембраны настоящего изобретения (измерено in vitro): влияние концентрации симвастатина на скорость высвобождения симвастатина (Фиг.12А); влияние ширины мембраны на скорость высвобождения симвастатина (Фиг.12В); влияние пластификатора на скорость высвобождения симвастатина (Фиг.12С); влияние типа пластификатора на скорость высвобождения симвастатина (Фиг.12D).
Фиг.13А-13В - график, показывающий параметры регенерации кости, достигнутые с мембраной АМСА как носителем МСК на модели дефекта критического размера у кролика. На Фиг.13А показан рост области каллуса. На Фиг.13В показана гистологическая оценка дефектов спустя 8 недель после имплантации мембраны.
ПОДРОБНОЕ ОПИСАНИЕ ВАРИАНТОВ ОСУЩЕСТВЛЕНИЯ
Настоящее изобретение предлагает мембрану, состоящую по меньшей мере из трех элементов, во-первых, синтетического гидрофобного полимера с положительным поверхностным зарядом, который не является биоразлагаемым в физиологических условиях, по меньшей мере одного гидрофильного полимера, который является биоразлагаемым в физиологических условиях, и по меньшей мере одного пластификатора. Без привязки к теории, сочетание этих элементов создает мембрану, которая достаточно гибкая, чтобы создавать трехмерные структуры, подходящие для различных терапевтических применений, например, в форме полой трубки. Более того, после воздействия жидкости (in vivo или ex vivo), гидрофильный полимер по меньшей мере частично разлагается, и мембрана становится пористой, этим позволяя адгезию клеток.
Клетки могут быть посеяны на мембрану настоящего изобретения, как будет подробно описано ниже.
В других вариантах осуществления мембрана настоящего изобретения может, кроме того, включать активное вещество, как будет объяснено ниже.
Мембрана настоящего изобретения может служить в качестве инфраструктуры для направленного восстановления ткани, а также в качестве системы доставки клеток. Мембрана настоящего изобретения также может служить в качестве барьерной мембраны для предотвращения инфильтрации нежелательных клеток, кровеносных сосудов и мягкой/рубцовой ткани в обрабатываемую область, а также для изоляции клеток, доставленных в упомянутую мембрану из окружающей ткани, и предотвращения утечки клеток и факторов из пространства внутри мембраны в окружающую ткань.
Мембрану настоящего изобретения можно использовать как таковую, например, путем закрытия области, в которую доставлены клетки, однако в некоторых вариантах осуществления ее можно использовать для формирования трехмерного устройства (например, полого трубчатого устройства), которое удерживает доставляемые клетки, или чтобы покрыть каркас для создания ткани, содержащий доставляемые клетки.
В некоторых вариантах осуществления мембрана настоящего изобретения сложена в желательную трехмерную структуру, например трубчатое устройство. Такое трубчатое устройство можно использовать в качестве инфраструктуры для направленного восстановления ткани, а также для доставки клеток в трубчатую область дефекта, такого как дефект кости, и мембрану можно использовать для удержания доставленных клеток и компонентов в устройстве и для предотвращения инфильтрации клеток, внеклеточного матрикса и кровеносных сосудов из окружающей ткани в пространство, окруженное устройством.
В других вариантах осуществления мембрану настоящего изобретения используют для покрытия каркаса для создания ткани. Такой каркас из покрытой мембраны может удерживать клетки, доставляемые в какое-то место тела. Покрытие мембраны изолирует клетки, доставленные в каркас из окружающей ткани, и препятствует утечке клеток и растворимых факторов из пространства внутри каркаса в окружающую ткань. Покрытие каркаса мембраной настоящего изобретения может позволить получить улучшенную адгезию клеток и повышенные дозы клеток, доставляемых в целевое место. В других вариантах осуществления область дефектной кости может быть обернута после имплантации каркаса мембраной настоящего изобретения, чтобы предотвратить утечку клеток и растворимых факторов и предотвратить рост мягкой ткани в каркасе. Термин "доставка клеток" относится к введению клеток в желательное место тела пациента в терапевтических целях.
Мембрана настоящего изобретения подходит для посева клеток любых типов, например стволовых клеток (как стволовых клеток взрослого человека, так и стволовых клеток эмбриона). В других вариантах осуществления тип клеток может быть выбран из следующего не ограничивающего перечня: мезенхимальные (стромальные) стволовые клетки, клетки крови пуповины, остеобласты, хондробласты или клетки CD 105+. Изобретение также охватывает посев плюрипотентных стволовых клеток эмбрионального происхождения, а также клеток взрослого человека, которые были перепрограммированы, чтобы стать плюрипотентными. Клетки могут быть аутогенными, аллогенными или ксеногенными.
В некоторых вариантах осуществления клетками являются аутогенные стволовые клетки взрослого человека, полученные, например, из костного мозга или жировой ткани. Посев клеток выполняют в некоторых вариантах осуществления ex vivo. Клетки могут быть помещены на мембрану (например, выполненную в форме полого трубчатого устройства) или помещены в матрицу для создания ткани (также называемую здесь "каркас"), покрытую мембраной настоящего изобретения. Примерами матрицы для создания ткани являются матрицы, изготовленные из биологических материалов или синтетических полимеров.
В некоторых вариантах осуществления мембрану настоящего изобретения, трубчатый имплант согласно изобретению или покрытый каркас согласно изобретению, с клетками, посеянными ех vivo, или без них помещают в желательное место тела. Такое место обычно является местом, где желательно создать новую ткань вместо поврежденной в результате травмы, хирургического вмешательства, генетических или болезненных процессов.
В некоторых вариантах осуществления желательным местом является место, где необходимо создать ткань из стволовых клеток взрослого человека; в некоторых вариантах осуществления таким местом являются связка, сухожилие, хрящ, межпозвоночный диск, дентин или костная ткань, наиболее предпочтительно костная ткань. Создание костной ткани необходимо в таких условиях, как несрастание переломов, остеопороз, заболевание периодонта или имплантация зубов, остеолитическое заболевание кости, период после пластической хирургии, после ортопедической имплантации, после нейрохирургии с удалением свода черепа, после процедур наращивания альвеолярного отростка, после артродеза позвонков, после перелома позвоночника. Создание ткани сухожилия/связки требуется, например, после разрыва ткани вследствие травмы или воспалительных состояний.
Создание ткани хряща требуется в таких условиях, как ревматоидный артрит, остеоартрит, травма, хирургия при раке или косметическая хирургия. Создание тканей межпозвоночного диска, включая nucleous pulposus и annulus fibrosus, требуется в таких условиях, как дегенерация nucleous pulposus, разрывы annulus fibrosus или после нуклеотомии или дискэктомия.
Обычно мембрану, например в форме полой трубки, помещают в желательное место путем имплантации.
В некоторых вариантах осуществления мембрана настоящего изобретения содержит синтетический гидрофобный положительно заряженный полимер, гидрофильный полимер, пластификатор и активное вещество, а также засеяна клетками. В одном конкретном варианте осуществления мембрана настоящего изобретения содержит синтетический гидрофобный положительно заряженный полимер и ПЭГ и, кроме того, засеяна стволовыми клетками. Используемый здесь термин "поверхность для роста клеток" относится к любой искусственной поверхности, подходящей для роста клеток, например предметное стекло, сосуд или чашка для культивирования клеток/ткани. Поверхность для роста клеток, покрытая мембраной в соответствии с изобретением, этим приобретает свойства, подходящие для адгезии, пролиферации и/или дифференциации клеток. Настоящее изобретение предлагает гибкую мембрану, способную поддерживать адгезию, пролиферацию и дифференциацию МСК. Такую мембрану можно использовать как средство лечения в применении в регенерации кости. Лечение смещенных переломов и регенерация дефектов кости не происходит только из-за пролиферации локально присутствующих остеобластов, но включает пополнение, пролиферацию и дифференциацию преостеобластических клеток. Дифференциация мультипотентных остеобластических прекурсоров является главным начальным событием при лечении кости и формировании каллуса, хотя уже существующие остеобласты также могут быть задействованы. Любая неудача в пополнении, создании, пролиферации и дифференциации этих клеток-предшественников может привести к задержке в срастании или несрастанию. Существует много трудностей, связанных с лечением дефектов кости критического размера. В общем, эти трудности являются результатом того, что существует недостаточное количество и/или активность остеобластов организма-хозяина, чтобы позволить лечение.
Мембрана настоящего изобретения может направлять регенерацию кости, а также предотвращать нежелательную васкуляризацию в новообразованной кости. Мембрана также может защищать область дефекта кости от инфильтрации соединительных и рубцовых тканей, направлять остеобласты и позволять хранить остеогенные компоненты в пространстве, окруженном мембраной, которое может быть потенциально высвобождено с концов кости и костного мозга [10, 12]. Кроме того, помещение МСК, прикрепленных к мембране в месте модели дефекта критического размера, даст исходный материал для новой ткани кости. Поэтому имплантация мембраны НРК с расширенными ex vivo МСК может значительно улучшить результат восстановления кости. Как продемонстрировано в Примерах ниже, были проверены несколько полимеров в сочетании с разными пластификаторами.
В одном варианте осуществления мембрана, состоящая из АМСА и 15% ПЭГ 400, могла поддерживать хорошую адгезию, пролиферацию и дифференциацию МСК: (I) МСК, сросшиеся с мембраной АМСА с 15% ПЭГ 400, что определено световой микроскопией, флуоресцентной микроскопией и СЭМ. (II) МСК поддерживают их активность в пролиферации, что определено окрашиванием CFSE и проточным цитометрическим анализом; (III) МСК поддерживали их способность к дифференциации, что определено окрашиванием ализариновым красным.
Мембрана АМСА, содержащая 15% ПЭГ 400, поддерживала дифференциацию МСК в остеобласты.
Материалы и способы
Полимеры: сополимер аммония-метакрилата типа A NF (AMCA, Eudragit® RL, Degussa, Германия) и этилцеллюлоза (ЕС, Ethocel® N 100, Hercules Inc, Уилмингтон, штат Делавэр, США).
Пластификаторы: полиэтиленгликоль 400 (ПЭГ 400, Merck, Германия), глицерилтриацетат (Триацетин, Fluka, Rehovot, Израиль), глицерин (Frutarom, Израиль), триэтилцитрат (Fluka, Rehovot, Израиль), дибутилсебацинат (Fluka, Rehovot, Израиль), дибутилфталат (Fluka, Rehovot, Израиль).
Изготовление и стерилизация полимерных мембран - Мембраны изготовили с использованием способа литья в растворителе, как сказано у Фридмана М. и Голомба Г. (Friedman М. and Golomb G. J) [13]. Полимерные мембраны были отлиты из раствора, состоящего из полимера, пластификатора и этанола (Frutarom, Израиль), в тефлоновые формы (круглые пластины, внутренний диаметр 9,6 см) и растворителю дали испаряться в течение ночи. Ширина мембран составляла: 100±5 мкм. Перед использованием в культивировании ткани мембраны погрузили в раствор ФБФ (Biological Industries, Beit Haemek, Израиль) на 24 часа, чтобы вымыть возможные остатки этанола, и затем стерилизовали УФ-излучением в течение 2 часов. Определение характеристик мембран - микрофотографии, полученные сканирующей электронной микроскопией (СЭМ) - Мембраны AMCA, содержащие 15% ПЭГ 400, фиксировали 2% глутаральдегидом в кокодилатном буфере (0,1 М; pH 7,2) в течение 2 часов. Затем образцы обрабатывали по способу воздушной сушки, пропуская последовательность дегидрирования этанолом (этанол растворяет AMCA, поэтому он должен быть исключен из подготовки образцов). Процесс завершили через 100% фреон 113. Образцы энергично встряхивали, что позволило быстро испарить фреоновую фазу. Мембраны установили в медные штыри, покрыли золотом и затем исследовали в приборе "FEI quanta 200" при ускоряющем напряжении 30 кВ. Сбор и культивирование клеток - МСК получили из утилизируемых костных тканей пациентов, перенесших хирургические операции по полной замене бедра, с одобрения Хельсинского комитета по этике Медицинского центра Хадасса (Hadassah Medical Center Helsinki Ethics Committee) после информированного согласия. Образцы МСК были отделены от других клеток, присутствовавших в костном мозге, путем сцепления с пластиком и затем выращивались в условиях культивирования тканей, которые описаны в работах Крампера М. и др. (Krampera М. et al.) [14] и Джоуада Ф. и др. (Djouad F et al) [15]. Клетки выдерживали в модифицированной среде с низким содержанием глюкозы Dulbecco's Modified Eagle Medium (DMEM), дополненной 10% фетальной телячьей сывороткой, инактивированной нагреванием, 2 мМ глутамина и пенициллином/стрептомицином (Biological Industries, Beit-Haemek, Израиль). Первичные культуры обычно выдерживали в течение 12-16 суток и затем отделяли трипсинизацией и пересевали (Барри Ф.П. и др. (Barry FP. et al.) [16]). Среду меняли каждые 3-4 суток.
Адгезия МСК к мембране - Для мечения МСК повторно суспендировали в ФБФ (107 клеток/мл), содержащем 5-карбоксифлуоресцеиндиацетоксиметилэфир (BCECF/AM или CFSE; 5 мкг/мл; Calbiochem), инкубировали при 37°C в течение 10 минут и затем клетки промывали три раза. Клетки культивировали на стерилизованной мембране, смоченной ФБФ, 15×104 клеток в 150 мкл среды, и инкубировали в течение 6 часов при 37°C. После этого добавили 3 мл среды. Клетки изучали через 24 часа после посева под флуоресцентным микроскопом. Полистирольные чашки для культивирования тканей использовали как положительный контроль для мембраны в проверке адгезии клеток.
Анализ пролиферации на основе CFSE - Для исследований деления клеток МСК повторно суспендировали в ФБФ (107 клеток/мл), содержащем 3'-0-ацетил-2',7'-бис(карбоксиэтил)-4 или 5-карбоксифлуоресцеин диацетоксиметилэфир (BCECF/AM или CFSE; 5 мкг/мл; Calbiochem), инкубировали при 37°C в течение 10 минут и промыли три раза. Клетки, помеченные CFSE, затем посеяли на мембране или на чашках для культивирования тканей, указанных выше. В указанное время клетки собирали и пролиферацию клеток визуально исследовали по нарастающей потере флуоресценции CFSE на проточном цитометре FACSCalibure (Becton Dickinson) с использованием программного обеспечения Cell Quest.
Дифференциация МСК на мембране - МСК посеяли на мембраны или на чашки для культивирования с центральным колодцем (Falcon) для контроля, как сказано выше. Как только МСК слились, питательную среду дополнили аскорбиновой кислотой (50 мкг/мл), дексаметазоном (10 М-8) и P-глицерофосфатом (10 мМ). Среду меняли два раза в неделю в течение 17 суток, после чего мембраны и чашки окрасили ализариновым красным, как сказано выше.
Окрашивание ализариновым красным - Основной раствор 2% ализаринового красного в дистиллированной воде корректировали до pH 4,2 с помощью NaOH и пропустили через фильтр 0,22 мкм. Культуры в чашках с центральным колодцем три раза промыли 150 мМ NaCl, зафиксировали в ледяном 70% этаноле, промыли дистиллированной водой и окрашивали при комнатной температуре в течение 10 минут, используя 500 мкл основного раствора ализаринового красного на один колодец. Отдельные колодцы промывали пять раз дистиллированной водой; шестую и последнюю промывку выполняли в течение 15 минут (Халворсен Й.Д. и др. (Halvorsen YD. et al.) [17]). Мембраны из-за их положительного заряда имели более высокое сродство к ализариновому красному, чем отрицательно заряженные чашки для культивирования с центральным колодцем, поэтому промывка дистиллированной водой не удалила краситель с мембран достаточно хорошо. Для уменьшения фона мы применили для мембран одинарную промывку с использованием 0,02 М НС1. Затем получили микрофотографии.
Пример 1 - Адгезия клеток с использованием мембраны настоящего изобретения
Были проверены разные мембраны на их способность поддерживать прикрепление и рост клеток. Проверенные мембраны отличались по их полимеру и типу пластификатора. Были проверены несколько пластификаторов, т.е. глицерин, полиэтиленгликоль, триэтилцитрат, дибутилсебацинат, дибутилфталат, триацетин. Проверенные пластификаторы были гидрофобными или гидрофильными и были добавлены для повышения гибкости мембраны. МСК были посеяны на стерилизованных мембранах, как сказано выше.
ЭЦ-мембраны: клетки МСК показали небольшую адгезию ко всем составам ЭЦ-мембран, и агрегация клеток была слабой. Разные пластификаторы не оказали влияния на адгезию клеток или форму клеток. В качестве контрольных использовали мембраны, покрытые поли-1-лизином. Поли-1-лизин, аминокислотная цепь с высоким положительным зарядом, обычно используется в качестве вещества покрытия для содействия адгезии клеток в культуре. Клетки прилипли в форме однослойного веретена к ЭЦ-мембранам, покрытым поли-1-лизином, отсюда был сделан вывод, что этилцеллюлоза не поддерживает адгезию клеток, как таковая. Однако было обнаружено, что этилцеллюлоза не токсична в присутствии поли-1-лизина.
Мембраны АМСА: Проверку на адгезию клеток выполнили с сополимером аммоний-метакрилата типа А (АМСА, Eudragit RL™, Degussa, Германия) [85%], смешанным с разными пластификаторами, указанными выше [15%]. МСК хорошо слипались с мембранами АМСА, изготовленными с разными пластификаторами (Фиг.1D-F) в форме однослойного веретена. Распространение клеток по мембранам АМСА было сходно с распределением на полистирольных чашках, которые использовали в качестве положительного контроля для адгезии клеток (Фиг.1А-С). Вид распределения указывает на хорошее состояние клеток.
Адгезию клеток далее анализировали, используя СЭМ. Как показано на Фиг.2, клетки на мембранах АМСА были плоскими и имели форму однослойного веретена. Кроме того, при более высоком увеличении было видно взаимодействие между клетками и мембраной, причем ножки клеток были прикреплены к мембране (Фиг.2, D-F). Более того, наблюдалось высвобождение многочисленных вакуолей с поверхности клеток, что продемонстрировало функциональность клеток. Подобные результаты были получены при использовании человеческих и кроличьих МСК.
Пример 2 - Пролиферация клеток с использованием мембраны настоящего изобретения
Способность МСК к пролиферации проверили, используя флуоресцентный маркер деления клеток, CFSE и проточный цитометрический анализ. Этот способ основан на красителе CFSE, относящемся к флуоресцеинам, который разделяется с отличной надежностью между дочерними клетками, позволяя идентифицировать от 8 до 10 дискретных генераций как in vitro, так и in vivo. Этот способ позволяет получать комплексную информацию относительно кинетики пролиферации и дифференциации. Согласно этому способу отдельные клетки помечают флуоресцентным красителем CFSE, который необратимо связывается с цитоплазмой клетки. Когда клетки делятся, их флуоресценция последовательно делится наполовину с каждым поколением, позволяя контролировать по времени историю пролиферации любой одной клетки (см. Лайонс А.Б. и др. (Lyons АВ. Et al) [18]).
Клетки МСК пролиферировались на мембране АМСА с ПЭГ 400 (Фиг.3В) (но пролиферации не было отмечено с другими пластификаторами; данные не показаны), хотя и в чем-то с пониженной скоростью по сравнению с их способностью к пролиферации на чашках для культивирования ткани, используемых как контрольные (Фиг.3А).
Затем скорость пролиферации МСК по времени проверили на мембранах, содержащих разные концентрации ПЭГ 400 (10, 15, 20 и 25 мас.%). Скорость пролиферации МСК обратно коррелировалась со средним значением интенсивности флуоресценции (СИФ) (Фиг.4). Этот анализ показал, что мембраны, содержащие 15% ПЭГ 400 и 20% ПЭГ 400 были вполне близки к контрольным полистирольным чашкам, но другие концентрации ПЭГ показали более высокие или более низкие скорости пролиферации.
Кроме того, характеристики мембран АМСА с 15% и с 5% ПЭГ 400 получали с помощью сканирующей электронной микроскопии (СЭМ). Мембраны наблюдали до и после погружения в ФБФ (Фиг.5). Отметим, что мембраны погружали в ФБФ на 24 часа перед каждым посевом МСК, чтобы вымыть остаточный этанол. Поскольку ПЭГ 400 растворим в воде и, таким образом, является порогенным, только после погружения в ФБФ на поверхности мембран наблюдали поры (Фиг.5В-С). В обеих концентрациях ПЭГ 400 снимки СЭМ демонстрировали пористую поверхность при среднем размере пор 0,18 мкм. Распределение пор прямо коррелировалось с разными концентрациями ПЭГ 400.
Пример 3 - Дифференциация клеток с использованием мембраны настоящего изобретения
Среду для дифференциации добавили так, как сказано выше. Мембраны и чашки затем окрасили ализариновым красным (Фиг.6А и 6В). Ализариновый красный необратимо связывается с двухвалентными положительными ионами и имеет особенно высокое сродство с кальцием. Кальций секретируется остеобластами и отлагается на мембране как часть создания внеклеточного матрикса. Поэтому присутствие кальция отмечает дифференциацию из МСК, которые не секретируют кальций в остеобласт. На Фиг.6 показано, что МСК, культивированные на мембране АМСА и контрольных полистирольных чашках, дифференцировались в остеобласт и создали внеклеточный матрикс. Эти данные подтверждают, что мембрана АМСА с 15% ПЭГ 400 поддерживает дифференциацию МСК и что МСК после сцепления с мембраной сохраняют свои особенности стволовых клеток.
Пример 4 - Исследование регенерации кости in vivo с использованием мембраны настоящего изобретения
Группа для исследований: пяти самцам новозеландских кроликов весом 3,8-4,4 кг была сделана двусторонняя резекция в средней части радиального сегмента кости (длиной 1 см) в передних конечностях. Трубчатые мембраны АМСА были имплантированы в левую переднюю конечность (лечение остеотомии) и правая конечность служила в качестве контрольной (остеотомия не лечилась).
Оценка процесса лечения: рентгенографическая оценка - боковые рентгеновские снимки передних конечностей были сделаны через 2, 4, 6 и 8 недель после операции. Для получения стандартизированных измерений дефектов кости во время восстановительного лечения подлинные боковые рентгеновские снимки обеих передних конечностей были сделаны в стандартных условиях (42 кВ, 2 мА*с). Рентгеновские снимки исследовали, используя программное обеспечение OsiriX для обработки медицинских изображений, чтобы оценить площадь и плотность новой кости.
Измеряемые параметры
Общая площадь регенерируемой костной ткани (появляющейся вокруг дефекта кости и в нем). Для устранения возможного смещения из-за изменчивости размеров кости калибровку данных выполнили с использованием диаметра процесса локтевого отростка в его самой узкой зоне в качестве стандартного контрольного значения. Этот диаметр был определен как 10 мм в каждом образце.
Относительная плотность новой регенерированной кости в дефекте. Была очерчена сегментированная область, и была измерена плотность. Плотность кости в центре процесса локтевого отростка была измерена в каждой передней конечности для калибровки в качестве контрольного значения. Плотность процесса локтевого отростка была определена как 100% для каждого образца (см. Мошейф Р. и др. (MosheiffR. et al.) [10]). Результаты: на Фиг.7 показана регенерация кости, выраженная средней площадью каллуса (мм2) в течение исследования (недели 2-8). На неделе 2 исследования средняя площадь каллуса в контрольной конечности была больше, чем в конечности, обработанной мембраной АМСА, возможно из-за образования гематомы или сгустка крови на месте операции. Когда это место было окружено мембраной, она изолировала эту область и, таким образом, замедлила разрушение гематомы. Однако с недели 4 исследования средняя площадь каллуса, созданного в конечности, обработанной мембраной АМСА, была немного больше, чем таковая в контрольной конечности (144,8 мм2 против 114,5 мм2). Эта тенденция продолжилась на неделях 6 и 8, одновременно с увеличением разницы между средней площадью каллуса в конечности с мембраной АМСА и в контрольной конечности. На неделе 8 разница между средней площадью каллуса в двух конечностях (с мембраной АМСА и контрольной) достигла своего максимума и составила 143,91 мм2 (см. таблицу 1 ниже). Однако эта разница статистически незначащая из-за малого размера пробы (n=5) в этом предварительном исследовании и высокой изменчивости результатов, как часто бывает в исследованиях in vivo.
Пример 5 - Исследование регенерации кости in vivo с использованием ЭЦ-мембраны настоящего изобретения, кроме того, содержащей симвастатин
У 6 самцов новозеландских кроликов дефект критического размера (10 мм) был создан в обеих передних конечностях. В одну конечность была введена ЭЦ-мембрана, которая содержала симвастатин, в противоположную конечность была введена ЭЦ-мембрана без активного вещества. Плотность каллуса и площадь каллуса измеряли и калибровали, используя программное обеспечение Osirix. На Фиг.8А и 8В показаны результаты количественного анализа рентгенограмм.
На Фиг.9 показан микроснимок компьютерной томографии регенерации кости с ЭЦ-мембраной. В этом эксперименте дефект кости был оставлен необработанным, Дефект кости находится в состоянии несрастания. Стрелками указана область дефекта кости. На Фиг.10 показан микроснимок компьютерной томографии регенерации кости с ЭЦ-мембраной, содержащей симвастатин. Стрелками указана область дефекта кости. В этом эксперименте дефект кости был обработан, и очевидно успешное перекрытие дефекта.
Пример 6 - Исследование регенерации кости in vivo с использованием мембраны АМСА настоящего изобретения, кроме того, содержащей симвастатин
Модель кролика: Был создан дефект критического размера 1 см. 5 кроликов были обработаны мембраной АМСА с контролируемым высвобождением симвастатина, и еще 5 кроликов были обработаны мембраной АМСА без активного ингредиента.
Мембраны:
Мембрана АМСА, содержащая симвастатин:
- симвастатин 20 мас.% - 0,36 г;
- AMCA (eudragit RL) 70 мас.% - 1,26 г;
- ПЭГ40010 мас.% - 0,18 г;
- ширина мембраны = 180 мкм. Контрольная мембрана AMCA:
- AMCA (eudragit RL) 90 мас.% - 1,62 г;
- ПЭГ40010 мас.% - 0,18 г;
- ширина мембраны = 180 мкм.
На Фиг.11 показана значительно большая область каллуса, сформировавшаяся в месте дефекта, обработанном мембраной AMCA с контролируемым высвобождением симвастатина (суммированные ранговые критерии Вилкоксона), а также увеличение в скорости роста каллуса в 2 первые недели после операции - может быть важно с клинической точки зрения.
Пример 7 - Скорость высвобождения симвастатина из разных мембран изобретения in vitro
Влияния различных параметров на высвобождение симвастатина из мембран настоящего изобретения были измерены in vitro следующим образом. Влияние концентрации симвастатина на скорость высвобождения симвастатина показано на Фиг.12А; состав проверенных мембран был следующим:
Влияние ширины мембраны на скорость высвобождения симвастатина показано на Фиг.12В; состав проверенных мембран был следующим:
Влияние пластификатора на скорость высвобождения симвастатина показано на Фиг.12С; состав проверенных мембран был следующим:
Влияние типа пластификатора на скорость высвобождения симвастатина показано на Фиг.12D.
Пример 8 - Регенерация кости с мембраной АМСА, содержащей МСК
Модель кролика: был создан дефект кости критического размера 1 см. Два кролика были обработаны мембраной АМСА с МСК в одном предплечье и мембраной АМСА без МСК в другом предплечье.
Свойства мембраны:
- АМСА (eudragit RL) 85 мас.% - 1,512 г;
- ПЭГ 400 15 мас.% - 0,266 г;
- ширина мембраны = 180 мкм.
На Фиг.13А продемонстрировано развитие области каллуса в пораженной кости. Как показано на Фиг.13 В, гистологическая оценка разных частей дефектной кости через 8 недель после операции выше для костей с имплантированной мембраной АМСА, содержащей МСК.
Источники информации
1. Gerstenfeld LC, Cullinane DM, Barnes GL, Graves DT, Einhorn ТА. Fracture healing as a post-natal developmental process: molecular, spatial, and temporal aspects of its regulation. J Cell Biochem 2003; 88(5): 873-84.
2. Megas P. Classification of non-union. Injury 2005;3 6 Suppi 4: S3 0-7.
3. Crenshaw H. Delayed union and non-union of fractures. St. Louis: CV Mosby; 1987. 2053.118р.
4. Hemigou P, Poignard A, Beaujean F, Rouard H. Percutaneous autologous bone-marrow grafting for nonunions. Influence of the number and concentration of progenitor cells. J Bone Joint Surg Am 2005;87(7): 1430-7.
5. Kraus KH, Kirker-Head C. Mesenchymal stem cells and bone regeneration. Vet Surg 2006;35(3):232-42.
6. Cancedda R, Mastrogiacomo M, Bianchi G, Derubeis A, Muraglia A, Quarto R. Bone marrow stromal cells and their use in regenerating bone. Novartis Found Symp 2003; 249:133-43; discussion 143-7, 170-4, 239-41.
7. Cancedda R, Dozin В, Giannoni P, Quarto R. Tissue engineering and cell therapy of cartilage and bone. Matrix Biol 2003;22(1):81-91.
8. Tsuchiya K, Mori T, Chen G, Ushida T, Tateishi T, Matsuno T, Sakamoto M, Umezawa A. Custom-shaping system for bone regeneration by seeding marrow stromal cells onto a web-like biodegradable hybrid sheet. Cell Tissue Res 2004; 316(2): 141-53.
9. Meinig RP, Rahn B, Perren SM, Gogolewski S. Bone regeneration with resorbable polymeric membranas: treatment ofdiaphyseal bone defects in the rabbit radius with poly(L-lactide) membrana. A pilot study. J Orthop Trauma 1996; 10(3): 178-90.
10. Mosheiff R, Friedman A, Friedman M, Liebergall M. Quantification of guided regeneration of weight-bearing bones. Orthopedics 2003; 26(8): 789-94.
11. Ito K, Nanba K, Murai S. Effects of bioabsorbable and non-resorbable barrier membranas on bone augmentation in rabbit calvaria. J Periodontal 1998; 69(11): 1229-37.
12. Nasser NJ, Friedman A, Friedman M, Moor E, Mosheiff R. Guided bone regeneration in the treatment of segmental diaphyseal defects: a comparison between resorbable and non-resorbable membranas. Injury 2005; 36(12): 1460-6.
13. Friedman M, Golomb G. New sustained release dosage form of chlorhexidine for dental use. I. Development and kinetics of release. J Periodontal Res 1982; 17(3): 323-8.
14. Krampera M, Glennie S, Dyson J, Scott D, Laylor R, Simpson E, Dazzi F. Bone marrow mesenchymal stem cells inhibit the response of naive and memory antigen-specific Т cells to their cognate peptide. Blood 2003; 101(9): 3722-9.
15. Djouad F, Plence P, Bony C, Tropel P, Apparailly F, Sany J, Noel D, Jorgensen C. Immunosuppressive effect of mesenchymal stem cells favors tumor growth in allogeneic animals. Blood 2003; 102(10): 3837-44.
16. Barry FP, Murphy JM. Mesenchymal stem cells: clinical applications and biological characterization. Int J Biochem Cell Biol 2004; 36(4): 568-84.
17. characterization. Int J Biochem Cell Biol 2004; 36(4): 568-84.
18. Halvorsen YD, Franklin D, Bond AL, Hitt DC, Auchter C, Boskey AL, Paschalis EP, Wilkison WO, Gimble JM. Extracellular matrix mineralization and osteoblast gene expression by human adipose tissue-derived stromal cells. Tissue Eng 2001; 7(6): 729-41.
19. Lyons AB. Analysing cell division in vivo and in vitro using flow cytometric measurement of CFSE dye dilution. J Immunol Methods 2000; 243(1-2): 147-54.
20. Gugala Z, Gogolewski S. Differentiation, growth and activity of rat bone marrow stromal cells on resorbable poly(L/DL-lactide) membranas. Biomaterials 2004; 25(12): 2299-307.
21. Aggeliki I. et al Macromolecules, 35 (7), 2506-2513, 2002.
Реферат
Изобретение относится к медицине, конкретно к мембране, включающей по меньшей мере один положительно заряженный синтетический гидрофобный полимер, по меньшей мере один гидрофильный полимер и по меньшей мере один пластификатор, причем упомянутая мембрана гибкая и способна поддерживать по меньшей мере одно из адгезии клеток, пролиферации клеток или дифференциации клеток. Изобретение, кроме того, относится к использованию мембраны при изготовлении имплантируемых устройств, включая системы доставки клеток, поверхности для роста клеток и каркасы. Описаны способы содействия регенерации ткани в области дефектной ткани с применением мембран. 2 н.и 10 з.п. ф-лы, 13 ил., 1 табл., 8 пр.
Формула
упомянутым положительно заряженным синтетическим гидрофобным полимером является сополимер аммоний-метакрилата типа A NF (АМСА);
упомянутый гидрофильный полимер и упомянутый пластификатор являются полиэтиленгликолем в диапазоне от 300 до 20000, причем упомянутый полиэтиленгликоль присутствует в концентрации приблизительно от 1 мас.% до 30 мас.%; и
упомянутая мембрана гибкая и способна поддерживать по меньшей мере одно из адгезии клеток, пролиферации клеток или дифференциации клеток.

Комментарии