Способ получения биоактивного покрытия c бактерицидными свойствами на имплантате из титана - RU2719475C1
Код документа: RU2719475C1
Чертежи







Описание
Изобретение относится к области медицины, а именно к травматологии и ортопедии, и предназначено для поддержания и стимуляция процесса лечения переломов, а также осложнений при сращении проксимального отдела бедренной кости, в области мыщелка, для накостного остеосинтеза переломов длинных трубчатых костей, мелких костей, костей черепа, для интрамедуллярного остеосинтеза переломов длинных костей, для остеосинтеза костных обломков в лечении переломов.
Травматизм был и остается одной из самых распространенных проблем нарушения костной ткани. Ежегодно в мире от травм погибает более 5 миллионов человек. В настоящее время ведутся интенсивные исследования по разработке имплантатов на основе биодеградируемых полимерных материалов как синтетических, так и природных. В практике по-прежнему наиболее распространенным материалом особенно при крупных повреждениях костной ткани остаются традиционные титановые имплантаты. При этом существует риск адсорбции на них бактерий организма и формирование на поверхности имплантата токсичной биопленки.
Это предполагает повторное хирургическое вмешательство по извлечению и замене имплантата. Для подавления развития этих инфекций разрабатываются активные покрытия с бактерицидными свойствами на поверхности имплантата, что является эффективной стратегией защиты ее от биообрастания, при этом стоит задача получения покрытий с длительным высвобождением антибактериальных препаратов.
В этой связи актуальной является задача создания защитной оболочки с антибактериальными свойствами на поверхности имплантата. Для решения этой проблемы разрабатываются имплантаты на основе хитозана. В таких имплантатах хитозан выполняет двойственную функцию. Он выступает не только как компонент, обеспечивающий бактерицидные свойства композиции, но и как органическая составляющая матрикса для костезамещения.
В патенте WO 2012138184 А2 описан способ получения биодеградируемого хитозанового покрытия с введенным лекарственным средством. Хитозан растворяли в 0,2 М уксусной кислоты и смешивали с раствором дексаметазона. Нанесение на стент осуществляли методом окунания и последующей сушкой в течение часа при температуре 100°С. При использовании сушки для фиксации покрытия его толщина оказывается неоднородна, что ведет к неравномерным биодеградации и выходу лекарственного средства.
В патенте РФ 2585576, A61K 9/00, опубл. 27.05.2016, описан способ получения биодеградируемого полимерного покрытия с контролируемым выходом лекарственного средства для малоинвазивной хирургии, включающий растворение хитозана в кислотах, добавление лекарственного средства, окунание проволоки из никелида титана в полученный раствор, фиксацию покрытия и сушку. Для растворения хитозана в качестве растворителя используют фосфорную, или соляную, или глутаминовую, или уксусную кислоты с концентрацией от 1 до 4% вес., в качестве лекарственного средства используется линкомицин, либо гентамицин, либо цефотоксим с концентрацией от 0,9 до 7% вес., фиксация покрытия происходит в спиртовом аммиачном растворе в соотношении 1:2 с последующей сушкой при температуре 40-45°С в течение 24 часов.
Недостатком способа является ограниченность применения никелида титана только для малоинвазивной хирургии. Никелид титана используется без активации и способен сорбировать азот и кислород, что может негативно сказаться на адсорбции на его поверхности хитозана. Кроме того, сама технология получения покрытия предполагает метод окунания в раствор хитозана с последующей фиксацией спиртовым аммиачным раствором. Процесс манипуляции окунание-фиксация является многостадийным, при этом метод не может обеспечить равномерности покрытия проволоки. Кроме того, использование одноосновных кислот - соляной, уксусной или двухосновной глутаминовой, в которой одна карбоксильная группа будет комплексно связана за счет водородной связи с аминогруппой не сможет обеспечить надежную адгезию лекарственного средства на хитозане.
Известно многокомпонентное биоактивное нанокомпозиционное покрытие с антибактериальным эффектом для металлических, полимерных и природных костных имплантатов, предназначенных для замены поврежденных участков костной ткани, на основе карбонитрида титана с введением дополнительных элементов, обеспечивающих требуемый комплекс механических и трибологических свойств, (см. патент РФ №2524654, A61L 27/02, опубл. 27.07.2014 г.).
Однако известное покрытие при своем использовании обладает следующими недостатками:
- не обеспечивает высокие антиадгезивные свойства подготовленного к применению металлического ортопедического имплантата,
- не препятствует образованию бактериальной биопленки на поверхности металлического ортопедического имплантата,
- не обеспечивает высокие антибактериальные свойства подготовленного к применению металлического ортопедического имплантата,
- не обеспечивает высокую биологическую совместимость в различных физиологических средах организма пациента,
- не обеспечивает надежную защиту поверхности имплантированного металлического ортопедического имплантата от возникновения процессов инфекции.
Известно многофункциональное антибактериальное покрытие, которое состоит из серебра, наносимое на имплантаты и/или медицинские инструменты, содержащим такое покрытие (патент РФ 2557938, A61L 27/32, C25D 11/02, A61F 2/02, опубл. 27.07.2015).
Ионы серебра сильно ингибируют рост бактерий и других микроорганизмов и разрушают важные компоненты клеток микроорганизмов, так чтобы их жизненные функции больше не работали. Серебро проявляет антибактериальную активность широкого спектра и эффективно даже против штаммов, резистентных к антибиотикам. Кроме того, серебро воздействует на многочисленные области внутри бактериальных клеток, уменьшая, таким образом, вероятность проявления бактериями резистентности любого рода.
Способ обработки поверхности медицинского изделия, в частности, металлического медицинского изделия, включающий в себя стадии, на которых: получают коллоидно-диспергированную систему, подвергают медицинское изделие обработке коллоидно-диспергированной системой таким образом, что поверхность медицинского изделия, которое подлежит обработке, погружают в коллоидно-диспергированную систему, создают разность потенциалов цепи переменного тока между медицинским изделием в качестве первого электрода и/или вторым электродом, помещенным в коллоидно-диспергированную систему, для превращения погруженной поверхности в оксидную пленку посредством плазменного электролитического оксидирования.
Однако недостатком этого метода является использование наночастиц серебра. Научная литература изобилует данными об их токсическом действии на организмы млекопитающих, полученными из экспериментов как in vitro, так и in vivo. Хотя механизм токсического действия наночастиц серебра на клетки эукариот, приводящий к клеточной смерти, до сих пор до конца не известен, ученые полагают, что их токсическое действие связано с индуцированием свободных радикалов, которые приводят к окислительному стрессу клетки. Было показано, что они оказывают токсическое действие на различные культуры человеческих клеток. Так, наночастицы серебра оказывали негативное воздействие как на кератиноциты кожи, так и на фибробласты.
Известны биоинертные, биосовместимые покрытия из оксидов металлов для медицинских изделий: покрытие (патент РФ 2465015, A61L 27/04, A61K 6/04, опубл. 27.10.2012), состоящее из смеси оксидов металлов (Cr, Ni, Fe, Ti) с содержанием меди при следующем соотношении компонентов: смесь оксидов металлов (Cr, Ni, Fe, Ti) от 95 до 98%, медь от 2 до 5%; покрытие (патент РФ 2361623, A61L 27/06, A61L 27/30, опубл. 20.07.2009) на имплантат, содержащее смесь оксидов титана и оксида меди при следующем соотношении компонентов, мас.%: оксид титана (TiO2) 65-75, оксид меди 15-25, остальное другие типы оксидных фаз титана (TiO, Ti3O5); покрытие (патент РФ 2502526, A61L 27/06, A61L 27/02, A61F 2/02, опубл. 27.12.2013) на имплантат, состоящее из двух слоев, где первый слой состоит из оксидов титана, второй слой состоит из оксида алюминия гамма-модификации, в соотношении компонентов, мас.%: оксид титана в пересчете на TiO2 - 10-30; гамма-оксид алюминия - 70-90.
Однако известные оксидные покрытия не обладают достаточной бактерицидной активностью в отношении микроорганизмов, что ограничивает применение в травматологии. Также недостатками являются высокая хрупкость материала покрытия, что приводит к растрескиванию, сдиранию, соскабливанию покрытия и потере в целом медицинских свойств, поэтому покрытие не может использоваться в винтах и других костных имплантатах, имплантируемых в костную ткань с большими усилиями.
Наиболее близким к заявляемому способу по технической сущности и достигаемому результату, выбранным в качестве прототипа, является способ получения биоактивного покрытия титанового имплантата, вводимого в костную ткань человека (патент РФ №2566060, A61L 27/06, A61L 27/30, A61F 2/28, опубл. 20.10.2015), Покрытие представляет собой многослойное биоактивное покрытие, полученное атомно-слоевым осаждением и состоящее, по меньшей мере, из слоев одного оксида переходного металла, выбранных из группы, включающей слои оксида титана TiO2 с кристаллической анатазной модификацией; слои из оксида циркония ZrO2, слои из оксида гафния HfO2 с поликристаллической структурой с тетрагональной решеткой, из слоев оксида тантала Ta2O5 с аморфной структурой, слоев из оксида ниобия Nb2O5 с аморфной структурой, из слоев многокомпонентного оксида (TiO2)xTa2O5)1-x, где х равен 0,8-0,95, со структурой твердого раствора на основе тетрагональной кристаллической решетки, с контролируемой толщиной покрытия, определяемой числом повторяющихся циклов осаждения соответствующих прекурсоров - химических реагентов в виде жидких органометаллических соединений указанных переходных металлов и воды.
Недостатком получения данного покрытия является то, что оксидные покрытия только лишь препятствуют биообрастанию самого имплантата и не являются лекарственным покрытием для имплантатов, высвобождающих в ткани лекарство. Кроме того, формирование прочного покрытия происходит из газовой фазы соответствующих реагентов. Технология атомно-слоевого осаждения для формирования покрытий может быть обеспечена только для реагентов, которые возможно перевести в газовую фазу. Такая технология неприменима для хитозана, в том числе хитозана, комплексно связанного с лекарственным средством, так как хитозан не может быть переведен в газовую фазу. Более того при температуре 140°С происходит карамелизация хитозана, а при более высоких температурах - его разложение.
Техническая проблема, решаемая предлагаемым изобретением, - разработка способа получения биоактивного покрытия с высокой адгезией к поверхности титана, обеспечивающего пролонгированное, т.е. длительное действие антибиотика в процессе биодеструкции полимера непосредственно в области раны, что происходит в течение послеоперационного периода.
Техническим результатом является создание покрытия с высокой адгезией к поверхности титана, обеспечивающего пролонгированное, т.е. длительное действие антибиотика в процессе биодеструкции полимера непосредственно в области раны, что происходит в течение послеоперационного периода.
Более того, кроме использования антибиотиков возможно использование других лекарственных средств (обезболивающие, прочие белковые субстанции).
Указанный результат достигается тем, что в способе получения биоактивного покрытия с бактерицидными свойствами на имплантате из титана, включающем обезжиривание и последующее активирование поверхности имплантата из титана, покрытие наносят электрофоретическим осаждением из раствора электролита, содержащего двух- или трехосновную кислоту, такую как янтарную, фосфорную, и одноосновную кислоту, такую как молочную или уксусную, хитозан и, по меньшей мере, один антибиотик из группы аминогликозидов, такой как гентамицин, канамицин, или ионы серебра или наночастицы серебра в воде при следующем соотношении компонентов, мас.%:
двух- или трехосновная кислота, такая как янтарная, фосфорная - от 1,5 до 2,5;
одноосновная кислота, такая как молочная или уксусная в количестве, обеспечивающем значение рН 3,5-4,0;
антибиотик из группы аминогликозидов, такой как гентамицин, канамицин - от 0,15 до 2,0; или ионы серебра от 1*10-4 до 1*10-3 масс. % или наночастицы серебра с концентрацией от 5*10-5 до 5*10-4 мас.%;
полимер хитозан - от 2 до 5;
вода - до 100,
затем покрытие сушат при температуре от 24 до 110°С и дополнительно обрабатывают водным раствором этанола для удаления остатков кислоты с покрытия.
Электрофоретическое осаждение проводят при температуре 20-30°С в течение 1-5 минут при силе тока 50-150 мА в автоматическом режиме регулирования напряжения.
Способ осуществляют следующим образом.
Поверхность имплантата из титана обезжиривают раствором этанола, активируют, обрабатывая раствором соляной кислоты, и наносят покрытие электрофоретическим осаждением из раствора электролита, содержащего двух- или трехосновную кислоту, такую как янтарную, фосфорную и одноосновную кислоту, такую как молочную или уксусную и хитозан (полимер аминоглюкана) в количестве от 2 до 5 мас.% и, по меньшей мере, один антибиотик из группы аминогликозидов, такой как гентамицин, канамицин в количестве от 0,15 до 2 мас.% или ионы серебра от 1*10-4 до 1*10-3 мас.% или наночастицы серебра со средним размером до 15 нм и концентрацией от 5*10-5 до 5*10-4 мас.% в воде до 100 мас.%. При меньшем количестве хитозана покрытие получается неоднородным, то же самое наблюдается при большем количестве хитозана. При меньшем количестве антибиотика не достигается бактерицидный эффект, а только бактериостатический. Большее количество антибиотика использовать нецелесообразно, так как не происходит полной адсорбции антибиотика на хитозане. Электрофоретическое осаждение проводят при температуре 20-30°С в течение 1-5 минут при силе тока 50-150 мА в автоматическом режиме регулирования напряжения. При повышенной температуре ухудшается адгезия покрытия к титану, при меньших температурах происходит структурирование раствора, покрытия получаются некачественными. При меньшем времени нанесения не достигается полное покрытие, а при большем - увеличивается толщине покрытия и происходит его отслаивание. При силе тока меньше 50 мА не происходит осаждения покрытия на поверхности, увеличивается время нанесения, при силе тока больше 150 мА увеличивается толщина покрытия, что приводит к его отслаиванию. Затем покрытие сушат при температуре от 24 до 110°С. При меньшей температуре увеличивается время сушки, а при большей температуре - происходит деструкция хитозана. Дополнительно обрабатывают спиртом для удаления остатков кислоты с покрытия. При рН меньше 3,5 осложняется удаление избытка кислоты с поверхности пленки имплантата, при значении рН, превышающем 4,0, - поверхность покрытия неоднородная. Интервал ионов серебра от 1*10-4 до 1*10-3 мас.% обеспечивает высокую бактерицидность покрытия. При значениях нижеуказанного наблюдается только бактериостатический эффект, при больших значениях - может проявляться токсичность. Интервал наночастиц серебра от 5*10-5 до 5*10-4 мас.% обеспечивает высокую бактерицидность покрытия.
Изобретение иллюстрируется нижеследующими примерами и фигурами, на которых изображено:
На фиг. 1. Адгезионная прочность (0 баллов) под микроскопом покрытия к Примеру 1;
На фиг. 2. Адгезионная прочность (0 баллов) под микроскопом покрытия к Примеру 2;
На фиг. 3. Адгезионная прочность (0 баллов) под микроскопом покрытия к Примеру 3;
На фиг. 4. Адгезионная прочность (0 баллов) под микроскопом покрытия к Примеру 8;
На фиг. 5. Адгезионная прочность (0 баллов) под микроскопом покрытия к Примеру 10;
На фиг. 6. Антибактериальные свойства покрытия к Примеру 9 на титановой пластине на примере бактерий Staphiloccocus aureus;
На фиг. 7. Антибактериальные свойства покрытия к Примеру 8 на титановой пластине на примере бактерий Pseudomonas aeruginosa;
На фиг. 8. Антибактериальные свойства покрытия к Примеру 10 на титановой пластине на примере бактерий Escherichia coli;
На фиг. 9. Антибактериальные свойства покрытия к Примеру 1 на титановой пластине на примере бактерий Staphiloccocus aureus;
На фиг. 10. Антибактериальные свойства покрытия к Примеру 3 на титановой пластине на примере бактерий Pseudomonas aeruginosa;
На фиг. 11. Антибактериальные свойства покрытия к Примеру 2 на титановой пластине на примере бактерий Escherichia coli;
На фиг. 12. Антибактериальные свойства покрытия к Примеру 4 на титановом винте на примере бактерий Pseudomonas aeruginosa;
На фиг 13. Таблица 1. Классификация результатов испытания по ГОСТу 31149-2014 методом решетчатого надреза;
На Фиг. 14. Таблица 2. Результаты испытаний адгезионной прочности полимерных покрытий на титановых изделиях при различных режимах сушки.
Пример 1
Поверхность имплантата из титана обезжиривают раствором этанола и активируют, обрабатывая раствором соляной кислоты. Готовят раствор электролита 2 мас.% хитозана в 1,5 мас.% янтарной кислоте, добавляют гентамицин в количестве 0,15 мас.%, добавляют уксусную кислоту до значения рН 3,5. В раствор погружают покрываемое титановое изделие, которое подключают к катоду, и наносят покрытие. Анодом является медный электрод. Температура раствора 20°С, время нанесения 1 минута при силе тока 150 мА в автоматическом режиме регулирования напряжения. Покрытое титановое изделие сушат при температуре 24°С и дополнительно обрабатывают спиртом для удаления остатков кислоты с покрытия.
Пример 2
Поверхность имплантата из титана обезжиривают раствором этанола и активируют, обрабатывая раствором соляной кислоты. Готовят раствор электролита 5 мас.% хитозана в 2,5 мас.% янтарной кислоте, добавляют гентамицин в количестве 2,0 мас.%, добавляют уксусную кислоту до значения рН 4,0. В раствор погружают покрываемое титановое изделие, которое подключают к катоду, и наносят покрытие. Анодом является медный электрод. Температура раствора 30°С, время нанесения 5 минут при силе тока 150 мА в автоматическом режиме регулирования напряжения. Покрытое титановое изделие сушат при температуре 110°С дополнительно обрабатывают спиртом для удаления остатков кислоты с покрытия.
Пример 3
Проведен аналогично примеру 1, но при следующих параметрах процесса - раствор 5 мас.% хитозана в 1,5 мас.% фосфорной кислоте, добавляют гентамицин в количестве 1,5 мас.%, добавляют уксусную кислоту до значения рН 3,5.
Пример 4
Проведен аналогично примеру 1, но при следующих параметрах процесса - раствор 2 мас.% хитозана в 1,5 мас.% янтарной кислоте, добавляют гентамицин в количестве 2,0 мас.%, добавляют уксусную кислоту до значения рН 3,5. время нанесения 5 минут.
Пример 5
Проведен аналогично примеру 1, но при следующих параметрах процесса - раствор электролита 5 мас.% хитозана в 2,5 мас.% янтарной кислоте, добавляют гентамицин в количестве 2,0 мас.%, добавляют молочную кислоту до значения рН 3,5, время нанесения 2 минуты при силе тока 150 мА.
Пример 6
Проведен аналогично примеру 1, но при следующих параметрах процесса - раствор 5 мас.% хитозана в 2,5 мас.% янтарной кислоте, добавляется канамицин в количестве 2 мас.%, добавляют уксусную кислоту до значения рН 3,5, время нанесения 5 минут при силе тока 50 мА.
Пример 7
Проведен аналогично примеру 1, но при следующих параметрах процесса - раствор 3 мас.% хитозана в 1,5 мас.% фосфорной кислоте, добавляют гентамицин в количестве 1 мас.%, добавляют уксусную кислоту до значения рН 3,5.
Пример 8
Готовят раствор 3 мас.% хитозана в 6 мас.% уксусной кислоте, добавляется AgNO3 в количестве 1*10-3 мас.%, в раствор погружают покрываемое титановое изделие, которое подключается к катоду и проводится электрофоретическое нанесение. Анодом является медный электрод. Температура раствора 25°С, время нанесения 1 минута.
Пример 9
Готовят раствор 3 мас.% хитозана в 6 мас.% уксусной кислоте, добавляется мас.% в количестве 1*10-4 мас.%, в раствор погружают покрываемое титановое изделие, которое подключается к катоду, и проводят электрофоретическое нанесение. Анодом является медный электрод. Температура раствора 25°С, время нанесения 1 минута.
Пример 10
Готовят раствор 3 мас.% хитозана в 6 мас.% уксусной кислоте, содержащий наночастицы серебра в количестве 5*10-5 мас.%, в раствор погружают покрываемое титановое изделие, которое подключается к катоду, и проводят электрофоретическое нанесение. Анодом является медный электрод. Температура раствора 25°С, время нанесения 1 минута.
Полученные покрытия испытывали на адгезию, длительность биодеструкции хитозана и на бактерицидность. Данные сведены в таблицы.
Изучение адгезии
Классификация результатов испытания по ГОСТу 31149-2014 методом решетчатого надреза приведена в Таблице 1 (фиг. 13). Результаты испытаний адгезионной прочности полимерных покрытий на титановых изделиях при различных режимах сушки приведены в Таблице 2.
Как видно из таблицы 2 (фиг. 14), согласно фиг. 1, 2, 3, 4, 5 во всех случаях выявлена высокая адгезионная прочность покрытий, которая составила 0 баллов.
Изучение биодеструкции
Изучение биодеструкции проводили на экспериментальных животных по изменению массы и размеров пленок хитозана и пленок хитозана, содержащих гентамицин, имплантированных экспериментальным животным в межлопаточную область спины. Работа проведена на белых нелинейных крысах-самках трехмесячного возраста массой 150-200 г. Все работы проводились на наркотизированных животных. Все процедуры на лабораторных животных осуществлялись в соответствии с требованиями Европейской конвенции о защите позвоночных животных, используемых для экспериментов или в иных научных целях (Страсбург, 18 марта 1986); Международными рекомендациям по проведению медико-биологических исследований с использованием животных (1993); Правила лабораторной практики в Российской Федерации (приказ МЗ РФ №267 от 19.06.2003) и Правилами проведения работ с использованием экспериментальных животных (МЗ №755 от 12.03.1977).

Видно, что хитозановая пленка с минимальным содержанием гентамицина 0,15 мас.% (Пример 1) биодеградирует в организме в течение 4 недель. Введение большего количества антибиотика - 1,5 мас.% (Пример 2) - в пленку замедляет процесс биодеградации хитозана, являющегося сорбентом антибиотика, до 8 недель, обеспечивая соответствующее ему выделение антибиотика.
Изучение антибактериальных свойств
Были исследованы титановые пластины с покрытием на бактерицидность. Для исследования использовали штаммы бактерий Staphylococcus aureus, Pseudomonas aeruginosa и Escherichia coli. Агаризованную среду мясопептонного агара в чашках Петри инокулировали суспензией бактерий, помещали на газон бактерий титановые пластины с покрытием и в качестве контроля без покрытия, термостатировали сутки при температуре 37°С. После этого измеряли зону ингибирования (диаметр):
d = до 3 мм - небактерицидные
d = 4-8 мм - малобактерицидные
d = 9-19 мм - бактерицидные
d > 19 мм – сильнобактерицидные.
Результаты антибактериального исследования полимерных пленок на титановых пластинах приведены в Таблице 4.
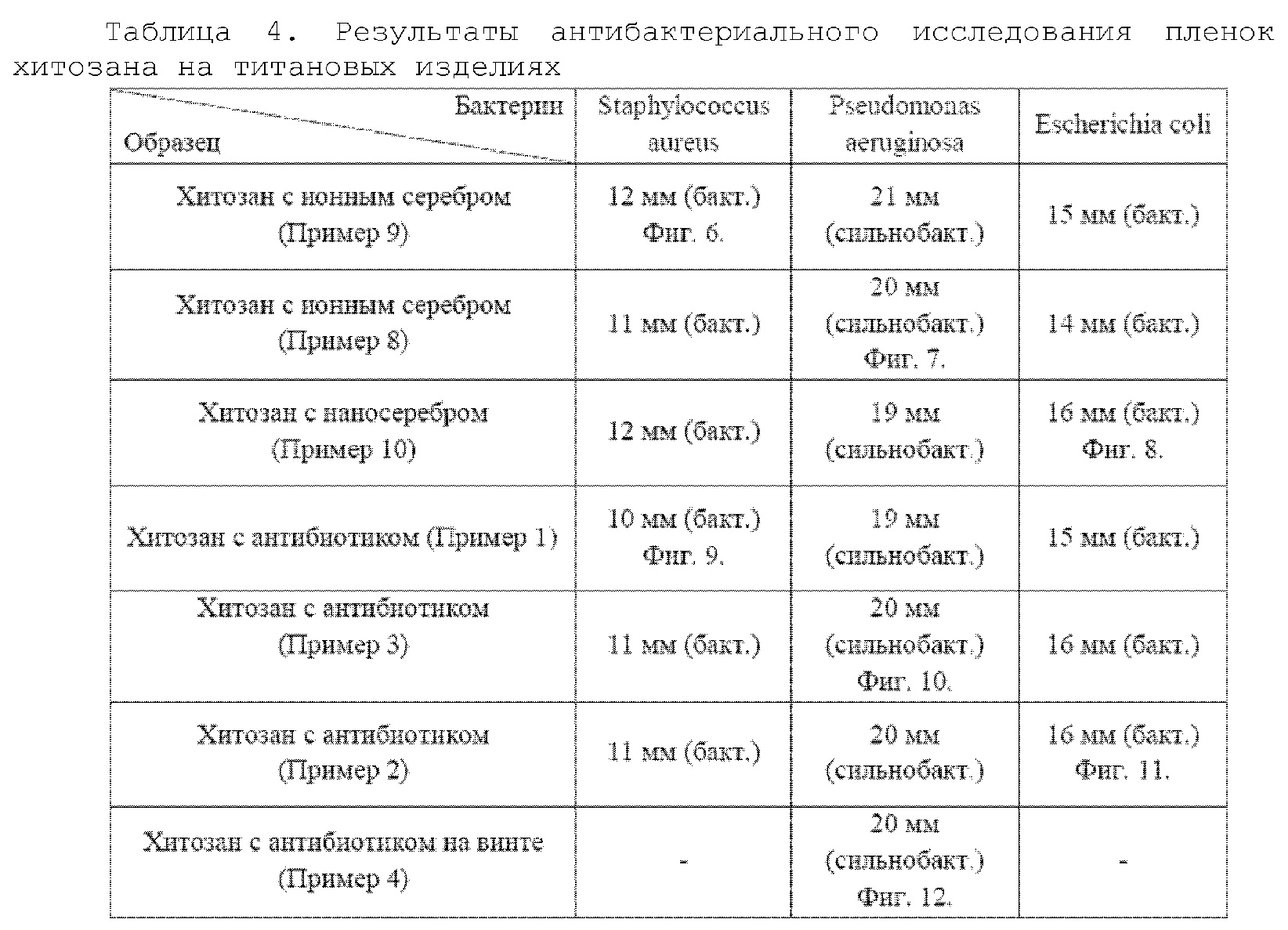
Все покрытия характеризуются зоной ингибирования, превышающей 9 мм, что свидетельствует о сильных бактерицидных свойствах покрытий.
Таким образом, предлагаемый способ позволяет получать биоактивные покрытия с бактерицидными свойствами на имплантате из титана с высокой адгезией к поверхности титана, обеспечивающие пролонгированное, т.е. длительное действие антибиотика в процессе биодеструкции полимера непосредственно в области раны, что происходит в течение послеоперационного периода.
Реферат
Изобретение относится к области медицины, а именно к травматологии и ортопедии. Предложен способ получения биоактивного покрытия c бактерицидными свойствами на имплантате из титана, включающий обезжиривание и последующее активирование поверхности имплантата из титана. Покрытие наносят электрофоретическим осаждением из раствора электролита, содержащего двух- или трехосновную кислоту, такую как янтарную, фосфорную, и одноосновную кислоту, такую как молочную или уксусную, хитозан и, по меньшей мере, один антибиотик из группы аминогликозидов, такой как гентамицин, канамицин или ионы серебра или наночастицы серебра в воде при следующем соотношении компонентов, мас.%: двух- или трехосновная кислота, такая как янтарная, фосфорная - от 1,5 до 2,5; одноосновная кислота, такая как молочная или уксусная в количестве, обеспечивающем значение рН 3,5-4,0; антибиотик из группы аминогликозидов, такой как гентамицин, канамицин - от 0,15 до 2,0; или ионы серебра от 1*10до 1*10мас.% или наночастицы серебра c концентрацией от 5*10до 5*10мас.%; полимер хитозан - от 2 до 5; вода - до 100. Электрофоретическое осаждение проводят при температуре 20 - 30°C в течение 1 - 5 минут при силе тока 50 - 150 мА в автоматическом режиме регулирования напряжения. Затем покрытие сушат при температуре от 24 до 110°C и дополнительно обрабатывают водным раствором этанола для удаления остатков кислоты с покрытия. Технический результат - создание покрытия с высокой адгезией к поверхности титана, обеспечивающего пролонгированное действие антибиотика в процессе биодеструкции полимера непосредственно в области раны, что происходит в течение послеоперационного периода. 4 табл., 10 пр., 14 ил.
Формула
Документы, цитированные в отчёте о поиске
Способ формирования покрытия на имплантате из сплава титана

Комментарии