Способ нанесения биоактивного покрытия на титановые имплантаты - RU2684617C1
Код документа: RU2684617C1
Чертежи

Описание
Изобретение относится к медицинской технике и может быть использовано для нанесения на титановые имплантаты, предназначенные для замены поврежденных участков костной ткани, покрытий из биосовместимых нанокомпозиционных материалов.
Процесс остеоинтеграции оказывает существенное влияние на срок биологического закрепления имплантатов и является важным показателем при их установке. Введение германия в состав гидроксиапатита в качестве модифицирующей добавки для покрытий имплантатов из титана и его сплавов улучшает процессы остеоинтеграции имплантатов и остеогенеза в организме реципиента.
Установлено, что германий в качестве микроэлемента принимает участие в метаболических процессах и оказывает антигипоксическое, антиоксидантное и обезболивающее действие. Обнаружено, что недостаток германия негативно влияет на функционирование желудочно-кишечного тракта, иммунной системы организма и на липидный обмен.
Известно также, что этот микроэлемент способствует лечению артрита, остеопороза, кандидоза и многих вирусных инфекций, активируя Т-лимфоциты и выработку γ-интерферонов.
Известен способ нанесения гидроксиапатит-титановых покрытий [RU 2158189, B05D 7/24, 27.10.2000], включающий смешивание порошка гидроксиапатита со связующим веществом, в качестве которого используют фосфатную связку в соотношении: гидроксиапатит : фосфатная связка = 1-1,5:1,5-2,0, после чего полученную смесь наносят на титановый имплантат и обжигают при температуре 250-600°С
Недостатком данного способа является относительно низкие качество и биологическая активность наносимого покрытия, так, нанесенное этим способом покрытие имеет плохую адгезию, неравномерно по толщине и обладает слабыми остеоиндуктивными и остеокондуктивными свойствами.
Известен способ нанесения покрытий из гидроксиапатита на имплантаты из титана и его сплавов [RU №2287315, С2, A61F 2/02, A61L 27/30, 20.06.2011], который осуществляют путем нанесения суспензии постоянным или импульсным током в условиях искрового разряда с последующей сушкой при температуре 80-120°С и обжига при температуре 600-800°С в течение 0,5-1 ч, причем, в качестве суспензии используют синтетический и биологический порошок гидроксиапатита при следующем соотношении компонентов, мас. %: синтетический порошок гидроксиапатита - 10-90, биологический порошок гидроксиапатита - 10-90
Недостатком данного способа являются относительно высокие энергозатраты и относительно низкая биоактивность реализуемого покрытия, обусловленная тем, что в составе покрытия отсутствуют микроэлементы, которые бы повышали его биоактивность.
Наиболее близким по технической сущности и достигаемому результату является способ нанесения биокерамического покрытия [RU 2581824, C1, В82В 1/00, A61L 31/16, A61L 31/08, A61L 27/32, A61L 27/30, 20.04.2016.], включающий смешивание порошка гидроксиапатита с биологически совместимым связующим веществом, в качестве которого используют фосфатные связки при соотношении связки и порошка 1,0-1,5:1,5-2,0, нанесение получаемой суспензии на поверхность имплантата, сушку и последующую термообработку, причем, в суспензию из фосфатных связок и порошка гидроксиапатита дополнительно добавляют наночастицы серебра при соотношении суспензии и наночастиц серебра 1,0-1,1:0,01-0,03, а термообработку имплантата с нанесенной серебросодержащей суспензией проводят в условиях индукционного нагрева при величине потребляемой электрической мощности 0,20-0,25 кВт, частоте тока на индукторе 90±10 кГц и продолжительности 1,0-1,5 мин.
Недостатком наиболее близкого технического решения является относительно низкое качество покрытия и относительно низкая его биоактивность, поскольку условиях индукционного нагрева наличие в составе покрытия наночастиц серебра может приводить к локальным перегревам, что снижает качество покрытия и способствует фазовым и химическим превращениям и разложению биоактивного гидроксиапатита до трикальцийфосфата и пирофосфата кальция, образование которых снижает биоактивность покрытия. Относительно низкое качество покрытия обусловливается еще и тем, что, обработка покрытий в условиях индукционного нагрева при температуре 900-950°С приводит к разложению гидроксиапатита и снижению биоактивности покрытия. При этом, использование для смешивания твердого порошка гидроксиапатита, жидкофазного связующего и наночастиц серебра, как правило, не позволяет получать однородные составы и, соответственно, остеоиндуктивные и остеокондуктивные процессы будут протекать неравномерно по поверхности имплантата. Это также снижает качество покрытия. Относительно низкое качество покрытия обусловливается и относительно низкой адгезией, например, из-за отсутствия предварительной обработки поверхности титана и не сформированного перед покрытием микрорельефа на поверхности изделия из титана, что приводит к уменьшению адгезии покрытия к имплантату и последующему его отслоению при механических нагрузках.
Задачей изобретения является разработка способа, обеспечивающего расширение арсенала технических средств, которые могут быть использованы для покрытии титановых имплантатов биосовместимыми нанокомпозиционными материалами, и обеспечивающих более высокое качество покрытия и повышенную биоактивности покрытия,
Технический результат заключается в расширении арсенала технических средств, которые могут быть использованы для покрытии титановых имплантатов биосовместимыми нанокомпозиционными материалами и в повышении качества покрытия и его биоактивности.
Поставленная задача решается, а требуемый технический результат достигается тем, что, в способе, заключающемся в нанесении биоактивного покрытия из гидроксиапатита на титановые имплантаты, согласно изобретения, предварительно готовят раствор электролита содержащего, масс %:
ортофосфорную кислоту 10-15;
биоактивный гидроксиапатит - 1-15;
нанодисперсный германий 0,5-4,5,
дистиллированная вода - остальное до 100,
а для покрытия на титановый имплантат используют микродуговое нанесение при длительность импульса 150-200 мкс, частоте следования импульсов 1-45 Гц и напряжении 310-400 В в течение 12-20 мин при постоянном перемешивании электролита.
Кроме того, требуемый технический результат достигается тем, что, перед нанесением на имплантат биоактивного покрытия из гидроксиапатита производят подготовку поверхности имплантата из титана химическим травлением в течение 5-10 с в селективном травителе, состоящим из водного раствора плавиковой и азотной кислот с массовым соотношением HF:HNO3:H2O.=1:3:4 и нагретом до температуры 30-70°С с последующей трехкратной промывкой имплантата дистиллированной водой и высушивании в кипящем изопропиловом спирте.
Кроме того, требуемый технический результат достигается тем, что, гидроксиапатит для биоактивного покрытия из гидроксиапатита на титановые имплантаты получают из костных тканей крупного рогатого скота с микроэлементами, идентичных микроэлементам костной ткани человека.
На чертеже представлены:
- на фиг.1 - схема экспериментальной ячейки, где 1 - источник питания, 2 - ванна с раствором электролита, 3 - катод, 4 - анод;
- на фиг.2 - внутренняя поверхность трубчатой кости с врастанием остеобластов молодой костной балки в крупнозернистое базофильное вещество (увеличение × 280).
Предложенный способ нанесения биоактивного покрытия на титановые имплантаты реализуется следующим образом.
Предварительно получают биоактивный гидроксиапатит из костных тканей крупного рогатого скота, в которых микроэлементы идентичны микроэлементам костной ткани человека.
Далее готовят раствор электролита содержащего, масс %:
ортофосфорную кислоту 10-15;
биоактивный гидроксиапатит - 1-15;
нанодисперсный германий 0,5-4,5,
дистиллированная вода - остальное до 100,
а для покрытия на титановый имплантат используют микродуговое нанесение при длительность импульса 150-200 мкс, частоте следования импульсов 1-45 Гц и напряжении 310-400 В в течение 12-20 мин при постоянном перемешивании электролита.
При использовании ортофосфорной кислоты концентрацией менее 10 масс % микродуговое нанесение покрытия протекает в нестабильном режиме. При концентрации ортофосфорной фосфорной кислоты выше 15 масс % происходит сильное фосфатирование поверхности титанового образца и адгезия покрытия снижается. При содержании биоактивного гидроксиапатита в электролите меньше 1 масс % покрытие формируется неоднородным (кальций дефицитным). При содержании биологического гидроксиапатита больше 15 масс % увеличивается его расход без изменения качества покрытия. При содержании нанодисперсного германия меньше 0,5 масс % биологические свойства покрытия практически не меняются. При содержании ультрадисперсного германия в электролите больше 4,5 масс % электролит быстро нагревается и покрытие формируется неоднородным. Параметры импульсного тока для микродугового нанесения покрытия (длительность импульса 150-250 мксм, частота следования импульсов 1-45 Гц и конечное напряжение 310-400 В) выбраны соответствующими получению качественного покрытия при проведенных экспериментальных исследований.
Разработанный режим микродугового нанесения покрытия позволяет существенно улучшить его характеристики: увеличить толщину, равномерность нанесения гидроксиапатита и содержание микроэлементов, улучшающих остеоиндуктивные и остеокондуктивные свойства. Применение биоактивного гидроксиапатита в качестве основного компонента покрытия, а также введение в электролит германия ускоряет процесс восстановления костных тканей живых организмов.
Предложенный электролит позволяет получить покрытие, в состав которого входят биоактивный гидроксиапатит с микроэлементным составом, соответствующим составу природной кости и содержащим дополнительно германий в количестве от 3 до 30 мг в зависимости от состава исходного электролита, времени нанесения покрытия и, соответственно, его толщины. Германий входит в состав покрытия локально и пролонгировано поступает в организм. Суточная норма потребления германия организмом человека составляет от 0,8, 1,5 мг.
В качестве имплантатов, были использованы имплантаты, изготовленные из титанового сплава ВТ6, представляющие собой штифты круглого сечения длиной 20 мм и диаметром 4 мм. Они использовались в качестве анода в схеме фиг. 1.
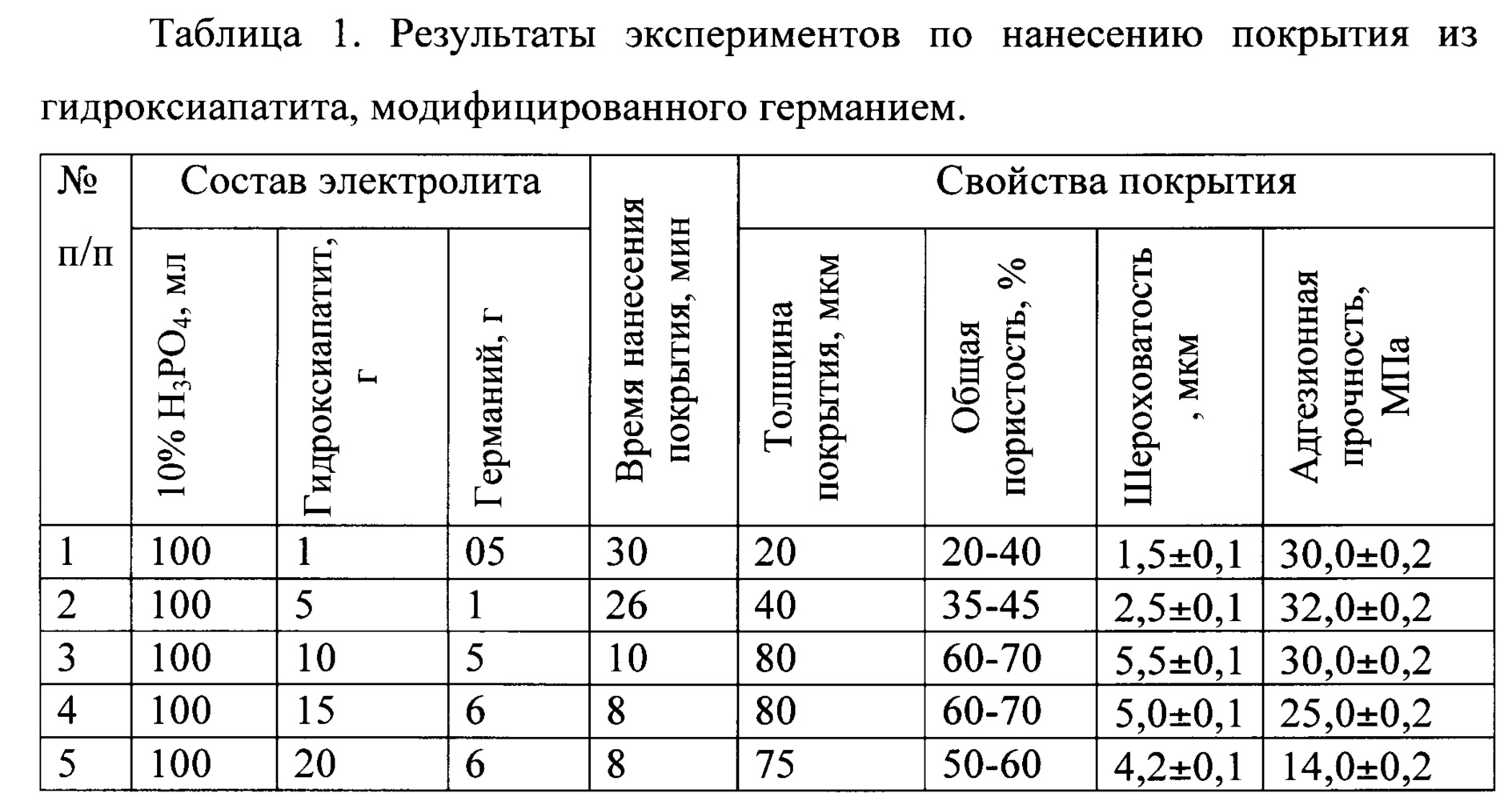
Пример 1. Подготовку поверхности имплантатов из титанового сплава ВТ6 выполняют химическим травлением в кислотном травителе, состоящим из смеси плавиковой и азотной кислот, следующего состава: HF:HNO3:H2O.=1:3:4 нагретом до температуры 30-70°С в течение 5-10 с. Протравленную поверхность титана промывают три раза дистиллированной водой, высушивают в кипящем изопропиловом спирте.
Приготавливают 100 мл 10% водный раствор ортофосфорной кислоты и при постоянном перемешивании вводят порошок биоактивного гидроксиапатита 1% масс. и порошок нанодисперсного германия - 0,5% масс. Подготовленный к нанесению покрытия имплантат (анод площадью 251 мм) помещают в раствор электролита. Через раствор электролита пропускают импульсный ток со следующими характеристиками: длительность импульса -150 мкс частота следования импульсов 10 Гц в течение 30 мин и конечном напряжении 310 В. Микродуговое нанесение покрытия проводят в анодном режиме при постоянном перемешивании электролита. Схема экспериментальной ячейки микродугового нанесения покрытия представлена на рисунке. 1.
Пример 2. Приготавливают 100 мл 10% водного раствора ортофосфорной кислоты, вводят 5 г порошка биоактивного гидроксиапатита и 1 г порошка нанодисперсного германия. Подготавливают имплантаты из титанового сплава ВТ6 аналогично как в примере 1 и погружают в ванну с электролитом. Через раствор электролита пропускают импульсный ток со следующими характеристиками: длительность импульса -200 мкс частота следования импульсов 20 Гц в течение 26 минут и конечном напряжении 400 В. Микродуговое нанесение покрытия проводят в анодном режиме при постоянном перемешивании электролита.
Пример 3. Приготавливают 100 мл 10% водного раствора ортофосфорной кислоты, вводят 10 г порошка биоактивного гидроксиапатита, и 5 г германия. Подготавливают имплантаты из титанового сплава ВТ6 аналогично как в примере 1 и погружают в ванну с электролитом. Через раствор электролита пропускают импульсный ток со следующими характеристиками: длительность импульса -200 мкс частота следования импульсов 30 Гц в течение 10 минут и конечном напряжении 400 В. Микродуговое нанесение покрытия проводят в анодном режиме при постоянном перемешивании электролита.
Пример 4. Приготавливают 100 мл 10% водного раствора ортофосфорной кислоты, вводят 15 г порошка биологического гидроксиапатита и 6 г германия. Подготавливают имплантаты из титанового сплава ВТ6 аналогично как в примере 1 и погружают в ванну с электролитом. Через раствор электролита пропускают импульсный ток со следующими характеристиками: длительность импульса -250 мкс, частота следования импульсов 40 Гц в течение 5 минут и конечном напряжении 400 В. Микродуговое нанесение покрытия проводят в анодном режиме при постоянном перемешивании электролита.
Пример 5. Приготавливают 100 мл 10% водного раствора ортофосфорной кислоты, вводят 20 г порошка биологического гидроксиапатита и 6 г германия. Подготавливают имплантаты из титанового сплава ВТ6 площадью 251 мм и погружают в ванну с электролитом. Микродуговое нанесение покрытия проводят в анодном режиме при постоянном перемешивании электролита.
Результаты экспериментов представлены в таблице 1.
Имплантаты из титанового сплава с покрытием, полученным заявляемым способом состава и успешно прошли биологические испытания на животных
Реципиентами для вживляемых имплантатов являлись 29 беспородных кошек мужского пола в возрасте от 1,5 до 4 лет массой от 2500 до 3400 г. Операции проводили под внутримышечным наркозом золетилом в дозировке 15 мг/кг с предварительной медикаментозной подготовкой атропина сульфатом в дозировке 0,04 мг/кг подкожно и 0,2% раствором рометара в дозировке 0,1 мл на 100 г массы тела. В верхней трети тазовой конечности выполняли разрез кожи и подлежащих тканей с открытием межвертельной ямки, где сверлом диаметром 4 мм высверливали канал длиной 20 мм в дистальном направлении бедренной кости. С помощью специального импактора в канале устанавливали штифт. Аналогичное хирургическое вмешательство осуществляли на противоположной задней конечности, после чего раны послойно ушивали.
Через 90 дней животных выводили из опыта. Под внутримышечным наркозом золетилом в дозировке 15 мг/кг в нижнюю полую вену реципиентов вводили 20 мл 10% раствора магнезии; после остановки дыхательной и сердечной деятельности проводили изъятие кости и готовили макропрепараты, которые затем помещали в 10% раствор формалина. Для исследования морфологии зоны имплантации штифтов на основе проксимальных отделов бедренных костей были приготовлены поперечные пластины толщиной 5 мм. Декальцинацию осуществляли в течение 21 суток в 4% растворе азотной кислоты при температуре 18-22°С, затем фрагменты кости извлекали из раствора кислоты, обезвоживали последовательно в 60, 80 и 96% растворах этанола в течение 24 ч в каждом спирте и просветляли в ксилоле. Материал заливали пластифицированным парафином и нарезали микротомом. Гистологические срезы материала толщиной 7-10 мкм окрашивали гематоксилином и эозином.
Морфологическая картина для всех образцов характеризовалась выраженными процессами регенерации костной ткани: на внутренней поверхности трубчатой кости обнаружены объемные скопления крупнозернистого базофильного вещества. Врастание остеобластов в это вещество свидетельствует о начале процесса формирования новых костных балок. Прочное соединение новообразовавшихся костных балок с покрытием штифта приводило к их разрушению при извлечении имплантата, подтверждением чему служили фрагменты разрушенных костных балок на внутренней поверхности трубчатой кости (фиг. 2). При этом клетки костного мозга, находившиеся в непосредственном контакте с биоактивным покрытием, не имели признаков разрушения.
Признаков воспаления, нагноения, аллергических реакций со стороны окружающих тканей вокруг покрытия не наблюдалось.
Биоактивное покрытие имеет многоуровневую пористую структуру с шероховатой поверхностью, а также требуемый комплекс механических свойств. Покрытие имеет толщину 20- 80 мкм, общую пористость 20-70%, шероховатость 1,5-5,5 мкм, адгезионную прочность 14-32 МПа.
Обогащение суспензии из гидроксиапатита, из которой производится нанесение покрытия, германием позволяет повысить биологическую активность покрытия, т.к. германий обладает широким спектром биологического действия, а именно: обеспечивает транспортировку кислорода к тканям организма, стимулирует иммунитет, оказывает противоопухолевое воздействие и биоцидное действие (противогрибковое, противовирусное, антибактериальное).
Биоактивное покрытие на титановом имплантате, нанесенное микродуговым методом из суспензии гидроксиапатита, полученного из природного гидроксиапатита, и нанодисперсного германия в растворе фосфорной кислоты, обладает повышенной биоактивностью, имеет высокие антибактериальные свойства, обладает хорошей адгезией к поверхности имплантата и развитой шероховатой поверхностью, достаточной для успешной остеоинтеграции костной ткани.
Таким образом, предложенный способ формирования покрытий из биологического гидроксиапатита на имплантате из титанового сплава ВТ6 существенным образом улучшает качество и биологическую активность покрытия имплантата. При этом в покрытии сохраняются микроэлементы, входящие в состав костной ткани, и не требуется их дополнительное введение в электролит. Применение имплантатов с предложенным покрытием ускоряет процесс восстановления поврежденных костных тканей и позволяет добиться наилучших лечебно-реабилитационных результатов.
Реферат
Изобретение относится к медицинской технике и раскрывает способ нанесения биоактивного покрытия на титановые имплантаты. Способ характеризуется тем, что готовят раствор для покрытия, представляющий собой электролит, содержащий ортофосфорную кислоту, биоактивный гидроксиапатит, нанодисперсный германий и дистиллированную воду с последующим нанесением покрытия на титановый имплантат посредством микродугового нанесения при длительности импульса - 150-200 мкс, частоте следования импульсов 1-45 Гц и напряжении 310-400 В в течение 12-20 мин при постоянном перемешивании электролита. Способ может быть использован для повышения качества покрытия и биоактивности титановых имплантатов, предназначенных для замены поврежденных участков костной ткани. 2 з.п. ф-лы, 2 ил., 1 табл., 5 пр.

Комментарии