Макромер с изоцианатной концевой группой и композиция на его основе для использования в качестве клея или уплотнителя для внутреннего применения - RU2516850C2
Код документа: RU2516850C2
Описание
Область изобретения
В настоящей заявке описываются новые полиизоцианатные макромеры или их смеси, а также их использование для создания клея или уплотнителя для внутреннего применения для использования в таких областях хирургии, как хирургия сердечно-сосудистой системы, периферийных сосудов, кардиоторакальная хирургия, а также гинекологическая, неврологическая хирургия и общая хирургия брюшной полости. Более конкретно, описываемые макромеры, их смеси или композиции на их основе полимеризуются в теле человека с образованием эластичного геля, являющегося биологически совместимым и распадающегося на нетоксичные и биосовместимые продукты. Кроме того, продукты распада растворимы в воде, что позволяет выводить их из организма вместе с продуктами обмена.
Предпосылки создания изобретения
В общем случае к тканевому клею предъявляются следующие основные требования.
(1) Хирургический клей/уплотнитель должен обеспечивать достаточную адгезионную или когезионную прочность для соединения или уплотнения тканей на месте применения.
(2) Протекающие при полимеризации клея экзотермические процессы не должны приводить к повреждению окружающей ткани.
(3) Клей не должен вызывать токсической реакции у окружающей здоровой ткани и должен, по возможности, способствовать регенерации новой ткани.
(4) Клей не должен выделять вредных продуктов распада.
(5) Клей должен распадаться и при распаде должен замещаться новой тканью с минимальным рубцеванием.
(6) Продукты биологического распада не должны накапливаться в организме, а должны естественным путем устраняться либо путем выделения, либо путем встраивания в естественный биохимический цикл.
Специалистам в данной области известно, что диизоцианатные и полиизоцианатные соединения могут использоваться для создания полимерных клеев и пен. Однако многие доступные в продаже диизоцианатные и полиизоцианатные мономеры представляют собой низкомолекулярные соединения, которые потенциально обладают токсичными и сенсибилизирующими свойствами и которые полимеризуются с образованием соединений, дающих токсичные продукты распада, например ароматические амины. Поэтому композиции, содержащие доступные в продаже низкомолекулярные диизоцианаты и полиизоцианаты, не пригодны для использования в теле человека.
Метаболически приемлемые полиизоцианатные мономеры описаны в патенте США № 4829099. Более конкретно, в указанном документе под формулой «I, предпочтительно» описан мономер, имеющий в качестве концевых групп ароматический бензоил-изоцианат и содержащий остатки гликолевой кислоты и остатки полиэтиленгликоля. В указанном выше документе сообщается, что образующийся полимер распадается с образованием метаболически приемлемых конечных продуктов, включая п-аминобензойную кислоту, полиэтиленгликоль и гликолевую кислоту. Хотя полученный полимер в принципе может распадаться на указанные выше соединения, считается, что in vivo гидролиз будет идти только по остаткам гликолевой кислоты с образованием смеси водорастворимых и водонерастворимых фрагментов. Водорастворимые фрагменты могут выводиться из организма естественным путем, через выделения. Однако водонерастворимые фрагменты естественным путем не выводятся, что приводит к нежелательному накоплению водонерастворимых фрагментов в организме.
В опубликованной заявке на патент США 2007/0276121 A1 описаны макромеры или их смеси, имеющие в структуре бензоил-изоцианатные концевые фрагменты и по меньшей мере два остатка водорастворимого полимера, связанных одной или несколькими гидролизуемыми связями, которые могут распадаться in vivo.
В опубликованной заявке на патент США 2006/0188547 A1 описан класс аминов, изоцианатов и образующихся при их полимеризации биорассасывающихся полиуретанов, полиамидов и полиэфируретанов. Также в указанном документе описаны способы присоединения таких фрагментов, как гликолевая кислота, молочная кислота, п-диоксанон и ε-капролактон, к фенолсодержащей аминокислоте с образованием новой химической структуры.
В патенте США № 6210441 описаны блок-сополимеры структуры полиэфир-уретан-мочевина, полученные из доступных в продаже низкомолекулярных диизоцианатов, таких как толуолдиизоцианат (TDI), дифенилметан-4,4'-диизоцианат (MDI) и гексаметиленизоцианат (HMDI). Однако указанные сополимеры не могут использоваться в качестве хирургического клея или уплотнителя, поскольку они уже полимеризованы, то есть затвердели, и не обеспечивают достаточных возможностей для манипуляции и выравнивания. Более того, указанные сополимеры не воспроизводят механических характеристик неповрежденной ткани. Кроме того, в ряде случаев они могут содержать, либо в результате процесса изготовления, либо в результате процессов распада, низкомолекулярные соединения, такие как ароматические диамины.
Таким образом, существует потребность в создании клея или уплотнителя для внутреннего применения на основе мономера, способного полимеризоваться in vivoс образованием клея или уплотнителя для внутреннего применения, сохраняющего способность к манипуляциям и выравниванию. В частности, желательно, чтобы указанный клей или уплотнитель заполнял внутренние пазухи и пустоты, проникал и плотно прилегал к полостям и порам ткани перед затвердеванием или схватыванием.
Кроме того, существует потребность в создании клея или уплотнителя для внутреннего применения на основе мономера, полимеризующегося in vivo, в котором мономер, композиция на его основе и образующийся полимер являются биосовместимыми. Образующийся полимер также должен быть биологически распадающимся. Продукты распада образующегося полимера также должны быть биосовместимыми и водорастворимыми, чтобы указанные продукты распада могли полностью выводиться из организма вместе с продуктами обмена.
Краткое описание изобретения
В настоящей заявке описаны новые макромеры или их смеси, в структуру которых входят множество изоцианатофенилэфирных концевых фрагментов и множество изоцианатофенилэфирных фрагментов, с которыми была проведена реакция с гидроксильными группами рассасываемого вещества, такого как эфиры полиэтиленгликоля, с образованием уретановой связи, а также поли(оксиалкилен)овая мостиковая группа между прореагировавшими и непрореагировавшими изоцианатофенилэфирными фрагментами.
Определения
Если не указано иное, все используемые в настоящем документе технические и научные термины имеют общепринятое значение, известное специалисту в области настоящего изобретения. Все указанные в настоящем документе патенты и публикации включены путем ссылки.
Используемый в настоящей заявке термин «биосовместимый» означает материал, который, будучи введенным, существенно не препятствует заживлению раны и (или) регенерации ткани и не вызывает существенных метаболических нарушений.
Используемые в настоящей заявке термины «биоразлагаемый» и «биорассасываемый» означают материал, который самопроизвольно или средствами организма млекопитающего разлагается на компоненты, которые поглощаются или выводятся из организма таким образом, что существенно не препятствуют заживлению раны и (или) регенерации тканей и не вызывают существенных метаболических нарушений.
Используемый в настоящей заявке термин «водорастворимый полимер» означает полимер, который при нормальных условиях (например, температуре тела) растворяется в воде с образованием прозрачного раствора.
Используемый в настоящей заявке термин «полиизоцианат» означает соединение с двумя или более изоцианатными группами.
Подробное описание изобретения
Композиция, составляющая предмет настоящего изобретения и описываемая в настоящем документе, представляет собой биосовместимый полиизоцианатный макромер с изоцианатофенилэфирными концевыми группами, имеющий структурную формулу I:
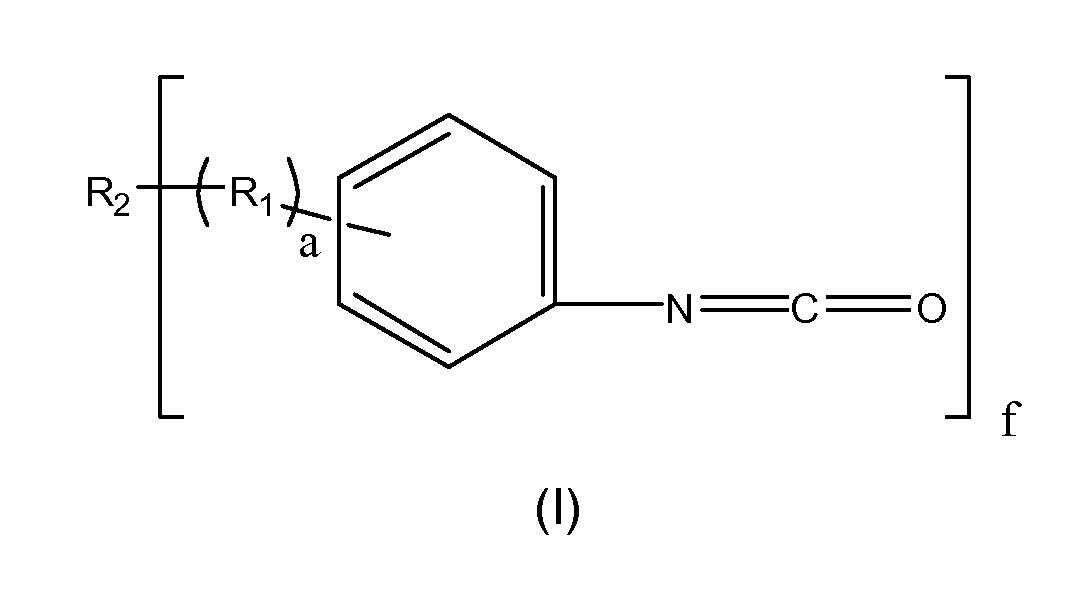
где R1представляет собой органический остаток, имеющий простую эфирную связь с ароматическим фрагментом и уретановую связь с R2, при этом a указывает количество повторяющихся R1 и находится в диапазоне от 1 до 5. R1 может находиться в ароматическом кольце в орто-, мета- и параположении по отношению к NCO, а также в любом их сочетании. Значение f указывает количество повторяющихся изоцианатных остатков, связанных с гидроксильной группой R2 макромера. R2 имеет следующую структуру:
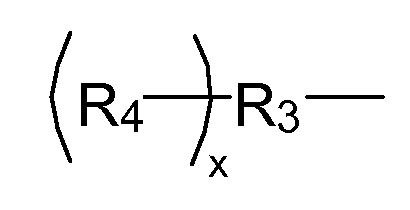
R2
где R3 представляет собой линейный или разветвленный остаток водорастворимого полимера, который образует сложноэфирные связи с R4 и уретановые связи с R1; R4 представляет собой линейный или разветвленный органический остаток, содержащий две или более карбоксилатные концевые группы, а x указывает количество повторяющихся R4 и находится в диапазоне от приблизительно 2 до приблизительно 6.
Наличие на ароматическом фрагменте электронно-донорной эфирной группы приводит к медленной реакции изоцианатной группы с водой с образованием амина. Образующийся в данном макромере амин имеет очень высокую реакционную способность и немедленно реагирует с изоцианатной группой другого макромера, тем самым образуя высокомолекулярный полимер, который может использоваться в качестве уплотнителя для функциональных тканей, даже из линейного (f=2) макромера.
Как описано выше, композиция клея или уплотнителя для внутреннего применения на основе мономера, способная полимеризоваться in vivo с образованием клея или уплотнителя для внутреннего применения, должна смачивать ткань, на которую она наносится, пропитывая ее и прилегая к полостям и порам ткани перед затвердеванием или схватыванием. Кроме того, мономер, композиция на его основе и получаемый полимер должны быть биосовместимыми.
Описанные в настоящем документе мономер и композиция на его основе могут иметь внутреннее применение, поскольку ни мономер, ни композиция на его основе, ни получаемый полимер не метаболизируются в организме человека с образованием токсичных продуктов.
Кроме того, указанный мономер и композиция на его основе полимеризуются и образуют биосовместимый полимер при контакте с водой или жидкостями организма. Далее биосовместимый полимер распадается in vivo с образованием биосовместимых и водорастворимых продуктов распада, которые выводятся из организма с продуктами обмена.
Указанный мономер и композиция на его основе имеют много вариантов применения в медицине и могут использоваться во многих типах хирургических операций, включая, помимо прочего, сердечно-сосудистую хирургию, хирургию периферических сосудов, кардиоторакальную хирургию, а также гинекологическую, неврологическую хирургию и общую хирургию брюшной полости.
Например, описываемый мономер и композиция на его основе могут использоваться в качестве хирургического клея для внутреннего применения при ортопедических процедурах, таких как восстановление передней крестообразной связки, лечение разрыва мениска (или в качестве гидрогеля при замене мениска), реконструкция задней суставной капсулы, восстановление манжеты вращателя плечевого сустава, а также в качестве клея для костей. Также он может использоваться в качестве клея для уменьшения объема легких, для фиксации заплат, пластики подкожной ткани и рассечения аорты. В частности, он может использоваться в качестве желудочного клея для сокращения объема желудка, а также в качестве клея для фиксации сетки при пластике грыжи, фиксации дренажных трубок, закрепления клапанов, противоспаечных пленок, скрепления ткани с тканью (например, скрепления синтетического или биологического тканевого каркаса с тканью, биоинженерной ткани с тканью), ткани с устройством (например, сеткой, клипсой, пленкой) и устройства с устройством.
Во-вторых, описываемый мономер и композиция на его основе могут использоваться для пластики подкожной ткани и для профилактики серомы в таких процедурах, как мастэктомия, восстановление и увеличение груди, восстановительная или косметическая пластика передней брюшной стенки, липосакция, подтяжка лица, кесарево сечение, гистерэктомия у страдающих ожирением пациентов, ортопедия в области бедра, пластика послеоперационной грыжи, удаление липомы, пластика травматического повреждения, пластика свища, фиксация трансплантата и реконструкция нерва.
В-третьих, описываемый мономер и композиция на его основе могут использоваться в качестве уплотнителя для закрепления и уплотнения дуральных заплаток, желчных протоков, ликвидации утечек желчи в печеночном ложе, утечек из мочевого пузыря, крепления и уплотнения костных трансплантатов, ожоговых трансплантатов и обтураций с истечением жидкости. В качестве уплотнителя он может наноситься на ткань, устройство и границу между тканью и устройством и может использоваться в качестве дурально-черепного уплотнителя, дурально-позвоночного уплотнителя, сердечно/периферийно-сосудистого уплотнителя, желудочно-кишечного уплотнителя (например, для пищевода, кишечника, крупных органов, поджелудочной железы, желудка и язвы желудка), легочного уплотнителя, уплотнителя для мягких уровней (например, печени, селезенки, поджелудочной железы), заменителя костного воска, уплотнителя опухолей, в сочетании скоба/клей, в сочетании уплотнитель/гемостат, в качестве уплотнителя для уретры. Его можно использовать в процедурах, включающих, помимо прочего, следующие процедуры: обходной желудочный анастомоз, резекция паренхиматозных органов, трахеостомия, дивертикулезный язвенный колит, радикальная простатэктомия, реконструкция синуса, стернотомия, холедоходуоденостомия, уплотнение ложа желчного пузыря (печеночного ложа) и холецистэктомия.
В-четвертых, описываемый мономер и композиция на его основе могут использоваться в качестве наполнителя или периуретрального объемообразующего агента в процедурах, включающих, помимо прочего, следующие процедуры: удаление мертвого пространства в восстановительной и косметической хирургии (например, в пластической/косметической/восстановительной хирургии, устранении дефектов лица и для заполнения пустот), лечение недержания мочи и иных гинекологических процедурах, пластика анальной трещины/свища, введение катетера в миокард для лечения застойной сердечной недостаточности, заполнение позвоночных имплантатов, заполнение кист/свищей поджелудочной железы/печени и пластики детского свища пищевода.
В-пятых, описываемый мономер и композиция на его основе могут использоваться в качестве матрицы для тканевой инженерии (например, создания каркасов тканей, транспортной матрицы для клеток, транспортной матрицы для радиотерапевтических агентов (в брахитерапии), транспортной матрицы для факторов роста, инжекционной матрицы для формирования пустого клеточного каркаса in situ, инжекционной матрицы для каркасов для доставки стволовых клеток, клеточного лизата или иных биологических, биоактивных, фармацевтических и нутрицевтических препаратов, локализующей матрицы для химиотерапии и локализующей матрицы для контрастных агентов.
В-шестых, описываемый мономер и композиция на его основе могут использоваться в качестве предотвращающего образование спаек барьера при таких процедурах, как сердечная хирургия, хирургия грудной полости, общая хирургия, акушерско-гинекологическая хирургия, ортопедическая хирургия и хирургия позвоночника (например, при установке искусственного позвоночного диска).
В-седьмых, описываемый мономер и композиция на его основе могут использоваться в качестве заградительного материала при эмболизации (например, при фистуле ЖКТ, церебральном/васкулярном закрытии аневризмы мозга, закрытии маточной трубы и закупоривании варикозных вен).
Макромер
Описываемая в настоящем документе композиция представляет собой биосовместимый полиизоцианатный макромер с изоцианатофенилэфирными концевыми группами, имеющий структурную формулу I:

где R1представляет собой органический остаток, имеющий уретановую связь с R2, где R2 имеет следующую структуру:
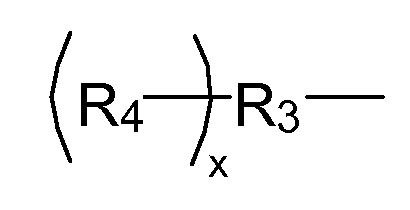
R2
где R3 представляет собой линейный или разветвленный остаток водорастворимого полимера, который образует сложноэфирные связи с R4 и уретановые связи с R1; и R4 представляет собой линейный или разветвленный органический остаток, содержащий две или более карбоксилатные концевые группы, где x указывает количество повторяющихся R4 и находится в диапазоне от приблизительно 2 до приблизительно 6.
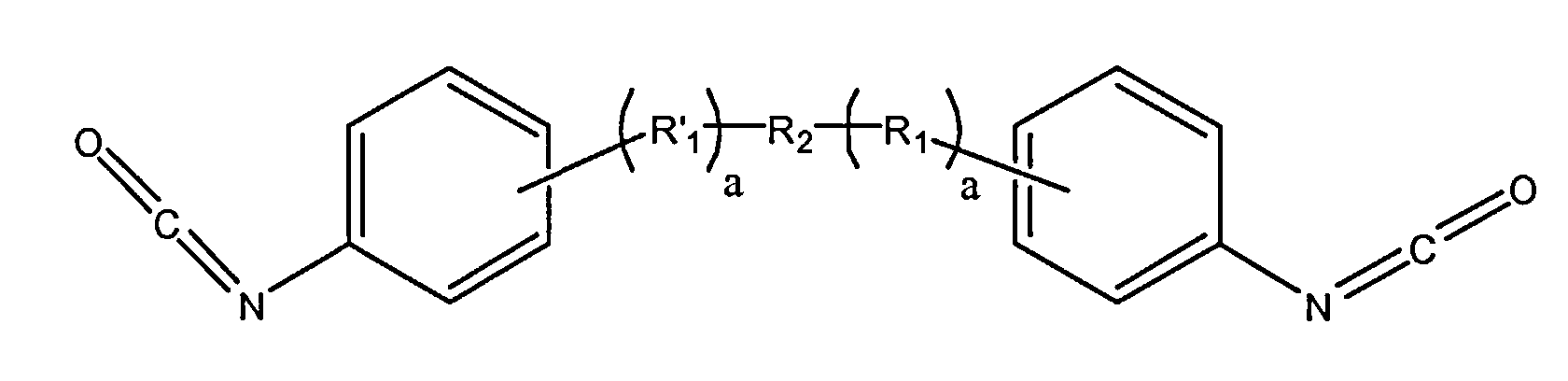
R1 может находиться в ароматическом кольце в орто-, мета- и параположении по отношению к NCO, а также в любом их сочетании. Значение f указывает количество изоцианатных остатков, связанных с гидроксильной группой R2 макромера. При f=2 формула I представляет линейный макромер с двумя изоцианатными концевыми группами. При f больше 2 формула I представляет разветвленный макромер с более чем двумя изоцианатными концевыми группами, причем a указывает количество повторяющихся R1 и находится в диапазоне от 1 до 5.
Отсутствие электронно-акцепторной группы (например, C=O) в структуре по формуле I (f=2) позволяет указанным линейным мономерам легко полимеризоваться с образованием синтетического клея при воздействии влажности, в отличие от функционализированных бензоилом диизоцианатных макромеров, описанных в опубликованной заявке на патент США № 2007/0276121 A1, где для получения полимеризованного эластичного высокомолекулярного соединения желательно иметь разветвленный макромер (f>2). Таким образом, обусловленная наличием простой эфирной связи повышенная реакционная способность макромеров, составляющих предмет настоящего изобретения, устраняет необходимость в разветвленном макромере, обсуждаемую в патентной заявке № 0276121. Преимущества, даваемые наличием простой эфирной связи, включают, помимо прочего, упрощение процессов производства и исследования получаемых макромеров, а также простоту их применения.
Ниже приведен пример R1 при a=1
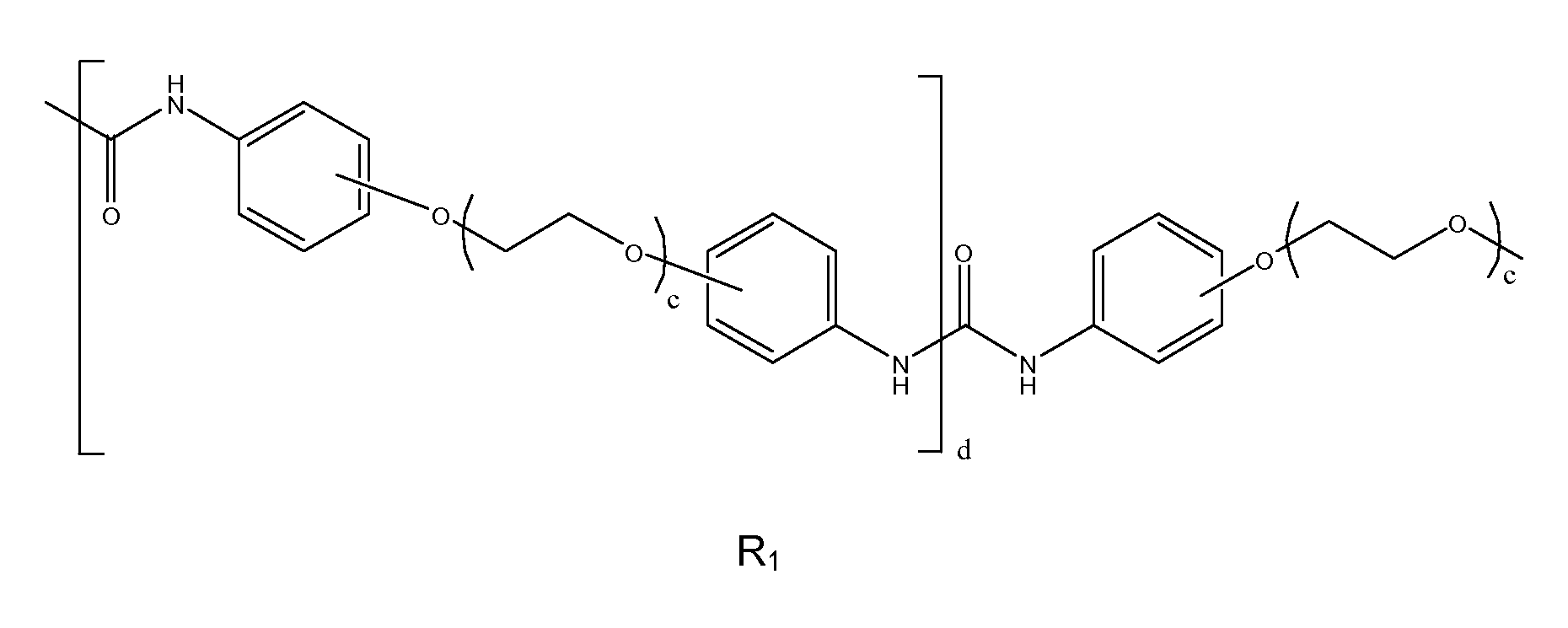

где d представляет собой среднее количество повторяющихся диарилэфирных звеньев в описываемом изоцианатном макромере и 0≤d≤5, этиленоксидный участок R1 может быть линейным или разветвленным, значение c, указывающее количество эфирных единиц повтора, может находиться в диапазоне от 1 до 100, предпочтительно - в диапазоне от 1 до 10.
Неограничивающий пример подобного макромера при a=1, c=4, d=0 и f=2 приведен ниже, где значение каждого из параметров a, c, d и f определены способом ЖХ-МС.
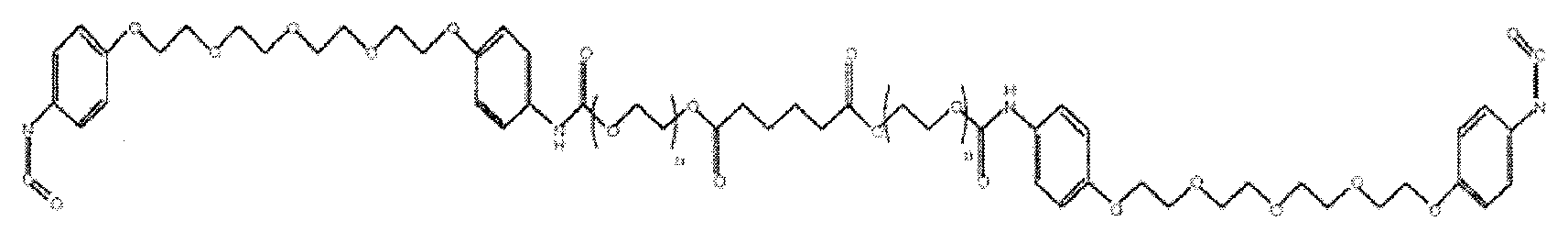
R2в формуле I имеет следующую структуру:
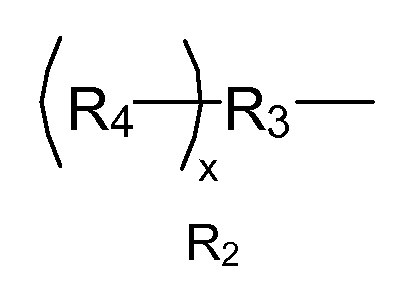
где R2 в формуле I имеет одну или несколько гидролизуемых сложноэфирных связей, которые биоразложимы in vivo;
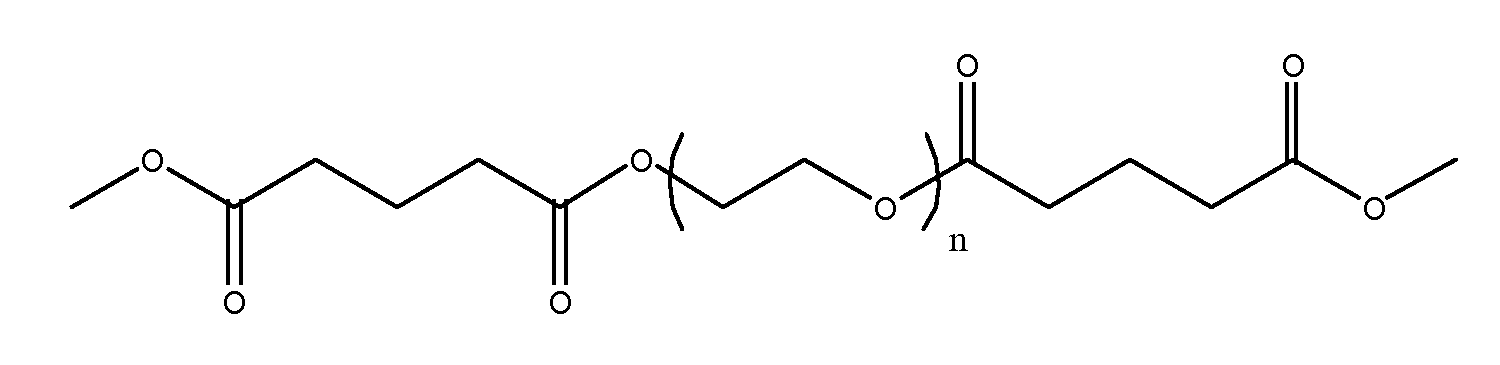
R3 может представлять собой остаток водорастворимого полимера, включая, помимо прочего, остаток полиалкиленгликоля, такого как полиэтиленгликоль, полиалкиленоксида, поливинилпирролидона, поливинилового спирта, поливинилметилового эфира, полигидроксиэтилметакрилата, полимера или сополимера полиакриловой кислоты, полиоксазолина, полифосфазина, полиакриламида, полипептида или водорастворимых производных любого из перечисленных выше классов соединений, который образует сложноэфирные связи с R4 и уретановые связи с R1 при a=1 или более. Кроме того, R3может быть линейным или разветвленным. Если R3 представляет собой остаток полиэтиленгликоля

и a=1 или более, n должно иметь достаточно большое значение, чтобы образующийся продукт разложения IV (показан ниже) оказался водорастворимым. Например, nможет находиться в диапазоне от 2 до 250, предпочтительно - от 5 до 100, более предпочтительно - от 5 до 25. Молекулярная масса R3 может находиться в диапазоне от 80 до 10000, предпочтительно - от 200 до 6000, более предпочтительно - от 200 до 4000. Указанные остатки водорастворимого полимера должны быть введены в макромер в положении R3 и критичны для растворимости образующихся продуктов разложения, как будет более подробно описано далее.
R4 может представлять собой органический остаток с f карбоксилатными концевыми группами. Например, R4 может представлять собой производное линейной двухосновной кислоты, такой как дигликолевая кислота, малоновая кислота, глутаровая кислота, янтарная кислота, адипиновая кислота, или полиалкиленгликолей с карбоксильными концевыми группами, такими как дикарбоксилаты полиалкиленгликоля.
Если R4 представляет собой алифатический дикарбоксилат:
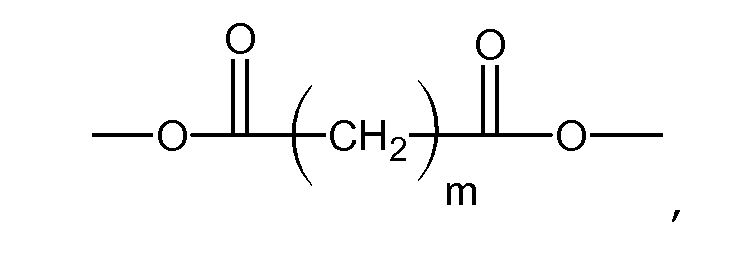
то m может находиться в диапазоне от 1 до 10. Выбор значения m производится на основе двух факторов: биосовместимости и растворимости продуктов разложения. Если m=0, то содержащий двухосновную кислоту продукт гидролитической деградации макромера будет слишком кислым, что отрицательно скажется на биосовместимости препарата. Если mимеет слишком большое значение, то содержащий двухосновную кислоту продукт распада будет нерастворим в воде.
В альтернативном варианте R4 может представлять собой производное разветвленной кислоты, такой как трикарбаллиловая кислота, лимонная кислота или винная кислота, или их глутарангидридное производное. В альтернативном варианте R4 может представлять собой производное любой из указанных выше кислот, полиалкиленгликолей с карбоксильными концевыми группами или глутарангидридного производного, в результате чего получается соединение с карбоксилатными концевыми группами. Дополнительные примеры R4 приведены ниже:
или
В альтернативном варианте R2может быть получен из любой карбонилсодержащей группы путем синтеза (включая, помимо прочего, следующие способы: транс-этерификацию, конденсацию галоген-ангидрида со спиртом, конденсацию кислоты со спиртом), приводящего к образованию сложноэфирных связей с R3.
Примеры R2, помимо прочего, включают остаток эфира полиэтиленгликоля (ПЭГ), полученный в результате реакции поликонденсации полиэтиленгликоля и соединения, содержащего несколько карбоксильных групп, при этом указанные соединения с карбоксильными группами включают, помимо прочего, следующие соединения: дигликолевая кислота, малоновая кислота, глутаровая кислота, адипиновая кислота, винная кислота и полиэтиленгликоли с карбоксильными концевыми группами.
Примеры ПЭГ-эфирного варианта остатка R2, включают, помимо прочего:
(a)

где n=20 для ПЭГ с молекулярной массой 900, а двухосновная кислота представляет собой дигликолевую кислоту;
(b)

где n=20 для ПЭГ с молекулярной массой 900, а двухосновная кислота представляет собой янтарную кислоту;
(c)

где n=20 для ПЭГ с молекулярной массой 900, а двухосновная кислота представляет собой глутаровую кислоту;
(d)
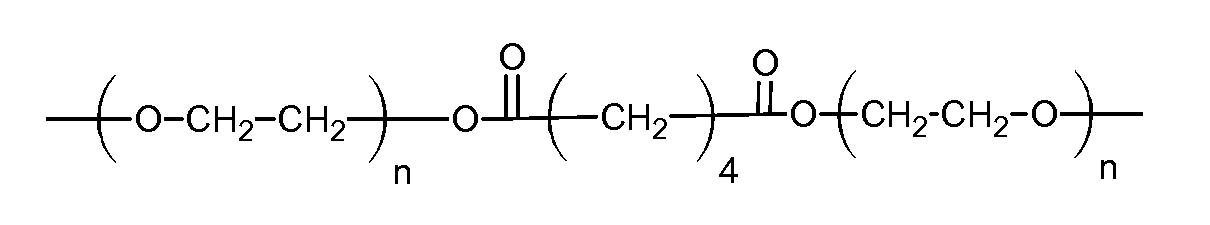
где n=20 для ПЭГ с молекулярной массой 900, а двухосновная кислота представляет собой адипиновую кислоту;
(e)
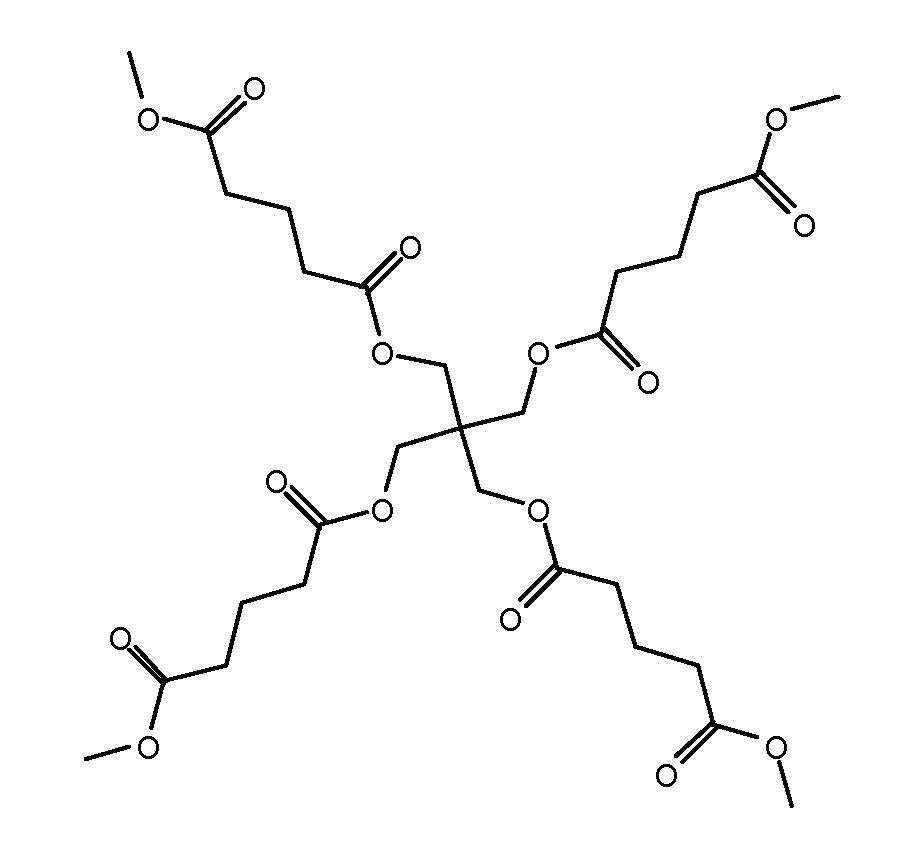
другие примеры содержат разветвленные остатки R2и включают:
(f)

(g)

(h)
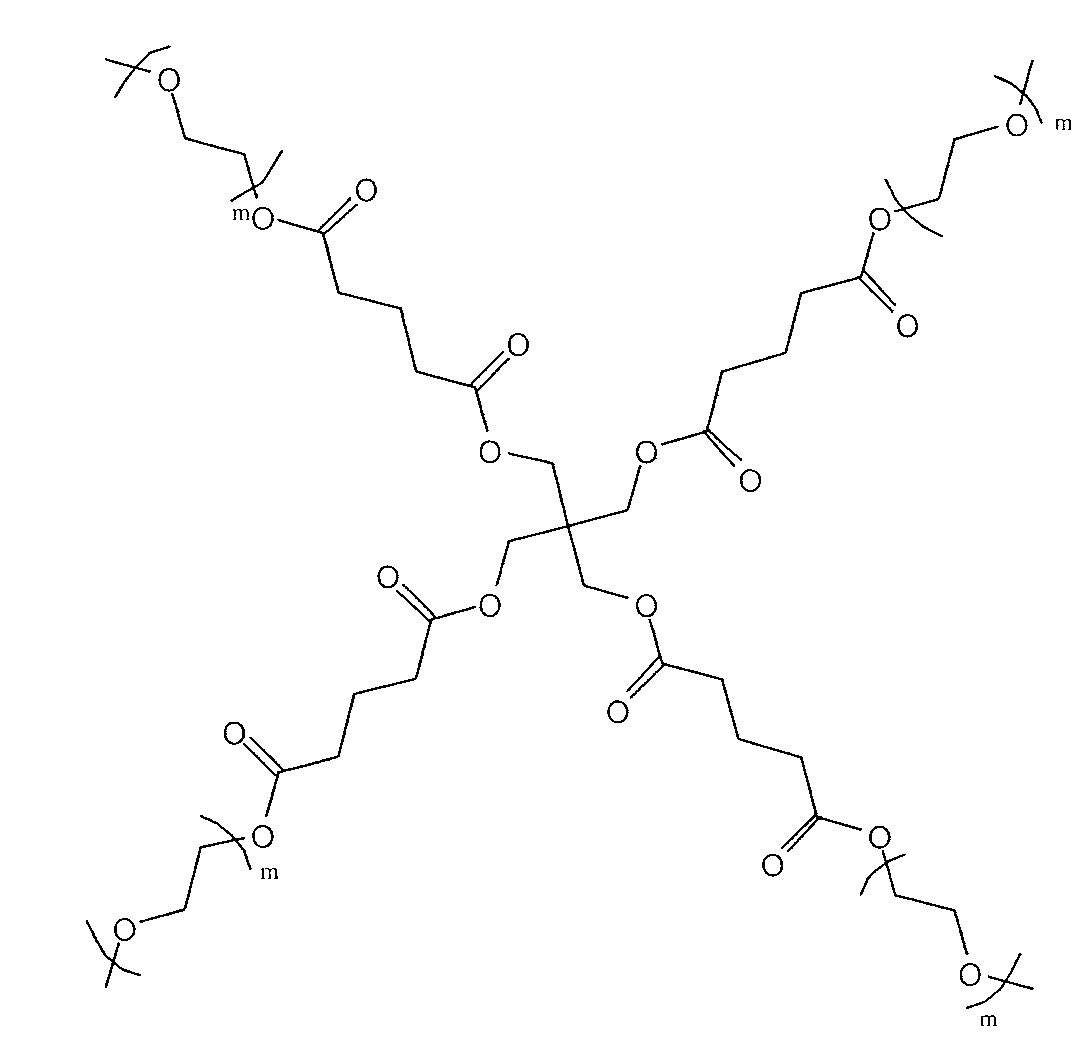
(i)
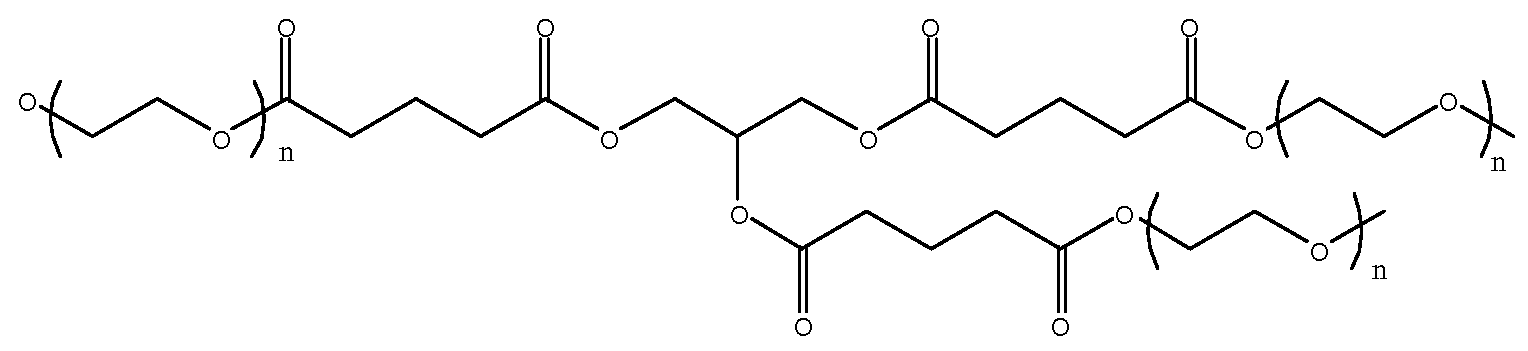
(j)
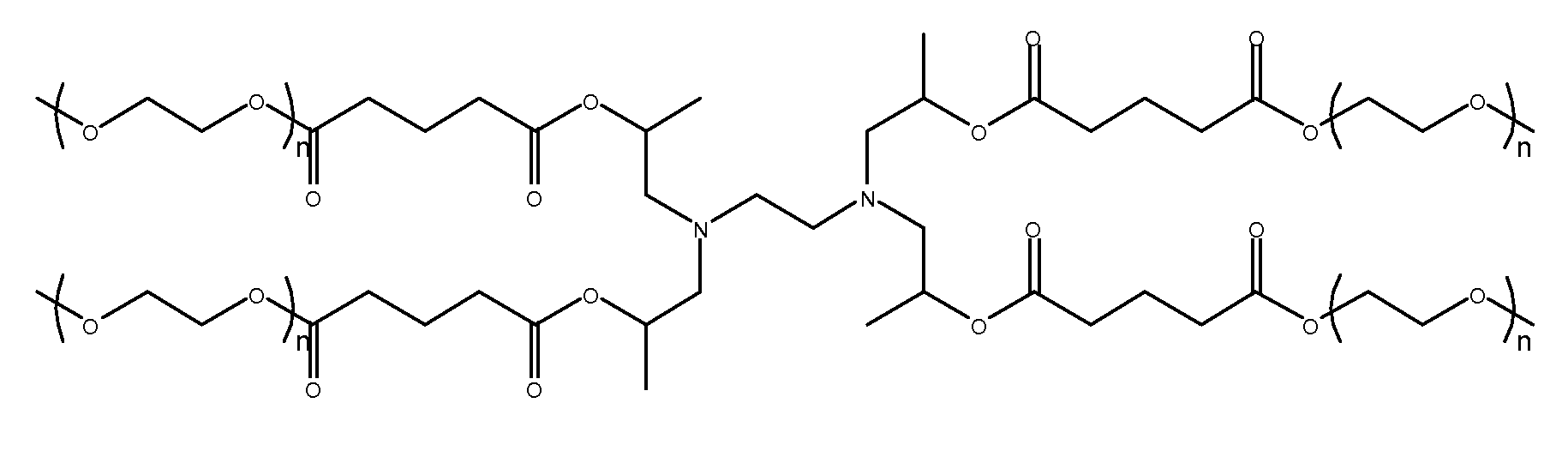
(k)
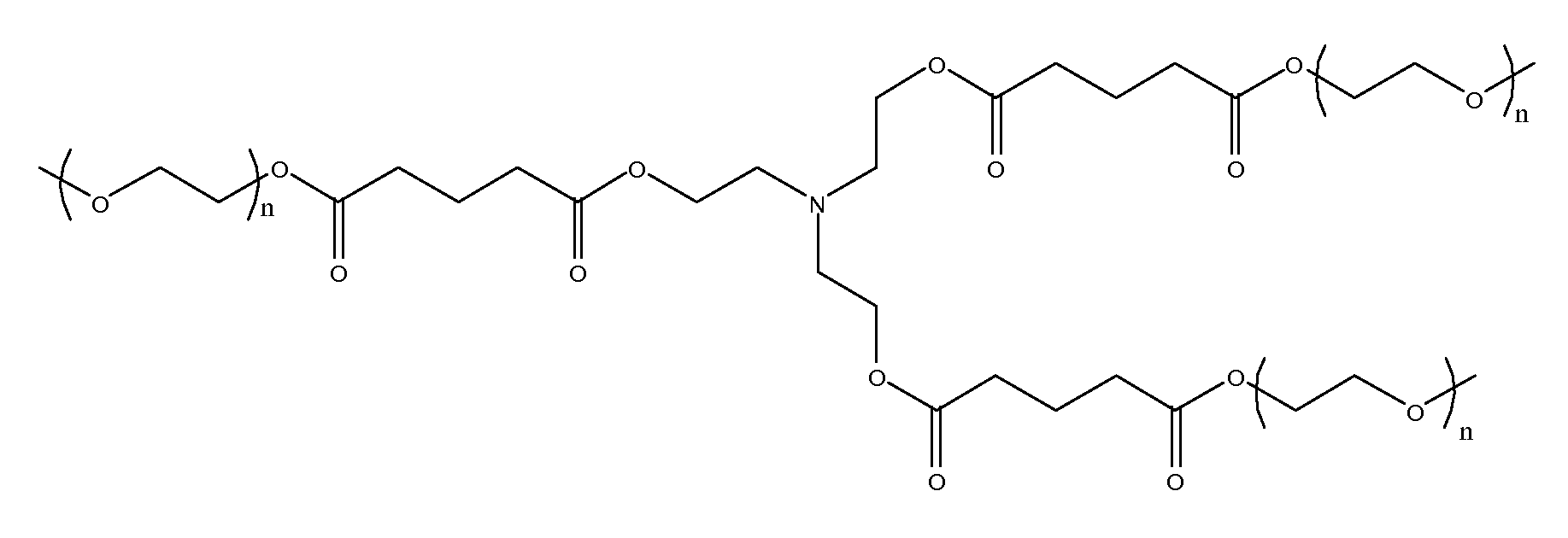
(l)

Молекулярная масса R2макромера может находиться в диапазоне от приблизительно 80 до 20000 г/моль.
Диапазон молекулярных масс описываемых в настоящем документе макромеров может составлять от приблизительно 500 до 20000 г/моль, предпочтительно - от приблизительно 500 до приблизительно 4000 г/моль.
Макромерсодержащая композиция
Приемлемая с медицинской точки зрения композиция может включать описываемый полиизоцианатный макромер, растворитель, катализатор, поверхностно-активное вещество, стабилизатор или антиоксидант, а также краситель.
Как правило, используемый растворитель представляет собой гидрофильный растворитель, включая, помимо прочего, диметилсульфоксид (DMSO), ацетон, диметоксиполиэтиленгликоли, глицерин, Tween 80, диметилизосорбид, пропиленкарбонат и 1-метил-2-пирролидинон (NMP). Также возможно использование менее гидрофильных растворителей, таких как этиллактат, триацетин, бензиловый спирт, бензилбензоат, различных сложноэфирные растворители: триэтилцитрат, ацетилтриэтилцитрат, три-н-бутилцитрат, ацетилтри-н-бутилцитрат, этилацетат и т.п. Например, растворитель может использоваться в количестве до приблизительно 50% вес. от совокупной массы растворителя и макромера.
Растворитель выполняет в макромерсодержащей композиции несколько функций, в том числе: (1) контроль вязкости; (2) контроль образования пузырьков/пены и ухода пузырьков; (3) улучшение проникновения композиции в ткани; и (4) улучшение смачиваемости ткани. Вязкость описываемой композиции находится в диапазоне от 0,01 до 100 Па·с (от 10 до 100000 сП), предпочтительно - от 0,5 до 50 Па·с (от 500 до 50 000 сП).
Также в композицию могут добавляться поверхностно-активные вещества для контроля пенообразования: неионные ПАВ, такие как Tween, Brij и силоксаны, а также ионные ПАВ, такие как лецитин (фосфатидилхолин), додецилсульфат натрия, а также иные ПАВ, известные специалистам в данной области техники.
Также в композицию могут добавляться катализаторы для увеличения скорости реакции, например триэтилендиамин (DABCO), пиридин, этил-2-пиридилацетат и октоат олова.
Красители, которые могут использоваться в макромерсодержащей композиции, включают, помимо прочего, метиленовый синий, FD&C синий № 1 или № 2 и традиционные красители, применяемые в рассасывающихся медицинских изделиях, таких как хирургические нити.
В макромерсодержащую композицию могут вводиться антиоксиданты, такие как бутилированный гидрокситолуол (BHT), для увеличения срока хранения продукта.
Клеящая система
Один из примеров клеящей системы включает, помимо прочего, систему, в которой макромер и растворитель хранятся раздельно до момента использования. Например, макромер может храниться в одном цилиндре двухцилиндрового шприца, а растворитель - в другом цилиндре. В альтернативном варианте макромер и растворитель могут смешиваться перед использованием любым традиционным способом.
Биосовместимый эластичный гель
Полимер, образующийся в результате in vivo полимеризации макромера, представляет собой биологически разлагаемый эластичный гель, и продукты его распада должны быть биосовместимы и водорастворимы, чтобы они могли полностью выводиться из организма вместе с продуктами обмена.
В частности, макромер или композиция на его основе полимеризуется с образованием биосовместимого эластичного геля при контакте с водой или жидкостями организма по следующей схеме реакции:

где X обозначает структурный фрагмент, расположенный между двух концевых функциональных групп; X зависит от типа используемого макромера. Описанная выше реакция легко протекает в условиях организма, приводя к спонтанному распаду дикарбамата на диамин и двуокись углерода. Реакционную способность изоцианата и образующегося из него амина можно регулировать путем контроля электронной плотности на реакционном азотном фрагменте с помощью вводимых в ароматическое кольцо функциональных заместителей, что позволяет адаптировать макромер или композицию на его основе для нужд конкретного клинического приложения.
На следующем этапе образовавшийся диамин реагирует с изоцианатной группой с образованием эластичного геля по следующей схеме:

Продукты распада
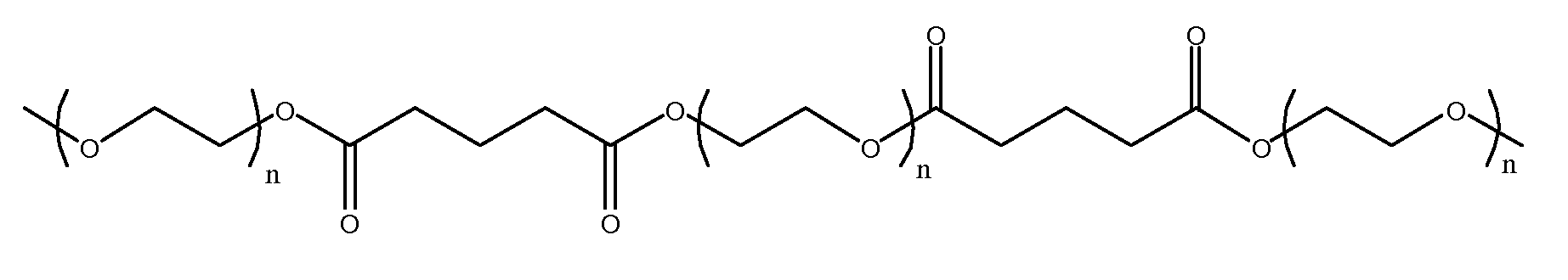
Образующийся из описываемого в настоящей заявке макромера эластичный гель является биологически разлагаемым и гидролизуется in vivo с образованием биосовместимых и водорастворимых продуктов распада, включая ароматические продукты. Для обеспечения водорастворимости всех ароматических продуктов распада структура эластичного геля выбирается таким образом, чтобы при расщеплении концевые группы на ароматических продуктах распада представляли собой остатки водорастворимых полимеров. Например, после полимеризации клея или уплотнителя на основе макромера образовавшийся в организме эластичный гель имеет повторяющийся фрагмент со структурой по формуле IV.

Образовавшийся биосовместимый эластичный гель (IV) содержит разнообразные гидролизуемые связи, которые включают, помимо прочего, алифатические сложноэфирные связи, уретановые связи и мочевинные связи. Указанные алифатические сложноэфирные связи в эластичном геле более склонны к распаду в условиях in vivo, чем другие типы связей, что приводит к образованию первичного ароматического продукта распада V.
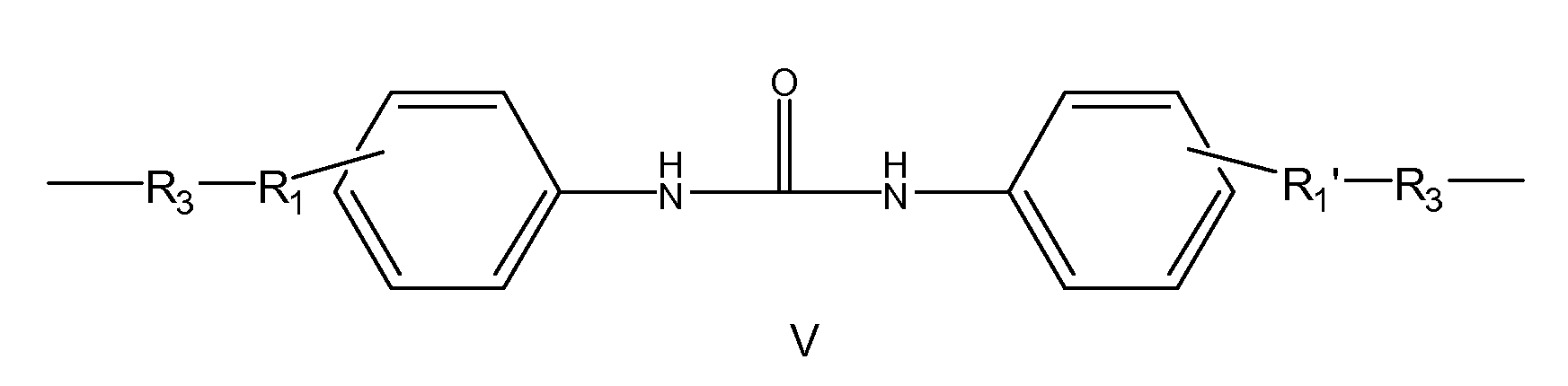
Описываемая композиция имеет множество вариантов применения в медицине. Например, она может использоваться в качестве хирургического клея для внутреннего применения, клея, соединяющего ткани друг с другом, ткани с медицинскими приспособлениями и медицинские приспособления друг с другом. В качестве уплотнителя композиция может наноситься на ткань, на медицинское устройство или на поверхность контакта медицинского устройства и ткани с целью предотвращения подтекания. Описываемая композиция может использоваться для образования пленок in situ, которые могут применяться, например, для предотвращения хирургических спаек. Описываемая композиция может использоваться для образования пен in situ, которые могут применяться, например, в качестве наполнителя (например, для удаления мертвого пространства, в восстановительной и косметической хирургии), объемообразующего агента, материала для тканевой инженерии (например, создания каркасов) и в других целях, когда могут применяться пены и губки. Описываемая композиция может быть приготовлена таким образом, чтобы ее можно было вводить методом инъекции и использовать для создания in situ локализованных гелей, прикрепляемых к ткани и остающихся на месте, в которое были введены. Такие композиции могут использоваться в качестве матриц для доставки клеток и других биологических объектов, биологически активных реагентов, фармацевтических препаратов и нутрицевтиков, реагентов, в качестве эмболизирующих агентов, а также в качестве средства локализации контрастирующих агентов. Описываемая композиция может также использоваться для закрепления медицинских устройств (например, сетки, клипсы, пленки) на ткани. Описываемая композиция может использоваться во многих типах хирургических операций, включая, помимо прочего, сердечно-сосудистую хирургию, хирургию периферических сосудов, кардиоторакальную хирургию, а также гинекологическую, неврологическую хирургию и общую хирургию брюшной полости.
В качестве хирургического уплотнителя/клея описываемая композиция может применяться в дополнение к первичным средствам закрытия ран, таким как скобы и нити, для изоляции возможных утечек газов, жидкостей или твердых веществ. Более конкретно указанный хирургический уплотнитель/клей может наноситься на ткань как часть хирургической процедуры в различных формах, например в форме жидкости, порошка, пленки, губки или пены, пропитанной ткани, пропитанной губки или пены, аэрозоля.
В качестве наполнителя описываемый макромер или композиция на его основе может применяться в лицевой хирургии для устранения дефектов или заполнения полостей. Например, описываемая композиция может быть введена в пространство внутренней полости и там полимеризоваться, так что образовавшийся полимер заполнит внутренние полости и пустоты, проникая внутрь и повторяя форму полостей и пор ткани. Описываемая композиция может использоваться после широкого спектра процедур, потенциально имеющих риск образования мертвого пространства, включая, помимо прочего, такие процедуры, как радикальная мастэктомия (т.е. удаление груди и локальных лимфатических узлов при терапии рака), процедура восстановления и увеличения груди, восстановительная или косметическая пластика передней брюшной стенки и липосакция, подтяжка лица, кесарево сечение и гистерэктомия у страдающих ожирением пациентов, ортопедические процедуры в области бедра, пластика послеоперационной грыжи, удаление липомы, пластика травматических повреждений, т.е. закрытой травмы.
Несмотря на то что в представленных ниже примерах демонстрируются некоторые варианты осуществления настоящего изобретения, их следует интерпретировать не как ограничение области изобретения, а как дополнительное средство для полного описания изобретения.
ПРИМЕРЫ
Пример 1. Диизоцианат (ПЭГ4-эфир-Ar-NCO), применяемый в качестве строительного блока для получения уретанов, составляющих предмет настоящего изобретения, получали по следующей схеме:

Конечный продукт, ПЭГ4-эфир-Ar-NCO, при комнатной температуре представляет собой воскообразное твердое вещество коричневого цвета с температурой плавления ниже 120°C. Структура полученного соединения подтверждена ЯМР. Чистота полученного соединения составляет по результатам ЯМР 99,5%, по результатам ВЭЖХ - 96%.
Следуя описанной выше процедуре, орто-и метапроизводные могут быть синтезированы из орто- и метафторнитробензола, соответственно.
Пример 2. Для изготовления рассасываемых ПЭГ-эфирных уретанов получили ПЭГ-эфиры следующей структуры:
(2.1) ди-ПЭГ400-адипат (L4Ad) получили из исходного реагента (номер по каталогу Aldrich 494852, партия 13009HS), очистили нагревом с толуолом и смешиванием с лимонной кислотой на окиси кремния, диатомовой землей и активированным углем с последующим фильтрованием через целлюлозный бумажный фильтр с размером пор 2 мкм.
(2.2) ди-ПЭГ900-глутарат (L9G)-

получили следующим образом. В чистую сухую тарированную колбу с якорьком мешалки поместили следующие реагенты: 90,00 г (0,1 моль) ПЭГ900 и 6,61 г (0,05 моль) глутаровой кислоты. Стеклянную пипетку соединили с линией подачи газообразного азота и погрузили ее конец в жидкость, организовав контролируемое барботирование потоком азота. Временно приостановив барботирование азотом, через второе горло добавили 0,5 г порошка оксалата олова (II). После засыпания всего порошка и тщательного перемешивания оксалата олова (II) в растворе ПЭГ в течение нескольких минут при комнатной температуре возобновили барботирование азотом, обеспечивая непрерывное, но контролируемое (практически без разбрызгивания) выделение газообразного азота через реакционную смесь. Затем колбу погрузили в масляную баню при температуре 180°C. Реакцию контролировали в течение 2 часов. После выдерживания в течение 2 часов при температуре 180°C колбу быстро переоборудовали для работы под высоким вакуумом с вакуумной ловушкой на смеси сухого льда с ацетоном. Реакцию продолжали при температуре 180°C в течение 16 часов под высоким вакуумом. Через 16 часов в колбе сбросили вакуум, запустив газообразный азот. Полученный продукт выделили следующим образом. Температуру масляной бани опустили до 80°C. Затем добавили следующие компоненты: ~100 мл толуола, 5 г лимонной кислоты на окиси кремния, 5 г диатомовой земли и 5 г активированного угля. Полученную смесь перемешивали в течение по меньшей мере 2 часов, затем профильтровали и сконцентрировали на роторном испарителе. Полученный продукт при комнатной температуре представляет собой воскообразное твердое вещество. Выход продукта составил 70%. Степень превращения групп COOH по результатам титрования составила 99,5%.
(2.3) ди-ПЭГ600-ПЭГ600-дикислоту (L6P6)-
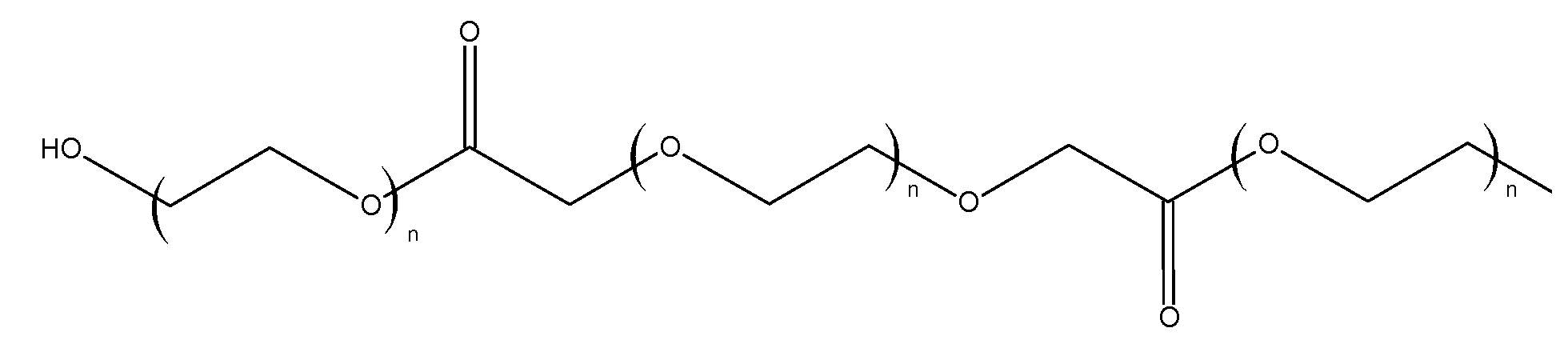
получили способом, аналогичным описанному выше продукту 2.2, со следующими изменениями: в качестве исходных реагентов брали 120,0 г (0,2 моль) ПЭГ600 и 60,0 г (0,1 моль) ПЭГ600-дикислоты.
(2.4) ПЭГ400-диглутарат-ди-ПЭГ600 (L6G4-линейный, ПЭГ600-глутарат-ПЭГ400-глутарат-ПЭГ600).

Для получения L6G4 использовали следующую процедуру. В сухую чистую четырехгорлую колбу объемом 1 л с установленными механической мешалкой, вводом для подачи азота, датчиком температуры и насадкой Дина-Старка поместили 149,79 г (0,3744 моль) ПЭГ400. Содержимое колбы при перемешивании нагрели до температуры 120°C в атмосфере азота. По достижении указанной температуры смесь выдержали под вакуумом в течение 1,5 часов. Затем вакуум сбросили и добавили 85,56 г (0,7499 моль) глутарового ангидрида. Полученный раствор перемешивали в атмосфере азота при температуре 120°C в течение 2,5 часов, пока ИК анализ не показал отсутствие ангидрида. Затем раствор охладили и добавили 436,06 г (0,7268 моль) ПЭГ600 NF и 0,67 г (0,0032 моль) оксалата олова (II). Колбу нагрели до температуры 180°C и выдержали 2 часа при азотном барботировании. Затем смесь на 16 часов поместили под вакуум, после чего степень превращения кислотных групп в эфирные составила 99,96% по результатам определения содержания кислоты. Полученный полиол охладили до температуры 80°C и добавили следующие реагенты: 6,97 г лимонной кислоты на окиси кремния, 7,11 г диатомовой земли и 3,39 г активированного угля. Полученную суспензию перемешивали при температуре 80°C под азотной подушкой в течение 1 часа. Затем суспензию разбавили 50% вес./об. толуолом, перемешали в течение еще 15 минут и профильтровали через целлюлозный бумажный фильтр с размером пор 2 мкм. Растворитель отогнали и получили вязкую жидкость бледно-желтого цвета. Выход =95%, степень этерификации =99,88%, содержание олова по данным атомно-абсорбционной спектроскопии составило менее 5 частей на миллион.
Пример 3
Сопряжение ряда ПЭГ-эфирных полиолов с ПЭГ4-эфир-Ar-NCO для получения ПЭГ-эфир-уретанов с концевыми изоцианатными группами при стехиометрии реакции 2 моля ди-NCO:1 моль полиола:
(3.1) ПЭГ4-эфир-Ar-NCO-уретан-терминальный-L4Ad.

В круглодонную колбу поместили 10,0 г L4Ad, колбу выдержали при температуре 120°C под высоким вакуумом (<13,3 Па (100 мм рт.ст.)) в течение 2 часов для удаления следов воды. Затем колбу охладили до 70°C. В колбу в азотной атмосфере добавили 9,55 г ПЭГ4-эфир-Ar-NCO. Полученную смесь перемешивали в азотной атмосфере при температуре 70°C в течение 24 часов. Получили продукт в виде вязкой жидкости янтарного цвета. Структуру продукта подтвердили ИК спектроскопией. При разведении в концентрации 75% в ацетоне вязкость по Брукфильду составила приблизительно 5 Па·с (5000 сантипуаз) при температуре 25°C.
Остальные ПЭГ-эфир-уретаны получили аналогичным образом, их композиции и описания приведены в таблице 1 ниже.
Следуя описанной выше процедуре, аналогичные ПЭГ-эфир-уретаны орто- (ПЭГ2-эфир-Ar-NCO)имета- (ПЭГ3-эфир-Ar-NCO) производные могут быть синтезированы аналогичным образом.
Полученные ПЭГ4-Ar-эфир-NCO и их уретановые производные могут быть стерилизованы облучением кобальта-60 при дозах до 40 кГр. Облучение не приводит к каким-либо заметным изменениям в спектре протонного ЯМР.
Проверили кратковременные ex vivo характеристики указанных NCO-уретанов при разведении в концентрации 75% в ацетоне, полученные данные представлены в таблице 2. Соответствующие долговременные ex vivo характеристики приведены в таблице 3. Представленные данные по ex vivo характеристикам показывают, что прочность описываемых макромеров при полимеризации на биологических тканях является более чем достаточной для их использования при локализации таких утечек, как утечки спинномозговой жидкости, крови, содержимого кишечника и воздуха.
Реферат
Настоящее изобретение относится к биосовместимому полиизоцианатному макромеру или смеси макромеров для использования в качестве клея или уплотнителя для внутреннего применения, представленных формулой:где f равно двум или более; а находится в диапазоне от 1 до 5 и Rпредставляет собойгде d находится в диапазоне от 0 до 5 и с может находиться в диапазоне от 1 до 100; Rпредставляет собойгде Rпредставляет собой линейный или разветвленный остаток водорастворимого полимера, который образует сложноэфирные связи с Rи уретановые связи с R, когда а равно единице или более; и Rпредставляет собой линейный или разветвленный органический остаток, содержащий две или более карбоксилатные концевые группы, и х указывает количество повторяющихся Rи находится в диапазоне 2≤х≤6. Также описаны биосовместимый эластичный гель, полученный полимеризацией указанного выше макромера, приемлемая для медицины композиция и способ закрытия внутренней раны. Технический результат - создание клея или уплотнителя для внутреннего применения, сохраняющего способность к манипуляциям и выравниванию, который заполняет внутренние пазухи и пустоты, проникает и плотно прилегает к полостям и порам ткани перед затвердеванием или схватыванием, а также является биологически распадающимся. 4 н. и 5 з.п. ф-лы, 3 табл., 3 пр.
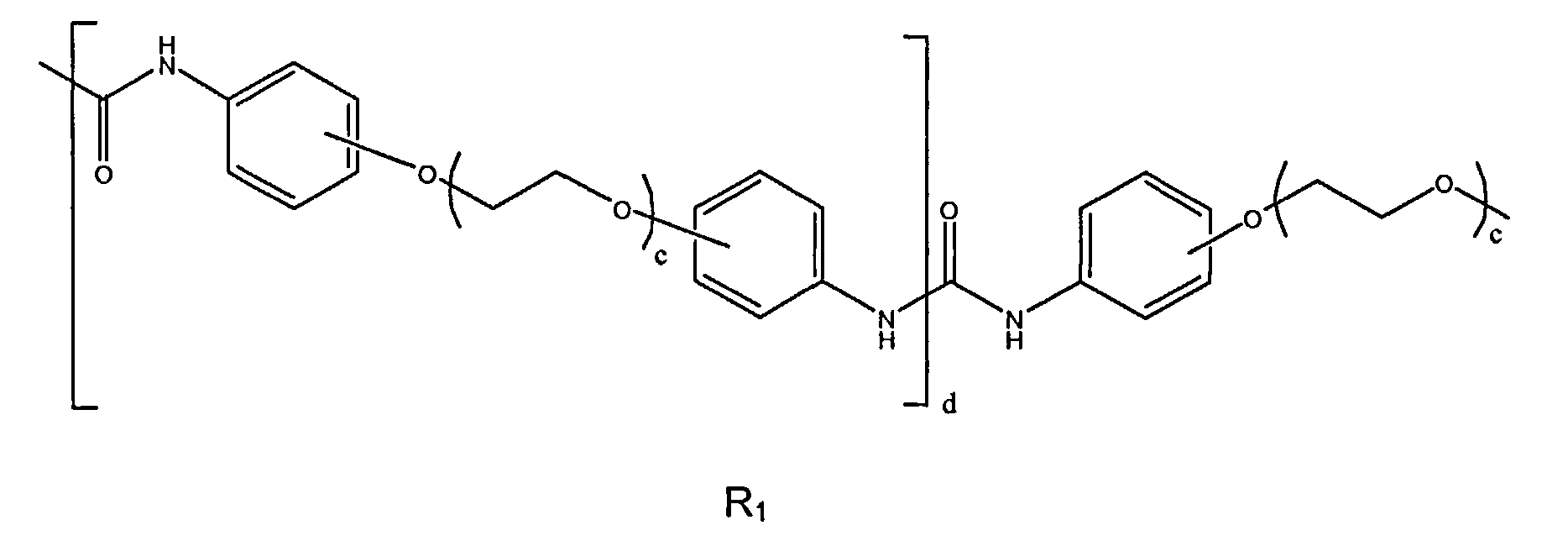
Формула

где f равно двум или более; а находится в диапазоне от 1 до 5, и R1 представляет собой
где d находится в диапазоне от 0 до 5, и с может находиться в диапазоне от 1 до 100;
R2 представляет собой
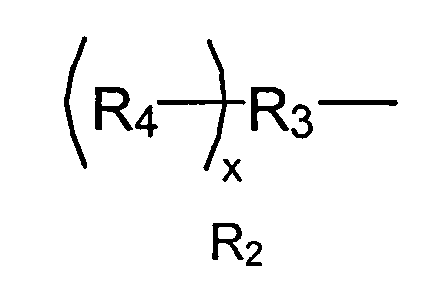
где R3 представляет собой линейный или разветвленный остаток водорастворимого полимера, который образует сложноэфирные связи с R4 и уретановые связи с R1, когда а равно единице или более; и
R4 представляет собой линейный или разветвленный органический остаток, содержащий две или более карбоксилатные концевые группы, и х указывает количество повторяющихся R4 и находится в диапазоне 2≤х≤6.
где R1' представлен следующей формулой:
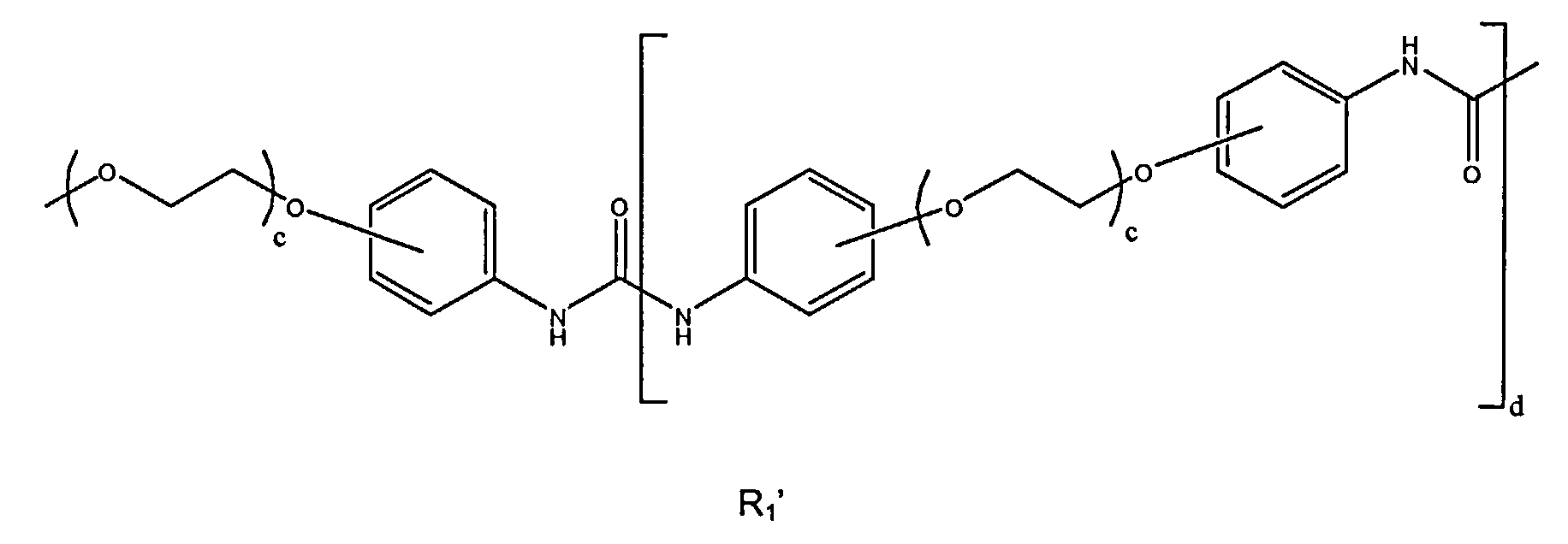
где d находится в диапазоне от 0 до 5, и с может находиться в диапазоне от 1 до 100,
R1, R2 и а имеют значения, как определено в п.1.
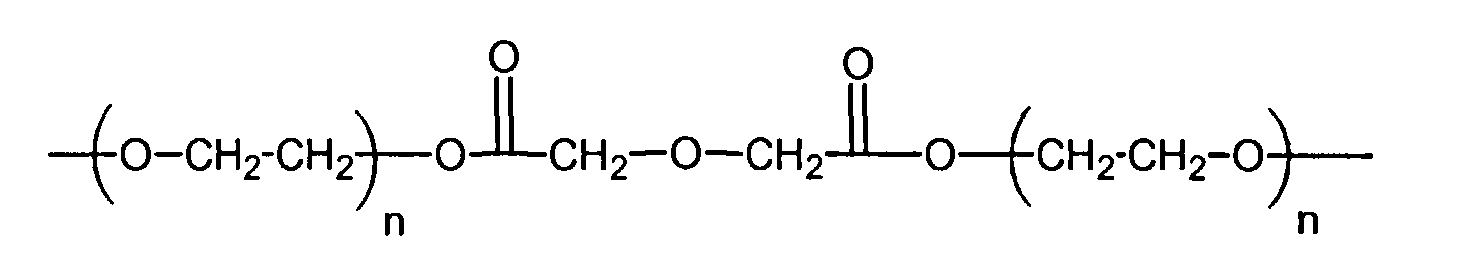
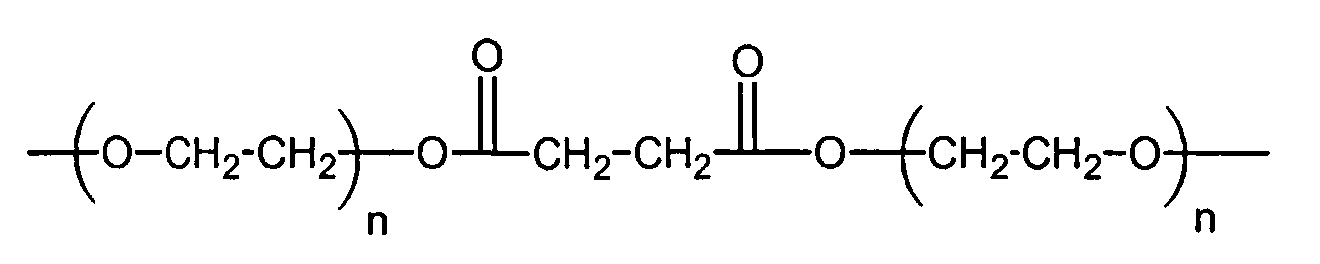
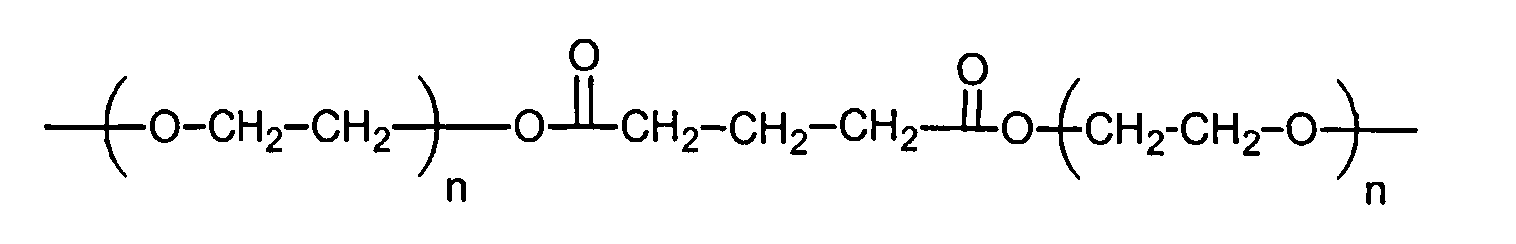

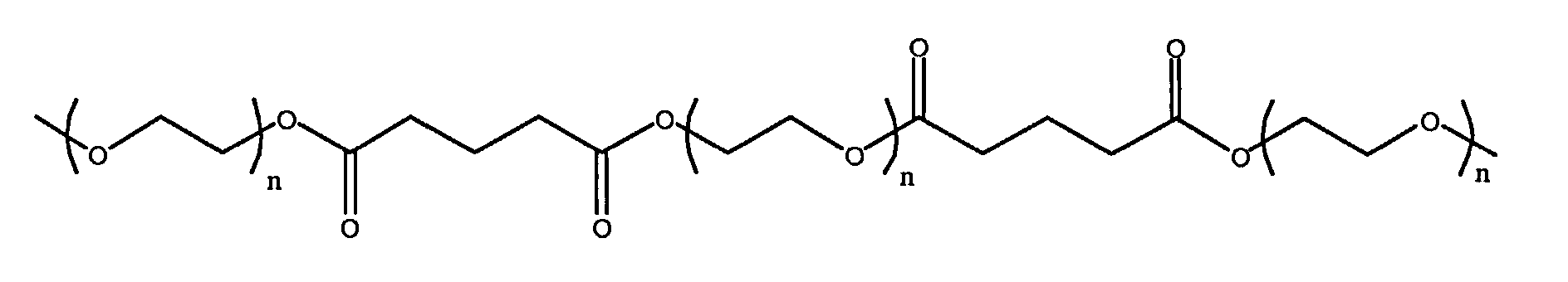


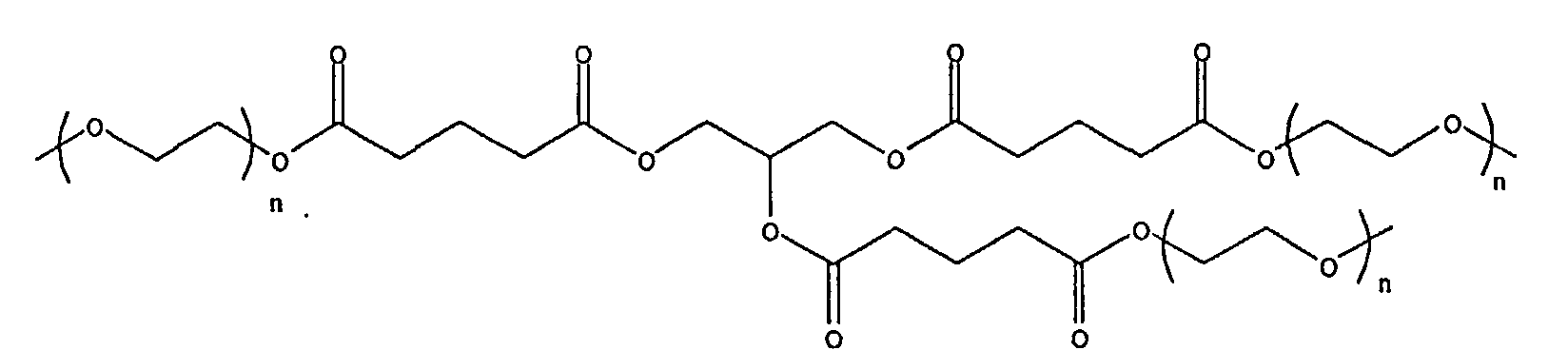




и

где n находится в диапазоне от 2 до 250, и m находится в диапазоне от 1 до 10.
R3 представляет собой линейный или разветвленный остаток водорастворимого полимера, который образует сложноэфирные связи с R4 и уретановые связи с R1 и R1',
R4 представляет собой линейный или разветвленный органический остаток,
и R1 и R1' представляют собой органические остатки, содержащие эфирные связи, уретановые связи и мочевинные связи; и
z представляет собой целое число в диапазоне от 10 до 100000.
Документы, цитированные в отчёте о поиске
Линейный блок-полимер, содержащий группу мочевины и уретановую группу, способ получения линейных блок-полимеров и использование блок-полимеров в качестве имплантатов

Комментарии