Медицинский клей и способ склеивания тканей - RU2346704C2
Код документа: RU2346704C2
Чертежи


Описание
ОБЛАСТЬ ТЕХНИКИ
Настоящее изобретение относится к медицинским связующим веществам, способам соединения тканей и, в частности, к медицинским клеям (связующим вещества) и способам склеивания тканей, при которых на ткань наносят смесь молекул с функциональными изоцианатными группами или форполимеров.
ПРЕДШЕСТВУЮЩИЙ УРОВЕНЬ ТЕХНИКИ
Ежегодно в США для лечения к врачам первой помощи поступает приблизительно одиннадцать миллионов пациентов с травматическими ранами. Травматические раны соперничают с респираторными инфекциями за первое место по числу людей, обращающихся за медицинской помощью. Обычные методы соединения тканей (например, кетгут и скрепки) имеют ряд существенных ограничений, включая невозможность обеспечить герметичное закрытие раны, непригодность для микрохирургических применений, необходимость для второй операции по удалению, увеличенная вероятность воспаления и инфекции, значительное образование рубцов и повреждение тканей во время установки. В ряде случаев используются медицинские пленки, но применение медицинских пленок ограничено слабой прочностью и проблемами, возникающими в связи с приклеиванием к тканям. Обработка рваных ран с помощью кетгута (нить для зашивания раны) часто требует введения местной анестезии и использования игл, которые могут негативно повлиять на психику и без того испуганного пациента. См., например, McCaig LF, "National Hospital Ambulatory Medical Care Survey: 1992 Emergency Department Summary, Vital Health Stat. 1994, 245, 1-12; Eland JM, Anderson JE, "The Experience of Pain in Children," In: Jacox AK, ed. Pain. Boston, Mass: Little Brown & Co., 1997 453-473. Обработка ран с помощью кетгута является болезненной и требует длительного времени. В течение длительного времени врачи изыскивали методы заживления ран, которые требуют небольшого времени, не требуют дополнительного хирургического вмешательства, минимизируют неудобства, создаваемые для пациентов, и обеспечивают хороший результат с косметической точки зрения.
В попытках достичь этих целей были разработаны как биологические, так и синтетические клеи для тканей. Применение клеев для биологических тканей включает склеивание тканей от мягких (соединительная ткань) до твердых (обызвествленных) тканей. Клеи для мягких тканей используют, например, как наружно, так и внутренне для соединения тканей и закрытия ран. Клеи для твердых тканей используют, например, чтобы прикрепить протезирующие материалы к зубам и костям. Четыре основных механизма приклеивания были предложены для таких клеев для тканей, включая механическое взаимное сцепление, адсорбцию, теорию диффузии и электронную теорию. При механическом взаимном сцеплении в качестве средства адгезии используется проникновение связывающего агента в неровности или поры на поверхности субстрата. Адсорбционная теория основывается на факте, что если устанавливается тесный контакт между поверхностями, межатомные и межмолекулярные силы устанавливают сильную связь. Диффузионная теория гласит, что адгезия полимеров к субстратам и наоборот требует взаимной диффузии молекул полимера или субстрата через границу между ними. Наконец, электронная теория полагает, что перенос электронов между связующим веществом и связуемым может привести к возникновению электростатических сил, которые приводят к высокой внутренней адгезии.
К несчастью, доступные в настоящий момент клеи для тканей имеют существенные ограничения. Например, биологические клеи для тканей, такие как фибриновые клеи эффективны в некоторых областях, но исключительно дороги, поскольку являются производными аутологичной ткани. Недостатком фибринового клея также является относительно слабая прочность на разрыв и трудоемкий способ его изготовления. Более того, фибриноген и тромбин получают из человеческой крови, что создает риск вирусных инфекций, например СПИД и/или гепатита. См. например, Spotniz WD, "History of Tissue Adhesives," в Sierra D, Sails R, editors, Surgical Adhesives and Sealants. Current Technology and Applications. USA: Technomic, 1996; и Borst АН, et al., "Fibrin Adhesive: An Important Hemostatic Adjunct in Cardiovascular Operations," J. Thorac. Cardiovasc. Surg. 1982, 84, 548-553.
Также были предложены синтетические и полусинтетические хирургические клеи, такие как цианоакрилат, уретановые форполимеры, и желатин-резорцинол-формальдегид. См., например, Tseng Y-C, et al., "In Vivo Evaluation of 2-cyanoacrylates as Surgical Adhesives," J. Appl. Biomater. 1990, 1, 11-22; Kobayashi H., et al., "Water-curable and Biodegradable Prepolymer, J. Biomed. Mater. Res. 1991, 25, 1481-1494; Matsuda Т, et al., "A Novel Elastic Surgical Adhesive, Design Properties and hi Vivo Performance," Trans. Am. Soc. Artif. Intern. Organ. 1986, 32, 151-156; и Matsuda Т, et al., Department of a Compliant Surgical Adhesive Derived from Novel Flurinated Hexamethyiene Diisocyanate," Trans. Am. Soc. Artif. Intern. Organ,. 1989, 35, 381-383. Однако эти синтетические клеи обладают рядом существенных недостатков, включая цитотоксичность, низкую скорость распада и хроническое воспаление, вызываемое длительным выделением продуктов их распада (таких как формальдегид из цианоакрилатных полимеров и желатин-резорцинол-формальдегида, а также ароматические диамины). См., например, Braumwald NS, et al., "Evaluation of Crosslinked Gelatin as a Tissue Adhesive and Hemostatic Agent: An Experimental Study," Surgery. 1966, 59, 1024-1030; and Toriumi D, "Surgical Tissue Adhesive: Host Tissue Response, Adhesive Strength and Clinical Performance," в Sierra D and Sails, R, ed. Surgical Adhesives and Sealants Current Technology and Applications. USA: Technomic, 1996: 61-69. В типичном случае, синтетические клеи не пригодны для внутреннего использования.
Цианоакрилатные макромономеры полимеризуются при контакте с водой путем химического механизма, подобного тому, который используется в хорошо известных "суперклеях". В добавок к трудностям, возникающим из-за вышеописанного, использование цианоакрилатных групп в цианоакрилатных полимерах ограничивает разнообразие составов, и другие функциональные группы в материале должны быть совместимы со сверхчувствительным цианоакрилатом. Использование полиэтиленгликолей с акрилатными функциональными группами обеспечивает склеивание и разложение (после включения повторяющихся единиц молочной кислоты или гликолевой кислоты в полиэтиленгликолевый предшественник). Однако для отверждения клея требуется применение ультрафиолетового или другого излучения. Имеющиеся ограничения на проникновение света в глубину, отверждение с помощью излучения ограничивает применение этой технологии тонкими пленками, которые легко доступны для источника света. Отсюда следует, что желательно разработать улучшенные клеи для тканей и способы склеивания тканей для использования с живыми тканями.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Одним из предметов настоящего изобретения является предложенный способ нанесения клея на органическую ткань. Способ включает нанесение смеси молекул на органическую ткань. Смесь молекул включает молекулы, имеющие концевые изоцианатные функциональные группы. Смесь молекул имеет среднее количество изоцианатных групп по меньшей мере 2,1, чтобы обеспечить сшивание (или отверждение). Более предпочтительно, когда среднее количество изоцианатных групп в смеси составляет не менее 2,5. Смесь молекул предпочтительно имеет вязкость от приблизительно 1 до приблизительно 100 сантипуаз, например, для того чтобы обеспечить возможность нанесения на ткань при температуре использования (обычно от приблизительно 0°С до приблизительно 40°С). Более предпочтительно вязкость составляет от приблизительно 1 до приблизительно 50 сантипуаз в диапазоне температур использования. В общем, смесь молекул должна быть такой, чтобы ее можно было нанести или распределить при температуре использования.
Смесь молекул образует сеть полимеров со сшивками или отверждается при контакте с органическими тканями в присутствии воды. Достаточное количество воды обычно присутствует на тканях или внутри тканей организма и добавления воды, как правило, не требуется. Сеть полимеров со сшивками является биологически совместимой и биологически разлагаемой. Сеть полимеров со сшивками биологически разлагается на молекулы, которые являются биологически совместимыми.
Не все молекулы смеси необходимо хранить в смешанном виде. Например, смешивание молекул можно осуществлять непосредственно перед нанесением или во время нанесения.
В одном из вариантов осуществления изобретения смесь молекул включает лизинтриизоцианат или производное лизинтриизоцианата (например, лизинтриизоцианатный этиловый эфир).
Предпочтительно смесь молекул включает молекулы, кэпированные изоцианатом (т.е. содержащие концевые изоцианатные группы), образованные посредством реакции молекул, содержащих множество изоцианатных групп, с многофункциональными молекулами-предшественниками, включающими концевые функциональные группы, выбранные из группы, состоящей из гидроксильной группы, первичной аминогруппы и вторичной аминогруппы. В данном описании термин «многофункциональный» или «содержащий множество функциональных групп» относится к соединению, которое имеет две (бифункциональный) или более функциональных групп. Таким образом, могут образовываться форполимеры полиуретана. Многофункциональные соединения-предшественники являются биологически совместимыми. Более того, предшественники, содержащие множество аминогрупп, молекул, содержащих множество изоцианатных групп, также являются биологически совместимыми. Предшественники с множеством аминогрупп молекул с изоцианатными функциональными группами могут, например, быть биологически совместимыми аминокислотами или биологически совместимыми производными аминокислот. Многофункциональные молекулы-предшественники могут, например, включать по меньшей мере один полиэтиленгликоль, полиаминокислоту (в типичном случае, более чем 50 связанных аминокислот, включая, например, белки и/или полипептиды), сложные алифатические полиэфиры (включая, например, полимолочную кислоту, полигликолевую кислоту и/или поликапролактон), сахарид (включая, например, сахар), полисахарид (например, крахмал), алифатический поликарбонат, полиангидрид, стероид (например, гидрокортизон), глицерин, аскорбиновую кислоту, аминокислоту (например, лизин, тирозин, серин, и/или триптофан), или пептид (в типичном случае, от 2 до 50 связанных аминокислот).
В одном из вариантов осуществления изобретения многофункциональные молекулы-предшественники включают полиэтиленгликоль, а молекулы со многими изоцианатными функциональными группами включают по меньшей мере либо этиловый эфир лизиндиизоцианата, либо этиловый эфир лизинтриизоцианата, либо оба эти соединения. Многофункциональные молекулы-предшественники могут включать также сахар, такой как глюкоза.
В случае если многофункциональная молекула-предшественник включает полиэтиленгликоль, полиэтиленгликоль предпочтительно имеет среднечисленную молекулярную массу менее чем 10000. Более предпочтительно полиэтиленгликоль имеет среднечисленную молекулярную массу менее чем 2000. Наиболее предпочтительно полиэтиленгликоль имеет среднечисленную молекулярную массу менее чем 1000. В некоторых вариантах осуществления настоящего изобретения полиэтиленгликоль имеет среднечисленную молекулярную массу от приблизительно 50 до приблизительно 1000.
Предпочтительно смесь молекул согласно настоящему изобретению образует сеть полимеров со сшивками менее чем за две минуты. Более предпочтительно смесь молекул образует сеть полимеров со сшивками менее чем за одну минуту. Сеть полимеров со сшивками, образующаяся в результате отверждения смеси молекул согласно настоящему изобретению при контакте с тканями организма, предпочтительно биологически распадается в течение периода времени, за который происходит излечение. Например, способность сети полимеров со сшивками связывать ткани рваной раны или пореза предпочтительно остается неизменной до тех пор, пока лечение не приведет к тому, что рана будет оставаться закрытой. В одном варианте осуществления изобретения, например, сеть полимеров со сшивками биологически распадается до потери по меньшей мере 2/3 ее вещества в течение от приблизительно 7 до приблизительно 30 дней и более предпочтительно в течение от приблизительно 7 до приблизительно 14 дней.
Другим предметом настоящего изобретения является клей, включающий смесь кэпированных изоцианатом молекул, образованных посредством реакции молекул, содержащих множество изоцианатных групп, с многофункциональными молекулами-предшественниками, включающими концевые функциональные группы, выбранные из группы, состоящей из гидроксильной группы, первичной аминогруппы и вторичной аминогруппы. Предпочтительно функциональные группы являются гидроксильными группами. Многофункциональные соединения-предшественники являются биологически совместимыми. Предшественники с множеством аминогрупп молекул с множеством изоцианатных функциональных групп также являются биологически совместимыми. Как обсуждалось выше, смесь молекул предпочтительно имеет среднее число изоцианатных групп по меньшей мере 2,1 и более предпочтительно по меньшей мере 2,5. Как также было описано выше, смесь молекул предпочтительно имеет вязкость от приблизительно 1 до приблизительно 100 сантипуаз. Смесь молекул образует сеть полимеров со сшивками при контакте с тканями организма в присутствии воды. Сеть полимеров со сшивками является биологически совместимой и биологически разлагаемой. Сеть полимеров со сшивками разлагается на продукты, включая молекулы предшественники и предшественники со многими аминогруппами.
Еще одним предметом настоящего изобретения является клей, включающий форполимеры, кэпированные изотиоцианатом, образованные посредством реакции молекул, содержащих множество изоцианатных групп, с многофункциональными молекулами-предшественниками, включающими концевые функциональные группы, выбранные из группы, состоящей из гидроксильной группы, первичной аминогруппы и вторичной аминогруппы. Эти многофункциональные соединения-предшественники являются биологически совместимыми. Также предшественники с множеством функциональных аминогрупп молекул с множеством функциональных изоцианатных групп являются биологически совместимыми. По меньшей мере один из многофункциональных предшественников является гибким биологически совместимым полимером, имеющим среднечисленную молекулярную массу по меньшей мере 50, Как описано выше, смесь форполимеров имеет среднее количество изоцианатных групп по меньшей мере 2,1. Предпочтительно смесь полимеров не является твердой, что позволяет ее легко намазывать при нанесении на ткани при температуре использования. Смесь форполимеров образует сеть полимеров со сшивками при контакте с тканями организма в присутствии воды. Сеть полимеров со сшивками является биологически совместимой и биологически разлагаемой. Сеть полимеров со сшивками разлагается на продукты разложения, включая молекулы предшественники и предшественники со многими аминогруппами.
В дополнение к другим механизмам связывания с тканями, которые были описаны выше, клеи согласно настоящему изобретению способны химически (ковалентно) присоединяться к тканям. Например, активные изоцианатные группы клея могут реагировать с активными группами, такими как гидроксильные группы или свободные аминогруппы, в ткани с образованием ковалентной связи (которая является, уретановой связью или мочевинной связью). Изоцианатные группы также образуют сеть полимеров со сшивками в присутствии влаги, так или иначе присутствующей на тканях и внутри тканей.
Как было обсуждено выше, клеи согласно настоящему изобретению, биологически разлагаемая сеть полимеров со сшивками, образующаяся из них, и продукты биологического разложения этой сети полимеров предпочтительно являются биологически совместимыми. Термин «биологически разлагаемый» по существу относится здесь к способности связующих соединений распадаться (особенно на безвредные продукты распада) с течением времени при условиях и в среде применения. Термин «биологически совместимый» относится в общем смысле к совместимости с живой тканью или живой системой, в этом смысле клеи, сеть полимеров и продукты распада согласно настоящему изобретению предпочтительно по существу нетоксичны и/или по существу не повреждают живые ткани или живые системы в количествах, требуемых в течение периода контакта или воздействия. Более того, такие материалы предпочтительно не вызывают существенных иммунологических реакций или отторжений в количествах, требуемых в течение периода контакта или воздействия.
В отличие от многих имеющихся в настоящее время клеев, используемых в медицине и лечебном деле для соединения тканей и других целей, клеи в соответствии с настоящим изобретением имеют относительно высокую прочность на разрыв и образуют относительно сильную связь с тканью, при этом, сводя минимуму или устраняя такие трудности, как цитотоксичское действие, низкая скорость распада и воспаление, связанное со многими имеющимися в настоящее время клеями. Клеи и способы в соответствии с настоящим изобретением обеспечивают, например, соединение тканей с минимальной инвазией в ткани, в общем случае без механического повреждения тканей и сниженной вероятностью инфекции. Клеи в соответствии с настоящим изобретением относительно легко синтезировать и они не требуют использования потенциально вредных растворителей.
В одном из вариантов осуществления настоящего изобретения предложены биологически совместимые и биологически разлагаемые уретановые полимеры/форполимеры на основе лизин-диизоцианата (ЛДИ) или лизин-триизоцианата (ЛТИ), пригодные для использования в качестве клеев для тканей. ЛДИ-полиуретановые клеи легко синтезировать, например, из ЛДИ, полиэтиленгликоля (иногда называемого ПЭГ) и глюкозы без растворителя. Продуктами распада являются лизин, ПЭГ, глюкоза и этанол. ЛДИ-полиуретановые клеи для тканей и другие клеи в соответствии настоящим изобретением уменьшают время, необходимое для заживления ран, обеспечивают гибкое водоустойчивое защитное покрытие и устраняют необходимость удаления кетгута. ЛДИ-полиуретановые клеи для тканей и другие клеи для тканей в соответствии с настоящим изобретением относительно легко использовать в соответствии с удобной и общепринятой процедурой обработки ран в сравнении с имеющимися в настоящее время клеями для кожи. Клеи в соответствии с настоящим изобретением более удобны в использовании, нежели обычные способы заживления, такие как кетгут, потому, например, что пациенты, и особенно дети, с большей охотой воспринимают мысль о том, чтобы быть «склеенными», чем обычные или традиционные способы заживления.
Кроме того, модуль или коэффициент упругости полиуретановых клеев для тканей на основе ЛДИ и других клеев для тканей в соответствии с настоящим изобретением можно легко регулировать для использования как в качестве клеев для мягких соединительных тканей (например, в качестве клеев для кожи для замены кетгута и скрепок для обработки некоторых рваных ран и/или порезов), так и в качестве клея для твердых (обызвествленных) тканей (например, в качестве клея для костей или зубов) как для человека, так и для животных.
КРАТКОЕ ОПИСАНИЕ ГРАФИЧЕСКИХ МАТЕРИАЛОВ
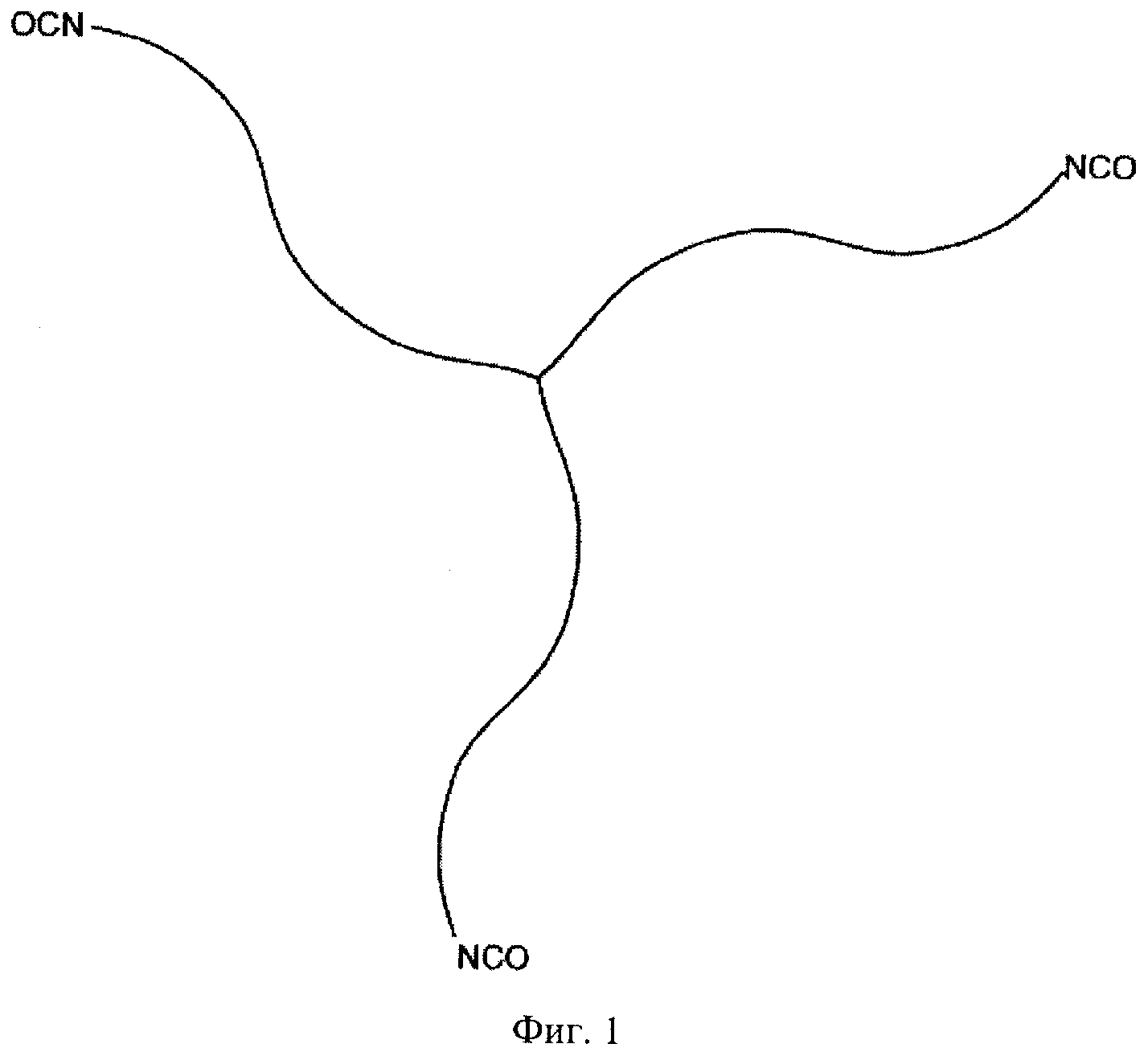
Фигура 1 иллюстрирует общую структуру форполимера, кэпированного изоцианатом, в соответствии с настоящим изобретением.
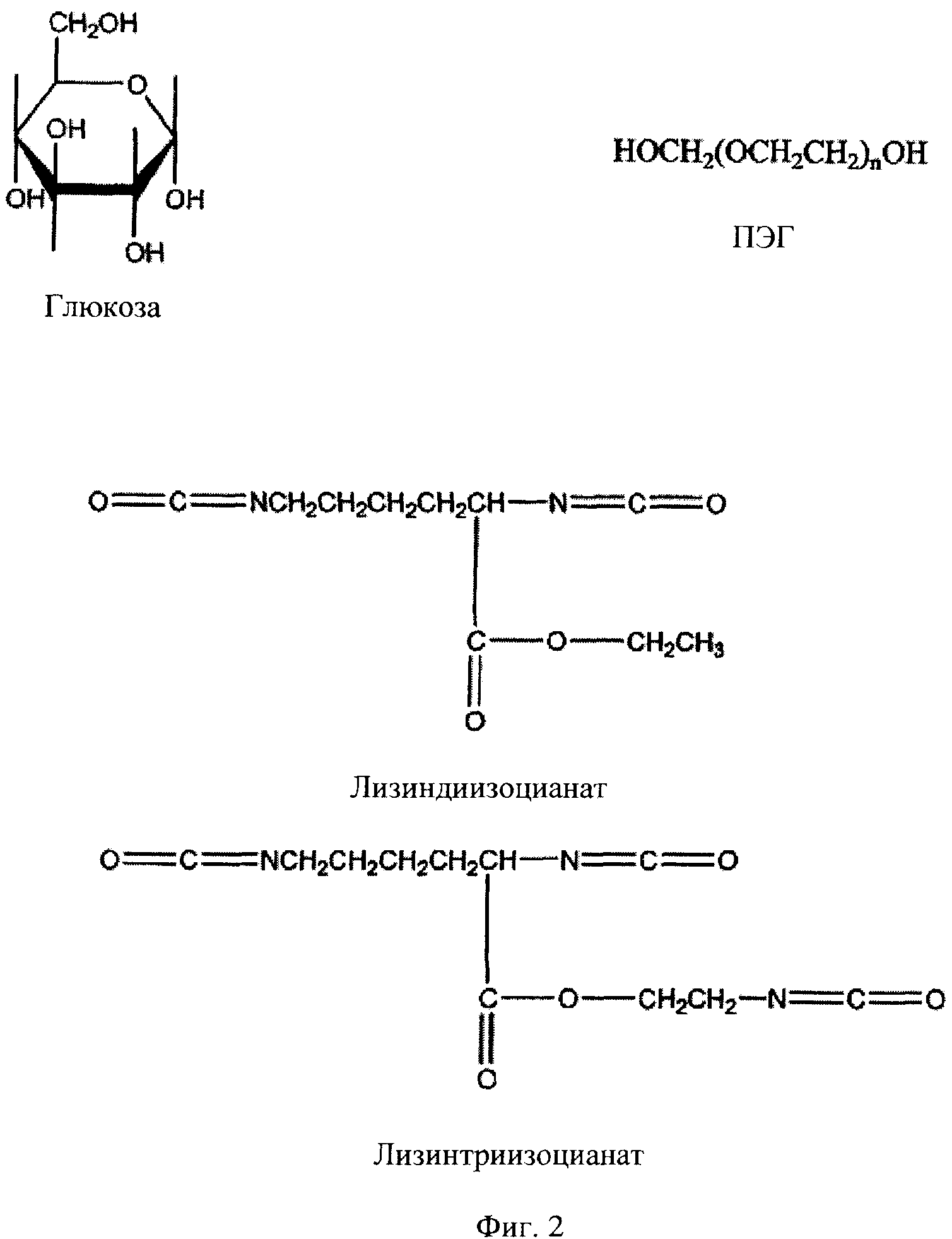
Фигура 2 иллюстрирует химические структуры лизиндиизоцианата (ЛДИ), лизинтриизоцианта (ЛТИ), полиэтиленгликоля (ПЭГ) и глюкозы.
Фигура 3 иллюстрирует примеры химической структуры глюкозы, кэпированной ЛДИ; полиэтиленгликоля, кэпированного ЛДИ, и форполимера ЛДИ-ПЭГ-глюкоза, кэпированного ЛДИ.
Фигура 4А иллюстрирует контейнер, заключающий в себе клей в соответствии с настоящим изобретением, в котором по существу все или все функциональные группы молекул клея кэпированы изоцианатными функциональными группами.
Фигура 4В иллюстрирует контейнер с двумя отделениями, в котором одно отделение содержит смесь молекул/форполимеров, имеющих избыток гидроксильных (и/или аминовых) функциональных групп, а другое отделение содержит смесь молекул/форполимеров, имеющих избыток изоцианатных (-NCO) функциональных групп.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Клей для ткани предпочтительно является жидкостью или другой формой, которую можно равномерно распределять (например, гель, подобный жидкости) при нанесении на ткань. Клей также предпочтительно затвердевает относительно быстро, когда его наносят, и связывается с живыми тканями в присутствии влаги. Клей для тканей также предпочтительно не должен оказывать местного раздражающего воздействия и не должен быть токсичным для всего организма в количествах, необходимых для получения эффективного соединения тканей. Кроме того, соответствующая гибкость и способность к распаду необходимы для отвержденного клея для того, например, чтобы закрытие раны не препятствовало заживлению. Клеи в соответствии с настоящим изобретением удовлетворяют этим критериям.
В общем, клеи в соответствии с настоящим изобретением включают смесь молекул, имеющих концевые изоцианатные функциональные группы. Смесь молекул имеет среднее количество изоцианатных групп более 2 (на молекулу или цепь), предпочтительно более 2,1, для того чтобы обеспечить образование сшивок (или отверждение). Более предпочтительно среднее количество функциональных групп в смеси составляет по меньшей мере 2,5. Также можно использовать молекулы с относительно низкой молекулярной массой, такие как лизинтриизоцианат или комбинация лизиндиизоцианата и триизоцианата, в качестве клеев в соответствии с настоящим изобретением, клеи в соответствии настоящим изобретением предпочтительно наносят как смесь полимеров/форполимеров, кэпированных изоцианатом. Общее описание примера такой молекулы проиллюстрировано на Фигуре 1. Такие форполимеры могут, например, образовываться реакцией молекул со многими изоцианатными группами с многофункциональными молекулами-предшественниками, включающими концевые функциональные группы, выбранные из группы, состоящей из гидроксильной группы, первичной аминогруппы и вторичной аминогруппы. Предпочтительно функциональные группы являются гидроксильными группами.
Как обсуждалось выше, изоцианатные кэпы молекул, как представлено на Фигуре 1, делают возможным образование сшивок и могут усилить склеивание тканей путем образования ковалентных связей с гидроксильными и аминогруппами в ткани. Соединения-предшественники, которые реагируют с молекулами со многими функциональными изоцианатными группами с образованием «средней» или внутренней цепи (цепей) таких молекул, предпочтительно выбирают таким образом, чтобы обеспечить контроль физических свойств, таких как вязкость клея и эластичность отвержденной сети полимеров.
Например, физические свойства отвержденной сети полимеров можно контролировать общим или средним количеством функциональных групп в связующем веществе (среднее число изоцианатных концевых групп на цепь), молекулярной массой между сшивками (то есть молекулярная масса между изоцианатными группами в форполимере), содержанием ароматических групп в форполимере для некоторых форполимеров, включающих ароматические группы (включенные, например, путем присоединения биологически совместимой аминокислоты тирозина), и числом групп, образующих водородные связи (например, мочевинных групп и уретановых групп) в форполимере. Например, увеличение числа функциональных групп (путем, например, использования больших количеств сахара, кэпированного изоцианатом, в предшественнике) приводит к образованию сети полимеров со сшивками с относительно высоким модулем упругости. Увеличение молекулярной массы между точками сшивки (путем, например, включения полиэтиленгликолевого «спейсера» более высокой молекулярной массы), уменьшение числа групп, образующих водородные связи, или уменьшение содержания ароматических групп снижает модуль упругости сетей полимеров со сшивками, образованных клеями в соответствии с настоящим изобретением. Таким образом, можно регулировать свойства связи в широких пределах путем известных модификаций первоначального состава.
Биологически совместимые соединения или молекулы, выбранные для средней или внутренней цепи, также можно выбирать для придания желательных изменений в свойствах связующих соединений. Например, активный фермент (белок) можно включить, например, для ингибирования роста какой-либо бактерии или усиления какой-либо биологической функции. Предварительно было показано, что добавление водного раствора белка к уретановому форполимеру вызывает включение белка (ковалентное) в полиуретановую сеть (путем реакции свободных аминов с белками по концевым изоцинатным группам). Такое включение сохраняет активность белка при увеличении его стабильности на несколько порядков. Сходным образом стероид, такой как гидрокортизон (который был включен в клей в соответствии с настоящим изобретением), может быть включен так, чтобы действовать в качестве, например, противовоспалительного средства.
Для иллюстрации настоящего изобретения были проведены исследования представителей клеев, включающих форполимер с изоцианатными группами, образованных из следующих молекул и блоков: этиловый эфир лизиндиизоцианата или ЛДИ (синтезированный фосгенированием этилового эфира лизина) или лизинтриизоцианата (ЛТИ); глюкоза (включающая пять гидроксильных групп) и полиэтиленгликоль или ПЭГ (включающий две гидроксильные группы). Изоцианатные группы ЛДИ или ЛТИ образуют форполимерную цепь путем реакции с гидроксильными группами глюкозы и ПЭГ. Использование избытка ЛДИ или ЛТИ способствует тому, что по существу все или все гидроксильные группы прореагируют с изоцианатом с образованием форполимера, кэпированного изоцианатом. Химическая структура молекулярных блоков, использованных в исследованиях в соответствии с настоящим изобретением, представлена на Фигуре 2. Фигура 3 иллюстрирует репрезентативные примеры глюкозы, кэпированной изоцианатом (ЛДИ), кэпированного изоцианатом (ЛДИ) ПЭГ и кэпированной изоцианатом (ЛДИ) ПЭГ-глюкоза-ЛДИ форполимерной молекулы. Лизиндиизоцианат, который является летучим соединением, становится нелетучим путем включения в полимерные предшественники в соответствии с настоящим изобретением (таким образом, ЛДИ не присутствует, но скорее связан в макромономер).
Клей, таким образом, просто является полиуретановым форполимером, то есть полиуретановым предшественником, в котором все активные концевые группы (амино- и гидроксильные) кэпированы, например, лизиндиизоцианатом, оставляя многочисленные концевые изоцианатные группы и предпочтительно мало или вовсе не оставляя свободных гидроксильных или аминогрупп (для предотвращения дальнейшей реакции) в форполимере. Нанесение такого форполимера на ткань может привести к ковалентному связыванию полимера с тканью путем реакции свободных аминогрупп или гидроксильных групп с изоцианатными группами в форполимере. Более того, вода также будет реагировать с изоцианатными группами, выделяя СО2 и образуя дополнительные свободные аминогруппы, которые тоже реагируют с изоцианатами, образуя точки сшивки.
В общем, число точек сшивки контролировали прежде всего через концентрацию глюкозы, которая включает пять гидроксильных групп. Используя относительно высокие концентрации глюкозы, увеличивают число точек сшивки и увеличивают модуль упругости сети полимеров со сшивками. Биологически совместимый, обычно гибкий полимер, такой как ПЭГ, действует, частично, как спейсер. Увеличение молекулярной массы ПЭГ, использованного в клеях согласно настоящему изобретению, увеличивает расстояние между точками сшивки и уменьшает модуль упругости полимерной сети со сшивками.
В отличие от клеев согласно настоящему изобретению имеющиеся в продаже полиуретаны (включая клеи) получают из ароматических изоцианатов. Их скорость разложения недостаточна для использования in vivo (в качестве биологически разлагаемых клеев), а побочные продукты разложения коммерчески доступных полиуретановых связующих соединений включают токсичные ароматические диамины.
Лизиндиизоцианат был получен фосгенированием этилового эфира лизина в присутствии пиридина. В отличие от лизина или его этилового эфира ЛДИ летуч и, как следствие, его легко очистить перегонкой при пониженном давлении.
Ряд исследований указывают на биологическую совместимость и биологическую разлагаемость полимеров на основе ЛДИ. Например, полимерные смолы были созданы добавлением воды к глицерин/ЛДИ форполимеру. Форполимер был получен путем кэпирования каждой из трех гидроксильных групп глицерина с помощью ЛДИ. Разложение пены произошло за период времени несколько недель с потерей 2/3 материала через 60 дней. Было определено, что продуктами распада были первичный лизин и глицерин. Эти вещества, таким образом, распадаются значительно быстрее, чем обычные полиуретаны. Возможно, сложноэфирная группа (из лизина) способствует гидролизу уретановой связи. Также сложноэфирная группа, будучи гидролизованной, действует in situ как кислый катализатор для ускорения гидролиза уретановых связей. Стромальные клетки костного мозга (СККМ) от новозеландских белых кроликов посеяли на пену глицерин/ЛДИ и произвели наблюдение за их адгезией и распределением. Коллаген, произведенный СККМ (как было показано измерением гидроксипролина) находится на уровне, сопоставимом с контрольными клетками.
Дополнительные исследования были проведены с использованием пены глюкоза/ЛДИ. В таких исследованиях ЛДИ был добавлен к глюкозе в соотношении 5:2. Добавление воды привело к появлению твердого (с высоким модулем упругости) вспененного материала. Отбором проб форполимера до завершения реакции между ЛДИ и глюкозой можно получить мягкую и упругую пену. Так же, как и в предыдущих исследованиях, СККМ были высеяны на эту пену. СККМ связались с пеной и распределились по ней. Пена глюкоза-ЛДИ разложилась на сахар и лизин за период от 2 до 3 месяцев, в зависимости от плотности сшивок в материале (т.е. мягкие пены разлагаются быстрее, чем более твердые пены). Более того, небольшие пробы пены глюкоза-ЛДИ были имплантированы новозеландским белым кроликам. Пробы материала и окружающей ткани были взяты через два месяца. В этих пробах, например, было обнаружено меньше гигантских клеток, нежели в контрольных пробах с использованием сополимеров полимолочной кислоты и гликолевой кислоты.
Полимерные пленки, описанные выше, были, в общем, материалами с большим количеством сшивок. После того как они образовались, их уже нельзя вернуть в исходное состояние. Также были синтезированы линейные полимеры из ЛДИ и бифункциональных полиэтиленгликолей (молекулярная масса от 200 до 8000). Хотя такие полимеры можно обрабатывать, они растворимы в воде. Дополнение «твердых» сегментов к этим полиуретанам для получения термопластических эластомеров (т.е. обрабатываемых, хотя и нерастворимых в воде полимеров) было произведено путем использования тирозина, лизина или триптофана в качестве удлинителей цепей. В этих исследованиях избыток ЛДИ был добавлен к другой аминокислоте. Полученное соединение ЛДИ-аминокислота-ЛДИ было затем введено в реакцию с полиэтиленгликолем. Использование твердых сегментов, продолженных цепями, позволило создать обрабатываемые полиуретаны из ЛДИ, которые не растворялись в воде.
Материалы со сшивками, описанные выше, в общем, не являются предпочтительными для использования в качестве клеев, хотя они могут применяться так, как это описано в связи с Фигурой 4В ниже. Тем не менее вышеописанные исследования указывают, что (а) изоцианат-концевые форполимеры легко синтезировать, (b) полимерная пена, образованная из ЛДИ и либо глюкозы, либо глицерина, распадается за период 2-3 месяца, образуя первичный лизин и предшественник с гидроксильной функциональной группой, (с) стромальные клетки костного мозга легко прикрепляются и растут на полимерных пенах, полученных из ЛДИ, (d) полимеры ЛДИ-глюкоза вызывают умеренный иммунный ответ in vivo.
Предпочтительные варианты осуществления клеев согласно настоящему изобретению включают смеси форполимеров, кэпированных изоцианатами, в которые введены соответствующие функциональные группы для образования сшивок при нанесении на ткань, как описано выше. Для получения распределяемого клея, который отверждается в водоустойчивую, биологически разлагаемую и биологически совместимую полимерную сеть, в форполимер можно включить молекулу со многими изоцианатными функциональными группами, такими как ЛДИ или ЛТИ, как описано выше, такую молекулу как глицерин или сахар, которая несет относительно большое количество функциональных групп (имеет по меньшей мере три функциональные группы), для получения точек сшивки, и спейсерную молекулу или группу, такую как ПЭГ, который должен иметь по меньшей мере две функциональные группы, для включения во внутреннюю цепь форполимера. Спейсер предпочтительно является полимером со среднечисленной молекулярной массой по меньшей мере 50, что при повышении концентрации относительно других компонентов форполимера снижает вязкость клея и/или уменьшает модуль упругости отвержденной полимерной сети.
Предпочтительно по существу все или все функциональные группы молекул клея кэпированы или снабжены изоцианатными функциональными группами для предотвращения дальнейшей реакции, с этой целью при синтезе используют по меньшей мере стехиометрическое количество изоцианатных функциональных групп и предпочтительно избыток функциональных изоцианатных групп. Как показано на Фигуре 4А, такой клей согласно настоящему изобретению (в котором по существу все или все функциональные группы молекул соединительного вещества кэпированы изоцианатными функциональными группами) может храниться в водонепроницаемом контейнере в отсутствие воды продолжительное время вплоть до применения. Как показано на Фигуре 4В, продолжительное хранение можно осуществлять также с помощью контейнера с двумя отделениями, в котором одно отделение содержат смесь молекул/форполимеров, имеющих избыток гидроксильных (и/или амино-) групп и другого отделения, которое содержат смесь молекул/форполимеров, имеющих избыток изоцианатных (-NCO) групп. Контейнер может включать устройство для смешивания или известный из уровня техники элемент для смешивания содержимого каждого отделения при нанесении на ткань для создания полимерной сети со сшивками.
ОПИСАНИЕ ПРИМЕРОВ ОСУЩЕСТВЛЕНИЯ ИЗОБРЕТЕНИЯ
Пример 1
Представитель полиуретанового клея для живых тканей на основе ЛДИ был синтезирован согласно методике, описанной ниже. Для получения клея 0,5889 г глюкозы (3,27 ммоль, -ОН 16,36 ммоль) добавили к 5 мл ПЭГ 400 (14,09 ммоль, -ОН 28,18 ммоль) в сухой круглодонной колбе, продутой азотом, и нагрели до 50°С для получения прозрачного раствора. ПЭГ является жидкостью при комнатной температуре и растворяет глюкозу, не нуждаясь в дополнительном растворителе. Затем добавили 4,6 мл лизиндиизоцианата (ЛДИ, d=1,157, молекулярная масса 226, 23,55 ммоль, -NCO 47,10 ммоль), закрыли колбу резиновой пробкой и запечатали. Реакционную смесь перемешивали при 50°С в течение 48 часов и получили вязкий раствор. Вязкий раствор хранили при комнатной температуре под азотом до использования. Вязкую жидкость распределили по каждому из двух участков влажной ткани, которые, когда их соединили сжатием, крепко прилипли друг к другу через приблизительно 1-2 минуты.
Пример 2
Другой клей для ткани из полиуретана на основе ЛДИ был синтезирован по следующей методике с использованием ПЭГ 200 вместо ПЭГ 400, он, в конечном счете, образовал соединение, которое было более жестким и прочным, нежели клей по примеру 1. По этой методике 0,6 г глюкозы (3 ммоль, -ОН 15 ммоль) добавили к 5 мл ПЭГ 200 (28,18 ммоль, -ОН 56,35 ммоль) в сухой круглодонной колбе, продутой азотом, и нагрели до 50°С до получения прозрачного раствора. Затем добавили 7 мл ЛДИ (d 1,157, молекулярная масса 226, 35,83 ммоль, -NCO 71,67 ммоль), закрыли колбу резиновой пробкой и запечатали. Реакционную смесь перемешивали при 50°С в течение 48 часов и получили вязкий раствор. Клей хранили при комнатной температуре под азотом до использования. Вязкую жидкость распределили по каждому из двух участков влажной ткани, которые, когда их соединили сжатием, крепко прилипли друг к другу через приблизительно 1-2 минуты.
Пример 3
Пример 3 иллюстрирует, что когда доля глюкозы в реакционной смеси увеличивается, время, необходимое для закрытия раны, короче, прочность связи увеличивается и конечный материал жестче. В этом эксперименте 1,8 г глюкозы (10 ммоль, -ОН 50 ммоль) добавили к 5 мл ПЭГ 200 (28,18 ммоль, -ОН 56,35 ммоль) в сухой круглодонной колбе, продутой азотом, и нагрели до 50°С до получения прозрачного раствора. Затем добавили 10 мл ЛДИ (d 1,157, молекулярная масса 226, 51,19 ммоль, -NCO 102,02 ммоль), закрыли колбу резиновой пробкой и запечатали. Реакционную смесь перемешивали при 50°С в течение 48 часов и получили вязкий раствор. Клей хранили при комнатной температуре под азотом до использования. Вязкую жидкость распределили по каждому из двух участков влажной ткани, которые, когда их соединили сжатием, крепко прилипли друг к другу через приблизительно 1 минуту.
Пример 4
В этом эксперименте в общем и целом следовали методике по примеру 3 за исключением того, что ПЭГ 200 заменили на ПЭГ 400. В этом эксперименте 1,8 г глюкозы (10 ммоль, -ОН 50 ммоль) добавили к 10 мл ПЭГ 400 (28,18 ммоль, -ОН 56,35 ммоль) в сухой круглодонной колбе, продутой азотом, и нагрели до 50°С до получения прозрачного раствора. Затем добавили 10 мл ЛДИ (d 1,157, молекулярная масса 226, 51,19 ммоль, -NCO 102,39 ммоль), закрыли колбу резиновой пробкой и запечатали. Реакционную смесь перемешивали при 50°С в течение 48 часов и получили вязкий раствор. Раствор хранили при комнатной температуре под азотом до использования. Вязкую жидкость намазали на каждый из двух участков влажной ткани, которые, когда их соединили сжатием, крепко прилипли друг к другу в течение приблизительно 1 минуты.
Пример 5
В этом эксперименте лизиндиизоцианат заменили на лизинтриизоцианат. Лизинтриизоцианат можно получить на коммерческой основе или синтезировать путем получения аминоамидного производного лизина через присоединение этилендиамина (с большим избытком) к лизину с использованием какого-либо из карбодиимидов, с последующим фосгенированием. Когда ЛТИ (лизинтриизоцианат) вместо ЛДИ реагирует с глюкозой и ПЭГ, время затвердевания материала значительно короче (только 30 секунд), а сила связывания значительно выше. В эксперименте по этому примеру 0,6 г глюкозы (3,33 ммоль, -ОН 16,67 ммоль) добавили к 5 мл ПЭГ 200 (28,18 ммоль, -ОН 56,35 ммоль) в сухой круглодонной колбе, продутой азотом, и нагрели до 50°С до получения прозрачного раствора. Затем добавили 5 мл ЛТИ (d 1,231, молекулярная масса 267,25, 23,05 ммоль, -NCO 69,15 ммоль), закрыли колбу резиновой пробкой и запечатали. Реакционную смесь перемешивали при 50°С в течение 48 часов и получили вязкий раствор. Раствор хранили при комнатной температуре под азотом до использования. Вязкую жидкость распределили по каждому из двух участков влажной ткани, которые, когда их соединили сжатием, крепко прилипли друг к другу через 30 секунд.
Пример 6
В этом примере в общем и целом следовали методике по примеру 5 за исключением того, что в реакцию с ЛТИ вводили ПЭГ 400 (вместо ПЭГ 200). В этом эксперименте время затвердевания материала было таким же, как в реакции ЛТИ-глюкоза-ПЭГ 200. Здесь 0,229 г глюкозы (1,27 ммоль, -ОН 6,36 ммоль) добавили к 5 мл ПЭГ 400 (14,1 ммоль, -ОН 28,2 ммоль) в сухой круглодонной колбе, продутой азотом, и нагрели до 50°С до получения прозрачного раствора. Затем добавили 2,5 мл ЛТИ (d 1,231, молекулярная масса 267,25, 11,52 ммоль, -NCO 34,55 ммоль), закрыли колбу резиновой пробкой и запечатали. Реакционную смесь перемешивали при 50°С в течение 48 часов и получили вязкий раствор. Вязкий раствор хранили при комнатной температуре под азотом до использования. Вязкую жидкость распределили по каждому из двух участков влажной ткани, которые, когда их соединили сжатием, крепко прилипли друг к другу через 30 секунд.
Пример 7
В этом примере были приготовлены два раствора предшественников, которые затем были смешаны непосредственно перед нанесением на влажную ткань. Раствор А был получен из 2,15 г ПЭГ 200 (10,75 ммоль, -ОН 21,5 ммоль) и 4,4 мл ЛДИ (d 1,157, молекулярная масса 226, 22,53 ммоль, -NCO 45,05 ммоль) через 48 часов реакции. Раствор В был получен из 4,2 г ПЭГ 200 (21 ммоль, -ОН 42 ммоль) и 2,2 мл ЛДИ (11,26 ммоль -NCO 22,52 ммоль) через 48 часов реакции. Так как в растворе А содержался избыток ЛДИ, а в растворе В содержался избыток ПЭГ 200, оба раствора А и В можно было хранить в течение длительного периода времени. Равные объемы каждого раствора были хорошо перемешаны для использования в качестве клея. Как только растворы А и В были тщательно смешаны (в соотношении 1:1 по объему), вязкая жидкость была намазана на каждый из двух участков влажной ткани. Будучи соединены вместе, они крепко прилипли друг к другу через 2 минуты.
Пример 8
В этом примере были приготовлены два раствора предшественников, которые затем были смешаны непосредственно перед нанесением на влажную ткань. Раствор А был получен из 4 г ПЭГ 400 (10 ммоль, -ОН 20 ммоль) и 4 мл ЛДИ (d 1,157, молекулярная масса 226, 20,48 ммоль, -NCO 40,96 ммоль) через 48 часов реакции. Раствор В был получен из 8 г ПЭГ 400 (20 ммоль, -ОН 40 ммоль) и 2 мл ЛДИ (10,23 ммоль -NCO 20,48 ммоль) через 48 часов реакции. Так как в растворе А содержался избыток ЛДИ, а в растворе В содержался избыток ПЭГ 200, оба раствора А и В можно было легко хранить в течение длительного периода времени. Равные объемы каждого раствора были хорошо перемешаны для использования в качестве клея. Как только растворы А и В были тщательно смешаны (в соотношении 1:1 по объему), вязкая жидкость была намазана на каждый из двух участков влажной ткани. Будучи соединены вместе, они крепко прилипли друг к другу через 2 минуты.
Пример 9
В этом примере были приготовлены два раствора предшественников, которые затем были смешаны непосредственно перед нанесением на влажную ткань. Раствор А был получен из 0,9 г глюкозы (5 ммоль, -ОН 25 ммоль) и 5 мл PEG 200 (28,18 ммоль, -ОН 56,35 ммоль, общее количество -ОН 81,35 ммоль) и 16 мл ЛДИ (d 1,157, молекулярная масса 226, 81,9 ммоль, -NCO 163,82 ммоль) через 48 часов реакции. Раствор В был получен из 1,8 г глюкозы (10 ммоль, -ОН 50 ммоль) в 10 мл ПЭГ 200 (56,35 ммоль, -ОН 112,7 ммоль, общее количество -ОН 162,7 ммоль) и 8 мл ЛДИ (40,96 ммоль, -NCO 81,91 ммоль) через 48 часов реакции. Так как в растворе А содержался избыток -NCO, а в растворе В содержался избыток -ОН, оба раствора А и В можно было легко хранить в течение длительного периода времени. Равные объемы каждого раствора были хорошо перемешаны для использования в качестве клея для кожи. Как только растворы А и В были тщательно смешаны (в соотношении 1:1 по объему), вязкая жидкость была намазана на каждый из двух участков влажной ткани. Будучи соединены вместе, они крепко прилипли друг к другу через 2 минуты.
Пример 10
В этом примере был использован желатин с ЛДИ-полиуретановым связующим веществом согласно настоящему изобретению. Было обнаружено, что время отверждения является более коротким, чем когда ЛДИ-полиуретановый клей использовали без желатина. В этом эксперименте 100 мкл 0,1% желатина (тип А: из свиной кожи, 300 bloom, Sigma Co.) смешали с 0,5 мл полиуретана на основе ЛДИ по примеру 1. Как только растворы А и В были тщательно смешаны (в соотношении 1:1 по объему), вязкая жидкость была намазана на каждый из двух участков влажной ткани, которые после соединения вместе крепко прилипли друг к другу через 10-30 секунд.
Предыдущее описание и прилагаемые графические материалы описывают предпочтительные в настоящее время варианты осуществления изобретения. Различные модификации, добавления и альтернативные варианты будут, разумеется, рассматриваться специалистами в свете предыдущих сведений без выхода из рамок изобретения. Объем охраны изобретения указан в нижеследующей формуле, а не в предыдущем описании. Все изменения и варианты, соответствующие по смыслу и попадающие под определение пунктов формулы изобретения, находятся в рамках изобретения.
Реферат
Изобретение относится к медицине. Предложен клей, содержащий смесь молекул, кэпированных изоцианатом, образованных реакцией молекул с множеством изоцианатных функциональных групп с многофункциональными молекулами-предшественниками, включающими концевые функциональные группы, выбранные из группы, состоящей из гидроксильной группы, первичной аминогруппы и вторичной аминогруппы. Предпочтительно функциональные группы являются гидроксильными группами. Многофункциональные предшественники являются биологически совместимыми. Предшественники с множеством аминогрупп молекул с множеством изоцианатных функциональных групп также являются биологически совместимыми. Смесь молекул предпочтительно имеет среднее число изоцианатных функциональных групп по меньшей мере 2,1 и более предпочтительно по меньшей мере 2,5. Смесь молекул образует смесь полимеров со сшивками при контакте с тканями организма в присутствии воды. Сеть полимеров со сшивками является биологически совместимой и биологически разлагаемой. Сеть полимеров со сшивками разлагается на продукты, которые включают молекулы и предшественники с множеством функциональных аминогрупп. 2 н. и 18 з.п. ф-лы, 5 ил.
Формула
Документы, цитированные в отчёте о поиске
Отверждающийся под действием влаги плавкий клей на основе полиуретана

Комментарии