Композиции и устройства для склеротерапии с применением светоотверждаемых клеев - RU2738739C2
Код документа: RU2738739C2
Чертежи

Описание
ОБЛАСТЬ ТЕХНИКИ
Настоящее изобретение относится к области медицины, более конкретно, к области заболеваний вен у людей и животных, таких как венозная недостаточность, варикозное расширение вен, экстазия или аневризмы. Настоящее изобретение также относится к области лекарственных средств и медицинских устройств для лечения указанных заболеваний.
УРОВЕНЬ ТЕХНИКИ
Кровеносные сосуды у людей и животных классифицируют как артериальные и венозные сосуды в зависимости от того, течет ли в сосуде кровь от сердца (артериальный) или по направлению к сердцу (венозный). Вены собирают кровь из органов, мышцы, соединительной ткани и кожи. Венозная кровь имеет низкое содержание кислорода и питательных веществ, но обогащена диоксидом углерода и другими компонентами, такими как продукты выделения.
Вследствие приобретенной функциональной слабости из-за недостатка активности или врожденных патологий большое количество людей имеют венозный застой крови в ногах. Застой означает наличие крови в количестве выше физиологического уровня. Если не происходит никаких изменений в привычках, застой превращается в недостаточность в течение нескольких лет. Недостаточность означает, что венозные клапаны становятся неработоспособными, что приводит к появлению реверсного кровотока. В таком порочном круге недостаточность дополнительно увеличивает застой венозной крови и указанное заболевание развивается с течением времени.
Варикозное расширение вен развивается в результате недостаточности. Варикозные вены представляют собой поверхностные вены, которые подвергались напряжению из-за перегрузки крови на протяжении многих лет и поэтому имеют большие диаметры и извилистые траектории. Неработоспособные ножные вены обнаруживаются у 21-25% людей в возрасте 35 лет или выше, а паукообразные вены даже у 50% (Maurins et al. Distribution and prevalence of reflux in the superficial and deep venous system in the general population - results from the Bonn Vein Study, Germany. Journal of Vascular Surgery, Vol 48, Issue 3, Sept. 2008, 680-687).
Помимо косметических проблем недостаточные и варикозные вены приводят к серьезным осложнениям вследствие застоя и плохой циркуляции через поврежденную конечность. Такие осложнения включают боль, тяжесть, неспособность ходить или стоять в течение многих часов, воспаление кожи, повреждение кожи, провоцирующее потерю кожи или появление кожных язв, особенно вблизи лодыжки, которые обычно называют венозными язвами, сильное кровотечение из-за легкой травмы, свертывание крови внутри поврежденных вен (тромбофлебит, тромбоз, эмболические осложнения).
В случае расширенных вен хирургическое удаление целевой структуры, например, варикозных вен, в течение многих десятилетий представляло собой широко применяемую терапию. Однако как и все хирургическое вмешательство, такое лечение может сопровождаться некоторыми частично серьезными неблагоприятными эффектами, т.е. повреждением соседних артерий, нервов или лимфатических сосудов, образованием ран и рубцов, раневыми инфекциями или непереносимостью пациентом наркотических лекарств. Кроме того, повреждение ткани, сопровождающее каждую хирургическую операцию, в частности, в местах соединения, таких как паховая область или подколенная вена, по-видимому, вызывает рост новых, но уже пораженных вен.
В качестве альтернативы хирургическому удалению были разработаны другие внутривенные способы закрытия вен. Термин «внутривенное» означает, что терапию осуществляют путем доступа через венозную систему и внутри пораженной вены. Целью таких способов является необратимое закрытие подвергаемой лечению вены или сегмента вены. Такой эффект может быть получен путем теплового воздействия (например, с помощью лазера, радиочастоты, пара) или путем инъекции химических веществ (жидкостей, пен). Вследствие применения катетеров и зондов тепловое воздействие ограничено сравнительно линейными сосудами, тогда как химические вещества могут также достигать изогнутых и извилистых сегментов или разветвленных (ретикулярных) вен.
Для многих применений современная катетерная техника не является удовлетворительной. Например, в методах, требующих солевое промывание, не предлагается применение конкретных промывочных катетеров. Вместо этого врачи должны использовать кровоостанавливающие трубки, изготовленные для доступа к артериям. Другим примером являются методы, пользующиеся отсутствием крови в венах, подвергаемых лечению, такие как склеротерапия, 810-1500 нм внутривенные лазеры, пар или радиочастота. Для перечисленных способов до сих пор не были представлены конкретные технические средства, предназначенные для обеспечения отсутствия крови. Даже для широко распространенной в настоящее время пенной склеротерапии конкретный катетер для доставки пены не является коммерчески доступным. Важно отметить, что при применении простых трубкообразных катетеров часто имеет место случайное неправильное размещение пены и показатели успешности не могут конкурировать с аналогичными показателями методов термической окклюзии.
Были описаны немногие другие способы лечения, относящиеся к другим типам венозного заболевания, таким как варикозное расширение вен пищевода, которое является следствием заболевания печени, вызванного венозным застоем, с осложнением в виде опасных кровотечений. Такие кровотечения представляют угрозу для жизни. Неотложные обследования выполняют с применением эндоскопии (большие управляемые трубки с волоконной оптикой), при этом рабочие каналы указанных эндоскопов использовали для ведения склерозирующих агентов или клеев. Такое показание предназначено для остановки кровотечения, а не для лечения недостаточности. Указанные способы вмешательства не являются эндоваскулярными и их нельзя использовать на периферических венах.
Возможность применения медицинских клеев в периферических венах с помощью простых трубкообразных катетеров автор изобретения исследовал с 2007 года. Однако распределение клея внутри вены было неравномерным, при этом некоторые участки эндотелия были избавлены от клея из-за его высокой вязкости. Чем выше вязкость клея, тем хуже распределение внутри вены. Участки с накоплением слишком большого количества клея вызывают воспалительные реакции. В частности, при применении вязкого клея с очень медленным затвердеванием в соответствии с идеей сохранения эластичности клея, денатурация эндотелия была неполной. Кроме того, акриловые клеи с низкой вязкостью были не эффективны при внутривенном применении, поскольку из-за их свойства быстрой полимеризации нарушается равномерное и низкодозированное распределение вдоль вены. Кроме того, применение таких клеев зависит от внешней ручной компрессии, что исключает их применение для наиболее важных, но более глубоких областей соединения подкожных вен, или перфорантных вен (вен, соединяющих поверхностные сосуды с глубокой венозной системой). Однако, если это осуществимо должным образом, склеивание могло сочетать закрытие вен с непосредственным уменьшением диаметра.
Эффект всех перечисленных эндоваскулярных способов, применяемых к периферическим венам, состоит в непрерывном денатурировании функциональных белков в наиболее глубоком слое ткани (слое эндотелиальных клеток). Указанный процесс денатурирования вызывает агрегацию клеток крови, в частности, тромбоцитов, на стенке вены. Это представляет своего рода искусственный тромбоз. В отличие от случайного тромбоза, который, как можно надеяться, способен рассосаться, при терапевтическом подходе цель состоит в том, чтобы полностью денатурировать весь эндотелий в сегменте, подлежащем лечению. Предполагается, что необратимо закрыть можно только части сосудистой стенки, которые можно достать в нужной степени с помощью термического или склеротического эффекта, так как неповрежденный эндотелий будет восстанавливаться и приведет к рецидивирующему патологическому кровотоку. Поэтому склеивание путем применения вязких акриловых клеев может вначале закрыть вену, но не позволяет им полностью распределиться для контакта со всем эндотелием и может привести к рецидиву венозной недостаточности.
Все внутривенные процедуры связаны с местным спазмом вены из-за эффектов, обусловленных исчезновением слоя эндотелий и достижением мышечного слоя. Спазм означает сужение мышечных клеток. Спазм вены, вызванный внутривенными методами, обычно не продолжается дольше, чем несколько минут активного присутствия описанного выше лечебного воздействия. Однако было бы желательно сохранить спазм или навсегда сохранить размер вены, уменьшенный за счет спазма, так как одна из важных целей состоит в уменьшении диаметра сосуда. Фактическое первоначальное сужение будет обеспечено только в случае, если указанный эффект распространяется глубоко в мышечный слой при постоянном укорачивании волокон. С другой стороны, при увеличении воздействия на мышечный слой возрастает опасность перфорации вены и поэтому во время лечения и после него возникает боль, так как расстояние до иннервированного наружного слоя стенки (называемого адвентициальной оболочкой) составляет только несколько микрометров. Поэтому все склерозирующие или термические окклюзионные методы изначально не обеспечивают достаточного уменьшения просвета. Спазм вены сам по себе заслуживает внимания, так как он представляет собой не просто случайный побочный эффект, но может быть использован в качестве основной стадии для более эффективного лечения вен.
Известные жидкие склерозирующие лекарственные средства представляют собой, например, спирты с моющими свойствами, такие как полидоканол или тетрадецилсульфат натрия. В старейшем способе лечения жидкое склерозирующее лекарственное средство инъецируют непосредственно в сосуды. Вследствие его высокой текучести жидкое склерозирующее лекарственное средство перемещается вместе с потоком крови и быстро смешивается с кровью, быстро обеспечивая неэффективное разбавление. Белковые связи дополнительно ограничивают эффект жидких склерозирующих веществ.
Для преодоления некоторых недостатков жидких склерозирующих лекарственных средств, обычно изготавливают склерозирующую пену путем смешивания жидкого склерозирующего лекарственного средства с газом. Полученное в виде пены склерозирующее лекарственное средство инъецируют в целевую структуру, например, варикозную вену. Для вспенивания склерозирующее лекарственное средство (например, тетрадецилсульфат натрия или полидоканол) смешивают со стерильным воздухом или физиологическим газом (диоксидом углерода) в шприце или с помощью механических насосов.
Вспенивание позволяет увеличить площадь поверхности лекарственного средства. Благодаря ее более высокой вязкости пена склерозирующего лекарственного средства является более эффективной в отношении склерозирования, чем жидкое склерозирующее лекарственное средство (утолщение стенки сосуда и блокирование кровотока; Yamaki et al. (2004) Comparative study of duplex-guided foam sclerotherapy and duplex-guided liquid sclerotherapy for the treatment of superficial venous insufficiency, DermatolSurg 30 (5): 718-22; Hamel-Desnos et al. Evaluation of the Efficacy of Polidocanol in the Form of Foam Compared With Liquid Form in Sclerotherapy of the Greater Saphenous Vein: Initial Results DermatolSurg 29(12): 1170-1175 (2003)).
Все пены, независимо от того, как они были получены, имеют несколько недостатков: при достаточно быстром инъецировании пена может заменить кровь в течение определенного времени, варьирующего от секунд до нескольких минут. В это время контакт со стенкой вены является более интенсивным, чем в случае жидкого болюса, просто проходящего через вену. Химическая реакция склерозанта на эндотелии (наиболее глубоком слое стенки) будет распространяться до среднего слоя и вызывать мышечные спазмы. Соответственно, вена будет ссужаться под действием спазма на от 5 до 80% процентов от ее первоначального диаметра. Спазм будет вытеснять большую часть пены в соседние сосуды и одновременно за счет повышенного сопротивления кровотоку предотвращать соответствующую перфузию сегментов, подвергаемых лечению. Мускулатура вены будет расслабляться через 5-60 минут и затем остатки пены будут смываться. После прекращения спазма вены кровь возвращается в целевой сосуд. Хотя под действием внешнего сжатия (чулки, бинты) количество крови, возвращающееся в обработанную вену, можно уменьшить до некоторой степени, такой возврат невозможно избежать полностью. Диаметр целевой вены невозможно отрегулировать до требуемого размера. Это, в частности, справедливо для более глубоких вен, для их эффективной компрессии необходимо одновременно сжать соседние главные вены, при этом в качестве последствия имеет место застой дистальных вен. Тем не менее пенная склеротерапия представляется важным методом лечения, так как она применима почти во всех пораженных венах при условии, что участок является доступным для катетера, и она не требует тумесцентной или даже общей анестезии.
Другой способ снижения количества крови в вене во время внутривенного лечения или после него может состоять в простом поднятии ноги выше уровня сердца. Однако это способ работает временно и не является очень эффективным, так как всегда имеется коллатеральный кровоток вследствие непрерывного артериального притока. К тому же краткосрочное поднятие ноги будет замедлять лечение, увеличивая риск развития тромбоза. Длительное поднятие ноги пациента (в течение от нескольких часов до дней) будет означать иммобилизацию, требующую антикоагуляции (например, инъекций гепарина). Некоторые преимущества внутривенного лечения, в частности, немедленное восстановление подвижности и способность работать и заниматься спортом, будут потеряны.
При полном денатурировании всего эндотелия он теряет свою способность предотвращать адгезию клеток крови. Соответственно, вена будет закрыта в течение следующих от 1 до 24 часов вследствие тромбоза. Некоторые способы позволяют обеспечить немедленный тромбоз (например, лазер 810-980 нм), но они не работают в отношении уменьшения размера первоначального просвета, кроме того, в дальнейшем заполнение просвета кровью, происходит поперечным способом с помощью открытых бронхиальных артерий или боковых ветвей. Под действием указанных эффектов диаметр вены увеличивается, незначительный поток можно обнаружить в течение нескольких дней, но затем вена будет закрыта на протяжении длительного времени или навсегда. В этот момент окончательного закрытия вены в данном сосуде больше нет перфузии и устранен патологический возвратный поток. Это тот же самый гемодинамический эффект, подобный эффекту, достигаемому при хирургическом вмешательстве («устранение рефлюкса»), при этом указанный эффект является основной конечной точкой качества лечения.
В отличие от хирургического вмешательства вена все еще на своем месте. С точки зрения оптимальных результатов вена не должна быть теперь ни видимой, ни прощупываемой. Пациент не должен ощущать ее присутствие при движении или в состоянии покоя. Однако эту цель невозможно достичь с помощью сегодняшних технических средств.
Когда после склеротерапии или термической окклюзии описанного типа кровь вновь поступает в целевую вену после прекращения спазма, общее количество свернувшейся крови, содержащейся в вене, будет определять продолжительность и симптомы процесса реорганизации. Свернувшуюся кровь внутри сосуда необходимо удалить посредством метаболизирования, которое приводит к превращению тромба в глянцевитую (shined) соединительную ткань. Фактически, частота появления нежелательных побочных эффектов, таких как болевые воспаления, изменение цвета на коричневатый, появление продолжительных уплотнений и видимых варикозных вен, возрастает с увеличением диаметра вены во время окончательного тромботического закрытия.
В клинической практике большинство склерозирующих терапий, а также способы лечения методами термической окклюзии, не являются исчерпывающими в смысле общей циркулярной денатурации эндотелия. Например, в случае медленной инъекции, а также в случае сложных и извилистых варикозных структур, которые ограничивают скорость инъекции, пена плавает на поверхности крови вместо того, чтобы заменять ее. Достигается только частичная денатурация эндотелия. Исследования показали, что переворачивание пациента действительно помогает. В случае неполного разрушения эндотелия из-за наличия островков жизнеспособного эндотелия часто возникает болевой флебит и, соответственно, закрытие вены не является устойчивым и демонстрирует ранний рецидив.
Таким образом, пены склерозирующих лекарственных средств согласно уровню техники не слишком хорошо подходят для лечения более крупных целевых структур, так как они часто вызывают болезненные воспалительные реакции или характеризуются недостатком продолжительных эффектов в отношении окклюзии целевых структур.
Другие средства нехирургического закрытия вены, такие как радиочастота, лазер или пар (обобщенно называемые термическими окклюзионными методами) проявляют указанный недостаток в меньшей, но все-таки существенной степени. Они все могут обеспечить закрытие целевой вены, но ни один из указанных способов не способен осуществить немедленное и достаточное сужение вены. Это, в частности, справедливо для вен с большими диаметрами (>12 мм). Чем больше диаметр вены, тем выше риск того, что останутся островки жизнеспособного эндотелия вследствие недостаточного переноса энергии. Кроме того, термические окклюзионные методы требуют местной анестезии и охлаждающих жидкостей, которые приходится инъецировать трудоемким способом. Вены с большими диаметрами будут при разрушении проявлять склонность к образованию складок, в которых эндотелий защищен от воздействия лазера, пара или радиочастотной энергии. Кроме того, воздействие перечисленных методов не будет включать боковые ветви и перфорантные вены, что позволяет остаться жизнеспособному эндотелию и, соответственно, приводит к неполным результатам и источникам рецидива.
В то время, как термические окклюзионные способы способны работать с точностью от 1 до 10 мм, склерозирующие терапии являются менее точными, так как жидкости или пены будут распространяться в зависимости от инъецируемого количества и от вызванного спазма, который будет уменьшать просвет и способствовать распределению склерозанта в направлении более или менее удаленных областей. Даже очень опытные врачи не могут контролировать эффект склерозантов с точностью менее нескольких сантиметров. Побочными эффектами являются тромбоз (от 1 до 3% случаев), флебит (от 3 до 18%), окклюзия здоровых вен (как правило, без симптомов и, таким образом, данные значительно занижены). Недостаток точности также приводит к частым неудачам, соответственно, во всем мире считается, что склеротерапия представляет собой многостадийный способ лечения. Уровень возмещения затрат является низким.
При лечении венозной недостаточности альтернативой стал способ внутривенного склеивания. Однако все технические решения имеют недостатки, такие как применение почти не резорбируемых акриловых адгезивов или ненадежность в венах с большими диаметрами. Настоящее изобретение решает указанные проблемы путем применения светоактивируемого клея, который предпочтительно является биологически разлагаемым и/или биологически совместимым, с помощью недавно разработанного катетера, который вводят в выбранные места внутри целевой вены. Помимо светопередающих элементов, применяемых для активации клея в подходящие моменты времени в процессе распределения, катетер включает средство для отделения распределенного клея от катетера. В результате склеивания стенки вены плотно подогнаны, что обеспечивает уменьшение диаметра пораженной вены на более 75%, что является достаточным для достижения лучших клинических и видимых результатов.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к композиции для применения для лечения варикозного расширения вен, содержащей а) фармацевтически приемлемый тканевой клей, b) склерозирующее лекарственное средство, предпочтительно в форме пены и необязательно с) медицинский газ, при этом указанный фармацевтически приемлемый тканевой клей представляет собой инъекционный, светоотверждаемый или светоактивируемый, биологически разлагаемый и/или биологически совместимый клей, предпочтительно гибкий после затвердевания.
Пенная склеротерапия представляет собой метод, включающий впрыскивание «вспененных склерозирующих лекарственных средств» в кровеносный сосуд с помощью шприца - в этом документе, предложенного в настоящем изобретении катетера. Склерозирующие лекарственные средства (например, тетрадецилсульфат натрия или полидоканол) смешивают с воздухом или физиологическим газом (например, диоксидом углерода, кислородом) в паре шприцов путем применения механических или электромеханических насосов или давления газов. Вспенивание увеличивает площадь поверхности лекарственного средства. Пенное склерозирующее лекарственное средство является более эффективным, чем жидкость, так как он меньше смешивается с кровью в сосуде и вместо этого замещает кровь, что, таким образом, позволяет избежать разбавления лекарственного средства и обуславливает максимальное склерозирующее действие.
В идеале, указанный клей находится в форме геля, пены или эмульсии.
Согласно предпочтительному варианту реализации изобретения композиция содержит от 0,001 до 1,0 г клея на 100 мм сегмента вены, подвергаемого лечению, предпочтительно от 0,001 до 0,5 и даже более предпочтительно от 0,001 до 0,1 г/100 мм.
Согласно наиболее предпочтительному варианту реализации изобретения композиция содержит от 0,01 до 1,0 г клея на 100 мм сегмента вены, подвергаемого лечению, предпочтительно от 0,05 до 0,5 и даже более предпочтительно от 0,05 до 0,1 г/100 мм.
Медицинский газ выбирают из перечня, включающего диоксид углерода, кислород, воздух или их смеси. Согласно предпочтительному варианту реализации изобретения медицинский газ представляет собой диоксид углерода.
Настоящее изобретение дополнительно относится к светоотверждаемому или светоактивируемому клею для применения для лечения заболеваний вен.
Клей предпочтительно используют для лечения заболеваний, вызывающих появление расширенных или эктазированных вен. Соответственно, настоящее изобретение также относится к способу лечения пациента, имеющего заболевание вен.
Заболевание вен предпочтительно выбирают из группы, состоящей из венозной недостаточности, расширения вен, варикозного расширения вен, экстазии или аневризмы.
Согласно предпочтительному варианту реализации композиции, описанной в настоящем изобретении, клей и газ загружают в устройство и/или применяют при последующем болюсном введении.
В отличие от светоотверждаемых или светоактивируемых клеев большинство адгезивов, разработанных в медицине, разработаны для других применений, подобно цианоактилатам для ушивания кожи до смесей на основе фибрина для применения в качестве герметиков для легких. Клей на основе фибрина либо получают из объединенной плазмы с потенциальным риском инфекций (HIV), либо указанный клей является дорогостоящим при получении его из аналогичного источника. С другой стороны, обычные актилаты почти не поддаются биологическому разложению. Однако актилаты можно выполнить таким образом, чтобы они были биологически совместимыми и/или биологически разлагаемыми. Биологически разлагаемые актилаты также можно использовать в настоящем изобретении. Такие актилаты должны иметь период полувыведения в ткани, составляющий менее 2 лет.
Светоактивируемые адгезивы используют в технике, а также медицине для решения задач, которые требуют определенного времени для приведения объектов в нужное место и затем их быстрой и необратимой фиксации. Перед активацией прочность прилипания является низкой и увеличивается по мере активации до определенного максимума. Например, активируемый ультрафиолетовым светом клей используют для приклеивания частей искусственного зуба. Хорошо известны даже биологические адгезивы (Photon activated biological adhesives in surgery; Mandley et al., International Journal of Adhesion and Adhesives, Volume 20, Issue 2, 1 April 2000, p. 97-102).
При применении адгезива, активируемого под действием света или других видов энергии, некоторые стадии являются обязательными: 1.) подготовка целевых объектов, например, удаление мешающих частиц или жидкостей, 2.) нанесение адгезива, 3) обеспечение источника света вблизи адгезива, 4) применение активирующего света или энергии способом, обеспечивающим разделение адгезива и инструмента для нанесения. Для выполнения стадии 4, либо нанесенный слой адгезива должен быть надежно отделен от инструмента для размещения, либо энергию активирования необходимо применять таким образом, чтобы НЕ активировать клей между планируемым слоем и инструментом для размещения, т.е. путем поддержания формирования определенного пространственного пучка. Соответственно, указанные стадии необходимо осуществлять с применением катетера.
Настоящее изобретение дополнительно относится к катетеру, который содержит источник света для облегчения быстрого затвердевания или активации клея. Источник света в контексте настоящего изобретения включает средство генерирования света в требуемом месте, например, с помощью светодиодов (LED), в том числе проводников электроэнергии, но также включает средства для передачи или проведения света в требуемое место, подобно стекловолокну или полимерному волокну. Источник света предпочтительно представляет собой волоконно-оптический или другой светопередающий элемент, или стенку катетера делают из прозрачного передающего свет материала.
Свет, генерируемый источником света, может иметь любую длину волны. Источник света предпочтительно излучает, передает или проводит УФ, видимый или инфракрасный свет. В контексте настоящего изобретения УФ-свет представляет собой свет с длиной волны от 10 до 380 нм, видимый свет представляет собой свет с длиной волны от 381 до 780 нм и инфракрасный свет представляет собой свет с длиной волны от 781 нм до 1 мм.
Катетер предпочтительно имеет по меньшей мере один просвет, при этом его внутренний диаметр составляет от 0,6 до 2,2 мм, наружный диаметр составляет от 0,8 до 2,8 мм и длина составляет от 15 до 85 см. Катетер дополнительно содержит источник света, который предпочтительно представляет собой светопроводящий элемент, встроенный внутрь стенки катетера или внутрь одного просвета катетера.
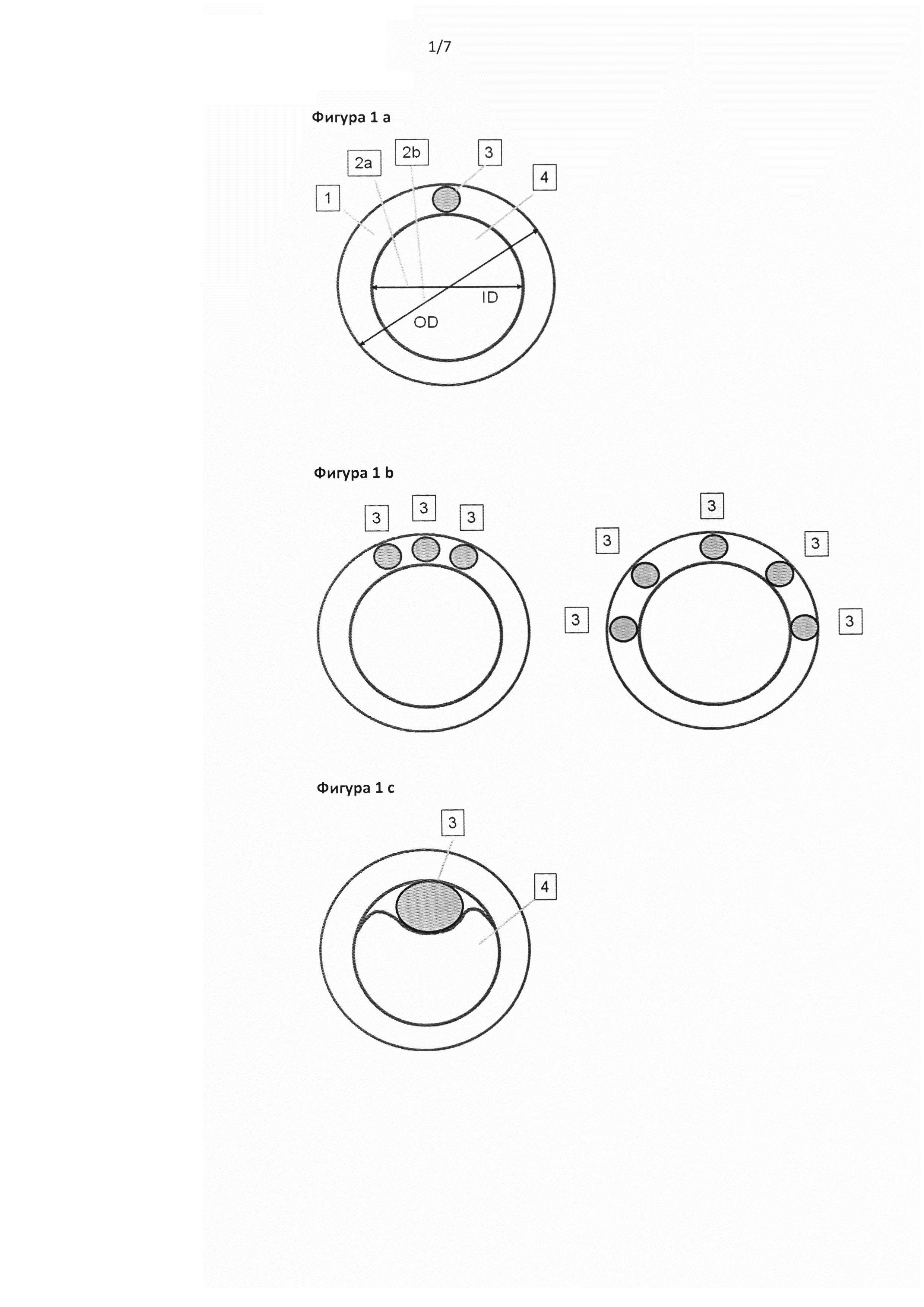
Типовые способы расположения для предложенного катетера можно увидеть на фигурах 1а-е.
Согласно одному из вариантов реализации изобретения источник света или световод встраивают в стенку катетера. Согласно одному из вариантов реализации изобретения стенка катетера содержит один источник света (фиг. 1а). Согласно другому варианту реализации изобретения стенка катетера содержит множество источников света (фиг. 1b). Источник света может излучать или передать свет разных длин волны или одной длины волны. При наличии множества источников света длину волны каждого источника света можно выбрать независимо от других источников.
Согласно конкретному варианту реализации настоящего изобретения используют множество источников света, при этом указанные источники света независимы друг от друга.
Согласно альтернативному варианту реализации изобретения источник света встраивают в просвет катетера. Согласно дополнительному варианту реализации изобретения источник света выдается в просвет катетера (фиг. 1с, 1е).
Согласно другому альтернативному варианту реализации изобретения источник света составляет основную часть стенки катетера или согласно предпочтительному варианту реализации изобретения стенка катетера представляет собой источник света (фиг. 1d-e).
Согласно предпочтительному варианту реализации изобретения катетер содержит трубкообразный контейнер для клея. Согласно более предпочтительному варианту реализации изобретения контейнер является светонепроницаемым.
Согласно предпочтительному варианту реализации изобретения катетер дополнительно содержит систему разделения для предотвращения прилипания клея к катетеру.
Согласно предпочтительному варианту реализации изобретения катетер содержит перемещаемую трубку для размещения клея: Трубка выдвигается в место, расположенное на расстояние от 0,5 до 20 мм впереди от основного катетера и в этом месте размещают заданное количество клея. Затем перемещаемую трубку отводят в определенное положение внутри основного катетера. Свет для активации клея направляют в сторону нанесенного слоя клея таким образом, чтобы избежать воздействия на содержащую клей трубку внутри основного катетера. Средство для фокусирования света может быть оптическим, таким как линзы, или иметь определенные геометрии LED или формы стекловолоконного наконечника.
Согласно другому варианту реализации изобретения катетер содержит неподвижную трубку для размещения клея. Согласно предпочтительному варианту реализации настоящего изобретения катетер обеспечивает втягивание столбика клея обратно. Согласно одному из вариантов реализации изобретения неподвижная трубка выходит за пределы основной трубки катетера (фигура 3 а, b, с). Согласно другому варианту реализации изобретения неподвижная трубка не выходит за пределы основной трубки катетера.
Согласно одному из вариантов реализации изобретения катетер дополнительно содержит систему датчиков для мониторинга количества введенного клея и/или функционирования средства разделения путем указания давления, расхода, содержимого трубки, содержимого вены или цвета содержимого. Согласно предпочтительному варианту реализации изобретения система датчиков содержит датчик давления и/или датчик расхода (фиг. 2b).
Согласно предпочтительному варианту реализации изобретения катетер для инъекций представляет собой двухтрубный катетер.
Согласно дополнительному предпочтительному варианту реализации изобретения клей и газ загружают в катетерное устройство для инъекций, предложенное в настоящем изобретении, и применяют при последующем болюсном введении. Клей предпочтительно представляет собой фармацевтически приемлемый тканевой клей. Кроме того, клей предпочтительно является светоотверждаемым или светоактивируемым клеем, а газ представляет собой медицинский газ, подходящий для внутривенного введения.
Согласно одному из конкретных вариантов реализации изобретения катетер представляет собой двухтрубное катетерное устройство для инъекций, содержащее:
a. Одну более большую и одну более маленькую трубку, образующие функциональный блок, при этом более маленькая трубка расположена внутри более большой трубки,
b. обе трубки необязательно являются перемещаемыми и разборными,
c. обе трубки имеют отверстие на обоих концах,
d. одно отверстие, сделанное в стенке наружной трубки, расположенное на расстоянии примерно от 5 мм до 40 мм от наконечника, или несколько отверстий, расположенных в сегменте на расстоянии от 5 до 250 мм от наконечника, при этом диаметр одного отверстия составляет от 70% до 120% от внутреннего диаметра наружной трубки, или, в случае нескольких отверстий, для каждого отверстия диаметр составляет от 30 до 60% от внутреннего диаметра наружной трубки; в случае нескольких отверстий: размер, форма и распределение выполнены таким образом, чтобы обеспечить равномерное размещение (пены) склерозанта,
e. источник света или световод,
f. при этом наружный диаметр внутренней трубки составляет от 0,6 мм до 2,0 мм и внутренний диаметр составляет от 0,3 до 1,6 мм, более предпочтительно от 0,4 до 1,0 мм и даже более предпочтительно от 0,5 до 0,8 мм,
g. наружный диаметр наружной трубки составляет от 1,3 мм до 3,3 мм и внутренний диаметр составляет от 1,1 до 3,0 мм, предпочтительно от 1,1 до 2,8 мм и даже более предпочтительно от 1,1 до 2,7 мм, расстояние между наружной стенкой внутренней трубки и внутренней стенкой наружной трубки составляет от 0,1 мм до 3,0 мм, предпочтительно от 0,1 до 2,5 мм и даже более предпочтительно от 0,1 до 2,0 мм.
Согласно конкретным вариантам реализации изобретения катетер имеет один или более из следующих размеров:
- Наружный диаметр наружной трубки: от 1,3 до 2,8 мм, предпочтительно от 1,5 до 2,6 мм, более предпочтительно от 1,7 до 2,4 мм.
- Внутренний диаметр наружной трубки: от 1,0 до 2,4 мм, предпочтительно от 1,4 до 2,0 мм, более предпочтительно от 1,2 до 1,8 мм.
- Диаметр стенки/толщина наружной трубки: от 0,1 до 1,5 мм, от 0,1 до 0,3 мм, предпочтительно от 0,125 до 0,25 мм, более предпочтительно от 0,15 до 0,2 мм.
Расстояние между отверстием наконечника и боковым отверстием(ями) может превышать внутренний диаметр наружной трубки в от 1 до 50 раз, предпочтительно от 2 до 50 раз, предпочтительно от 5 до 40 раз, даже более предпочтительно от 15 до 25 раз.
Свет, генерируемый источником света, может иметь любую длину волны. Источник света предпочтительно излучает, передает или проводит УФ, видимый или инфракрасный свет.
Согласно одному из вариантов реализации настоящего изобретения источник света встраивают в стенку катетера. Согласно одному из вариантов реализации изобретения стенка катетера содержит один источник света. Согласно другому варианту реализации изобретения стенка катетера содержит множество источников света. Источник света может излучать или передавать свет разных длин волны или одной длины волны. Если присутствует множество источников света, длину волны каждого источника света можно выбрать независимо от других источников.
Согласно конкретному варианту реализации настоящего изобретения используют множество источников света, при этом указанные источники света независимы друг от друга.
Согласно альтернативному варианту реализации изобретения источник света встраивают в просвет катетера. Согласно дополнительному варианту реализации изобретения источник света выдается в просвет катетера.
Согласно другому альтернативному варианту реализации изобретения источник света составляет основную часть стенки катетера или согласно предпочтительному варианту реализации изобретения стенка катетера представляет собой источник света.
В идеале, обе трубки можно видеть при ультразвуковой визуализации или согласно другому варианту реализации изобретения также при флуороскопии, флебографии, КТ или МРТ.
Согласно некоторым вариантам реализации изобретения зону наконечника наружной трубки изменяют таким образом, что сопротивление потоку происходит в наконечнике. Сопротивление потоку можно обеспечить за счет сужения внутреннего диаметра наружной трубки по направлению к наконечнику. Наружный диаметр можно оставить без изменений или также уменьшить в зоне наконечника, что приводит к получению конической наружной трубки. При применении конической наружной трубки катетерное устройство может быть удобно введено в вену с меньшим риском повреждения сосуда. Сопротивление потоку в зоне наконечника увеличивает поток через боковое отверстие(я). Такое увеличение рекомендуется при применении склерозирующих веществ, в частности склерозирующих пен. В большинстве вариантов применения настоящего изобретения желательным является 100% поток пены через боковое отверстие(я). Область оттока, образованная коническим наконечником наружной трубки, предпочтительно меньше области оттока, образованной боковым отверстием(ями).
Большое значение имеют размеры катетера и, в частности, боковые отверстия. Все ранее изготовленные так называемые аспирационные катетеры нацелены на сбор тромба в артериях или венах. Некоторые из них просто представляют собой трубки со сравнительно тонкой стенкой и, следовательно, имеют большой просвет. Другие катетеры имеют боковые отверстия маленьких размеров с целью распределения контрастного вещества (для ангиографии) или литических веществ (для тромболизиса). Настоящее изобретение, в частности, предназначено для применения в венах. Вены представляют собой сосуды с очень тонкой и мягкой стенкой. Сосуды часто бывают извилистыми. Катетер для вен должен проходить через изгибы сосудов, поэтому он должен быть достаточно гибким. Одновременно катетер должен иметь определенную способность к проталкиванию или жесткость, чтобы добраться до всех целевых участков. Удобно, если катетер может продвигаться в вене даже без направляющей спицы.
Боковые отверстия должны быть сравнительно большими для двух целей: большие отверстия позволяют осуществлять простую эвакуацию, и, что даже более важно, большие отверстия позволяют применять пенные склерозанты без разрушения пузырьков пены, тогда как в случае маленьких отверстий такое разрушение имеет место. «Большой» можно определить, как по меньшей мере в 20 раз больше среднего диаметра пузырька пен, предпочтительно в 50 раз больше среднего диаметра пузырька пены.
Катетеры с одним большим единственным боковым отверстием подходят при работе с короткими сегментами. Катетеры с большим количеством боковых отверстий будут лучше работать для лечения более длинных сегментов вены, так как распределение склерозирующего средства будет более гомогенным. При приложении отрицательного давления к катетеру, содержащему много боковых отверстий, в откачанных областях стенка вены будет закрывать боковое отверстие(я) подобно клапану, при этом отрицательное давление будет воздействовать на участок, подвергаемый склеиванию.
Для достижения цели, состоящей в обеспечении равномерного и точного размещения пенного склерозанта, конструкция бокового отверстия была адоптирована к вязкости пены. Например, для определенной пены размер бокового отверстия в месте, наиболее удаленном от наконечника на расстояние 10 см, может начинаться с диаметра, составляющего 50% от внутреннего просвета катетера, и далее может продолжать изменяться в направлении к наконечнику с 11 дополнительными боковыми отверстиями, диаметры которых поэтапно уменьшаются на +2,5%.
Применение катетера такого рода будет обеспечивать очень равномерное и точное нанесение пенного склерозанта с до сих пор неизвестным качеством. Однако без дополнительного склеивания указанный склерозант не будет фиксировать сосуд до заданного размера.
Положение катетера/катетеров можно контролировать только путем наблюдения или пальпации в очень поверхностных венах (на уровне поверхности кожи). При мониторинге путем ультразвукового исследования можно прослеживать даже извилистые сосуды. При необходимости ограничения ультразвуковой визуализации (ожирение, шрамы, эхосигналы газа) контролирование катетеров можно осуществлять с помощью флуороскопии или флебографии. При выборе метода визуализации с применением рентгеноконтрастных веществ указанные вещества можно наносить через внутренний или наружный катетер в зависимости от требуемого количества и степени замещения крови.
Наружный катетер обеспечивает ведение контрастных веществ, при этом функциональные зонды (катетер для склеивания, лазерные или радиочастотные зонды, пар или катетеры для склеротерапии) находятся на своем месте. Большие количества контрастного вещества можно собрать путем применения аспирационной функции наружного катетера, что, в частности является преимуществом для пациентов с чувствительностью к контрастным веществам. У пациентов с непереносимостью или повышенными рисками в отношении контрастных веществ, жидкие контрастные вещества, обычно содержащие йод, можно заменить на диоксид углерода. Кроме того, диоксид углерода можно собрать посредством аспирации или открыв проход через наружный катетер.
Согласно конкретному варианту реализации изобретения наружная трубка состоит из двух перемещаемых слоев или трубок, добавляющих к наружной трубке дополнительную трубку с толщиной стенки от 0,1 до 0,6 мм, расположенных на расстоянии от 0,1 до 0,5 мм друг от друга. Задача дополнительной трубки состоит в том, что она закрывает или раскрывает отверстия в стенке наружного катетера за счет ее скольжения вперед и назад. Согласно одному из вариантов реализации изобретения указанная трубка имеет проксимальное зажимное устройство, или рукоятку, для более легкого перемещения. Согласно другому варианту реализации изобретения имеются проксимальные отметки на трубках или сигнальное устройство на трубке или внутри нее, для указания состояния закрытия отверстий в стенке наружных катетеров. Согласно дополнительному варианту реализации изобретения трубка, закрывающая отверстия, имеет конический наконечник. Ее максимальная длина ограничена длиной наружного катетера минус длина области бокового отверстия.
Способ лечения с применением дополнительной трубки для закрытия или раскрытия некоторых или всех боковых отверстий наружной трубки дает возможность использовать один и тот же катетер для нескольких целей, таких как лечение неизогнутых пораженных сосудов и одной боковой ветви или повреждений из-за перфорации, при воздействии одного и того же катетера посредством одного единственного доступа. Кроме того, это еще дополнительно дает уникальную возможность перейти от абсорбции через боковые отверстия к абсорбции через переднее отверстие за счет закрытия боковых отверстий.
Длина внутренней и наружной трубки предпочтительно составляет от 6 см и 120 см. Длина внутренней трубки всегда больше длины наружной трубки, при этом превышение длины варьирует от 0,1 до 140 см.
Указанная длина определяется длиной сегмента с максимальной длиной, подвергаемого лечению. Расстояние от паха до лодыжки определяет максимальную длину подвергаемого лечению участка, но большинство из показаний имеют гораздо более короткий сегмент.
В идеале, толщина стенки наружной трубки составляет от 0,1 до 0,6 мм. Толщина стенки наружной трубки предпочтительно составляет от 0,1 мм до 0,3 мм, более предпочтительно от 0,125 мм до 0,25 мм, наиболее предпочтительно от 0,15 мм до 0,2 мм. Толщина стенки внутренней трубки составляет в идеале от 0,1 мм до 0,4 мм.
Предпочтительно, чтобы наружная трубка имела зону терминального наконечника, в которой диаметр просвета был полностью или частично уменьшен для обеспечения направленного перемещения внутренней трубки. Альтернативно, внутренняя трубка может иметь терминальное расширение с увеличением толщины стенки или без него с целью фиксации внутреннего катетера внутри наружного катетера, при одновременно сохранении возможности легкого скольжения внутренней трубки внутри наружной трубки.
Наружная трубка и/или внутренняя трубка предпочтительно оборудованы на своих концах соединителем с наконечником типа Люэра с наружной резьбой или внутренней резьбой или другим типом соединителя и/или соединены с встроенной или отдельной Y-образной или Т-образной деталью, позволяющей пропускать внутреннюю трубку через входное отверстие наружной трубки, а также осуществлять промывку или эвакуацию посредством наружной трубки, согласно одному из вариантов реализации изобретения с зоной захвата или рукояткой для более легкого перемещения со скольжением.
Конус Люэра представляет собой стандартизированную систему маломасштабных жидкостных фитингов, применяемых для изготовления герметичных соединений между фитингом конуса с наружной резьбой и его сопряженной деталью с внутренней резьбой в медицинских и лабораторных инструментах, в том числе канюлях и иглах шприцов для подкожных инъекций или кранах и иглах. Названный в честь немецкого изготовителя медицинских инструментов 19 века Германна Вульфинга Люэра, конус Люэра появился как фитинг с конусностью 6%, предназначенный для пробок стеклянных бутылок. Ключевые особенности соединителей конуса Люэра определены в стандартах ISO 594. Он также описан в стандарте DIN и EN 1707:1996 и 20594-1:1993.
Предпочтительно, если одна, несколько или все трубки имеют конический наконечник. Наиболее предпочтительно, когда все трубки имеют конический дистальный наконечник для более легкого введения в целевую вену.
Внутренняя и/или наружная трубка предпочтительно выполнена или покрыта материалом, уменьшающим липкость, таким как политетрафторэтилен (PTFE), также известный как тефлон или перфторалкокси (PFA). Предпочтительно, чтобы внутренняя и наружная трубка была выполнена или покрыта политетрафторэтиленом (PTFE), также известным как тефлон или PFA или FEP, или была выполнена или покрыта аналогичным пластмассовым материалом со свойствами, защищающими указанный материал от прилипания к любым веществам. Как было показано, это имеет большое значение, так как такая защита гарантирует, что клей и возможно оставшиеся фракции крови не прилипают к устройству. Политетрафторэтилен (PTFE) представляет собой синтетический фторполимер тетрафторэтилена, находящий многочисленные применения. Наиболее известным торговым названием PTFE является тефлон от компании DuPont Co. PTFE является фторуглеродным твердым веществом, так как он представляет собой высокомолекулярное соединение, целиком состоящее из углерода и фтора. PTFE является гидрофобным: ни вода, ни водосодержащие вещества не смачивают PTFE, поскольку фторуглероды демонстрируют уменьшенные лондонские дисперсионные силы вследствие высокой электроотрицательности фтора.
PTFE имеет один из самых низких коэффициентов трения по сравнению с любым твердым телом. PTFE используют в качестве антипригарных покрытий при изготовлении сковородок и другой кухонной утвари. Он очень нереакционноспособный, частично вследствие прочности связей углерод-фтор, и поэтому его часто используют в контейнерах и трубопроводах для химически активных и агрессивных реагентов. Кроме того, его используют для катетеров. Перфторалкокси или PFA представляет собой тип фторполимера со свойствами, аналогичными свойствам политетрафторэтилена (PTFE). Он отличается от PTFE смол тем, что его можно обрабатывать в расплаве с помощью обычных способов литьевого формования и шнековой экструзии. PFA был разработан компанией DuPont и продается под торговой маркой тефлон PFA. Тефлон более известен под торговым названием PTFE. Другими торговыми марками для гранул являются Neoflon PFA от компании Daikin или Hyflon PFA от компании Solvay Solexis. PFA очень похож по составу на фторполимеры PTFE и FEP (фторированный этилен-пропилен). PFA и FEP оба разделяют полезные свойства PTFE в виде низкого коэффициента трения и химической инертности, но более легко поддаются формованию. PFA мягче, чем PTFE и плавится при 305°С.
Предпочтительно, чтобы внутренняя и/или наружная трубка содержала средство для фиксации положения двух трубопроводов относительно друг друга, такое как устройство для расширения, крючки или фиксаторы.
Предпочтительно, чтобы внутренние и/или наружные трубопроводы комбинировали при следующих конфигурациях размера (наружного диаметра):
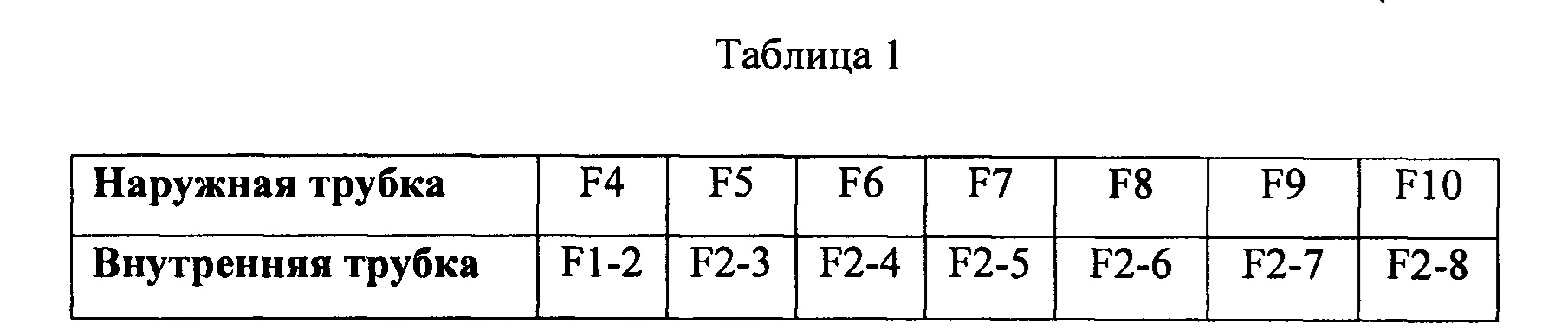
Французскую шкалу диаметра катетеров или систему единиц по шкале Шарьера обычно используют для измерения размера (внешнего диаметра) катетера. В качестве ее аббревиатуры наиболее часто используют Fr, но ее также можно сократить как FR или F. Во франкоговорящих странах в качестве аббревиатуры такой шкалы используют СН или Ch (в честь Charrière, ее изобретателя). 1 Fr=0,33 мм и соответственно, диаметр катетера в миллиметрах можно определить путем деления французского калибра на 3:
D (мм)=Fr/3 или Fr=D (мм) × 3
Например, если французский калибр составляет 9, диаметр равен 3 мм.
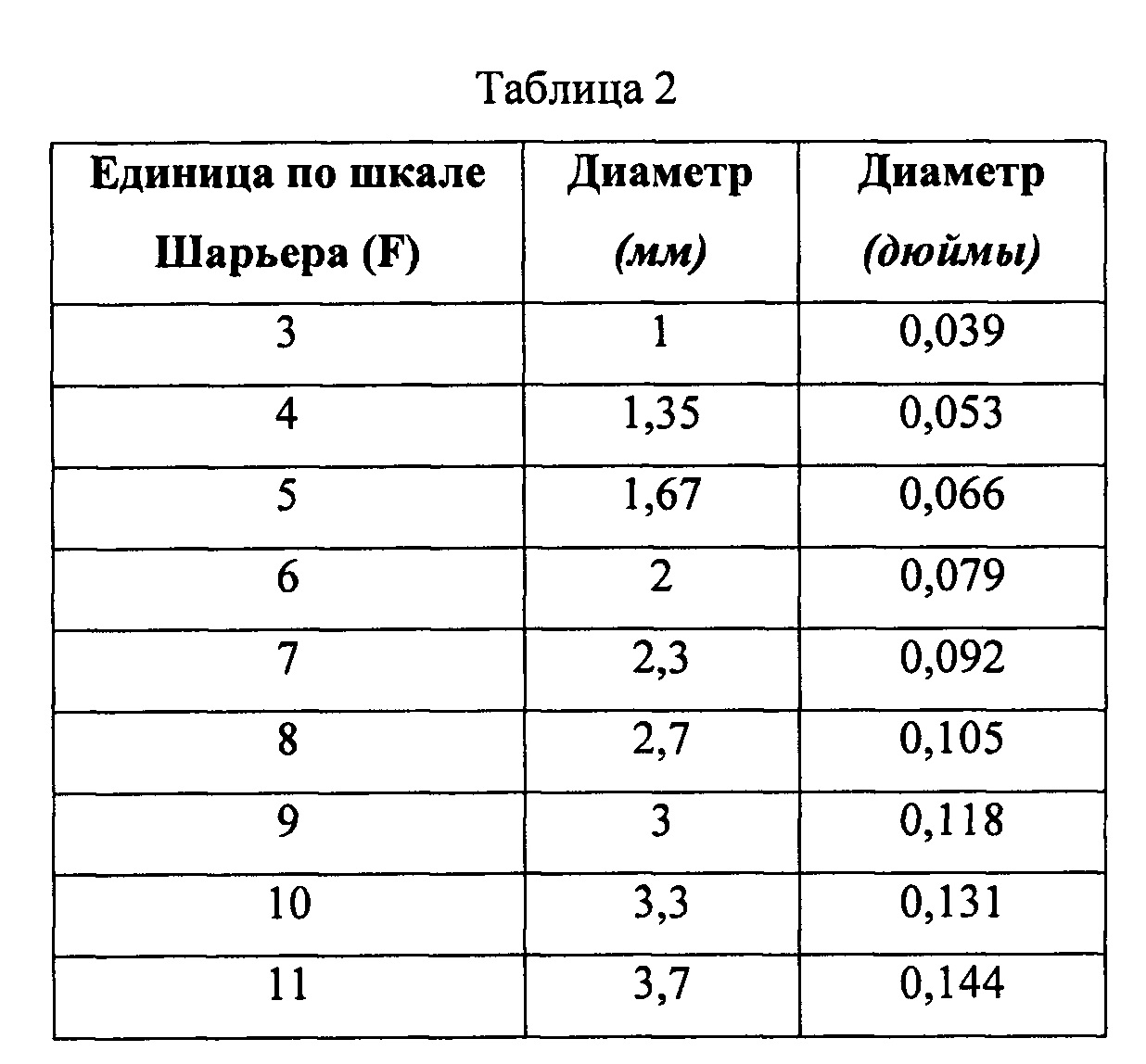
Повышение французского калибра соответствует катетеру с большим диаметром. Это противоречит размеру калибра иглы, где возрастающий калибр соответствует катетеру с меньшим диаметром. Французская шкала диаметра катетеров была разработана Жозефом-Фредериком-Бенуа Шарьером, парижским производителем хирургических инструментов 19 века, который установил отношение «диаметр умножить на 3»; см. таблицу 2.
Предпочтительно, если одна из трубок содержит направляющую спицу (от 0,14 до 0,38 дюймов (от примерно 0, 36 до примерно до 0,97 см)).
Согласно одному из вариантов реализации изобретения зона наконечника внутренней и/или наружной трубки имеет такую форму или способна принять такую форму на расстоянии от 1 до 4 см, чтобы образовать кривую, охватывающую угол от 5 до 45 градусов, служащую в качестве инструмента для исследования венозных изгибов, соединений, боковых ветвей или перфорантных вен.
Настоящее изобретение относится к двухтрубному инъекционному и аспирационному катетерному устройству, в котором внутреннюю трубку заменяют, обменивают, могут легко заменить или обменять на металлическую или металлообразную полую иглу с наконечником с двумя или тремя насечками.
При выборе короткой и маленькой конфигурации катетера, например, с наружным диаметром (OD) F4, длиной от 6 до 20 см, прямое введение в целевой сосуд можно обеспечить путем добавления в наружный катетер полой иглы, фитинга, предпочтительно с наконечником с двумя или тремя насечками.
Инъекция с помощью двухтрубного катетера может включать применением прозрачной аспирационной камеры.
Настоящее изобретение дополнительно относится к способу склеротерапии, в котором подлежащую лечению вену подвергают окклюзии с помощью клея на участке, составляющем менее 20% от ее длины, предпочтительно менее 15% от ее длины, более предпочтительно менее 10% от ее длины и наиболее предпочтительно менее 5% от ее длины.
Один из вариантов реализации настоящего изобретения относится к способу склеротерапии, в котором вена подвергается окклюзии путем применения светоотверждаемого клея. Клей предпочтительно осаждают в вене в форме слоев клея. Нанесенные слои клея могут иметь любую форму, предпочтительно они являются сферическими или цилиндрическими. Если нанесенные слои клея являются цилиндрическими, они предпочтительно имеют радиус от 0,1 до 0,5 мм и длину от 0,1 до 10 мм. Расстояние между отдельными нанесенными слоями клея предпочтительно составляют от 1×D до 10×D, более предпочтительно от 1×D до 5×D, где D представляет собой диаметр вены, подвергаемой окклюзии.
Согласно предпочтительному варианту реализации изобретения вена подвергается окклюзии путем применения светоотверждаемого клея, при этом указанный клей осаждается в форме горошин клея, расположенных друг от друга на расстоянии по меньшей мере 2 см. Указанные горошины предпочтительно расположены друг от друга на расстоянии 5 см, более предпочтительно 10 см. Согласно наиболее предпочтительному варианту реализации изобретения горошины расположены друг от друга на расстоянии от 5 до 10.
Согласно дополнительному варианту реализации изобретение также относится к набору, содержащему композицию, предложенную в настоящем изобретении, в которой клей представляет собой фармацевтически приемлемый и/или биологически совместимый светоотверждаемый клей, а также катетер согласно настоящему изобретению.
ПРИМЕР
Лабораторные испытания были выполнены с применением прототипа прозрачного PTFE катетера длиной 30 см с OD 2,3 мм, ID 1,6 мм, объединенного с непрозрачным PTFE внутренним катетером длиной 40 см с OD 1,2 мм и ID 0,8 мм для размещения клея, при этом оба катетера содержали проксимальные адаптеры Люэра и были соединены с помощью Y-соединителя. В свежем образце вены с длиной 20 см и собственным диаметром 8 мм выполняли пенную склеротерапию путем инъекции через наружный катетер и затем 3 капли, содержащие 0,05 мл светоактивируемого акрилового клея, последовательно посещали на расстоянии 5 см. Облучение УФ-светом осуществляли после каждого размещения клея с помощью 8 В источника УФ-излучения, передающего свет через стенку катетера, в течение 20 секунд. Часть вены отбирали на гистологию, которая показала полную денатурацию эндотелия. Все капли клея были плотно пригнаны к стенкам вены и оказались устойчивыми к мешающим внешним силам, составляющим 10 Н.
Условные обозначения к чертежам
Фигура 1a: Катетер для распределения светоактивируемого клея, показанный в виде поперечного сечения вместе со стенкой катетера (1), внутренним диаметром ID (2а), наружным диаметром OD (2b), светогенерирующим или светопередающим элементом (3) и просветом катетера (4).
Фигура 1b: Стенка катетера может содержать в разных местах один или несколько светогенерирующих или светопередающих элементов (5).
Фигура 1с: Светогенерирующие или светопередающие элементы (3) могут быть встроены в просвет катетера или могут выдаваться в просвет катетера (4).
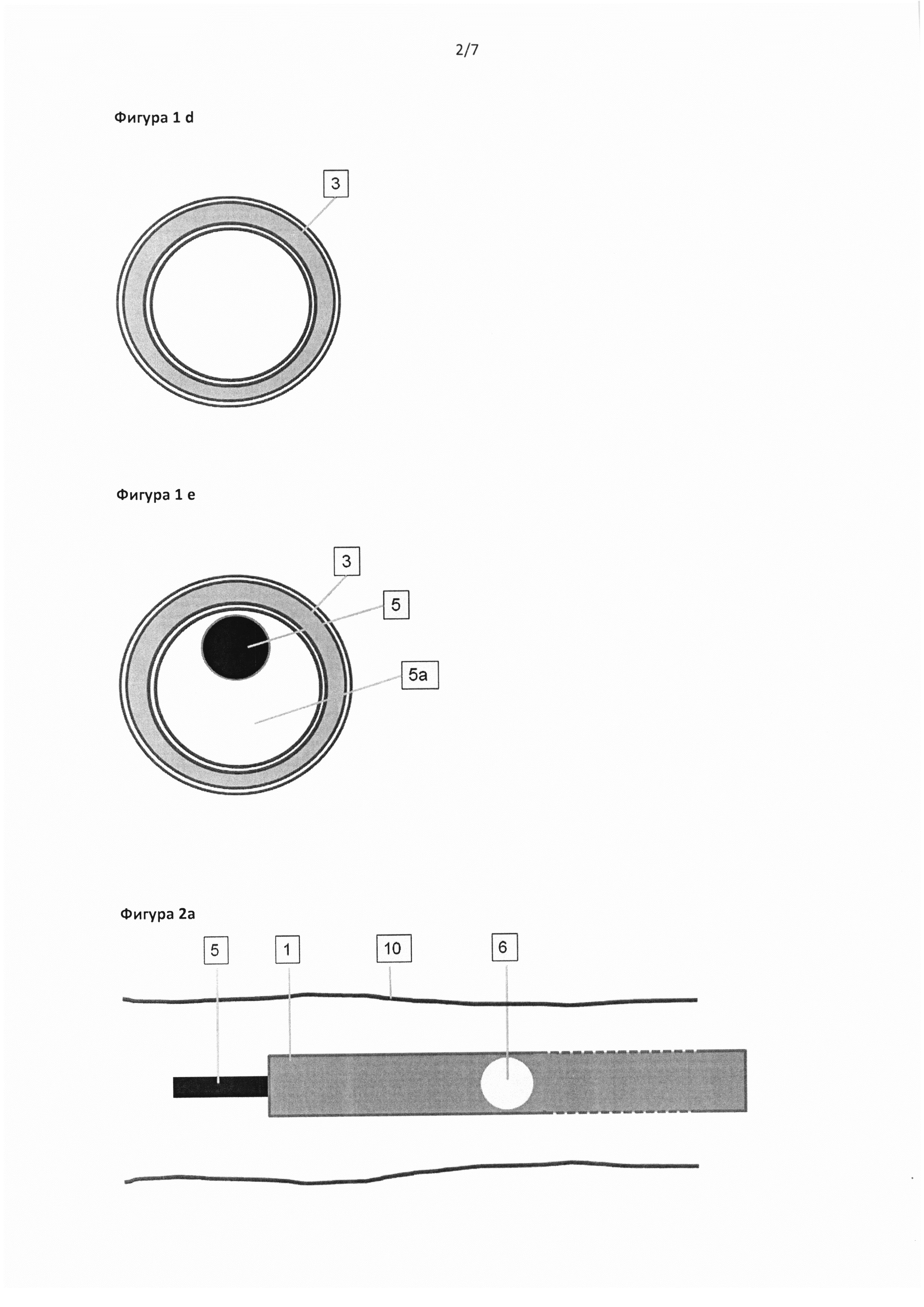
Фигура 1d: Светогенерирующий или светопередающий элемент (3) можно выполнить в виде основной части стенки катетера или катетер сам изготавливают из светопередающего материала.
Фигура 1е: Просвет катетера можно разделить на функциональные блоки, что позволяет независимо или одновременно наносить инъекции клея (5), проводить аспирацию крови, промывать с применением жидкостей или газов, создавать отрицательное давление или инъецировать склерозирующие средства (5а) или использовать для направляющей спицы.
Фигура 2а: Применение светоактивируемого клея при склеротерапии в вене (10) с помощью катетерной системы, состоящей из основной трубки (1) с одним или несколькими необязательными боковыми отверстиями (6) и отдельной трубки с меньшим диаметром, расположенной внутри основной трубки и предназначенной для переноса клея. Согласно такому варианту реализации изобретения указанная трубка для переноса клея может перемещаться. В начале лечения катетерную систему вводят в целевую вену.
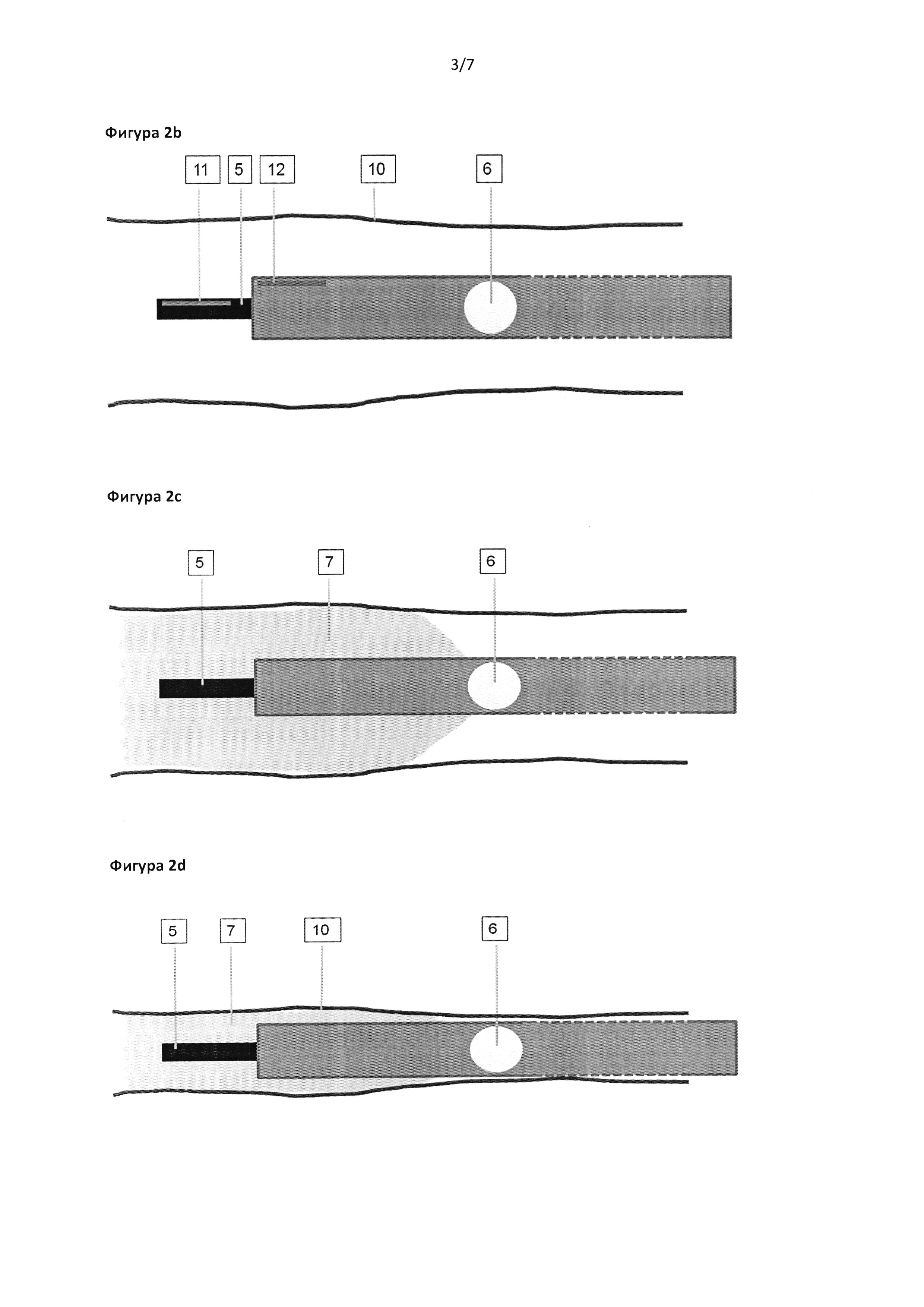
Фигура 2b: Необязательно, одна или несколько трубок могут содержать датчики для мониторинга размещения порций клея.
Фигура 2 с: После установки катетера в целевую область склерозирующее средство (7) наносят из отверстия наконечника или из одного или нескольких боковых отверстий.
Фигура 2d: Благодаря склерозирующему средству вена (10) будет сжиматься при спазме и в конце концов вплотную прикрепится к катетеру. Разрушение вены может усиливаться под действием отрицательного давления.
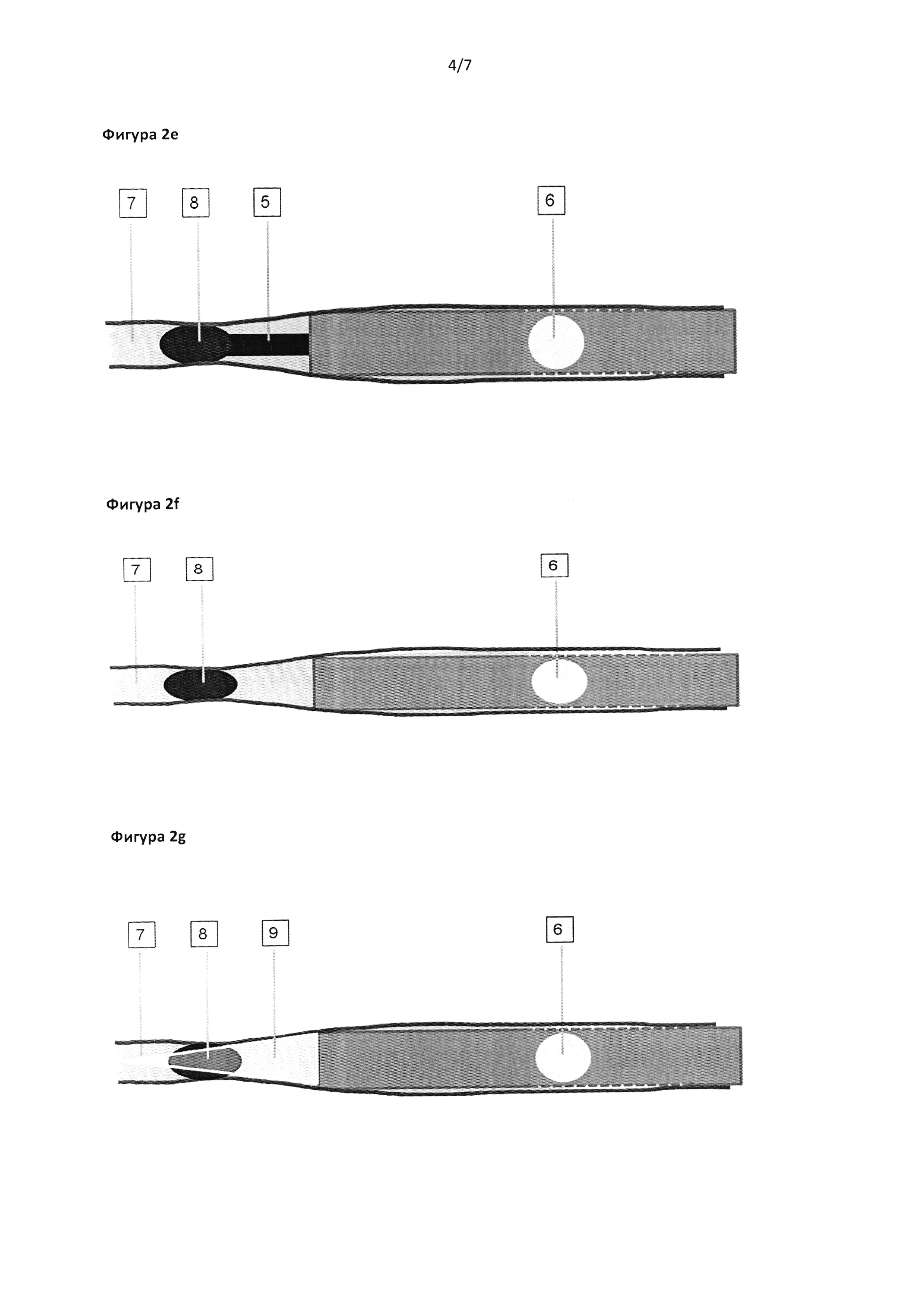
Фигура 2е: На этой стадии спазма клей (8) наносят из трубки (5) для доставки клея.
Фигура 2f: Согласно такому варианту реализации изобретения трубку (5) для доставки клея втягивают обратно для избежания образования мостиков клея между нанесенным слоем (8) клея и катетером (1).
Фигура 2g: После разделения нанесенного слоя клея и катетера включают свет для активации клея (9) в течение определенного времени, необходимого для обеспечения необратимого закрытия вены и плотной подгонки стенок вены.
Фигура 2h: Процедуру продолжают путем сегментарного склерозирования (7) и точечного склеивания (8) до тех пор, пока пораженная вена (10) не будет полностью обработана.
Фигура 2i: Обработанная вена через несколько недель. Указанная вена сузилась вследствие эффектов склеротерапии и точечного активируемого светом склеивания.
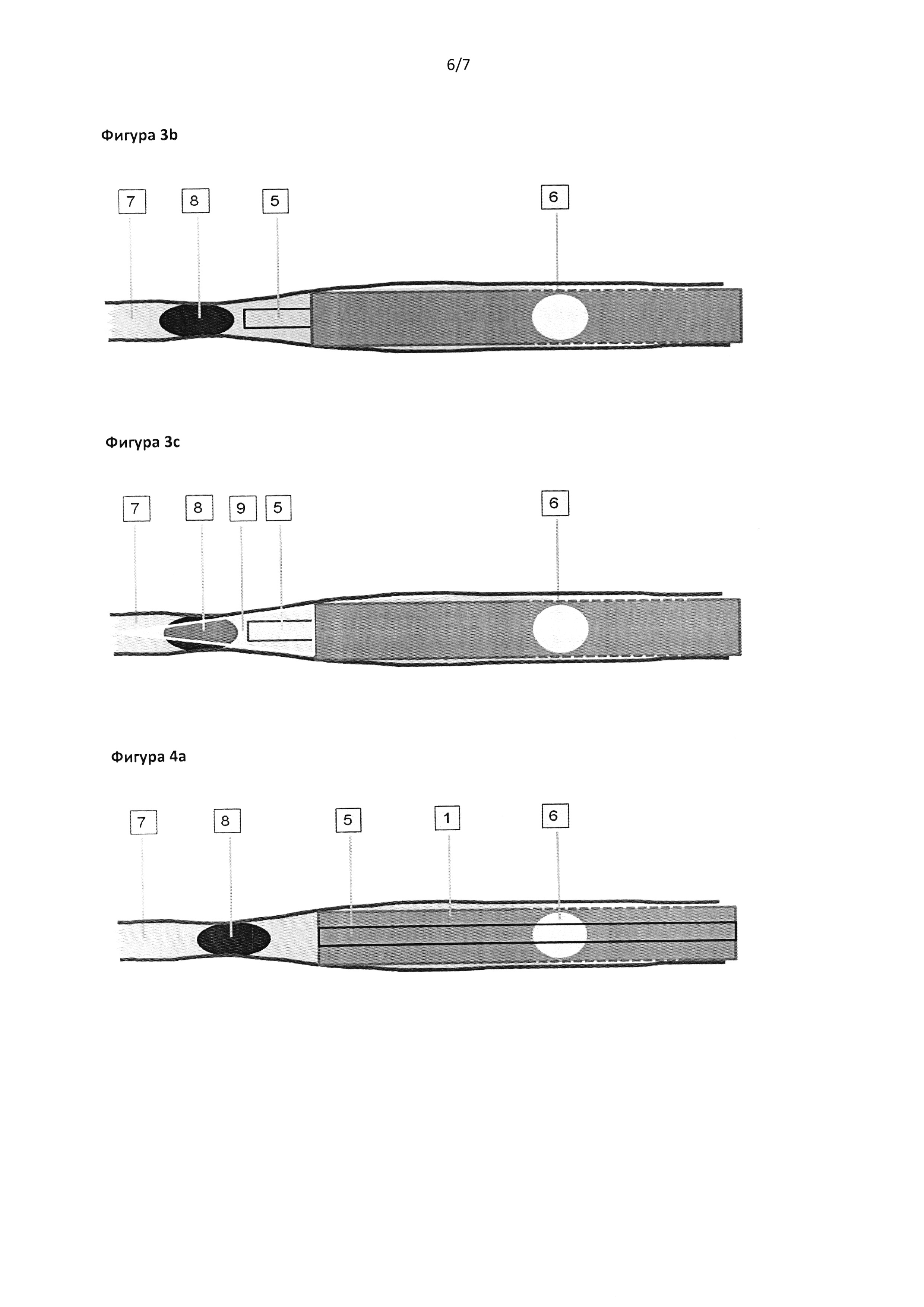
Фигура 3а: В другом варианте реализации катетера используют неподвижное устройство (5) для подачи клея.
Фигура 3b: После нанесения склерозирующего средства (7) и размещения порции клея (8) столбик клея внутри трубки (5) для подачи клея втягивают обратно, чтобы он был вне досягаемости света, активирующего клей.
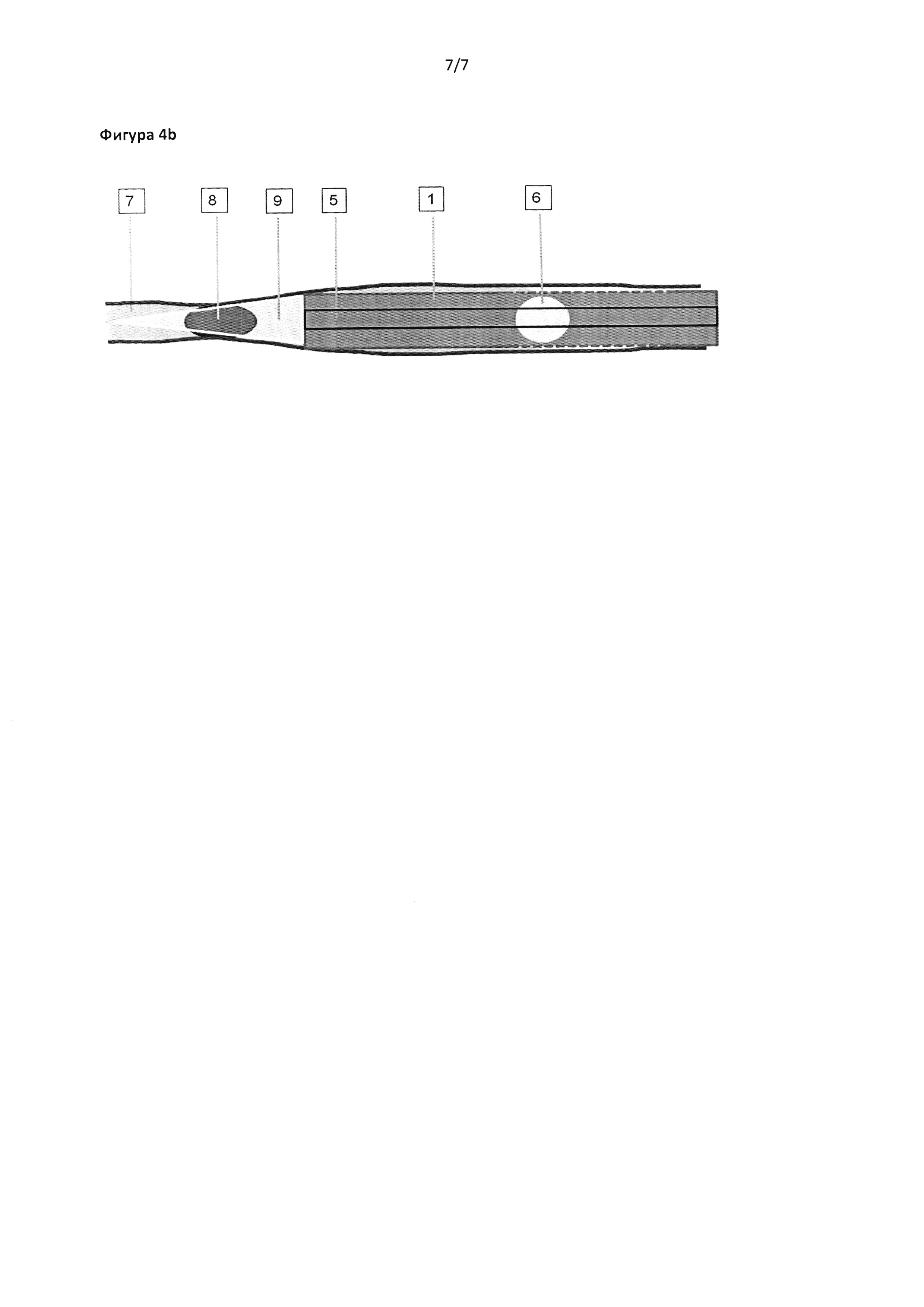
Фигура 3с: Порция клея отверждается под действием активации светом (9).
Фигура 4а: В другом варианте реализации катетера используют неподвижное устройство (5) для подачи клея, не превышающее размера основной трубки (1).
Фигура 4b: Во время активации светом (9) любой другой клей отсутствует в пределах досягаемости светового луча, за исключением предназначенного слоя клея.
Реферат
Группа изобретений относится к области медицины, а именно к флебологии, и предназначена для лечения заболеваний вен. Композиция для склеротерапии содержит фармацевтически приемлемый тканевой клей и склерозирующее лекарственное средство. При этом указанный фармацевтически приемлемый тканевой клей представляет собой инъекционный, светоотверждаемый или светоактивируемый, биологически разлагаемый и/или биологически совместимый клей. Клей представляет собой акрилат и указанный акрилат имеет период полувыведения в ткани, составляющий менее 2 лет. Также обеспечивается катетерное устройство для инъекций для введения указанной композиции, содержащее источник света, где клей и газ загружают в катетер и применяют при последующем болюсном введении. Катетерное устройство дополнительно содержит систему разделения. В других воплощениях представлены набор для склеротерапии, способ склеротерапии и применение светоотверждаемого клея в составе указанной композиции для лечения заболеваний вен. Использование группы изобретений обеспечивает возможность временной окклюзии вены. 5 н. и 10 з.п. ф-лы, 2 табл., 1 пр., 4 ил.

Комментарии