Повязки на рану, содержащие белковый полимер и полифункциональный спейсер - RU2349347C2
Код документа: RU2349347C2
Чертежи

Описание
Это изобретение относится к области ухода за ранами, в частности к образованию белковых полимерных гелей для местного применения в качестве перевязочных материалов для ран. Изобретение также относится к области доставки лекарств, в частности к способам и композициям для доставки терапевтических агентов либо внутривенно, либо местно. Изобретение также описывает способы для получения систем белковых носителей для присоединения или включения терапевтических агентов для лечения состояний болезни, устранения кровотечения и заживления ткани.
Изобретение относится к образованию ряда средств доставки лекарств, от растворимых небольших белковых полимеров до гелей, используя легко выполнимые химические методики. Процесс является простым и масштабируемым для коммерческого применения.
Растворимые полимеры могут быть использованы для нацеливания в специфические участки организма и доставки одного или нескольких терапевтически активных агентов, от небольших лекарств до больших белков. Присоединение активного агента к полимеру происходит предпочтительно путем химического связывания, или путем адсорбции, или путем включения активного агента в полимер в процессе образования. Более чем один агент может быть доставлен одним и тем же полимером.
Изобретение также связано с образованием гелей, пригодных для местного применения, например для поверхностных ран, ожогов и язв, среди прочих применений. Применение может быть либо в качестве включения в повязку, либо как перевязочный материал, или как спрей или раствор, наносимый непосредственно на кожу, которому дают возможность превратиться в гель. Гели могут также быть использованы внутренне, как транспортные средства для медленного или контролируемого высвобождения лекарств, и могут также быть использованы для предотвращения или ингибирования адгезий тканей после хирургических операций, путем образования барьера между смежными тканевыми мембранами.
Изобретение также описывает образование соединений, пригодных для покрытия хирургических инструментов, например катетеров или стентов, и стеклянных или пластиковых плашек для диагностики (например, ELISA, ELISPOT) или для целей обработки, например для использования для роста клеток, включая стволовые клетки.
Изобретение также описывает образование «натуральных» тканевых герметиков с добавлением или без добавления кровоостанавливающих и/или свертывающих кровь агентов.
Подбор перевязочного материала является сложным. Выбор подходящего перевязочного материала для пациента требует внимательной и тщательной оценки раны, знания процессов заживления и специальных знаний свойств многих перевязочных материалов на рынке. Пациент и экономически выгодные факторы должны также приниматься во внимание.
Без внимательного рассмотрения всех факторов выбор перевязочного материала, вероятно, будет произвольным и потенциально неэффективным.
Широко признано, что теплое и влажное окружение раны способствует заживлению и предотвращает дегидратацию ткани и некроз клеток. Большинство современных средств по уходу за ранами создано для обеспечения этих условий.
Существует несколько типов доступных перевязочных материалов по уходу за ранами. Среди тех, что наиболее часто используются, находятся гидрогели, гидроколлоиды, альгинаты, полимерные пленки и полимерные пены. Каждый тип продукта имеет общие характеристики, но конструирование и, таким образом, исполнение каждого отдельного бренда может значительно изменяться в пределах отдельного типа продукта. Унифицированные продукты непригодны для использования с ранами всех типов или на всех стадиях заживления.
Основные характеристики перевязочного материала, которые определяют его пригодность для использования для отдельных типов ран, включают плотное прилегание к телу (желательное для поддержания полной герметизации раны), характеристики адсорбции жидкости и запаха, свойства в обращении, адгезивные свойства и присутствие антибактериальной и кровоостанавливающей активности, где требуется. Другие факторы, которые могут влиять на выбор продукта, включают возможность перевязочного материала вызывать реакции чувствительности, легкость наложения и удаления (важна для минимизации боли и травмы поверхности раны) и интервал между сменами перевязочного материала. Перевязочные материалы не должны терять частицы или волокна, которые могут замедлить заживление или вызвать предрасположенность раны к инфицированию. Они также не должны содержать экстрагируемые вещества, которые могут иметь неблагоприятное влияние на клеточный рост.
Полное покрывание глубокой раны важно для большинства согласованных заживлений ран, гарантируя бактериальный барьер и сниженные скорости инфицирования, уменьшая потерю влаги и минимизируя боль. Чтобы гарантировать, что полость полностью покрыта, перевязочные материалы часто оказывают давление на рану, дополнительно повреждая ткань.
Гидрогелевые перевязочные материалы для ран практически полезны для ожогов, язв и глубоких ран, таких как пролежни, так как, среди прочих эффектов, они облегчают боль, дают ощущение холода и обеспечивают контроль за гидратацией поверхности раны. В отличие от многих альгинатных перевязочных материалов, они не приклеиваются к ране и могут быть легко удалены без предварительного отмачивания. Однако, хотя они легки в использовании, часто трудно полностью заполнить полость раны гидрогелевым перевязочным материалом (например, когда покрывают язвы на ногах), поэтому гидрогелевые перевязочные материалы часто обеспечивают недостаточный барьер против бактерий и не могут быть пригодны для использования на инфицированных ранах.
Несомненно, существует необходимость в улучшенных перевязочных материалах для ран, которые проявляют большее число желаемых характеристик, будучи более «универсальными», по этой причине они пригодны для широкого диапазона типов ран и стадий заживления.
В частности, перевязочный материал с преимуществами гидрогелевого перевязочного материала, но с лучшими антибактериальными свойствами и способностью полностью заполнять полости любой формы и размера обеспечит ценное улучшение по отношению к гидрогелям, используемым в настоящее время.
Более того, перевязочный материал для ран, который также доставляет активные ингредиенты, например лекарства, в место раны контролируемым способом, будет представлять собой дополнительное преимущество. Желаемые активные ингредиенты могут помогать борьбе или защищать против инфекции, уменьшать боль, уменьшать воспаление и/или ускорять заживление, например, путем поддержания свертываемости.
Белок сывороточного альбумина человека (HSA), как было обнаружено, проявляет ряд свойств, которые делают его практически полезным для заживления ран. Например, путем обратимого связывания широкого ряда молекул лекарств HSA может предложить механизм контролируемого выделения для доставки лекарств. HSA связывает ионы металлов (например, цинка, меди и серебра), которые могут быть важны в антиинфекционной обработке ран и могут детоксифицировать место раны и связывать свободные радикалы. Патологическая агрегация тромбоцитов ингибируется HAS, и уровни воспалительных химических соединений (и, следовательно, зуд) также снижаются. HAS не является аллергенным и может естественным образом оказывать антибактериальное/антивирусное действие в месте раны.
Альбумин используется для ряда других медицинских целей, например для увеличения объема крови. WO 99/66964 относится к основанным на альбумине композициям для использования в качестве биоадгезивных веществ, хирургических герметиков и имплантируемых приборов для доставки лекарственных средств и для протезов. Адгезивные свойства этих композиций делают их непригодными для использования в качестве перевязочных материалов для внешних ран, и, хотя композиции предназначены для того, чтобы распадаться в теле, пригодность для внутреннего использования также ограничивается нежелательной адгезией. После хирургических процедур адгезивные вещества, предназначенные для воссоединения поврежденных тканей, могут также присоединять место раны к расположенным рядом тканям/органам и вызывать дальнейшее повреждение.
WO 99/66964 раскрывает использование вспомогательных молекул для изменения скорости и/или степени поперечных сшивок между молекулами альбумина. Утверждается, что дикарбоновые кислоты способны ускорять гелеобразование бычьего сывороточного альбумина. Однако мы обнаружили, что продукты, образуемые в соответствии с WO 99/66964, являются сухими и хрупкими, по сравнению с полимерами по настоящему изобретению. Такие хрупкие продукты непригодны для использования в качестве перевязочных материалов для ран.
В настоящее время был разработан способ получения перевязочного материала для ран, который преодолевает или существенно уменьшает вышеупомянутые и/или другие недостатки, связанные с предшествующим уровнем техники.
В соответствии с первым аспектом изобретения раскрыт способ получения перевязочного материала для ран, где способ включает образование белкового полимера посредством реакции белка с полифункциональным спейсером или его активированным производным.
Перевязочный материал для ран может образовываться на месте (in situ). Термин «на месте» в контексте настоящего изобретения означает, что реакция белка с полифункциональным спейсером для образования перевязочного материала происходит в месте раны. Компоненты композиции могут наноситься на место раны одновременно, или в быстрой последовательности, или компоненты могут быть смешаны непосредственно перед использованием и смесь затем нанесена на место раны.
Образование перевязочного материала на месте является практически преимущественным, потому что перевязочный материал принимает точную форму раны, полностью заполняя полость раны без раздражения ткани, подверженной воздействию. Точная прилегаемость гарантирует, что рана полностью герметизирована.
Вспомогательные вещества могут быть введены в перевязочный материал, образуемый на месте, путем добавления к композиции перед тем, как происходит гелеобразование, или в процессе гелеобразования. В частности, может оказаться предпочтительным покрыть композицию поропроницаемой мембраной, которая будет оберегать полимерный гель от высыхания и, что более важно, сохранять рану влажной. Поропроницаемая мембрана могла бы предпочтительно быть добавлена в конце процесса гелеобразования, так чтобы она плотно и равномерно присоединилась, но не впитывалась бы слишком сильно в композицию.
Перевязочный материал по настоящему изобретению может также быть предварительно сформован (то есть поперечно сшит перед наложением на место раны). Такие перевязочные материалы могут принимать форму повязок, пропитанных белковым полимером, или гелевых пластов, содержащих или не содержащих вспомогательный субстрат. Гели особых форм и размеров могут быть специально сформованы для особых типов ран или частей тела. Альтернативно, перевязочные материалы подходящего размера могут быть нарезаны из больших пластов геля непосредственно перед аппликацией.
Под «белковым полимером» в контексте настоящего изобретения подразумеваются полимерные образцы, составленные из множества завершенных белковых частиц, соединенных вместе связывающими группами, получаемыми от полифункционального спейсера. Нужно понимать, что отдельные молекулы белка являются полимерными в смысле того, что они составлены из цепи аминокислотных остатков, связанных друг с другом. Такая отдельная белковая молекула не является «белковым полимером» в том значении этого термина, как использовано здесь. Вместо этого белковый полимер представляет собой продукт реакции, полученный соединением вместе отдельных молекул белка до образования цепи или матрицы таких молекул, ковалентно соединенных вместе через связывающие группы.
Белки, которые могут быть использованы в настоящем изобретении, включают глобулярные белки и фибриллярные или структурные белки, а также их смеси.
Примеры глобулярных белков включают синтетические или природные сывороточные белки, их природные или синтетические производные, соли, ферментативно, химически или иным способом модифицированные, расщепленные, укороченные или поперечно-сшитые, окисленные или гидролизованные производные или их субъединицы. Примерами сывороточных белков являются альбумин, α-глобулины, β-глобулины, γ-глобулины, фибриноген, гемоглобулин, тромбин и другие факторы коагуляции. Примеры фибриллярных или структурных белков включают синтетические или природные коллаген, эластин, кератин, фибрин и фибронектин, их природные или синтетические производные и их смеси.
Особенно предпочтительными белками являются альбумины.
Там, где белковые полимеры, полученные в соответствии с изобретением, предназначены для введения в тело человека, используемый белок предпочтительно является белком человеческого происхождения, то есть действительно полученным от человека или идентичным (или в основном таким) по структуре белку человеческого происхождения. Особенно предпочтительным белком является сывороточный альбумин человека.
Сывороточный альбумин человека может быть сывороточного происхождения, например, полученный из донорской крови. Сывороточный альбумин человека является легко доступным в качестве продукта фракционированной крови и безопасно использовался в течение многих лет для внутривенного снабжения в качестве увеличителя объема крови. Однако для исключения или снижения риска передачи возможных загрязняющих веществ, например вирусных или других вредных агентов, которые могут присутствовать в продуктах, извлекаемых из крови, а также потенциальные ограничения по ресурсам, связанные с материалами, выделяемыми из донорской крови, белок, например сывороточный альбумин человека, может быть рекомбинантным продуктом, выделяемым из микроорганизмов (включая клеточные линии), из трансгенных растений или животных, которые были трансформированы или трансфицированы для экспрессии белка.
Для ветеринарного использования может быть использован соответствующий нечеловеческий белок животного происхождения. Примеры таких белков включают сывороточный альбумин лошади, сывороточный альбумин собаки и т.д.
Смеси белков, то есть более чем один разный белок, могут быть использованы.
Функциональные группы белковых молекул, с которыми может реагировать спейсер, включают аминогруппы. Предпочтительные белки, таким образом, включают белки с высокой долей аминокислотных остатков, которые содержат свободные аминогруппы, особенно NH2 группы. Одним примером таких аминокислотных остатков является лизин, и, таким образом, особенно предпочтительные белки для использования в изобретении включают белки, содержащие остатки лизина, особенно белки с высокой долей остатков лизина, например, более чем 20 остатков лизина на молекулу белка, более предпочтительно более чем 30 или более чем 40 остатков лизина.
Полифункциональные спейсеры, которые могут быть использованы в настоящем изобретении, включают поликарбоновые кислоты, полиамины, поли(карбокси/амино) соединения (то есть соединения, имеющие многочисленные карбоксильные и амино- группы), полиспирты, поликетоны, полиальдегиды и полиэфиры.
Спейсеры из поликарбоновых кислот или полиаминов являются предпочтительными, более предпочтительны дикарбоновые кислоты и диамины.
Поликарбоновые кислоты включают лимонную кислоту и полиакриловую кислоту.
Предпочтительными спейсерами являются бифункциональные спейсеры, особенно гомобифункциональные спейсеры.
Полиамины включают поли(лизин) и хитозан.
Особенно предпочтительными спейсерами являются дикарбоновые кислоты.
Из дикарбоновой кислоты наиболее предпочтительной является алкилендикарбоновая кислота, особенно молекулы неразветвленной алкилендикарбоновой кислоты формулы
HOOC(CH2)nCOOH,
в которой n равно от 1 до 20. Предпочтительно n равно от 2 до 12, более предпочтительно от 3 до 8.
Предпочтительными спейсерами неразветвленных алкилендикарбоновых кислот являются:
Неразветвленные алкилендикарбоновые кислоты являются особенно полезными спейсерами, поскольку свойства получающихся в результате белковых полимеров могут изменяться просто варьированием длины алкиленовой цепи. В целом, при фиксированной концентрации белка время гелеобразования уменьшается, и полимеры становятся более твердыми, менее резиновыми и более непрозрачными с увеличением длины цепи дикарбоновой кислоты. Химия проста, и широкий диапазон белковых полимерных систем может еще быть получен путем корректировки только небольшого числа переменных. Так же, как и активация высокой степени контроля, свойства полимеров могут быть предугаданы достаточно хорошо из состава и реакционных условий.
Для того чтобы ускорить реакцию спейсеров с молекулами белка, вообще, было бы желательно, чтобы спейсер был активирован, то есть функциональные группы спейсера были превращены в группы с большей реактивностью по отношению к группам белка. Химизм подходящих активаций хорошо знаком специалистам в данной области и включает образование активных эфирных групп.
Одним особым классом активаторов, пригодных для использования со спейсерами из дикарбоновых кислот, являются карбодиимидные соединения, и особенно предпочтительным активатором для использования в изобретении является этил[диметиламинопропил]-карбодиимид (EDC). В одном варианте осуществления изобретения дикарбоновую кислоту (предпочтительно длиной С6-С10) добавляют к раствору белка. EDC добавляют к смеси и дают реакции пройти. Концентрация раствора белка, количественное соотношение дикарбоновой кислоты и белка, количество EDC и время - все являются важными для желаемого результата. EDC активирует COOH-группы и делает возможным связывание со свободными аминогруппами белка.
Контроль реакции означает, что полимеризация может контролироваться, давая растворимые полимеры, нерастворимые частицы или гели из той же самой реакционной смеси. Может быть получена более чем 95% конверсия исходной концентрации белка в полимер и до 100% конверсии в гель.
Исключение спейсера из дикарбоновой кислоты и использование одного EDC (в описанных здесь условиях) приводит только к частичной полимеризации за период от нескольких часов до дней с более низким выходом полимера по сравнению с получаемым, когда используется дикарбоновая кислота.
Вообще, метод в соответствии с изобретением будет проводиться в растворе. Предпочтительно активирующий агент, например, EDC добавляют к раствору белка и дикарбоновой кислоты. EDC может находиться в растворе, например, дистиллированной воды или он может добавляться к раствору белка и дикарбоновой кислоты в форме твердого вещества, например порошка. Хотя, в принципе, также возможно сначала активировать EDC дикарбоновую кислоту и затем добавить активированный спейсер к раствору белка, это, как было обнаружено на практике, не дает таких хороших результатов, как те, что получались при добавлении EDC к смеси белка и спейсера.
Для облегчения нанесения было бы желательно составить рецептуру из реагентов как смешанный сухой порошок, к которому непосредственно перед использованием добавляют воду, солевой раствор или буферный раствор. Белок и дикарбоновая кислота не могут реагировать без добавления EDC, по этой причине, для того чтобы хранить реагенты в качестве порошков без риска преждевременной реакции, было бы желательно держать порошок белка/дикарбоновой кислоты отдельно от порошка EDC, например помещенным в отдельные пакетики. В предпочтительном способе нанесения используется шприц, содержащий раствор белка/дикарбоновой кислоты и порошок EDC, причем раствор и порошок разделены слабой мембраной. Нажимая на поршень шприца, пользователь надавливает на мембрану до разрыва, и реагенты смешиваются непосредственно перед использованием.
Нанесение растворов на место раны может происходить путем заливания, смазывания или распыления растворов.
Было бы желательно для перевязочного материала для ран доставлять в место раны терапевтически активные ингредиенты. Лекарства, такие как антибиотики, антивирусные и противовоспалительные агенты, кровоостанавливающие агенты, болеутоляющие средства и фаги, могут быть добавлены непосредственно к композиции или через носители, которые способствуют адсорбции из места раны, например липосомы. Активные вещества, которые способствуют или улучшают заживление тканей, могут также быть введены, например факторы роста, агенты, препятствующие образованию рубцов, и агенты, способствующие развитию кровеносных сосудов. Путем устранения инфекции и адсорбции экссудатов может быть уменьшен запах зловонных ран. Однако запах ран может также быть уменьшен/устранен путем введения в перевязочный материал агентов (например, древесного угля), которые адсорбируют летучие молекулы, ответственные за запах.
Введенные активные соединения могут доставляться в место раны путем вымывания из геля и путем выделения из геля при его разложении. Ключевым фактором в определении скорости высвобождения активного вещества будет мягкость/жесткость белкового полимера. Активные соединения будут более легко вымываться из более мягкого полимера, потому что они не держатся в нем так эффективно, как поперечно-сшитые молекулы белка. Более мягкие полимеры будут также распадаться с большей скоростью, из-за того, что слабосвязанная структура позволит влаге и ферментам проникать более легко.
В соответствии с другим аспектом данного изобретения обеспечивается перевязочный материал, полученный методами, описанными выше, то есть перевязочный материал, содержащий белковый полимер, образованный посредством реакции белка с полифункциональным спейсером или его активированным производным.
Особенно предпочтительная химия настоящего изобретения, как было также обнаружено, дает белковые полимеры, которые пригодны для ряда других терапевтических применений.
Таким образом, в соответствии с другим аспектом изобретения обеспечивается способ образования белкового полимера, в котором способ включает реагирование белка с дикарбоновой кислотой или ее активированным производным, при условии, что белок не является бычьим сывороточным альбумином.
Дальнейшим аспектом изобретения является способ получения белкового полимера, где способ включает реагирование белка с алкилендикарбоновой кислотой или ее активированным производным.
Предпочтительным белком является альбумин, особенно сывороточный альбумин человека.
При соответствующем выборе реагентов и условий реакции могут быть получены продукты с широким разнообразием свойств. Таким образом, белковый полимер может быть получен в растворимой форме, в форме нерастворимых частиц или в форме геля. Форма геля может варьироваться от очень липких до мягких, но неадгезивных, и жесткость может быть увеличена с определенным шагом до очень жестких гелей с низкой деформацией. Параметры, которые могут быть изменены для достижения этих отличающихся результатов, включают выбор исходного белкового материала, выбор спейсера, концентрации различных реактантов, температуры реакции и продолжительности различных реакционных стадий.
Скорость гелеобразования может также варьироваться в широких пределах от секунд до минут и часов путем контролирования соотношения реагентов, используемых для образования геля, и от температуры.
Реакция гелеобразования наилучшим образом выполняется при умеренно кислых рН (например, рН=5-6). Однако часто предпочтительно увеличить конечный рН геля ближе к физиологическому рН. Существует ряд способов контролирования рН конечного геля. Один подход заключается в изменении молярного отношения белка к дикарбоновой кислоте; низкие уровни дикарбоновой кислоты дают гели с рН, близким к физиологическому. Второй подход заключается в изменении молярного отношения белка к EDC; высокий уровень EDC приводит к гелям с более высокими рН. Для специалистов в данной области очевидно, что возможно найти баланс условий, при которых достигается требуемая консистенция геля для отдельных применений при желаемом рН.
Реакция гелеобразования может быть бифазной реакцией, в которой за первоначальным гелеобразованием следует вторая «вулканизирующая» стадия. Реакция не будет протекать до стадии вулканизации при определенных соотношениях HAS, дикарбоновой кислоты и EDC, например, если уровень EDC слишком низкий. Вместо этого падение рН наблюдается после гелеобразования, и гель повторно растворяется. Полагают, что минимальный процент групп карбоновой кислоты должен быть активирован EDC для того, чтобы направлять реакцию полностью к стадии вулканизации. Полимеры с низким рН вообще менее стабильны, потому что у спейсера и HAS присутствуют непрореагировавшие карбоксильные группы.
Добавление дополнительных соединений может быть полезным. Например, добавление лекарств или других активных соединений для контролируемого высвобождения (как описано в отношении к перевязочным материалам для ран выше) и/или других модифицирующих агентов, которые изменяют свойства полимера, например для удаления воды, для влияния на гибкость, для улучшения адсорбции, ощущения кожей и эстетики, механической и/или адгезивной силы или для изменения профиля деградации белкового полимера.
Этанол, глюкоза и глицерин являются примерами соединений, которые могут быть добавлены к белковым гелям настоящего изобретения.
Этанол, хорошо известный бактериостатический агент, может быть добавлен для улучшения антибактериальных свойств геля, глюкоза - для обеспечения источника энергии и, таким образом, промотирования роста клеток, а глицерин - для помощи в предотвращении потери влаги и поддержания целостности геля в месте раны.
Глюкоза может быть особенно полезна в перевязочных материалах согласно настоящему изобретению для использования при хронических ранах, потому что хронические раны вообще имеют недостаточное кровоснабжение, следовательно, недостаточное снабжение энергией и, таким образом, недостаточный клеточный рост.
Мы обнаружили, что добавление этанола, глицерина или глюкозы улучшает консистенцию полимера путем дополнительного уменьшения хрупкости.
Хотя возможно добавлять модифицирующие агенты к HSA и дикарбоновой кислоте в одну стадию, на практике (используя этанол, глюкозу или глицерин) мы обнаружили, что более эффективно модифицировать процентное содержание HSA c модифицирующим агентом перед смешиванием с остающимся немодифицированным HSA и спейсером из карбоновой кислоты. Таким образом, модифицирующий агент добавляется к водному HSA, и EDC добавляется для содействия реакции. Раствор модифицированного HSA и этанола добавляются к раствору немодифицированного HSA и дикарбоновой кислоты, и затем этот «гелеобразующий раствор» реагирует с EDC до образования геля.
Поскольку модификация белка используется для улучшения физических свойств белкового полимера, модифицированный HSA может найти применение в качестве терапевтического средства. Лишенный лигандов альбумин, например, имеет доступные места связывания, которые могут улавливать и удалять токсины, цитокины и прочее.
Полимеры могут быть получены в растворимой форме, используя низкие концентрации белка. Растворимые полимеры более легко получаются при нейтральных рН. Низкие концентрации и нейтральные рН легко достижимы путем добавления подходящего буфера, например фосфатного буферного раствора. Растворимые полимеры пригодны для парентеральной доставки и имеют ряд применений в качестве средств доставки, например доставки лекарств, доставки контрастирующих агентов, применимых для методов формирования изображения, или как заменитель или усилитель тромбоцитов (доставка кровоостанавливающих агентов).
Использование для лечения онкологических пациентов стимулирует необходимость в заменителях тромбоцитов и/или их усилителях. Одним из побочных эффектов противоопухолевой терапии является резкое уменьшение тромбоцитов, или тромбоцитопения. Состояние в настоящее время лечили переливанием тромбоцитов, выделенных из крови, но, поскольку режимы химиотерапии становятся более агрессивными и поскольку возрастает использование трансплантации костного мозга, требования к тромбоцитам растут. Более того, тромбоциты, выделенные из крови, имеют потенциальную возможность передачи вирусных инфекций, страдают от нестабильности при хранении и вызывают иммунные реакции.
Термины «заменители тромбоцитов» и «усилители тромбоцитов» часто взаимозаменяются либо некорректно, либо для удобства. Под «заменителями тромбоцитов» в контексте настоящего изобретения понимают полное замещение тромбоцитов, которое не обязательно требует присутствия тромбоцитов, полученных естественным путем. «Усилители тромбоцитов», с другой стороны, могут требовать естественного образования пробки тромбоцитов в месте раны (и, таким образом, естественной концентрации тромбоцитов может потребоваться быть выше порогового уровня). Усилители тромбоцитов затем агрегируют в месте тромбоцитной пробки, образуя сгусток, улучшая, таким образом, активность тромбоцитов в условиях тромбообразования. Заменители/усилители тромбоцитов могут быть получены в соответствии с настоящим изобретением путем иммобилизации коагулирующих агентов или других активных пептидных производных на поверхность полимера таким образом, чтобы поддерживать их биохимическую активность. В частности, белковые полимеры настоящего изобретения могут быть конъюгированы с такими агентами, которые промотируют или регулируют адгезию и агрегацию тромбоцитов посредством специфических рецепторов, выраженных на поверхности тромбоцитов. Примером является GPllb/llla рецептор, который взаимодействует с фибриногеном, активными пептидами фибриногена и с фактором фон Виллебранда. Способы конъюгирования с фибриногеном включают тиолирование белкового полимера, активацию фибриногена гидразидом N-[малеимидокапроновой кислоты] и затем конъюгирование активированного фибриногена через тиоловые группы с белковым полимером. Заменитель/усилитель тромбоцитов может доставляться путем внутривенного вливания и активироваться в месте внутренних ран в кровеносных сосудах.
В качестве средства доставки белковые полимеры пригодны для медленного и контролируемого высвобождения лекарств. Более того, при доставке активных агентов или при хорошем качестве их адсорбционных свойств белковые полимеры настоящего изобретения могут быть полезны для применения для детоксификации.
Белковые полимеры могут естественным образом увеличивать доставку лекарств в области организма, в которые трудно нацелиться независимо. Более предпочтительно белковые полимеры могут быть конъюгированы с одним или несколькими нацеливающими компонентами, которые имеют сродство к специфическому месту в теле. Подходящими нацеливающими компонентами могут быть антитела. Антитело может действовать как терапевтический агент по своему праву, или еще один или несколько вторичных агентов могут быть присоединены, например, цитокины радионуклиды для направленной противоопухолевой терапии, или вакцины, или гены. Нацеливающий компонент может иметь сродство к отдельному органу или месту болезни, это может увеличивать доставку вторичного агента в это место и/или может изменять биораспределение этих агентов, например, заставляя агент аккумулироваться в отдельном органе, например в печени, позволяя тем самым этому органу быть целевым.
Подобным же образом белковые полимеры настоящего изобретения могут связываться с нацеливающим компонентом и контрастирующим агентом. Контрастирующими агентами могут быть металлы, используемые для генерации магниторезонансных изображений или ядерных изображений или как терапевтические агенты в радиотерапии.
Нерастворимые белковые частицы могут быть получены при повышенных концентрациях спейсера из дикарбоновой кислоты по отношению к активированному агенту и/или при увеличенном времени реакции при поддержании низкой концентрации белка. Альтернативно нерастворимые частицы могут быть получены при диспергировании растворимого белкового полимера настоящего изобретения в органических растворителях, например в ацетоне.
Используя метод изобретения, может быть получен гель белкового полимера с различной консистенцией (от мягкого до жесткого) и с различной силой адгезии.
Неадгезивные белковые гели по настоящему изобретению пригодны для предотвращения или ингибирования адгезии тканей после хирургических процедур путем образования барьера между соседними тканевыми мембранами. Путем корректировки реагентов и условий реакции скорость деградации может быть выбрана так, например, что полимер может быть разработан, чтобы деградировать к моменту заживления раны. Образование геля на месте будет гарантировать полное покрытие отдельной области желаемой толщиной. Гель может быть нанесен как тонкая пленка, или композиция также может быть отлита в полость, так чтобы заполнить полость.
Альтернативно адгезивные гели по настоящему изобретению могут использоваться для скрепления тканей вместе, например для герметизации включений, разрывов, отверстий и/или жидких или газообразных утечек в тканях. Хорошо понятно, что наложение швов и скрепление нежных тканей вызывает, по сути, их повреждение/ослабление и последующие проблемы, например утечку биологических жидкостей или бактериальные инфекции. Были описаны адгезивные вещества, которые обеспечивают средства связывания тканей. Однако ни одна из этих композиций, как было обнаружено, не является полностью удовлетворительной. Все еще существует потребность в эффективных биоадгезивных композициях, которые действительно безопасны и эффективны и чьи свойства могут легко быть сделаны соответствующими природе ткани и степени повреждения.
Белковые гели также пригодны для покрытия протезов и хирургических инструментов, например катетеров или стентов. Такое покрытие может иметь биоадгезивные свойства, которые способствуют удерживанию прибора в желаемом положении. Использование природных белков в полимерах и, в частности, HSA будет снижать риск отторжения имплантата естественными защитными средствами организма против введения инородного тела.
Белковые полимеры по настоящему изобретению пригодны для покрытия стеклянных и пластиковых плашек для диагностики (например, ELISA, ELISPOT) или для целей обработки, например, при использовании для роста клеток, включая стволовые клетки.
Жесткие гели могут быть получены, используя высокие уровни спейсера из дикарбоновой кислоты и/или EDC. Предусматривается, что жесткие гели по настоящему изобретению могут быть использованы для укрепления костей или хрящей, в качестве имплантатов искусственных костей или в других протезах. Гель может быть получен на месте или преформован в форме.
Далее изобретение будет описано с большими подробностями, только в целях иллюстрации, со ссылкой на следующие неограничивающие Примеры, которые демонстрируют, что:
- Варьирование условий реакций в терминах концентрации и состава компонентов, рН и времени может давать различные формы полимеров.
- Растворимые полимеры более легко получаются при нейтральных рН с низкими концентрациями белка.
- Увеличение уровней спейсера и активатора в реакции будет давать нерастворимые частицы, которые также получаются, когда растворимые полимеры смешиваются с органическими растворителями.
- Увеличение концентрации белка и понижение рН реакции дает гели. Более того, возможно изменять физические характеристики геля (мягко-жесткие и адгезивные свойства) при изменении соотношения компонентов геля, концентрации белка и рН или комбинации этих факторов. Это - важный фактор в получении гелей для терапевтического применения, включая перевязочные материалы для ран, гелевые имплантаты и биоадгезивные вещества.
Сокращения
DMSO - диметилсульфоксид
EDC - этил[диметиламинопропил]карбодиимид
EMCH- гидразид N-[малеимидокапроновой кислоты]
HSA - сывороточный альбумин человека
PBS - фосфатный буферный раствор
Описание чертежей
Фиг.1 показывает выделение растворимого полимера по настоящему изобретению гель-фильтрацией на колонке с Sepharose 6B, используя стандартные условия, в которых поглощение контролировалось при 280 нм.
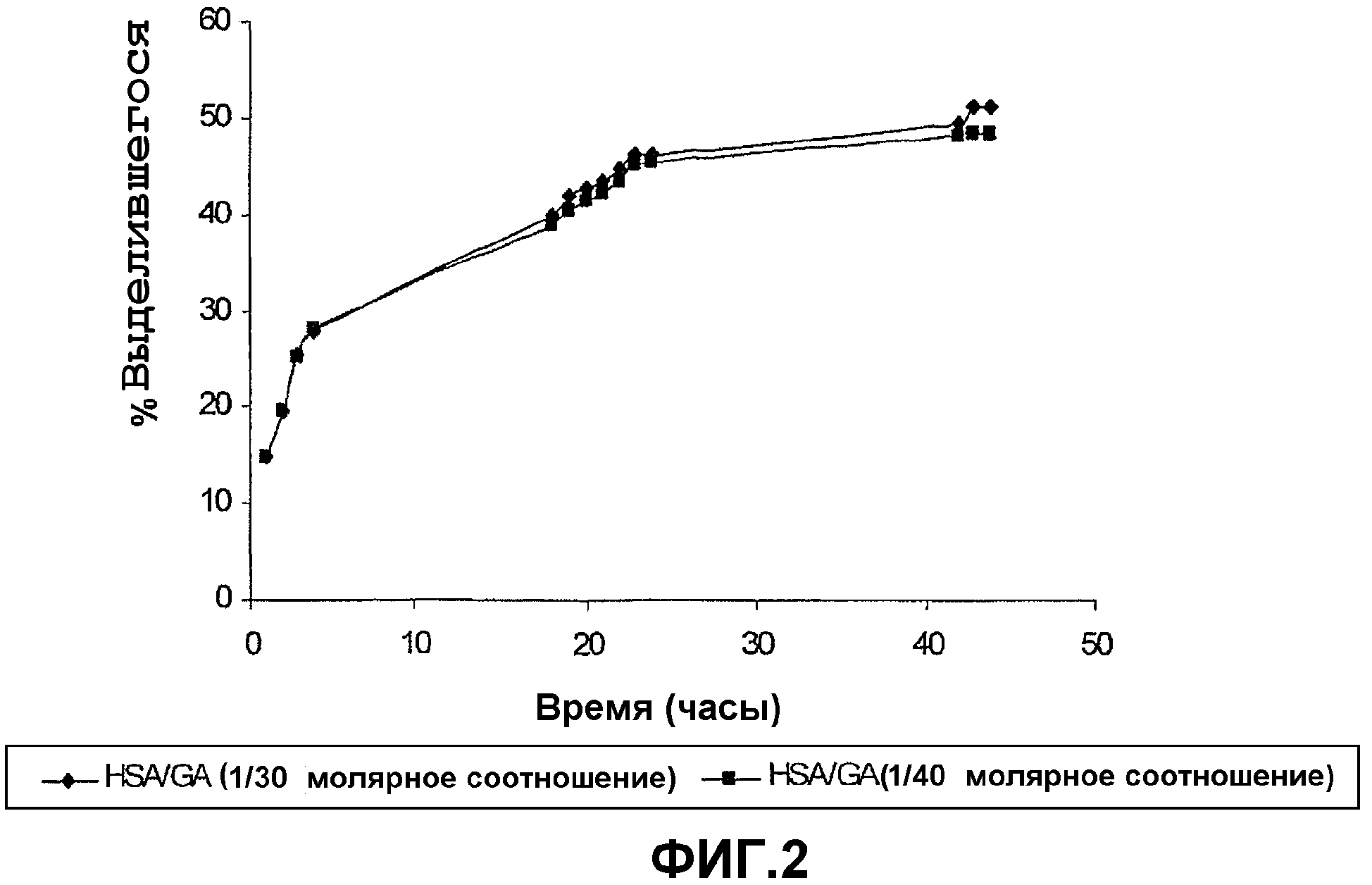
Фиг.2 показывает высвобождение тетрациклина из геля по настоящему изобретению за 45-часовой период.
Пример 1: Образование водорастворимых полимеров
1.1 Образование растворимого полимера HSA с использованием себациновой кислоты
Себациновую кислоту (146 мг) в 2,5 мл DMSO добавляли к 10 мл 20% раствора HSA (BPL, Zenalb) и 20 мл 0,01 М PBS буфера рН=7,4 с перемешиванием до тех пор, пока раствор не становился прозрачным. EDC (276 мг) в 7,5 мл PBS буфера добавляли к раствору и перемешивали 16 часов (в течение ночи). Получающийся в результате раствор центрифугировали для удаления небольшого количества нерастворимого полимера. Растворимую фракцию подвергали гель-фильтрации на колонке с Sepharose 6B, используя стандартные условия. Элюцию белка контролировали при А280нм. Результаты показаны на фиг.1. Мономерный HSA элюируется при ˜340 мл.
1.2 Получение растворимого полимера HSA с использованием адипиновой кислоты
Адипиновую кислоту, 26,3 мг в 1 мл 50% этанола, добавляли к перемешиваемому раствору 5 мл 20% раствора HSA (BPL, Zenalb) и 25 мл 0,01 М PBS буфера рН=7,4 с перемешиванием до тех пор, пока раствор не становился прозрачным. EDC, 69 мг в 4 мл PBS буфера, добавляли по каплям к раствору при перемешивании. Получающийся в результате раствор перемешивали далее 2 часа. Получающийся в результате раствор центрифугировали для удаления небольшого количества нерастворимого полимера. Растворимую фракцию подвергали гель-фильтрации на колонке с Sepharose 6B (как в примере 1.1 выше), используя стандартные условия.
1.3 Связывание фибриногена с растворимым HSA белковым полимером для получения заменителя тромбоцитов
В этом примере заменитель тромбоцитов (усилитель) получали иммобилизацией коагулирующего фактора, фибриногена, на поверхность HSA белкового полимера таким образом, чтобы сохранить биохимическую активность фибриногена. Заменитель тромбоцитов может быть доставлен внутривенным вливанием и активирован в месте внутренних ран в кровеносных сосудах.
1.3.1 Получение растворимого белкового полимера
Себациновую кислоту (30 мг) в 1,25 мл DMSO добавляли к 5 мл 20% раствора HSA (BPL, Zenalb) и 15 мл PBS буфера (0,01 М; рН=7,4) и перемешивали до тех пор, пока раствор не становился прозрачным. EDC (57 мг) в 4 мл PBS буфера добавляли к раствору HSA/спейсера и перемешивали при комнатной температуре 3 часа.
Другие дикарбоновые кислоты с различной длиной углеродной цепи могут быть использованы вместо себациновой кислоты в вышеописанной реакции.
1.3.2 Тиолирование белкового полимера
2-иминотиолан (210 мг) добавляли как твердое вещество к раствору полимера, за которым следовала инкубация в темноте при комнатной температуре в течение 1,5 часов. Полимер затем обессоливали гель-фильтрацией в 0,01 М; рН=7,4 PBS растворе на колонке с Sephadex G25, используя стандартные условия
1.3.3 Активация фибриногена для соединения с полимером
Фибриноген (750 мг) в 10 мл 0,05 М фосфатного буфера смешивали с 2,5 мл 100 мМ перйодата натрия в 0,1 М натрий ацетатном буфере и инкубировали в темноте при комнатной температуре в течение 30 минут. Активированный фибриноген затем обессоливали гель-фильтрацией в 0,01 М; рН=7,4 PBS растворе на колонке с Sephadex G25. Активированные сахара реагировали с гидразидом, в этом примере с гидразидом N-[малеимидокапроновой кислоты] (EMCH), (11 мг) в течение 2 часов в темноте при комнатной температуре.
1.3.4 Конъюгирование активированного фибриногена с белковым полимером
Раствор активированного EMCH-фибриногена добавляли к раствору иминотиолированного полимера и перемешивали в течение ночи. Получающийся в результате раствор центрифугировали для удаления некоторого количества нерастворимого материала и затем подвергали гель-фильтрации в 0,01 М; рН=7,4 PBS растворе на колонке с Sepharose 6B.
Пример 2: Образование нерастворимых частиц
2.1 Образование нерастворимой частицы в водных растворах
Нерастворимые полимерные частицы могут быть получены способами, аналогичными способам примера 1, но при повышенных концентрациях спейсера из дикарбоновой кислоты и EDC и/или увеличенном времени реакции, при поддержании низкой концентрации белка.
HSA (1 мл; 20%; BPL, Zenalb) и глутаровую кислоту смешивали в 3 мл дистиллированной воды в молярном соотношении 1/40. EDC в 1 мл дистиллированной воды добавляли к перемешиваемому раствору в 1/20 молярном соотношении HSA/EDC. Раствор перемешивали 3 часа при комнатной температуре и затем центрифугировали. Осадок промывали дистиллированной водой и затем сушили.
2.2 Образование нерастворимой частицы в органических растворителях
Нерастворимые частицы также могут быть получены диспергированием растворимых полимеров, полученных в примере 1 выше, в органических растворителях, например в ацетоне.
Один объем раствора растворимого полимера (пример 1) смешивали с 10 объемами ацетона в течение 15 минут при комнатной температуре. Получающиеся в результате частицы могут быть собраны центрифугированием или декантированием.
Пример 3: Образование гелей из белковых полимеров
3.1 Получение HSA полимерного геля, используя себациновую кислоту и высокую концентрацию раствора HSA
Раствор 48,5 мг себациновой кислоты в 1 мл DMSO добавляли к 4 мл 20% раствора HSA (BPL, Zenalb). Раствор перемешивали до тех пор, пока он не становился прозрачным. Добавляли раствор 92 мг EDC в 2 мл дистиллированной воды. Конечная концентрация HSA в реакции была 114 мг/мл. Конечное молярное соотношение HSA/себациновая кислота/EDC было 1/20/40.
Получающаяся в результате смесь образовывала гель через 30 секунд после добавления EDC.
Было отмечено, что в эксперименте, эквивалентном этому примеру, но в отсутствие дикарбоновой кислоты, гель образовывался через 2 часа. Свойства гелей в этом случае были непригодны для перевязочных материалов для ран, которые были жесткими, хрупкими по свойствам, что делало бы их трудным для нанесения и удаления. Время гелеобразования на месте было бы слишком продолжительным для практического применения.
3.2 Получение HSA полимерного геля, используя себациновую кислоту и низкую концентрацию раствора HSA
Использовали ту же экспериментальную методику, которая описана в примере 3.1, за исключением того, что конечная концентрация HSA была 72 мг/мл. Конечное молярное соотношение HSA/себациновая кислота/EDC было 1/20/40.
Получающаяся в результате смесь образовывала гель менее чем за 5 минут.
3.3 Получение HSA полимерного геля, используя адипиновую кислоту и высокую концентрацию раствора HSA
Адипиновую кислоту, 35 мг, растворяли в 4 мл 20% раствора HSA (BPL, Zenalb). Добавляли раствор 92 мг EDC в 2 мл дистиллированной воды, как ранее. Конечное молярное соотношение HSA/адипиновая кислота/EDC было 1/20/40.
Получающаяся в результате смесь образовывала мягкий гель спустя 2 минуты.
3.4 Получение геля, содержащего гемоглобин
HSA (300 мг) и гемоглобин (100 мг), себациновую кислоту (24,25 мг в 0,5 мл DMSO), EDC (46 мг в 1 мл дистиллированной воды) и 2 мл PBSa (как выше) смешивали вместе до получения конечной концентрации белка 80 мг/мл.
Гель образовывался спустя 10 минут.
Пример 4: Влияние длины спейсера на характеристики геля
Для того чтобы определить эффекты варьирования длины цепи спейсера из дикарбоновой кислоты, получали белковые полимерные гели, используя HSA при различных концентрациях и четыре различных спейсера из дикарбоновых кислот, с EDC в качестве активатора.
Раствор дикарбоновой кислоты в DMSO (120 мкмолей в 250 мкл или 90 мкмолей в 250 мкл) добавляли к 1 мл 20% водного раствора HSA в молярном соотношении дикарбоновая кислота/HSA 40/1 и 30/1. Раствор перемешивали при комнатной температуре до тех пор, пока он не становился прозрачным. Водный раствор EDC затем добавляли в молярном соотношении EDC/дикарбоновая кислота 2/1. Время гелеобразования и свойства гелей подробно описаны в таблицах 1-3 ниже.
Реакция гелеобразования является бифазной реакцией: за первоначальным гелеобразованием следует дополнительная стадия «вулканизации». Время гелеобразования связано с первоначальным наблюдаемым гелеобразованием, а жесткость геля относится к конечному состоянию геля после «вулканизации».
При каждой концентрации HSA время гелеобразования уменьшается, и гели становятся в общем жестче, менее резиновыми и более мутными с увеличением длины цепи дикарбоновой кислоты. Увеличение концентрации HSA уменьшает время гелеобразования и увеличивает жесткость гелей.
Пример 5: Контроль времени гелеобразования и свойств геля
Различные применения гелей требуют различных времен гелеобразования и консистенций геля. Гели могут быть образованы за секунды или за много большие периоды времени. Гели могут быть чрезвычайно мягкими и липкими или жесткими и резиновыми. Существуют несколько подходов к контролированию этих параметров, и для любого применения могут быть использованы любые из или все следующие подходы. Все гели, описанные ниже, являлись прозрачными, если не утверждалось иное.
5.1 Контроль времени гелеобразования и свойств геля путем варьирования молярного отношения HSA к спейсеру из дикарбоновой кислоты
Гели получали растворением глутаровой кислоты (GA) в водном растворе HSA (20% USP) при комнатной температуре, затем добавлением раствора EDC в дистиллированной воде для активирования реакции гелеобразования. Смеси в процессе гелеобразования осторожно переворачивали несколько раз для того, чтобы быть уверенными в полном смешивании.
Молярное отношение HSA к глутаровой кислоте варьировали от 1/0 до 1/40 при двух концентрациях EDC. Экспериментальные результаты представлены в таблицах 4 и 5 ниже.
Первоначально повышение уровня глутаровой кислоты уменьшает время гелеобразования и дает более жесткие гели. Однако при более высоких уровнях глутаровой кислоты гели становятся нестабильными, что может быть компенсировано увеличением уровней EDC. Это обсуждается в примере 6.
5.2 Контроль времени гелеобразования и характеристик геля при варьировании концентрации HSA
Гели готовили, используя способ, описанный в примере 5.1. Использовали молярное отношение HSA к глутаровой кислоте 1/5 и молярное отношение HSA к EDC 1/70. Концентрацию HSA варьировали от 182 мг/мл до 120 мг/мл. Результаты представлены в таблице 6 ниже.
Уменьшение концентрации HSA приводит к более продолжительным временам гелеобразования и более мягким гелям.
5.3 Контроль времени гелеобразования и характеристик геля при варьировании молярного отношения HSA к EDC
Гели готовили, как описано в примере 5.1. Использовали молярное отношение HSA к глутаровой кислоте 1/10, и конечная концентрация HSA была 166 мг/мл. Молярное отношение HSA к EDC варьировали от 1/35 до 1/80. Результаты представлены в таблице 7 ниже.
Таблица 7 и сравнение таблиц 4 и 5 выше показывает, что более высокие уровни EDC приводят к укорочению времени гелеобразования и более жестким гелям.
5.4 Контроль времени гелеобразования и характеристик геля при добавлении этанола, глюкозы и глицерина
Следующий важный подход заключался в получении «гелеобразующего раствора» HSA при первоначальном модифицировании HSA по реакции с реагентом, таким как этанол, глюкоза или глицерин (каждый из которых имеет -ОН группы), в присутствии низких концентраций EDC. Получение гелеобразующего раствора HSA по реакции с этанолом описано ниже.
5.4.1 Получение гелеобразующего раствора HSA по реакции с этанолом
Этанол добавляли по каплям к перемешиваемому водному 20% раствору HSA. Раствор перемешивали до тех пор, пока он не становился прозрачным. К раствору добавляли твердый EDC (в молярном соотношении HSA/EDC 1/15) и перемешивали при комнатной температуре минимум 2 часа. Глутаровую кислоту растворяли в 20% водном HSA и перемешивали при комнатной температуре в течение 30 минут.
Для получения конечного «гелеобразующего раствора» раствор модифицированный HSA/этанол смешивали с раствором немодифицированный HSA/глутаровая кислота в объемном соотношении 1/1 и перемешивали при комнатной температуре 30 минут. Конечное молярное отношение HSA к глутаровой кислоте было 1/5.
Эта смесь «гелеобразующего раствора» реагировала с EDC до образования геля, как в предыдущих примерах.
Молярное соотношение раствора этанол/HSA варьировали от 1/7 до 1/14, результаты представлены в таблице 8 ниже.
Сначала реакция HSA с этанолом приводит к общему уменьшению времени гелеобразования. При низких уровнях этанола получаются более мягкие гели. Однако более чем 10% об./об. этанола приводит к более жестким гелям. В этих гелях не обнаруживалось никакой хрупкости; несмотря на их жесткость, они оставались эластичными.
Эксперименты, описанные в примере 5.1, были повторены, используя гелеобразующий раствор этанол/HSA, полученный, как описано выше, с 10% об./об. этанола и с молярным соотношением HSA/глутаровая кислота в интервале от 1/0 до 1/40. Результаты представлены в таблицах 9 и 10 ниже.
5.4.2 Получение гелеобразующего раствора HSA при реакции с глюкозой
Гелеобразующий раствор получали, как в примере 5.4.1, заменяя этанол глюкозой, в конечном молярном соотношении HSA/глюкоза 1/15 и конечном молярном соотношении HSA/глутаровая кислота 1/5.
Получаемые гели были мягче, чем аналогичные без глюкозы, а время гелеобразования уменьшалось.
5.4.3 Получение гелеобразующего раствора HSA при добавлении глицерина
Глицерин добавляли к 20% раствору HSA (USP) в объемных процентах от 0 до 16,7. Гели затем получали, используя способ, описанный в примере 5.1.
Добавление глицерина уменьшало время гелеобразования и, как было показано, замедляло высыхание геля, когда его оставляли ненакрытым при комнатной температуре на период в две недели.
5.4.4 Получение гелеобразующего раствора HSA при добавлении этанола или глюкозы непосредственно в гелеобразующий раствор
Если этанол или глюкозу добавляли непосредственно в раствор HSA и затем использовали для образования гелей по способу, описанному в примере 5.1, аналогичный, но менее явный эффект наблюдали по сравнению с примерами 5.4.1 и 5.4.2, соответственно, куда была включена стадия предварительной модификации HSA добавками.
Пример 6: Влияние увеличения уровня дикарбоновой кислоты на стабильность образующегося геля
Повышение уровней глутаровой кислоты в гелеобразующем растворе, как было показано, приводит либо к образованию первоначально от средних до жестких гелей, которые со временем переходят в мягкие гели, или мягких гелей, которые повторно растворяются, образуя вязкие растворы. Контроль этих процессов растворения может быть полезным способом контролирования доставки лекарств в различных применениях, описанных здесь.
Гели получали, следуя методу, описанному в примере 5.1. Молярное отношение HSA к глутаровой кислоте варьировали от 1/5 до 1/35 при двух молярных отношениях HSA к EDC. Результаты представлены в таблице 11 ниже.
Так как соотношение глутаровой кислоты увеличивалось, время гелеобразования уменьшалось вплоть до точки, при которой гель не образовывался. Промежуточные уровни давали гели, которые повторно растворялись, образуя вязкие растворы при стоянии. Это, как было показано, является результатом изменения рН в ходе реакции. При низких уровнях глутаровой кислоты рН гелеобразующего раствора поднимался до 6-7 после добавления EDC, до тех пор, пока не образовывался гель. При высоких уровнях глутаровой кислоты рН первоначально поднимался, затем опять падал до кислого рН 5-6, заставляя мягкий гель повторно растворяться или предотвращая образование геля.
Пример 7: Контролирование рН геля
Реакция гелеобразования наилучшим образом выполняется при кислых рН. Возможно повысить рН конечного геля ближе к физиологическому рН. Существуют два способа контролирования рН геля. Один подход заключается в изменении молярного отношения HSA к дикарбоновой кислоте; низкие уровни дикарбоновой кислоты дают гели с рН ближе к физиологическому. Второй подход заключается в изменении молярного отношения HSA к EDC, большие уровни EDC приводят к гелям с более высокими рН. Для специалистов в данной области очевидно, что возможно найти баланс условий, при которых достигается требуемая консистенция геля для отдельного применения при желаемом рН.
7.1 Контролирование рН гелей, используя различные концентрации дикарбоновых кислот
Гели готовили, растворяя глутаровую кислоту в 20% растворе HSA (USP) и добавляя раствор EDC в дистиллированной воде до получения конечной концентрации HSA 166 мг/мл. Использовали молярное отношение HSA к EDC 1:35 и 1:70. Результаты представлены в таблицах 4 и 5 выше.
При всех этих уровнях EDC гели могут быть образованы, используя молярное отношение HSA к глутаровой кислоте 1:20 или меньше. При более высоких уровнях дикарбоновой кислоты гели являются нестабильными, если они вообще образуются, как обсуждалось в примере 6. рН Величины гелей в интервале от 5,3 до 7,6 были получены.
7.2 Контролирование рН гелей, используя различные уровни EDC
Гели готовили, растворяя глутаровую кислоту в 20% растворе HSA (USP) в молярном отношении HSA к глутаровой кислоте 1:10. Растворы EDC в дистиллированной воде добавляли до получения конечной концентрации HSA 166 мг/мл и молярных отношений HSA к EDC от 1:35 до 1:80. Результаты представлены в таблице 6 выше.
рН Величины гелей от 5,6 до 6,6 были достигнуты при варьировании уровней EDC. Это также поддерживается сравнением данных таблиц 4 и 5 выше. Увеличение уровней EDC в гелеобразующей смеси также приводит к более коротким временам гелеобразования и более жестким гелям.
Пример 8: Получение биоадгезивных веществ
Биоадгезивные гели готовили либо как жидкость, либо как сухой порошок. Силу эластичности измеряли, помещая жидкость или порошок между двумя кусочками мяса (3 см3 бифштекса). Один кусочек мяса присоединяли к гребню и удерживали на месте зажимом и штативом. Грузы присоединяли ко второму нижнему кусочку мяса для измерения силы эластичности. Мясо инкубировали при 37°С в течение 5 минут перед добавлением грузов.
8.1 HSA (4 мл 20%; BPL, Zenalb) смешивали с глутаровой кислотой и EDC в соотношении 1/50/100 соответственно.
Измеренная сила эластичности была 63 мг/мм2.
8.2 Рецептуру сухого порошка готовили путем смешивания 200 мг лиофилизованного HSA (Sigma) с глутаровой кислотой и EDC в молярном соотношении или 1/50/100 или 1/60/120 соответственно.
Сила эластичности возрастала с возрастанием соотношения спейсера и EDC.
1/50/100 смесь давала силу эластичности ˜180 мг/мм2.
1/60/120 смесь давала силу эластичности ˜280 мг/мм2.
Пример 9: Высвобождение лекарств из геля (тетрациклин)
К 1 мл 20% раствора HSA добавляли 150 мкл 10 мг/мл раствора тетрациклина в этаноле. Гели образовывали, как описано в предыдущих примерах выше, используя молярное соотношение HSA/глутаровая кислота/EDC 1/30/60 или 1/40/80 соответственно. Гель оставляли на ночь, перед тем как поместить в пузырек, содержащий 5 мл дистиллированной воды. Высвобождение тетрациклина со временем измеряли при 364 нм (фиг.2).
Пример 10: Стабильность HSA гелеобразующих растворов
10.1 Стабильность модифицированного этанолом HSA гелеобразующего раствора при 4°С и при комнатной температуре
Модифицированный этанолом HSA гелеобразующий раствор (полученный, как описано в примере 5.4.1) фильтровали в стерильных условиях через 0,22 мкм фильтр. Половину раствора хранили при 4°С, а половину - при комнатной температуре в запаянных пузырьках. В 0, 7, 21 и 28 дни аликвоты растворов реагировали с водным раствором EDC, и время гелеобразования, характеристики геля, рН и стабильность геля сравнивались.
Все полученные гели выдерживали в запаянных пузырьках при 37°С 14 дней для сравнения стабильности гелей; ни один из них не проявил каких-либо признаков порчи или бактериального роста за этот период.
Эти данные демонстрируют, что модифицированные этанолом HSA гелеобразующие растворы стабильны, по меньшей мере, 4 недели при 4°С и при комнатной температуре.
10.2 Стабильность модифицированного глюкозой HSA гелеобразующего раствора при 4°С и при комнатной температуре
Вышеописанный эксперимент готовили, используя модифицированный глюкозой HSA гелеобразующий раствор (как описано в примере 5.4.2). Раствор, хранимый при комнатной температуре, как было показано, оставался стабилен в течение 2 недель. Раствор, хранимый при 4°С, как было показано, оставался стабилен в течение, по меньшей мере, 4 недель.
10.3 Стабильность раствора HSA/глутаровая кислота при 4°С и при комнатной температуре
Раствор HSA (200 мг/мл) и глутаровой кислоты (молярное соотношение HSA/глутаровая кислота 1/37), как было показано, используя методики, описанные в примере 10.1, оставался стабилен в течение, по меньшей мере, 4 недель при 4°С и при комнатной температуре.
10.4 Стабильность раствора HSA/адипиновая кислота при 37°С и при комнатной температуре
Раствор HSA (200 мг/мл) и адипиновой кислоты (молярное соотношение HSA/адипиновая кислота 1/30), как было показано, используя методики, описанные в примере 10.1, оставался стабилен в течение, по меньшей мере, 3 недель при 37°С и при комнатной температуре.
Пример 11: Стабильность образующихся гелей
Гели с молярным соотношением HSA/глутаровая кислота/EDC 1/40/80, 1/50/100, 1/60/120 и 1/70/140 выдерживали при 4°С, комнатной температуре и при 37°С в запаянных пузырьках в течение 6-недельного периода. Все гели, хранимые при 4°С и при комнатной температуре, оставались стабильными в течение 6 недель, хотя мутность гелей с высоким молярным соотношением слегка повышалась после 4 недель. Все гели, хранимые при 37°С, оставались стабильными в течение 2 недель. В течение 3 недели эти гели увеличивали жесткость и становились более мутными. Ни один из гелей не показывал никаких признаков бактериального роста.
Пример 12: Нанесение геля на месте
Лунки (2 см3 и 0,5 см глубиной) нарезали в куске свиной кожи в искусственных условиях. Гели (полученные, как описано в примере 5.1 выше) формировали на месте в лунках, покрывая паропроницаемой мембраной (например, Tagaderm, 3M) и инкубировали при 37°С. Гели оставались мягкими и не высыхали. Они легко удалялись из «раны», будучи присоединенными к мембране.
Реферат
Изобретение относится к медицине. Раскрыт способ получения перевязочного материала для ран. Способ включает получение белкового полимера посредством реакции белка с полифункциональным спейсером или его активированным производным. Полифункциональным спейсером предпочтительно является поликарбоновая кислота, особенно дикарбоновая кислота; и белковые полимеры, полученные с использованием таких спейсеров, пригодны для широкого диапазона терапевтических применений, включая использование в качестве перевязочных материалов для ран, для доставки терапевтически активных агентов в организм и в качестве биоадгезивов и герметиков. Перевязочный материал принимает точную форму раны, полностью заполняя полость раны без раздражения ткани, подверженной воздействию. 5 н. и 22 з.п. ф-лы, 2 ил., 13 табл.
Формула
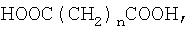
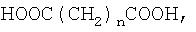
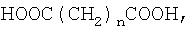
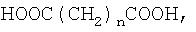

Комментарии