Желатин-трансглутаминазные кровоостанавливающие повязки и изолирующие средства - RU2464015C2
Код документа: RU2464015C2
Чертежи











Описание
ОБЛАСТЬ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к кровоостанавливающим повязкам, средствам и агентам, которые содержат рассасывающиеся или нерассасывающиеся вещества и/или коагуляционные белки. Кровоостанавливающие средства являются полезными для лечения раненой ткани.
ПРЕДШЕСТВУЮЩИЙ УРОВЕНЬ ТЕХНИКИ
Контроль кровоизлияния (кровотечения) является критическим этапом при первой помощи и в полевой травматологической службе. К сожалению, не является редкостью возникновение избыточного кровотечения или летального кровоизлияния из открытого места (J.M.Rocko et al.). (1982). J. Trauma 22:635). Данные о смертности в ходе вьетнамской войны свидетельствуют, что 10% боевых потерь имели место вследствие неконтролируемой кровопотери из конечностей. Вплоть до одной трети смертей от потери крови во время вьетнамской войны можно было бы предупредить путем использования эффективных способов регулирования кровотечения в полевых условиях (SAS/STAT Users Guide, 4th ed. (Gary, N.C.: SAS Institute Inc; 1990)).
Хотя статистика смертности от бытовых ран не предоставляет точные цифры догоспитальных смертей от кровотечений из конечностей, судебные отчеты и несистематическая информация указывают на аналогичную частоту (J.M.Rocko et аl.). (1982). J. Trauma 22:635). Эти данные позволяют предположить, что существенное увеличение выживания может быть достигнуто при догоспитальном использовании простого и эффективного способа контроля кровоизлияния. К сожалению, такой способ не был успешно продемонстрирован при использовании имеющихся в продаже кровоостанавливающих средств.
Особо, хирургическое закрытие раны достигается в настоящее время с помощью швов и скобок, которые облегчают заживление посредством стягивания тканей вместе. Однако очень часто они не обеспечивают достаточного изолирования, необходимого для предотвращения истечения жидкости. Таким образом, существует огромная, неудовлетворенная медицинская потребность в средствах и способах для предотвращения истечения после операции, включая подтекания, которые часто происходят вдоль скобки и линии шва. Такие средства и методы нужны в качестве дополнения к швам или скобкам для остановки кровотечения или остановки истечения других жидкостей при реконструкциях периферических сосудов, реконструкциях твердой мозговой оболочки, при торакальных, сердечно-сосудистых, легочных, неврологических и желудочно-кишечных хирургических операциях.
В настоящее время большинство из имеющихся в продаже средств, останавливающих кровотечение высокого давления, являются номинально, если вообще являются, адгезивными. Хорошими примерами таких средств являются повязка QuikClot® ACS™ (Z-Medica, Wallington, CT) и HemCon™ (HemCon, Portland, OR), два кровоостанавливающих средства, которые в настоящее время поставляют членам вооруженных сил США. Кристаллы минерала цеолита в губке QuikClot вызывают адсорбцию молекул воды в крови, таким образом концентрируя факторы свертываемости крови и ускоряя свертывание крови. Смесь хитозана, которая составляет бандаж HemCon, имеет положительный заряд и притягивает эритроциты, которые имеют отрицательный заряд. Эритроциты втягиваются в повязку, образуя уплотнение поверх раны и стабилизируя раневую поверхность.
Бандажный продукт HemCon, указанный выше, был разработан в попытке предложить догоспитальный контроль кровоизлияния, и он уже продемонстрировал ограниченный успех в полевых условиях. Однако хитозановая матрица, которая образует бандаж HemCon, может насыщаться кровью и быстро выходит из строя при столкновении с активным потоком крови или через 1-2 часа при столкновении с умеренным потоком крови из раны (B.S.Kheirabadi et al. (2005). J. Trauma. 59:25-35; A.E.Pusateri et al. (2006). J. Trauma 60:674-682). Кроме того, бандажный пластырь HemCon доступен только в виде жесткого пластыря, который нельзя легко подогнать к неровным ранам, что дополнительно ограничивает его применение.
Другими кровоостанавливающими средствами на основе полисахаридов, которые были предложены для использования в контроле кровоизлияния, является RDH™ (ацетилглюкозамин), TraumaDEX™ (МРН (микропористые полисахаридные гемосферы)), и Chitoskin™ (хитозан и желатин). Однако ни один из этих типов повязок не был способен постоянно демонстрировать отсутствие недостатков при значительном потоке крови. Другие внедренные в последнее время кровоостанавливающие средства включают Celox™ (кристаллы хитозана) и WoundStat™ (TraumaCure Inc., MD) (гранульная смесь минерала смектита и суперпоглощающего полимера). Однако оба эти продукта быстро разбухают с заполнением раневых участков, что делает их подходящими только для ускорения свертывания крови в отдельных типах ран, и представляющими опасность ослабления или даже остановки течения крови в близлежащих кровеносных сосудах.
QuikClot ACS™, также упоминаемый выше, также показал эффективность в остановке кровоизлияний умеренной степени. Однако механизм адсорбции воды минералом цеолитом не может быть осуществлен без высвобождения большого количества тепла. По этой причине применение QuikClot ACS™ ведет к высоким температурам и тяжелым ожогам на пораженном участке, что повреждает участки окружающих тканей и значительно усложняет дальнейшее лечение (А.Е.Pusateri et al. (2006). J. Trauma. 60:674-682). Очевидно, более идеальным является кровоостанавливающий раствор без такого существенного побочного эффекта. Хотя QuikClot разработал минеральную смесь, которая высвобождает меньше тепла при применении, эффективность более холодной смеси является недостаточной для помощи при серьезной травме. Кроме того, ни исходная, ни более холодная минеральная смесь не могли остановить активное артериальное кровотечение.
Все вышеуказанные изделия основаны на каскаде естественного свертывания для контроля истечения жидкости из раненого участка. По этой причине они все полезны только для остановки потока крови, и каждое - только в условиях, подходящих для данного конкретного средства. Общая изоляция раневого участка, в частности поврежденных участков с истечением жидкостей, отличных от крови, выходит за пределы возможностей этих продуктов.
КРАТКОЕ ИЗЛОЖЕНИЕ СУЩНОСТИ ИЗОБРЕТЕНИЯ
Существует потребность и было бы полезно иметь нетоксичное адгезивное вещество, которое можно было бы применять для широкого ряда применений, включая, без ограничения ими, хирургические применения, контроль за кровоизлиянием и контроль за кровотечением из раны. Также существует потребность и было бы полезно иметь нетоксичное адгезивное вещество, которое можно было бы использовать в качестве части кровоостанавливающего бандажа. Также существует потребность и было бы полезно иметь нетоксичное адгезивное вещество, которое было бы полезно в качестве хирургического изолирующего средства.
Настоящее изобретение преодолевает недостатки предшествующего уровня техники, предлагая адгезивный материал, который содержит сшиваемый белок и нетоксичное вещество, индуцирующее сшивание сшиваемого белка. Предпочтительно сшиваемый белок включает желатин и любой вариант желатина или вариантный белок, как описано в данном описании изобретения. Возможно и предпочтительно нетоксичное вещество включает трансглутаминазу (TG), которая возможно может содержать микробную трансглутаминазу (mTG). Согласно некоторым воплощениям настоящего изобретения адгезивное вещество предложено в виде бандажа, который предпочтительно адаптирован для использования в качестве кровоостанавливающего бандажа. Согласно другим воплощениям предлагается изолирующее средство, которое предпочтительно адаптировано для использования в качестве хирургического изолирующего средства.
При воздействии трансглутаминазы желатин, представляющий собой денатурированную форму белкового коллагена, быстро сшивается с образованием колеблющегося геля. Процесс гелеобразования, который имеет место, чрезвычайно похож на позднюю стадию каскада естественного свертывания, которое претерпевает фибрин при вступлении в контакт с фактором XIII и кальцием. Кроме того, полученный гель демонстрирует адгезивную способность, очень похожую, если не выше, чем у фибриновых клеев (M.K.McDermott, Biomacromolecules. 2004 Jul-Aug; 5(4): 1270-9).
В настоящем изобретении используются аналогии сшивания желатин-TG с каскадом свертывания фибрина для имитации превосходных кровоостанавливающих характеристик улучшенного фибринового средства. Замена фибрин-тромбинового сэндвича фибринового бандажа сэндвичем желатин-TG приводит к созданию новой, недорогой и стабильной повязки, которая может контролировать кровоизлияние без существенных побочных эффектов. Такой новый бандаж максимально увеличивает адгезивные свойства смеси желатин-TG, допуская контролируемое прикладывание большого количества смеси к раневому участку способом, который предупреждает распространение TG на области, не контактирующие с бандажом. По этой причине такая синергическая технология является достижением как в области улучшенных фибриновых повязок, так и в области адгезии желатина-TG.
В отличие от матрицы из свернувшегося фибрина дополнительным преимуществом матрицы из желатина-TG является то, что она может быть растворена специально, с использованием специфической протеазы, то есть иначе не является физиологически реакционно-способной (T.Chen, Biomacromolecules. 2003 Nov-Dec; 4(6): 1558-63). Таким образом, наряду с тем, что желатин-mTG кровоостанавливающая сэндвич-повязка может копировать действие фибрин-тромбиновой кровоостанавливающей сэндвич-повязки, она может быть удалена по мере необходимости без осложнения.
Кроме его применения в травматологии в качестве кровоостанавливающего средства для полевых условий, настоящее изобретение кровоостанавливающего средства на основе желатина-TG является очень перспективным в контролировании активного артериального кровотечения во время хирургической операции, кровотечения после эндоваскулярной катеризации, или истечения других физиологических жидкостей после травм или хирургической операции.
К настоящему времени, хотя гелеобразующие свойства сшитого желатина-TG и адгезивная способность сшивки желатин-TG были по отдельности изучены, не было предпринято попыток использовать обе характеристики вместе для получения кровоостанавливающего или тканевого изолирующего средства.
Адгезивное применение соединения желатин-TG было продемонстрировано in vivo на модели сетчатки крысы, где каплю смеси желатин-TG использовали для фиксации сетчатки (T.Chen, J Biomed Mater Res В Appl Biomater. 2006 Мау; 77(2):416-22).
Также исследовалось применение геля желатин-TG в качестве каркаса для клеточной терапии (патент US 5834232. Also Ito A, J Biosci & Bioeng. 2003; 95(2): 196-99. Also, Broderick EP, J Biomed Mater Res В Аррl Biomater. 2005 Jan 15; 72(I):37-42).
Хотя данные исследования подчеркивали безопасность физиологического применения смеси желатин-TG, каждое из них использовало только одну из характеристик сшивки желатин-TG, и не сообщалось о достижении или не предполагалось достижения остановки кровотечения и изоляции ткани, представленных в настоящем изобретении.
Использование смеси желатин-TG для остановки кровотечения или истечения жидкости также является показателем значительного достижения по сравнению с рядом документально подтвержденных попыток использовать трансглутаминазы, в частности тканевую TG, независимо в качестве хирургических адгезивов (среди прочего патент US 5736132, патент US 61908196). Использование желатина в качестве субстрата для TG добавляет механический каркас к активности TG, что обеспечивает ряд преимуществ по сравнению с использованием одной TG. TG, взятую вместе с желатином, можно применять более точно, чем одну TG, можно приспособить точно к области раны, и обеспечить регулируемую биоабсорбируемость.
Настоящее изобретение преодолевает недостатки предшествующего уровня техники. В растворах из предыдущих попыток использовали многие формы модифицированных и немодифицированных желатиновых матриц для остановки кровотечения в степени от легкой до умеренной. Однако способ образования, in situ, матрицы из прочно сшитого желатина, которая может контролировать активное артериальное кровоизлияние или другие значительные истечения физиологических жидкостей, отсутствовал. Способ, такой как сшивание желатин-TG, который может сформировать прочную желатиновую матрицу in vivo, увеличивает механическую прочность желатиновой матрицы и делает ее пригодной для регулирования артериального кровотечения высокого давления и других истечений физиологических жидкостей. Кроме улучшенного способа сшивания, настоящее изобретение включает много других инноваций, которые обеспечивают его преимуществами по сравнению с существующими кровоостанавливающими материалами на основе желатина. Неограничивающий, иллюстративный, неполный перечень представлен ниже:
1) In-situ сшивание цепей желатина и эндогенного коллагена тканевой ЕСМ (внеклеточной матрицы) создает прочный кровоостанавливающий барьер для жидкостей.
2) Желатин и TG могут более эффективно действовать на остановку кровотечения или остановку жидкости посредством применения в лиофилизированной форме и восстановленными с помощью крови или другой биологической жидкости.
3) Смесь желатин-TG в лиофилизированной форме имеет увеличенный срок годности.
4) Желатин и TG в многослойной, лиофилизированной форме обеспечивают более быстрое восстановление, что является полезным в среде потока жидкости с высоким давлением.
5) Добавление механической основы к основной смеси желатин-TG увеличивает кровоостанавливающую или регулирующую жидкость способность смеси, замедляя жидкости и обеспечивая большее время сшивания желатина-TG, и блокирует истечения жидкости.
Согласно некоторым предпочтительным воплощениям настоящего изобретения смесь желатин-mTG является частично сшитой перед прикладыванием к раневому участку или перед лиофилизацией. В другом воплощении не сшитый желатин или mTG присутствуют вместе с частично сшитым желатином-mTG.
Кровоостанавливающие бандажи, которые являются по природе адгезивными, известны в данной области техники, и пока еще имеют много осложнений и недостатков в применении. Например, широко распространенное кровоостанавливающее применение фибриногена и тромбина было обычным в последний год второй мировой войны, но было прекращено из-за передачи гепатита (D.B.Kendrick, Blood Program in WW II (Washington, DC: Office of the Surgeon General, Department of Army; 1989), 363-368).
Фибриногеновые повязки впервые использовались хирургами-травмотологамим во время первой мировой войны, когда Грей и его сотрудники изготовили предварительно полимеризованные фибриновые пластины и порошки. Во время второй мировой войны вооруженными силами США и Американским Красным Крестом был создан фибриновый клей с предварительно полимеризованными подобными стироформу пластинами фибрина и фибриновыми пленками. Повязки на основе фибрина продемонстрировали значительное различие во времени регулирования кровотечения и уменьшении кровопотери по сравнению с контролем (Jackson, М., et аl. (1996). J. of Surg. Res. 60:15-22; и Jackson, M., et al. (1997). Surg. Forum. XL. VIII:770-772).
Несмотря на эффективность фибриногеновых повязок в регулировании кровоизлияния, использование фибриногеновых повязок было прекращено, так как часто передавались заболевания, переносимые кровью и сывороткой, такие как гепатит и ВИЧ, поскольку средства содержали очищенный человеческий или животный фибриноген или другие очищенные продукты из крови (Holcomb, J.В., et аl. (1997). Surgical Clinics of North America. 77:943-952).
В последние несколько лет, однако, возобновился интерес к продуктам на основе фибрина для лечения ран, так как методы очистки плазмы значительно снижали риск заболеваний, переносимых кровью и сывороткой.
Красным Крестом США описана кровоостанавливающая сэндвич-повязка, которая содержит слой тромбина, помещенного между слоями фибриногена (смотри, например PCT/US99/10952, патенты US 6054122, 6762336). Такая кровоостанавливающая повязка продемонстрировала больший успех в лечении потенциально летальных травматических ран (E.M.Acheson. (2005). J. Trauma. 59(4):865-74; discussion 874-5; B.S.Kheirabadi. (2005). J. Trauma. 59(I):25-34; discussion 34-5; A.E.Pusateri. (2004). J. Biomed. Mater. Res. В Аррl. Biomater. 15; 70(1):114-21). Фактически в исследованиях на свиньях фибриновая сэндвич-повязка значительно превзошла продукты HemCon и QuikOot в лечении потенциально летальных травматических ран, демонстрируя коэффициент выживаемости >75% через 2 часа, против 0% выживаемости, когда использовали стандартный армейский полевой бандаж, бандаж HemCon или порошок QuikClot.
Хотя такие повязки можно использовать в способах лечения раненой ткани, такие обычные сэндвич-повязки могут расслаиваться, в результате чего кромки слоев повязки больше не прилипают друг к другу. Такое расслоение может приводить к пониженному взаимодействию слоев компонентов повязки, с уменьшением эффективности повязки в предупреждении кровоизлияния.
Была описана улучшенная кровоостанавливающая сэндвич-повязка на основе фибрина, которая содержит множество слоев, содержащих рассасывающиеся вещества и/или коагуляционные белки. Конкретно, повязка (смотри PCT/US03/28100, патентная заявка US 0060155234) содержит слой тромбина, расположенный между первым и вторым слоями фибриногена, где слой тромбина является не одинаковым по протяженности с первым и/или со вторым слоем фибриногена.
Несмотря на достижения в фибриновых раневых повязках, такие бандажи страдают многими недостатками. Лиофилизированный фибриноген, используемый для изготовления бандажа, должен быть очищен от плазмы человеческой крови. Так как это является дорогостоящим и тонким процессом, полученный фибриногеновый бандаж является исключительно дорогостоящим в получении и имеет очень короткий срок годности при комнатной температуре. Чем больше фибриногена добавляют к основе, тем лучше бандаж работает в отношении остановки кровотечения. Однако чем больше фибриногена добавлено к основе, тем более дорогостоящей является бандаж. Кроме того, большие количества фибриногена в основе бандажа могут способствовать ломкости бандажа, делая его ломким и неудобным в работе с ним. Как результат данных ограничений, в продаже отсутствует эффективный фибриновый бандаж.
Таким образом, хотя улучшенная фибриновая повязка могла регулировать кровоизлияние без существенных побочных эффектов и восполняет вышеуказанный недостаток в активной остановке крови травматологической службой, ограничения по стоимости и стабильности являются серьезными недостатками в использования этого типа повязки.
Жидкие фибриновые изолирующие средства или клеи использовали в течение многих лет в качестве операционного вспомогательного средства для контроля за кровоизлиянием (J.L.Garza et al.). (1990). J. Trauma. 30:512-513; H.B.Kram et al. (1990). J. Trauma. 30:97-101; M.G.Ochsner et al. (1990). J. Trauma. 30:884-887; T.L.Matthew et al. (1990). Ann. Thorac. Surg. 50:40-44; H.Jakob et al. (1984). J. Vase. Surg. 1:171-180). Кроме того, одиночные изолирующие средства из донорского фибрина также клинически широко использовали в различных хирургических ситуациях (W.D.Spotnitz. (1995). Thromb. Haemost. 74:482-485; R.Lerner et al.). (1990). J. Surg. Res. 48:165-181).
Хотя в настоящее время в хирургической области используют ряд абсорбируемых хирургических кровоостанавливающих средств, ни один из существующих продуктов не является достаточно прочным для обеспечения механической и биологической поддержки, необходимой для регулирования серьезного кровоизлияния или интенсивного течения других биологических жидкостей.
Существующие в настоящее время кровоостанавливающие бандажи, такие как коллагеновые раневые повязки (INSTAT™, Ethicon, Somerville, NJ, и AVITENE™, CR Bard, Murray Hill), NJ) или сухие фибрин-тромбиновые раневые повязки (TACHOCOMB™, Hafslund Nycomed Pharma, Linz, Austria) ограничены применением в хирургии, и являются недостаточно устойчивыми к растворению в интенсивном потоке крови. Они также не обладают достаточными адгезивными свойствами, чтобы служить какой-либо практической цели при остановке серьезного кровотечения. Эти существующие в настоящее время хирургические кровоостанавливающие бандажи также являются ломкими, и таким образом предрасположены к поломке, если они повреждены путем изгиба или нагрузки давлением. Они также подвержены растворению при кровотечении. Такое растворение и разрушение этих бандажей может быть катастрофическим, так как оно может вызывать потерю адгезии к ране и позволить кровотечению продолжаться без ослабления.
Артериальным кровотечением также нельзя управлять с помощью прикладывания впитывающих кровоостанавливающих средств из окисленной целлюлозы (SURGICEL, Ethicon, Somerville, NJ) или желатиновой губки (SURGIFOAM, Ethicon, Somerville, NJ). Эти продукты предназначены для регулирования кровотечения низкого давления из кости и эпидурального венозного выделения. Желатиновые губки не подходят для артериального кровотечения высокого давления, с активным потоком, так как они не образуют сильной связи с источником кровотечения и, таким образом, легко смещаются. Окисленная целлюлоза также не подходит для регулирования артериального кровотечения, так как она набухает и нуждается в удалении из места прикладывания, когда достигается остановка кровотечения. Если поток крови является слишком высоким, имеет место чрезмерное набухание перед тем, как может быть достигнута остановка кровотечения (M.Sabel et al. (2004). Eur. Spine J. 13(1):S97-101).
Наиболее широко используемые тканевые адгезивы обычно непригодны для использования в качестве кровоостанавливающих или останавливающих внутреннюю жидкость средств, по причинам, в основном относящимся к умеренной токсичности и невозможности легкого их получения и применения в полевых условиях. Хорошим примером этого является цианоакрилатное семейство местных кожных адгезивов, таких как Dermabond™, Indermil™, Liquiband™ и так далее. Характер быстрого цианоакрилатного активирования под воздействием воздуха делает изделия на основе цианоакрилата неподходящими для использования в активной кровеостанавливающей полевой повязке и их неспособность связываться с влажными поверхностями делает их неподходящими для использования в остановке внутреннего кровотечения или истечения жидкости.
Существующие продукты, которые предназначены для использования в остановке внутренних жидкостей, также имеют значительные проблемы. BioGlue™ (Cryolife Inc.) является сильным адгезивом и изолирующим средством, но содержит альбумин, сшитый посредством глутаральдегида, вещества, которое является токсичным и высоко нейротоксичным. Эта токсичность значительно ограничивает его применение. Другим изолирующим средством является CoSeal (Baxter), который состоит из полиэтиленгликоля (PEG). Хотя оно является нетоксичным, это средство имеет лишь слабую адгезивную силу, что значительно ограничивает его применения.
Желатин использовали в различных раневых повязках. Так как желатиновые гели имеют относительно низкую точку плавления, они являются не очень стабильными при температуре тела. Следовательно, обязательна стабилизация этих гелей путем создания поперечных связей между белковыми цепочками. На практике это обычно достигается путем обработки желатина глутаральдегидом или формальдегидом. Таким образом, сшитый желатин может быть изготовлен в виде сухих губок, полезных для индуцирования остановки крови в кровоточащих ранах. Имеющиеся в продаже примеры таких губок включают Spongostan (Ferrosan, Denmark), Gelfoam (Upjohn, USA) и Surgifoam (Ethicon. Somerville, NJ). Главным недостатком таких губок является то, что используемый сшивающий агент (формальдегид или глутаральдегид) является токсичным для клеток. Негативный эффект глутаральдегидного сшивания проиллюстрирован, например, данными, полученными de Vries et al. (Abstract Book of the Second Annual Meeting of the WHS, Richmond, USA, p51, 1992). Эти авторы показали, что сшитые глутаральдегидом коллагеновые решетки были токсичны для клеток, в то время как несшитая разновидность являлась нетоксичной. Таким образом, несмотря на их полезные кровоостанавливающие свойства, эти изделия являются не очень оптимальными в качестве раневых повязок для обработки проблемных ран. Таким образом, была бы очень желательна раневая повязка на основе желатина с использованием другой, менее токсичной технологию сшивания.
Помимо возможной токсичности, желатиновые матрицы сами по себе не обеспечивают механические свойства, необходимые для регулирования активного кровотечения. Они являются более подходящими для применений в обработке ран, при которых требуется лишь небольшая абсорбция жидкости. В одном исследовании был сделан вывод, что пластины сшитого глутаральдегидом желатина являются более подходящими в качестве средства для продолжительного заживления раны, в частности дистрофической ткани, для которой требуется более продолжительное время. Альтернативно, они могут быть полезны в качестве каркаса для прикрепления клеток, где они могут стимулировать микросреду со слабой реакционной способностью благодаря пролонгированному присутствию in situ (MG Tucci. (2001). J. Bioactive & Соmp. Polymers. 16(2): 145-157).
Желатиновые матрицы, сшитые с полисахаридами, также были рекомендованы для использования в регулировании кровотечения. Эти кровоостанавливающие соединения не имеют возможной токсичности сшитых глутаральдегидом желатиновых губок. Однако у желатин-полисахаридных веществ обычно отсутствует механическая прочность, и они предназначены главным образом для регулирования небольших количеств выделяющейся жидкости во время операции или для ограничения раневого выделения на протяжении продолжительного периода после лечения.
Одним из примеров желатин-полисахаридного соединения является желатин-альгинатная раневая повязка, которая сшивается in situ. Такая повязка не выполняет адгезивной функции, и ее главным образом используют для сохранения влаги на раневом участке. Повязки набухают до 90% их первоначального размера, что значительно снижает их механическую прочность (В Balakrishnan et al. (2005). Biomaterials. 26(32):6335-42).
Еще одним более распространенным примером является сшитая желатин-хитозановая раневая повязка (примеры в патентах US 6509039, 4572906). Хотя были предложения использовать такие повязки для травматологии (Chitoskin™), кровоостанавливающие свойства данного вещества просто недостаточны для контролирования кровотечения высокого давления. Кроме того, это вещество значительно набухает, когда сталкивается с большими объемами физиологических жидкостей. Такие повязки являются более подходящими для лечения хронических ран и ожогов.
Упоминается еще один пример (патент US 6132759), где солюбилизированный желатин сшивают с окисленным декстраном. Данное вещество предложено для покрытия и продолжительного лечения ран, так как оно продемонстрировало высокую поглощающую способность и подходящие свойства контролируемого высвобождения для доставки лекарственных веществ, особенно к ранам.
В настоящее время ни одно вещество, включающее сшитые желатиновые матрицы или матрицы из других веществ, сшитых с желатином, не может независимо обеспечить остановку кровотечения при активном внутреннем кровотечении, даже при добавлении тромбина. Было проведено исследование по сравнению кровоостанавливающей способности желатиновой матрицы FloSeal (BioSurgery, Fremont, CA) и желатиновой матрицы GelFoam, пропитанной активным раствором тромбина. Ни одно улучшенное кровоостанавливающее средство не было способно остановить потоковое кровотечение у более чем 2/3 пациентов через 5 минут. Пульсирующее артериальное кровотечение является гораздо более активным, чем потоковое кровотечение, и, конечно, будет создавать проблему для таких пропитанных тромбином матриц (FA Weaver et al. (2002). Ann. Vase. Surg. 16(3):286-93).
В любом случае, явным недостатком в травматологии остается то, что нет новой доступной активной кровоостанавливающей полевой повязки, которая может контролировать кровоизлияние без значительных побочных эффектов. Аналогично, явным недостатком в хирургии остается то, что нет нетоксичного доступного изолирующего средства, которое способно противостоять активному кровотечению и может изолировать раневые участки, с истекающими биологическими жидкостями, отличными от крови.
Согласно некоторым воплощениям настоящего изобретения предложен способ лечения раненой ткани, включающий нанесение на ткань композиции, содержащей желатин и нетоксичный сшивающий агент.
Возможно, нетоксичный сшивающий агент содержит трансглутаминазу. Предпочтительно трансглутаминаза включена как часть трансглутаминазной композиции, и массовое отношение желатина к трансглутаминазной композиции находится в диапазоне от примерно 1:1 до примерно 300:1. Более предпочтительно трансглутаминазная композиции имеет уровень специфической активности по меньшей мере примерно 40 ед./г. Более предпочтительно трансглутаминазная композиция имеет уровень специфической активности по меньшей мере примерно 800 ед./г.
Возможно и предпочтительно активность трансглутаминазы в желатин-трансглутаминазной композиции составляет от примерно 25 до примерно 400 ед./г желатина. Более предпочтительно активность составляет от примерно 40 до примерно 200 ед./г желатина.
Возможно, трансглутаминаза включает растительную, рекомбинатную животную, или микробного происхождения трансглутаминазу, отличную от фактора XIII крови. Предпочтительно композиция имеет pH в диапазоне от примерно 5 до примерно 8.
Возможно, желатин получают из животного источника, рекомбинантного источника или их комбинации. Предпочтительно животный источник выбирают из группы, состоящей из рыб и млекопитающих. Более предпочтительно млекопитающее выбирают из группы, состоящей из свиней и коров.
Возможно, желатин представляет собой тип А (обработанный кислотой) или тип В (обработанный щелочью). Более предпочтительно желатин содержит высокомолекулярный желатин.
Возможно, раненую ткань выбирают из группы, состоящей из хирургически разрезанной ткани, хирургически восстановленной ткани и травмированной ткани.
Возможно, способ дополнительно включает уменьшение кровотечения или истечения других физиологических жидкостей из ткани. Возможно физиологическую жидкость выбирают из группы, состоящей из цереброспинальной жидкости, желудочно-кишечной жидкости, воздуха, желчи и мочи. Предпочтительно способ дополнительно включает индуцирование остановки кровотечения или остановку других истекающих физиологических жидкостей в ткани.
Возможно, рана представляет собой кровотечение или истечение другой физиологической жидкости, и лечение раненой ткани включает нанесение композиции на область раны для стимулирования in situ сшивания желатиновых цепочек и эндогенного коллагена тканевой внутриклеточной матрицы для создания барьера для истечения жидкости или кровотечению.
Возможно, способ дополнительно включает образование биомиметического сгустка.
Возможно, нанесение композиции включает: смешивание желатина и трансглутаминазы с образованием смеси; и нанесение смеси на ткань.
Согласно другим воплощениям настоящего изобретения предлагается способ индуцирования остановки кровотечения в ране у млекопитающего, включающий нанесение на рану композиции, содержащей желатин и трансглутаминазу.
Согласно другим воплощениям настоящего изобретения предлагается способ индуцирования образования биомиметического сгустка на участке поврежденного кровеносного сосуда, включающий нанесение на рану композиции, содержащей желатин и трансглутаминазу.
Согласно другим воплощениям настоящего изобретения предлагается композиция, содержащая комбинацию желатина и трансглутаминазы, где соотношение количества желатина и количества трансглутаминазы выбирают для индуцирования образования биомиметического сгустка у млекопитающего.
Согласно другим воплощениям настоящего изобретения предлагается композиция, содержащая комбинацию желатина и нетоксичного сшивающего агента, где соотношение количества желатина и количества нетоксичного сшивающего агента является достаточным для уменьшения кровотечения в ране млекопитающего.
Предпочтительно нетоксичный сшивающий агент содержит трансглутаминазу. Более предпочтительно трансглутаминазу добавляют в виде части трансглутаминазной композиции, и массовое отношение желатина к трансглутаминазной композиции находится в диапазоне от примерно 1:1 до примерно 300:1. Более предпочтительно отношение находится в диапазоне от примерно 1:1 до примерно 100:1. Более предпочтительно трансглутаминазная композиция имеет уровень специфической активности по меньшей мере примерно 40 ед./г. Также более предпочтительно трансглутаминазная композиция имеет уровень специфической активности по меньшей мере примерно 80 ед./г. Также более предпочтительно трансглутаминазная композиция имеет уровень специфической активности по меньшей мере примерно 200, 400 или 800 ед./г.
Возможная активность трансглутаминазы в желатин-трансглутаминазной композиции составляет от примерно 25 до примерно 400 ед./г желатина. Предпочтительно активность составляет от примерно 40 до примерно 200 ед./г желатина.
Возможно, трансглутаминаза содержит растительную, рекомбинантную, животную или микробную трансглутаминазу, отличную от фактора крови XIII. Предпочтительно композиция дополнительно содержит стабилизатор или наполнитель. Также предпочтительно композиция имеет pH в диапазоне от примерно 5 до примерно 8.
Возможно, желатин получают из животного источника, рекомбинантного источника или их комбинации. Предпочтительно животный источник выбирают из группы, состоящей из рыбы и млекопитающих. Более предпочтительно млекопитающее выбирают из группы, состоящей из свиней и коров. Более предпочтительно желатин включает желатин из свиных шкур или свиных костей или их комбинацию. Также более предпочтительно желатин представляет собой тип А (обработанный кислотой) или тип В (обработанный щелочью). Также наиболее предпочтительно желатин включает высокомолекулярный желатин.
Возможно, желатин имеет прочность геля по блуму по меньшей мере примерно 250. Предпочтительно, рыбы включают холодноводные виды рыб.
Возможно, рекомбинантный желатин получают, используя бактериальные, дрожжевые, животные, растительные системы или системы насекомых или любой тип клеточной культуры.
Возможно, желатин очищают для удаления солей. Возможно, желатин имеет по меньшей мере одну скорректированную, адаптированную или ранее определенную характеристику. Возможно, желатин не подвергают термообратимому гелеобразованию.
Согласно другим воплощениям настоящего изобретения предложен кровоостанавливающий или изолирующий биологическую жидкость агент, содержащий комбинацию желатина и нетоксичный сшивающий агент. Возможно, нетоксичный сшивающий агент содержит трансглутаминазу. Предпочтительно комбинация содержит агрегированный желатин и трансглутаминазу.
Как описано в данном описании изобретения, способ или композиция, в которой трансглутаминаза может быть возможно экстрагирована из одного или более Streptoverticillium Baldaccii, штамма Streptomyces Hygroscopicus или Escherichia coli.
Согласно другим воплощениям настоящего изобретения предложен способ индуцирования остановки кровотечения в и/или изолирования раненой ткани, включающий нанесение на эту ткань композиции, содержащей сшиваемый белковый субстрат и нетоксичный сшивающий агент. Возможно, нетоксичный сшивающий агент содержит трансглутаминазу. Предпочтительно субстрат содержит одну или более чем одну синтезированную полимерную последовательность, характерную для сшиваемого трансглутаминазой участка. Более предпочтительно субстрат содержит модифицированный полипептид, содержащий по меньшей мере один участок сшивания трансглутаминазой.
Согласно другим воплощениям настоящего изобретения предложена композиция для индуцирования остановки кровотечения и/или изолирования раны, содержащая смесь желатина и трансглутаминазы, где смесь модифицирована таким образом, что желатин образует раствор с трансглутаминазой при температуре более низкой, чем естественная температура золь-гелеобразования обычного животного желатина.
Возможно, желатин был модифицирован, чтобы иметь пониженную температуру золь-гелеобразования. Предпочтительно композиция дополнительно содержит добавку для увеличения растворимости желатина в смеси. Более предпочтительно композиция дополнительно содержит добавку для снижения температуры золь-гелеобразования желатина. Наиболее предпочтительно композиция дополнительно содержит пластификатор. Возможно и наиболее предпочтительно пластификатор выбран из группы, состоящей из многоатомного спирта, глицерина, глицерола, ксилита, сахарозы, сорбита, триэтаноламина, резорцина, тиодигликоля, натриевой соли толуолсульфокислоты, бутиленгликоля, нитрата мочевины, тиомочевины, мочевины, глутаминовой кислоты, аспарагиновой кислоты, валина, глицина, KSCN, Kl и LiBr.
Возможно, диапазон относительной концентрации глицерина составляет от примерно 0,5:1 до примерно 5:1 глицерин: желатин, масса/масса. Предпочтительно диапазон относительной концентрации составляет от примерно 1:1 до примерно 2:1 глицерин: желатин, масса/масса. Возможно, диапазон относительной концентрации сорбита составляет от примерно 0,5:1 до примерно 5:1 сорбит: желатин, масса/масса. Предпочтительно диапазон относительной концентрации составляет от примерно 1:1 до примерно 3:1 сорбит: желатин, масса/масса.
Возможно, диапазон относительной концентрации мочевины составляет от примерно 1:2 до примерно 2:2 мочевина: желатин, масса/масса.
Возможно, композиция дополнительно содержит корректирующий агент, выбранный из группы, состоящей из агента, корректирующего pH, и агента, корректирующего концентрацию ионнов. Предпочтительно агент, корректирующий pH, обеспечивает pH в диапазоне от примерно 1,5 до примерно 5,0 или от примерно 7,0 до примерно 9,0.
Возможно, композиция дополнительно содержит соль. Возможно, композиция дополнительно содержит углевод трегалозу, углевод маннит или другой углевод для стабилизации при распылительной сушке, лиофилизации или другой сушке белка.
Возможно, композиция дополнительно содержит денатурирующее средство. Предпочтительно денатурирующее средство выбирают из группы, состоящей из гидрохлорида гуанидина и мочевины. Более предпочтительно диапазон относительной концентрации составляет от примерно 1:2 до примерно 2:2 GuHCl: желатин, масса/масса. Также более предпочтительно диапазон относительной концентрации составляет от примерно 0,5:1 до примерно 1:1 мочевина: желатин, масса/масса.
Возможно, композиция дополнительно содержит восстановитель. Предпочтительно восстановитель выбирают из группы, состоящей из хлорида магния и гидрохинона. Более предпочтительно гидрохинон присутствует в растворе из смеси в концентрации от примерно 0,2 до примерно 0,5 М. Более предпочтительно концентрация равна от примерно 0,3 до примерно 0,4 М.
Возможно, хлорид магния присутствует в растворе смеси в концентрации от примерно 2 до примерно 4 М. Предпочтительно концентрация равна от примерно 2,5 до примерно 3,5 М.
Возможно, композиция дополнительно содержит экзотермическое вещество. Предпочтительно экзотермическое вещество включает одно или более чем одно из хлорида кальция, других солей кальция, хлорида магния, оксидов металлов/цеолитов или их комбинации. Более предпочтительно хлорид кальция присутствует в количестве от примерно 0,2 до примерно 0,7 г хлорида кальция на мл смеси в растворе для увеличения температуры на каждый градус Цельсия выше температуры окружающей среды.
Возможно, композиция дополнительно содержит желатин-специфическую протеазу.
Возможно, композиция дополнительно содержит ингибитор протеазы. Возможно, композиция дополнительно содержит дополнительный кровоостанавливающий агент. Предпочтительно дополнительный кровоостанавливающий агент дополнительно содержит один или более чем один из альбумина, коллагена, фибрина, тромбина, хитозана, сульфата железа (III) или сульфатов других металлов.
Согласно другим воплощениям настоящего изобретения предложено кровоостанавливающее или изолирующее средство, которое содержит: (1) первый желатиновый слой; (2) слой трансглутаминазы, прилегающий к первому желатиновому слою; и (3) второй желатиновый слой, прилегающий к слою трансглутаминазы, где слой трансглутаминазы имеет одинаковую протяженность или имеет неодинаковую протяженность с первым желатиновым слоем и/или со вторым желатиновым слоем.
Согласно другим воплощениям настоящего изобретения предложена кровоостанавливающая или изолирующая повязка, которая содержит: (1) рассасывающийся или нерассасывающийся слой вещества; (2) первый желатиновый слой, прилегающий к слою этого вещества; (3) слой трансглутаминазы, прилегающий к первому желатиновому слою; и (4) второй желатиновый слой, прилегающий к слою трансглутаминазы, где слой трансглутаминазы имеет одинаковую протяженность или имеет неодинаковую протяженность с первым желатиновым слоем и/или вторым желатиновым слоем.
Согласно другим воплощениям настоящего изобретения предложена кровоостанавливающая или изолирующая повязка, которая содержит: (1) желатиновый слой; (2) слой трансглутаминазы, прилегающий к желатиновому слою; где слой трансглутаминазы имеет одинаковую протяженность или имеет неодинаковую протяженность с желатиновым слоем.
Согласно другим воплощениям настоящего изобретения предложена кровоостанавливающая или изолирующая повязка, которая содержит: (1) рассасывающийся или нерассасывающийся слой вещества; (2) желатиновый слой, прилегающий к слою этого вещества; (3) слой трансглутаминазы, прилегающий к желатиновому слою; где слой трансглутаминазы имеет одинаковую протяженность или имеет неодинаковую протяженность с желатиновым слоем.
Согласно другим воплощениям настоящего изобретения предложена кровоостанавливающая или изолирующая повязка, которая содержит: (1) желатиновый слой; (2) рассасывающийся или нерассасывающийся слой вещества, прилегающий к первому желатиновому слою; (3) слой трансглутаминазы, прилегающий к слою этого вещества; где слой трансглутаминазы имеет одинаковую протяженность или имеет неодинаковую протяженность с желатиновым слоем.
Возможно, повязка дополнительно содержит вещество основы.
Согласно другим воплощениям настоящего изобретения предложено кровоостанавливающее или изолирующее средство, которое содержит: (1) рассасывающуюся или нерассасывающуюся матрицу; (2) желатин; (3) трансглутаминазу; где желатин и трансглутаминаза включены в матрицу.
Согласно другим воплощениям настоящего изобретение предложено кровоостанавливающее или изолирующее средство, которое содержит: (1) пористую рассасывающуюся или нерассасывающуюся матрицу; (2) желатин; (3) трансглутаминазу; где желатин и трансглутаминаза прикреплены к матрице.
Согласно другим воплощениям настоящего изобретение предложено медицинское средство для введения в организм человека или низшего млекопитающего, содержащее кровоостанавливающий или изолирующий агент или композицию, как описано в данном описании изобретения. Предпочтительно средство содержит сосудистый катетер.
Согласно другим воплощениям настоящего изобретение предложено медицинское средство для местного применения на теле человека или низшего млекопитающего, содержащее кровоостанавливающий или изолирующий агент или композицию, как описано в данном описании изобретения. Возможно, средство содержит находящуюся под давлением аэрозоль или пену.
Понятно, что как вышеизложенное общее описание, так и нижеследующее подробное описание являются лишь иллюстративными и поясняющими в отношении заявленного изобретения.
Если не определено иное, все технические и научные термины, используемые в данном описании изобретения, имеют значение, общепонятное специалисту в той области техники, к которой данное изобретение относится. Все патенты, патентные заявки и публикации, указанные в данном описании изобретения, включены в данное описание изобретения посредством ссылки.
При использовании в данном описании изобретения трансглутаминазный слой, который называется "неодинаковым по протяженности" с желатиновым слоем, является слоем, в котором пространственные границы трансглутаминазного слоя в двух измерениях меньше, чем пространственные границы одного или обоих желатиновых слоев, так что слой трансглутаминазы имеет одинаковую протяженность только с примерно 5% до примерно 95% площади поверхности первого желатинового слоя кровоостанавливающей повязки и/или имеет одинаковую протяженность только с примерно 5% до примерно 95% площади поверхности второго желатинового слоя кровоостанавливающей повязки независимо. Например, слой трансглутаминазы может иметь одинаковую протяженность с примерно 10, 20, 30, 40, 50, 60, 70, 75, 80, или 90% площади поверхности каждого из первого и второго желатиновых слоев независимо. Слой трансглутаминазы, который "имеет одинаковую протяженность" с желатиновым слоем, обеспечивает полное покрытие желатинового слоя и имеет одинаковую протяженность со 100% площади поверхности желатинового слоя. Слой трансглутаминазы может быть некоэкстенсивным с первым желатиновым слоем и все же быть коэкстенсивным со вторым желатиновым слоем, или наоборот, например, при использовании желатиновых слоев, имеющих разные общие площади поверхности или формы.
"Пациент" при использовании в данном описании изобретения относится к человеческим или животным индивидуумам, нуждающимся в медицинской помощи и/или лечении.
"Рана" при использовании в данном описании изобретения относится к любому повреждению любой ткани пациента, которая приводит к потере крови из системы кровообращения или потере любой другой физиологической жидкости из их физиологических путей. Ткань может представлять собой внутреннюю ткань, такую как орган или кровеносный сосуд, или внешнюю ткань, такую как кожа. Потеря крови или физиологической жидкости может быть внутренней, например из прободного органа, или внешней, например из разрыва. Рана может находиться в мягкой ткани, такой как орган, или в твердой ткани, такой как кость. Повреждение может быть вызвано любым агентом или источником, включая травматическое повреждение, инфекцию или хирургическое вмешательство. Повреждение может быть опасным для жизни или не опасным для жизни.
"Рассасывающееся вещество" при использовании в данном описании изобретения относится к веществу, которое распадается самопроизвольно и/или с помощью млекопитающего организма на компоненты, которые поглощаются или удаляются таким образом, чтобы значительно не мешать заживлению раны и/или тканевой регенерации, и не вызывают какого-либо значительного метаболического нарушения.
"Стабильность" при использовании в данном описании изобретения относится к сохранению тех характеристик вещества, которые определяют активность и/или функцию.
"Связующий агент" при использовании в данном описании изобретения относится к соединению или смеси соединений, которые улучшают прилипание одного слоя кровоостанавливающей повязки к одному или более чем одному другому слою, и/или прилипание компонентов данного слоя к другим компонентам этого слоя.
"Солюбилизирующий агент" при использовании в данном описании изобретения относится к соединению или смеси соединений, которые улучшают растворение белка или белков в (предпочтительно) водном растворителе.
"Наполнитель" при использовании в данном описании изобретения относится к соединению или смеси соединений, которые обеспечивают наполнение и/или пористость одного или более слоев кровоостанавливающих повязок.
"Высвобождающий агент" при использовании в данном описании изобретения относится к соединению или смеси соединений, которые облегчают извлечение кровоостанавливающей повязки из производственной формы.
"Пенообразующий агент" при использовании в данном описании изобретения относится к соединению или смеси соединений, которые производят газ при гидратировании в подходящих условиях.
«TG» относится к трансглутаминазе любого типа; "mTG" может также относиться к микробной трансглутаминазе и/или к любому типу трансглутаминазы, в зависимости от контекста (ниже, в конкретных экспериментальных примерах, термин относится к микробной трансглутаминазе).
Термин "млекопитающее", в частности в отношении способа лечения и/или применения или нанесения средства и/или композиции, относится как к человеку, так и к низшим млекопитающим, если не указано иное.
При использовании в данном описании изобретения "примерно" означает плюс или минус приблизительно десять процентов от указанной величины.
Другие характеристики и преимущества изобретения будут очевидны из следующего подробного описания и из формулы изобретения.
КРАТКОЕ ОПИСАНИЕ ГРАФИЧЕСКИХ МАТЕРИАЛОВ
Изобретение описано в данном описании изобретения только посредством примера, со ссылкой на прилагаемые графические материалы. Подчеркивается, теперь с конкретной ссылкой на подробные графические материалы, что показанные частные случаи являются примером, и предназначены для целей иллюстрированного обсуждения предпочтительных воплощений настоящего изобретения, и представлены, чтобы обеспечить то, что, как полагают, является наиболее полезным и легко понятным описанием принципов и концептуальных аспектов изобретения. В этом отношении не предпринимается попытка показать структурные детали изобретения более подробно, чем это необходимо для понимания принципов изобретения, причем описание, взятое с графическими материалами, демонстрирует специалистам в данной области техники, как отдельные формы изобретения могут быть воплощены на практике.
В графических материалах:
Фиг.1 представляет собой схематическую блок-диаграмму типичного бандажа по настоящему изобретению;
Фиг.2 показывает вид спереди типичного бандажа по настоящему изобретению, покрытого возможной абсорбируемой основой и возможной пластиковой оберткой;
Фиг.3 представляет собой схематическую блок-диаграмму типичного кровоостанавливающего средства по настоящему изобретению, включающего пористую матрицу;
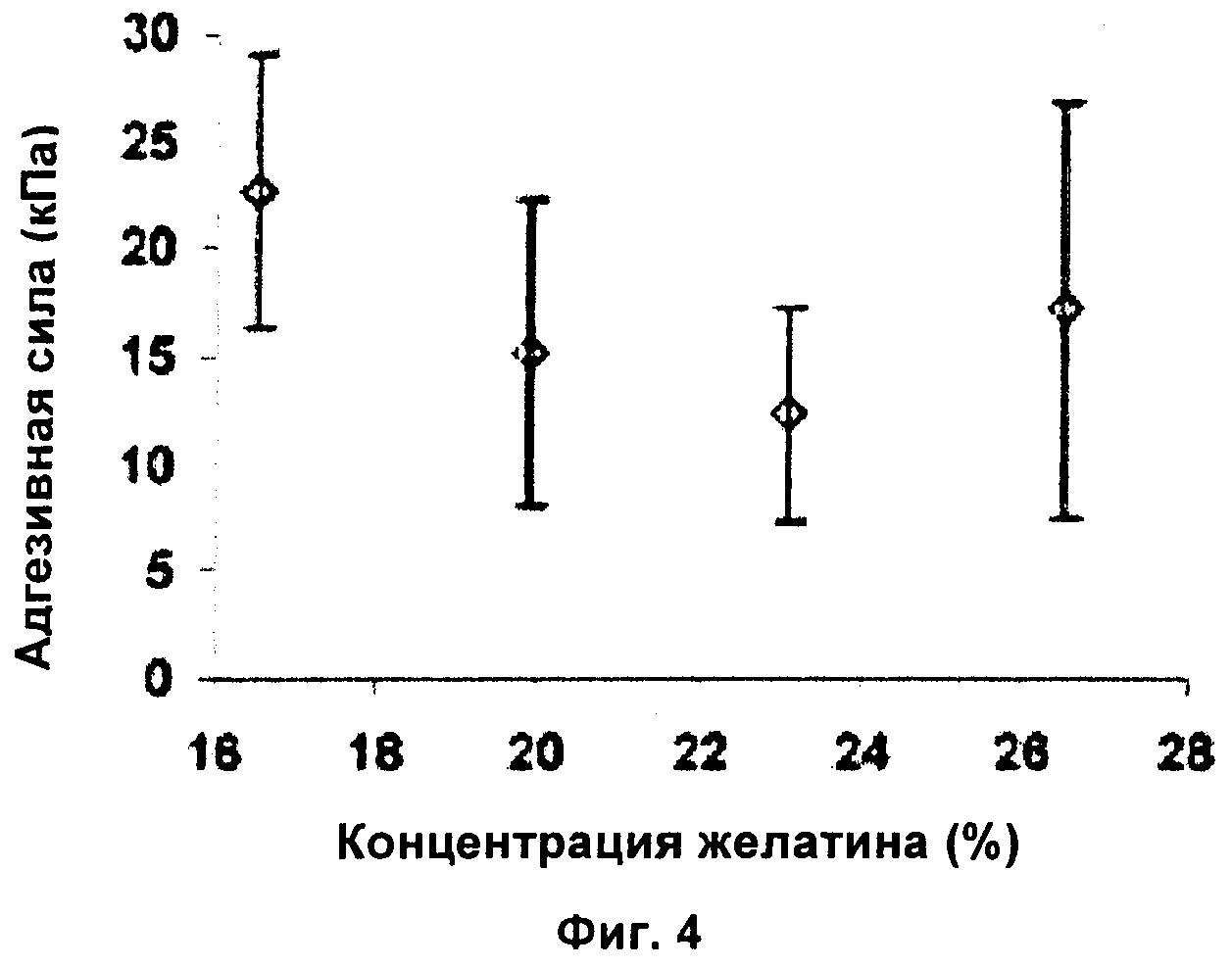
Фиг.4 представляет собой диаграмму, демонстрирующую влияние разных процентных содержаний исследуемого желатина на прочность раны;
Фиг.5 показывает влияние температуры на активность трансглутаминазы (исследуемый диапазон температуры составлял от 32 до ~150°F (0-65,55°C);
оптимальный диапазон составлял 122-131°F (50-55°C));
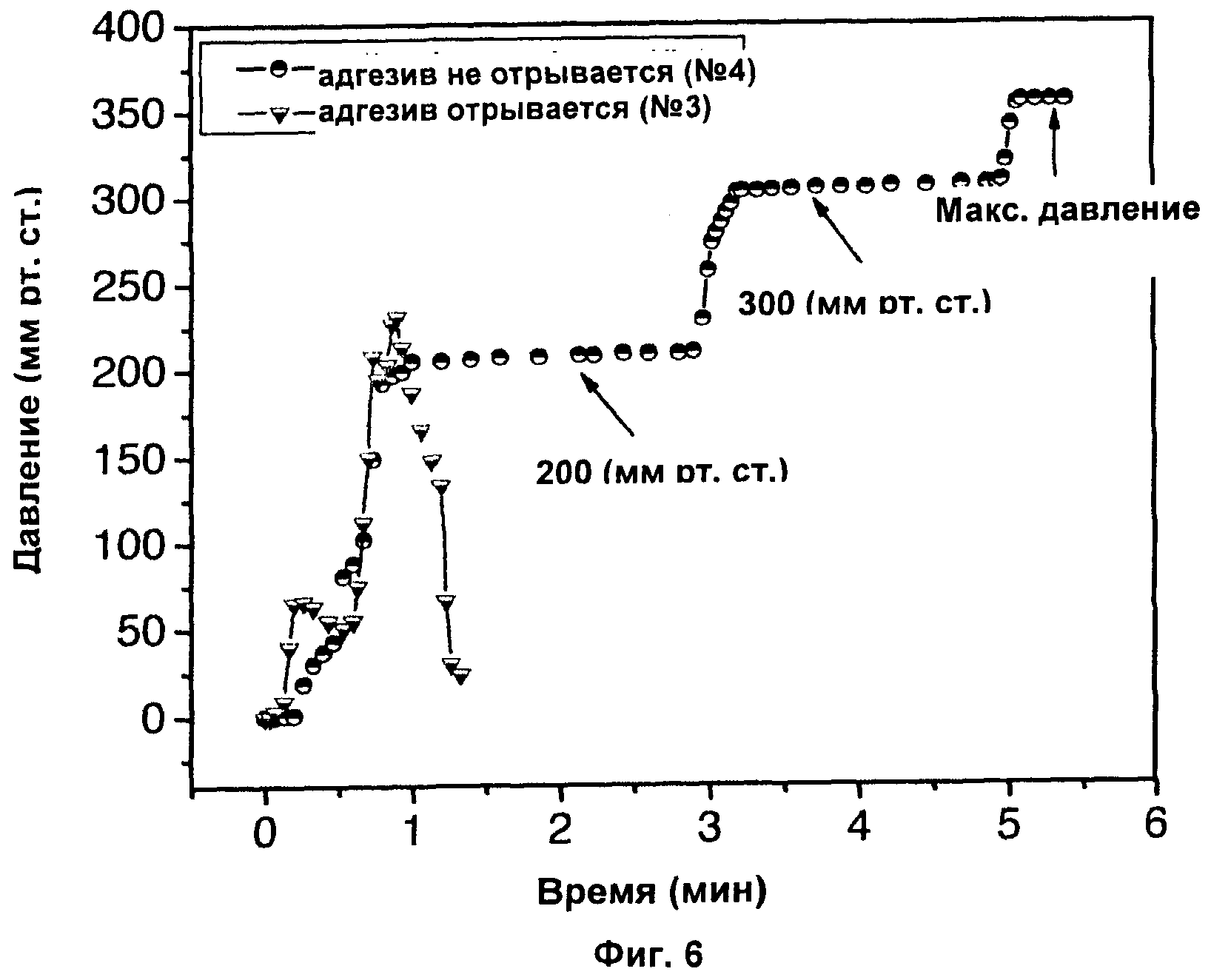
Фиг.6 показывает репрезентативные измерения давления разрыва тканевых адгезивов на основе композиции А;
Фиг.7 показывает репрезентативные измерения давления разрыва тканевых адгезивов на основе композиции В;
Фиг.8 представляет собой фотографию, показывающую образование геля и также индукцию остановки крови (Фиг.8А показывает всю область, в то время как Фиг.8Б показывает часть области, увеличенную для показа дополнительных подробностей);
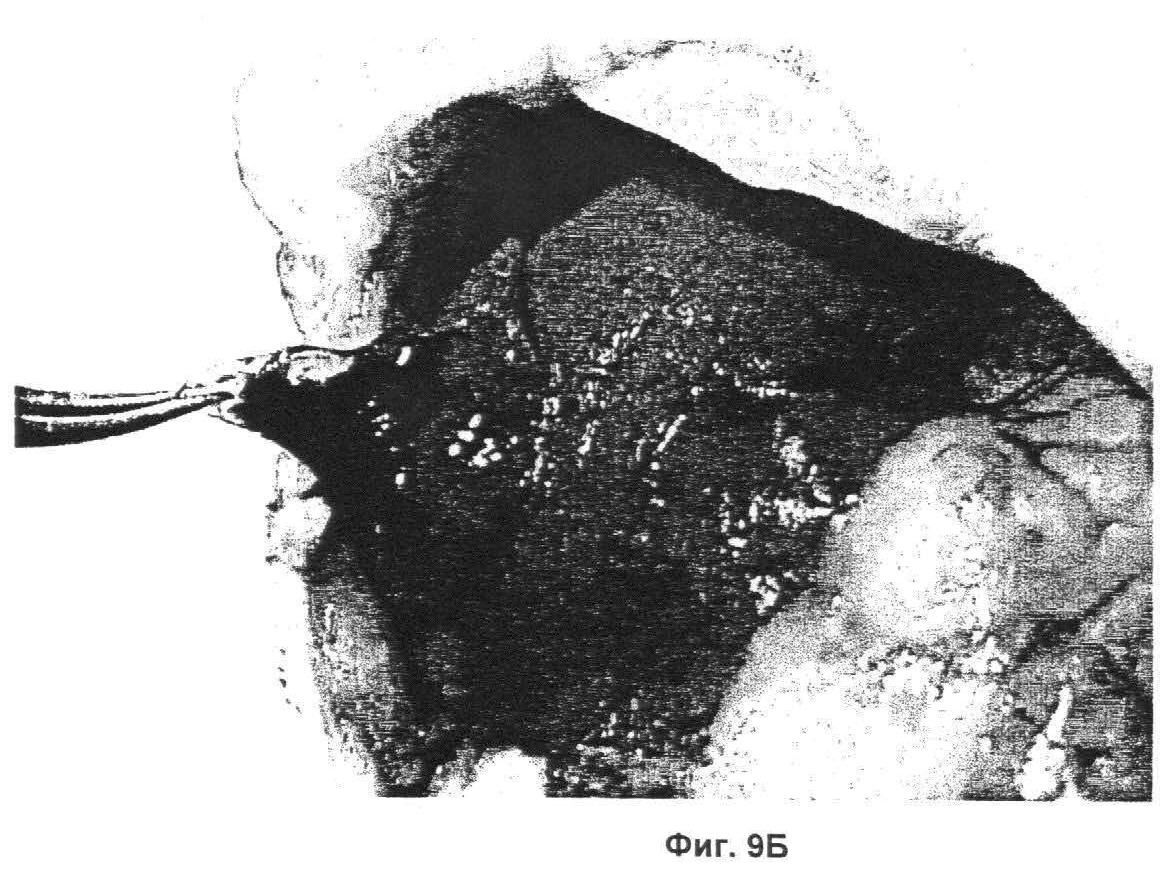
Фиг.9А показывает отсутствие образования сгустка после применения контрольного раствора, в то время как
Фиг.9Б показывает гелеобразование экспериментального раствора и остановку крови;
Фиг.10А-Г показывают фотографии артерии: как производили разрез (10А); разрезанная артерия, сильное кровотечение (10Б); применение композиции по настоящему изобретению на разрезанной артерии (10В); и остановку крови с образованием биомиметического сгустка (10Г);
Фиг.11А и 11Б показывают пример применения двухкомпонентной кровоостанавливающего изолирующего средством с помощью двух шприцев; и
Фиг.12А и 12Б показывают пример закрытия точки ввода в сосуды, где катетер покрыт компонентами, описанными в данном описании изобретения.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Настоящее изобретение представляет собой изобретение адгезивного материала, который содержит сшиваемый белок и нетоксичное вещество, которое индуцирует сшивание сшиваемого белка. Предпочтительно сшиваемый белок включает желатин и любой вариант желатина или вариант белка, как описано в данном описании изобретения. Возможно и предпочтительно нетоксичное вещество содержит трансглутаминазу (TG), которая возможно может содержать любой тип кальций-зависимой или кальций-независимой трансглутаминазы (mTG), которая может, например, возможно представлять собой микробную трансглутаминазу. Согласно некоторым воплощениям настоящего изобретения адгезивное вещество представлено в бандаже, который предпочтительно адаптирован для применения в качестве кровоостанавливающего бандажа. Различные воплощения настоящего изобретение описаны более подробно ниже, под заголовками разделов, которые представлены только для ясности и без какого-либо намерения любого ограничения.
Желатин и трансглутаминаза
Согласно предпочтительному воплощению настоящего изобретения предложена композиция для остановки крови и тканевое изолирующее средство, в которых сшивающее вещество содержит трансглутаминазу и сшиваемый белок содержит желатин.
Согласно предпочтительному воплощению трансглутаминаза присутствует в композиции, имеющей уровень специфической активности по меньшей мере примерно 100 ед./г, хотя возможно также могут использоваться более низкие уровни активности, например, путем возможного корректирования описанных выше отношений. Такие возможно более низкие уровни активности композиции предпочтительно содержат по меньшей мере примерно 20 ед./г, более предпочтительно по меньшей мере примерно 40 ед./г, даже более предпочтительно по меньшей мере примерно 60 ед./г и более предпочтительно по меньшей мере примерно 80 ед./г.
Трансглутаминазу, или самостоятельно, или в качестве части композиции, предпочтительно добавляют к желатину в количестве, таком что результирующая активность трансглутаминазы в смеси предпочтительно равна от примерно 25 до примерно 100 ед./г желатина и более предпочтительно от примерно 40 до примерно 60 ед./г желатина.
Подходящие желатин и трансглутаминазу можно получать любыми способами, известными и доступными специалистам в данной области техники. Желатин возможно может содержать любой тип желатина, который содержит белок, известный в данной области техники, предпочтительно включая, но без ограничения ими, желатин, полученный посредством неполного гидролиза животной ткани, и/или коллаген, полученный из животной ткани, включая, но без ограничения ими, шкуру животного, соединительную ткань (включая, но без ограничения ими, связки, хрящ и подобное), оленьи рога или копыта и тому подобное, и/или кости, и/или рыбью чешую, и/или кости или другие компоненты; и/или рекомбинантный желатин, полученный с использованием бактериальных, дрожжевых, животных, растительных систем и систем насекомых или любого типа клеточной культуры.
Согласно предпочтительным воплощениям настоящего изобретения желатин животного происхождения предпочтительно содержит желатин, происходящий из млекопитающих, и более предпочтительно содержит один или более из: свиных шкур, свиных и коровьих костей, или распиленного голья крупного рогатого скота, или любого другого источника свиного или говяжьего происхождения. Более предпочтительно такой желатин содержит свиной желатин, так как он обладает более низкой скоростью анафилаксии. Желатин животного происхождения возможно может представлять собой тип А (обработанный кислотой) или тип В (обработанный щелочью), хотя предпочтительно он представляет собой тип А.
Предпочтительно желатин животного происхождения содержит желатин, полученный во время первой экстракции, которую обычно выполняют при более низких температурах (50-60°C, хотя такой точный температурный диапазон не является обязательным ограничением). Желатин, полученный таким путем, имеет диапазон прочности геля по Блуму 250-300 и имеет высокую молекулярную массу по меньшей мере примерно 95-100 кДа. Предпочтительно применяют желатин с прочностью геля по Блуму 300.
Неограничивающим примером производителя таких желатинов является РВ Gelatine (Tessenderlo Group, Belgium).
Согласно некоторым воплощениям настоящего изобретения желатин животного происхождения возможно содержит желатин из рыб. Возможно, можно использовать любой тип рыб, предпочтительно холодноводные виды рыб, такие как карп, треска, или щука, или тунец. pH такого желатина (измеренный в 10%-ном растворе) предпочтительно варьируется от 4-6.
Желатин холодноводных рыб образует раствор в воде при 10°C и, таким образом, весь желатин холодноводных рыб считаются имеющим 0 прочность геля по Блуму. Для настоящего изобретения предпочтительно применяют высокомолекулярный желатин холодноводных рыб, более предпочтительно включая молекулярную массу по меньшей мере примерно 95-100 кДа. Это эквивалентно молекулярной массе животного желатина с прочностью геля по Блуму 250-300. Желатин холодноводных рыб подвергается термообратимому гелеобразованию при значительно более низких температурах, чем животный желатин, что является результатом более низких содержаний в нем пролина и гидроксипролина. На 1000 аминокислотных остатков желатин холодноводных рыб имеет 100-130 пролиновых и 50-75 гидроксипролиновых групп по сравнению с 135-145 пролиновыми и 90-100 гидроксипролиновыми группами в животных желатинах (Haug IJ, Draget KI, Smidsr0d O. (2004). Food Hydrocolloids. 18:203-213).
Неограничивающим примером производителя такого желатина является Norland Products (Cranbury, NJ).
В предпочтительном воплощении изобретения желатин очищают для удаления солей. Это может быть достигнуто согласно уже описанным методикам. Одна такая методика включает образование 20% мас./об. раствора желатина в воде и нагревание его до 60°C при перемешивании. Затем смеси оставляют неподвижно стоять в течение ночи. Полученный гель подвергают диализу против многократных замен обессоленной воды для удаления солей, перемешивают и нагревают до 50°C для дезагрегирования физической матрицы. Конечный раствор фильтровали и лиофильно сушили (Crescenzi V, Francescangeli A, Tagtienti A. (2002). Biomacromolecules. 3:1384-1391). Альтернативно, желатин можно обессоливать с помощью гель-фильтрационной колонки.
Согласно некоторым воплощениям настоящего изобретения используют рекомбинантный желатин. Рекомбинантные желатины в настоящее время производит для продажи FibroGen (San Francisco, CA). В настоящее время предпочтительный способ представляет собой использование системы рекомбинантных дрожжей (Pichia Pastoris) для экспрессии определенных фрагментов коллагена типа I, альфа1 с последовательностью человека.
В возможном, но предпочтительном воплощении настоящего изобретения рекомбинантные желатины представляют собой полностью синтетические молекулы, не содержащие загрязняющих компонентов от человека или каких-либо животных. Под "синтетическим" подразумевается, что желатин предпочтительно произведен способом, выбранным из химического синтеза, бесклеточного синтеза белка, культивирования клеток ткани, любого типа культуры бактерий, насекомых или дрожжей, или в растениях. Применение синтетических желатинов устраняет многие из переменных факторов и недостатков, связанных с веществами, происходящими из тканей, включая провоцирование нежелательных иммунных ответов. Например, рыбные желатины демонстрируют высокую аллергенность, а животные желатины проявляют низкую-умеренную аллергенность, в то время как рекомбинантные желатины могут иметь нулевую аллергенность. В исследованиях безопасности у человека не было обнаружено нежелательных явлений, относящихся к рекомбинантному желатину.
Способы создания рекомбинантных желатинов и преимущества их применения в полной мере описаны в патентах US 6413742 и 6992172, которые включены в данное описание изобретения посредством ссылки, как если бы были полностью изложены в данном описании изобретения.
Рекомбинантные желатины могут быть получены высокоочищенными (99%). Получение рекомбинантного желатина позволяет возможное изготовление желатинов по меньшей мере с одной определенной и заранее заданной характеристикой, включая, но без ограничения ими, определенные молекулярный массы, pi (изоэлектрическая точка), гарантированную воспроизводимость от партии к партии, и возможность адаптировать молекулу для соответствия конкретному применению.
Ранее был описан пример адаптации молекулы для соответствия конкретному применению, где создавали желатин с высокой гидрофильностью (Werten MWT, et аl). (2001). Protein Engineering. 14 (6): 447-454). Возможно и предпочтительно желатин по настоящему изобретению содержит желатин, имеющий по меньшей мере одну скорректированную, адаптированную или заранее определенную характеристику.
Неограничивающие примеры других типов характеристик, которые также возможно могут быть адаптированы согласно настоящему изобретению, включают претерпевание или не претерпевание термообратимого гелеобразования. Рекомбинантные желатины могут быть созданы претерпевающими термообратимое гелеобразование или не претерпевающими термообратимое гелеобразование. Желатин, который имеет одну или более чем одну полезную характеристику природного животного желатина, но не претерпевает термообратимое гелеобразование, исключительно полезен в создании возможности сшивания желатина другими способами при температурах, при которых он при нормальных условиях подвергается термообратимому гелеобразованию. Такой желатин также входит в некоторые воплощения настоящего изобретения.
Животный (говяжий, свиной и так далее) желатин, желатин из тепловодных рыб и рекомбинантный желатин (гелеобразующий тип) может претерпевать термообратимое гелеобразование приблизительно между 35-40 градусами, особенно при больших молекулярных массах, и/или высоких концентрациях (>20%), и/или с модификацией(модификациями), и/или одним или более дополнительными веществами (смотри описание ниже). При комнатной температуре они находятся в гелеобразной форме и не могут легко смешиваться с mTG. Ниже описаны различные модификации композиции по некоторым воплощениям настоящего изобретения для поддержания желатиновых растворов в жидкой форме при комнатной температуре.
Желатин из холодноводных рыб и рекомбинантный желатин (негелеобразующего типа) не образует термообратимые гели при комнатной температуре даже в отсутствие дополнительной модификации и/или в присутствии одного или более дополнительных веществ. Они имеют точки перехода намного ниже комнатной температуре. При комнатной температуре они остаются в растворе и могут взаимодействовать с mTG без дополнительной модификации.
Согласно предпочтительным воплощениям настоящего изобретения относительно рекомбинантного желатина для получения рекомбинантного желатина применяют подходящую систему культивирования in vitro. В дополнение к применению рекомбинантных метилотрофных дрожжевых систем для получения рекомбинантного желатина использовали другие организмы.
Рекомбинантные желатиноподобные белки экспрессировали в Escherichia coli, хотя уровни экспрессии, обычно получаемые в E.coli, достаточно низкие, и очистка внутриклеточно продуцируемого белка может быть трудной. Bacillus brevis использовали для экспрессии желатиноподобных белков, где участки последовательностей выбирали из генов натурального коллагена и полимеризовали с образованием полусинтетического желатина (Werten MWT, et al. Secreted production of a custom-designed, nighly hydrophilic gelatin in Pichia pastoris. Protein Engineering. Vol.14, №6, стр.447-454, июнь 2001).
Дополнительные успешние попытки получения рекомбинантного желатина включали получение рекомбинантного желатина с использованием клеток млекопитающих и насекомых. Коллаген и желатин также экспрессировали в трансгенных растениях табака, трансгенных мышах. Для получения слитого белка, содержащего коллагеновую последовательность, использовали систему трансгенного шелкопряда. В таких системах отсутствует достаточное количество эндогенной пролил-гидроксилазы, чтобы продуцировать полностью гидроксилированный коллаген, что может быть преодолено посредством сверхэкспрессирования пролил-гидроксилазы (Olsen D, et al. Recombinant collagen and gelatin for drug delivery. Adv Drug Deliv Rev. 2003 Nov 28; 55(12): 1547-67). Также возможно можно использовать системы на основе растений; например, сотрудничество между университетом штата Айова и Fibrogen представляет собой разработку экспрессии желатина в трансгенной кукурузе.
Желатин, используемый в кровоостанавливающем средстве, может представлять собой желатиновый комплекс, или любой желатин, или его производное, или метаболит, или желатин, полученный согласно одному способу или совокупности способов. Например, желатин возможно может содержать желатин типа А, или желатин типа В, или их комбинацию.
Трансглутаминаза возможно может содержать любую трансглутаминазу растительного, животного или микробного происхождения, предпочтительно не являющуюся фактором крови XIII. Предпочтительно используют микробную трансглутаминазу, полученную из Streptoverticillium mobaraensis.
Трансглутаминаза возможно может находиться в композиции, содержащей по меньшей мере одно другое вещество, такое как стабилизатор или, например, наполнитель. Неограничивающие примеры таких веществ включают мальтодекстрин, гидролизованный белок обезжиренного молока или любое другое белковое вещество, хлорид натрия, сафлоровое масло, трехзамещенный фосфат натрия, казеинат натрия или лактозу, или их комбинацию.
Хотя оптимальный pH для активности неочищенной трансглутаминазы равен 6,0, он также действует при более высокой активности в диапазоне pH от 5,0 до pH 8,0. Таким образом, композиция по настоящему изобретению для остановки кровотечения предпочтительно имеет величину pH в диапазоне от примерно 5 до примерно 8.
Трансглутаминаза характеризуется отрицательным температурным коэффициентом. Во всем температурном диапазоне трансглутаминазной активности он требует более короткого времени для взаимодействия при более высоких температурах и больше времени для начала функционирования при более низких температурах. Следующая таблица показывает разное время взаимодействия при разных температурах по сравнению с реакционной смесью аналогичной классификации, что и реакционная смесь при 50°C, pH 6,0, реакция в которой происходит за 10 минут:
Неограничивающие примеры имеющихся в продаже трансглутаминазных продуктов включают производимые Ajinomoto Co. (Kawasaki, Japan). Предпочтительным примером такого продукта от данной компании является Activa TG-TI (в Европе: Activa WM) - ингредиенты: mTG и мальтодекстрин; активность: 81-135 ед./г Activa. Другие неограничивающие примеры подходящих продуктов от данной компании включают Activa TG-FP (ингредиенты: гидролизованный белок обезжиренного молока, mTG; активность: 34-65 ед./г Activa TG-FP); Activa TG-GS (ингредиенты: хлорид натрия, желатин, трехзамещенный фосфат натрия, мальтодекстрин, mTG, и сафлоровое масло (технологическая добавка); активность: 47-82 ед./г Activa TG-GS); Active TG-RM (в Европе: Activa ЕВ) - ингредиенты: казеинат натрия, мальтодекстрин и mTG; активность: 34-65 ед./г Activa; Activa MP (ингредиенты: mTG, лактоза и мальтодекстрин; активность: 78-126 ед./г Activa).
Другие неограничивающие примеры имеющихся в продаже трансглутаминазных продуктов включают произведенные Yiming Biotogica) Products Co. (Jiangsu, China). А предпочтительным примером такого продукта от данной компании является TG-B (ингредиенты: 1% mTG, 99% со-белка; активность: 80-130 ед./г TG-B). Другие неограничивающие примеры пригодных продуктов от данной компании включают TG-A (ингредиенты: 0,5% mTG, 99,5% совместного белка; активность: 40-65 ед./г TG-A).
Для обоих примеров предпочтительными трансглутаминазными продуктами являются продукты с наиболее высокой специфической активностью и наиболее простыми со-ингредиентами, так как они, как предполагается (без желания быть ограниченными одной гипотезой), имеют наилучшую реакционную способность при применении и наиболее низкий потенциал нежелательных побочных эффектов.
В еще одном воплощении трансглутаминазу возможно можно экстрагировать из штамма Streptoverticillium Baldaccii или Streptomyces Hygnoscopicus для получения ферментных вариантов, которые, как было показано, оптимально функционируют при более низких температурах (приблизительно 37°C и 37°C - 45°C соответственно) (Negus SS. A Novel Microbial Transglutaminase Derived From Streptoverticillium Baldaccii. PhD Thesis. School of Biomotecular and Biomedical Science. Griffith University, Queenstand, Australia and Cui L et al. Purification and characterization of transglytaminase from a newly isolated Streptomyces hygroscopicus. 2007: 105(2). p.612-618). Более высокая специфическая активность при более низких температурах желательна для достижения более быстрого и более сильного сшивания желатина в условиях окружающей среды.
Согласно некоторым воплощениям трансглутаминазу можно применять в форме любой из описанных выше композиций, возможно включая любую из имеющихся в продаже смесей, которые содержат трансглутаминазу.
В еще одном воплощении любая из вышеуказанных трансглутаминазных смесей возможно может быть очищена с помощью гель-хроматографии, катионообменной хроматографии, фильтрация при помощи полых волокон или тангенциальной проточной фильтрации для удаления ее белков-носителей и/или углеводов. Некоторые из этих способов были ранее описаны (Bertoni F. Barbani N, Glusti P. Ciardelli G. Transglytaminase reactivity with gelatine: perspective applications in tissue engineering Biotechnol Lett (2006) 28:697-702) (Broderick EP. et al. Enzymatic Stabilization of Gelatin-Based Scaffolds J Biomed Mater Res 72B: 37-42, 2005). Размер пор фильтра, используемого для фильтрации, предпочтительно равен приблизительно 10 кДа.
В любом случае активность трансглутаминазы предпочтительно измеряют перед применением и/или изготовлением композиции по настоящему изобретению с помощью анализа реакционной способности трансглутаминазы. Такой анализ возможно может включать, но без ограничения ими, гидроксаматный метод, анализ Несслера, колориметрический анализ или любой другой анализ активности трансглутаминазы (смотри, например, Folk JE, Cole PW. Transglytaminase: mechanistic features of the active site as determined by kinetic и inhibitor studies. Biochim Biophys Acta. 1966; 122:244-64; or the Nessier Assay as described in: Bertoni F, Barbani N, Giusti P, Ciardelli G. Transglytaminase reactivity with gelatine: perspective applications in tissue engineering Biotechnol Lett (2006) 28:697-702).
В общем случае чистота и/или качество желатина и/или трансглутаминазы для применения в кровоостанавливающей композиции будут соответствовать чистоте, которая, как известно специалисту в соответствующей области техники, приводит к эффективности и стабильности белка.
Белки для сшивания субстратов, отличные от желатина
Как отмечено выше, сшиваемый белок предпочтительно содержит желатин, но может также, дополнительно или альтернативно, содержать другой тип белка. Согласно некоторым воплощениям настоящего изобретения белок также является субстратом для трансглутаминазы, и предпочтительно характеризуется подходящей трансглутаминаза-специфической полипептидной и полимерной последовательностями. Данные белки возможно могут включать, без ограничения ими, синтезированные полимерные последовательности, которые независимо обладают свойствами образовывать биоклей или полимеры, которые были более предпочтительно модифицированы трансглутаминаза-специфическими субстратами, которые усиливают способность вещества сшиваться трансглутаминазой. Неограничивающие примеры каждого из таких типов веществ описаны ниже.
Были разработаны синтезированные полипептидные и полимерные последовательности с подходящей трансглутаминазной мишенью для сшивания, которые имеют точки перехода предпочтительно от примерно 20 до примерно 40°C. Предпочтительные физические характеристики включают, без ограничения ими, способность связвать ткань и способность образовывать волокна. Подобно желатинам гелеобразующего типа (описанным выше), такие полипептиды возможно можно применять в композициях, которые также содержат одно или более веществ, которые понижают их точку перехода.
Неограничивающие примеры таких пептидов описаны в патентах US 5428014 и 5939385, оба из которых поданы ZymoGenetics Inc и включены в данное описание изобретения посредством ссылки, как если бы они были полностью изложены в данном описании изобретения. В патенте US 5428014 описаны биосовместимые, биоадгезивные, сшиваемые трансглутаминазой полипептиды, где известно, что трансглутаминаза катализирует реакцию переноса ацила между γ-карбоксамидной группой связывающих белок глутаминильных остатков и ε-аминогруппы остатков Lys, приводящего к образованию ε-(γ-глютамил)лизин-изопептидных связей.
Например, описаны полипептиды, имеющие 13-120 аминокислотных остатков, содержащие сегмент формулы S1-Y-S2, где: S1 представляет собой Thr-Ile-Gly-Glu-Gly-Gln; Y представляет собой спейсерный пептид из 1-7 кислот или отсутствует; и S2 представляет собой Xaa-Lys-Xaa-Ala-Gly-Asp-Val. Возможно, спейсерный пептид Y представляет собой Gln-His-His-Leu-Gly, Gln-His-His-Leu-Gly-Gly или His-His-Leu-Gly-Gly. Также возможно, Хаа, аминокислота 1 из S2 представляет собой Аlа или Ser. Возможно, спейсерный пептид содержит His-His-Leu-Gly. Возможно и предпочтительно, по меньшей мере один из Y и S2 не содержит остатков Gln. Возможно, карбоксильный концевой аминокислотный остаток полипептида представляет собой Pro или Gly. Конкретные неограничивающие примеры полипептидов включают следующие: Thr-Ile-Gly-Glu-Gly-Gln-Gln-His-His-Leu-Gly-Gly-Ala-Lys-Gln-Ala-Gly-Asp-Val, Thr-Ile-Gly-Glu-Gly-Gln-Gln-His-His-Leu-Gly-Ala-Lys-Gln-Ala-Gly-Asp-Val, Thr-Ile-Gly-Glu-Gly-Gln-His-His-Leu-Gly-Gly-Ala-Lys-Gln-Ala-Gly-Asp-Val или Leu-Ser-Gln-Ser-Lys-Val-Gly. В данном патенте также описаны высокомолекулярные, биосовместимые, биоадгезивные, сшиваемые трансглутаминазой сополимеры и гомополимеры, включающие эти пептиды.
В патенте US 5939385 описаны биосовместимые, биоадгезивные сшиваемые трансглутаминазой полипептиды. Такие полипептиды предпочтительно имеют примерно 9-120 аминокислотных остатков, содержащих сегмент формулы S1-Y-S2, где: S1 выбирают из группы, состоящей из Ile-Gly-Glu-Gly-Gln, Gly-Glu-Gly-Gln, Glu-Gly-Gln и Gly-Gln; Y представляет собой His-His-Leu-Gly-Gly или His-His-Leu-Gly; и S2 выбирают из группы, состоящей из Ala-Lys-Gln-Ala-Gly-Asp, Ala-Lys-Gln-Ala-Gly, Ala-Lys-Gln-Ala, Ala-Lys-Gln, Ala-Lys-Ala-Gly-Asp-Val, Ala-Lys-Ala и Ala-Lys, где указанный полипептид имеет аминный и карбоксильный конец и сшивается трансглутаминазой. Предпочтительный полипептид представляет собой Gly-Gln-His-His-Leu-Gly-Gly-Ala-Lys-Gln. Также предпочтительным является полипептид, где полипептид фланкирован на любом или обоих, аминном и карбоксильном конце, эластомерным полипептидом. Кроме того, предлагается эластомерный полипептид, где эластомерный полипептид представляет собой пентапептид или тетрапептид, в частности фланкированный полипептид, где фланкированный эластомерный полипептид представляет собой Val-Pro-Gly-Val-Gly, Ala-Pro-Gly-Val-Gly, Gly-Val-Gly-Val-Pro, Val-Pro-Gly-Gly или любую его часть, предпочтительно такую, чтобы аминный конец фланкированного полипептида представлял собой Val и карбоксильный конец фланкированного полипептида представлял собой Gly. В патенте также описаны высокомолекулярные, биосовместимые, биоадгезивные, сшиваемые трансглутаминазой сополимеры и гомополимеры, охватывающие данные пептиды.
Данные патенты признают полезность описанных пептидов и полимеров для применения в качестве тканевых адгезивов, в закрытии раны и в разных других медицинских применениях. Однако в обоих патентах отмечается, что нужные точки перехода таких пептидов и полимера равны 20-40°C, и признается необходимость снижения точки перехода так, чтобы пептид/полимер был способен взаимодействовать с трансглутаминазой в раневом участке. В обоих патентах утверждается: "Температура перехода полимера может быть скорректирована с помощью ряда полипептидов, полипептидных мономеров, способных сшиваться трансглутаминазой. Специалисту в данной области техники понятно, что для клинических применений снижение температуры перехода во время применения облегчит быстрое затвердевание матрицы на раневом участке."
Конечно, часто не представляется возможным удаление сшиваемых мономеров с целью обеспечения максимальной когезионной и адгезионной прочности сшитого полимера, предназначенного для применения в качестве биоадгезива. Действительно, для максимального увеличения когезионной и адгезионной прочности таких адгезивов, как правило, желательно добавлять больше сшиваемых мономерных субстратов. Таким образом, биоадгезивный потенциал полимеров, описанных в данных патентах, существенно ограничен температурой перехода раствора полимера.
Предпочтительное воплощение настоящего изобретения значительно развивает использование данных полипептидов или полимеров для применения в остановке кровотечения, тканевых адгезивах и тканевых изолирующих прокладках. Например, ниже описаны возможные воплощения для снижения точки перехода полимеров, которые образуют гель при комнатной температуре. Такие стратегии можно использовать в снижении точки перехода пептидных для последовательностей и полимеров, описанных в этих патентах.
Также, как подробнее описано ниже, предпочтительно количество этих полимеров различается в воплощениях настоящего изобретение, в отличие от исходных применений, описанных в вышеуказанных патентах (которые ни указывают на, ни предлагают ни одно из применений, описанных в данном описании изобретения для настоящего изобретения). Например, диапазон концентрации полимера, указанный в этих патентах, для использования в наборе тканевого адгезива составляет 5-100 мг/мл и предпочтительно 35-50 мг/мл. Некоторые воплощения настоящего изобретения включают более высокие концентрации полимеров, например в диапазоне 150-250 мг/мл. Для некоторых воплощений настоящего изобретения также предпочтительны более высокие концентрации трансглутаминазы.
Согласно некоторым воплощениям настоящего изобретения также возможно могут быть предложены другие синтетические субстраты. Предпочтительно синтезируют короткие трансглутаминазные субстраты и затем соединяют их и/или связывают с крупными полимерными молекулами. Субстраты трансглутаминазы обычно являются очень короткими (<20 аминокислотных остатков). Растворимость и точка перехода таких субстратов зависит от полимера, к которому субстрат прикреплен. Например, если субстрат прикреплен к гелеобразующему желатину, то для того чтобы оставаться в жидкой форме при комнатной температуре, требуется добавление другого вещества в раствор такой только что синтезированной молекулы.
Неограничивающий пример такого типа вещества описан в патенте US 7208171, который включен в данное описание изобретения посредством ссылки, как если бы был полностью изложен в данном описании изобретения, где описан рациональный дизайн пептидов, являющихся трансглутаминазными субстратами. Стратегия данного дизайна была основана на максимальном увеличении числа доступных ацил-акцепторных лизин-пептидных субстратов и ацил-донорных глутаминил-пептидных субстратов, доступных для сшивания трансглутаминазой. Кроме этого, были сконструированы Lys- и Glu-субстратные пептиды, обладающие основными характеристиками известных биомакромолекулярных и синтетических пептидных субстратов трансглутаминазы. Например, Glu-субстратные пептиды содержали 2-5 следующих друг за другом остатков Glu на основе данных, что пептиды становились более хорошими субстратами трансглутаминазы при увеличении длины повторов Glu (Gorman, J.J.; Folk, J.E. J. Biol. Chem. 1980, 255, 419-427. & Kahlem, P.; Terre, C.; Green, H.; Djian, P. Proc. Natl. Acad. Sci. U.S.A. 1996, 93, 14580-14585) и что белки, содержащие два или более соседних остатков Glu, известны как хорошие субстраты. (Etoh, Y.; Simon, M.; Green, H. Biochem. Biophys. Res. Commun. 1986, 136, 51-56. & Hohenadl, C.; Mann, K.; Mayer, U.; Timpl, R.; Paulsson, R.; Aeschlimann, D.J. Biol. Chem. 1995, 270, 23415-23420.) Остаток Leu помещали в соседнее положение с Glu, около С-конца в нескольких пептидах, потому что это, как было показано, приводит к значительному возрастанию Glu-специфичности. (Gross, M; Whetzel, N.K.; Folk, J.E. J. Biol. Chem. 1975, 250, 4648-4655.) В отношении Lys-субстратных пептидов было доказано, что композиция и последовательность аминокислот, соседних к лизиновым остаткам в пептидном и белковом субстратах, могут оказывать влияние на аминную специфичность. (Groenen, P.; Smulders, R.; Peters, R.F.R.; Grootjans, J.J.; Vandenijssel, P.; Bloemendal, H.; Dejong, W.W. Eur. J. Biochem. 1994, 220, 795-799. & Grootjans. J.J.; Groenen, P.; Dejong, W.W. J. Biol. Chem. 1995, 270, 22855-22858.) В конечном счете, во всех пептидах остаток Gly добавляли к С-концевой стороне для действия в качестве спейсера между пептидом и полимером в пептид-полимерных конъюгатах, так чтобы пептид в конъюгате мог быть более доступным для фермента.
Анализы трансглутаминазной специфичности пептидов, описанных в данном патенте, показали, что они успешно создавали ацил-акцепторные и ацил-донорные субстраты с высокой специфичностью связывания трансглутаминазы. В патенте предполагается, что эти субстраты могут быть ковалентно конъюгированы с PEG, дендримерами, хитозаном, желатином, растворимыми коллагенами, гиалуроновой кислотой, альгинатами и альбуминами. Патент предполагает, что такие пептид-полимерные конъюгаты в растворе или в жидкой форме можно использовать в качестве хирургических изолирующих средств и/или медицинских адгезивов.
Хотя в данном патенте описаны высокоспецифичные сшиваемые трансглутаминазой пептидные субстраты, в нем не сообщаются или не предлагаются улучшенные способы применения или модификации веществ, описанные как часть настоящего изобретения, не указываются или не предлагаются композиции по настоящему изобретению. Однако указанные субстраты из патента возможно могут быть полезными в улучшении биоадгезива, созданного посредством сшивания трансглутаминазой, или в создании такого биоадгезива из иного полимера, неспецифического для трансглутаминазы. Как описано в данном описании изобретения, такие субстраты нуждаются в объединении с одним или более другими белками или каркасами, чтобы являться полезными в настоящем изобретении.
Сшивающие вещества, отличные от трансглутаминазы
Как указано выше, сшивающее вещество предпочтительно содержит трансглутаминазу, но также может, дополнительно или альтернативно, содержать другой тип сшивающего вещества.
Неограничивающие примеры таких сшивающих агентов включают карбодиимиды, такие как N,N-(3-(диметиламино)пропил)-N-этилкарбодиимид (EDC), N-гидроксисукцинимид (NHS) с EDC или карбодиимиды, применяемые вместе с поли-L-глутаминовой кислотой (PLGA) и полиакриловой кислотой. В другом воплощении такие сшивающие агенты могут включать тирозиназу или тирозиназу с хитозаном. В другом воплощении сшивание (полимеризация) фотоиндуцируется ультрафиолетовым светом или улучами. В другом воплощении сшивающие агенты могут включать алкилен, лимонную кислоту (угольную кислоту), или нано-гидроксиапатит (н-НА) + поливиниловый спирт (PVA).
В еще одном воплощении сшивающий агент представляет собой полифенол растительного происхождения, такой как, например, гидроксилированные коричные кислоты, такие как кофейная кислота (3,4-дигидроксикоричная кислота), хлоргеновая кислота (ее эфир хинной кислоты), кафтаровая кислота (ее виннокислый эфир), и флавоноиды (то есть такие, как кверцетин и рутин). В другом воплощении дополнительный сшивающий агент представляет собой окисленный моно- или дисахарид, оксо-лактозу или диальдегид, основанный на сахарной группировке (галакто-гексодиальдоза) (GALA). В другом воплощении генипин или другое иридоид-гликозидное производное, или секоиридоиды, предпочтительно олевропеин, содержат сшивающий агент. В другом воплощении сшивающий агент представляет собой тиол-реактивный полиэтиленгиколь. В другом воплощении сшивающий агент представляет собой декстран, окисленный декстран, декстрановый диальдегид. В другом воплощении сшивающий агент представляет собой мультиоксидазу меди, такую как лакказа или билирубиноксидаза.
Иллюстративные композиции
Описанные выше сшивающие субстраты и сшивающие вещества могут быть возможно объединены с одним или более дополнительными веществами с образованием различных композиций по настоящему изобретению. Согласно некоторым воплощениям адгезивное вещество возможно и предпочтительно содержит: (1) желатин; (2) трансглутаминазу; где желатин и трансглутаминаза сформированы в частицы либо по отдельности, либо вместе. Более предпочтительно желатин и трансглутаминаза представлены в достаточных количествах, чтобы быть полезными в качестве изолирующего, кровоостанавливающего агента.
Различные количества каждого из них и их соотношения были описаны ранее. Содержание трансглутаминазы возможно может быть увеличено для увеличения скорости реакции или уменьшено для улучшения безопасности. Согласно некоторым воплощениям настоящего изобретения предпочтительно применяют 15-30%-ный раствор желатина и затем 15-30%-ный раствор трансглутаминазы.
Кроме того, одна или более чем одна добавка также могут содержаться в кровоостанавливающем продукте, например лекарственные средства, такие как факторы роста, поликлональные и моноклональные антитела и другие соединения. Иллюстративные примеры таких добавок включают, без ограничения ими: антибиотики, такие как тетрациклин и ципрофлоксацин, амоксициллин и метронидазол; антикоагулянты, такие как активированный белок С, гепарин, простациклин (PGb), простагландины, лейкотриены, антитрансглутаминаза III, АДФаза, и активатор плазминогена; стероиды, такие как дексаметазон, ингибиторы простациклина, простагландины, лейкотриены и/или хинины для ингибирования воспаления; сердечно-сосудистые лекарственные средства, такие как блокаторы кальциевых каналов, сосудорасширяющие средства и сосудосуживающие средства; хемоаттрактанты; местные анестетики, такие как бупивакаин; и антипролиферативные/противоопухолевые лекарственные средства, такие как 5-фторурацил (5-FU), таксол и/или таксотер; противовирусные средства, такие как гангцикловир, зидовудин, амантидин, видарабин, рибаварин, трифлюридин, ацикловир, дидезоксиуридин и антитела к вирусным компонентам или генным продуктам; цитокины, такие как альфа- или бета- или гамма-интерферон, фактор некроза опухолей альфа или бета, и интерлейкины; колониестимулирующие факторы; эритропоэтин; противогрибковые средства, такие как дифлюкан, кетоконизол и нистатин; противопаразитарные агенты, такие как пентамидин; противовоспалительные агенты, такие как альфа-1-антитрипсин и альфа-1-антихимотрипсин; анестетики, такие как бупивакаин; анальгетики; антисептики; и гормоны. Другие иллюстративные добавки включают, без ограничения ими: витамины и другие пищевые добавки; гликопротеины; фибронектин; пептиды и протеины; углеводы (как простые, так и/или сложные); протеогликаны; антиангиогенины; антигены; липиды или липосомы; и олигонуклеотиды (смысловая и/или антисмысловая ДНК и/или РНК).
Согласно некоторым предпочтительным воплощениям настоящего изобретения предложена композиция, характерным признаком которой является желатин, подверженный термообратимому сшиванию (как описано выше, некоторые, но не все типы желатина, подвержены термообратимому сшиванию без модификации и/или применения одного или более дополнительных веществ). Термообратимое гелеобразование животного желатина происходит, когда раствор желатина охлаждают ниже приблизительно температуры тела (37°C). В смесях желатин-mTG при комнатной температуре такое гелеобразование задерживает mTG в термообратимом геле и предотвращает ее взаимодействие с желатином с образованием необратимого изолирующего геля. Так как рабочая комнатная температура обычно поддерживается при 22°C, термообратимое гелеобразование в растворе желатина будет происходить гораздо быстрее в клинической ситуации, если нет непрерывного нагревания. Это представляет собой проблему в применении смеси желатин-mTG для остановки кровотечения, так как раствор желатина подлежит нагреванию перед его смешиванием с mTG. Необходимость нагревания желатина непосредственно перед применением является нежелательной как с материально-технической точки зрения, так и из соображения безопасности, так как нагревательный прибор требуется добавить, например, к чувствительной среде операционной; в кризисных ситуациях и/или в экстренных ситуациях медицинской помощи вне операционных такая необходимость нагревания является еще более проблемной.
Независимо от его препятствования тканевой адгезии и остановке кровотечения, неспособность желатина образовывать раствор при комнатной температуре и смешиваться с микробной трансглутаминазой также представляет трудности для других возможных применений смеси желатин-mTG. Например, хотя гели желатин-mTG были использованы в качестве каркасов для клеточной инкапсуляции в тканевой инженерии, чрезвычайное внимание необходимо было уделять обеспечению того, чтобы желатиновый раствор достаточно охлаждали перед инкапсулированием клеток. Кроме того, имплантация инкапсулированных клеток является довольно сложной, так как термообратимое гелеобразование желатина происходит до того, как смесь желатин-mTG может быть безопасно имплантирована в организм. Аналогичная проблема возникает в отношении местной доставки лекарственного средства, когда эффективность некоторых лекарственных средств может снижаться при приведении в контакт с нагретым желатином, и имплантация геля желатин-mTG, который включает некоторое лекарственное средство, может быть затруднена термообратимым гелеобразованием желатина.
К счастью, сшивание желатина с помощью mTG происходит путем сшивании аминогрупп Lys и Gin (Chen et al. Biomacromolecules, Vol.4, №6, 2003), в то время как аминокислотными группами в желатине, которые являются ответственными за его термообратимое гелеобразование, являются Pro и Hyp (Haug et al. Food Hydrocolloids 18 (2004) 203-213). Таким образом, существует возможность уменьшения склонности желатина к термообратимому гелеобразованию без уменьшения его способности образовывать сшитые гели посредством сшивания mTG. Другими словами растворимость желатина, используемого в смеси желатин-mTG, можно увеличивать, и его точку плавления снижать, позволяя ему образовывать при комнатной температуре раствор с mTG без негативного воздействия на образующийся сшитый желатин-mTG гель.
Согласно некоторым воплощениям настоящего изобретения предложены композиции из смеси желатин-mTG, где смесь модифицирована одним из ряда способов для увеличения растворимости желатина и обеспечена возможность образования раствора желатина с mTG при температурах ниже естественной точки плавления стандартного животного желатина. Такие композиции включают (1) смеси желатин-mTG, изготовленные с использованием стандартного желатина, который был модифицирован с целью снижения его точки плавления; (2) смеси желатин-mTG, которые включают добавки, увеличивающие растворимость самого желатина в растворе желатин-mTG; (3) смеси желатин-mTG, изготовленные с использованием имеющихся в продаже желатиновых продуктов, обработанных с целью получения более низких температур перехода; и (4) смеси желатин-mTG, которые образуют раствор в конкретных, строго контролируемых условиях окружающей среды (температура, pH, ионная концентрация и так далее), которые понижают точку плавления желатина.
Такие новые композиции значительно расширяют применимость гелей желатин-mTG и делают возможным широкий ряд применений, особенно в области медицины, где можно ипользовать гели желатин-mTG, которые могут быть образованы посредством смешивания желатина с mTG при комнатной температуре. Кроме того, во многих случаях растворы желатина и желатин-mTG, образованные с использованием желатиновых растворов, которые содержат желатин с более низкой точкой плавления, будут иметь дополнительное преимущество от снижения исходной вязкости раствора, что обеспечивает mTG большую степень подвижности и увеличение скорости, при которой происходит взаимодействие желатин-mTG.
Согласно некоторым воплощениям настоящего изобретения также предложены дополнительные улучшения смеси желатин-mTG, которые могут улучшать свойства продукта на основе желатин-mTG. Например, настоящее изобретение также включает способы дополнительной стабилизации mTG в смеси желатин-mTG для увеличения ее срока годности.
В другом воплощении изобретения в раствор желатин-mTG включают пластификатор. Было показано, что пластификаторы снижают точку плавления желатина, позволяя ему образовывать раствор при более низких температурах, не претерпевая термообратимого гелеобразования. Один или больше пластификаторов предпочтительно добавляют к желатиновым гранулам или к раствору желатина для снижения его точки плавления перед смешиванием желатинового раствора с mTG или раствором mTG. В ситуации, когда растворы желатина и mTG лиофилизируют, к желатиновому раствору перед его лиофилизацией добавляют один или более пластификаторов. В альтернативном воплощении, как описано выше, к раствору желатина добавляют один или более пластификаторов, что позволяет добавлять mTG при более низкой температуре, при которой mTG не является очень реакционно-способной. Раствор желатин-mTG-пластификатор затем можно лиофилизировать или сушить иным образом в уже смешанной форме.
В предпочтительном воплощении в качестве пластификатора используют многоатомный спирт, или полиол. Такие полиолы включают глицерин, ксилит, сахарозу и сорбит. Сорбит делает гели желатин-mTG более эластичными и адгезивными. Глицерин делает гели желатин-mTG более жесткими и ускоряет сшивание желатина с помощью mTG. Предпочтительный диапазон отношений концентраций для глицерина составляет предпочтительно от примерно 0,5:1 до примерно 5:1 глицерин: желатин, более предпочтительно от примерно 1:1 до примерно 2:1 глицерин: желатин, масса на массу. Предпочтительный диапазон отношений концентраций для сорбита составляет предпочтительно от примерно 0,5:1 до примерно 5:1 сорбит: желатин, более предпочтительно от примерно 1:1 до примерно 3:1 сорбит: желатин, масса на массу.
Многоатомные спирты имеют более высокие точки кипения по сравнению с одноатомными спиртами аналогичного размера. Растворимости в воде многоатомных спиртов выше по сравнению с одноатомными спиртами аналогичного размера, так как у них имеется больше гидроксильных групп для притягивания молекул воды. В пищевой промышленности многоатомные спирты, такие как глицерин, используют для увеличения растворимости в воде желатина, как описано в патенте US 2558065, который включен в данное описание изобретения посредством ссылки, как если бы он был полностью изложен в данном описании изобретения, где многоатомным спиртом, таким как глицерин, обливают желатиновые гранулы, и в патенте US 3939001, который включен в данное описание изобретения посредством ссылки, как если бы он был полностью изложен в данном описании изобретения, где обеспечивают возможность абсорбции желатином многоатомного спирта в течение периода времени, достаточного для набухания желатиновых гранул, но до их растворения. Такие способы и разновидности таких способов, описанные в данных патентах, следует рассматривать как предпочтительные воплощения использования полиолов, описанного как часть настоящего изобретения.
Убедительно доказаны влияния разных концентраций пластификаторов глицерина, ксилита, сорбита, сахарозы и трегалозы на снижение точек перехода желатина (D'Cruz NM, Bell LN. Thermal Unfolding of Желатин in Solids as Affected by the Glass Transition. J Food Science 2005: 70(2), Kozlov PV, Burdygina GI. The structure and properties of solid gelatine и the principles of their modification. Polymer, 1983 (24): стр.651-666).
Хотя влияние многоатомных спиртов на точку плавления желатина было убедительно доказано, до настоящего изобретения они никогда не использовались с желатином или желатиновым раствором до их смешивания с mTG или с раствором желатин-mTG.
В одном воплощении добавления полиоловых пластификаторов предпочтительный диапазон отношений масс пластификатора к желатину составляет предпочтительно от примерно 0,5:1 до примерно 1:1, пластификатор: желатин.
В другом воплощении применения пластификаторов желатина для снижения точки плавления желатина в растворе тип используемого пластификатора может включать триэтаноламин, резорцин, тиодигликбль, натриевую соль толуолсульфокислоты, бутиленгликоль, нитрат мочевины, тиомочевину, мочевину, глутаминовую кислоту, аспарагиновую кислоту, валин, глицин, KSCN, KJ и LiBr.
Ранее было изучено добавление мочевины к раствору желатина и была показана способность препятствовать образованию геля высокомолекулярным желатином (99 кДа) термообратимого геля при 25°C (Otani Y, Tabata Y, Ikada Y. Effect of additives on gelation and tissue adhesion of gelatin-poly(L-glutamic acid) mixture. Biomaterials 19 (1998) 2167-2173).
В предпочтительном воплощении применения мочевины для предотвращения термообратимого гелеобразования в желатине или в растворе желатин-mTG при температурах ниже их естественных точек плавления к растворам добавляют мочевину в соотношении мочевина: желатин 0,25-2,0, масса на массу. Еще более предпочтительно мочевину добавляют к растворам в соотношении мочевина: желатин от примерно 1:2 до примерно 2:2, масса на массу.
В другом воплощении настоящего изобретения уровень pH и ионную концентрацию водного растворителя модифицируют для увеличения растворимости желатина, растворенного в растворителе. Чем дальше pH продукта от изоионного pH, тем лучше будет растворимость желатина. Предпочтительный водный растворитель, используемый в этом способе, представляет собой фосфатно-солевой буферный раствор (PBS). Другие подходящие буферы включают боратный, фосфатный, HEPES (N-[2-гидроксиэтил]пиперазин-N'-[2-этансульфоновая кислота]) и тому подобные.
В общем, в композициях, которую применяют в живых организмах, предпочтительно растворить желатин в водном растворителе, забуференном при pH 5,5-9,0 и с ионной силой от низкой до умеренной (эквивалентной примерно 1-1000 мМ NaCl, предпочтительно 100-150 мМ NaCl). Более предпочтительно pH раствора равен примерно 6,0-8,0, более предпочтительно примерно 7,4. Хотя желатин растворим при таких pH и ионных концентрациях, его растворимость может быть увеличена путем увеличения несоответствия между pH раствора и изоионным pH желатина.
Одна или более чем одна соль также возможно может быть добавлена для снижения температуры перехода желатина. Предпочтительно соли добавляют в подходящем диапазоне концентраций для снижения температуры перехода, более предпочтительно ниже комнатной температуре. Например, обнаружено, что следующие соли в указанном диапазоне концентраций снижают точку перехода желатина ниже комнатной температуры: бромид натрия (1-2 М), нитрат натрия (1-2 М), тиоцианат натрия (0,5-1,5 М), иодид натрия (0,5-1,5 М), бензолсульфонат натрия (0,5-1,5 М), салицилат натрия (0,25-1 М), дихлорацетат натрия (1-2 М), трихлорацетат натрия (0,5-1,5 М), дибромацетат натрия (0,5-1,5 М), трибромацетат натрия (0,25-1 М), дийодацетат натрия (0,5-1,5 М), ацетилтриптофан натрия (0,5-1,5 М), ацетилендикарбоксилат натрия (1-2 М), салицилат лития (1-2 М), дийодосалицилат лития (0.2-1 М) (смотри, например, Bello J, Riese HCA, Vinograd JR. Mechanism of Gelation of Gelatin. Influence of Certain Electrolytes on the Melting Points of Gets of Gelatine and Chemically Modified Gelatines. Am Chem Soc. Sept 1956(60). P.1299-1306).
Возможно и предпочтительно, одно или более чем одно кислое вещество добавляют к композиции для уменьшения pH. Уменьшение pH желатинового раствора снижает его точку перехода. В общем случае снижение точки перехода желатина полезно для восстановления желатина в организме при 37 градусах. Для некоторых предпочтительных типов желатина, применяемых в данном описании изобретения, напримера из млекопитающих источников, понижение pH обеспечивает лучшие результаты для точки перехода желатина. Однако для некоторых типов желатина повышение pH возможно может обеспечить лучшие результаты.
В другом воплощении увеличения несоответствия pH между желатиновым раствором и изоионной точкой желатина модифицируют сам желатин. Это может быть достигнуто путем его обработки перед растворением в растворе с получением электростатически заряженного желатина, как в патенте US 6863783, который полностью включен в данное описание изобретения посредством ссылки, как если бы он был полностью изложен в данном описании изобретения, или посредством контролирования изоэлектрической точки желатина, как в патенте US 2398004, который полностью включен в данное описание изобретения посредством ссылки, как если бы он был полностью изложен в данном описании изобретения.
Когда pH желатинового раствора повышают, вместо того, чтобы его понижать, тогда pH раствора будет ближе к изоионной точке желатина, и точка перехода повысится. Такую модификацию возможно можно использовать для поддержания несшитого желатина в виде термообратимого геля после имплантации в тело.
В другом воплощении настоящего изобретения желатин, mTG, или оба вещества подвергают сушке после их смешивания с углеводом трегалозой или другим углеводом для стабилизации белка или фермента в его активной форме, что позволяет ему легко восстановиться. Различными воплощениями сушки являются лиофилизация, распылительная сушка, барабанная сушка, сушка на воздухе, сушка при нагревании, вакуумная сушка или любой другой способ сушки раствора желатин-трегалоза или желатин-mTG-трегалоза.
Исключительная стабилизирующая способность трегалозы при сушке на воздухе и лиофильной сушке была убедительно доказана. Было показано, что высушенные вещества претерпевают более быстрое восстановление, когда сушку проводят после того, как трегалоза была добавлена к конкретному веществу или раствору (Crowe LM, Reid DS, Crowe JH. Is Trehalose Special for Preserving Dry Biomaterials? Biophysical Journal 1996 (71): 2087-2093).
Сушка белковых растворов, содержащих трегалозу, при температуре окружающей среды и атмосферном давлении была в полной мере описана в патенте US 4891319. В примерах, описанных в данном описании изобретения, функция сухих белков сохранялась.
В конкретном случае с желатином включение трегалозы в раствор желатина обеспечивает дополнительное преимущество, увеличивая прочность желатиновых гелей (Norie N, Kazuhiro M, Masami N, Yusuke O, Takashi O, Keiko N. Factors Affecting the Gelation of a Gelatin Solution in the Presence of Sugar. Journal of Home Economics of Japan. 55(2): стр.159-166 (2004)).
Кроме того, реакция сшивания желатин-mTG во многом аналогична реакции сшивания естественных факторов крови. Недавно была продемонстрирована сушка с трегалозой для стабилизации факторов крови (патенты US 6649386 и 7220836) и она входит в процесс коммерческого способа получения продуктов с белками крови, которые могут быть легко восстановлены (ProFibrix™, Leiderdorp).
В другом воплощении настоящего изобретения желатин сушат в присутствии сахара. Сушка может включать аэрозольное напыление желатинов на разные носители, такие как сахар, мальтодекстрины или крахмалы.
В одном возможном воплощении настоящего изобретения используют имеющийся в продаже желатиновый продукт по названием Cryogel™, производимый РВ Gelatins (Tessenderlo Group, Belgium). Cryogel растворим при температурах на 5-6°C ниже чем эквивалентный необработанный желатин. Точный процесс обработки, используемый в получении Cryogel, запатентован.
В еще одном воплощении настоящего изобретения композиция возможно может включать одно или более чем одно дополнительное вещество. Например, композиция возможно может содержать денатурирующий агент, включая, но без ограничения ими, один или более из гуанидина гидрохлорида или мочевины. Композиция может также возможно, альтеранативно или дополнительно, содержать восстановитель, включая, но без ограничения ими, один или более из хлорида магния или гидрохинона. Композиция также возможно может, альтернативно или дополнительно, содержать вещество, такое изопропанол, для увеличения образования водородных связей. Композиция также может возможно, альтернативно или дополнительно, содержать протонный полярный растворитель, предпочтительно способный структурно взаимодействовать с белками и препятствующий образованию спиралей в желатине, такой как DMSO (диметилсульфоксид). Композиция также может возможно, альтернативно или дополнительно, содержать влагопоглотитель, который является экзотермическим при внесении в раствор, такой как, например, хлорид кальция.
Согласно некоторым воплощениям настоящего изобретения также включает желатин-специфическую протеазу, которая содержит фермент или ферментную смесь, которые могут быстро разлагать нити желатиновой молекулы, но не оказывают отрицательного влияния на естественные сетчатые структуры свертывания крови на основе фибрина.
Желатин-специфическую протеазу возможно можно использовать для удаления бандажа/повязки/абсорбируемого кровоостанавливающего средства/изолирующего средства с раневого участка без повреждения естественного эндогенного фибринового сгустка и вызова повторных кровотечений. Это свойство является дополнительным преимуществом настоящего изобретения по сравнению с существующими продуктами, и решает техническую проблему таких кровоостанавливающих средств, которые, являясь достаточно клейкими для хорошего прилипания к раневому участку и остановки кровотечения, не могут быть удалены без удаления или разрушения фибринового сгустка. Хотя по меньшей мере некоторые воплощения бандажа по настоящему изобретению являются реабсорбирующими, может возникнуть необходимость в удалении их из раны, если врач хочет обработать участок раны или наложить бандаж на другое место.
Типичным неограниченным примером протеазы является протеиназа К (Chen, et al. Biomacromolecules 2003, 4, 1558-1563). Однако другие протеазы, в частности более быстродействующие ферменты, могут использоваться альтернативно.
Согласно другим воплощениям возможно добавляют один или более чем один ингибитор протеазы, включая, но без ограничения ими, апротинин, транексамовую кислоту, ингибитор плазмина альфа-2, альфа-1-антитрипсин, или питтсбургский мутант альфа-1-антитрипсина (Arg-358 альфа-1-антитрипсин; смотри Owen et аl. N. Engl. J. Med. 309: 694-698, 1983 и патент US 4711848, который включен в данное писание изобретения посредством ссылки, как если бы он был полностью изложен в данном описании изобретения). В предпочтительном воплощении апротинин включен в количестве, достаточном для обеспечения конечной рабочей концентрации 1500-20000 кМЕ/мл.
Согласно другим воплощениям кровоостанавливающее вещество по настоящему изобретению в дополнение к желатину и TG может дополнительно содержать дополнительное кровоостанавливающий вещество. Такое вещество может быть биологическим или синтетическим по природе и может включать, но без ограничения ими, один или более из известных кровоостанавливающих агентов, таких как альбумин, коллаген, фибрин, тромбин, хитозан, сульфат железа(III) или сульфаты других металлов.
Согласно другим воплощениям кровоостанавливающее вещество по настоящему изобретению может дополнительно содержать ускоритель для увеличения скорости сшивания при объединении сшивающего вещества, такого как, например, трансглутаминаза, и желатина. Такой ускоритель возможно может содержать, например, кальций.
Кальций является предпочтительным компонентом реакции сшивания трансглутаминаза/желатин. Различные исследования показали, что варьирование концентраций кальция и/или добавление кальциймобилизующих лекарственных средств (включая, но без ограничения ими, майтотоксин (МТХ)) может ускорять трансглутаминазную реакцию свертывания. Таким образом, согласно воплощениям настоящего изобретения включены кальциевые и/или кальциймобилизующие лекарственные средства, хотя альтернативно кальций и/или кальциймобилизующее лекарственное средство не используется. Эти модификации использования кальция полезны в случае кальцийзависимых трансглутаминаз, но не в случае кальцийнезависимых трансглутаминаз.
Согласно другим воплощениям кровоостанавливающее вещество по настоящему изобретению дополнительно может содержать вещество для индуцирования экзотермической реакции, предпочтительно при объединении сшивающего вещества, такого как, например, трансглутаминаза, и желатина. Индукция экзотермического взаимодействия может возможно и предпочтительно способствовать сшиванию даже в тех условиях окружающей среды, когда "окружающую" возможно можно определить как любую среду, имеющую температуру менее чем примерно 30°C. Такой экзотермический агент возможно может содержать один или более чем один агент из кальциевых, хлорсодержащих молекул (таких как хлорид кальция или хлорид магния), или, например, оксидов металлов/цеолитов, или их комбинацию.
Получение композиции
Композиции, как описано в данном описании изобретения, возможно можно получать одним или более способами согласно различным воплощениям настоящего изобретения. В одном воплощении изобретения желатин в смеси желатин-mTG подвергают очень специфическим способам сушки, которые включают использование нагревания перед его смешиванием с mTG. Эти способы сушки увеличивают растворимость желатина путем понижения его точки плавления, предпочтительно ниже рабочих комнатных температур. Способы сушки могут увеличивать растворимость желатина без каких-либо добавок и без изменения условий среды, при которых образуются желатин или растворы желатин-mTG. Однако добавление некоторых добавок, таких как пластификаторы или стабилизаторы, или управление некоторыми факторами окружающей среды, такими как температура, ионная концентрация и осмотическое давление, растворов желатина или желатина-mTG можно использовать для дополнительного улучшения свойств смеси желатин-mTG, которая уже включает желатин, высушенный способом, который понижает его точку плавления.
В предпочтительном воплощении теплозависимой сушки желатина для получения желатина, который может образовывать раствор с mTG при пониженных температурах, раствор чистого желатина с содержанием воды по меньшей мере 35% распыляют при температуре, превышающей температуру гелеобразования и отвердевания, на избыточное количество точноизмельченных твердых желатиновых частиц, которые содержат менее 8% воды. Затем эти частицы сушат в псевдоожиженном слое до влагосодержания 8-13%. Данный способ, а также варианты данного способа, которые также включены в рамки настоящего изобретения, подробно описаны в патенте US 4889920, который включен в данное описание изобретения посредством ссылки, как если бы он был полностью изложен в данном описании изобретения.
В еще одном предпочтительном воплощении теплозависимой сушки желатина для получения желатина, который может образовывать раствор с mTG при пониженных температурах, желатин с влагосодержанием более 8% по массе в расчете на общую массу желатина и воды подвергают микроволновому нагреванию для удаления по меньшей мере 35% указанного влагосодержания с получением обработанного желатина, имеющего влагосодержание не более 16% от массы в расчете на общую массу желатина и воды. Данный способ, а также варианты данного способа, которые следует также считать частью настоящего изобретения, подробно описаны в патенте US 4224348, который включен в данное описание изобретения посредством ссылки, как если бы он был полностью изложен в данном описании изобретения.
В другом воплощении теплозависимой сушки желатина для получения желатина, который может образовывать раствор с mTG при пониженных температурах, желатин сушат при 100°C при пониженном давлении, как описано в патенте US 2803548, который включен в данное описание изобретения посредством ссылки, как если бы он был полностью изложен в данном описании изобретения. Этот способ изменяет нити самого желатина, делая их неспособными к термообратимому гелеобразованию. Хотя сшивание желатина с помощью mTG не зависит от способности желатина образовывать термообратимый гель, такой способ сушки приводит к ослаблению нитей желатина, и, следовательно, любого геля, образованного с использованием такого желатина в сшивании желатин-mTG.
В другом воплощении изобретения желатин в смеси желатин-mTG подвергают очень специфическим способам сушки, которые включают использование лиофилизации перед его смешиванием с mTG. Данные способы сушки увеличивают растворимость желатина, понижая его точку плавления, предпочтительно ниже рабочих комнатных температур. Способы сушки могут увеличивать растворимость желатина без каких-либо добавок и без изменения условий окружающей среды, при которых образуются растворы желатина или желатина-mTG. Однако добавление некоторых добавок, таких как пластификаторы или стабилизаторы, или управление некоторыми факторами окружающей среды, такими как температура, ионная концентрация и осмотическое давление, растворов желатина или желатина-mTG можно использовать для дополнительного улучшения свойств смеси желатин-mTG, которая уже включает желатин, высушенный с использованием способа лиофилизации, который понижает его точку плавления.
В предпочтительном воплощении лиофильной сушки желатина для получения желатина, который может образовать раствор с mTG при пониженных температурах, желатин, растворенный в воде в концентрации 0,1-2% по массе, лиофильно сушат при пониженном давлении. Данный способ, а также варианты данного способа, которые также следует считать частью настоящего изобретения, подробно описаны в патенте US 2166074, который включен в данное описание изобретения посредством ссылки, как если бы он был полностью изложен в данном описании изобретения
В другом воплощении изобретения смесь желатин-mTG подвергают лиофлизации после того, как желатин и mTG уже были смешаны в растворе. Это снижает точку плавления желатин, и в то же время приводит к равномерно смешанной, лиофилизированной смеси желатин-mTG, где желатин в сухой форме находится в контакте с mTG в сухой форме. В данном воплощении желатин и mTG одновременно восстанавливают из лиофилизированного состояния и они сразу же образуют раствор на месте восстановления. Данный способ можно предпочтительно применять с желатином или желатиновой смесью, которые уже имеют более низкую точку плавления, чем стандартный желатин, так как активность mTG экспоненциально уменьшается при более низких температурах (ниже примерно 37°C).
Таким образом, раствор, состоящий из желатина с пониженной точкой плавления и mTG, может быть образован при низкой температуре без быстро происходящего сшивания и гелеобразования. Затем такой раствор можно лиофилизировать, получая в высушенной смеси однородно распределенные желатин и mTG. Такую смесь можно быстро восстановить с образованием геля путем приведения в контакт с более теплым растворителем. Такой способ предпочтительно можно использовать в повязке для ран, где физиологические жидкости при их естественной температуре 37°C могут восстанавливать желатин и mTG.
Предпочтительно, согласно некоторым воплощениям настоящего изобретения, предложена смесь частиц желатин-mTG с целью остановки кровотечения или изоляции ткани, где желатин и mTG вместе взятые сушат распылением с образованием хорошо диспергированного порошка, содержащего желатин и mTG в концентрации, подходящей для кровоостанавливающих или тканеизолирующих применений.
В другом воплощении настоящего изобретения желатин, используемый в виде части смеси желатин-mTG, был гидролизован, частично гидролизован, или некоторый процент желатиновой смеси был гидролизован или частично гидролизован с целью увеличения их растворимости. Пример такого метода был успешно продемонстрирован в способе, включающем покрытие гранул стандартного желатина пленкой гидролизованного желатина (патент US 4729897, который включен в данное описание изобретения посредством ссылки, как если бы он был полностью изложен в данном описании изобретения). Данное воплощение может включать применение желатина, который был гидролизован или частично гидролизован, в присутствии пластификатора, который может включать многоатомный спирт, углевод или другой пластификатор, как описано выше.
В другом воплощении настоящего изобретения раствор, содержащий предварительно смешанные mTG и желатин, или другие белковые гидролизаты, лиофильно сушат для увеличения стабильности соединения. Такой способ, который применяли в получении композиции, используемой для производства пищевых продуктов, описан в патенте US 6030821, который включен в данное описание изобретения посредством ссылки, как если бы он был полностью изложен в данном описании изобретения.
В другом воплощении настоящего изобретения желатин, используемый как часть смеси желатин-mTG, сушили распылением после смешивания с кислотой с образованием слабокислого желатинового раствора, где кислота составляет 5-20% содержания желатина, что позволяет образоваться мелким каплям для улучшенной сушки. Такой способ описан в канадском патенте 896965, который включен в данное описание изобретения посредством ссылки, как если бы он был полностью изложен в данном описании изобретения.
В другом воплощении настоящего изобретения один или более из вышеописанных способов улушения продукта, содержащего желатин и mTG, используют совместно или последовательно. Способ может предпочтительно включать совместное использование двух или более пластификаторов в желатиновом растворе или в растворе желатин-mTG, использование одного или более пластификаторов в растворе желатина или желатин-mTG до его сушки с использованием одного из описанных способов сушки. Способ может также включать сушку желатина или желатина-mTG с использованием одного способа сушки, растворения высушенных желатина или желатин-mTG в растворе и затем повторную сушку желатина или желатина-mTG.
Такие способы также возможно можно использовать для композиции, которая претерпевает термообратимое гелеобразование, предпочтительно включая композиции, содержащие, например, различные комбинации нежелатиновых белков и также возможно другие сшиватели (отличные от трансглутаминазы).
Бандажи
Типичное воплощение настоящего изобретения направлено на кровоостанавливающую повязку, например, для обработки раненой ткани у пациента, которая содержит желатин и трансглутаминазу, предпочтительно разделенные, пока их взаимодействие будет требоваться или будет желательным для активности бандажа. Бандаж возможно может включать неабсорбирующую основу, такую как пластиковая основа. Бандаж также возможно может включать рассасывающийся слой вещества.
Еще одно воплощение настоящего изобретения направлено на кровоостанавливающую повязку для обработки раненой ткани у пациента, которая возможно и предпочтительно содержит: (1) желатиновый слой; (2) слой трансглутаминазы, прилегающий к указанному желатиновому слою; где слой трансглутаминазы имеет одинаковую протяженность или неодинаковую протяженность с желатиновым слоем.
Другое воплощение настоящего изобретения направлено на кровоостанавливающую повязку для обработки раненой ткани у пациента, которая возможно и предпочтительно содержит: (1) рассасывающийся или нерассасывающийся слой вещества; (2) желатиновый слой, прилегающий к указанному слою вещества; (3) слой трансглутаминазы, прилегающий к указанному желатиновому слою; слой трансглутаминазы имеет одинаковую протяженность или неодинаковую протяженность с желатиновым слоем.
Другое воплощение настоящего изобретения направлено на кровоостанавливающее средство для обработки раненой ткани у пациента, которое содержит: (1) первый желатиновый слой; (2) рассасывающийся слой вещества, прилегающий к первому желатиновому слою; (3) слой трансглутаминазы, прилегающий к рассасывающемуся слою вещества; и (4) второй желатиновый слой, прилегающий к слою трансглутаминазы, где слой трансглутаминазы имеет неодинаковую протяженность с первым и/или вторым желатиновым слоем.
Согласно некоторым воплощениям в настоящем изобретении предложена кровоостанавливающая повязка (например, бандаж), которая содержит слой трансглутаминазы, помещенный между первым и вторым слоями желатина, где слой трансглутаминазы может имеет одинаковую протяженность или неодинаковую протяженность с первым и/или вторым желатиновым слоем. Такая кровоостанавливающая повязка полезна для обработки ран. Преимуществом модели с неодинаковой протяженностью является подавление отслаивания слоев, по сравнению с повязками, в которых слой трансглутаминазы имеет одинаковую протяженность с полными первым и вторым желатиновыми слоями. Однако кровоостанавливающее действие модели с одинаковой протяженностью может быть лучше, чем у модели с одинаковой протяженностью.
Согласно другим воплощениям настоящего изобретения предложена повязка по изобретению, которая возможно и предпочтительно содержит: (1) рассасывающуюся или нерассасывающуюся матрицу; (2) желатин; (3) трансглутаминазу; где желатин и трансглутаминаза включены в указанную матрицу.
В еще одном воплощении кровоостанавливающее средство содержит: (1) пористую рассасывающуюся или нерассасывающуюся матрицу; (2) желатин; (3) трансглутаминазу; где желатин и трансглутаминаза прилипают к указанной матрице.
В различных воплощениях слой трансглутаминазы может быть сформировать любым из множества форм и картин. Например, и без ограничения, слой трансглутаминазы можно сформировать в виде совокупности пятен, содержащих трансглутаминазу, или в виде одиночного пятна, содержащего трансглутаминазу. Альтернативно, слой трансглутаминазы можно сформировать в виде множества полос, содержащих трансглутаминазу.
Каждый слой кровоостанавливающих повязок также возможно может содержать один или более подходящих наполнителей, связывающих агентов и/или солюбилизаторов. Кроме того, каждая из кровоостанавливающих повязок также возможно может содержать разделяющий слой, который содержит разделяющий агент и/или материал основы.
Согласно предпочтительным воплощениям каждый слой кровоостанавливающих повязок возможно может содержать один или больше подходящих наполнителей, таких как сахароза. Каждый слой кровоостанавливающих средств также возможно может содержать один или более подходящих связывающих агентов, таких как сахароза. Каждая из кровоостанавливающих повязок также возможно может содержать разделяющий слой, который содержит разделяющий агент. Типичный разделительный агент представляет собой сахарозу. Каждый слой кровоостанавливающих повязок также возможно может содержать один или более чем один подходящий солюбилизирующий агент, такой как сахароза.
Без желания быть ограниченными одной гипотезой свойства сахарозы как части настоящего изобретения могут возможно по меньшей мере частично определяться добавленным количеством. В относительно высоких концентрациях (20-30%-ный раствор сахарозы) его можно нанести распылением на поверхность (такую, как бандаж) для получения поверхности для нанесения еще одного раствора (такого, как желатин или раствор mTG) подлежащего приклеиванию. При более низких концентрациях (например, приблизительно 2%) сахарозу можно добавлять к желатину или раствору mTG, чтобы помочь такому раствору прилипнуть к поверхности (такой, как бандаж).
Каждый слой кровоостанавливающих повязок также возможно может содержать один или более подходящих пенообразующих агентов, таких как смесь лимонной кислоты и бикарбоната натрия.
Каждая из кровоостанавливающих повязок также может содержать материал основы на стороне средства, обратного лицевой стороне, обращенной к ране, когда средство применяется. Материал основы может быть прикреплен с помощью физиологически приемлемого адгезива или может быть самоадгезивным (например, иметь поверхностное статическое электричество). Материал основы может представлять собой рассасывающееся вещество или нерассасывающееся вещество, такое как силиконовый пластырь или пластиковый пластырь, и/или устройство, такое как сосудистый катетер и/или другой тип медицинского устройства, которое возможно может быть введено в тело.
Слой трансглутаминазы может быть нанесен на первый желатиновый слой, таким образом чтобы он являлся одинаковым по протяженности с первым желатиновым слоем и/или был бы не одинаковым по протяженности со вторым желатиновым слоем при нанесении второго желатинового слой. Например, слой трансглутаминазы может занимать от примерно 5% до примерно 95% площади поверхности первого желатинового слоя и/или от примерно 5% до примерно 95% площади поверхности второго желатинового слоя. Трансглутаминазу можно наносить на желатиновый слой одним пятном или в виде ряда пятен на желатиновом слое, таким образом, что общая площадь поверхности трансглутаминазных пятен занимала от примерно 5% до примерно 95% площади поверхности первого желатинового слоя и/или от примерно 5% до примерно 95% площади поверхности второго желатинового слоя.
Такое пятно или пятна трансглутаминазы могут иметь любую геометрическую форму, например, заполненных или незаполненных кругов, прямоугольников, треугольников, полосок, неопределенных форм или их комбинации. Такие пятна можно наносить на первый желатиновый слой упорядоченным или случайным образом. Множество пятен может образовать любое из множества форм и картин, таких как массив, сетка, ряд концентрических пятен (например, концентрических кругов или пятна), перекрывающиеся ряды вкраплений (например, перекрывающиеся круги), лучи, выходящие из оси, или любая другая конфигурация, при условии, что общая площадь поверхности трансглутаминазы составляет от примерно 5% до примерно 95% площади поверхности первого желатинового слоя и/или от примерно 5% до примерно 95% площади поверхности второго желатинового слоя. В общем случае большое число небольших вкраплений является предпочтительным по сравнению с небольшим числом больших пятен. Например, массив 20 по 20 пятен в общем случае является предпочтительным по сравнению с массивом 10 по 10 пятен, занимающим такую же общую площадь поверхности. Однако пятна могут быть любого размера при условии, что общая площадь поверхности трансглутаминазы составляет от примерно 5% примерно 95% площади поверхности первого желатинового слоя и/или от примерно 5% до примерно 95% площади поверхности второго желатинового слоя. Например, в зависимости от общего размера повязки, пятна могут быть диаметром, шириной или длиной, без ограничения, по меньшей мере примерно 0,01, 0,1, 0,5, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10 мм или более. В одном воплощении, например, 4 круглых пятна, диаметром 2-3 мм каждый, могут занимать квадратный сантиметр повязки. Ряд других конфигураций входят в объем данного изобретения и могут быть легко использованы специалистами в данной области техники.
Повязку возможно можно получать в виде любого множества размеров и форм. Обычно повязки имеют такие размер и форму, чтобы с ними мог легко обращаться специалист в данной области техники, обычно менее 12 дюймов (30,5 см) в длину вдоль любой стороны, например, I"×I" (2,54×2,54 см), I"×2" (2,54×5,08 см), 4"×4" (10,16×10,16 см) и так далее. Уровень влажности повязки обычно составляет менее 8% (например, менее 7, 6, 5, 4, 3, 2 или 1%).
Любое из множества рассасывающихся веществ, известных специалистам в данной области техники, возможно можно использовать в настоящем изобретении. Например, рассасывающееся вещество может представлять собой белковое вещество, такое как фибрин, кератин, коллаген и/или желатин, или углеводные вещества, такие как альгинаты, хитин, целлюлоза, протеогликаны (например, поли-N-ацетилглюкозамин), полимеры гликолевой кислоты, полимеры молочной кислоты или сополимеры гликолевой кислоты/молочной кислоты. Например, рассасывающееся вещество может представлять собой углеводное вещество. Иллюстративные примеры рассасывающихся веществ продаются под торговыми знаками VICRYL.TM. и DEXON.TM.
В общем случае различные слои кровоостанавливающей повязки могут быть присоединены один к другому посредством любых способов, известных и доступных специалистам в данной области техники. Например, возможно и предпочтительно желатиновый слой(и) и/или сло(и) трансглутаминазы наносят в виде ряда слоев быстрозамороженного водного раствора и затем лиофилизированного или высушенного сублимацией, например, после нанесения каждого слоя и при сборке всей повязки. Слои можно наносить любым из множества способов, включая распыление, пипетирование (например, с помощью микроканального дозатора), орошение, используя маску, электростатическое осаждение, используя систему массива микрошприцов, или диспергируя с использованием раздаточной гребенки, которая содержит отверстия, для получения поля с высокой плотностью.
В некоторых воплощениях настоящего изобретения, если повязки получают, используя форму, разделяющий агент, такой как сахароза, вносят в форму перед нанесением первого слоя средства. В таком воплощении кровоостанавливающее средство дополнительно содержит разделяющий слой, который содержит указанный разделяющий агент.
Альтернативно, физиологически приемлемый адгезив можно наносить на рассасывающееся вещество и/или материал основы (если оно присутствует), и желатиновый слой(и) и/или слой(и) трансглутаминазы последовательно присоединяют к нему.
В одном воплощении повязки физиологически приемлемый адгезив имеет такую прочность при сдвиге и/или структуру, что рассасывающееся вещество и/или материал основы можно отделить от желатинового слоя после нанесения средства на раненую ткань. В еще одном воплощении физиологически приемлемый адгезив имеет такую прочность при сдвиге, что рассасывающееся вещество и/или материал основы не может отделиться от желатинового слоя после прикладывания повязки к раненой ткани.
Концентрация желатина на единицу площади раны зависит от ряда факторов, включая, но без ограничения ими, конечную конструкцию бандажа, используемые вещества и так далее.
Согласно другим воплощениям настоящего изобретения предложены способы получения кровоостанавливающей повязки, при которых возможно и предпочтительно берут первый слоя желатина, наносят слой трансглутаминазы на первый слой желатина, и наносят второй слоя желатина на слой трансглутаминазы, где слой трансглутаминазы является неодинаковым по протяженности с первым желатиновым слоем и/или неодинаковым по протяженности со вторым желатиновым слоем.
Аналогично, другие воплощения изобретения включают способ получения кровоостанавливающей повязки путем получения рассасывающегося или нерассасывающегося слоя основы, присоединенного к нему первого слоя желатина; нанесение слоя трансглутаминазы на указанный первый слой желатина на ту сторону желатинового слоя, которая противоположна стороне, к которой рассасывающийся или нерассасывающийся слой основы присоединен; и нанесение второго слоя желатина на слой трансглутаминазы, где слой трансглутаминазы является неодинаковым по протяженности с первым желатиновым слоем и/или неодинаковым по протяженности со вторым желатиновым слоем.
Кровоостанавливающее устройство
Еще одно типичное воплощение настоящего изобретения направлено на кровоостанавливающее устройство, например, для остановки кровотечения в хирургической обстановке у интенсивно истекающего кровью пациента, которое содержит: (1) пористую рассасывающуюся или нерассасывающуюся матрицу; (2) желатин в порошковой форме, в виде смеси частиц или другой твердой форме, и (3) трансглутаминазу в порошковой форме, в виде смеси частиц или другой твердой форме; где желатин и трансглутаминазу включают в указанную матрицу.
Еще одно воплощение настоящего изобретения направлено на кровоостанавливающее устройство, например, для остановки кровотечения в хирургической обстановке у интенсивно истекающего кровью пациента, которое содержит: (1) пористую рассасывающуюся или нерассасывающуюся матрицу; (2) желатин; (3) трансглутаминазу; где желатин и трансглутаминаза приклеены к указанной матрице.
Другие воплощения настоящего изобретения включают нанесение кровоостанавливающей/изолирующей смеси принятыми способами нанесения изолирующего средства. Такие способы возможно могут включать применение смеси в виде части геля, пены или спрея. Нанесение кровоостанавливающей/изолирующей смеси данными способами может возможно достигаться, например, путем раздельного хранения компонентов смеси и смешивания их непосредственно перед нанесением; и/или, например, возможно путем совместного хранения компонентов в неактивированной форме и активирования их непосредственно перед нанесением. Неактивированные формы изолирующих компонентов возможно могут быть представлены в виде одного или более замороженного раствора, лиофилизированного порошка, который требует растворения, высушенного распылением порошка, который требует растворения, и/или любой другой полдходящей формы неактивированной изолирующей смеси.
Получение кровоостанавливающего устройства
Согласно некоторым воплощениям настоящего изобретения методику сублимационной сушки и/или лиофилизации возможно можно использовать для прилипания или фиксации изолирующей композиции по настоящему изобретению на поверхность любых катетеров, троакаров или имплантов, или действительно любого другого подобного медицинского средства. Это возможно может облегчить остановку кровотечения при проникающей ране и ее закрытие, которое возможно может быть полезным, например, для артериальных катетеров/устройств. Остановка кровотечения после операции на артерии является критичной для пациентов, которых лечили антикоагуляционной терапией и которые более предрасположены к осложнениям кровотечения. Кровоостанавливающая композиция по настоящему изобретению является независимой от свертывания крови и поэтому предлагает дополнительную помощь для предотвращения чрезмерного кровотечения.
Применение устройства, композиции или бандажа
Во время применения кровоостанавливающей повязки, устройства или агента желатин и трансглутаминазу можно активировать в тот момент, когда повязку, устройство или смесь частиц наносят на раненую ткань с помощью эндогенных жидкостей (например, крови, воздуха, желчи, желудочно-кишечной жидкости) пациента, выделяющихся из кровоточивой или сочащей раны. Альтернативно, в ситуациях, когда потеря жидкости из раненой ткани является недостаточной для обеспечения достаточной гидратации белковых слоев, желатин и/или трансглутаминаза могут быть активированы путем нанесения физиологически приемлемой жидкости (например, воды, буфера, физиологического раствора), возможно содержащей любые необходимые кофакторы и/или ферменты, перед применением или при применении кровоостанавливающей повязки, устройства или агента к раненой ткани.
Принципы и осуществление настоящего изобретения могут быть лучше поняты со ссылкой на графические материалы и прилагаемое описание.
Обращаясь к графическим материалам:
Фиг.1 представляет собой схематическую блок-схему типичного бандажа по настоящему изобретению. Как показано, бандаж 100 предпочтительно включает по меньшей мере один и предпочтительно несколько слоев желатина 102, показанных в виде двух таких слоев только с целью описания и без намерения каким-либо образом ограничить изобретение. Также предпочтительно представлен по меньшей мере один слой трансглутаминазы 104; в данном примере слой трансглутаминазы 104 показан в виде слоя, помещенного между множеством слоев желатина 102 только с целью пояснения и без намерения каким-либо образом ограничить изобретение. Также показана подходящая основа 106, которая предпочтительно обеспечивает механическую прочность бандажа 100. Основа 106 возможно может быть выполнена в виде сетки или пластыря из полигликолевой кислоты, таких как, например, предлагаемые Dexon™ или Vicryl™.
На Фиг.2 показан вид спереди типичного бандажа по настоящему изобретению, покрытого возможной абсорбируемой основой и возможной пластиковой оберткой.
Фиг.3 представляет собой схематическую блок-схему типичного кровоостанавливающего устройства по настоящему изобретению, включающего пористую матрицу. Как показано, кровоостанавливающее устройство 300 предпочтительно включает по меньшей мере один и предпочтительно множество слоев желатина 302, показанных в виде двух таких слоев только с целью описания и без намерения каким-либо образом ограничить изобретение. Также предпочтительно представлен по меньшей мере один слой трансглутаминазы 304; в данном примере слой трансглутаминазы 304 показан в виде слоя, помещенного между множеством слоев желатина 302, только с целью описания и без намерения каким-либо образом ограничить изобретение. Также показана подходящая основа 306, которая предпочтительно обеспечивает механическую прочность бандажа 300. Основа 306 возможно может быть выполнена в виде любого типа биоразлагаемого вещества.
Обращаясь теперь к приведенным ниже примерам, различные композиции по настоящему изобретению были созданы и исследованы в отношении их способности уменьшать кровотечение и индуцировать остановку крови. Обнаружено, что исследованные композиции являются очень действенными и были способны останавливать кровотечение, даже артериальное кровотечение, у экспериментального животного.
ПРИМЕР 1
Получение иллюстративного адгезива
Данный пример относится к получению иллюстративного, неограничивающего объем изобретения адгезива по настоящему изобретению. Для данного примера использовали кальцийнезависимую микробную трансглутаминазу (Lot No. L-04207, Ajinomoto USA, Chicago, IL) с уровнем специфической активности 100 ед./г. Также исследованный желатин представлял собой желатин типа А, с прочностью геля по Блуму 300 из свиной шкуры (Sigma-Atdrich, St. Louis, МО).
Следующий способ использовали для получения иллюстративного адгезива: получали 20%-ный мас./мас. желатин в PBS (фосфатно-солевой буферный раствор; 20 г желатина в 80 г PBS). После этого получали 20%-ный мас./об. раствор mTG в PBS (1 г mTG в 5 мл PBS). Затем 5 г раствора желатина смешивали с 0,5 мл раствора mTG (другими словами, в соотношении 10:1).
На Фиг.4 показано влияние разных процентных содержаний желатина на прочность прилипания адгезива. Прочность прилипания измеряли, прилепляя образца свиной шкуры ко второму такому образцу, помещая 47,5 г массы на место соединения, и затем сразу же погружая его в воду на 120 минут. После периода погружения прикладывали растягивающее усилие 5 мм/мин для определения предельной прочности прилипания (Mcdermott et al. Biomacromolecules 2004, 5, 1270-1279).
Как показано на Фиг.5, оптимальный уровень реактивности микробной трансглутаминазы находится в диапазоне 50-55°C. При физиологическом уровне 37°C уровень реактивности составляет только примерно 60% оптимального уровня. Как таковое, повышение температуры реакции с использованием экзотермического агента повышало уровень реактивности и, таким образом, ускоряло сшивание желатина. Таким образом, возможно и предпочтительно экзотермический агент представляет собой часть настоящего изобретения.
Кальций возможно можно использовать как часть такого агента, так как хлорид кальция высвобождает тепло при растворении, но не недостаточно тепла, чтобы повредить ткань. Кроме того, как указано выше, кальций возможно помогает ускорить взаимодействие другим образом, независимо от его экзотермического растворения.
Возможно, нетоксичное экзотермическое вещество может быть включено в бандаж с одним или более факторами сшивания. Альтернативно или дополнительно, один или более чем один нерассасывающийся экзотермический агент возможно может быть добавлен после основы бандажа, как описано ранее.
ПРИМЕР 2
Исследование разрывающего давления in vitro
Данный пример демонстрирует способность композиции по настоящему изобретению сопротивляться разрыванию в качестве приближения к ее способности сопротивляться потоку артериальной крови высокого давления. Систему разрывающего давления разрабатывали, как описано ниже, чтобы имитировать поток крови высокого давления, с теплым PBS, используемым вместо крови для приложения давления на рану в образце свиной кожи. Сопротивление давлению 200 мм рт.ст. (26,7 кПа) в течение 2 минут считалось критерием успеха, так как физиологическое кровяное давление почти всегда ниже 200 мм рт.ст. Такие результаты испытания на разрыв показали, что композиции по настоящему изобретению пригодны для лечения потока крови, включая артериальный поток высокого давления.
Большинство образцов (8/10) выдерживало давление 200 мм рт.ст. (26,7 кПа) в течение 2 минут. Те образцы, которые не прошли, вероятно относились к человеческой или системной ошибке. Среднее разрывающее давление составляло 320±50 мм рт.ст (42.65±6,67 кПа), но это значение является заниженным, так как образцам, которые не разорвались, приписывали численное значение 354 мм рт.ст. (47,2 кПа), так как оно представляло собой максимальное значение, измеряемое с помощью экспериментальной аппаратуры. Эти результаты демонстрируют возможность применения адгезивной композиции согласно некоторым воплощениям настоящего изобретения с целью остановки крови, даже в жестких условиях тестирования.
Вещества
Желатин (тип А от свиней, значение прочности геля по Блуму 300) получали от Sigma-Aldrich (St. Louis, МО). Смесь кальцийнезависимой микробной трансглутаминазы (mTG) TG-TI получали от Ajinomoto и использовали без дополнительной очистки. Как сообщается производителем, данный фермент должен иметь специфическую активность 100 ед./г. Свиную кожную ткань приобретали в местном продуктовом магазине.
Получение образца
Свиную шкуру обрабатывали разбавленным NaOH в течение 1 ч, затем нарезали в форме дисков с диаметром примерно 6-6,5 см. Жир на коже удаляли скальпелем. Отверстие 2 мм пробивали в центре участка кожи для моделирования раны. Шкуру промывали большим количеством воды и буфера PBS и до использования хранили в чашке Петри с примерно 1 мл буфера PBS для сохранения влажности кожи. Для всех экспериментов, описанных в данном описании изобретения, использовали фосфатно-солевой буферный раствор Дулбекко с pH 7,4 буфера PBS.
Раствор желатина (25% мас./мас.) в буфере PBS готовили каждый день заново и до использования хранили при 65°C. Получали исходный раствор mTG (20% мас./мас.) в буфере PBS и аликвотировали его в 2 мл флаконы, и хранили при -18°C. Раствор фермента перед использованием размораживали при комнатной температуре.
Поверхность кожи осушали с помощью лабораторной тканевой салфетки, затем наносили адгезив. Адгезив получали в 2 мл флаконе путем смешивания 1 мл желатина и 0,5 мл mTG. Получали две разные композиции. В композиции "А" использовали трансглутаминазу от Ajinomoto, в то время как в композиции "Б" использовали трансглутаминазу от (Yiming Biological Products Со. (Jiangsu, China); предпочтительный продукт, как описано выше). 0,6 мл полученной смеси (типичная тканевая адгезивная композиция по настоящему изобретению) наносили на свиную кожу поверх отверстия. После нанесения адгезива кожную ткань инкубировали при 37°C в течение 30 мин. Испытания на разрыв выполняли немедленно после инкубирования.
Испытание на разрыв
Самодельное устройство уравновешивали в теплом буфере (~44°C) перед сборкой. После быстрой установки инкубированной кожи в устройство примерно 50 мл буфера PBS при 42°C вливали в устройство наверх кожной ткани. Поток азота контролировали вручную для увеличения давления. Общая методика для испытания на разрыв была следующей:
Стадия 1 - увеличение давления до 200 мм рт.ст. (26,7 кПа) и выдерживание в течение 2 минут;
Стадия 2 - увеличение давления до 300 мм рт.ст. (40 кПа) и выдерживание в течение 2 минут;
Стадия 3 - увеличение давления до >354 мм рт.ст. (47,2 кПа) (максимальное измеряемое давление).
В качестве контролей к коже прикладывали чистый желатиновый раствор и давали возможность образовать гель (например, застыть) при комнатной температуре в течение 30 мин путем образования физического геля. Желатин-теплый относится к использованию буферного раствора 42°C, который может плавить физический желатиновый гель.
Результаты
На Фиг.6 показаны типичные измерения давления на разрыв для тканевых адгезивов на основе композиции А. Данные показаны для образцов №4 и №5 на Фиг.6. Обобщение результатов испытания на разрыв для композиции А приведены в Таблице 2, в то время как полный перечень образцов приведен в Таблице 3.
На Фиг.7 показаны репрезентативные измерения давления на разрыв тканевых адгезивов композиции Б. Данные показаны для образцов №4 и №5 на Фиг.7. Результаты для полного перечня образцов показаны в Таблице 4.
Пример 3
Остановка кровотечения в крысиной модели
В данном примере представлена первоначальная in vivo демонстрация композиции желатин-mTG по настоящему изобретению для достижения остановки крови у живого животного. Крыса представляла собой взрослую самку сирийской крысы.
Вещества
Использовали раствор желатина, который включал 25% мас./мас. желатина (свиной, тип А, прочности геля по Блуму 300, от Sigma-Aldrich (St. Louis, МО)) в PBS. Раствор смешивали путем примешивания нагретого (50°C) PBS в желатиновый порошок, по мере того как его перемешивали вручную, используя шпатель. Перед применением раствор желатина хранили в закрытых колпачками 5 мл шприцах, погруженных в 50°C водяную баню для поддержания его жидкой фазы.
Раствор трансглутаминазы (mTG) включал 20% мас./мас. микробной трансглутаминазы (Activa WM, Ajinomoto™) в PBS. Раствор mTG поддерживали при комнатной температуре.
Перед применением 1 мл раствора желатина добавляли к 0,5 мл раствора mTG в 2 мл пробирке Эппендорфа. Пробирку переворачивали 2-3 раза для смешивания растворов, и затем раствор накладывали на область раны, используя 1 мл наконечник для пипетки. Это был экспеиментальный раствор.
Для контрольного раствора протокол повторяли, но без добавления раствора mTG, так что вводили один желатин.
И для экспериментального, и для контрольного использований наконечник для пипетки отрезали приблизительно в 1/2 см от конца, чтобы увеличить отверстие и облегчить прохождение вязкого раствора желатин-mTG.
Рана в печени
И для экспериментального, и для контрольного использований разрезали левую долю печени, используя скальпель, в рострально-каудальном направлении, создавая сагиттальный разрез длиной 1 см, 1/2 см глубиной. Через приблизительно 10 секунд кровотечения использовали хлопковую марлю для удаления скопившейся крови непосредственно перед нанесением растворов либо желатина (контроль), либо желатина-mTG (экспериментальный).
Первый, экспериментальный, раствор наносили на разрез на левой стороне доли. Гель образовывался приблизительно через две минуты после нанесения, и кровотечение полностью останавливалось менее чем через примерно 2,5 минуты после нанесения. Через 5 минут ткань энергично встряхивали, и прикладывали растягивающее напряжение поперек области раны, используя пинцет, пока еще гель оставался неповрежденным и рана закрытой. Фиг.8 представляет собой фотографию, показывающую образование геля, а также индукцию остановки крови (на Фиг.8А показана вся область, в то время как на Фиг.8Б показана часть области, увеличенной для показа подробностей).
Впоследствие контрольный раствор наносили на разрез на правой стороне доли. Гель не образовывался, и раствор большей частью вымывался из участка раны посредством кровотечения. Даже через 6-7 минут сгусток не образовывался, и печень продолжала кровоточить (Фиг.9А).
Контрольный раствор удаляли, и затем на участок раны наносили экспериментальный раствор без удаления скопившейся крови. Несмотря на то что скопившаяся кровь заметно мешала прилипанию экспериментального раствора к печени, гель все же образовывался, что в значительной степени замедляло кровотечение примерно через одну минуту и полностью останавливало его через 4,5 минуты (Фиг.9Б). Это показало, что композиция по настоящему изобретению способна замедлить кровотечение и индуцировать остановку кровотечения даже в присутствии скопившейся крови.
Разрез бедренной артерии
Левую бедренную артерию крысы разрезали, используя скальпель. Через приблизительно 10 секунд интенсивного кровотечения для удаления скопившейся крови использовали хлопковую марлю непосредственно перед нанесением раствора желатин-mTG (экспериментального). Когда раствор был нанесен, кровь смешивалась с экспериментальным гелем, по мере того как происходило гелеобразование. В данных жестких условиях гель по-прежнему полностью останавливал кровотечение менее чем за три минуты. Через 5 минут гель испытывали вручную, используя пинцет. Гель был заметно менее крепким и менее клейким, когда его интенсивно смешивали с кровью, но по-прежнему образовывал прочный сгусток поверх разрезанного участка артерии. Фиг.10 А-Г показывают фотографии артерии: как она была разрезана (10А); разрезанную артерию с обильным кровотечением (10Б); нанесение композиции по настоящему изобретению на разрезанную артерию (10В); и остановку кровотечения с образованием биомиметического сгустка (10Г).
Затем разрезали правую бедренную артерию крысы, используя скальпель. Через приблизительно 10 секунд кровотечения для удаления скопившейся крови использовали хлопковую марлю непосредственно перед нанесением раствора желатин-mTG (экспериментального). Наблюдалось интенсивное кровотечение, но оно почти немедленно было остановлено гелем, и кровотечение было полностью остановлено менее чем за одну минуту. Гель держался очень прочно, и кровь, которую задержали с помощью геля, была легко заметна. Через 5 минут гель испытывали вручную, используя пинцет. Он приклеился к ткани очень прочно на участке артерии, несмотря на присутствие захваченной крови в образованном геле.
Таким образом, ясно, что композиции по настоящему изобретению способны замедлять скорость кровотечения и индуцировать останову крови у модели in vivo, даже в присутствии скопившейся крови и/или интенсивного кровотечения (как, например, из артерии и/или васкуляризованного органа, включая, но без ограничения ими, например, печень, желудок, почки, сердце, легкие и/или кожу).
Пример 4
Остановка кровотечения на свиной модели
В данном примере представлена первоначальная демонстрация in vivo композиции желатин-mTG по настоящему изобретению для достижения остановки кровотечения у крупной животной модели. Была ясно показана возможность применения для остановки кровотечения на крупной животной модели.
Вещества
Раствор желатина включал 25% мас./мас. желатина (свиной, тип А, прочности геля по Блуму 300, от Sigma-Atdrich (St. Louis, МО)) в PBS (pH 7.4) и был получен, как описано в данном описании изобретения. PBS непрерывно перемешивали при 60°C, используя горячую плиту с магнитной мешалкой, в то время как постепенно добавляли порошок желатина. Ручное перемешивание с использованием стеклянной палочки выполняли периодически для увеличения скорости растворения порошка и получения гомогенного раствора. На всем протяжении эксперимента раствор желатина держали в горячей ванне, отрегулированной на ~50°C, для поддерживания его жидкой фазы и предупреждения образования термообратимого геля.
Раствор mTG включал 20% мас./мас. микробной трансглутаминазы (Activa WM, Ajinomoto™), растворенной в PBS (pH 7,4). Его готовили следующим образом. Раствор PBS комнатной температуры (комнатной температуры) перемешивали, используя магнитную мешалку, и постепенно добавляли порошок mTG. На всем протяжении эксперимента раствор mTG держали в горячей бане, отрегулированной на ~30°C, за исключением времени его фактического использования.
Взрослую самку свиньи массой 45 кг подвергали общей анестезии перед началом эксперимента. На всем протяжении эксперимента свинья находилась на искусственном дыхании, и показатели ее жизнедеятельности контролировались.
Перед нанесением на участок раны, как описано ниже, готовили раствор желатин-mTG по настоящему изобретению, и для помещения изолирующего средства на участок раны использовали аппликатор. В качестве поддерживающего бандаж материала изучали разные аппликаторы. Если не установлено иное, перед его непосредственным нанесением на участок раны, 6 мл нового хирургического изолирующего раствора наносили на аппликатор и оставляли охлаждаться в течение 1 мин при комнатной температуре. Эту подушечку, содержащую изолирующее вещество, считают "прототипом бандажа". Для "контрольного бандажа" следовали аналогичному протоколу, но с контрольным раствором, наносимым через аппликатор.
Новый хирургический изолирующий раствор - А: смесь 2:1 желатина с mTG. Если не установлено иное, смесь получали путем добавления 2 мл раствора mTG к 4 мл раствора желатина в 15 мл пробирке, и пробирку переворачивали 5 раз для смешивания растворов.
Контрольный раствор - для контрольного раствора повторяли методику, описанную для получения препарата нового хирургического изолирующего средства, за исключением того, что использовали только PBS вместо раствора mTG. Соответственно, желатин разбавляли в отношении 2:1 раствором PBS (pH 7,4), погружали в ~30°C горячую баню. Если не установлено иное, смесь готовили путем добавления 2 мл раствора PBS к 4 мл раствора желатина в 15 мл пробирке, и пробирку переворачивали 5 раз для смешивания растворов.
Использовали указанные ниже аппликаторы:
1. 4 см × 4 см хлопчатобумажная марлевая подушечка.
2. 4 см ч 4 см одноразовая впитывающая подушечка с пластиковой основой. Раствор наносили на пластиковую, не впитывающую сторону подушечки.
3. Силиконовая форма.
4. 4 см × 4 см одноразовая впитывающая подушечка с пластиковой основой, помещенная в силиконовую форму. Раствор наносили на пластиковую, не впитывающую сторону подушечки.
5. Прозрачная гибкая пластиковая форма с высокими кромками.
6. Непосредственное нанесение изолирующего средства на раневой участок с использованием шприца или розлив из 15 мл пробирки.
Нанесение нового хирургического изолирующего средства в данном исследовании выполнял хирург, вручную помещающий изолирующее средство на участок раны с использованием разных аппликаторов. При необходимости для удаления скопившейся крови непосредственно перед нанесением использовали хлопчатобумажную марлю. Кровоостанавливающее давление прикладывали к обратной стороне бандажа в течение 3 минут. Через 3 минуты хирург ослаблял давление, и наблюдали остановку кровотечения на этом участке раны. Если полная остановка кровотечения не происходила, участок раны закрывали общепринятыми хирургическими способами остановки крови. При нанесении контрольного раствора следовали тому же способу, и немедленно использовали общепринятые кровоостанавливающие способы, если не наблюдалось остановки кровотечения после удаления контрольного бандажа.
Рана ягодичной мышцы
Животное помещали в положении лежа на животе, и удаляли кожу над ягодичными мышцами. Всего провели 7 экспериментов, в которых изучали остановку крови и тканевую адгезию. Если не установлено иное, в каждом испытании мышцу площадью 3 см × 3 см надрезали в глубину на 2 см, используя скальпель №15. Избыток крови при необходимости удаляли из области раны, и новый хирургический изолирующий раствор или контрольный раствор наносили, как описано ранее.
В Таблицах 5 и 6 обобщены и описаны методика экспериментов и результаты каждого из экспериментов. Таблица 5 относится к остановке кровотечения, в то время как Таблица 6 относится к свойствам тканевых адгезивов.
Обращаясь сначала к остановке кровотечения, контрольный раствор наносили на участок раны, используя хлопчатобумажную марлевую подушечку (Таблица 5, контроль №1). Контрольный раствор наносили на хлопчатобумажную марлю и оставляли охлаждаться в течение 1 мин 20 сек перед его непосредственным применением. Участок раны только слегка кровоточил, и полную остановку кровотечения наблюдали через 2 мин после нанесения контрольного бандажа. Хотя биомиметический сгусток на участке раны не наблюдался, кровоостанавливающее давление, приложенное к участку раны, было достаточным, чтобы стимулировать остановку кровотечения.
Эксперимент повторяли на другом участке раны с той разницей, что используемый аппликатор представлял собой одноразовую подушечку с пластиковой основой, и контрольный раствор оставляли на 30 сек перед его нанесением (Таблица 5, контроль №2). Участок раны показал очень незначительное кровотечение, и через 2 мин после нанесения контрольного бандажа наблюдалась полная остановка кровотечения. Как и в предыдущем случае, это возможно происходило благодаря кровоостанавливающему давлению, приложенному к участку во время применения бандажа. Биомиметического сгустка на участке раны не наблюдалось.
Из-за небольшой величины кровотечения, наблюдаемого во время первых двух контрольных экспериментов, эксперимент повторяли, за исключением того, что делали более глубокий разрез глубиной 4 см (Таблица 5, контроль №3). Соответственно, наблюдалось интенсивное кровотечение. Контрольный раствор наносили на впитывающую прокладку и оставляли на 50 с. Хирург удалял избыток крови из области раны и накладывал контрольный бандаж. Через 3 мин кровотечение уменьшалось, но полной остановки кровотечения не наблюдалось.
Контрольный раствор удаляли из раневого участка, образованного в предыдущем эксперименте, используя хлопчатобумажную марлевую подушечку. По-прежнему наблюдалось кровотечение. К области раны прикладывали новое хирургическое изолирующее средство для достижения остановки кровотечения (Таблица 5, изолирующее средство №1). Изолирующий раствор помещали на впитывающую подушечку, оставляли на 1 мин и наносили на участок раны. Через 3 мин наблюдалась полная остановка кровотечения. Изолирующее средство образовывало биомиметический сгусток на раневом участке. Гель встряхивали, используя пинцет, и наблюдалось сильное прилипание к ткани. Гель удаляли, применяя некоторое усилие, и он выглядел как пленка. Таким образом, данные результаты демонстрируют кровоостанавливающие свойства композиции по настоящему изобретению.

После демонстрации кровоостанавливающей способности изолирующего средства на модели ягодичной мышцы изучали тканевую адгезию (Таблица 6). Сделали хирургические разрезы для подтяжки сегмента ткани из мышечного ложа, открывая раневой участок.
В первом эксперименте по адгезии (Таблица 6, изолирующая подушечка №2) изолирующее средство непосредственно наносили на раневой участок, и хирург немедленно прикладывал сильное давление на верхнюю часть ткани в течение 3 мин, вытесняя всю изолирующее средство из участка раны и приводя к отсутствию адгезии.
Эксперимент повторяли, за исключением того, что после нанесения изолирующего средства хирург применял только умеренное давление (Таблица 6, изолирующее средство №3). Через 3 мин оказалось, что ткани склеились. При встряхивании верхней части ткани чувствовалось умеренное сопротивление его полному удалению.
Эксперимент повторяли, обращая особое внимание на то, чтобы не вытеснить изолирующее средство с раневого участка при прикладывании давления (Таблица 6, изолирующее средство №4). На другом раневом участке изолирующее средство прикладывали на обе части ткани и оставляли на 10 сек. Затем верхнюю сторону ткани замещали и прикладывали умеренное давление. Через 3 мин наблюдали сильную тканевую адгезию. Требовалось значительное усилие, чтобы затем разделить склеенные ткани.
Остановка кровотечения в печени
Свинью располагали навзничь, и ее печень раскрывали посредством лапаротомии средней линии. Выполняли серийные разрезы для извлечения все более глубоких биопсий печени, последовательно раскрывая более крупные кровеносные сосуды. Всего заранее сформировали 5 биопсий. При необходимости использовали хлопчатобумажную марлю для удаления скопившейся крови непосредственно перед нанесением композиции по настоящему изобретению.
Для первой серий биопсий применяли контрольный бандаж с кровоостанавливающим давлением на обратную сторону бандажа в течение 3 минут. Через 3 минут хирург ослаблял давление, и участок раны осматривали в отношении остановки кровотечения. Если полная остановка кровотечения не происходила, выполняли более глубокую биопсию с последующим применением нового хирургического изолирующего средства. Снова применяли изолирующее средство с кровоостанавливающим давлением на обратную сторону бандажа в течение 3 мин, и затем проверяли остановку кровотечения. Когда наблюдалась полная остановки кровотечения, извлекали более глубокую биопсию печени, и эксперимент повторяли с изолирующим средством. Так демонстрировали кровоостанавливающую способность изолирующей прокладки в отношении высокого кровяного давления. В Таблице 7 обобщены методика эксперимента и результаты каждого эксперимента.
Биопсию глубиной 4 см извлекали из левой доли печени (Таблица 7, Контроль №1). Контрольный раствор наносили на впитывающую прокладку, помещенную в силиконовую матрицу, и оставляли на 1 мин. Контрольный бандаж с кровоостанавливающим давлением прикладывали поверх раневого участка. Через 3 мин давление снимали, и остановка кровотечения не наблюдалась.
После того как остановка кровотечения не была достигнута путем применения контрольной повязки, извлекали биопсию на 1 см глубже и оставляли кровоточить в течение 30 сек. Затем эксперимент повторяли с новым изолирующим средством (Таблица 7, изолирующее средство № 1). Новое изолирующее средство помещали на подушку в силиконовой матрице и через 1 мин прикладывали к раневому участку с кровоостанавливающим давлением. Через 3 мин давление ослабляли, прототипный бандаж снимали, и проверяли остановку кровотечения. Изолирующее средство образовало видимую биомиметическую пленку. Остановка кровотечения была достигнута, но не была полной, так как изолирующее средство не покрывало всю рану. Было очевидно, что поверхности, покрытые изолирующей прокладкой, прекращали кровоточить. При удалении биомиметической пленки через несколько минут кровоточивость возобновлялась.
Снова извлекали биопсию на 1 см глубже, вызывая обильное кровотечение. Эксперимент повторяли за исключением того, что в качестве аппликатора использовали силиконовую матрицу, и перед применением удаляли избыток крови (Таблица 7, изолирующее средство №2). Затем хирург прикладывал давление к раневому участку в течение 3 мин. Когда хирург убирал свою руку, поверх участка раны был виден биомиметический сгусток. Давление напора крови на биомиметический сгусток было заметным, и еще через несколько минут кровь прорвалась из-под края биомиметического изолирующего средства. Прорыв произошел через боковую часть раневого участка, которую не закрыли изолирующим средством. Это означало, что на данной стадии кровоостанавливающая способность изолирующего средства зависит от покрытия всего раневого участка.
Чтобы избежать прорыва, предыдущий эксперимент повторяли; за исключением того, что к участку раны прикладывали большее количество изолирующего средства (Таблица 7, изолирующее средство №3). Извлекали на 0,5 см более глубокую биопсию из доли печени. На участок раны наносили 9 мл изолирующего средства с давлением. К сожалению, во время нанесения почти все изолирующее средство по каплям стекло к краям раневого участка, не оставляя различимого изолирующего средства на участке раны после прикладывания хирургом давления.
Эксперимент повторяли (Таблица 7, изолирующее средство №4). Извлекали еще одну 1 см биопсию, и наблюдалось сильное кровотечение. В это время 15 мл изолирующего средства наносили на раневой участок, используя прозрачную пластиковую матрицу с высокими краями, чтобы удержать изолирующее средство на месте. Изолирующее средство помещали на аппликатор и оставляли охлаждаться в течение 1 мин 20 сек. Изолирующее средство наносили на участок раны, и через 4 мин наблюдался тонкий слой биомиметического сгустка и была достигнута полная остановка кровотечения. Через 50 мин ткань сново осматривали и по-прежнему наблюдалась остановка кровотечения. Это указывало на сильную кровоостанавливающую способность изолирующего средства, когда достаточное количество изолирующего средства наносили на раневой участок и удерживали на месте. Образовавшуюся биомиметическую пленку было трудно удалить, так как она крепко приклеилась к поверхности ткани, и удаление пленки вызывало небольшую кровоточивость.

Остановка кровотечения в бедренной артерии
Затем изучали способность композиции по настоящему изобретению индуцировать остановку кровотечения в ранах или травмах артерии, конкретно бедренной артерии. Обнажали правую бедренную артерию животного. Затем, используя лезвие скальпеля, выполняли кольцевой разрез длиной 2 мм. Наблюдалось обильное кровотечение и вследствие этого использовали кровоостанавливающее средство. Избыток крови удаляли, используя хлопчатобумажную марлевую подушку непосредственно перед применением изолирующего средства. Готовили примерно 9 мл нового хирургического изолирующего средства и наносили его, используя шприц, на область раны. Через 4 мин осторожно удаляли кровоостанавливающее средство и изучали остановку кровотечения с помощью изолирующего средства. Наблюдался биомиметический сгусток, и была достигнута полная остановка кровотечения. В Таблице 9 обобщены методика эксперимента и результаты данного эксперимента.

ПРИМЕР 5
Протокол - Влияние гуанидина гидрохлорида на гелеобразование и сшивание
Данный пример относится к действию типичного денатурирующий агента, гуанидина гидрохлорида (описанного в данном описании изобретения как "GuCl"), на композиции по некоторым воплощениям настоящего изобретения. Предпочтительный диапазон отношений концентрации является следующим: от примерно 1:2 до примерно 2:2 GuHCl: желатин, масса/масса.
Получение раствора
1) 10 г GuCl (Fluka, St. Louis, МО) растворяли в 30 мл PBS Дулбекко (Biological Industries, Israel) при комнатной температуре (комнатной температуры). 10 г порошка свиного желатина типа А, прочность геля по Блуму 300 (Sigma, St. Louis, МО), взвешивали отдельно. Затем желатин и раствор GuCl смешивали при умеренном перемешивании с получением гомогенного раствора. Полученный раствор имел соотношение желатин: GuCl (мас.:мас.) 1:1.
Молекулярная масса (MW) GuCl равна 95,53. В данном растворе конечная концентрация GuCl составляла, таким образом, 3,489 М. Конечным раствором был 20%-ный желатин мас./мас., но в соответствии с объемом, эквивалентный 25% мас./мас. раствору желатина в PBS.
2) 2 г GuCl растворяли в 30 мл PBS при комнатной температуре. 10 г свиного желатина типа А, прочность геля по Блуму 300, взвешивали отдельно. Затем желатин и раствор GuCl смешивали при небольшом перемешивании с получением гомогенного раствора. Полученный раствор имел соотношение желатин: GuCl (мас.:мас.) 5:1. Конечная концентрация GuCl составляла 698 мМ. Конечным раствором был 23,8%-ный желатин мас./мас., но в соответствии с объемом, эквивалентный 25%-ному мас./мас. раствору желатина в PBS.
3) 6 г GuCl растворяли в 30 мл PBS при комнатной температуре. 10 г порошка свиного желатина типа А, прочность геля по Блуму 300, взвешивали отдельно. Желатин и раствор GuCl затем смешивали при умеренном перемешивании с образованием гомогенного раствора. Полученный раствор имел отношение желатин: GuCl (мас.:мас.) 5:3. Конечная концентрация GuCl составляла 2,09 М. Конечным раствором являлся 21.7%-ный желатин мас./мас., но в соответствии с объемом, эквивалентный 25% мас./мас. раствору желатина в PBS.
4) 4 г GuCl растворяли в 30 мл PBS при комнатной температуре. 10 г порошка свиного желатина типа А, прочность геля по Блуму 300, взвешивали отдельно. Желатин и раствор GuCl затем смешивали при умеренном перемешивании с образованием гомогенного раствора. Полученный раствор имел отношение желатин: GuCl (мас.:мас.) 5:2. Конечная концентрация GuCl составляла 1,40 М. Конечным раствором являлся 22,7%-ный желатин мас./мас., но в соответствии с объемом, эквивалентный 25%-ному мас./мас. раствору желатина в PBS.
5) 8 г GuCl растворяли в 30 мл PBS при комнатной температуре. 10 г порошка свиного желатина типа А, прочность геля по Блуму 300, взвешивали отдельно. Желатин и раствор GuCl затем смешивали при умеренном перемешивании с образованием гомогенного раствора. Полученный раствор имел отношение желатин:GuCl (мас.:мас.) 5:1. Конечная концентрация GuCl составляла 2,79 М. Конечным раствором являлся 20,8%-ный мас./мас. желатин, но в соответствии с объемом, эквивалентный 25%-ному мас./мас. раствору желатина в PBS.
Добавление mTG
Приготовили 20%-ный мас./мас. раствор 1% порошка микробной трансглутаминазы (mTG) (Ajinomoto ActivaTI-WM, Japan) в PBS.
а) 2 мл каждого раствора желатин-GuCl смешивали с 1 мл раствора mTG в прозрачных 4 мл пластиковых пробирках. Раствор mTG впрыскивали в раствор желатин-GuCl. Каждую пробирку переворачивали несколько раз и затем оставляли стоять.
б) 2 мл каждого раствора желатин-GuCl смешивали с 1 мл раствора mTG в пластиковых взвешенных чашках. Смеси смешивали вручную с помощью наконечников пипеток.
в) Растворы желатин-GuCl нагревали до 43°C, и затем 2 мл аликвоты растворов желатин-GuCl смешивали с 1 мл раствора mTG в пластиковых взвешенных чашках. Смеси смешивали вручную с помощью наконечников пипеток.
г) Растворы желатин-GuCl 1 (10 г GuCl) и 5 (8 г GuCl) нагревали до 43°C, и затем 2 мл аликвоты растворов желатин-GuCl смешивали с 2 мл раствора mTG в пластиковых взвешенных чашках. Смеси смешивали вручную с помощью наконечников пипеток.
Результаты
1) Раствор 1:1 желатин:GuCl образовывал гомогенный раствор при комнатной температуре в течение 2 минут. Сразу после образования раствор содержал много пузырьков. После 2 ч стояния при комнатной температуре почти все воздушные пузырьки покинули раствор. Раствор сохранялся в жидкой форме и выглядел прозрачным с желтым оттенкам, подобно стандартным растворам желатина. Через 24 часа свойства раствора не изменились и больше не было заметно пузырьков.
2) 5:1 желатин:GuCl не образовал гомогенный раствор при комнатной температуре. Гранулы желатина набухли, но не растворились, как обычно происходило с желатином в PBS при комнатной температуре. Раствор нагревали до 42°C до образования раствора. При охлаждении до комнатной температуры он образовал гель приблизительно при 32°C.
3) 5:3 желатин:GuCl образовывал гомогенный раствор при комнатной температуре через 5-6 минут интенсивного перемешивания. Сразу после образования раствор содержал много пузырьков. После 2 ч стояния при комнатной температуре почти все воздушные пузырьки покинули раствор. Раствор оставался в жидкой форме и выглядел прозрачным с желтым оттенком, подобно стандартным растворам желатина. Раствор находился в жидкой форме, но более вязкой, чем раствор 1:1 желатин: GuCl. Однако его по-прежнему можно было без труда отбирать пипеткой. Через 24 часа свойства раствора не изменились, и не было заметно пузырьков.
4) 5:2 желатин:GuCl образовывал слабозернистый раствор при комнатной температуре через 10 минут интесивного перемешивания. Сразу после образования раствор содержал много-много пузырьков. Сразу после образования раствор оказался очень вязким, но по-прежнему в жидкой форме. Однако через 2 ч выдерживания при комнатной температуре множество воздушных пузырьков были по-прежнему заметны в растворе, и раствор был гелеобразным. Раствор нельзя было легко отбирать пипеткой, и он был слишком вязким для смешивания с другими растворами. Через 24 часа множество воздушных пузырьков оставалось в растворе, и раствор образовывал термообратимый гель.
5) 5:4 желатин:GuCl образовывал гомогенный раствор при комнатной температуре через 2-3 минуты перемешивания. Сразу после образования раствор содержал много пузырьков. После 2 ч выдерживания при комнатной температуре почти все воздушные пузырьки покинули раствор. Раствор оставался в жидкой форме и казался прозрачным с желтым оттенком, подобно стандартным растворам желатина. Раствор находился в жидкой форме, более вязкой, чем раствор 1:1 желатин: GuCl, но менее вязкой, чем раствор 5:3 желатин:GuCl, и мог отбираться пипеткой без труда. Через 24 часа свойства раствора не изменялись, и больше не было заметно пузырьков.
mTG Результаты
а) 2 мл раствора желатин-GuCl, 1 мл раствора mTG при комнатной температуре в 4 мл пробирке
1) Для раствора 1:1 желатин:GuCl, образовался небольшой гелеобразный комок ближе к верху пробирки через 4 минуты. Комок удаляли, и добавляли дополнительно 1 мл раствора mTG. Через 35 минут образовался средней мягкости гель. Комок не был термообратимым, как подтверждено при микроволновом нагревании. Однако он не был сильно когезивным, как должен быть сшитый гель. Было подтверждено с помощью микроволнового нагревания, что средней мягкости гель является термически необратимым.
2) Раствор 5:1 желатин:GuCl был слишком вязким для смешивания с mTG.
3) Для раствора 5:3 желатин:GuCl, образовался небольшой гелеобразный комок ближе к верху пробирки через 4 минуты. Его не удаляли. Через 20 минут образовался средний гель по всему раствору. Комок был совершенно другой консистенции, чем остаток геля. Как и выше, хотя он не был термообратимым, как подтверждено с помощью микроволнового нагревания, он был также не очень когезивным и легко ломался при ощупывании. Образовавшийся средний гель сделался немного мягче при нагревании в микроволновой печи, но являлся термически необратимым.
4) Результаты для раствора 5:2 желатин:GuCl были очень неровными, так как раствор стал очень вязким в течение первых нескольких минут после добавления mTG в результате термобратимого гелеобразования (показанного контрольным раствором, где mTG не был добавлен). Через 15 минут образовался умеренно устойчивый гель, но он был частично термообратимым и стал намного мягче при нагревании.
5) Для раствора 5:4 желатин:GuCl, образовался небольшой гелеобразный комок недалеко от верха пробирки через 4 минуты. Его не удаляли. Через 30 минут по всему раствору образовался средний гель. Комок был совершенно другой консистенции, чем остаток геля. Как и выше, хотя он не был термообратимым, как подтверждено с помощью микроволнового нагревания, он был также не очень когезивным и легко разбивался при ощупывании. Образовавшийся средний гель сделался немного мягче при нагревании в микроволновой печи, но являлся термически необратимым.
б) 2 мл раствора желатина-GuCl, 1 мл раствора mTG при комнатной температуре в пластиковой чашке
Результаты в отношении времени гелеобразования для растворов, смешанных в пластиковой чашке, были практически идентичными результатам, найденным в растворах, смешанных в 4 мл пластиковой пробирке: 1:1 желатин:GuCl образовал гель средней мягкости через 35 минут, 5:3 желатин:GuCl образовал средний гель через 20 минут, 5:4 желатин:GuCl образовал средний гель через 30 минут.
Однако гелеобразные комки, наблюдаемые при впрыскивании mTG в растворы желатин-CuCl, не наблюдались в этих экспериментах.
в) 2 мл раствора желатин-GuCl при 43°C, 1 мл раствора mTG в пластиковой чашке - результаты были следующими: для раствора 1:1 желатин:GuCl, гель не образовался через 35 минут; для раствора 5:3 желатин:GuCl, средний гель образовался через 17 минут; для раствора 5:4 желатин: GuCl, средний гель образовался через 25 минут.
г) 2 мл раствора желатин-GuCl при 43°C, 2 мл раствора mTG в пластиковой чашке, результаты представляли собой следующее: для раствора 1:1 желатин:GuCl, гель не образовался через 25 минут; для раствора 5:4 желатин:GuCl, средний гель образовался через 9 минут.
Из вышесказанных результатов было обнаружено, что GuCl значительно улучшает растворимость желатина в PBS. Для концентраций 25% мас./мас. желатина в PBS, добавление GuCl в соотношениях желатин:GuCl 5:4 и 1:1 позволяет желатину растворяться в комнатной температуры PBS почти сразу же. Такой эффект значительно снижается при соотношении желатин: GuCl 5:3. Для концентраций 25% мас./мас. желатина в PBS, добавление GuCl с отношениями желатин:GuCl 5:3, 5:4 и 1:1 может поддерживать раствор желатин-GuCl в жидкой форме неопределенный период времени. При соотношении желатин:GuCl 5:2 раствор претерпевает замедленное термообратимое гелеобразование, и образует полный гель через 2 часа. При соотношении 2:1 раствор желатин-GuCl:раствор mTG гель не образуется, если соотношение желатин: раствор GuCl составляет 1:1. При более низких концентрациях GuCl образовались сшитые гели. Время гелеобразования оказалось зависимым от концентрации GuCl.
Нагревание раствора желатин-GuCl до 43°C перед смешиванием с mTG ускоряет процесс сшивания, когда соотношение желатин:GuCl составляет 5:4 и 5:3. Это предполагалось, так как активность mTG увеличивается с увеличением температуры реакции вплоть до 55°C. Вероятно что, если активность mTG увеличена, растворы желатин:GuCl будут более быстро сшиваться с помощью mTG.
При соотношении раствор желатин-GuCl: раствор mTG 1:1 сшитые гели были образованы даже когда соотношение раствора желатин:GuCl составляло 1:1. Увеличение количества mTG значительно снижает время гелеобразования гелей, которые не образовывали гели при соотношении желатин: раствор GuCl:раствор mTG 2:1. Время гелеобразования, как обнаружено, зависело от концентрации GuCl. Это ожидалось, а также GuCl вероятно денатурирует некоторое количество mTG. mTG, которую добавляют выше такого количества, свободна для сшивания желатина.
Не желая ограничиваться простой гипотезой, возможно что если добавляют больше фермента mTG, растворы желатин:GuCl будут сшиваться гораздо быстрее с помощью mTG. Это может быть достигнуто, например, путем удаления носителя из порошка mTG и образования концентрированного раствора самого фермента.
ПРИМЕР 6
Протокол: Добавление MgCl2 к желатину - Влияние на гелеобразование и сшивание
Данный пример относится к влиянию типичного восстановителя, хлорида магния, на композиции по некоторым воплощениям настоящего изобретения. Диапазон предпочтительной концентрации для растворения желатина в хлориде магния-PBS составляет предпочтительно от примерно 2 до примерно 4 М, более предпочтительно от примерно 2,5 до примерно 3,5 М.
Вещества и способы
Вещества
Свиной желатин типа А, прочность геля по Блуму 300, и порошок MgCl2, - 325 меш получали от Sigma-Aldrich corporation (St. Louis, МО). Микробная трансглутаминаза (mTG) ActivataTI-WM была поставлена Ajinomoto (Япония). Дулбекко PBS (pH 7,4) получали от Biological Industries (Kibbutz Beit HaEmek, Israel).
Получение раствора mTG:
Свежую смесь микробной трансглутаминазы (mTG) Activa TI-WM (Ajinomoto, Japan) получали путем растворения в Дулбекко PBS с образованием 20% мас./мас. раствора. Раствор поддерживали при комнатной температуре (комнатной температуры) на всем протяжении эксперимента.
Получение раствора желатин-MgCl2:
Желатин растворяли в растворах MgCl2 разных концентраций следующим образом.
Раствор А - 5 г MgCl2 растворяли в 15 мл Дулбекко PBS до конечной концентрации 3,5 М. Реакция растворения MgO2 является экзотермической, достигая 90°C. Раствор оставляли охлаждаться до комнатной температуры. Аликвоту 25%-ного желатина (мас./мас.) получали, растворяя 5 г желатина в 15 г 3,5 М раствора MgCl2 и перемешивая при комнатной температуре.
Раствор Б - 2,5 г MgCl2 растворяли в 15 мл Дулбекко PBS до конечной концентрации 1,75 М. Реакция растворения MgCl2 является экзотермической, достигая 63°C. Раствор оставляли охлаждаться до комнатной температуры. Аликвоту 25%-ного желатина (мас./мас.) получали, растворяя 5 г желатина в 15 г 63°C 1,75 М раствора MgCl2 и перемешивая.
Влияние MgCl2 на гелеобразование желатина:
Желатин, растворенный в растворах MgCl2 в разных концентрациях, оставляли охлаждаться до комнатной температуры. Для наблюдения за температурой каждого раствора использовали термометр. По мере снижения температуры оценивали внешний вид и вязкость растворов желатин-MgCl2 путем наблюдения и ощупывания раствора с помощью стеклянной палочки.
Влияние MgCl2 на химическое сшивание растворов желатина с использованием mTG:
Желатин-MgCl2 "раствор А" испытывали в отношении химического сшивания с использованием mTG. 1 или 2 мл 20% мас./мас. раствора mTG смешивали с 2 мл раствора желатин-MgCl2 в 4 мл пробирке от Техникона. Раствор желатин-MgCl2 добавляли либо при комнатной температуре, либо предварительно нагревали до 50°C, используя водяную баню. Растворы смешивали путем осторожного перемешивания с помощью наконечников пипеток и переворачивая пробирку 4 раза и измеряли время до гелеобразования. Внешний вид и вязкость растворов желатин- MgCl2 после смешивания с mTG оценивали путем визуального наблюдения и с помощью ощупывания раствора с помощью стеклянной палочки. Когда гель образовался, его испытывали в отношении термообратимости путем нагревания геля до 50°C, используя водяную баню.
Результаты
Влияние MgCl2 на гелеобразование желатина:
Раствор А - 3,5 М раствор MgCl2 снижал точку перехода желатина. Раствор желатин-MgCl2 был вязким при комнатной температуре. Раствор казался слегка непрозрачным и состоял из небольших темных частиц. Такие частицы возможно представляют собой частицы магния, который прошел окисление. Раствор Б - 1,75 М желатин - MgCl2 раствор загустевал при комнатной температуре. Точка перехода составляла 29°C. Гель был непрозрачным и содержал несколько черных частиц, которые, вероятно, образовались при окислении Mg.
MgCl2 влияет на химическое сшивание растворов желатина с использование mTG:
Влияние MgCl2 на сшивание исследовали с помощью раствора А следующим образом. 2 мл раствора А комнатной температуры смешивали с 1 мл раствора mTG - Необратимый гель получали через 90 мин. Гель был очень вязким и немного мягким. 2 мл нагретого до 50°C раствора А смешивали с 1 мл раствора mTG - Необратимый гель получали через 70 мин. 2 мл нагретого до 50°C раствора А смешивали с 2 мл раствора mTG - Необратимый гель получали через 25 мин. Гель был довольно слабый. Вязкость геля увеличивалась после нагревания его в водяной бане при 50°С.
Из вышесказанного видно, что добавление хлорида магния к растворам желатина значительно понижает точку перехода желатина. Очевидно, что точка перехода обратно пропорциональна концентрации хлорида магния. Точку перехода понижают ниже комнатной температуры путем добавления 3,5 М хлорида магния. При 1,75 М хлорида магния точка перехода растворов желатина является незначительно выше комнатной температуры. Добавление хлорида магния к желатину должно быть оптимизировано для нахождения минимальной концентрации, которая снижает точку перехода желатина ниже комнатной температуры.
Также было показано, что возможно сшивание желатина с использованием mTG в присутствии хлорида магния. Хлорид магния оказывает нежелательное действие на сшивающее соотношение желатина. Возможно могут быть добавлены дополнительные количества mTG для ослабления такого влияния.
Активность mTG при 50°C значительно больше, чем активность mTG при комнатной температуре. Это подтверждают теоретические данные и свидетельствуют о полезности добавления экзотермического элемента в смесь желатин-mTG для обеспечения температуры реакции выше комнатной температуры.
Из вышеприведенных данных, экзотермическое растворение хлорида магния возможно можно использовать как для разжижения желатина и для увеличения активности mTG.
ПРИМЕР 7
Протокол: Добавление гидрохинона к желатину - Влияние на гелеобразование и сшивание
Данный пример относится к влиянию типичного восстановителя, гидрохинона, на композиции по некоторым воплощениям настоящего изобретения. Гидрохинон представляет собой встречающийся в природе, растворимый в воде восстановитель. Восстановители могут увеличивать растворимость желатина, позволяя ему оставаться жидкостью при комнатной температуре (RT). Предпочтительный диапазон концентрации предпочтительно определен для растворения желатина в растворе гидрохинон-PBS при концентрации от примерно 0,2 до примерно 0,5 М, и более предпочтительно от примерно 0,3 до примерно 0,4 М.
Вещества и обособы
Вещества
Свиной желатин типа А, с прочностью геля по Блуму 300, и гидрохинон (ReagentPlusTM, >99%) получали от корпорации Sigma-Aldrich (St. Louis, МО). Микробная трансглутаминаза (mTG) ActivataTI-WM поставлялась Ajinomoto (Japan). Дулбекко PBS (pH 7,4) получали от Biotogical Industries (Kibbutz Beit HaEmek, Israel).
Получение раствора mTG:
Свежую смесь микробной трансглутаминазы (mTG) ActivaTI-WM (Ajinomoto, Japan) получали растворением в Дулбекко PBS с образованием 20%-ного мас./мас. раствора. Этот раствор поддерживали при комнатной температуре (RT) на всем протяжении эксперимента.
Получение раствора желатин-гидрохинон:
Желатин растворяли в растворах гидрохинона с разными концентрациями следующим образом. Раствор А - 2,75 г гидрохинона растворяли в Дулбекко PBS до конечной концентрации 0,5 М. Во время эксперимента раствор хранили в плотно закрытом лабораторном стакане, завернутом в алюминиевую фольгу во избежание воздействия на него воздуха и света. 25% аликвоту желатина (мас./мас.) в 0,5 М растворе гидрохинона получали путем смешивания 5 г желатина с 15 г 0,5 М раствора гидрохинона и перемешивания.
Раствор Б - 1,32 г гидрохинона растворяли в Дулбекко PBS до конечной концентрации 0,4 М. Во время эксперимента раствор хранили в плотно закрытом лабораторном стакане, завернутом в алюминиевую фольгу во избежание воздействия на него воздуха и света. Аликвоту 25%-ного желатина (мас./мас.) в 0,4 М растворе гидрохинона получали путем смешивания 5 г желатина с 15 г 0,4 М раствора гидрохинона. Смесь перемешивали и затем нагревали на водяной бане при 50°C.
Влияние гидрохинона на гелеобразование желатина:
Растворы желатина, растворенного в разных концентрациях гидрохинона, либо хранили при комнатной температуре, либо нагревали при 50°C на водяной бане и затем охлаждали до комнатной температуры. Для контроля за температурой каждого раствора использовали термометр. По мере того как температура уменьшалась, внешний вид и вязкость растворов желатин-гидрохинон оценивали с помощью визуального наблюдения и ощупывания раствора стеклянной палочкой.
Гидрохинон оказывает влияние на химическое сшивание растворов желатина с использованием mTG:
«Раствор Б» желатин-гидрохинон исследовали на химическое сшивание с использованием mTG. 1 мл 20% мас./мас. раствора mTG смешивали с 2 мл раствора желатин-гидрохинон, нагревали до 50°C в 4 мл пробирке от Техникона. Растворы смешивали путем осторожного перемешивания с помощью наконечников пипеток и переворачивая пробирку 4 раза, и измеряли время гелеобразования. Внешний вид и вязкость раствора желатин-гидрохинон после смешивания с mTG оценивали с помощью визуального наблюдения и посредством ощупывания раствора стеклянной палочкой. Когда образовался гель, его исследовали на термообратимость путем нагревания до 50°C с использованием водяной бани.
Результаты
Влияние гидрохинона на гелеобразование желатина
Раствор А - 0,5 М раствор гидрохинона при комнатной температуре не растворяет желатин. Желатиновый порошок пропитывался в растворе гидрохинона, образуя зернистый, коричневый гетерогенный раствор. Раствор Б - 0,4 М раствор гидрохинона использовали для снижения точки перехода желатина. Раствор гидрохинона не растворяет желатин при комнатной температуре. После нагревания смеси при 50°C на водяной бане желатин растворялся, и получался гомогенный раствор. Раствор охлаждали до комнатной температуры. При 28°C желатин оставался растворимым, но был очень вязким. Гель образовался при охлаждении до комнатной температуры. Гель имел коричневый цвет.
Гидрохинон воздействует на химическое сшивание растворов желатина с использованием mTG:
Влияние на сшивание исследовали с раствором Б. 2 мл раствора Б, нагретого до 50°C, смешивали с 1 мл раствора mTG. Через 4 мин образовался необратимый гель. Гель был прочным, напоминающим сшитый гель, который образует смесь 25% (мас./мас.) одного желатина с 20% (мас./мас.) mTG.
Из вышесказанного следует, что добавление гидрохинона к растворам желатина снижает точку перехода желатина. При концентрации гидрохинона 0,4 М точка перехода растворов желатина немного выше комнатной температурь) (28°C).
В отличие от других веществ, которые исследовали в качестве методов снижения точки перехода желатина, гидрохинон не оказывает существенного ингибирующего воздействия на сшивание желатина с mTG.
Гидрохинон возможно можно использовать для снижения температуры перехода золь-гель у желатина без негативного влияния на mTG-сшивание желатина, как показали вышеуказанные данные. Как описано ранее, это является весьма желательным для многих воплощений настоящего изобретения.
ПРИМЕР 8
Протокол: Добавление CaCl2 к желатину - Влияние на гелеобразование и сшивание
Данный пример относится к влиянию типичного влагопоглотителя, хлорида кальция, на композиции по некоторым воплощениям по настоящему изобретению. Диапазон предпочтительной концентрации в отношении растворения желатина в растворе хлорида кальция-PBS предпочтительно находится в диапазоне от примерно 1 до примерно 2 М, для снижения точки перехода желатина. Для получения экзотермической реакции, которая может помочь растворению желатина или увеличению активности mTG, приблизительно 0,2-0,7 г хлорида кальция на мл раствора возможно и предпочтительно добавляли для увеличения температуры на каждый градус Цельсия выше температуры окружающей среды, хотя точное количество зависит от нескольких факторов.
Раствор желатин-хлорид кальция в DPBS получали следующим образом: 4 М исходный раствор CaCl2 получали путем растворения 44,396 г CaCl2 (97%, MW=110,99, Alfa Aesar, Lancaster) в 100 мл Дулбекко PBS (Biological Industries, Israel) при перемешивании. В результате экзотермической реакции растворения СаСl2 после растворения раствор достиг максимальной температуры 80°C.
Раствор 1 получали следующим образом. Взвешивали 5 г порошка свиного желатина типа А, прочность геля по Блуму 300 (Sigma, St. Louis, МО). 25%-ные мас./мас. растворы желатина в PBS-CaCl2 получали путем добавления 15 г растворов PBS-CaCl2 разной концентрации к 5 г желатина. Желатин-CaCl2 смешивали, используя магнитную мешалку, а также время от времени ручное перемешивание для диспергирования комков. Исследованные концентрации CaCl2 представляли собой:
а. 2 М раствор CaCl2 в PBS.
б. 2 М раствор CaCl2 в PBS.
в. 1 М раствор CaCl2 в PBS.
Для а и б, 2 мл раствора желатин-CaCl2 смешивали с 1 мл 20%-ного мас./мас. раствора порошка микробной трансглутаминазы (mTG), каждый в 4 мл пластиковой пробирке. Используемый mTG-продукт (ActivaTI-WM, Ajinomoto, Japan) имел специфическую активность приблизительно 100 ед./г порошка mTG-продукта.
Раствор 2 получали следующим образом. 20%-ный мас./мас. исходный раствор mTG получали путем растворения 10 г порошка mTG в 40 мл PBS.
а. 25%-ный мас./мас. раствор желатина получали путем растворения 5 г желатина в 15 м PBS путем нагревания смеси желатин-PBS в микроволновой печи в течение 5 секунд, а затем 15 секунд. Раствор сразу же перемешивали после каждого периода микроволнового нагревания. После второго нагревания температура составляла 72°C. Затем добавляли 3,325 г CaCl2 с образованием 2 М раствора CaCl2. После добавления CaCl2 температура составляла 74°C. Непосредственно после растворения CaCl2 и измерения температуры 2 мл раствора желатин-CaCl2 смешивали с 1 мл 20%-ного мас./мас. раствора порошка микробной трансглутаминазы (mTG) в 4 мл пластиковой пробирке.
б. 5 г порошка желатина смешивали с 3,33 г порошка CaCl2. Затем 30 мл PBS перемешивали с этой смесью для образования раствора. Температура раствора при растворении достигала 42°C. После того как образовался гомогенный раствор, 2 мл раствора желатин-CaCl2 смешивали с 1 мл 20% мас./мас. раствора порошка микробной трансглутаминазы (mTG) в 4 мл пластиковой пробирке.
Раствор 3 получали следующим образом. 25%-ный раствор желатина в 2 М CaCl2-PBS (1a, выше) оставляли стоять в течение 2 часов. Затем 2 мл раствора желатин-CaCl2 смешивали с 2 мл 20%-ного мас./мас. раствора mTG в 4 мл пластиковой пробирке.
Раствор 4 получали следующим образом. После выстаивания в течение двух часов 25%-ный раствор желатина в 2 М CaCl2-PBS (1б, выше) нагревали до 43°C. Затем 2 мл раствора желатин-CaCl2 смешивали с: а) 1 мл 20%-ного мас./мас. раствора mTG; или б) 2 мл 20%-ного мас./мас. раствора mTG; каждый в 4 мл пластиковой пробирке.
Результаты
Растворы получались при всех концентрациях CaCl2. При использовании 2 М раствора CaCl2 (1a) гомогенный раствор образовывался и сохранялся в жидкой форме. Раствор был умеренно вязким и содержал много воздушных пузырьков. Перед смешиванием с раствором mTG раствор желатин-CaCl2 оставляли стоять в течение 30 минут, чтобы позволить пузырькам диспергироваться.
Второй 2 М раствор (1) был идентичен первому за исключением того, что требовал дополнительного ручного перемешивания для диспергирования образовавшихся комков желатина.
При использовании 1 М раствора CaCl2 (1в) гомогенный раствор образовывался, но через несколько минут начинал образовывать гель. Через 2 часа полностью образовался термообратимый гель. Однако такой гель был гораздо мягче, чем термообратимый гель, обычно образуемый желатином при комнатной температуре. Раствор был слишком вязким, чтобы смешиваться с раствором mTG через полчаса.
После добавления раствора mTG к 2 М растворам желатин-CaCl2 растворы постепенно становились более вязкими в течение периода 20 минут, но не формировали когезивный гель.
Нагревание растворов желатин-CaCl2 увеличивало гелеобразующий эффект mTG. Нагретый в микроволновой печи раствор постепенно становился более вязким. Через 20 минут образовался очень мягкий, необратимый (как подтверждено посредством нагревания до 50°C) гель. Нагретый раствор CaCl2 постепенно становился более вязким. Через 20 минут образовался очень мягкий, необратимый (как подтверждено посредством нагревания до 50°C) гель.
Для раствора желатин-CaCl2 (2 М), смешанного с 2 мл 20%-ного мас./мас. раствора mTG, мягкий гель образовался через 10 минут. Через 20 минут образовался гель средней прочности. Через 35 минут образовался гель средней устойчивости.
Для раствора желатин-CaCl2 (2 М), нагретого до 43°C, после смешивания с 1 мл 20%-ного мас./мас. раствора mTG мягкий гель образовался через 10 минут, и мягкий гель средней прочности образовался через 20 минут. Однако после смешивания с 2 мл 20%-ного мас./мас. раствора mTG гель средней прочности образовался через 10 минут, и гель средней устойчивости образовался через 20 минут.
ПРИМЕР 9
Протокол: Микроволновая сушка желатина - Влияние на гелеобразование и сшивание
В данном примере изучено влияние сушки желатина в микроволновой печи на растворимость. Наблюдалась увеличенная растворимость. Возможный, но предпочтительный диапазон энергии микроволнового излучения предпочтительно включает общую скорость специфической абсорбции (SAR) от примерно 1 до примерно 100 мВт/см3, более предпочтительно от примерно 30 до примерно 60 мВт/см3. Способ осуществляли следующим образом.
Препарат желатина и сушка
10 г порции свиного желатинового порошка типа А, прочность геля по Блуму 300 (Sigma, St. Louis, МО), взвешивали в лабораторных стаканах либо 50 мл, либо 250 мл. Затем желатин нагревали в микроволновой печи при 700 Вт и 2,450 МГц (Kennedy mode) KN-949, China) в течение следующих промежутков времени:
Образец А: 30 секунд, 50 мл лабораторный стакан
Образец Б: 60 секунд, 250 мл лабораторный стакан
Образец В: 120 секунд, 250 мл лабораторный стакан
Образец Г: 180 секунд, 250 мл лабораторный стакан
Контроль: Желатин, который не подвергали микроволновому нагреванию.
После нагревания добавляли 30 мл Дулбекко PBS (Biological Industries, Israel) при 37°C к желатину, и смесь перемешивали при 37°C. Для образца А PBS добавляли непосредственно после извлечения желатина из микроволновой печи. Для остальных образцов желатин оставляли охлаждаться до комнатной температуры (RT) перед добавлением PBS.
Для образца В: после смешивания желатина с PBS часть смеси отделяли, нагревали до 50°C и затем смешивали с 20%-ным мас./мас. раствором микробной трансглутаминазы (mTG) (Ajinomoto Activa TI-WM, Japan) в отношении 2:1 раствор желатина: раствор mTG.
Микроволновое нагревание смеси желатин/PBS
В образце F желатин не нагревали в порошковой форме. Предпочтительно желатин наливали непосредственно в 30 мл PBS комнатной температуры в 50 мл лабораторном стакане, и затем смесь дважды последовательно нагревали в микроволновой печи в течение 15 секунд, с 5-секундной паузой между периодами нагревания. После нагревания его перемешивали вручную. Раствор желатина затем смешивали с 20%-ным мас./мас. раствором mTG в отношении 2:1 раствор желатина: раствор mTG.
Нагревание mTG
20%-ный мас./мас. раствор mTG дважды последовательно нагревали в микроволновой печи в течение 15 секунд, с 5-секундной паузой между периодами нагревания. Затем mTG добавляли к 25%-ному мас./мас. раствору желатина в отношении 1:2 mTG: раствор желатина.
Результаты
Образец А: желатин легко растворялся в PBS с образованием вязкого раствора. После охлаждения до комнатной температуры раствор желатина образовал прочный термообратимый гель, сравнимый с термообратимым гелем, образованным стандартными растворами желатина при комнатной температуре.
Контроль: желатин не полностью растворялся в PBS. Хотя он был полностью пропитан PBS, желатин оставался очень зернистым.
Образец Б: желатин не полностью растворялся в PBS. Хотя он был полностью пропитан PBS, желатин оставался очень зернистым.
Образец В: желатин не полностью растворился в PBS. Хотя он был полностью пропитан PBS, желатин оставался довольно зернистым. Затем зернистую смесь желатин-PBS нагревали в микроволновой печи в течение 30 секунд. Температура при извлечении из микроволновой печи составляла 76°C. Затем смесь перемешивали вручную для образования гомогенного раствора. Раствор оставляли охлаждаться до комнатной температуры и образовать термообратимый гель, сравнимый с термообратимым гелем, образованным стандартными растворами желатина при комнатной температуре.
При нагревании раствора до 50°C и смешивании с mTG через 3 минуты образовался плотный и липкий гель. Этот гель нагревали в течение 10 секунд в микроволновой печи для подтверждения его необратимости. При выходе из микроволновой печи гель был более липким, но более прочным. Он оказался слегка сухим.
Образец Г: во время нагревания желатин образовал карбонизированный пузырь. Пузырь образовался внутри желатинового порошка из-за горения желатина. Это явление сопровождалось сильным запахом горения.
Нагретая смесь желатин/PBS: при нагревании в микроволновой печи смеси желатин/PBS образовался жидкий раствор. Добавление mTG к раствору привело к образованию прочного необратимого геля.
Нагретая mTG: mTG, которая была нагрета в микроволновой печи, не сшивала желатин.
Из указанного выше очевидно, что нагревание желатинового порошка в микроволновой печи снижает влагосодержание желатина, на что указывают значительные снижения массы желатина (данные не приведены). Нагревание желатинового порошка в микроволновой печи с последующим немедленным добавлением 37°C PBS уменьшает время растворения желатина. Однако, если желатиновый порошок охлажден до комнатной температуры, затем не происходит улучшения времени растворения желатина.
Если нагретый микроволновыми лучами желатин нагревают, после того как его смешивают с PBS, затем образовавшийся раствор может быть сшит с помощью mTG. Можно растворить желатин в PBS комнатной температуры и затем нагреть его в микроволновой печи при нагревании в течение 15 с и затем снова 15 с. Растворение его таким способом не сказывается негативно на сшивании с помощью mTG.
Сухой желатин горит при нагревании в микроволновой печи в течение более 2 минут. Нагревание mTG в микроволновой печи резко снижает ее активность.
ПРИМЕР 10
Влияние мочевины на гелеобразование и сшивание желатина
Данный пример относится к влиянию мочевины как части типичной композиции по настоящему изобретению. Было обнаружено, что мочевина снижает точку перехода растворов желатина. Изложенные ниже данные подтверждают, что она существенно снижает точку перехода даже раствора желатина с высокой концентрацией до температуры ниже комнатной, так что раствор по-прежнему находится в жидкой форме при комнатной температуре. Было обнаружено, что трансглутаминаза способна сшивать желатин даже в присутствии мочевины.
Получение раствора желатина:
Применяли свиной желатин типа А с прочностью геля по Блуму 300 (Sigma, St. Louis, МО). Получали растворы желатина 25% и 15% мас./мас. путем растворения 50 г и 30 г желатина в 150 мл и 170 мл Дулбекко PBS (Biological Industries, Israel) соответственно при перемешивании на нагретой плитке при 50°C. Желатин добавляли к PBS постепенно и перемешивали вручную, используя стеклянную палочку. Растворы желатина держали на водяной бане при 50°C на всем протяжении эксперимента.
Получение раствора трансглутаминазы:
Смесь микробной трансглутаминазы (mTG) ActivaTI-WM (Ajinomoto, Japan) растворяли в Дулбекко PBS с образованием 20%-ного мас./мас. раствора. Раствор поддерживали при комнатной температуре (RT) на всем протяжении эксперимента.
Получение раствора желатин-мочевина:
40 г аликвоты 25%-ного или 15%-ного мас./мас. растворов желатина перемещали в 100 мл лабораторные стаканы и перемешивали при 50°C. Мочевину (98%, Alfa Aesar, Lancaster, UK) добавляли в эти лабораторные стаканы в разных соотношениях, как подробно изложено в таблице ниже:
После добавления мочевины раствор желатин-мочевина перемешивали при 50°C в течение 5 мин, чтобы обеспечить гомогенность, и затем перемещали водяную баню на 37°C.
Влияние мочевины на термообратимое гелеобразование желатина:
Каждый раствор желатин-мочевина извлекали поочередно из водяной бани на 37°C и оставляли охлаждаться при комнатной температуре. Чтобы следить за понижением температуры каждого раствора, использовали термометр. По мере того как температура уменьшалась, оценивали внешний вид и вязкость растворов желатин-гидрохинон с помощью визуального наблюдения и ощупывания раствора стеклянной палочкой. Результаты такого испытания описаны в следующей таблице:
Сшивание раствора желатин-мочевина с использованием mTG:
Растворы желатин-мочевина сшивали, используя mTG. 1 или 2 мл 20%-ного мас./мас. раствора mTG смешивали вручную с 2 мл раствора желатин-мочевина в пластмассовой посуде. Раствор желатин-мочевина добавляли либо при комнатной температуре, либо предварительно нагретым до 50°C. В некоторых исследованиях его нагревали до 50°C, чтобы облегчить сравнение с одним желатином, который нуждается в нагревании для смешивания с mTG. Растворы смешивали путем осторожного перемешивания наконечниками пипеток и оставляли сшиваться в течение нескольких минут. Как при изучении образования термообратимого геля, внешний вид и вязкость раствора желатин-мочевина после смешивания с mTG оценивали посредством визуального наблюдения и ощупывания раствора стеклянной палочкой. Результаты обобщены в следующей таблице:
Вышеуказанные исследования показали, что добавление мочевины к растворам желатина значительно снижает точку перехода желатина. Для обоих 15%-ного и 25%-ного мас./мас. растворов желатина точку перехода снижали до значения ниже комнатной температуры путем добавления мочевины в соотношении 1:1 мочевина: желатин и выше. При соотношении мочевина: желатин 0,5:1 точка перехода растворов желатина была немного выше комнатной. Вероятно, что соотношение мочевина: желатин между 0,5:1 и 1:1 достаточно для снижения точки перехода желатина ниже комнатной температуры.
Также было показано, что возможно сшивание желатина с использованием mTG в присутствии мочевины. Однако мочевина оказывает нежелательное воздействие на активность mTG. Представляется, что это воздействие связано с концентрацией мочевины, так что активность mTG в присутствии мочевины обратно пропорциональна концентрации мочевины.
Активность трансглутаминазы при 50°C была намного больше, чем активность mTG при комнатной температуре, как следовало ожидать. Добавление мочевины к желатину можно оптимизировать, чтобы найти минимальную концентрацию, которая снижает точку перехода желатина ниже комнатной температуры. Если добавлено достаточное количество mTG, возможно преодолеть вредное воздействие мочевины.
ПРИМЕР 11
Влияние pH на точку перехода желатина
Данный пример демонстрирует влияние изменения pH растворов желатина на точку перехода этих растворов желатина.
Получение раствора
58,82 г 99% дигидрата цитрата натрия (Alfa Aesar, Lancaster, UK) растворяли в 100 мл дважды дистиллированной воды с получением 2 М исходного раствора цитрата натрия. Основной раствор - 25%-ный мас./мас. раствор желатина в Dulbecco PBS (Biological Industries, Israel) получали, используя свиной желатин типа А с прочностью геля по Блуму 300 (Sigma, St. Louis, МО). Раствор желатина непрерывно перемешивали и поддерживали при 50°C. 19,21 г безводного цитрата натрия (Frutarom, Israel) растворяли в 50 мл дважды дистиллированной воды для создания 2 М исходного раствора лимонной кислоты.
Измерения pH
pH раствора измеряли, используя pH-метр (Eutech pH510, Singapore) со стеклянным электродом. pH-метр калибровали перед экспериментом, используя калибровочные растворы со значениями pH 4,01, 7 и 10,01. На всем протяжении эксперимента периодически определяли правильность измерения pH. pH 2 М раствора цитрата натрия составлял 8,54. pH 2 М раствора лимонной кислоты составлял 1,4.
Добавление цитрата натрия
20 мл аликвоту 25%-ного мас./мас. раствора желатина отделяли в 100 мл лабораторный стакан, который поддерживали при 50°C с умеренным перемешиванием. Измеряли исходное значение pH раствора желатина, равное 4,89. Разные количества 2 М раствора цитрата натрия добавляли к 20 мл растворов желатина с образованием следующих растворов:
Раствор 1: pH 5,87 - 2 мл раствора цитрата натрия
Раствор 2: pH 6,55 - 4 мл раствора цитрата натрия
Раствор 3: pH 6,7 - 6 мл раствора цитрата натрия
Затем каждый раствор оставляли охлаждаться до комнатной температуры.
Добавление лимонной кислоты
100 мл аликвоту 25%-ного мас./мас. раствора желатина отделяли в 250 мл лабораторный стакан, который поддерживали при 50°C с умеренным перемешиванием. Измеряли исходное значение pH раствора желатина, равное 5,19.
Разные количества 2 М раствора лимонной кислоты добавляли к растворам желатина с получением следующих растворов:
Раствор 1: pH 3,99
Раствор 2: pH 3,54
Раствор 3: pH 2,72
Раствор 4: pH 2,35
Раствор 5: pH 2,17
Раствор 6: pH 2,04
Раствор 7: pH 1,7
Затем каждый раствор оставляли охлаждаться до комнатной температуры.
Результаты в отношении цитрата натрия
По мере добавления цитрата натрия добавка образовывала мутный белый комок в растворе желатина. Интенсивное перемешивание диспергировало этот комок, сначала в более мелкие комки, и затем в гомогенный раствор. Гомогенный раствор, который образовался, был мутным и непрозрачным.
При значении pH 5,87 аликвота раствора желатина, которую оставили охладиться, образовала термообратимый гель приблизительно за такой же период времени, за который один желатин образует термообратимый гель.
При значении pH 6,55 аликвота раствора желатина, которую оставили охладиться, образовала термообратимый очень быстро, за минуту. Это произошло намного быстрее, чем в случае одного желатина.
При значении pH 6,70 аликвота образовала термообратимый гель почти мгновенно. После того как раствор желатин-цитрат натрия оставляли при 50°C в течение нескольких минут, нетронутый раствор образовал гель. Точка перехода повышалась до точки выше 50°С.
Показано, что при всех значениях pH гели являлись термообратимыми, так как они все возвращались в жидкую форму после погружения в воду 60°C.
Результаты в отношении лимонной кислоты
При значениях pH выше 3,54 не наблюдалось четкого различия точки перехода. При значении pH 3,54 раствор желатина оставался жидким от 50°C до приблизительно 32°C, когда образовался очень липкий гель.
При значении pH 2,72 точка перехода составляла приблизительно 31°C, и образовавшийся гель был пористым, зернистым, со множеством воздушных пузырьков.
При значении pH 2,04 точка перехода падала до 29°C. Образовавшийся гель был более пористым, чем гель, образовавшийся при значении pH 2,72.
При значении pH 1,7 точка перехода падала до 27-28°C. Образовавшийся гель был полностью пористым.
При всех значениях pH гели демонстрировали термообратимость, так как все они возвращались в жидкую форму после погружения в воду 50°C.
Однако, после того как гели оставляли в 50°C воде в течение 30 минут, образовался гель, который не возвращался в жидкую форму. Это могло указывать на то, что лимонная кислота вызывала сшивание желатина после 30 минут при 50°C.
Выше показано, что снижение pH раствора желатина во время добавления лимонной кислоты может значительно понизить точку перехода геля. Добавление лимонной кислоты, которое понижает pH раствора желатина до значений ниже 2, не приводит к сшиванию желатина. Дополнительные добавления лимонной кислоты для снижения pH ниже 2 могут приводить к сшиванию желатина через 30 минут при 50°C.
ПРИМЕР 12
Влияние многоатомных спиртов на гелеобразование и сшивание желатина
Данный пример относится к влиянию многоатомных спиртов, таких как сорбит, на сшивание желатина.
Вещества и способы
Вещества
Свиной желатин типа А с прочностью геля по Блуму 300 и 97%-ный D-сорбит получали от корпорации Sigma-Aldrich (St. Louis, МО). 99%-ный Глицерин приобретали у Frutarom (Israel). Микробную трансглутаминазу (mTG) Activata TI-WM поставлял Ajinomoto (Japan). Дулбекко PBS (pH 7.4) получали от Biological Industries (Kibbutz Beit HaEmek, Israel).
Получение раствора mTG:
Смесь микробной трансглутаминазы (mTG) Activa TI-WM (Ajinomoto, Japan) получали путем растворения в Дулбекко PBS с образованием 20%-ного мас./мас. раствора. Раствор поддерживали при комнатной температуре (RT) на всем протяжении эксперимента.
Получение растворов желатин-многоатомный спирт:
Раствор А - 10 г глицерина растворяли в 30 м PBS. Затем 10 г желатина погружали в раствор глицерина в течение 1,5 часов при комнатной температуре. Через 1,5 часов пропитывания добавляли 10 мл PBS, и смесь нагревали до 50°C. Смесь перемешивали вручную до образования гомогенного жидкого раствора (соотношение глицерин: желатин 1:1).
Раствор Б - 27,5 мл 20%-ного мас./мас. раствора желатина нагревали до 50°C при перемешивании. 11 г глицерина добавляли к раствору желатина (соотношение глицерин: желатин 2:1). Затем раствор глицерин-желатин оставляли охлаждаться. Раствор 2:1 глицерин: желатин оставляли пропитываться в течение 1,5 ч при 50°C. Затем раствор убирали и оставляли охлаждаться при комнатной температуре.
Раствор В - 20%-ный раствор желатина, содержащий глицерин в соотношении глицерин: желатин 2:1, нагревали до 50°C при перемешивании. Добавляли 11 г сорбита с образованием гомогенного раствора (соотношение глицерин: сорбит: желатин 2:2:1).
Раствор Г - 12 г сорбита добавляли к 20 мл 20%-ного мас./мас. раствора желатина при 50°C с образованием гомогенного раствора с отношением сорбит: желатин 3:1. Затем раствор оставляли охлаждаться.
Раствор Д - 5:1 глицерин: раствор желатина получали путем добавления 25 г глицерина при комнатной температуре к 20 мл 20%-ного мас./мас. раствора желатина при 50°C. Смесь смешивали путем перемешивания при 50°C.
Раствор Е - 20 г сорбита добавляли к 20 мл 20%-ного раствора желатина, получая соотношение 5:1 сорбит: желатин. Смесь смешивали при 50°C. Затем смесь охлаждали при комнатной температуре.
Влияние многоатомного спирта на гелеобразование желатина:
При получении в соответствии с вышеуказанным описанием 2 мл растворов желатина с многоатомными спиртами (смотри выше растворы А-Е) извлекали и оставляли охлаждаться до комнатной температуры. Для определения температуры каждого раствора использовали термометр. По мере того как температура уменьшалась, внешний вид и вязкость растворов желатин-гидрохинон оценивали с помощью визуального наблюдения и ощупывания раствора стеклянной палочкой.
Влияние многоатомных спиртов на сшивание растворов желатина с использованием mTG:
Растворы желатин-многоатомный спирт исследовали в отношении химического сшивания с использованием mTG. 1 мл 20%-ного мас./мас. раствора mTG смешивали с 2 мл растворов желатин-многоатомный спирт в небольшой пластмассовой емкости. Растворы желатин-многоатомный спирт добавляли либо при комнатной температуре, либо предварительно нагретыми до 50°C с использованием водяной бани. Растворы смешивали вручную посредством осторожного перемешивания с помощью наконечников пипеток и измеряли время гелеобразования. Внешний вид и вязкость растворов желатин-многоатомный спирт после смешивания с mTG оценивали с помощью визуального наблюдения и ощупывания раствора стеклянной палочкой. После образования геля его исследовали в отношении термоообратимости, нагревая гель до 50°C с использованием водяной бани.
Результаты
Влияние многоатомного спирта на гелеобразование желатина:
Раствор А - После замачивания в глицерине частицы желатина комковались вместе с образованием очень ломкого, твердого зернистого вещества. Казалось, что присутствие глицерина вообще не замедляет термообратимое гелеобразование. Термообратимый гель образовался за 2-3 минуты, как это происходит с 20%-ными мас./мас. растворами желатина в отсутствие глицерина. При 35°C раствор желатин-глицерин был очень вязким, на грани гелеобразования. Как и в случае охлаждения до комнатной температуре, фазовый переход желатин-глицерина был практически идентичным переходу одного желатина.
Раствор Б - Как и в случае раствора 1:1 глицерин: желатин, глицерин в соотношении 2:1 глицерин: желатин не снижал температуру перехода желатина. Раствор был высоковязким при 35°C и образовывал когезивный гель при 33-34°C. Замачивание 2:1 раствора глицерин: желатин на 1,5 часа не влияло на точку перехода желатина. Термообратимый гель начинал формироваться при 34°C.
Раствор В - При 50°C раствор желатин-глицерин-сорбит был более вязким, чем раствор желатин-глицерин сам по себе и гораздо более непрозрачным. Когда такую смесь охлаждали, гель формировался при 35°C. В результате точка перехода сорбита и глицерина не снижалась вообще.
Раствор Г - Раствор желатин-сорбит начинал образовывать гель при 40°C, показывая, что высокие концентрации сорбита действительно повышают точку перехода желатина. При комнатной температуре образовавшийся термообратимый гель был гораздо более эластичным, чем гель одного желатина.
Раствор Д - Даже при очень высоких концентрациях отношения 5:1 глицерин: желатин температура перехода желатина не понижалась. Образовался термообратимый гель, который мог быть образован одним желатином.
Раствор Е - Термообратимый гель образовался при 40°C. Наблюдалось довольно небольшое различие между свойствами растворов сорбит: желатин 3:1 и 5:1. Оба раствора незначительно повышали точку перехода желатина, но приводили к чрезвычайно липким и эластичным термообратимым гелям.
Влияние многоатомных спиртов на сшивание растворов желатина с использованием mTG:
Раствор А - Раствор желатин-глицерин превращали в плотный гель с помощью mTG за 3 минуты. Гель, образующийся через 3 минуты, был более когезивным, чем гели, образованные желатином и mTG без глицерина за такой же период времени. Гель повторно нагревали до 50°C, используя водяную баню, и он оставался твердым, подтверждая, что сшивание mTG являлось механизмом гелеобразования.
Раствор Б - Через 3 мин образовался необратимый гель. Гель повторно нагревали до 50°C, используя водяную баню, и он оставался твердым, подтверждая, что сшивание посредством mTG являлось механизмом гелеобразования. Как отмечалось в случае раствора с соотношением глицерин: желатин 1:1, присутствие глицерина приводило к более прочному гелю через 3 минуты. При соотношении в растворе глицерин: желатин 2:1 также наблюдалось, что образующийся гель был значительно более ломким, чем гели, образованные одним желатином, и также заметно более ломким, чем гели, образующиеся из раствора глицерин: желатин с соотношением 1:1.
Раствор В - Через 3 минуты образовался твердый, липкий, очень эластичный гель. Такой гель вообще не являлся ломким, и нелегко отделялся. Это расценивалось как очень важный результат, так как сшитый желатиновый гель только с глицерином был очень ломким. Сорбит значительно увеличивает эластичность в ином случае ломкого вещества. Гель повторно нагревали до 50°C, используя водяную баню, и он оставался твердым, подтверждая, что сшивание mTG являлось механизмом гелеобразования.
Раствор Г - Результаты были очень похожи на результаты с глицерином в соотношении глицерин: желатин 2:1: присутствие глицерина приводило к образованию гораздо более ломкого геля, чем гели, которые были образованы одним желатином. Однако через 3 минуты в присутствии mTG образовавшийся гель был более твердым, чем гель, который образован одним желатином с mTG через 3 минуты.
Раствор Д - Через 3 минуты твердый, однако чрезвычайно эластичный и липкий гель образовался в результате сшивания mTG раствора желатин-сорбит. По-видимому, сорбит не оказывал влияния на mTG-сшивание желатина за исключением значительного увеличения эластичности и клейкости желатиновых гелей, сшитых mTG.
Из вышесказанного было обнаружено, что добавление глицерина к желатину вообще не снижает точку перехода желатина. Замачивание желатина в глицерине не изменяет значительно его склонности к образованию термообратимых гелей. По-видимому, присутствие глицерина приводит к более жестким гелям, после того как раствор желатина смешивали с mTG в течение 3 минут. Это может указывать на ускорение mTG-сшивания желатина, когда желатин находится в присутствии глицерина.
Присутствие высоких концентраций глицерина во время mTG-сшивания желатина, как оказалось, делает полученные сшитые гели более ломкими, чем гели, образованные сшиванием одного желатина. Глицерин, по-видимому, ускоряет mTG-сшивание желатина.
Добавление сорбита вместе с глицерином не снижает точку перехода желатина. Однако сорбит значительно увеличивает эластичность и клейкость желатиновых гелей. Сорбит можно использовать для увеличения эластичности желатиновых гелей, которые становятся более ломкими при добавлении других веществ. Сорбит, по-видимому, не ингибирует mTG-сшивание желатина. Хотя сорбит, по-видимому, незначительно повышает точку перехода желатина, он существенно увеличивает эластичность и клейкость желатиновых гелей.
Увеличение отношения глицерин: желатин до 5:1 делает сшитые желатиновые гели более хрупкими, чем гели, изготовленные с использованием раствора 2:1 глицерин: желатин, но не оказывает какого-либо дополнительного действия на точку перехода желатина. Однако эффект небольшого ускорения сшивания все же имеет место при таком более высоком соотношении глицерин: желатин, но не является более отчетливым, чем данный эффект при соотношениях глицерин: желатин 1:1 и 2:1.
Раствор с соотношением сорбит: желатин 5:1 повышает точку перехода желатина, но не более чем ее увеличение в растворе с соотношением сорбит: желатин 3:1. Однако сшитый желатиновый гель, образованный раствором с 5:1, являлся еще более эластичным и липким. Это также дает возможность предположить, что количество сорбита можно менять, чтобы варьировать эластичность сшитого желатинового геля.
ПРИМЕР 13
Влияние распылительной сушки на гелеобразование и сшивание желатина
Данный пример относится к влиянию распылительной сушки на сшивание желатина. Предпочтительный диапазон для размера частиц, образованных с использованием распылительной сушки, предпочтительно является следующим: от примерно 20 до примерно 140 мкм, более предпочтительно от примерно 60 до примерно 100 мкм (диаметр).
Возможно можно рассматривать различные подходы к образованию частиц. Одна возможная стратегия состоит в образовании легко восстанавливаемой частицы желатина и mTG раздельно или с использованием специальных методов сушки для этой цели, или посредством включения добавок и затем сушки желатина и mTG с добавками в частицы. Другой возможный способ состоит в образовании легко восстанавливаемых частиц, которые включают желатин и mTG вместе. Такие частицы можно формировать только путем использования специальных методов сушки или путем включения добавок, которые улучшают способность к восстановлению таких частиц. Кроме того, такие частицы могут быть созданы, когда желатин и mTG не подвергаются какому-либо сшиванию или после того, как они подверглись частичному сшиванию.
Вещества и способы
Вещества
Свиной желатин типа А с прочностью геля по Блуму 300 получали от корпорации Sigma-Aldrich (St. Louis, МО). Микробную трансглутаминазу (mTG) ActivataTI-WM поставлял Ajinomoto (Japan). Дулбекко PBS (pH 7,4) получали от Biological Industries (Kibbutz Beit HaEmek, Israel). 98%-ную мочевину получали от Alfa Aesar (Lancaster, UK).
Получение раствора mTG:
20%-ный раствор микробной трансглутаминазы (mTG) (мас./мас.) получали путем растворения 4 г mTG с 16 г Дулбекко PBS. Раствор поддерживали при комнатной температуре (RT) на протяжении всего эксперимента.
4%-ный раствор (мас./мас.) микробной трансглутаминазы (mTG) получали путем растворения 2,04 г mTG с 50 г Дулбекко PBS. Раствор поддерживали при комнатной температуре (RT) на протяжении всего эксперимента.
Получение раствора желатина:
5%-ный раствор желатина (мас./мас.) получали путем растворения 10,52 г порошка желатина в 200 г Дулбекко PBS. Смесь нагревали до 50°C и перемешивали до образования гомогенного раствора.
Раствор 1 представлял 50 мл 5%-ного раствора желатина.
Раствор 2 - раствор 1:1 (мас./мас.) желатин-маннитол готовили путем добавления 2,63 г маннитола к 50 мл 5%-ного раствора желатина. Раствор перемешивали и сохраняли при 50°C в водяной бане. В течение всего эксперимента раствор сохраняли в емкости с водой ~50°C для предотвращения термообратимого гелеобразования.
Раствор 3 - раствор 1:1 (мас./мас.) желатин-трегалоза готовили путем растворения 2,63 г трегалозы в 50 мл 5%-ного раствора желатина при перемешивании и нагревании до 50°C. В течение всего эксперимента раствор поддерживали при 50°C.
Раствор 4 - раствор 1:1 (мас./мас.) желатин-мочевина готовили путем растворения 2,63 г мочевины в 50 мл 5%-ного раствора желатина при перемешивании и нагревании до 50°C. В течение всего эксперимента раствор поддерживали при 50°C.
Раствор 5 - 40 г 5%-ного раствора желатина смешивали с 20 г 4%-ного раствора mTG. В течение всего эксперимента раствор поддерживали при 50°C. Распылительная сушка растворов желатина
Для получения частиц желатина, высушенных распылением, получали разные 5%-ные растворы желатина в Дулбекко PBS (растворы 1-5). Растворы желатина сушили распылением, используя микрораспылительную сушилку BUCHI. Тип потока был прямоточным со смешиванием воздуха и жидкости в сопле головки. Скорость вентилятора и входную температуру поддерживали постоянными при 100% и 100°C соответственно. Скорость подачи жидкости варьировали согласно условиям процесса, воздействуя на выходную температуру, как изложено ниже.
Раствор 1 - 50 мл 5%-ного (мас./мас.) раствора желатина сохраняли нагретым и сушили распылением со скоростью подачи 15%, с выходной температурой 57°C.
Раствор 2 - 50 мл 1:1 (мас./мас.) раствора желатин-маннитол сохраняли растворенными в 50°C водяной бане. Скорость подачи жидкости составляла 15% с выходной температурой 62°C.
Раствор 3 - 50 мл 1:1 (мас./мас.) раствора желатин-трегалоза сохраняли растворенными в 50°C водяной бане. Скорость подачи жидкости составляла 15% с выходной температурой 54°C.
Раствор 4 - 50 мл 1:1 (мас./мас.) раствора желатин-мочевина сохраняли растворенными в 50°C водяной бане. Скорость подачи жидкости устанавливали равной 15% с выходной температурой 57°C. В ходе эксперимента скорость подачи жидкости меняли на 20% с выходной температурой 54°C, чтобы сделать возможным образование порошка.
Раствор 5 - 40 мл 5%-ного раствора желатина, смешанного с 4%-ным раствором mTG, сушили распылением со скоростью подачи жидкости 20% и выходной температурой 56°C. В течение всего эксперимента раствор сохраняли в емкости с водой 37°C.
Влияние распылительной сушки на гелеобразование растворов желатина:
Порошки высушенного распылением желатина растворяли в 4 мл флаконах, используя Дулбекко PBS, и смешивали путем переворачивания пробирки 4 раза. Осаждающиеся растворы нагревали в 50°C водяной бане и смешивали вручную до растворения. Затем растворы оставляли охлаждаться при комнатной температуре, и по мере того как температура уменьшалась, внешний вид и вязкость каждого раствора оценивали с помощью визуального наблюдения и ощупывания раствора стеклянной палочкой.
Раствор 1 - 0,33 г 5%-ного раствора высушенного распылением желатина растворяли в 1 мл Дулбекко PBS комнатной температуры до конечного 25%-ного (мас./мас.) желатина. Затем добавляли еще 1 мл Дулбекко PBS, восстанавливая содержание желатина до 12,5% (мас./мас.).
Раствор 2 - 0,33 г высушенного распылением раствора 1:1 желатин-маннитол растворяли в 1 мл Дулбекко PBS комнатной температуры.
Раствор 3 - 0,33 г высушенного распылением раствора 1:1 желатин-трегалоза растворяли в 1 мл Дулбекко PBS комнатной температуры.
Раствор 4 - не удалось получить порошок при распылительной сушке желатина-мочевины.
Раствор 5 - 0,25 г высушенного распылением раствора желатин-mTG растворяли в 0,75 мл 37°C Дулбекко PBS.
Влияние распылительной сушки на химическое сшивание растворов желатина с использованием mTG:
Порошки высушенного распылением желатина растворяли, как описано в предыдущем разделе, и хранили в 50°C водяной бане. 20%-ный раствор mTG комнатной температуры добавляли в отношении 2:1 желатин mTG и осторожно смешивали, используя наконечники пипеток и переворачивая пробирку 4 раза. Измеряли время гелеобразования, и внешний вид, и вязкость растворов после смешивания с mTG оценивали с помощью визуального наблюдения и ощупывания раствора стеклянной палочкой. Когда образовался гель, его исследовали в отношении термообратимости путем нагревания геля до 50°C с использованием водяной бани.
Результаты:
Распылительная сушка растворов желатина
Распылительная сушка растворов желатина давала мелкий белый порошок в разных количествах. Раствор 1 - ~50 мл 5%-ного раствора желатина давали 0,78 г. Раствор 2 - ~40 мл 5%-ного раствора желатина, смешанного с маннитолом в отношении 1:1 (мас./мас.), давали 0,73 г. Раствор 3 - ~50 мл 5%-ного раствора желатина, смешанного с трегалозой в отношении 1:1 (мас./мас.), давали 1,135 г. Раствор 4 - порошок не был получен. Эксперимент прекращали, так как желатин, смешанный с мочевиной, давал высоковязкую массу, которую не могли собрать. Раствор 5 - ~40 мл 5%-ного раствора желатина, смешанного с 4% раствора mTG, давали 1,27 г.
Влияние распылительной сушки на гелеобразование растворов желатина
Раствор 1 - желатиновый порошок по частям растворяли в PBS комнатной температуры до конечного 25%-ного (мас./мас.) желатина, с образованием белого нерастворимого осадка. После нагревания в 50°C водяной бане порошок растворялся, образуя гомогенный раствор. При охлаждении до комнатной температуры раствор образовывал гель, добавляли еще 1 мл PBS для снижения содержания желатина до 12,5% (мас./мас.). 12,5%-ный раствор желатина образовывал гель при 26-27°C.
Раствор 2 - порошок желатин-маннитол по частям растворяли в PBS комнатной температуры до конечных ~12,5% (мас./мас.) желатина (ожидается, что желатин составит 1/2 количества полученного порошка, хотя точное процентное содержание желатина неизвестно). Образовался белый нерастворимый осадок. После нагревания в 50°C водяной бане порошок растворялся с образованием гомогенного раствора. При охлаждении до комнатной температуры раствор образовал гель при 28-29°C.
Раствор 3 - порошок желатин-трегалоза по частям растворяли в PBS комнатной температуры до конечного ~12,5%-ного (мас./мас.) желатина (ожидается, что желатин составит 1/2 количества полученного порошка, хотя точное процентное содержание желатина неизвестно). Образовался белый нерастворимый осадок. После нагревания в 50°C водяной бане порошок растворяли, получая гомогенный раствор. При охлаждении до комнатной температуры раствор образовал гель при 25-26°C.
Раствор 4 - раствор содержал сшивающий агент и, следовательно, его исследовали в отношении сшивания, а не гелеобразования.
Влияние распылительной сушки на химическое сшивание растворов желатина с использованием mTG:
Раствор 1 - 500 мкл 20%-ного раствора mTG добавляли к 2 мл 12,5%-ного раствора желатина. Через 4 мин образовался прочный белый гель. Гель был необратимым.
Раствор 2 - 250 мкл 20%-ного раствора mTG добавляли к 1 мл 12,5%-ного раствора желатина с маннитолом. Через 2,5 мин образовался прочный белый гель. Гель был необратимым.
Раствор 3 - 250 мкл 20%-ного раствора mTG добавляли к 1 мл 12,5%-ного раствора желатина с трегалозой. Через 3 мин образовался прочный белый гель. Гель был необратимым.
Раствор 4 - раствор mTG-желатин растворяли в 1 мл Дулбекко PBS, нагретого до 37°C. Сразу же образовался белый слабый гель, препятствуя полному растворению в PBS. Образовавшийся гель был необратимым.
Из вышесказанного ясно, что возможна распылительная сушка растворов желатина. Например, 5%-ные растворы желатина можно сушить распылением, получая мелкодисперсные белые порошки. Можно сушить распылением желатин с маннитолом и трегалозой в отношении 1:1 (мас./мас.) желатин к маннитолу или трегалозе. Высушенные распылением растворы желатин-маннитол имеют более высокую точку перехода по сравнению с одним желатином, высушенным распылением. Высушенные распылением растворы желатин-трегалоза имеют более низкую точку перехода по сравнению с одним желатином, высушенным распылением.
Возможно сшивание высушенных распылением растворов желатина. Распылительная сушка 1:1 (мас./мас.) растворов желатин-маннитол улучшала сшивание. Распылительная сушка 1:1 (мас./мас.) растворов желатин-трегалоза не влияла на сшивание.
Возможна распылительная сушка растворов желатина, смешанного с mTG. Образовавшиеся частицы могут немедленно при восстановлении образовать гель.
ПРИМЕР 14
Аппликатор для нанесения изолирующего средства
Данный пример относится к типичному, иллюстративному аппликатору для нанесения кровоостанавливающего изолирующего средства согласно некоторым воплощениям настоящего изобретения. На Фиг.11А показан пример двойного шприцевого аппликатора 1700, включающего два шприца 1702 и 1704, для размещения каждого из двух компонентов кровоостанавливающего изолирующего средства. Шприц 1702 возможно может содержать желатин или заместитель, как описано в данном описании изобретения, в то время как шприц 1704 возможно может содержать трансглутаминазу или заместитель, как описано в данном описании изобретения. Разница в объеме флаконов отражает относительное соотношение при смешивании между двумя компонентами. Два компонента можно смешивать в сопле 1705. Для улучшенного смешивания сопло 1705 может содержат элемент, создающий водоворот 1706 (показан более детально на Фиг.11Б). Шприцевой аппликатор 1700 возможно можно присоединять к системе сжатого воздуха 1708 в сопле 1705 для создания эффекта распыления. Сжатый воздух возможно может поступать в проксимальный или дистальный кончик сопла 1705 согласно нужному применению.
ПРИМЕР 15
Катетер и способ его применения
Данный пример относится к типичному, иллюстративному катетеру и способу его применения по некоторым воплощениям настоящего изобретения. На Фиг.12А приведен пример закрытия точки ввода в сосуды, где катетер 1200 предпочтительно включает покрытие 1202, содержащее изолирующие компоненты, описанные в данном описании изобретения. Покрытие 1202 возможно и предпочтительно включает по меньшей мере один желатиновый слой 1204, два из которых показаны только с целью пояснения и без какого-либо стремления ограничить изобретение. Желатиновый слой 1204 возможно может быть заменен другим типом белкового субстрата, как описано в данном описании изобретения. Покрытие 1202 также возможно и предпочтительно включает по меньшей мере один трансглутаминазный слой 1206, который снова возможно может быть замещен другим сшивающим веществом, как описано в данном описании изобретения. Покрытие 1202 предпочтительно обернуто вокруг оболочки сосудистого интродуктора 1208, также называемого троакаром.
Оболочка 1208 возможно может быть покрыта еще одной наружной оболочкой 1209, которая создает механический барьер между сухим изолирующим компонентом и физиологическими жидкостями, как показано в Фиг.12Б. Как только наружную оболочку 1209 удаляют, изолирующие компоненты активируют с помощью физиологических жидкостей с созданием массы, закрывающей периваскулярную точку ввода.
Хотя изобретение было описано со ссылкой на вышеизложенное подробное описание и предпочтительные воплощения, вышеизложенное описание предназначено для иллюстрации и не ограничивает изобретение, которое определено объемом прилагаемой формулы изобретения. Другие аспекты, преимущества и модификации входят в объем формулы изобретения.
Реферат
Группа изобретений относится к медицине, а именно к травматологии и хирургии, и может быть использована для остановки кровотечения. Для этого используют композицию, а также адгезивный материал, содержащие желатин и трансглутаминазу, где их соотношение является достаточным для уменьшения кровотечения в ране и где указанный желатин не подвергается необратимому гелеобразованию и образует раствор с трансглутаминазой при температуре ниже естественной гель-золь перехода стандартного животного желатина, полученного из животного источника или представляющего собой рекомбинантный желатин или их комбинацию. Использование данных изобретений позволяет сократить время остановки кровотечения в ране. 2 н. и 20 з.п. ф-лы, 19 ил., 11 табл., 15 пр.

Комментарии