Биополимерное волокно, состав формовочного раствора для его получения, способ приготовления формовочного раствора, полотно биомедицинского назначения, способ его модификации, биологическая повязка и способ лечения ран - RU2468129C2
Код документа: RU2468129C2
Чертежи





Описание
Группа изобретений относится к химической и биохимической технологии, в частности к способам получения растворов для формования биополимерных волокон из хитозана, к получению биополимерных волокон и нетканых волокнисто-пористых материалов из хитозана методом электроформования, а также к медицине, конкретно к новым биологическим повязкам на основе хитозана, предназначенным для лечения ран различной этиологии (ожогов II-IIIАБ степени, донорских участков, длительно незаживающих ран, трофических язв, пролежней и других дефектов кожного покрова), позволяющим ускорить процесс заживления, создать оптимальную среду для регенерации, защитить рану от возникновения инфекционного процесса и травматизации, предотвратить образование грубых рубцов. Группа изобретений может быть использована в химической, биохимической и косметической промышленности, биологии, медицине, фармакологии, а также в научно-исследовательской практике в этих областях.
Аминополисахарид животного происхождения хитозан, получаемый из хитина панцирей членистоногих, характеризуется рядом ценных свойств: не токсичен, в процессе получения полностью утрачивает антигенность, обладает высокой сорбционной способностью, совместим с большинством лекарственных средств, проявляет антибактериальное и противогрибковое действие, биосовместим с тканями человека, влияет на процессы регенерации поврежденных кожных покровов, биодеградируем естественным метаболическим путем и др. Важной особенностью хитозана является сохранение, а в ряде случаев улучшение этих полезных качеств у формованных изделий на его основе.
Хитозан широко используется в биотехнологии, фармакологии и является основным компонентом многих новых лекарственных, косметических и др. препаратов. Биосовместимость с живыми тканями, близость по функциональным качествам к компонентам дермы in vivo, биоинертность, биоразлагаемость, биоцидные и другие свойства хитозана определяют перспективность разработки на его основе новых материалов медико-биологического назначения.
Макромолекула хитозана имеет гетероцепное строение и построена из звеньев остатков D-глюкозамина (в основном) и N-ацетил-D-глюкозамина, связанных β-1,4-гликозидными связями. В настоящее время термином хитозан принято называть сополимер со степенью деацетилирования (количество звеньев D-глюкозамина) выше ~75 мольн.% [Хитин и хитозан: Получение, свойства и применение / Под ред. К.Г.Скрябина, Г.А.Вихоревой, В.П.Варламова. М.: Наука. 2002. 368 с.]. Структурная формула макромолекулы хитозана приведена ниже, индекс n-x соответствует степени деацетилирования хитозана.

Замечено, что практически все функциональные свойства хитозана зависят от его молекулярных параметров, в частности молекулярной массы



В настоящее время одним из перспективных направлений переработки хитозана в материалы биомедицинского назначения является получение на его основе волокон с диаметром от нано- (нм) до микрометров (мкм), а также нетканых волокнисто-пористых материалов с наноразмерными порами.
На сегодняшний день единственным высокопроизводительным и апробированным в промышленности методом получения полимерных нановолокон и волокон субмикронного диаметра является электродинамический метод (электроформование). В основе метода лежит процесс образования тонких полимерных струй под действием электрического поля высокой напряженности с последующим высыханием струи и оседанием в виде однородного по длине волокна. Использование нановолокон для создания нетканых материалов биомедицинского назначения обусловлено рядом присущих волокнам наноскопического и субмикронного диаметра уникальных свойств, в числе которых большая удельная площадь поверхности и сверхмалый размер пор. Известно, что малый размер пор способствует фильтрации наноразмерных частиц уже на поверхности материала, а также препятствует диффузии находящейся в порах материала жидкости, эффективно удерживая ее внутри. С другой стороны, при использовании нетканого материала с наноразмерными порами и включением лекарственных веществ, могут быть осуществлены точное дозирование и адресная доставка препарата к поврежденным тканям. Эти свойства необходимы в клинической практике применения нетканого волокнисто-пористого материала для улучшенной абсорбции раневого отделяемого, надежной биологической защиты раневой поверхности на этапе восстановления эпителия, создания эффекта управляемого влияния на процессы регенерации и т.п.
Известен состав раствора для формования волокон из хитозана электродинамическим способом, включающий хитозан в концентрации С=6-8 мас.% и трифторуксусную кислоту или хитозан С=8 мас.% и смесь трифторуксусной кислоты с дихлорметаном в соотношении компонентов 90:10-70:30 [Ohkawa К., Cha D., Kim H. et al. // Macromolec. Rapid Communic. 2004. V.25. P.1600-1605. DOI: 10.1002/marc.200400253]. Электропряденое волокно, полученное из растворов хитозана в трифторуксусной кислоте, характеризуется диаметром d=330-610 нм, из растворов хитозана в смеси трифторуксусной кислоты с дихлорметаном - d=200-660 нм.
Недостатком является использование агрессивных растворителей - трифторуксусной кислоты и дихлорметана, небольшое количество которых неизбежно остается в готовом волокне. Трифторуксусная кислота обладает сильной кислотностью и быстро проникает в ткани, вызывая тяжелые ожоги кожи, глаз, слизистых оболочек и др. Вдыхание паров трифторуксусной кислоты вызывает отек легких. Дихлорметан очень летуч, в организме метаболизируется до монооксида углерода, что может вызвать острое отравление. Длительный покровный контакт с дихлорметаном может вызвать накопление его в жировых тканях и привести к ожогу. При длительной работе с дихлорметаном возможно поражение печени и нейропатия. ПДК дихлорметана в рабочей зоне 50 мг/м3, в воде водоемов не более 7.5 мг/л. Существенным недостатком является также нестабильность процесса электроформования.
Известны составы формовочных растворов для электроформования волокон из хитозана, включающие хитозан со СД=56-65 мольн.% в концентрации С=7 мас.% и уксусную кислоту концентрации CK=90% [Geng X., Kwon Oh-H., Jang J. // Biomaterials. 2005. V.26. P.5427-5432. DOI: 10.1016/j.biomaterials.2005.01.06] или хитозан со СД-75-85 мольн.% в концентрации С=3-5 мас.% и уксусную кислоту CK=80-90% [Vrieze De S., Westbroek P., Camp T.V., Langenhove Van L. // J.Mater. Sci. 2007. V.42. P.8029-8034. DOI: 10.1007/s10853-006-1485-6]. Средний диаметр получаемого электропряденого волокна составляет ~130 нм и 50-100 нм, соответственно.
Недостатком является использование хитозана с низкой степенью деацетилирования, что ограничивает применение волокна в медицинской практике. Кроме того, используется концентрация уксусной кислоты, близкая к ледяной уксусной кислоте, что экологически и экономически не целесообразно. Существенным недостатком является также нестабильность процесса электроформования волокна: незначительное увеличение концентрации хитозана в растворе (например, с 7 мас.% до 8 мас.%) или средневязкостной молекулярной массы хитозана (например, с
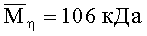
Описан способ получения хитозановых волокон линейной плотности 0.52-1.0 Текс из раствора полимера С=3-4 мас.% в 2%-ной уксусной кислоте способом мокрого формования в осадительную ванну, содержащую 2% NaOH и 10% Na2SO4, с последующей фильерной вытяжкой от -45 до +90% и пластификационным вытягиванием от 20 до 110% [Илларионова Е.Л., Калинина Т.Н., Чуфаровская Т.И., Хохлова В.А. // Хим. волокна. 1995. №6. С.18-22]. При этом используют хитозан с

Недостатки: способ мокрого формования в осадительную ванну и, соответственно, низкая производительность процесса, необходимость фильерной и платификационной вытяжки. Цель - получение волокна из хитозана электростатическим методом - в способе не ставилась.
Расширению областей и эффективности применения хитозансодержащих материалов медико-биологического назначения способствует возможность их модификации, в том числе путем смешения хитозана с другими полимерами. Наиболее перспективными представляются смеси хитозана с биологически инертными искусственными полимерами многоцелевого назначения (применяемых в медицине, фармакологии, косметологии и т.п.): полиэтиленоксидом [Алексеев В.Л., Кельберг Е.А., Бронников С. В., Евмененко Г.А. // Высокомолек. соед. 2001. Т.43А. №10. С.1856-1860], поливиниловым спиртом [Мухина В.Р., Пастухова Н.В., Семчиков Ю.Д. и др. // Высокомолек. соед. 2001. Т.43А. №10. С.1797-1804; Внучкин А.А. // Автореф. канд. химич. наук. СПб. 2009], поливинилпирролидоном [Патент РФ №2247555, МПК A61K 7/48, A61K 31/14, A61K 31/722, А61Р31/04; Патент РФ №2379025, МПК A61K 9/06, A61K 31/79, A61K 31/722], диацетатом целлюлозы [Du J., Hsieh Y.-L. // Cellulose. 2009. V.16. P.247-260. DOI: 10.1007/s10570-008-9266-9] и др.
Смесевые хитозансодержащие материалы можно получить в виде электропряденых волокон и нетканых волокнисто-пористых полотен из общего формовочного раствора, получаемого посредством смешения водно-кислотного раствора хитозана и водного раствора вспомогательного полимера. Добавка второго полимерного компонента в формовочный раствор хитозана приводит к устойчивому и воспроизводимому электроформованию и получению волокна практически без наличия дефектов.
Известен состав формовочного раствора для получения хитозансодержащего волокна способом электродинамического формования, включающий хитозан с
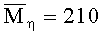


Недостатком является низкая степень деацетилирования хитозана, использование муравьиной кислоты (что недопустимо при получении биомедицинских материалов). Кроме того, устойчивое формование бездефектного волокна наблюдается только из растворов смесей хитозан:поливиниловый спирт при большом содержании второго полимерного компонента (>50%). В связи с чем основное содержание волокна составляет поливиниловый спирт, который, в отличие от хитозана, не является биологически активным полимером и не проявляет антибактериальные, репаративные и др. свойства.
Значительная часть литературных и патентных источников касается процесса электроформования, свойств и морфологии бикомпонентных нановолокон из смесей хитозана с полиэтиленоксидом в разном соотношении компонентов.
Известны составы для электроформования хитозансодержащего волокна из растворов смесей хитозана с полиэтиленоксидом в относительно разбавленной уксусной кислоте. Например, из растворов смесей хитозан: полиэтиленоксид = 50:50 или 67:33 с общей концентрацией полимера СП=4-6 мас.% в 2%-ной уксусной кислоте получают волокна с диаметром 80-180 нм [Duan В., Dong С., Yuan X., Yao K. // J. Biomater. Sci. Polymer Edn. 2004. V.15. №6. P.797-811], из растворов смесей хитозан:полиэтиленоксид = 25:75 с общей концентрацией полимера СП=5 мас.% в 3%-ной уксусной кислоте формуют при температуре 70°С волокна с core-shell структурой и d=340-495 нм [Zhang J.-F., Yang D.-Z., Xu F. et al. // Macromolec. 2009. V.42. №14. P.5278-5284. DOI: 10.1021/ma900657y]. Нановолокна из растворов смесей хитозан: полиэтиленоксид с общей концентрацией полимера СП=2.2-3 мас.% в 0.5 М уксусной кислоте получают только при соотношении полимерных компонентов в смеси 60:40 [Bhattarai N., Edmondson D., Veiseh O. et al. // Biomaterials. 2005. V.26. P.6176-6184. DOI: 10.1016/j.biomaterials.2005.03.027]. Для получения нановолокна из растворов смесей хитозан:полиэтиленоксид = 90:10 в 0.5М уксусной кислоте в систему добавляют сурфактант (Triton Х-100™ в количестве 0.3%) и сорастворитель (диметилсульфоксид в количестве 10%).
Недостатком всех составов, за исключением состава хитозан:полиэтиленоксид = 90:10, является малое содержание хитозана в формовочном растворе. Получение нановолокна из раствора смеси хитозан:полиэтиленоксид в соотношении компонентов 90:10 требует дополнительного введения неионогенного поверхносто-активного вещества и диметилсульфоксида. Все это существенно снижает биосовместимость, биодеградируемость и другие полезные свойства электропряденого волокна.
Известны также составы для электроформования хитозансодержащего нановолокна из растворов смесей хитозана с полиэтиленоксидом в концентрированной уксусной или муравьиной кислоте.
Известен состав прядильного раствора для формования нановолокон с d=60-145 нм, включающий хитозан и полиэтиленоксид или N-карбоксиэтилхитозан и полиэтиленоксид в соотношении компонентов 50:50 с общей концентрацией полимера в растворе СП=1.7-2 мас.%, уксусную кислоту концентрации СК=85% или муравьиную кислоту СК=85% [Penchev H., Paneva D., Manolova N., Rashkov I. // Macromolec. Biosci. 2009. №9. P.884-894. DOI: 10.1002/mabi.200900003].
Недостатками является небольшое содержание хитозана и низкая общая концентрация полимеров в формовочном растворе, что экономически не целесообразно. Содержание биополимера хитозана в готовом волокне также невелико.
Известен состав формовочного раствора, включающий хитозан и полиэтиленоксид в соотношении компонентов 62.5:37.5-30:70 с общей концентрацией полимера СП=2.5-4 мас.%, уксусную кислоту СК=32-45%, из которого формуют волокно с d=100-180 нм [Klossner R.R., Queen H.A., Coughlin A.J., Krause W.E. // Biomacromolec. 2008. V.9. №10. P.2947-2953]. При этом используется хитозан со СД=75-85 мольн.%. Хитозан растворяют в уксусной кислоте СК=80-90%, полиэтиленоксид - в воде (время приготовления гомогенных растворов индивидуальных полимеров 24-72 ч), затем осуществляют смешение полученных растворов в заданном соотношении компонентов. Отмечено также влияние содержания хитозана в формовочном растворе на диаметр электропряденого композитного волокна. Так, более тонкие волокна получаются при электроформовании из растворов смесей хитозан:полиэтиленоксид с большим содержанием хитозана.
Недостатком является то, что раствор и электропряденое волокно содержат сравнительно малое количество биосовместимого полимера, сравнительно низкая степень деацетилирования используемого хитозана, а также длительность и многостадийность процесса получения формовочного раствора. Задача получения волокна из водных растворов водорастворимого хитозана в способе не ставилась.
Имеется ряд патентов, описывающих способ получения волокон из хитинхитозана и многокомпонентных композитных волокон из смеси хитозана с другими природными и синтетическими полимерами, а также нетканого волокнисто-пористого материала на их основе.
Известен способ электроформования нановолокон из растворов хитинхитозана в N-метилморфолиноксиде, гексафлуоро-2-пропаноле, гидратированном гексафлюороацетоне и муравьиной кислоте [Патент KR 2005/10-0032656 А].
Недостатком является использование агрессивных и технологически не приемлемых растворителей.
Известен способ электроформования биокомпозитных нановолокон из смеси хитозана или олигохитозана с альгиновой кислотой в соотношении компонентов хитозан (олигохитозан):альгиновая кислота в готовом волокне 20:80-1:99 с использованием в качестве растворителя полимеров и олигомера водных растворов уксусной (СК=1%), соляной (СК=1-5%) и т.п. кислот [Патент WO 2007/093805 А1, МПК A61L 15/28; C08J 5/18; D01F 8/18].
Недостатки: максимальное содержание аминополисахарида хитозана в сухом волокне не превышает 80%, невозможность получения биокомпозитного волокна из водных растворов полимеров.
Известны способы получения электростатическим методом композитных нановолокон и нетканого материала на их основе из смесей хитозана с синтетическими полимерами: полиамидами [Патент KR 2007/10-0749966 В1; Патент CN 2009/10-1502759 А], полиэфирами (например, полиэтилентерефталатом) [Патент KR 2006/10-0652496 В1].
Главный недостаток - использование агрессивных растворителей (гексафлуороизопропанола, муравьиной кислоты и др.) для растворения синтетического полимера.
Известен способ получения нетканого волокнистого функционального материала, содержащего синтетический полимер полилактид, биополимеры хитозан, пептид, зеин, желатину, коллаген [Патент JP 2008/38271 А]. Описан способ получения биодеградируемого композитного нетканого материала из нановолокон, содержащих, мас.%: хитозан 0-50, полилактид и полигликолид 49.9-99.9, противовоспалительные и антибактериальные лекарства 0.1-25 [Патент CN 2009/10-1491689 А]. Известен способ получения волокнистого скаффолда биомедицинского назначения, включающий макромолекулы синтетических полимеров - полилактида, полигиколида, сополимеров полилактида и полигиколида, полигидроксибутирата, полигидроксивалериата, биополимеров - хитозана, хитина, альгиновой кислоты, коллагена, желатины и гиалуроновой кислоты [Патент KR 10-2007-0024092, МПК A61L 27/14, A61L 27/20, A61L 27/40]. Описан способ получения электростатическим методом нетканого материала, содержащего хитозан, биодеградирующий природный полимер (коллаген, желатину, полиглутаминовую кислоту, шелк, целлюлозу, альгиновую кислоту, гиалуроновую кислоту), биодеградирующий синтетический полимер (полиэтиленоксид, поливиниловый спирт, полигидроксибутират, полигидроксибутиратгидроксивалериат, полилактид, полигликолид, сополимеры полилактида с полигликолидом, поликапролактон, полиэфир, полиангидрид) и фактор роста клеток [Патент KR 2008/10-0104932 В1]. Описаны электропряденые аморфные фармацевтические композиции, предназначенные для изготовления стабильных твердых дисперсий аморфной формы лекарственного средства в полимерных нановолокнах, состоящие из водо- или неводорастворимого волокнообразующего полимера, или их комбинаций и частиц лекарственного вещества, в частности, из хитозана и его производных, полиэтиленоксида, поливинилацетата, поливинилпирролидона, поливинилового спирта, гиалуроновой кислоты, альгината, каррагинана, производных целлюлозы (Na-карбоксиметилцеллюлозы, метилцеллюлозы, этилцеллюлозы, гидроксиэтилцеллюлозы, гидроксипропилцеллюлозы, гидроксипропилметилцеллюлозы, фталат гидроксипропилметилцеллюлозы, ацетофталат целлюлозы), некристаллической целлюлозы, крахмала и его производных (гидроксиэтилкрахмала, гликолят натрий-крахмала), альбумина, желатины, коллагена, полиакрилатов и их производных (таких как члены семейства полимеров Eudragit от компании Rohm Pharma), полиальфагидроксикислоты, полиальфааминокислоты и их сополимеры, сложные полиортоэфиры, полифосфазины или полифосфоэфиры [Патент РФ №2331411, МПК A61K 9/48, A61K 9/20, A61K 9/52, A61K 9/22].
Главными недостатками указанных композиций являются их многокомпонентность, большое количество вспомогательного(ных) полимера(ов), сложная структурная организация и высокая себестоимость.
Имеются также патенты, описывающие составы формовочных растворов для формования двух- и трехкомпонентных композитных хитозансодержащих волокон со сравнительно высоким содержанием хитозана, способы получения и составы этих волокон и нетканого волокнисто-пористого материала на их основе, включающие хитозан и дополнительно полиэтиленоксид и/или другие инертные синтетические и природные полимеры.
Известны способы получения трехкомпонентных композитных волокон с d=50-500 нм и составы прядильных растворов для их формования. Например, предложен способ получения композитного нановолокна, содержащего хитозан:серин:полиэтиленоксид в соотношении компонентов 66:17:17 [Патент JP 2008/163520 А]. Описан способ получения нетканого волокнистого материала из нановолокон, содержащих, мас.%: хитозан 10-90 и смесь полиэтиленоксида с поливиниловым спиртом, остальное [Патент CN 2004/1569254 А]. Соотношение полиэтиленоксид: поливиниловый спирт варьируют от 90:10 до 10:90. Формование проводят из растворов с общей концентрацией полимера СП=4-8 мас.% в уксусной кислоте при напряжении электрического поля 5-30 кВ, объемном расходе 0.1-0.5 мл/ч, межэлектродном расстоянии 5-25 см.
Главный недостаток данных способов и составов - максимальное содержание хитозана в электропряденом волокне не превышает 90%.
Известен способ получения двухкомпонентного хитозансодержащего волокна с d=60-120 нм и содержанием хитозана до 96.3% электроформованием растворов смеси хитозана с полиэтиленоксидом или поливиниловым спиртом в трифторуксусной кислоте или других тригалогенкарбоновых кислотах [Патент WO 2009/011944 А2, МПК D01F 6/02, D01D 5/00, C12N 0/00]. При этом используется хитозан со СД=72-83 мольн.%. Получаемый материал дополнительно обрабатывают сшивающим агентом - глутаровым альдегидом.
Недостатками способа являются использование агрессивных канцерогенных растворителей, что исключает применение получаемого материала в медицине, фармакологии и т.п.; дополнительная обработка с применением токсичного глутарового альдегида, что приводит к образованию сшивок между глутаровым альдегидом, хитозаном и полиэтиленоксидом или поливиниловым спиртом, сопровождающемуся утратой водорастворимости, биодеградируемости и эластичности волокна и материала в целом. Цель - получение нановолокна из водных растворов смесей хитозана с полиэтиленоксидом или поливиниловым спиртом - в способе не ставилась.
Известны также способы получения хитозансодержащих искусственных волокон, обладающих антибактериальной активностью к Staphylococcus aureus. Streptococcus salivarius, Pseudomonas aeruginosa, биосовместимостью и биодеградируемостью, из хитина путем измельчения хитина, деацетилирования до хитозана с СД=91 мольн.% и более, ксантогенирования и мокрого формования [Патент РФ №2258102, МПК D01F 4/00, С08В 9/00], а также из хитозана путем измельчения хитозана, добавления раствора NaOH, проведения мерсеризации хитозана с последующим ксантогенированием, мокрого формования из полученной вискозы хитозана, отделки и сушки [Патент РФ №2278188, МПК D01F 4/00, С08В 9/00]. Полученное волокно содержит 10-100 мас.% хитозана, имеет толщину 16.6-17.2 текс, прочность 105-125 мН/текс, удлинение при разрыве 11-13%.
Недостатком является длительность и трудоемкость способа; микронный диаметр, высокая прочность и низкие эластичные свойства волокна. Задача получения хитозансодержащего нановолокна с антибактериальной активностью методом электростатического формования для получения лечебного покрытия для ран в способе не ставилась.
Между тем, использование электропряденых нетканых волокнисто-пористых материалов из волокон хитозана с нано- и субмикронным диаметром в качестве раневых покрытий или других биологических повязок чрезвычайно перспективно. Это обусловлено как ценными лечебными функциями аминополисахарида хитозана, так и уникальными особыми свойствами электропряденых волокон и материалов на их основе, определяемыми малым размером (диаметром) нановолокна, отсутствием протяженных дефектов, высокой удельной поверхностью материала и др. Однако до настоящего времени о применении нетканого полотна из нановолокон хитозана в клинической медицинской практике не известно.
Актуальность разработки и совершенствования раневых покрытий диктуется задачами современной хирургии и низкой эффективностью традиционных перевязочных средств. В медицине давно стоит проблема получения искусственных материалов, обладающих физико-химическими и биологическими свойствами, близкими к свойствам кожи, которые можно использовать в качестве раневых покрытий.
Условиями, обеспечивающими оптимальное заживление раны, являются: влажность раневой поверхности, достаточное напряжение кислорода в тканях раны, отсутствие избыточного количества раневого экссудата, предотвращение вторичного инфицирования, защита от внешних травмирующих воздействий и тепловых потерь.
Исходя из этого сформулированы требования к современным повязкам. Роль повязки сводится не только к защите раны от внешней среды и механической травматизации, ее назначение - активное воздействие на раневой процесс за счет создания наилучших условий для заживления и необходимой дозировки лекарственных средств, а также благоприятного микроклимата, достигаемого оптимальной паро- и газопроницаемостью и своевременным дренажом экссудата. Кроме того, повязка должна хорошо моделироваться на ране, плотно прилегать к раневой поверхности, иметь достаточную эластичность и механическую прочность, быть атравматичной, не оказывать токсического и местнораздражающего действия, не иметь антигенных и пирогенных свойств, быть устойчивой к стерилизации, комфортной в ношении, удобной в наложении и удалении, длительно эксплуатироваться на ране, иметь большой срок хранения. Используемые для этой цели раневые покрытия должны отвечать следующим требованиям: изолировать рану от попадания инфекции, защищать ее от высыхания, эффективно удалять избыток раневого экссудата и его токсических компонентов, обеспечивать влажную среду, газообмен, постоянную температуру вокруг раны, уменьшать теплоотдачу, обладать определенными антибактериальными свойствами, создавать оптимальную среду для регенерации и эпителизации, предотвращать травматизацию раны, потери тепла, белка и тканевой жидкости, защищать рану от загрязнения макрочастицами, обеспечивать возможность быть носителями для лекарственных препаратов. Биоматериалы, применяемые для создания раневых покрытий, должны быть достаточно прочными и эластичными, устойчивыми к стерилизации, удобными в применении для больного и медперсонала, биосовместимыми с дермальными тканями, а так же биодеградирующими [Шаповалов С.Г. // ФАР Миндекс-Практик. 2008. №8. С.38-46].
Однако ни одно из имеющихся к настоящему времени биопокрытий не удовлетворяет хирургов в полной степени. Все это ставит задачу разработки нового поколения материалов для решения проблем хирургии, способных не только выполнять защитные функции (закрытие раны от внешнего инфицирования, антибактериальное воздействие, дозированное сорбирование раневого экссудата и др.), но и способствовать развитию репарационных процессов вплоть до полной эпителизации поврежденной поверхности. Кроме того, одним из свойств новых биопокрытий должно явиться их эффективное воздействие на рану, что позволит уменьшить число болезненных перевязок и значительно увеличить интервал между ними.
В настоящее время наиболее удачно решают эту проблему покрытия, выполненные в виде листов или пленок из смеси синтетических полимеров и полимеров биологического происхождения, поскольку покрытия, выполненные только из синтетических полимеров, например монокомпонентные полиуретановые [Патент США №2871218, МПК C08G 18/66; C08G 18/76; C08G 18/00] или многокомпонентные из смеси полиуретана и полиаллилового эфира [Патент ФРГ №34098558], обладают хорошими физико-механическими свойствами, достаточно прочные, водо- и паропроницаемые, но выполняют только защитную функцию и не обладают способностью стимулировать регенерационные процессы. С другой стороны, покрытия, выполненные только из биополимеров, например монокомпонентные из коллагена [Патент США №4578067, A61L 15/32; A61L 15/16; A61F 13/16; A61L 15/00] или многокомпонентные из смеси желатина и хитозана [Патент США №4572906, A61L 26/00; C08L 5/08; C08L 89/06; A61F 13/00; A61K 31/70; A61K 37/00; C09D 3/04], смеси коллагена, хитозана и гликозоаминогликанов [Патент WO 88/10123, МПК A61L 27/00; A61L 27/26; A61L 27/34; C08L 89/06; C12N 5/00; A61L 27/00; C08L 89/00; C12N 5/00; A61L 15/04], хорошо стимулируют регенерационные процессы, но обладают низкими физико-механическими свойствами: хрупкие в сухом и непрочные во влажном состоянии, быстро разрушаются под действием ферментов, находящихся в биологических жидкостях раны, что приводит к потере защитных функций.
Известно достаточно много образцов раневых покрытий, отличающихся по химическому составу. Из существующего в настоящее время широкого ассортимента полимерных раневых покрытий в наибольшей степени отвечают всем медико-биологическим требованиям биодеградируемые покрытия из полисахаридов, которые могут быть полезны как на ранних стадиях лечения ран, так и на более поздних. Общими свойствами биосовместимых материалов из полисахаридов (в том числе хитозана) является их гидрофильность, обусловливающая высокую адсорбирующую способность (до 5000%), хорошая адгезия к ране, отсутствие токсичности и раздражающего действия, а также гемостатические свойства. Отмечено их стимулирующее действие на процессы заживления ран и ожогов, что способствует более быстрому развитию грануляционной ткани, ускорению эпителизации. Присутствие на ране полисахаридных материалов благоприятно сказывается на репарационных процессах на всех стадиях лечения раны. Основной проблемой получения покрытий из природных полисахаридов является достижение хорошей механической прочности покрытия и устойчивости на ране. Разработка биодеградируемых полимерных покрытий с высокой сорбирующей способностью и различными сроками рассасывания является в настоящее время наиболее актуальным направлением в области создания эффективных биологических повязок для лечения ран.
В настоящее время широко исследуются для решения указанной выше задачи биологические материалы на основе аминополисахарида хитина и его деацетилированного производного хитозана.
В последние годы препараты на основе хитозана и его композиций с другими природными, искусственными или синтетическими полимерами находят применение в регенеративной медицине в качестве порошкообразных [Патент РФ №2086247, МПК A61K 35/70; Алексеев А.А., Феофилова Е.П., Терешина В.М. и др.// Комбустиология. 2002. №4. http://burn.ru/all/number/show/?id=3493] или гелеобразных дерматопротекторных средств [Патент РФ №2258515, МПК A61K 31/722, A61K 31/355, A61K 9/08, А61Р 17/02], перфорированных пленочных покрытий для лечения ран [Патент РФ №2219954, МПК A61L 15/28], гидроколлоидных аппликационных покрытий [Патент РФ №2219955, МПК A61L 15/32, A61L 15/22, А61Р 17/02], покрытий губчатого типа [Патент РФ №2240830, МПК A61L 15/44], биологических композиций [Патент РФ №2108114, МПК A61L 15/28], гидрогелевых перевязочных средств [Патент РФ №2270646, МПК A61F 13/02, A61L 15/22, A61L 15/44, A61L 15/60] и др. При этом у материалов с волокнистой структурой отмечены более высокие кинетические характеристики, а также улучшенные биологические свойства.
Покрытия из хитозана воздухо- и паропроницаемы, препятствуют инвазии извне микроорганизмов, создают оптимальный микроклимат в ране, способствуют клеточному росту и пролиферации в ране. Хитозан, помимо стимулирования пролиферации на первых стадиях раневого процесса, очень полезен на завершающей фазе заживления - перестройке рубца. Его присутствие в ране помогает избежать образования грубых рубцов.
Известна повязка, один из вариантов которой содержит хитозан и выполнен в форме эластичной перфорированной пленки [Заявка РФ №99100105/14, МПК A61L 15/26, A61L 15/28, A61L 15/64].
Недостатками являются: многослойность и, как следствие, невозможность полной конгруэнтности с раневой поверхностью, удаление раневого отделяемого путем впитывания сорбирующим слоем повязки, что приводит к неизбежности частой смены повязок.
Известна также биологически активная полимерная сорбирующая пленка, созданная на основе хитозана [Кильдеева Н.Р., Вихорева Т.А., Ларионова А.С, Гальбрайх Л.С. // Современные подходы к разработке эффективных шовных материалов и полимерных имплантатов: Матер. III международ. Конф. М. 1998. 130-131 с.], содержащая ферментативный препарат трипсин и модифицированная сшивающим реагентом - додецилсульфатом натрия, проявляющим, кроме того, антимикробные свойства.
Недостатками являются: плохая моделируемость на ране, низкая прочность повязки во влажном состоянии, что создает вероятность выброса раневого отделяемого из повязки в раневую зону, а присутствие токсичного для организма человека реагента - додецилсульфата натрия.
Известна полимерная пленка на рану на основе хитозана, имеющая толщину 5-50 мкм, модифицированная сшивающим агентом - эпихлоргидрином, которая также может содержать 0-20% поливинилового спирта или полиэтиленгликоля и антибактериальные или антисептические вещества [Патент WO 2001/0141820 А1, МПК A61L 15/28; A61L 15/16].
Недостатки: относительно невысокая адсорбирующая способность пленки, быстрая биодеградация пленки в раневой среде, что затрудняет очищение раны, т.к. адсорбируемое пленкой раневое отделяемое и продукты биодеградации остаются в ране, полное удаление пленки возможно лишь при использовании на относительно сухих ранах.
Известна повязка, представляющая собой перфорированную пленку и содержащая хитозан в виде соли органической кислоты (уксусной, янтарной или гликолевой), глутаровый альдегид, поливиниловый спирт и биологически активную добавку в виде CO2-экстрактов лекарственных растений [Патент РФ 2219954, МПК A61L 15/28].
Недостатки повязки: недостаточная конгруэнтность с раневой поверхностью, невысокая адсорбирующая способность, ограниченная паропроницаемость, невозможность своевременного удаления избыточного раневого отделяемого из-за выполнения перфорации в виде отверстий или насечек. В случае использования в качестве биологически активной добавки CO2-экстрактов лекарственных растений (например, тысячелистника, облепихи, подорожника, эвкалипта, полыни горькой, зверобоя, кориандра) повышается вероятность развития аллергических реакций. Недостатками являются также сложный состав повязки, включение в нее токсичного глутарового альдегида, низкие эластичные свойства из-за увеличения сшивок между глутаровым альдегидом, хитозаном и поливиниловым спиртом.
Известна биологическая композиция для лечения ран «Коллахит», содержащая хитозан, глутаровый альдегид и антисептические препараты - синтетические или растительного происхождения, являющаяся биодеградируемым средством [Патент РФ №2108114, МПК A61L 15/28]. Композиция «Коллахит» может быть выполнена в форме пленки или губки.
Недостатками являются: высокая адгезия к раневой поверхности, невозможность использования на всех стадиях раневого процесса, необходимость частых перевязок, фрагментируемость повязки в результате ее лизиса при увеличении срока экспозиции повязки на ране, трудности при проведении перевязок, связанные с прилипанием повязок к ране. При наличии в ране даже умеренного количества раневого отделяемого отмечается лизис покрытия в течение первых суток его применения и образование на поверхности раны гелеобразной массы, что требовало замены покрытия и необходимости контроля за его целостностью. Кроме того, при получении повязки используется токсичный глутаровый альдегид.
Известны губчатые повязки для лечения ран из смеси желатины, хитозана и формальдегида [Патент КНР №1097980], целлюлозы и хитозана [Заявка Японии №0376029], коллагена и хитозана [Патент WO №8504413, МПК A01N 25/10; A61F 13/00; A61F 2/10; A61K 47/00; A61K 9/00; A61K 9/22; A61K 9/70; A61L 15/00; A61L 15/32; A61L 15/44; A61L 15/64; A61L 17/00; A61L 27/24; A61L 27/56; A61L 27/58; С08Н 1/00; C08L 89/00; C08L 89/06; С09Н 1/00].
Основными недостатками данных губок являются низкая гигроскопичность, высокая плотность, относительно невысокая ранозаживляющая активность, обусловленная либо частичной деструкцией биодеградируемых компонентов губчатой повязки, либо прилипанием губки к ране и плохим подводом кислорода к зоне репарации. Нередко в их состав вводятся антибактериальные средства (обычно фурацилин и гентамицин). Однако эти вещества присутствуют в избыточном количестве и часто вызывают аллергические реакции.
Серьезным недостатком многих повязок является их прилипание к ране, в результате чего перевязки становятся болезненными, а главное при этом происходит травмирование регенерирующих тканей. Многие положительные свойства перевязочных материалов снижаются вследствие повреждений, вызываемых снятием повязки, прилипшей к заживающей ране [Turner T.D., Schmidt R.J., Harding K.G. Advances in wound management. London: John Wiley & Sons, 1986. C.23-29]. Адгезия повязки к ране возникает в силу разных причин. В большинстве случаев происходит «склеивание» покрытия с поверхностью раны. Роль «клея» выполняет экссудат, который при высыхании образует струп. Прочность такого соединения зависит от химической природы полимера в повязке.
Известны также коллаген-хитозановые губчатые раневые покрытия [Свидетельство на полезную модель РФ №8608 U1, МПК A61L 15/44], представляющие собой губки для лечения раневых поверхностей в виде пористого эластичного тела из смеси фибрилл коллагена и волокон хитозана, причем фибриллы закреплены в пространстве с помощью сетчатой структуры на основе молекул хитозана и структурообразователя, содержащей биологически активное вещество или его смесь с антибиотиками или антисептиками.
Недостатки: при использовании данных раневых покрытий происходит быстрое всасывание раневого экссудата и набухание губки. Губка постепенно полностью «приживается» к поверхности раны, превращаясь в корку. При обильной экссудации губки нужно менять 1 раз в сутки. Частая смена повязок делает перевязки болезненными, приводит к нарушению эпителизации раны, что травмирует молодой эпителий, удлиняет сроки лечения и нередко способствует формированию грубых рубцов.
Кроме того, общими недостатками для всех губчатых покрытий являются: способность толстых пластов губки пропитываться раневым экссудатом и играть роль субстрата для микробной флоры раны. Большой диаметр пор губки способствует прорастанию грануляций и травматичному удалению покрытия с поверхности ран.
Вне зависимости от этиологии и патогенеза ран принципы наружной терапии дефектов кожи общие и включают: очищение от некротических масс, антисептическую обработку, стимуляцию роста грануляций и процесса эпителизации, механическую защиту ран. Однако способов лечения ран известно множество.
Традиционно с этой целью применяют примочки, влажно-высыхающие повязки, мази, эмульсии, суспензии различных лекарственных средств. Однако эти средства плохо переносятся больными, особенно при больших площадях поражения, высокой болезненности ран, частой смене повязок (влажные повязки присыхают ко дну язвы, мазевые - препятствуют газообмену на поверхности раны, плохо впитывают раневой экссудат). Поэтому в настоящее время предпочтение отдается раневым покрытиям, в состав которых включено лекарственное вещество.
Известен способ лечения ран [Патент РФ №2108078, МПК A61F 13/02, A61F 13/54, A61L 15/00] путем наложения поверх раны перфорированного пленочного перевязочного материала, выполненного из полиэтиленовой пленки с нанесенной на ее поверхность комплексной пудрой Брейтмана в виде смеси талька, цефалолексина, стрептомицина, эритромицина, террамицина, тетрациклина, вибромицина, синтомицина, неомицина, канамицина, нистатина, дактарина, канестена и риванола. Перевязки осуществляют по мере необходимости через 24, 48 и 72 ч. Лечение проводят до полного заживления ран.
Недостатки: наличие в перевязочном материале большого количества антибиотиков разного вида повышает частоту аллергических реакций, а полиэтиленовая пленка не обладает ни барьерными, ни сорбционными свойствами и выполняет только функцию механического барьера и является чужеродной для тканей раны.
Известен способ лечения ран [Патент РФ №2265454, МПК A61K 47/36], заключающийся в том, что на раны накладывают поликомпозиционную перфорированную пленку, которая содержит (мас.%): поливиниловый спирт 9.8-19.8, хитозан 78.3-89.4, анестетик 0.1-0.2, антибактериального вещества в виде антибиотика аминогликозидного ряда, например гентамицина, 0.5-2.0.
Недостатки этого способа состоят в том, что применяемая повязка имеет низкую механическую прочность, так как не содержит связующих компонентов. Кроме того, содержит большое количество поливинилового спирта, который не является биологически активным полимером и, частично растворяясь в раневом экссудате, нередко обладает местнораздражающим действием.
Известен способ лечения ран [Патент РФ №2386436, МПК A61K 31/14], заключающийся в том, что на рану накладывают поликомпозиционный перевязочный материал, представляющий собой комбинацию геля на основе смеси водорастворимых полисахаридов и пленки, содержащей, по меньшей мере, латекс фторкаучука и полисахарид растительного происхождения, которую накладывают поверх геля. Повязку меняют каждые 2-4 суток до полной эпителизации раны. При необходимости перед наложением перевязочного материала проводят дебризинг - туалет раны, включающий очистку раны от микроорганизмов, мертвой ткани, крови и ее сгустков, вызывающих фагоцитарную воспалительную реакцию. В качестве геля берут гидрогель по патенту РФ №2180856, МПК A61L 15/28 или патенту РФ №2194535, МПК A61L 15/28, преимущественно содержащий водорастворимое производное целлюлозы, соль альгиновой кислоты, каррагинан или пектин или их смесь, воду и антисептик. В качестве пленки берут монослойную пленку по патенту РФ №2193896, МПК A61L 15/28, преимущественно содержащую латекс фторкаучука, водорастворимое производное целлюлозы или соль альгиновой кислоты, или каррагинан, или пектин, или их смесь и антисептик.
Недостатки этого способа состоят в сложности и трудоемкости применения, особенно при обширных раневых дефектах, недостаточной абсорбции раневого отделяемого, отсутствии возможностей для расширения спектра терапевтического воздействия на рану за счет включения дополнительных лекарственных препаратов, что суживает возможности применения способа в различных областях хирургии.
Наиболее близким по составу к заявляемому водно-кислотному раствору для формования биополимерных волокон из хитозана и способу его получения является раствор, содержащий хитозан и полиэтиленоксид с общей концентрацией полимера СП=1.33-4.4 мас.%, уксусную кислоту концентрации СК=50-90% [Desai K., Kit K., Li J., Zivanovic S. // Biomacromolec. 2008. V.9. №3. P.1000-1006]. Хитозан и полиэтиленоксид отдельно растворяют в уксусной кислоте, смешивают полученные растворы в соотношении компонентов 95:5, 90:10, 75:25, 50:50 и формуют волокно электродинамическим методом при комнатной температуре. Используется хитозан со степенью ацетилирования СД=67-83 мольн.% (для получения бездефектного волокна наиболее оптимальна СД=70 мольн.%), полиэтиленоксид со средневесовой молекулярной массой

Недостатки: использование хитозана с относительно невысокой степенью деацетилирования, что ограничивает медико-биологическое применение волокна; использование полиэтиленоксида с относительно невысокой молекулярной массой; низкая концентрация полимерного вещества (смеси хитозана и полиэтиленоксида) в формовочном растворе, что снижает производительность процесса электроформования; относительно невысокое (менее 90%) содержание биосовместимого полимера хитозана в растворе, пригодного для стабильного электроформования, и, соответственно, в готовом волокне; необходимость применения повышенной температуры для получения электропряденого волокна с содержанием хитозана более 90%, что экономически и экологически не целесообразно.
Наиболее близким по составу к заявляемому водному раствору для формования биополимерных волокон из хитозана и способу его получения является раствор, содержащий водорастворимый хитозан и полиэтиленоксид или олигохитозан и полиэтиленоксид с общей концентрацией полимера СП=5 мас.%, деионизованную воду [Zhang J.-F, Yang D.-Z., Xu F. et al. // Macromolec. 2009. V.42. №14. P.5278-5284. DOI: 10.1021/ma900657y]. Водорастворимый хитозан, олигохитозан и полиэтиленоксид растворяют в деионизованной воде, смешивают полученные растворы в соотношении компонентов водорастворимый хитозан:полиэтиленоксид = 75:25, 50:50 и 25:75, олигохитозан:полиэтиленоксид = 25:75 и формуют волокно электродинамическим методом при Т=70°С. Волокно, сформованное из водного раствора смеси олигохитозана с полиэтиленоксидом имеет диаметр d~600 нм, водорастворимого хитозана с полиэтиленоксидом - d~145-220 нм. Используется полиэтиленоксид

Недостатки: относительно невысокое содержание хитозана в растворе и, соответственно, в готовом волокне, необходимость проведения процесса электроформования при повышенной температуре, сравнительно большой диаметр олигохитозансодержащего волокна.
Наиболее близким к заявляемому электропряденому биополимерному волокну из хитозана, нетканому волокнисто-пористому полотну из хитозана и способу его получения является метод получения нановолокон с помощью электроформования полимерных матриц, приготовленных на основе биополимера хитозана в смеси со вспомогательным нетоксичным полимером полиэтиленоксидом, отличающийся тем, что хитозан до формования растворяется в уксусной кислоте концентрации СК=50-90% в течение 12-24 часов и подогревается до температуры T=35-50°С, затем полученный раствор смешивается с предварительно (отдельно) полученным при T=35-50°С водным раствором полиэтиленоксида и помещается в электростатическое поле между формующим и собирающим электродами при напряжении электрического поля 60-75 кВ, межэлектродном расстоянии 10-20 см [Патент WO 2009/049565 А2, МПК D01D 5/00; D01D 5/06; D01F 4/00; D01F 9/00]. При этом используется хитозан с


Недостатки способа: длительность и повышенная температура приготовления формовочного раствора; использование образцов хитозана с относительно невысокой степенью деацетилирования и полиэтиленоксида со сравнительно низкой молекулярной массой. Существенным недостатком является использование образцов хитозана в относительно узком диапазоне молекулярной массы и с невысокой степенью деацетилирования, а также невысокое (90.3% и менее) содержание биосовместимого полимера хитозана в готовом волокне. Сравнительно высокое содержание в готовом нановолокне вспомогательного полимера синтетического происхождения (полиэтиленоксида) снижает биосовместимость, бактериостатичность, биодеградируемость и другие ценные качества электропряденого волокна и нетканого материала, что ограничивает его использование в биомедицине, фармакологии и т.п. Цель - получение нановолокна и нетканого волокнисто-пористого полотна из водных растворов хитозана со вспомогательным нетоксичным полимером - не ставилась.
Решений использования нетканых волокнисто-пористых материалов из электропряденых полимерных волокон, в частности из нановолокон хитозана, в качестве раневых покрытий и биологических повязок для лечения ран различной этиологии в клинических условиях в патентной и научной литературе не обнаружено.
Заявляемое изобретение направлено на решение следующих задач:
- получение электропряденых биополимерных волокон из хитозана и нетканого волокнисто-пористого полотна на их основе с использованием хитозана с высокой степенью деацетилирования и в широком диапазоне молекулярной массы;
- получение электропряденых биополимерных волокон из хитозана и нетканого волокнисто-пористого полотна на их основе с содержанием хитозана в готовом продукте более 90.3 мас.% из водно-кислотных растворов хитозана со вспомогательным нетоксичным полимером с использованием для растворения хитозана и вспомогательного нетоксичного полимера не только водных растворов уксусной кислоты, но и водных растворов природных органических кислот (или их производных) многоцелевого назначения (применяемых в медицине, фармакологии, косметологии и т.п.) - лимонной, молочной, аскорбиновой, янтарной, а также с включением биологически активных веществ - гемостатических, антисептических, антимикробных препаратов, местных анестетиков, протеолитических ферментов и др. с целью придания готовому продукту дополнительного лечебного эффекта;
- получение электропряденых биополимерных волокон из хитозана и нетканого волокнисто-пористого полотна на их основе с содержанием хитозана в готовом продукте более 75 мас.% из водных растворов водорастворимого хитозана со вспомогательным нетоксичным полимером с включением биологически активных веществ - гемостатических, антисептических, антимикробных препаратов, местных анестетиков, протеолитических ферментов и др., а также с использованием для растворения хитозана водных растворов аминокапроновой и транексамовой аминокислот, являющихся гемостатическими препаратами, с целью придания готовому продукту дополнительного лечебного эффекта;
- повышение эластичности нетканого волокнисто-пористого полотна на основе электропряденых биополимерных волокон из хитозана;
- создание биологической повязки в виде раневого покрытия из нетканого волокнисто-пористого полотна биомедицинского назначения из электропряденых волокон хитозана для лечения ран различной этиологии (ожогов II-IIIАБ степени, донорских участков, длительно незаживающих ран, трофических язв, пролежней и других дефектов кожного покрова), позволяющей ускорить процесс заживления, создать оптимальные условия для неосложненного течения раневого процесса и регенерации, защитить рану от микробной инвазии и травматизации, предотвратить образование грубых рубцов;
- создание биологической повязки в виде раневого покрытия из нетканого волокнисто-пористого полотна биомедицинского назначения из электропряденых волокон хитозана с расширенными терапевтическими возможностями, обладающего пролонгированным лечебным действием за счет дозированной доставки биологически активных лекарственных веществ в зону запланированного воздействия. В качестве биологически активной добавки повязка может содержать протеолитический фермент, антимикробный, антисептический, гемостатический или обезболивающий препарат;
- разработка эффективного способа лечения ран различной этиологии, учитывающего объективное состояние раны и стадию ее заживления, с использованием биологической повязки, представляющей собой лечебное раневое покрытие из нетканого волокнисто-пористого полотна биомедицинского назначения, полученного из электропряденых нановолокон хитозана.
Технический результат, который может быть получен при реализации группы изобретений.
1. Получение электропряденых биополимерных бездефектных волокон и нетканого волокнисто-пористого полотна на их основе:
- из хитозана с высокой степенью деацетилирования (СД≥80 мольн.%) и в широком диапазоне молекулярной массы;
- с минимальным количеством вспомогательного нетоксичного полимера, в частности, из водно-кислотных растворов хитозана при достижении содержания хитозана в готовом продукте более 90.3 мас.%, из водных растворов хитозана при достижении содержания хитозана в готовом продукте более 75 мас.%;
- с использованием для растворения хитозана и вспомогательного нетоксичного полимера водных растворов природных органических кислот (или их производных) многоцелевого назначения (применяемых, например, в медицине, фармакологии, косметологии и т.п.) - лимонной, молочной, аскорбиновой, янтарной, аминокапроновой и транексамовой;
- с включением биологически активных веществ - гемостатических, антисептических, антимикробных препаратов, местных анестетиков, протеолитических ферментов и др., с целью придания готовому продукту дополнительного лечебного эффекта.
2. Достижение оптимального и экономически обоснованного способа смешения и растворения компонентов прядильного раствора, используемого для электроформования волокна.
3. Выбор оптимальных составов прядильной композиции на основе хитозана для устойчивого электроформования бездефектных волокон нано- и субмикронного размера и нетканого волокнисто-пористого полотна разной поверхностной плотности.
4. Разработка оптимального экологически чистого и экономически целесообразного способа модификации нетканого волокнисто-пористого полотна для получения материала с улучшенными эластическими свойствами при обеспечении прочности, достаточной для использования материала в медицинских приложениях.
5. Создание биологической повязки в виде раневого покрытия из нетканого волокнисто-пористого полотна биомедицинского назначения, полученного из электропряденых волокон хитозана, обеспечивающего:
- максимальную пластичность и полную конгруэнтность биологической повязки с поверхностью раны;
- высокую степенью атравматичности;
- заданное антибактериальное действие;
- улучшенную абсорбцию раневого отделяемого и удерживание раневого отделяемого внутри покрытия;
- регенеративное воздействие на рану при одновременной биорезорбции раневого покрытия под действием раневого отделяемого;
- адресную доставку лекарственных средств к поврежденным тканям;
- пролонгированный и равномерный лечебный эффект воздействия на рану;
- возможность длительного нахождения на ране вплоть до полного восстановления утраченного кожного покрова с достижением заживления за счет однократной аппликации препарата;
- неосложненное течение раневого процесса и регенерации при лечении ожогов II-IIIАБ степени, донорских участков, длительно незаживающих ран, трофических язв, пролежней и других дефектов кожного покрова.
6. Разработка способа лечения ран различной этиологии, включающего туалет раны и наложение на нее описанной выше биологической повязки, обеспечивающего возможность длительного нахождения повязки на ране, в ряде случаев до полного восстановления утраченного кожного покрова с достижением заживления за счет однократной аппликации препарата.
Поставленная задача достигается тем, что состав формовочного раствора для формования биополимерных волокон включает хитозан, полиэтиленоксид, органическую кислоту, воду, при этом хитозан используют с молекулярной массой 30-500 кДа, степенью деацетилирования 80-95 мольн.% при соотношении компонентов, мас.%: хитозан - 2.0-7.0, полиэтиленоксид - 0.012-0.4, кислота органическая - 2.5-70, вода - остальное. Полиэтиленоксид используют с молекулярной массой 2000-8000 кДа. В качестве органической кислоты используют уксусную кислоту 50-80%-ной концентрации, или лимонную кислоту 10-50%-ной концентрации, или молочную кислоту 5-30%-ной концентрации, или аскорбиновую кислоту 10-30%-ной концентрации, или янтарную кислоту 5-10%-ной концентрации, или аминокапроновую кислоту 3-6%-ной концентрации, или транексамовую кислоту 2.5-5%-ной концентрации. Состав дополнительно содержит диацетатцеллюлозы в количестве 0.051-0.09 мас.%.
Состав может содержать добавки биологически активных веществ в количестве 0.4-0.55 мас.%, при этом в качестве добавок используют устойчивые в кислой среде биологически активные вещества местноанестезирующего действия (например, новокаин, лидокаин) или антибактериального и бактериостатического действия (азитромицин, эритромицин, кларитромицин и др.).
Другой вариант состава формовочного раствора для формования биополимерных волокон включает хитозан, полиэтиленоксид, воду, при этом хитозан используют с молекулярной массой 30-40 кДа при соотношении компонентов, мас.%: хитозан - 5.71-6.89, полиэтиленоксид - 0.069-0.6, вода - остальное. Полиэтиленоксид используют с молекулярной массой 2000-8000 кДа. Состав может содержатт добавки биологически активных веществ в количестве 0.1-1.25 мас.%, при этом в качестве добавок используют биологически активные вещества антисептического, дезинфицирующего и противовоспалительного действия (например, протаргол), или протеолитического действия (химотрипсин, химопсин, коллагеназа), или гемостатического действия (тромбин, феррокрил, аминокапроновую или транексамовую кислоту), или местноанестезирующего действия (новокаин, лидокаин), или антибактериального и бактериостатического действия (фурагин, фузидин-Na и др.).
Состав формовочного раствора для формования биополимерных волокон включает хитозан, поливиниловый спирт или поливинилпирролидон, воду, при этом хитозан используют с молекулярной массой 30-40 кДа при соотношении компонентов, мас.%: хитозан - 6.0-7.14, поливиниловый спирт или поливинилпирролидон - 1.43-1.92, вода - остальное.
Способ приготовления формовочного раствора, в котором формовочный раствор биополимера хитозана со вспомогательным полимером или вспомогательными полимерами готовится путем смешения полимеров в порошкообразном состоянии с последующем их растворением в растворителе на магнитной мешалке до гомогенного состояния в течение 2-8 часов в зависимости от молекулярной массы и концентрации полимера, типа и концентрации органической кислоты.
Биополимерное волокно, включающее хитозан в виде соли органической кислоты и полиэтиленоксид, при этом хитозан используют с молекулярной массой 30-500 кДа, степенью деацетилирования 80-95 мольн.% при соотношении компонентов, мас.%: хитозан в виде соли органической кислоты - 90.7-99.75, полиэтиленоксид - остальное. Полиэтиленоксид используют с молекулярной массой 2000-8000 кДа. В качестве соли хитозана и органической кислоты используют ацетат хитозана, или цитрат хитозана, или лактат хитозана, или аскорбат хитозана, или сукцинат хитозана, или аминокаприат хитозана, или транексамиат хитозана. Биополимерное волокно дополнительно содержит диацетатцеллюлозы в количестве 4.0-7.3 мас.%
Биополимерное волокно содержит добавки биологически активных веществ в количестве 6.2-8.3 мас.%, при этом в качестве добавок используют устойчивые в кислой среде биологически активные вещества местноанестезирующего действия или антибактериального и бактериостатического действия.
Другой вариант биополимерного волокна включает хитозан и полиэтиленоксид, или поливиниловый спирт, или поливинилпирролидон, при этом хитозан используют с молекулярной массой 30-40 кДа при соотношении компонентов, мас.%: хитозан - 75.8-99, полиэтиленоксид - остальное. Полиэтиленоксид используют с молекулярной массой 2000-8000 кДа.
Биополимерное волокно содержит добавки биологически активных веществ в количестве 1.4-14.9 мас.%, при этом в качестве добавок используют биологически активные вещества антисептического, дезинфицирующего и противовоспалительного действия, или протеолитического действия, или гемостатического действия, или местноанестезирующего действия, или антибактериального и бактериостатического действия.
Полотно биомедицинского назначения, представляющее собой нетканый волокнисто-пористый материал, сформированный из биополимерных волокон хитозана или соли хитозана и органической кислоты, характеризующееся средним диаметром волокон из диапазона 50-600 нм, поверхностной плотностью из диапазона 5-25 г/м2, разрывной нагрузкой при одноосном растяжении 0.61-33.6 Н, относительным удлинением при разрыве 6.0-16.4%, степенью сорбции паров воды 55-110 мас.% и паров 0.5Н соляной кислоты 450-1500 мас.%, степенью сорбции физиологического раствора 600-800 мас.% и дистиллированной воды 450-650 мас.%, при этом используют хитозан с молекулярной массой 30-500 кДа, степенью деацетилирования 80-95 мольн.%.
Способ модификации полотна биомедицинского назначения, согласно которому полотно дополнительно подвергают набуханию в физиологическом растворе или дистиллированной воде при температуре 20-25°С в течение 2-3 мин до степени сорбции полотном физиологического раствора не менее 600-800 мас.%, дистиллированной воды не менее 450-650 мас.%, при этом обеспечивают величину относительного удлинения полотна при разрыве не менее 35%. Полотно дополнительно подвергают термообработке при температуре 80-150°С в течение 15-30 минут, помещают в дистиллированную воду или физиологический раствор на 2-3 мин до степени набухания полотна 700-1100 мас.%, при этом обеспечивают величину относительного удлинения полотна при разрыве не менее 35%. Полотно дополнительно обрабатывают щелочным реагентом в течение 1 ч с последующим промыванием дистиллированной водой до достижения нейтрального значения pH. В качестве щелочного реагента используют 1 Н раствор едкого натрия или триэтаноламин или этиловый спирт. После промывки полотно помещают в дистиллированную воду до степени набухания полотна не менее 200-410 мас.%, при этом обеспечивают величину относительного удлинения полотна при разрыве не менее 35%.
Биологическая повязка для лечения ран различной этиологии в виде раневого покрытия, представляющая собой нетканое волокнисто-пористое полотно биомедицинского назначения, сформированное из электропряденых биополимерных волокон хитозана или соли хитозана и органической кислоты, при этом используют хитозан с молекулярной массой 30-500 кДа, степенью деацетилирования 80-95 мольн.%.
Способ лечения ран различной этиологии, включающий туалет раны и наложение на нее биологической повязки, при этом используют биологическую повязку, описанную выше.
Способ осуществляется следующим образом.
1. Приготовление формовочного раствора. Воздушно-сухую навеску хитозана смешивают с воздушно-сухой навеской вспомогательного полимера или вспомогательных полимеров, заливают растворителем (водным раствором кислоты заданной концентрации или водой), перемешивают на магнитной мешалке при комнатной температуре и нормальном атмосферном давлении в течение τ=2-8 часов до гомогенного состояния и фильтруют через нитроцеллюлозный фильтр с диаметром пор 0.45 мкм. При необходимости на последнем этапе гомогенизации в раствор вводят биологически активное вещество в виде молекулярного или дисперсного раствора. Раствор хранят в статических условиях при комнатной температуре, время хранения раствора не более 4-5 сут.
2. Электроформование биополимерных волокон из хитозана и нетканого волокнисто-пористого полотна на их основе. Полученный формовочный раствор помещают в прядильную однокапиллярную ячейку - стальную иглу 20 g с плоским наконечником - установки электроформования. К ячейке подсоединяют положительный электрод источника постоянного тока с подаваемым напряжением U=10-40 кВ. Формовочный раствор подается микронасосом-дозатором. Собирающий электрод-коллектор в виде вращающегося цилиндра со скоростью вращения до 1500 об/мин или неподвижной плоской металлической пластины заземляется. Игла прядильной ячейки расположена перпендикулярно оси вращения барабана или плоскости пластины на расстоянии L=8-40 см. Объемный расход прядильного раствора, контролируемый микронасосом, составляет 0=2.5-10 мл/ч. Сформировавшаяся под действием электрического поля струя прядильного раствора оседает на электроде-коллекторе и отверждается в виде воздушно-сухих волокон. В течение времени на электроде-коллекторе образуется нетканое волокнисто-пористое полотно с хаотичным или упорядоченным расположением волокон.
3. Физико-химическая модификация нетканого волокнисто-пористого полотна из электропряденых биополимерных волокон хитозана. Полотно выдерживают в дистиллированной воде или физиологическом растворе (0.9% NaCl) в химическом сосуде любого типа при температуре 20-25°С и нормальном атмосферном давлении в течение 2-3 минут. Полотно выдерживают в термошкафу при температуре 80-150°С в течение 15-30 минут, затем в дистиллированной воде в течение 2-3 минут.
4. Химическая модификация нетканого волокнисто-пористого полотна из электропряденых биополимерных волокон хитозана. Полотно выдерживают в растворе едкого натра (CNaOH=1 H), или триэтаноламина (СТЭА≤60%), или этилового спирта (СЭС≤70%) в течение 1 часа при модуле ванны 1:10 в химическом сосуде любого типа при температуре 20-25°С и нормальном атмосферном давлении. Затем полотно промывают дистиллированной водой до нейтрального значения рН=7.0-7.5 и помещают в дистиллированную воду на 3-5 минут.
5. Оценка биосовместимости нетканого волокнисто-пористого полотна из электропряденых биополимерных волокон хитозана. Полотно модифицируют, стерилизуют и используют в качестве матрицы для культивирования эпителиоподобных или эпителиальных клеток.
6. Клинические исследования биологической повязки в виде раневого покрытия из нетканого волокнисто-пористого полотна биомедицинского назначения из электропряденых волокон хитозана.
Биологическая повязка для лечения ран изготавливается из нетканого волокнисто-пористого полотна биомедицинского назначения из электропряденых волокон хитозана и представляет собой лечебное раневое покрытие, обладающее рядом уникальных характеристик: улучшенной абсорбцией раневого отделяемого и свойством удерживания его внутри покрытия, точным дозированием лекарственного средства и его адресной доставкой к поврежденным тканям, антибактериальным действием и регенеративным эффектом, свойством постепенно рассасываться самостоятельно под действием раневого отделяемого.
Перед наложением биологической повязки рана тщательно обрабатывается растворами антисептиков. При необходимости проводят туалет раны, включающий очистку ее от избытка раневого экссудата, мертвых тканей, сгустков крови, попавших в рану макрочастиц. Затем с помощью пинцета раневое покрытие переносится на рану, вырезается в соответствии с ее конфигурацией и фиксируется сверху марлевой повязкой. Покрытия меняют по мере промокания раневым отделяемым, в среднем через 3-4 суток, при этом с раневой поверхности удаляют только промокшие участки покрытия и заменяют их новыми, по размеру соответствующими удаленным участкам. В случае если покрытия не промокают, их не удаляют до полной эпителизации ран. Если покрытия применяются как временное закрытие ран в области глубоких ожогов после некрэктомии, их удаляют по мере подготовки ран к аутодермопластике.
При решении поставленных в изобретении задач используют хитозан с молекулярной массой


Вязкость (η, Па·с) формовочных растворов определяли на ротационных вискозиметрах: автоматическом вискозиметре Rheotest RN 4.1 (Германия) с рабочим узлом цилиндр-цилиндр (измерительные системы Н2, S1) в диапазоне напряжений сдвига τ=2-160 Па, Brookfield LVDV-II+ (Brookfield Engineering, США) с рабочим узлом цилиндр-цилиндр (измерительная система SC4-31) в диапазоне τ=0.082-1.02 Па. Электропроводность (æ, мСм/см) формовочных растворов измеряли на кондуктометре Анион-4120 (Россия).
Линейную скорость волокнообразования определяли по формуле

где Q - объемный расход, СП - концентрация полимера, d - диаметр волокна, ρж и ρП - плотности полимера и растворителя, соответственно.
Диаметр волокна (d, нм) измеряли на сканирующем электронном микроскопе Tescan MIRA LMU (Чехия). Поверхностную плотность (δ, г/м2) нетканого полотна определяли взвешиванием прямоугольного лоскута площадью 200 см2 на аналитических весах Ohaus (точность взвешивания ±0.001 г).
Процесс сорбции характеризовали величиной степени сорбции (α, мас.%), которую рассчитывали по формуле: α=(m-m0)·100%/m0, где m и m0 - массы набухшего и исходного, соответственно, нетканого волокнисто-пористого полотна. В качестве сорбата использовали физиологический раствор (0.9% NaCl), дистиллированную воду, а также пары воды и пары среды, образованной 0.5 Н соляной кислотой (последняя выбрана в качестве среды, имитирующей раневой экссудат).
Упруго-пластические свойства определяли согласно Material test i130 «Static tensile test of non-woven cloth» на разрывной машине одноосного растяжения Tira Test 28005 (Германия) с ячейкой нагружения 100 Н, скоростью хода траверсы 10-50 мм/мин. Разрывную нагрузку (F, Н) и удлинение определяли при разрыве. Относительное удлинение при разрыве (ε, %) рассчитывали с учетом первоначальной длины образца, взятого на испытание, и выражали в процентах.
Для оценки биосовместимости нетканого волокнисто-пористого полотна из электропряденых биополимерных волокон хитозана в качестве тестовых культур использовали трансформированную клеточную линию эмбрионального эпителия почки макаки (МА-104) из коллекции НИИ цитологии РАН (г.С-Петербург) и дермальные фибробласты человека. Фибробласты выделяли в процессе культивирования путем спонтанной миграции клеток из фрагментов кожи, подученных от здоровых доноров при пластических операциях. Культуры клеток выращивали в ростовой среде DMEM с добавлением 10% эмбриональной сыворотки крупного рогатого скота в течение 1-7 суток в CO2-инкубаторе при T=37°С. Жизнеспособность клеток оценивали на флуоресцентном микроскопе «МикМед-2» (Россия), окрашивание проводили акридиновым оранжевым и этидиумом бромидом. Наблюдение за адгезией и пролиферацией клеток проводили на сканирующем электронном микроскопе Tescan MIRA LMU (Чехия). Дезагрегацию монослоя клеточной культуры и отделение его от нетканого волокнисто-пористого полотна проводили путем ферментативной обработки монослоя смесью 0.25%-ого раствора трипсина с 0.2%-ым раствором версена в соотношении 1:1 при Т=37°С.
Изобретение поясняется примерами конкретного исполнения и иллюстрациями, где:
на фиг.1 показана микрофотография биополимерных волокон состава ацетат хитозана:полиэтиленоксид = 99:1 (мас.%), полученная методом сканирующей электронной микроскопии;
на фиг.2 приведена фотография нетканого волокнисто-пористого полотна из биополимерных волокон состава ацетат хитозана:полиэтиленоксид = 99:1 (мас.%);
на фиг.3 - микрофотография биополимерных волокон состава хитозан:полиэтиленоксид = 95:5 (мас.%), полученная методом сканирующей электронной микроскопии;
на фиг.4 представлен монослой клеточной культуры эмбрионального эпителия МА-104 через 1 сут культивирования на нетканом волокнисто-пористом полотне из биополимерных волокон состава хитозан:полиэтиленоксид = 99:1 (мас.%);
на фиг.5 - результат воздействия трипсина на монослой клеточной культуры МА-104, выращенный на нетканом волокнисто-пористом полотне из биополимерных волокон состава хитозан:полиэтиленоксид = 99:1 (мас.%).
Группа примеров 1-6. Влияние концентрации уксусной кислоты на физико-химические характеристики формовочного раствора, параметры процесса электроформования и характеристики биополимерных волокон из ацетата хитозана.
Пример 1. Готовят формовочный раствор с общей концентрацией полимера СП=3.12 мас.% в уксусной кислоте концентрации Ск=50%. Воздушно-сухую навеску 3.09 г хитозана


хитозан - 3.09,
полиэтиленоксид - 0.03,
уксусная кислота - 50,
вода - остальное.
Характеристика формовочного раствора: вязкость η=1.62-1.82 Па·с, электропроводность æ=2.8 мСм/см.
Раствор фильтруют, подают в прядильную ячейку установки электроформования и формуют волокно на плоский электрод при напряжении U=20-25 кВ, межэлектродном расстоянии L=25 см, объемном расходе Q=5-7 мл/ч.
Электропряденые волокна имеют диаметр d=200-260 нм, отмечается незначительное количество дефектов в виде веретенообразных утолщений. Хитозан в сформованном волокне находится в солевой форме ацетата хитозана - соли хитозана и уксусной кислоты. Состав биополимерного волокна, мас.%:
ацетат хитозана - 99.0,
полиэтиленоксид - остальное.
Пример 2 выполнен аналогично примеру 1. Отличие состояло в использовании уксусной кислоты концентрации СК=70%. Состав формовочного раствора, мас.%:
хитозан - 3.09,
полиэтиленоксид - 0.03,
уксусная кислота - 70,
вода - остальное.
Физико-химическая характеристика формовочного раствора: вязкость η=2.20-2.28 Па·с, электропроводность æ=1.2 мСм/см. Параметры процесса электроформования: плоский электрод, напряжение U=20-25 кВ, межэлектродное расстояние L=25 см, объемный расход Q=5-7 мл/ч. Характеристика электропряденых волокон: диаметр d=150-200 нм, дефекты на волокне отсутствуют. Состав биополимерного волокна, мас.%:
ацетат хитозана - 99.0,
полиэтиленоксид - остальное.
Пример 3 выполнен аналогично примеру 1. Отличие состояло в использовании уксусной кислоты концентрации СК=80%. Состав формовочного раствора, мас.%:
хитозан - 3.09,
полиэтиленоксид - 0.03,
уксусная кислота - 80,
вода - остальное.
Физико-химическая характеристика формовочного раствора: η=2.20-2.28 Па·с, æ=1.2 мСм/см. Параметры электроформования: плоский электрод, U=18-20 кВ, L=20 cM, Q=2.5 мл/ч. Характеристика электропряденых волокон: d=150-200 нм, дефекты на волокне отсутствуют. В процессе длительного электропрядения наблюдается подсыхание формовочного раствора на выходе из прядильной ячейки. Состав биополимерного волокна, мас.%:
ацетат хитозана - 99.0,
полиэтиленоксид - остальное.
Пример 4 выполнен аналогично примеру 1. Отличие в том, что при смешении воздушно-сухих навесок полимеров используют 3.105 г хитозана и 0.015 г полиэтиленоксида. Состав формовочного раствора, мас.%:
хитозан - 3.105,
полиэтиленоксид - 0.015,
уксусная кислота - 50,
вода - остальное.
Характеристика формовочного раствора: η=1.38-1.66 Па·с, æ=2.7 мСм/см. Параметры электроформования: плоский электрод, U=20-25 кВ, L=25 см, Q=5-7 мл/ч. Характеристика электропряденых волокон: d=200-250 нм, отмечаются дефекты в виде веретенообразных утолщений. Состав биополимерного волокна, мас.%:
ацетат хитозана - 99.5,
полиэтиленоксид - остальное.
Пример 5 выполнен аналогично примеру 2. Отличие в том, что при смешении воздушно-сухих навесок полимеров используют 3.105 г хитозана и 0.015 г полиэтиленоксида. Состав формовочного раствора, мас.%:
хитозан - 3.105,
полиэтиленоксид - 0.015,
уксусная кислота - 70,
вода - остальное.
Характеристика формовочного раствора: η=1.38-1.66 Па·с, æ=2.7 мСм/см. Параметры электроформования: плоский электрод, U=20-25 кВ, L=25 см, Q=5-7 мл/ч. Характеристика электропряденых волокон: d=150-200 нм, дефекты на волокне отсутствуют. Состав биополимерного волокна, мас.%:
ацетат хитозана - 99.5,
полиэтиленоксид - остальное.
Пример 6 выполнен аналогично примеру 3. Отличие в том, что при смешении воздушно-сухих навесок полимеров используют 3.105 г хитозана и 0.015 г полиэтиленоксида. Состав формовочного раствора, мас.%:
хитозан - 3.105,
полиэтиленоксид - 0.015,
уксусная кислота - 80,
вода - остальное.
Характеристика формовочного раствора: η=1.02-1.06 Па·с, æ=1.8 мСм/см. Параметры электроформования: плоский электрод, U=20 кВ, L=20 см, Q=3 мл/ч. Характеристика электропряденых волокон: d=150-200 нм, дефекты на волокне отсутствуют. В процессе длительного электропрядения наблюдается подсыхание формовочного раствора на выходе из прядильной ячейки. Состав биополимерного волокна, мас.%:
ацетат хитозана - 99.5,
полиэтиленоксид - остальное.
Из примеров 1-6 видно, что наиболее оптимальной для электроформования биополимерных волокон из хитозана является концентрация уксусной кислоты СК=70%.
Группа примеров 7-17. Формование биополимерных волокон и нетканого волокнисто-пористого полотна из растворов хитозана со вспомогательным полимером в уксусной кислоте СК=70%; влияние молекулярной массы хитозана и полиэтиленоксида на физико-химические характеристики формовочного раствора, параметры процесса электроформования и характеристики биополимерных волокон из ацетата хитозана.
Пример 7 выполнен аналогично примеру 2. Отличие состояло в том, что используют образец хитозана с
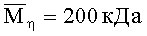
хитозан - 4.28,
полиэтиленоксид - 0.043,
уксусная кислота - 70,
вода - остальное.
Физико-химическая характеристика формовочного раствора: η=1.13 Па·с, æ=1.5 мСм/см. Параметры электроформования: цилиндр с диаметром D=8 см и скоростью вращения 1200-1500 об/мин, U=30-35 кВ, L=15-40 см, Q=3-6 мл/ч. Характеристика электропряденых волокон: d=200-500 нм, дефекты на волокне отсутствуют (фиг.1). Состав биополимерного волокна, мас.%:
ацетат хитозана - 99.0,
полиэтиленоксид - остальное.
В течение времени на электроде-коллекторе образуется нетканое волокнисто-пористое полотно с хаотичным или упорядоченным расположением волокон из ацетата хитозана и поверхностной плотностью 5-25 г/м2 (фиг.2), легко моделирующее поверхность со сложным рельефом.
Пример 8 выполнен аналогично примеру 2. Отличие: используют хитозан с

хитозан - 3.0,
полиэтиленоксид - 0.03,
уксусная кислота - 70,
вода - остальное.
Характеристика формовочного раствора: η=1.2Па·с, æ=1.2 мСм/см. Параметры электроформования: плоский электрод, U=20-30 кВ, L=15-20 см, Q=3-6 мл/ч. Характеристика электропряденых волокон: d=300-500 нм, дефекты на волокне отсутствуют. Состав биополимерного волокна, мас.%:
ацетат хитозана - 99.0,
полиэтиленоксид - остальное.
Поверхностная плотность нетканого волокнисто-пористого полотна из биополимерных волокон ацетата хитозана δ=5-25 г/м2.
Пример 9 выполнен аналогично примеру 8. Отличие: используют полиэтиленоксид с

хитозан - 3.0,
полиэтиленоксид - 0.03,
уксусная кислота - 70,
вода - остальное.
Характеристика формовочного раствора: η=1.02-1.08 Па·с, æ=1.4 мСм/см. Параметры электроформования: плоский электрод, U=10 кВ, L=8-12 см, Q=2.5-5 мл/ч. Характеристика электропряденых волокон: d=50-250 нм, имеются незначительные дефекты на волокне. Состав биополимерного волокна, мас.%:
ацетат хитозана - 99.0,
полиэтиленоксид - остальное.
Поверхностная плотность нетканого волокнисто-пористого полотна δ=5-25 г/м2.
Пример 10 выполнен аналогично примеру 2. Отличие: используют хитозан с

хитозан - 2.0,
полиэтиленоксид - 0.02,
уксусная кислота - 70,
вода-остальное.
Характеристика формовочного раствора: η=1.17-1.34 Па·с, æ=1.0 мСм/см. Параметры электроформования: плоский электрод, U=30 кВ, L=20 см, Q=2-6 мл/ч. Характеристика электропряденых волокон: d=150-200 нм, имеются незначительные дефекты на волокне. Состав биополимерного волокна, мас.%:
ацетат хитозана - 99.0,
полиэтиленоксид - остальное.
Поверхностная плотность нетканого волокнисто-пористого полотна δ=5-25 г/м2.
Пример 11 выполнен аналогично примеру 7. Отличие в том, что общая концентрация полимера в формовочном растворе СП=4.201 мас.%, при смешении воздушно-сухих навесок полимеров используют 4.18 г хитозана и 0.021 г полиэтиленоксида. Состав формовочного раствора, мас.%:
хитозан - 4.18,
полиэтиленоксид - 0.021,
уксусная кислота - 70,
вода - остальное.
Характеристика формовочного раствора: η=0.48-0.54 Па·с, æ=2.3 мСм/см. Параметры электроформования: плоский электрод, U=25-40 кВ, L=15-40 см, Q=3-6 мл/ч. Характеристика электропряденых волокон: d=70-200 нм, дефекты на волокне отсутствуют. Состав биополимерного волокна, мас.%:
ацетат хитозана - 99.5,
полиэтиленоксид - остальное.
Поверхностная плотность нетканого волокнисто-пористого полотна δ=5-25 г/м2.
Пример 12 выполнен аналогично примеру 7. Отличие в том, что общая концентрация полимера в формовочном растворе СП=4.633 мас.%, при смешении воздушно-сухих навесок полимеров используют 4.61 г хитозана и 0.023 г полиэтиленоксида. Состав формовочного раствора, мас.%:
хитозан - 4.61,
полиэтиленоксид - 0.023,
уксусная кислота - 70,
вода - остальное.
Характеристика формовочного раствора: η=3.1 Па·с, æ=2.2 мСм/см. Параметры электроформования: плоский электрод, U=25-40 кВ, L=15-40 см, Q=3-6 мл/ч. Характеристика электропряденых волокон: d=70-200 нм, дефекты на волокне отсутствуют. Состав биополимерного волокна, мас.%:
ацетат хитозана - 99.5,
полиэтиленоксид - остальное.
Поверхностная плотность нетканого волокнисто-пористого полотна δ=5-25 г/м2.
Пример 13 выполнен аналогично примеру 8. Отличие: общая концентрация полимера в формовочном растворе СП=3.015 мас.%, при смешении воздушно-сухих навесок полимеров используют 3.0 г хитозана и 0.015 г полиэтиленоксида. Состав формовочного раствора, мас.%:
хитозан - 3.0,
полиэтиленоксид - 0.015,
уксусная кислота - 70,
вода - остальное.
Характеристика формовочного раствора: η=1.32-1.34 Па·с, æ=1.2 мСм/см. Параметры электроформования: плоский электрод, U=12.5 кВ, L=20 см, Q=2.5 мл/ч. Характеристика электропряденых волокон: d=300-500 нм, дефекты на волокне отсутствуют. Состав биополимерного волокна, мас.%:
ацетат хитозана - 99.5,
полиэтиленоксид - остальное.
Поверхностная плотность нетканого волокнисто-пористого полотна δ=5-25 г/м2.
Пример 14 выполнен аналогично примеру 13. Отличие состояло в том, что используют полиэтиленоксид с
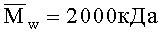
хитозан - 3.0,
полиэтиленоксид - 0.015,
уксусная кислота - 70,
вода - остальное.
Характеристика формовочного раствора: η=1.7-1.8 Па·с, æ=1.2 мСм/см. Параметры электроформования: плоский электрод, U=10-25кВ, L=10-20 см, Q=2.5-5 мл/ч. Характеристика электропряденых волокон: d=100-500 нм, имеются незначительные дефекты на волокне. Состав биополимерного волокна, мас.%:
ацетат хитозана - 99.5,
полиэтиленоксид - остальное.
Поверхностная плотность нетканого волокнисто-пористого полотна δ=5-25 г/м2.
Пример 15 выполнен аналогично примеру 7. Отличие: общая концентрация полимера в формовочном растворе СП=4.19 мас.%, при смешении воздушно-сухих навесок полимеров используют 4.18 г хитозана и 0.01 г полиэтиленоксида. Состав формовочного раствора, мас.%:
хитозан - 4.18,
полиэтиленоксид - 0.01,
уксусная кислота - 70,
вода - остальное.
Характеристика формовочного раствора: η=0.24-0.40 Па·с, æ=2.4 мСм/см. Параметры электроформования: плоский электрод, U=25-40 кВ, L=15-40 см, Q=3-6 мл/ч; неустойчивое формование волокна. Характеристика электропряденых волокон: d=170-600 нм, имеются дефекты на волокне. Состав биополимерного волокна, мас.%:
ацетат хитозана - 99.75,
полиэтиленоксид - остальное.
Пример 16 выполнен аналогично примеру 7. Отличие: общая концентрация полимера в формовочном растворе СП=4.812 мас.%, при смешении воздушно-сухих навесок полимеров используют 4.80 г хитозана и 0.012 г полиэтиленоксида. Состав формовочного раствора, мас.%:
хитозан - 4.80,
полиэтиленоксид - 0.012,
уксусная кислота - 70,
вода - остальное.
Характеристика формовочного раствора: η=2.97 Па·с, æ=2.3 мСм/см. Параметры электроформования: плоский электрод, U=25-40 кВ, L=15-40 см, Q=3-6 мл/ч. Характеристика электропряденых волокон: d=170-600 нм, дефекты на волокне отсутствуют. Состав биополимерного волокна, мас.%:
ацетат хитозана - 99.75,
полиэтиленоксид - остальное.
Поверхностная плотность нетканого волокнисто-пористого полотна δ=5-25 г/м2.
Пример 17 выполнен аналогично примеру 8. Отличие в том, что используют полиэтиленоксид с
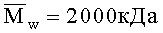
хитозан - 3.0,
полиэтиленоксид - 0.03,
уксусная кислота - 70,
вода - остальное.
Характеристика формовочного раствора: η=1.17-1.32 Па·с, æ=1.2 мСм/см. Параметры электроформования: плоский электрод, U=10-25 кВ, L=10-20 см, 0=1-5 мл/ч; неустойчивое формование волокна. Характеристика электропряденых волокон: d=50-95 нм, множественные дефекты на волокне. Состав биополимерного волокна, мас.%:
ацетат хитозана - 99.9,
полиэтиленоксид - остальное.
Группа примеров 18-20. Влияние концентрации хитозана в формовочном растворе на физико-химические характеристики формовочного раствора, параметры процесса электроформования, характеристики биополимерных волокон из ацетата хитозана и нетканого волокнисто-пористого полотна на их основе.
Пример 18 выполнен аналогично примеру 7. Отличие в том, что общая концентрация полимера в формовочном растворе СП=3.03 мас.%, при смешении воздушно-сухих навесок полимеров используют 3.0 г хитозана и 0.03 г полиэтиленоксида. Состав формовочного раствора, мас.%:
хитозан - 3.0,
полиэтиленоксид - 0.03,
уксусная кислота - 70,
вода - остальное.
Характеристика формовочного раствора: η=0.24 Па·с, æ=1.2 мСм/см. Параметры электроформования: плоский электрод, U=30 кВ, L=20 см, Q=6 мл/ч, линейная скорость волокнообразования V=1130 м/с. Характеристика электропряденых волокон: d=190±10 нм, дефекты на волокне и волокнистой структуре нетканого волокнисто-пористого полотна отсутствуют. Состав биополимерного волокна, мас.%:
ацетат хитозана - 99.0,
полиэтиленоксид - остальное.
Пример 19 выполнен аналогично примеру 18. Отличия: общая концентрация полимера в формовочном растворе СП=6.06 мас.%, при смешении воздушно-сухих навесок полимеров используют 6.0 г хитозана и 0.06 г полиэтиленоксида. Состав формовочного раствора, мас.%:
хитозан - 6.0,
полиэтиленоксид - 0.06,
уксусная кислота - 70,
вода - остальное.
Характеристика формовочного раствора: η=0.8 Па·с, æ=1.5 мСм/см. Параметры электроформования: плоский электрод, U=30 кВ, L=20 см, Q=6 мл/ч, V=1080 м/с. Характеристика электропряденых волокон: d=160±10 нм, дефекты на волокне и волокнистой структуре нетканого волокнисто-пористого полотна отсутствуют. Состав биополимерного волокна, мас.%:
ацетат хитозана - 99.0,
полиэтиленоксид - остальное.
Пример 20 выполнен аналогично примеру 18. Отличия: общая концентрация полимера в формовочном растворе СП=7.07 мас.%, при смешении воздушно-сухих навесок полимеров используют 7.0 г хитозана и 0.07 г полиэтиленоксида. Состав формовочного раствора, мас.%:
хитозан - 7.0,
полиэтиленоксид - 0.07,
уксусная кислота - 70,
вода - остальное.
Характеристика формовочного раствора: η=1.8 Па·с, æ=2.5 мСм/см. Параметры электроформования: плоский электрод, U=30 кВ, L=20 см, Q=6 мл/ч, V=845 м/с. Характеристика электропряденых волокон: d=360±20 нм, дефекты на волокне и волокнистой структуре нетканого волокнисто-пористого полотна отсутствуют. Состав биополимерного волокна, мас.%:
ацетат хитозана - 99.0,
полиэтиленоксид - остальное.
Группа примеров 21-27. Влияние времени хранения формовочного раствора на реологические параметры системы и характеристики электропряденых биополимерных волокон из ацетата хитозана.
Пример 21 выполнен аналогично примеру 7, но с использованием плоского электрода и формовочного раствора, хранившегося в статических условиях в течении 1 сут. Характеристика формовочного раствора: η=0.86 Па·с, æ=1.5 мСм/см. Характеристика электропряденых волокон: d=300-320 нм, дефекты на волокне и волокнистой структуре нетканого волокнисто-пористого полотна отсутствуют.
Пример 22 выполнен аналогично примеру 21, но с использованием формовочного раствора, хранившегося в статических условиях в течении 2 сут. Характеристика формовочного раствора: η=0.75 Па·с, æ=1.5 мСм/см. Характеристика электропряденых волокон: d=150-170 нм, дефекты на волокне и волокнистой структуре отсутствуют.
Пример 23 выполнен аналогично примеру 21, но с использованием формовочного раствора, хранившегося в статических условиях в течении 3 сут. Характеристика формовочного раствора: η=0.70 Па·с, æ=1.5 мСм/см. Характеристика электропряденых волокон: d=120-140 нм, дефекты на волокне и волокнистой структуре отсутствуют.
Пример 24 выполнен аналогично примеру 21, но с использованием формовочного раствора, хранившегося в статических условиях в течении 4 сут. Характеристика формовочного раствора: η=0.65 Па·с, æ=1.5 мСм/см. Характеристика электропряденых волокон: d~90 нм, появляются незначительные дефекты на волокне и волокнистой структуре.
Пример 25 выполнен аналогично примеру 21, но с использованием формовочного раствора, хранившегося в статических условиях в течении 5 сут. Характеристика формовочного раствора: η=0.61 Па·с, æ=1.5 мСм/см. Характеристика электропряденых волокон: d~80 нм, дефекты на волокне и волокнистой структуре в виде утолщений.
Пример 26 выполнен аналогично примеру 21, но с использованием формовочного раствора, хранившегося в статических условиях в течении 6 сут. Характеристика формовочного раствора: η=0.56 Па·с, æ=1.5 мСм/см. Характеристика электропряденых волокон: d~ 80 нм, дефекты на волокне в виде утолщений и капель.
Пример 27 выполнен аналогично примеру 21, но с использованием формовочного раствора, хранившегося в статических условиях в течении 8 сут. Характеристика формовочного раствора: η=0.52 Па·с, æ=1.5 мСм/см. Неустойчивое электроформование, переходящее в распыление раствора в виде капель. Характеристика электропряденых волокон: d~80 нм, значительное количество дефектов на волокне в виде утолщений и капель.
Примеры 28, 29. Формование биополимерных волокон и нетканого волокнисто-пористого полотна из формовочных растворов хитозана с бикомпонентным модификатором (на примере биополимерных волокон из ацетата хитозана).
Пример 28 выполнен аналогично примеру 7. Отличие заключалось в том, что в формовочный раствор дополнительно вводят диацетат целлюлозы, общая концентрация полимера в формовочном растворе СП=4.51 мас.%, при смешении воздушно-сухих навесок полимеров используют 4.09 г хитозана, 0.33 г полиэтиленоксида и 0.09 г диацетата целлюлозы. Состав формовочного раствора, мас.%:
хитозан - 4.28,
полиэтиленоксид - 0.33,
диацетат целлюлозы - 0.09,
уксусная кислота - 70,
вода - остальное.
Параметры электроформования: вращающийся электрод-цилиндр с D=8 см и скоростью вращения 300-600 об/мин, U=30 кВ, L=30 см, Q=5 мл/ч. Характеристика электропряденых волокон: d=300-500 нм, дефекты на волокне отсутствуют. Состав биополимерного волокна, мас.%:
ацетат хитозана - 90.7,
диацетат целлюлозы - 7.3,
полиэтиленоксид - остальное.
Поверхностная плотность нетканого волокнисто-пористого полотна δ=5-25 г/м2.
Пример 29 выполнен аналогично примеру 28. Отличие в том, что общая концентрация полимера в формовочном растворе СП=5.126 мас.%, при смешении воздушно-сухих навесок полимеров используют 4.87 г хитозана, 0.205 г полиэтиленоксида и 0.051 г диацетата целлюлозы. Состав формовочного раствора, мас.%:
хитозан - 4.87,
полиэтиленоксид - 0.205,
диацетат целлюлозы - 0.051,
уксусная кислота - 70,
вода - остальное.
Параметры электроформования: вращающийся электрод-цилиндр с D=8 см и скоростью вращения 300-600 об/мин, U=30 кВ, L=30 см, Q=5 мл/ч. Характеристика электропряденых волокон: d=300-500 нм, дефекты на волокне отсутствуют. Состав биополимерного волокна, мас.%:
ацетат хитозана - 95.5,
диацетат целлюлозы - 4.0,
полиэтиленоксид - остальное.
Поверхностная плотность нетканого волокнисто-пористого полотна δ=5-25 г/м2.
Группа примеров 30-33. Формование биополимерных волокон из растворов хитозана со вспомогательным полимером в других органических кислотах (на примере образца хитозана с

Пример 30 выполнен аналогично примеру 7. Отличие в том, что используют лимонную кислоту концентрации СК=10-50%, общая концентрация полимера в формовочном растворе СП=4.44 мас.%, при смешении воздушно-сухих навесок полимеров используют 4.13 г хитозана и 0.31 г полиэтиленоксида. Состав формовочного раствора, мас.%:
хитозан - 4.44,
полиэтиленоксид - 0.31,
лимонная кислота - 10-50,
вода - остальное.
Параметры электроформования: плоский электрод, U=30 кВ, L=20 см, Q=5 мл/ч. Диаметр электропряденых биополимерных волокон d=140-900 нм. Хитозан в сформованном волокне находится в солевой форме цитрата хитозана - соли хитозана и лимонной кислоты. Состав биополимерного волокна, мас.%:
цитрат хитозана - 93.0,
полиэтиленоксид - остальное.
Пример 31 выполнен аналогично примеру 7. Отличие: используют полиэтиленоксид с

хитозан - 3.67,
полиэтиленоксид - 0.19,
молочная кислота - 5-30,
вода - остальное.
Параметры электроформования: плоский электрод, U=25 кВ, L=35 см, Q=4 мл/ч. Диаметр электропряденых биополимерных волокон d=200-840 нм. Хитозан в сформованном волокне находится в солевой форме лактата хитозана - соли хитозана и молочной кислоты. Состав биополимерного волокна, мас.%:
лактат хитозана - 95.0,
полиэтиленоксид - остальное.
Пример 32 выполнен аналогично примеру 31. Отличие: используют аскорбиновую кислоту концентрации СК=10-30%, общая концентрация полимера в формовочном растворе СП=3.406 мас.%. Состав формовочного раствора, мас.%:
хитозан - 3.27,
полиэтиленоксид - 0.136,
аскорбиновая кислота - 10-30,
вода - остальное.
Параметры электроформования: плоский электрод, U=25 кВ, L=25 см, Q=4 мл/ч. Диаметр электропряденых биополимерных волокон d=1000-1750 нм. При формовании волокна укладываются в упорядоченные спиральные структуры. Хитозан в сформованном волокне находится в солевой форме аскорбата хитозана - соли хитозана и аскорбиновой кислоты. Состав биополимерного волокна, мас.%:
аскорбат хитозана - 96.0,
полиэтиленоксид - остальное.
Пример 33 выполнен аналогично примеру 31. Отличие: используют янтарную кислоту концентрации СК=5-10%, общая концентрация полимера в формовочном растворе СП=3.86 мас.%. Состав формовочного раствора, мас.%:
хитозан - 3.67,
полиэтиленоксид - 0.19,
янтарная кислота - 5-10,
вода - остальное.
Параметры электроформования: плоский электрод, U=20 кВ, L=25 см, Q=5 мл/ч. Диаметр электропряденых биополимерных волокон d=350-600 нм. Хитозан в сформованном волокне находится в солевой форме сукцината хитозана - соли хитозана и янтарной кислоты. Состав биополимерного волокна, мас.%:
сукцинат хитозана - 95.0,
полиэтиленоксид - остальное.
Группа примеров 34-41. Формование биополимерных волокон и нетканого волокнисто-пористого полотна из водных растворов водорастворимого хитозана.
Пример 34. Готовят формовочный раствор с общей концентрацией полимера СП=4.88 мас.%. Воздушно-сухую навеску 4.44 г хитозана


хитозан - 4.44,
полиэтиленоксид - 0.44,
вода - остальное.
Физико-химическая характеристика формовочного раствора: η=2.25 Па·с, æ=11.2 мСм/см, соотношение компонентов хитозан:полиэтиленоксид=90:10. Дальнейшие процедуры выполняют аналогично примеру 1. Параметры электроформования: плоский электрод, U=25-35 кВ, L=20-30 см, Q=2.5-6 мл/ч. Волокно не формуется.
Пример 35 выполнен аналогично примеру 34. Отличие заключалось в том, что общая концентрация полимера в формовочном растворе СП=6.4 мас.%, при смешении воздушно-сухих навесок полимеров используют 5.8 г хитозана и 0.6 г полиэтиленоксида. Состав формовочного раствора, мас.%:
хитозан - 5.8,
полиэтиленоксид - 0.6,
вода - остальное.
Параметры электроформования: цилиндр с диаметром D=8 см и скоростью вращения 1200-1500 об/мин, U=30-40 кВ, L=30 см, Q=6 мл/ч. Характеристика электропряденых волокон: d=180-320 нм, дефекты на волокне и волокнистой структуре нетканого волокнисто-пористого полотна отсутствуют. Состав биополимерного волокна, мас.%:
хитозан - 90.0,
полиэтиленоксид - остальное.
Поверхностная плотность нетканого волокнисто-пористого полотна δ=5-25 г/м2.
Пример 36 выполнен аналогично примеру 34. Отличие в том, что общая концентрация полимера в формовочном растворе СП=5.99 мас.%, при смешении воздушно-сухих навесок полимеров используют 5.71 г хитозана и 0.28 г полиэтиленоксида. Состав формовочного раствора, мас.%:
хитозан - 5.71,
полиэтиленоксид - 0.28,
вода - остальное.
Характеристика формовочного раствора: η=1.65 Па·с, æ=10.5 мСм/см. Параметры электроформования: плоский электрод, U=30-35 кВ, L=25-30 см, Q=2.5-4 мл/ч, нестабильное формование. Характеристика электропряденых волокон: d=200-600 нм, дефекты на волокне. Состав биополимерного волокна, мас.%:
хитозан - 95.0,
полиэтиленоксид - остальное.
Поверхностная плотность нетканого волокнисто-пористого полотна δ=5-25 г/м2.
Пример 37 выполнен аналогично примеру 34. Отличие: общая концентрация полимера в формовочном растворе СП=6.9 мас.%, при смешении воздушно-сухих навесок полимеров используют 6.55 г хитозана и 0.35 г полиэтиленоксида. Состав формовочного раствора, мас.%:
хитозан - 6.55,
полиэтиленоксид - 0.35,
вода - остальное.
Параметры электроформования: цилиндр с диаметром D=8 см и скоростью вращения 1200-1500 об/мин, U=30-40 кВ, L=30 см, Q=6 мл/ч. Характеристика электропряденых волокон: d=220-320 нм, дефекты на волокне и волокнистой структуре нетканого волокнисто-пористого полотна отсутствуют (фиг.3). Состав биополимерного волокна, мас.%:
хитозан - 95.0,
полиэтиленоксид - остальное.
Поверхностная плотность нетканого волокнисто-пористого полотна δ=5-25 г/м2.
Пример 38 выполнен аналогично примеру 34. Отличие: общая концентрация полимера в формовочном растворе СП=6.96 мас.%, при смешении воздушно-сухих навесок полимеров используют 6.89 г хитозана и 0.069 г полиэтиленоксида с

хитозан - 6.89,
полиэтиленоксид - 0.069,
вода - остальное.
Характеристика формовочного раствора: η=1.95 Па·с, æ=15.4 мСм/см. Параметры электроформования: плоский электрод, U=30-35 кВ, L=25-30 см, Q=2.5-4 мл/ч, нестабильное формование. Характеристика электропряденых волокон: d=200-600 нм, дефекты на волокне отсутствуют. Состав биополимерного волокна, мас.%:
хитозан - 99.0,
полиэтиленоксид - остальное.
Пример 39 выполнен аналогично примеру 34. Отличие в том, что в качестве вспомогательного полимера используют поливиниловый спирт, общая концентрация полимера в формовочном растворе СП=8.12 мас.%, при смешении воздушно-сухих навесок полимеров используют 6.25 г хитозана и 1.87 г поливинилового спирта. Состав формовочного раствора, мас.%:
хитозан - 6.25,
поливиниловый спирт - 1.87,
вода - остальное.
Характеристика формовочного раствора: η=2.26 Па·с, æ=11.5 мСм/см. Параметры электроформования: плоский электрод, U=10-40кВ, L=20-35 см, Q=3-10 мл/ч. Диаметр электропряденых волокон d=170-250 нм. Состав биополимерного волокна, мас.%:
хитозан - 77.0,
поливиниловый спирт - остальное.
Пример 40 выполнен аналогично примеру 39. Отличие в том, что общая концентрация полимера в формовочном растворе СП=8.57 мас.%, при смешении воздушно-сухих навесок полимеров используют 7.14 г хитозана и 1.43 г поливинилового спирта. Состав формовочного раствора, мас.%:
хитозан - 7.14,
поливиниловый спирт - 1.43,
вода - остальное.
Характеристика формовочного раствора: η=2.3 Па·с, æ=13.6 мСм/см. Параметры электроформования: плоский электрод, U=10-40 кВ, L=20-35 см, Q=3-10 мл/ч. Диаметр электропряденых волокон d=150-300 нм. Состав биополимерного волокна, мас.%:
хитозан - 83.0,
поливиниловый спирт - остальное.
Пример 41 выполнен аналогично примеру 34. Отличие: в качестве вспомогательного полимера используют поливинилпирролидон, общая концентрация полимера в формовочном растворе СП=7.92 мас.%, при смешении воздушно-сухих навесок полимеров используют 6.0 г хитозана и 1.92 г поливинилпирролидона. Состав формовочного раствора, мас.%:
хитозан - 6.0,
поливинилпирролидон - 1.92,
вода - остальное.
Характеристика формовочного раствора: η=3.15 Па·с, æ=10.0 мСм/см. Параметры электроформования: плоский электрод, U=10-40 кВ, L=20-35 см, Q=5-10 мл/ч. Диаметр электропряденых волокон d=90-150 нм. Состав биополимерного волокна, мас.%:
хитозан - 75.8,
поливинилпирролидон - остальное.
Примеры 42, 43. Формование биополимерных волокон и нетканого волокнисто-пористого полотна из растворов хитозана со вспомогательным полимером в органических кислотах медицинского назначения (на примере образца хитозана с

Пример 42 выполнен аналогично примеру 35. Отличие в том, что используют аминокапроновую кислоту концентрации CK=3-6%, общая концентрация полимера в формовочном растворе СП=5.3 мас.%, при смешении воздушно-сухих навесок полимеров используют 5.0 г хитозана и 0.3 г полиэтиленоксида с

хитозан - 5.0,
полиэтиленоксид - 0.3,
аминокапроновая кислота - 3-6,
вода - остальное.
Параметры электроформования: цилиндр с диаметром D=8 см и скоростью вращения 1500 об/мин, U=20 кВ, L=30 см, Q=4 мл/ч. Характеристика электропряденых волокон: d=250-400 нм, дефекты на волокне отсутствуют. Хитозан в сформованном волокне находится в солевой форме аминокаприата хитозана - соли хитозана и аминокапроновой кислоты. Состав биополимерного волокна, мас.%:
аминокаприат хитозана - 94.0,
полиэтиленоксид - остальное.
Поверхностная плотность нетканого волокнисто-пористого полотна δ=5-25 г/м2.
Пример 43 выполнен аналогично примеру 35, общая концентрация полимера в формовочном растворе СП=6.4 мас.%. Отличие: используют транексамовую кислоту концентрации СК=2.5-5%, при смешении воздушно-сухих навесок полимеров используют 6.0 г хитозана и 0.4 г полиэтиленоксида с

хитозан - 6.0,
полиэтиленоксид - 0.4,
транексамовая кислота - 2.5-5,
вода - остальное.
Параметры электроформования: цилиндр с диаметром D=8 см и скоростью вращения 1500 об/мин, U=35-40 кВ, L=30 см, Q=5 мл/ч. Характеристика электропряденых волокон: d=350-500 нм, дефекты на волокне отсутствуют. Хитозан в сформованном волокне находится в солевой форме транексамиата хитозана - соли хитозана и транексамовой кислоты. Состав биополимерного волокна, мас.%:
транексамиат хитозана - 93.7,
полиэтиленоксид - остальное.
Поверхностная плотность нетканого волокнисто-пористого полотна δ=5-25 г/м2.
Группа примеров 44-49. Формование биополимерных волокон и нетканого волокнисто-пористого полотна из хитозана с добавками биологически активных веществ (на примере образцов хитозана с

Пример 44 выполнен аналогично примеру 35. Было приготовлено три состава, отличающихся количеством биологически активного вещества антисептического, дезинфицирующего и противовоспалительного действия, а именно проторгола. Отличие от примера 35 в том, что общая концентрация формовочного раствора СП=7.64-8.39 мас.%, при смешении воздушно-сухих навесок полимеров используют 6.7 г хитозана, 0.44 г полиэтиленоксида и дополнительно вводят протаргол в количестве для одного состава 0.5 г, для другого состава 0.7 г и для третьего 1.25 г. Состав формовочного раствора, мас.%:
хитозан - 6.7,
полиэтиленоксид - 0.44,
протаргол - 0.5, или 0.7, или 1.25,
вода - остальное.
Волокно получали из описанных выше трех составов. Параметры электроформования: цилиндр с диаметром D=8 см и скоростью вращения 1500 об/мин, U=20 кВ, L=25 см, Q=4 мл/ч. Характеристика электропряденых волокон: d=150-300 нм, дефекты на волокне отсутствуют. При этом состав биополимерного волокна, мас.%, следующий:
хитозан - 79.9-87.7,
протаргол - 6.6-14.9,
полиэтиленоксид - остальное.
Поверхностная плотность нетканого волокнисто-пористого полотна δ=5-25 г/м2.
Пример 45 выполнен аналогично примеру 44. Было приготовлено четыре состава, отличающихся количеством биологически активного вещества протеолотического действия, а именно химотрипсина. Отличие от примера 44: дополнительно вводят химотрипсин в количестве для одного состава 0.1 г, для другого состава 0.3 г, для третьего 0.7 г и для четвертого 1.25 г. Состав формовочного раствора, мас.%:
хитозан - 6.7,
полиэтиленоксид - 0.44,
химотрипсин - 0,1, или 0.3, или 0.7, или 1.25,
вода - остальное.
Волокно получали из описанных выше четырех составов. Характеристика электропряденых волокон: d=130-280 нм, дефекты на волокне отсутствуют. При этом состав биополимерного волокна, мас.%, следующий:
хитозан - 79.9-92.5,
химотрипсин - 1.4-14.9,
полиэтиленоксид - остальное.
Поверхностная плотность нетканого волокнисто-пористого полотна δ=5-25 г/м2.
Пример 46 выполнен аналогично примеру 45. Отличие: было приготовлено четыре состава, отличающихся количеством биологически активного вещества гемостатического действия, а именно тромбина. Состав формовочного раствора, мас.%:
хитозан - 6.7,
полиэтиленоксид - 0.44,
тромбин - 0.1, или 0.3, или 0.7, или 1.25,
вода - остальное.
Волокно получали из описанных выше четырех составов. Характеристика электропряденых волокон: d=130-280 нм, дефекты на волокне отсутствуют. При этом состав биополимерного волокна, мас.%, следующий:
хитозан - 79.9-92.5,
тромбин - 1.4-14.9,
полиэтиленоксид - остальное.
Поверхностная плотность нетканого волокнисто-пористого полотна δ=5-25 г/м2.
Пример 47 выполнен аналогично примеру 35. Было приготовлено три состава, отличающихся количеством биологически активного вещества местноанестезирующего действия, а именно новокаина. Отличие от примера 35: общая концентрация формовочного раствора СП=7.84-8.66 мас.%, навеску 6.6 г хитозана смешивают с навеской 0.34 г полиэтиленоксида и дополнительно вводят новокаин в количестве для одного состава 0.4 г, для другого состава 0.78 г и для третьего 1.2 г. Состав формовочного раствора, мас.%:
хитозан - 6.6,
полиэтиленоксид - 0.34,
новокаин - 0.4, или 0.78, или 1.2,
вода - остальное.
Волокно получали из описанных выше трех составов. Параметры электроформования: цилиндр с диаметром D=8 см и скоростью вращения 1500 об/мин, U=35-40 кВ, L=30 см, Q=6 мл/ч. Характеристика электропряденых волокон: d=150-250 нм, дефекты на волокне отсутствуют. При этом состав биополимерного волокна, мас.%, следующий:
хитозан - 81.0-89.9,
новокаин - 5.5-14.7,
полиэтиленоксид - остальное.
Поверхностная плотность нетканого волокнисто-пористого полотна δ=5-25 г/м2.
Пример 48 выполнен аналогично примеру 47. Отличие: было приготовлено три состава, отличающихся количеством биологически активного вещества антибактериального и бактериостатического действия, а именно фузидина-Na. Состав формовочного раствора, мас.%:
хитозан - 6.6,
полиэтиленоксид - 0.34,
фузидин-Na - 0.4, или 0.78, или 1.2,
вода - остальное.
Волокно получали из описанных выше трех составов. Характеристика электропряденых волокон: d=140-260 нм, дефекты на волокне отсутствуют. При этом состав биополимерного волокна, мас.%, следующий:
хитозан-81.0-89.9,
фузидин-Na - 5.5-14.7,
полиэтиленоксид - остальное.
Поверхностная плотность нетканого волокнисто-пористого полотна δ=5-25 г/м2.
Пример 49 выполнен аналогично примеру 19, при этом используют хитозан с
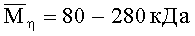
хитозан - 6.0,
полиэтиленоксид - 0.06,
лидокаин - 0.4, или 0.48, или 0.55,
уксусная кислота - 50, или 70, или 80,
вода - остальное.
Волокно получали из описанных выше трех составов. Характеристика электропряденых волокон: d=150-250 нм, дефекты на волокне отсутствуют. При этом состав биополимерного волокна, мас.%, следующий:
ацетат хитозана - 90.8-92.9,
лидокаин - 6.2-8.3,
полиэтиленоксид - остальное.
Поверхностная плотность нетканого волокнисто-пористого полотна δ=5-25 г/м2.
Пример 50 выполнен аналогично примеру 49. Отличие: было приготовлено три состава, отличающихся количеством биологически активного вещества антибактериального и бактериостатического действия, а именно эритромицина. Состав формовочного раствора, мас.%:
хитозан - 6.0,
полиэтиленоксид - 0.06,
эритромицин - 0.4, или 0.48, или 0.55,
уксусная кислота - 50, или 70, или 80,
вода - остальное.
Волокно получали из описанных выше трех составов. Характеристика электропряденых волокон: d=120-250 нм, дефекты на волокне отсутствуют. При этом состав биополимерного волокна, мас.%, следующий:
ацетат хитозана - 90.8-92.9,
азитромицин - 6.2-8.3,
полиэтиленоксид - остальное.
Поверхностная плотность нетканого волокнисто-пористого полотна δ=5-25 г/м2.
Группа примеров 51-58. Упруго-пластические и сорбционные характеристики нетканого волокнисто-пористого материала, сформованного из биополимерных волокон хитозана или соли хитозана и органической кислоты.
Пример 51. Нетканый волокнисто-пористый материал (полотно биомедицинского назначения) из биополимерных волокон ацетата хитозана


Пример 52 выполнен аналогично примеру 51. Отличие: образец имеет поверхностную плотность δ=10 г/м2. Характеристика образца: F1=13.3 H, F2=1.8 H, ε1=7.1%, ε2=8.6%, α1=90 мас.%, α2=1500 мас.%.
Пример 53 выполнен аналогично примеру 51. Отличие: образец имеет поверхностную плотность δ=14.5 г/м2 и сформован на цилиндр диаметром D=60 мм со скоростью вращения 600 об/мин. Характеристика образца: F1=23.3 H, F2=3.9 H, ε1=10.2%, ε2=16.4%, α1=110 мас.%, α2=450 мас.%.
Пример 54 выполнен аналогично примеру 53, но образец сформован на цилиндр D=25 мм. Характеристика образца: F1=28.9 Н, F2=5.7 H, ε1=4.5%, ε2=13.5%.
Пример 55 выполнен аналогично примеру 53, но образец сформован на плоский неподвижный электрод. Характеристика образца: разрывная нагрузка при одноосном растяжении 2.6 Н, относительное удлинение при разрыве 13.1%.
Пример 56 выполнен аналогично примеру 51. Отличие: образец имеет поверхностную плотность δ=25.3 г/м2. Характеристика образца: F1=33.6 H, F2=4.1 Н, ε1=7.1%, ε2=11.6%, α1=55 мас.%, α2=1400 мас.%; α3=~600 мас.%; α4=~450 мас.%.
Пример 57 выполнен аналогично примеру 55. Отличие состояло в том, что используют нетканый волокнисто-пористый материал из биополимерных волокон ацетата хитозана


Пример 58 выполнен аналогично примеру 55. Отличие в том, что используют нетканый волокнисто-пористый материал из биополимерных волокон хитозана

Группа примеров 59-64. Влияние физико-химической модификации нетканого волокнисто-пористого полотна из биополимерных волокон хитозана или соли хитозана и органической кислоты на упруго-пластические свойства материала (на примере нетканого волокнисто-пористого полотна из биополимерных волокон ацетата хитозана).
Пример 59. Нетканый волокнисто-пористый материал (полотно биомедицинского назначения) из биополимерных волокон ацетата хитозана, полученный по примеру 51, выдерживают в физиологическом растворе в течение 2-3 мин до достижения степени сорбции α3=~800 мас.%. Модифицированное полотно подвергают одноосному растяжению на разрывной машине. Величина разрывной нагрузки в направлении преимущественной ориентации волокон в материале F1=1.8 Н, величина относительного удлинения в направлении преимущественной ориентации волокон в материале ε1=35.6%.
Пример 60 выполнен аналогично примеру 59. Отличие состояло в том, что полотно выдерживают в дистиллированной воде в течение 2-3 мин до достижения степени сорбции α4=~650 мас.%. Упруго-пластические характеристики модифицированного полотна: F1=1.8 Н, ε1=40.4%.
Пример 61 выполнен аналогично примеру 59. Отличие состояло в использовании полотна биомедицинского назначения из биополимерных волокон ацетата хитозана, полученного по примеру 56. Степень сорбции 0.9%-ного NaCl - α3=~600 мас.%. Упруго-пластические характеристики модифицированного полотна: F1=16.3 Н, ε1=40%.
Пример 62 выполнен аналогично примеру 61. Отличие состояло в использовании в качестве сорбционной среды дистиллированной воды. Характеристика модифицированного полотна: α4=~450 мас.%, F1=13.2 H, ε1=35%.
Пример 63. Полотно биомедицинского назначения из биополимерных волокон ацетата хитозана, полученное по примеру 51, выдерживают в термошкафу при Т=80-150°С в течение 15-30 мин. Модифицированное полотно помещают в дистиллированную воду на 2-3 мин. Характеристика модифицированного полотна: α4=~1000-1100 мас.%, F1=3.4 H, ε1=45%.
Пример 64 выполнен аналогично примеру 63. Отличие состояло в использовании полотна биомедицинского назначения из биополимерных волокон ацетата хитозана, полученного по примеру 56. Характеристика модифицированного полотна: α4=~700-750 мас.%, F1=20.5 Н, ε1=37.7%.
Группа примеров 65-69. Влияние химической модификации нетканого полотна из биополимерных волокон хитозана или соли хитозана и органической кислоты на упруго-пластические свойства материала (на примере нетканого волокнисто-пористого полотна из биополимерных волокон ацетата хитозана).
Пример 65. Полотно биомедицинского назначения из биополимерных волокон ацетата хитозана, полученное по примеру 51, выдерживают в растворе триэтаноламина (СТЭА≤60%) в течение 1 ч. Модифицированное полотно промывают дистиллированной водой до рН=7.0-7.5, помещают в дистиллированную воду на 3-5 мин до достижения степени сорбции α4=~400-410 мас.% и подвергают одноосному растяжению на разрывной машине. Упруго-пластические характеристики модифицированного полотна: F1=2.0 H, ε1=41.9%.
Пример 66 выполнен аналогично примеру 65. Отличие состояло в том, что в качестве модифицирующего реагента используют раствор едкого натрия (CNaOH=1 Н). Характеристика модифицированного полотна: (α4=~300-360 мас.%, F1=1.8 Н, ε1=35.6%.
Пример 67 выполнен аналогично примеру 65. Отличие в том, что в качестве модифицирующего реагента используют этиловый спирт (СЭС≤70%). Характеристика модифицированного полотна: α4=~350-400 мас.%, F1=2.7 Н, ε1=40.2%.
Пример 68 выполнен аналогично примеру 65. Отличие в том, что используют полотно биомедицинского назначения из биополимерных волокон ацетата хитозана, полученное по примеру 56. Характеристика модифицированного полотна: α4=~200-250 мас.%, F1=13.2 Н, ε1=39.2%.
Пример 69 выполнен аналогично примеру 66. Отличие состояло в использовании полотна биомедицинского назначения из биополимерных волокон ацетата хитозана, полученного по примеру 56. Характеристика модифицированного полотна: α4=~250-280 мас.%, F1=15.5 Н, ε1=36.4%.
Примеры 70-72. Культивирование эпителиоподобных клеток МА-104 и фибробластов кожи человека на нетканом волокнисто-пористом полотне из биополимерных волокон хитозана.
Пример 70. Используют нетканое волокнисто-пористое полотно из биополимерных волокон хитозана, полученное по примеру 51 и модифицированное по примеру 67. Полотно стерилизуют, помещают в стерильную чашку Петри, заливают ростовой средой с добавлением 10% эмбриональной сыворотки крупного рогатого скота и вносят суспензию клеток МА-104 в концентрации 3·105 кл./см2. Культивирование осуществляют в CO2-инкубаторе в атмосфере 5% CO2 при Т=37°С. Образование полноценного монослоя клеток наблюдается через 1 сут. культивирования (фиг.4). При перемещении полотна с выращенным на них монослоем культуры эмбрионального эпителия МА-104 на другую чашку Петри жизнеспособность клеток и их способность к дальнейшей адгезии и пролиферации сохраняется.
Пример 71. Монослой клеточной культуры эмбрионального эпителия МА-104 дезагрегируют и отделяют от нетканого волокнисто-пористого полотна ферментативной обработкой смесью 0.25%-ого раствора трипсина с 0.2%-ым раствором версена в соотношении 1:1 при Т=37°С (фиг.5).
Пример 72 выполнен аналогично примеру 70. Отличие в том, что используют нормальные фибробласты, выделенные из кожи человека, в концентрации не меньше 1 миллиона в 1 мл. Образование полноценного монослоя клеток наблюдается в сроки от 5 до 7 дней.
Примеры 70-72 показывают высокую биосовместимость нетканого волокнисто-пористого полотна из электропряденых биополимерных волокон хитозана с дермальными и эпителиоподобными клетками, что позволяет дать положительные рекомендации к его применению в медицине, фармакологии, косметологии и т.п.
Пример 73. Применение биологической повязки из нетканого волокнисто-пористого полотна, сформованного из биополимерных волокон хитозана или соли хитозана и органической кислоты, для лечения ран различной этиологии.
Клинические исследования биологической повязки в виде раневого покрытия из нетканого волокнисто-пористого полотна биомедицинского назначения из электропряденых волокон хитозана или соли хитозана и органической кислоты и способа лечения ран различной этиологии с использованием этой повязки проведены в МУЗ «Городская клиническая больница №7» г.Саратова на пациентах-добровольцах при лечении ожогов II-IIIАБ степени, донорских участков, длительно незаживающих ран, трофических язв, пролежней и других дефектов кожного покрова согласно ГОСТу Р 52379-2005 «Надлежащая клиническая практика».
В клиническое исследование вошли 59 пациентов. При этом созданная биологическая повязка в виде раневого покрытия из нетканого волокнисто-пористого полотна биомедицинского назначения из электропряденых волокон хитозана или соли хитозана и органической кислоты была применена для лечения ожогов II-IIIA степени у 15 человек, остаточных длительно незаживающих ран у 18, донорских ран у 8, трофических язв у 5, пролежней у 3, как временное закрытие ран в области глубоких ожогов после некрэктомии с целью подготовки их к аутодермопластике у 5, для лечения ран, закрытых аутодермотрансплантатами у 5. Площадь ожоговых ран, для лечения которых использовалась биологическая повязка, составляла от 0.5 до 15% поверхности тела.
Оценка эффективности применения раневых покрытий проводилась на основании клинических наблюдений. Контроль над течением раневого процесса осуществляли на основании клинических данных (цвета и характера экссудата, купирования признаков воспаления, времени появления грануляций, образования эпителиального слоя), сроков завершения эпителизации и продолжительности отдельных фаз. Оценивались также субъективные ощущения больного (болезненность, жжение, зуд), выявлялись побочные эффекты, оценивалось удобство использования повязок.
Клинические исследования показали, что раневые покрытия на основе нетканого волокнисто-пористого полотна биомедицинского назначения из электропряденых волокон хитозана или соли хитозана и органической кислоты легко моделируются по поверхности ран и плотно прилегают к раневой поверхности благодаря высокой пластичности, хорошо сорбируют избыток раневого отделяемого. Отмечено их выраженное стимулирующее воздействие на регенераторные процессы в ранах. Использование разработанных раневых покрытий способствует более ранней регенерации верхнего слоя кожи и быстрому самостоятельному заживлению поверхностных ран, росту грануляционной ткани и ускоренной подготовке ран к пересадке аутодермотрансплантатов в области глубоких ран, стимулирует краевую и островковую эпителизацию при лечении длительно незаживающих ран, уменьшает объем кровопотери в области донорских ран.
Покрытия могут длительно находиться на ране, атравматичны, а также легко отслаиваются по мере эпителизации раны, что позволяет осуществлять перевязки безболезненно и без травматизации подлежащих тканей раны. В ряде случаев полное восстановление утраченного кожного покрова достигается за счет однократной аппликации покрытия. Эти свойства разработанных биологических повязок позволяют защитить раны от инфицирования, предотвратить дополнительную травматизацию вновь образующегося эпителия, значительно снизить число и кратность перевязок, количество анестезиологических пособий, сократить плазмопотерю в области обширных ран, что уменьшает потребность пострадавших в трансфузиях белковых жидкостей.
Созданные раневые покрытия хорошо переносятся больными, не вызывают аллергических реакций даже при длительном нахождении на раневой поверхности. Наложение раневого покрытия не сопровождается болезненными ощущениями у пациента. После наложения повязки все пациенты отмечали снижение чувства дискомфорта, болевых ощущений, что позволяло снизить дозу обезболивающих препаратов. Побочных эффектов при применении раневых покрытий не отмечалось. Во всех наблюдениях не отмечалось случаев нагноения и осложненного течения раневого процесса.
Таким образом, раневые покрытия на основе нетканого волокнисто-пористого полотна биомедицинского назначения из электропряденых волокон хитозана обеспечивают оптимальные условия для регенерации и неосложненного течения раневого процесса, обладают стимулирующим воздействием на регенераторные процессы в ранах различной этиологии, способствуют своевременной эпителизации ран, что позволяет значительно ускорить процесс заживления, защитить рану от возникновения инфекционного процесса и травматизации, сократить сроки лечения пациентов и предотвратить образование грубых рубцов.
Разработанная биологическая повязка обладает рядом уникальных характеристик по сравнению с известными композициями того же назначения: улучшенными потребительскими свойствами, хорошо переносится больными, уменьшает расход перевязочного материала и дорогостоящих медикаментов, удобна в эксплуатации, что позволяет использовать ее для оказания медицинской помощи пациентам с ранами различной этиологии, в том числе в экстремальных условиях.
Применение созданной биологической повязки является эффективным способом лечения ран различной этиологии в зависимости от объективного состояния раны и стадии ее заживления и может быть рекомендовано для лечения ожогов II-IIIАБ степени, донорских участков, длительно незаживающих ран, трофических язв, пролежней и других дефектов кожного покрова.
Таким образом, в изобретении впервые определены составы и способы приготовления формовочных растворов хитозана и вспомогательного полимера или хитозана и вспомогательных полимеров для электроформования нановолокна и волокон субмикронного диаметра из хитозана или соли хитозана и органической кислоты, а также нетканого волокнисто-пористого полотна на их основе:
- с малым содержанием вспомогательного полимера: полиэтиленоксида в количестве 0.012-0.4 мас.% при использовании кислоторастворимых образцов хитозана, полиэтиленоксида в количестве 0.069-0.6 мас.%, поливинилового спирта или поливинилпирролидона в количестве 1.43-1.92 мас.% при использовании водорастворимых образцов хитозана;
- с малым содержанием вспомогательных полимеров: полиэтиленоксида в количестве 0.012-0.4 мас.% и диацетата целлюлозы в количестве 0.051-0.09 мас.%;
- с использованием органических кислот многоцелевого назначения, применяемых в медицине, фармакологии, косметологии, пищевой промышленности и т.п.: уксусной, лимонной, молочной, аскорбиновой, янтарной, аминокапроновой, транексамовой.
- с добавками биологически активных веществ: гемостатических, антисептических, антимикробных препаратов, местных анестетиков, протеолитических ферментов и др.
Впервые получены электропряденые биополимерные нано- и микроволокна из хитозана или соли хитозана и органической кислоты, а также образцы нетканого волокнисто-пористого полотна на их основе с поверхностной плотностью 5-25 г/м2:
- с малым содержанием вспомогательного полимера: полиэтиленоксида в количестве 0.25-9.3 мас.% при использовании кислоторастворимых образцов хитозана, полиэтиленоксида в количестве 1.0-24.2 мас.% при использования водорастворимых образцов хитозана,
- с малым содержанием вспомогательных полимеров: полиэтиленоксида в количестве 0.25-9.3 мас.% и диацетата целлюлозы в количестве 4.0-7.3 мас.%;
- с использованием органических кислот многоцелевого назначения, многие из которых используются в качестве лекарственных средств;
- с добавками биологически активных веществ, придающих готовому продукту дополнительный лечебный эффект.
Разработаны способы модификации нетканого волокнисто-пористого полотна из электропряденых биополимерных волокон хитозана или соли хитозана и органической кислоты, позволяющие получать полотно с высокими эластическими свойствами и с достаточной прочностью для использования в медицинской практике. Способы модификации просты в исполнении, экологически чисты и экономически целесообразны.
На основе полученного высокоэластичного, нетоксичного, биосовместимого и биодеградируемого нетканого волокнисто-пористого полотна из электропряденых биополимерных волокон хитозана или соли хитозана и органической кислоты создана биологическая повязка и разработан способ лечения ран различной этиологии с использованием этой повязки в зависимости от объективного состояния раны и стадии ее заживления. В качестве биологически активной добавки повязка может содержать протеолитический фермент, антимикробный, антисептический, гемостатический или обезболивающий препарат.
Повязка представляет собой лечебное раневое покрытие и обладает рядом уникальных характеристик, обусловленными собственными свойствами полотна:
- максимальной пластичностью и эластичностью;
- полной конгруэнтностью с поверхностью раны;
- высокой степенью атравматичности;
- улучшенной абсорбцией раневого отделяемого;
- свойством удерживания раневого отделяемого внутри покрытия;
- воздействием на рану с регенеративным эффектом;
- умеренным антибактериальным действием;
- неаллергенностью;
- обеспечением газообмена раневой поверхности;
- свойством постепенно рассасываться самостоятельно под действием раневого отделяемого;
- точным дозированием лекарственного средства, находящегося в повязке;
- адресной доставкой лекарственного средства к поврежденным тканям;
- пролонгированным лечебным эффектом воздействия на рану;
- равномерным лечебным действием на рану по всей ее площади;
- возможностью длительного нахождения на ране, в ряде случаев до полного восстановления утраченного кожного покрова с достижением заживления за счет однократной аппликации препарата;
- отсутствием необходимости в частых перевязках, значительным снижением болезненности и кратности перевязок;
- удобством в эксплуатации.
Стимулирующий эффект раневого покрытия обусловлен также введением в ткани биологически активных веществ, стимулирующих регенерацию и создающих структурную основу для эпителизации, прорастания сосудов и роста грануляционной ткани. При этом структура покрытия обеспечивает благоприятные условия для миграции клеток и формирования их монослоев.
Таким образом, биологическая повязка в виде раневого покрытия из нетканого волокнисто-пористого полотна биомедицинского назначения из электропряденых нановолокон хитозана или соли хитозана и органической кислоты обеспечивает поддержание на раневой поверхности условий, оптимальных для ее заживления, что приводит к уменьшению сроков лечения, а также улучшению функциональных и косметических результатов лечения за счет уменьшения возможности образования рубцов.
Реферат
Изобретение относится к получению биополимерных волокон из хитозана методом электроформования и нетканого волокнисто-пористого материала на их основе для получения полотна биомедицинского назначения в качестве биологической повязки для лечения ран. Состав формовочного раствора для формования биополимерных волокон включает полиэтиленоксид, хитозан, органическую кислоту и воду. Или состав формовочного раствора для формования биополимерных волокон включает хитозан, воду и компонент, выбранный из полиэтиленоксида, поливинилового спирта или поливинилпирролидона. При этом используют хитозан с молекулярной массой 30-40 кДа и полиэтиленоксид с молекулярной массой 2000-8000 кДа. Состав дополнительно содержит диацетат целлюлозы и биологически активные вещества. Способ приготовления формовочного раствора включает смешивание компонентов в порошкообразном состоянии и растворение их с перемешиванием до гомогенного состояния. Полотно биомедицинского назначения, сформированное из биополимерных волокон на основе хитозана, для получения из него повязки для лечения ран, подвергают набуханию в физиологическом растворе или дистиллированной воде. Дополнительно полотно биомедицинского назначения подвергают термообработке, после чего полотно помещают в дистиллированную воду или физиологический раствор для набухания. Или полотно дополнительно обрабатывают щелочным реагентом, с последующим промыванием дистиллированной водой, после чего помещают в дистиллированную воду для набухания. Для лечения ран полотно биомедицинского назначения в качестве биологической повязки накладывают на рану. Изобретение позволяет п
Формула
Документы, цитированные в отчёте о поиске
Термосклеиваемое разлагающееся полотно, впитывающее изделие, тампон и аппликатор для тампона



Комментарии