Гидрофильное полимерное соединение, имеющее антикоагулянтный эффект - RU2539566C2
Код документа: RU2539566C2
Чертежи



Описание
Область техники, к которой относится изобретение
Настоящее изобретение относится к гидрофильному полимерному соединению, имеющему антикоагулянтный эффект (антикоагулянтную активность).
Уровень техники
Реакция свертывания крови, требуемая для свертывающейся крови, представляет собой чрезвычайно сложную реакцию, в которой участвуют различные факторы свертывания крови. Считается, что первичная стадия остановки кровотечения (гемостаза), в которой участвуют тромбоциты, и стадия образования коагуляционного тромба, в которой участвуют факторы свертывания крови, такие как тромбин, чтобы стабилизировать и укрепить фибрин, являются особенно важными.
Реакция свертывания крови является необходимой для остановки кровотечения вследствие травмы и т.п. С другой стороны, однако, в тех случаях, где реакция свертывания крови происходит вследствие контакта между кровью и медицинским устройством или медицинским материалом, таким как контур искусственного кровообращения в гемодиализе, существует риск того, что образующийся при свертывании тромб повышает давление в системе кровообращения или закупоривает кровеносный сосуд.
Чтобы уменьшить эти риски, существует известный способ предотвращения свертывания крови, в котором гепарин, представляющий собой антикоагулянт, заблаговременно вводят пациенту, которому назначена процедура гемодиализа. Однако этот способ создает ряд проблем, связанных с тем, что введение гепарина в избыточном количестве вызывает побочные эффекты, затруднено регулирование вводимой дозы, данный способ неприменим к пациенту, склонному к кровотечениям, и так далее.
Недавно появились сообщения (патентные документы 1-9) об исследования в целях решения этих проблем и предотвращения свертывания крови во время лечения путем иммобилизации соединения, имеющего антикоагулянтную активность, включая гепарин, на поверхности медицинских устройств или медицинских материалов, таких как системы кровообращения и т.п.
Документы предшествующего уровня техники
Патентные документы
Патентный документ 1: японская переведенная выложенная патентная заявка PCT № 2003-507082
Патентный документ 2: японский патент JP 2001-213984 A
Патентный документ 3: японская переведенная выложенная патентная заявка PCT № 2004-525888
Патентный документ 4: японский патент JP 2006-291193 A
Патентный документ 5: международная патентная заявка WO 08/032758
Патентный документ 6: японский патент JP 2009-225824 A
Патентный документ 7: японский патент JP 2010-082067 A
Патентный документ 8: японский патент JP 2007-181691 A
Патентный документ 9: японский патент JP 2007-181692 A
Сущность изобретения
Проблемы, решаемые изобретением
Однако до настоящего времени еще не было разработано в качестве соединения, имеющего антикоагулянтную активность, для иммобилизации на поверхности медицинских устройств или медицинских материалов, таких как система кровообращения и т.п., определенного соединения, которое способно ингибировать реакции свертывания крови как на первичной стадии остановки кровотечения, в которой участвуют тромбоциты, так и на стадии образования коагуляционного тромба, в которой участвуют факторы свертывания крови. Даже если традиционное соединение, имеющее антикоагулянтную активность, должно быть иммобилизовано на поверхности медицинского устройства или медицинского материала, трудно иммобилизовать соединение, сохраняющее достаточную антикоагулянтную активность, и даже когда иммобилизация оказывается успешной, существует проблема того, что иммобилизованное соединение выделяется из медицинского устройства или медицинского материала в кровь. Кроме того, в тех случаях, где используют множество соединений для ингибирования реакции свертывания крови как на первичной стадии остановки кровотечения, в которой участвуют тромбоциты, так и на стадии образования коагуляционного тромба, в которой участвуют факторы свертывания крови, необходимо регулировать конкурентную адсорбцию между соединениями и регулировать степень иммобилизации, что весьма затруднительно.
Соответственно, цель настоящего изобретения заключается в том, чтобы предложить гидрофильное полимерное соединение, которое способно ингибировать реакции свертывания крови как на первичной стадии остановки кровотечения, в которой участвуют тромбоциты, так и на стадии образования коагуляционного тромба, в которой участвуют факторы свертывания крови, чтобы данное гидрофильное полимерное соединение было способно прочно иммобилизоваться на поверхности медицинских устройств или медицинских материалов, в состоянии сохранения антикоагулянтной активности.
Средства решения проблем
Чтобы решить вышеописанные проблемы, авторы настоящего изобретения провели интенсивные исследования и обнаружили, что гидрофильное полимерное соединение, включающее полимерное соединение, которое ингибирует адгезию тромбоцитов, и соединение, которое ингибирует реакцию свертывания крови, связанное с полимерным соединением, проявляет превосходную антикоагулянтную активность и может быть прочно иммобилизовано на поверхности медицинских устройств и медицинских материалов.
Таким образом, настоящее изобретение предлагает гидрофильное полимерное соединение, включающее полимерное соединение, которое ингибирует адгезию тромбоцитов, и соединение, которое ингибирует реакцию свертывания крови, связанное с вышеописанным полимерным соединением.
Вышеописанное полимерное соединение, которое ингибирует адгезию тромбоцитов, предпочтительно представляет собой сополимер, который состоит из гидрофобного полимера и гидрофильного полимера и у которого величина адсорбции к полиметилметакрилату составляет не менее чем 0,1 пг/мм2, предпочтительнее сополимер мономеров, выбранных из группы, которую составляют этиленгликоль, винилацетат, винилпирролидон, пропиленгликоль, виниловый спирт и силоксан, наиболее предпочтительно модифицированное простым полиэфиром кремнийорганическое соединение.
Вышеописанное соединение, которое ингибирует реакцию свертывания крови и предпочтительно обладает антитромбиновой активностью, предпочтительнее является соединением, представленным приведенной ниже общей формулой (I), наиболее предпочтительно это (2R,4R)-4-метил-1-((2S)-2-{[(3RS)-3-метил-1,2,3,4-тетрагидрохинолин-8-ил]сульфонил}амино-5-гуанидинопентаноил)пиперидин-2-карбоновая кислота.

[где R1 представляет собой (2R,4R)-4-алкил-2-карбоксипиперидиновую группу; R2 представляет собой фенильную группу или остаток конденсированного полициклического соединения, где остаток конденсированного полициклического соединения необязательно замещен низшей алкильной группой, низшей алкоксигруппой или аминогруппой, которая замещена низшей алкильной группой].
Настоящее изобретение также предлагает средство для обработки поверхности медицинских устройств или медицинских материалов, где средство для обработки поверхности включает вышеописанное гидрофильное полимерное соединение, которое обладает антикоагулянтной активностью.
Настоящее изобретение также предлагает медицинское устройство или медицинский материал, которые обработаны вышеописанным средством для обработки поверхности.
Эффекты изобретения
Используя настоящее изобретение, можно в значительной степени ингибировать реакции свертывания крови как на первичной стадии остановки кровотечения, в которой участвуют тромбоциты, так и на стадии образования коагуляционного тромба, в которой участвуют факторы свертывания крови, и гидрофильное полимерное соединение можно прочно иммобилизовать на поверхности медицинских устройств или медицинских материалов в состоянии сохранения антикоагулянтной активности. Кроме того, гидрофильное полимерное соединение согласно настоящему изобретению можно использовать в качестве средства для обработки поверхности, чтобы придавать антикоагулянтную активность медицинским устройствам или медицинским материалам.
Краткое описание чертежей
Фиг. 1 представляет схематическое изображение, иллюстрирующее мини-модуль, изготовленный в примере.
Фиг. 2 представляет схематическое изображение, иллюстрирующее замкнутую систему кровообращения, используемую в лабораторном исследовании кровообращения.
Фиг. 3 представляет схематическое изображение, иллюстрирующее систему обращения плазмы крови человека, используемую для измерения количества элюированного гидрофильного полимерного соединения.
Способ осуществления изобретения
Если не указаны иные условия, термины, используемые в настоящем документе, имеют следующие определения:
«Гидрофильное полимерное соединение» согласно настоящему изобретению отличается тем, что в нем связаны полимерное соединение, которое ингибирует адгезию тромбоцитов, и соединение, которое ингибирует реакцию свертывания крови.
Термин «гидрофильный» в настоящем документе означает, что соединение является растворимым в воде или, даже если соединение не растворяется в воде, это соединение взаимодействует с молекулами воды посредством электростатического взаимодействия или водородной связи. «Гидрофильное полимерное соединение» включает, например, гидрофильные полимерные соединения, в которых сополимер мономеров, выбранных из группы, которую составляют этиленгликоль, винилацетат, винилпирролидон, пропиленгликоль, виниловый спирт и силоксан, связан с соединением, представленным следующей общей формулой (I):

[где R1 представляет собой (2R,4R)-4-алкил-2-карбоксипиперидиновую группу; R2 представляет собой фенильную группу или остаток конденсированного полициклического соединения, где остаток конденсированного полициклического соединения необязательно замещен низшей алкильной группой, низшей алкоксигруппой или аминогруппой, которая замещена низшей алкильной группой].
Термин «полимерное соединение, которое ингибирует адгезию тромбоцитов» в настоящем документе означает полимерное соединение, у которого среднечисленная молекулярная масса составляет не менее чем 1000, которое обладает совместимостью с кровью и способно ингибировать адгезию тромбоцитов к поверхности подложки или материала, обеспечивая существование полимерного соединения на поверхности медицинского устройства или медицинского материала.
Примеры «полимерного соединения, которое ингибирует адгезию тромбоцитов» включают поливиниловый спирт, поливинилпирролидон, полиэтиленгликоль, полипропиленгликоль, полимерные соединения, которые составляют простой полиэфир и полисилоксан, полиэтиленимин, полиаллиламин, поливиниламин, поливинилацетат, полиакриловую кислоту, полиакриламид, полигидроксиэтилметакрилат, или сополимер или привитой сополимер мономера данных полимерных соединений и другого мономера, который может предпочтительно содержать аминогруппу, карбоксильную группу, гидроксильную группу, эпоксидную группу или меркаптогруппу для образования связи с соединением, которое ингибирует свертывание крови, предпочтительнее сополимер, состоящий из гидрофобного полимера и гидрофильного полимера для адсорбции на поверхность медицинских устройств или медицинских материалов, наиболее предпочтительно полимерное соединение, состоящее из простого полиэфира и полисилоксана, которые обладают высокой степенью гидрофильности, или частично омыленный поливиниловый спирт или сополимер винилпирролидона и винилацетата.
Примеры «полимерного соединения, состоящего из простого полиэфира и полисилоксана» включают сополимеры, полимерные комплексы, полимерные смеси простого полиэфира и полисилоксана. Сополимер простого полиэфира и полисилоксана состоит из звеньев простого полиэфира и звеньев полисилоксана, и образованный из них сополимер может представлять собой любой статистический сополимер, блок-сополимер или привитой сополимер. Среди них предпочтительным является модифицированное простым полиэфиром кремнийорганическое соединение, которое обладает высокой степенью гидрофильности.
Примеры «простого полиэфира» включают полиэтиленоксид и структуры, образованные из полиэтиленоксида. «Простой полиэфир» в настоящем документе означает структуру, представленную общей формулой (II) (R3 представляет собой алкильную группу, содержащую не более чем 6 атомов углерода), и «структура, образованная из полипропиленгликоля», который представляет собой один пример простого полиэфира, означает структуру, представленную общей формулой (III).
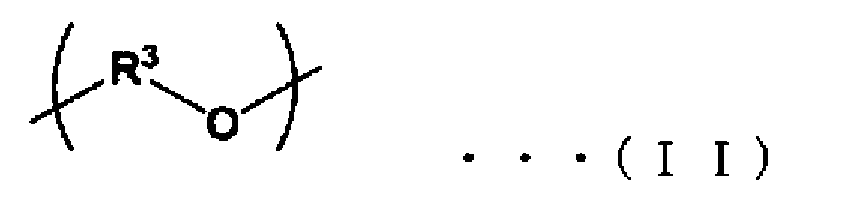

«Модифицированное простым полиэфиром кремнийорганическое соединение» означает кремнийорганическое соединение, в котором звенья простого полиэфира связаны с боковыми цепями кремнийорганических цепей, и можно также использовать модифицированное простым полиэфиром кремнийорганическое соединение, которое модифицировано аминогруппой или модифицировано карбоксильной группой.
Когда полимерное соединение, которое ингибирует адгезию тромбоцитов, представляет собой частично омыленный поливиниловый спирт, степень омыления составляет предпочтительно от 50 до менее чем 100 мол.%, предпочтительнее от 74 до 99,9 мол.%, наиболее предпочтительно от 78 до 95 мол.% с точки зрения достижения предпочтительной простоты обращения или гидрофильности.
«Степень омыления» в настоящем документе представляет собой значение, вычисляемое согласно уравнению 1.
Степень омыления = m/(n+m)·100 (уравнение 1)
m: число структур, представленных общей формулой (IV), в поливиниловом спирте
n: число структур, представленных общей формулой (V), в поливиниловом спирте


Когда полимерное соединение, которое ингибирует адгезию тромбоцитов, представляет собой сополимер винилпирролидона и винилацетата, звенья винилпирролидона составляют предпочтительно не менее чем 50 мол.% звеньев, предпочтительнее не менее чем 60 мол.% звеньев с точки зрения достижения предпочтительной простоты обращения или гидрофильности. С другой стороны, с точки зрения достижения предпочтительной величины адсорбции к материалу основы, звенья винилпирролидона составляют предпочтительно менее чем 100 мол.% звеньев. Процентное содержание звеньев винилпирролидона в сополимере винилпирролидона и винилацетата (мол.% звеньев) вычисляют по данным спектра ЯМР1H сополимера (растворитель CDCl3).
Величина адсорбции полимерного соединения, которое ингибирует адгезию тромбоцитов, к материалам основы, такой как медицинское устройство, медицинский материал и т.п., составляет предпочтительно не менее чем 0,1 пг/мм2, предпочтительнее не менее чем 1 пг/мм2, наиболее предпочтительно не менее чем 10 пг/мм2.
Величину адсорбции измеряли следующим способом.
Сначала необработанный сенсорный чип Sensor Chip Au от фирмы GE Healthcare подвергали предварительной обработке (дистиллированной водой при температуре 25°C и скорости потока мкл/мин в течение 10 минут), используя систему поверхностного плазмонного резонанса (далее называется SPR) BIACORE 3000 от фирмы GE Healthcare, и измеряли величину сигнала в резонансных единицах (RU).
«Материал основы», т.е. материал адсорбента, растворяли в растворителе, получая 0,5 мас.% раствора материала адсорбента. Одну каплю раствора материала адсорбента капали в центр детали из золотой пленки и затем ее немедленно вращали при скорости 3000 об/мин в течение 1 минуты при комнатной температуре, чтобы покрыть сенсорный чип материалом адсорбента.
Убедившись в том, что на сенсорном чипе больше не находится капля, сенсорный чип промывали дистиллированной водой, используя SPR (при температуре 25°C и скорости потока 20 мкл/мин в течение 10 минут), и затем промывали три раза раствором 0,025 мас.% Triton-X100 (при температуре 25°C и скорости потока 20 мкл/мин в течение 1 минуты), и затем измеряли величину сигнала через 10 минут после окончания промывки.
Среди сенсорных чипов, полученных вышеописанным способом, выбирали чип, у которого разность величин сигнала до и после нанесения покрытия на центрифуге составляла от 3000 до 8000, затем промывали дистиллированной водой (при температуре 25°C и скорости потока 20 мкл/мин в течение 10 минут) и далее промывали три раза раствором 0,025 мас.% Triton-X100 (при температуре 25°C и скорости потока 20 мкл/мин в течение 1 минуты).
Через 10 минут после окончания промывки водный раствор гидрофильного полимерного соединения, подлежащего адсорбции на материале основы (концентрация 100 мкг/мл), вводили (при температуре 25°C и скорости потока 20 мкл/мин в течение 1 минуты) и затем полученный материал промывали дистиллированной водой (при температуре 25°C и скорости потока 20 мкл/мин в течение 3 минут). Определяли разность между величиной сигнала непосредственно перед введением (далее называется «величина сигнала A») и величиной сигнала через 3 минуты после окончания введения (далее называется «величина сигнала B»), которую затем пересчитывали как 1 RU = 1 пг/мм2.
После этого сенсорный чип промывали дистиллированной водой (при температуре 25°C и скорости потока 20 мкл/мин в течение 2 минут), и затем промывали три раза раствором 0,025 мас.% Triton-X100 (при температуре 25°C и скорости потока 20 мкл/мин в течение 1 минуты), и опять водный раствор гидрофильного полимерного соединения, подлежащего адсорбции (концентрация 100 мкл/мл), вводили (при температуре 25°C и скорости потока 20 мкл/мин в течение 1 минуты). После этого такие же стадии повторяли, чтобы пятикратно определить разности сигналов, и среднее значение рассматривали в качестве «величины адсорбции полимерного соединения, которое ингибирует адгезию тромбоцитов к материалу основы».
«Соединение, которое ингибирует реакцию свертывания крови» означает соединение, имеющее антикоагулянтную активность, такую как антитромбиновая активность, и, более конкретно, означает соединение, которое увеличивает протромбиновое время по сравнению с натуральной кровью не менее чем на 30% при введении данного соединения в кровь до концентрации 10 мкг/мл.
«Протромбиновое время» измеряли способом, описанным в известной литературе (Masamitsu Kanai и др. «Справочник по клиническим испытаниям», издательство Kanihara, 1993 г., т. 30, с. 416-418). Более конкретно, смешивали 1 об. ч. 3,2% цитрата натрия и 9 об. ч. крови, помещали аликвоту 0,1 мл смеси раствора цитрата натрия и плазмы крови в мелкую пробирку (внутренний диаметр: 8 мм, длина: 7,5 см), после чего нагревали ее в термостатируемой бане при 37°C в течение 3 минут. После этого в смесь добавляли 0,2 мл содержащего тканевой тромбопластин и кальций реагента, выдержанного при 37°C, и затем пробирку слегка встряхивали и оставляли для осаждения фибрина путем отстаивания. Здесь измеряли время, требуемое для осаждения фибрина после добавления содержащего тканевой тромбопластин и кальций реагента, и измеренное время определяли как «протромбиновое время».
Примеры «соединения, которое ингибирует реакцию свертывания крови» включают гепарин, мезилат нафамостата, цитрат натрия, оксалат натрия, α1-антитрипсин, α2-макроглобулин, ингибитор C1 эстеразы, тромбомодулин, протеин C, соединения, имеющие гуанидиновую структуру, простагландины, гирудин, ингибиторы фактора Xa, ингибитор тканевого фактора и антитромбин, и предпочтительными являются соединения, имеющие антитромбиновую активность.
«Соединение, имеющее антитромбиновую активность» означает соединение, которое имеет высокую склонность к связыванию тромбина.
Пример показателя для оценки антитромбиновой активности соединения представляет собой константа ингибирования (далее называется «Ki»), которую вычисляют по графику Лайнуивера-Берка (Lineweaver-Burk) на основе величины поглощения исследуемого раствора. Меньшее значение Ki указывает на повышенную склонность к связыванию тромбина и повышенную антитромбиновую активность.
Примеры «соединения, имеющего антитромбиновую активность» включают соединения, имеющие гуанидиновую структуру, и предпочтительный пример представляет собой (2R,4R)-4-метил-1-((2S)-2-{[(3RS)-3-метил-l,2,3,4-тетрагидрохинолин-8-ил]сульфонил}амино-5-гуанидинопентаноил)пиперидин-2-карбоновая кислота (далее называется «аргатробан»). Аргатробан, который был синтезирован в 1978 г., представляет собой используемое в медицине соединение, обладающее селективной антитромбиновой активностью производного аргинина.
Средство для обработки поверхности медицинского устройства или медицинского материала согласно настоящему изобретению отличается содержанием вышеописанного гидрофильного полимерного соединения и наличием антикоагулянтной активности.
Примеры «медицинского устройства или медицинского материала» включают имплантируемые искусственные органы, искусственные кровеносные сосуды, катетеры, стенты, пакеты для переливания крови, контактные линзы, внутриглазные линзы и технические приспособления для хирургии; и разделительные мембраны и адсорбенты, которые включены в модули для разделения биогенных веществ, гемолиза и т.п.
Способы обработки поверхности медицинских устройств или медицинских материалов с использованием вышеописанного средства для обработки поверхности, т.е. способы иммобилизации вышеописанного гидрофильного полимерного соединения, которое представляет собой его активный ингредиент, на поверхности медицинских устройств или медицинских материалов, включают, например, способ, в котором вышеописанное средство для обработки поверхности изготавливают для контакта с медицинскими устройствами или медицинскими материалами и затем подвергают его облучению. Что касается типа излучения, предпочтительными являются пучки электронов или γ-излучение.
Примеры материала, составляющего «медицинские устройства или медицинские материалы» включают целлюлозу, ацетат целлюлозы, поликарбонаты, полисульфоны, полиэфирсульфоны, полиметакрилаты, такие как полиметилметакрилат (далее называется «PMMA»), полиакрилаты, полиамиды, поливинилиденфторид, поливинилхлорид, полиакрилонитрил, сложные полиэфиры, полиуретаны, полистирол, полиэтилен, полипропилен, поливинилиденфторид, полиметилпентен и полиимиды.
Примеры
Далее настоящее изобретение будет описано более подробно со ссылкой на примеры. Однако настоящее изобретение не ограничено ими.
(Пример 1: связывание между модифицированным простым аминополиэфиром кремнийорганическим соединением и аргатробаном)
Аргатробан в количестве 5 ммоль помещали в колбу для восстановления и к нему добавляли 10 мл безводного диметилформамида (далее называется «безводный DMF»), чтобы растворить аргатробан. После этого 10 мл раствора 4N хлористоводородной кислоты в 1,4-диоксане (TOYOKASEI) добавляли каплями при охлаждении в колбу для восстановления и полученную смесь перемешивали в течение 1 часа. Затем растворитель испаряли, используя роторный испаритель, и полученный остаток дополнительно сушили ночь в вакуумной печи, после чего добавляли 25 мл безводного DMF, чтобы получить раствор соли аргатробана и хлористоводородной кислоты в безводном DMF.
Раствор соли аргатробана и хлористоводородной кислоты в безводном DMF в количестве, приведенном в таблице 1, помещали в двугорлую колбу и добавляли раствор дициклогексилкарбодиимида (далее называется «DCC») в безводном DMF и раствор 4-гидроксибензотриазола (далее называется «HOBt») в безводном DMF. Затем дополнительно добавляли модифицированное простым полиэфиром кремнийорганическое соединение X-22-3939A (SHIN-ETSU CHEMICAL) и полученную смесь оставляли реагировать при комнатной температуре в течение 3 суток. Затем реакционный раствор помещали в трубку для диализа (SPECTRAPORE RC, PORE 6, MWCO1000) и проводили диализ в течение 3 суток против дистиллированной воды с более чем десятикратным объемом, в результате чего была соответствующим образом вытеснена дистиллированная вода. Реакционный раствор после диализа фильтровали и растворитель из фильтрата испаряли, используя роторный испаритель, после чего полученный остаток сушили ночь в вакуумной печи, чтобы получить гидрофильное полимерное соединение (далее называется «соединение примера 1»).
(Измерение антитромбиновой активности соединения примера 1)
Для измерения использовали прибор ECA-T (HAEMOSYS). К 100 мкл соединения примера 1 добавляли 900 мкл дистиллированной воды, чтобы приготовить водный раствор соединения примера 1. Раствор соединения примера 1 в количестве 30 мкл отбирали и смешивали с 100 мкл содержащего ECA и протромбин буфера и 25 мкл субстрата ECA-T. После инкубации полученной смеси при 37°C в течение 60 секунд смесь помещали в прибор COATRON M1 (код 80 800 000) и измерение осуществляли после добавления 50 мкл экаринового реагента ECA.
Смесь 20 мкл раствора аргатробана, который приготовляли в произвольной концентрации, используя смешанный растворитель, содержащий этанол и хлористоводородную кислоту в объемном соотношении 4/1, и 80 мкл плазмы крови человека, и смесь 20 мкл чистой дистиллированной воды и 80 мкл плазмы крови человека подвергали измерению соответственно вместо вышеописанного водного раствора соединения примера 1, используя прибор ECA-T, и по результатам измерений строили калибровочную кривую. Концентрацию 1494,3 мас. м.д. в пересчете на аргатробан водного раствора соединения примера 1, вычисленную по калибровочной кривой, определяли как значение, показывающее антитромбиновую активность соединения примера 1.
(Примеры 2-13)
Соединения примеров 2-13 получали, соответственно, таким же образом, как в примере 1, за исключением того, что изменяли молярные соотношения DCC, HOBt, модифицированного простым полиэфиром кремнийорганического соединения (X-22-3939A) и соли аргатробана с хлористоводородной кислотой и объемное соотношение безводного DMF и модифицированного простым полиэфиром кремнийорганического соединения, чтобы измерить его антитромбиновую активность. Молярные соотношения DCC, HOBt, модифицированного простым полиэфиром кремнийорганического соединения (X-22-3939A) и аргатробана и результаты измерения антитромбиновой активности каждого из соединений примеров 2-13 представлены в таблице 1.
Также измеряли антитромбиновую активность модифицированного простым полиэфиром кремнийорганического соединения (X-22-3939A), но измеренное значение было таким же, как у чистой дистиллированной воды, и было подтверждено, что модифицированное простым полиэфиром кремнийорганическое соединение само по себе не обладает антитромбиновой активностью.
(Измерение константы ингибирования тромбина соединения примера 1)
Водный раствор тромбина из плазмы бычьей крови готовили растворением 10000 ед. тромбина из раствора плазмы бычьей крови (ITO LIFE SCIENCES) в 1 мл физиологического раствора соли.
Водный раствор субстрата S-2238 готовили растворением 25 мг концентрированного раствора S-2238 (SEKISUI MEDICAL) в 40 мл дистиллированной воды.
Разбавляли каждый из водного раствора бычьего тромбина, водного раствора субстрата S-2238 и вышеописанного водного раствора соединения примера 1, используя разбавленный буферный раствор (0,05M Tris, 0,1 М NaCl, 1 мг/мл бычьего сывороточного альбумина (BSA), pH 7,4).
В 96 лунок микропланшета помещали по 100 мкл разбавленного раствора водного раствора субстрата S-2238 и 50 мкл разбавленного раствора водного раствора соединения примера 1, затем плашку герметизировали и нагревали в термостатируемой сушилке, установленной на 37°C, в течение 30 минут. После этого добавляли по 50 мкл разбавленного водного раствора тромбина из раствора бычьей плазмы, который нагревали при 37°C в течение 30 минут, и поглощение полученной смеси немедленно измеряли, используя считывающее устройство для микропланшетов (длина волны измерения: 405 нм, длина волны сравнения: 595 нм).
Немедленно после выполнения первого измерения поглощения осуществляли второе измерение поглощения. Третье или последующие измерения поглощения осуществляли через 4, 6, 8, 10, 12, 14, 16, 18 и 20 минут, соответственно, после помещения разбавленного водного раствора тромбина из раствора бычьей плазмы. Константу Ki вычисляли по каждому полученному значению поглощения, используя график Лайнуивера-Берка. Константа Ki у соединения примера 1 составляла 21 нМ.
Кроме того, константу Ki модифицированного простым полиэфиром кремнийорганического соединения (X-22-3939A) вычисляли таким же способом, но константа Ki модифицированного простым полиэфиром кремнийорганического соединения без антитромбиновой активности была такой же, как у холостого раствора, как и ожидалось.
Кроме того, константу Ki аргатробана вычисляли таким же способом, и Ki составила 42 нМ, что не менее чем в два раза превышало константу Ki соединения примера 1.
Из этих результатов очевидно, что вышеописанное гидрофильное полимерное соединение имеет чрезвычайно высокую склонность к связыванию тромбина и способно придавать значительно более высокую антитромбиновую активность, чем аргатробан, который, как известно, обладает антитромбиновой активностью, медицинским устройствам, включая диализатор из полых волокон или медицинский материал.
(Изготовление мини-модуля с мембраной из полых волокон PMMA)
Добавляли 5 мас.ч. изотактического PMMA и 20 мас.ч. синдиотактического PMMA к 75 мас.ч. диметилсульфоксида и перемешивали полученную смесь при 110°C в течение 8 часов, чтобы получить образующую мембрану жидкость. Полученную образующую мембрану жидкость экструдировали из коаксиальной цилиндрической насадки типа диафрагмы, и после прохождения 300 мм в воздухе материал вводили в коагуляционную ванну, содержащую 100% воду, получая в результате полые волокна PMMA, имеющие внутренний диаметр 0,2 мм, толщину мембраны 0,03 мм. В качестве газа, вводимого внутрь волокон, использовали сухой азот.
Изготавливали модульный корпус, имеющий внутренний диаметр 10 мм и длину 120 мм, который содержал два порта, соединенных с внутренней частью полых волокон (порты для ввода и вывода крови), и два порта, соединенных с наружной частью полых волокон (порты для ввода и вывода диализата), соответственно.
Из 50 вышеописанных полых волокон PMMA изготавливали пучки, чтобы образовать мембраны из полых волокон PMMA и оба края мембран из полых волокон PMMA прикрепляли к вышеописанному модульному корпусу, используя эпоксидный герметизирующий материал, обращая внимание на то, чтобы не закупоривать полые части мембран из полых волокон PMMA. После этого мембраны из полых волокон PMMA и внутреннюю сторону модульного корпуса промывали дистиллированной водой, чтобы получить мини-модуль 6, как показано на фиг. 1.
(Иммобилизация соединения примера 1 на мембранах из полых волокон PMMA)
Bis-Tris (DOJINDO LABORATORIES) и хлорид натрия растворяли в ультрачистой воде таким образом, чтобы получить конечные концентрации 0,25 М и 0,5 М соответственно, и pH полученного раствора доводили до 5, добавляя каплями 6 N раствор хлористоводородной кислоты, чтобы приготовить буферный раствор Bis-Tris, имеющий пятикратную концентрацию.
Дистиллированную воду, оставшуюся со стороны, соприкасающейся с кровью (внутренняя сторона мембран из полых волокон PMMA), и со стороны, не соприкасающейся с кровью (внешняя сторона мембран из полых волокон PMMA), изготовленного мини-модуля 6 удаляли с помощью сжатого воздуха. Затем водный раствор соединения примера 1 в концентрации 4000 мас. м.д. в пересчете на аргатробан, пропиленгликоль и буферный раствор Bis-Tris, имеющий пятикратную концентрацию, смешивали в объемном соотношении 5/3/2, чтобы получить заполняющий раствор.
Только на соприкасающейся с кровью стороне мини-модуля 6 вышеописанный заполняющий раствор (400 мкл) помещали, используя шприц. После этого заполняющий раствор удаляли сжатым воздухом, все порты для ввода и вывода крови 1a и 1b и порты для ввода и вывода диализата 2a и 2b плотно закрывали, чтобы облучать мини-модуль 6 рентгеновским излучением при дозе 25 кГр в течение 3 часов.
Мембраны из полых волокон PMMA 4 и внутреннюю сторону мини-модуля 6 промывали, пропуская водный раствор 0,025 мас.% полиоксиэтиленоктилфенилового эфира в мембраны из полых волокон PMMA 4 и на внутреннюю сторону мини-модуля 6 при скорости потока 10 мл/мин в течение 8 часов с помощью перистальтического насоса 8. После этого пропускали дистиллированную воду и физиологический раствор соли при скорости потока 10 мл/мин в течение 30 минут соответственно, чтобы осуществить дополнительную промывку и получить мини-модуль, в котором было иммобилизовано соединение примера 1 (далее называется «мини-модуль примера 1»).
Мини-модуль, в котором было иммобилизовано модифицированное простым полиэфиром кремнийорганическое соединение (далее называется «сравнительный мини-модуль примера 1»), изготавливали, осуществляя такую же процедуру, как описано выше, за исключением того, что модифицированное простым полиэфиром кремнийорганическое соединение (X-22-3939A) использовали вместо водного раствора соединения примера 1 в концентрации 4000 мас. м.д. в пересчете на аргатробан.
(Лабораторное исследование кровообращения)
Кровь, сданную добровольцем, и лимонную кислоту смешивали в объемном соотношении 9/1, чтобы получить кровь с добавкой лимонной кислоты. Calcicol в количестве 43,6 мкл добавляли к 1 мл крови с добавкой лимонной кислоты, чтобы получить исследуемую кровь.
Силиконовые трубки 7a и 7b соединяли с мини-модулем примера 1 и перистальтический насос 8 устанавливали в середине силиконовой трубки 7b. Исследуемую кровь пропускали при скорости потока 0,9 мл/мин в течение 5 секунд из силиконовой трубки 7a, соединенной с портом для ввода крови 1a, и исследуемую кровь, выводимую из порта для вывода крови 1b, выводили из силиконовой трубки 7b, чтобы удалить пузырьки на внутренней стороне мембран из полых волокон PMMA. После этого силиконовые трубки 7a и 7b соединяли с соединительной деталью 9, чтобы получить замкнутый контур, представленный на фиг. 2.
Кровообращение исследуемой крови начинали при скорости потока 0,9 мл/мин, чтобы измерить продолжительность кровообращения, пока силиконовые трубки 7a или 7b не отсоединялись от соединительной детали 9 вследствие повышения внутреннего давления в контуре, вызываемого коагуляционным тромбом, образующимся в контуре. Продолжительность кровообращения при использовании мини-модуля примера 1 составляла 46 минут.
Мини-модуль 6, в котором никакое соединение не было иммобилизовано на мембранах из полых волокон PMMA (далее называется «мини-модуль сравнительного примера 2»), изготавливали для осуществления такого же исследования кровообращения, как описано выше. Продолжительность кровообращения в данном случае составляла 20 минут, что не превышало половины продолжительности кровообращения при использовании мини-модуля примера 1. Из этих результатов очевидно, что вышеописанные гидрофильные полимерные соединения способны придавать значительную антикоагулянтную активность медицинским устройствам, включая диализатор из полых волокон, или медицинским материалам.
Когда такое же исследование кровообращения осуществляли, как описано выше, используя сравнительный мини-модуль примера 1, продолжительность кровообращения составляла 20 минут, что совпадало с продолжительностью кровообращения при использовании мини-модуля сравнительного примера 2, в котором никакое соединение не было иммобилизовано на мембранах из полых волокон PMMA.
(Измерение элюированного количества соединения примера 1)
Силиконовую трубку 7b, имеющую внутренний диаметр 0,8 мм и длину 520 мм, соединяли с портом для вывода крови 1b отдельно изготовленного мини-модуля примера 1, и перистальтический насос 8 устанавливали в середину силиконовой трубки 7b. Силиконовую трубку 7a, имеющую внутренний диаметр 0,8 мм и длину 160 мм, соединяли с портом для ввода крови 1a. После этого каждый из других концов силиконовых трубок 7a и 7b вставляли в круглую трубку из полистирола (код 352054; BECTON DICKINSON), содержащую 5 мл плазмы крови человека, чтобы приготовить систему кровообращения, представленную на фиг. 3.
После обращения плазмы крови человека при скорости потока 0,5 мл/мин в течение 4 часов с использованием перистальтического насоса 8 концентрацию соединения примера 1 в плазме крови человека в круглой трубке из полистирола 10 измеряли, используя прибор ECA-T. Однако концентрация соединения примера 1 в плазме крови человека после обращения была ниже уровня обнаружения прибора ECA-T, и элюирование соединения примера 1 из мини-модуля примера 1 не было подтверждено. Этот результат показывает, что вышеописанное гидрофильное полимерное соединение может быть прочно иммобилизовано на медицинских устройствах, включая диализатор из полых волокон, или медицинских материалах.
(Определение величины адсорбции полимерных соединений, обладающих активностью ингибирования адгезии тромбоцитов)
Материалы PVP (K-90), VA73, VA64, VA55 и VA37 (любые из них производит фирма BASF Corporation) поставлялись в виде сополимера винилпирролидона и винилацетата (далее называется «сополимер VA»), и данный сополимер, составляющий вышеописанные гидрофильные полимерные соединения, был одним из полимерных соединений, ингибирующих адгезию тромбоцитов. Аналогичным образом, PVA217, PVA417 и PVA205c (любые из них производит фирма KURARAY) поставлялись в виде частично омыленного поливинилового спирта, который представлял собой одно из полимерных соединений, ингибирующих адгезию тромбоцитов. Кроме того, в качестве модифицированного простым полиэфиром кремнийорганического соединения поставлялись F114, F244, F303, F3031, F348, F350s, F502, F506 и X-22-3939A (любые из них производит фирма SHIN-ETSU SILICONE). Каждый из полученного сополимера VA, частично омыленного поливинилового спирта и модифицированного простым полиэфиром кремнийорганического соединения разбавляли дистиллированной водой, чтобы приготовить водный раствор с концентрацией 10000 мас. м.д.
С другой стороны, для сравнения были поставлены в качестве полимерных соединений, составляющих вышеописанные гидрофильные полимерные соединения, которые не были включены в полимерные соединения, ингибирующие адгезию тромбоцитов, PEG2000, PEG4000, PEG6000 и PEG20000 (любые из них производит фирма NACALAITESQUE), и метиловый эфир полиэтиленгликоля (PEG-em) и диметиловый эфир полиэтиленгликоля (PEG-dm) (оба производит фирма SIGMA-ALDRICH). Каждое из приготовленных полимерных соединений разбавляли дистиллированной водой, чтобы приготовить водный раствор с концентрацией 10000 мас. м.д.
В качестве растворов 0,5 мас.% материалов адсорбентов, адсорбирующих полимерные соединения, которые ингибируют адгезию тромбоцитов, готовили раствор PMMA (среднемассовая молекулярная масса 93000, производитель SIGMA-ALDRICH), раствор в толуоле, раствор полиуретана в диметилацетамиде, раствор полисульфона Udel P-3500 (зарегистрированный товарный знак, производитель SOLVAY) в диметилацетамиде, раствор поливинилхлорида (среднемассовая молекулярная масса 80000, производитель SIGMA-ALDRICH) в тетрагидрофуране, раствор полистирола (производитель WAKO) в хлороформе и раствор поликарбоната (среднемассовая молекулярная масса 20000, производитель TEIJIN) в хлороформе.
Величины адсорбции различных полимерных соединений, ингибирующих адгезию тромбоцитов, измеряли для каждого материала адсорбента. Результаты представлены в таблице 2.
Из результатов в таблице 2 очевидно, что полимерные соединения, составляющие вышеописанные гидрофильные полимерные соединения, которые ингибируют адгезию тромбоцитов, не ограничены модифицированным простым полиэфиром кремнийорганическим соединением (X-22-3939A) и способны прочно адсорбироваться на медицинских устройствах, включая диализатор из полых волокон, или медицинских материалах.
(Определение активности ингибирования адгезии тромбоцитов)
Отдельно изготовленный модульный корпус мини-модуля примера 1 разрезали ультразвуковым дисковым ножом, чтобы извлечь мембраны из полых волокон PMMA (далее называются «мембраны из полых волокон примера 1»), на которых было иммобилизовано соединение примера.
Двухстороннюю клейкую ленту прикрепляли к одной поверхности круглой пленки из полиэтилентерефталата, имеющей диаметр 18 мм, и после установки на нее мембран из полых волокон примера 1 установленные мембраны из полых волокон PMMA разрезали на полуцилиндрические формы, чтобы открыть внутренние поверхности мембран из полых волокон PMMA. Мембраны из полых волокон согласно примеру, прикрепленные к круглой пленке, прикрепляли к цилиндрической трубке Falcon (зарегистрированный товарный знак), разрезанной на цилиндрические формы (диаметр 18 мм, № 2051), и пространство между цилиндрической трубкой и круглой пленкой герметизировали, используя парафильм. После этого цилиндрическую трубку заполняли физиологическим раствором соли.
Венозную кровь немедленно после ее сдачи добровольцем помещали в пробирку для сбора крови, в которую был заблаговременно помещен гепарин, и полученную смесь перешивали, переворачивая пробирку вверх дном, чтобы приготовить кровь с добавкой гепарина. Концентрацию крови с добавкой гепарина устанавливали на уровне 50 ед/мл.
После помещения физиологического раствора соли в вышеописанную цилиндрическую трубку в нее добавляли 1,0 мл крови с добавкой гепарина, и цилиндрическую трубку встряхивали при 37°C в течение 1 часа. После этого мембраны из полых волокон примера 1 в вышеописанной цилиндрической трубке промывали 10 мл физиологического раствора соли и затем компоненты крови фиксировали, добавляя физиологический раствор соли, содержащий 2,5 об.% глутаральдегида, после чего дополнительно промывали мембраны дистиллированной водой. Затем круглую пленку, фиксирующую мембраны из полых волокон примера 1, снимали с вышеописанной цилиндрической трубки, и круглую пленку, фиксирующую мембраны из полых волокон согласно примеру, сушили при пониженном давлении и нормальной температуре, используя абсолютное давление 0,5 торр (66,5 Па), в течение 12 часов.
Круглую пленку, высушенную при пониженном давлении, на которой были фиксированы мембраны из полых волокон примера 1, прикрепляли для стадии сканирующей электронной микроскопии с помощью двухсторонней клейкой ленты и затем на поверхности мембран из полых волокон согласно примеру методом напыления получали тонкую пленку из платины/палладия. Внутренние поверхности в центральной части в продольном направлении мембран из полых волокон согласно примеру, на поверхности которых была образована тонкая пленка из платины/палладия, наблюдали, используя полевой эмиссионный сканирующий электронный микроскоп S800 (производитель HITACHI) при увеличении в 1500 раз, и считали число прикрепленных тромбоцитов в одном поле зрения (4300 мкм2).
Округленное до целого числа среднее значение чисел прикрепленных тромбоцитов, сосчитанных в пяти различных полях зрения определяли как число прикрепленных тромбоцитов (число тромбоцитов на 4300 мкм2), и число прикрепленных тромбоцитов к мембранам из полых волокон примера 1 было равно одному.
С другой стороны, отдельно изготовленный модульный корпус мини-модуля сравнительного примера 2 разрезали ультразвуковым дисковым ножом, и мембраны из полых волокон, в которых не было иммобилизовано какое-либо соединение (далее называются «мембраны из полых волокон сравнительного примера»), извлекали, чтобы также подтвердить число прикрепленных тромбоцитов. В результате число прикрепленных тромбоцитов на мембранах из полых волокон сравнительного примера составляло не менее чем 100.
Из этих результатов очевидно, что вышеописанные гидрофильные полимерные соединения способны придавать значительную активность ингибирования адгезии тромбоцитов медицинским устройствам, включая диализатор из полых волокон, или медицинским материалам.
(Измерение времени свертывания цельной крови)
Кровь, сданную добровольцем, и лимонную кислоту смешивали в объемном соотношении 9/1, чтобы приготовить кровь с добавкой лимонной кислоты.
В кювету (комплект для исследования неактивированного свертывания крови) помещали 18 мкл физиологического раствора соли и добавляли 14,8 мкл иминодиуксусной кислоты, после чего дополнительно добавляли 342 мкл крови с добавкой лимонной кислоты. После этого осуществляли измерения, используя анализатор свертывания крови/функции тромбоцитов Sonoclot фирмы IMI, чтобы определить момент начала реакции как время свертывания цельной крови. Время свертывания цельной крови, сданной добровольцем, составляло 545 секунд.
Время свертывания цельной крови составляло 531, 746 и 849 секунд соответственно, когда такие же измерения осуществляли, используя растворы 2, 10 и 20 мкМ аргатробана (растворитель: смесь метанола и хлористоводородной кислоты в объемном соотношении 4/1) соответственно вместо физиологического раствора соли.
Время свертывания цельной крови составляло 527, 693 и 730 секунд соответственно, когда такие же измерения осуществляли, используя водные растворы 0,3, 1,3 и 2,5 мкМ соединения примера 1 соответственно вместо физиологического раствора соли.
(Пример 14: связывание сополимера винилацетата и винилпирролидона с аргатробаном)
В пробирку с завинчивающейся крышкой помещали 14,9 г тетрагидрофурана, 11,5 г винилацетата, 10,8 г N-винилпирролидона, 0,028 г 2-аминоэтантиола и 0,016 г азобисизобутиронитрила, и после герметизации пробирки с завинчивающейся крышкой на полученную смесь воздействовали ультразвуком в течение 10 минут. Затем пробирку с завинчивающейся крышкой разгерметизировали, через смесь пропускали пузырьки газообразного аргона в течение 10 минут и после повторной герметизации пробирки с завинчивающейся крышкой пробирку с завинчивающейся крышкой погружали в баню с горячей водой при температуре 60°C для перемешивания в течение 1 часа и затем выдерживали в бане с горячей водой при температуре 70°C в течение 6 часов для сополимеризации винилацетата и винилпирролидона. К полученному реакционному раствору добавляли 80 мл метанола и полученную смесь добавляли в приблизительно пятикратное количество эфира, после чего отделяли надосадочную жидкость. После трехкратного повторения операции промывки, в которой добавляли новые порции эфира и отделяли надосадочную жидкость, осадок сушили при пониженном давлении, чтобы получить сополимер винилацетата и винилпирролидона. Полученный сополимер винилацетата и винилпирролидона исследовали методом спектроскопии ЯМР1H (растворитель CDCl3) и определяли 60,6 мол.% звеньев винилпирролидона.
Раствор сополимера винилацетата и винилпирролидона в безводном DMF готовили, растворяя 3,58 г полученного сополимера винилацетата и винилпирролидона в 20 мл безводного DMF. Всю массу полученного раствора сополимера винилацетата и винилпирролидона раствор в безводном DMF и 0,5 мл раствора гидрохлорида аргатробана в безводном DMF (0,49 М) помещали в двугорлую колбу и в нее добавляли 0,5 мл раствора DCC в безводном DMF (1,04 М) и 0,5 мл раствора HOBt в безводном DMF (1,02 М) соответственно при охлаждении льдом и перемешивании, после чего оставляли реагировать в атмосфере азота при комнатной температуре в течение 3 суток. Затем реакционный раствор помещали в трубку для диализа SPECTRAPORE RC (PORE 6, отсечка молекулярной массы 1000) и проводили диализ в течение 3 суток против дистиллированной воды с более чем десятикратным объемом, надлежащим образом вытесняя дистиллированную воду. Реакционный раствор после диализа фильтровали и растворитель из фильтрата испаряли, используя роторный испаритель, после чего сушили остаток ночь в вакуумной сушилке, чтобы получить гидрофильное полимерное соединение (далее называется «соединение примера 14»).
(Измерение антитромбиновой активности соединения примера 14)
Антитромбиновую активность раствора соединения примера 14 в метаноле (концентрация: 20 мас.%) измеряли таким же образом, как измеряли антитромбиновую активность соединения примера 1, и вычисленную концентрацию 104,1 м.д. в пересчете на аргатробан раствора соединения примера 14 в метаноле определяли как значение, показывающее антитромбиновую активность раствора соединения примера 14 в метаноле.
Из данных результатов очевидно, что вышеописанные гидрофильные полимерные соединения способны увеличивать время свертывания цельной крови по сравнению с аргатробаном, который обладает известной антитромбиновой активностью, даже если концентрации гидрофильных полимерных соединений являются очень низкими, и гидрофильные полимерные соединения способны придавать превосходную антикоагулянтную активность медицинским устройствам, включая диализатор из полых волокон, или медицинским материалам.
(Промышленная применимость)
Настоящее изобретение можно использовать для придания превосходной антикоагулянтной активности медицинским устройствам, включая диализатор из полых волокон, или медицинским материалам.
(Список условных обозначений)
1a, 1b - Порты для ввода и вывода крови
2a, 2b - Порты для ввода и вывода диализата
3 - Модульный корпус
4 - Мембрана из полых волокон PMMA
5 - Герметизирующий материал
6 - Мини-модуль
7a, 7b - Силиконовые трубки
8 - Перистальтический насос
9 - Соединительная деталь
10 - Круглая трубка из полистирола
Реферат
Изобретение относится к области органической химии, а именно к гидрофильному полимерному соединению, включающему полимерное соединение, которое ингибирует адгезию тромбоцитов, и соединение, которое ингибирует реакцию свертывания крови, ковалентно связанное с указанным полимерным соединением, где указанное полимерное соединение, которое ингибирует адгезию тромбоцитов, представляет собой сополимер мономеров, выбранных из группы, которую составляют винилацетат, винилпирролидон и силоксан, при этом указанный сополимер имеет аминогруппу для образования ковалентной связи с соединением, которое ингибирует свертывание крови; и где соединение, которое ингибирует реакцию свертывания крови, представляет собой соединение, выраженное общей формулой (I), где Rпредставляет собой (2R,4R)-4-алкил-2-карбоксипиперидино группу, Rпредставляет собой 1,2,3,4-тетрагидрохинолин, замещенный низшей алкильной группой. Также изобретение относится к средству для обработки поверхности медицинских устройств или медицинских материалов на основе гидрофильного полимерного соединения. Технический результат: получено новое гидрофильное полимерное соединение, обладающее полезными свойствами. 3 н. и 5 з.п. ф-лы, 3 ил., 2 табл., 14 пр.
Формула
полимерное соединение, которое ингибирует адгезию тромбоцитов,
и соединение, которое ингибирует реакцию свертывания крови, ковалентно связанное с указанным полимерным соединением,
где указанное полимерное соединение, которое ингибирует адгезию тромбоцитов, представляет собой сополимер мономеров, выбранных из группы, которую составляют винилацетат, винилпирролидон и силоксан, при этом указанный сополимер имеет аминогруппу для образования ковалентной связи с соединением, которое ингибирует свертывание крови;
и где соединение, которое ингибирует реакцию свертывания крови, представляет собой соединение, выраженное общей формулой (I):

где R1 представляет собой (2R,4R)-4-алкил-2-карбоксипиперидино группу, R2 представляет собой 1,2,3,4-тетрагидрохинолин, замещенный низшей алкильной группой.

Комментарии