Способ и устройство для объединения хирургического лечения катаракты с хирургическим лечением глаукомы или астигматизма - RU2580749C2
Код документа: RU2580749C2
Чертежи


















Описание
УРОВЕНЬ ТЕХНИКИ
Настоящий патентный документ относится к методам, устройствам и системам для объединения хирургического лечения катаракты с хирургическим лечением глаукомы или астигматизма.
Хирургическое лечение катаракты является одной из наиболее часто выполняемых офтальмологических операций. Основной целью хирургического лечения катаракты является удаление дефектного хрусталика и замена искусственным хрусталиком или интраокулярной линзой (IOL), который(ая) восстанавливает некоторые из оптических характеристик дефектного хрусталика. В общем, линза IOL способна улучшить пропускание света и уменьшить рассеяние, поглощение или и то и другое.
Широко применяемая форма хирургического лечения катаракты предусматривает факоэмульсификацию. В процессе хирургического вмешательства данного типа, в хрусталик глаза входят через разрез факоэмульсификационный зонд. Зонд генерирует ультразвук, который разбивает хрусталик на мелкие фракции, что приводит к его эмульсификации. Следует отметить, что данная операция оставалась, в основном, неизменной в течение последних двадцати лет. В процессе хирургического лечения катаракты, основанной на факоэмульсификации, выполняют последовательность отдельных хирургических манипуляций, содержащих (1) разрез роговицы и парацентез; (2) введение вискоэластика для сохранения общей структуры передней камеры и предотвращения ее разрушения; (3) разрез передней капсулы; (4) создание разрыва передней капсулы; (5) гидродиссекцию ядра хрусталика; (6) фрагментацию ядра хрусталика механическими и ультразвуковыми способами; (7) аспирацию ядра хрусталика; (8) введение вискоэластика в капсулу хрусталика; (9) аспирацию кортикальных масс хрусталика; (10) введение и позиционирование интраокулярной линзы; (11) удаление вискоэластика; и (12) исследование целостности роговичной раны, возможного места наложения шва. Некоторые из упомянутых этапов необходимы из-за того, что, во время хирургической операции глаза, глаз вскрыт, и в него физически вводят инструменты для дробления и удаления хрусталика.
Хирургическое лечение катаракты, выполняемое упомянутым способом, предусматривает высокую квалификацию хирурга и применение специализированного оборудования и расходных материалов, многие из которых требуют поддержки операционной сестры. Поскольку каждый этап является отдельным от остальных, то, возможно, было бы трудно оптимально координировать этапы между собой во время операции.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Вкратце и, в общем, осуществление настоящего изобретения содержит способ комплексной офтальмологической хирургии, содержащий следующие этапы: определяют целевую область при катаракте в хрусталике глаза; подают лазерные импульсы для лечения катаракты, чтобы выполнить фотодеструкцию участка определенной целевой области при катаракте; определяют целевую область при глаукоме в периферической области глаза; и подают лазерные импульсы для лечения глаукомы, чтобы создать, один или более разрезов в целевой области при глаукоме посредством фотодеструкции; при этом, этапы способа выполняют в рамках комплексной хирургической операции.
В некоторых вариантах осуществления этап подачи лазерных импульсов для лечения катаракты выполняют перед этапом подачи лазерных импульсов для лечения глаукомы.
В некоторых вариантах осуществления этап подачи лазерных импульсов для лечения катаракты выполняют после этапа подачи лазерных импульсов для лечения глаукомы.
В некоторых вариантах осуществления этап подачи лазерных импульсов для лечения катаракты выполняют, по меньшей мере, частично, одновременно с этапом подачи лазерных импульсов для лечения глаукомы.
В некоторых вариантах осуществления этап подачи лазерных импульсов для лечения глаукомы может содержать подачу лазерных импульсов в, по меньшей мере, что-то одно из склеры, лимбальной области, участка угла глаза или корня радужной оболочки.
В некоторых вариантах осуществления этап подачи лазерных импульсов для лечения глаукомы может содержать подачу лазерных импульсов в соответствии с картиной, связанной с, по меньшей мере, чем-то одним из трабекулопластики, иридотомии или иридэктомии.
В некоторых вариантах осуществления этап подачи лазерных импульсов для лечения глаукомы может содержать подачу лазерных импульсов для формирования, по меньшей мере, чего-то одного из дренажного канала и отверстия для оттока внутриглазной жидкости.
В некоторых вариантах осуществления способ содержит этап введения имплантируемого устройства во что-то одно из дренажного канала или отверстия для оттока внутриглазной жидкости.
В некоторых вариантах осуществления дренажный канал и отверстие для оттока внутриглазной жидкости формируют с возможностью соединения передней камеры оперируемого глаза с поверхностью оперируемого глаза, что допускает снижение внутриглазного давления внутриглазной жидкости в оперируемом глазу.
Некоторые варианты осуществления могут содержать использование одного лазера для подачи как лазерных импульсов для лечения катаракты, так и лазерных импульсов для лечения глаукомы.
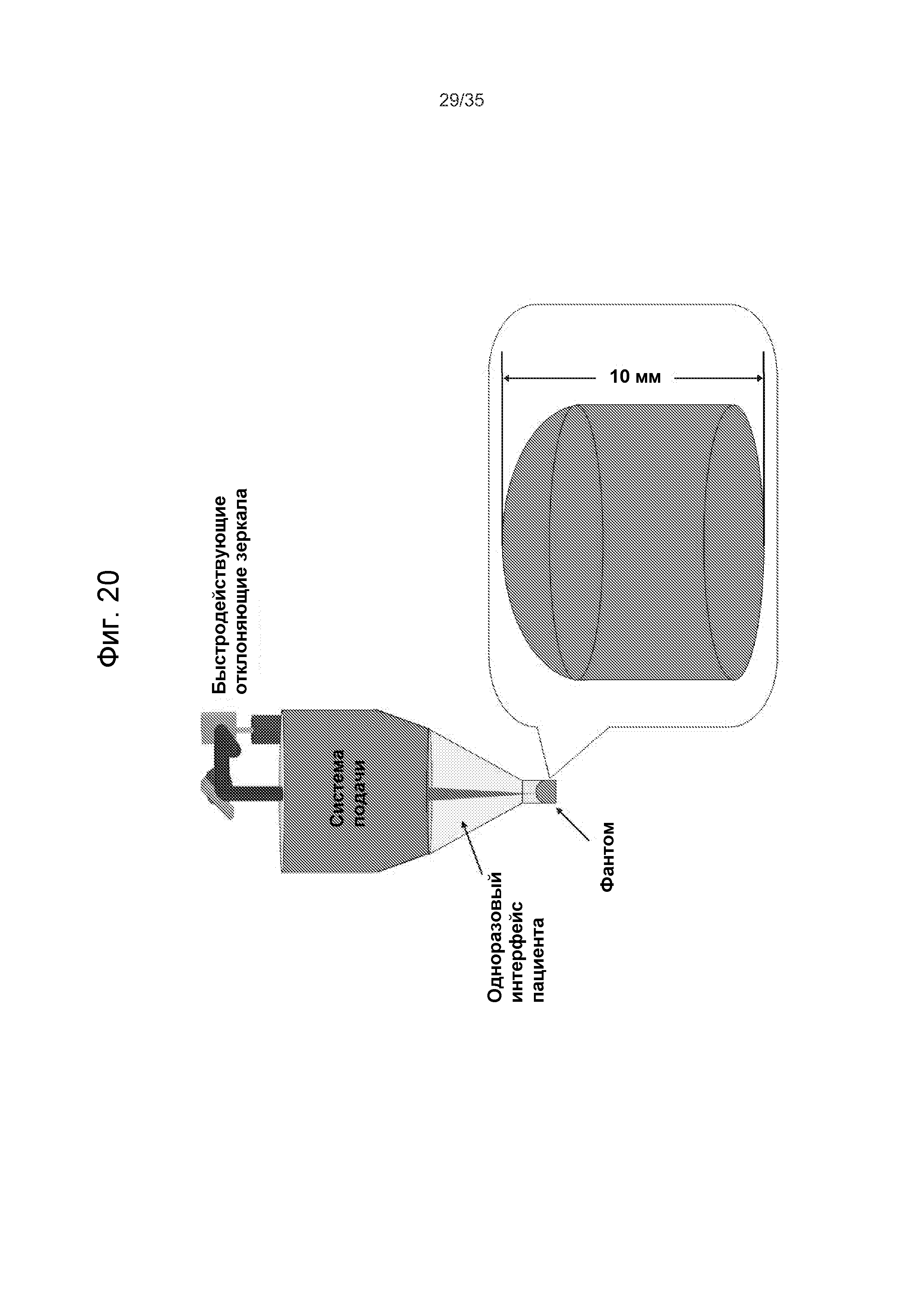
В некоторых вариантах осуществления этап подачи лазерных импульсов для лечения глаукомы содержит: подачу лазерных импульсов для лечения глаукомы в оптимизированную целевую область при глаукоме, при этом, местоположение оптимизированной целевой области при глаукоме выбирают для меньшего рассеивания лазерных импульсов для лечения глаукомы, чем в склере глаза, и меньшего нарушения оптического пути глаза сформированным дренажным каналом, чем центрально сформированным дренажным каналом.
В некоторых вариантах осуществления целевая область при глаукоме является какой-то одной из граничной области между лимбом и склерой или области пересечения лимба и роговицы.
В некоторых вариантах осуществления этап подачи лазерных импульсов для лечения глаукомы содержит: подачу лазерных импульсов для лечения глаукомы для формирования дренажного канала в направлении, выбранном для оптимизации конкурирующих требований меньшего рассеивания лазерных импульсов для лечения глаукомы, чем в склере глаза, и меньшего нарушения оптического пути глаза сформированным дренажным каналом, чем центрально сформированным дренажным каналом.
В некоторых вариантах осуществления определение места подачи лазерных импульсов для лечения катаракты и место подачи лазерных импульсов для лечения глаукомы можно выполнять скоординированным способом.
В некоторых вариантах осуществления способ может содержать формирование изображений фотодеструкции, выполняемой лазерными импульсами для лечения катаракты; и определение, по меньшей мере, участков целевой области при глаукоме по отображаемой фотодеструкции.
В некоторых вариантах осуществления способ может содержать формирование изображений фотодеструкции, выполняемой лазерными импульсами для лечения глаукомы; и определение, по меньшей мере, участков целевой области при катаракте по отображаемой фотодеструкции.
В некоторых вариантах осуществления лазерные импульсы для лечения катаракты подают с длиной волны λ-c лазера для лечения катаракты; и лазерные импульсы для лечения глаукомы подают с длиной волны λ-g лазера для лечения глаукомы.
В некоторых вариантах осуществления лазерные импульсы для лечения катаракты подают посредством интерфейса пациента с катарактой; и лазерные импульсы для лечения глаукомы подаются посредством интерфейса пациента с глаукомой.
В некоторых вариантах осуществления универсальная (многоцелевая) офтальмологическая хирургическая система может содержать универсальный лазер, выполненный с возможностью подачи лазерных импульсов для лечения катаракты в целевую область при катаракте и подачи лазерных импульсов для лечения глаукомы в целевую область при глаукоме; и систему формирования изображений, выполненную с возможностью формирования изображений фотодеструкции, создаваемой, по меньшей мере, какими-то одними из лазерных импульсов для лечения катаракты и лазерных импульсов для лечения глаукомы.
В некоторых вариантах осуществления универсальная офтальмологическая хирургическая система выполнена с возможностью подачи лазерных импульсов для лечения катаракты с длиной волны λ-c лазера для лечения катаракты и подачи лазерных импульсов для лечения глаукомы с длиной волны λ-g лазера для лечения глаукомы.
В некоторых вариантах осуществления универсальный лазер выполнен с возможностью подачи лазерных импульсов для лечения катаракты посредством интерфейса пациента с катарактой и подачи лазерных импульсов для лечения глаукомы посредством интерфейса пациента с глаукомой.
В некоторых вариантах осуществления универсальная офтальмологическая хирургическая система выполнена с возможностью подачи лазерных импульсов для лечения катаракты и лазерных импульсов для лечения глаукомы одним лазером.
В некоторых вариантах осуществления способ комплексной офтальмологической хирургии может содержать следующие этапы: определяют целевую область при катаракте в хрусталике глаза; подают лазерные импульсы для лечения катаракты, чтобы выполнить фотодеструкцию участка определенной целевой области при катаракте; определяют целевую область при астигматизме в центральной, средней или периферической области глаза; и подают лазерные импульсы для коррекции астигматизма, чтобы создать, по меньшей мере, один разрез в целевой области при астигматизме посредством фотодеструкции; при этом, этапы способа выполняют в течение комплексной хирургической операции.
В некоторых вариантах осуществления способ может содержать формирование изображений фотодеструкции, выполняемой лазерными импульсами для лечения катаракты; и определяют, по меньшей мере, участки целевой области при астигматизме по отображенной фотодеструкции.
В некоторых вариантах осуществления универсальная офтальмологическая хирургическая система может содержать универсальный лазер, выполненный с возможностью подачи лазерных импульсов для лечения катаракты в целевую область при катаракте и подачи лазерных импульсов для коррекции астигматизма в целевую область при астигматизме; и систему формирования изображений, выполненную с возможностью формирования изображений фотодеструкции, создаваемой, по меньшей мере, какими-то одними из лазерных импульсов для лечения катаракты и лазерных импульсов для коррекции астигматизма.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
Фиг.1 - изображение глаза.
Фиг.2 - изображение ядра глаза.
Фиг.3 - пояснение способа фотодеструкции.
Фиг.4 - пояснение применения хирургического лазера на этапе 320a-b.
Фиг.5A-G - пояснение создания разрезов роговицы и капсулы и введения линзы IOL.
Фиг.6A-G - пояснение различных осуществлений хирургического лечения катаракты, объединенной с хирургическим лечением глаукомы или астигматизма.
Фиг.7 - пример лазерной хирургической системы с управлением по изображениям, в которой обеспечен модуль формирования изображений для обеспечения формирования изображений целевого объекта для устройства управления лазером.
Фиг.8-16 - примеры лазерной хирургической системы с управлением по изображениям, с изменением степеней интегрирования лазерной хирургической системы и системы формирования изображений.
Фиг.17 - пример способа выполнения лазерной хирургической операции с использованием лазерной хирургической системы с управлением по изображениям.
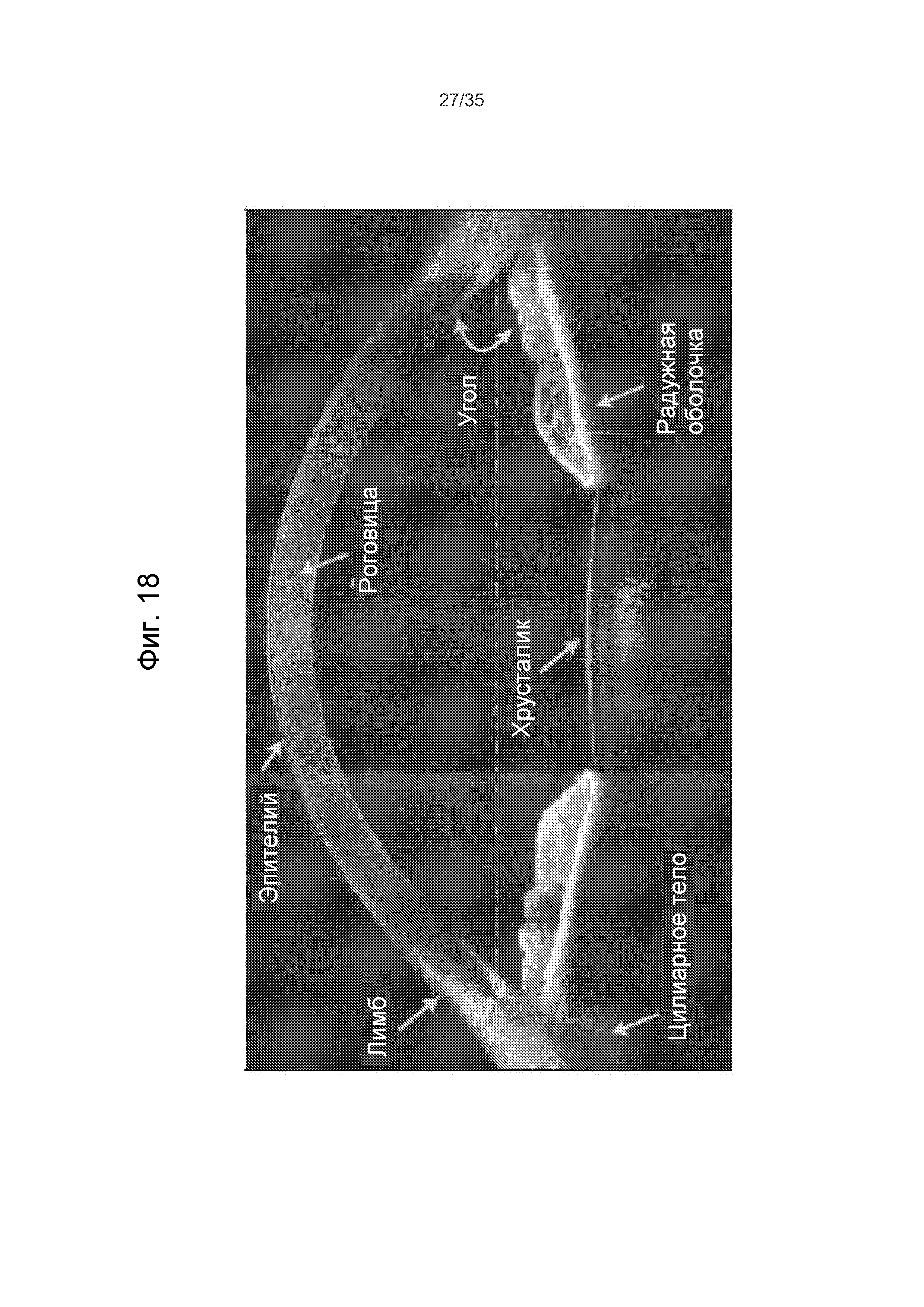
Фиг.18 - пример изображения глаза, полученного модулем формирования изображений методом оптической когерентной томографии (ОКТ).
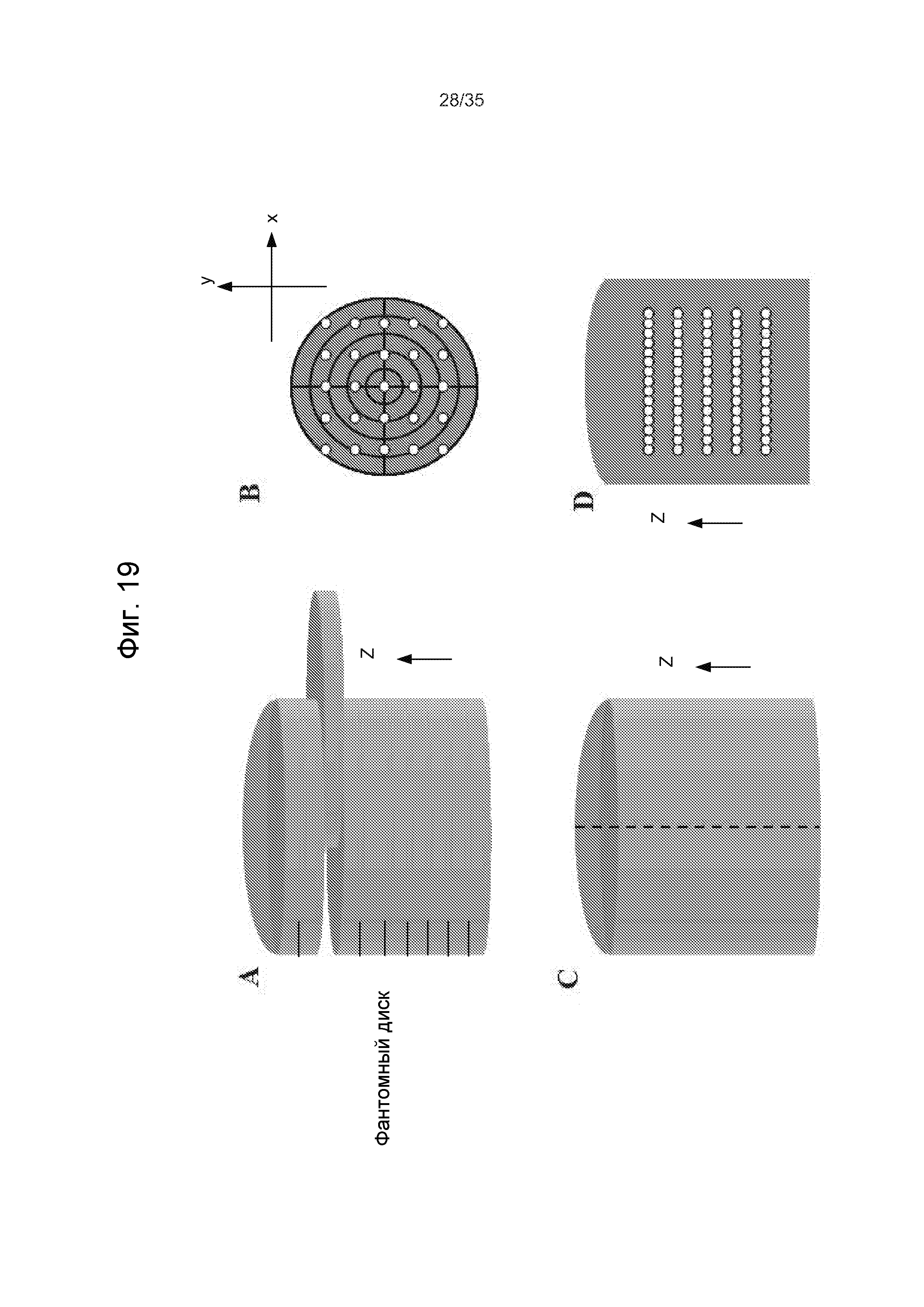
Фиг.19A-D - два примера калибровочных образцов для калибровки лазерной хирургической системы с управлением по изображениям.
Фиг.20 - пример закрепления материала калибровочного образца к интерфейсу пациента в лазерной хирургической системе с управлением по изображениям, для калибровки системы.
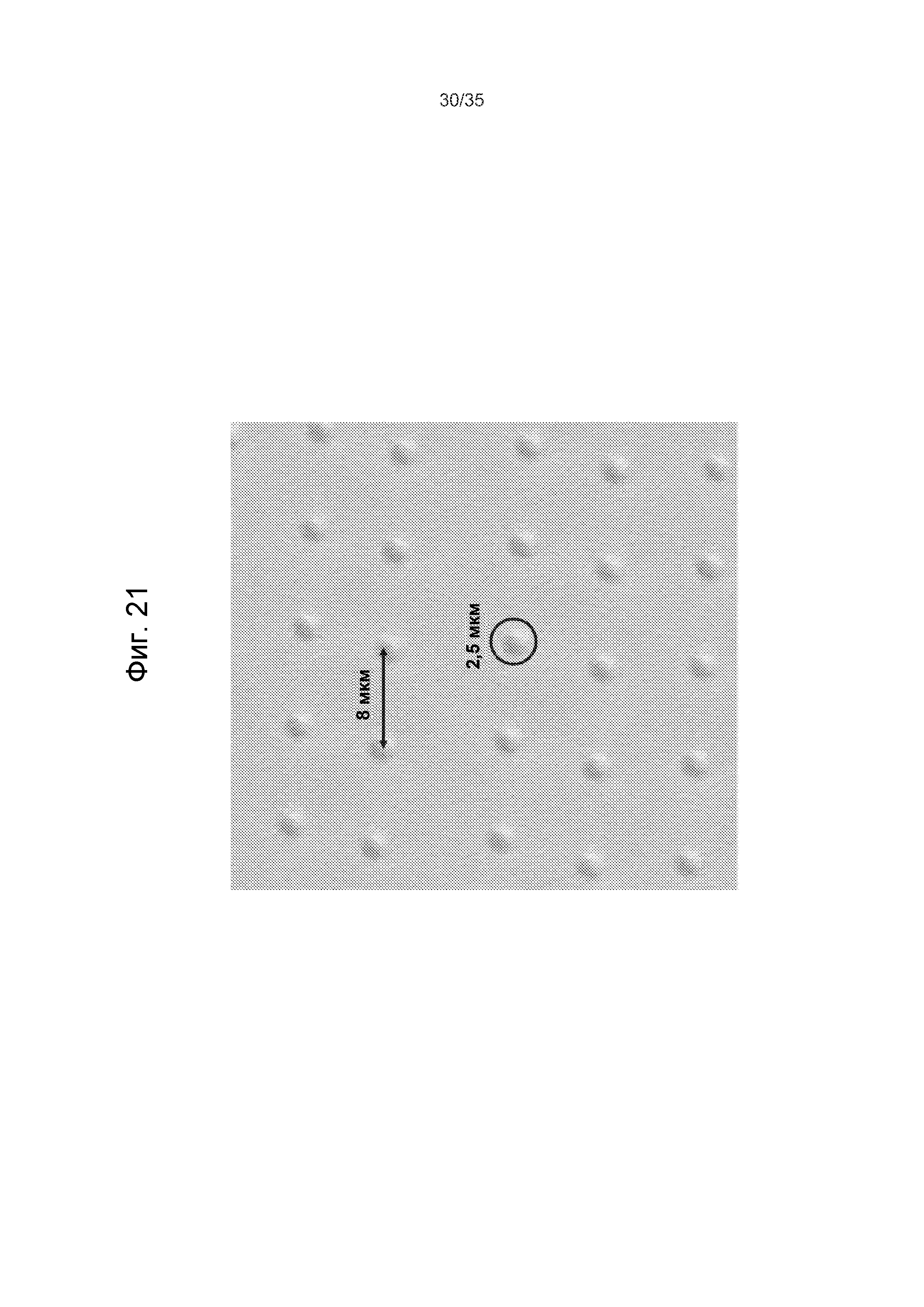
Фиг.21 - пример реперных отметок, созданных хирургическим лазерным пучком на стеклянной поверхности.
Фиг.22 - пример способа калибровки и хирургической операции после калибровки лазерной хирургической системы с управлением по изображениям.
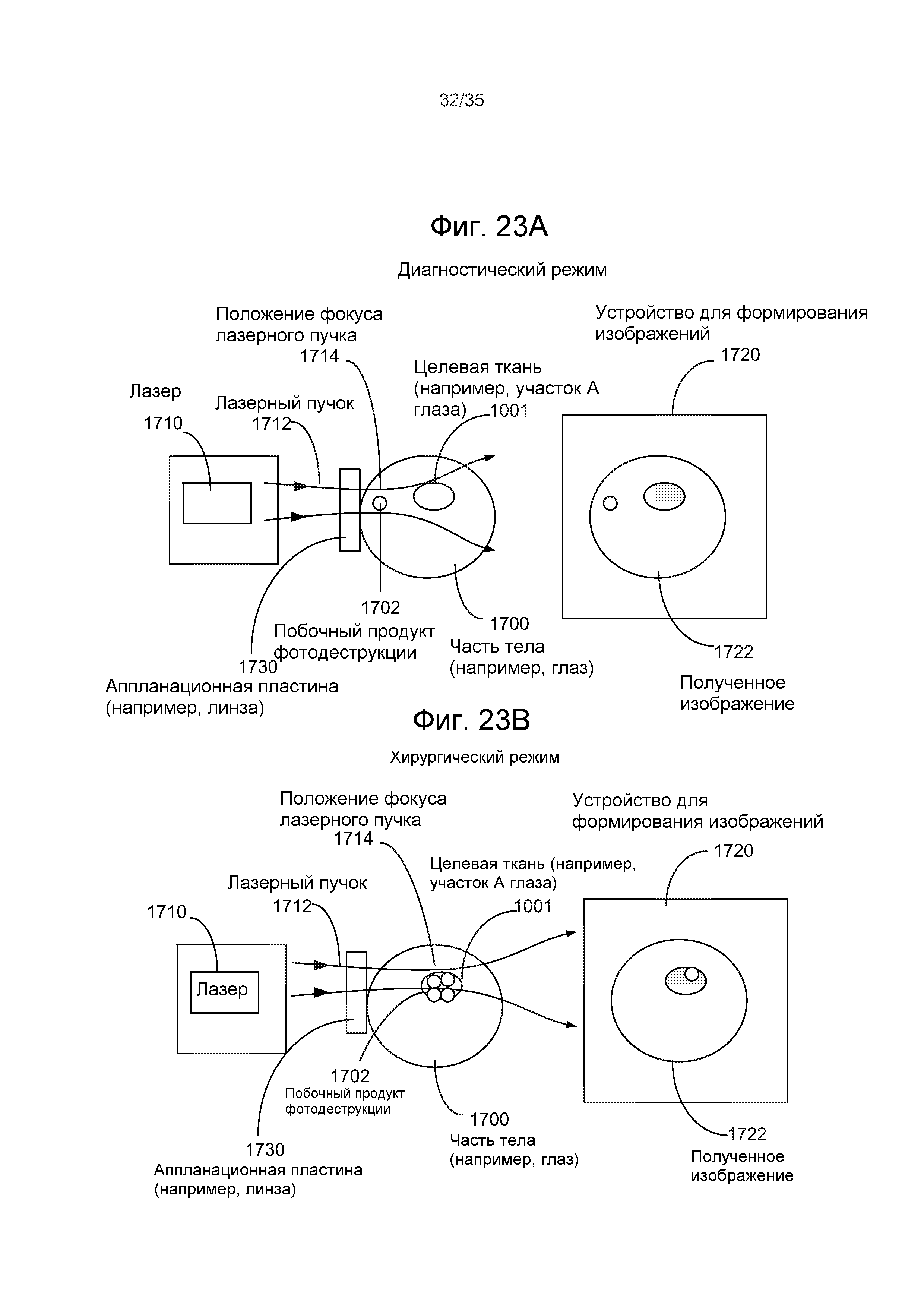
Фиг.23A-B - два режима работы примерной лазерной хирургической системы с управлением по изображениям, которая захватывает изображения побочного продукта лазерной фотодеструкции и целевой ткани для управления настройкой лазера.
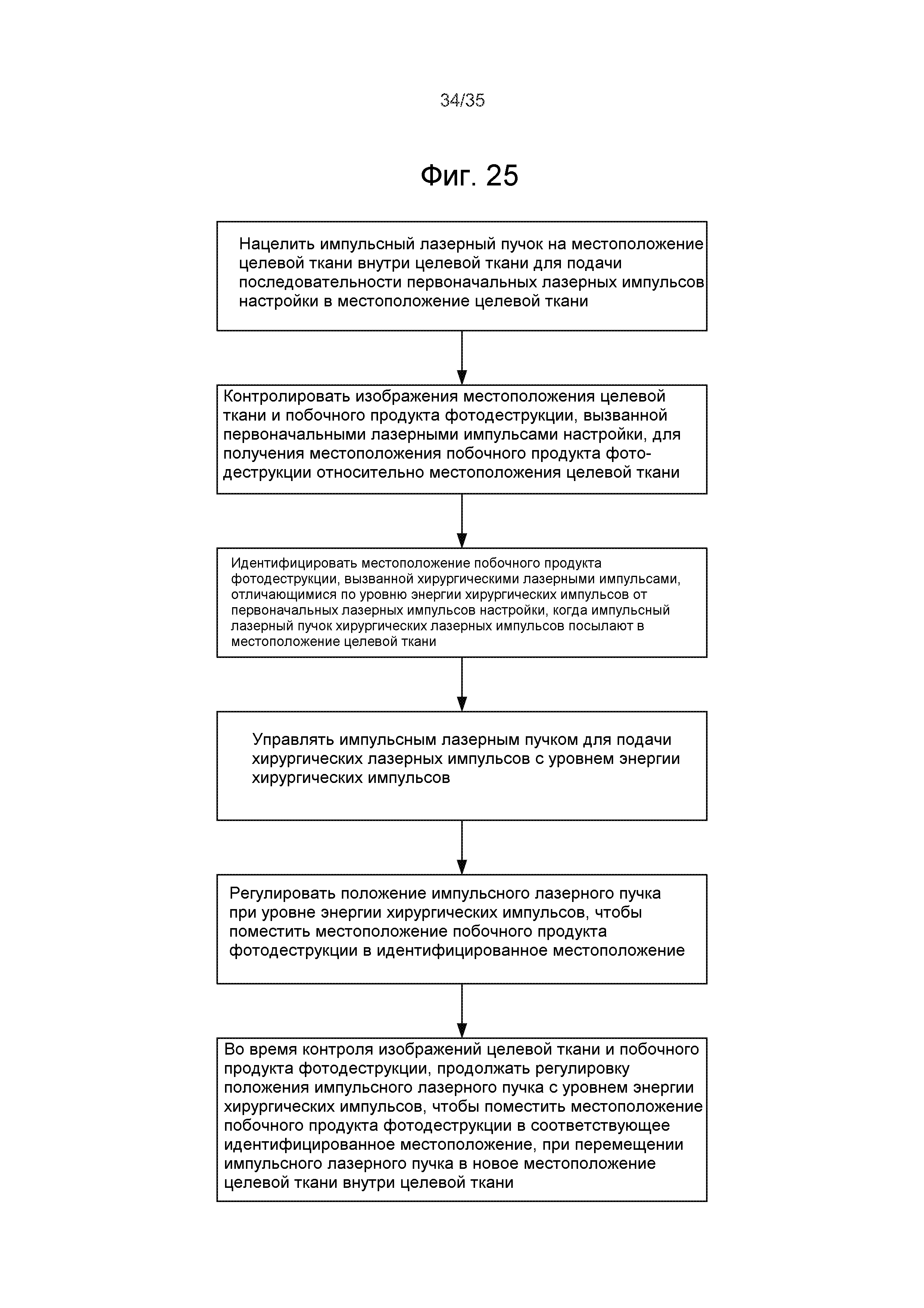
Фиг.24-25 - примеры операций настройки лазера в лазерных хирургических системах с управлением по изображениям.
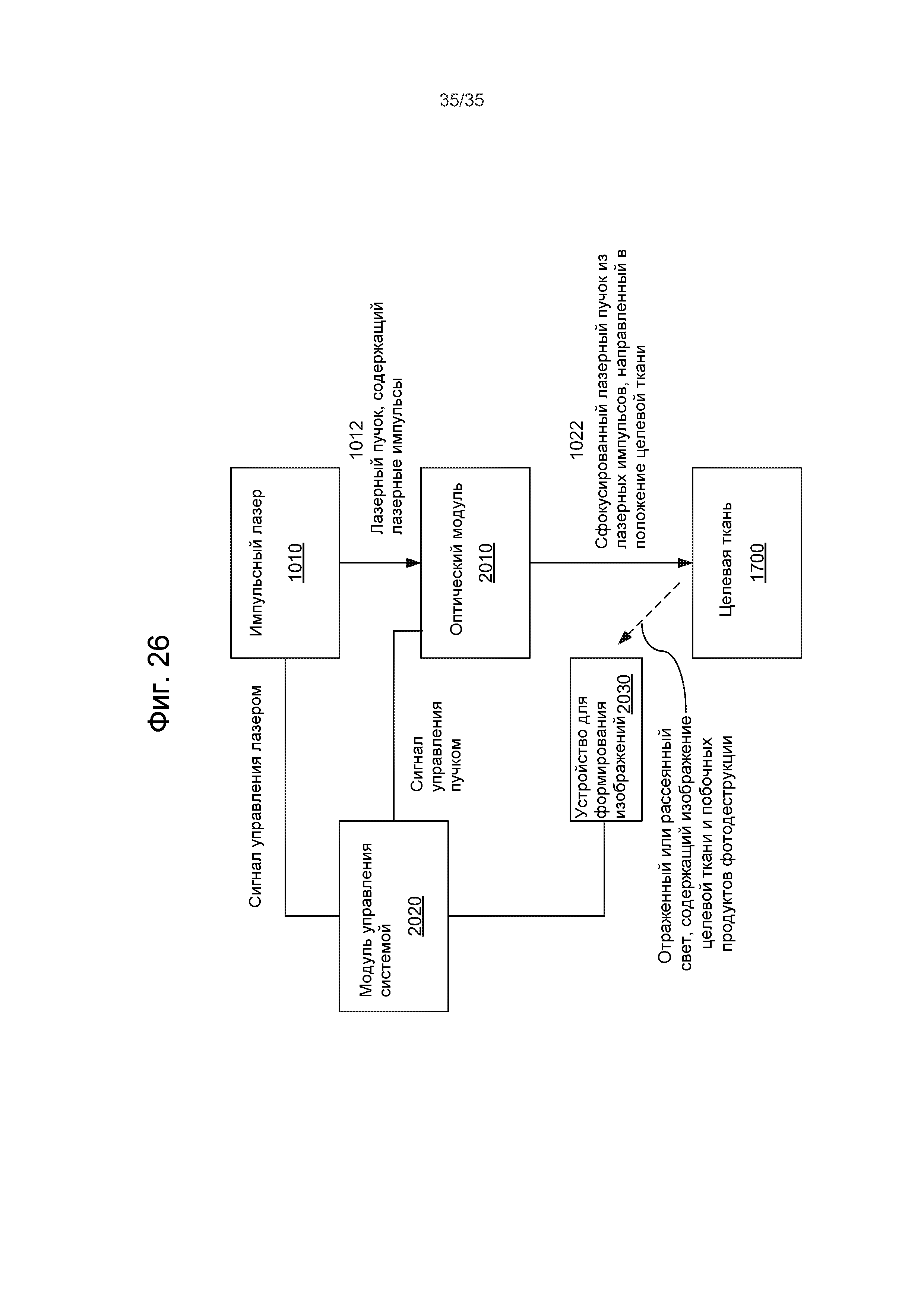
Фиг.26 - примерная лазерная хирургическая система с настройкой лазера с использованием изображения побочного продукта фотодеструкции.
ПОДРОБНОЕ ОПИСАНИЕ
На Фиг.1 представлено общее строение глаза 1. Падающий свет распространяется по оптическому пути, который содержит роговицу 140, зрачок 160, ограниченный радужной оболочкой 165, хрусталик 100 и стекловидное тело. Данные оптические элементы направляют свет на сетчатку 170.
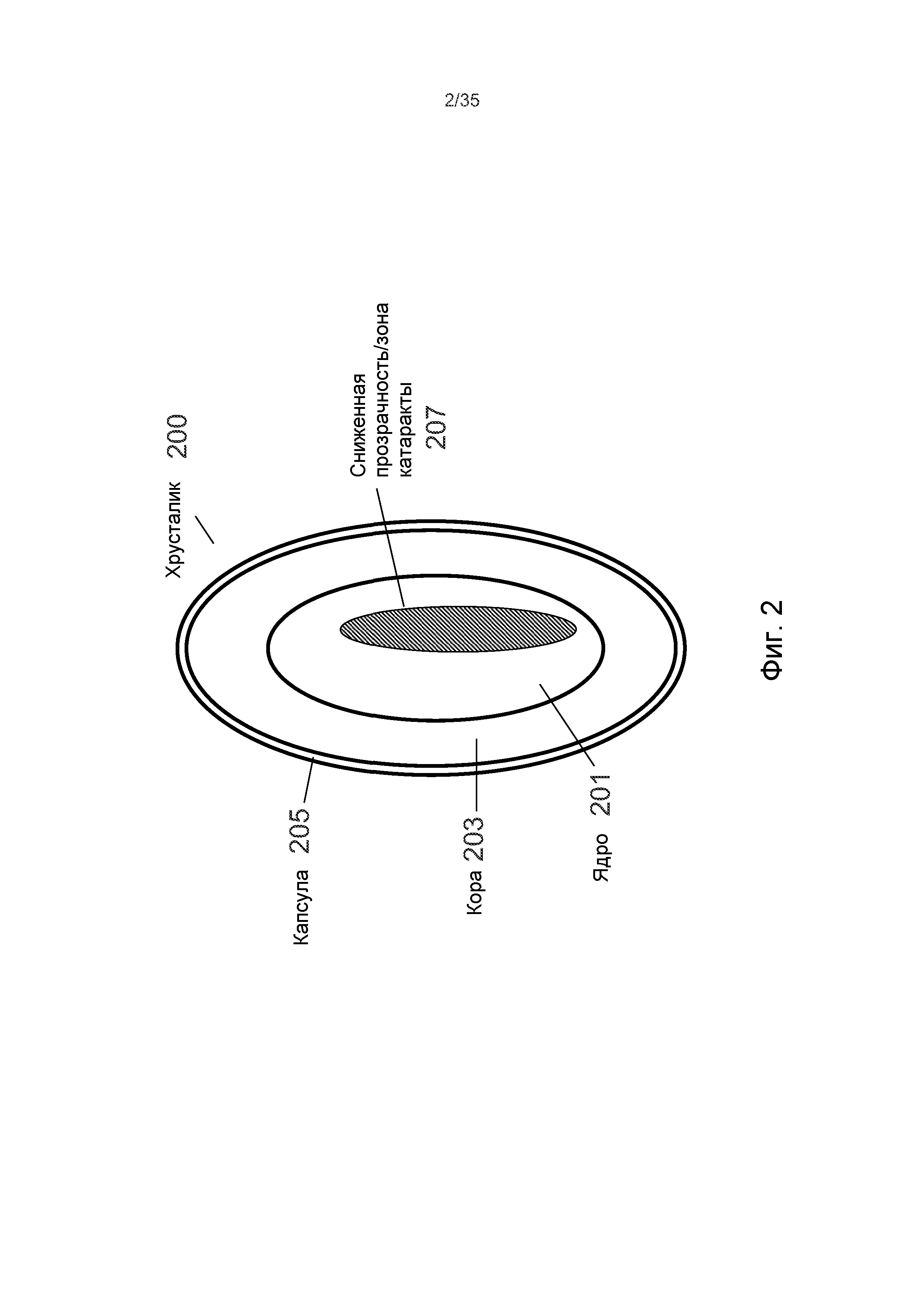
На Фиг.2 приведено более подробное изображение хрусталика 200. Хрусталик 200 иногда называют кристаллическим из-за α, β и γ кристаллических белков, которые составляют, приблизительно, 90% хрусталика. Кристаллический хрусталик обеспечивает несколько оптических функций в глазу, в том числе, его динамическую фокусирующую способность. Хрусталик является особой тканью человеческого организма, в котором хрусталик продолжает увеличиваться в размере в период беременности, после рождения и в течение всей жизни. Хрусталик растет путем образования новых волокнистых клеток хрусталика, с началом от зародышевого ядра, находящегося на экваториальной периферии хрусталика. Волокна хрусталика являются длинными тонкими прозрачными клетками с диаметрами, обычно, в диапазоне 4-7 микрометров и длинами до 12 мм. Самые старые волокна хрусталика расположены по центру внутри хрусталика, с формированием ядра. Ядро 201 можно дополнительно подразделить на эмбриональную, фетальную и зрелую зоны ядра. Новообразование вокруг ядра 201, называемое корой 203, развивается концентрическими эллипсоидальными слоями, областями или зонами. Поскольку ядро 201 и кора 203 формируются на разных стадиях развития человека, то их оптические характеристики различаются. Хотя диаметр хрусталика увеличивается со временем, хрусталик может также уплотняться, и поэтому свойства ядра 201 и окружающей коры 203 могут различаться еще значительнее (Freel et al BMC Ophthalmology 2003, vol. 3, p. 1).
В результате вышеописанного сложного процесса роста, типичный хрусталик 200 содержит более твердое ядро 201, аксиально продолжающееся, приблизительно, на 2 мм, окруженное более мягкой корой 203 с аксиальной шириной 1-2 мм, заключенное в намного более тонкую капсульную сумку 205 с типичной шириной, приблизительно, 20 микрометров. Приведенные значения могут значительно различаться от человека к человеку.
Волокнистые клетки хрусталика постепенно теряют эндоплазматические элементы с течением времени. Поскольку никакие кровеносные или лимфатические сосуды не достигают хрусталика для питания его внутренней зоны, то с приближением старости иногда ухудшаются оптическая прозрачность, гибкость и другие функциональные свойства хрусталика.
На Фиг.2 показано, что, в некоторых обстоятельствах, включая долговременное облучение ультрафиолетовым излучением, воздействие излучения вообще, денатурирование белков хрусталика, вторичные эффекты заболеваний типа диабета, гипертензии и старения, область ядра 201 может становиться областью 207 с пониженной прозрачностью. Область 207 с пониженной прозрачностью является, обычно, центрально расположенной областью хрусталика (Sweeney et al Exp Eye res, 1998, vol. 67, p. 587-95). Упомянутая потеря прозрачности часто коррелируется с развитием катаракты наиболее распространенного типа в той же области, а также с повышением жесткости хрусталика. Данный процесс может происходить с приближением старости постепенно от периферического к центральному участку линзы (Heys et al Molecular Vision 2004, vol. 10, p. 956-63). Одним результатом данных изменений является развитие старческой дальнозоркости и катаракты, которая усиливается по тяжести и широте распространения с возрастом.
Целью хирургического лечения катаракты является удаление данной непрозрачной области с пониженной прозрачностью, области катаракты. Во многих случаях, при этом необходимо удалить всю внутреннюю область хрусталика, с оставлением только капсулы хрусталика.
Как упоминалось в разделе уровня техники, хирургическому лечению катаракты на основе факоэмульсификации могут быть свойственны различные ограничения. Например, упомянутая ультразвуковая хирургия может создавать в роговице разрезы, которые не легко контролировать по размеру, форме и местоположению, что приводит к недостаточной самогерметизации раны. Работа с неконтролируемыми разрезами может потребовать наложения швов. Метод факоэмульсификации требует также выполнения большого разреза на капсуле, иногда, до 7 мм. Операция может сопровождаться обширными непреднамеренными модификациями: оперированный глаз может проявлять большой астигматизм и остаточную или вторичную погрешность рефракции или другую погрешность. Данная погрешность часто требует последующей рефракционной или другой хирургической операции или устройства. Кроме того, ткань радужной оболочки может быть разорвана зондом, или операция может вызвать пролапс ткани радужной оболочки в ране. Доступ к раздробленному материалу хрусталика может быть сложным, и имплантация линзы IOL может представлять трудную задачу. Ультразвуковая хирургическая операция может также приводить к нежелательному повышению глазного давления вследствие остаточных виксоэластичных препаратов, которые блокируют дренажные каналы глаза. Кроме того, данные операции могут приводить к неоптимальным центрированию, формам или размерам отверстий в капсуле, что может осложнять удаление материала хрусталика и/или ограничивать точность позиционирования и размещение линзы IOL в глазу.
Две причины вышеупомянутых затруднений и осложнений состоят в том, что дробление хрусталика выполняют (i) посредством вскрытия глаза, и (ii) за большое число отдельных этапов, каждый из которых требует введения или извлечения инструментов, с оставлением глаза вскрытым между данными этапами.
Приведенные и другие ограничения и сопутствующие риски в процессе хирургического лечения катаракты с использованием факоэмульсификации привели к разработке операций для лечения катаракты без выполнения разреза в глазу. Например, в патенте США 6726679 предложен способ устранения помутнения хрусталика посредством направления ультракоротких лазерных импульсов на местоположения помутнений в глазу. Однако упомянутый, ранее предложенный способ не принимает во внимание некоторые сложности управления хирургическим процессом. Кроме того, полезность данного способа ограничена для случаев, когда состояние глаза вызвано проблемами, отличающимися от непрозрачности хрусталика. Например, в случае сопутствующей погрешности рефракции, требовались отдельные процедуры.
Осуществления настоящего изобретения характеризуют способы и устройства для выполнения хирургического лечения катаракты, которые справляются с двумя вышеописанными проблемами. Данные осуществления выполняют разрушение хрусталика (i) без вскрытия глаза, и (ii) за одну комплексную процедуру. Кроме того, данные осуществления обеспечивают надежное управление хирургической процедурой, сокращают возможность ошибки, минимизируют необходимость дополнительной технической поддержки и повышают эффективность хирургии. Способы и устройства для хирургического лечения катаракты, описанные в настоящей заявке, можно осуществлять для удаления хрусталика глаза и объединения удаления хрусталика с другими хирургическими этапами, и выполнения всей процедуры скоординированным и эффективным способом.
Физический вход в глаз можно исключить посредством применения фотодеструкции с использованием, например, коротких лазерных импульсов. Операторы лазеров для офтальмологической хирургии могут подавать лазерный пучок в область хрусталика, намеченную для фрагментации, с высокой точностью. Фрагментацию хрусталика, основанную на фотодеструкции, можно осуществлять в различных конфигурациях, например, в конфигурациях, описанных в патентах США №№: 4538608, 5246435 и 5439462. Способы и устройства, описанные в настоящей заявке, можно применять с обеспечением выполнения данных и других способов фрагментации хрусталика, основанных на фотодеструкции, вместе комплексно с другими хирургическими этапами, необходимыми в процессе хирургического лечения катаракты, включая этап вскрытия глаза и/или капсулы, этап удаления фрагментированного материала хрусталика и этап введения искусственного хрусталика в свободное пространство, оставленное удаленным фрагментированным материалом.
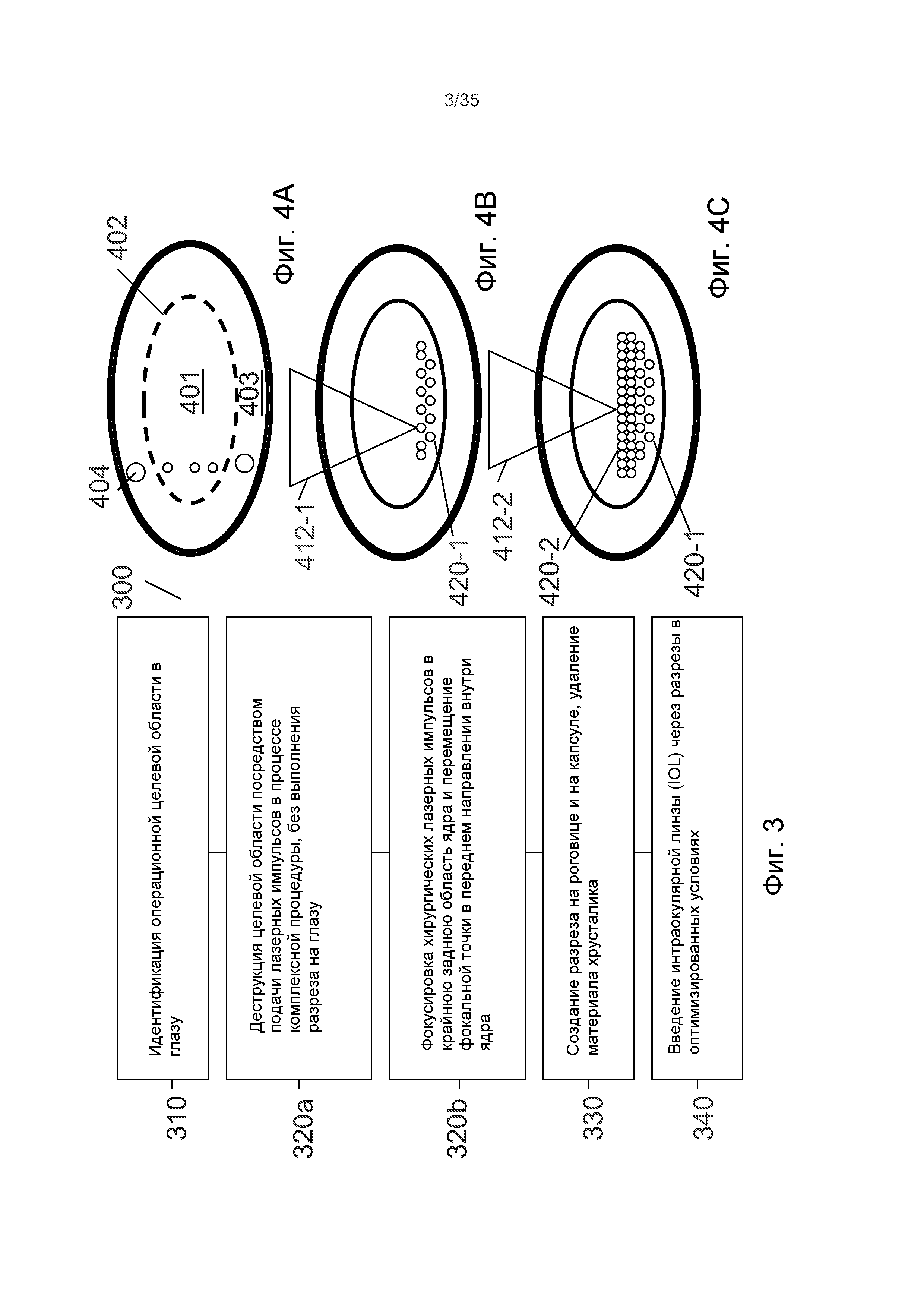
На Фиг.3-4 показано, что, в варианте осуществления 300 настоящих способов, хирургические этапы для удаления катаракты могут содержать следующее.
Этап 310 может содержать определение операционной целевой области в глазу. В нескольких из описанных вариантов осуществления, целевая область может быть ядром или областью, имеющей отношению к ядру, в которой развилась катаракта. В других вариантах осуществления возможно планирование других целевых областей.
На Фиг.4A показано, что, в соответствии с некоторыми особенностями этапа 310, определение операционной целевой области содержит определение границ целевой области, например, границы 402 ядра. Данное определение может содержать создание группы пробных пузырьков 404 внутри хрусталика лазерными импульсами и наблюдение их роста или динамику. Пробные пузырьки увеличиваются быстрее в области коры, которая мягче, а в ядре пробные пузырьки увеличиваются медленнее, так как ядро тверже. Возможно также применение других способов для оценки границы 402 ядра на основании наблюдения пробных пузырьков 404, например, ультразвукового возбуждения и измерения реакции на данное возбуждение. По наблюдаемым росту или динамике пробных пузырьков 404 можно оценить твердость окружающего материала: данный способ эффективен при разделении более жесткого ядра с более мягкой корой, для идентификации, тем самым, границы ядра.
Этап 320a может содержать деструкцию целевой области, без выполнения разреза на глазу. Деструкцию выполняют подачей лазерных импульсов в процессе комплексной процедуры в целевую область.
Одна из особенностей, в связи с которой этап 320a называют комплексной процедурой, состоит в том, что этап 320a обеспечивает результат, эквивалентный пяти этапам вышеописанной ультразвуковой хирургической операции:
(1) Разрез роговицы и парацентез; (3) разрез передней капсулы; (4) создание разрыва передней капсулы; (5) гидродиссекция ядра хрусталика; (6) фрагментация ядра хрусталика механическим и ультразвуковым способами.
Особенности этапа 320a содержат следующее. (i) Поскольку глаз не вскрывают для деструкции хрусталика, то оптический путь не нарушается, и лазерным пучком можно управлять с высокой точностью для поражения предполагаемой целевой области с высокой точностью, (ii) кроме того, поскольку в разрезы глаза не вводят физических объектов, то разрезы не разрываются дополнительно трудноконтролируемым образом, при введении и извлечении физического объекта, (iii) поскольку глаз не вскрывают в процессе деструкции, то хирург не должен работать с жидкостями во вскрытом глазу, которая, в ином случае, истекала бы и нуждалась бы в восполнении, например, введением вязких текучих сред, как на этапе (2) ультразвуковой хирургической операции.
В процессе лазерной фрагментации хрусталика, лазерные импульсы ионизируют участок молекул в целевой области. Ионизация может вызвать лавину вторичных процессов ионизации выше «порога образования плазмы». В процессе многих хирургических процедур, в целевую область передается большое количество энергии короткими импульсами. Данные импульсы концентрированной энергии могут превращать ионизированную область в газ, что приводит к образованию кавитационных пузырьков. Данные пузырьки могут формировать диаметр несколько микрометров и расширяться со сверхзвуковой скоростью до 50-100 микрометров. Когда расширение пузырьков замедляется до субсветовых скоростей, данные пузырьки могут возбуждать в окружающей ткани ударные волны, вызывающие вторичную деструкцию.
Как сами пузырьки, так и возбужденные ударные волны выполняют одну из задач этапа 320a: деструкцию, дефрагментацию или эмульсификацию ядра 201, без выполнения разреза на капсуле 205.
Как отмечено выше, фотодеструкция снижает прозрачность облучаемой области. Если подача лазерных импульсов начинается с фокусировки импульсов во фронтальной или передней области хрусталика, и затем фокус перемещают глубже к задней области, то кавитационные пузырьки и сопутствующая ткань со сниженной прозрачностью может находиться на оптическом пути последующих лазерных импульсов и блокировать, ослаблять или рассеивать данные импульсы. Данное действие может снижать точность и управляемость подачи последующих лазерных импульсов, а также ослаблять импульс энергии, фактически доставляемый в более глубокие задние области хрусталика. Поэтому эффективность процедур лазерной офтальмологической хирургии можно повысить с использованием способов, при которых пузырьки, сформированные прежними лазерными импульсами, не блокировали оптического пути последующих лазерных импульсов.
Один из возможных способов предотвращать загораживание ранее сформированными пузырьками оптического пути подаваемых впоследствии лазерных импульсов заключается в том, чтобы сначала подавать импульсы в крайнюю заднюю область хрусталика и затем перемещать фокальную точку к передним областям хрусталика.
Метод, предложенный в патенте США № 5246435, не принимал во внимание различные проблемы, связанные с сопутствующими процессами. Упомянутые проблемы включают в себя то, что пузырьки, сформированные в коре, часто неконтролируемо распространяются из-за низкой твердости и большей вязкости коры. Следовательно, если лазер направляют на заднюю сторону хрусталика, где находится задний участок коры, то хирург будет создавать пузырьки, которые быстро и неконтролируемо распространяются по большой площади, с высокой вероятностью загораживания оптического пути.
Этап 320b является пояснением усовершенствованного выполнения этапа 320a: посредством фокусировки хирургических лазерных импульсов в крайнюю заднюю область ядра 401 и перемещения фокальной точки в переднем направлении внутри ядра 401.
На Фиг.4B показано, что варианты осуществления настоящего способа используют апроксимированные данные о границах 402 ядра 401, которые получены на этапе 310. Этап 320b предотвращает загораживание ранее сформированными пузырьками оптического пути подаваемых впоследствии лазерных импульсов (например, путем распространения в кору 403) посредством сначала подачи импульсов 412-1 в крайнюю заднюю область 420-1 ядра 401. Затем подают последующие лазерные импульсы 412-2 в область 420-2 в ядре 401, которая является передней относительно области 420-1, в которую первоначально подавали лазерные импульсы 412-1.
Иначе говоря: фокальную точку лазерных импульсов 412 перемещают из задней области к передней области ядра 401.
Особенность этапов 320a и 320b состоит в том, что лазерные импульсы подают с мощностью, которая является достаточно большой для обеспечения требуемой фотодеструкции хрусталика, но не достаточной для вызова деструкции или другого разрушения в других областях, например, в сетчатке. Кроме того, пузырьки размещают достаточно тесно, чтобы вызывать фотодеструкцию, но не настолько тесно, чтобы созданные пузырьки сливались и формировали большой пузырек, который может неконтролируемо разрастаться и распространяться. Пороговую мощность для достижения деструкции можно назвать «порогом деструкции», и пороговую мощность для вызова нежелательного распространения газовых пузырьков можно назвать «порогом распространения».
Вышеописанные верхний и нижний пороги налагают ограничения на параметры лазерных импульсов, например, их мощность и интервал между импульсами. Длительность лазерных импульсов также может иметь аналогичные пороги деструкции и распространения. В некоторых вариантах осуществления длительность может изменяться в диапазоне от 0,01 пикосекунд до 50 пикосекунд. Для некоторых пациентов, определенные результаты получали в диапазоне длительностей импульсов от 100 фемтосекунд до 2 пикосекунд. В некоторых вариантах осуществления энергия лазера на один импульс может изменяться между порогами 1 мкДж и 25 мкДж. Частота повторения лазерных импульсов может изменяться между порогами 10 кГц и 100 МГц.
Энергию, разделение целевых объектов, длительность и частоту повторения лазерных импульсов можно также выбирать на основании предоперационного измерения оптических или структурных характеристик. В альтернативном варианте, выбор энергии лазера и разделения целевых объектов может быть основан на предоперационном измерении общих размеров хрусталика и применении возрастного алгоритма, вычислений, измерениях на препарированном анатомическом материале или базах данных.
Следует отметить, что методы лазерной деструкции, разработанные для других областей глаза, например, роговицы, нельзя применять на хрусталике без значительной модификации. Одна из причин данного условия состоит с том, что роговицы является очень многослойной структурой, очень эффективно сдерживающей распространение и перемещение пузырьков. Таким образом, распространение пузырьков создает качественно меньше проблем в роговице, чем в более мягких слоях хрусталика, содержащих само ядро.
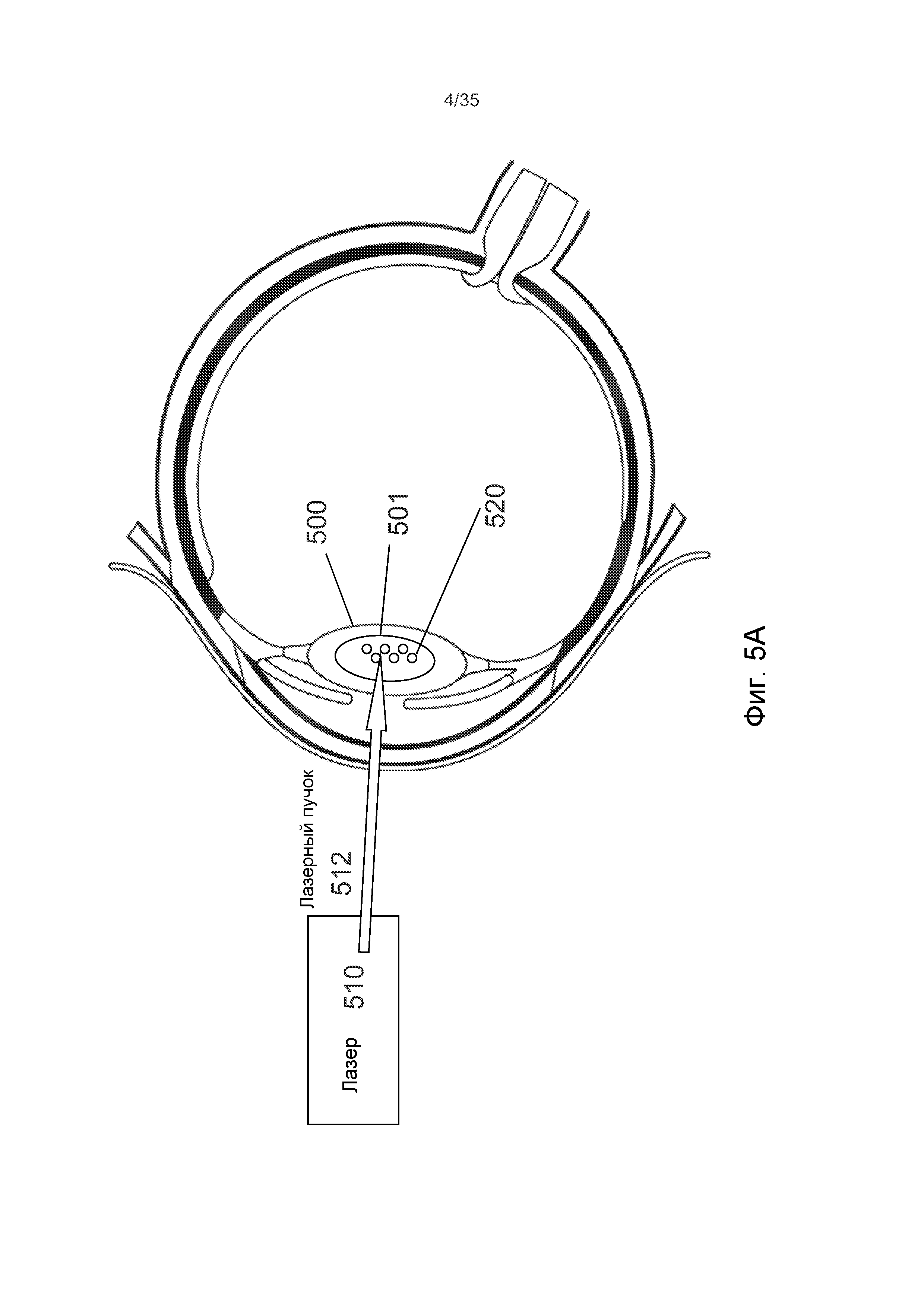
На Фиг.5A также поясняются этапы 320a-b. При использовании сходной нумерации, лазерный пучок 512 может вызывать деструкцию ядра 501 внутри хрусталика 500 посредством формирования пузырьков 520, при этом, подаваемый лазерный пучок 512 имеет параметры в диапазоне между порогами деструкции и распространения, с перемещением его фокальной точки в направлении с задней стороны вперед.
Этап 330 может содержать выполнение разрезов на роговице и на капсуле. Данные разрезы выполняют с, по меньшей мере, двумя целями: вскрытие пути для удаления деструктированного ядра и другого материала хрусталика и для последующего введения линзы IOL.
На Фиг.5B-C поясняется создание разреза на капсуле 505 хрусталика 500, иногда называемого капсулотомией. На этапе 330, лазерный пучок 512 можно сфокусировать на поверхности капсулы таким образом, чтобы число созданных «капсулотомических пузырьков» 550 был достаточно для деструкции капсулы 505, в сущности, перфорировали ее. На Фиг.5B представлен вид сбоку глаза, и на Фиг.5C представлен вид спереди хрусталика 500 после того, как создано кольцо из «капсулотомических пузырьков» 550, ограничивающих разрез 555 капсулы. В некоторых вариантах осуществления из данных пузырьков 550 формируют полную окружность, и дисковидную, так называемую, крышку капсулы, т.е. разрез 555 капсулы, просто снимают. В других вариантах осуществления на капсуле 505 формируют неполную окружность, крышка остается закрепленной на капсуле, и, в конце процедуры, крышку можно восстановить в ее исходное положение.
Затем, дисковидный разрез 555 капсулы, ограничиваемый перфорацией посредством капсулотомических пузырьков 550, можно поднять и удалить хирургическим инструментом на более позднем этапе, с преодолением минимального сопротивления перфорированной ткани капсулы 505.
На Фиг.5D-E показано создание разреза на роговице 540. Лазерный пучок 512 можно направлять для создания цепочки пузырьков, которые создают разрез через роговицу 540. Данный разрез может быть не полной окружностью, а крышкой или только лоскутом, который можно снова закрыть в конце процедуры.
И вновь, подаваемый пучок для лазерной хирургии, по существу, перфорирует роговицу, с ограничением крышки роговице таким образом, что, на последующем этапе, крышку роговицы можно легко отделить от остальной части роговицы и поднять, чтобы представить возможность физического проникновения в глаз.
В некоторых вариантах осуществления разрез роговицы может быть многоплоскостным или «клапанным» разрезом, как показано на виде сбоку на Фиг.5E (не в масштабе). Данный разрез может быть самогерметизирующимся и намного лучше заключает текучую среду внутри глаза после того, как хирургическая процедура заканчивается. Кроме того, данные разрезы лучше и эффективнее заживляются, обеспечивают более широкое перекрытие тканей роговицы, при этом, заживление не испытывает помех из-за сложностей с разрывом.
На данных Фиг.5A-E хорошо заметны различия между разрезами при выполнении ультразвуковых хирургических операций и фотодеструктивных хирургических операций, описанных в настоящей заявке.
В процессе ультразвуковых хирургических операций разрезы выполняют механическим разрывом целевой ткани, например, роговицы и капсулы, посредством пинцета: данный метод называется криволинейным разрывом капсулы. Кроме того, в процессе ультразвуковых хирургических операций, стороны разрезов испытывают многократные воздействия, оказываемые различными механическими устройствами, перемещаемыми внутрь и наружу. По данным причинам, контуры разрезов нельзя достаточно точно контролировать, и разрезы нельзя выполнить вышеописанным самогерметизирующимся образом. Следовательно, ультразвуковой способ характеризуется менее точным контролем размеров и отсутствием способности к самогерметизации многоплоскостных разрезов, которые возможны при фотодеструктивных процедурах.
Приведенные положения подтверждены во время процедур тестирования, когда в процессе обеих процедур пробовали создавать номинально 5-мм отверстия. Разрез, созданный механическим разрывом, имел диаметр 5,88 мм, при среднем отклонении 0,73 мм. Напротив, при фотодеструктивном способе, описанном в настоящей заявке, отверстие с диаметром 5,02 мм получали со средним отклонением 0,04 мм.
Приведенные результаты испытаний показывают качественно более высокую точность фотодеструктивного способа. Важность приведенного различия можно оценить, например, с учетом того, что, если разрез роговицы для коррекции астигматизма отклоняется только на 10-20%, то тем самым подавляется или даже нейтрализуется большая часть запланированного воздействия данного разреза, что, возможно, потребует повторной хирургической операции.
Кроме того, в момент, когда роговицу вскрывают разрезом во время осуществления ультразвукового способа, «внутриглазная жидкость передней камеры», т.е. текучая среда, содержащаяся в глазу, начинает вытекать, фактически, текучая среда начинает капать из глаза.
Данная потеря текучей среды имеет негативные последствия, так как внутриглазная жидкость выполняет жизненно важную функцию в поддержании структурной целостности глаза посредством его поддерживания, в какой-то степени подобно воде в водонаполненном баллоне.
Следовательно, значительные усилия требуется затрачивать на непрерывное восполнение текучей среды, вытекающей из глаза. Во время ультразвуковых хирургических операций, комплексная система с компьютерным управлением контролирует и наблюдает за упомянутым управлением операциями с текучей средой. Однако данная задача требует высокой квалификации от самого хирурга.
Напротив, осуществления настоящего способа не предусматривают вскрытия глаза для обеспечения фотодеструкции. По данной причине, при фотодеструкции хрусталика отсутствует задача управления операциями с текучей средой, и, следовательно, снижаются требования к квалификации хирурга и сложности оборудования.
Как видно из Фиг.3, этап 330 содержит также удаление фрагментированного, деструктированного, эмульсифицированного или иначе модифицированного ядра и другого материала хрусталика, например, более текучей коры. Данное удаление обычно выполняют введением аспирационного зонда через разрезы роговицы и капсулы и аспирацией материала.
На Фиг.5F показано, что этап 340 может содержать введение интраокулярной линзы (IOL) 530 в капсулу 505 хрусталика для замены деструктированного врожденного хрусталика. Предварительно созданные разрезы роговицы и капсулы могут выполнять функцию входных каналов для введения линзы IOL. По настоящему способу 300, выполненные разрезы не предусматривали вмещения факоэмульсификационного зонда. Поэтому позиционирование разрезов, их центрирование и угол можно оптимизировать для введения линзы IOL 530. Капсулотомические пузырьки 550 и разрез 555 роговицы можно разместить так, чтобы оптимизировать введение линзы IOL 530. В таком случае можно ввести линзу IOL 530 и снова закрыть или предоставить самогерметизироваться отверстию в роговице. Обычно капсула 505 хрусталика обволакивает и вмещает линзу IOL 530, без значительного вмешательства. В случаях, когда разрез на капсуле имеет большие размеры, для разреза часто выбирают положение по центру. В случаях, когда разрез на капсуле имеет небольшой размер, как показано на нижеприведенной Фиг.6, можно применить разрез со смещением от центра.
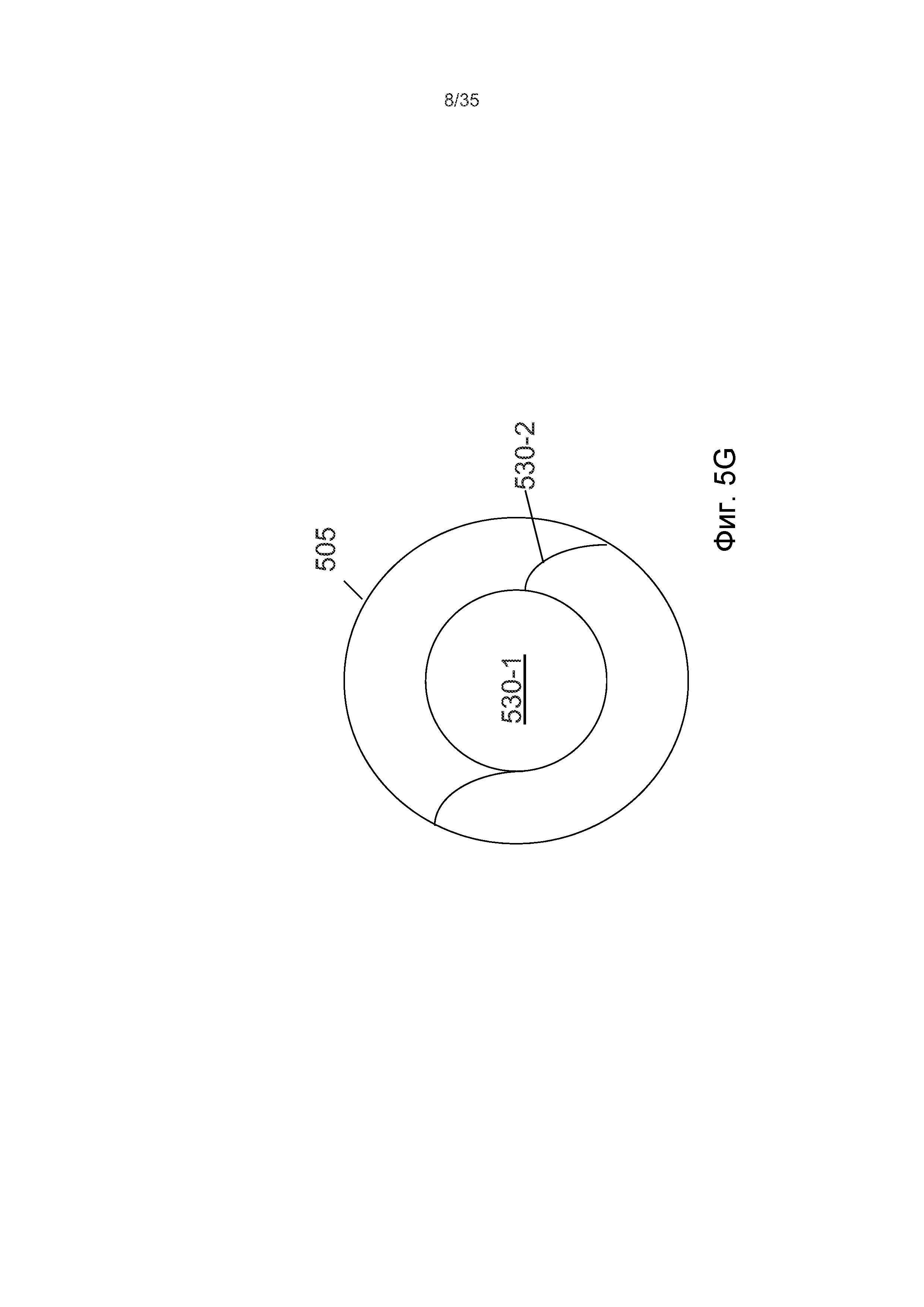
На Фиг.5G показано, что интраокулярная линза 530 может содержать «оптический» участок 530-1, который может быть, по существу, хрусталиком и «гаптический» участок 530-2, который может быть представлен разнообразными устройствами или конструкциями, функции которых содержат фиксацию оптического участка 530-1 в требуемом положении внутри капсулы 505. В некоторых вариантах осуществления оптический участок 530-1 может быть значительно меньше, чем диаметр капсулы 505, что делает необходимыми упомянутые фиксирующие «гаптические» участки. На Фиг.5G представлен вариант осуществления, в котором гаптический участок 530-2 содержит две спиральные ножки.
В некоторых вариантах осуществления настоящей системы соединение оптического и гаптического участков выполняют посредством создания, по меньшей мере, одного разреза в передней капсуле.
В некоторых вариантах осуществления капсулу 505 хрусталика надувают газом во время введения линзы IOL, чтобы можно было оптимально разместить гаптический участок 530-2. Например, гаптический участок 530-2 можно поместить в крайние периферические выемки капсулы 505 для оптимизации центрирования и передне-задней локализации оптического участка 530-1.
В некоторых вариантах осуществления газ из капсулы 505 хрусталика после введения линзы IOL откачивают, чтобы управляемым способом свести передний и задний участки капсулы 505 для оптимизации центрирования и передне-задней локализации оптического участка 530-1.
В некоторых вариантах осуществления вышеописанной хирургии глаза, доступ к периферическим зонам хрусталика получают оптически, посредством поставленного под углом зеркала.
В ряде случаев может иметь место ситуация, когда оптический доступ к периферическим областям хрусталика 600 невозможен. В некоторых вариантах осуществления настоящих способов, данные зоны можно фрагментировать или растворять, кроме фотодеструкции, другими средствами, содержащими ультразвук, нагретую воду или аспирацию.
На Фиг.6A представлено осуществление, в котором используют много элементов, изображенных на Фиг.3-5F и обозначенных сходными номерами позиций, которые не будут повторно описаны для данного осуществления. Кроме того, осуществление, представленное на Фиг.6A, содержит троакар 680. Троакар 680, который является, по существу, цилиндром подходящей формы, может быть введен через разрез 665 роговицы, по всей длине в капсулу 605 хрусталика через разрез 655 капсулы. Диаметр троакара может быть, в некоторых случаях, приблизительно, 1 мм, в других случаях, в диапазоне 0,1-2 мм.
Данный троакар 680 может обеспечивать улучшенное управление разными стадиями вышеописанного процесса фотодеструкции. Троакар 680 можно использовать для управления операциями с текучей средой, так как троакар создает управляемый канал для движения текучих сред внутрь и наружу. В некоторых вариантах осуществления троакар 680 можно поместить, по существу, водонепроницаемым способом в разрез 665 роговицы и разрез 655 капсулы. В данных вариантах осуществления просачивание наружу троакара 680 является минимальным, и, следовательно, потребность в управлении операциями с текучей средой снаружи троакара 680 также является минимальной.
Кроме того, возможно более управляемое и безопасное перемещение инструментов внутрь и наружу через троакар 680. Можно также безопаснее и достаточно управляемо удалять ядро и другие материалы хрусталика, подвергнутые фотодеструкции. И, наконец, через троакар 680 можно вводить линзу IOL, так как некоторые IOL можно сворачивать до минимального размера, самое большее, 2 мм. Данные линзы IOL можно продвигать по троакару 680, имеющему диаметр немного больше, чем диаметр свернутой линзы IOL. После введения в заданное место, линзы IOL можно расправлять или распаковывать внутри капсулы 605 хрусталика 600. Линзы IOL можно также надлежащим образом выравнивать, чтобы расположить их по центру и без нежелательного наклона внутри капсулы 605 хрусталика 600. Кроме того, троакарные хирургические процедуры требуют создания очень небольших разрезов, порядка, 2 мм, вместо разрезов, приблизительно, 7 мм, используемых при факоэмульсификации.
В общем, троакар 680 обеспечивает частично или полностью изолированное и контролируемое операционное пространство. После того, как все операции закончены, троакар 680 можно вывести, и самогерметизирующийся разрез 665 роговицы может эффективно и надежно зарубцеваться. При использовании данного способа, фотодеструктивный процесс может в максимально возможной степени восстанавливать зрение пациента.
В общем, варианты осуществления вышеописанного фотодеструктивного способа могут и сконфигурированы с возможностью выполнять этапы фотодеструкции ядра хрусталика глаза или любого другого целевого объекта (i) без создания вскрывающего отверстия в глазу; и (ii) в ходе одного комплексного процесса, вместо обязательных многочисленных этапов, выполняемых различными устройствами, высоких требований к квалификации хирурга.
Одно из осуществлений настоящего устройства для хирургического лечения катаракты может поддерживать объем глаза, при исключении или ослаблении потребности в вискоэластиках, и может обеспечивать более простую установку линзы IOL в надутом, минимально искаженном капсульном мешке, чтобы оптимизировать размещение и поддержку линзы IOL в оптимально центрированном и ненаклонном положении. Приведенный процесс может повышать предсказуемость оптических и/или рефракционных характеристик глаза после вмешательства. Приведенный процесс может также снижать потребность хирурга в ассистентах и обеспечивает возможность эффективного проведения операции, например, с разделением процедуры на две части, которые можно выполнять в разных условиях стерильности, в разных помещениях или даже в разное время.
Например, лазерную процедуру можно выполнить сначала в менее затратных, нестерильных окружающих условиях, при этом, удаление хрусталика и установку линзы IOL можно выполнять в традиционных стерильных окружающих условиях, например, в операционной, позднее. В качестве альтернативы, поскольку уровень квалификации и поддержки, необходимых для удаления хрусталика и установки линзы IOL, благодаря применению фотодеструкции, уровень требований к месту проведения работ также можно снизить, что имеет следствием экономию затрат и времени или большее удобство (например, возможность выполнять процедуры в обстановке процедурного кабинета, как при лазерной коррекции зрения (LASIK-хирургии)).
Вышеописанное заболевание глаза катарактой часто сосуществует с другой болезнью глаза, глаукомой. Глаукома связана с заболеваниями оптического нерва, проистекающими из избыточного внутриглазного давления (IOP) внутриглазной жидкости. Дренирование подходящего количества внутриглазной жидкости может привести к снижению избыточного давления IOP и устранению заболеваний оптического нерва. Создание разрезов в периферической глазной области с применением хирургических лазеров может снижать давление IOP однократно или может создавать постоянный дренажный канал для стабилизации давления IOP на сниженном уровне. Таким образом, офтальмологическая лазерная хирургия обеспечивает перспективный способ лечения глаукомы.
Для пациентов с катарактой и глаукомой, возможно, было бы полезно лечить оба заболевания одновременно. И даже в случаях, когда процедуры выполняют неодновременно, возможно, было бы полезно координировать разрезы для каждой процедуры, чтобы минимизировать вероятность осложнений и максимизировать успешный результат каждой процедуры.
На Фиг.6B-D представлены осуществления комплексных офтальмологических хирургических процедур, которые выполняют катарактальную и глаукомную процедуры либо одновременно, либо комплексным или скоординированным образом.
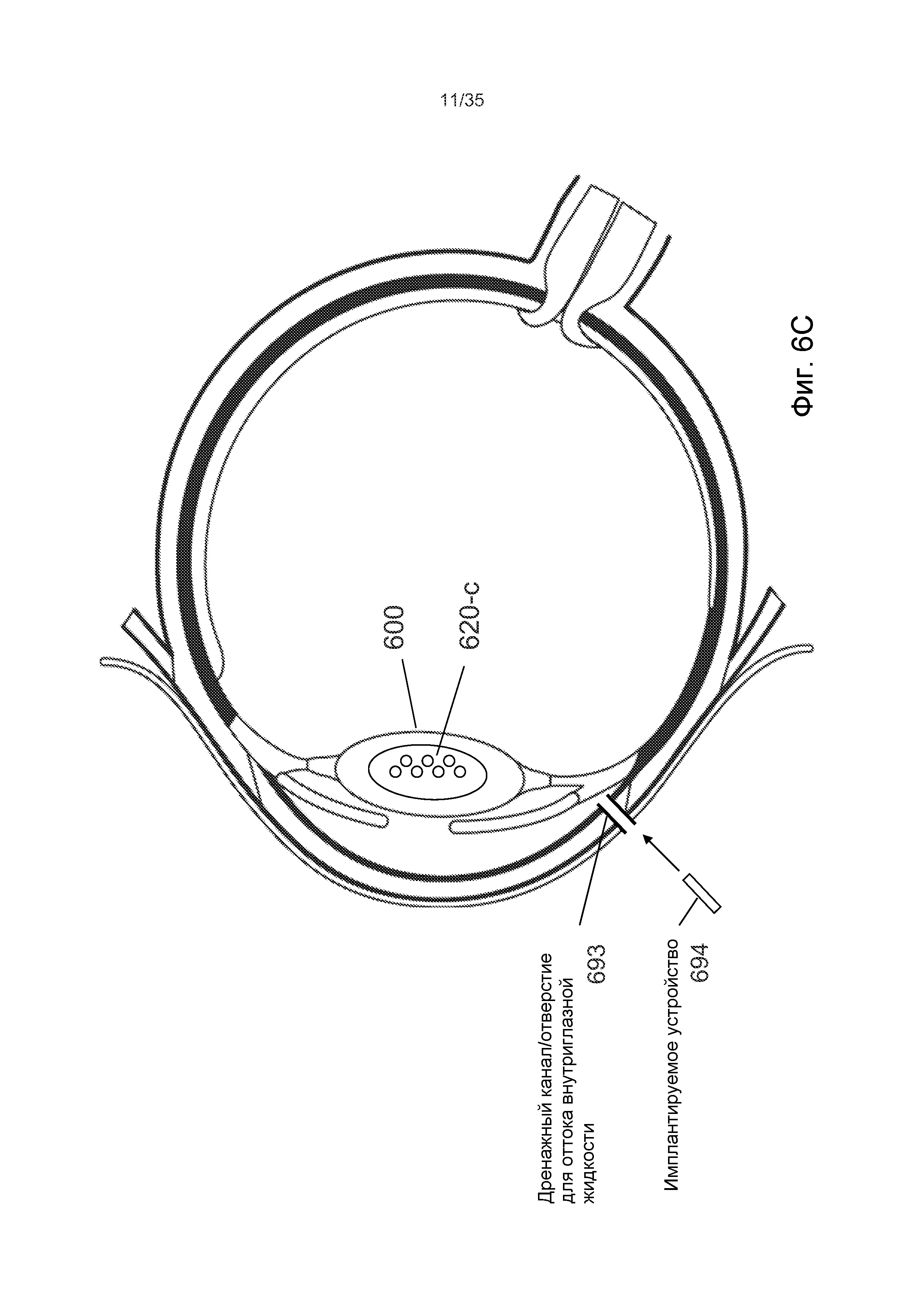
На Фиг.6B показано, что, в процессе комплексной офтальмологической процедуры, хирургический лазер 610 можно использовать для подачи группы лазерных импульсов 612-c катарактальной процедуры в ядро 601 хрусталика 600, чтобы сформировать группу пузырьков 620-c, создаваемых лазерным излучением, (в дальнейшем, лазерных пузырьков) катарактальной процедуры. До, после или одновременно с катарактальной процедурой, хирургический лазер 610 может подать группу лазерных импульсов 612-g глаукомной процедуры в периферическую область глаза, например, склеру, лимбальную область, участок угла глаза или корень радужной оболочки. Данные лазерные импульсы 612-g глаукомной процедуры могут быть частью любой известной глаукомной процедуры, в том числе, помимо прочего, трабекулопластики, иридотомии или иридэктомии. В ходе любой из данных процедур формируют группу лазерных пузырьков 620-g глаукомной процедуры в периферической глазной области, чтобы создать, по меньшей мере, один разрез или отверстие в соответствии с различными паттернами.
На Фиг.6C показано, что, в некоторых вариантах осуществления, данные разрезы или отверстия могут, в конечном итоге, формировать дренажный канал или отверстие 693 для оттока внутриглазной жидкости. В некоторых вариантах осуществления, в дренажный канал можно вводить имплантируемое устройство 694 для регулировки оттока. Имплантируемое устройство 694 может быть простой дренажной трубкой или может содержать регулятор или клапан давления. Форма упомянутого устройства может быть прямолинейной или может иметь повороты, углы или колена.
В любом из данных осуществлений, дренажный канал 693 или имплантируемое устройство 694 может соединять переднюю камеру глаза с поверхностью глаза, что облегчает снижение внутриглазного давления.
На Фиг.6B представлено осуществление комплексной офтальмологической процедуры, когда хирургический лазер 610 содержит интерфейс 690 пациента, содержащий контактную линзу 691, которая может быть плоской аппланационной пластиной или изогнутой линзой, а также вакуумное уплотнительное ограждение 692, которое создает частичный вакуум, чтобы, по меньшей мере, частично иммобилизовать глаз для процедуры. Если интерфейс 690 пациента имеет подходящий размер, то хирургический лазер не нуждается в изменении положения или настройке. В данных вариантах осуществления, система сканирования по осям x-y или x-y-z может достаточно отклонять или нацеливать хирургический лазер для достижения периферических глазных областей при глаукомной процедуре.
В ходе комплексных процедур контактную линзу 691 можно заменять с контактной линзы 691-c, оптимизированной для катарактальных процедур, на другую контактную линзу 691-g, оптимизированную для глаукомных процедур.
Склера сильно рассеивает падающий лазерный свет, на что указывает, например, яркий белый цвет склеры. Следовательно, лазеры на большинстве длин волн не особо эффективны для прорезания склеры и формирования дренажного канала 693. Иначе говоря, для создания транссклерального разреза, лазерные пучки должны обладать такими высокими энергиями, которые вызывают чрезмерную деструкцию в глазной ткани.
Для решения упомянутой задачи, в некоторых комплексных системах идентифицируют специфические длины волн λ-g, на которых поглощение и рассеяние склерой имеет провал, минимум или интервал минимальных значений. Лазеры с упомянутыми длинами волн могут быть пригодны для формирования дренажного канала 693 в склере.
Однако упомянутые длины волн λ-g, специфические для глаукомы, могут быть непригодны, в частности, для катарактальных процедур, которые могут лучше всего исполняться на других длинах волн λ-c.
Поэтому в некоторых вариантах осуществления, рабочая длина волны хирургического лазера 610 может быть изменяемой со значения λ-c, оптимизированного для катаракты, на значение λ-g, оптимизированное для глаукомы. В других вариантах осуществления можно использовать отдельные лазеры: один для катарактальной процедуры, выполняемой на длине волны λ-c, и другой для глаукомной процедуры, выполняемой на длине волны λ-g.
Однако изменение рабочей длины волны хирургического лазера может быть сложной задачей, и применение системы с двумя разными лазерами может затруднять оптимизацию оптических рабочих характеристик и обеспечение конкурентоспособности системы по затратам.
На Фиг. 6D показано, что некоторые осуществления предназначены для решения упомянутых задач благодаря содержанию одночастотного лазера и его нацеливанию на области, которые оптимизированы для альтернативных и частично противоречивых требований обеспечения слабого рассеяния целевой областью, при минимизации возмущений оптического пути.
Одна упомянутая оптимизированная область может быть, например, граничной областью между склерой 695 и лимбом 696. Упомянутая граничная область между лимбом и склерой может рассеивать лазерный пучок меньше, чем сама склера, что позволяет применять единственный лазер как для глаукомных, так и катарактальных процедур с длиной волны, подобранной для достаточно эффективного выполнения катарактальных процедур, но не обязательно для минимизации рассеяния и поглощения склерой. При этом, дренажный канал 693 в упомянутой граничной области между лимбом и склерой может находиться в области, достаточно периферической, так что данный канал лишь в минимальной степени нарушает оптический путь и, следовательно, зрение пациента. Обычно, в данном аспекте, возможно, полезно выбирать целевой объект как можно дальше от оптической оси глаза. Другие целевые области также могут предлагать решения, обеспечивающие удовлетворительный компромисс между требованиями к хирургическому лечению глаукомы и катаракты, например, место пересечения роговицы и лимба.
Кроме местоположения дренажного канала 693, его направление
также может влиять на эффективность формирования дренажного канала 693. Например, дренажный канал 693 может быть направлен таким путем, который не обязательно перпендикулярен поверхности глаза, а, вместо этого, выбран для прохода через такие области склеры, которые характеризуются минимальным рассеянием и, следовательно, нуждаются в лазерных импульсах только ограниченной энергии.
На Фиг.6E представлены осуществления комплексной офтальмологической процедуры, в рамках которой либо настраивают хирургический лазер 610 между катарактальной процедурой и глаукомной процедурой, либо, фактически, используют отдельные лазеры для двух процедур.
Точность данных процедур можно повысить формированием изображений операционных областей. Для комплексной катарактальной/глаукомной процедуры, система формирования изображений может быть объединена с лазерной хирургической системой, как поясняется ниже. Система формирования изображений может быть сконфигурирована с возможностью формирования изображения хрусталика 600, роговицы 140, лимбального, склерального участков глаза или участка угла глаза. Изображения можно анализировать, чтобы координировать формирование разрезов для катарактальной процедуры и глаукомной процедуры таким образом, чтобы оптимизировать выполнение комплексных процедур.
В вариантах осуществления, в которых две процедуры выполняют последовательно, этап формирования изображения можно выполнять после первой процедуры, чтобы создавать изображение пузырьков и фотодеструкции, соответственно, сформированных и полученной в процессе первой процедуры. Данное изображение может помогать наведению в заданное место лазерных импульсов во время второй процедуры.
В частности, если сначала выполняют катарактальную процедуру, то следующий этап формирования изображения можно выполнять для формирования изображений фотодеструкции, вызванной лазерными импульсами 612-c катарактальной процедуры. Данное изображение можно использовать для выбора целевых областей, в которые будут направлены лазерные импульсы 612-g глаукомной процедуры. И, наоборот, если первой выполняют глаукомную процедуру, то последующий этап формирования изображения можно выполнять для формирования изображений фотодеструкции, вызванной лазерными импульсами 612-g глаукомной процедуры. Данное изображение можно использовать для выбора целевых областей, в которые будут направлены лазерные импульсы 612-c катарактальной процедуры.
В аналогичном варианте осуществления, для пациентов с катарактой и астигматизмом, возможно, также было полезно одновременно лечить оба дефекта. И даже в случаях, когда процедуры выполняют неодновременно, возможно, было бы полезно координировать разрезы для каждой процедуры, чтобы минимизировать вероятность осложнений и максимизировать успешный результат каждой процедуры.
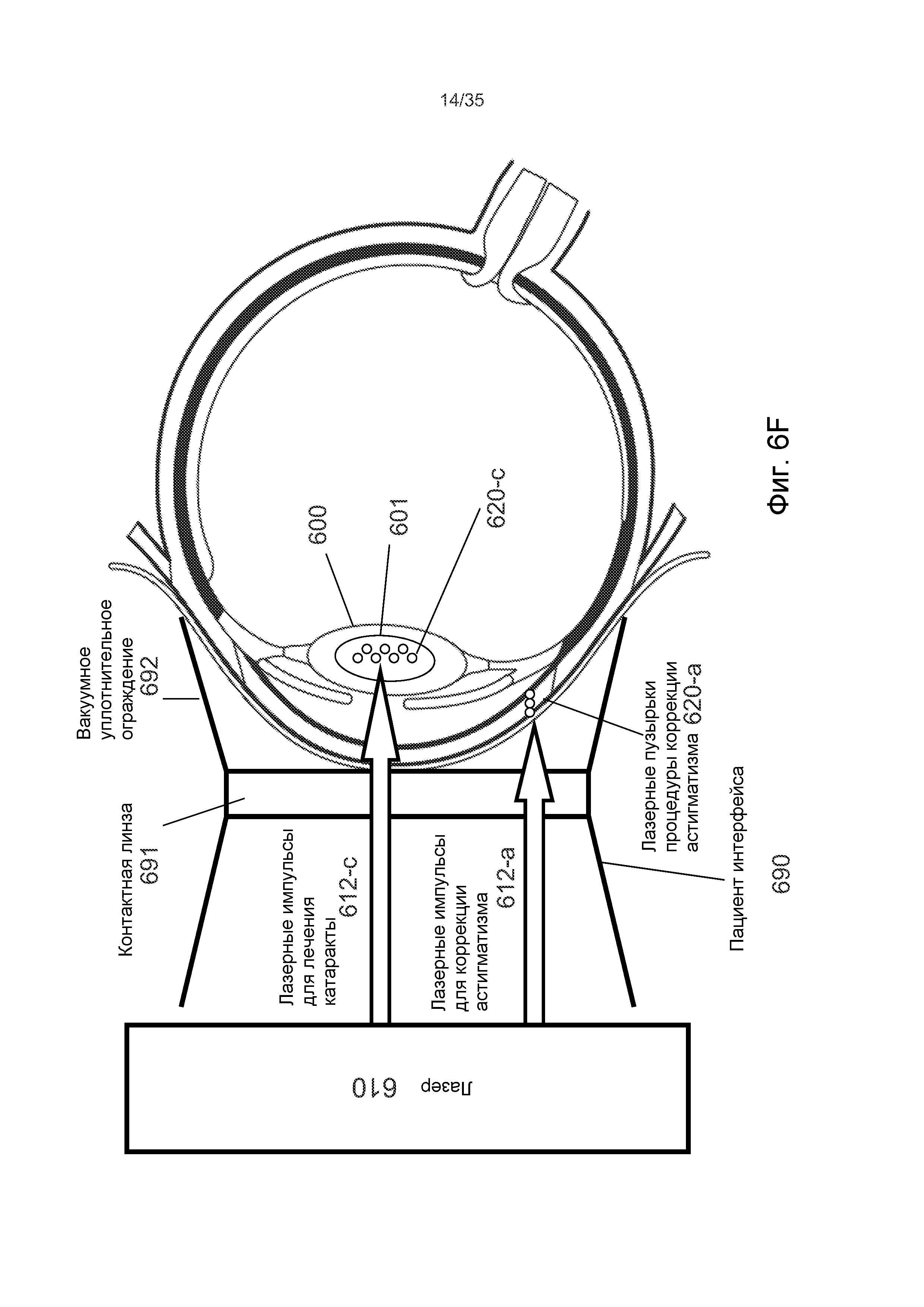
На Фиг.6F-G представлены осуществления комплексных офтальмологических процедур, которые выполняют катарактальную процедуру и процедуру коррекции астигматизма либо одновременно, либо объединенным или скоординированным образом.
На Фиг.6F показано, что, в процессе комплексной офтальмологической процедуры, хирургический лазер 610 можно использовать для подачи группы лазерных импульсов 612-c катарактальной процедуры в ядро 601 хрусталика 600, чтобы сформировать группу лазерных пузырьков 620-c катарактальной процедуры. До, после или одновременно с катарактальной процедурой, хирургический лазер 610 может подать группу лазерных импульсов 612-a процедуры коррекции астигматизма в центральную, среднюю или периферическую роговичную или лимбальную область. Данные лазерные импульсы 612-a процедуры коррекции астигматизма могут быть частью любой известной процедуры коррекции астигматизма, в том числе, помимо прочего, астигматической кератотомии, лимбального послабляющего разреза или клиновидной резекции роговицы. В ходе любой из данных процедур, можно формировать группу лазерных пузырьков 620-a процедуры коррекции астигматизма, чтобы создать, по меньшей мере, один разрез или отверстие в соответствии с различными паттернами для снижения типа астигматизма роговицы.
На Фиг.6G представлено осуществление комплексной офтальмологической процедуры на виде спереди глаза. В рамках процедуры коррекции астигматизма, в периферической лимбальной области могут быть созданы лимбальные послабляющие разрезы 699-1 и 699-2. При планировании использования диагностических оптических измерений, упомянутые лимбальные послабляющие области могут способствовать уменьшению астигматизма глаза.
В других аспектах, вышеописанная комплексная катарактальная процедура с коррекцией астигматизма может иметь несколько особенностей, аналогичных ранее описанной комплексной глаукомной/катарактальной процедуре.
Данные особенности содержат (a) использование интерфейса пациента с контактной линзой, чтобы, по меньшей мере, частично иммобилизовать глаз для процедуры; (b) использование систем сканирования по осям x-y или x-y-z для нацеливания лазерного пучка в соответствии с картиной коррекции астигматизма; (c) изменение контактной линзы между процедурами; (d) изменение длины волны лазера между процедурами или использование разных лазеров для процедур; (e) выбор местоположения процедуры коррекции астигматизма посредством оптимизации требований к минимальному рассеянию склерой, с размещением, при этом, разрезов коррекции астигматизма так, чтобы в минимальной степени нарушать оптический путь; и (f) настройка положения или нацеливания лазера между процедурами.
Кроме того, точность комплексной катарактальной процедуры с коррекцией астигматизма также можно повысить посредством формирования изображений операционных областей путем объединения системы формирования изображений с лазерной хирургической системой. Система формирования изображений может быть сконфигурирована с возможностью формирования изображения хрусталика 600, роговицы 140, лимбального, склерального участков глаза или участка угла глаза. Изображения можно анализировать, чтобы координировать формирование разрезов для катарактальной процедуры и процедуры коррекции астигматизма таким образом, чтобы оптимизировать выполнение комплексных процедур.
В вариантах осуществления, в которых две процедуры выполняют последовательно, этап формирования изображения можно выполнять после первой процедуры, чтобы создавать изображение пузырьков и фотодеструкции, соответственно, сформированных и полученной в процессе первой процедуры. Данное изображение может помогать наведению в заданное место лазерных импульсов во время второй процедуры.
В частности, если сначала выполняют катарактальную процедуру, то следующий этап формирования изображения можно выполнять для формирования изображений фотодеструкции, вызванной лазерными импульсами 612-c катарактальной процедуры. Данное изображение можно использовать для выбора целевых областей, в которые будут направлены лазерные импульсы 612-a процедуры коррекции астигматизма. И, наоборот, если первой выполняют процедуру коррекции астигматизма, то последующий этап формирования изображения можно выполнять для формирования изображений фотодеструкции, вызванной лазерными импульсами 612-a процедуры коррекции астигматизма. Данное изображение можно использовать для выбора целевых областей, в которые будут направлены лазерные импульсы 612-c катарактальной процедуры.
На Фиг.7-26 представлены варианты осуществления лазерной хирургической системы, относящейся к вышеописанному фотодеструктивному лазерному лечению.
Одним из важных аспектов лазерных хирургических процедур является точное управление лазерным пучком и его нацеливание, например, положением пучка и фокусировкой пучка. Лазерные хирургические системы могут быть выполнены с возможностью содержания средств управления лазером и его прицеливания для точного нацеливания лазерных импульсов на конкретный целевой объект внутри ткани. В различных фотодеструктивных хирургических системах с наносекундными лазерами, например, системах с Nd:YAG лазерами, требуемая степень точности наведения на целевой объект является сравнительно низкой. Данное нежесткое требование, частично, объясняется тем, что применяемая энергия лазера является сравнительно высокой и, следовательно, зона воздействия на ткань также является сравнительно большой, часто охватывающей зону воздействия с размерами сотни микрометров. Время между лазерными импульсами в данных системах, обычно, велико, и осуществимо и широко применяется ручное управление прицеливанием. Одним из примеров упомянутых механизмов ручного прицеливания является биомикроскоп для формирования изображения целевой ткани, в комбинации со вспомогательным источником лазерного излучения, применяемого в качестве направляющего пучка. Хирург, обычно, путем управления джойстиком вручную перемещает фокус линзы фокусировки лазерного пучка, который является парфокальным (со смещением или без смещения) со своим изображением, создаваемым микроскопом, так что хирургический пучок или направляющий пучок являются оптимально сфокусированными на заданный целевой объект.
Приведенные методы, предназначенные для применения с лазерными хирургическими системами с низкими частотами повторения импульсов, могут быть затруднительными для применения с лазерами с высокой частотой повторения импульсов, излучающими несколько тысяч импульсов в секунду со сравнительно невысокой энергией на импульс. При хирургических операциях лазерами с высокой частотой повторения импульсов может потребоваться намного большая точность из-за слабых воздействий каждого отдельного лазерного импульса, и может потребоваться намного большая скорость позиционирования из-за необходимости очень быстрой подачи нескольких тысяч импульсов в новые зоны воздействия.
Примеры импульсных лазеров с высокой частотой повторения импульсов для лазерных хирургических систем содержат импульсные лазеры с частотой повторения импульсов несколько тысяч импульсов в секунду или выше, при невысокой энергии на один импульс. Данные лазеры используют сравнительно невысокую энергию на один импульс для определения местоположения воздействия на ткань, вызываемого лазерной фотодеструкцией, например, зоной воздействия на ткань посредством фотодеструкции порядка нескольких микрометров или нескольких десятков микрометров. Данное локализованное воздействие на ткань может повысить точность лазерной хирургии и может быть желательным при некоторых хирургических процедурах, например, лазерной хирургической операции глаза. В одном примере данной хирургической операции, подачу множества сотен, тысяч или миллионов контактирующих или почти контактирующих импульсов или импульсов, разделенных известными расстояниями, можно применить для получения некоторых требуемых хирургических результатов, например, разрезов, расслоений или фрагментации ткани.
Различные хирургические процедуры, использующие фотодеструктивные лазерные хирургические системы с высокой частотой повторения импульсов с укороченными длительностями лазерных импульсов, могут требовать высокой точности позиционирования каждого импульса в оперируемой целевой ткани с точки зрения как абсолютного положения относительно целевого местоположения в целевой ткани, так и относительного положения по отношению к предшествующим импульсам. Например, в некоторых случаях, лазерные импульсы, возможно, потребуется подводить один вблизи другого, с точностью несколько микрометров, за время между импульсами, которое может быть порядка нескольких микросекунд. Поскольку время между двумя последовательными импульсами является малым, и требование к точности настройки импульсов является высоким, то ручное прицеливание, применяемое в импульсных лазерных системах с низкой частотой повторения импульсов, может быть больше недостаточным или неосуществимым.
Один метод упрощения и управления высокоскоростным позиционированием, необходимым для подачи лазерных импульсов в ткань состоит в приложении аппланационной пластины, выполненной из прозрачного материала, например, стекла, с предварительно заданной контактной поверхностью к ткани таким образом, чтобы контактная поверхность аппланационной пластины формировала четко определенный оптический интерфейс с тканью. Данный четко определенный интерфейс может облегчать пропускание и фокусировку лазерного света в ткани, для регулировки или уменьшения оптических аберраций или изменений (например, обусловленных специфическими оптическими свойствами глаза или изменениями, которые происходят при высыхании поверхности), которые являются в высшей степени критическими на границе раздела воздух-ткань, которая находится в глазу на передней поверхности роговицы. Контактные линзы могут быть предназначены для различных применений и целевых объектов внутри глаза и других тканей, в том числе, такие, которые являются одноразовыми или многократно используемыми. Контактное стекло или аппланационную пластину на поверхности целевой ткани можно использовать в качестве базовой пластины, относительно которой фокусируют лазерные импульсы посредством регулировки фокусирующих элементов в системе подачи лазерного излучения. Вышеописанное применение контактного стекла или аппланационной пластины обеспечивает усовершенствованное управление оптическими параметрами поверхности ткани и, следовательно, дает возможность точно подавать лазерные импульсы с высокой скоростью в требуемое место (точку взаимодействия) в целевой ткани относительно аппланационной базовой пластины с малым оптическим искажением лазерных импульсов.
Один способ применения аппланационной пластины на глазу состоит в использовании аппланационной пластины для обеспечения позиционной базы отсчета для доставки лазерных импульсов в целевую ткань в глазу. Данное применение аппланационной пластины в качестве позиционной базы отсчета может быть основано на определении известного требуемого местоположения фокуса лазерного импульса в целевом объекте с достаточной точностью до подачи лазерных импульсов и на том, что относительные положения базовой плоскости и отдельного внутреннего целевого объекта ткани должны оставаться постоянными во время включения лазера. Кроме того, данный способ может требовать, чтобы фокусировка лазерного импульса в требуемое местоположение была предсказуемой и воспроизводимой для разных глаз или в разных областях внутри одного глаза. В реальных системах, применение аппланационной пластины в качестве позиционной базы отсчета для точного назначения местоположения лазерным импульсам внутри глаза может представлять сложности из-за того, что в реальных системах вышеприведенные условия могут не встречаться.
Например, если целевым объектом операции является хрусталик, то точное расстояние от базовой пластины на поверхности глаза до целевого объекта, обычно, изменяется из-за присутствия сжимаемых структур, например, самой роговицы, передней камеры и радужной оболочки. Значительная изменчивость расстояния между уплощенной роговицей и хрусталиком характерна не только для отдельных глаз, но возможно также изменение внутри одного глаза, в зависимости от конкретного хирургического и аппланационного метода, используемого хирургом. Кроме того, целевая ткань хрусталика может перемещаться относительно уплощенной поверхности во время подачи нескольких тысяч лазерных импульсов, необходимых для достижения хирургического результата, что дополнительно осложняет точную доставку импульсов. Кроме того, структура внутри глаза может двигаться вследствие накопления побочных продуктов фотодеструкции, например, кавитационных пузырьков. Например, лазерные импульсы, подводимые к хрусталику, могут вызывать выпучивание вперед капсулы хрусталика, что требует настройки для нацеливания на данную ткань для последующей подачи лазерных импульсов в заданное место. Кроме того, использование компьютерных моделей и моделирования для достаточно точного прогнозирования фактического местоположения целевых тканей после того, как аппланационную пластину снимают, и для настройки посылки лазерных импульсов с целью достижения требуемой локализации без уплощения может быть сложной задачей, частично, из-за очень непостоянного характера аппланационных воздействий, которые могут зависеть от факторов, специфических для отдельной роговицы или глаза, и специфического хирургического и аппланационного метода, применяемого хирургом.
Кроме физических эффектов уплощения, которое непропорционально влияет на локализацию внутренних тканевых структур, в процессе некоторых хирургических операций, возможно, потребуется система прицеливания для прогнозирования или учета нелинейных характеристик фотодеструкции, которая может происходить при использовании лазеров с малой длительностью импульсов. Фотодеструкция является нелинейным оптическим процессом в тканевом материале и может создавать затруднения при настройке пучка и нацеливании пучка. Например, один из нелинейных оптических эффектов в тканевом материале, при взаимодействии с лазерными импульсами, во время фотодеструкции заключается в том, что показатель преломления тканевого материала, испытывающего воздействие лазерных импульсов, больше не остается постоянным, а изменяется с изменением интенсивности света. Поскольку интенсивность света в лазерных импульсах пространственно изменяется в пределах пучка импульсного лазера вдоль и поперечно направлению распространения пучка импульсного лазера, то показатель преломления тканевого материала также пространственно изменяется. Одним из последствий упомянутой нелинейности показателя преломления является самофокусировка или самодефокусировка в тканевом материале, что изменяет фактический фокус и сдвигает положение фокуса пучка импульсного лазера внутри ткани. Поэтому точная настройка пучка импульсного лазера на каждое положение целевой ткани в целевой ткани может также требовать учета влияния нелинейных оптических эффектов в тканевом материале на лазерный пучок. Кроме того, возможно, потребуется настраивать энергию в каждом импульсе, чтобы обеспечивать одинаковый физический эффект в разных областях целевого объекта, из-за разных физических характеристик, например, твердости, или вследствие учета оптических свойств, например, поглощения или рассеяния импульсного лазерного света, распространяющегося в конкретную область. В данных случаях, различия между нелинейными эффектами фокусировки импульсов с разными значениями энергии могут также влиять на настройку лазера и прицеливание лазерных хирургических импульсов.
Таким образом, во время хирургических процедур, при которых выполняют прицеливание на неповерхностные структуры, применение поверхностной аппланационной пластины из соображений базирования на позиционную базу отсчета, обеспечиваемую аппланационной пластиной, может быть недостаточным для обеспечения точной локализации лазерных импульсов во внутренних целевых объектах тканей. Применение аппланационной пластины в качестве ориентира для наводки подводимого лазерного излучения может требовать высокоточных измерений толщины и положения пластины для аппланационной пластины, так как отклонение от номинальных значений непосредственно преобразуется в случайную ошибку по глубине. Высокоточные аппланационные линзы, особенно, выбрасываемые аппланационные пластины одноразового использования, могут быть дорогими.
Методы, устройства и системы, описанные в настоящем документе, могут быть осуществлены так, чтобы обеспечивать механизм прицеливания для точной и высокоскоростной подачи коротких лазерных импульсов сквозь аппланационную пластину в требуемую локализацию внутри глаза, без обязательного определения известного требуемого местоположения фокуса лазерного импульса в целевом объекте с достаточной точностью до подачи лазерных импульсов и без требования, чтобы относительные положения базовой пластины и отдельного внутреннего целевого объекта ткани оставались постоянными во время включения лазера. По существу, настоящие методы, устройства и системы можно применять для различных хирургических процедур, в ходе которых физические условия в оперируемой целевой ткани, обычно, изменяются и трудно поддаются управлению, и размер аппланационной линзы, обычно, различается для разных линз. Настоящие методы, устройства и системы можно также применять для других целевых объектов операции, когда имеют место искажение или перемещение целевого объекта операции относительно поверхности структуры, или нелинейные оптические эффекты затрудняют точное прицеливание. Примеры упомянутых целевых объектов операции, отличающихся от глаза, содержат сердце, глубоко расположенные ткани в коже и другие.
Настоящие методы, устройства и системы могут быть осуществлены так, чтобы сохранять преимущества, обеспечиваемые аппланационной пластиной, в том числе, например, управление формой и увлажнением поверхности, а также уменьшение оптических искажений, при одновременном обеспечении точной локализации фотодеструкции относительно внутренних структур уплощенной поверхности. Упомянутые преимущества можно получить путем применения встроенного устройства формирования изображений для определения местоположения целевой ткани относительно фокусирующей оптики системы подачи импульсов. Точный тип устройства и способа формирования изображений может изменяться и может зависеть от специфической природы целевого объекта и требуемой степени точности.
Аппланационная линза может быть осуществлена с другим механизмом для фиксации глаза, чтобы предотвращать поступательное и поворотное движение глаза. Примеры подобных фиксирующих устройств содержат применение вакуумного кольца. Данный фиксирующий механизм может также приводить к нежелательному искажению или перемещению целевого объекта операции. Настоящие методы, устройства и системы могут быть осуществлены так, чтобы обеспечивать для лазерной хирургической системы с высокой частотой повторения импульсов, которая использует аппланационную пластину и/или фиксирующее средство для неповерхностных целевых объектов операции, механизм прицеливания для обеспечения интраоперационного формирования изображений, чтобы контролировать упомянутые искажения и перемещение целевого объекта операции.
Конкретные нижеприведенные примеры лазерных хирургических методов, устройств и систем используют оптический модуль формирования изображений для получения изображений целевой ткани, чтобы получать позиционную информацию, касающуюся целевой ткани, например, до и во время хирургической процедуры. Упомянутую полученную позиционную информацию можно использовать для управления позиционированием и фокусировкой хирургического лазерного пучка в целевой ткани, чтобы обеспечивать точное управление подачей в заданное место хирургических лазерных импульсов в лазерных системах с высокой частотой повторения импульсов. В одном варианте осуществления, во время хирургической процедуры, изображения, полученные оптическим модулем формирования изображений, можно использовать для динамического управления положением и фокусом хирургического лазерного пучка. Кроме того, короткие лазерные импульсы малой энергии, обычно, чувствительны к оптическим искажениям, и, поэтому, в данной лазерной хирургической системе возможно применение аппланационной пластины с плоской или криволинейной контактной поверхностью, прикладываемой к целевой ткани, для обеспечения регулируемого и стабильного оптического интерфейса между целевой тканью и хирургической лазерной системой и для уменьшения и регулирования оптических аберраций на поверхности ткани.
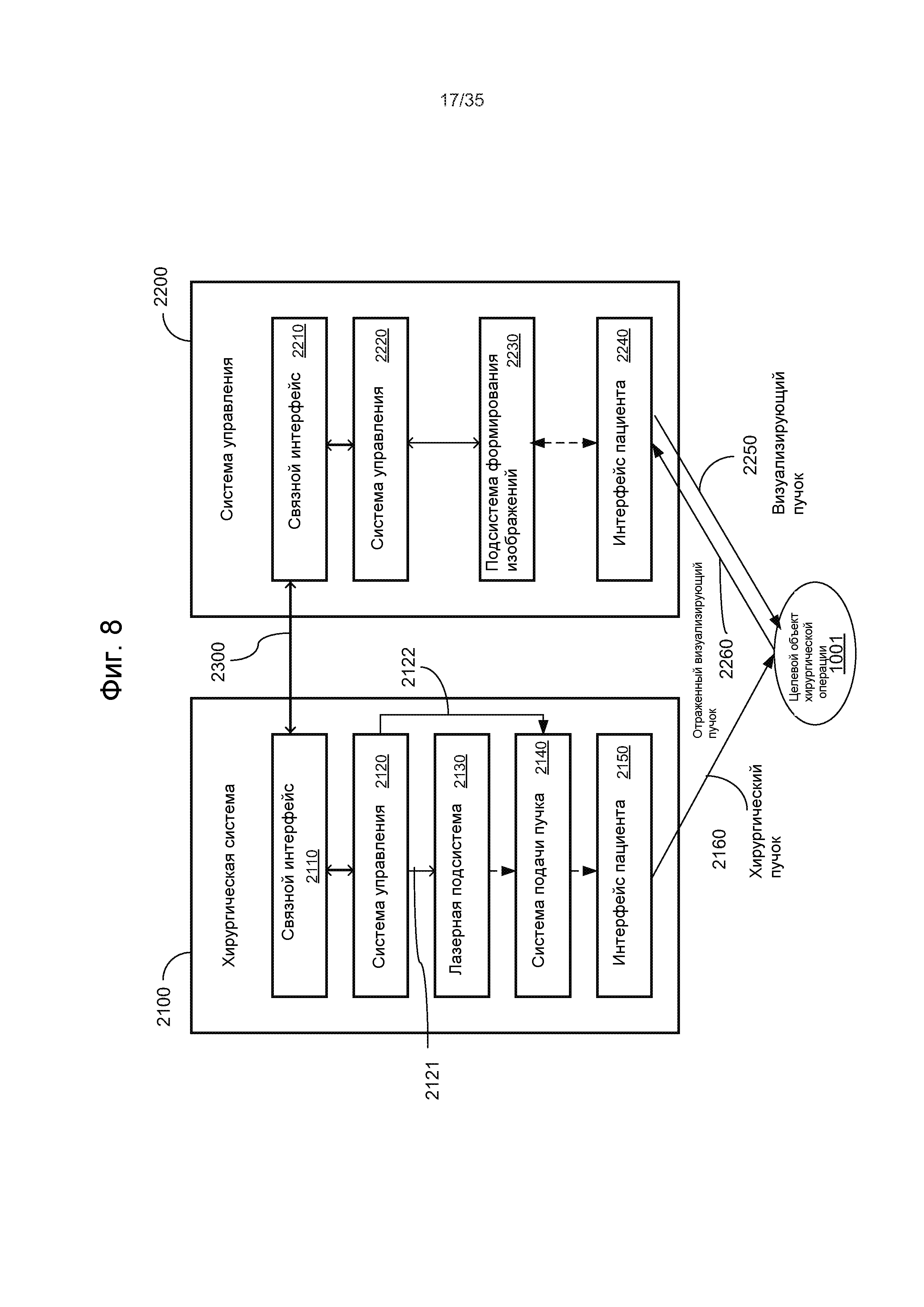
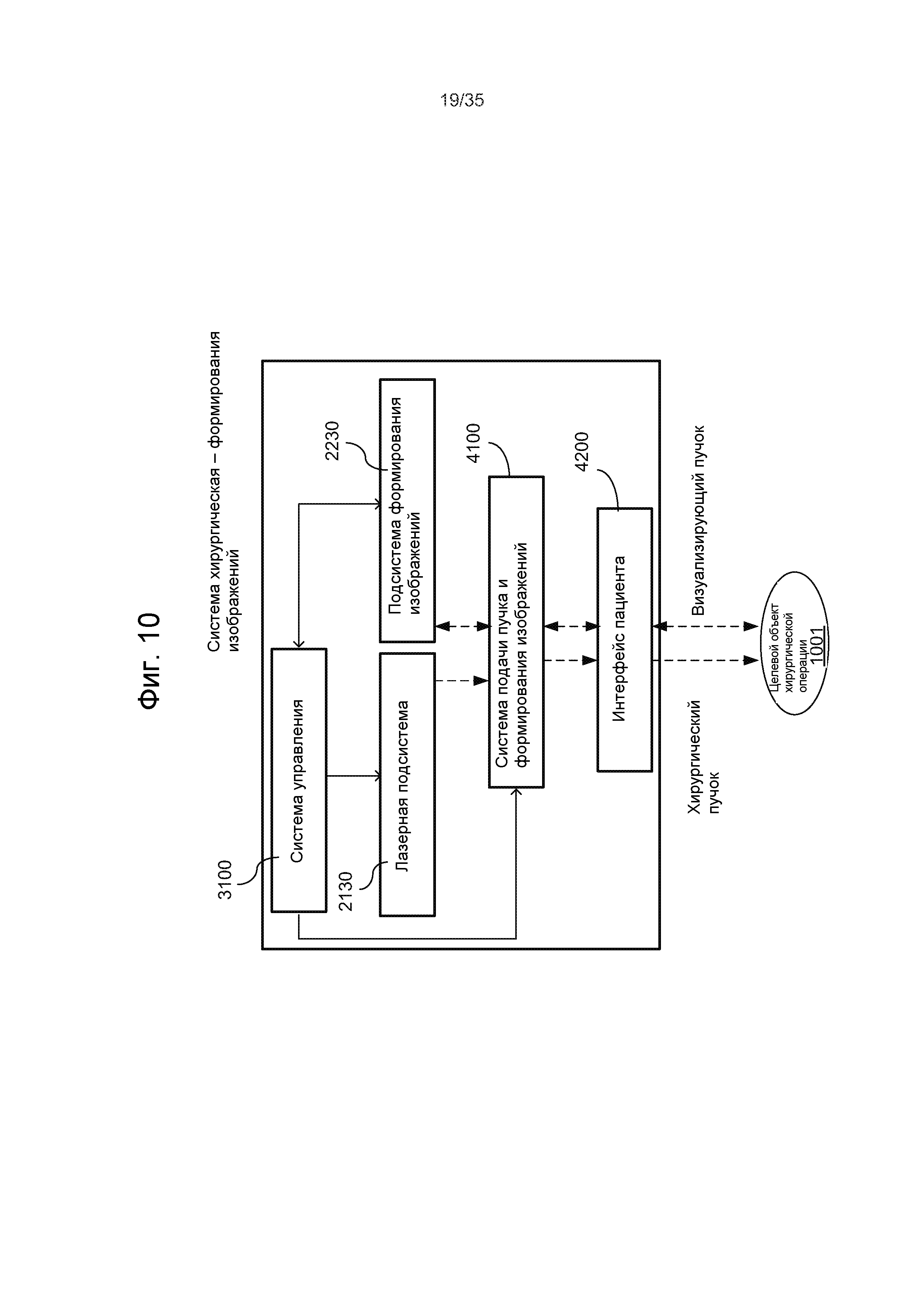
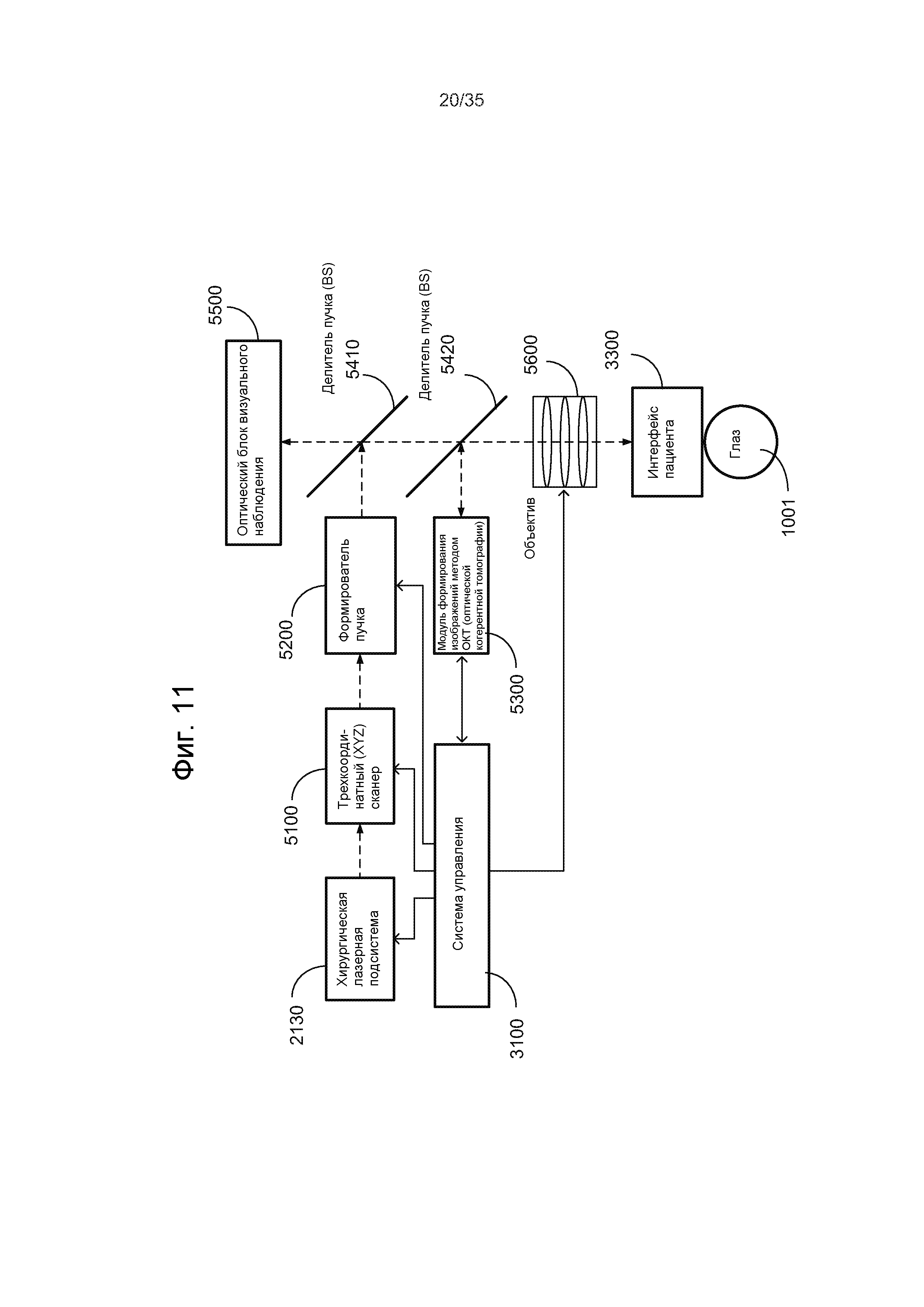
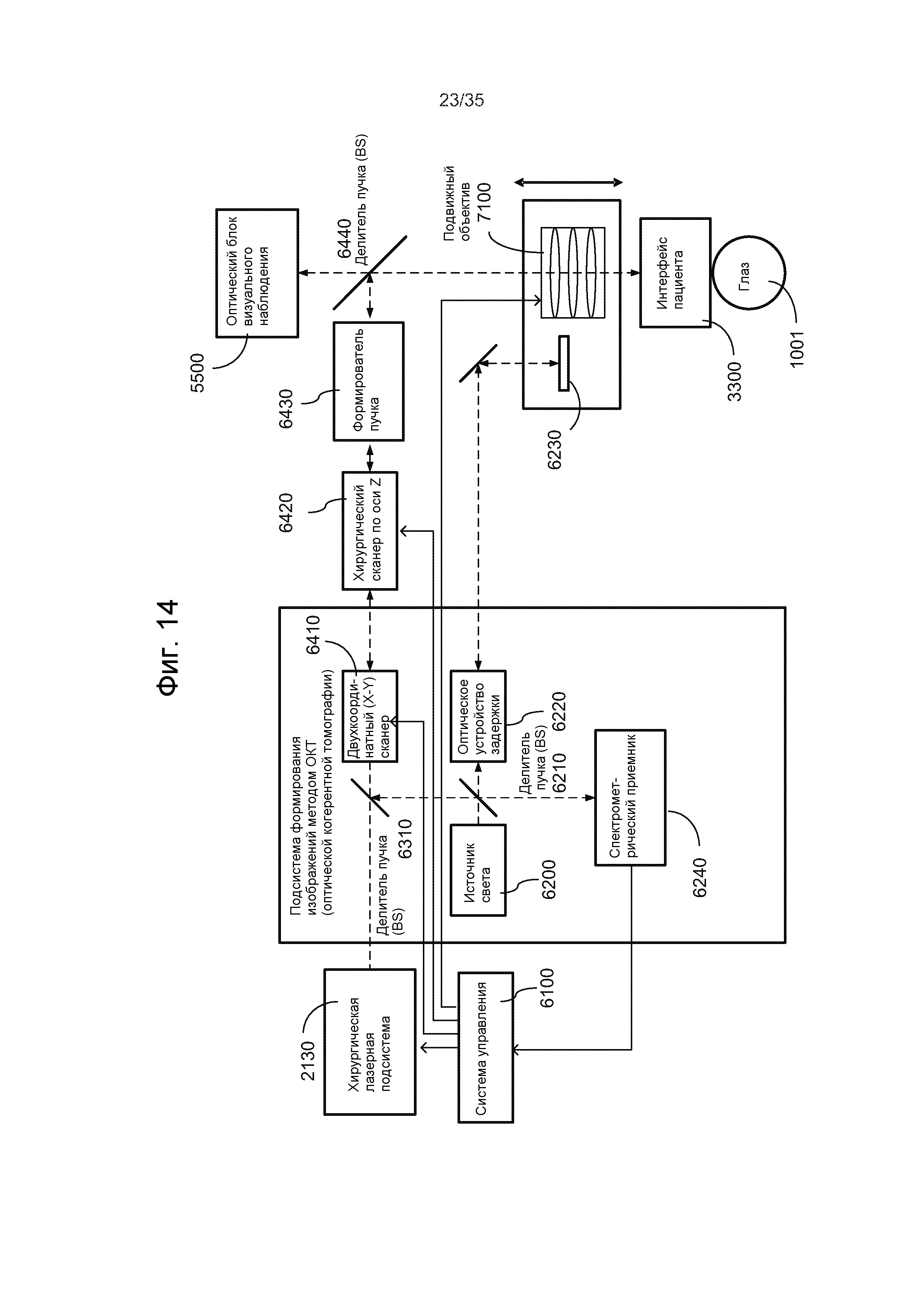
Например, на Фиг.7 показана лазерная хирургическая система, основанная на оптическом формировании изображений и уплощении. Данная система содержит импульсный лазер 1010 для генерации хирургического лазерного пучка 1012 лазерных импульсов и оптический модуль 1020 для приема хирургического лазерного пучка 1012 и фокусировки и нацеливания сфокусированного хирургического лазерного пучка 1022 на целевую ткань 1001, например, глаз, чтобы вызвать фотодеструкцию в целевой ткани 1001. Чтобы создавать контактную поверхность для пропускания лазерных импульсов в целевую ткань 1001 и света, исходящего из целевой ткани 1001, сквозь контактную поверхность, можно обеспечить аппланационную пластину для контактирования с целевой тканью 1001. Следует отметить, что для сбора света 1050, несущего изображения 1050 целевых тканей или информацию для формирования изображений из целевой ткани 1001, чтобы создавать изображение целевой ткани 1001, обеспечено оптическое устройство 1030 формирования изображений. Сигнал 1032 формирования изображений из устройства 1030 формирования изображений передается в системный модуль 1040 управления. Системный модуль 1040 управления выполняет функцию обработки полученных изображений из устройства 1030 формирования изображений и управления оптическим модулем 1020 для регулировки положения и фокуса хирургического лазерного пучка 1022 в целевой ткани 1001 на основании информации из полученных изображений. Оптический модуль 1020 может содержать, по меньшей мере, одну линзу и может дополнительно содержать, по меньшей мере, один отражатель. В составе оптического модуля 1020 может содержать исполнительный механизм управления для регулировки фокусировки и направления пучка по сигналу 1044 управления пучком из системного модуля 1040 управления. Модуль 1040 управления может также управлять импульсным лазером 1010 посредством сигнала 1042 управления лазером.
Оптическое устройство 1030 формирования изображений может быть выполнено с возможностью формирования оптического визуализирующего пучка, который является отдельным от хирургического лазерного пучка 1022, чтобы зондировать целевую ткань 1001, и отраженный свет оптического визуализирующего пучка собирается оптическим устройством 1030 формирования изображений, чтобы получать изображения целевой ткани 1001. Один пример данного оптического устройства 1030 формирования изображений представляет собой модуль формирования изображений методом оптической когерентной томографии (ОКТ), который использует два визуализирующих пучка, один зондирующий пучок, направляемый в целевую ткань 1001 сквозь аппланационную пластину, и другой опорный пучок, направляемый по опорному оптическому пути, чтобы данные пучки оптически интерферировали между собой для получения изображений целевой ткани 1001. В других вариантах осуществления, оптическое устройство 1030 формирования изображений может использовать свет, рассеянный или отраженный целевой тканью 1001, для получения изображений без направления упомянутого оптического визуализирующего пучка на целевую ткань 1001. Например, устройство 1030 формирования изображений может быть чувствительной матрицей из чувствительных элементов, например, датчиков CCD (на основе приборов с зарядовой связью) или датчиков CMS (датчиков измерения тока). Например, изображения побочного продукта фотодеструкции, созданного хирургическим лазерным пучком 1022, могут быть получены оптическим устройством 1030 формирования изображений, чтобы управлять фокусировкой и позиционированием хирургического лазерного пучка 1022. Когда оптическое устройство 1030 формирования изображений выполнено с возможностью управления настройкой хирургического лазерного пучка с использованием изображения побочного продукта фотодеструкции, то оптическое устройство 1030 формирования изображений получает изображения побочного продукта фотодеструкции, например, лазерных пузырьков или полостей. Устройством 1030 формирования изображений может быть также устройство ультразвуковой визуализации для получения изображений по акустическим изображениям.
Системный модуль 1040 управления обрабатывает данные изображения из устройства 1030 для формирования изображений, которые содержат информацию, касающуюся смещения положения, для побочного продукта фотодеструкции из положения целевой ткани в целевой ткани 1001. На основании информации, полученной из изображения, формируется сигнал 1044 управления пучком для управления оптическим модулем 1020, который регулирует лазерный пучок 1022. В системном модуле 1040 управления может содержаться блок цифровой обработки для выполнения разнообразной обработки данных для настройки лазера.
Вышеописанные методы и системы можно применять для подачи лазерных импульсов с высокой частотой повторения в подповерхностные целевые объекты с точностью, необходимой для подачи в заданное место контактирующих импульсов, как требуется при применении для разрезания или объемной деструкции. Решение данной задачи выполнимо с использованием или без использования опорного источника на поверхности целевого объекта и может учитывать перемещение целевого объекта после уплощения или во время подачи лазерных импульсов в заданное место.
Аппланационная пластина в настоящей системе обеспечена для упрощения и управления высокоскоростным позиционированием, необходимым для подачи лазерных импульсов в ткань. Упомянутая аппланационная пластина может быть выполнена из прозрачного материала, например, стекла, с предварительно заданной контактной поверхностью для контакта с тканью, таким образом, чтобы контактная поверхность формировала четко определенный оптический интерфейс с тканью. Данный четко определенный интерфейс может облегчать пропускание и фокусировку лазерного света в ткани, для регулировки или уменьшения оптических аберраций или изменений (например, обусловленных специфическими оптическими свойствами глаза или изменениями, которые происходят при высыхании поверхности), которые являются в высшей степени критическими на границе раздела воздух-ткань, которая находится в глазу на передней поверхности роговицы. Для различных применений и целевых объектов внутри глаза и других тканях разработано большое число контактных линз, в том числе, линзы, которые являются одноразовыми или используются многократно. Контактное стекло или аппланационная пластина на поверхности целевой ткани служат как базовая пластина, относительно которой фокусируют лазерные импульсы путем регулировки фокусирующих элементов в системе подачи лазерного излучения. Данный подход обладает собственными дополнительными преимуществами, обеспечиваемыми ранее описанным контактным стеклом или аппланационной пластиной и включающими в себя управление оптическими параметрами поверхности ткани. Соответственно, лазерные импульсы можно точно подавать с высокой скоростью в требуемое местоположение (точку взаимодействия) в целевой ткани относительно аппланационной базовой пластины, при незначительном оптическом искажении лазерных импульсов.
Оптическое устройство 1030 формирования изображений, показанное на Фиг.7, получает изображения целевой ткани 1001 через аппланационную пластину. Модуль 1040 управления обрабатывает собранные изображения для выделения позиционной информации из полученных изображений и использует выделенную позиционную информацию как позиционную базу отсчета или ориентир для управления положением и фокусом хирургического лазерного пучка 1022. Данную лазерную хирургическую операцию с управлением по изображениям можно осуществлять без опоры на аппланационную пластину в качестве позиционной базы отсчета, так как положение аппланационной пластины, обычно, изменяется вследствие влияния различных вышеописанных факторов. Следовательно, хотя аппланационная пластина обеспечивает требуемый оптический интерфейс для входа хирургического лазерного пучка в целевую ткань и для получения изображений целевой ткани, аппланационную пластину сложно применять как позиционную базу отсчета, чтобы настраивать хирургический лазерный пучок и управлять им по положению и фокусу для точной подачи лазерных импульсов. Управление по изображениям положением и фокусом хирургического лазерного пучка при посредстве устройства 1030 формирования изображений и модуля 1040 управления позволяет использовать изображения целевой ткани 1001, например, изображения внутренних структур глаза, в качестве позиционных баз отсчета, без применения аппланационной пластины для обеспечения позиционной базы отсчета.
Кроме физических эффектов уплощения, которое непропорционально влияет на локализацию внутренних тканевых структур, в процессе некоторых хирургических операций, возможно, потребуется система прицеливания для прогнозирования или учета нелинейных характеристик фотодеструкции, которая может происходить при использовании лазеров с малой длительностью импульсов. Фотодеструкция может создавать затруднения при настройке пучка и нацеливании пучка. Например, один из нелинейных оптических эффектов в тканевом материале, при взаимодействии с лазерными импульсами, во время фотодеструкции заключается в том, что показатель преломления тканевого материала, испытывающего воздействие лазерных импульсов, больше не остается постоянным, а изменяется с изменением интенсивности света. Поскольку интенсивность света в лазерных импульсах пространственно изменяется в пределах пучка импульсного лазера вдоль и поперечно направлению распространения пучка импульсного лазера, то показатель преломления тканевого материала также пространственно изменяется. Одним из последствий упомянутой нелинейности показателя преломления является самофокусировка или самодефокусировка в тканевом материале, что изменяет фактический фокус и сдвигает положение фокуса пучка импульсного лазера внутри ткани. Поэтому точная настройка импульсного лазера на каждое положение целевой ткани в целевой ткани может также требовать учета влияния нелинейных оптических эффектов в тканевом материале на лазерный пучок. Вследствие разных физических характеристик, например, твердости, или вследствие учета оптических свойств, например, поглощения или рассеяния импульсного лазерного света, распространяющегося в конкретную область, энергию лазерных импульсов можно настраивать, чтобы обеспечивать одинаковый физический эффект в разных областях целевого объекта. В данных случаях, различия между нелинейными эффектами фокусировки импульсов с разными значениями энергии могут также влиять на настройку лазера и прицеливание лазерных хирургических импульсов. В этом отношении, прямые изображения, полученные из целевой ткани устройством 1030 формирования изображений, можно использовать для контроля фактического положения хирургического лазерного пучка 1022, которое отражает комбинированные эффекты нелинейных оптических эффектов в целевой ткани и обеспечивает позиционные базы отсчета для управления положением пучка и фокусом пучка.
Методы, устройства и системы, описанные в настоящей заявке, можно использовать в комбинации с аппланационной пластиной, чтобы обеспечивать управление формой и увлажнением поверхности, уменьшать оптические искажения и обеспечивать точную локализацию фотодеструкции относительно внутренних структур через уплощенную поверхность. Вышеописанное управление по изображениям положением и фокусом пучка можно применить в хирургических системах и процедурах, в которых применяют другие средства, кроме аппланационных пластин, для фиксации глаза, в том числе применяют вакуумное кольцо, которое может приводить к искажению или перемещению целевого объекта операции.
В последующих разделах, сначала описаны примеры методов, устройств и систем для автоматизированной лазерной хирургической операции с управлением по изображениям, основанных на разных степенях объединения функций формирования изображений в часть управления лазером систем. Оптический или другого рода модуль формирования изображений, например, модуль формирования изображений методом оптической когерентной томографии (ОКТ), можно применять для направления зондирующего света или пучка другого типа для получения изображений целевой ткани, например, структур внутри глаза. Хирургический лазерный пучок лазерных импульсов, например, фемтосекундных или пикосекундных лазерных импульсов можно направлять с использованием позиционной информации, содержащейся в полученных изображениях, чтобы управлять фокусировкой и позиционированием хирургического лазерного пучка по время хирургической операции. Как хирургический лазерный пучок, так и зондирующий световой пучок можно последовательно или одновременно направлять в целевую ткань во время хирургической операции таким образом, что хирургическим лазерным пучком можно управлять по полученным изображениям, чтобы обеспечивать прицеливание и точность хирургической операции.
Вышеописанную хирургическую операцию с управлением по изображениям можно применять для обеспечения точных и прицельных фокусировки и позиционирования хирургического лазерного пучка во время хирургической операции, поскольку управление пучком основано на изображениях целевой ткани после уплощения или фиксации целевой ткани либо непосредственно до или почти одновременно с подачей хирургических импульсов. Следует отметить, что некоторые параметры целевой ткани, например, глаза, измеренные до хирургической операции, могут изменяться во время хирургической операции под влиянием различных факторов, например, подготовки целевой ткани (например, фиксации глаза к аппланационной линзе) и изменение целевой ткани хирургическими операциями. Поэтому измеренные параметры целевой ткани до влияния упомянутых факторов и/или хирургической операции могут больше не отражать физических условий в целевой ткани во время хирургической операции. Настоящая лазерная хирургическая операция с управлением по изображениям может смягчать технические проблемы в связи с данными изменениями, касающиеся фокусировки и позиционирования хирургического лазерного пучка до и во время хирургической операции.
Настоящую хирургическую операцию с управлением по изображениям можно эффективно применять для точных хирургических операций внутри целевой ткани. Например, при выполнении лазерной хирургической операции внутри глаза, лазерный свет фокусируют внутри глаза для обеспечения оптического разрушения целевой ткани, и данные оптические взаимодействия могут изменять внутреннюю структуру глаза. Например, хрусталик может изменять свои положение, форму, толщину и диаметр во время аккомодации, не только между предварительным измерением и хирургической операций, но также во время хирургической операции. Прикрепление глаза к хирургическому инструменту механическим средством может изменять форму глаза не вполне определенным образом, и, кроме того, изменение может варьироваться во время хирургической операции под влиянием различных факторов, например, движения пациента. Крепежное средство содержит фиксацию глаза вакуумным кольцом и уплощение глаза плоской или криволинейной линзой. Приведенные изменения достигают нескольких миллиметров. Механические базирование и фиксация поверхности глаза, например, передней поверхности роговицы или лимба, не достаточно эффективны при выполнении высокоточной лазерной микрохирургической операции внутри глаза.
Формирование изображений после подготовки или почти одновременно в течение настоящей лазерной хирургической операции с управлением по изображениям можно применять для установления трехмерных позиционных баз отсчета между внутренними элементами глаза и хирургическим инструментом в окружающих условиях, в которых изменения происходят до и во время хирургической операции. Информация о позиционной базе отсчета, обеспечиваемая посредством формирования изображения до уплощения и/или фиксации глаза или в течение фактической хирургической операции отражает эффекты изменений в глазу и, следовательно, обеспечивает точное управление фокусировкой и позиционированием хирургического лазерного пучка. Система, в основу которой положена настоящая лазерная хирургическая операция с управлением по изображениям, может быть выполнена просто в конструктивном отношении и экономично. Например, участок оптических компонентов, относящихся к наведению хирургического лазерного пучка, можно использовать совместно с оптическими компонентами для наведения зондирующего светового пучка с целью формирования изображений целевой ткани, чтобы упростить конструкцию устройства и оптическую настройку и калибровку визуализирующего и хирургического световых пучков.
В нижеописанных лазерных хирургических системах, управляемых по изображениям, используют формирование изображений методом ОКТ в качестве примера инструмента для формирования изображений, и можно также применять другие устройства формирования изображений методом, отличающимся от ОКТ, чтобы получать изображения для управления хирургическими лазерами в процессе хирургической операции. Как показано в нижеприведенных примерах, объединение визуализирующих и хирургических подсистем можно осуществлять в разной степени. В простейшей форме без объединения аппаратных средств, визуализирующие и лазерные хирургические подсистемы разделены и могут обмениваться данными через интерфейсы. Данные конструкции могут обеспечивать гибкость конструкций двух подсистем. Объединение между двумя подсистемами некоторых аппаратных компонентов, например, интерфейса пациента, дополнительно расширяет функциональные возможности посредством обеспечения более точного совмещения операционного поля с аппаратными компонентами, более точной калибровки и может усовершенствовать поток рабочих действий. С повышением степени объединения между двумя подсистемами, данную систему можно делать все более экономичной и компактной, и калибровка системы будет еще более простой и более стабильной во времени. Примеры лазерных хирургических систем с управлением по изображениям, представленные на Фиг.8-16, характеризуются различными степенями объединения.
Одно осуществление настоящей лазерной хирургической системы с управлением по изображениям, например, содержит хирургический лазер, который генерирует хирургический лазерный пучок хирургических лазерных импульсов, которые вызывают хирургические изменения в оперируемой целевой ткани; держатель интерфейса пациента, который приводит интерфейс пациента в контакт с целевой тканью для фиксации целевой ткани в заданном положении; и модуль подачи лазерного пучка, расположенный между хирургическим лазером и интерфейсом пациента и выполненный с возможностью направления хирургического лазерного пучка на целевую ткань через интерфейс пациента. Упомянутый модуль подачи лазерного пучка может выполнять функцию сканирования хирургического лазерного пучка в целевой ткани в соответствии с предварительно заданным операционным паттерном. Приведенная система содержит также модуль управления лазером, который управляет работой хирургического лазера и управляет модулем подачи лазерного пучка для формирования предварительно заданного операционного паттерна, и модуль ОКТ, установленный относительно интерфейса пациента таким образом, чтобы находиться в известном пространственном положении относительно интерфейса пациента и целевой ткани, зафиксированной к интерфейсу пациента. Модуль ОКТ выполнен с возможностью направления оптического зондирующего пучка в целевую ткань и приема зондирующего света оптического зондирующего пучка, отраженного из целевой ткани, чтобы получать изображения ОКТ целевой ткани в то время, когда хирургический лазерный пучок направляют в целевую ткань для выполнения хирургической операции, так что оптический зондирующий пучок и хирургический лазерный пучок распространяются в целевой ткани одновременно. Модуль ОКТ обменивается данными с модулем управления лазером, для передачи информации собранных изображений ОКТ в модуль управления лазером.
Кроме того, модуль управления лазером в данной конкретной системе реагирует на информацию полученных изображений ОКТ путем управления модулем подачи лазерного пучка во время фокусировки и сканирования хирургического лазерного пучка и регулирует фокусировку и сканирование хирургического лазерного пучка в целевой ткани на основании позиционной информации из полученных изображений ОКТ.
В некоторых вариантах осуществления, возможно, не обязательно получать полное изображение целевой ткани для совмещения целевой зоны с хирургическим инструментом, и, возможно, достаточно получить изображение участка целевой ткани, например, нескольких точек, из операционной области, например, естественных или искусственных ориентиров. Например, твердое тело имеет шесть степеней подвижности в 3-мерном пространстве, и для описания твердого тела будет достаточно шести независимых точек. Когда точный размер операционной области не известен, для обеспечения позиционной базы отсчета необходимо обеспечить дополнительные точки. В этом отношении, несколько точек можно использовать для определения положения и кривизны передней и задней поверхностей, которые, обычно, являются разными, и толщины и диаметра хрусталика человеческого глаза. На основании упомянутых данных, тело, составленное из двух половин из эллипсоидных тел с данными параметрами, может аппроксимировать и визуализировать хрусталик для практических целей. В другом варианте осуществления, информацию из полученного изображения можно объединять с информацией из других источников, например, предоперационных измерений толщины хрусталика, которые используют как входные данные для контроллера.
На Фиг.8 представлен один пример лазерной хирургической системы с управлением по изображениям, с раздельными лазерной хирургической системой 2100 и системой 2200 формирования изображений. Лазерная хирургическая система 2100 содержит лазерную подсистему 2130 с хирургическим лазером, который генерирует хирургический лазерный пучок 2160 хирургических лазерных импульсов. Модуль 2140 подачи лазерного пучка выполнен с возможностью направления хирургического лазерного пучка 2160 из лазерной подсистемы 2130 в целевую ткань 1001 через интерфейс 2150 пациента и может выполнять функцию сканирования хирургического лазерного пучка 2160 в целевой ткани 1001 по предварительно заданному операционному паттерну. Модуль 2120 управления лазером выполнен с возможностью управления работой хирургического лазера в лазерной подсистеме 2130 по каналу 2121 связи и управляет модулем 2140 подачи лазерного пучка по каналу 2122 связи, чтобы формировать предварительно заданный операционный паттерн. Держатель интерфейса пациента выполнен с возможностью приведения интерфейса 2150 пациента в контакт с целевой тканью 1001 для фиксации целевой ткани 1001 в заданном положении. Интерфейс 2150 пациента может быть осуществлен с возможностью содержания контактной линзы или аппланационной линзы с плоской или криволинейной поверхностью для согласованного по форме сцепления с передней поверхностью глаза и фиксации глаза в заданном положении.
Система 2200 формирования изображений, показанная на Фиг.8, может быть модулем ОКТ, установленный относительно интерфейса 2150 пациента хирургической системы 2100 таким образом, чтобы находиться в известном пространственном положении относительно интерфейса 2150 пациента и целевой ткани 1001, зафиксированной к интерфейсу 2150 пациента. Упомянутый модуль ОКТ 2200 может быть выполнен в конфигурации с собственным интерфейсом 2240 пациента для взаимодействия с целевой тканью 1001. Система 2200 формирования изображений содержит модуль 2220 управления формированием изображений и подсистему 2230 формирования изображений. Подсистема 2230 содержит источник света для генерации визуализирующего пучка 2250 для формирования изображения целевого объекта 1001 и блок подачи визуализирующего пучка, чтобы направлять оптический зондирующий пучок или визуализирующий пучок 2250 в целевую ткань 1001 и принимать отраженный зондирующий свет 2260 оптического визуализирующего пучка 2250 из целевой ткани 1001 для получения изображений ОКТ целевой ткани 1001. Как оптический визуализирующий пучок 2250, так и хирургический пучок 2160 можно одновременно направлять на целевую ткань 1001, чтобы обеспечивать последовательно или одновременно формирование изображений и хирургическую операцию.
Как показано на Фиг.8, интерфейсы 2110 и 2210 связи обеспечены как в лазерной хирургической системе 2100, так и в системе 2200 формирования изображений для поддержки связи между управлением лазером посредством модуля 2120 управления лазером и формированием изображений посредством системы 2200 формирования изображений, так что модуль ОКТ 2200 может передавать информацию полученных изображений ОКТ в модуль 2120 управления лазером. В ответ на информацию полученных изображений ОКТ, модуль 2120 управления лазером в представленной системе реагирует управлением модулем 2140 подачи лазерного пучка при фокусировке и сканировании хирургического лазерного пучка 2160 и динамически настраивает фокусировку и сканирование хирургического лазерного пучка 2160 в целевой ткани 1001 на основании позиционной информации из полученных изображений ОКТ. Объединение лазерной хирургической системы 2100 с системой 2200 формирования изображений имеет место, главным образом, за счет связи между интерфейсами 2110 и 2210 связи на уровне программного обеспечения.
В данном и других примерах возможно также объединение различных подсистем или устройств. Например, в системе могут быть также обеспечены некоторые диагностические инструменты, например, волновые аберрометры, устройства для измерения топографии роговицы, или предоперационную информацию из упомянутых устройств можно использовать для дополнения внутриоперационного формирования изображений.
На Фиг.9 представлен пример лазерной хирургической системы с управлением по изображениям. Система формирования изображений и хирургическая система совместно используют общий интерфейс 3300 пациента, который иммобилизует целевую ткань 1001 (например, глаз), без применения двух отдельных интерфейсов пациента, показанных на Фиг.8. Хирургический пучок 3210 и визуализирующий пучок 3220 объединяются в интерфейсе 3330 пациента и направляются в целевой объект 1001 посредством общего интерфейса 3300 пациента. Кроме того, обеспечен общий модуль 3100 управления для управления как подсистемой 2230 формирования изображений, так и хирургической частью (лазерной подсистемой 2130 и системой 2140 подачи пучка). Приведенная более высокая степень объединения части формирования изображений с хирургической частью обеспечивает возможность точной калибровки двух подсистем и стабильность положения объема пациента и оперативного вмешательства. Общий корпус 3400 выполнен с возможностью вмещения как хирургической подсистемы, так и подсистемы формирования изображений. Когда две системы не объединены в общем корпусе, то общий интерфейс 3300 пациента может быть частью либо подсистемы формирования изображений, либо хирургической подсистемы.
На Фиг.10 представлен пример лазерной хирургической системы с управлением по изображениям, в которой лазерная хирургическая система и система формирования изображений совместно используют как общий модуль 4100 подачи пучка, так и общий интерфейс 4200 пациента. Данный уровень объединения дополнительно упрощает конструкцию системы и процесс управления системой.
В одном варианте осуществления, система формирования изображений в вышеописанном и других примерах может быть системой оптической вычислительной томографии (ОКТ), и лазерная хирургическая система является офтальмологической хирургической системой на базе фемтосекундного или пикосекундного лазера. В томографии ОКТ, свет от широкополосного источника света с низкой когерентностью, например, суперлюминесцентного диода, делится на два отдельных пучка, когерентный и сигнальный пучки. Сигнальный пучок является визуализирующим пучком, посылаемым в целевой объект операции, и отраженный свет визуализирующего пучка собирают и когерентно рекомбинируют с опорным пучком для формирования интерферометра. Сканирование сигнального пучка перпендикулярно оптической оси оптической системы или направления распространения света обеспечивает пространственную разрешающую способность в направлении осей x-y, при этом, разрешающую способность по глубине получают посредством выделения разностей между длинами хода в опорном плече и отраженного сигнального пучка в сигнальном плече интерферометра. Хотя двухкоординатный (x-y) сканер в разных вариантах осуществления ОКТ является, по существу, одним и тем же, сравнение длин путей и получение информации сканирования по оси z может совершаться разными способами. В одном варианте осуществления, известном как ОКТ во временной области, опорное плечо, например, непрерывно регулируют для изменения его длины пути, а фотоприемник регистрирует интерференционную модуляцию интенсивности рекомбинированного пучка. В других вариантах осуществления, опорное плечо является, по существу, статическим, и анализируют спектр комбинированного света для определения интерференции. Фурье-преобразование спектра комбинированного пучка обеспечивает пространственную информацию о рассеянии из внутренней области образца. Данный способ известен как способ ОКТ в спектральной области или в Фурье-области. В другом варианте осуществления, известном как ОКТ с качающейся частотой (S. R. Chinn, et. al, Opt. Lett. 22, 1997), используют узкополосный источник света с частотой, быстро качающейся по спектральному диапазону. Интерференцию между опорным и сигнальным плечами регистрируют быстродействующим приемником и динамическим анализатором сигналов. В приведенных примерах, в качестве источника света можно применить диодный лазер с внешним резонатором или частотно перестраиваемый лазер, работающий в режиме синхронизации мод в частотной области (FDML), разработанный для данной цели (R. Huber et. Al. Opt. Express, 13, 2005) (S. H. Yun, IEEE J. of Sel. Q. El. 3(4) p. 1087-1096, 1997). Фемтосекундный лазер, применяемый в качестве источника света в системе ОКТ, может иметь достаточную ширину полосы частот и может обеспечить дополнительные преимущества повышения отношений сигнал-шум.
Устройство для формирования изображений методом ОКТ в системах, приведенных в настоящем документе, можно применять для выполнения различных функций формирования изображений. Например, метод ОКТ можно применять, чтобы подавлять комплексно сопряженные составляющие, образующиеся из-за оптической конфигурации системы или присутствия аппланационной пластины, получать изображения ОКТ выбранных местоположений внутри целевой ткани для обеспечения трехмерной позиционной информации для контроля фокусировки и сканирования хирургического лазерного пучка внутри целевой ткани или получать изображения ОКТ выбранных местоположений на поверхности целевой ткани или на аппланационной пластине с тем, чтобы обеспечивать позиционное совмещение для управления изменениями ориентации, которые происходят вместе с изменениями положения целевого объекта, например, от вертикального до обращенного вверх. Метод ОКТ можно калибровать путем выполнения процесса позиционного совмещения, основанного на размещении меток или маркеров в одной позиционной ориентации целевого объекта, которые, после этого, могут быть зарегистрированы модулем ОКТ, когда целевой объект находится в другой позиционной ориентации. В других вариантах осуществления, систему формирования изображений методом ОКТ можно применить для формирования зондирующего светового пучка, который поляризован для оптического сбора информации о внутренних структурах глаза. Лазерный пучок и зондирующий световой пучок могут быть поляризованными в разных плоскостях поляризации. Метод ОКТ может содержать механизм управления поляризацией, который управляет зондирующим светом, применяемым для упомянутой оптической томографии, для поляризации в одной плоскости поляризации, при проходе к глазу, и в отличающейся плоскости поляризации, при проходе из глаза. Механизм управления поляризацией может содержать, например, волновую пластину или устройство поворота плоскости поляризации на основе эффекта Фарадея.
Система на Фиг.10 изображена в конфигурации OCT в спектральной области и может иметь конфигурацию, допускающую совместное использование фокусирующей оптической части в модуле подачи пучка как хирургической системой, так и системой формирования изображений. Основные требования к оптике зависят от рабочей длины волны, качества изображения, разрешающей способности, искажений и т.п. Лазерная хирургическая система может быть системой с фемтосекундным лазером с высокоапертурной системой, предназначенной для получения дифракционно-ограниченных размеров фокальной точки, например, около, 2-3 микрометров. Различные фемтосекундные офтальмологические хирургические лазеры могут работать на различных длинах волн, например, на длинах волн, приблизительно, 1,05 микрометров. Рабочую длину волны устройства формирования изображений можно выбрать близкой к длине волны лазера, для компенсации оптики на хроматические аберрации для обеих длин волн. Данная система может содержать третий оптический канал, канал визуального наблюдения, например, хирургический микроскоп, для обеспечения дополнительного устройства для формирования изображений, чтобы получать изображения целевой ткани. Если оптический путь для данного третьего оптического канала содержит оптику, используемую также хирургическим лазерным пучком и светом устройства для формирования изображений методом ОКТ, то совместно используемая оптика может быть сконфигурирована с компенсацией хроматических аберраций в видимом спектральном диапазоне для третьего оптического канала и спектральных диапазонах для хирургического лазерного пучка и визуализирующего пучка системы ОКТ.
На Фиг.11 представлен конкретный пример конструкции системы, показанной на Фиг.9, в котором сканер 5100 для сканирования хирургического лазерного пучка и формирователь 5200 пучка для формирования (коллимации и фокусировки) хирургического лазерного пучка является отдельным от оптики в модуле 5300 формирования изображений методом ОКТ, для управления визуализирующим пучком для ОКТ. Хирургическая система и система формирования изображений совместно используют модуль объектива 5600 и интерфейс 3300 пациента. Объектив 5600 направляет и фокусирует как хирургический лазерный пучок, так и визуализирующий пучок на интерфейс 3300 пациента, и управление фокусировкой пучка осуществляется модулем 3100 управления. Для направления хирургического и визуализирующего пучков обеспечены два делителя 5410 и 5420 пучка. Делитель 5420 пучка служит также для направления обратно возвращающегося визуализирующего пучка в модуль 5300 формирования изображений методом ОКТ. Два делителя 5410 и 5420 пучка также направляют свет от целевого объекта 1001 в оптический блок 5500 визуального наблюдения для непосредственного просмотра или формирования изображения целевого объекта 1001. Блок 5500 может быть системой формирования изображения хрусталика, чтобы хирург наблюдал целевой объект 1001, или камерой для получения изображения или видеоизображений целевого объекта 1001. Возможно использование различных делителей пучка, например, дихроичных и поляризационных делителей пучка, дифракционной решетки, голографического делителя пучка или их сочетаний.
В некоторых вариантах осуществления, на оптические компоненты может быть соответственно нанесено просветляющее покрытие как для хирургической длины волны, так и для длины волны ОКТ, чтобы ослабить блики от нескольких поверхностей на оптическом пути пучка. Иначе, отражения будут уменьшать пропускаемую мощность системы и снижать отношение сигнала к шуму за счет усиления фонового света в блоке формирования изображений методом ОКТ. Один из способов ослабления бликов в системе ОКТ состоит в том, чтобы поворачивать плоскость поляризации света, возвращающегося обратно из образца, волновой пластиной или фарадеевским вентилем, размещенным вблизи целевой ткани, и ориентировать поляризатор перед приемником системы ОКТ так, чтобы регистрировать, предпочтительно, свет, возвращающийся обратно из образца и ослаблять свет, рассеянный на оптических компонентах.
В лазерной хирургической системе, как хирургический лазер, так и система ОКТ могут содержать свой сканер пучка для одной и той операционной области в целевой ткани. Следовательно, сканирование пучка для хирургического лазерного пучка и сканирование пучка для визуализирующего пучка можно объединить для совместного использования общих сканирующих устройств.
На Фиг.12, пример данной системы представлен более подробно. В данном варианте осуществления двухкоординатный (x-y) сканер 6410 и сканер 6420 по оси z совместно используются обеими подсистемами. Для управления операциями системы, содержащими хирургические операции и операции формирования изображений, обеспечена общая система 6100 управления. Подсистема ОКТ содержит источник 6200 света для ОКТ, который создает визуализирующий свет, который делится на визуализирующий пучок и опорный пучок посредством делителя 6210 пучка. Визуализирующий пучок объединяется с хирургическим пучком в делителе 6310 пучка, для распространения по общему оптическому пути, ведущему к целевому объекту 1001. Сканеры 6410 и 6420 и блок 6430 формирователя пучка расположены после делителем 6310 пучка в направлении распространения света. Делитель 6440 пучка служит для направления визуализирующего и хирургического пучков в объектив 5600 и интерфейс 3300 пациента.
В подсистеме ОКТ, опорный пучок проходит сквозь делитель 6210 пучка в оптическое устройство 6220 задержки и отражается зеркалом 6230 обратного отражения. Отраженный визуализирующий пучок из целевого объекта 1001 направляется обратно в делитель 6310 пучка, который отражает, по меньшей мере, часть отраженного визуализирующего пучка в делитель 6210 пучка, где отраженный опорный пучок и отраженный визуализирующий пучок совмещаются и интерферируют между собой. Для регистрации интерференции и формирования изображений ОКТ целевого объекта 1001 служит спектрометрический приемник 6240. Информация изображений ОКТ передается в систему 6100 управления для управления хирургической лазерной подсистемой 2130, сканерами 6410 и 6420 и объективом 5600 и управления, тем самым, хирургическим лазерным пучком. В одном варианте осуществления, оптическое устройство 6220 задержки можно регулировать, чтобы изменять оптическую задержку для регистрации различных глубин в целевой ткани 1001.
Если ОКТ является системой, работающей во временной области, то две подсистемы используют два разных сканера по оси z, так как два сканера работают различным образом. В данном примере, сканер по оси z хирургической системы работает посредством изменения расходимости хирургического пучка в блоке формирователя пучка, без изменения длин путей пучка в пути хирургического пучка. С другой стороны, система ОКТ во временной области сканирует по z-направлению путем физического изменения пути пучка посредством переменной задержки или посредством смещения положения зеркала обратного отражения опорного пучка. После калибровки, два сканера по оси z могут быть синхронизированы модулем управления лазером. Зависимость между двумя перемещениями можно упростить до линейной или полиномиальной зависимости, с которой может работать модуль управления, или, в качестве альтернативы, калибровочные точки могут задавать таблицу преобразования для правильного масштабирования. Устройства ОКТ в спектральной/Фурье-области и с источником качающейся частоты не содержат сканера по оси z, длина в опорном плече является постоянной. Кроме меньшей стоимости, взаимная калибровка двух систем будет относительно прямолинейной. Отсутствует необходимость компенсации разностей, возникающих вследствие искажений изображения в фокусирующей оптике или вследствие различий между сканерами двух систем, так как данные сканеры являются совместно используемыми.
В практических вариантах осуществления хирургических систем, фокусирующий объектив 5600 установлен с возможностью сдвига или перемещения на основании, и вес объектива уравновешен для ограничения усилия, прилагаемого к глазу пациента. Интерфейс 3300 пациента может содержать аппланационную линзу, присоединяемую к держателю интерфейса пациента. Держатель интерфейса пациента закреплен на установочном блоке, который поддерживает фокусирующий объектив. Данный установочный блок выполнен с возможностью обеспечения устойчивого соединения между интерфейсом пациента и системой в случае неизбежного перемещения пациента и допускает плавную постановку интерфейса пациента на глаз. Фокусирующий объектив можно применять в различных вариантах осуществления, и один пример предложен в патенте США 5336215, выданном изобретателю Hsueh. Применение регулируемого фокусирующего объектива может изменять оптическую длину пути оптического зондирующего пучка в качестве составной части оптического интерферометра подсистемы ОКТ. Перемещение объектива 5600 и интерфейса 3300 пациента может изменять разности хода между опорным пучком и визуализирующим сигнальным пучком системы ОКТ неуправляемым способом, и упомянутое изменение может снижать качество определяемой методом ОКТ информации о глубине в ОКТ. Такая потеря информации будет происходить в системах ОКТ, работающих не только во временной области, но также в спектральной/Фурье-области и с качающейся частотой.
На Фиг.13-14 представлены примерные лазерные хирургические системы с управлением по изображениям, которые решают техническую проблему, связанную с регулируемым фокусирующим объективом.
Система, представленная на Фиг.13, обеспечивает позиционно-чувствительное устройство 7110, соединенное с перемещаемым фокусирующим объективом 7100, для измерения положения объектива 7100 на подвижной опоре и передачи измеренного положения в модуль 7200 управления в системе ОКТ. Система 6100 управления может управлять и передвигать положение объектива 7100 для настройки оптической длины пути, проходимого визуализирующим сигнальным пучком для работы системы ОКТ, и положение объектива 7100 измеряется и контролируется позиционным кодовым датчиком 7110 и подается непосредственно в модуль 7200 управления ОКТ. При составлении 3-х мерного изображения во время обработки данных ОКТ, модуль 7200 управления в системе ОКТ применяет алгоритм для компенсации разностей хода между опорным плечом и сигнальным плечом интерферометра внутри ОКТ, обусловленных перемещением фокусирующего объектива 7100 относительно интерфейса 3300 пациента. Надлежащая величина изменения положения объектива 7100, вычисленная модулем 7200 управления ОКТ, передается в систему 6100 управления, которая управляет объективом 7100 для изменения его положения.
На Фиг.14 показана другая примерная система, в которой зеркало 6230 обратного отражения в опорном плече интерферометра системы ОКТ или, по меньшей мере, одна часть в узле задержки распространения оптического сигнала в системе ОКТ жестко закреплено(на) к подвижному фокусирующему объективу 7100, и, поэтому, в сигнальном плече и опорном плече происходит одинаковое по величине изменение оптической длины пути, когда перемещается объектив 7100. По существу, в системе ОКТ, перемещение объектива 7100 на подвижном элементе автоматически компенсируется с учетом разностей хода, без дополнительной потребности в вычислительной компенсации.
В вышеприведенных примерах лазерных хирургических систем с управлением по изображениям, лазерная хирургическая система и система ОКТ используют разные источники света. При еще более полном объединении лазерной хирургической системы и системы ОКТ, фемтосекундный хирургический лазер в качестве источника света для хирургического лазерного пучка можно также применить в качестве источника света для системы ОКТ.
На Фиг.15 представлен пример, в котором для генерации как хирургического лазерного пучка для хирургических операций, так и зондирующего светового пучка для формирования изображений методом ОКТ применен фемтосекундный импульсный лазер в световом модуле 9100. Для разделения лазерного пучка на первый пучок в качестве как хирургического лазерного пучка и сигнального пучка для ОКТ и второй пучок в качестве опорного пучка для ОКТ обеспечен делитель 9300 пучка. Первый пучок направляется двухкоординатным (x-y) сканером 6410, который сканирует пучок в направлениях осей x и y, перпендикулярных направлению распространения первого пучка, и второй сканер (сканер по оси z) 6420, который изменяет расходимость пучка для регулировки фокусировки первого пучка на целевую ткань 1001. Упомянутый первый пучок выполняет хирургические операции на целевой ткани 1001, и часть упомянутого первого пучка рассеивается в обратном направлении к интерфейсу пациента и собирается объективом в качестве сигнального пучка для сигнального плеча оптического интерферометра системы ОКТ. Упомянутый отраженный свет объединяют со вторым пучком, который отражается зеркалом 6230 обратного отражения в опорном плече и задерживается регулируемым оптическим элементом 6220 задержки для ОКТ во временной области, чтобы управлять разностью хода между сигнальным и опорным пучками при формировании изображений разных глубин целевой ткани 1001. Система 9200 управления управляет работой системы.
Практика хирургических операций на роговице показала, что длительность импульса несколько сот фемтосекунд может быть достаточной для обеспечения высокой эффективности хирургических операций, хотя для ОКТ с подходящей разрешающей способностью по глубине требуется более широкая спектральная ширина полосы частот, создаваемая более короткими импульсами, например, короче нескольких десятков фемтосекунд. В данном контексте, конструкция устройства ОКТ определяет длительность импульсов фемтосекундного лазера.
На Фиг.16 показана другая система с управлением по изображениям, которая использует один импульсный лазер 9100 для генерации хирургического света и визуализирующего света. В выходном оптическом пути фемтосекундного импульсного лазера помещена нелинейная среда 9400, уширяющая спектр, чтобы использовать оптический нелинейный процесс, например, генерацию белого света или уширение спектра, для расширения спектральной ширины полосы частот импульсов от лазерного источника с относительно длительными импульсами несколько сотен фемтосекунд, обычно, применяемыми в хирургии. Среда 9400 может быть, например, волоконно-оптическим материалом. Требования к интенсивности света двух систем различны, и для удовлетворения упомянутым требованиям в двух системах можно применить механизм для настройки интенсивностей пучков. Например, в оптических путях двух систем можно обеспечить зеркала для управления пучками, прерыватели или аттенюаторы пучков для надлежащего управления наличием и интенсивностью пучка, при получении изображения ОКТ или выполнении хирургической операции, чтобы обеспечивать защиту пациента и чувствительных инструментов от чрезмерной интенсивности света.
Во время работы, примеры, приведенные на Фиг.8-16, можно использовать для выполнения лазерной хирургической операции с управлением по изображениям. На Фиг.17 представлен один пример способа для выполнения лазерной хирургической операции с использованием лазерной хирургической системы с управлением по изображениям. Данный способ использует в системе интерфейс пациента, чтобы контактировать с оперируемой целевой тканью и фиксировать ее в заданном положении, и направляет одновременно хирургический лазерный пучок лазерных импульсов из лазера в системе и оптический зондирующий пучок из модуля ОКТ в системе через интерфейс пациента в целевую ткань. Хирургическим лазерным пучком управляют для выполнения лазерной хирургической операции в целевой ткани, и модулем ОКТ управляют для получения изображений ОКТ внутренней области целевой ткани из света оптического зондирующего пучка, отраженного из целевой ткани. Позиционная информация в полученных изображениях ОКТ применяется при фокусировке и сканировании хирургического лазерного пучка для регулировки фокусировки и сканирования хирургического лазерного пучка в целевой ткани до или во время хирургической операции.
На Фиг.18 представлен пример изображения ОКТ глаза. Контактная поверхность аппланационной линзы в интерфейсе пациента может быть выполнена с кривизной, которая минимизирует искажения или изгибы в роговице под действием давления, оказываемого на глаз во время уплощения. После того, как глаз достаточно уплощается на интерфейсе пациента, может быть получено изображение ОКТ. Как показано на Фиг.18, на изображении ОКТ можно идентифицировать кривизну хрусталика и роговицы, а также расстояния между хрусталиком и роговицей. Менее выделяющиеся детали, например, границу перехода между эпителием и роговицей, также можно обнаружить. Каждую из упомянутых идентифицируемых деталей можно использовать как внутренний ориентир для привязки лазерных координат к глазу. Координаты роговицы и хрусталика можно оцифровать с использованием обоснованных алгоритмов машинного зрения, например, выделения контуров или, так называемых, блобов. После того, как установлены координаты хрусталика, данные координаты можно использовать для управления фокусировкой и позиционированием хирургического лазерного пучка для хирургической операции.
В альтернативном варианте, для формирования 3-ех мерной матрицы реперных отметок в местоположениях с известными координатами места можно использовать материал калибровочного образца. Изображение ОКТ материала калибровочного образца можно получать для установления отображающей зависимости между известными координатами места реперных отметок и изображениями ОКТ реперных отметок в полученном изображении ОКТ. Упомянутая отображающая зависимость сохраняется в памяти в виде цифровых калибровочных данных и применяется при управлении фокусировкой и сканированием хирургического лазерного пучка во время хирургической операции в целевой ткани, на основании изображений ОКТ целевой ткани, полученных во время хирургической операции. Система формирования изображений методом ОКТ использована в настоящем случае для примера, и данную калибровку можно применять с изображениями, полученными другими методами формирования изображений.
В лазерной хирургической системе с управлением по изображениям, описанной в настоящем документе, хирургический лазер может вырабатывать сравнительно высокие пиковые мощности, достаточные для возбуждения сильной полевой/многофотонной ионизации внутри глаза (т.е. внутри роговицы и хрусталика) при условии высокоапертурной фокусировки. В данном режиме, один хирургический лазерный импульс создает плазму внутри фокального объема. Охлаждение плазмы приводит, в результате, к четко определенной зоне разрушения или «пузырьку», который можно применить в качестве реперной точки. В нижеприведенных разделах предлагается описание калибровочной процедуры для калибровки хирургического лазера по системе формирования изображений методом ОКТ, с использованием зон разрушения, созданных хирургическим лазером.
Перед тем, как можно будет выполнять хирургическую операцию, систему ОКТ калибруют по хирургическому лазеру для определения относительного расположения, чтобы хирургическим лазером можно было управлять по положению в целевой ткани относительно положения, соответствующего изображениям в изображении ОКТ целевой ткани, полученном методом ОКТ. Один способ выполнения упомянутой калибровки использует предварительно калиброванный целевой объект или «фантом», который можно разрушать лазером, а также отображать методом ОКТ. Фантом может быть изготовлен из различных материалов, например, стекла или твердого пластика (например, PMMA (полиметилметакрилата)), чтобы материал мог постоянно записывать оптическое разрушение, создаваемое хирургическим лазером. Фантом можно также выбрать из условия обладания оптическими или другими свойствами (например, водосодержания), которые подобны свойствам целевого объекта операции.
Фантом может быть, например, цилиндрическим материалом, имеющим диаметр, по меньшей мере, 10 мм (или диаметр, равный диапазону сканирования системы подачи пучка) и длину цилиндра, по меньшей мере, 10 мм, перекрывающую расстояние от эпителия до хрусталика глаза или достигающую глубины сканирования хирургической системы. Верхняя поверхность фантома может быть криволинейной для плавного сопряжения с интерфейсом пациента, или материал фантома может быть сжимаемым для обеспечения полного уплощения. Фантом может содержать трехмерную сетку, чтобы как положение лазера (по осям x и y), так и фокус (z), а также изображение ОКТ можно было привязать к фантому.
На Фиг.19A-19D представлены две примерные конфигурации для фантома. На Фиг.19A изображен фантом, который сегментирован на тонкие диски. На Фиг.19B изображен один диск с нанесенным рисунком в виде сетки реперных меток в качестве базы отсчета для определения положения лазера поперек фантома (т.е. координат x и y). Координату z (по глубине) можно определять извлечением отдельного диска из пакета и формирования его изображения под конфокальным микроскопом.
На Фиг.19C изображен фантом, который можно разделить на две половины. Аналогично сегментированному фантому, показанному на Фиг.19A, данный фантом конструктивно выполнен с возможностью содержания сетки реперных меток в качестве базы отсчета для определения положения лазера в координатах x и y. Информацию о глубине можно выделить разделением фантома на две половины и измерением расстояния между зонами разрушения. Сводная информация может обеспечивать параметры для хирургической операции с управлением по изображениям.
На Фиг.20 изображена часть хирургической системы лазерной хирургической системы с управлением по изображениям. Данная система содержит отклоняющие зеркала, которые можно приводить в действие исполнительными устройствами, например, гальванометрами или катушками линейного электропривода, объектив и одноразовый интерфейс пациента. Хирургический лазерный пучок отражается от отклоняющих зеркал через объектив. Объектив фокусирует пучок непосредственно за интерфейсом пациента. Сканирование по координатам x и y выполняют изменением угла пучка относительно объектива. Сканирование в плоскости z обеспечивают изменением расходимости входящего пучка, с использованием системы линз перед отклоняющими зеркалами.
В данном примере, коническая секция одноразового интерфейса пациента может быть либо с воздушной прослойкой, либо сплошной, и секция сопряжения с пациентом содержит криволинейную контактную линзу. Криволинейная контактная линза может быть изготовлена из кварцевого стекла или другого материала, стойкого к формированию центров окраски, при облучении ионизирующим излучением. Радиус кривизны имеет верхнее предельное значение из радиусов, совместимых с глазом, например, приблизительно, 10 мм.
Первый этап калибровочной процедуры заключается в состыковке интерфейса пациента с фантомом. Кривизна фантома соответствует кривизне интерфейса пациента. После состыковки, следующий этап процедуры содержит создание оптического разрушения внутри фантома, чтобы создать реперные отметки.
На Фиг.21 приведены примеры фактических зон разрушения, созданных фемтосекундным лазером в стекле. Расстояние между зонами разрушения составляет, в среднем, 8 мкм (энергия в импульсе составляет 2,2 мкДж, при длительности 580 фс полной ширины на полувысоте). Оптическое разрушение, наблюдаемое на Фиг.21, показывает, что зоны разрушения, созданные фемтосекундным лазером, являются четко определенными и дискретными. В приведенном примере, зоны разрушения имеют диаметр, приблизительно, 2,5 мкм. Зоны оптического разрушения, аналогичные зонам, показанным на Фиг.20, создают в фантоме на различных глубинах, чтобы сформировать 3-ех мерную матрицу реперных отметок. Упомянутые зоны разрушения сравнивают с калиброванным фантомом либо посредством извлечения соответствующих дисков и формирования их изображений под конфокальным микроскопом (Фиг.19A), либо посредством разделения фантома на две половины и измерения глубины, с использованием микрометра (Фиг.19C). Координаты x и y можно установить из предварительно калиброванной сетки.
После разрушения фантома хирургическим лазером, выполняют ОКТ на фантоме. Система формирования изображений методом ОКТ обеспечивает 3-мерное представление фантома, с установлением зависимости между системой координат ОКТ и фантомом. С помощью системы формирования изображений можно обнаружить зоны разрушения. Систему ОКТ и лазер можно взаимно калибровать с использованием внутреннего стандарта фантома. После того, как выполняют взаимную привязку системы ОКТ и лазера, фантом можно выбросить.
Перед хирургической операцией можно выполнить поверку калибровки. Данный поверочный этап содержит создание оптического разрушения в различных положениях внутри второго фантома. Оптическое разрушение должно быть достаточно интенсивным, чтобы несколько зон разрушения, которые создают кольцевой паттерн, можно было отобразить методом ОКТ. После того, как паттерн создан, формируют изображение второго фантома методом ОКТ. Сравнение изображения ОКТ с лазерными координатами обеспечивает окончательную поверку калибровки системы перед хирургической операцией.
После подачи координат в лазер, внутри глаза можно выполнять лазерную хирургическую операцию. Лазерная операция содержит фотоэмульсификацию хрусталика лазером, а также другие лазерные воздействия на глаз. Хирургическую операцию можно прекратить в любой момент, и изображение переднего сегмента глаза (Фиг.17) можно сформировать повторно для контроля хода хирургической операции; кроме того, после того, как вводят линзу IOL, формирование изображения линзы IOL (со слабым уплощением или без него) обеспечивает информацию, относящуюся к положению линзы IOL в глазу. Данная информация может служить врачу для уточнения положения линзы IOL.
На Фиг.22 приведен пример процесса калибровки и хирургической операции после калибровки. Приведенный пример поясняет, что способ выполнения лазерной хирургической операции посредством лазерной хирургической системы с управлением по изображениям может содержать использование интерфейса в системе, который вводят в контакт с оперируемой целевой тканью для ее фиксации в заданном положении, для фиксации материала калибровочного образца в процессе калибровки, перед выполнением хирургической операции; направление хирургического лазерного пучка лазерных импульсов от лазера в системе к интерфейсу пациента в материал калибровочного образца для выжигания реперных отметок в выбранных трехмерных реперных местоположениях; направление оптического зондирующего пучка из модуля оптической когерентной томографии (ОКТ) в системе к интерфейсу пациента в материал калибровочного образца для получения изображений ОКТ выжженных опорных отметок; и установление зависимости между координатами места модуля ОКТ и выжженными опорными отметками. После установления зависимости, интерфейс пациента в системе используют для ввода в контакт с оперируемой целевой тканью и ее фиксации в заданном положении. Хирургический лазерный пучок лазерных импульсов и оптический зондирующий пучок направляют к интерфейсу пациента в целевую ткань. Хирургическим лазерным пучком управляют для выполнения лазерной хирургической операции в целевой ткани. Модуль ОКТ применяют для получения изображений ОКТ внутри целевой ткани от света оптического зондирующего пучка, отраженного из целевой ткани, и позиционную информацию в полученных изображениях ОКТ и установленную зависимость применяют при фокусировке и сканировании хирургического лазерного пучка, чтобы регулировать фокусировку и сканирование хирургического лазерного пучка в целевой ткани во время хирургической операции. Несмотря на то, что упомянутые калибровки можно выполнять непосредственно перед лазерной хирургической операцией, их можно также выполнять с различными промежутками перед процедурой, с применением поверок калибровки, которые демонстрировали отсутствие дрейфа или изменения калибровки в течение упомянутых промежутков.
Приведенные далее примеры служат описанием лазерных хирургических методов и систем с управлением по изображениям, в которых применяются изображения побочных продуктов лазерной фотодеструкции для настройки хирургического лазерного пучка.
На Фиг.23A-B представлен другой вариант осуществления настоящего метода, в котором фактические побочные продукты фотодеструкции в целевой ткани используют для управления, в дальнейшем, размещением лазера. Импульсный лазер 1710, например, фемтосекундный или пикосекундный лазер, используют для генерации лазерного пучка 1712 с лазерными импульсами для вызова фотодеструкции в целевой ткани 1001. Целевая ткань 1001 может быть частью части 1700 тела пациента, например, участком хрусталика одного глаза. Лазерный пучок 1712 фокусируют и направляют оптическим модулем лазера 1710 в некоторое положение целевой ткани в целевой ткани 1001 для получения некоторого хирургического эффекта. Поверхность целевого объекта оптически связана с оптическим модулем лазера посредством аппланационной пластины 1730, которая пропускает лазерную длину волны, а также длины волн изображения из целевой ткани. Аппланационная пластина 1730 может быть аппланационной линзой. Чтобы собирать отраженный или рассеянный свет или звук из целевой ткани 1001 для получения изображений целевой ткани 1001 либо до, либо после (или как до, так и после) того, как приложена аппланационная пластина, обеспечено устройство 1720 для формирования изображений. Затем, собранные данные изображения обрабатываются модулем управления лазерной системой для идентификации требуемого положения целевой ткани. Модуль управления лазерной системой перемещает или регулирует оптические или лазерные элементы на основании стандартных оптических моделей, чтобы обеспечить совмещение центра побочного продукта 1702 фотодеструкции с положением целевой ткани. Данный процесс может быть динамическим процессом настройки, в ходе которого изображения побочного продукта 1702 фотодеструкции и целевой ткани 1001 непрерывно контролируются в течение хирургического процесса для обеспечения надлежащего позиционирования лазерного пучка в каждое положение целевой ткани.
В одном варианте осуществления, лазерная система может работать в двух режимах: во-первых, в диагностическом режиме, в котором лазерный пучок 1712 сначала настраивают с использованием лазерных импульсов настройки для создания побочного продукта 1702 фотодеструкции для настройки, и, затем, в хирургическом режиме, в котором генерируются хирургические лазерные импульсы для фактического выполнения хирургической операции. В обоих режимах, изображения побочного продукта 1702 фотодеструкции и целевой ткани 1001 контролируются для управления настройкой пучка. На Фиг.17A показан диагностический режим, в котором для лазерных импульсов настройки в лазерном пучке 1712 можно устанавливать уровень энергии, отличающийся от уровня энергии хирургических лазерных импульсов. Например, лазерные импульсы настройки могут нести энергии меньше, чем хирургические лазерные импульсы, но достаточно, чтобы вызвать заметную фотодеструкцию в ткани для получения изображения побочного продукта 1702 фотодеструкции в устройстве 1720 формирования изображений. Разрешающая способность упомянутого грубого прицеливания может быть недостаточной для обеспечения требуемого хирургического эффекта. На основании собранных изображений можно правильно настроить лазерный пучок 1712. После данной первоначальной настройки, лазером 1710 можно управлять так, чтобы генерировать хирургические лазерные импульсы с энергией повышенного уровня для выполнения хирургической операции. Поскольку хирургические лазерные импульсы отличаются по уровню энергии от лазерных импульсов настройки, то нелинейные эффекты в тканевом материале во время фотодеструкции могут вызывать фокусировку лазерного пучка 1712 в положении, отличающемся от положения пучка в диагностическом режиме. Поэтому настройка, достигнутая в диагностическом режиме, является грубой настройкой, то, затем, можно выполнить дополнительную настройку, чтобы точно позиционировать каждый хирургический лазерный импульс в хирургическом режиме, когда хирургические лазерные импульсы выполняют реальную хирургическую операцию. Как показано на Фиг.23A, в хирургическом режиме устройство 1720 формирования изображений получает изображения из целевой ткани 1001, и модуль управления лазером регулирует лазерный пучок 1712, чтобы помещать положение 1714 фокуса лазерного пучка 1712 в требуемого положение целевой ткани в целевой ткани 1001. Приведенный процесс выполняется для каждого положения целевой ткани.
На Фиг.24 представлен один вариант осуществления способа настройки лазера, когда лазерный пучок сначала приблизительно нацеливается на целевую ткань, и, затем, для настройки лазерного пучка получают и используют изображение побочного продукта фотодеструкции. Изображение целевой ткани части тела в качестве целевой ткани и изображение ориентира на части тела контролируют для нацеливания импульсного лазерного пучка на целевую ткань. Изображения побочного продукта фотодеструкции и целевой ткани используют для регулировки импульсного лазерного пучка, чтобы совместить местоположение побочного продукта фотодеструкции с целевой тканью.
На Фиг.25 представлен один вариант осуществления способа настройки лазера, основанного на формировании изображения побочного продукта фотодеструкции в целевой ткани в процессе лазерной хирургической операции. В рамках данного способа, импульсный лазерный пучок нацеливают на местоположение целевой ткани внутри целевой ткани, чтобы подавать последовательность первоначальных лазерных импульсов настройки в местоположение целевой ткани. Изображения местоположения целевой ткани и побочного продукта фотодеструкции, вызванной первоначальными лазерными импульсами настройки, контролируют для получения местоположения побочного продукта фотодеструкции относительно местоположения целевой ткани. Местоположение побочного продукта фотодеструкции, вызванной хирургическими лазерными импульсами, отличающимися по уровню энергии хирургических импульсов от первоначальных лазерных импульсов настройки, идентифицируют, когда импульсный лазерный пучок хирургических лазерных импульсов посылают в местоположение целевой ткани. Импульсным лазерным пучком управляют для подачи хирургических лазерных импульсов с уровнем энергии хирургических импульсов. Положение импульсного лазерного пучка регулируют при уровне энергии хирургических импульсов, чтобы поместить местоположение побочного продукта фотодеструкции в идентифицированное местоположение. Во время контроля изображений целевой ткани и побочного продукта фотодеструкции, положение импульсного лазерного пучка с уровнем энергии хирургических импульсов регулируют, чтобы поместить местоположение побочного продукта фотодеструкции в соответствующее идентифицированное местоположение, при перемещении импульсного лазерного пучка в новое местоположение целевой ткани внутри целевой ткани.
На Фиг.26 представлена примерная лазерная хирургическая система, основанная на настройке лазера с использованием изображения побочного продукта фотодеструкции. Для фокусировки и нацеливания лазерного пучка на целевую ткань 1700 обеспечен оптический модуль 2010. Оптический модуль 2010 может содержать, по меньшей мере, одну линзу и может дополнительно содержать, по меньшей мере, один отражатель. В оптическом модуле 2010 содержится исполнительный механизм управления для регулировки фокусировки и направления пучка по сигналу управления пучком. Для управления как импульсным лазером 1010 по сигналу управления лазером, так и оптическим модулем 2010 по сигналу управления пучком обеспечен системный модуль 2020 управления. Системный модуль 2020 управления обрабатывает данные изображения из устройства 2030 для формирования изображений, которые содержат информацию, касающуюся смещения положения, для побочного продукта 1702 фотодеструкции из положения целевой ткани в целевой ткани 1700. На основании информации, полученной из изображения, формируется сигнал управления пучком для управления оптическим модулем 2010, который регулирует лазерный пучок. В системном модуле 2020 управления содержится блок цифровой обработки для выполнения разнообразной обработки данных для настройки лазера.
Устройство 2030 для формирования изображений может быть выполнено в различных формах, включая устройство для оптической когерентной томографии (ОКТ). Кроме того, возможно также использование устройства ультразвуковой визуализации. Положение лазерного фокуса перемещают так, чтобы поместить лазерный фокус, приблизительно, в местоположение на целевом объекте, с разрешающей способностью устройства для формирования изображений. Погрешность привязки лазерного фокуса к целевому объекту и возможные нелинейные оптические эффекты, например, самофокусировка, затрудняют точное предсказание местоположения лазерного фокуса и последующего акта фотодеструкции. Различные способы калибровки, в том числе, применение системной или компьютерной программы моделирования для прогнозирования фокусировки лазера внутри материала, можно использовать для обеспечения грубого нацеливания лазера внутри отображаемой ткани. Формирование изображения целевого объекта можно выполнять как до, так и после фотодеструкции. Положение побочных продуктов фотодеструкции относительно целевого объекта используют для сдвига фокальной точки лазера, чтобы точнее локализовать лазерный фокус и процесс фотодеструкции на целевом объекте или относительно него. Таким образом, акт фактической фотодеструкции используют, чтобы обеспечить точное прицеливание для посылки последующих хирургических импульсов.
Фотодеструкцию для прицеливания в диагностическом режиме можно выполнять с уровнем энергии ниже, выше или равном уровню, который требуется для последующей хирургической обработки в хирургическом режиме системы. Для корреляции локализации акта фотодеструкции, выполненной с отличной энергией в диагностическом режиме, с предсказанной локализацией при хирургической энергии, можно применить калибровку, поскольку уровень энергии оптического импульса может влиять на точное местоположение акта фотодеструкции. После того, как выполняют данные первоначальную локализацию и настройку, можно подводить объем или паттерн лазерных импульсов (или один импульс) относительно данного положения. В процессе подачи дополнительных лазерных импульсов можно формировать дополнительные выборочные изображения, чтобы обеспечить надлежащую локализацию лазера (выборочные изображения можно получать с использованием импульсов с меньшей, более высокой или такой же энергией). В одном варианте осуществления, для обнаружения кавитационного пузырька или ударной волны, или другого побочного продукта фотодеструкции применяют ультразвуковое устройство. Затем, можно находить корреляцию локализации упомянутого продукта со сформированным изображением целевого объекта, полученным ультразвуковым или другим способом. В другом варианте осуществления, устройство для формирования изображений является просто биологическим микроскопом или другим устройством для оптической визуализации акта фотодеструкции оператором, например, оптическим когерентным томографом. После первоначального наблюдения, лазерный фокус перемещают в положение требуемого целевого объекта, после чего подают паттерн или объем импульсов относительно упомянутого первоначального положения.
В качестве отдельного примера, лазерная система для точной подповерхностной фотодеструкции может содержать средство для генерации лазерных импульсов, способных создавать фотодеструкцию, с частотами повторения 100-1000 миллионов импульсов в секунду, средство для грубой фокусировки лазерных импульсов на целевой объект под поверхностью, с использованием изображения целевого объекта и калибровки лазерного фокуса по данному изображению, без создания хирургического эффекта, средство для обнаружения или визуализации под поверхностью, чтобы обеспечивать изображение или визуализацию целевого объекта, соседнего пространства или материала вокруг целевого объекта и побочных продуктов, по меньшей мере, одного акта фотодеструкции, приблизительно локализованных вблизи целевого объекта, средство для, по меньшей мере, однократной корреляции положения побочных продуктов фотодеструкции с положением подповерхностного целевого объекта и перемещения фокуса лазерного импульса в положение побочных продуктов фотодеструкции в подповерхностном целевом объекте или в относительное положение по отношению к целевому объекту, средство для подачи последующей серии из, по меньшей мере, одного дополнительного лазерного импульса по паттерну относительно положения, указанного вышеупомянутой точной корреляцией положения побочных продуктов фотодеструкции с положением подповерхностного целевого объекта, и средство для продолжения контроля актов фотодеструкции во время подачи последующей серии импульсов, чтобы дополнительно настроить положение последующих лазерных импульсов относительно того же или уточненного отображаемого целевого объекта.
Вышеописанные методы и системы можно применять для подачи лазерных импульсов с высокой частотой повторения в подповерхностные целевые объекты с точностью, необходимой для размещения контактирующих импульсов, что требуется для резки или объемной деструкции. Выполнение данной задачи возможно с использованием или без опорного источника на поверхности целевого объекта и может учитывать перемещение целевого объекта после уплощения или во время посылки лазерных импульсов.
Хотя настоящее описание содержит много деталей, данные детали следует интерпретировать не в смысле ограничений объема любого изобретения или того, на что можно притязать, а в качестве описаний признаков, специфических для конкретных вариантов осуществления. Некоторые признаки, которые представлены в настоящем описании в контексте отдельных вариантов осуществления, можно также реализовать в комбинации в одном варианте осуществления. И, наоборот, различные признаки, которые описаны в контексте одного варианта осуществления, можно также реализовать в нескольких вариантах осуществления по отдельности или в любой подходящей субкомбинации. Кроме того, хотя в вышеприведенном описании признаки могут быть представлены как функционирующие в некоторых комбинациях, и даже первоначально заявлены как таковые, однако, по меньшей мере, один признак из заявленной комбинации может быть, в некоторых случаях, исключен из комбинации, и заявленная комбинация может быть назначена субкомбинации или варианту субкомбинации.
Реферат
Изобретение относится к медицине. Универсальная офтальмологическая хирургическая система содержит: систему формирования изображений, сконфигурированную с возможностью поддержки определения целевой области при катаракте в хрусталике глаза; лазер, выполненный с возможностью подачи лазерных импульсов для лечения катаракты, чтобы выполнить фотодеструкцию участка определенной целевой области при катаракте. При этом система формирования изображений сконфигурирована также с возможностью поддержки определения целевой области при глаукоме в периферической области глаза; и лазер выполнен также с возможностью подачи лазерных импульсов для лечения глаукомы, чтобы создать один или более разрезов в целевой области при глаукоме посредством фотодеструкции. Причем лазерные импульсы для лечения катаракты и лазерные импульсы для лечения глаукомы подают при комплексной хирургической операции. 18 з.п. ф-лы, 26 ил.
Формула
систему формирования изображений, сконфигурированную с возможностью поддержки определения целевой области при катаракте в хрусталике глаза;
лазер, выполненный с возможностью подачи лазерных импульсов для лечения катаракты, чтобы выполнить фотодеструкцию участка определенной целевой области при катаракте; при этом указанная система формирования изображений сконфигурирована также с возможностью поддержки определения целевой области при глаукоме в периферической области глаза; и
лазер выполнен также с возможностью подачи лазерных импульсов для лечения глаукомы, чтобы создать один или более разрезов в целевой области при глаукоме посредством фотодеструкции; причем лазерные импульсы для лечения катаракты и лазерные импульсы для лечения глаукомы подают при комплексной хирургической операции.
лазер выполнен с возможностью подачи лазерных импульсов для лечения катаракты до лазерных импульсов для лечения глаукомы.
лазер выполнен с возможностью подачи лазерных импульсов для лечения катаракты после лазерных импульсов для лечения глаукомы.
лазер выполнен с возможностью подачи лазерных импульсов для лечения катаракты, по меньшей мере, частично, одновременно с лазерными импульсами для лечения глаукомы.
лазер выполнен с возможностью подачи лазерных импульсов для лечения глаукомы в, по меньшей мере, что-то одно из склеры, лимбальной области, участка угла глаза или корня радужной оболочки.
лазер выполнен с возможностью подачи лазерных импульсов для лечения глаукомы в соответствии с картиной, связанной с, по меньшей мере, чем-то одним из трабекулопластики, иридотомии или иридэктомии.
лазер выполнен с возможностью подачи лазерных импульсов для лечения глаукомы для формирования, по меньшей мере, чего-то одного из дренажного канала и отверстия для оттока внутриглазной жидкости.
лазер выполнен с возможностью формирования, по меньшей мере, чего-то одного из дренажного канала и отверстия для оттока внутриглазной жидкости таким образом, что имплантируемое устройство можно ввести во что-то одно из дренажного канала или отверстия для оттока внутриглазной жидкости.
дренажный канал или отверстие для оттока внутриглазной жидкости формируют с возможностью соединения передней камеры оперируемого глаза с поверхностью оперируемого глаза, что допускает снижение внутриглазного давления внутриглазной жидкости в оперируемом глазу.
использование одного и того же лазера для подачи как лазерных импульсов для лечения катаракты, так и лазерных импульсов для лечения глаукомы.
лазер выполнен с возможностью подачи лазерных импульсов для лечения глаукомы в оптимизированную целевую область при глаукоме,
при этом местоположение оптимизированной целевой области при глаукоме выбирают для меньшего рассеивания лазерных импульсов для лечения глаукомы, чем в склере глаза, и
меньшего нарушения оптического пути глаза сформированным дренажным каналом, чем центрально сформированным дренажным каналом.
целевая область при глаукоме является какой-то одной из граничной области между лимбом и склерой или области пересечения лимба и роговицы.
лазер выполнен с возможностью подачи лазерных импульсов для лечения глаукомы для формирования дренажного канала в направлении целевой области, выбранном для оптимизации альтернативных требований
меньшего рассеивания лазерных импульсов целевой областью для лечения глаукомы, чем в склере глаза, и
меньшего нарушения оптического пути глаза, чем центрально сформированным дренажным каналом.
лазер выполнен с возможностью
формирования изображения фотодеструкции, выполняемой лазерными импульсами для лечения катаракты; и
определения, по меньшей мере, участков целевой области при глаукоме по отображаемой фотодеструкции.
лазер выполнен с возможностью
формирования изображения фотодеструкции, выполняемой лазерными импульсами для лечения глаукомы; и
определения, по меньшей мере, участков целевой области при катаракте по отображаемой фотодеструкции.
лазерные импульсы для лечения катаракты подают с длиной волны λ-c лазера для лечения катаракты; и
лазерные импульсы для лечения глаукомы подают с длиной волны λ-g лазера для лечения глаукомы.
лазерные импульсы для лечения катаракты подают посредством интерфейса пациента с катарактой; и
лазерные импульсы для лечения глаукомы подаются посредством интерфейса пациента с глаукомой.
целевая область представляет собой граничную область между склерой и лимбом.
лазер выполнен с возможностью подачи лазерных импульсов с рабочей длиной волны для лечения катаракты и подачи лазерных импульсов с такой же рабочей длиной волны для лечения глаукомы.

Комментарии