Внутриглазные имплантаты, содержащие простамиды - RU2666603C2
Код документа: RU2666603C2
Чертежи










Описание
ПЕРЕКРЕСТНАЯ ССЫЛКА
В данной заявке заявляется приоритет согласно кодексу США, раздел 35, § 119 (е) по предварительной заявке на патент США №61/798291, поданной 15 марта 2013 года, предварительной заявке на патент США №61/877573, поданной 13 сентября 2013 года и предварительной заявке на патент США №61/898210, поданной 31 октября 2013 года, которые включены в данный документ в полном объеме посредством ссылки.
УРОВЕНЬ ТЕХНИКИ
[0001] Изобретение в целом относится к устройствам и способам лечения заболеваний глаза у пациента, а более конкретно - к внутриглазным имплантатам, которые обеспечивают пролонгированное высвобождение терапевтического агента в глаз, в который установлен имплантат, для лечения глазной гипертензии, например, путем снижения или по меньшей мере поддержания внутриглазного давления (ВГД), и к способам получения и использования таких имплантатов.
[0002] Агенты, понижающие давление в глазу, эффективны при лечении ряда различных гипертензивных состояний глаза, таких как приступы повышенного внутриглазного давления после хирургической или лазерной трабекулэктомии, глаукома, и как предоперационные дополнительные вспомогательные вещества.
[0003] Глаукома представляет собой заболевание глаза, которое часто характеризуется повышенным внутриглазным давлением. На основании ее этиологии, различают первичную или вторичную глаукому. Например, первичная глаукома у взрослых (врожденная глаукома) может быть либо открытоугольной, либо острой или хронической закрытоугольной. Вторичная глаукома возникает вследствие ранее перенесенных глазных заболеваний, таких как увеит, внутриглазные опухоли или расширенная катаракта.
[0004] Увеличение внутриглазного давления при глаукоме происходит вследствие затруднения оттока внутриглазной жидкости. При хронической открытоугольной глаукоме передняя камера и ее анатомические структуры выглядят практически нормально, но дренаж внутриглазной жидкости затруднен. При острой или хронической закрытоугольной глаукоме передняя камера неглубокая, радужно-роговичный угол сужен, а радужная оболочка может заслонять трабекулярную сеть на входе в канал Шлемма. Расширение зрачка может приводить к выталкиванию корня радужки по направлению к углу и может вызывать блокировку зрачка и, таким образом, спровоцировать острый приступ. Глаза с узкими углами передней камеры предрасположены к приступам острой закрытоугольной глаукомы различных степеней тяжести.
[0005] Вторичную глаукому может вызвать любое препятствие оттоку внутриглазной жидкости из задней камеры в переднюю камеру и впоследствии в канал Шлемма. Воспалительные заболевания передней камеры могут препятствовать оттоку влаги за счет полной задней синехии бомбированной радужки и могут закупоривать дренажный канал экссудатом. Другими распространенными причинами являются внутриглазные опухоли, расширенная катаракта, окклюзия центральной вены сетчатки, травма глаза, хирургические процедуры и внутриглазное кровоизлияние.
[0006] Снижение внутриглазного давления может способствовать предотвращению глаукомы или потери зрения вследствие глаукомы. В настоящий момент глазные капли, содержащие терапевтически активные агенты для снижения внутриглазного давления, назначаются многим пациентам, которые могут принимать капли один или более раз в день для снижения повышенного внутриглазного давления, связанного с глаукомой.
[0007] Было бы полезно предложить системы доставки лекарственных средств, которые можно имплантировать в глаз, такие как внутриглазные имплантаты, и способы использования таких систем, которые способны высвобождать терапевтический агент, такой как гипотензивный (или снижающий ВГД) агент, с постоянной или контролируемой скоростью в течение длительных периодов времени и в количествах с минимальными или без негативных побочных эффектов, благодаря чему снижается внутриглазное давление в глазу пациента, включая, но не ограничиваясь ими, пациентов, страдающих от или склонных к глаукоме.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
[0008] Длительное, долговременное снижение внутриглазного давления в глазу может обеспечиваться введением в глаз одного или более биодеградируемых внутриглазных имплантатов, представленных в данном документе. Биодеградируемый внутриглазной имплантат в соответствии с данным изобретением содержит или состоит из биодеградируемого полимерного материала и терапевтического агента, связанного с биодеградируемым полимерным материалом. Имплантат(-ы) можно вводить в глаз в качестве монотерапии, и он может доставлять терапевтический агент непосредственно в глазничную область глаза в количестве, эффективном для снижения повышенного внутриглазного давления (глазная гипертензия) в глазу в течение длительного периода, такого как, например, 1-6 месяцев или более. Имплантаты могут также использоваться для лечения или предотвращения глаукомы или других медицинских патологических состояний глаза, связанных с повышенным внутриглазным давлением.
[0009] Терапевтический агент, входящий в состав внутриглазного имплантата в соответствии с данным изобретением, содержит, преимущественно состоит или состоит из соединения, которое является эффективным для уменьшения внутриглазного давления в глазу с гипертензией. В некоторых вариантах реализации изобретения терапевтический агент содержит или состоит из соединения Формулы I или его фармацевтически приемлемой соли, или его сложноэфирного пролекарства

где волнистые сегменты представляют собой α- или β-связь, пунктирные линии представляют собой двойную связь или одинарную связь, R представляет собой замещенный гетероарильный радикал, где каждый R1 независимо выбран из группы, состоящей из водорода и низшего алкильного радикала, содержащего до шести атомов углерода, X представляет собой -OR1, -N(R1)2 или -N(R5)SO2R6, где R5 представляет собой водород или CH2OR6, R6 представляет собой водород, низший алкильный радикал, содержащий до шести атомов углерода, галоген-замещенное производное вышеуказанного низшего алкильного радикала или фтор-замещенное производное вышеуказанного низшего алкильного радикала, и R15 представляет собой водород или низший алкильный радикал, содержащий до шести атомов углерода; и Y представляет собой =O или 2 водородных радикала.
[0010] Заместитель(-и) замещенного гетероарильного радикала в Формуле I может быть выбран из группы, состоящей из С1-C6 алкилов; галогенов (таких как фтор, хлор и бром); трифторметила (CF3); COR1 (такого как СОСН3); COCF3; SO2N(R1)2 (такого как SO2NH2); NO2; и CN.
[0011] В более конкретных вариантах реализации изобретения терапевтический агент может содержать или состоять из соединения Формулы II, или его фармацевтически приемлемой соли, или его сложноэфирного пролекарства

где R1, X, Y, R5, R6 и R15 являются такими, как определено выше для Формулы I, и где Z выбран из группы, состоящей из О и S, А выбран из группы, состоящий из N, -СН и С, R2 выбран из группы, состоящей из водорода, галогена и низшего алкила, содержащего от 1 до 6 атомов углерода, R3 и R4 независимо выбраны из группы, состоящей из водорода, галогена, низшего алкила, содержащего от 1 до 6 атомов углерода, или вместе с

[0012] В некоторых вариантах реализации изобретения терапевтический агент, входящий в состав имплантата в соответствии с данным изобретением, содержит или состоит из соединения Формулы II, где по меньшей мере один из R2, R3 или R4 независимо выбран из группы, состоящей из хлора, брома и C1-C6 алкила. В более конкретных вариантах реализации изобретения по меньшей мере один из R2, R3 или R4 представляет собой хлор или бром. В более конкретных вариантах реализации изобретения по меньшей мере один из R2, R3 или R4 представляет собой бром. В более конкретном варианте реализации изобретения по меньшей мере два из R2, R3 или R4 представляют собой хлор. В некоторых вариантах реализации изобретения терапевтический агент содержит или состоит из соединения Формулы II, где по меньшей мере один из R2, R3 или R4 представляет собой этил, пропил или бутил. В некоторых вариантах реализации изобретения R6 представляет собой метил, этил или трифторметил. В одном варианте реализации изобретения терапевтический агент содержит или состоит из соединения Формулы II, где R15 представляет собой водород или метил.
[0013] В одном варианте реализации изобретения терапевтический агент содержит или состоит из соединения Формулы II, где X представляет собой -N(R1)2, и Y представляет собой =О.
[0014] В одном варианте реализации изобретения терапевтический агент, входящий в состав имплантата в соответствии с данным изобретением, содержит или состоит из соединения Формулы III

или его фармацевтически приемлемой соли, или его сложноэфирного пролекарства, где X представляет собой -ОН или -N(R1)2, и где R1 независимо выбран из группы, состоящей из водорода и C1-C6 алкила.
[0015] В дополнительных вариантах реализации изобретения терапевтический агент содержит или состоит из соединения Формулы IV

или его фармацевтически приемлемой соли или его сложноэфирного пролекарства, где X представляет собой -ОН или -N(R1), и где R1 независимо выбран из группы, состоящей из водорода и C1-C6 алкила.
[0016] В конкретном варианте реализации изобретения терапевтический агент содержит или состоит из соединения Формулы IV, где X представляет собой -NH2. Это соединение обозначено в данном документе как Соединение 1 и имеет следующую структуру:

[0017] В других вариантах реализации изобретения терапевтический агент содержит или состоит из соединения Формулы IV или его фармацевтически приемлемой соли, где X представляет собой -ОН. Это соединение обозначено в данном документе как Соединение 2 и имеет следующую структуру:

[0018] Специалистам в данной области очевидно, что Формулы I-IV содержат один или более стереоцентров. Если специально не указано иное, в объем данного изобретения входят все энантиомеры и диастереомеры Формул I-IV и их рацемические смеси. Некоторые Соединения, имеющие одну из Формул I-IV, могут образовывать соли с фармацевтически приемлемыми кислотами или основаниями, и такие фармацевтически приемлемые соли соединений также входят в объем данного изобретения.
[0019] Таким образом, настоящее изобретение предлагает биодеградируемый внутриглазной имплантат, эффективный для снижения внутриглазного давления в глазу пациента, который содержит или состоит из биодеградируемого полимерного материала и Соединения, имеющего Формулу I, II, III или IV, как определено выше, или его фармацевтически приемлемой соли. Конкретные варианты реализации изобретения предлагают биодеградируемый внутриглазной имплантат, содержащий или состоящий из биодеградируемого полимерного материала и Соединения 1 или Соединения 2, или их смеси, связанных с биодеградируемым полимерным материалом.
[0020] Другой вариант реализации изобретения представляет собой биодеградируемый внутриглазной имплантат, содержащий биодеградируемый полимерный материал и Соединение 1 в качестве фармацевтически активного агента, причем внутриглазной имплантат не содержит никаких других фармацевтически активных агентов или агентов, понижающих ВГД, кроме Соединения 1.
[0021] Соединения, имеющие любую из Формул I-IV, могут быть получены с помощью способов, известных в данной области. Например, см. патенты США №№6602900, 6124344, 5741810 и 5834498.
[0022] Соединение, имеющее Формулу I, II, III или IV, может быть связано с биодеградируемым полимерным материалом. Таким образом, Соединение может быть смешано с, растворено и/или диспергировано в, заключено в или присоединено к биодеградируемому полимерному материалу. Соединение, имеющее Формулу I, II, III или IV, может быть однородно или неоднородно диспергировано или распределено в биодеградируемом полимерном материале. Высвобождение Соединения из имплантата после установки в глаз может происходить путем диффузии Соединения, эрозии или разрушения полимерного материала, растворения, осмоса или любой их комбинации.
[0023] Биодеградируемый внутриглазной имплантат, представленный в данном документе, может иметь подходящий размер и состав для установки в глазничную область глаза, такую как, например, стекловидное тело или передняя камера глаза, для лечения глаукомы и снижения внутриглазного давления, включая, например, повышенное внутриглазное давление (или глазную гипертензию) в глазу.
[0024] Конкретные варианты реализации изобретения предлагают внутриглазной биодеградируемый имплантат, который должен высвобождать Соединение, имеющее любую из Формул I-IV (например, Соединение 1), непрерывно in vitro и/или in vivo в глазу в течение 1-3 месяцев, 3 месяцев или более, 3-6 месяцев или 6 месяцев или более после установки в глаз пациента.
[0025] Внутриглазной имплантат в соответствии с данным изобретением может высвобождать от 5 до 200 нанограмм (нг) Соединения в день, от 10 до 200 нанограмм Соединения в день, от 5 до 100 нанограмм Соединения в день, от 10 до 100 нанограмм Соединения в день, от 10 до 50 нанограмм Соединения в день, по меньшей мере 10 нг, но не более 50 нг Соединения в день, от 10 до около 35 нг Соединения в день или от 20 до 35 нанограмм Соединения в день в течение 1 месяца или более, 2 месяцев или более, 1-3 месяцев, 3-6 месяцев или 6 месяцев или более.
[0026] Имплантаты в соответствии с данным изобретением разработаны так, чтобы контролированным образом высвобождать Соединение Формулы IV, такое как, например, Соединение 1. В некоторых формах имплантат будет обеспечивать линейную или практически постоянную скорость высвобождения Соединения 1 в течение 1 месяца или более, например в течение 1, 3 или 6 месяцев.
[0027] Суточные дозировки Соединения 1 в интервале от 5 до 200, от 10 до 100 нанограмм, или даже 5-50 нанограмм, при доставке или высвобождении непосредственно в переднюю камеру, могут являться терапевтически эффективным количеством для снижения внутриглазного давления в глазу. Термин «терапевтически эффективное количество» или «эффективное количество» относится к уровню или количеству активного агента (например, Соединения 1 или Соединения 2), необходимого для снижения внутриглазного давления без значительных негативных или побочных эффектов в глазу или в области глаза, в которой агент применяется.
[0028] Имплантаты в соответствии с данным изобретением могут уменьшать внутриглазное давление в глазу пациента в течение 1 месяца (30 дней) или более, 1-3 месяцев, 3 месяцев, 3-6 месяцев или даже 6 месяцев или более после установки имплантата в глаз. Пациентом, как правило, является человек или другое млекопитающее, которое ощущает или у которого диагностировано повышенное внутриглазное давление или глазная гипертензия в одном или обоих глазах. Пациента можно дополнительно определить как субъекта, страдающего глаукомой, так как глаукома часто сопровождается повышенным внутриглазным давлением. Следовательно, имплантаты, описанные в данном документе, могут быть использовны, как правило, для снижения повышенного внутриглазного давления в глазу и для лечения глаукомы у пациента. В связи с этим один вариант реализации изобретения представляет собой способ уменьшения глазной гипертензии или снижения повышенного внутриглазного давления у пациента, нуждающегося в этом, включающий установку в глаз пациента биодеградируемого внутриглазного имплантата в соответствии с данным изобретением.
[0029] В конкретных формах способа лечения один или более внутриглазных имплантатов, содержащих Соединение, имеющее любую из Формул I-IV, можно устанавливать, или, более конкретно, вводить при помощи инъекций в переднюю камеру глаза, чтобы таким образом снижать внутриглазное давление и уменьшать глазную гипертензию в глазу. Следовательно, внутриглазной имплантат, например, может иметь подходящий размер и состав для установки в переднюю камеру глаза. Такие имплантаты могут называться «внутриглазными» имплантатами.
[0030] Имплантаты в соответствии с данным изобретением разработаны так, чтобы обеспечивать долговременное снижение повышенного внутриглазного давления (или глазной гипертензии) путем обеспечения пролонгированного непрерывного высвобождения терапевтически эффективного количества Соединения 1 (или в целом Соединения, имеющего Формулу I, II, III или IV) или его фармацевтически приемлемой соли непосредственно в пораженную область глаза, такую как передняя камера глаза. В этом контексте терапевтически эффективное количество Соединения 1 может представлять собой дозировку между 5 и 200 нг/день, 10 и 200 нг/день, 5 и 50 нг/день или, конкретнее, 10-40 нг/день, или, еще конкретнее, около 15 нг/день, 20 нг/день или 30 нг/день. Пациентом может являться человек или другое млекопитающее, нуждающееся в лечении глазной гипертензии (повышенного внутриглазного давления) или глаукомы. Имплантат может быть в форме экструдированного волокна или прессованной таблетки. Другие формы могут включать капсулы, пленки или пластины. Экструдированное волокно может представлять собой цилиндрический или нецилиндрический стержень, имеющий диаметр и длину, подходящие для установки в глаз, например в переднюю камеру или стекловидное тело глаза.
[0031] Один вариант реализации изобретения представляет собой экструдированный внутрикамерный биодеградируемый имплантат, содержащий около 8 масс. %. Соединения 1 и от 0,001% до 10 масс. % гексадекан-1-ола (гексадеканола), причем общая масса имплантата составляет от 30 до 100 мкг, и он высвобождает от 10 до 50 нг Соединения 1 в день в течение 3-5 месяцев in vitro в фосфатно-солевом буферном растворе при 37°C. В некоторых формах такого имплантата биодеградируемый полимерный материал содержит поли(D,L-лактид), имеющий кислотную концевую группу и характеристическую вязкость 0,16-0,24 дл/г, и поли(D,L-лактид), имеющий сложноэфирную концевую группу и характеристическую вязкость 0,25-0,35 дл/г, и сополимер поли(D,L-лактид-со-гликолид), имеющий сложноэфирную концевую группу, молярное соотношение D,L-лактида к гликолиду, равное около 75:25 (например, от 73:27 до 77:23) и характеристическую вязкость 0,16-0,24 дл/г, причем характеристическая вязкость каждого полимера и сополимера измерена в 0,1% растворе полимера или сополимера в хлороформе при 25°C.
[0032] Пациенты, которых можно эффективно лечить, используя биодеградируемые внутрикамерные имплантаты, содержащие Соединение, имеющее Формулу I, II, III или IV (например, Соединение 1), могут включать тех, кто приобрел или страдает от или у кого диагностированы глаукома, открытоугольная глаукома, закрытоугольная глаукома, хроническая закрытоугольная глаукома, общеизвестная иридотомия, глазная гипертензия, повышенное внутриглазное давление, псевдоэксфолиативная глаукома или пигментная глаукома. Имплантат в соответствии с данным изобретением может быть эффективным для уменьшения внутриглазного давления в глазу с низким, нормальным или повышенным внутриглазным давлением. Поэтому, имплантат в соответствии с данным изобретением может являться эффективным для лечения глаукомы во всех ее формах, включая глаукому с повышенным внутриглазным давлением, а также глаукому с низким или нормальным давлением, так как такие пациенты также потенциально могут получать пользу от дальнейшего снижения внутриглазного давления. Вследствие способности высвобождать терапевтически эффективные количества потенциальных агентов для снижения внутриглазного давления, таких как Соединение 1, в течение длительных периодов, ожидается, что имплантаты в соответствии с данным изобретением будут способны снижать внутриглазное давление у таких пациентов в течение продолжительных периодов без необходимости в частых внутриглазных инъекциях или регулярном введении глазных капель на поверхность глаза, что может быть обязательно для местного применения. Более того, большая эффективность Соединения 1 для снижения ВГД по сравнению с некоторыми другими простамидами и противоглаукомными агентами делает возможным изготавливать меньшие имплантаты с более длительными периодами введения, которые будут безопаснее и лучше для глаза, а следовательно для пациента.
[0033] Таким образом, один вариант реализации настоящего изобретения представляет собой способ снижения внутриглазного давления (ВГД) в глазу, который включает установку биодеградируемого внутриглазного имплантата в глаз, содержащего или состоящего из биодеградируемого полимерного материала и Соединения, имеющего любую из Формул I-IV, или его фармацевтически приемлемой соли, связанной с полимерным материалом, причем имплантат снижает внутриглазное давление в глазу в течение 1, 3 или 6 месяцев или более после установки в глаз. В некоторых случаях имплантат может снижать ВГД в глазу по меньшей мере на 30% по сравнению с ВГД в глазу без имплантата или до получения имплантата (исходное ВГД) в течение 1, 3 или 6 месяцев или более. Имплантат можно устанавливать в глазничную область глаза, и поэтому он может иметь размер, подходящий для установки в глазничную область глаза. Пациент может иметь низкое или нормальное внутриглазное давление или может страдать от повышенного внутриглазного давления, иногда называемого внутриглазной гипертензией, или у пациента может быть глаукома. В более конкретной форме пациент страдает от или у него диагностированы глаукома или повышенное внутриглазное давление, и имплантат устанавливают в переднюю камеру или стекловидное тело пораженного глаза (пораженных глаз). В конкретном варианте реализации изобретения имплантат устанавливают в угол передней камеры (или радужно-роговичный угол), а еще более конкретно - в нижний угол передней камеры пораженного глаза (пораженных глаз). В любом из этих способов Соединение в имплантате (т.е. терапевтический агент) может содержать или представлять собой Соединение 1 или Соединение 2, фармацевтически приемлемую соль Соединения 1 или 2 или любую их смесь, и имплантат может быть установлен в переднюю камеру или стекловидное тело глаза путем внутрикамерного или интравитреального введения. В конкретных вариантах реализации изобретения имплантат устанавливают в угол передней камеры (или радужно-роговичный угол) глаза. Имплантат также может быть установлен в субконъюнктивальную область глаза.
[0034] Соответственно, данное изобретение предлагает способ лечения глаукомы у пациента, включающий стадию установки биодеградируемого внутриглазного имплантата, как описано в данном документе, в глаз пациента. Имплантат также может быть установлен в переднюю камеру глаза или в другую глазничную область глаза для лечения глаукомы.
[0035] Некоторые варианты реализации изобретения включают способ введения Соединения, имеющего Формулу III или IV, такого как Соединение 1 или Соединение 2, без глазных капель, включающий установку имплантата, описанного в данном документе, в глаз пациента, нуждающегося в этом. Имплантат предпочтительно устанавливают в переднюю камеру глаза.
[0036] В одном варианте реализации изобретения предлагается способ снижения внутриглазного давления у пациента, нуждающегося в этом, включающий введение в глаз(-а) пациента фармацевтической композиции, состоящей из терапевтически эффективного количества соединения, имеющего Формулу I, II, III или IV. В некоторых вариантах реализации изобретения предлагается способ уменьшения внутриглазного давления у пациента, нуждающегося в этом, включающий введение в глаз(-а) пациента фармацевтической композиции, содержащей терапевтически эффективное количество Соединений 1 или 2. Фармацевтическая композиция для снижения внутриглазного давления должна, как правило, быть биологически совместимой с глазом и содержать терапевтически эффективное количество Соединения и фармацевтически приемлемого эксципиента. Биологически совместимые имплантаты и полимеры вызывают лишь небольшое количество или не вызывают токсических эффектов, не являются опасными или физиологически активными и не вызывают иммунологическую реакцию. В конкретных вариантах реализации изобретения фармацевтическая композиция находится в форме жидкости, такой как водный раствор, масло или эмульсия. В одном варианте реализации изобретения фармацевтическую композицию вводят в глаз(-а) пациента местно. Например, фармацевтическую композицию можно вводить в виде глазных капель. В другом варианте реализации изобретения фармацевтическую композицию вводят в переднюю камеру глаза без использования глазных капель.
[0037] Фармацевтические композиции могут быть получены комбинированием терапевтически эффективного количества по меньшей мере одного соединения согласно настоящему изобретению, или его фармацевтически приемлемой соли, в качестве активного агента, с традиционными фармацевтически приемлемыми эксципиентами, и путем приготовления дозированных лекарственных форм, подходящих для местного применения в глазу. Терапевтически эффективное количество может варьироваться от 0,0001 до 5% или 10% (масса к объему) в жидких препаратах. Для офтальмологического применения одной из возможных сред может быть физиологический солевой раствор. pH таких композиций желательно поддерживать между 6,5 и 7,2 с помощью подходящего буферного агента или системы, причем предпочтительным является практически нейтральный pH. Препараты могут также содержать один или более традиционных, фармацевтически приемлемых консервантов, стабилизаторов, антиоксидантов, комплексообразующих веществ, веществ, регулирующих тоничность (например, соли щелочных или щелочно-земельных металлов) и поверхностно-активных веществ. Некоторые композиции могут содержать как буферный компонент, так и компонент, регулирующий тоничность.
[0038] В других вариантах реализации изобретения предлагается способ получения биодеградируемых внутриглазных имплантатов, эффективных для снижения внутриглазного давления у пациента, которые содержат или состоят из терапевтического агента, биодеградируемого полимерного материала и, необязательно, одного или более эксципиентов. Способ включает следующие стадии по порядку: а) смешивание терапевтического агента с биодеградируемым полимером или двумя или более биодеградируемыми полимерами и одним или более эксципиентами, если присутствуют, с получением смеси, б) экструдирование смеси с получением волокна, и в) разрезание волокна на куски с длиной, подходящей для установки в глаз пациента, страдающего от повышенного глазного давления, с получением с получением внутриглазных имплантатов. В конкретных вариантах реализации изобретения волокно разрезают на куски, длиной, подходящей для установки в переднюю камеру глаза. Терапевтический агент может содержать соединение, имеющее любую из Формул I-IV, или может содержать Соединения 1 или 2, как определено в данном документе. В некоторых случаях терапевтический агент, используемый для смешивания с полимером(-ами) (стадия а), может представлять собой твердое вещество. Смесь можно экструдировать при температуре от 60°C до 150°C.
[0039] В других вариантах реализации изобретения предлагается устройство для имплантирования или введения биодеградируемого внутриглазного имплантата согласно любому из вариантов реализации изобретения, представленных в данном документе, в глазничную область глаза у пациента, страдающего от глаукомы или глазной гипертензии (т.е. повышенного внутриглазного давления), которое содержит удлиненный корпус с продольной осью и катетер, проходящий в продольном направлении от корпуса, имеющий полость внутри него, сконструированную таким образом, чтобы вмещать внутриглазной имплантат. Устройство дополнительно содержит внутриглазной имплантат согласно любому из вариантов реализации изобретения, представленных в данном документе. Имплантат может быть расположен внутри полости катетера или ближе к центру полости катетера. Для конкретных форм реализации устройства размеры катетера равны или не более чем размеры иглы 21, 22, 25, 27, 28 или 30 калибра, и катетер должен иметь скошенный или острый конец для более легкого проникновения в ткань глаза. В некоторых формах внутренний и внешний диаметры катетера не более чем у иглы 25 или 27 калибра.
[0040] Также в объем данного изобретения входят способы доставки внутриглазного имплантата в глаз пациента, страдающего от глаукомы или повышенного внутриглазного давления, с использованием устройства, описанного вышесодержащего катетер, который имеет внутренний конец, острый дистальный конец и полость, проходящую внутри него, внутриглазной имплантат, выбранный из любого имплантата, представленного в данном документе, привод, движение которого приводит к выталкиванию имплантата из устройства. Полость катетера имеет такой размер, чтобы вместить внутриглазной имплантат и позволить ему перемещаться по ней. Способ включает стадии введения катетера в глазничную область глаза пациента и нажатия на или активации привода, что приводит к выталкиванию имплантата из катетера в глаз пациента. В некоторых вариантах реализации изобретения глазничная область глаза, в которую вводят имплантат, может представлять собой переднюю камеру или стекловидное тело глаза.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
[0041] Фиг. 1 иллюстрирует поперечное сечение глаза млекопитающих.
[0042] Фиг. 2 иллюстрирует кумулятивное общее высвобождение в процентах in vitro Соединения 1 в фосфатно-солевой буферный раствор (0,01 М; pH 7,4) при 37°C в зависимости от времени для четырех (4) отдельных имплантатов (Имплантаты 1-4), полученных с помощью двухшнекового экструдера. Композиция каждого имплантата представлена в Таблице 2.
[0043] Фиг. 3 иллюстрирует кумулятивное общее высвобождение в процентах in vitro Соединения 1 в фосфатно-солевой буферный раствор (0,01 М; pH 7,4) при 37°C в зависимости от времени для Имплантатов 5 и 6, полученных с помощью поршневого экструдера. Композиция каждого имплантата представлена в Таблице 2.
[0044] Фиг. 4 иллюстрирует кумулятивное общее высвобождение в процентах in vitro Соединения 1 в фосфатно-солевой буферный раствор (0,01 М; pH 7,4) при 37°C в зависимости от времени для Имплантатов 7 и 8, полученных с помощью поршневого экструдера. Композиция каждого имплантата представлена в Таблице 2.
[0045] Фиг. 5 иллюстрирует пролонгированный эффект понижения внутриглазного давления (ВГД) у собак при введении Соединения 1 в глаз в форме экструдированного биодеградируемого внутрикамерного имплантата (Имплантат 1, представленный в Таблице 2). Один имплантат устанавливали в переднюю камеру одного глаза каждой собаки из исследуемой группы. Противоположный глаз оставляли без обработки. Исследуемая группа состояла из 8 собак (n=8). Среднее изменение (в процентах) ВГД относительно исходного ВГД в пролеченных и непролеченных глазах для каждой группы измеряли в различные моменты времени и затем наносили на линейный график, демонстрирующий изменение ВГД со временем.
[0046] Фиг. 6 иллюстрирует эффект уменьшения ВГД при помощи Имплантата 2 у собак (n=8) после установки одного имплантата в переднюю камеру глаза. In vivo исследование проводили так, как описано для Фиг. 5 и в Примере 2.
[0047] Фиг. 7 иллюстрирует эффект уменьшения ВГД при помощи Имплантата 3 у собак (n=8) после установки одного имплантата в переднюю камеру глаза. In vivo исследование проводили так, как описано для Фиг. 5 и в Примере 2.
[0048] Фиг. 8 иллюстрирует эффект уменьшения ВГД при помощи Имплантата 4 у собак (n=8) после установки одного имплантата в переднюю камеру глаза. In vivo исследование проводили так, как описано для Фиг. 5 и в Примере 2.
[0049] Фиг. 9 иллюстрирует in vitro кумулятивное общее высвобождение в процентах Соединения 1 в фосфатно-солевой буферный раствор (0,01 М; pH 7,4) при 37°C в зависимости от времени для Имплантата 9, полученного с помощью поршневого экструдера. Композиция Имплантата 9 представлена в Таблице 2.
[0050] Фиг. 10 иллюстрирует кумулятивное общее высвобождение в процентах in vitro (в процентах) Соединения 1 в фосфатно-солевой буферный раствор (0,01 М; pH 7,4) при 37°C в зависимости от времени для Имплантатов №3, 10 и 11, полученных с помощью двухшнекового экструдера. Композиции Имплантатов 3, 10 и 11 представлены в Таблице 2.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Определения
[0051] «C1-C6 алкил» означает алкил, содержащий от 1 до 6 атомов углерода.
[0052] Символ «Н», при использовании в Формулах в данном документе, обозначает атом водорода.
[0053] Символ «О», при использовании в Формулах в данном документе, обозначает атом кислорода.
[0054] Символ «N», при использовании в Формулах в данном документе, обозначает атом азота.
[0055] Символ «S», при использовании в Формулах в данном документе, обозначает атом серы.
[0056] Символ «С», при использовании в Формулах в данном документе, обозначает атом углерода.
[0057] Символ «Cl», при использовании в Формулах в данном документе, обозначает атом хлора.
[0058] Символ «Br», при использовании в Формулах в данном документе, обозначает атом брома.
[0059] «Профиль кумулятивного высвобождения» относится к кумулятивному суммарному процентному содержанию активного агента (такого как, например, Соединение 1), высвобожденного из имплантата в глазничную область in vivo со временем или в специальную среду для высвобождения (например, ФСБ) in vitro со временем.
[0060] «Пролекарство» означает соединение (например, предшественник лекарственного средства), которое превращается in vivo с образованием активной формы соединения. Превращение может происходить по различным механизмам (например, путем метаболических или химических процессов), таким как, например, гидролиз.
[0061] Термин «фармацевтически приемлемые соли» относится к солям или комплексам, которые сохраняют требуемую биологическую активность Соединения или терапевтического агента и практически или совсем не проявляют нежелательных токсических эффектов у млекопитающих или в клеточной системе, в которую они были введены.
[0062] «Внутриглазной имплантат» относится к устройству или элементу, которые имеет форму, пригодную для установки в глаз. Примеры включают экструдированные волокна, состоящие из биодеградируемого полимерного материала и фармацевтически активного агента, такого как Соединение, имеющее Формулу I, II, III, или IV, связанное с полимерным материалом, и разрезанные на куски, пригодные для установки в глаз. Внутриглазные имплантаты, как правило, биологически совместимы с физиологическими условиями глаза и не оказывают побочных реакций на глаз. В некоторых формах настоящего изобретения внутриглазной имплантат может иметь подходящий размер и состав для установки в переднюю камеру или стекловидное тело глаза. Внутриглазные имплантаты могут быть введены в глаз без значительного нарушения зрения. Внутриглазные имплантаты, состоящие из одного или более биодеградируемых полимеров и Соединения, имеющего Формулу I, II, III или IV, или его фармацевтически приемлемой соли, представляют собой примеры внутриглазных имплантатов (системы доставки лекарственных средств) в рамках настоящего изобретения.
[0063] «Внутрикамерный» имплантат представляет собой внутриглазной имплантат, который имеет подходящий размер и состав для установки в переднюю камеру глаза. Неограничивающие примеры включают Имплантаты 1-4 и 9-11, представленные в Таблице 2.
[0064] «Интравитреальный» имплантат представляет собой внутриглазной имплантат, который имеет подходящий размер и состав для установки в стекловидное тело глаза.
[0065] «Пригодный для или имеющий подходящую форму, размер или структуру для введения, имплантации или установки в глазничную область или участок» по отношению к имплантату, означает имплантат, который имеет такой размер (т.е. геометрические параметры и массу), что его можно ввести, имплантировать или установить в глазничную область, такую как передняя камера или стекловидное тело глаза без значительного повреждения тканей или ухудшения зрения пациента, которому имплантируют или вводят имплантат.
[0066] «Лечение», при использовании в данном документе, включает любой полезный эффект в глазу пациента, производимый с помощью представленных способов. Лечение патологического состояния глаза, такого как глазная гипертензия или повышенное внутриглазное давление, или глаукома, может ослаблять или устранять патологическое состояние глаза или может ослаблять или замедлять развитие одного или более признаков, симптомов или факторов риска, присущих патологическому состоянию глаза или связанных с ним. Признак(-и) или симптом(-ы), на который положительно повлияло лечение, будет зависеть от конкретного патологического состояния. Примеры полезных (а следовательно, положительных) эффектов, производимых представленными способами, могут включать снижение внутриглазного давления, глазной боли (т.е. боли в глазах), отека глаз и/или воспаления глаз. Лечение с помощью любого из способов, представленных в данном документе, с использованием одного или более внутриглазных имплантатов, описанных в данном документе, может в некоторых случаях также улучшать общее самочувствие, комфорт и/или эффективность зрительного восприятия глаза.
[0067] «Активный агент», «лекарственное средство», «терапевтический агент», «терапевтически активный агент» и «фармацевтически активный агент» относятся к химическому соединению или лекарственной субстанции, которая производит желаемый терапевтический эффект в глазу пациента (человека или другого млекопитающего), которому ее ввели, и которая лечит патологическое состояние глаза (медицинское патологическое состояние глаза), такое как повышенное внутриглазное давление (глазная гипертензия) или глаукома, поражающее пациента. Одним из неограничивающих примеров терапевтически (или фармацевтически) активного агента или терапевтического агента в контексте настоящего изобретения является Соединение 1.
[0068] «Пациент» может быть человеком или другим млекопитающим, нуждающимся в лечении.
[0069] «Глаз» представляет собой зрительный орган чувства и включает глазное яблоко, глазной чувствительный орган, который улавливает свет и передает зрительную информацию в центральную нервную систему. В общем, глаз включает глазное яблоко и области, ткани и жидкости глаза, которые образуют глазное яблоко, окологлазные мышцы (такие как косые и прямые мышцы) и часть зрительного нерва, которая находится внутри или прилегает к глазному яблоку.
[0070] Термин «терапевтически эффективное количество» или «эффективное количество» относится к уровню или количеству активного агента, необходимого для лечения патологического состояния глаза без значительных негативных или побочных эффектов в глазу или в области глаза, в которой агент применяется.
[0071] Термин «биодеградируемый полимер» относится к полимеру или полимерам, которые распадаются in vivo, причем распад полимера или полимеров со временем проходит одновременно или последовательно с высвобождением терапевтического агента. Биодеградируемый полимер может быть гомополимером, сополимером или полимером, содержащим более чем две различные структурные повторяющиеся единицы.
[0072] Термин «глазничная область» или «глазничный участок» относится, как правило, к любому участку глазного яблока, включая передний и задний отрезки глаза, и который, как правило, включает, но не ограничиваясь ими, любые функциональные (т.е. для зрения) или структурные ткани, находящиеся в глазном яблоке, или ткани или клеточные слои, которые частично или полностью покрывают внутреннюю или внешнюю часть глазного яблока. Конкретные примеры глазничных областей в глазу включают переднюю камеру, заднюю камеру, стекловидную полость (стекловидное тело), сосудистую оболочку, супрахороидальное пространство, конъюнктиву, подконъюнктивальное пространство, субтеноновое пространство, эписклеральное пространство, внутрироговичное пространство, эпикорнеальное пространство, склеру, плоскую часть ресничного тела, вызванные хирургическим путем бессосудистые области, желтое пятно и сетчатку.
[0073] Как используется в данном документе, «патологическое состояние глаза» представляет собой заболевание, недомогание или патологическое состояние, которое поражает или затрагивает глаз или одну из частей или областей глаза. В общем, глаз включает глазное яблоко и ткани и жидкости, которые образуют глазное яблоко, окологлазные мышцы (такие, как косые и прямые мышцы) и часть зрительного нерва, которая находится внутри или прилегает к глазному яблоку.
[0074] Патологическое состояние переднего отрезка глаза представляет собой заболевание, недомогание или состояние, которое поражает или затрагивает переднюю область или участок глазницы (переднюю часть глаза), такую как окологлазная мышца, глазное веко или ткань или жидкость глазного яблока, расположенные спереди по отношению к задней стенке мембраны хрусталика, или цилиарные мышцы. Таким образом, патологическое состояние переднего отрезка глаза главным образом поражает или затрагивает конъюнктиву, роговую оболочку, переднюю камеру, радужную оболочку, заднюю камеру (за сетчаткой, но перед задней стенкой мембраны хрусталика), хрусталик или мембрану хрусталика и кровеносные сосуды и нервы, которые васкуляризируют или иннервируют переднюю область или участок глазницы. Глаукома может рассматриваться как патологическое состояние переднего отрезка глаза, так как клинической целью лечения глаукомы может быть уменьшение гипертензии водной жидкости в передней камере глаза (т.е. уменьшение внутриглазного давления).
[0075] Патологическое состояние заднего отрезка глаза представляет собой заболевание, недомогание или состояние, которое поражает или затрагивает главным образом заднюю область или участок глазницы в глазу, такие как сосудистая оболочка или склера (находятся сзади по отношении к плоскости, проходящей через заднюю стенку мембраны хрусталика), стекловидное тело, стекловидная камера, сетчатка, зрительный нерв (т.е. диск зрительного нерва) и кровеносные сосуды и нервы, которые васкуляризируют или иннервируют заднюю область или участок глазницы. Глаукома также может рассматриваться как патологическое состояние заднего отрезка глаза, так как терапевтической целью является предотвращение потери или уменьшение возможности потери зрения вследствие повреждения или потери клеток сетчатки или клеток зрительного нерва (т.е. нейропротекция).
Фармацевтические композиции для местного применения в глазу
[0076] Для местного применения (например, в форме глазных капель) фармацевтические композиции могут быть получены комбинированием терапевтически эффективного количества по меньшей мере одного соединения согласно настоящему изобретению или его фармацевтически приемлемой соли, в качестве активного агента, с одним или более фармацевтически приемлемыми эксципиентами, и путем приготовления дозированных лекарственных форм, подходящих для местного применения в глазу. Терапевтически эффективное количество может варьироваться от 0,0001 до 10% (масса к объему) или от 0,001 до 5,0% (масса к объему) в жидких препаратах.
[0077] Растворы желательно готовить с использованием физиологического солевого раствора в качестве основной среды. pH таких офтальмологических растворов желательно поддерживать между 6,5 и 7,2 с помощью подходящей буферной системы, причем предпочтительным является практически нейтральный уровень pH. Композиции также могут содержать традиционные фармацевтически приемлемые консерванты, буферные вещества, вещества, регулирующие тоничность, антиоксиданты, стабилизаторы и поверхностно-активные вещества.
[0078] Предпочтительные консерванты, которые могут использоваться в фармацевтических композициях настоящего изобретения, включают, но не ограничиваясь ими, хлорид бензалкония, хлорбутанол, тимеросал, фенилртутьацетат или фенилртутьнитрат. Предпочтительное поверхностно-активное вещество представляет собой, например, Твин 80. Также в офтальмологических препаратах по настоящему изобретению могут использоваться различные предпочтительные среды. Эти среды включают, но не ограничиваясь ими, поливиниловый спирт, повидон, гидроксипропилметилцеллюлозу, полоксамеры, карбоксиметилцеллюлозу, гидроксиэтилцеллюлозу и очищенную воду.
[0079] Если это необходимо или целесообразно, можно добавлять вещества, регулирующие тоничность. Они включают, но не ограничиваясь ими, соли, в частности хлорид натрия, хлорид калия, манит и глицерин, или любые другие офтальмологически пригодные регуляторы тоничности.
[0080] Различные буферные вещества и способы регулировки pH можно использовать до тех пор, пока полученный препарат не будет офтальмологически приемлем. Соответственно, буферные растворы включают ацетатные буферные растворы, цитратные буферные растворы, фосфатные буферные растворы и боратные буферные растворы. Для регулировки pH этих препаратов можно использовать кислоты или основания, если это необходимо.
[0081] Приемлемые антиоксиданты могут включать метабисульфит натрия, тиосульфат натрия, ацетилцистеин, бутилированный гидроксианизол и бутилированный гидрокситолуол.
[0082] Другие вспомогательные вещества могут включать один или более комплексообразователей.
[0083] Фармацевтические композиции для местного применения можно легко расфасовать так, чтобы они были пригодны для дозированного применения, например, в контейнеры, оснащенные капельницами, для облегчения введения в глаз.
Размер и форма биодеградируемого внутриглазного имплантата
[0084] Биодеградируемые имплантаты имеют подходящий размер и состав для установки в глаз пациента (внутриглазные имплантаты), а те, которые содержат Соединение, имеющее любую из Формул I-IV, диспергированное в биодеградируемом полимерном материале (или матрице), могут быть эффективны для снижения внутриглазного давления и лечения глаукомы. Мы обнаружили, что Соединение 1 особенно эффективно для снижения внутриглазного давления, когда его вводят непосредственно в переднюю камеру глаза. Биодеградируемые имплантаты представляют собой безопасное, нетоксичное и эффективное средство введения этого соединения в переднюю камеру.
[0085] С учетом предпочтительного места доставки имплантаты данного изобретения имеют подходящий размер и состав для установки в переднюю камеру глаза (например, глаза человека), и предпочтительно - в угол передней камеры глаза с незначительными или без побочного действия на глаз, особенно на эндотелий роговицы, и без создания препятствий или значительного ухудшения зрения пациента. Пациенты, которые получили имплантат, получают терапевтически эффективное количество Соединения (которое в некоторых вариантах реализации изобретения представляет собой Соединение 1), и, как правило, у них практически или совсем не должно наблюдаться покраснение или воспаление глаза после установки имплантата в глаз. В связи с этим изобретение описывает внутриглазные имплантаты, которые имеют подходящий размер и состав для установки в переднюю камеру глаза, и которые биологически совместимы с глазом, практически или совсем не вызывая иммунологической реакции или воспаления в глазу, и могут быть эффективными для снижения внутриглазного давления в глазу в течение по меньшей мере одного месяца, как, например, в течение от 1 до 6 месяцев или более. Исключительная эффективность Соединения 1 для снижения ВГД, например, делает возможным уменьшить размер внутриглазного имплантата, необходимого для доставки терапевтически эффективной дозы агента, понижающего ВГД, к целевым тканям и участкам в глазу, таким как передняя камера, по возможности минимизируя вероятное раздражение или повреждение тканей глаза, а в общем обеспечивая повышенную безопасность и большую пользу и комфорт для пациента. Более того, использование меньших имплантатов может уменьшать время, необходимое для полного распада имплантата в глазу после высвобождения лекарственного средства.
[0086] Имплантат может иметь размер, пригодный для введения, установки или имплантации в глазничную область или участок, такой как передняя камера, задняя камера или стекловидное тело глаза. Размер имплантата может влиять на скорость высвобождения, период лечения и концентрацию Соединения, имеющего одну из Формул I-IV, в ткани, подвергаемой лечению. При равных содержаниях активного агента большие имплантаты могут доставлять пропорционально большие дозы.
[0087] Имплантат, имеющий размер, подходящий для установки в переднюю камеру (внутрикамерный имплантат) должен, как правило, иметь диаметр (или другие параметры, соответствующие нецилиндрическим волокнам) от 100 до 400 мкм, а длину от 0,5 до 6 мм. Имплантаты могут, как правило, быть получены с помощью единичного или двойного процесса экструзии, могут быть цилиндрическими или нецилиндрическими и могут иметь общую массу в интервале от 10 мкг до 500 мкг. Масса частично может зависеть от желаемой дозировки. В некоторых вариантах реализации изобретения имплантаты, пригодные для установки в переднюю камеру глаза и пригодные для использования согласно данному изобретению, должны иметь диаметр между 100 мкм и 300 мкм, длину между 0,5 мм и 2 мм и общую массу между 10 мкг и 200 мкг или между 10 мкг и 100 мкг. В некоторых случаях внутрикамерный имплантат для снижения ВГД имеет общую массу от 10 мкг до 100 мкг или более конкретно - 30-100 мкг. Один вариант реализации изобретения представляет собой экструдированный биодеградируемый внутриглазной имплантат, который подходит для установки в переднюю камеру глаза и имеет диаметр около 200 мкм и длину около 1,5 мм.
[0088] Глаз(-а) некоторых пациентов, страдающих от глаукомы или в целом от глазной гипертензии, может быть более восприимчивым к установке биодеградируемого имплантата в стекловидное тело глаза. Стекловидное тело может вмещать имплантаты большего размера с тем же самым общим составом. Например, интравитреальный имплантат может иметь длину от 1 мм до 10 мм, диаметр от 0,5 мм до 1,5 мм и общую массу от 50 мкг до 5000 мкг. Имплантат можно увеличивать или уменьшать в зависимости от места введения в глаз и размера или объема стекловидного тела пациента. Хотя в большинстве случаев установлено, что один имплантат снижает внутриглазное давление в глазу в течение длительного периода (например, по меньшей мере 3 месяца), иногда практикующий врач может посчитать целесообразным установить два или более из описанных в данном документе имплантатов в глазничную область глаза для улучшения терапевтического эффекта.
[0089] Касательно формы, внутриглазные имплантаты могут иметь форму экструдированных стержней или нецилиндрических волокон с размерами, представленными выше. Капсулы, пластины или пленки и в некоторых случаях прессованные таблетки также могут найти применение согласно настоящему изобретению.
[0090] Биодеградируемый полимерный материал
[0091] В общем, имплантат согласно настоящему описанию должен содержать или состоять из биодеградируемого полимерного материала и Соединения, имеющего одну из Формул I-IV, связанного с биодеградируемым полимерным материалом. Полимерный материал может содержать или состоять из одного, двух, трех или более биодеградируемых полимеров и, необязательно, одного или более вспомогательных веществ для дополнительного увеличения стабильности и/или улучшения характеристик высвобождения имплантата.
[0092] Примеры пригодных биодеградируемых полимеров включают полилактидные полимеры и сополимеры поли(лактид-со-гликолиды). В некоторых вариантах реализации изобретения биодеградируемый полимерный материал может содержать полилактид, поли(лактид-со-гликолид), смесь двух или более полилактидных полимеров (например, первого и второго полилактидных полимеров), смесь двух или более сополимеров поли(лактид-со-гликолидов) или смесь полимеров полилактида и поли(лактид-со-гликолида). В конкретных формах любого из данных имплантатов полилактидный полимер может представлять собой поли(D,L-лактид), и сополимер поли(лактид-со-гликолид) может представлять собой поли(D,L-лактид-со-гликолид). В любой из вышеприведенных комбинаций два или более полимеров могут отличаться друг от друга своими концевыми группами, повторяющимся звеном, характеристической вязкостью или любой комбинацией этих параметров. Полимеры полилактид и поли(лактид-со-гликолид), используемые в настоящих имплантатах, могут иметь или карбоксильную (-СООН), или сложноэфирную концевую группу. Дополнительно, два или более полимеров поли(D,L-лактид-со-гликолидов) могут отличаться друг от друга соотношением лактид : гликолид в каждом полимере, которое может изменяться от около 85:15 до около 50:50 или около 75:25 в зависимости от полимера.
[0093] Поли(D,L-лактид), или PLA, может быть идентифицирован по номеру С AS 26680-10-4 и представлен формулой:

[0094] Поли(D,L-лактид-со-гликолид), или PLGA, может быть идентифицирован по номеру CAS 26780-50-7 и представлен формулой:
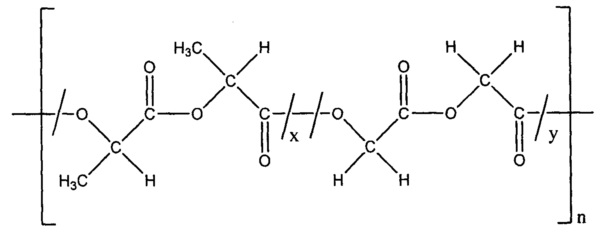
где x представляет собой количество повторяющихся единиц D,L-лактида, а y представляет собой количество повторяющихся единиц гликолида, и n представляет собой количество повторяющихся единиц D,L-лактид-со-гликолида. Таким образом, поли(D,L-лактид-со-гликолид) (или PLGA) содержит один или более блоков повторяющихся единиц D,L-лактида и один или более блоков повторяющихся единиц гликолида, причем размер и количество соответствующих блоков может варьироваться.
[0095] Молярное процентное содержание каждого мономера или повторяющейся единицы в сополимере PLGA может составлять 0-100%, около 15-85%, около 25-75% или около 35-65%. В некоторых вариантах реализации изобретения мольная доля D,L-лактида в полимере PLGA может составлять от около 50% до около 75%, от около 48% до около 52%, или около 50%; от около 73% до около 77%, или около 75%. Оставшуюся часть полимера могут представлять в основном повторяющиеся единицы гликолида. Например, мольная доля гликолида в полимере PLGA может составлять от около 25% до около 50%, от около 23% до около 27%, или около 25%; от около 48% до около 52%, или около 50%. В небольших количествах могут присутствовать другие группы, такие как терминальные или блокирующие группы (концевые группы). Как описано выше, в некоторых вариантах реализации изобретения сополимеры PLGA используются совместно с полимерами PLA. В некоторых имплантатах используется полимер 75/25 PLGA со сложноэфирной концевой группой.
[0096] Гидрофильный или гидрофобный характер концевых групп может быть полезным при варьировании распада полимерного материала. Полимеры с гидрофильной концевой группой могут распадаться быстрее, чем полимеры с гидрофобной концевой группой, потому что гидрофильная группа может поглощать воду. Примеры подходящих гидрофильных концевых групп включают, но не ограничиваясь ими, карбоксильную (кислотную концевую группу), гидроксильную и полиэтилегликолевую. Эти группы можно вводить с использованием подходящего инициатора. Концевые группы также можно вводить после завершения полимеризации для превращения концевых гидроксильных групп в другие концевые группы. Например, этиленоксид может превратить гидроксильную группу в полиэтиленгликолевую. Полимеры с концевыми гидрофобными группами (также называемые полимерами с блокированными или с концевыми блокированными группами) имеют сложноэфирное звено гидрофобной природы в конце полимера.
[0097] Другие рассматриваемые полимеры включают или могут быть выбраны из гидроксиалифатических карбоновых кислот, как гомополимеров, так и сополимеров, гиалуроновой кислоты, гиалуроната натрия, поликапролактонов, полисахаридов, полимеров простых эфиров, альгината кальция, целлюлозы, карбоксиметилцеллюлозы, поливинилового спирта, полимеров сложных эфиров и их комбинации.
[0098] Пригодные полисахариды могут включать, без ограничения, альгинат кальция и функционализированные целлюлозы, такие как сложные эфиры карбоксиметилцеллюлозы, нерастворимые в воде и обладающие молекулярной массой, например, от около 5 кДа до 500 кДа.
[0099] Высвобождение лекарственного средства из биодеградируемого полимерного материала является результатом нескольких механизмов или комбинации механизмов. Некоторые из этих механизмов включают десорбцию с поверхности имплантата, растворение, диффузию через пористые каналы гидратированного полимера и эрозию полимера(-ов), который формирует матрицу. Эрозия может происходить или в объеме, или на поверхности, или сочетать в себе оба процесса. Полимерная матрица может высвобождать терапевтический агент со скоростью, достаточной для поддержания высвобождения некоторого количества агента (например, Соединения 1) в течение более чем одного месяца, в течение 1-3 месяцев, в течение 3-6 месяцев или в течение 6 месяцев после имплантирования в глаз. Например, имплантат может содержать Соединение 1, и полимерный материал (или матрица) имплантата может распадаться со скоростью, оптимальной для поддержания высвобождения терапевтически эффективного количества Соединения 1 в течение одного, двух, трех или 6 месяцев in vitro или после установки в глаз, или, более конкретно, после установки в переднюю камеру глаза.
[00100] Желательно, чтобы один или более биодеградируемых полимеров, используемых для получения матрицы, (полимерный материал имплантата) характеризовался ферментной или гидролитической нестабильностью. Дополнительные предпочтительные характеристики полимера(-ов) включают биосовместимость, совместимость с терапевтическим компонентом, простоту использования полимера при изготовлении имплантата по данному изобретению, период полувыведения в физиологической среде по меньшей мере 6 часов, предпочтительнее более чем около одного дня, и нерастворимость в воде.
[00101] Биодеградируемый полимерный материал предпочтительно распадается in vivo так, что обеспечивает высвобождение терапевтически эффективного количества терапевтического агента в течение периода, который значительно превышает время распада агента in vivo при введении в виде глазных капель. Как обсуждалось выше, полимерный материал может представлять собой гомополимер или сополимер или в некоторых случаях комбинацию или смесь биодеградируемых полимеров и/или сополимеров.
[00102] В дополнение к биодеградируемому полимеру(-ам) и Соединению, имеющему Формулу I, II, III или IV, внутриглазной имплантат согласно данному изобретению может содержать одно или более эксципиентов для увеличения стабильности (например, срока годности) терапевтического агента в готовом имплантате, упрощения изготовления и обработки имплантата и/или улучшения характеристик высвобождения имплантата. Соединение 1, например, подвержено окислительному разложению при различных условиях производства, получения препарата и хранения. Полагают, что основной продукт распада представляет собой С-15 кетон.
[00103] Примеры эксципиентов для любой из этих целей могут включать консерванты, антиоксиданты, буферные вещества, комплексообразователи, электролиты или другие вещества. Как правило, эксципиенты, если присутствуют, могут составлять от 0,001 до 10% или до 15 масс. % от массы имплантата и могут быть выбраны из любых веществ, представленных ниже.
[00104] Пригодные водорастворимые консерванты могут включать бисульфит натрия, бисульфат натрия, тиосульфат натрия, бензалкония хлорид, хлорбутанол, тимеросал, фенилртутьацетат, фенилртутьнитрат, метилпарабен, бензиловый спирт, поливиниловый спирт и фенилэтиловый спирт.
[00105] Пригодные водорастворимые буферные вещества представляют собой карбонаты, фосфаты, гидрокарбонаты, цитраты, бораты, ацетаты, сукцинаты щелочных или щелочно-земельных металлов и тому подобное, такие как фосфат, цитрат, борат, ацетат, гидрокарбонат и карбонат натрия. Эти вещества могут присутствовать в количествах, достаточных для поддержания pH гидратированного имплантата между 2 и 9, а предпочтительнее - между 4 и 8. В связи с этим буферное вещество может присутствовать в количестве до 5 масс. % по массе всей композиции.
[00106] Пригодные электролиты могут включать хлорид натрия, хлорид калия и тому подобное, в том числе MgCl2. Также могут быть рассмотрены соли цинка.
[00107] Примеры антиоксидантов включают аскорбаты, аскорбиновую кислоту, L-аскорбиновую кислоту, мелатонин, бутилированный гидроксианизол, тиолы, полифенолы, токоферолы, такие как альфа-токоферол, маннит, восстановленный глутатион, различные каротеноиды, цистеин, мочевую кислоту, таурин, тирозин, супероксиддисмутазу, лютеин, зеаксантин, криптоксантин, астаксантин, ликопен, N-ацетилцистеин, карнозин, гамма-глутамилцистеин, кверцетин, лактоферрин, дигидролипоевую кислоту, цитрат, экстракт гинкго билоба, чайные катехины, экстракт черники, витамин Е или сложный эфир витамина Е, ретинилпальмитат и их производные.
[00108] Пригодные комплексообразователи могут быть выбраны из, например, этилендиаминтетрауксусной кислоты (ЭДТА), этилендиамина, порфина и витамина В-12.
[00109] Другие эксципиенты включают спирты, такие как, например, гексадеканол (также называют цетиловым спиртом или гексадекан-1-олом и иногда обозначают С16-ОН). В некоторых вариантах реализации изобретения имплантат может содержать спирт с разветвленной или неразветвленной цепью, длиной более 10 атомов углерода.
[00110] В одном варианте реализации изобретения имплантат может дополнительно содержать полиэтиленгликоль, как, например, полиэтиленгликоль 3350 (ПЭГ 3350). В других вариантах реализации изобретения имплантат не содержит ПЭГ 3350.
[00111] Имплантат может включать комбинацию двух или более вышеупомянутых эксципиентов.
[00112] Кислород может являться важным элементом на маршруте распада терапевтического агента, такого как Соединение 1. Другие или дополнительные способы увеличения срока годности и сохранения эффективности готового имплантата могут включать стадию хранения имплантата в обедненной кислородом атмосфере, такой как плотно закрытый пакет (например, алюминиевый пакет), содержащий пакетик с поглотителем кислорода. Дополнительные стадии могут включать заполнение пакета азотом или аргоном перед запечатыванием пакета для дополнительного удаления кислорода из пакета.
[00113] Один вариант реализации изобретения представляет собой внутриглазной имплантат в соответствии с данным изобретением, содержащий антиоксидант, который сохраняет по меньшей мере 90%, или более чем 95%, или по меньшей мере 98% его изначальной эффективности (или потери составляют не более чем 5%, иди не более чем 2% его изначальной эффективности) после хранения экструдированного имплантата в течение одного месяца или трех месяцев при 25°C в плотно закрытом пакете, содержащем поглотитель кислорода. Изначальная эффективность может основываться на фактическом или теоретическом количестве активного агента (например, Соединения 1), выраженном как масса к общей массе (масс. %), которое присутствует в имплантате непосредственно после его изготовления. В некоторых вариантах реализации изобретения имплантат может дополнительно находиться в устройстве для доставки глазного имплантата с наконечником в виде иглы в пакете, и пакет может дополнительно содержать осушитель.
[00114] Количество биодеградируемого полимерного материала, а следовательно доля и/или количество конкретного биодеградируемого полимера(-ов), используемого в имплантате, может изменяться в зависимости от используемого Соединения и требуемых характеристик высвобождения. Линейная или постоянная, или практически постоянна скорость высвобождения в течение длительного периода может быть пригодна для непрерывного пролонгированного (>1 месяца, например 3-6 месяцев) снижения внутриглазного давления. Как правило, биодеградируемый полимерный материал имплантата в соответствии с данным изобретением может составлять от 1% до 99% от массы имплантата (масс. %). В некоторых вариантах реализации изобретения биодеградируемый полимерный материал составляет от 80% до 99% от массы имплантата (масс. %). В некоторых вариантах реализации изобретения биодеградируемый полимерный материал составляет от около 92% до около 99% от массы имплантата (% масс).
[00115] В одном варианте реализации изобретения биодеградируемый полимерный материал содержит или состоит из первого, второго и третьего биодеградируемых полимеров. Первый и второй полимеры могут представлять собой полимеры поли(D,L-лактиды), которые отличаются друг от друга своей концевой группой (сложноэфирной или кислотной) и/или своей характеристической вязкостью (определенной для 0,1% раствора в хлороформе при 25°C); и третий полимер может представлять собой поли(D,L-лактид-со-гликолид). Имплантат может необязательно дополнительно содержать гексадеканол.
[00116] В одном варианте реализации изобретения первый полимер представляет собой поли(D,L-лактид), имеющий сложноэфирную концевую группу и характеристическую вязкость 0,25-0,35 дл/г (измеренную для 0,1% (масса/объем) раствора в хлороформе при 25°C) (например, R203S); второй полимер представляет собой поли(D,L-лактид), имеющий кислотную концевую группу (т.е. карбоксильную концевую группу) и характеристическую вязкость 0,25-0,35 дл/г (измеренную для 0,1% (масса/объем) раствора в хлороформе при 25°C) (например, R203H); и третий полимер представляет собой поли(D,L-лактид-со-гликолид), имеющий сложноэфирную концевую группу, характеристическую вязкость 0,16-0,24 дл/г (измеренную для 0,1% (масса/объем) раствора в хлороформе при 25°C) и соотношение D,L-лактид : гликолид, равное около 75:25 (например, RG752S).
[00117] В некоторых вариантах реализации изобретения первый, второй и третий биодеградируемые полимеры независимо выбраны из группы, состоящей из:
[00118] R202H, который представляет собой поли(D,L-лактид), имеющий кислотную концевую группу и характеристическую вязкость 0,16-0,24 дл/г, измеренную для 0,1% раствора в хлороформе при 25°C;
[00119] R203H, который представляет собой поли(D,L-лактид), имеющий кислотную концевую группу и характеристическую вязкость 0,25-0,35 дл/г, измеренную для 0,1% раствора в хлороформе при 25°C;
[00120] R202S, который представляет собой поли(D,L-лактид), имеющий сложноэфирную концевую группу и характеристическую вязкость 0,16-0,24 дл/г, измеренную для 0,1% раствора в хлороформе при 25°C;
[00121] R203S, который представляет собой поли(D,L-лактид), имеющий сложноэфирную концевую группу и характеристическую вязкость 0,25-0,35 дл/г, измеренную для 0,1% раствора в хлороформе при 25°C; и
[00122] RG752S, который представляет собой поли(D,L-лактид-со-гликолид) имеющий сложноэфирную концевую группу и характеристическую вязкость 0,16-0,24 дл/г (измеренную для 0,1% раствора в хлороформе при 25°C), и соотношение D,L-лактидтликолид, равное около 75:25.
[00123] В одном варианте реализации изобретения первый полимер представляет собой поли(D,L-лактид), имеющий сложноэфирную концевую группу и характеристическую вязкость 0,25-0,35 дл/г, второй полимер представляет собой поли(D,L-лактид), имеющий кислотную концевую группу и характеристическую вязкость 0,16-0,24 дл/г, и третий полимер представляет собой поли(D,L-лактид-со-гликолид), имеющий сложноэфирную концевую группу, и характеристическую вязкость 0,16-0,24 дл/г, и соотношение D,L-лактид : гликолид, равное около 75:25, причем характеристическая вязкость каждого полимера или сополимера измерена для 0,1% раствора полимера или сополимера в хлороформе при 25°C.
[00124] В одном конкретном варианте реализации изобретения первый полимер представляет собой R203S, второй полимер представляет собой R202H, и третий полимер представляет собой RG752S, а имплантат дополнительно содержит вспомогательное вещество гексадекан-1-ол. В конкретных формах имплантат содержит от 0,001% до 10% масс. гексадекан-1-ола.
[00125] В другом варианте реализации изобретения биодеградируемый полимерный материал содержит или состоит из первого и второго биодеградируемых полимеров, причем первый полимер представляет собой поли(D,L-лактид), имеющий сложноэфирную концевую группу и характеристическую вязкость 0,25-0,35 дл/г (измеренную для 0,1% (масса/объем) раствора в хлороформе при 25°C) (например, R203S), и второй полимер представляет собой поли(D,L-лактид), имеющий кислотную концевую группу (т.е. карбоксильную) и характеристическую вязкость 0,25-0,35 дл/г (измеренную для 0,1% (масса/объем) раствора в хлороформе при 25°C) (например, R203H).
[00126] В другом варианте реализации изобретения биодеградируемый полимерный материал содержит или состоит из поли(D,L-лактида), имеющего кислотную концевую группу (т.е. карбоксильную концевую группу) и характеристическую вязкость 0,16-0,24 дл/г (измеренную для 0,1% (масса/объем) раствора в хлороформе при 25°C) (например, R202H).
[00127] В другом варианте реализации изобретения биодеградируемый полимерный материал содержит или состоит из поли(D,L-лактида), имеющего кислотную концевую группу (т.е. карбоксильную концевую группу) и характеристическую вязкость 0,25-0,35 дл/г (измеренную для 0,1% (масса/объем) раствора в хлороформе при 25°C) (например, R203H).
[00128] Один вариант реализации изобретения представляет собой экструдированный биодеградируемый внутрикамерный имплантат, содержащий Соединение 1, гексадекан-1-ол (гексадеканол) и биодеградируемый полимерный материал, который содержит или состоит из первого, второго и третьего полимеров, причем первый полимер представляет собой R203S, второй полимер представляет собой R202H, и третий полимер представляет собой RG752S. Имплантат может дополнительно содержать антиоксидант. Неограничивающие примеры включают Имплантаты 3,10 и 11, составы которых приведены ниже в Таблице 2.
[00129] Один вариант реализации изобретения представляет собой биодеградируемый внутриглазной имплантат, содержащий биодеградируемый полимерный материал, гексадекан-1-ол и около 8 масс. % соединения, имеющего формулу

причем соединение и 1-гексадеканол связаны с биодеградируемым полимерным материалом, а биодеградируемый полимерный материал содержит i) полиф,L-лактид), имеющий сложноэфирную концевую группу и характеристическую вязкость около 0,25-0,35 дл/г, ii) поли(D,L-лактид), имеющий кислотную концевую группу и характеристическую вязкость около 0,16-0,25 дл/г, и iii) поли(D,L-лактид-со-гликолид), имеющий сложноэфирную концевую группу, характеристическую вязкость около 0,16-0,24 дл/г и соотношение D,L-лактид : гликолид, равное около 75:25, причем характеристическая вязкость каждого поли(D,L-лактида) и поли(0,L-лактид-со-гликолида), приведенная выше, измерена для 0,1% раствора полимера в хлороформе при 25°C. В некоторых вариантах реализации изобретения имплантат представляет собой экструдированный имплантат. В одном варианте реализации изобретения имплантат дополнительно содержит антиоксидант, комплексообразователь или одновременно антиоксидант и комплексообразователь. В конкретных формах изобретения антиоксидант представляет собой бутилированный гидроксианизол или аскорбиновую кислоту, а комплексообразователь представляет собой ЭДТА. Внутриглазной имплантат может иметь подходящий размер для установки в переднюю камеру глаза.
[00130] Один конкретный вариант реализации изобретения представляет собой внутриглазной имплантат, содержащий около 8 масс. % соединения, имеющего формулу

и около 5,6 масс. % гексадекан-1-ола, около 50,3 масс. % R203S, который представляет собой поли(D,L-лактид), имеющий сложноэфирную концевую группу и характеристическую вязкость около 0,25-0,35 дл/г, около 22,4 масс. % RG752S, который представляет собой поли(D,L-лактид-со-гликолид), имеющий сложноэфирную концевую группу и характеристическую вязкость около 0,16-0,24 дл/г, и соотношение D,L-лактид : гликолид, равное около 75:25, около 11,2 масс. % R202H; который представляет собой поли(D,L-лактид), имеющий кислотную концевую группу и характеристическую вязкость около 0,16-0,25 дл/г, около 2,0 масс. % бутилированного гидроксианизола и около 0,5 масс. % ЭДТА, причем характеристические вязкости полимеров R203S, R202H и RG752S соответствуют измеренным для 0,1% раствора полимера в хлороформе при 25°C.
[00131] Имплантаты согласно любому из вариантов реализации изобретения, перечисленных выше, могут предпочтительно содержать по меньшей мере около 1%, но не более чем 8% Соединения 1 по массе. Например, Соединение 1 может присутствовать в имплантате в количестве между 7 и 9% от массы имплантата. Имплантат может содержать 8,0% масс. Соединения1.
[00132] Имплантаты, содержащие биодеградируемый полимерный материал одного из типов, представленных выше, могут обеспечивать постоянное, постепенное высвобождение Соединения 1 в течение длительных периодов времени, таких как 3 месяца, 4-5 месяцев или в течение 6 месяцев.
[00133] Полимеры PLA и PLGA серии RESOMER® доступны у Evonik Industries AG, Германия.
[00134] Конкретные варианты реализации изобретения включают, но не ограничиваясь ими, экструдированный внутриглазной имплантат с размером, подходящим для установки в переднюю камеру глаза, и содержащий любой из составов, представленных для Имплантатов №1-4, 10 или 11 в Таблице 2.
Терапевтические агенты
[00135] Настоящее изобретение включает биодеградируемые внутриглазные имплантаты, полученные с помощью процесса экструзии, которые могут быть эффективными для снижения внутриглазного давления в глазу пациента в течение по меньшей мере одного месяца, в течение 1-3 месяцев, по меньшей мере 3 месяцев, в течение 3-6 месяцев или в течение 6 месяцев или более. Как правило, имплантат содержит или состоит из биодеградируемого полимерного материала и терапевтического агента, связанного с биодеградируемым полимерным материалом. Терапевтический агент может содержать соединение, имеющее Формулу I, II, III или IV. В предпочтительных вариантах реализации изобретения терапевтический агент содержит Соединение 1, и внутриглазной имплантат пригоден для установки в переднюю камеру глаза. Внутриглазной имплантат может высвобождать от около 10 до около 50 нг терапевтического агента в день в течение по меньшей мере одного месяца in vitro.
[00136] Примеры Соединений, имеющих Формулу IV, где R1 представляет собой -NH2 или -ОН, включают Соединения 1 и 2, представленные выше. Понятно, что Формула III также включает Соединения 1 и 2. Способы получения Соединений 1 и 2 описаны в патенте США №5834498.
[00137] Как правило, содержание терапевтического агента в имплантате может составлять от около 1% до около 90% от общей массы имплантата. В некоторых вариантах реализации изобретения содержание терапевтического агента может составлять от 1% до 20% от общей массы имплантата. Желательно, чтобы количество Соединения 1 в имплантате, выраженное как отношение массы к общей массе (масс. %), не превышало 8% от общей массы имплантата. Следовательно, в имплантате, содержащем Соединение 1, Соединение 1 предпочтительно составляет от 1% до 8% от массы имплантата, а в конкретных формах изобретения - 8% от массы имплантата. Ограничение массовой доли Соединения в имплантате до этих заданных уровней может помочь избежать нежелательного быстрого или скачкообразного высвобождения лекарственного средства при установке имплантата в жидкую среду, такую как глаз.
[00138] Способ исследования растворимости или высвобождения, утвержденный в Фармакопее США (USP 23; NF 18 (1995) pp. 1790-1798), можно использовать для измерения скорости высвобождения терапевтически активного агента, такого как Соединение 1, из имплантата. Например, при использовании способа многократных стоков, взвешенный образец имплантата добавляют к определенному объему раствора (среда для высвобождения), содержащего 0,9% NaCl (водн.) или фосфатно-солевому буферному раствору, где объем раствора должен быть таким, что концентрация терапевтически активного агента после высвобождения будет менее 20% и желательно менее 5% от насыщения. Смесь выдерживают при 37°C и медленно перемешивают или встряхивают для осуществления диффузии терапевтически активного агента из имплантата. За появлением терапевтически активного агента в растворе или среде для высвобождения как функции от времени можно наблюдать с помощью различных способов, известных в данной области, таких как спектрофотометрия, ВЭЖХ, масс-спектроскопия и т.д.
[00139] Как описано выше, имплантат согласно данному изобретению может содержать Соединение, имеющее Формулу I, II, III или IV в форме фармацевтически приемлемой соли. Термин «фармацевтически приемлемые соли» относится к солям или комплексам, которые сохраняют требуемую биологическую активность соединения и проявляют минимальные или совсем не проявляют нежелательные токсические эффекты у пациента или в клеточной системе, в которую они были введены.
[00140] Соль присоединения основания соединения, которое в своей свободной форме находится в виде кислоты, можно получить путем обработки кислоты подходящим основанием, таким как неорганическое основание, например: гидроксид натрия, гидроксид магния, гидроксид калия, гидроксид кальция, аммиак и тому подобное; или органическое основание, например: L-аргинин, этаноламин, бетаин, бензатин, морфолин и тому подобное. (Handbook of Pharmaceutical Salts, P. Heinrich Stahl & Camille G. Wermuth (Eds), Verlag Helvetica Chemica Acta -

[00141] Кислотно-аддитивную соль соединения, которое в своей свободной форме находится в виде основания, можно получить путем обработки свободного основания подходящей кислотой, такой как неорганическая кислота, например, соляная кислота, бромистоводородная кислота, серная кислота, фосфорная кислота, азотная кислота и тому подобное; или органическая кислота, например, уксусная кислота, гидроксиуксусная кислота, пропановая кислота, молочная кислота, пировиноградная кислота, малоновая кислота, фумаровая кислота, малеиновая кислота, щавелевая кислота, винная кислота, янтарная кислота, яблочная кислота, аскорбиновая кислота, бензойная кислота, дубильная кислота, памовая кислота, лимонная кислота, метилсульфоновая кислота, этансульфоновая кислота, бензолсульфоновая кислота или муравьиная кислота и тому подобное (Handbook of Pharmaceutical Salts, P. Heinrich Stahl & Camille G. Wermuth (Eds), Verlag Helvetica Chemica Acta -

[00142] В имплантате согласно настоящему описанию Соединение, имеющее любую из Формул I-IV, такое как Соединение 1 или Соединение 2, может быть диспергировано или распределено в, и/или покрывать, и/или окружать биодеградируемый полимерный материал. Когда имплантат контактирует с физиологической жидкостью, такой как глазная жидкость (например, водянистая влага), in vivo, физиологическая жидкость может контактировать с порцией Соединения, которая находится на поверхности имплантата, но не может - с порцией Соединения, которая диспергирована внутри полимерного материала. После имплантации биодеградируемый полимер может начать гидратироваться. Гидратация имплантата может усиливать диффузию и высвобождение Соединения. Дополнительно, имплантат может начать распадаться или подвергаться эрозии с течением времени. Распад может усиливать гидратацию, увеличивать подвижность полимерных цепей и образовывать поры для ускорения диффузии. Таким образом, имплантаты могут иметь такую конфигурацию, что Соединение высвобождается из полимерного материала по мере того, как полимерный материал гидратируется и/или распадается in vivo. Так как разрушение за счет гидратирования и/или распад имплантата может занимать заметное время и может протекать значительно дольше, чем обычный распад Соединения при введении обычного препарата в виде глазных капель, имплантат может обеспечивать долговременное высвобождение. Долговременное высвобождение может продолжаться пока по меньшей мере какая-то часть биодеградируемого полимерного материала, содержащего по меньше мере часть Соединения, имеющего одну из Формул I-IV, остается нетронутой.
[00143] Скорость, с которой Соединение, имеющее Формулу I, II, III или IV, высвобождается из имплантата, и период времени, в течение которого имплантат высвобождает Соединение, могут зависеть от различных факторов, включая, но не ограничиваясь этим, размер и форму имплантата, размер частиц Соединения, растворимость Соединения, соотношение Соединения и полимерного материала, используемый полимер(-ы) (в том числе соотношения мономеров в используемом полимере, концевые группы полимера, молекулярная масса полимера), кристалличность полимера, способ изготовления, площадь поверхности, подвергающуюся воздействию, скорость эрозии полимерного материала и биологическую среду, в которой находятся имплантаты после введения дозы.
Способы изготовления
[00144] Для изготовления внутриглазных имплантатов, представленных в данном документе, можно использовать различные способы. Пригодные способы могут включать экструзию (например, экструзию горячего расплава) для получения стержневых имплантатов (или волокон), прессование для получения таблеток, капсул или гранул и формование из раствора для получения биодеградируемых пластинок, пленок и сухих порошков. Также может использоваться эмульгирование для получения большого количества микросфер при изготовлении биодеградируемой внутриглазной системы доставки лекарственных средств для долговременного высвобождения Соединения, имеющего любую из Формул I-IV, в глаз пациента. Следовательно, в одном варианте реализации изобретения предлагается фармацевтическая композиция, пригодная для установки в глазничную область глаза и содержащая большое количество биодеградируемых микросфер, заключающих в себе Соединение 1.
[00145] Экструдированный имплантат может быть получен способом единичной или двойной экструзии, например, с помощью поршневого или двухшнекового экструдера. Выбранный способ и параметры способа, используемые для получения имплантатов, могут влиять на скорости высвобождения лекарственного средства. Способы экструзии могут давать возможность проводить крупномасштабное изготовление имплантатов, при этом с увеличением температуры изготовления получаются имплантаты с все более гомогенным распределением лекарственного средства в сплошной полимерной матрице. Температуры экструзии могут варьироваться от около 60°C до около 150°C, или от около 70°C до около 100°C, или ниже, если необходимо.
[00146] В одном варианте реализации изобретения внутриглазной имплантат согласно настоящему изобретению получен с помощью процесса экструзии. Полимеры и вспомогательные вещества, если присутствуют, как правило, смешивают с терапевтическим агентом, а затем соэкструдируют при выбранной температуре для получения волокна, содержащего биодеградируемую полимерную матрицу (или материал) и терапевтический агент, диспергированный в и/или распределенный в матрице (или материале). При желании волокно можно растереть и повторно экструдировать для получения дважды экструдированного имплантата.
[00147] В одном варианте изготовления имплантатов с помощью процесса экструзии терапевтический агент, биодеградируемый полимер(-ы) и, необязательно, один или более вспомогательных веществ вначале смешивают при комнатной температуре (перемешивают в емкости), а затем нагревают до температуры в диапазоне от 60°C до 150°C в течение периода времени от 1 до 60 минут, такого как 1-30 минут, 5-15 минут или 10 минут. Затем смесь экструдируют через наконечник при температуре от 60°C до 130°C или при 75°C. Затем экструдированное волокно разрезают на куски желаемой длины для получения внутриглазных имплантатов с конкретной массой. Отверстие наконечника, через которое экструдируется смесь, должно, как правило, иметь диаметр соответствующий желаемому диаметру имплантата, но если необходимо, экструдированное волокно можно вытягивать из наконечника для дополнительного уменьшения диаметра имплантата. Как правило, экструдированный имплантат может быть цилиндрическим или нецилиндрическим с длиной и диаметром (или другими геометрическими параметрами, соответствующими нецилиндрическим волокнам), пригодными для установки в глазничную область глаза, такую как передняя камера или стекловидное тело.
[00148] В одном из возможных способов изготовления внутриглазного имплантата в соответствии с данным изобретением совместно используются формование из раствора и экструзия горячего расплава. См., например, US 2010/0278897. В этом способе сначала получают сухой порошок или пленку путем растворения всех веществ (активного агента, полимера(-ов) и вспомогательных веществ, если присутствуют) в подходящем растворителе, таком как этилацетатс получением раствора. Затем этот раствор наливают в подходящую емкость (например, в тефлоновую (Teflon®) чашу), а затем высушивают в вакууме в течение ночис получением сухуй пленки. Затем пленку измельчают до частиц, которые собирают и экструдируют с помощью экструзии горячего расплава (используя, например, поршневой экструдер) для получения волокна, содержащего активный агент и один или более биодеградируемых полимеров. Волокно можно разрезать на куски с длиной, а поэтому и массой, подходящими для установки в глаз. Температура экструзии для этого процесса может изменяться от 45°C до 85°C.
[00149] В конце, экструдированное волокно или имплантат, вырезанный из экструдированного волокна, можно стерилизовать с помощью электронно-лучевого излучения. Эффективная доза электронно-лучевого излучения может составлять 20-30 кГр, а более конкретно - 25 кГр.
[00150] Соответственно, настоящее изобретение охватывает способы изготовления и использования экструдированных биодеградируемых имплантатов (которые могут, как правило, называться экструдированными стержнями или волокнами), пригодных для установки в глаз пациента для снижения внутриглазного давления, в том числе повышенного внутриглазного давления в глазу.
Способы и места введения
[00151] Для обеспечения надлежащего терапевтического эффекта (например, пролонгированного снижения внутриглазного давления) у пациента, включая страдающих от глаукомы, имплантат согласно настоящему изобретению предпочтительно устанавливать в переднюю камеру глаза. Передняя камера относится к пространству внутри глаза между радужной оболочкой и наиболее удаленной частью поверхности роговицы (эндотелием). Однако у некоторых пациентов может быть необходимо установить имплантат в стекловидное тело глаза. Задняя камера относится к пространству внутри глаза между задней частью радужной оболочки и передней поверхностью стекловидного тела. Задняя камера включает пространство между хрусталиком и ресничным отростком, который вырабатывает водянистую влагу, питающую роговицу, радужку и хрусталик и поддерживающую внутриглазное давление. На Фиг. 1 в поперечном сечении представлены эти и другие глазничные области глаза (100). Конкретные участки глаза (100) включают роговицу (102) и радужную оболочку (104), которые окружают переднюю камеру (106). За радужной оболочкой (104) находится задняя камера (108) и хрусталик (110). Внутри передней камеры находятся угол передней камеры (112) и трабекулярная сеть (114). Также показаны: эпителий роговицы (118), склера (116), стекловидное тело (119), ресничный поясок (120) и ресничный отросток (121). Задний отрезок глаза занимает задние две трети глазного яблока (за хрусталиком) и включает стекловидное тело, сетчатку и зрительный нерв.
[00152] Для уменьшения внутриглазного давления и лечения глаукомы у пациента имплантат, представленный в данном документе, можно имплантировать в переднюю камеру (или другую глазничную область) глаза млекопитающего в качестве монотерапии для доставки терапевтического агента (такого, как Соединение 1) в переднюю камеру глаза без необходимости использовать глазные капли. В альтернативном варианте имплантат можно использовать совместно с глазными каплями в качестве смежной терапии. В некоторых вариантах реализации изобретения введение имплантата, представленного в данном документе, в переднюю камеру глаза, может приводить к снижению внутриглазного давления в глазу по меньшей мере на около 20% или 30% или более по сравнению с исходным ВГД в течение 1 месяца, 2 месяцев, 3 месяцев, 4 месяцев или 6 месяцев или более после установки в глаз пациента. Пациент может являться человеком или другим млекопитающим, страдающим от повышенного внутриглазного давления или глаукомы и поэтому нуждающимся в лечении. В некоторых вариантах реализации изобретения имплантат может высвобождать Соединение 1 в соответствии с линейной кинетикой или кинетикой псевдонулевого порядка в течение по меньшей мере одного месяца после установки имплантата в глаз.
[00153] Биодеградируемые имплантаты можно вводить в глаз с помощью различных способов, включаю установку с помощью пинцета, троакара или ручного, оснащенного иглой (с наконечником в виде иглы) устройства для доставки (инструмента для введения). Некоторые ручные инструменты можно использовать для введения одного или более биодеградируемых имплантатов в глаз. Ручные инструменты для введения могут содержать иглу из нержавеющей стали 18-30 калибра (GA), рычаг, привод и поршень или толкатель для облегчения выталкивания имплантата. Имплантат может быть введен склеральным, лимбальным или роговичным путем для осуществления доступа к передней камере. В альтернативном варианте имплантат может быть введен в стекловидное тело с использованием подходящего инструмента для введения с иглой или катетером длиной, подходящей для достижения целевого участка и доставки имплантата. Некоторые способы введения имплантата включают доступ к целевому участку в глазничной области с помощью иглы, троакара или устройства для имплантации. После попадания в целевой участок, например переднюю камеру или стекловидное тело, можно нажать на рычаг на ручном устройстве, чтобы привод продвинул поршень или толкатель вперед. По мере движения поршня вперед, он может выталкивать устройство или имплантат в целевой участок (такой как стекловидное тело или передняя камера). Один пример устройства для доставки глазного имплантата описан в опубликованной заявке на патент США 2004/0054374.
[00154] Соответственно, способы лечения глаукомы и снижения внутриглазного давления в глазу пациента, обсуждаемые в данном документе, могут включать введение биодеградируемого внутриглазного имплантата типа, описанного в настоящем документе, в глаз с помощью инъекции в переднюю камеру (внутрикамерная инъекция) или стекловидное тело глаза (интравитреальная инъекция). Шприц, включающий иглу подходящего размера (например, иглу 22, 25, 27, 28 или 30 калибра), может использоваться для инъецирования одного или более имплантатов в эти области глаза. Соответственно, ширина или диаметр имплантата могут быть выбраны так, чтобы позволить имплантату находиться внутри и перемещаться через полость иглы выбранного калибра.
[00155] перед введением субъекту имплантат можно простерилизовать подходящей дозой бета-излучения. Предпочтительно, чтобы способ стерилизации не уменьшал значительно терапевтическую активность терапевтического агента в имплантате или сохранял по меньшей мере 50 или 80% или более от изначальной активности.
[00156] Соответственно, настоящее изобретение включает, но не ограничиваясь ими, следующие варианты реализации изобретения (1-16):
1. Биодеградируемый внутриглазной имплантат, содержащий биодеградируемый полимерный материал и терапевтический агент, связанный с биодеградируемым полимерным материалом, причем терапевтический агент содержит соединение, имеющее формулу (I)

или его фармацевтически приемлемую соль, или его сложноэфирное пролекарство, где волнистые линии представляют собой α- или β-связь, пунктирные линии представляют собой двойную связь или одинарную связь, R представляет собой замещенный гетероарильный радикал, где каждый R1 независимо выбран из группы, состоящей из водорода и низшего алкильного радикала, содержащего до шести атомов углерода, X представляет собой -OR1, -N(R1)2 или -N(R5)SO2R6, где R5 представляет собой водород или CH2OR6, R6 представляет собой водород, низший алкильный радикал, содержащий до шести атомов углерода, галоген-замещенное производное вышеуказанного низшего алкильного радикала или фтор-замещенное производное вышеуказанного низшего алкильного радикала, и R15 представляет собой водород или низший алкильный радикал, содержащий до шести атомов углерода; и Y представляет собой =O или 2 водородных радикала, где заместитель(-и) замещенного гетероарильного радикала в Формуле I выбран(-ы) из группы, состоящей из C1-C6 алкилов, галогенов, трифторметила, COR1, COCF3, SO2N(CR1)2, NO2 и CN.
2. Биодеградируемый внутриглазной имплантат, содержащий биодеградируемый полимерный материал и терапевтический агент, связанный с биодеградируемым полимерным материалом, причем терапевтический агент содержит соединение, имеющее формулу (III)

или его фармацевтически приемлемую соль, или его сложноэфирное пролекарство, где X представляет собой -ОН или -N(R1)2, и где R1 независимо выбран из группы, состоящей из водорода и С1-C6 алкила, причем имплантат эффективен для снижения внутриглазного давления (ВГД) в глазу млекопитающего.
3. Внутриглазной имплантат согласно варианту реализации 2, отличающийся тем, что терапевтический агент содержит соединение, имеющее формулу (IV)

или его фармацевтически приемлемую соль, или его сложноэфирное пролекарство, где X представляет собой -ОН или -N(R1)2, и где R1 независимо выбран из группы, состоящей из водорода и C1-C6 алкила.
4. Внутриглазной имплантат согласно варианту реализации 3, отличающийся тем, что терапевтический агент содержит соединение, имеющее формулу (Соединение 1)

а имплантат является эффективным для снижения ВГД в глазу млекопитающего в течение 5 месяцев или более после установки в глаз.
5. Внутриглазной имплантат согласно любому из вариантов реализации 1-4, отличающийся тем, что имеет размер, подходящий для установки в переднюю камеру глаза.
6. Внутриглазной имплантат согласно любому из вариантов реализации 1-5, отличающийся тем, что биодеградируемый полимерный материал содержит поли(D,L-лактид), поли(D,L-лактид-со-гликолид) или их комбинацию.
7. Внутриглазной имплантат согласно варианту реализации 4, отличающийся тем, что является эффективным для снижения ВГД в глазу млекопитающего на 20-30% в течение 5 месяцев или более по сравнению с ВГД в глазу до получения имплантата.
8. Имплантат согласно варианту реализации 4, отличающийся тем, что терапевтический агент составляет по меньшей мере около 1%, но не более чем около 8% от массы имплантата.
9. Имплантат согласно любому из вариантов реализации 1-8, отличающийся тем, что получен с помощью процесса экструзии, и длина имплантата составляет от около 0,5 до около 2 мм, диаметр - от около 100 до около 500 мкм, и общая масса - от около 10 до около 200 мкг.
10. Способ снижения внутриглазного давления у пациента, включающий введение терапевтически эффективного количества терапевтического агента в переднюю камеру глаза пациента, благодаря чему снижается внутриглазное давление в глазу, причем терапевтический агент имеет формулу

11. Способ уменьшения внутриглазного давления у пациента, включающий установку внутриглазного имплантата согласно любому из вариантов реализации 1-9 в глаз пациента, благодаря чему снижается внутриглазное давление в глазу в течение 5 месяцев или более.
12. Способ согласно варианту реализации 10 или 11, отличающийся тем, что пациент страдает от, склонен к или у него диагностированы повышенное внутриглазное давление или глаукома.
13. Способ согласно любому из вариантов реализации 11-12, отличающийся тем, что внутриглазной имплантат установлен в переднюю камеру глаза пациента.
14. Способ согласно любому из вариантов реализации 11-13, отличающийся тем, что внутриглазной имплантат снижает внутриглазное давление в глазу по меньшей мере на около 30%, по сравнению с внутриглазным давлением в глазу перед получением имплантата, в течение 3-5 месяцев или более после установки имплантата.
15. Способ получения биодеградируемого внутриглазного имплантата, эффективного для снижения внутриглазного давления у пациента, причем имплантат содержит или состоит из биодеградируемого полимерного материала и терапевтического агента, связанного с биодеградируемым полимерным материалом и имеющего формулу (Соединение 1)

при этом способ включает по порядку I) получение Соединения 1 в форме твердого вещества; II) смешивание указанной твердой формы Соединения 1 с биодеградируемым полимером или двумя или более биодеградируемыми полимерами для получения смеси; III) экструдирование смеси с получением волокна; и IV) разрезание волокна на куски подходящей длины для установки в глазничную область глаза, с получением таким образом внутриглазного имплантата, причем получение Соединения 1 в форме твердого вещества включает:
a) добавление Соединения 1 в виде масла к этилацетату (EtOAc) при около 50°C для получения смеси;
b) перемешивание смеси, полученной на стадии а), при 50°C с получением прозрачного раствора;
c) охлаждение прозрачного раствора, полученного на стадии b), до около 30°C в течение 1-3 часов;
d) добавление затравочного кристалла Соединения 1 к охлажденному раствору, полученному на стадии с);
e) выдерживание раствора с введенной затравкой, полученного на стадии d), при около 30°C в течение 1-3 часов;
f) охлаждение раствора с введенной затравкой, полученного на стадии е), до температуры около 0-5°C в течение около 1-5 часов.
g) перемешивание раствора, полученного на стадии f), при температуре около 0-5°C в течение 1-3 часов с получением суспензии.
h) фильтрование суспензии при температуре между около 20°C и 25°C, с получением твердой формы Соединения 1, а
затравочный кристалл Соединения 1 получен с помощью способа, включающего:
i) растворение Соединения 1 в виде масла в ЕЮ Ас при температуре около 35-40°C с получением смеси;
ii) перемешивание смеси, полученной на стадии i), при температуре около 35-40°C, с получением прозрачного раствора;
iii) охлаждение прозрачного раствора, полученного на стадии ii), до температуры около 0-5°C в течение около 1-5 часов.
iv) перемешивание охлажденного раствора, полученного на стадии iii), при температуре около 0-5°C в течение 1-3 часов с получением белой суспензии.
v) фильтрование белой суспензии, полученной на стадии iv), при температуре между около 20°C и 25°C с получением таким образом затравочного кристалла Соединения 1.
16. Другой вариант реализации изобретения представляет собой способ получения кристаллической формы Соединения 1 в соответствии со стадиями i-v выше.
Пример 1
Сравнение активностей понижения ВГД простамидов in vivo
[00157] Соединение 1 попадает в класс соединений, известных под общим названием простамиды (Woodward et al. (2007) British Journal of Pharmacology 150:342-352).
[00158] Ряд простамидов был выбран в качестве возможных кандидатов для внутрикамерной биодеградируемой системы доставки лекарственных средств (например, имплантата), и была исследована их способность снижать ВГД при прямом введении в водянистую влагу (следовательно, при внутрикамерном введении). В Таблице 1 перечислены значения ЕС50 (нМ), полученные при анализе радужных оболочек кошек, рассчитанные значения log Р (log Ррассчит.) и величины понижения ВГД, полученные после или местного, или внутрикамерного введения различных простамидов. Внутрикамерное введение лекарственного средства осуществляли путем установки инфузионного насоса в подкожный карман на шее у собак с катетером, входящим в переднюю камеру глаза. Испытания проводились, чтобы измерить и сравнить концентрацию соединения в растворе, выходящем из насоса, с той, которую изначально вводили в насос для того, чтобы установить уровень дозировки. Как показано в Таблице 1, Соединение 1 эффективно снижает ВГД, значительно эффективнее, чем биматопрост при внутрикамерном введении (непосредственно в переднюю камеру) в глаз с нормальным давлением у собаки.
[00159] Структуры молекул Соединений 3-5 представлены ниже. Описание относительно Соединений 3-5, включая способы синтеза, можно найти в патентах США №№6602900, 6124344, 5834498 и/или 5688819 в зависимости от конкретного случая. Ссылки также можно найти в WO 95/18102, WO 96/36599 и WO 99/25358, US 2007/0099984 и в патенте США №5741810, и у Schuster et al. (2000) Mol. Pharmacol. 58:1511-1516.


Символ «~» означает приблизительно
Символ «<» означает менее чем
Log Ррассчит. (рассчитанное значение log Р) является мерой липофильности Соединения. Коэффициент распределения (Р) для каждого Соединения определяли, рассчитывая отношение равновесных концентраций растворенного неионизированного Соединения в каждой фазе двухфазной системы, состоящей из н-октанола и воды.
* Исследуемые соединения вводили непосредственно в переднюю камеру (внутрикамерное введение) в дозах в диапазоне от 15 нг/день до 108 нг/день с использованием инфузионного насоса, имплантированного подкожно в животных. Хирургическое вмешательство и введение лекарственного средства выполняли только для правого глаза, тогда как левый оставался необработанным и служил в качестве контрольного. Количество животных, принимавших участие в исследовании, варьировалось от 3 до 5. Инфузию исследуемых соединений в правые глаза поддерживали в течение 2-3 недель, а ВГД измеряли для обоих глаз трижды в неделю, используя тонометр TonoVet. Снижение ВГД (%) рассчитывали как наблюдаемое различие в процентах в значении ВГД в моменты времени после начала проведения инфузии по сравнению с исходным значением ВГД до начала проведения инфузии. Уровень дозы 15 нг/день был выбран для представляющих интерес соединений на основании исходных данных о содержании лекарственного средства в 1С DDS (внутрикамерной системе доставки лекарственных средств) и ограничении размера системы, определяемом предполагаемым местом введения.
** Измерено влияние соединений на внутриглазное давление у собак при местном введении в глаз. Соединения были получены в указанных концентрациях в среде, содержащей 0,1% полисорбата 80 и 10 мМ Трис-основания. Собакам с нормальным давлением вводили 25 мкл на поверхность одного глаза, а в противоположный глаз вводили среду для контроля. Внутриглазное давление измеряли с помощью аппланационной пневмотонометрии. Внутриглазное давление у собак измеряли непосредственно перед введением лекарственного средства и через 6 часов после.
*** Активность простамидов по отношению к FP-рецепторам для каждого соединения была измерена по сокращению изолированного сфинктера радужки кошки.
Пример 2
Биодеградируемые внутрикамерные имплантаты для долговременной доставки Соединения 1 in vivo
[00160] Дополнительные исследования были проведены для определения биодеградируемого состава, который можно получить в форме экструдированного имплантата, пригодного для установки в переднюю камеру глаза и способного обеспечить высвобождение практически нулевого порядка Соединения 1 в течение по меньшей мере трех месяцев, а желательно в течение по меньшей мере шести месяцев после установки в переднюю камеру глаза. Дополнительное требование заключалось в том, что имплантат должен хорошо переноситься глазом, практически или совсем не вызывая побочных эффектов, таких как, например, боль, покраснение или воспаление. С учетом этих целей ряд экструдированных имплантатов (включая, например, Имплантаты 1-9) получен и исследован in vitro и in vivo, как описано ниже. Композиции, геометрические параметры и массы Имплантатов 1-9 представлены в Таблице 2. Биодеградируемые полимеры, используемые для получения имплантатов, выбраны среди полимеров RESOMER®, имеющихся в наличии у Evonik Industries, AG, и обозначены в соответствии с их регистрационными номерами полимеров в Таблице 2.
Изготовление имплантатов с использованием двухшнекового экструдера
[00161] Имплантаты 1-4, 10 и 11 в Таблице 2 изготовлены с помощью экструзии горячего расплава с использованием двухшнекового экструдера (DSM Xplore 5 Micro Extruder), как указано далее.
[00162] До экструзии чистая твердая форма Соединения 1 была получена растворением неочищенного Соединения 1 в этилацетате (EtOAc) при приблизительно 50°C и перемешиванием при этой температуре до получения прозрачного раствора. Затем этот прозрачный раствор медленно охлаждали до температуры приблизительно 30°C в течение определенного периода времени до введения затравочного кристалла Соединения 1. Этот раствор выдерживали при приблизительно 30°C в течение определенного периода времени до охлаждения его до 0-5°C в течение нескольких часов и продолжали перемешивать его при этой температуре в течение некоторого времени. Затем суспензию фильтровали при температуре окружающей среды с получением чистого Соединение 1.
[00163] Затравочный кристалл Соединения 1 был получен растворением чистого Соединения 1 (масла после хроматографической очистки) в EtOAc при приблизительно 35-40°C и перемешиванием при этой температуре до получения прозрачного раствора. Этот прозрачный раствор затем медленно охлаждали до температуры приблизительно 0-5°C в течение нескольких часов, а затем перемешивали при этой температуре в течение некоторого времени. Образовалась белая суспензия, которую затем фильтровали при температуре окружающей среды с получением затравочный кристалл Соединения 1.
[00164] Перед началом экструзии полимер(-ы), чистую твердую форму Соединения 1 (полученную как указано выше) и вспомогательные вещества, если присутствуют, перемешивали до однородного состояния. Для того с получением однородную смесь компонентов имплантатов до экструзии, Соединение 1, полимер(-ы) и вспомогательные вещества (если присутствуют) точно взвешивали и переносили в небольшую емкость из нержавеющей стали с двумя шариками из нержавеющей стали. Вещества перемешивали, используя смеситель Turbula в течение 20-45 минут. После перемешивания порошковую смесь снова размешивали вручную с помощью шпателя. Двухшнековый экструдер DSM был собран и предварительно нагрет до желаемой температуры экструзии (обычно от 60°C до 100°C). Затем перемешанный материал вручную загружали в отверстие в верхней части цилиндра между двумя вращающимися шнеками. Расплавленные вещества перемещались вниз по цилиндру за счет вращения шнеков и экструдировались через насадку 500 мкм. Диаметр экструдированного волокна контролировали с помощью устройства для вытягивания Beta Lasermike, которое присоединяли к оборудованию. Диаметр волокон регулировали, изменяя скорость устройства для вытягивания. Конечный диаметр волокна, как правило, изменялся от 0,006 дюймов до 0,025 дюймов. Экструдированные волокна разрезали на куски длиной от 5 до 10 дюймов и собирали в пробирку для хранения. Пробирку для хранения помещали в пакет из алюминиевой фольги, содержащий пакетик с осушителем и поглотителем кислорода, термоизолировали и хранили при -20°C в морозильной камере. Изготовление имплантатов с использованием поршневого экструдера
[00165] Имплантаты 5-9 в Таблице 2 были изготовлены с использованием способов формования из раствора/экструзии горячего расплава с помощью механического плунжерного микроэкструдера (поршневого экструдера). Субстанцию лекарственного средства (Соединение 1 в форме масла), полимер(-ы) и вспомогательные вещества, если присутствуют, вместе растворяли в этилацетатес получением одного раствора. Раствор наливали в тефлоновую (Teflon®) чашу и сушили в течение ночи в вакуумной печи при 35°C с получением пленки. Пленку измельчали до частиц, которые затем помещали в нагретый резервуар поршневого экструдера и экструдировали волокна диаметром 200-250 мкм с использованием поршневого экструдера при температуре в интервале 45-85°C через насадку 200 мкм и параметре скорости 0,0025. Меньшие имплантаты изготавливали, используя меньшие насадки или вытягивая при более высокой скорости. Экструдированные волокна разрезали на куски длиной 5 дюймов и собирали в пробирку для хранения. Пробирку для хранения помещали в пакет из алюминиевой фольги, содержащий пакетик с осушителем и поглотителем кислорода, термоизолировали и хранили при -20°C в морозильной камере.
Анализ скорости высвобождения in vitro
[00166] Для измерения скорости высвобождения in vitro и определения кривой суммарного высвобождения in vitro для каждого имплантата в жидкой среде, три имплантата длиной 1,5 мм отрезали от трех случайно выбранных волокон из каждой партии волокон для каждого состава. Каждый имплантат помещали в 8 мл стеклянный флакон, содержащий 3 мл 0,01 М фосфатно-солевого буферного раствора (рН 7,4) (среда для высвобождения). Флаконы затем помещали на водяную баню и встряхивали при 37°C и 50 об/мин. В различные моменты времени флаконы снимали с бани и весь объем среды для высвобождения (3 мл) извлекали и анализировали с помощью ВЭЖХ на общее количество высвободившегося простамида. Непосредственно после извлечения среды для высвобождения из флакона, 3 мл свежего фосфатно-солевого буферного раствора добавляли во флакон, и флакон помещали обратно на водяную баню для дальнейшей инкубации до момента следующего пробоотбора. Кривую суммарного in vitro высвобождения (или профиль) строили, используя величины содержания простамидов, полученные с помощью ВЭЖХ.
[00167] Суммарное количество высвободившегося соединения выражают в процентах от общего количества соединения, изначально присутствующего в имплантате. Для определения общего количества соединения, изначально присутствующего в имплантате, приблизительно 4 мг каждого исследуемого имплантата взвешивали и переносили в мерную колбу объемом 5 мл. Затем в каждую колбу добавляли 2,5 мл ацетонитрила. Колбы встряхивали и вращали до полного растворения волокна. Затем в колбу добавляли воду до объема 5 мл. После того как содержимое колбы хорошо перемешали, приблизительно 1,5 мл раствора переносили в микроцентрифужную пробирку и центрифугировали в течение 10 минут при 12000 об/мин. Порцию прозрачной надосадочной жидкости помещали в сосуд для ВЭЖХ-анализа содержания простамида (например, Соединения 1).
Исследования снижения внутриглазного давления (ВГД) in vivo
[00168] Эффект снижения ВГД для Имплантатов 1-4 исследовали на собаках с нормальным давлением. Каждый имплантат вводили всего восьми собакам с нормальным давлением. При подготовке к исследованиям по снижению ВГД in vivo каждый имплантат (с геометрическими параметрами, массой и композицией, представленными в Таблице 2) помещали в устройство для доставки с наконечником в виде иглы (один имплантат в одно устройство). Весь агрегат (устройство и имплантат) затем стерилизовали с помощью 20-25 кГр электронно-лучевого излучения. Каждой собаке вводили один имплантат в переднюю камеру правого глаза, тогда как левый глаз оставался необработанным и служил в качестве контрольного. Измерения ВГД проводили для обоих глаз перед и после введения дозы с частотой 3 раза в неделю в течение ~5 месяцев после введения дозы. Снижение ВГД (%) рассчитывали как наблюдаемое различие в процентах в значениях ВГД в моменты времени после введения дозы по сравнению с исходным значением ВГД. Среднее снижение ВГД (в %) для обработанных и необработанных глаз, наблюдаемое для каждой группы из восьми собак, представлено на Фиг. 5-8. При сравнении продолжительности действия in vivo с кривой высвобождения in vitro для Имплантатов 1-4 становится понятным, что эффект снижения ВГД у собак с нормальным давлением наблюдается значительно дольше, чем можно было ожидать, основываясь на результатах исследований высвобождения in vitro, неожиданный, но все же положительный результат.
[00169] Фиг. 2-4 и 9 иллюстрируют кривые суммарного высвобождения Соединения 1 из каждого из имплантатов, перечисленных в Таблице 2. Среднее суточное количество (нг/день) Соединения 1, которое высвобождается из каждого имплантата со временем in vitro, представлено в Таблице 2. Как показано на Фиг. 2 и 9, имплантаты 1-4 и 9 высвобождают Соединение 1 с постоянной или практически нулевого порядка скоростью непрерывно с небольшими или без периодов задержки для длительных периодов. Имплантат 5 высвобождает небольшое количество лекарственного средства (Соединения 1) in vitro в среду для высвобождения в течение первых двух месяцев, а затем наблюдается резкий скачок высвобождения лекарственного средства, равный около 80% изначального содержания (Фиг. 5). Имплантат 6, подобно, не способен высвобождать значительное количество лекарственного средства даже после двух полных месяцев инкубации в среде для высвобождения (Фиг. 3).
[00170] Кроме того, неожиданно было обнаружено, что когда количество Соединения 1 в имплантате превышает 8 масс. %, наблюдается резкий скачок высвобождения лекарственного средства и/или очень большие скорости высвобождения, которые, как правило, считаются непригодными для предполагаемых терапевтических целей. Например, имплантат 7 высвобождает около 55% общего содержания лекарственного средства в 1 день и впоследствии только небольшие количества лекарственного средства (Фиг. 4). Имплантат 8 высвобождает более 70% общего содержания лекарственного средства в течение первых двух недель в среду для высвобождения (Фиг. 4).
[00171] При исследованиях на собаках каждый из четырех имплантатов (Имплантаты 1-4; см. Таблицу 2) снижает внутриглазное давление в глазу в среднем на 20%) и 30% от исходного значения ВГД в зависимости от состава (Фиг. 5-8). Эффект снижения ВГД в глазу, произведенный каждым из имплантатов, содержащих простамид (Соединение 1), длится в течение по меньшей мере 120 дней после установки имплантата в переднюю камеру глаза.
Стабильность Соединения 1 в Имплантате №3 (измеренная по образованию примесей после хранения при 25°C или 30°C в течение 1,5 месяцев и 3 месяцев) была улучшена путем включения антиоксиданта в состав Имплантата №3 (Имплантаты 10 и 11). Например, включение 2,0% аскорбиновой кислоты с соответствующей регулировкой массового процентного содержания трех полимеров (как в Имплантате №11) приводило к понижению общего содержания примесей (в %), образуемых в имплантате после 1,5 и 3 месяцев хранения при 25°C или 30°C, по сравнению с общим содержанием примесей (в %), образуемых в течение таких же периодов в имплантате с составом №3 (Таблица 3). Подобно, включение 2% бутилированного гидроксианизола (БГА) и 0,5% ЭДТА с соответствующей регулировкой массового процентного содержания трех полимеров (как в Имплантате №10) приводило к понижению общего содержания примесей (в %), образуемых в имплантате после 1,5 и 3 месяцев хранения по сравнению с общим содержанием примесей (в %), образуемых в течение таких же периодов в Имплантате с составом №3 (Таблица 3). Таким образом, включение антиоксидантов повышает стабильность Соединения 1, и таким образом увеличивается срок годности и сохраняется эффективность изготовленного имплантата. Включение ЭДТА, комплексообразователя ионов металлов, также может увеличивать стабильность. In vitro суммарное высвобождение Соединения (в %) из каждого из Имплантатов 10 и 11 по сравнению с высвобождением из Имплантата 3 представлено на Фиг. 10.


RESOMER® RG755S представляет собой поли(D,L-лактид-со-гликолид), имеющий сложноэфирную концевую группу и характеристическую вязкость около 0,50-0,70 дл/г (измеренную для 0,1% раствора в хлороформе при 25°C), и молярное соотношение D,L-лактид:гликолид, равное около 75:25.
ПЭГ 3350 = полиэтиленгликоль со средней молекулярной массой 3350.
Гексадеканол = гексадекан-1-ол (цетиловый спирт)
БГА = бутилированный гидроксианизол
ЭДТА = этилендиаминтетрауксусная кислота
Соединение 1 представляет собой простамид, имеющий следующую структуру:


Реферат
Группа изобретений относится к медицине и предназначена для снижения внутриглазного давления у пациента с глаукомой. Описаны биодеградируемый внутриглазной имплантат, содержащий простамиды и соединения простамидов, а также способ его получения. Группа изобретений позволяет расширить арсенал терапевтических средств. 2 н. и 1 з.п. ф-лы, 10 ил., 3 табл., 2 пр.
Формула


Комментарии