Глазной имплантат, изготавливаемый способом двойной экструзии - RU2389479C2
Код документа: RU2389479C2
Чертежи







Описание
Перекрестная ссылка
Данная заявка является частичным продолжением заявки на патент США № 10/340237, поданной 9 января 2003 г., полное содержание которой включено в данную заявку посредством ссылки.
Предшествующий уровень техники
Настоящее изобретение относится к имплантатам и способам лечения патологических состояний глаз. В частности, настоящее изобретение относится к имплантатам и способам лечения патологических состояний глаз посредством имплантации в глазничную область или сайт биодеградируемого имплантата, содержащего активный агент и биодеградируемую полимерную матрицу, где имплантат изготавливается способом двойной экструзии. Биодеградируемые имплантаты по настоящему изобретению имеют варьируемые и сниженные скорости высвобождения для обеспечения улучшенной кинетики высвобождения одного или нескольких активных (терапевтических) агентов в течение определенного периода времени.
Патологическое состояние глаза может включать заболевание, недомогание или состояние, поражающее глаз или затрагивающее глаз, либо его часть, либо область глаза. В общем, глаз включает глазное яблоко и ткани, а также жидкости, содержащиеся в глазном яблоке, окологлазные мышцы (такие как косые и прямые мышцы), а также участок глазного нерва, находящийся внутри или прилегающий к глазному яблоку. Состоянием, затрагивающим переднюю область глаза, является болезнь, недомогание или состояние, поражающее или затрагивающее переднюю (т.е. фронтальную область глаза) область глаза или его сайт, например окологлазная мышца, веко, ткани глазного яблока или жидкость, находящаяся перед задней стенкой оболочки хрусталика, а также ресничная мышца. Таким образом, состояния, затрагивающие переднюю область глаза, в первую очередь поражают или затрагивают конъюнктиву, роговицу, переднюю камеру, радужку, заднюю камеру (позади сетчатки, но спереди задней стенки оболочки хрусталика), хрусталик или оболочку хрусталика, а также кровеносные сосуды, нервы, которые васкуляризуют или иннервируют переднюю область глаза или ее участок. Состоянием, затрагивающим заднюю область глаза, является болезнь, недомогание или состояние, которое в первую очередь поражает или затрагивает заднюю область глаза или ее участок, например сосудистую оболочку глаза или склеру (в заднем положении по отношению к проекции через заднюю стенку оболочки хрусталика), стекловидное тело, камеру стекловидного тела, сетчатку, зрительный нерв (т.е. диск зрительного нерва), а также кровеносные сосуды и нервы, которые васкуляризуют или иннервируют заднюю область глаза либо ее участок.
Так, состоянием, затрагивающим заднюю область глаза, может являться заболевание, недомогание или состояние, такое как, например, дегенерация желтого пятна сетчатки (такая как неэкссудативная возрастная дегенерация желтого пятна сетчатки и экссудативная возрастная дегенерация желтого пятна сетчатки); хориоизадная неоваскуляризация; острая нейроретинопатия желтого пятна сетчатки, отек сетчатки (например, кистоидный отек желтого пятна сетчатки и диабетический отек сетчатки); болезнь Бехчета, заболевания сетчатки, диабетическая ретинопатия (включая пролиферативную диабетическую ретинопатию); артериальная закупорка сосудов сетчатки, закупорка центральной вены сетчатки; увеит; отслойка сетчатки; травмы глаза, поражающие заднюю область глаза или область глаза в целом; состояние, затрагивающее заднюю область глаза, вызванное или явившиеся следствием действия лазера; состояния, затрагивающие заднюю область глаза, вызванные или явившиеся следствием фототерапии; фотокоагуляция; лучевая ретинопатия; заболевания эпиретинальной мембраны; закупорка венозных сосудов сетчатки; передняя ишемическая зрительная невропатия; неретинопатическая диабетическая ретинальная дисфункция, пигментная дегенерация сетчатки и глаукома. Глаукома может рассматриваться как состояние, затрагивающее заднюю область глаза, поскольку задачей терапии является предотвращение или снижение вероятности потери зрения вследствие повреждения или гибели клеток сетчатки или клеток зрительного нерва (т.е. нейропротективное действие).
Состоянием, затрагивающим переднюю часть глаза, может являться заболевание, недомогание или состояние, такое как, например, афакия; артифакия; астигматизм; блефароспазм; катаракта; заболевания конъюнктивы; конъюнктивит; заболевания роговицы; язва роговицы; синдром сухих глаз; заболевания века; заболевания слезного аппарата; закупорка слезных каналов; миопия; старческая заднозоркость; нарушения функции зрачка и косоглазие. Глаукома также может рассматриваться как состояние, затрагивающее переднюю область глаза, поскольку клинической целью лечения глаукомы может являться понижение давления водосодержащей жидкости в передней камере глаза (т.е. понижение внутриглазного давления).
Настоящее изобретение направлено и связано с имплантатом и способами лечения патологических состояний глаза, таких как состояния, затрагивающие переднюю или заднюю область глаза, либо состояний глаза, которые можно характеризовать как затрагивающие переднюю, так и заднюю области глаза.
Терапевтические соединения, пригодные для лечения состояний глаза, могут включать активные агенты, например, с антиопухолевой, антиангиогенезной, киназно-ингибирующей, холиноблокирующей, антиадренергической и/или противовоспалительной активностью.
Дегенерация желтого пятна сетчатки, такая как возрастная дегенерация желтого пятна (ВДЖП), является основной причиной слепоты во всем мире. Установлено, что тринадцать миллионов американцев имеют симптомы дегенерации желтого пятна. Дегенерация желтого пятна приводит к разрушению пятна, светочувствительной части сетчатки, ответственной за четкую, направленную видимость, необходимую для чтения или вождения. Особенно травмируется центральное зрение. Диагностируют или сухую (атрофическую) дегенерацию желтого пятна, или влажную (экссудативную). Сухая форма дегенерации желтого пятна более распространена, чем влажная, и около 90% пациентам с ВДЖП был поставлен диагноз сухая ВДЖП. Влажная форма заболевания, как правило, приводит к более серьезной потере зрения. Дегенерация желтого пятна вызывает постепенную или внезапную безболезненную потерю зрения. Причины возникновения дегенерации желтого пятна не ясны. Сухая форма ВДЖП может быть следствием старения и истончения тканей желтого пятна, отложения пигментов в желтом пятне, либо комбинации этих двух процессов. При влажной ВДЖП под сетчаткой растут новые кровеносные сосуды, выделяющие кровь и жидкость. Эти выделения вызывают смерть клеток сетчатки и порождают слепые пятна в центральном зрении.
Отек желтого пятна (ОЖП) может привести к опуханию пятна. Отек вызывают выделения жидкости из кровеносных сосудов сетчатки. Кровь просачивается из слабых стенок сосудов в очень маленькую область пятна, достигая светового конуса и нервных окончаний, которые детектируют цвет и от которых зависит дневное зрение. В области центрального зрения возникает размытость в центре или только по краям. Потеря зрения может прогрессировать в течение нескольких месяцев. Закупорка кровеносных сосудов сетчатки, воспаление глаза, возрастная дегенерация желтого пятна - все эти заболевания связаны с отеком пятна. Желтое пятно также может быть повреждено из-за опухоли вследствие экстракции катаракты. Симптомы ОЖП включают размытое центральное зрение, искаженное видение, видение с розовым оттенком, а также светочувствительность. Причинами возникновения ОЖП могут быть закупорка венозных сосудов сетчатки, дегенерация желтого пятна, диабетическая утечка желтого пятна, воспаление глаза, идиопатическая центральная серозная хориопатия, передний или задний увеит, задний циклит, пигментная дегенерация сетчатки, лучевая ретинопатия, задняя отслойка стекловидного тела, образование эпиретинальной оболочки, идиопатическая юкстафовеальная телеангиэктазия сетчатки, Nd:YАG (иттрий-аллюминий-галлий) капсулотомия или иридотомия. Некоторые пациенты с ОЖП могут в течение некоторого времени местно применять адреналин или аналоги простагландина для глаукомы. Основной способ лечения ОЖП обычно заключается в местном применении противовоспалительных капель.
Отек желтого пятна обычно представляет собой неспецифичный ответ сетчатки на различные повреждения. Он связан с различными заболеваниями, включая увеит, аномалии сосудистой системы сетчатки (диабетическая ретинопатия и болезнь закупорки кровеносных сосудов сетчатки), последствия операций катаракты (кистоидный отек желтого пятна после катаракты), эпиретинальную мембрану желтого пятна, а также наследственную или приобретенную дистрофию сетчатки. Отек пятна включает разрыв внутреннего гемато-ретинального барьера на уровне капиллярного эндотелия, приводящий к аномальной проницаемости сосудов сетчатки и просачиванию в примыкающие к сетчатке ткани. Желтое пятно становится плотнее вследствие накапливания жидкости, приводя к существенным нарушениям в зрительной активности (Ahmed I, Ai E. Macular disorders: cystoid macular oedema. In: Yanoff M, duker JS, eds. Ophthalmology. London: Mosby; 1999:34; Dick J, Jampol LM, Haller JA. Macular edema. In: Ryan S, Schachat AP, eds. Retina. 3rd ed. St. Louis, МО: CV Mosby; 2001, v.2, Section 2 chap. 57:967-979).
Отек сетчатки может возникать в результате заболеваний, приводящих к накоплению повреждений в течение нескольких лет, таких как диабетическая ретинопатия, либо в результате более серьезных явлений, таких как закупорка центральной вены сетчатки или закупорка ответвлений кровеносных сосудов сетчатки.
В некоторых случаях отек желтого пятна проходит самопроизвольно или после короткого лечения. Выбор способа лечения отека желтого пятна зависит от причины и тяжести состояния. В настоящий момент не существует утвержденных фармакологических способов лечения отека желтого пятна. Было показано, что фокальная/рассеянная лазерная фотокоагуляция является эффективной для предотвращения умеренного снижения зрения вследствие отека желтого пятна, обусловленного диабетической ретинопатией (Akduman L, Olk RS. The early treatment diabetic retinopathy study. In: Kertes PS, Conway MD, eds. Clinical trials in ophthalmology: a summary and practice guide. Baltimore, MD: Lippincott Williams&Wilkins; 1998:15-35; Frank RN. Etiologic mechanisms in diabetic retinopathy. In: Ryan S, Schachat AP, eds. Retina. 3rd ed. St. Louis, МО: CV Mosby; 2001, v.2, section 2, chap. 71:1259-1294). Фотокоагуляция аргоновым лазером увеличивает вероятность улучшения зрения у пациентов с отеком желтого пятна, обусловленным закупоркой ответвлений кровеносных сосудов (ЗОКС) (Orth D. The branch vein occlusion study. In: Kertes P, Conway M, eds. Clinical trials in ophthalmology: a summary and practice guide. Baltimore, MD: Lippincott Williams&Wilkins; 1998:113-127; Fekrat S, Finkelstein D. The Central Vein Occlusion Study. In: Kertes PS, Conway MD, eds. Clinical trials in ophthalmology: a summury and practice guide. Baltimore, MD: Lippincott Williams&Wilkins; 1998:129-143), но не улучшает зрение у пациентов с отеком желтого пятна, обусловленным закупоркой центральной вены сетчатки (ЗЦВС) (Fekrat and Finkelstein 1998, выше; Clakson JG. Central retinal vein occlusion. In: Ryan S, Schachat AP, eds. Retina. 3rd ed. St. Louis, МО: CV Mosby; 2001, v.2, chap. 75:1368-1375). Эффективные способы лечения ЗЦВС в настоящее время не известны.
Можно использовать противовоспалительные агенты (т.е. иммунодепрессанты) для лечения патологических состояний глаза, таких как состояния, затрагивающие заднюю область глаза, которые включают воспалительные процессы, например увеит или отек желтого пятна. Так, для лечения увеита можно применять глюкокортикоиды местно или перорально. Основной проблемой местного или перорального введения лекарства является неспособность лекарства обеспечить соответствующую (т.е. терапевтической) концентрацию внутри глаза. См., например, Bloch-Michel E. (1992). Opening address: intermediate uveitis, In Intermediate Uveitis, Dev. Ophthalmol, W.R.F. Böke et al. editors., Basel: Karger, 23:1-2; Pinar, V., et al. (1997). Intraocular inflammation and uveitis" In Basic and Clinical Science Course. Section 9 (1997-1998) San Francisco: American Academy of Ophthalmolgy, pp. 57-80, 102-103, 152-156; Böke, W. (1992). Clinical picture of intermediate uveitis, In IntermediateUveitis, Dev. Ophthalmol. W.R.F. Böke et al. editors., Basel: Karger, 23:20-7; and Cheng C-K et al. (1995). Intravitreal sustained-release dextramethasone device in the treatment of experimental uveitis, Invest. Ophthalmol. Vis. Sci. 36:442-53.
Для лечения увеита может производиться системное введение глюкокортикоидов отдельно или в добавление к местному применению глюкокортикоидов. Однако продолжительное действие стероидов с высокой концентрацией в плазме (введение 1 мг/кг/день в течение 2-3 недель) часто является необходимым для того, чтобы достигнуть терапевтического уровня содержания лекарства в глазу.
К сожалению, эти уровни высокой концентрации лекарства в плазме часто приводят к системным побочным эффектам, таким как гипертензия, гипергликемия, повышенная восприимчивость к инфекциям, язвенная болезнь, психоз и другие осложнения. Cheng C-K et al. (1995). Intravitreal sustained-release dextramethasone device in the treatment of experimental uveitis, Invest. Ophthalmol. Vis. Sci. 36:442-53; Schwartz, B. (1966). The response of ocular pressure to corticosteroids, Ophthalmol. Clin. North Am. 6:929-89; Skalka, H.W. et al. (1980). Effect of corticosteroids on cataract formation, Arch Ophtalmol. 98:1773-7; and Renfro, L. et al. 91992). Ocular effects of topical and systemic steroids, Dermathologic Clinics 10:505-12.
Кроме того, доставка терапевтического количества активного агента в глаз может быть сложной задачей, а иногда и невозможной, для лекарств с коротким периодом полураспада в плазме, поскольку действие лекарства на внутриглазные ткани ограничено. Поэтому более эффективным путем доставки лекарства для лечения состояний, затрагивающих заднюю область глаза, является помещение лекарства прямо в глаз, например, непосредственно в стекловидное тело. Maurice, D.M. (19983). Micropharmaceutics of the eye, Ocular Inflammation Ther. 1:97-102; Lee, V.H.L et al. (1989). Dug delivery to the posterior segment" Chapter 25 In Retina. Т.Е. Ogden and A.P. Schachat eds., St. louis: CV Mosby, Vol.1, pp.483-98; and Olsen, T.W. et al. (1995). Human scleral permeability: effects of age, cryotherapy, transscleral diode laser, and surgical thinning, Invest. Ophthalmol. Vis. Sci. 36:1893-1903.
Такие способы, как инъекции лекарства в стекловидное тело, дают многообещающие результаты, но из-за короткого времени полураспада активных агентов, например глюкокортикоидов (около 3 часов), инъекции в стекловидное тело следует часто повторять для поддержания терапевтического уровня лекарства. В свою очередь, этот многократно повторяемый процесс увеличивает возможность возникновения побочных эффектов, таких как отслоение сетчатки, эндофтальмит и катаракта. Maurice, D. М. (1983). Micropharmaceutics of the eye, Ocular Inflammation Ther. 1:97-102; Olsen, T.W. et al. (1995). Human scleral permeability: effects of age, cryotherapy, transscleral diode laser, and surgical thinning, Invest. Ophthalmol. Vis. 36:1893-1903; and Kwak, H.W. and D'Amico, D.J. (1992). Evaluation of the retinal toxicity and pharmacokinetics of dexamethasone after intravitreal injection, Arch. Ophthalmol. 110:259-66.
Кроме того, лечение глюкокортикоидами местным, системным или периокулярным введением должно проводиться под тщательным наблюдением из-за токсичности и долговременных побочных эффектов, связанных с хроническими осложнениями вследствие системного действия лекарства. Rao, N.A. et al. (1997). Intraocular inflammation and uveitis, In Basic and Clinical Science Course. Section 9 (1997-1998) San Francisco: American Academy of Ophthalmology, pp.57-80, 102-103, 152-156; Schwartz, В. (1966). The response of ocular pressure to corticosteroids, Ophthalmol Clin North Am 6:929-89; Skalka, H.W. and Pichal, J.T. (1980). Effect of corticosteroids on cataract formation, Arch Ophthalmol 98:1773-7; Renfro, L. and Snow, J.S. (1992). Ocular effects of topical and systemic steroids, Dermatologic Clinics 10:505-12; Bodor, N et al. (1992). A comparison of intraocular pressure elevating activity of loteprednol etabonate and dexamethasone in rabbits, Current Eye Reserch 11:525-30.
В патенте США 6,217,895 рассматривается способ введения кортикостероидов в заднюю область глаза, но в нем не раскрыты биодеградируемые имплантаты.
В патенте США 5,501,856 раскрываются фармацевтические препараты с контролируемым высвобождением для внутриглазных имплантатов, применяемых во внутренней области глаза после хирургического вмешательства в случаях заболеваний сетчатки/стекловидного тела или в случае глаукомы.
В патенте США 5,869,079 раскрыта комбинация гидрофильных и гидрофобных элементов в биодеградируемом имплантате с продолжительным высвобождением, а также описан имплантат из сополимера молочной и гликолевой кислот (СМГК), содержащий дексаметазон. Как показало исследование кинетики высвобождения in vitro, описанный имплантат, содержащий 100-120 мкг 50:50 СМГК/дексаметазона, не показал значимого высвобождения лекарства до начала четвертой недели, и ситуация изменилась только лишь после добавления в состав агента, усиливающего высвобождение, такого как ГПМЦ (гидроксипропилметилцеллюлоза).
В патенте США 5,824,072 раскрыты имплантаты для введения в супрахориоидальную область глаза или бессосудистый участок глаза, а также описан имплантат из метилцеллюлозы (т.е. не являющийся биодеградируемым), содержащий дексаметазон. В WO 95/13765 раскрыты имплантаты, содержащие активные агенты, для введения в супрахориоидальную или бессосудистую область глаза в терапевтических целях.
В патенте США 4,997,652 и 5,164,188 раскрыты биодеградируемые глазные имплантаты, содержащие лекарство в микрокапсулах, а также описаны микрокапсулы для имплантации в заднюю область глаза, включающие сукцинат гидрокортизона.
В патенте США 5,164,188 раскрыты агенты в виде микрокапсул для введения в супрахориоидальную область глаза, а также описано размещение микрокапсул и дисков, содержащих гидрокортизон, в ресничный кружок. В патенте США 5,443,505 и 5,766,242 раскрыты имплантаты, содержащие активные агенты, для введения в супрахориоидальную или бессосудистую области глаза, а также описано размещение микрокапсул и дисков, содержащих гидрокортизон, в ресничный кружок.
Zhou с соавторами описали имплантат, содержащий несколько лекарств, включая 5-фторуридин, триамцинолон, а также рекомбинантный активатор плазминогена ткани человека, для внутриглазной терапии полиферативной витреоретинопатии (ПВР). Zhou Т., et al. (1998). Development of a multiple-drug delivery implant for intraocular management of proliferative vitreoretinopathy, Journal of Controlled Release 55:281-295.
В патенте США 6,046,187 рассматриваются способы и композиции для модулирования местного обезболивающего посредством введения одного или нескольких глюкокортикоидных агентов до, одновременно или после введения местного обезболивающего пациенту.
В патенте США 3,986,510 рассматриваются вкладыши для глаз, имеющие один или несколько внутренних резервуаров для лекарственной композиции, заключенных внутри биодеградируемого материала, контролирующего степень высвобождения лекарства, размера, подходящего для введения и удерживания этих вкладышей в «глазном мешочке», который определен как пространство, ограниченное поверхностью конъюнктивы склеры глазного яблока и соединительной оболочкой века, либо для размещения вкладышей над областью роговицы глаза.
В патенте США 6,369,116 рассматриваются имплантаты с модификатором высвобождения, введенные в склеральный лоскут.
В патенте ЕР 654256 рассматривается применение после хирургической операции на стекловидном теле тампонов для склеры для закупоривания надрезов.
В патенте США 4,863,457 рассматривается применение биодеградируемых имплантатов для предотвращения осложнений при фильтрационной хирургии глаукомы посредством размещения имплантата либо в подконъюнктивальной области между мембраной конъюнктивы, покрывающей конъюнктиву, и склерой, расположенной ниже, либо помещением имплантата непосредственно в склеру, в частично утолщенный склеральный лоскут.
В патенте ЕР 488401 рассматриваются внутриглазные имплантаты, изготовленные из определенного полимера молочной кислоты, для применения во внутренней части глаза после хирургического вмешательства в случаях заболеваний сетчатки/стекловидного тела или в случае глаукомы.
В патенте ЕР 430539 рассматривается применение биодеградируемых имплантатов, введенных в супрахориоидальную область.
В патенте США 6,726,918 рассматриваются имплантаты для лечения воспалений, обусловленных патологическими состояниями глаза.
Известно, что составы СМГК биодеградируемых полимеров, содержащих активный агент, обычно характеризуются сигмоидальной кривой высвобождения (которая изображается как зависимость процента высвобожденного активного агента от времени), то есть после относительно долгого начального периода задержки (первая фаза высвобождения), когда высвобождается совсем небольшое количество активного агента, далее следует значительный подъем кривой, когда высвобождается наибольшее количество активного агента (вторая фаза высвобождения), затем следует почти горизонтальный участок кривой (третья фаза высвобождения), когда высвобождение лекарства достигает плато.
Одной из альтернатив введения лекарств посредством инъекций в стекловидное тело является помещение биодеградируемых имплантатов под склерой или в подконъюнктивальное или супрахориоидальное пространство, как описано в патенте США 4,863,457 Lee; заявках WO 95/13765 Wong et al.,; WO 00/37056 Wong et al.; ЕР 430,539 Wong; Gould et al. Can. J. Ophthalmol., 29(4):168-171 (1994); а также Apel et al., Curr. Eye Res. 14:659-667 (1995).
Кроме того, контролируемое высвобождение лекарства из СМГК в стекловидное тело было раскрыто Ohtori et al. в патенте США 5,501,856, а также Ogura в патенте ЕР 654,256.
Последние научные исследования показали, что СМГК без концевых функциональных групп распадаются быстрее, чем с концевыми функциональными группами (Park et al. Control. Rel. 55:181-191 (1998); Tracy et al., Biomaterials 20:1057-1062 (1999); и Jong et al., Polymer 42:2795-2802 (2001). Таким образом, созданы имплантаты, содержащие смеси СМГК с концевыми функциональными группами и без таковых, для модулирования высвобождения лекарства. Например, в патенте США 6,217,911 Vaughn et al. ('911) и в патенте США 6,309,669 Setterstrom et al. ('699) раскрыта доставка лекарства из смеси СМГК с концевыми функциональными группами и без них, для сокращения начального внезапного высвобождения лекарств. В '911 патенте композицию для доставки нестероидных противовоспалительных лекарств из микросфер СМГК получают способом экстракции растворителем или способом упаривания растворителя в течение периода от 24 часов до 2 месяцев. В патенте '699 раскрыта композиция для доставки различных фармацевтических препаратов из СМГК микрокапсул в течение 1-100 дней. Микросферы или микрокапсулы из СМГК вводятся перорально или в виде водной инъекции. Как отмечено выше, пероральное введение обеспечивает недостаточное распределение лекарства в глазничной области. Кроме того, следует избегать применения водных лекарственных композиций для инъекций (для инъекций в глазничную область), поскольку глаз представляет собой закрытое пространство (ограниченный объем) с точно поддерживаемым диапазоном внутриглазного давления. Инъекционное введение может увеличить внутриглазной объем до предела, когда внутриглазное давление станет патологическим.
Сильные кортикостероиды, такие как дексаметазон, подавляют воспаление, тормозя отек, отложение фибрина, прорыв капилляров и фагоцитарную миграцию, все основные факторы реакции на воспаление. Кортикостероиды предотвращают высвобождение простагландинов, некоторые из них определены как медиаторы кистоидного отека желтого пятна (Leopold IH. Nonsteroidal and steroidal anti-inflammatory agents. In: Sears M, Tarkkanen A, eds. Surgical pharmacology of the eye. New York, NY: Raven Press; 1985:83-133; Tennant JL. Cystoid maculopathy: 125 prostaglandins in ophthalmology. In: Emery JM, ed. Current concepts in cataract surgery: selected proceedings of the fifth biennial cataract surgical congress, Section 3. St. Louis, МО: CV Mosby; 1978:360-362). Кроме того, было показано, что кортикостероиды, включая дексаметазон, ингибируют экспрессию васкулярного эндотелиального фактора роста (ВЭФР), цитокина, являющегося сильным стимулятор проницаемости сосудов (Nauck M, Karakiulakis G, Perruchoud АР, Papakonstantinou E, Roth M. Corticosteroids inhibit the expression of the vascular endothelial growth factor gene in human vascular smooth muscle cells. Eur J Pharmacol 1998; 341:309-315).
На настоящий момент применение дексаметазона доступными способами введения принесло лишь ограниченный успех в лечении заболеваний сетчатки, включая отек желтого пятна, большей частью вследствие невозможности доставить и поддержать соответствующее количество лекарства в заднюю область глаза, избегая при этом последствий, связанных с токсичностью. После местного введения дексаметазона только около 1% достигает передней области, и только некоторая часть этого количества попадает в заднюю область (Lee VHL, Pince KJ, Frambach DA, Martini B. Drug delivery to the posterior segment. In: Ogden ТЕ, Schachat AP, eds. Retina. St. Louis, МО: CV Mosby, 1989, chap 25:483-498). Хотя инъекции дексаметазона в стекловидное тело применяются, действие лекарства очень коротко, поскольку время полураспада лекарства внутри глаза составляет примерно 3 часа (Peyman GA, Herbst R. Bacterial endophthalmitis. Arch Ophthalmol 1974; 91:416-418). Инъекции дексаметазона в окологлазную область или заднюю область под тенонову оболочку также обладают очень непродолжительным лечебным эффектом (Riordan-Eva P, Lightman S. Orbital floor steroid injections in the treatment of uveitis. Eye 1994; 8 (Pt 1):66-69; Jennings T, Rusin M, Tessler H, Cunha-Vaz J. Posterior sub-Tenon's injections of corticosteroids in uveitits patients with cystoid macular edema. Jpn J Ophthalmol 1988:32:385-391).
Неблагоприятные эффекты, перечисленные для известных офтальмологических препаратов, содержащих дексаметазон, включают: повышенное глазное давление, глаукома, образование задней субкапсулярной катаракты, а также вторичные патогенные глазные инфекции, включая простой герпес (Lee et al. 1989 выше; Skalka HW, Prchal JT. Effect of corticosteroids on cataract formation. Arch Ophthalmol 1980; 98:1773-1777; Renfro L, SnowJS. Ocular effedts of topical and systemic steroids. Dermatol Clin 1992; 10(3):505-512; Physician's Desk Reference, 2003). Системное введение доз также связано с дополнительными опасными побочными эффектами, включая гипертензию, гипергликемии, повышенную восприимчивость к инфекциям, а также язвенную болезнь (Physician's Desk reference, 2003).
Доставляя лекарство непосредственно в полость стекловидного тела, можно избежать осложнений, связанных с гематоофтальмическим барьером, и достигнуть терапевтического уровня содержания лекарства с минимальным риском возникновения системной токсичности (Lee et al., 1989 выше). Такой путь введения обычно приводит к короткому периоду полураспада, за исключением случаев, когда лекарство можно доставить, используя состав, способный обеспечить продолжительное высвобождение.
В результате, биодеградируемые имплантаты для доставки терапевтического агента в глазничную область могут обеспечить существенную медицинскую пользу для пациентов, страдающих от различных заболеваний глаз.
Графические материалы
Фиг.1 показывает концентрацию дексаметазона in vivo в стекловидном теле глаза кролика в течение 42-дневного периода после имплантации в заднюю область глаза кролика спрессованных и экструдированных биодеградируемых имплантатов, содержащих 350 мкг дексаметазона.
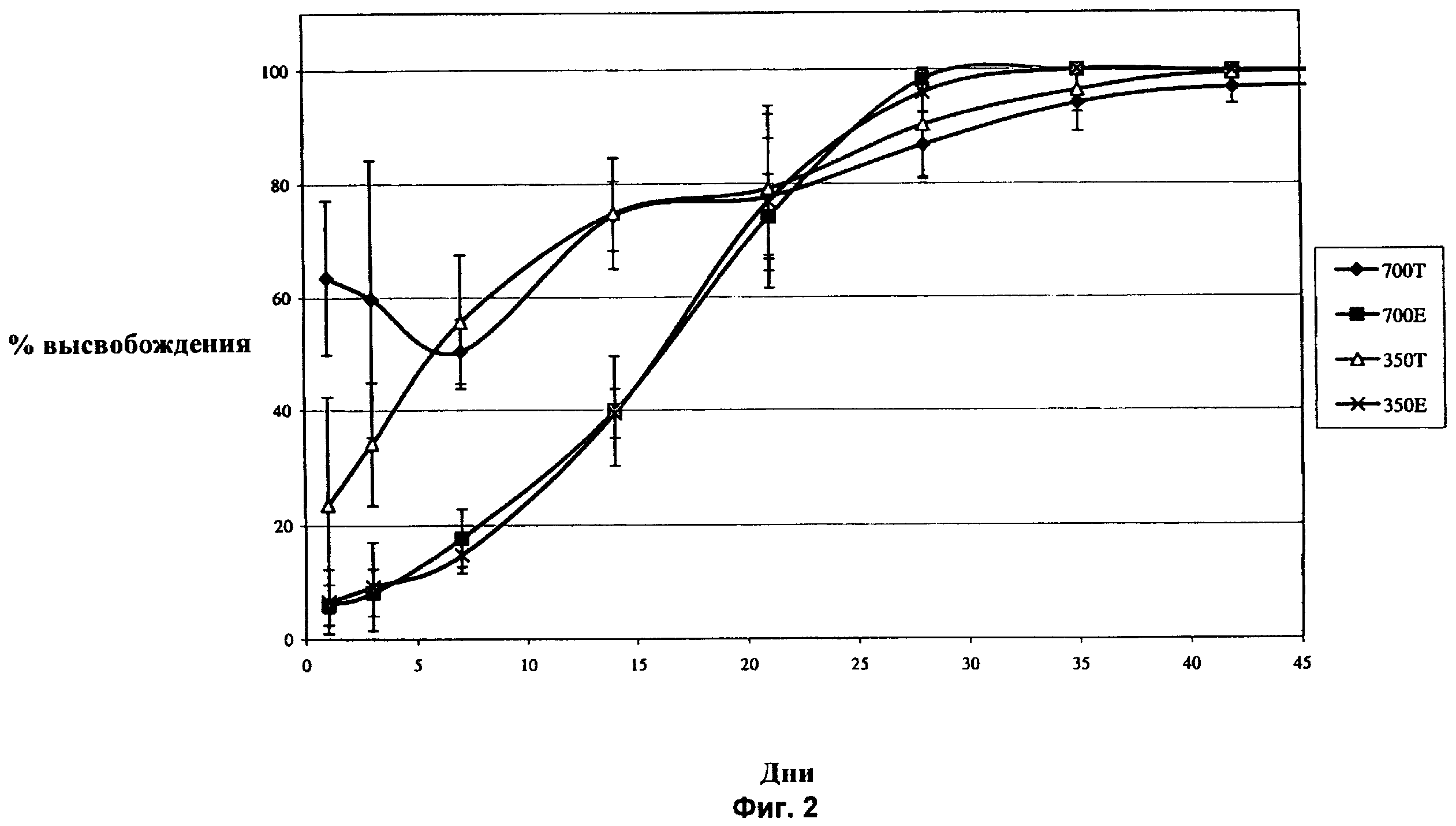
Фиг.2 показывает суммарное процентное высвобождение дексаметазона in vivo в стекловидном теле глаза кролика в течение 42-дневного периода после имплантации в заднюю область глаза спрессованных и экструдированных биодеградируемых имплантатов, содержащих 350 мкг дексаметазона и 700 мкг дексаметазона.
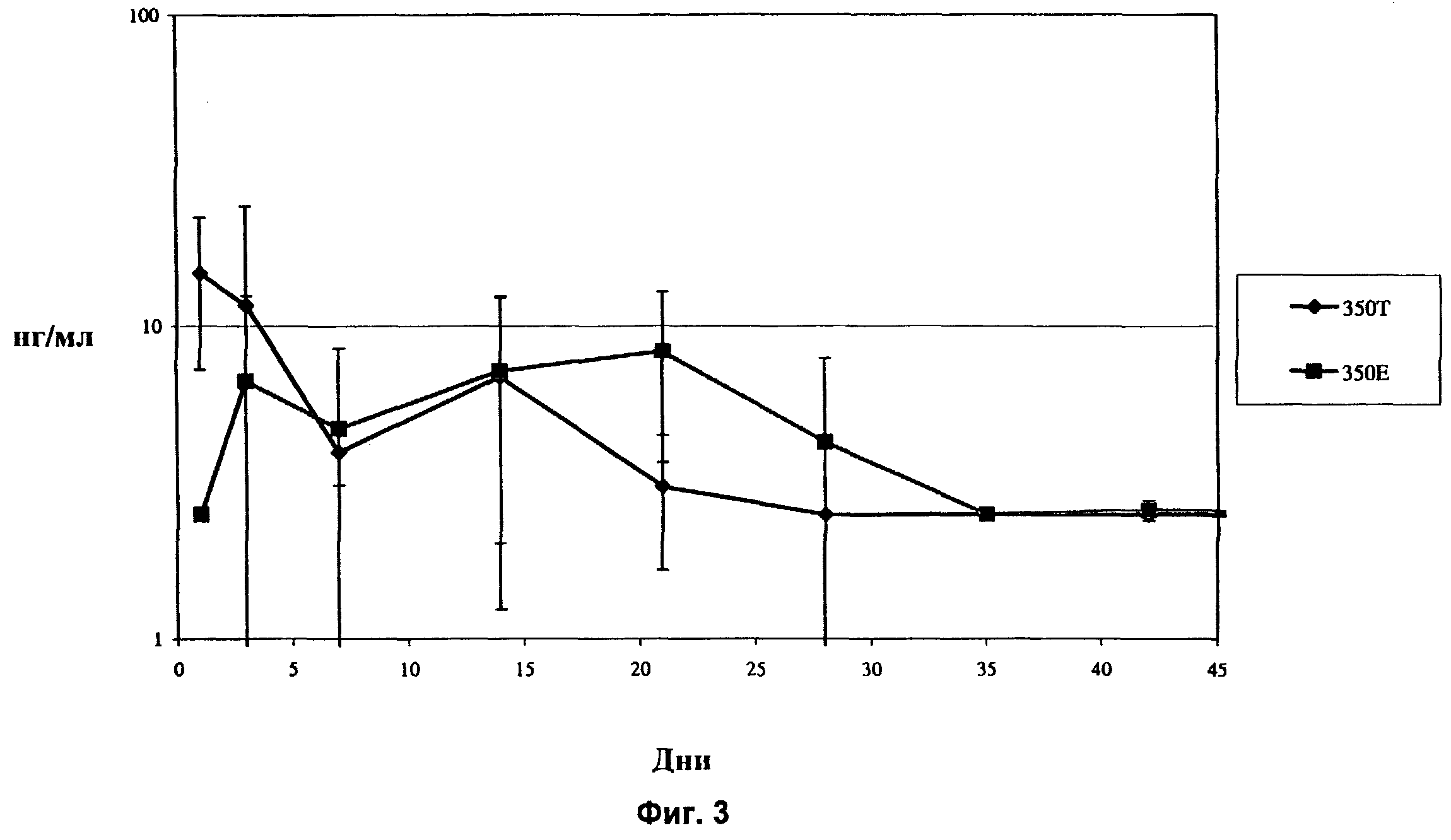
Фиг.3 показывает концентрацию дексаметазона в водянистой жидкости глаза кролика in vivo в течение 42-дневного периода после имплантации в заднюю область глаза кролика спрессованных и экструдированных биодеградируемых имплантатов, содержащих 350 мкг дексаметазона.
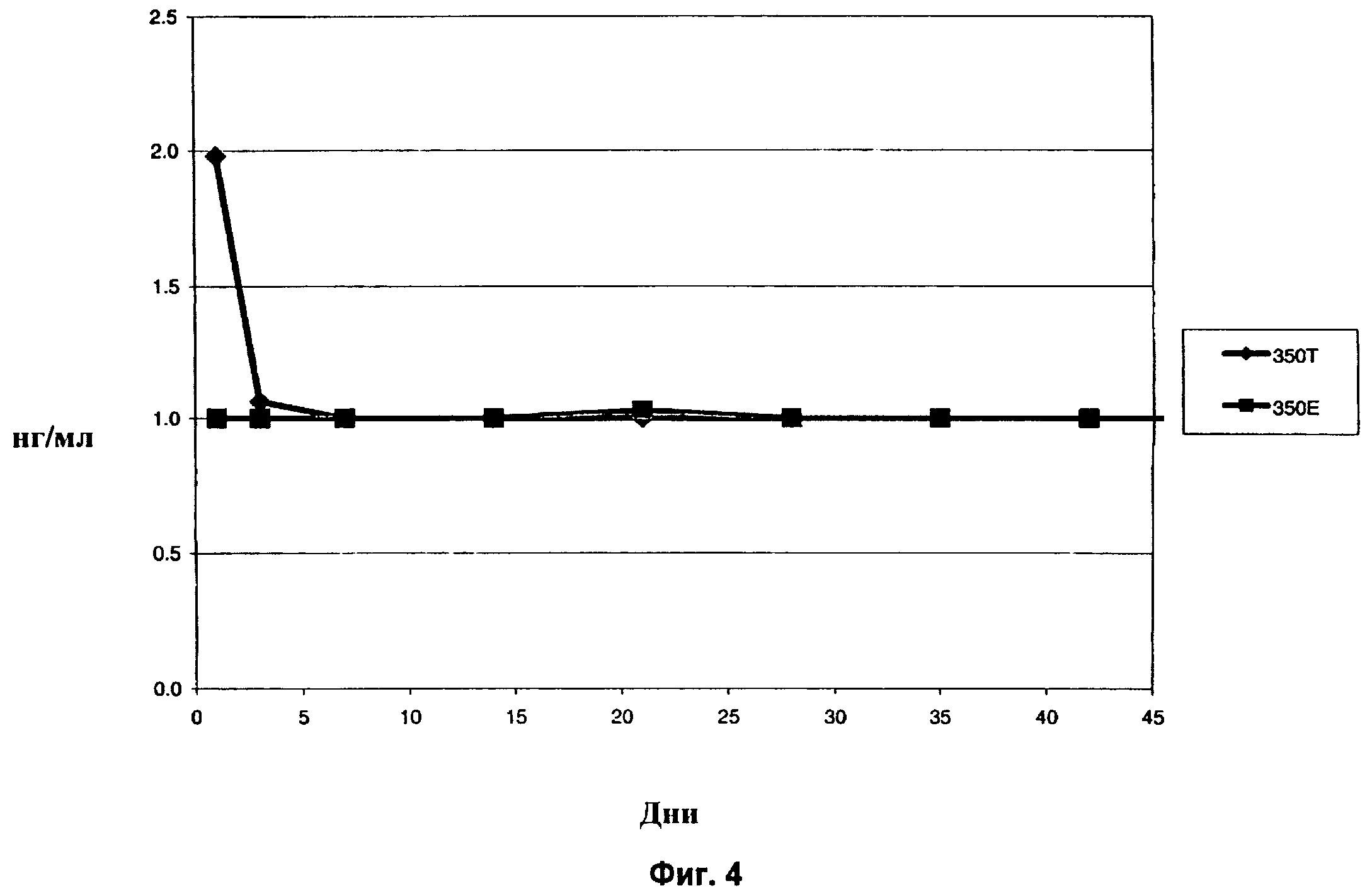
Фиг.4 показывает концентрацию дексаметазона в плазме (из образца крови кролика) in vivo в течение 42-дневного периода после имплантации в заднюю область глаза кролика спрессованных и экструдированных биодеградируемых имплантатов, содержащих 350 мкг дексаметазона.
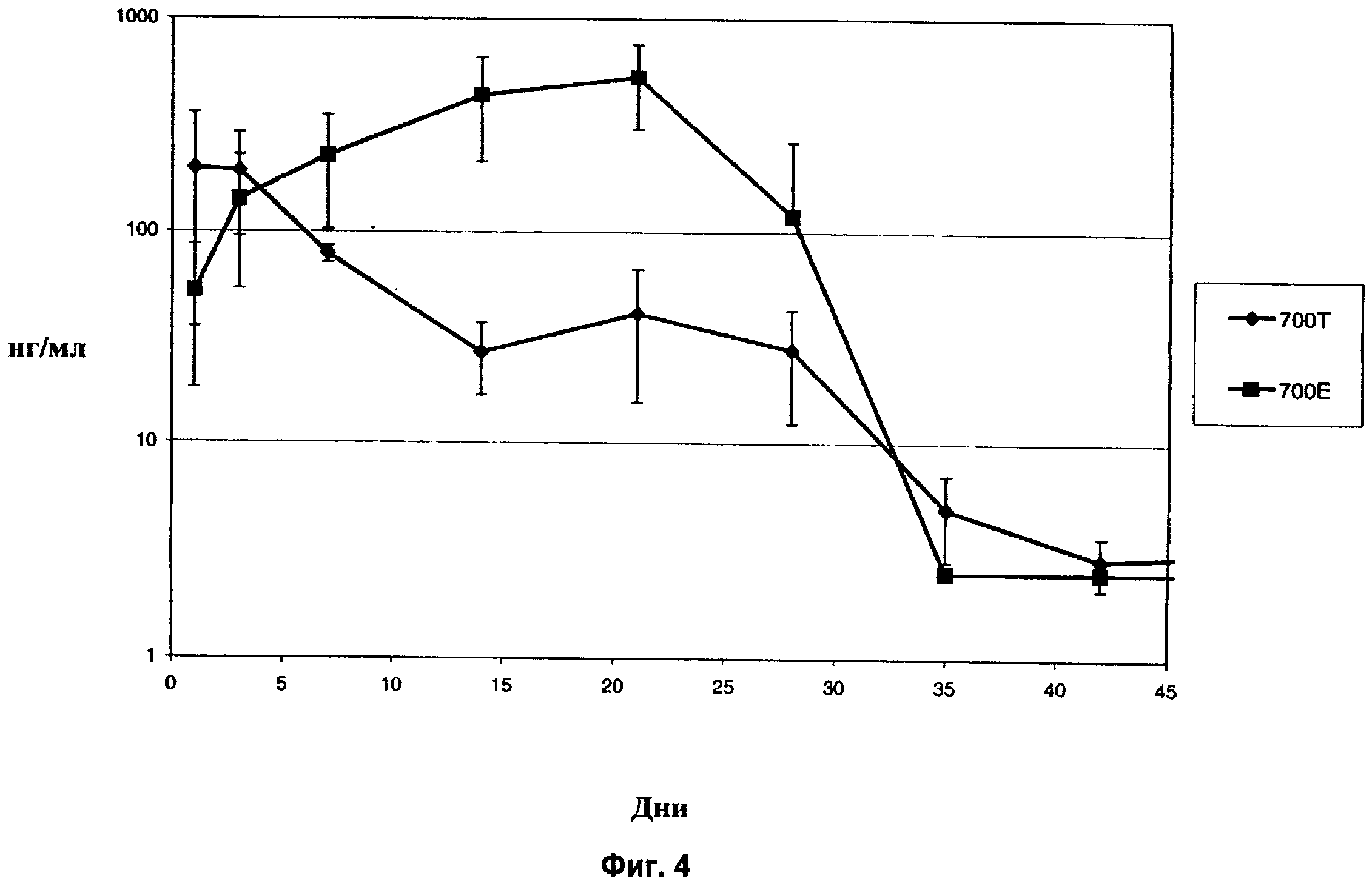
Фиг.5 показывает концентрацию дексаметазона в стекловидном теле глаза кролика in vivo в течение 42-дневного периода после имплантации в заднюю область глаза спрессованных и экструдированных биодеградируемых имплантатов, содержащих 700 мкг дексаметазона.
Фиг.6 показывает концентрацию дексаметазона в водянистой влаге глаза кролика in vivo в течение 42-дневного периода после имплантации в заднюю область глаза спрессованных и экструдированных биодеградируемых имплантатов, содержащих 700 мкг дексаметазона.
Фиг.7 показывает концентрацию дексаметазона в плазме (из образца крови кролика) in vivo в течение 42-дневного периода после имплантации в заднюю область глаза кролика спрессованных и экструдированных биодеградируемых имплантатов, содержащих 700 мкг дексаметазона.
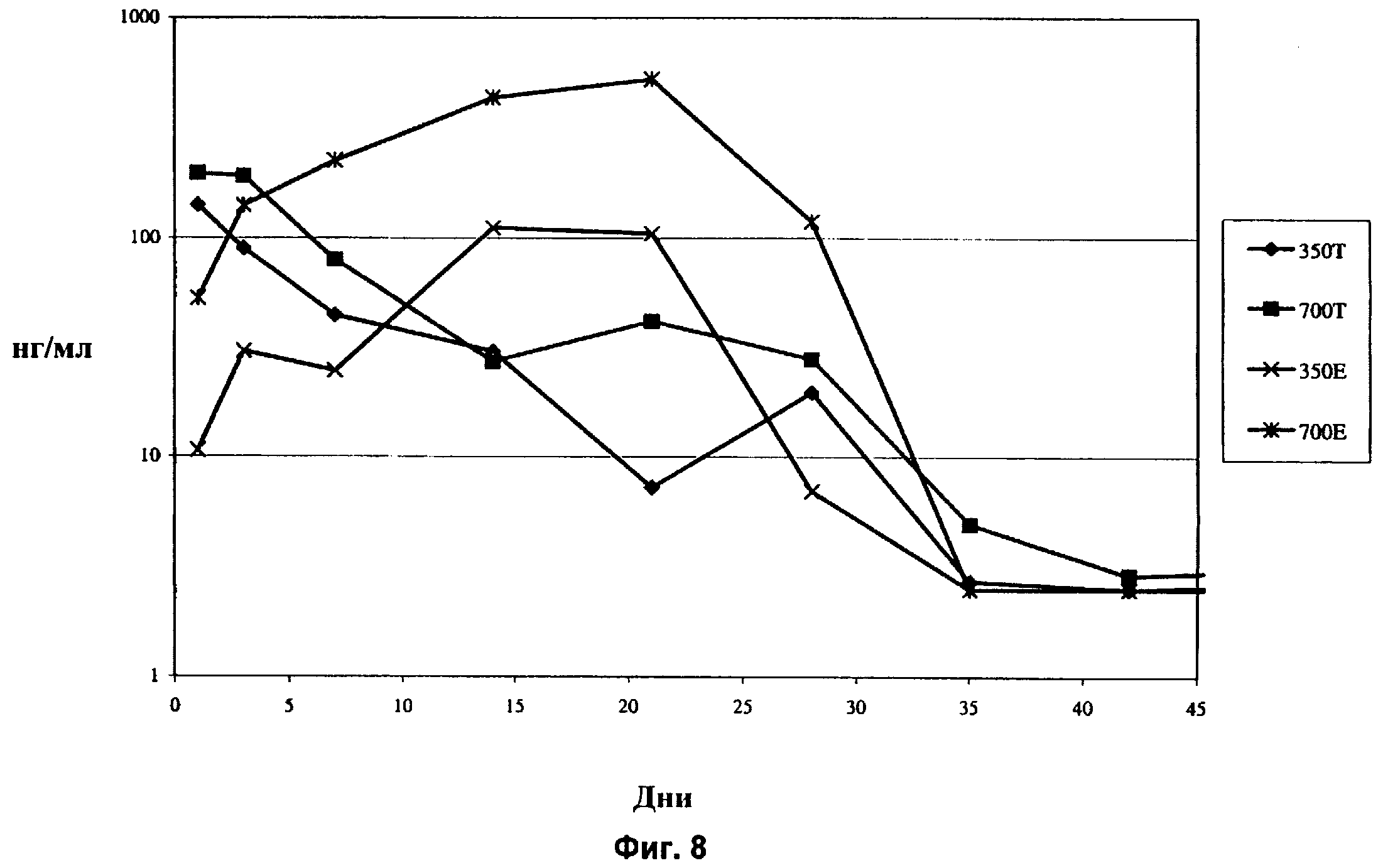
Фиг.8 показывает концентрацию дексаметазона в стекловидном теле глаза кролика in vivo в течение 42-дневного периода после имплантации в заднюю область глаза спрессованных и экструдированных биодеградируемых имплантатов, содержащих 350 мкг дексаметазона и 700 мкг дексаметазона.
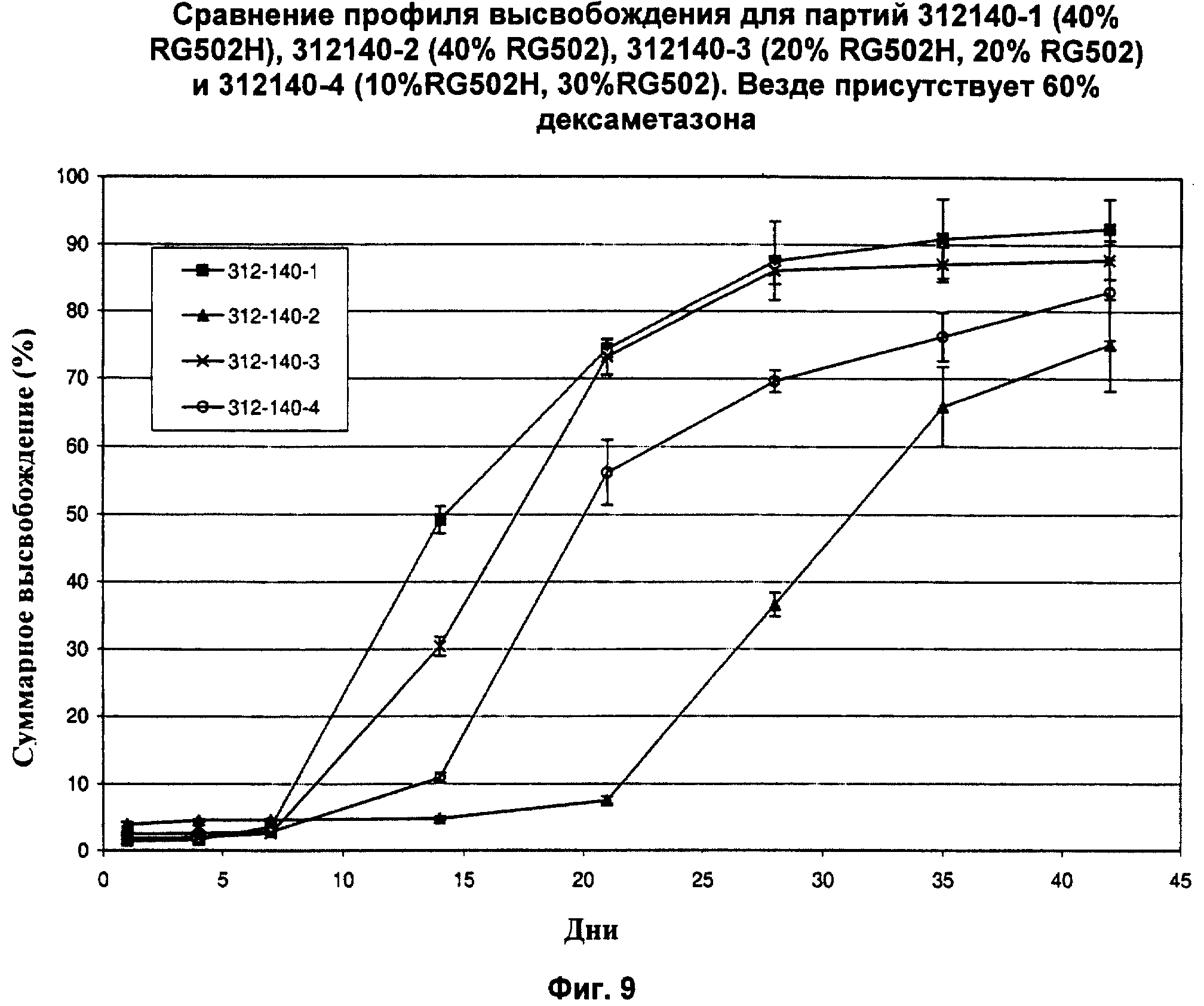
Фиг.9 показывает суммарное процентное высвобождение дексаметазона in vitro в физиологическом растворе при температуре 37°С из имплантатов, имеющих массовое соотношение дексаметазона и СМГК 60:40, с массовым соотношением СМГК с гидрофобными концами и гидрофильными концами 40:0 (312-140-2), с массовым соотношением СМГК с гидрофобными концами и гидрофильными концами 30:10 (312-140-4), с массовым соотношением СМГК с гидрофобными концами и гидрофильными концами 20:20 (312-140-3) и с массовым соотношением СМГК с гидрофобными концами и гидрофильными концами 0:40 (312-140-1).
На Фиг.10 приведено сравнение суммарного процентного высвобождения дексаметазона in vitro в физиологическом растворе при температуре 37°С для шести партий спрессованных имплантатов, содержащих около 60 мас.% дексаметазона, 30 мас.% СМГК с гидрофильными концами и 10 мас.% СМГК с гидрофобными концами.
Фиг.11 представляет собой технологическую схему, иллюстрирующую способ производства таблеток, способы однократный и двойной экструзии для производства глазных имплантатов, без ограничения объема изобретения.
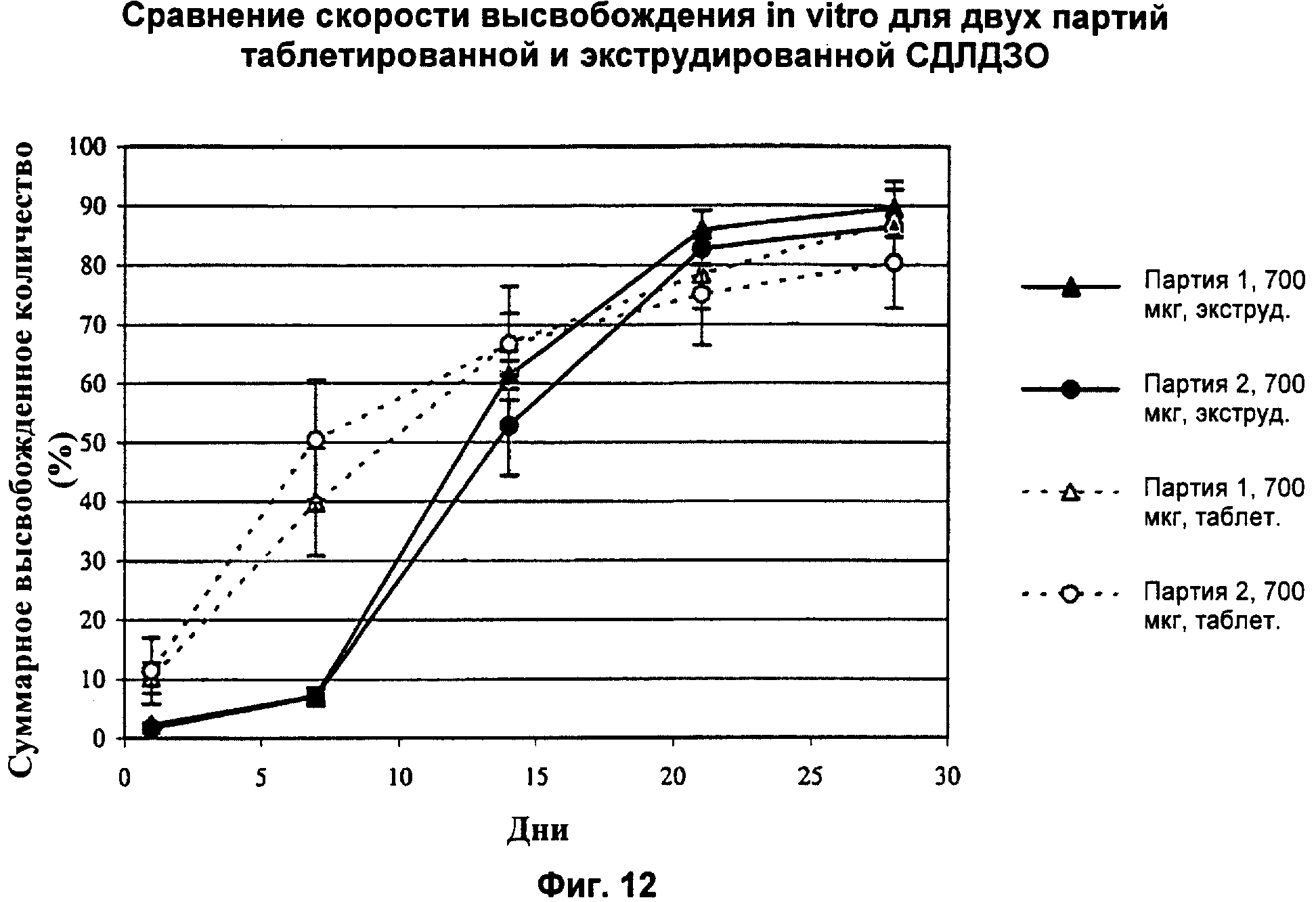
Фиг.12 представляет собой график, показывающий суммарное количество дексаметазона, высвобожденного in vitro в течение некоторого времени из глазных имплантатов, произведенных способом либо таблетирования, либо однократной экструзии.
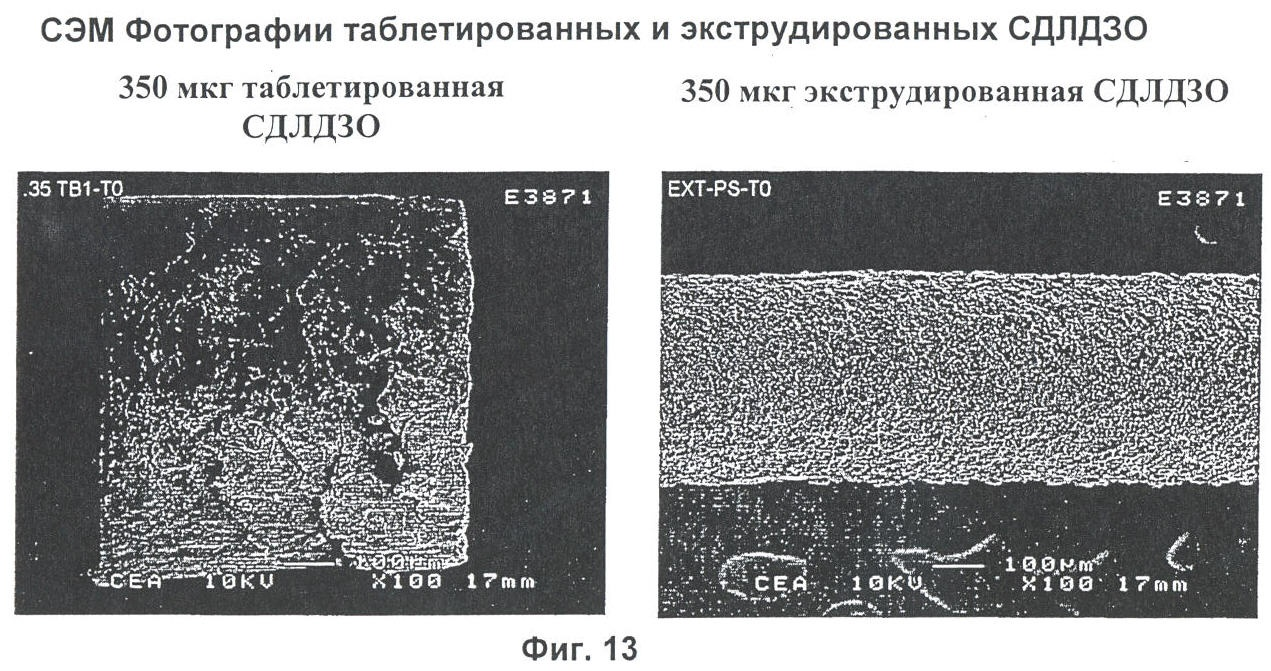
Фиг.13 представляет собой фотографии сканирующей электронной микроскопии СДЛДЗО имплантатов, изготовленных способом таблетирования и способом однократной экструзией.
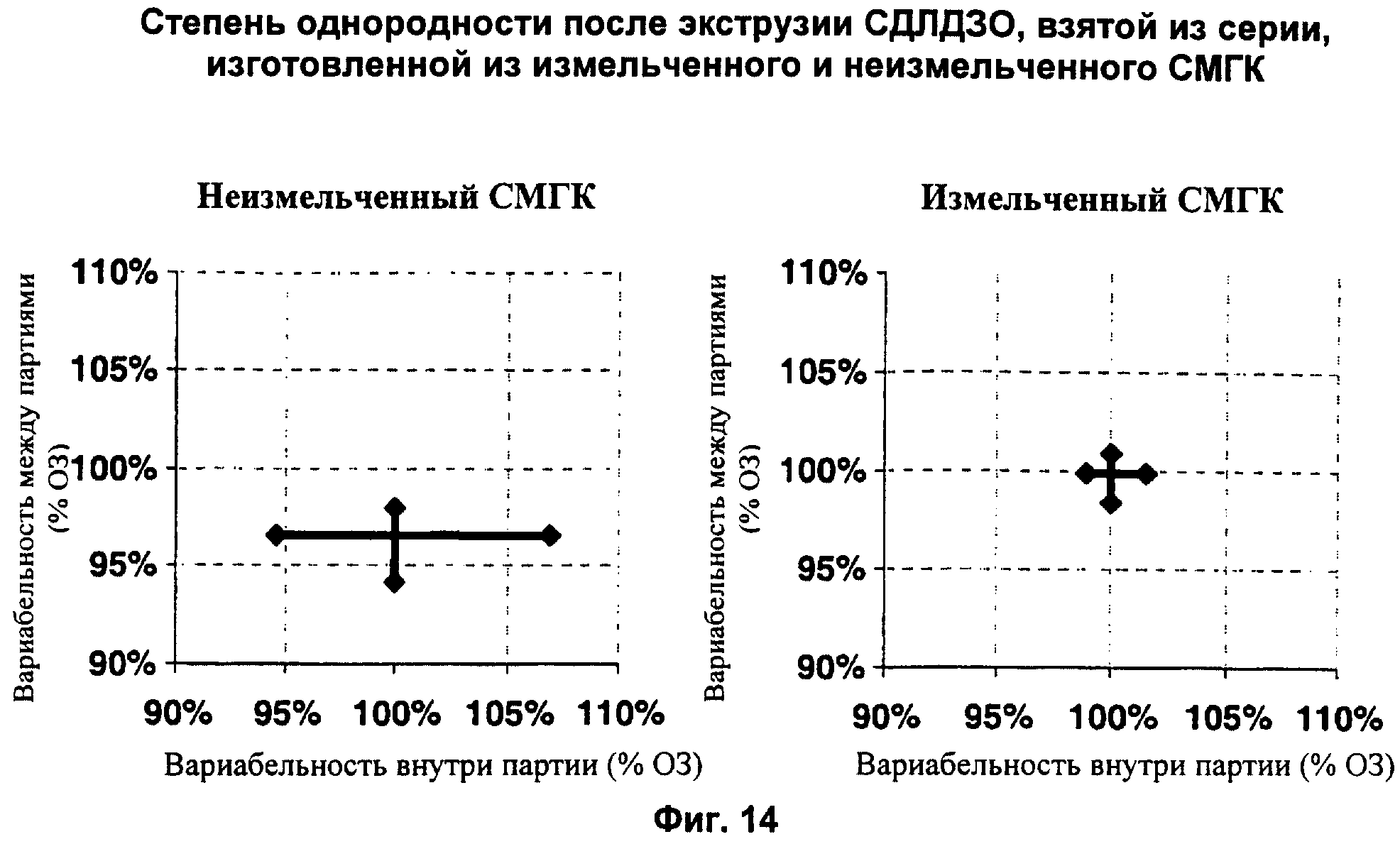
Фиг.14 демонстрирует два графика, сравнивающие варьирование %ОЗ (-% общего дексаметазона) от партии к партии и в пределах одной партии имплантатов, изготовленных как из неизмельченных, так и из измельченных СМГК.
Фиг.15 представляет собой график, показывающий высвобождение in vitro дексаметазона из СДЛДЗО имплантатов, изготовленных как способом однократной, так и способом двойной экструзии.
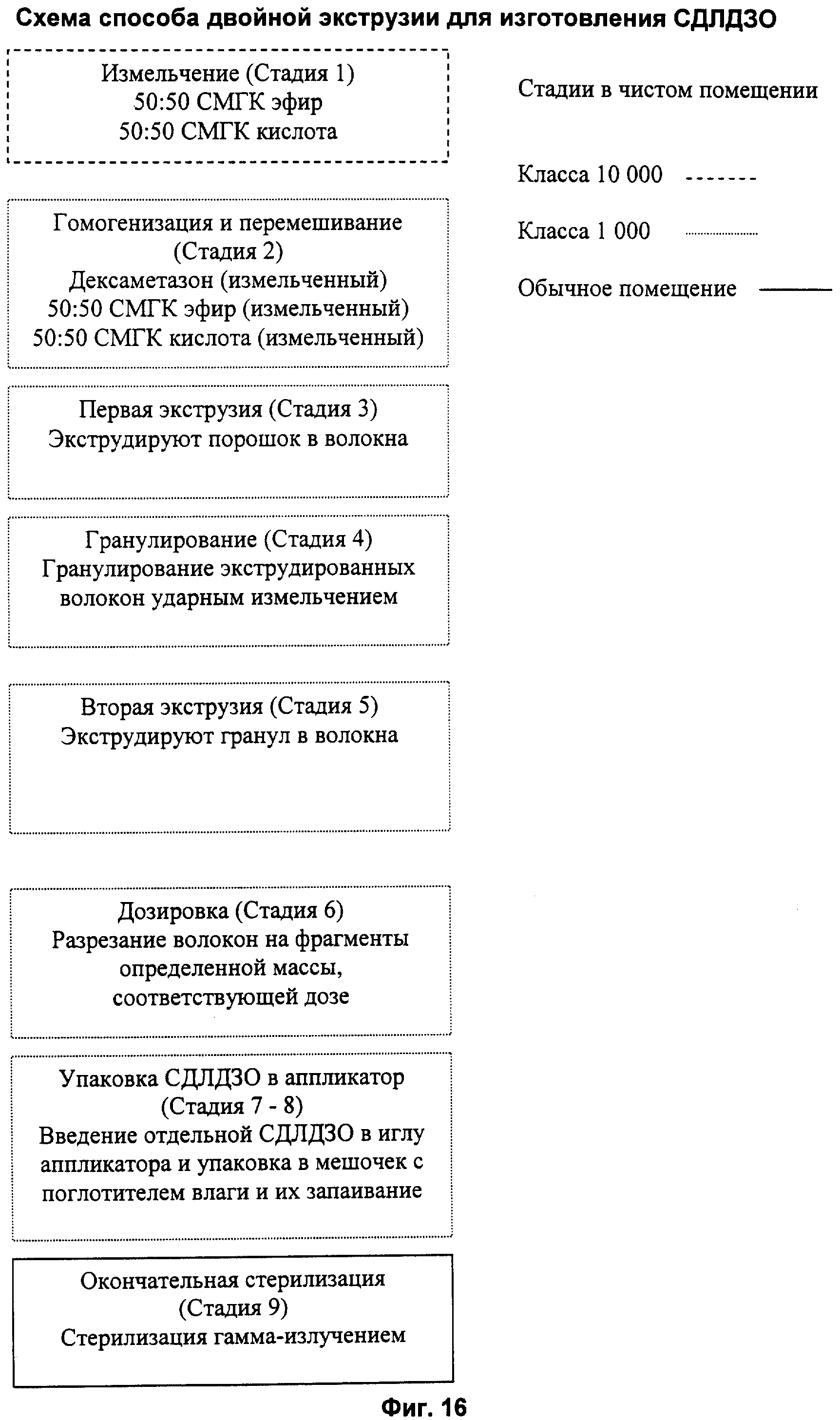
Фиг.16 представляет собой технологическую схему, иллюстрирующую производство глазных имплантатов способом двойной экструзии, без ограничения объема настоящего изобретения.
Фиг.17 вид в боковом срезе аппликатора для имплантации глазного имплантата, без ограничения объема настоящего изобретения.
Краткое изложение сущности изобретения
Определения
Следующие термины, использующиеся в тексте настоящей заявки, имеют следующие значения:
«Примерно» означает примерно или почти и в контексте числовых значений или диапазонов, приведенных здесь, означает ±10% от числового значения или диапазона, перечисленного либо заявленного.
«Активный агент» и «лекарство» используются здесь взаимозаменяемо и означают любую субстанцию, применяемую для лечения патологических состояний глаз.
«Биодеградируемый полимер» означает полимер, деградирующий in vivo, и деградация полимера со временем является необходимым условием для достижения кинетики высвобождения активного агента по настоящему изобретению. Так, гидрогели, такие как метилцеллюлоза, в которых лекарство высвобождается посредством набухания полимера, особенно исключаются из термина «биодеградируемый (биоразлагающийся) полимер». Слова «биодеградируемый» и «биоразлагающийся» являются синонимичными и используются здесь взаимозаменяемо.
«Концентрационный эквивалент дексаметазона» или «эквивалент дексаметазона» означает концентрацию активного агента, такого как стероидный противовоспалительный агент, необходимую для достижения примерно такой же эффективности in vivo, какую обеспечивает индивидуальная доза дексаметазона. Например, гидрокортизон примерно в двадцать пять раз менее эффективный по сравнению с дексаметазоном, и поэтому доза 25 мг гидрокортизона будет эквивалентна дозе 1 мг дексаметазона. Специалисты в данной области могут определить концентрационный эквивалент дексаметазона для индивидуального стероидного противовоспалительного агента с помощью нескольких стандартных тестов, известных из уровня техники. Относительную эффективность некоторых кортикостреоидов можно обнаружить, например, у Gilman A.G. et al., eds. (1990). Goodman and Gilman's: The Pharmacological Basis of Therapeutics. 8th Edition, Pergamon Press: New York, p.1447.
«Суммарный профиль высвобождения» означает суммарный общий процент активного агента, высвобожденного имплантатом в область или часть глаза in vivo или в специфичную среду для высвобождения in vitro в течение некоторого времени.
«Глаукома» означает первичную, вторичную и/или наследственную глаукому. Первичная глаукома может включать открытоугольную или закрытоугольную глаукому. Вторичная глаукома может возникать как следствие различных состояний, таких как травмы, воспаления, сосудистые заболевания и диабет.
«Опосредованное воспалением» в отношении патологических состояний глаз означает любое состояние глаза, которое может возникнуть вследствие лечения противовоспалительным агентом, включая увеит, отек желтого пятна, острую дегенерацию желтого пятна, отслоение сетчатки, глазные опухоли, грибковые или вирусные инфекции, многоочаговый хориоидит, диабетический увеит, пролиферативную витреоретинопатию (ПВР), симпатическую офтальмию, синдром Фогта-Койанаги-Харада (ФКХ), гистоплазмоз и увеальную диффузию, но не ограничиваясь ими.
«Травма» или «повреждение» являются взаимозаменяемыми и относятся к клеточным и морфологическим проявлениям и симптомам, возникающим в результате состояний, опосредованных воспалительными процессами, такими как воспаление.
«Измерение при бесконечно убывающих условиях in vitro» означает анализы по измерению высвобождения лекарства in vitro, когда эксперимент выполняют таким образом, что концентрация лекарства в рецепторной среде никогда не превышает 5% от насыщения. Примеры подходящих анализов можно найти, например, в USP 23; NF 18 (1995) pp.1790-1798.
«Состояние глаза» означает заболевание, недомогание или состояние, поражающее или затрагивающее глаз либо одну из частей или областей глаза, например болезнь сетчатки. Глаз включает глазное яблоко, ткани и жидкости, содержащиеся в глазном яблоке, окологлазные мышцы (например, косая и прямая мышцы), а также участок зрительного нерва, находящийся или примыкающий к глазному яблоку. «Состояние глаза» является синонимичным понятию «патологическое состояние глаза».
«Множество» означает два или больше.
«Состояние, затрагивающее заднюю область глаза» означает болезнь, недомогание или состояние, поражающее или затрагивающее заднюю область глаза или ее участок, такую как сосудистая оболочка или склера (в заднем положении по отношению к проекции через заднюю стенку оболочки хрусталика), стекловидное тело, камеру стекловидного тела, сетчатку, зрительный нерв (т.е. диск зрительного нерва), а также кровеносные сосуды и нервы, которые васкуляризуют или иннервируют заднюю область глаза либо ее участок.
«Стероидный противовоспалительный агент» и «глюкокортикоид» являются здесь взаимозаменяемыми и означают стероидные агенты, соединения или лекарства, снижающие воспаление, при введении с терапевтически эффективным уровнем.
«По существу» в отношении профиля высвобождения или характеристик высвобождения активного агента из биодеградируемого имплантата, как, например, в выражении «по существу в продолжительном темпе» о скорости высвобождения активного агента из имплантата, означает, что скорость высвобождения (т.е. количество высвобожденного активного агента в единицу времени) не изменяется более чем 100% и предпочтительно, не изменяется более чем на 50% в течение выбранного промежутка времени (т.е. нескольких дней). «По существу» в отношении гомогенизации, смешивания или диспергирования активного агента в полимере, например, в выражении «по существу гомогенно диспергированный» означает отсутствие или почти полное отсутствие частиц (т.е. скоплений) активного агента в подобном гомогенном распределении.
«Подходящий для введения (или имплантации) в глазничную область или участок» по отношению к имплантату означает, что имплантат имеет размер (габариты), позволяющие его вводить или имплантировать без чрезмерного повреждения тканей и без создания чрезмерных помех имеющемуся зрению пациента, которому был введен или имплантирован имплантат.
«Терапевтический уровень» или «терапевтическое количество» означает количество или концентрацию активного агента, которое следует местно доставить в глазничную область, безопасное для лечения состояний глаза, предназначенное для уменьшения или предотвращения возникновения симптомов глазных состояний.
Значения аббревиатур, используемых в тексте настоящей заявки, поясняются ниже:
Настоящее изобретение охватывает биодеградируемые имплантаты для лечения патологических состояний глаза, содержащие активный агент, диспергированный в полимерной биодеградируемой матрице, где примерно 75% частиц активного агента имеют диаметр менее примерно 10 мкм. Предпочтительно, чтобы, по меньшей мере, примерно 99% частиц имели диаметр менее примерно 20 мкм.
Активный агент может быть выбран из группы, состоящей из ингибиторов АПФ (ангиотензин-превращающий фермент), эндогенных цитокинов, агентов, действующих на базальную мембрану, агентов, действующих на рост клеток эндотелия, адренергических агонистов или блокаторов, холинергических агонистов или блокаторов, ингибиторов альдозоредуктазы, анальгетиков, анестетиков, противоаллергических агентов, противовоспалительных агентов, стероидов (например, стероидный противовоспалительный агент), противогипертонических, сосудосуживающих, антибактериальных, противовирусных, противогрибковых, противопротозойных, противоинфекционных, противоопухолевых агентов, антиметаболитов и антиангиогенных агентов. Так, активным агентом может быть кортизон, дексаметазон, флуоцинолон, гидрокортизон, метилпреднизолон, преднизолон, преднизон, триамцинолон, а также их любые производные.
Размер биодеградируемых имплантатов должен позволять имплантировать их в глазничную область глаза. Глазничной областью могут являться одно или несколько из перечисленных: передняя камера, задняя камера, полость стекловидного тела, сосудистые оболочки, супрахориоидальное пространство, конъюнктива, подконъюнктивное пространство, надсклеральное (теноново) пространство, внутрироговичное пространство, надроговичное пространство, склера, ресничный кружок, бессосудистые области, созданные хирургическим путем, желтое пятно и сетчатка.
Альтернативное воплощение биодеградируемого имплантата может содержать стероидный активный агент, диспергированный внутри полимерной биодеградируемой матрицы, где, по меньшей мере, примерно 75% частиц активного агента имеют диаметр менее примерно 20 мкм.
Настоящее изобретение также включает способ изготовления биодеградируемых имплантатов для лечения патологический состояний глаз, способ включает многократную экструзию биодеградируемого полимера. Этот способ может также включать стадии размельчения биодеградируемого полимера перед процессом экструзии. Биодеградируемым полимером может являться сополимер поли(молочная-со-гликолевая) кислота (СМГК). Соотношение мономеров молочной и гликолевой кислот в сополимере может составлять примерно 50:50 мас.%.
Кроме того, СМГК может составлять примерно 20-90 мас.% от общей массы биодеградируемого имплантата. Альтернативно, СМГК может составлять около 40 мас.% от массы биодеградируемого имплантата.
Подробный способ изготовления биодеградируемых имплантатов для лечения патологических состояний глаз может включать следующие этапы: (а) размельчение биодеградируемого полимера; (б) смешивание размельченного полимера и частиц активного агента для получения смешанного состава размельченного полимера и частиц активного агента, где, по меньшей мере, примерно 75% частиц активного агента имеют диаметр менее примерно 20 мкм; (в) проведение первого процесса экструзии смешанной смеси для получения продукта первой экструзии; (г) гранулирование продукта первой экструзии; (д) выполнение второго процесса экструзии гранулированного продукта после первой экструзии, с получением биодеградируемого имплантата для лечения патологических состояний глаз. Настоящее изобретение также относится к биодеградируемым имплантатам для лечения патологических состояний глаз, полученным данным подробным способом.
Описание изобретения
Настоящее изобретение представляет собой биодеградируемые глазные имплантаты и способы для лечения патологических состояний глаз. Как правило, имплантаты изготовляются монолитными, т.е. частицы активного агента распределены по всему объему биодеградируемой полимерной матрицы. Более того, имплантаты изготовляются для высвобождения активного агента в глазничную область в течение разных промежутков времени. Активный агент может высвобождаться в течение периода времени, включая, но не ограничиваясь ими, приблизительно шесть месяцев, приблизительно три месяца, приблизительно один месяц, или меньше чем в течение одного месяца.
Биодеградируемые имплантаты для лечения медицинских состояний глаз
Имплантаты по изобретению содержат активный агент, диспергированный в биодеградируемом полимере. Композиции имплантата обычно варьируют в зависимости от предпочитаемого профиля высвобождения лекарства, особенностей применяемого активного агента, состояния, которое лечат, а также истории болезни пациента. Можно применять следующие активные агенты: ингибиторы АПФ, эндогенные цитокины, агенты, действующие на базальную мембрану, агенты, влияющие на рост клеток эндотелия, адренергические агонисты или блокаторы, холинергические агонисты или блокаторы, ингибиторы альдозоредуктазы, анальгетики, анестетики, противоаллергические агенты, противовоспалительные агенты, противогипертонические, сосудосуживающие, антибактериальные, противовирусные, противогрибковые, противопротозойные, противоинфекционные, противоопухолевые агенты, антиметаболиты и антиангиогенные агенты, но не ограничиваясь ими.
Одним из вариантов активный агент представляет собой метотрексат. Другим вариантом является ретиноевая кислота. В предпочтительном воплощении противовоспалительным агентом является нестероидный противовоспалительный агент. Нестероидные противовоспалительные агенты могут включать аспирин, диклофенак, флубипрофен, ибупрофен, кеторолак, напроксен и супрофен, но не ограничиваясь ими. В наиболее предпочтительном воплощении противовоспалительным агентом является стероидный противовоспалительный агент.
Стероидные противовоспалительные агенты
Стероидные противовоспалительные агенты, которые могут применяться в глазных имплантатах, включают 21-ацетоксипрегненолон, алкпометазон, алгестон, амцинонид, беклометазон, бетаметазон, будезонид, хлорпреднизон, клобетазол, клобетазон, клокортозон, клопреднол, кортикостерон, кортизон, кортивазол, дефлазакорт, дезонид, дезоксиметазон, дексаметазон, дифлоразон, дифлукортолон, дифлупреднат, эноксолон, флуазакорт, флуклоронид, флуметазон, флунизолид, ацетонид флуоцинолона, флуцинонид, флукортин бутил, флукортолон, фторметолон, флуперолон ацетат, флупредниден ацетат, флупреднизолон, флурандренолид, флутиказон пропионат, формокортал, галцинонид, галобетазол пропионат, галометазон, галопредон ацетат, гидрокортамат, гидрокортизон, лотепреднол этабонат, мазипреднол, медризон, мепреднизон, метилпреднизолон, мометазон фуроат, параметазон, предникарбат, преднизолон, преднизолон 25-диэтиламиноацетат, преднизолон фосфат натрия, преднизон, преднивал, преднилиден, римексолон, тиксокортол, триамцинолон, триамцинолон ацетонид, триамцинолон бенетонид, триамцинолон гексацетонид, а также любые их производные, но не ограничиваясь ими.
В одном из воплощений кортикозон, дексаметазон, флуоцинолон, гидрокортизон, метилпреднизолон, преднизолон, преднизон и триамцинолон, а также их производные являются предпочтительными стероидными противовоспалительными агентами. В другом предпочтительном воплощении стероидным противовоспалительным агентом является дексаметазон. В другом предпочтительном воплощении биодеградируемый имплантат содержит комбинацию двух или нескольких стероидных противовоспалительных агентов.
Стероидный противовоспалительный агент может составлять примерно от примерно 10 до примерно 90 мас.% от массы имплантата. В одном из воплощений агент составляет от примерно 40 до примерно 80 мас.% от массы имплантата. В предпочтительном воплощении агент составляет примерно 60 мас.% от веса имплантата.
Биодеградируемая полимерная матрица
В одном из воплощений активный агент может быть гомогенно диспергированным в биодеградируемой полимерной матрице имплантатов. Выбор применяемой биодеградируемой полимерной матрицы зависит от желаемой кинетики высвобождения, выносливости пациента, природы заболевания, подлежащего лечению, и т.п. Характеристики полимера, которые следует принимать во внимание, включают, но не ограничивают:
биосовместимость и биодеградируемость в месте имплантации, совместимость с рассматриваемым активным агентом, а также температура обработки. Биодеградируемая полимерная матрица обычно составляет примерно 10, по меньшей мере примерно 20, по меньшей мере примерно 30, по меньшей мере примерно 40, по меньшей мере примерно 50, по меньшей мере примерно 60, по меньшей мере примерно 70, по меньшей мере примерно 80, либо по меньшей мере примерно 90 мас.% от массы имплантата. В одном из воплощений биодеградируемая полимерная матрица составляет около 40 мас.% от массы имплантата.
Биодеградируемые полимерные матрицы, которые можно применять, включают, но не ограничивают, полимеры, состоящие из мономеров, таких как органические сложные или простые эфиры, которые при разложении в физиологической среде дают допустимые продукты разложения. Также могут применяться ангидриды, амиды, ортоэфиры или подобные соединения как таковые, либо в комбинации с другими мономерами. Полимеры, как правило, являются конденсационными полимерами. Полимеры могут быть сшитыми, либо несшитыми. Сшитые полимеры должны быть сшиты не более чем на 5%, обычно менее чем на 1%.
В основном, помимо углерода и водорода, полимеры могут включать кислород и азот, в основном кислород. Кислород может присутствовать в виде окси-группы, например, в виде гидрокси-группы или эфирной группы, карбонильной, например, неоксокарбонильной группы, такой как эфир карбоновой кислоты и т.п. Азот может присутствовать в виде амидо-, циано- и аминогруппы. Иллюстративный список биодеградируемых полимеров, которые можно применять, описаны Heller, Biodegradable Polymers in Controlled drug Delivery, In: "CRC Critical Reviews in Therapeutic Drug Carrier Systems", Vol.1. CRC Press, Boca Raton, FL (1987).
Особенный интерес представляют полимеры гидроксиалифатических карбоновых кислот, или гомо-, или сополимеры, а также полисахариды. Среди полиэфиров особый интерес представляют гомо- или сополимеры D-молочной кислоты, L-молочной кислоты, рацемической смеси молочной кислоты, гликолевой кислоты, капролактона, а также их комбинации. Сополимеры гликолевой и молочной кислоты представляют особенный интерес, так как степень биодеградации контролируется соотношением гликолевой к молочной кислоте. Процент каждого мономера в СМГК может составлять 0-100%, примерно 15-85%, около 25-75%, либо около 35-65%. В предпочтительном воплощении используется 50:50 СМГК. Более предпочтительно применять случайный 50:50 СМГК.
Также можно применять биодеградируемые полимерные матрицы, содержащие смеси СМГК с гидрофильными и гидрофобными концами, и это оказывается полезным в модулировании степени разложения полимерной матрицы. Гидрофобные концы (это также относится к полимерам с концевыми реакционными группами и без таковых) СМГК имеют эфирные связи, гидрофобные по природе, находящиеся на концах полимера. Типичными гидрофобными группами являются сложные эфиры алкилов и ароматические сложные эфиры, но не ограничиваются ими. Гидрофильные концы (также относится к полимерам без концевых реакционных групп) СМГК имеют концевые группы, гидрофильные по природе, находящиеся на концах полимера. СМГК с гидрофильными концевыми группами, расположенными на концах полимера, разлагаются быстрее, чем СМГК с гидрофобными окончаниями, поскольку, поглощая воду, претерпевают гидролиз с большей скоростью (Tracy et al., Biomaterials 20:1057-1062 (1999)). Примеры подходящих гидрофильных концевых групп, которые можно вводить для усиления гидролиза, включают, но не ограничиваются ими, карбоксил, гидроксил, а также полиэтиленгликоль. Конкретные концевые группы обычно переходят от инициатора, применяемого в процессе полимеризации. Например, если инициатором являются вода или карбоновая кислота, образующейся концевой группой будет карбокси- или гидрокси-группа. Аналогично, если инициатором является монофункциональный спирт, то образующейся группой будет эфир или гидроксил.
Имплантаты можно изготавливать из любых типов СМГК - с гидрофильными концами или гидрофобными концами. В основном, однако, отношение гидрофильных окончаний СМГК к гидрофобным в биодеградируемых полимерных матрицах по настоящему изобретению варьирует от примерно 10:1 до примерно 1:10 по массе. Например, отношение может быть 3:1, 2:1 или 1:1 по массе. В предпочтительном воплощении используются имплантаты с соотношением гидрофильных концов СМГК к гидрофобным, равным 3:1 по массе.
Дополнительные агенты
Для различных целей можно применять другие агенты, добавляя их в состав. Например, можно применять буферные агенты и консерванты. Консерванты, которые можно применять, включают, но не ограничиваются ими, бисульфит натрия, бисульфат натрия, тиосульфат натрия, бензалконий хлорид, хлорбутанол, тимеросал, нитрат фенилртути, метилпарабен, поливиниловый спирт, а также фенилэтиловый спирт. Примеры буферных агентов, которые можно применять, включают, но не ограничиваются ими, карбонат натрия, борат натрия, фосфат натрия, ацетат натрия, бикарбонат натрия, а также другие агенты, пригодные для указанного пути введения, одобренные Управлением по контролю за продуктами и лекарствами США. Электролиты, такие как хлорид натрия и хлорид калия, также могут быть применять при составлении композиции.
Биодеградируемые глазные имплантаты также могут содержать дополнительные гидрофильные или гидрофобные соединения, увеличивающие или затормаживающие высвобождение активного агента.
Кроме того, изобретатели полагают, поскольку СМГК с гидрофильными концами обладают более высокой степенью разложения по сравнению с СМГК с гидрофобными концами, благодаря их способности поглощать воду быстрее, увеличение количества СМКГ с гидрофильными концами в полимерной матрице имплантата приведет к более высокой скорости растворения. Фиг.9 показывает, что период времени от имплантации до начала существенного высвобождения активного агента (время задержки) увеличивается с уменьшением в глазных имплантатах количества СМГК с гидрофильными концами. На Фиг.9 видно, что время задержки для имплантата с 0% СМГК с гидрофильными концами (40 мас.% гидрофобных концов) составляет примерно 21 день. Для сравнения, было отмечено существенное уменьшение времени задержки для имплантата, содержащего 10 мас.% и 20 мас.% СМГК с гидрофильными концами.
Кинетика высвобождения
Изобретатели предлагают имплантаты по изобретению, изготовленные с частицами активного агента, диспергированными в полимерной биодеградируемой матрице.
Не ограничиваясь какими-либо теориями, изобретатели полагают, что высвобождение активного агента достигается посредством деградации биодеградируемой полимерной матрицы, а также посредством диффузии частичного агента в жидкость глаза, например в стекловидное тело, с последующим растворением полимерной матрицы и высвобождением активного агента. Изобретатели полагают, что факторы, влияющие на кинетику высвобождения, включают такие характеристики, как размер частиц активного агента, растворимость активного агента, соотношение активного агента и полимера (полимеров), способ изготовления, площадь поверхности обработки, а также степени деградации полимера (полимеров). Кинетика высвобождения, достигаемая таким способом высвобождения, отличается от кинетики, достигаемой в составах, в которых высвобождение активного агента происходит благодаря набуханию полимеров, например, таких как сшитые гидрогели. В этом случае активный агент высвобождается не в результате деградации полимера, а в результате набухания полимера, который высвобождает агент в виде жидкости, диффундирующей по образовавшимся путям.
Изобретатели полагают, что степень высвобождения активного агента зависит, по крайней мере частично, от степени деградации компонента основной цепи полимера, либо компонентов, составляющих матрицу полимера. Например, конденсационные полимеры могут деградировать в результате гидролиза (среди прочего), и поэтому любые изменения в композиции имплантата, приводящие к увеличению поглощения воды имплантатом, будут, вероятно, увеличивать степень гидролиза, тем самым увеличивая степень деградации полимера и разложения, таким образом увеличивая степень высвобождения активного агента.
Кинетика высвобождения имплантата по изобретению частично зависит от площади поверхности имплантата. Большая площадь поверхности позволяет воздействовать глазной жидкости на большее количество полимера и активного агента, вызывая более быстрое разложение полимерной матрицы и растворение частиц активного агента в жидкости. Размер и форму имплантата можно также использовать для контроля степени высвобождения, времени лечения, а также концентрации активного агента в месте имплантации. При равной загрузке активного агента больший имплантат будет доставлять пропорционально большую дозу, но, в зависимости от отношения поверхности к массе, может обладать более медленной степенью высвобождения. Для имплантации в глазничную область общая масса имплантата предпочтительно должна составлять, к примеру, примерно 100-5000 мкг, обычно примерно 500-1500 мкг. В одном из воплощений общий вес имплантата составляет примерно 600 мкг. В другом воплощении общий вес имплантата составляет примерно 1200 мкг.
Биодеградируемые имплантаты обычно являются твердыми и могут быть сформированы в виде частиц, пластин, накладок, бляшек, пленок, дисков, волокон, стержней и т.п., либо могут быть любого размера или объема, совместимого с выбранным местом имплантации, пока имплантат обладает желаемой кинетикой высвобождения и доставляет количество активного агента, являющееся терапевтическим количеством для указанного патологического состояния глаза. Верхний предел размера имплантата определяется такими факторами, как желаемая кинетика высвобождения, переносимость имплантата в месте имплантации, ограничение размера для введения, а также легкость в использовании. Например, камера стекловидного тела способна вмещать относительно большие имплантаты в виде стержней, в основном имеющих диаметры примерно 0,05 мм-3 мм и длину примерно 0,5-10 мм. В одном из воплощений стержень имеет диаметр примерно 0,1 мм-1 мм. В другом воплощении стержень имеет диаметр от примерно 0,3 до примерно 0,75 мм. В других воплощениях также можно использовать имплантаты, имеющие варьируемую форму, но примерно одинаковый объем.
Как обсуждалось ранее, высвобождение активного агента из биодеградируемой матрицы можно также модулировать посредством варьирования соотношения содержания в матрице СМГК с гидрофильными концами и СМГК с гидрофобными концами. Степени высвобождения также можно изменять в процессе производства имплантата. Например, как показано в Примерах 4-7, экструдированный имплантат, содержащий 60/40 по массе дексаметазон/СМГК, с соотношением СМГК с гидрофильными концами и СМГК с гидрофобными концами, равным 3:1, и имплантат в виде спрессованных таблеток демонстрируют разный профиль высвобождения лекарства и концентрацию агента в стекловидном теле в течение примерно 1 месяца. В целом, экструдированные имплантаты демонстрируют более плавное высвобождение агента и более постоянные уровни агента в стекловидном теле.
Как показано на Фиг.2 и в Примерах 4 и 5, в случае имплантата в виде спрессованных таблеток с содержанием 350 мкг дексаметазона (350Т), наблюдается более высокий начальный всплеск в высвобождении активного агента на следующий день после имплантации по сравнению с экструдированным имплантатом, содержащим 350 мкг дексаметазона (350Е). Как показано на Фиг.2 и в Примерах 6 и 7, в случае спрессованного имплантата, содержащего 700 мкг дексаметазона (700Т), в первый день наблюдается более высокий начальный всплеск в высвобождении по сравнению с экструдированным имплантатом, содержащим 700 мкг дексаметазона (700Е).
Пропорции активного агента, биодеградируемой полимерной матрицы, а также других добавок можно установить эмпирически, изготавливая несколько имплантатов с различными пропорциями и установив зависимости высвобождения in vitro и in vivo. Для оценки степени высвобождения in vitro можно использовать тест на растворение или высвобождение, одобренный ФСША (USP 24; NF 19 (2000) pp.1941-1951). Например, навеску имплантата добавляют к измеренному объему раствора, содержащего 0,9% NaCl в воде, причем объем раствора должен быть таким, чтобы концентрация активного агента после высвобождения составляла менее 20% от концентрации насыщенного раствора. Смесь перемешивают или медленно встряхивают при 37°С для получения суспензии. Установление зависимости высвобождения растворенного активного агента от времени можно производить различными способами, известными на современном уровне техники, такими как спектрофотометрический, ВЭЖХ, масс-спектроскопия, и тому подобное, до тех пор, пока концентрация раствора не станет постоянной, или до тех пор, пока не высвободится более чем 90% активного агента.
В одном из воплощений экструдированные имплантаты, описанные здесь (соотношение СМГК с гидрофильными концами и СМГК с гидрофобными концами составляет 3:1), могут обладать суммарным процентным высвобождением in vivo, со следующими описанными характеристиками, как показано на Фиг.2, причем зависимость высвобождения представлена для случая высвобождения активного агента in vivo после имплантации имплантата в стекловидное тело глаза кролика. Объем глаза кролика составляет примерно 60-70% от объема человеческого глаза.
На следующий день после имплантации суммарный процент высвобождения in vivo может составлять от примерно 0% до примерно 15%, но обычно составляет от примерно 0% до примерно 10%. Через день после имплантации суммарный процент высвобождения in vivo может составлять менее примерно 15%, как правило, менее примерно 10%.
На третий день после имплантации суммарный процент высвобождения in vivo может составлять примерно 0%-20%, как правило, около 5%-15%. Через три дня после имплантации суммарное процентное высвобождение in vivo может составлять меньше примерно 20%, как правило, менее примерно 15%.
На седьмой день после имплантации суммарный процент высвобождения in vivo может составлять примерно 0%-35%, как правило, примерно 5%-30%, и еще более вероятно, примерно 10%-25%. На седьмой день после имплантации, суммарный процент высвобождения in vivo может быть больше примерно 2%, как правило, больше примерно 5%, и еще более вероятно, более примерно 10%.
На четырнадцатый день после имплантации суммарный процент высвобождения in vivo может составлять примерно 20%-60%, как правило, примерно 25%-55%, более вероятно, примерно 30%-50%. На четырнадцатый день после имплантации суммарный процент высвобождения in vivo может быть более примерно 20%, обычно более примерно 25%, и еще более вероятно, более примерно 30%.
На двадцать первый день после имплантации суммарный процент высвобождения in vivo может составлять примерно 55%-99%, более вероятно, примерно 60%-90%, и наиболее вероятно, примерно 65%-85%. На двадцать первый день после имплантации суммарный процент высвобождения in vivo может быть больше примерно 55%, более вероятно, больше примерно 60%, и наиболее вероятно, больше примерно 65%.
На двадцать восьмой день после имплантации суммарный процент высвобождения in vivo может составлять примерно 80%-100%, более вероятно, примерно 85%-100% и наиболее вероятно, примерно 90%-100%. На двадцать восьмой день после имплантации суммарный процент высвобождения in vivo может быть больше примерно 80%, более вероятно, больше примерно 85%, и наиболее вероятно, больше примерно 90%.
На тридцать пятый день после имплантации суммарный процент высвобождения in vivo может составлять примерно 95%-100%, более вероятно, примерно 97%-100%. Через тридцать пять дней после имплантации суммарный процент высвобождения in vivo может быть больше примерно 95%, как правило, больше примерно 97%.
В одном из воплощений суммарное высвобождение in vivo в процентах имеет следующие характеристики: на первый день после имплантации оно составляет менее примерно 15%; на третий день после имплантации оно примерно составляет менее примерно 20%; на седьмой день после имплантации оно составляет более примерно 5%; на четырнадцатый день после имплантации составляет более примерно 25%; на двадцать первый день после имплантации составляет более примерно 60%; на двадцать восьмой день после имплантации составляет более примерно 80%. В другом воплощении суммарное высвобождение in vivo в процентах имеет следующие характеристики: на первый день после имплантации оно составляет менее примерно 10%; на третий день после имплантации оно примерно составляет менее примерно 15%; на седьмой день после имплантации оно составляет более примерно 10%; на четырнадцатый день после имплантации составляет более примерно 30%; на двадцать первый день после имплантации составляет более примерно 65%; на двадцать восьмой день после имплантации примерно составляет более примерно 85%.
В еще одном воплощении экструдированные имплантаты, описанные в данной заявке, могут иметь профиль суммарного высвобождения in vitro в процентах в физиологическом растворе при 37°С со следующими характеристиками, как описано выше и как это показано на Фиг.10.
Суммарный процент высвобождения in vitro в первый день после имплантации может составлять примерно 0%-5%, более вероятно примерно 0%-3%. Суммарный процент высвобождения in vitro в первый день может быть менее примерно 5%, как правило, менее примерно 3%.
Суммарный процент высвобождения in vitro на четвертый день может составлять примерно 0%-7%, более вероятно примерно 0%-5%. Суммарный процент высвобождения in vitro на четвертый день может быть менее примерно 7%, как правило, менее примерно 5%.
Суммарный процент высвобождения in vitro на седьмой день может составлять примерно 1%-10%, более вероятно примерно 2%-8%. Суммарный процент высвобождения in vitro на седьмой день может быть выше примерно 1%, как правило, выше примерно 2%.
Суммарный процент высвобождения in vitro на четырнадцатый день может составлять примерно 25%-65%, более вероятно примерно 30%-60%, наиболее вероятно примерно 35%-55%. Суммарный процент высвобождения in vitro на четырнадцатый день может быть более примерно 25%, более вероятно, больше примерно 30%, наиболее вероятно, больше примерно 35%.
Суммарный процент высвобождения in vitro на двадцать первый день может составлять примерно 60%-100%, как правило, примерно 65%-95%, наиболее вероятно 70%-90%. Суммарный процент высвобождения in vitro на двадцать первый день может быть примерно больше примерно 60%, более вероятно, больше примерно 65% и, наиболее вероятно, больше примерно 70%.
Суммарный процент высвобождения на двадцать восьмой день может составлять примерно 75%-100%, более вероятно, примерно 80%-100%, наиболее вероятно, 85% - 95%. Суммарный процент высвобождения in vitro на двадцать восьмой день может быть больше примерно 75%, более вероятно, больше примерно 80% и, наиболее вероятно, больше примерно 85%.
Суммарный процент высвобождения in vitro на тридцать пятый день может составлять примерно 85%-100%, более вероятно, 90%-100%, наиболее вероятно, примерно 95%-100%. Суммарный процент высвобождения in vitro на тридцать пятый день может быть больше примерно 85%, более вероятно, больше примерно 90%, и наиболее вероятно, больше примерно 95%.
В одном из воплощений суммарный процент высвобождения in vitro имеет следующие характеристики: один день спустя - менее примерно 1%; через четыре дня - менее примерно 7%; через семь дней - более примерно 2%; через 14 дней - более примерно 30%; через 21 день - более примерно 65%; через 28 дней - более примерно 80%; через 35 дней - более примерно 90%. В другом воплощении суммарный процент высвобождения in vitro имеет следующие характеристики: через один день - менее примерно 3%; через четыре дня - менее примерно 5%; через семь дней - более примерно 2%; через 14 дней - более примерно 35%; через 21 день - более примерно 70%; через 28 дней - примерно 85%; через 35 дней - примерно 90%.
Помимо иллюстрации эффекта менее резкого всплеска при высвобождении для экструдированных имплантатов Фиг.2 и 10 также показывают, что через 28 дней в глазу кролика in vivo, или in vitro в физиологическом растворе при 37°С, соответственно, практически весь активный агент был высвобожден имплантатами. К тому же Фиг.2 и 10 показывают, что профили высвобождения активного агента для экструдированных имплантатов in vivo (как функция от времени имплантации) и in vitro (как функция от времени помещения в физиологический раствор при 37°С) по существу одинаковы и приближенно описываются сигмоидальной кривой, и спустя 28 дней активный агент высвобождается практически полностью. Начиная с первого по примерно семнадцатый день, кривые идут плавно вверх (т.е. производная кривой возрастает по мере увеличения времени), и, начиная приблизительно с 17-го дня и далее, кривые идут по нисходящей (т.е. производная кривой уменьшается с увеличением времени).
Напротив, графики на Фиг.2, для случаев имплантатов в виде спрессованных таблеток, содержащих 350 мкг и 700 мкг дексаметазона, показывают более резкий начальный всплеск при высвобождении агента, в основном высвобождение описывается постепенным возрастанием. Кроме того, как показано на Фиг.1 и 5, имплантация спрессованных имплантатов приводит к различным концентрациям активного агента в стекловидном теле в разные промежутки времени, в отличие от экструдированных имплантатов. Например, как показано на Фиг.1 и 5, в случае экструдированных имплантатов наблюдается постепенное возрастание, плато и постепенное уменьшение концентраций активного агента в стекловидном теле. В случае имплантатов в виде спрессованных таблеток, напротив, наблюдается более сильное начальное высвобождение активного агента и последующее примерно постоянное уменьшение со временем. Следовательно, кривая зависимости концентрации в стекловидном теле для экструдированных имплантатов указывает на более постоянные уровни содержания активного агента в глазничной области.
Помимо вышеописанных имплантатов, высвобождающих все количество активного агента в течение 35 дней, варьируя компоненты имплантата, включая композицию биодеградируемой полимерной матрицы, но не ограничиваясь этим, можно изготовить имплантаты для высвобождения терапевтического агента в течение любого периода времени, например в течение примерно недели, примерно двух недель, примерно трех недель, примерно четырех недель, примерно пяти недель, примерно шести недель, примерно семи недель, примерно восьми недель, примерно девяти недель, примерно десяти недель, примерно одиннадцати недель, примерно двенадцати недель, либо более чем 12 недель.
Еще одним важным признаком экструдированных имплантатов является возможность устанавливать различные уровни концентрации активного агента в стекловидном теле, применяя разные дозы активного агента. Как показано на Фиг.8, концентрация агента в стекловидном теле существенно выше в случае экструдированного имплантата, содержащего 700 мкг дексаметазона, по сравнению с экструдированным имплантатом, содержащим 350 мкг дексаметазона. Различные концентрации активного агента в случае имплантатов в виде спрессованных таблеток не показаны. Так, применяя экструдированные имплантаты, возможно более легко контролировать концентрацию активного агента в стекловидном теле. В частности, можно установить конкретную зависимость ответа от дозы, поскольку можно контролировать размер имплантата, для того чтобы доставить заранее определенное количество активного агента.
Применения
Случаи патологических состояний глаза, которые можно лечить с помощью имплантатов и способов по настоящему изобретению, включают увеит, отек желтого пятна, дегенерацию желтого пятна, отслойку сетчатки, опухоли глаза, грибковые или вирусные инфекции, многофокальный хориоидит, диабетическую ретинопатию, пролиферативную витреоретинопатию (ПВР), симпатическую офтальмию, синдром Фогта-Койанаги-Харада, гистоплазмоз, увеальную диффузию и закупорку сосудов, но не ограничиваются ими. В одном из воплощений имплантаты особенно эффективны при лечении таких патологических состояний, как увеит, отек пятна, состояния закупорки сосудов, пролиферативная витреоретинопатия (ПВР), а также другие виды ретинопатии.
Способы имплантации
Биодеградируемые имплантаты можно вводить в область глаза различными способами, включая помещение с помощью пинцета, троакара, либо с помощью других разновидностей аппликаторов, после надрезания склеры. В некоторых частных случаях троакар или аппликатор можно использовать без надрезания. В предпочтительном воплощении для введения одного или нескольких биодеградируемых имплантатов внутрь глаза применяют ручной аппликатор. Ручной аппликатор обычно снабжен 18-30 GA (калиброванной) иглой из нержавеющей стали, ручкой управления, приводом и плунжером.
Способ имплантации включает, в первую очередь, введение иглы в намеченную область внутри глаза. Находясь в области имплантации, например в полости стекловидного тела, с помощью ручки управления на рукоятке приводят в действие управляющий механизм, выдвигающий плунжер. Как только плунжер будет выдвинут, он выталкивает имплантат в намеченную область.
Способы экструзии
Применение способов экструзии позволяет производить имплантаты в крупном масштабе и обеспечивает получение имплантатов с гомогенным распределением лекарства внутри полимерной матрицы. При применении способов экструзии следует выбирать полимеры и активные агенты, стабильные при температуре, необходимой для производства, обычно она составляет не менее примерно 50°С. В способах экструзии используемая температура составляет от примерно 25°С до примерно 150°С, более предпочтительно от примерно 60°С до примерно 130°С.
С помощью различных способов экструзии можно получать имплантаты с разными характеристиками, включая гомогенность распределения активного агента в полимерной матрице, но не ограничиваясь перечисленным. Например, используя поршневой ленточный пресс, одношнековый экструдер, двухшнековый экструдер, можно получать имплантаты со значительно более высокой гомогенностью распределения активного агента. При применении способа однократной экструзии такие параметры, как температура, скорость экструзии, геометрия прессования, а также конечная поверхность прессования, будут влиять на профиль высвобождения из полученных имплантатов.
В одном из воплощений получения имплантатов способом экструзии лекарство и полимер сначала смешивают при комнатной температуре, затем нагревают до температуры примерно 60°С-150°С, более вероятно, до температуры примерно 130°С, время нагревания составляет от 0 до 1 часа, более вероятно, от 0 до 30 мин, более вероятно, 5-15 минут, наиболее вероятно, 10 минут. Затем имплантаты экструдируют при температуре примерно 60°С-130°С, предпочтительно при примерно 75°С-110°С и наиболее предпочтительно при температуре примерно 90°С.
В предпочтительном воплощении способа экструзии порошок гомогенизированных активного агента и СМГК добавляют в одно- или двухшнековый экструдер с заранее установленной температурой примерно 80°С-130°С и непосредственно экструдируют в виде нитей или стержней с минимальной продолжительностью обработки в экструдере. Затем экструдированные нити или стержни разрезают на имплантаты небольшого размера, содержащие загруженную дозу активного агента, пригодную для лечения патологического состояния, для которого намечали применять имплантаты.
СДЛДЗО
Настоящее изобретение основано на создании системы доставки лекарства внутрь глаза, которая может помочь решить многие проблемы, связанные с традиционными способами лечения патологических состояний глаз, такие как воспаление задней области глаза, включая колебание уровней содержания лекарства, короткий период полураспада внутри глаза, а также длительное системное воздействие высокого уровня содержания кортикостероидов. Система доставки лекарства внутрь глаза по настоящему изобретению включает применение дексаметазона в качестве активного фармацевтического агента, и в этом случае систему доставки лекарства внутрь глаза по настоящему изобретению можно отнести к Системе Доставки Лекарства Дексаметазона в Заднюю Область (глаза) (СДЛДЗО). СДЛДЗО предназначена для введения в заднюю область глаза с помощью инъекции в ресничный кружок, хорошо известного для офтальмологов способа введения.
СДЛДЗО может включать биодеградируемый полимер, сополимер молочной и гликолевой кислот (СМГК), содержащих микрочастицы дексаметазона. СДЛДЗО высвобождает дексаметазон, обеспечивая общую дозу около 350-700 мкг в течение более примерно 35 дней. Для сравнения, другие пути введения (местное, периокулярное, системное введение, а также стандартные инъекции в стекловидное тело) требуют значительно большие суточные дозы для доставки эквивалентного количества дексаметазона в заднюю область, в то же время также подвергая другие органы действию кортикостероидов. Местное введение 2 капель офтальмологической 0,1%-ной суспензии дексаметазона четыре раза ежедневно в оба глаза эквивалентно почти 500 мкг в день. Системная доза может быть такой высокой, как 1000 мкг/кг/день (Pinar V. Intermediate uveitis. Massachusetts Eye& Ear Infirmary Immunology Service, http://www.immunologv.meei.harvard.edu/imed.htm. 1998: Wiesbecker CA, Fraunfelder FT, Naidoff M, Tippermann R, eds, 1999 Physicians' desk Reference for Ophthalmology, 27th ed. Montvale, NJ: Medical Economics Company, 1998; 7-8, 278-279). С помощью СДЛДЗО можно вводить значительно более низкие суточные дозы дексаметазона непосредственно в заднюю область глаза по сравнению с дозами, требуемыми для традиционного местного, системного введения или введения в стекловидное тело, таким образом сводя к минимуму возможность возникновения побочных эффектов. Высвобождая дексаметазон, полимер постепенно полностью деградирует, и поэтому нет необходимости удалять СДЛДЗО после помещения в заднюю область глаза пациента.
Для облегчения доставки СДЛДЗО в заднюю область глаза был разработан аппликатор для доставки СДЛДЗО непосредственно в стекловидное тело. СДЛ аппликатор позволяет помещать СДЛДЗО в заднюю область глаза с помощью маленькой полой калиброванной иглы, тем самым уменьшая болезненные ощущения, связанные с хирургией и инъекцией в ресничный кружок в стекловидное тело. Экструдированную СДЛДЗО помещают в аппликатор во время производства стерильного конечного лекарственного препарата. Аппликатор СДЛДЗО является устройством одноразового пользования.
700 мкг и 350 мкг Систему Доставки Лекарства в Заднюю Область (СДЛДЗО аппликатор) можно применять при лечении, например, пациентов с отеком желтого пятна, возникшим вследствие закупорки центральной вены сетчатки или закупорки ответвлений вены сетчатки.
Дексаметазон можно получить из Авентис Фарма, Монтвиль, Нью-Джерси, США. Химическим названием дексаметазона является прегна-1,4-диен-3,20-дион-9-фтор-11,17,21-тригидрокси-16-метил-(11□, 16□), а его химическую структуру можно изобразить схематически следующим образом:

Другие характеристики дексаметазона следующие:
Дополнительная информация о физических и химических свойствах дексаметазона приведена в текущей Европейской Фармакопее (Ph. Eur.).
К воплощению настоящего изобретения можно отнести СДЛДЗО. СДЛДЗО является имплантатом (система доставки лекарства или СДЛ) для введения в стекловидное тело (т.е. в заднюю область или 30), содержащим Дексаметазон (т.е. Декс) (лекарственное вещество) и полимерную матрицу 50:50 СМГК, состоящую из двух видов СМГК (50:50 СМГК эфир и 50:50 СМГК кислота). Подробности приведены в таблице 1. Данная биодеградируемая система доставки лекарства разработана для высвобождения лекарственного вещества в заднюю область глаза за 35-дневный период. СДЛДЗО можно имплантировать в стекловидное тело глаза, используя аппликатор.
Две дозы, одна, содержащая 350 мкг дексаметазона, и вторая, содержащая 700 мкг дексаметазона, оценивали в клинических испытаниях. Обе дозы имели одинаковую рецептуру, как указано в таблице 2. Они были изготовлены с использованием одинаковой массы и способом двойной экструзии, однако разрезаны разными по длине для получения соответствующей силы дозы.
Лекарственным веществом, использующимся в СДЛДЗО, является измельченный дексаметазон.
СДЛДЗО может содержать два эксципиента (т.е. неактивные ингредиенты), которые могут присутствовать как два разных вида одного и того же биодеградируемого 50:50 СМГК, поставляемого Бойхрингер Ингелхейм: 50:50 СМГК эфир и 50:50 СМГК кислота.
Поли(D,L-лактид-ко-гликолид) используется уже более 15 лет в препаратах для парентерального введения и является главным компонентом рассасывающегося шовного материала. Перечень некоторых коммерчески доступных лекарственных препаратов приведен в Таблице 3.
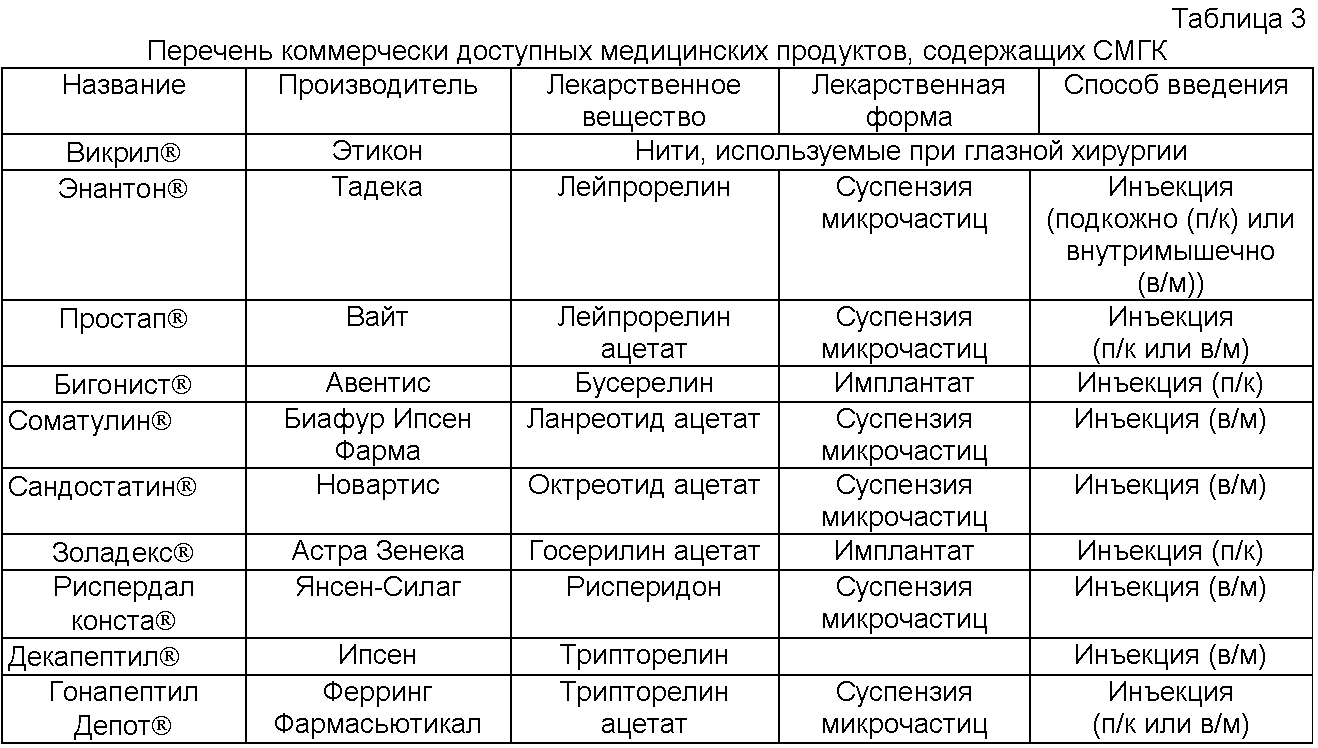
СМГК существует в разных видах, в зависимости от соотношения лактида и гликолида и концов полимерной цепи. Все виды СМГК разлагаются посредством гидролиза остова (разложение массы), и продукты разложения, молочная и гликолевая кислота, в конечном счете в ходе обмена веществ превращаются в СO2 и H2O. Две комбинации СМГК, представленные в таблице 2, были выбраны для достижения высвобождения лекарственного вещества в течение 35-дневного срока. Основные свойства выбранных видов СМГК представлены в таблице 4.
СДЛДЗО была разработана для высвобождения дексаметазона в заднюю область глаза в течение продолжительного периода в 35 дней. Указанное длительное высвобождение достигается посредством включения дексаметазона в биодеградируемую полимерную матрицу. В качестве полимера выбран 50:50 СМГК. Степень высвобождения в основном зависит от степени деградации СМГК, зависящей, в свою очередь, от многих факторов, таких как молекулярный вес и распределение массы, соотношение лактидных и гликолидным фрагментов, концов полимерной цепи и т.д. Механизм разложения СМГК представляет собой гидролиз, начинающийся в присутствии жидкостей в теле, т.е. в стекловидном теле в случае СДЛДЗО.
Первые составы содержали только один вид СМГК (50:50 с эфирными концевыми группами), индивидуально синтезированный. Впоследствии было обнаружено, что форма СМГК с «кислотными концевыми группами», обозначенная как «50:50 СМГК кислота», смешанная с 50:50 СМГК эфиром (равноценная начальному СМГК), обеспечивает желаемый профиль высвобождения от времени. СМГК с «кислотными концевыми группами» немного более гидрофильная и поэтому разлагается в воде быстрее. Остовы обоих полимеров идентичны, но в процессе полимеризации, использующемся для получения СМГК с кислотными концевыми группами, применяются различные агенты обрыва цепи, ведущие к образованию карбоксильной группы на концах полимерной цепи. В процессе биодеградации имплантата образуются продукты разложения, одинаковые для обоих видов полимера, т.е. молочная и гликолевая кислоты. Подробности предложенного состава можно найти выше. Кроме того, была оценена стабильность СДЛДЗО.
Примеры
Приведенные ниже примеры служат для более полного описания применения вышеописанного изобретения. Следует понимать, что данные примеры не ограничивают объем изобретения и приведены здесь для иллюстрации.
Пример 1
Производство имплантатов в виде спрессованных таблеток
Измельченный дексаметазон (Фармация, Пипак, Нью-Джерси) и измельченный 50:50 СМГК с гидрофобными концами (Бирмингем Полимерз, Инк., Бирмингем, Алабама) аккуратно взвешивали и помещали в стальной нержавеющий сосуд для смешивания. Сосуд запечатывали, помещали в мешалку Турбула и перемешивали с заданной скоростью, например 96 об/мин в течение, например, 15 минут. Полученную порошковую смесь загружали одной порцией в одногнездный пресс для таблеток. Пресс включали при заранее установленном давлении, например 172,4 кПа, продолжительность составила 6 секунд, затем сформированные таблетки вынимали из пресса при комнатной температуре. Соотношение дексаметазона и СМГК составляло 70:30 по массе для всех имплантатов в виде спрессованных таблеток.
Пример 2
Производство экструдированных имплантатов
Измельченный дексаметазон (Фармация, Пипак, Нью-Джерси) и неизмельченный СМГК аккуратно взвешивали и помещали в стальной нержавеющий сосуд для смешивания. Сосуд запечатывали, помещали в мешалку Турбула и перемешивали с заданной скоростью, например 96 об/мин в течение 10-15 минут. Неизмельченная композиция СМГК содержала 30:10 по массе смеси СМГК с гидрофильными концами (Бойхрингер Ингелхейм, Валлингфорд, Коннектикут) и СМГК с гидрофобными концами (Бойхрингер Ингелхейм, Валлингфорд, Коннектикут). Полученную порошковую смесь загружали в пресс-экструдер DACA (ДАКА, Голета, Калифорния) и подвергали воздействию при заранее установленной температуре, например 115°С, и скорости вращения 12 об/мин. Нити экструдировали в направляющем механизме и разрезали на отрезки точной длины, соответствующие намеченной массе имплантата. Отношение дексаметазона к общему количеству СМГК (с гидрофильными и гидрофобными концами) было 60:40 по массе для всех экструдированных имплантатов.
Пример 3
Способ введения имплантатов в стекловидное тело
Имплантаты помещали в заднюю часть правого глаза Новозеландских белых кроликов, надсекая конъюнктиву и склеру в положении между 10 и 12 часами микровитреоретинальным (МВР) лезвием 20 размера. 50-100 мкл влаги стекловидного тела удалили с помощью шприца 1 см3 с иглой 27 мм. Стерильный трокар, предварительно загруженный соответствующим имплантатом (система доставки лекарства, СДЛ), ввели на 5 мм через склеротомию и затем ретрагировали нажатием механизма, оставляя имплантат в задней области. Склеру и конъюнктиву затем зашили с помощью 7-0 викрилового шва.
Пример 4
Высвобождение дексаметазона in vivo из имплантатов в виде спрессованных таблеток, содержащих 350 мкг дексаметазона
Пример 4 показывает высокий уровень начального высвобождения, но в основном низкую концентрацию дексаметазона внутри стекловидного тела в случае имплантатов в виде прессованных таблеток по сравнению с экструдированными имплантатами. Имплантаты в виде прессованных таблеток, содержащие 350 мкг дексаметазона (350Т), помещали в правый глаз Новозеландского белого кролика способом, описанным в Примере 3. Периодически брали образцы стекловидного тела и анализировали ЖХ/МС/МС (Жидкостная хроматография/Масс-спектроскопия) для определения характеристики высвобождения дексаметазона. Как видно на Фиг.1, концентрация дексаметазона внутри стекловидного тела достигала детектируемой величины, начиная с 1-го дня (142,20 нг/мл) по 35-ый день (2,72 нг/мл), концентрация дексаметазона внутри стекловидного тела постепенно уменьшалась со временем.
В добавление к образцам стекловидного тела брали также образцы водянистой жидкости и плазмы. В случае образца 350Т спустя время выявлено постепенное понижение концентрации дексаметазона в водянистой влаге, детектируемая величина концентрации дексаметазона в водянистой влаге зарегистрирована с 1-го дня (14,88 нг/мд) по 21-й день (3,07 нг/мл), как показано на Фиг.3. Уровни содержания дексаметазона в водянистой влаге строго коррелировали с уровнями содержания дексаметазона в стекловидном теле, но на гораздо более низких уровнях (примерно в 10-кратном размере). Фиг.4 демонстрирует, что в плазме были обнаружены лишь следовые количества дексаметазона.
Пример 5
Высвобождение дексаметазона in vivo из экструдированных имплантатов, содержащих 350 мкг дексаметазона
Пример 5 показывает в случае экструдированных имплантатов более низкий уровень начального высвобождения и в целом более постоянную концентрацию дексаметазона в стекловидном теле. Экструдированные имплантаты, содержащие 350 мкг дексаметазона (350Е), помещали в правый глаз Новозеландского белого кролика способом, описанным в Примере 3. Периодически брали образцы стекловидного тела и анализировали ЖХ/МС/МС для определения характеристики высвобождения дексаметазона. Согласно Фиг.1, в случае образца 350Е детектируемая величина концентрации дексаметазона в стекловидном теле выявлялась с 1-го дня (10,66 нг/мл) по 28-ой день (6,99 нг/мл). Имплантат 350Т показал статистически значительно более высокие значения концентраций дексаметазона на первый день (р=0,037), в то время как 350Е показал статистически значительно более высокие значения концентраций дексаметазона на 21 день (р=0,041).
В добавление к образцам стекловидного тела брали также образцы водянистой жидкости и плазмы. Как видно на Фиг.3, в случае 350Е детектируемая величина концентраций дексаметазона в стекловидном теле достигалась, начиная с первого дня (6,67 нг/мл) по 42-й день (2,58 нг/мл), за исключением 35-го дня, когда значение было ниже количественного. В целом, уровни содержания дексаметазона в водянистой жидкости коррелировали с уровнями дексаметазона в стекловидном теле, но при гораздо более низких уровнях (приблизительно 10-кратном размере). Фиг.4 показывает, что в плазме были обнаружены только следовые количества.
Пример 6
Высвобождение дексаметазона in vivo из имплантатов в виде спрессованных таблеток, содержащих 700 мкг дексаметазона
Пример 6 также показывает высокий уровень начального высвобождения и в основном низкую концентрацию дексаметазона в стекловидном теле в случае имплантатов в виде спрессованных таблеток. Лекарственную форму 700 мкг в виде спрессованных таблеток (700Т) поместили в правый глаз Новозеландского белого кролика, как описано в Примере 3. Периодически брали образцы стекловидного тела и анализировали ЖХ/МС/МС для определения характеристики высвобождения дексаметазона. Как видно из Фиг.5, в случае 700Т детектируемая величина концентраций дексаметазона в стекловидном теле достигается с 1-го дня (198,56 нг/мл) по 42-й день (2,89 нг/мл) и постепенно уменьшается со временем.
В добавление к образцам стекловидного тела брали также образцы водянистой жидкости и плазмы. Как видно из Фиг.6, в случае 700Т наблюдается постепенное уменьшение концентрации дексаметазона в стекловидном теле со временем, а детектируемая величина концентрации дексаметазона в водянистой жидкости достигается с 1-го дня (25,90 нг/мл) по 42-й день (2,64 нг/мл) за исключением 35-го дня, когда значение было ниже количественного. Уровни содержания дексаметазона в водянистой жидкости строго коррелировали с уровнями содержания дексаметазона в жидкости стекловидного тела, но при гораздо более низких уровнях (примерно в десять раз меньше). Фиг.7 показывает, что в плазме были обнаружены только следовые количества.
Пример 7
Высвобождение дексаметазона in vivo из экструдированных имплантатов, содержащих 700 мкг дексаметазона
Пример 7 также показывает более низкий уровень начального высвобождения и в основном более высокую концентрацию дексаметазона в стекловидном теле в случае экструдированных имплантатов.
Экструдированные имплантаты, содержащие 700 мкг дексаметазона (700Е), поместили в правый глаз Новозеландского белого кролика, как описано в Примере 3. Периодически брали образцы стекловидного тела и анализировали ЖХ/МС/МС для определения характеристики высвобождения дексаметазона. Как видно из Фиг.5, в случае 700Е концентрация дексаметазона в стекловидном теле имеет детектируемые значения, начиная с 1-го дня (52,63 нг/мл) по 28-й день (119,70 нг/мл).
В добавление к образцам стекловидного тела брали также образцы водянистой жидкости и плазмы. Как видно из Фиг.6, в случае образца 700Е концентрация дексаметазона в водянистой жидкости достигала детектируемой величины, начиная с 1-го дня (5,04 нг/мл) по 28-й день (5,93 нг/мл). Уровни содержания дексаметазона в водянистой жидкости строго коррелировали с уровнями содержания дексаметазона в стекловидном теле, но гораздо при более низких значениях (примерно в 10 раз ниже). Фиг.7 показывает, что в плазме обнаружены только следовые количества дексаметазона.
Пример 8
Способы экструзии для производства имплантатов
1. Имплантаты СДЛДЗО изготовляли таблетированием, способом однократной экструзии и двойной экструзии.
Эксципиенты (полимеры), применяемые в СДЛДЗО, были двух типов 50:50 поли(D,L-лактид-ко-гликолид)а с эфирной и с кислотной концевой группой. Оба эксципиента являются фармацевтической разновидностью ненормативного материала.
Предпочтительное воплощение трех партий 50:50 СМГК эфира, применяемого для изготовления имплантатов, приведено в Таблице А. Предпочтительное воплощение трех партий 50:50 СМГК кислоты, применяемого для изготовления имплантатов, приведено в Таблице Б.
Предпочтительное воплощение полимеров, применяемых для изготовления имплантатов
Полимерная композиция: Было установлено, что соотношение лактида и гликолида играет существенную роль в кинетике разложения полимера и, следовательно, влияет на зависимость высвобождения дексаметазона из имплантата. Соотношение поддерживали в диапазоне от 48% до 52% (мас.%) для обеспечения постоянства высвобождения активного агента.
Свойственная вязкость: свойственная вязкость играет существенную роль в кинетике разложения полимера и, следовательно, влияет на зависимость высвобождения дексаметазона из имплантата. Это мера размера основной цепи полимера и распределения по размеру (т.е. молекулярного веса и весового распределения). Вязкость поддерживали в диапазоне 0,16-0,24 дсм3/г для обеспечения постоянства высвобождения.
Вода: Содержание воды в полимере влияет на его стабильность во время хранения и является фактором, способствующим биодеградации полимерной матрицы. Содержание воды поддерживали ниже 0,5% для обеспечения стабильности всех наполнителей, так же как лекарственного вещества (дексаметазона), а также для обеспечения постоянства высвобождения (дексаметазона).
Остаточные мономеры: остаточные мономеры показывают завершение синтеза полимера, и содержание остаточных мономеров поддерживают ниже 0,5 мас.%.
Остаточные растворители:
- содержание ацетона поддерживают ниже 0,1 мас.%
- содержание толуола поддерживают ниже 0,089 мас.%
Коэффициент кислотности: Коэффициент кислотности является мерой числа концов цепи в СМГК кислотном полимере. Число кислотных концов полимера облегчает проникновение влаги при введении имплантата, а также влияет на зависимость высвобождения. Коэффициент кислотности поддерживали выше 6,5 мгKOH/г для обеспечения постоянства высвобождения.
Предпочтительные характеристики дексаметазона
Размер частиц дексаметазона и распределение частиц по размеру рассматривается как критический параметр для гомогенности СДЛДЗО. Предпочтительное распределение частиц дексаметазона по размеру является таковым, что по меньшей мере 75% частиц дексаметазона меньше (т.е. диаметр меньше) 10 мкм. Наиболее предпочтительное распределение частиц дексаметазона по размеру является таковым, что по меньшей мере 99% частиц дексаметазона меньше чем (т.е. диаметр меньше) 20 мкм. Мы обнаружили, что применение таких малых частиц дексаметазона в имплантате предусматривает более равномерное распределение активного агента в имплантате (т.е. отсутствие скопления), что приводит к более равномерному высвобождению активного агента из имплантата при его имплантации.
В добавление ко всем тестам ЕФ для дексаметазона проводились дополнительные тесты с применением анализатора размера частиц, а также дополнительный аналитический способ для подтверждения того, что дексаметазон, применяемый в СДЛДЗО, имеет предпочтительный или наиболее предпочтительный размер частиц.
В нашем изобретении размер частиц дексаметазона и распределение частиц по размеру является важным фактором, поскольку гомогенность дексаметазона влияет на характеристики высвобождения.
Также предпочтительно, чтобы дексаметазон, применяемый в настоящем изобретении, содержал в общем >1% примесей, включая >0,50% ацетата дексаметазона, >0,25% бетаметазона, >0,25% 3-кето-дельта 4-производного и >0,10% любых других примесей.
Показательная формула для обычной производственной партии 80 г (применяемой для изготовления имплантата способом таблетирования, однократной или двойной экструзии) приведена в Таблице 2. Для дозировок 350 мкг и 700 мкг способ производства и окончательной стерилизации одинаковы.
На Фиг.11 приведена схема трех различных способов производства.
2. Для изготовления имплантата применяли способ однократной экструзии. При продолжительной экструзии, способе однократной экструзии, измельченный дексаметазон и неизмельченный дексаметазон перед загрузкой в двухшнековый экструдер смешивали, а затем экструдировали при заданных температуре и скорости вращения. Волокна экструдировали в направляющем аппарате, а затем разрезали на куски точной длины, соответствующей определенному весу СДЛДЗО. Продолжительный процесс экструзии являлся более контролируемым и более управляемым, чем процесс таблетирования. Это проиллюстрировано зависимостью высвобождения СДЛДЗО in vitro, приведенной на Фиг.12.
Изучали четыре партии 700 мкг СДЛДЗО, две из которых изготовлены способом таблетирования и две способом однократной экструзии. При способе однократной экструзии между двумя дозировками единственным отличием является то, что дозировка 350 мкг отрезается от волокон одного экструдата (того же состава), что дозировка 700 мкг, однако их длина вдвое меньше. Тестировали 12 образцов СДЛДЗО из каждой серии в течение 28 дней, показания снимали в 5 различных моментов времени. Было обнаружено, что стандартное отклонение от среднего значения скорости высвобождения дексаметазона больше в случае таблетированных образцов, чем в случае экструдированных образцов. Было обнаружено также трехкратное снижение стандартного отклонения на протяжении всей кривой высвобождения в случае экструдированного продукта по сравнению с таблетированным. К тому же, начальный всплеск в высвобождении уменьшался в случае имплантатов, изготовленных способом однократной экструзии, по сравнению с имплантатами, изготовленными способом таблетирования.
Приведенные результаты подтвердили в GLP фармакокинетическом исследовании in vivo с кроликами, где произведено сравнение высвобождения дексаметазона из таблетированной и экструдированной СДЛДЗО. Было показано, что таблетированная и экструдированная СДЛДЗО высвобождают одинаковое количество дексаметазона в течение одного периода, обеспечивая доставку в течение примерно 35 дней.
Для дальнейшего выяснения характеристик и сравнения СДЛДЗО, изготовленных способами экструзии и таблетирования, использовали фотографии сканирующей электронной микроскопии (СЭМ) для оценки внешнего вида. Фиг.13 показывает, что СДЛДЗО, изготовленная способом однократной экструзии, является более однородной, чем таблетированный имплантат. Было обнаружено, что это не только обеспечивает более равномерное высвобождение in vitro из имплантата, изготовленного способом однократной экструзии, а также увеличивает устойчивость к раздавливанию. С помощью анализатора текстуры было показано, что трехкратное увеличение в силе воздействия (1200 г по сравнению с 400 г) требуется для раздавливания экструдированного имплантата по сравнению с таблетированным. Это показывает, что экструдированные имплантаты не требуют слишком бережного обращения.
Кроме того, было установлено, что СДЛДЗО, изготовленная способом однократной экструзии и способом двойной экструзии, остается стабильной в течение как минимум 12 месяцев (и до 18-24 месяцев) при хранении при 25°С/60% ОВ и как минимум в течение 6 месяцев при 40°С/75% OВ. Стабильность устанавливалась исходя из эффективности дексаметазона, примесей дексаметазона (кислота, кетон, альдегид и общие примеси), содержания влаги, усиления срабатывания аппликатора, разрушающего усилия/работы разрушения имплантата, а также кривой растворения дексаметазона in vitro и стерильности.
3. Изобретатели улучшили способ однократной экструзии следующими мерами: (1) измельчение полимера перед смешиванием и (2) добавление второго процесса экструзии после приготовления гранул из волокон, полученных после первой экструзии. После того как 50:50 СМГК кислота и 50:50 СМГК эфир измельчили, получили гомогенизированную СДЛДЗО. Гомогенность способствует более равномерному и планомерному растворению полимера и высвобождению активного агента дексаметазона. СМГК измельчали, используя воздушный жиклер. На Фиг.14 представлено межгрупповое различие по сравнению с различием внутри одной группы, взятых из партий, изготовленных из перемолотого (т.е. тонкоизмельченного) и неперемолотого (т.е. неизмельченного) СМГК. Хорошо видно, что способ двойной экструзии позволяет лучше контролировать, особенно когда различие внутри одной партии было сокращено от диапазона 94,7% ОЗ-107,0% ОЗ (неизмельченный СМГК) до 98,9% ОЗ-101,5% ОЗ (измельченный СМГК). «ОЗ» означает отмеченное значение (регуляторный термин), означающий количество дексаметазона, присутствующего в имплантате (350 мкг или 700 мкг), измеренное различными анализами in vitro, например ВЭЖХ.
Сравнивали способы однократной и двойной экструзии. Как показано на Фиг.15, имплантат, изготовленный способом двойной экструзии, обеспечивал высвобождение примерно 60% дексаметазона к 14-му дню, в то время как имплантат, изготовленный способом однократной экструзии, обеспечивал высвобождение примерно 40% от общего содержания дексаметазона к 14-му дню, хотя общее высвобожденное количество дексаметазона к 21-му дню было сопоставимым. Поскольку чаще желательно более быстрое высвобождение дексаметазона, способ двойной экструзии является более предпочтительным для производства СДЛДЗО. Способ двойной экструзии также предусмотрен для более сильного растяжения волокон имплантата, т.е. для более однородного распределения дексаметазона по всему полимеру имплантата.
Подробная схема производства имплантатов способом двойной экструзии приведена на Фиг.16. Основное оборудование, используемое при производстве СДЛДЗО, перечислено в Таблице В.
4. Особенностями способа двойной экструзии являются;
(а) Размельчение СМГК (резомеры RG502 и RG502H)
30 грамм RG502 (50:50 СМГК эфир) измельчили, используя струйную мельницу (вибрационный дозатор) при давлении измельчения 413,7 кПа, 551,6 кПа и 551,6кПа для насадки эжектора, насадки размельчителя и насадки размельчителя, соответственно. Далее, 60 г RG502H измельчили с использованием струйной мельницы при давлении измельчения 137,9 кПа, 275,8 кПа и 275,8 кПа для насадки эжектора, насадки размельчителя и насадки размельчителя, соответственно. Средний размер частиц как RG502, так и RG502H измеряли, используя анализатор размера частиц TSI 3225 Аэросайзер с цифровым процессором сигналов (ЦПС). Предпочтительно оба вида измельченного полимера должны иметь средний размер частиц не больше 20 мкм.
(б) Смешивание двух видов СМГК и дексаметазона
48 г дексаметазона, 24 г измельченного RG502H и 8 г измельченного RG502 смешали, используя турбулентный измельчитель, при 96 об/мин в течение 60 мин.
(в) Первая экструзия
(1) Все 80 г смеси дексаметазон/РС502Н/РС502 добавили в подающее устройство двойного шнекового экструдера Хаака (Haake). Экструдер Хаака включили, установив следующие параметры:
Температура барабана: 105°С
Температура насадки: 102°С
Скорость вращения: 120 об/мин
Скорость подачи: 250
Температура направляющей планки: 50-55°С
Температура циркулирующей воды водной бани: 10°С
(2) Волокна собирали. Первые волокна выходили через 15-25 мин после добавления порошковой смеси. Волокна, вышедшие в течение первых 5 минут, отбрасывали. Собирали оставшиеся волокна до полного расходования экструдата, обычно время составляло 3-5 часов.
(г) Гранулирование
Волокна после 3 стадии, описанной выше, гранулировали с помощью турбулентного шейкера и одного 19 мм стального шарика при 96 об/мин в течение 5 мин.
(д) Вторая экструзия
(1) все гранулы добавили в тот же входной карман и включили экструдер Хаака.
В экструдере Хаака установили следующие параметры:
Температура барабана: 107°С
Температура насадки: 90°С
Скорость вращения: 100 об/мин
Температура направляющей планки: 60-65°С
Температура циркулирующей воды водной бани: 10°С
(2) Все экструдированные волокна собирали до полного расходования эструдата. Обычно это занимало примерно 3 часа.
(е) Приведение волокон к соответствующей дозировке - 350 мкг или 700 мкг СДЛДЗО изготовляли в двух лекарственных формах - 350 мкг или 700 мкг посредством отрезания волокон соответствующей длины.
(ж) Введение СДЛДЗО в аппликатор
СДЛДЗО вводили в аппликаторное устройство во время процесса сборки аппликатора. Все операции производили в чистом производственном помещении 10000 класса.
(з) Упаковка аппликатора СДЛДЗО
Собранный аппликатор СДЛДЗО поместили в мешочек из фольги, содержащий маленький мешочек с поглотителем влаги, и заклеили способом термосклеивания. Образцы для тестирования перед стерилизацией биологической нагрузки отбирали до 9-й стадии.
(и) Стерилизация аппликатора СДЛДЗО гамма-излучением
Запаянные мешочки из фольги, содержащие аппликатор СДЛДЗО и небольшой мешочек с поглотителем влаги, помещали в картонную коробку и коробку склеивали. Окончательную стерилизацию коробок, содержащих продукт, проводили, облучая гамма-излучением дозой 25-40 кГрэй. Образцы из каждой партии тестировали на стерильность согласно требованиям ЕФ и ФСША.
(к) Мечение аппликатора СДЛДЗО
Имплантаты, изготовленные способом одинарной и двойной экструзии, имели следующие характеристики, приведенные в Таблицах Г и Д, соответственно.
Таблица Е суммирует другие предпочтительные воплощения как для СДЛДЗО, так и для аппликатора
Имплантаты и аппликаторы, изготовленные, как описано выше, обладали параметрами предпочтительного воплощения.
Предпочтительное воплощение аппликатора: Предпочтительный вариант аппликатора для имплантации СДЛДЗО описан в международной заявке на патент WO 2004/026106, опубликованной 1 апреля 2004 г. Аппликатор был разработан для облегчения введения имплантата в заднюю область глаза. Имплантат располагается в игле аппликатора. Аппликатор разработан для удобного расположения в руке терапевта и позволяет проводить операцию одной рукой. По размеру он соответствует щипцам для хирургии сетчатки глаза, длиной 165 мм и шириной 13 мм. На Фиг.17 показан вид аппликатора в продольном разрезе, а также типичные функции и положение всех элементов.
При повороте ручки управления прикладывается сила на сцепление, которое ослабляет и передвигает плунжер по направлению к игле, выталкивая СДЛДЗО в заднюю камеру глаза. Как только СДЛДЗО доставлена, ручка затем задвигается в корпус аппликатора, показывая то, что аппликатор использован, и препятствуя вторичному использованию. Игла, используемая в аппликаторе, является тонкостенной 22-размерной подкожной иглой. Силиконовое кольцо, помещенное в канавку иглы, удерживает СДЛДЗО внутри иглы и остается вне глаза, в контакте с конъюнктивой. Для того чтобы воздух не проник в глаз, аппликатор разработан с отводом воздуха. Небольшая щель между СДЛДЗО и внутренней стенкой иглы позволяет воздуху передвигаться к щели и выходить из нее, как только СДЛДЗО доставлена. Маленький размер этой щели предотвращает вытекание жидкости глаза через иглу. Частями аппликатора, которые могут контактировать с пациентом, являются плунжер, игла и кольцо. Плунжер и игла изготовлены из материалов, считающихся биосовместимыми и давно применяющихся в медицине. Биосовместимость кольца установили с помощью теста на цитотоксичность.
Аппликатор упаковывается с поглотителем влаги в мешок, разработанный для защиты имплантата от влаги. Упакованный имплантат в аппликатор затем стерилизуется гамма-излучением. Мешок также гарантирует стерильность продукта в течение срока хранения.
СДЛДЗО окончательно стерилизуется гамма-излучением в своем аппликаторе, запакованном в мешок из фольги, используя дозу от 25 до 40 кГрэй. Способ окончательной паровой стерилизации (автоклавирование) не используется, поскольку полимеры, применяемые для контролируемого высвобождения, чрезвычайно чувствительны к влаге и нагреванию и разлагаются даже при ненормативных стерилизационных циклах с низкой температурой.
Аппликатор СДЛДЗО является стерильным, для одноразового использования, предназначен для доставки одной СДЛДЗО. СДЛДЗО загружается в иглу аппликатора на стадии сборки. Затем он упаковывается в мешок из фольги с поглотителем влаги и окончательно стерилизуется гамма-излучением.
Все публикации, патенты и заявки на патент, упоминаемые здесь, приводятся здесь как ссылки, в полном объеме для всех целей и в том же самом объеме, как и для отдельной индивидуальной публикации, патента или заявки на патент, специально и отдельно отмеченной здесь в качестве ссылки. Хотя вышеприведенное изобретение было описано в некоторых деталях с помощью иллюстраций и примеров, в целях ясности изложения специалисты в данной области в свете данного изложения понимают, что могут быть сделаны определенные изменения и модификации изобретения без отклонения от сущности и объема прилагаемой формулы изобретения.
Реферат
Изобретение относится к области медицины, в частности к офтальмологии. Изобретение характеризует изготовление биодеградируемых имплантатов путем двойной экструзии, подходящих по размеру для имплантации в глазничную область, чтобы, по меньшей мере, 75% частиц активного агента имели диаметр менее 10 или 20 микрон, и способ лечения патологического состояния глаза с помощью изготовленного биодеградируемого имплантата. Имплантаты изготовлены из смеси СМГК с гидрофильными и гидрофобными концами. Изобретение обеспечивает доставку активных агентов в глазничную область без высвобождения с резким выбросом. 2 н. и 12 з.п. ф-лы, 10 табл., 17 ил.
Формула
(а) измельчение биодеградируемого полимера, представляющего собой сополимер молочной и гликолевой кислот (СМГК);
(б) смешивание измельченного СМГК и частиц активного агента для получения смеси измельченного СМГК и частиц активного агента, где по меньшей мере примерно 75% частиц активного агента имеют диаметр менее примерно 20 мкм;
(в) выполнение первой экструзии смеси с получением продукта первой экструзии;
(г) гранулирование продукта первой экструзии, и;
(д) выполнение второй экструзии гранулированного продукта первой экструзии с получением биодеградируемого имплантата для лечения патологического состояния глаза.
Документы, цитированные в отчёте о поиске
Микрочастицы, включающие соли пептидов с полиэфирами, имеющими концевые карбоксигруппы, и содержащие их композиции
Биоматериал для предотвращения послеоперационных спаек, включающий производные гиалуроновой кислоты (варианты) и способ предотвращения послеоперационных спаек ткани

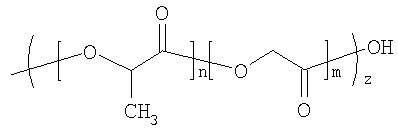

Комментарии