Биодеградируемые системы доставки лекарственных средств для долговременного высвобождения белков - RU2676102C2
Код документа: RU2676102C2
Чертежи



Описание
ПЕРЕКРЕСТНАЯ ССЫЛКА НА РОДСТВЕННЫЕ ЗАЯВКИ
В данной заявке заявлен приоритет по предварительной заявке на патент США №61/706516, зарегистрированной 27 сентября 2012 г., описание которой включено в данный документ в полном объеме посредством ссылки.
ОБЛАСТЬ ТЕХНИКИ
Данное изобретение относится к биодеградируемым имплантатам с долговременным высвобождением белка в ткань млекопитающих. Имплантаты разработаны для обеспечения долговременной доставки белка, такого как антитело, в биологически активной форме in vivo в течение по меньшей мере одного месяца (30 дней или более). Имплантаты пригодны для лечения патологических состояний глаз (включая болезни глаз), поражающих передний и задний отрезки глаза, а также медицинских патологических состояний, поражающих области и ткани всего тела. Конкретные примеры включают имплантаты, разработанные для внутриглазного или внутрисуставного применения. Также описаны способы получения долговременно-высвобождающих белоксодержащих имплантатов.
ПРЕДШЕСТВУЮЩИЙ УРОВЕНЬ ТЕХНИКИ
Существует большой интерес к созданию инъекционных биосовместимых композиций, которые могут обеспечивать длительное высвобождение белка. Особенно желательна разработка биосовместимых и биодеградируемых композиций, которые высвобождают биологически активный белок на терапевтических уровнях с контролируемой скоростью в течение одного, двух, трех месяцев или более.
Биодеградируемые композиции, такие как внутриглазные имплантаты, способные доставлять функциональные белки на терапевтических уровнях в течение длительных периодов, могут быть крайне полезны для лечения болезни глаз, при которых использование белков, таких как антитела, как правило, требует частых внутриглазных инъекций или высоких общих доз.
Помимо дискомфорта и затрат времени, связанных с частыми инъекциями, прямые внутриглазные инъекции могут повлечь за собой определенные риски для пациента, включая отслоение сетчатки, повреждение хрусталика и инфекцию. Прямая внутриглазная инъекция может привести также к местной токсичности вследствие высоких импульсных концентраций лекарственного белка в хрусталике и других внутриглазных тканях. Кроме того, проникновение в сетчатку белков, вводимых системно, в значительной степени ограничено гематоретинальными барьерами (ГРБ).
Соединения, как правило, элиминируются из стекловидного тела глаза путем диффузии в ретрозонулярное пространство с выведением с помощью водянистой влаги или путем транс-ретинальной элиминации. Большинство высокомолекулярных соединений используют первый путь, тогда как липофильные соединения и соединения с транс-ретинальными транспортными механизмами - второй путь. К сожалению, соединения, которые элиминируются через сетчатку, обладают чрезвычайно короткими периодами полувыведения. Поэтому, для таких соединений сложно поддерживать терапевтические концентрации с помощью прямой внутриглазной инъекции. Для этого необходимы частые инъекции. Даже для макромолекул, таких как белки, которые выводятся с помощью водянистой влаги, период полувыведения в стекловидном теле мал по сравнению с длительностью терапии. Поэтому такие препараты как LUCENTIS® необходимо вводить с частотой раз в месяц путем интравитреальной инъекции.
Следовательно, было бы очень полезно избавить пациентов от необходимости в частых инъекциях белков с помощью разработки биодеградируемых имплантатов, которые могут обеспечивать безопасное, эффективное и длительное высвобождение биологически активного белка из единичной дозы, при этом избегая высоких кратковременных концентраций, связанных с импульсной дозировкой.
КРАТКОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Техническая задача, на решение которой направлено настоящее изобретение, заключается в получении биодеградируемого внутриглазного имплантата, обеспечивающего долговременную доставку белка в ткань млекопитающих в биологически активной форме in vivo в течение по меньшей мере одного месяца.
Полученные имплантаты позволяют осуществлять успешную доставку белка с улучшенным профилем высвобождения в течение нескольких месяцев.
Соответственно, в некоторых вариантах реализации данное изобретение предлагает биодеградируемые системы доставки лекарственных средств (СДЛС), в которых терапевтически эффективное количество биологически активного белка может высвобождаться in vivo в течение месяца или более, двух месяцев или более или трех месяцев или более (т.е. 90 дней или более).
Биодеградируемые системы доставки лекарственных средств могут содержать, состоять из или состоять преимущественно из биодеградируемой полимерной матрицы и белка, связанного с биодеградируемой полимерной матрицей. Примеры биодеградируемых систем доставки лекарственных средств в пределах объема данного изобретения включают экструдированные волокна (т.е. имплантат, полученный с помощью процесса экструзии) и прессованные таблетки.
Например, биодеградируемая система доставки лекарственных средств может быть в форме экструдированного волокна, полученного с помощью единичного или двойного процесса экструзии. Экструдированному волокну можно придать конфигурацию и размер, подходящие для размещения в глазе млекопитающего, в частности в глазничной области глаза. Такое волокно может называться "внутриглазным имплантататом", "биодеградируемым внутриглазным имплантатом" или более точно "экструдированным биодеградируемым внутриглазным имплантатом". Экструдированным волокнам можно придать конфигурацию, подходящую для размещения во внутрисуставной области для лечения заболевания или медицинского патологического состояния. Такие волокна могут называться "внутрисуставным имплантатом". Экструдированное волокно может быть твердым, полутвердым или вязкоупругим.
Соответственно, в одном варианте реализации данное изобретение предлагает биодеградируемые внутриглазные имплантаты, содержащие или состоящие из биодеградируемой полимерной матрицы и белка, связанного с биодеградируемой полимерной матрицей, причем имплантат обеспечивает непрерывное высвобождение белка в биологически активной форме по меньшей мере в течение 30, 60 или 90 дней после введения имплантата в глаз млекопитающего. В конкретном варианте реализации данное изобретение предлагает биодеградируемые внутриглазные имплантаты, содержащие биодеградируемую полимерную матрицу и белок, связанный с биодеградируемой полимерной матрицей, причем имплантат обеспечивает непрерывное высвобождение белка в биологически активной форме в течение более чем 3 месяцев после введения имплантата в глаз млекопитающего. Белок может быть инкапсулирован и/или диспергирован в биодеградируемой полимерной матрице. Белок может быть распределен в полимерной матрице равномерно и неравномерно. Имплантат может содержать один белок или первый и второй белки, как например, первое и второе антитела, направленные против первого и второго целевых белков, причем антитела сконструированы так, что связывают и блокируют активность первого и второго целевых белков in vivo. Одним из примеров является имплантат, содержащий антитело DARPin (сконструированный белок с анкириновыми повторами) или антикалин, который специфически связывает (другими словами, специфичен к) фактор роста эндотелия сосудов (VEGF) или фактор роста тромбоцитов (PDGF). Например, имплантат согласно данному изобретению может содержать анти-VEGF или анти-PDGF-антитело или оба анти-VEGF- и анти-PDGF-антитела.
Неограничивающие примеры белков, которые могут быть включены в и поэтому доставлены с помощью внутриглазного или внутрисуставного имплантата, включают моноклональные и поликлональные антитела, биспецифические антитела, фрагменты антител, антикалины, белки DARPin и ферменты. Другие примеры включают гликопротеины и сывороточные альбумины. Моноклональное или поликлональное антитело может применяться в его природной форме, как, например, производимая клетками или может содержать или не содержать посттрансляционные модификации или может применяться в химически или ферментативно измененной форме, полученной после его выделения из культуры клеток или другого биологического образца. Антитело может быть гибридным. В конкретных вариантах реализации изобретения антитело может представлять собой IgA, IgD, IgE, IgG или IgM. Подходящие фрагменты антител включают полученные путем расщепления антитела папаином (т.е. Fab-фрагмент) или пепсином. В целом, подходящие фрагменты антител включают фрагменты Fab', F(ab)2, Fabc и Fv. Фрагменты антител могут или быть получены путем модификации полных антител или синтезированы de novo с использованием методологии рекомбинантной ДНК, и дополнительно включают "гуманизированные" антитела, полученные по общепринятым методам. "Фрагменты антител" содержат участок полноразмерного антитела, как правило, его антигенсвязывающий или вариабельный домен.
В некоторых вариантах данное изобретение предлагает биодеградируемые имплантаты, содержащие анти-VEGF-антитело или белок (т.е. антитело или белок, который специфично связывается с белком фактора роста эндотелия сосудов, или VEGF-A). Подходящие анти-VEGF-антитела включают, но не ограничиваясь ими, ранибизумаб (LUCENTIS®) и бевацизумаб (AVASTIN®). Подходящие анти-VEGF белки включают афлиберцепт (Eylea®) (также известный как VEGF TRAP), VEGF-связывающие белки DARPin и VEGF-связывающие антикалины. VEGF Trap (Regeneron Pharmaceuticals, Нью-Йорк) представляет собой рекомбинантный белок, который содержит участки внеклеточных доменов двух различных VEGF-рецепторов, связанных с Fc-областью (С-концевая) антитела человека. В некоторых вариантах реализации изобретения имплантат может содержать антитело, выбранное из группы, состоящей из анти-VEGF-антител, анти-рецептор VEGF-антител, анти-PDGF (фактор роста тромбоцитов)-антител, анти-интегрин-антител, их терапевтически эффективные фрагменты и комбинации.
В другом варианте реализации данное изобретение предлагает биодеградируемые имплантаты, полученные экструзией, содержащие анти-TNF (фактор некроза опухолей)- антитело или белок. Подходящие анти-TNF-антитела включают, но не ограничиваясь ими, адалимумаб (HUMIRA®), инфликсимаб (REMICADE®), цертолизумаб пегол (CIMZIA®) и голимумаб (SIMPONI®). Подходящие анти-TNF-белки включают рекомбинантный белок этанерцепт (ENBREL®). Имплантаты, содержащие анти-TNF-белки, могут быть в частности полезны для лечения увеита и болезни Бехчета.
Другие белки, подходящие для включения во внутриглазые или внутрисуставные имплантаты согласно данному изобретению включают факторы роста, такие как факторы роста нервов, кислотные факторы роста фибропластов и основные факторы роста фибропластов; нейротрофические факторы, такие как цилиарный нейротрофический фактор, нейротрофический фактор головного мозга и нейротрофический фактор глиальной клеточной линии; цитокины, такие как интерферон гамма и интердейкин 10; противопролиферативные соединения, такие как ритуксимаб; и фибринолитический белок, такой как тканевой активатор плазминогена. В целом, терапевтические применения таких белков могут быть известны в данной области.
Таким образом, биодеградируемые внутриглазные или внутрисуставные имплантаты согласно данному изобретению могут содержать антитело, выбранное из группы, состоящей из анти-VEGF-антител (антитела, которые специфично связываются с VEGF), анти-PDGF-антител, анти- рецептор VEGF-антител, анти-интегрин-антител, их терапевтически эффективные фрагменты и комбинации.
Фактор роста эндотелия сосудов A (VEGF-A, также именуемый VEGF) представляет собой секретированный митоген, специфичный для эндотелиальных клеток сосудов, который может стимулировать рост эндотелиальных клеток in vitro и развитие кровеносных сосудов in vivo. VEGF-A может находиться в различных изоформах. Все изоформы VEGF-A, за исключением VEGF-A121, связываются с гепарином. Наиболее распространенной изоформой VEGF-А у людей является полипептид, состоящий из 165 аминокислот, VEGF-A165. См., например Houck et al., Mol. Endocrin. 5:1806 (1991) и Leung et al., Science 246:1306 (1989).
Соответственно, в некоторых вариантах настоящего изобретения предложены биодеградируемые имплантаты, состоящие из биодеградируемой полимерной матрицы и антитела, DARPin или антикалина, который связывается с VEGF-A165. Одно и то же антитело, DARPin или антикалин могут распознавать и связывать все изоформы VEGF-А, так как антитело, DARPin или антикалин могут распознавать эпитоп, присутствующий во всех изоформах VEGF-A. Например, антитело, DARPin или антикалин могут распознавать и специфически связывать эпитоп в области связывающих доменов VEGF-A-рецептора, присутствующих во всех изоформах VEGF-А, включая VEGF121. Соответственно, одно анти-VEGF антитело (или DARPin, или антикалин) в имплантате по данному изобретению может распознавать и специфически связывать все изоформы VEGF-A. Описаны антитела, включая моноклональные антитела и гуманизированные анти-VEGF антитела, которые связываются с VEGF-A или VEGF-рецептором. См., например Патент США 5955311 и Патент США 6884879. Бевацизумаб является одним из примеров моноклонального антитела, которое специфически связывается с и ингибирует VEGF-A человека. Также описаны ингибирующие антитела, направленные против PDGF. См., например, WO 2003/025019.
Биодеградируемые имплантаты с пролонгированным высвобождением активного вещества, содержащие ингибитор VEGF (фактор роста эндотелия сосудов) или фактора роста тромбоцитов (PDGF) (или оба), такой как антитело или комбинацию антител, которое(ые) специфически связывает(ют) VEGF и/или PDGF in vivo, могут в частности применяться для лечения дистрофии желтого пятна (включая влажную возрастную дистрофию желтого пятна), ретинопатии, диабетической ретинопатии, пролиферативной диабетической ретинопатии, серповидно-клеточной ретинопатии, ретролетальной фиброплазии, ишемеческой ретинопатии, глазной неоваскуляризации (аномального роста новых кровеносных сосудов в глазе), хороидальной неоваскуляризации, неоваскуляризации вследствие окклюзии вены сетчатки, роговичной неоваскуляризации, диабетической ретинальной ишемии и отека желтого пятна у пациентов, которые нуждаются в лечении.
В одном варианте реализации изобретения предложены биодеградируемые внутриглазные имплантаты, состоящие из биодеградируемой полимерной матрицы, а также первого и второго антител, или биспецифического антитела, которое специфически связывает VEGF и PDGF, соответственно, причем имплантат обеспечивает непрерывное высвобождение первого и второго антител или биспецифического антитела в биологически активной форме в течение по меньшей мере 30, 60 или 90 дней после введения имплантата в глаз млекопитающего. В одной форме, антитела или биспецифическое антитело специфичны по отношению к фактору роста эндотелия сосудов-А (VEGF-A) и фактору роста тромбоцитов-В (PDGF-B). Эти имплантаты могут применяться при лечении глазных опухолей, глазной неоваскуляризации, хороидальной неоваскуляризации и дистрофии желтого пятна. Под "PDGF-B" понимают В полипептидную цепь PDGF.
Данные имплантаты сконструированы таким образом, чтобы поддерживать биологическую активность антитела, так что когда антитело высвобождается из системы, оно специфично связывается с соответствующим целевым белком. Связывание антитела с целевым белком может мешать взаимодействию между белком и его лигандом или рецептором, и, таким образом, с помощью антитела может быть ингибирована или ослаблена функция, которая опосредуется путем взаимодействия белок/рецептор. В данной области известно несколько методов для определения того, связывается ли антитело специфично, или оно "иммунореактивно" с целевым белком (полипептидом). Несколькими примерами являются иммунохемилюминометрический анализ (ICMA), твердофазный иммуноферментный анализ (ELISA) и радиоиммунологический анализ (RJA).
В некоторых вариантах реализации изобретения предложены биодеградируемые имплантаты, полученные экструзией, содержащие биодеградируемую полимерную матрицу и одно или более моноклональных антител, биспецифичных антител, белков DARPin, антикалинов, фрагментов антител, рекомбинантных полипетидов, полученных из вариабельной области антитела, или их смеси, которые взаимодействуют с (т.е. связываются с и понижают или ингибируют активность) VEGF или фактором роста тромбоцитов (PDFG), или как с VEGF, так и с PDFG. Например, в изобретении предложены биодеградируемые имплантаты, полученные экструзией, содержащие биодеградируемую полимерную матрицу и биспецифическое антитело, которое специфически связывает VEGF и PDFG, причем имплантат обеспечивает непрерывное высвобождение антитела в биологически активной форме в течение по меньшей мере 90 дней после введения имплантата в глаз млекопитающего. В других вариантах реализации изобретения имплантат по данному изобретению может содержать биодеградируемую полимерную матрицу и антитело, специфичное к VEGF-рецептору.
Моноклональные антитела, пригодные для настоящих препаратов доставки лекарственных средств, могут быть получены с использованием рутинных методов, известных специалистам в данной области. Кратко, животным, таким как мыши, вводили требуемый целевой белок или его часть (антиген), такой как VEGF или VEGFR. Целевой белок преимущественно связывается с белком-носителем. Животным повторно вводят инъекции одного или более целевых белков и гипериммунизируют с помощью внутривенной (ВВ) бустер-инъекции за 3 дня до слияния. Клетки селезенки мышей изолируют и проводят слияние с миеломными клетками по стандартным методикам. Гибридомы могут быть отобраны в стандартной гипоксантиновой/аминоптериновой/тиминовой (HAT) среде согласно стандартным методикам. Гибридомы, выделяющие антитела, которые распознают целевой белок, идентифицированы, культивированы и субклонированы с использованием стандартных иммунологических методов, а антитела очищали, например, с помощью аффинной хроматографии. В некоторых вариантах реализации данных систем доставки, анти-VEGF или анти-VEGFR моноклональное антитело получено от ImClone Systems, Inc. (NY, NY). Например, настоящие препараты могут включать антитело, имеющееся у ImClone Systems под названием IMC-18F1, или антитело под названием IMC-1121 Fab. Другим анти-VEGF фрагментом антитела, который может применяться в настоящих лекарственных препаратах является ранибизумаб, Fab-фрагмент, который связывает VEGF-A. Другим анти-VEGF антителом, пригодным для настоящих систем доставки лекарственных средств является бевацизумаб, моноклональное антитело, которое связывает VEGF-А.
В некоторых вариантах реализации изобретения белок (белки) в системах доставки лекарственных средств (например, внутриглазной или внутрисуставный имплантат) могут быть по меньшей мере 20, по меньшей мере 30, по меньшей мере 50, по меньшей мере 100, по меньшей мере 200, по меньшей мере 300 аминокислот в длину. В некоторых вариантах реализации изобретения белок содержит три или более аминокислоты. В некоторых случаях белок может быть длиной от 30 до 50 аминокислот или от 100 до 500 аминокислот.В некоторых формах изобретения белок может иметь молекулярную массу менее чем 5 килодальтон (кДа). В других формах белки могут иметь молекулярную массу выше чем 5 кДа, выше чем 10 кДа, выше чем 20 кДа, выше чем 50 кДа, выше чем 100 кДа. В некоторых формах изобретения белок может иметь молекулярную массу от 10 до 30 кДа или от 20 до 50 кДа. Например, белок может иметь молекулярную массу от 14 до 16 кДа или от 14 до 21 кДа. Белок может быть линейным, разветвленным или кольцевым и может быть синтезированным химически (с использованием, например, твердофазного синтеза), природным, или рекомбинантно полученным. Белок может быть гибридным. Белок может быть усеченным по сравнению со встречающейся в природе формой. Белок может содержать не более чем одну аминокислотную цепь или две, или более аминокислотных цепей. Две или более цепей могут быть ковалентно или нековалентно связаны друг с другом. Например, аминокислотные цепи могут быть связаны посредством дисульфидных связей, или две или более цепей могут быть связаны друг с другом только посредством нековалентных связей. Белок может содержать или не содержать синтетически или посттрансляционно модифицированные аминокислоты. Белки, используемые в настоящих имплантатах, могут быть получены рекомбинантно (с помощью культуры клеток млекопитающих или прокариот), синтетически (например, с помощью твердофазного синтеза) или выделены из природных источников (т.е. культур клеток млекопитающих или бактерий, плазмы, сыворотки, растения, гриба и тому подобного). Одна или более аминокислот в белке могут не встречаться в природе.
Биодеградируемые внутриглазные или внутрисуставные имплантаты согласно данному изобретению могут содержать от около 1% до около 50% белка от массы имплантата (т.е. массовые %), от около 5% до около 30% белка от массы имплантата, от около 5% до около 40% белка от массы имплантата, от около 10% до около 25% белка от массы имплантата или около 5%, 10%, 20% или 30% белка от массы имплантата.
В дополнение к белку и биодеградируемой полимерной матрице, имплантат может содержать одно или более вспомогательных веществ, солей, буферных агентов, консервантов, полиэлектролитов или их комбинации.
Подходящие вспомогательные вещества включают углеводы, такие как трегалоза (например, трегалоза, α,α-трегалозы дигидрат), инулин и сахароза; поверхностно-активные вещества, такие как полисорбат 20, полисорбат 80 и плюроник F127; полиэтиленгликоли, такие как полиэтиленгиколь 3350 (ПЭГ 3350); аминокислоты, такие как глицин, аспарагиновые кислоты, глутаминовые кислоты, аргинин, лизин и гистидин; хелатирующие агенты, такие как безводная динатриевая соль этилендиаминтетрауксусной кислоты; многоатомные спирты, такие как глицерин, сорбит и маннит; холестерин; альбумины; циклодекстрины; декстраны; поливиниловый спирт; глицерин; хлорид цинка и их комбинации. Вспомогательное вещество (или вещества) может присутствовать в имплантате в количестве от 0,01 масс. % до 30 масс. %, от 0,01 до 20 масс. % или от 0,01 до около 15 масс. %.
Подходящие водорастворимые буферные агенты могут включать, без ограничений, карбонаты, фосфаты, гидрокарбонаты, цитраты, бораты, ацетаты, сукцинаты и т.д. щелочных и щелочноземельных металлов, такие как фосфат натрия (т.е. фосфат мононатрия (NaH2PO4) и фосфат динатрия (Na2HPO4), цитрат натрия, борат натрия, ацетат натрия, гидрокарбонат натрия, карбонат натрия и тому подобное. Эти вещества преимущественно присутствуют в количествах, достаточных для поддержания рН системы между 2 и 9 или конкретнее, между 4 и 8. Буферный агент может присутствовать в имплантате в количестве от 0,01 до 10 масс. %, как, например, от около 0,01 до 5 масс. %.
Подходящие водорастворимые консерванты включают гидросульфит натрия гидросульфат, натрия, тиосульфат натрия, аскорбат, хлорид бензалкония, хлорбутанол, тиомерсал, ацетат фенилртути, борат фенилртути, нитрат фенилртути, парабен, метилпарабен, поливиниловый спирт, бензиловый спирт, фенилэтанол и тому подобное и их смеси. Эти вещества могут присутствовать в имплантате в количестве от 0,001 до около 5 масс. %, как, например, от 0,01 до около 2 масс. %.
Подходящие полиэлектролиты включают полиаргинин, полигистидин, полилизин, протамин, гистоны, полимиксин В сульфат, полиаллиламин, полиэтиленимин, диэтиламиноэтилдекстран, каррагенаны, хондроитин сульфаты, альгинат сульфаты, декстран сульфаты, гепарин, полистиролсульфонат, поливинилсульфат и полифосфат.
Подходящие соли включают NaCl, KCl, MgCl2 и тому подобное.
Биодеградируемая полимерная матрица может содержать поли(D,L-лактид), поли(D,L-лактид-ко-гликолид) (PLGA) и их комбинации. В некоторых вариантах реализации изобретения матрица содержит смесь первого и второго PLGA-сополимеров. Первый PLGA-сополимер может иметь сложноэфирную концевую группу, а второй PLGA-сополимер может иметь кислотную концевую группу. Конкретнее, первый PLGA-сополимер может быть RESOMER® RG752S, а второй PLGA-сополимер может быть RESOMER® RG502H. В одном конкретном варианте реализации изобретения соотношение массы RG752S к массе RG502H в системе Доставки лекарственных средств (например, в экструдированном имплантате) составляет около 90 к 10. В другом варианте реализации изобретения первый PLGA-сополимер может быть RESOMER® RG753S, а второй PLGA-сополимер может быть RESOMER® RG502H. В используемой форме соотношение массы RG753S к массе RG502H в экструдированном имплантате составляет около 90 к 10.
В некоторых вариантах реализации изобретения имплантат может дополнительно содержать рассасывающийся полимер. Рассасывающийся полимер является полимером, который растворяется, но не деградирует in vivo. Соответственно рассасывающийся полимер является, как правило, водорастворимым. Одним из примеров рассасывающегося полимера является полиэтиленгликоль 3350 (ПЭГ 3350).
Некоторые предпочтительные характеристики полимеров или полимерных материалов, используемых в данном изобретении, могут включать биосовместимость, совместимость с терапевтическим компонентом, простоту использования полимера при производстве систем доставки лекарственных средств по данному изобретению, период полуразложения в физиологической среде, составляющий по меньшей мере 6 часов, предпочтительно более чем около один день, незначительное повышение вязкости стекловидного тела и нерастворимость в воде.
Биодеградируемые полимеры, которые используют для образования матрицы, выбирают исходя из ферментной и гидролитической нестабильности. Степень стабильности может варьироваться в широком интервале, в зависимости от выбора мономера, от того, используется ли гомополимер или сополимер, используемой смеси полимеров и от того, содержит ли полимер концевые кислотные группы.
Полимерная матрица может содержать или состоять из биодеградируемого полимера или комбинации первого или второго полимеров. В дополнение к одному или более полимерам или в дополнение к одному или более белкам, связанным с матрицей, полимерная матрица может необязательно дополнительно содержать одно или более вспомогательных веществ, солей, буферных агентов, консервантов или полиэлектролитов, примеры которых приведены выше.
Полилактид, или PLA включает поли(D-лактид), поли(L-лактид) и поли(D,L-лактид), а также может быть идентифицирован по номеру CAS 26680-10-4 и представлен формулой:

Поли(лактид-ко-гликолид) или PLGA включает поли(D,L-лактид-ко-гликолид), также идентифицируемый по номеру CAS 26780-50-7, и может быть представлен формулой:

Таким образом, поли(D,L-лактид-ко-гликолид) является сополимером, который содержит один или более блоков повторяющихся единиц D,L-лактида и один или более блоков повторяющихся единиц гликолида, причем размер и количество соответствующих блоков может варьироваться. Молярный процент каждого мономера (повторяющейся единицы) в сополимере поли(лактид-ко-гликолиде) (PLGA) может быть 0-100%, около 15-85%, около 25-75% или около 35-65%. В некоторых вариантах реализации изобретения молярное соотношение D,L-лактида и гликолида может составлять около 50:50 или около 75:25.
Полимер PLA и/или PLGA, включенный в полимерную матрицу, может содержать сложноэфирную или свободную кислотную карбоксильную концевые группы.
Полимеры PLA и PLGA RESOMER® имеются в наличии у Evonik Industries AG, Германия.
RESOMER® R203H представляет собой поли(D,L-лактид), имеющий кислотную концевую группу и характеристическую вязкость 0,25-0,35 дл/г, измеренную для 0,1% (отношение массы к объему) раствора в хлороформе (CHCl3) при 25°С.
RESOMER® RG502 представляет собой поли(D,L-лактид-ко-гликолид), имеющий сложноэфирную концевую группу, характеристическую вязкость 0,16-0,24 дл/г (измеренную для 0,1% (отношение массы к объему) раствора в хлороформе при 25°С) и соотношение D,L-лактид : гликолид равное около 50:50.
RESOMER® RG502H представляет собой поли(D,L-лактид-ко-гликолид), имеющий кислотную концевую группу, и характеристическую вязкость 0,16-0,24 дл/г (измеренную для 0,1% (отношение массы к объему) раствора в хлороформе при 25°С) и соотношение D,L-лактид : гликолид равное около 50:50.
RESOMER® RG503H представляет собой поли(D,L-лактид-ко-гликолид), имеющий кислотную концевую группу, характеристическую вязкость 0,32-0,44 дл/г (измеренную для 0,1% (отношение массы к объему) раствора в хлороформе при 25°С) и соотношение D,L-лактид : гликолид равное около 50:50 (RESOMER®RG503H).
RESOMER®RG753S представляет собой поли(D,L-лактид-ко-гликолид), имеющий сложноэфирную концевую группу, характеристическую вязкость 0,32-0,44 дл/г (измеренную для 0,1% (отношение массы к объему) раствора в хлороформе при 25°С) и соотношение D,L-лактид : гликолид равное около 75:25.
RESOMER®RG752S представляет собой поли(D,L-лактид-ко-гликолид), имеющий сложноэфирную концевую группу, характеристическую вязкость 0,16-0,24 дл/г (измеренную для 0,1% (отношение массы к объему) раствора в хлороформе при 25°С) и соотношение D,L-лактид : гликолид равное около 75:25.
Имплантат согласно данному изобретению может обеспечивать непрерывное высвобождение терапевтически эффективного количества биологически активного белка в течение по меньшей мере одного, двух или трех месяцев после введения системы в глазничную или внутрисуставную область. Белок, такой как антитело, может высвобождаться из имплантата путем диффузии, эрозии, растворения или осмоса.
Количество белка (такого как антитело) в биодеградируемом имплантате для целей данного изобретения может быть количеством, необходимым для уменьшения одного или более симптомов патологических состояний глаза или сустава. Такое количество может находиться, например, между около 20 мкг и около 500 мкг белка или более. Кроме того, имплантат (такой как экструдированный имплантат) должен преимущественно высвобождать терапевтически эффективное количество белка в течение длительного периода, который может составлять 30 или 90 дней или более. Терапевтически эффективное количество белка может высвобождаться со скоростью от около 0,5 мкг белка/день до около 4 мкг белка/день. В некоторых случаях терапевтически эффективное количество белка может высвобождаться со скоростью от около 0,5 мкг белка/день до около 2 мкг белка/день. Например, имплантаты могут обеспечивать терапевтически эффективное количество антитела при высвобождении около 2 мкг белка/день. Кроме того, имплантат может обеспечивать терапевтический эффект в течение более чем 3 месяцев не только за счет непрерывного высвобождения белка в течение одного, двух или трех месяцев или более, но также вследствие остаточного эффекта белка в глазу или ткани, в которые имплантат был установлен.
Количество белка, которое непрерывно высвобождается в течение по меньшей мере одного, двух или трех месяцев может быть количеством, терапевтически эффективным для лечения патологических состояний глаза (включая патологические состояния переднего и заднего отрезка глаза) или суставных заболеваний или патологических состояний.
Экструдированному волокну согласно данному изобретению можно придать размер и конфигурацию, пригодные для введения в глазничную область глаза, включая стекловидное тело, переднюю камеру или субконъюнктивальное пространство. Экструдированное волокно может быть палочкообразным или нецилиндрическим.
Биодеградируемая полимерная матрица волокна может содержать не более одного биодеградируемого полимера или может содержать смесь двух или более биодеградируемых полимеров. Например, имплантат может содержать смесь первого и второго биодеградируемых полимеров, причем первый полимер отличается от второго полимера. Полимер может отличаться от другого полимера концевой группой, характеристической вязкостью или повторяющейся единицей полимера или любой комбинацией этих признаков. Один или более биодеградируемых полимеров могут иметь кислотные концевые группы. Например, первый биодеградируемый полимер может быть с кислотной концевой группой (иметь кислотную концевую группу), а второй биодеградируемый полимер может быть со сложноэфирной концевой группой (иметь сложноэфирную концевую группу). В другом варианте реализации изобретения биодеградируемая полимерная матрица содержит первый, второй и третий биодеградируемые полимеры.
Соответственно, одним из примеров системы доставки лекарственных средств согласно данному изобретению является экструдированное волокно (например, внутриглазной или внутрисуставной имплантат), содержащее антитело и биодеградируемую полимерную матрицу, причем полимерная матрица содержит смесь первого и второго биодеградируемых полимеров, а волокно высвобождает терапевтически эффективное количество антитела в биологически активной форме в течение по меньшей мере около одного месяца от момента введения волокна в глазничную или внутрисуставную область. В конкретных вариантах реализации изобретения волокно высвобождает терапевтически эффективное количество биологически активного антитела в течение по меньшей мере около одного, двух или по меньшей мере около трех месяцев от момента введения волокна в глазничную или внутрисуставную область.
Другим примером является экструдированное волокно, содержащее антитело и биодеградируемую полимерную матрицу, причем полимерная матрица состоит из не более одного биодеградируемого полимера, а волокно высвобождает терапевтически эффективное количество антитела в биологически активной форме в течение по меньшей мере около одного месяца или по меньшей мере около двух или трех месяцев от момента введения волокна в глазничную или внутрисуставную область.
Как было объяснено ранее, независимо от того, содержит волокно один или более чем один биодеградируемый полимер, оно может, тем не менее, дополнительно содержать одно или более вспомогательных веществ, солей, буферных агентов, консервантов или полиэлектролитов, которые могут улучшать стабильность и/или регулировать скорость высвобождения антитела из волокна. Регулирование высвобождения может проявляться в форме более линейной скорости высвобождения и/или более длительного периода высвобождения по сравнению с тем же волокном без одного или более вспомогательных веществ, солей, буферных агентов, консервантов или полиэлектролитов. Подходящие вспомогательные вещества, соли, буферные агенты, консерванты или полиэлектролиты были описаны выше и включают полисорбат 20, трегалозу и фосфат натрия.
В волокнах, содержащих смесь первого и второго биодеградируемых полимеров, первый и второй полимер могут быть независимо выбраны из группы, состоящей из сополимеров поли(D,L-лактид-ко-гликолида) со сложноэфирными концевыми группами и сополимеров поли(D,L-лактид-ко-гликолида) с кислотными концевыми группами. В конкретном варианте реализации изобретения соотношение массы сополимеров со сложноэфирными концевыми группами к массе сополимеров с кислотными концевыми группами в имплантате составляет около 90:10.
В волокнах, содержащих единственный биодеградируемый полимер и никаких других биодеградируемых полимеров, единственный биодеградируемый полимер может быть выбран из группы, состоящей из сополимеров поли(D,L-лактид-ко-гликолида) со сложноэфирными концевыми группами (сополимеры PLGA, имеющие сложноэфирные концевые группы) и сополимеров поли(D,L-лактид-ко-гликолида) с кислотными концевыми группами (сополимеры PLGA, имеющие кислотные концевые группы).
В любом из вышеупомянутых вариантов реализации изобретения сополимер(ы) поли(D,L-лактид-ко-гликолида) со сложноэфирными и/или кислотными концевыми группами может (могут) быть независимо выбран(ы) из группы, содержащей:
i) поли(D,L-лактид-ко-гликолид), имеющий сложноэфирную концевую группу, характеристическую вязкость 0,16-0,24 дл/г (0,1% (отношение массы к объему) в хлороформе при 25°С) и соотношение D,L-лактид : гликолид равное около 75:25 (RESOMER®RG752S);
ii) поли(D,L-лактид-ко-гликолид), имеющий сложноэфирную концевую группу, характеристическую вязкость 0,32-0,44 дл/г (0,1% (отношение массы к объему) в хлороформе при 25°С) и соотношение D,L-лактид : гликолид равное около 75:25 (RESOMER®RG753S);
iii) поли(D,L-лактид-ко-гликолид), имеющий кислотную концевую группу, характеристическую вязкость 0,16-0,24 дл/г (0,1% (отношение массы к объему) в хлороформе при 25°С) и соотношение D,L-лактид : гликолид равное около 50:50 (RESOMER®RG502H); и
iv) поли(D,L-лактид-ко-гликолид), имеющий кислотную концевую группу, характеристическую вязкость 0,32-0,44 дл/г (0,1% (отношение массы к объему) в хлороформе при 25°С) и соотношение D,L-лактид : гликолид равное около 50:50 (RESOMER®RG503H).
Некоторые примеры включают биодеградируемые имплантаты согласно Составам №1-9, перечисленные и описанные в Таблице 1 ниже.
В одном варианте реализации изобретения предложено экструдированное биодеградируемое волокно (т.е. экструдированный имплантат), содержащее антитело и биодеградируемую полимерную матрицу, причем полимерная матрица состоит из RESOMER® RG753S и RESOMER® RG502H. В одной форме данного имплантата антитело является анти-VEGF антителом.
В другом варианте реализации изобретения предложен экструдированный биодеградируемый имплантат, содержащий антитело, такое как, например, анти-VEGF антитело, и биодеградируемую полимерную матрицу, причем полимерная матрица состоит из RESOMER® RG752S и RESOMER® RG502H. В конкретном варианте реализации данного изобретения имплантат состоит из RESOMER® RG752S и RESOMER® RG502H в массовом соотношении (RG752S к RG502H) около 90 к 10, а антителом является анти-VEGF антитело. Примеры включают Составы №3 и 5, описанные в Таблице 1 ниже.
В любом из вышеупомянутых вариантов реализации изобретения волокну можно придать конфигурацию, подходящую для введения в глазничную или внутрисуставную область. То есть волокну можно придать конфигурацию, подходящую для применения в качестве внутриглазного или внутрисуставного имплантата.
Экструдированное волокно, имеющее необходимые размер и конфигурацию и пригодное для введения в глазничную область (т.е. внутриглазной имплантат), может быть палочкообразным или нецилиндрическим и составлять от около 0,5 мм до около 10 мм в длину. Например, волокно может быть около 1 мм, 2 мм, 3 мм, 4 мм, 5 мм, 6 мм или около 7 мм в длину. Диаметр может варьироваться от около 250 мкм до около 1 мм или составлять менее чем около 500 мкм. В одном примере длина волокна, имеющего конфигурацию, необходимую для введения в стекловидное тело, составляет от около 1 до около 7 мм, а диаметр - от около 0,5 до около 2 мм. В другом примере длина волокна, имеющего конфигурацию, необходимую для введения в переднюю камеру, составляет от около 0,5 до около 2 мм, а диаметр - от около 50 мкм до около 500 мкм. Эти имплантаты могут также подходить для введения во внутрисуставную область для доставки терапевтически эффективного количества белка пациенту, который в нем нуждается, как, например, пациенту, страдающему от воспаления или аутоиммунного нарушения сустава. Белок, выбранный для использования в данных имплантатах, должен быть эффективным для уменьшения воспаления или лечения аутоиммунного нарушения.
Общая масса внутриглазного или внутрисуставного имплантата может варьироваться от около 100 мкг до около 5000 мкг, от около 1000 до около 2000 мкг или составлять более чем 5000 мкг. Например, экструдированный имплантат может иметь массу около 500 мкг, около 1000 мкг, около 2000 мкг или около 5000 мкг.
Для получения биодеградируемых полимеров могут применяться различные способы. Пригодные способы включают способы экструзии и сжатия. Стандартный способ для получения белоксодержащих имплантатов включает смешивание или размалывание порошка белка с полимерами и, необязательно, одним или более вспомогательных веществ, солей, буферных агентов, консервантов или полиэлектролитов в подходящих соотношениях. Белковый порошок обычно получают лиофилизацией или сушкой распылением, при этом вспомогательные вещества могут быть также лиофилизированы или высушены распылением. Затем из порошковой смеси с помощью экструзии получают волокна с помощью экструдера горячей плавки, такого как изготовленный на заказ поршневой экструдер или двухшнековый экструдер, при подходящей температуре, скорости экструзии и размере наконечника/шнека. Палочкообразный имплантат может быть получен из волокон, экструдированных из наконечника и разрезанных до нужного размера. Диаметр отверстия наконечника может варьироваться от 200 до 440 мкм.
Температура экструзии может варьироваться от около 25°С до около 150°С, или от около 60°С до около 90°С, от около 60°С до около 100°С, или от около 50°С до около 80°С.Имплантат можно получить, например, путем повышения температуры до около 60°С или около 100°С для смеси белок/полимер в течение периода времени от около 5 минут до 1 часа, от 1 минуты до около 30 минут или 5-20 минут. Например, период времени может составлять от около 10 до около 30 минут, как, например, около 20 мин. Затем имплантаты экструдируются при температуре от около 60°С до около 90°С или от около 60 до около 100°С.
Скорость высвобождения белка из имплантата можно эмпирически определить путем приготовления нескольких имплантатов с различными пропорциями полимера, белка и других компонентов, таких как вспомогательные вещества, соли или буферные агенты, описанные в данном документе. Для измерения скорости высвобождения может применяться метод контроля растворения и высвобождения, утвержденный USP (USP 23; NF 18 (1995) pp.1790-1798). Например, при использовании метода многократных разбавлений, взвешенный образец устройства доставки лекарственных средств добавляют к определенному объему раствора, содержащего 0,9% NaCl в воде (или другой подходящей среды высвобождения, такой как натрий-фосфатный буфер (PBS)), где объем раствора должен быть таким, что концентрация белка после высвобождения будет менее 20% и желательно менее 5% от насыщения. Смесь выдерживают при температуре 37°С и медленно перемешивают для обеспечения высвобождения белка. Количество белка, которое перешло в среду высвобождения, как функцию от времени можно определить с помощью различных методов, известных в данной области, таких как спектрофотометрия, высокоэффективная жидкостная хроматография (иногда называемая высокого давления) (HPLC), масс-спектроскопия и т.д. В случае данного изобретения высвобождение неповрежденного или биологически активного антитела или другого белка из экструдированного имплантата можно наблюдать с использованием эксклюзионной высокоэффективной жидкостной хроматографии (SEC-HPLC) и твердофазного иммуноферментного анализа (ELISA).
Системы доставки лекарственных средств и, следовательно, биодеградируемые имплантаты, описанные в данном документе могут быть введены (или имплантированы) в глазничную область глаза пациента для лечения разнообразных патологических состояний глаза, включая дистрофию желтого пятна (в том числе влажную возрастную дистрофию желтого пятна); глазную неоваскуляризацию (образование новых аномальных кровеносных сосудов в глазу), включая, но не ограничивая ими, хороидальную неоваскуляризацию и неоваскуляризацию радужки; острую нейроретинопатию желтого пятна; отек желтого пятна (в том числе кистозный отек желтого пятна и диабетический отек желтого пятна); болезнь Бехчета; ретинопатию, включая диабетическую ретинопатию и пролиферативную диабетическую ретинопатию; пролиферативную витреоретинопатию; окклюзионное поражение артерии сетчатки; окклюзию центральной вены сетчатки; окклюзию ветки вены сетчатки; увеальное заболевание сетчатки; отслоение сетчатки; нарушение эпиретинальной мембраны; переднюю ишемическую оптическую нейропатию; неретинопатическую диабетическую дисфункцию сетчатки; пигментную дистрофию сетчатки; и глаукому у пациентов, которые нуждаются в лечении.
Имплантаты, описанные в данном документе, могут также быть установлены в сустав для лечения внутрисуставных патологических состояний, таких как остеоартрит, ревматоидный артрит, псориатический артрит, болевой синдром в надколенно-бедренном суставе, боль в суставах и воспаление суставов у пациентов, которые нуждаются в лечении. Соответственно, в одном варианте реализации данного изобретения предлагается способ лечения внутрисуставных патологических состояний (любых, приведенных выше) в суставе пациента, который нуждается в лечении, который включает введение биодеградируемого имплантата в сустав, причем имплантат содержит белок, необходимый для лечения патологического состояния и биодеградируемую полимерную матрицу, причем белок связан с матрицей, а имплантат уменьшает по меньшей мере один симптом патологического состояния в течение 3 месяцев или более после его введения в сустав.
ОПРЕДЕЛЕНИЯ ДАННОГО ИЗОБРЕТЕНИЯ
"Индивид", "субъект" или "пациент" относится к живому человеку или млекопитающему кроме человека, такому как примат, обезьяна, лошадь, собака, кролик, крыса, мышь, морская свинка или свинья. Индивид или субъект может быть дополнительно классифицирован как пациент, индивид или субъект, нуждающийся в лечении (страдающий от) патологического состояния глаза или медицинского патологического состояния.
Как используется в данном документе, термин "патологическое состояние глаза" относится к заболеванию или патологическому состоянию одной или более тканей, частей или глазничных областей глаза, которые нарушают нормальную работу глаза. Патологическое состояние глаза может быть классифицировано как патологическое состояние переднего отрезка глаза и патологическое состояние заднего отрезка глаза.
Патологическое состояние переднего отрезка глаза представляет собой заболевание или патологическое состояние, поражающее переднюю область или участок глазницы (переднюю часть глаза), такой как окологлазная мышца, глазное веко или ткань глазного яблока или жидкость, расположенная между передней и задней стенкой мембраны хрусталика, или цилиарные мышцы. Таким образом, патологическое состояние переднего отрезка глаза главным образом поражает или затрагивает конъюнктиву, роговую оболочку, переднюю камеру, радужную оболочку, заднюю камеру, хрусталик или мембрану хрусталика и кровеносные сосуды и нервы, которые васкуляризируют или иннервируют переднюю область или участок глазницы.
Примеры патологического состояния переднего отрезка глаза включают афакию; артифакию; астигматизм; блефароспазм; катаракту; заболевания конъюнктивы; конъюнктивит; заболевания роговой оболочке; язва роговицы; сухость глаз; заболевания века; заболевания слезного аппарата; закупорку слезных проток; миопию; пресбиопию; заболевания зрачка; рефракционные нарушения и косоглазие. Глаукома также может рассматриваться как патологическое состояние переднего отрезка глаза, так как клинической целью лечения глаукомы может являться уменьшение гипертензии водной жидкости в передней камере глаза, т.е. уменьшение внутриглазного давления.
Патологическое состояние заднего отрезка глаза представляет собой заболевание или патологическое состояние, поражающее заднюю область или участок глазницы в глазе, такой как сосудистая оболочка глаза или склера (находятся сзади по отношении к плоскости, проходящей через заднюю стенку мембраны хрусталика), стекловидное тело, стекловидная камера, сетчатка, пигментный эпителий сетчатки, мембрана Бруха, зрительный нерв (диск зрительного нерва) и кровеносные сосуды и нервы, которые васкуляризируют или иннервируют заднюю область или участок глазницы.
Примеры патологического состояния заднего отрезка глаза включают острую нейроретинопатию желтого пятна; болезнь Бехчета; хороидальную неоваскуляризацию; диабетический увеит; гистоплазмоз; инфекции, такие как грибковая или вирусная инфекции; дистрофию желтого пятна, такую как острая дистрофия желтого пятна, неэкссудативная возрастная дистрофия желтого пятна и экссудативная возрастная дистрофия желтого пятна; отек, такой как отек желтого пятна, кистозный отек желтого пятна и диабетический отек желтого пятна; многофокусный хориоидит; глазную травму, которая затрагивает задний участок или область глазницы; глазные опухоли; нарушения сетчатки, такие как окклюзия центральной вены сетчатки, диабетическая ретинопатия (включая пролиферативную диабетическую ретинопатию), пролиферативная витреоретинопатия (ПВР), окклюзионное поражение артерии сетчатки, отслоение сетчатки, увеальное заболевание сетчатки; симпатическую офтальмию; синдром Фогта-Коянаги-Харада (ФКХ); увеальную диффузию; патологическое состояние заднего отрезка глаза, вызванное или связанное с лазерным лечением глаза; патологическое состояние заднего отрезка глаза, вызванное или связанное с фотодинамической терапией, фотокоагуляцию, радиационную ретинопатию, нарушение эпиретинальной мембраны, окклюзию ветки вены сетчатки, передняюю ишемическую оптическую нейропатию, не связанную с ретинопатией, диабетическую дисфункцию сетчатки, пигментную дистрофию сетчатки и глаукому. Глаукома также может рассматриваться как патологическое состояние заднего отрезка глаза, так как терапевтической целью является предотвращение потери или уменьшение возможности потери зрения вследствие повреждения или потери клеток сетчатки или клеток зрительного нерва (нейропротекция).
"Глаз" представляет собой зрительный орган чувств и включает глазное яблоко, глазной чувствительный орган, который улавливает свет и передает зрительную информацию в центральную нервную систему. В общем, глаз включает глазное яблоко и глазничные области, ткани и жидкости, которые образуют глазное яблоко, окологлазные мышцы (такие как косые и прямые мышцы) и часть зрительного нерва, которая находится внутри или прилегает к глазному яблоку.
Как используется в данном документе, "глазничная область" или "глазничный участок" относится, как правило, к любому участку глазного яблока, включая передний и задний отрезки глаза и которая, как правило, включает, но не ограничивается ими, любые функциональные (т.е. для зрения) или структурные ткани, находящиеся в глазном яблоке, или ткани или клеточные слои которые частично или полностью покрывают внутреннюю или внешнюю часть глазного яблока. Конкретные примеры участков глазного яблока в глазничной области включают переднюю камеру, заднюю камеру, стекловидное тело (иногда называемое стекловидной полостью), сосудистую оболочку, супрахороидальное пространство, конъюнктиву, субконъюнктивальное пространство, субтеноновое пространство, эписклеральное пространство, внутрироговичное пространство, эпикорнеальное пространство, склеру, плоскую часть ресничного тела, вызванные хирургическим путем бессосудистые области, желтое пятно и сетчатку.
Передняя камера относится к пространству внутри глаза между радужной оболочкой и наиболее удаленной частью поверхности роговицы (эндотелий).
Задняя камера относится к пространству внутри глаза между задней частью радужной оболочки и передней поверхностью стекловидного тела. Задняя камера включает пространство между хрусталиком и ресничным отростком, который вырабатывает водянистую влагу, питающую роговицу, радужку и хрусталик, и поддерживает внутриглазное давление.
"Интравитреальный" имплантат представляет собой имплантат, который имеет размер, конфигурацию и состав для введения в стекловидное тело глаза.
Как используется в данном документе, "внутриглазной имплантат" относится к устройству или элементу, который имеет конфигурацию, пригодную для установки в глазничную область глаза. Примеры включают экструдированные волокна, состоящие из биодеградируемой полимерной матрицы и белка, связанного с полимерной матрицей и имеющего длину, подходящую для установки в глаз. Внутриглазные имплантаты, как правило, биосовместимы с физиологическими условиями глаза и не оказывают побочного действия на глаз. В некоторых формах данного изобретения внутриглазной имплантат может иметь конфигурацию для установки в стекловидное тело, переднюю камеру, субконъюнктивальное пространство или субтеноновое пространство. Внутриглазные имплантаты, как правило, биосовместимы с физиологическими условиями глаза и не оказывают побочных действий на глаз. Внутриглазные имплантаты могут быть введены в глаз без нарушения зрения. Имплантаты могут быть биодеградируемыми и могут быть получены экструзией, как описано в данном документе. Имплантаты, полученные с помощью процесса экструзии и состоящие из белка и биодеградируемой полимерной матрицы, являются одним из примеров систем доставки лекарственных средств в пределах объема данного изобретения.
Термин "биосовместимый" означает совместимый с живой тканью или живой системой. Биосовместимые имплантаты и полимеры вызывают лишь небольшое количество или не вызывают токсических эффектов, неопасные или физиологически неактивные и не вызывают имунологическую реакцию.
Как используется в данном документе, "связанный с биодеградируемой полимерной матрицей" означает смешанный с, растворенный и/или диспергированный в, инкапсулированный или присоединенный к.
Как используется в данном документе, термин "медицинское патологическое состояние" относится к патологическому состоянию или заболеванию ткани или структуры тела, которое нарушает нормальное функционирование ткани или структуры. Медицинские патологические состояния включают патологические состояния глаза и сустава.
Примеры патологических состояний сустава включают ревматоидный артрит, воспаление и боль, связанную с воспалением сустава. Патологическое состояние сустава может нарушать и, таким образом, ограничивать подвижность субъекта. Биодеградируемая система доставки лекарственных средств, описанная в данном документе, может применяться для доставки терапевтически эффективного количества белка в сустав, при этом уменьшая воспаление и ослабляя боль у субъекта, нуждающегося в лечении.
Термин "внутрисуставной" означает расположенный внутри, происходящий внутри или применяемый путем введения в сустав.
"Внутрисуставная область" относится к суставу, такому как коленный, локтевой, плечевой, тазобедренный сустав или сустав пальцев руки или стопы. Внутрисуставные области включают суставы запястья и позвоночник в шее и спине.
"Сустав", при использовании в данном документе, относится к точке соединения двух или более костей в скелете животного или человека с частями, которые ее окружают и поддерживают. Примеры суставов включают без ограничений коленный сустав, суставы пальцев руки и ноги, лучезапястный, голеностопный, тазобедренный, плечевой, локтевой сустав и спину (позвоночник и позвоночные диски).
Термин "биодеградируемый полимер" относится к полимеру или полимерам, которые распадаются in vivo, причем эрозия полимера или полимеров со временем проходит одновременно или последовательно с высвобождением терапевтического агента. Термины "биодеградируемый" и "биоразлагаемый" эквивалентны и используются в данном документе взаимозаменяемо. Биодеградируемый полимер может быть гомополимером, сополимером или полимером, состоящим из более чем двух различных полимерных единиц.
Термин "терапевтически эффективное количество", используемый в данном документе, относится к уровню или количеству агента, необходимому для лечения патологического состояния глаза или медицинского патологического состояния, или уменьшения или предотвращения травмы или повреждения глаза без значительных негативных или побочных эффектов в глазу или в области глаза или части тела, в которой применяется агент. На основании вышеизложенного, терапевтически эффективным количеством белка, такого как антитело, является количество, необходимое для уменьшения по меньшей мере одного симптома медицинского патологического состояния, такого как патологическое состояние глаза или сустава. Посредством уменьшения одного или более симптомов патологического состояния глаза, терапевтически эффективное количество белка может улучшать качество зрения и эффективность зрительного восприятия глаза у индивида, страдающего от патологического состояния глаза. Посредством уменьшения одного или более симптомов медицинского патологического состояния, терапевтически эффективное количество белка может улучшать физическое здоровье, самочувствие и/или подвижность субъекта. Белок, который ослабляет или устраняет по меньшей мере один симптом медицинского патологического состояния, является терапевтическим белком, или белком с терапевтической эффективностью для лечения медицинского патологического состояния.
Как используется в данном документе, термины "лечение" и "лечить" относятся к ослаблению или устранению по меньшей мере одного симптома патологического состояния глаза или медицинского патологического состояния. Ослабление или устранение симптома может наблюдаться или ощущаться как улучшение зрения и/или ослабление отека, боли или красноты. "Лечение" включает любой лечебный или медицинский эффект в глазу или ткани тела индивида, вызванный введением системы доставки лекарственных средств (например, биодеградируемого имплантата) как описано в данном документе, которая может ослаблять один или более симптомов патологического состояния глаза или медицинского патологического состояния и/или улучшать самочувствие, эффективность зрительного восприятия и/или качество зрения глаз(а) индивида. Ослабление одного или более симптомов включает, но не ограничиваясь ими, ослабление глазной боли, суставной боли, воспаления или дискомфорта. Симптом (или симптомы), на который положительно повлияло лечение (т.е. ослабленный), будет зависеть от конкретного патологического состояния.
"Биспецифическое моноклональное антитело (BsMAb)" представляет собой искусственный белок, который составлен из фрагментов двух различных моноклональных антител и, соответственно, способен связываться с двумя различными типами антигенов.
"Биспецифическое антитело" представляет собой антитело, способное одновременно связывать две различные мишени, такие как два различных белка.
"Кумулятивная кривая высвобождения" представляет кумулятивный общий процент активного агента (такого как терапевтический белок), высвобожденного из имплантата в глазничную область или участок in vivo с течением времени или в специальную среду высвобождения in vitro с течением времени.
КРАТКОЕ ОПИСАНИЕ ГРАФИЧЕСКИХ МАТЕРИАЛОВ
Фигура 1 иллюстрирует in vitro высвобождение бевацизумаба из имплантата PLGA-бевацизумаб (Состав №1) (0,53 мм × 5 мм), показывая сопоставимые кривые, полученные методами SEC-HPLC и ELISA, демонстрирующие, что связывающая активность сохраняется после инкубации в среде высвобождения в течение одного месяца.
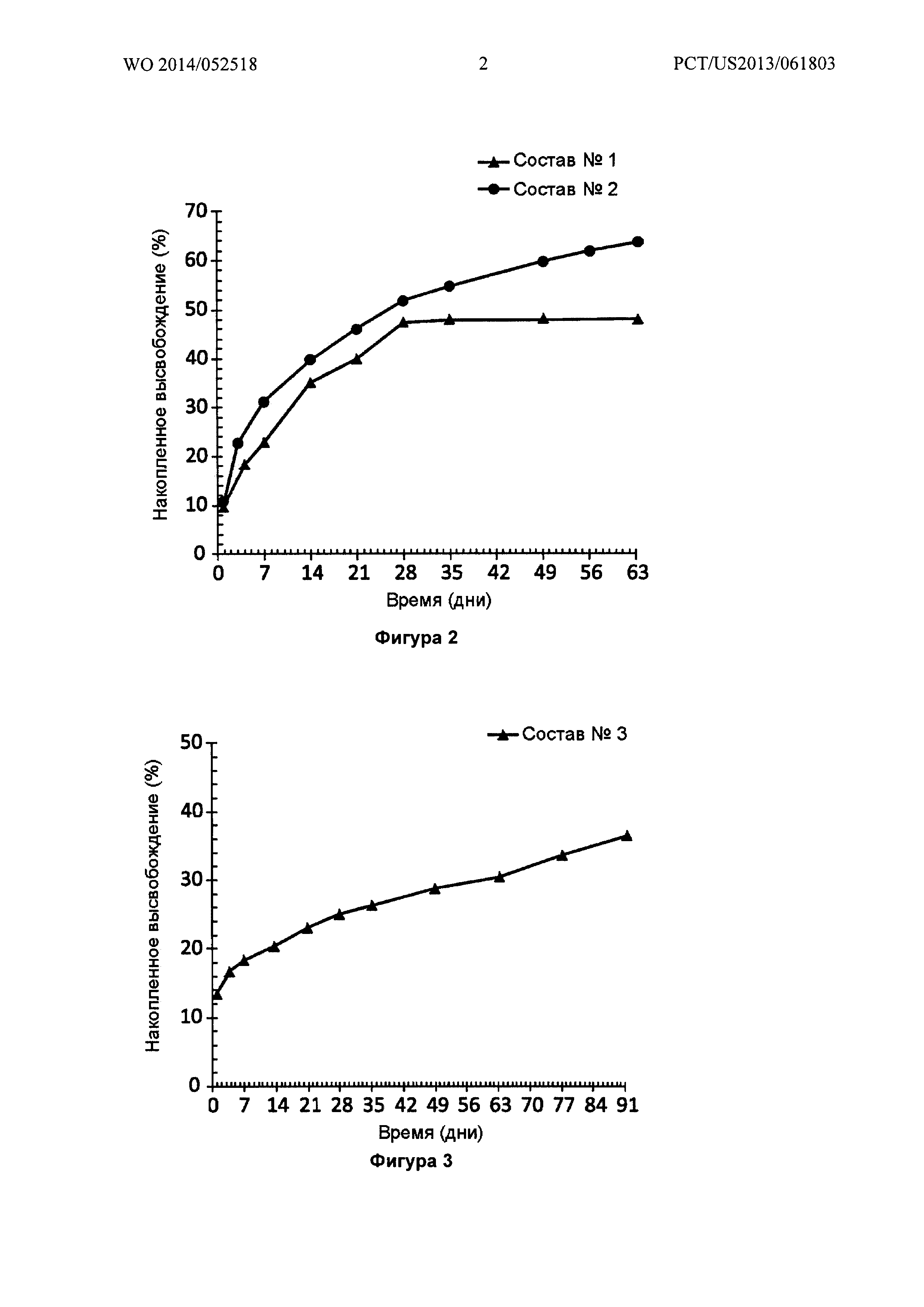
Фигура 2 иллюстрирует in vitro высвобождение (SEC-HPLC) бевацизумаба из двух различных имплантатов PLGA-бевацизумаб (Составы №1 и 2), показывая увеличение непрерывной длительности высвобождения с 1 месяца до 2 месяцев при изменении полимерной композиции.
Фигура 3 иллюстрирует in vitro высвобождение (SEC-HPLC) бевацизумаба из имплантата PLGA-бевацизумаб (Состав №3), показывая увеличение непрерывной длительности высвобождения до 3 месяцев при изменении полимерной композиции.
Фигура 4 иллюстрирует in vitro высвобождение (SEC-HPLC) бевацизумаба из трех различных имплантатов PLGA-бевацизумаб (Составы №4, 5 и 6), показывая возможность регулировать высвобождение антитела путем смешивания двух различных типов полимеров PLGA (RG752S и RG502H), причем RG502H облегчает высвобождение.
Фигура 5 иллюстрирует in vitro высвобождение (SEC-HPLC) бевацизумаба из трех различных имплантатов PLGA-бевацизумаб (Составы №4, 7 и 8), показывая возможность изменять скорости высвобождения антитела из PLGA-имплантата путем включения водорастворимых вспомогательных веществ, таких как трегалоза.
Фигура 6 иллюстрирует in vitro высвобождение (SEC-HPLC) бевацизумаба из двух различных имплантатов PLGA-бевацизумаб (Составы №1 и 9), показывая как содержание лекарственного средства (массовые проценты антитела) влияет на высвобождение антитела из имплантата.
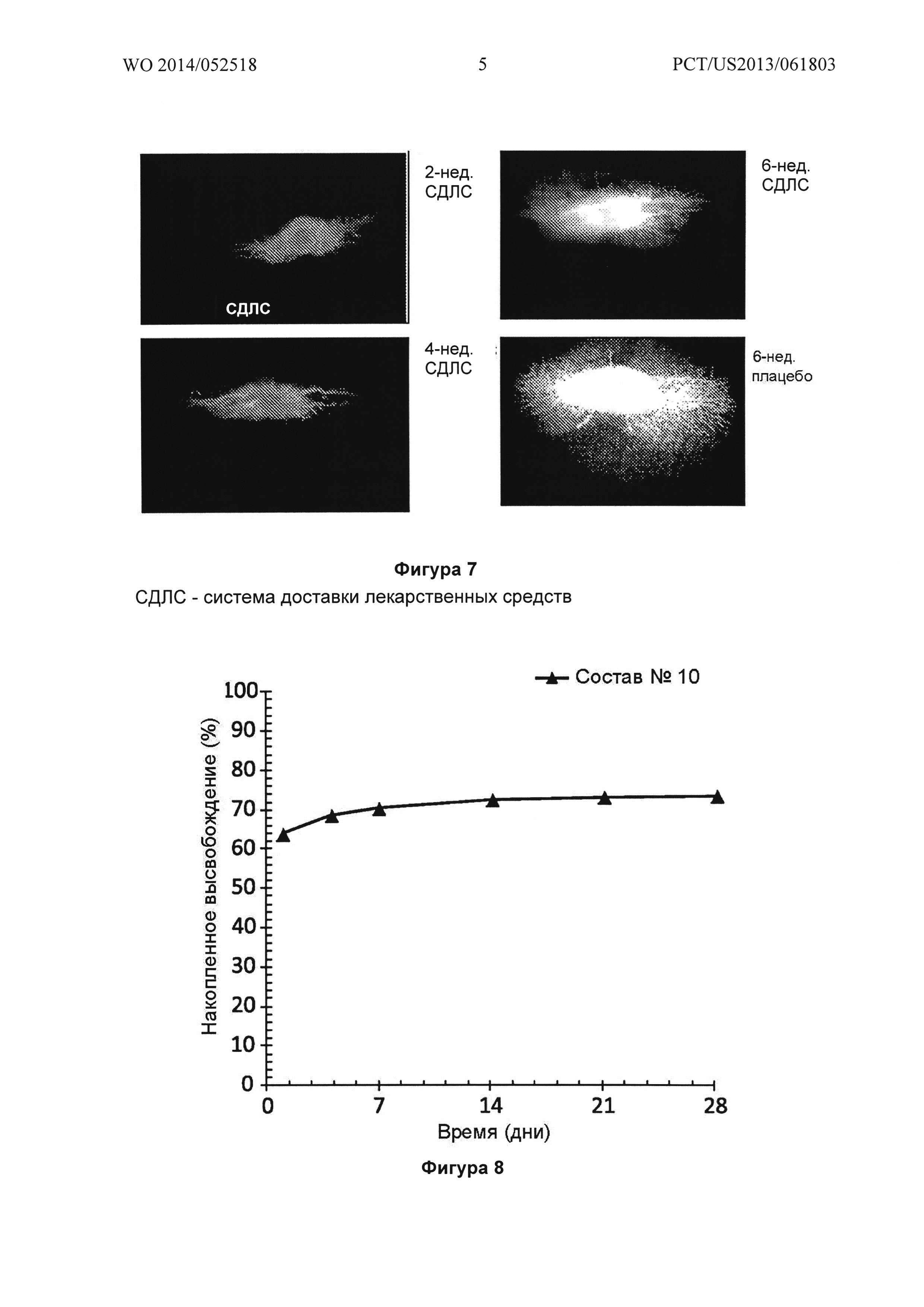
Фигура 7 иллюстрирует изображения стекловидного тела кролика после введения флюоресцеина, в которое хирургическим путем введены имплантат PLGA-бевацизумаб (СДЛС: Состав №1) и имплантат-плацебо, содержащий только PLGA; VEGF определяли каждые две недели, при этом наблюдался спад активности VEGF в глазу под воздействием имплантата, содержащего бевацизумаб, на 2 и 4 неделях.
Фигура 8 иллюстрирует in vitro высвобождение (SEC-HPLC) бевацизумаба из имплантата PLGA-бевацизумаб (Состав №10), показывая, что высвобождение антитела сначала резко возрастает, а затем практически не меняется.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Изобретение можно дополнительно понять на основании следующего описания и примеров совместно с приложенными графическими материалами.
В некоторых формах данного изобретения система доставки лекарственных средств представляет собой биодеградируемый внутриглазной или внутрисуставной имплантат.Имплантат может быть получен с помощью экструзии. Как правило, имплантат твердый или полутвердый. "Имплантат" представляет собой устройство для доставки лекарственных средств, которое значительно больше микросферы. Биодеградируемый имплантат, как правило, содержит белок, связанный с биодеградируемой полимерной матрицей. Матрица может состоять из двух или более биодеградируемых полимеров и/или двух или более структурно различных белков. Имплантат предпочтительно имеет конфигурацию, подходящую для имплантации в глазничную область глаза или внутрисуставное пространство тела, такое как локтевой, коленный сустав или сустав пальцев руки, и разработан, чтобы обеспечить высвобождение терапевтически эффективного количества белка в биологически активной форме в течение по меньшей мере около 1, 2, 3 или 6 месяцев. В некоторых вариантах реализации изобретения имплантат может высвобождать биологически активный белок непрерывно в течение 2 месяцев или более, или 3 месяцев или более.
"Биологически активной формой" белка является форма, обладающая размером и четвертичной структурой, обычно ожидаемыми для белка в неденатурирующих условиях, и поэтому обладающая биохимической активностью, обычно ожидаемой для белка. В случае белков DARPin, антикалинов и антител, биологически активной формой является форма, которая специфично связывает (иммунореактивна) требуемый антиген. Примеры антигенов включают белки (в том числе ферменты). Ожидаемая специфичность связывания антитела может быть получена на основании информации об антигене, используемом для первоначального получения антитела и/или очищения антитела или идентичности антигена, используемого (например, в таком анализе как ELISA) для обнаружения присутствия и/или измерения количества (титр) антитела в образце до его включения в систему доставки лекарственных средств (такую как экструдированный имплантат). В случае ферментов, биологически активной формой является форма, катализирующая химическую реакцию, которую бы она катализировала in vitro или in vivo до ее включения в систему доставки лекарственных средств (такую как экструдированный имплантат). Биологическую активность антитела in vivo или in vitro можно обнаружить и/или измерить по уменьшению активности целевого белка. Например, специфическое связывание антитела, DARPin или антикалина с целевым белком может мешать взаимодействию между целевым белком и его лигандом или рецептором, и, таким образом, может быть ингибирована или ослаблена функция, передаваемая взаимодействием белок/рецептор. Соответственно, подавление конкретной функции или активности в клеточной системе (например, культуре клеток) или ткани in vitro или in vivo может служить одним из показателей биологической активности антитела, введенного в эту клетку или ткань. Кроме того, в данной области известно несколько других методов для определения специфического связывания антитела. Несколькими примерами являются
иммунохемилюминометрический анализ (ICMA), твердофазный иммуноферментный анализ (ELISA) и радиоиммунологический анализ (RIA).
Как было описано ранее, "биодеградируемая полимерная матрица" может содержать не более одного биодеградируемого полимера или может содержать смесь двух, трех или более биодеградируемых полимеров. Биодеградируемая полимерная матрица, и, следовательно, имплантат может дополнительно необязательно содержать вспомогательное вещество, соль, буферный агент, консервант или полиэлектролит, которые могут регулировать высвобождение белка из биодеградируемой полимерной матрицы. Белок может быть связан с и/или диспергирован в биодеградируемой полимерной матрице.
В дополнение к биодеградируемому полимеру или смеси полимеров, система доставки лекарственных средств, такая как экструдированный имплантат, может дополнительно необязательно содержать рассасывающийся полимер, такой как ПЭГ 3350. Количество ПЭГ 3350 в имплантате может варьироваться, например, от 1 до 20 масс. % от общей массы имплантата (массовые %).
Биодеградируемая система доставки лекарственных средств, как описано в данном документе, может быть в форме экструдированного волокна, которое может иметь размер (например, разрезано на куски подходящей длины) для установки (имплантации) в глазничную область глаза, как например, переднюю камеру, субтеноновое пространство, стекловидное тело или субконъюнктивальное пространство.
Понятно, что полимерные компоненты данных систем связаны с белком, поэтому высвобождение белка в глаз или другие ткани организма происходит путем диффузии, эрозии, растворения или осмоса. Как обсуждалось в данном документе, полимерная матрица системы доставки лекарственных средств может высвобождать белок со скоростью, достаточной для поддержания высвобождения терапевтически эффективного количества белка (и, следовательно, белка в биологически активной форме) в течение более чем одного месяца, двух месяцев, трех месяцев или четырех месяцев после введения в глаз. Высвобождение белка из имплантата, содержащего биодеградируемую полимерную матрицу, может включать первоначальный всплеск высвобождения, за которым следует плавное увеличение количества высвобожденного белка или высвобождение может включать первоначальную задержку высвобождения, за которой следует возрастание. Когда система практически полностью деградировала, количество высвобожденного белка составляет приблизительно 100%. Всплеск относится к количеству лекарственного средства (например, белка), которое высвободилось в течение первого дня после введения имплантата млекопитающему или в жидкую среду (такую как водный буфер или солевой раствор). Задержка относится к периоду, за который высвобождается небольшое количество лекарственного средства или не высвобождается совсем в сравнении со скоростью высвобождения в течение любого другого периода. Всплеск высвобождения лекарственного средства может применяться при некоторых патологических состояниях глаза, таких как хороидальная неоваскуляризация (CNV), где может наблюдаться чрезмерное количество VEGF, которое необходимо блокировать или эффективно ингибировать с помощью лекарственного средства. Задержка высвобождения может применяться как способ увеличения длительности высвобождения.
Полимерные системы доставки лекарственных средств, используемые в данном способе, могут быть монолитными, т.е. характеризоваться гомогенным распределением белка по всей полимерной матрице.
До введения субъекту имплантат можно простерилизовать подходящей дозой гамма или бета-излучения. Как правило, способ стерилизации не уменьшает биологическую или терапевтическую активность терапевтических агентов данных систем. Как пример, имплантат можно простерилизовать воздействием 5-25 кГр гамма или бета-излучения. В некоторых случаях можно применять от 10 до 15 кГр гамма или бета-излучения.
Один вариант реализации данного изобретения является способом лечения патологического состояния глаза у пациента, нуждающегося в лечении, который включает установку биодеградируемого внутриглазного имплантата в глаз пациента, причем имплантат содержит биодеградируемую полимерную матрицу и белок, действенные при лечении патологических состояний глаза. Имплантат может быть экструдированным волокном, а белок может быть связан с биодеградируемой полимерной матрицей. Имплантат можно устанавливать в переднюю камеру, стекловидное тело, субконъюнктивальное пространство или субтеноновое пространство глаза для лечения патологического состояния глаза в течение длительного периода, такого как один, два, три, четыре месяца или более.
Другой вариант реализации данного изобретения является способом лечения патологического состояния сустава у пациента, нуждающегося в таком лечении, который заключается в установке биодеградируемого внутриглазного имплантата в сустав пациента, причем имплантат содержит биодеградируемую полимерную матрицу и белок, действенные при лечении патологических состояний сустава. Имплантат может быть экструдированным волокном, а белок может быть связан с биодеградируемой полимерной матрицей.
Имплантаты данного изобретения могут быть введены в глазничную область глаза или внутрисуставную область тела с помощью различных способов, включая введение с помощью хирургических щипцов, шприца (оснащенного катетером или иглой), троакара или других подходящих устройств. Подходящие устройства (инструменты) включают устройства, описанные в патенте США №2004/0054374 и патенте США 6899717.
Шприц с иглой подходящего размера, например, с иглой 22 калибра, иглой 27 калибра или иглой 30 калибра, может эффективно применяться для инъецирования имплантата в глаз человека или животного. Повторные инъекции часто не являются обязательными, вследствие пролонгированного высвобождения белка из имплантатов. Это особо важно при лечении возрастной дистрофии желтого пятна, когда иногда необходимы частые инъекции для поддержания терапевтически эффективных уровней белка.
Настоящее изобретение включает, но не ограничивается ими, следующие варианты реализации изобретения (1-24):
1. Экструдированный биодеградируемый внутриглазной имплантат, содержащий биодеградируемую полимерную матрицу и белок, связанный с биодеградируемой полимерной матрицей, причем биодеградируемая полимерная матрица содержит поли(D,L-лактид-ко-гликолид), а имплантат обеспечивает непрерывное высвобождение белка в биологически активной форме в течение по меньшей мере 30 дней после введения имплантата в глаз млекопитающего.
2. Имплантат по п. 1, отличающийся тем, что биодеградируемая матрица содержит первый поли(D,L-лактид-ко-гликолид) и второй поли(D,L-лактид-ко-гликолид), причем первый поли(D,L-лактид-ко-гликолид) имеет сложноэфирную концевую группу и соотношение D,L-лактид : гликолид, равное около 75:25, а второй поли(D,L-лактид-ко-гликолид) имеет кислотную концевую группу и соотношение D,L-лактид : гликолид, равное около 50:50, а имплантат обеспечивает непрерывное высвобождение белка в биологически активной форме в течение около 90 дней после введения имплантата в глаз млекопитающего.
3. Имплантат по п. 2, отличающийся тем, что массовое соотношение первого поли(D,L-лактид-ко-гликолида) ко второму поли(D,L-лактид-ко-гликолиду) составляет около 90:10.
4. Имплантат по любому из пп. 1-3, отличающийся тем, что белок обладает терапевтической эффективностью при лечении патологического состояния глаза.
5. Имплантат по п. 4, отличающийся тем, что белок обладает терапевтической эффективностью для уменьшения по меньшей мере одного симптома патологического состояния глаза, выбранного из группы, включающей неоваскуляризацию глаза, хороидальную неоваскуляризацию, дистрофию желтого пятна и отек желтого пятна.
6. Имплантат по п. 5, отличающийся тем, что белок является антителом, фрагментом антитела, биспецифическим антителом, антикалином или DARPin.
7. Имплантат по п. 6, отличающийся тем, что белок является антителом, фрагментом антитела, DARPin или антикалином, который связывает фактор роста эндотелия сосудов (VEGF) или фактор роста тромбоцитов (PDGF).
8. Имплантат по п. 7, отличающийся тем, что белок является анти-VEGF антителом.
9. Имплантат по п. 6, отличающийся тем, что белок является биспецифическим антителом, которое связывает фактор роста эндотелия сосудов (VEGF) или фактор роста тромбоцитов (PDGF).
10. Имплантат по п. 7, отличающийся тем, что белок является антителом, которое связывает фактор роста эндотелия сосудов (VEGF) или фактор роста тромбоцитов (PDGF), причем имплантат эффективно ингибирует или уменьшает активность VEGF или PDGF in vivo в глазу млекопитающего в течение по меньшей мере 4 недель после введения имплантата в глаз млекопитающего.
11. Имплантат по п. 10, отличающийся тем, что белок является антителом, которое связывает VEGF (анти-VEGF антитело), причем имплантат обеспечивает непрерывное высвобождение анти-VEGF антитела в биологически активной форме в течение около 90 дней после введения имплантата в глаз млекопитающего.
12. Имплантат по любому из пп. 1-10, отличающийся тем, что биодеградируемая полимерная матрица содержит
a) поли(D,L-лактид-ко-гликолид), имеющий концевую сложноэфирную группу, характеристическую вязкость 0,16-0,24 дл/г (0,1% в хлороформе при 25°С) и соотношение D,L-лактид : гликолид, равное около 75:25 (RESOMER® RG752S);
b) поли(D,L-лактид-ко-гликолид), имеющий концевую сложноэфирную группу, характеристическую вязкость 0,32-0,44 дл/г (0,1% в хлороформе при 25°С) и соотношение D,L-лактид : гликолид, равное около 75:25 (RESOMER® RG753S);
c) поли(D,L-лактид-ко-гликолид), имеющий концевую кислотную группу, характеристическую вязкость 0,16-0,24 дл/г (0,1% в хлороформе при 25°С) и соотношение D,L-лактид : гликолид, равное около 50:50 (RESOMER® RG502H);
d) поли(D,L-лактид-ко-гликолид), имеющий концевую кислотную группу, характеристическую вязкость 0,32-0,44 дл/г (0,1% в хлороформе при 25°С) и соотношение D,L-лактид : гликолид, равное около 50:50 (RESOMER® RG503H); или
e) их комбинации.
13. Имплантат по п. 12, который дополнительно содержит трегалозу, фосфат натрия, полисорбат 20 или их комбинацию.
14. Имплантат по п. 13, который содержит около 82,5 масс. % поли(D,L-лактид-ко-гликолида), имеющего кислотную концевую группу, характеристическую вязкость 0,32-0,44 дл/г (0,1% в хлороформе при 25°С) и соотношение D,L-лактид : гликолид, равное около 50:50 (RESOMER® RG503H); около 10 масс. % антитела, DARPin или антикалина; около 6 масс. % трегалозы; около 0,1 масс. % полисорбата 20; и около 1,4 масс. % фосфата натрия.
15. Имплантат по п. 13, который содержит около 8,8 масс. % поли(D,L-лактид-ко-гликолида), имеющего кислотную концевую группу, характеристическую вязкость 0,16-0,24 дл/г (0,1% в хлороформе при 25°С) и соотношение D,L-лактид : гликолид, равное около 50:50 (RESOMER® RG502H); около 79,7 масс. % поли(D,L-лактид-ко-гликолида), имеющего сложноэфирную концевую группу, характеристическую вязкость 0,16-0,24 дл/г (0,1% в хлороформе при 25°С) и соотношение D,L-лактид : гликолид, равное около 75:25 (RESOMER® RG752S); около 10 масс. % антитела, DARPin или антикалина; около 0,1 масс. % полисорбата 20; и около 1,4 масс. % фосфата натрия.
16. Имплантат по любому из пп. 1-15, который экструдирован при температуре между 60°С и 90°С.
17. Устройство для инъецирования внутриглазного имплантата в глаз млекопитающего, включающее i) удлиненный корпус с продольной осью, и ii) катетер, проходящий в продольном направлении от корпуса, имеющий внутренний конец, острый дистальный конец и полость внутри него. Катетер дополнительно содержит имплантат по любому из вышеприведенных пп. 1-16, причем имплантат расположен в полости катетера.
18. Способ лечения патологического состояния глаза у млекопитающего, нуждающегося в таком лечении, который включает установку имплантата по любому из пп. 1-16 в глаз млекопитающего, таким образом, осуществляя лечение патологического состояния глаза.
19. Способ по п. 18, отличающийся тем, что патологическим состоянием глаза является неоваскуляризация глаза, хороидальная неоваскуляризация, дистрофия желтого пятна или отек желтого пятна.
20. Способ по п. 19, отличающийся тем, что имплантат устанавливают в стекловидное тело глаза.
21. Способ по п. 20, отличающийся тем, что млекопитающим является человек.
22. Способ по п. 21, отличающийся тем, что имплантат эффективно лечит патологическое состояние глаза, в течение по меньшей мере 4 недель после введения имплантата в глаз.
23. Способ по п. 22, отличающийся тем, что имплантат эффективно лечит патологическое состояние глаза, в течение по меньшей мере 90 дней после введения имплантата в глаз.
24. Способ получения биодеградируемого внутриглазного имплантата, который обеспечивает непрерывное высвобождение белка в биологически активной форме в течение по меньшей мере 30, 60 или 90 дней после введения имплантата в глаз млекопитающего, включающий:
a) приготовление сухого порошка, состоящего из одного или более белков и, необязательно, одного или более вспомогательных веществ, солей, буферных агентов, консервантов, полиэлектролитов или их комбинации;
b) смешивание сухого порошка с одним или более сополимером поли(D,L-лактидом-ко-гликолидом) для образования смеси;
c) экструдирование смеси при температуре между 60°С и 90°С для образования волокна;
d) разрезание волокна для получения имплантатов длиной 0,5-10 мм, пригодных для введения в глазничную область глаза.
Пример 1
Составы
Моноклональные антитела встраивают в PLGA- или PLA-имплантаты путем экструзии. Композиция AVASTIN®, коммерчески доступное моноклональное антитело, содержит 25 мг/мл бевацизумаба, 60 мг/мл α,α трегалозы дигидрата, 51 мМ фосфата натрия рН 6,2 и 0,04% полисорбата 20. Замену буфера осуществляли на вращающейся обессоливающей колонке Zeba, чтобы изменить состав композиции AVASTIN® при помощи различных типов и количеств углеводов, солей и поверхностно-активных веществ. Измененный состав затем лиофилизировали до образования порошка. При необходимости, дополнительные вспомогательные вещества, такие как компоненты для улучшения растворимости, высвобождающие модуляторы и консерванты, могут быть добавлены и лиофилизированы совместно с белковым составом. Лиофилизированный порошок смешивали с полимерами и вспомогательными веществами в соответствующих соотношениях при помощи шейкера Turbula. Компоненты могут быть размолоты по отдельности или совместно при помощи Retsch М200. Порошкообразная смесь затем экструдируется в волокна с диаметром различного размера и позже разрезается на имплантаты различной длины.
Несколько имплантатов с PLGA/PLA и моноклональными антителами были изготовлены способом, описанным в последующих примерах. Выход моноклонального антитела из имплантатов оценивали in vitro.
Имплантаты помещали в пробирки, содержащие среду высвобождения (PBS с 0,01% азида натрия), и встряхивали при температуре 37°С. В подходящие моменты времени образец извлекали из среды высвобождения для анализа и среду полностью заменяли на свежую, чтобы сохранить условия достаточного разбавления. Неповрежденные антитела в образце анализировали при помощи SEC-HPLC и кумулятивный процент высвобождения лекарственного средства из имплантата записывали как функцию времени. Активность антител определяли при помощи ELISA.
Пример 2
Изготовление и тестирование имплантатов, содержащих моноклональные антитела и биодеградируемые полимеры
Полноразмерное моноклональное антитело, бевацизумаб, видоизменяли из его исходной композиции (AVASTIN®) при помощи вращающейся обессоливающей колонки Zeba (Thermo scientific), как это описано выше в Примере 1. Соответствующие количества вспомогательных веществ и буферного агента в композиции AVASTIN® варьировали в пределах диапазона концентраций фосфата натрия (от 0 до 51 мМ, включая фосфаты натрия и динатрия, для создания рН перед лиофилизацией около 6-7), α,α трегалозы дигидрата (от 0 до 60 мг/мл), полисорбата 20 (от 0 до 0,04%) и совместно лиофилизировали с антителом бевацизумаб. При необходимости, дополнительные вспомогательные вещества, такие как ПЭГ 3350 (от 0 до 10 мг/мл), могут быть добавлены и совместно лиофилизированы. Лиофилизированный порошок получали на FTS Lyostar, используя цикл лиофилизации, подходящий для белков.
Содержание влаги в сухом порошке измеряли в диапазоне 3-6% при помощи термогравиметрического анализа (TGA), чистоту антитела определяли в пределах 70-100% при помощи эксклюзионной хроматографии - HPLC (SEC-HPLC).
Для разделения использовалась колонка TSKgel G3000SWxl (7,8 мм × 30 см). SEC-HPLC-анализ выполняли в изократическом режиме при скорости потока 0,5 мл/мин, продолжительность 30 мин. Детектор устанавливали на длину волны 280 нм.
Различные полимерные композиции были получены от Boehringer Ingelheim Corp, включая RESOMER® Products RG502H, RG503H, RG504H, RG502, RG503, RG504, RG752S, RG753S, RG755S, R203S и R203H. Полимерные компоненты, дополнительные вспомогательные вещества, если они были, и лиофилизированный порошок смешивали в соответствующих соотношениях, используя шейкер Turbula типа T2F (Glenn Mills) при 96 rpm в течение 10 минут (дважды), или перемалывали при помощи Retsch модели ММ200 при 20 cpm в течение 10 минут (дважды). Порошкообразную смесь спрессовывали в цилиндре из нержавеющей стали при помощи модифицированного порошкового компактора с пневматическим приводом (Janesville Tool) при давлении 50 psi. Порошкообразную смесь экструдировали при помощи изготовленного на заказ поршневого экструдера. Параметры процесса выбирали, исходя из состава композиции и желаемого диаметра. Диаметр насадки изменяли в пределах от 400 до 480 мкм. Температуру экструзии изменяли в пределах от 60 до 90°С.Систему приводили в равновесие в течение 20 мин перед экструзией со скоростью 0,0025 дюйма/мин. Первые 2-4 дюйма экструдата отбрасывали. После этого, кусок длиной 3-5 дюймов отрезали и помещали в пробирку центрифуги. Образцы маркировали и хранили в запечатанных конвертах из фольги с осушителем.
Шесть образцов длиной 5-6 мм (от 1 до 1,5 мг) отрезали от каждого состава. Образцы взвешивали и помещали в стеклянные пробирки объемом 4 мл. Два миллилитра среды высвобождения (натрий-фосфатного буфера в модификации Дульбекко с 0,2 мг/мл азида натрия) добавляли в каждую пробирку. Каждую пробирку запечатывали пленкой и помещали во встряхиваемую водяную баню при температуре 37°С и 50 rpm. В подходящие моменты времени образец извлекали из среды высвобождения для анализа и среду полностью заменяли на 2 мл свежей среды. Образцы анализировали при помощи модуля разделения Waters 2690 и абсорбционного детектора при двух длинах волн Waters 2487. Для разделения использовалась колонка TSK gel G3000SWx1 (7,8 мм × 30 см). Степень высвобождения может быть определена путем расчета количества антитела, которое было высвобождено в заданный объем среды в течение времени. Выбранные образцы анализировали на активность при помощи твердофазного иммуноферментного анализа (ELISA), используя рекомбинант человека VEGF-A для захвата антитела и нечеловеческий Fc/HRP для обнаружения антитела. Таблица 1 содержит список примеров внутриглазных имплантатов (экструдированных волокон), содержащих антитело, изготовленных при помощи этого процесса. Полимер(ы) RESOMER® PLGA и PLA, включенные в каждый состав, можно распознать по номеру полимера, указанному в верхней части таблицы. Степень и длительность высвобождения антитела in vitro из этих имплантатов представлены на Фигурах 1-6 и 8 и описаны ниже.


Фигура 1 демонстрирует in vitro высвобождение бевацизумаба из имплантата PLGA-бевацизумаб, содержащего 82,5 масс. % RG503H, 10 масс. % бевацизумаба, 6 масс. % трегалозы, 1,4 масс. % фосфата натрия и 0,1 масс. % полисорбата 20 (Состав №1). График показывает, что около 10% моноклонального антитела высвобождается из полимерного имплантата в течение первого дня. Относительно постоянная скорость высвобождения наблюдалась для первых 28 дней с кумулятивным высвобождением приблизительно 45% лекарственного средства на 28 день. На 35 день высвободилось незначительное количество неповрежденного антитела. Важно, что сопоставимые профили высвобождения наблюдались с помощью SEC-HPLC и ELISA, иллюстрируя тот факт, что моноклональное антитело сохраняет свою биологическую активность после встраивания в и высвобождения из биодеградируемого полимера.
Фигура 2 иллюстрирует возможность увеличения продолжительности высвобождения лекарственного средства из PLGA-имплантата путем выбора полимера. При смешивании RG753S и RG502H в соотношении 90 к 10 (Состав №2) имплантат PLGA-бевацизумаб показывает увеличение длительности высвобождения от 1 месяца до 2 месяцев.
Фигура 3 иллюстрирует возможность увеличить непрерывную длительность высвобождения по меньшей мере до 3 месяцев (около 90 дней) путем изменения состава композиции. В этом примере вспомогательное вещество трегалоза было удалено, и полимер представлял собой смесь RG752S и RG502H в соотношении 90 к 10 (Состав №3).
Фигура 4 демонстрирует возможность регулировать высвобождение бевацизумаба из имплантатов PLGA-бевацизумаб путем изменения состава полимера, в особенности смеси полимеров (например, RG752S и RG502H). Включение RG502H (50:50 лактид: гликолид с кислотной концевой группой) может увеличить поглощение воды и следовательно облегчить высвобождение, как в случае имплантатов, содержащих смесь RG752S и RG502H на Фигуре 4. Фигура 4 сравнивает in vitro высвобождение антитела бевацизумаба из имплантатов, имеющих Составы №4, 5 и 6.
Фигура 5 показывает возможность модифицирования высвобождения бевацизумаба из имплантатов PLGA-бевацизумаб путем изменения количества вспомогательного вещества, в особенности содержания трегалозы. Включение водорастворимого углевода, подобного трегалозе, может увеличить поглощение воды и создать пористые каналы, следовательно, облегчить высвобождение. Фигура 5 сравнивает in vitro высвобождение антитела бевацизумаба из имплантатов, имеющих Составы №4, 7 и 8.
Фигура 6 иллюстрирует влияние количества лекарственного средства на кривую высвобождения имплантатов PLGA-бевацизумаб. Когда количество лекарственного средства увеличивается, возрастает начальный всплеск, а длительность уменьшается. Фигура 6 сравнивает in vitro высвобождение антитела бевацизумаба из имплантатов, имеющих Составы №1 и 9.
Фигура 8 показывает кривую высвобождения "всплеск-плато", полученный для имплантата, имеющего Состав №10, с ~65% высвобождением бевацизумаба в 1 день и кумулятивным высвобождением ~70% к 7 дню. Минимальное высвобождение, либо его отсутствие, наблюдалось после 7 дня.
Пример 3
In vivo тестирование имплантата, содержащего антитело
Фигура 7 демонстрирует результат in vivo тестирования, при котором экструдированный имплантат (Состав №1) был установлен хирургическим путем в стекловидное тело одного глаза кролика. В этой фармакодинамической модели кролика подвергали действию VEGF, что привело к разрушению гематоретинального барьера на двухнедельный срок; изображения, записанные при помощи флуоресцентной ангиографии, позволили оценить, настолько ли эффективно лекарственное средство высвобождалось из имплантата, чтобы устранить нарушение. Флуоресцентные изображения показали, что имплантат PLGA-бевацизумаб (СДЛС, система доставки лекарственных средств) по сравнению с PLGA-имплантатом (плацебо) является эффективным для устранения нарушения на 2 и 4 неделях, что свидетельствует о непрерывном высвобождении в течение как минимум месяца.
Этот результат является важным, так как он демонстрирует, что большие макромолекулы, подобные полноразмерному моноклональному антителу, могут сохранять свою третичную структуру во время лиофилизации, могут быть встроены в полимерную систему доставки лекарственных средств (СДЛС), что происходит при повышенных температурах, и могут быть высвобождены из полимерной системы доставки лекарственных средств в биологически активной форме.
Эти фигуры и примеры демонстрируют возможность формирования разнообразных составов, содержащих бевацизумаб, для получения различных непрерывных длительностей высвобождения. Кроме того, эти примеры иллюстрируют, что большие макромолекулы могут сохранять свою структуру и активность на протяжении всего процесса изготовления (лиофилизация и экструзия при повышенной температуре) и высвобождаться из полимера. Эти результаты являются значительными, так как они демонстрируют возможность успешно доставлять активные моноклональные антитела из полимерных имплантатов в течение нескольких месяцев.
Реферат
Группа изобретений относится к биодеградируемым имплантатам с долговременным высвобождением белка в ткань млекопитающих. Раскрыт экструдированный биодеградируемый внутриглазной имплантат, содержащий биодеградируемую полимерную матрицу и белок, связанный с биодеградируемой полимерной матрицей, причем биодеградируемая полимерная матрица содержит первый поли(D,L-лактид-ко-гликолид) и второй поли(D,L-лактид-ко-гликолид), причем первый поли(D,L-лактид-ко-гликолид) имеет сложноэфирную концевую группу и соотношение D,L-лактид : гликолид, равное 75:25, а второй поли(D,L-лактид-ко-гликолид) имеет кислотную концевую группу и соотношение D,L-лактид : гликолид, равное 50:50. Также раскрыты устройство для установки внутриглазного имплантата, способ лечения патологического состояния глаза с использованием внутриглазного имплантата, способ получения внутриглазного имплантата, а также экструдированный биодеградируемый внутриглазной имплантат, дополнительно содержащий фосфат натрия, полисорбат 20 и антитело, которое связывает фактор роста эндотелия сосудов. Группа изобретений обеспечивает непрерывное высвобождение белка в биологически активной форме в течение по меньшей мере двух месяцев после установки имплантата в глаз млекопитающего. 5 н. и 9 з.п. ф-лы, 8 ил., 1 табл., 3 пр.

Комментарии