Металл-саленовое комплексное соединение, локальный анестетик и антибластомное лекарственное средство - RU2617450C2
Код документа: RU2617450C2
Чертежи















Описание
Область техники, к которой относится изобретение
Настоящее изобретение относится к металл-саленовому комплексному соединению и к металл-саленовому комплексному соединению, которое является намагничивающимся и может быть использовано в составах мазей, локальному анестетику, содержащему металл-саленовое комплексное соединение, и антибластомному лекарственному средству, содержащему это металл-саленовое комплексное соединение.
Предпосылки создания изобретения
Обычно, когда лекарственное средство вводят в живой организм, оно проникает в пораженную область и оказывает свои фармакологические воздействия на эту пораженную область, таким образом оказывая свои терапевтические воздействия. С другой стороны, даже если лекарственное средство достигает ткани, другой, чем пораженная область (то есть, нормальная ткань), оно не должно быть терапевтическим. Следовательно, важным является то, каким образом направлять лекарственное средство к пораженной области.
Способ направления лекарственного средства к пораженной области называют доставкой лекарственного средства к участку действия, которая была недавно активно изучена и разработана. Эта доставка лекарственного средства к участку действия имеет, по меньшей мере, два преимущества. Одним преимуществом является то, что в ткани пораженной области может быть достигнута достаточно высокая концентрация лекарственного средства. Фармакологические воздействия не могут быть видны, если концентрация лекарственного средства в пораженной области не имеет постоянного значения или более. Достаточные терапевтические воздействия не могут быть ожидаемыми, если концентрация лекарственного средства является низкой. Вторым преимуществом является то, что лекарственное средство направляется только к ткани пораженной области и, следовательно, могут быть ингибированы побочные реакции в нормальной ткани.
Такая доставка лекарственного средства к участку действия является наиболее эффективной для лечения рака противоопухолевыми агентами. Наибольшее количество противоопухолевых агентов ингибирует клеточный рост раковых клеток, которые активно делятся, так что противоопухолевые агенты также ингибируют клеточный рост даже в случае нормальной ткани, в которой клетки активно делятся, такой, как костный мозг, корни волос или слизистая оболочка пищеварительного канала. Следовательно, пациенты с раковым заболеванием, которым вводят противоопухолевые агенты, страдают от побочных реакций, таких, как анемия, потеря волос и рвота. Так как такие побочные реакции оказывают тяжелые нагрузки на пациентов, доза должна быть ограничена, таким образом, вызывая проблему неспособности к достижению в достаточной степени фармакологических воздействий противоопухолевых агентов.
Алкильные антибластомные лекарственные средства среди таких противоопухолевых агентов (антибластомные лекарственные средства) представляют собой общий термин для противоопухолевых агентов, обладающих способностью комбинирования алкильной группы (-СН2-СН2-), например, с полинуклеотидным белком, и проявляют эффекты алкилирования ДНК и ингибирования репликации ДНК, вызывая гибель клетки. Эти эффекты действуют, невзирая на клеточные циклы, также оказывается действие на клетки G0-периода, имеет место сильное воздействие на клетки, которые активно растут, и имеется тенденция к повреждению, например, костного мозга, слизистой оболочки пищеварительного канала, половых клеток или корней волос.
Кроме того, антиметаболитные антибластомные лекарственные средства представляют собой соединения, имеющие структуры, подобные структурам нуклеиновых кислот или метаболитов в процессе синтеза белка, повреждают клетки, например, путем ингибирования синтеза нуклеиновых кислот и специфически воздействуют на клетки митотического периода.
Противоопухолевые антибиотики представляют собой химические вещества, продуцируемые микроорганизмами, оказывают воздействия, как например ингибирование синтеза ДНК и разрыв нити ДНК, и проявляют противоопухолевую активность.
Также, микроканальцевые ингибиторы обладают противоопухолевыми эффектами путем прямого воздействия на микроканальцы, которые играют важные роли для сохранения нормальных функций клеток, например, путем образования веретен во время деления клеток, локализации клеточных органелл и транспортировки веществ. Микроканальцевые ингибиторы воздействуют на клетки, которые активно делятся, и нервные клетки.
Кроме того, платиновые препараты ингибируют синтез ДНК путем образования нитей ДНК, межцепочечных связей или связей ДНК-белок. Цисплатин представляет собой типичное лекарственное средство, однако, он вызывает тяжелые нефропатии и требует замены большого количества жидкости.
Кроме того, парагормональные антибластомные лекарственные средства являются эффективными против гормонзависимых опухолей. Женские гормоны или антиандрогеновые лекарственные средства вводят в случае андрогензависимого рака простаты.
Молекулярнонаправленные лекарственные средства используют для направленного на молекулы лечения, которое соответствует молекулярным биологическим характерным особенностям, специфическим для соответственных злокачественных опухолей.
Кроме того, ингибиторы топоизомеразы представляют собой ферменты для временно генерируемых разрывов в ДНК и изменения числа сплетений ДНК-нитей. Ингибитор топоизомеразы I представляет собой фермент, который генерирует разрывы в одной нити кольцевой ДНК, позволяет проходить другой нити и затем замыкает разрывы, а ингибитор топоизомеразы II временно разрывает две нити кольцевой ДНК, позволяет другим двум нитям ДНК проходить между первыми двумя нитями и снова связывает разорванные нити.
Кроме того, неспецифические иммунопотенциаторы ингибируют увеличение раковых клеток путем активации иммунной системы.
Локальные анестетики также обладают преимуществом доставки лекарственного средства к месту действия. Локальные анестетики используют для лечения локальных зудов и болей, например, в случае слизистой оболочки или кожи, вызываемых геморроидальным заболеванием, стоматита, заболевания десен, полостей, удаления зубов или в случае операций. Лидокаин (название продукта: ксилокаин) известен как типичный локальный анестетик; однако, этот лидокаин является более быстро действующим, но обладает антиаритмическим действием. Кроме того, если лидокаин, который является анестетиком, инъецируют в цереброспинальную жидкость, когда осуществляют спинальную анестезию, лидокаин распространяется по цереброспинальной жидкости; и, по «сценарию» наихудшего случая, имеется опасение, что лидокаин может достигать цервикальной части спинного мозга и, таким образом, вызывает прекращение дыхательной функции и оказывает критические отрицательные воздействия.
Примером конкретного способа доставки лекарственного средства к участку действия является использование носителя. Этот способ представляет собой нагружение носителя, который имеет тенденцию концентрироваться в пораженной области, лекарственным средством и носитель переносит лекарственное средство к пораженной области. Подающим надежды кандидатом в носители является магнитное вещество и имеется предлагаемый способ присоединения носителя, который является магнитным веществом, к лекарственному средству и позволяет носителю аккумулироваться в пораженной области посредством магнитного поля (см., например, Патентную Литературу 1).
Однако, когда используют магнитное вещество в качестве носителя, является затруднительным введение магнитного вещества-носителя, так как молекулы носителя являются обычно гигантскими и имеются технические проблемы в отношении прочности связывания и аффинности между носителем и молекулами лекарственного средства; и, вследствие вышеуказанных причин, является затруднительным достижение практического применения магнитного вещества-носителя.
Поэтому вводят локальный анестетик, в котором боковые цепи, для достижения плотности положительного или отрицательного спин-заряда, связаны с основным скелетом органического соединения и который пригоден в целом до тех пор, пока локальный анестетик направлен посредством магнетизма за счет внешнего магнитного поля; и, если локальный анестетик применяют в случае человеческого организма или животного, он сохраняется в области, где магнитное поле наложено локально посредством магнитного поля вне тела, и на область оказываются лекарственные воздействия, которыми первоначально обладает локальный анестетик. В случае вышеуказанного способа используют железо-саленовый комплекс в качестве примера такого лекарственного средства (см. Патентную Литературу 2).
Кроме того, представлена обзорная статья в отношении органического магнитного вещества, которое образует магниты из высокополимерных материалов посредством синтеза «высокоспиновых молекул» с более параллельными спинами, чем обычные металл-магнитные вещества (например, см. Патентную Литературу 3).
Кроме того, также приводится способ, согласно которому содержащуюся в цисплатине платину заменяют другим элементом (например, см. Патентную литературу 4).
Перечень ссылок
Патентная литература
Патентная Литература 1: открытая выкладка заявки на патент Японии (Kokai), публикация № 2001-10978
Патентная Литература 2: Международная заявка WO-2008/001851
Непатентная Литература 1: Hiizu Iwamura, «Molecular Design Aimed at Organic Ferromagnetic Substances», февраль 1989, сс. 76-88
Непатентная Литература 2: Krsity Cochran и др., Structural Chemistry, 13 (2002), сс. 133-140
Краткое изложение сущности изобретения
Техническая проблема
Однако, разработка, например, лекарственных средств и систем доставки лекарственных средств к участку действия, способных эффективно переносить более превосходные инвазивные лекарственные средства к пораженной области, известна для лечений, которые относительно приводят к деформации у пациентов, как, например, в случае лечений раковых заболеваний языка, тканей посторбитальной части или т.п.
Настоящее изобретение задумано с точки зрения таких обстоятельств и целью настоящего изобретения является получение металл-саленового комплексного соединения, которое проявляет превосходные неинвазивности и может быть эффективно перенесено к пораженной области, локального анестетика, содержащего это металл-саленовое комплексное соединение, и антибластомного лекарственного средства, содержащего это металл-саленовое комплексное соединение.
Решение проблемы
Для достижения вышеуказанной цели, настоящее изобретение относится к металл-саленовому комплексному соединению, в котором часть атома металла в каждой из составных молекул металл-саленового комплекса или производного металл-саленового комплекса мультимеризована через воду, и которое смешивают с основой для получения мази.
Кроме того, относительно металл-саленового комплексного соединения согласно настоящему изобретению, составные молекулы, более предпочтительно, должны быть двумя молекулами и часть атома металла каждой из двух молекул, более предпочтительно, должна быть димеризована через воду.
Так как это металл-саленовое комплексное соединение может быть смешано с основой для получения мази, оно может быть введено в виде мази в пораженную область. Следовательно, металл-саленовое комплексное соединение проявляет превосходную неинвазивность и может быть эффективно перенесено к пораженной области.
Между прочим, «мазь» согласно настоящему изобретению включает, кроме того, например, мази, в которых используют маслянистые основы, крема, в которых используют эмульсионные основы, как описано в Фармакопее Японии. «Основа», используемая для получения мази, служит для прилипания к коже и приводит к оставлению на коже активных ингредиентов в течение длительного периода времени и основа, которая может быть легко нанесена, не обладает вызывающим раздражение эффектом на коже и не повреждает стабильность активных ингредиентов.
Кроме того, металл-саленовое комплексное соединение согласно настоящему изобретению может быть нанесено, например, на язык, десны и внутреннюю сторону щек путем смешения с основой, которая может быть использована в полости рта.
Примеры такой основы включают гидрофобные основы (маслянистые основы), гидрофильные основы (эмульсионные основы, водорастворимые основы, лиофобные основы), специальные композиции (как например линименты, пасты, пластыри, лосьоны и спреи), оральные мази и глазные мази; более конкретно, например, мазевые основы, как например вазелин (желтый вазелин, гидрофильный вазелин и белый вазелин), кеналог, жидкий парафин, полиэтоксилированное гидрогенизированное касторовое масло, макрогол и желатинируемый углеводород.
Предпочтительным воплощением настоящего изобретения является намагничивающийся металл-саленовый комплекс, представленный следующими химическими формулами (I), (II), (III), и его производные.
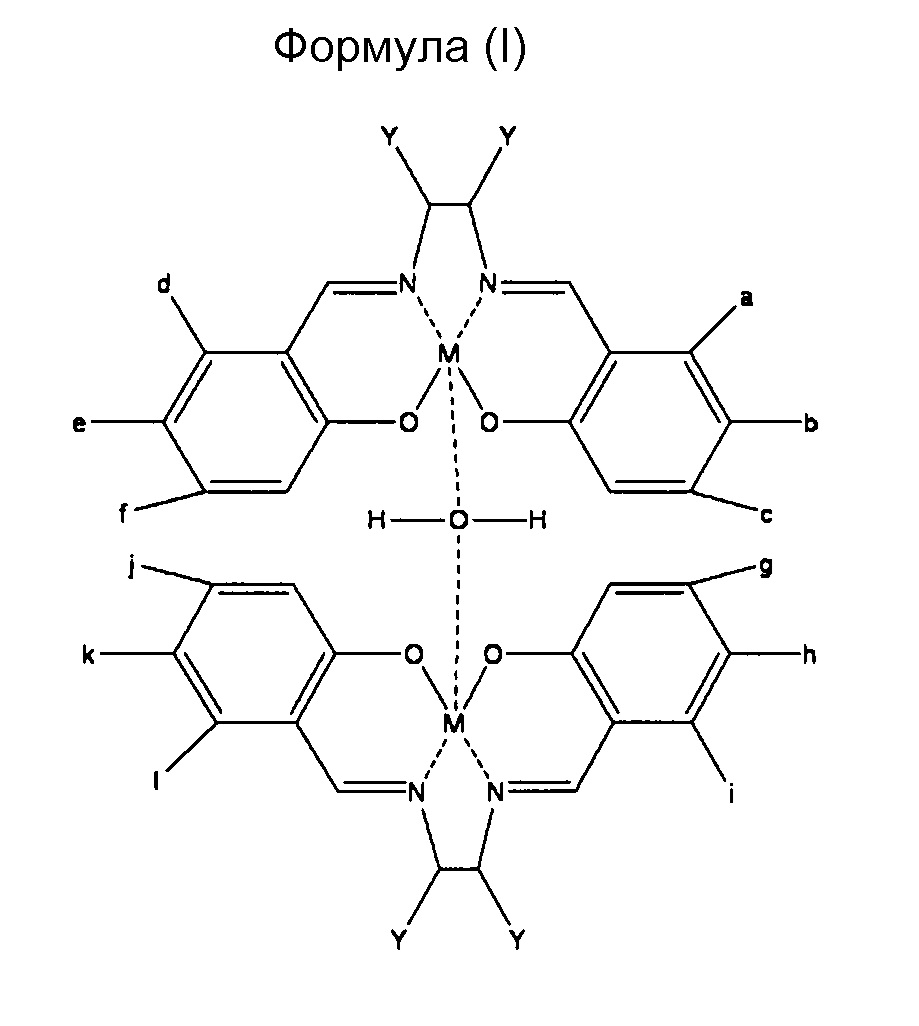


Однако, относительно всех формул (I), (II) и (III), М означает Fe (железо), Cr (хром), Mn (марганец), Со (кобальт), Ni (никель), Мо (молибден), Ru (рубидий), Rh (родий), Pd (палладий), W (вольфрам), Re (рений), Os (осмий), Ir (иридий), Pt (платина), Nd (ниобий), Sm (самарий), Eu (европий) или Gd (гадолиний), и каждый от а до f и Y означает водород (где М означает Fe, за исключением случая, где все от а до f и Y означают атомы водорода), или имеет любое значение из нижеперечисленного (1)-(7):
(1) -СО2Ме;
(2) -СО(ОСН2СН2)2ОСН3;

(где R2 представляет собой множество нуклеиновых кислот, которые комбинированы вместе и образованы из аденина, гуанина, тимина, цитозина или урацила);
(5) -NHCOH, -NH2, -NHR1 или -NR1R2;
(где R1 и R2 означают алкил или алкан с одинаковым числом атомов углерода или с числом атомов углерода от 1 до 6;
(6) -NHR3, -NHCOR3 или -R3;
(где R3 представляет собой замещающую связь как результат десорбции функциональной группы, такой как водород или гидроксильная группа); и
(7) атомы галогена, такие как хлор, бром или фтор.
Кроме того, перенос заряда от R3 предпочтительно должен быть менее чем 0,5 электронов (е).
Кроме того, R3 может быть одним любым из соединений, представленных следующими формулами (1)-(27).
(1) Ибупрофенпиконол, фенилпропионовая кислота, анальгетическое/противовоспалительное средство:

(2) Мефенаминовая кислота, антраниловая кислота, противовоспалительный анальгетик:


(3) Лекарственное средство для лечения гиперлипидемии:

(4) Антибактериальное средство:

(5) Фторохром (родамин):

(6) Гормон (эстроген):

(7) Гормон (эстроген):

(8) Таксол (паклитаксел):

(9) Аминокислота (глицин):

(10) Аминокислота (аланин):
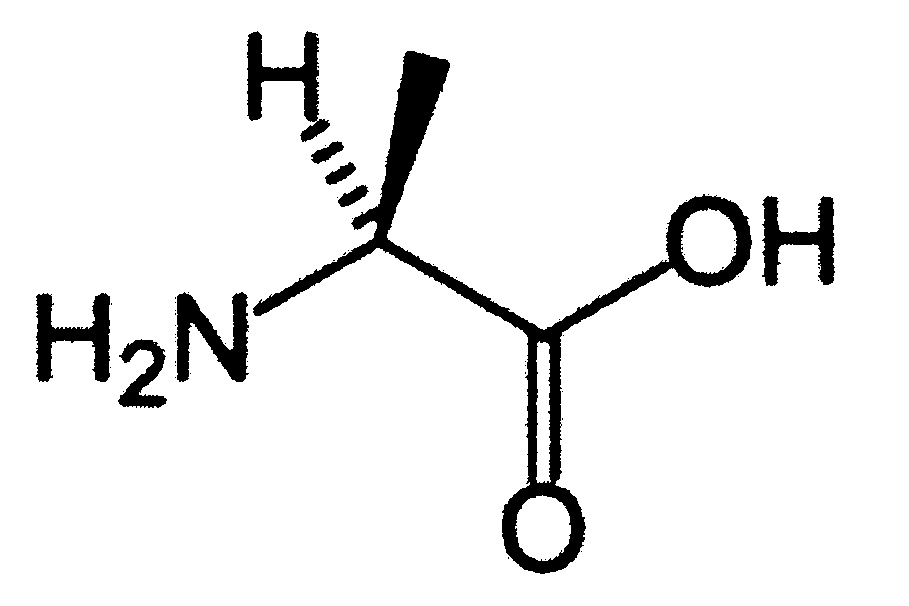
(11) Аминокислота (аргинин):

(12) Аминокислота (аспарагин):
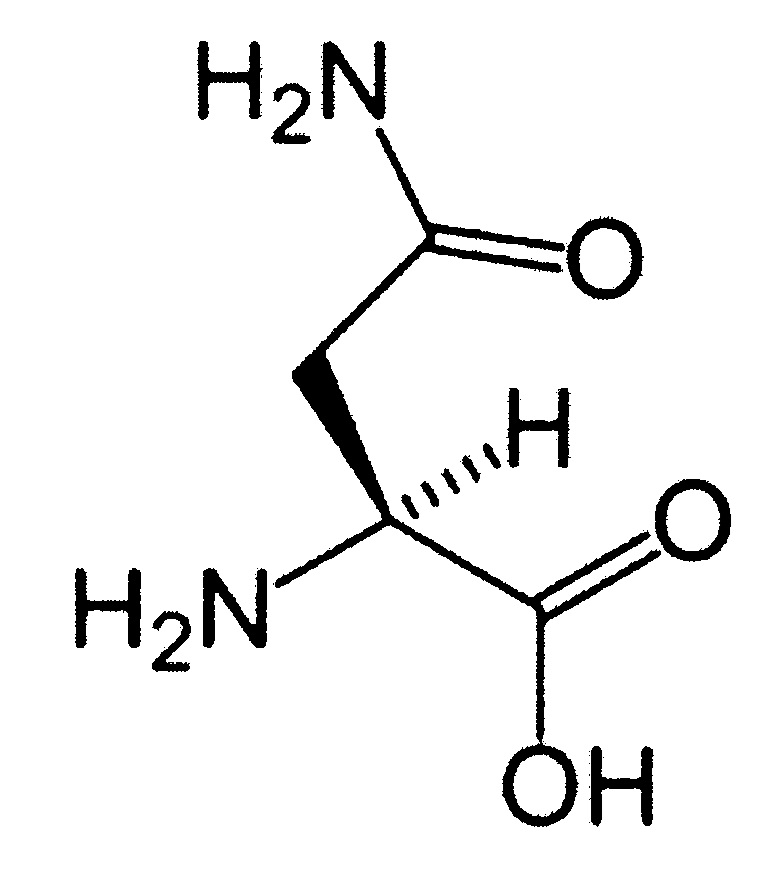
(13) Аминокислота (аспарагиновая кислота):

(14) Аминокислота (цистеин):

(15) Аминокислота (глутаминовая кислота):

(16) Аминокислота (гистидин):

(17) Аминокислота (изолейцин):

(18) Аминокислота (лейцин):

(19) Аминокислота (лизин):

(20) Аминокислота (метионин):
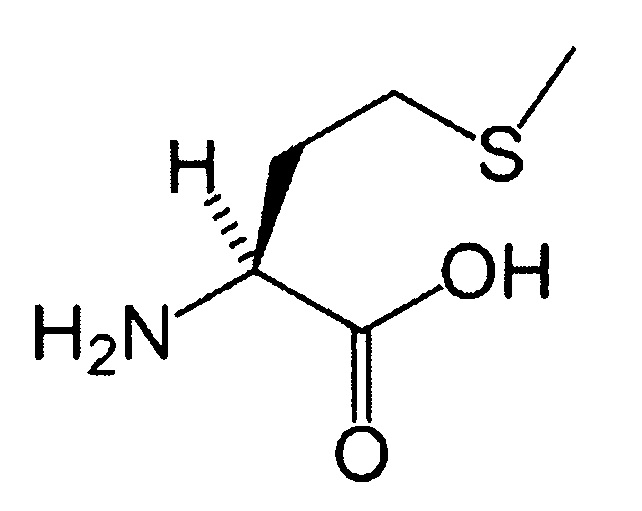
(21) Аминокислота (фенилаланин):

(22) Аминокислота (пролин):
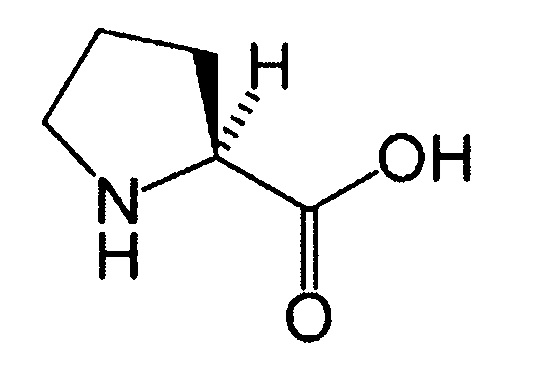
(23) Аминокислота (серин):

(24) Аминокислота (треонин):
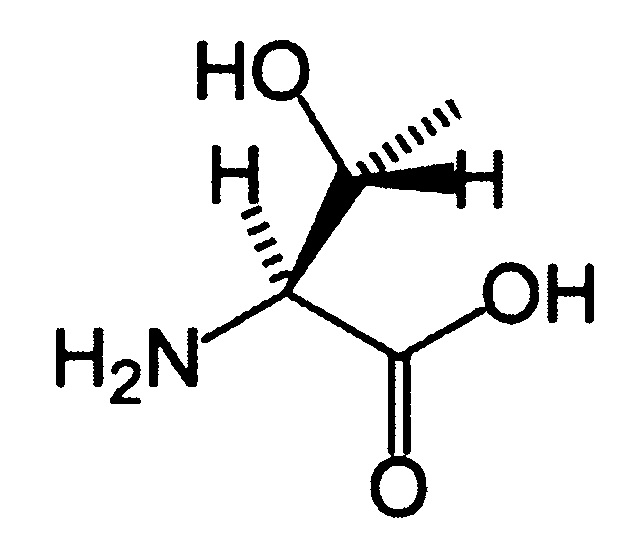
(25) Аминокислота (триптофан):

(26) Аминокислота (тирозин):

(27) Аминокислота (валин):

Кроме того, настоящее изобретение относится к локальному анестетику, включающему намагничивающееся металл-саленовое комплексное соединение, где R3 представляет собой заместитель, представленный любой из следующих формул (28)-(38), получаемый как результат десорбции водорода от соединения, которое имеет метильную группу и перенос заряда которого составляет менее чем 0,5 электронов (е).
(28) Общее название: лидокаин

(29) Общее название: этиламинобензойная кислота

(30) Общее название: оксибупрокаингидрохлорид

(31) Общее название: оксетазаин

(32) Общее название: дибукаин
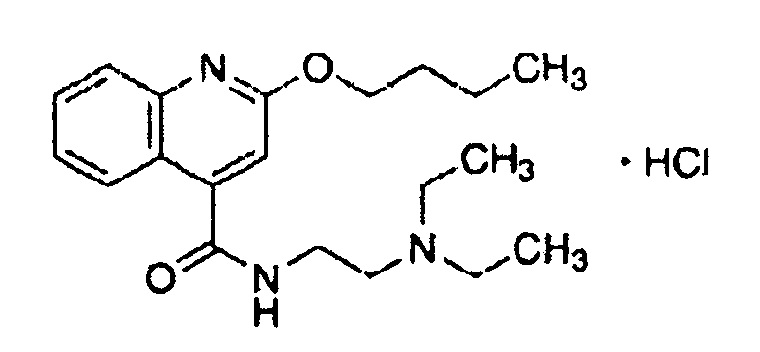
(33) Общее название: этилпиперидиноацетиламинобензоат
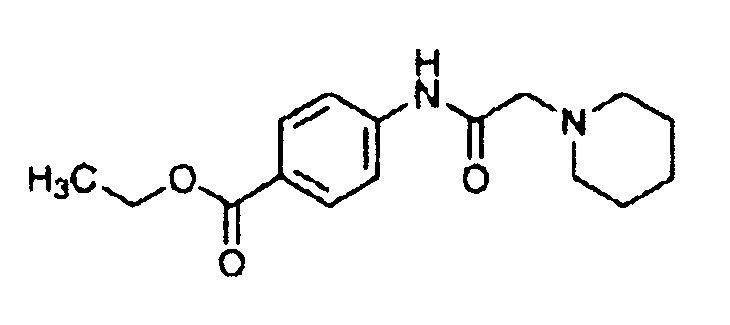
(34) Общее название: прокаин

(35) Общее название: мепивакаин

(36) Общее название: п-бутиламинобензоилдиэтиламиноэтанол-гидрохлорид

(37) Общее название: бупивакаингидрохлорид

(38) Общее название: ропивакаингидрохлоридгидрат

Кроме того, настоящее изобретение относится к антибластомному лекарственному средству, включающему намагничивающееся металл-саленовое комплексное соединение, где R3 представляет собой любое одно из соединений, представленных следующими формулами (39)-(103), которое комбинируется с основным скелетом соединения вышеприведенной формулы (I) через часть связывающей группы, получаемую как результат десорбции водорода (однако, в соединении (83), цианогруппа (-CN) представляет собой связывающую группу).
(39) Общее название: ифосфамид, алкильное антибластомное лекарственное средство

(40) Общее название: циклофосфамид, алкильное антибластомное лекарственное средство

(41) Общее название: дакарбазин, алкильное антибластомное лекарственное средство

(42) Общее название: бусульфан, алкильное антибластомное лекарственное средство

(43) Общее название: мелфалан, алкильное антибластомное лекарственное средство

(44) Общее название: ранимустин, алкильное антибластомное лекарственное средство

(45) Общее название: эстрамустиннатрийфосфат, алкильное антибластомное лекарственное средство

(46) Общее название: нимустингидрохлорид, алкильное антибластомное лекарственное средство

(47) Общее название: эноцитабин, антиметаболитное антибластомное лекарственное средство

(48) Общее название: капецитабин, антиметаболитное антибластомное лекарственное средство
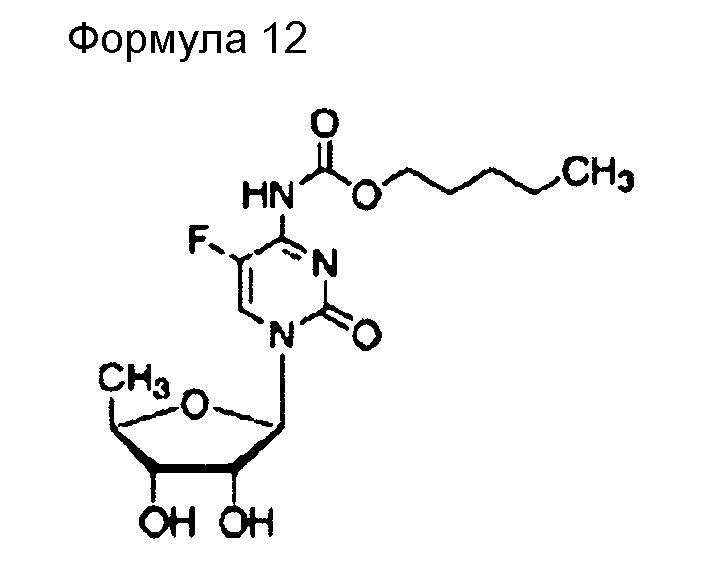
(49) Общее название: кармофур, антиметаболитное антибластомное лекарственное средство


(50) Общее название: гимерацил, антиметаболитное антибластомное лекарственное средство


(51) Общее название: отерацилкалий, антиметаболитное антибластомное лекарственное средство

(52) Общее название: цитарабин, антиметаболитное антибластомное лекарственное средство
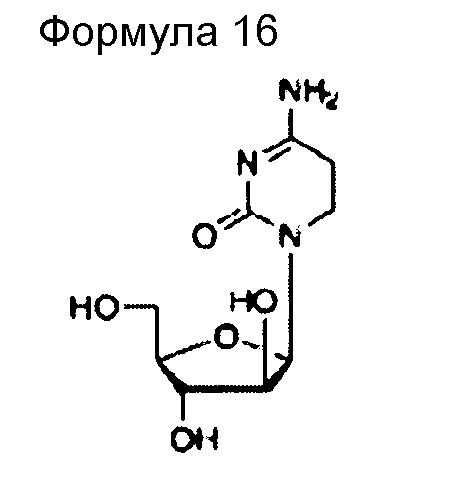
(53) Общее название: цитарабинокфосфат, антиметаболитное антибластомное лекарственное средство

(54) Общее название: тегафур, антиметаболитное антибластомное лекарственное средство

(55) Общее название: доксифлуридин, антиметаболитное антибластомное лекарственное средство
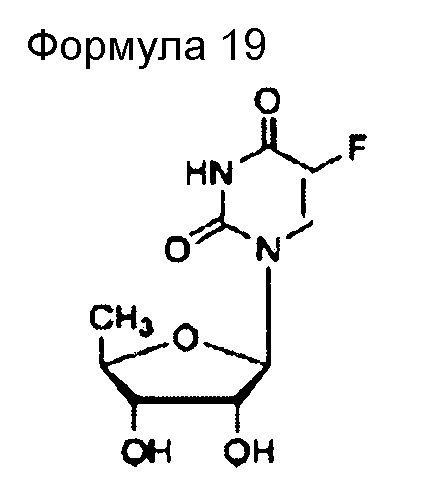
(56) Общее название: гидроксикарбамид, антиметаболитное антибластомное лекарственное средство
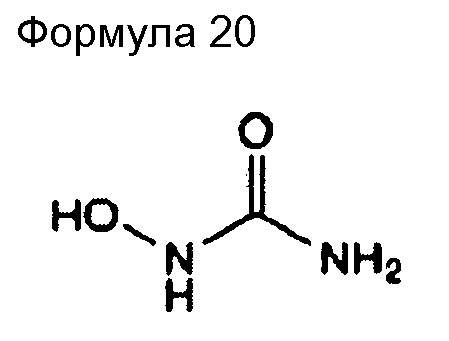
(57) Общее название: фторурацил, антиметаболитное антибластомное лекарственное средство

(58) Общее название: меркаптопурингидрат, антиметаболитное антибластомное лекарственное средство

(59) Общее название: флударабинфосфат, антиметаболитное антибластомное лекарственное средство

(60) Общее название: гемцитабингидрохлорид, антиметаболитное антибластомное лекарственное средство

(61) Общее название: актиномицин-D, противоопухолевый антибиотик

(62) Общее название: акларубицингидрохлорид, противоопухолевый антибиотик

(63) Общее название: идарубицингидрохлорид, противоопухолевый антибиотик

(64) Общее название: эпирубицингидрохлорид, противоопухолевый антибиотик

(65) Общее название: зиностатинстималамер, противоопухолевый антибиотик

R1 и R2 отличаются друг от друга и отвечают следующим формулам, соответственно, и то же самое относится к R’1 и R’2:

А1=Н или NH4
A2, A3=Н или NH4 или С4Н9
(А2 и А3 не означают С4Н9, в одно и то же время)
M+n: приблизительно в среднем 5,5
(66) Общее название: даунорубицингидрохлорид, противоопухолевый антибиотик
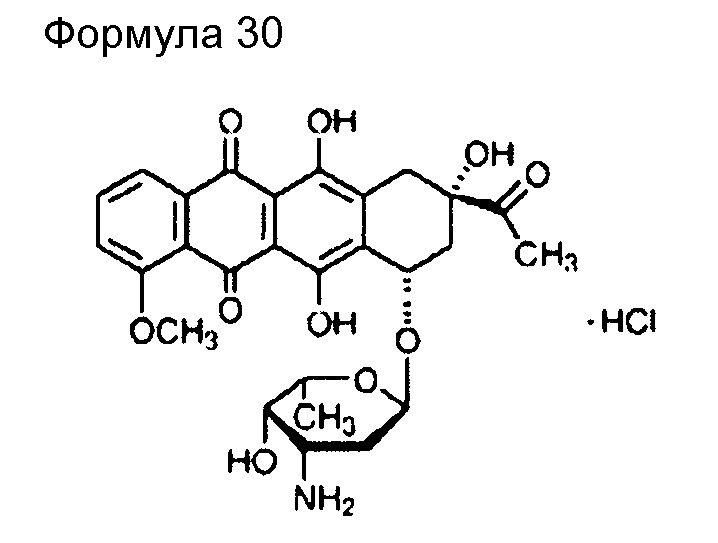
(67) Общее название: доксорубицингидрохлорид, противоопухолевый антибиотик

(68) Общее название: блеомицингидрохлорид, противоопухолевый антибиотик

(69) Общее название: пепломицинсульфат, противоопухолевый антибиотик

(70) Общее название: митомицин С, противоопухолевый антибиотик

(71) Общее название: амрубицингидрохлорид, противоопухолевый антибиотик

(72) Общее название: вибрамицингидрохлорид, противоопухолевый антибиотик

(73) Общее название: пирарубицингидрохлорид, противоопухолевый антибиотик

(74) Общее название: доцетакселгидрат, микроканальцевый ингибитор

(75) Общее название: винкристинсульфат, микроканальцевый ингибитор

(76) Общее название: винбластинсульфат, микроканальцевый ингибитор
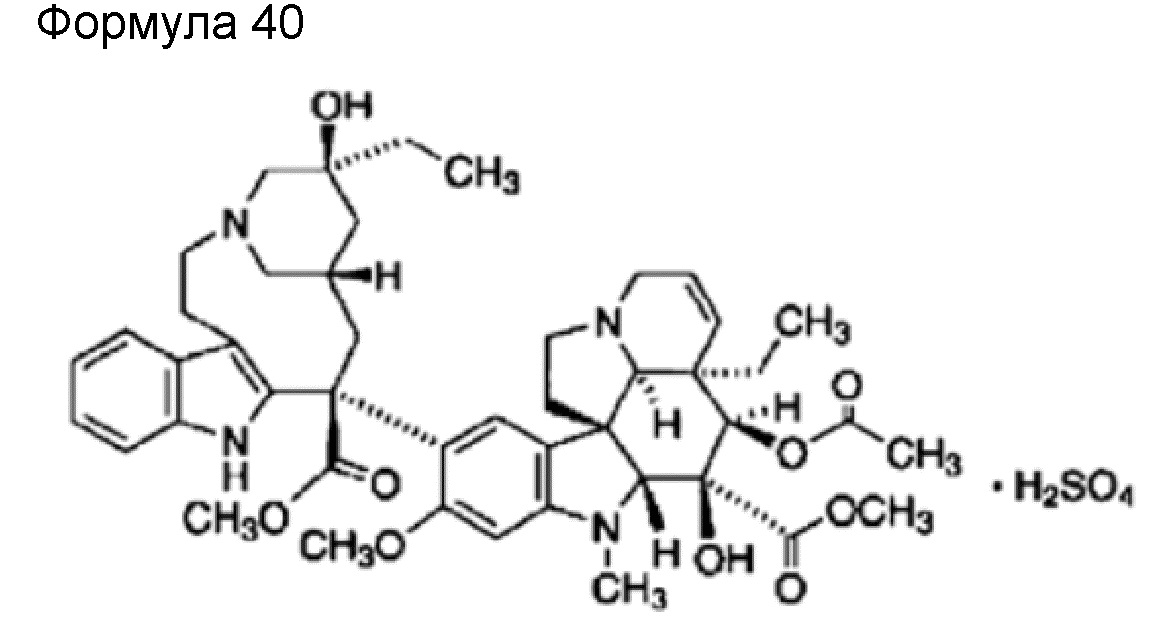
(77) Общее название: винорелбинтартрат, микроканальцевый ингибитор

(78) Общее название: виндесинсульфат, микроканальцевый ингибитор
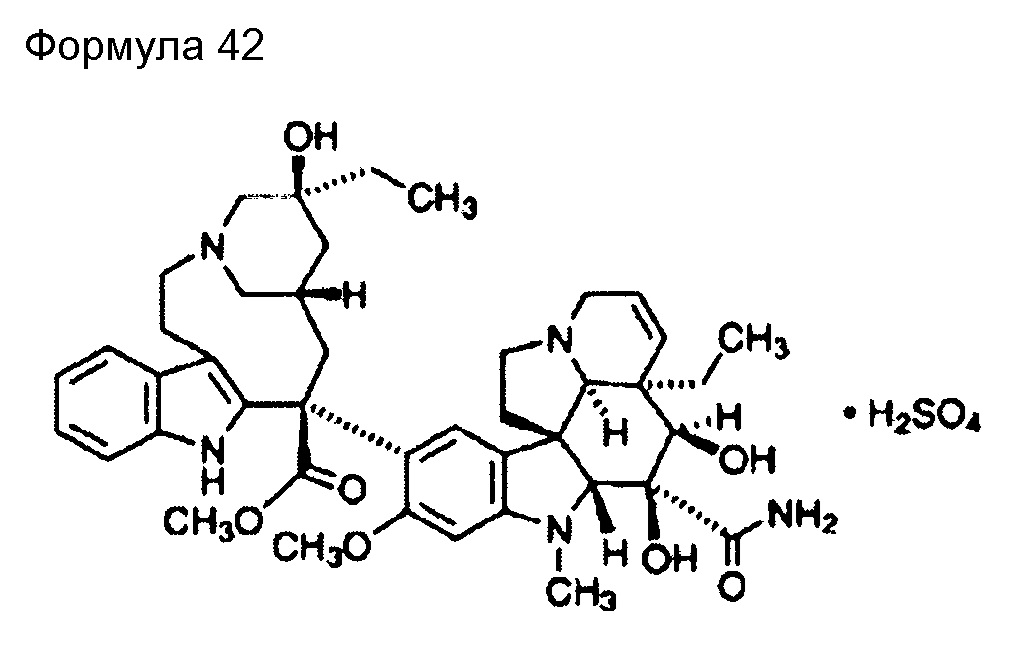
(79) Общее название: оксалиплатин, препарат на основе платины

(80) Общее название: карбоплатин, препарат на основе платины

(81) Общее название: цисплатин, препарат на основе платины
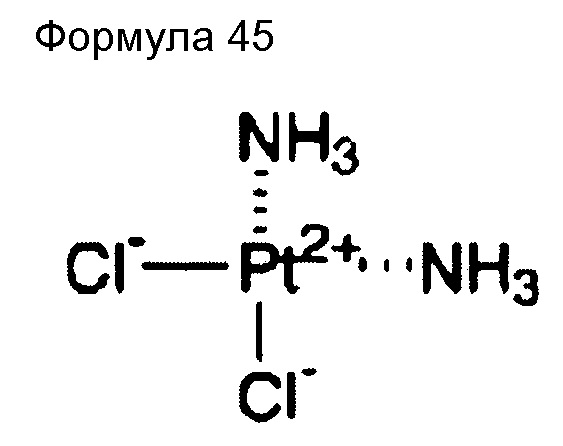
(82) Общее название: недаплатин, препарат на основе платины

(83) Общее название: анастрозол, парагормональное лекарственное средство

(84) Общее название: афема, парагормональное лекарственное средство


(85) Общее название: эксеместан, парагормональное лекарственное средство

(86) Общее название: тамоксифенцитрат, парагормональное лекарственное средство

(87) Общее название: торемифенцитрат, парагормональное лекарственное средство

(88) Общее название: бикалутамид, парагормональное лекарственное средство

(89) Общее название: флутамид, парагормональное лекарственное средство

(90) Общее название: мепитиостан, парагормональное лекарственное средство

(91) Общее название: эстрамустиннатрийфосфат, парагормональное лекарственное средство
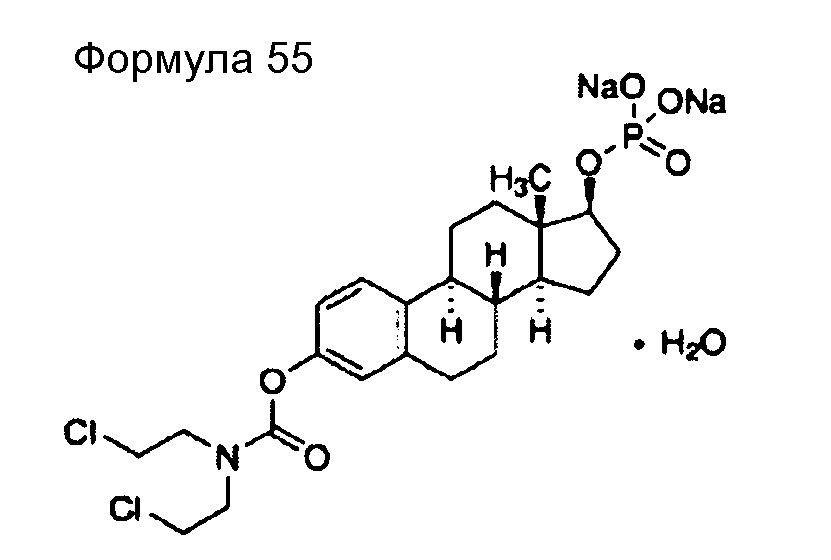

(92) Общее название: медроксипрогестеронацетат, парагормональное лекарственное средство
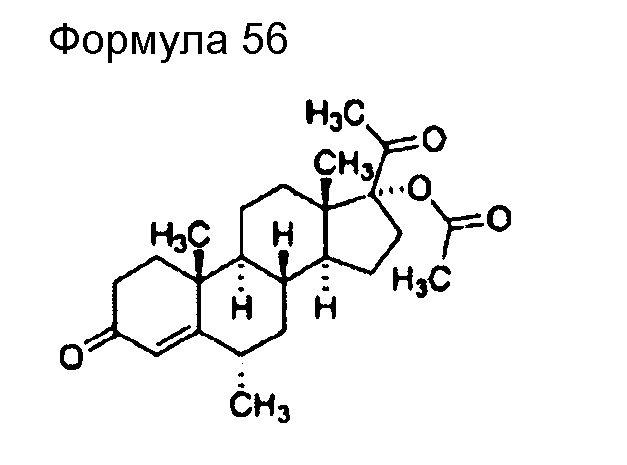
(93) Общее название: тамибаротен, молекулярно направленное терапевтическое лекарственное средство

(94) Общее название: гефитиниб, молекулярно направленное терапевтическое лекарственное средство
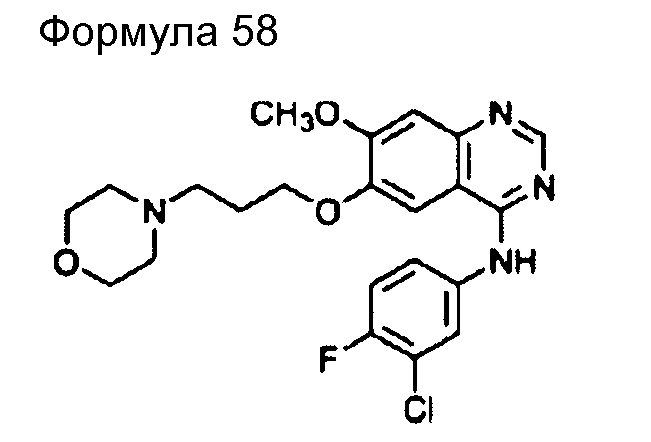
(95) Общее название: третиноин, молекулярно направленное терапевтическое лекарственное средство
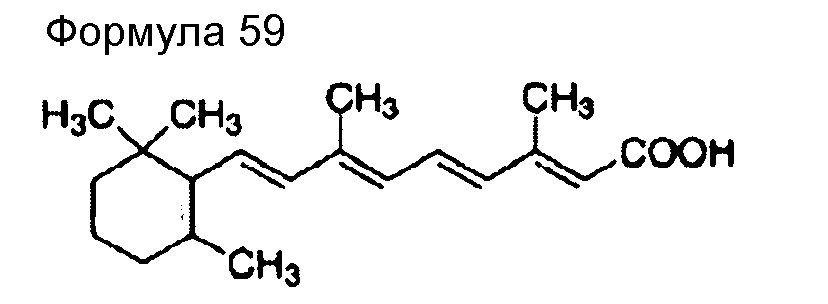

(96) Общее название: иматинибмезилат, молекулярно направленное терапевтическое лекарственное средство

(97) Общее название: этопозид, ингибитор топоизомеразы
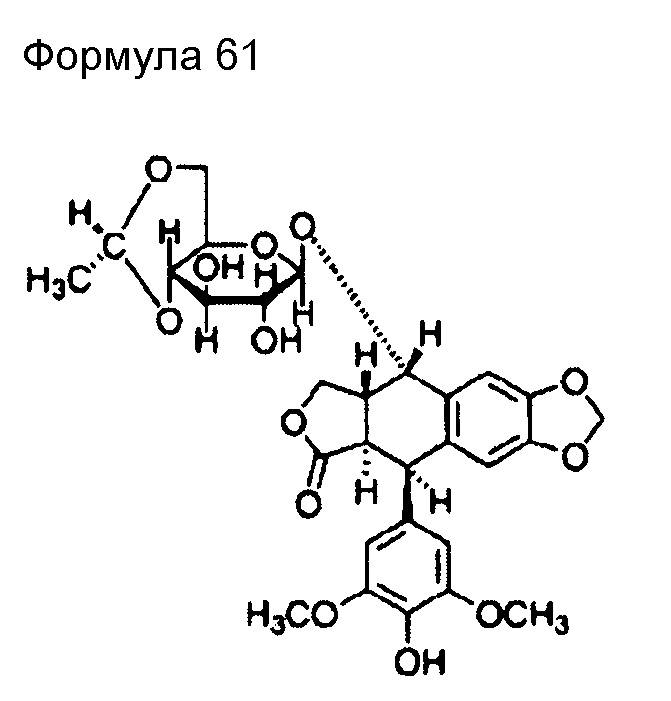
(98) Общее название: собузоксан, ингибитор топоизомеразы

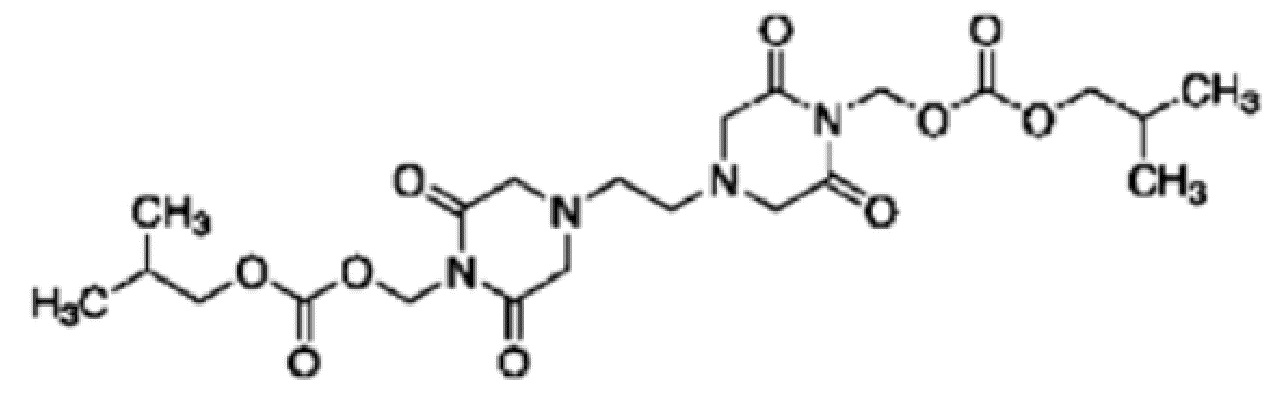
(99) Общее название: иринотекангидрохлорид, ингибитор топоизомеразы


(100) Общее название: ногитекангидрохлорид, ингибитор топоизомеразы


(101) Общее название: убенимекс, неспецифический иммуностимулятор

(102) Общее название: сизофиран, неспецифический иммуностимулятор

(103) Общее название: лентинан, неспецифический иммуностимулятор

Кроме того, настоящее изобретение относится к антибластомному лекарственному средству, включающему намагничивающееся металл-саленовое комплексное соединение, где R3 представляет собой любое одно из соединений, представленных следующими формулами (104)-(109).
(104) Наименование продукта: лейплин; и общее название: лейпрорелинацетат, противоопухолевый агент

(105) Наименование продукта: метотрексат; и общее название: метотрексат, противоопухолевый агент

(106) Наименование продукта: новантрон; и общее название: митоксантронгидрохлорид, противоопухолевый агент

(107) Наименование продукта: фотофрин; и общее название: порфимернатрий, противоопухолевый агент

(108) Наименование продукта: фотофрин; и общее название: порфимернатрий, противоопухолевый агент

(109) Наименование продукта: милотарг; и общее название: гемтузумабозогамицин, противоопухолевый агент

Полезные эффекты данного изобретения
В соответствии с настоящим изобретением, можно получать металл-саленовое комплексное соединение, которое проявляет превосходную неинвазивность и может быть эффективно перенесено в пораженную область, локальный анестетик, содержащий это металл-саленовое комплексное соединение, и антибластомное лекарственное средство, содержащее это металл-саленовое комплексное соединение.
Краткое описание чертежей
На фиг.1 представлен график, показывающий изменения по массе (TG) и результаты дифференциального термического анализа (ДТА), что касается металл-саленовых комплексных соединений согласно настоящему изобретению.
На фиг.2 представлена диаграмма, показывающая интегральную кривую металл-саленовых комплексных соединений согласно настоящему изобретению.
На фиг.3 представлена диаграмма, показывающая кривую магнитное поле-намагничивание Mn-саленового комплексного соединения.
На фиг.4 представлена диаграмма, показывающая кривую магнитное поле-намагничивание Cr-саленового комплексного соединения.
На фиг.5 представлена диаграмма, показывающая кривую магнитное поле-намагничивание Со-саленового комплексного соединения, при температуре 37°С (310 К).
На фиг.6 представлена кривая магнитное поле-намагничивание Fe-саленового комплексного соединения.
На фиг.7 представлен диаграммный рисунок состояния, где полюсовой магнит введен в контакт с прямоугольным флаконом.
На фиг.8 представлена типичная диаграмма, показывающая связь между расстоянием от магнита и количеством клеток (образцы) на единицу площади.
На фиг.9 представлен перспективный вид системы наведения.
На фиг.10 представлена типичная диаграмма, показывающая результаты измерения SNR клеток после помещения в систему наведения при использовании MRI.
На фиг.11 представлены фотоснимки, показывающие воздействия Fe-саленового комплексного соединения на рост меланомы у мыши.
На фиг.12 представлена типичная диаграмма, показывающая воздействия Fe-саленового комплексного соединения на меланомы.
На фиг.13 представлена диаграмма, показывающая результаты гистологического исследования Fe-саленового комплексного соединения.
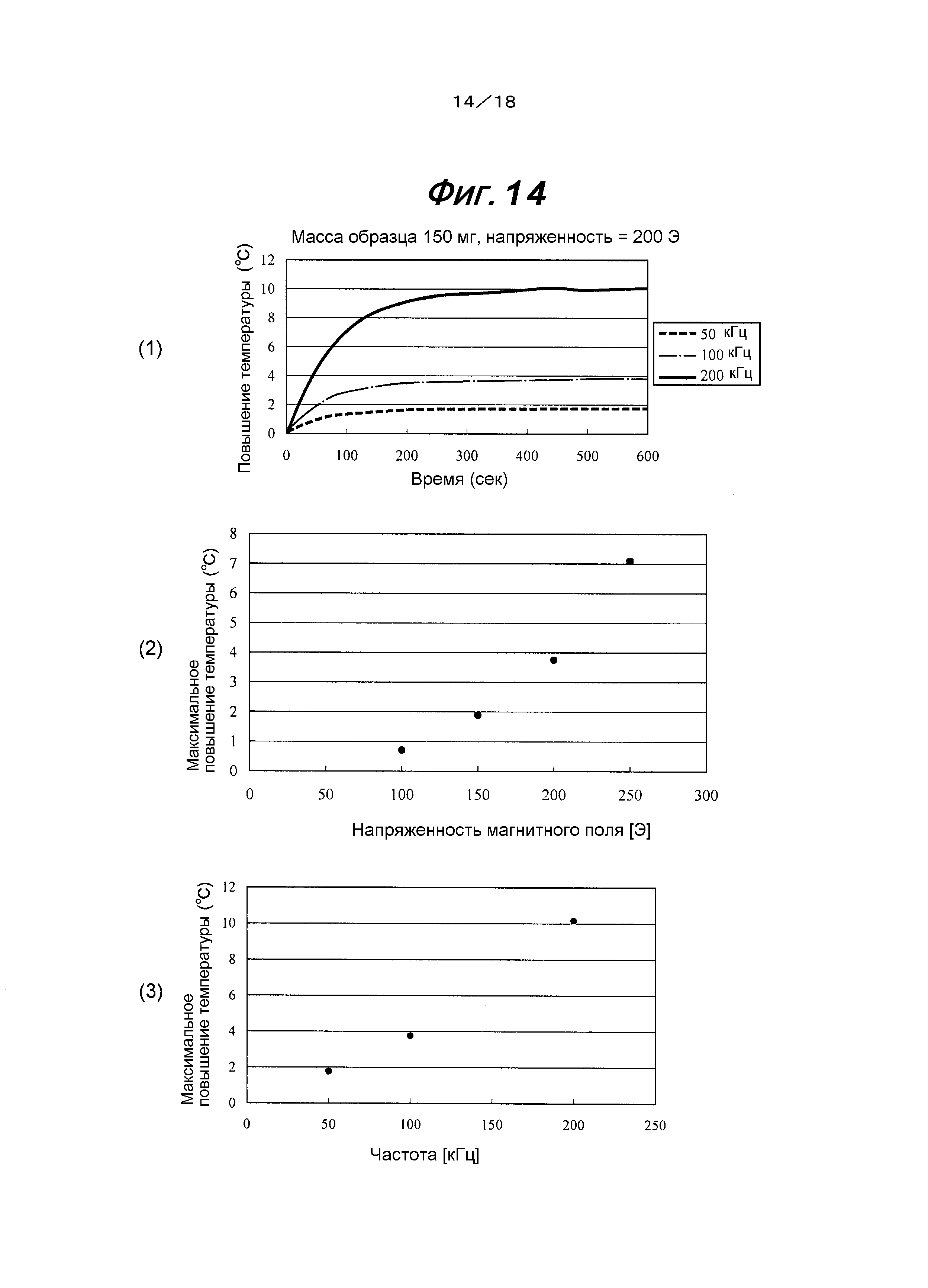
На фиг.14 представлен график, показывающий зависимость между напряженностью магнитного поля Fe-саленового комплексного соединения и повышением температуры.
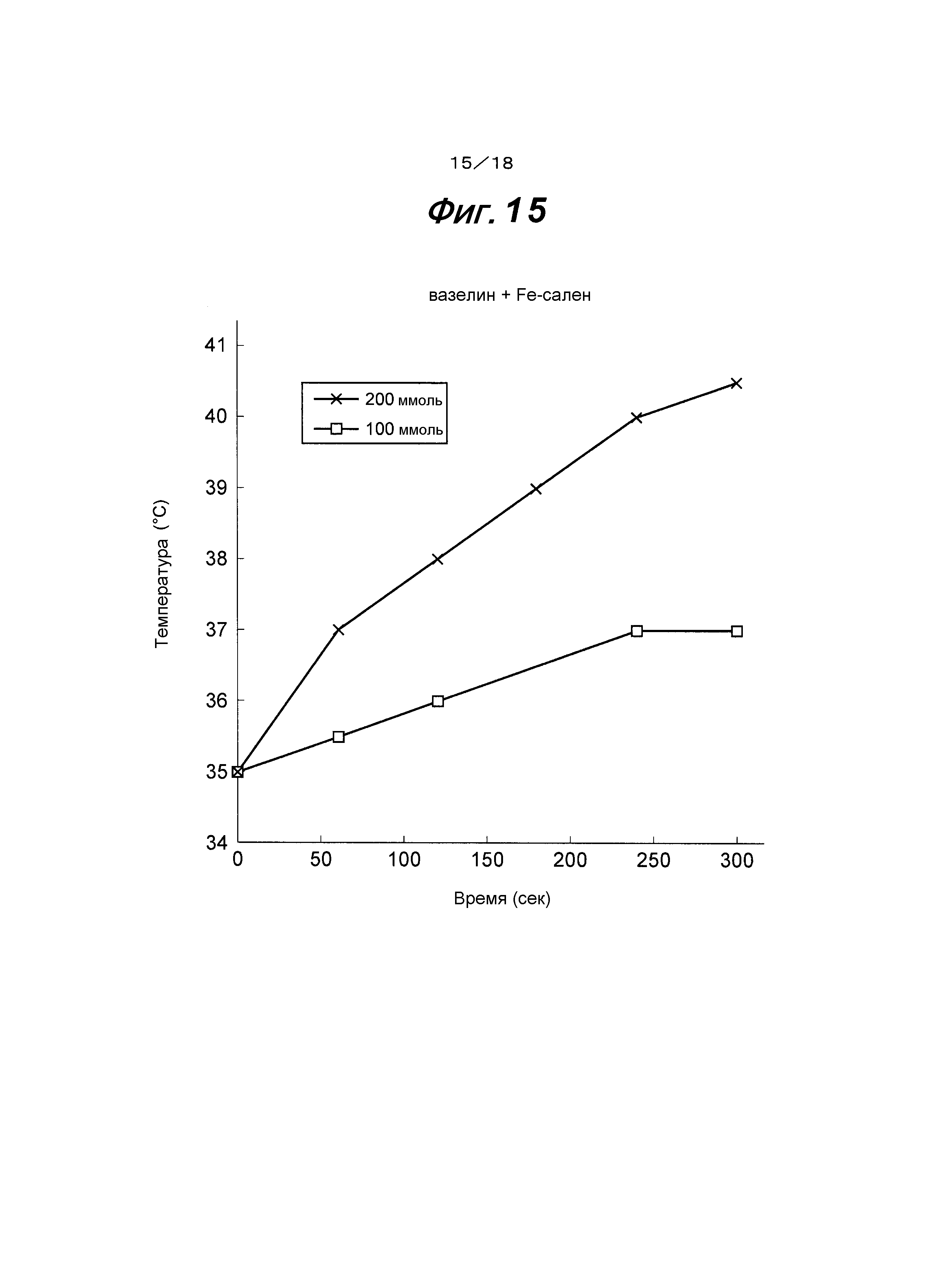
На фиг.15 представлен график, показывающий зависимость между временем и повышением температуры, когда магнитное поле АС наложено на мазь, в которой использован вазелин в качестве основы и смешан с Fe-саленовым комплексным соединением.
На фиг.16 представлен график, показывающий зависимость между временем и повышением температуры, когда магнитное поле АС наложено на мазь, в которой использован кеналог в качестве основы и смешан с Fe-саленовым комплексным соединением.
На фиг.17 представлен график, показывающий зависимость между временем и повышением температуры, когда магнитное поле АС наложено только на вазелин и только на кеналог.
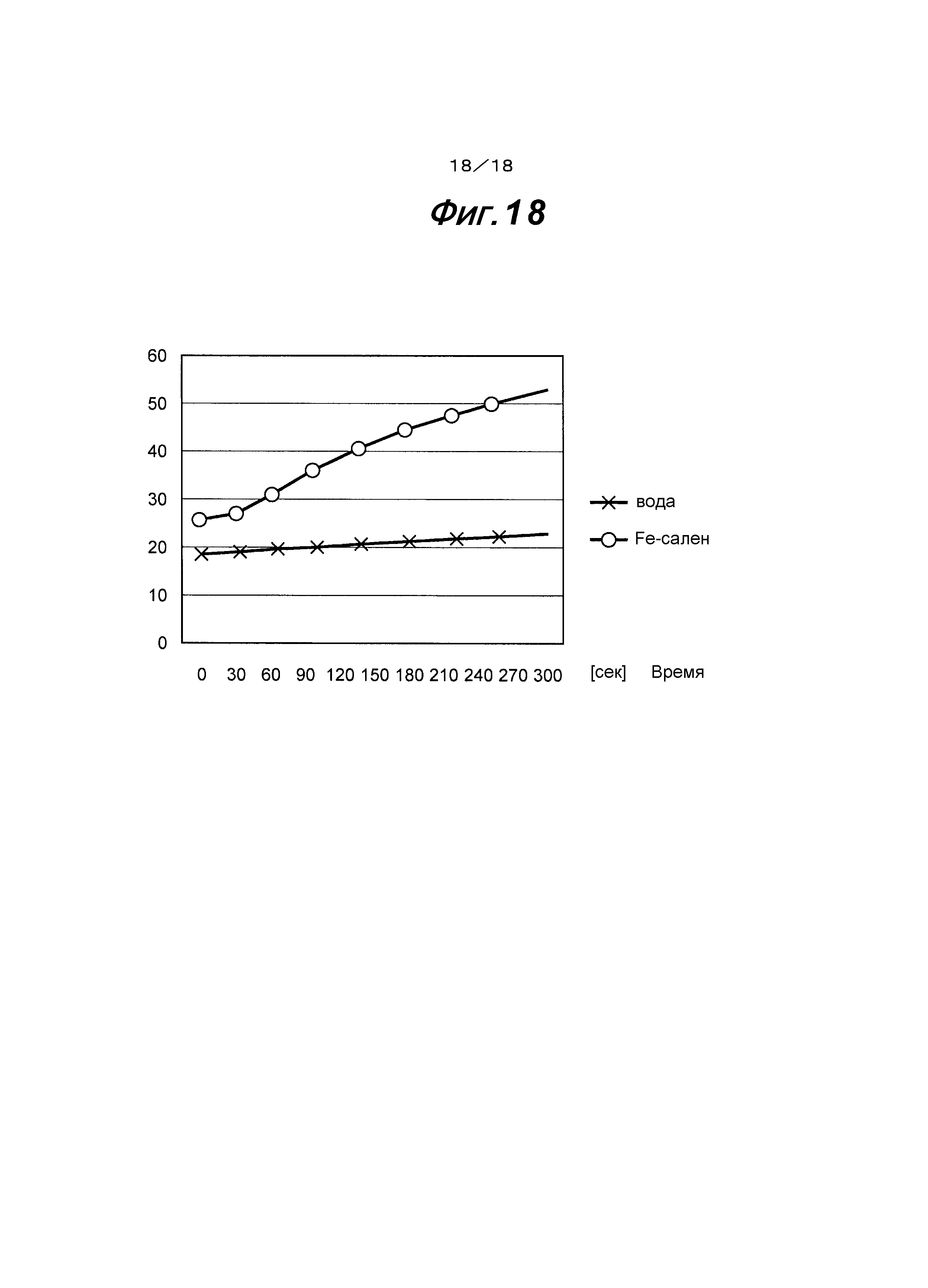
На фиг.18 представлен график, показывающий зависимость между временем и повышением температуры, когда образец двухатомного Fe-саленового комплексного соединения, растворенный в агарозе, подвергают воздействию инфракрасного излучения в ближней области спектра.
Описание воплощений
Пример 1
Металл-саленовое комплексное соединение согласно настоящему изобретению получают следующим образом.

Смесь 4-нитрофенола (Соединение 1) (25 г, 0,18 моль), гексаметилентетрамина (25 г, 0,18 моль) и полифосфорной кислоты (200 мл) перемешивают в течение одного часа при температуре 100°С. Затем эту смесь вводят в 500 мл этилацетата и 1 л (литр) воды и перемешивают до полного растворения. Кроме того, когда 400 мл этилацетата добавляют к этому раствору, раствор разделяется на две фазы. Затем водную фазу удаляют из раствора, который разделен на две фазы; и остающееся соединение дважды промывают основным растворителем и сушат над безводным MgSO4 (сульфат магния). В результате, синтезируют 17 г Соединения 2 (выход 57%).

Соединение 2 (17 г, 0,10 моль), уксусный ангидрид (200 мл) и H2SO4 (минимальное количество) перемешивают в течение одного часа при комнатной температуре. Полученный раствор перемешивают в течение 0,5 часа в смеси воды со льдом (2 л) для осуществления гидролиза. Полученный раствор отфильтровывают и высушивают на воздухе, после чего получают порошкообразное вещество белого цвета. Это порошкообразное вещество перекристаллизуют, используя растворитель, содержащий этилацетат. В результате получают 24 г Соединения 3 (выход 76%) в виде кристаллов белого цвета.

Смесь углерода (2,4 г), содержащего 10% палладия, с Соединением 3 (24 г, 77 ммоль) и метанолом (500 мл) восстанавливают в течение ночи, в атмосфере водорода, при давлении 1,5 атм. После завершения восстановления, продукт отфильтровывают, таким образом получая 21 г Соединения 4 в виде масла коричневого цвета.
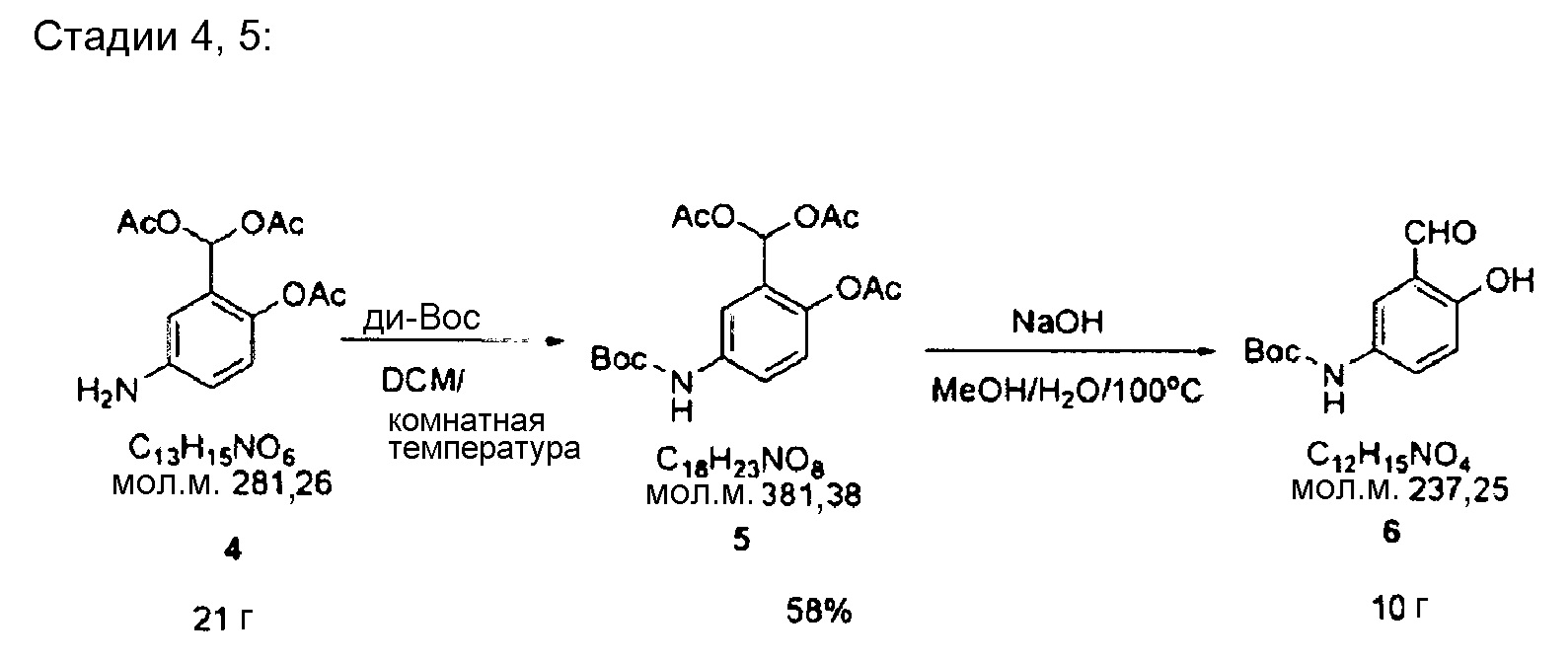
Соединение 4 (21 г, 75 ммоль) и ди(трет-бутил)дикарбонат (18 г, 82 ммоль) перемешивают в течение ночи в безводном дихлорметане (DCM) (200 мл), в атмосфере азота. Полученный раствор (Соединение 5) выпаривают в вакууме и затем растворяют в метаноле (100 мл). Потом добавляют гидроксид натрия (15 г, 374 ммоль) и воду (50 мл) и раствор кипятят с обратным холодильником в течение 5 часов. Затем раствор охлаждают, отфильтровывают, промывают водой и доводят досуха в вакууме, таким образом получая соединение коричневого цвета. Полученное соединение дважды подвергают флэш-хроматографии при использовании силикагеля, таким образом получая 10 г Соединения 6 (выход 58%).

Соединение 6 (10 г, 42 ммоль) вводят в 400 мл безводного этанола, смесь доводят до кипения с обратным холодильником во время нагревания и добавляют несколько капель этилендиамина (1,3 г, 21 ммоль) в 20 мл безводного этанола, в то время как перемешивают в течение 0,5 часа. Смесь вводят в емкость со льдом, где ее охлаждают и перемешивают в течение 15 минут. Затем смесь промывают с помощью 200 мл этанола, отфильтровывают и высушивают в вакууме, таким образом получая 8,5 г (выход 82%) Соединения 7.

Соединение 7 (8,2 г, 16 ммоль) и триэтиламин (22 мл, 160 ммоль) вводят в стандартный метанол (метанол выпускается фирмой Showa Chemical, чистота 99,5% или более) (50 мл); и раствор FeCl3·4H2O (тетрагидрат хлорида железа (III)) (2,7 г, 16 ммоль), в случае Fe-саленового комплексного соединения, MnCl3·4H2O (тетрагидрат хлорида марганца (III)) (2,7 г, 16 ммоль), в случае Mn-саленового комплексного соединения, или CrCl3·4H2O (тетрагидрат хлорида хрома (III)) (2,7 г, 16 ммоль), в случае Cr-саленового комплексного соединения, добавленного к 10 мл метанола, перемешивают в атмосфере азота. Кроме того, можно использовать CoCl2 (хлорид кобальта (II), выпускаемый фирмой Alfa Aesar), в случае Со-саленового комплексного соединения, NiCl2 (хлорид никеля (II), выпускаемый фирмой Alfa Aesar), в случае Ni-саленового комплексного соединения, MoCl3 (хлорид молибдена (III), выпускаемый фирмой Alfa Aesar), в случае Мо-саленового комплексного соединения, RuCl3 (хлорид рутения (III), выпускаемый фирмой Alfa Aesar), в случае Ru-саленового комплексного соединения, RhCl3 (хлорид родия (III), выпускаемый фирмой Alfa Aesar), в случае Rh-саленового комплексного соединения, PdCl2 (хлорид палладия (II), выпускаемый фирмой Alfa Aesar), в случае Pd-саленового комплексного соединения, WCl6 (хлорид вольфрама (VI), выпускаемый фирмой Alfa Aesar), в случае W-саленового комплексного соединения, ReCl5 (хлорид рения (V), выпускаемый фирмой Alfa Aesar), в случае Re-саленового комплексного соединения, тригидрат хлорида осмия (тригидрат хлорида осмия (III), выпускаемый фирмой Alfa Aesar), в случае Os-саленового комплексного соединения, IrCl3 (хлорид иридия (III), выпускаемый фирмой Alfa Aesar), в случае Ir-саленового комплексного соединения, PtCl2 (хлорид платины (II), выпускаемый фирмой Alfa Aesar), в случае Pt-саленового комплексного соединения, NdCl3 (хлорид неодима (III), выпускаемый фирмой Alfa Aesar), в случае Nd-саленового комплексного соединения, SmCl3 (хлорид самария (III), выпускаемый фирмой Alfa Aesar), в случае Sm-саленового комплексного соединения, EuCl3 (хлорид европия (III), выпускаемый фирмой Alfa Aesar), в случае Eu-саленового комплексного соединения, и GdCl3 (хлорид гадолиния (III), выпускаемый фирмой Alfa Aesar), в случае Gd-саленового комплексного соединения.
Ингредиенты перемешивают в течение одного часа, в атмосфере азота, при комнатной температуре, таким образом получая соединение коричневого цвета. Затем это соединение высушивают в вакууме или содержащуюся в нем воду в достаточной степени удаляют посредством, например, использования магния или адсорбируют и удаляют с помощью магния. Полученное соединение разбавляют с помощью 400 мл дихлорметана, дважды промывают основным раствором, сушат над Na2SO4 и высушивают в вакууме, таким образом получая металл-саленовое комплексное соединение в виде димера, содержащего молекулы воды. Полученное соединение перекристаллизуют из раствора диэтилового эфира и парафина, и анализ посредством высокоскоростной жидкостной хроматографии показывает димерное металл-саленовое комплексное соединение, содержащее молекулы воды, чистотой 95% или выше.
Химические структурные формулы полученного димера с молекулами воды следуют ниже.
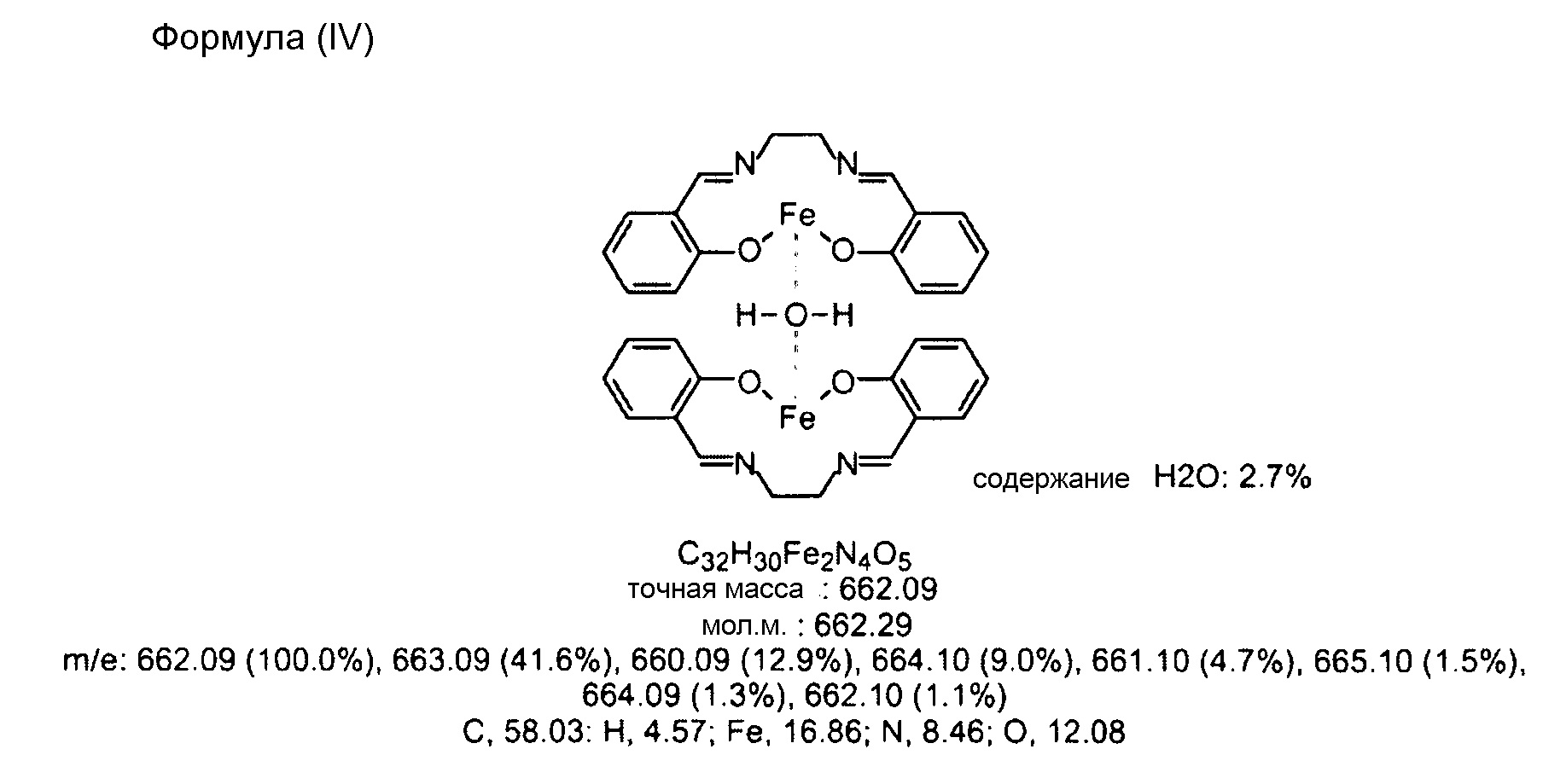


Между прочим, связь между металлом и кислородом можно считать слиянием ковалентной связи и металлической связи. Элементный анализ полученного димера с молекулами воды показывает, что он содержит 57,73% С, 4,42% Н, 17,2% Fe, 8,49% N и 12,16% О; и все различия между рассчитанными значениями и экспериментальными значениями находятся в пределах диапазона абсолютной погрешности ±0,4%.
Кроме того, когда используют Mn-саленовое комплексное соединение или Cr-саленовое комплексное соединение в вышеуказанных примерах, каждый атом Fe в вышеуказанных химических формулах становится Mn или Cr.
Затем осуществляли TG-масс-анализ для внесения ясности в отношении наличия включенных молекул воды. В результате, найдено, что молекулы воды детектируются в диапазоне от комнатной температуры до 260°С. Это происходит вследствие того, что молекулы воды включены в кристаллы. Результаты TG-масс-анализа представлены на фиг.1 и фиг.2.
Между прочим, экспериментальные условия для TG-масс-анализа описаны ниже.
Прибор для TG-анализа: TG-40 фирмы SHIMADZU CORPORATION;
Прибор для MS: GC/MS QP2010(1) фирмы SHIMADZU CORPORATION.
Условия измерения
Перед началом измерения: после помещения образца в прибор для TG-анализа, пропускали газ-носитель в течение 15 минут или более, и затем начинали повышать температуру;
Условия нагревания: от комнатной температуры до 500°С (скорость повышения температуры: 5°С/мин);
Масса образца: 3,703 мг;
Чувствительность MS: 1,80 кВ;
Диапазон массового числа: m/z=10-300;
Атмосфера: гелий (50 мл/мин);
Стандартное ссылочное вещество: дигидрат вольфрамата натрия, 1-бутен, диоксид углерода.
Пример 2
Кривую магнитное поле-намагничивание Mn-саленового комплексного соединения, полученного вышеописанным способом, при 37°С (310 К) рассчитывали, используя MPMS7 Quantum Design, Inc., и измерение показало, что Mn-саленовое комплексное соединение является парамагнитным. Результаты представлены на фиг.3.
Пример 3
Кривая магнитное поле-намагничивание Cr-саленового комплексного соединения, полученного посредством вышеописанного способа, при температуре 37°С (310 K), была измерена путем использования MPMS7 от Quantum Design Inc. и измерение показало, что Cr-саленовое комплексное соединение является парамагнитным. Результаты представлены на фиг.4.
Пример 4
Кривая магнитное поле-намагничивание Co-саленового комплексного соединения, полученного посредством вышеописанного способа, при температуре 37°С (310 K), была измерена путем использования MPMS7 от Quantum Design Inc., и измерение показало, что Co-саленовое комплексное соединение является парамагнитным. Результаты представлены на фиг.6.
Пример 5
На фиг.6 представлена кривая магнитное поле-намагничивание Fe-саленового комплексного соединения, при температуре 37°С (310 K). На фиг.3, фиг.5 и фиг.6 показано, что, по сравнению с Fe-саленовым комплексным соединением, Со-саленовое комплексное соединение имеет более значительное намагничивание, когда магнитное поле имеет напряженность 10000 Э (эрстед; (1 Тл (тесла))) или более. Кроме того, по сравнению с Fe-саленовым комплексным соединением, Mn-саленовое комплексное соединение имеет более значительное намагничивание, когда магнитное поле имеет напряженность 30000 Э (3 Тл) или более. Следовательно, Fe-саленовое комплексное соединение имеет самое значительное намагничивание, когда магнитное поле имеет напряженность менее чем 10000 Э (1 Тл); и является подходящим для использования в системах доставки лекарственного средства к участку действия за счет магнитной индукции, в случае которых используют, например, постоянные электромагниты на основе неодима. Однако, когда магнитное поле превышает 10000 Э (1 Тл), Со-саленовое комплексное соединение или Mn-саленовое комплексное соединение имеет значительное намагничивание и является наиболее подходящим для систем доставки лекарственного средства к участку действия за счет магнитной индукции, в случае которых используют сверхпроводящие электромагниты.
Пример 6
Культуральную среду посыпали порошком металл-саленового комплексного соединения, который получали, что касается каждого из Fe-саленового комплексного соединения, Mn-саленового комплексного соединения, Cr-саленового комплексного соединения и Со-саленового комплексного соединения, посредством вышеописанного способа, в количествах, позволяющих видеть магнитное притяжение, наблюдаемое по конфлюенции крысиных L6 клеток, составляющей 30%, и состояние среды фотографировали спустя 48 часов. Между прочим, на фиг.7 представлен полюсовой магнит в контакте с прямоугольным флаконом, содержащим культуральную среду крысиных L6 клеток.
Затем, спустя 48 часов, наружную поверхность основания прямоугольного флакона фотографировали от одного конца до другого и подсчитывали количество клеток. Из результатов такого подсчета, результаты относительно Fe-саленового комплексного соединения представлены на фиг.8. Между прочим, ссылаясь на фигуру 8, «проксимальная к электромагниту позиция» находится в пределах площади проекции поверхности конца электромагнита у основания прямоугольного флакона, а «дистальная к электромагниту позиция» означает область относительно стороны, противоположной поверхности конца магнита у основания прямоугольного флакона.
На фиг.8 представлено, что около электромагнита Mn-саленовый комплекс притянут, приводя в результате к более сильной концентрации Fe-саленового комплекса, так что ингибирующее рост ДНК воздействие Fe-саленового комплекса в результате приводит к разительно более низкому числу клеток, чем в случае дистальной к электромагниту позиции. Кроме того, относительно каждого из Mn-саленового комплексного соединения, Cr-саленового комплексного соединения и Со-саленового комплексного соединения, результаты разительно более низкого числа клеток получали в случае позиции, проксимальной к электромагниту, чем позиции, дистальной к электромагниту. В результате, магнитные лекарственные средства и система, снабженная генерирующими магнетизм средствами, согласно настоящему изобретению, таким образом, могут позволять лекарственным средствам концентрироваться в тканях-мишенях и тканях индивидуумов.
Затем должен быть описан пример наведения при использовании системы наведения. В этой системе наведения, как проиллюстрировано на фиг.9, пару магнитов 230 и 232, обращенных друг к другу в направлении силы тяжести, поддерживали посредством штатива 234 и зажима 235 и между магнитами 230 и 232 располагали металлическую пластину 236. Металлическую пластину 236, главным образом железную пластину, помещали между парой магнитов 230 и 232 так, чтобы могло быть создано магнитное поле локально постоянной и сильной напряженности. Вместо магнита может быть использован электромагнит для модификации магнитной силы, генерируемой в этой системе наведения. Генерирующие магнетизм средства можно перемещать к позиции-мишени индивидуума на столе для возможности паре генерирующих магнетизм средств перемещаться в направлениях Х, Y и Z. Ткань индивидуума может быть помещена в область магнитного поля для концентрирования лекарственного средства в ткани.
Более конкретно, например, вышеуказанное Fe-саленовое комплексное соединение (концентрация лекарственного средства 5 мг/мл (15 ммоль)) инъецировали внутривенно мыши массой около 30 г, осуществляли лапаротомию и мышь помещали на железную пластину 236 для локализации ее правой почки между парой магнитов 230 и 232. Между прочим, используемые магниты представляли собой Продукт № N50 (постоянные электромагниты на основе неодима), выпускаемый фирмой Shin-Etsu Chemical Co. Ltd., с остаточной магнитной индукцией от 1,39 Тл до 1,44 Тл. В этом случае, магнитное поле, наложенное на правую почку, составляло 0,3 (Тл), а магнитное поле, наложенное на левую почку мыши, составляло около 1/10 вышеуказанного магнитного поля.
Вместе с левой почкой и почкой, на которую не было наложено поле (контроль), магнитное поле налагали на правую почку мыши и спустя 10 минут измеряли SNR посредством MRI по Т1-способу и Т2-способу. Как представлено на фиг.10, было подтверждено, что возможно осуществление пребывания лекарственного средства в правой почке (RT), на которую было наложено магнитное поле, по сравнению с левой почкой (LT) и контролем.
Кроме того, когда каждое из Mn-саленового комплексного соединения, Cr-саленового комплексного соединения и Со-саленового комплексного соединения инъецировали внутривенно мыши, осуществляли лапаротомию и налагали магнитное поле на мышь путем использования системы наведения, представленной на фиг.9, таким же образом, было подтверждено, что возможно осуществление пребывания лекарственного средства в правой почке (RT), на которую было наложено магнитное поле, по сравнению с левой почкой (LT) и контролем.
На фиг.11 представлено воздействие Fe-саленового комплексного соединения на рост меланомы у мышей. Меланому создавали в мышиных хвостах in vivo за счет локальной трансплантации культивированных клеток меланомы (клетки меланомы М3-клона). Между прочим, фиг.11(1) представляет собой фотографию, демонстрирующую влияния солевой группы (солевой раствор), в случае которой вместо Fe-саленового комплексного соединения вводят соленую воду; на фиг.11(2) представлена фотография, показывающая влияния группы (SC), в случае которой Fe-саленовое комплексное соединение инъецировали без наложения магнитного поля; и на фиг.11(3) представлена фотография, показывающая влияние группы (SC + Mag), в случае которой Fe-саленовое комплексное соединение инъецировали во время наложения магнитного поля (n=7-10).
Fe-саленовое комплексное соединение (50 мг/кг) вводили внутривенно в хвостовую вену с последующим локальным наложением магнитного поля с помощью коммерчески доступного полюсового магнита (630 мТл, цилиндрический магнит на основе неодима, длиной 150 мм и 20 мм в диаметре). Наложение полюсового магнита осуществляли путем трехчасового легкого контакта с областью меланомы непосредственно после инъекции Fe-саленового комплексного соединения в течение 10-14 суток.
Наложение полюсового магнита осуществляли таким путем, чтобы напряженность магнитного поля становилась максимальной касательно площади ожидаемой протяженности меланомы, которая составляла приблизительно 150 мм или была короче в мышином хвосте в течение периода роста 2 недели. Спустя двенадцать суток после начальной инъекции Fe-саленового комплексного соединения, протяженность меланомы оценивали путем определения площади меланомной пигментации.
Как представлено на фиг.12, протяженность меланомы была самой большой в солевой группе (100±17,2%), которой инъецировали физиологический раствор вместо Fe-саленового комплексного соединения. С другой стороны, протяженность меланомы умеренно уменьшалась (63,68±16,3%) в SC-группе, которой инъецировали Fe-саленовое комплексное соединение без наложения сильного магнитного поля. В противоположность, более всего меланома исчезала (9,05±3,42%) в группе SC+Mag, в случае которой инъецировали Fe-саленовое комплексное соединение и налагали сильное магнитное поле как описано выше (n=7-10).
Между прочим, такие же результаты получали в случае каждого из Mn-саленового комплексного соединения, Cr-саленового комплексного соединения и Со-саленового комплексного соединения.
Гистологическое исследование осуществляли, как представлено на фиг.13, при использовании гематоксилин-эозинового красителя и иммуно-гистохимического красителя с анти-Ki-67-антителом и анти-циклин-D1-антителом, которые оба являются маркерами пролиферации опухоли в срезах ткани. В результате, гистологическое исследование показало, что опухолевая протяженность меланомы уменьшалась, когда инъецировали Fe-саленовое комплексное соединение (SC); и опухолевая протяженность меланомы большей частью исчезала, когда наложение сильного магнитного поля комбинировали с Fe-саленовым комплексным соединением.
Между прочим, такие же результаты получали в случае каждого из Mn-саленового комплексного соединения, Cr-саленового комплексного соединения и Со-саленового комплексного соединения.
Кроме того, наложение АС магнитного поля с напряженностью магнитного поля 200 Э и частотой от 50 кГц до 200 кГц к лекарственному средству (Fe-саленовое комплексное соединение; 9,25 ммоль) повышало температуру лекарственного средства на 2-10°С (фиг.14). Это подтверждало то, что такое повышение температуры соответствует диапазону от 39°С до 47°С, как рассчитано с точки зрения температуры во время введения живому организму, и такой диапазон температуры представляет собой зону температуры, способную подвергать лизису раковые клетки. На фиг.14(1) представлены изменения температуры с временем, когда на лекарственное средство налагают АС магнитное поле; на фиг.14(2) представлена максимальная температура, когда изменяли только магнитное поле, тогда как использовали фиксированную частоту; и на фиг.14(3) представлена максимальная температура, когда изменяли только частоту, тогда как использовали фиксированное магнитное поле.
Между прочим, такие же результаты получали в случае каждого из Mn-саленового комплексного соединения, Cr-саленового комплексного соединения и Со-саленового комплексного соединения.
Пример 7
Перенос электронов от соединения, которое связывается с металл-саленовыми комплексами, может быть определен посредством первых принципов расчета. Система для реализации этого компьютерного моделирования снабжена хорошо известными ресурсами аппаратного обеспечения, как компьютер, то есть, память, вычислительное устройство, снабженное вычислительной схемой, как например центральный процессор (CPU), и средства визуального отображения для вывода вычисленных результатов.
Память включает данные, указывающие существование органических соединений или трехмерных структур, и системные программы для осуществления компьютерного моделирования. Системная программа способна осуществлять, в целом, добавление, модификацию и удаление боковых цепей из каждого соединения, сшивку некоторых боковых цепей, расчет областей высокой плотности спин-заряда и определение плотности спин-заряда для структур. Например, в качестве этой программы может быть использована коммерчески доступная программа (Dmol3 фирмы Accelrys).
Пользователь вводит позицию, где боковые цепи должны быть добавлены к соединению, или выбирает позицию, в которой боковые цепи модифицированы или удалены, и использует программу поддержки памяти для обозначения в вычислительном устройстве позиции, где должна быть образована сшивка. Компьютер получает входные данные для расчета плотности спин-заряда и выводит результаты на экран дисплея. Пользователь также может добавлять структурные данные относительно существующих соединений в компьютерную систему для получения плотности спин-заряда существующих соединений.
Перенос заряда от соединения, полученного путем связывания с другим соединением, на металл-саленовый комплекс может быть определен посредством интегрирования предварительно определенной повышающейся и понижающейся плотности спин-заряда в трехмерном пространстве. Расчетные результаты в отношении переноса заряда в положениях e, b, k, h или е, h вышеуказанных химических формул (I) и (II) представлены в каждой из следующих таблиц. В каждой таблице, знак минус (-) указывает увеличение электронов, а знак плюс (+) указывает уменьшение электронов.

Пример 8
Вышеуказанное Fe-саленовое комплексное соединение смешивали с вазелином, который является корректором для мазей, в качестве основы в концентрациях 100 ммоль и 200 ммоль, соответственно, для получения мазей. Затем определяли соотношение между временем и повышением температуры путем наложения АС магнитного поля на эти мази при условиях 258 А, 400 кГц и 51,74 мТл. Результаты представлены на фиг.15. На фиг.15 показано, что температура мазей при концентрациях 100 ммоль и 200 ммоль непосредственно после измерения (0 секунд) составляет 35°С и повышение температуры приблизительно на 5°С наблюдают спустя 300 секунд для мази с концентрацией 200 ммоль.
Затем соединение, представленное вышеуказанной формулой (I), смешивали с кеналогом, который представляет собой мазь для стоматита, в качестве основы при концентрациях 100 ммоль и 200 ммоль, соответственно, для получения мазей. После этого определяли соотношение между временем и повышением температуры путем наложения АС магнитного поля на эти мази при условиях 258 А, 400 кГц и 51,74 мТл. Результаты представлены на фиг.16. На фиг.16 показано, что температура мазей при концентрациях 100 ммоль и 200 ммоль непосредственно после измерения (0 секунд) составляет 35°С и повышение температуры приблизительно на 5°С наблюдают спустя 300 секунд для мази с концентрацией 200 ммоль.
Затем, в качестве сравнений, определяли соотношение между временем и повышением температуры путем наложения АС магнитного поля на каждые из 200 мг вазелина и 200 мг кеналога при условиях 258 А, 400 кГц и 51,74 мТл. Результаты представлены на фиг.17. На фиг.17 показано, что температура обоих, вазелина и кеналога, непосредственно после измерения (0 секунд) составляет 30оС и повышение температуры даже после наложения АС магнитного поля на 300 секунд меньше, чем 2°С.
Вышеуказанные результаты показывают, что температура мази, в которую примешано металл-саленовое комплексное соединение, непосредственно после измерения составляет на 5оС выше, чем только вазелина и только кеналога, и мазь подходит в качестве противоопухолевого агента. Кроме того, мазь, содержащая металл-саленовое комплексное соединение в концентрации 200 ммоль, показывает значительное повышение температуры после наложения АС магнитного поля и вследствие этого является более подходящей в качестве противоопухолевого агента.
Между прочим, такие же результаты получены в случае каждого из Mn-саленового комплексного соединения, Cr-саленового комплексного соединения и Со-саленового комплексного соединения.
Кроме того, такие же эксперименты, в качестве данного воплощения, проводили для других металл-саленовых комплексных соединений согласно настоящему изобретению, получали хорошие результаты в соответствии с вышеуказанным.
Пример 9
Затем двухатомное Fe-саленовое комплексное соединение (CAS № 14167-12-5; выпускается фирмой Tokyo Chemical Industry Co., Ltd.) растворяли в агарозе, получая 100 мМ раствор, который помещали в пробирку, таким образом получая образец. Образец чистой воды, помещенный в пробирку, также получали в качестве сравнения. Затем эти образцы соответственно подвергали воздействию используемого в медицине инфракрасного излучения в ближней области спектра (длины волн: от 600 нм до 1600 нм) путем использования Super Lizer PX, тип I (мощность: 10 Вт), выпускаемого фирмой TOKYO IKEN CO., LTD. Соотношение между временем и повышением температуры представлено на фиг.18.
На фиг.18 представлено, что температура образца, содержащего двухатомное Fe-саленовое комплексное соединение, непосредственно после измерения (0 секунд) составляет 26°С и температура повышается приблизительно до 53°С спустя 300 секунд. С другой стороны, показано, что температура образца, содержащего чистую воду, непосредственно после измерения (0 секунд) составляет приблизительно 19°С и спустя 300 секунд его температура составляет приблизительно 23°С и почти не повышается.
Вышеприведенные результаты показывают, что температура образца растворенного в агарозе двухатомного Fe-саленового комплексного соединения значительно повышена в результате подвергания воздействию инфракрасного излучения в ближней области спектра и, следовательно, этот образец является подходящим в качестве противоопухолевого агента.
Реферат
Изобретение относится к медицине, в частности к применению мази, получаемой путем смешения намагничивающегося металл-саленового комплексного соединения с основой в качестве антибластомного лекарственного средства. Масляная основа смешана с намагничивающим металл-саленовым комплексным соединением в количестве, эффективном для доставки, и где температура мази достигает по меньшей мере 39°С или более после наложения АС магнитного поля на мазь при условиях 400 кГц в течение 300 секунд и более. Осуществление изобретения позволяет получить металл-саленовое комплексное соединение, которое проявляет превосходную неинвазивность и может быть эффективно перенесено в пораженную область. 10 табл., 9 пр., 18 ил.
Формула


Комментарии