Способ стерилизации - RU2630979C2
Код документа: RU2630979C2
Чертежи

Описание
ОБЛАСТЬ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к способу стерилизации имплантируемых биоматериалов. В частности, изобретение относится к способу стерилизации коллагенсодержащих имплантируемых биоматериалов и к их последующему хранению.
ПРЕДШЕСТВУЮЩИЙ УРОВЕНЬ ТЕХНИКИ
Имплантируемые биоматериалы, особенно биоматериалы на основе коллагена, требуют стерилизации и чаще всего хранения перед использованием. Обычно выделяют два больших класса имплантируемых биоматериалов на основе коллагена: (1) природная ткань и (2) химически сшитая ткань. Таким образом, в зависимости от типа биоматериала на основе коллагена и того, было ли осуществлено сшивание, существует потребность в стерилизации ткани, а также хранении ткани после того, как она была стерилизована.
Химически сшитые биоматериалы на основе коллагена, такие как сердечнососудистые заплатки, сердечные клапаны, матрицы и артерии, обычно стерилизуют после сшивания и хранят в стерильном растворе вплоть до имплантации. За последние три-четыре десятилетия было протестировано и внедрено несколько способов стерилизации химически сшитых биоматериалов на основе коллагена, включая гамма-излучение, УФ-излучение и разнообразные химические агенты. Хотя большинство этих способов стерилизации являются эффективными в предупреждении инфицирования, побочные эффекты, такие как повреждение структуры (разрыв пептидных связей) и разрушение ткани (снижение прочности на разрыв), сделали некоторые из этих способов менее привлекательными для промышленного применения.
Например, биоматериалы на основе коллагена, сшитые глутаровым альдегидом, могут становиться химически нестабильными при воздействии спиртосодержащих растворов для стерилизации вследствие взаимодействия спирта с остаточным и несвязанным глутаровым альдегидом, присутствующим в ткани. При взаимодействии спирта с глутаровым альдегидом образуются нестабильные гемиацетилы. Эти нестабильные гемиацетилы обладают способностью взаимодействовать со спиртом с образованием ацетила, который может диссоциировать с образованием альдегида и спирта.
Таким образом, в настоящее время большинство производителей биоматериалов на основе коллагена предпочитают использовать комбинации глутаровый альдегид-формальдегид для химического сшивания и неальдегидные агенты для стерилизации. Одним из таких неальдегидных агентов является газообразный этиленоксид (оксиран), который использовался для стерилизации механических сердечных клапанов в течение многих лет. Газообразный этиленоксид также использовали для стерилизации разнообразного медицинского оборудования, одноразовых предметов и механических сердечных клапанов.
После того, как биоматериал на основе коллагена был простерилизован, его обычно хранят в течение некоторого периода времени перед имплантацией. Средне-долгосрочное хранение биоматериалов на основе коллагена требует адекватной защиты от инфицирования в физиологически стабильном растворе. Хотя большинство коммерчески доступных биоматериалов на основе коллагена все еще хранят в растворах на основе альдегида, хорошо известны побочные эффекты, такие как кальцификация и фиброз.
С 1970-х в качестве стерилизующего агента используют пропиленоксид (см., например, Hart & Brown, 1974, Appl Microbiol, Dec. p. 1069-1070; Brown & Ng, 1975, Appl Microbiol, Sept. p483-484). В каждом случае раствор, содержащий 5% пропиленоксида и 70% изопропилового спирта или 0,5% хлоргексидина или 2% цетримида, являлся эффективным для разрушения суспензии бактериальных спор. Однако, хотя сообщалось об использование пропиленоксида, его обычно применяют в присутствии спирта (этанола или изопропанола). Таким образом, использование спирта в качестве добавки к стерилизации пропиленоксидом тканей, сшитых альдегидом (содержащих остаточные альдегиды), может приводить к повышенным уровням альдегидов, что, в свою очередь, увеличивает возможность кальцификации этих тканей и, в конце концов, повреждение биопротеза.
Следовательно, требуется эффективный способ стерилизации, который не только стерилизует химически сшитые биоматериалы на основе коллагена, но также обеспечивает подходящую среду хранения для стерилизованного биоматериала.
КРАТКОЕ ИЗЛОЖЕНИЕ СУЩНОСТИ ИЗОБРЕТЕНИЯ
Авторы изобретения разработали способ, который преодолевает или по меньшей мере облегчает проблемы, связанные с обычно используемыми способами стерилизации и/или хранения сшитых биоматериалов на основе коллагена.
Соответственно, в первом аспекте настоящего изобретения предложен способ стерилизации сшитого биоматериала на основе коллагена, включающий приведение указанного сшитого биоматериала на основе коллагена в контакт с раствором для стерилизации, содержащим от 3% до 6% об./об. пропиленоксида, и выдерживание указанного биоматериала в термостате при 30°C-55°C в течение более 48 часов; при условии, что раствор для стерилизации не содержит спирт.
В некоторых воплощениях температура выдерживания в термостате составляет от 30°C, 31°C, 32°C, 33°C, 34°C, 35°C, 36°C, 37°C, 38°C, 39°C, 40°C, 41°C, 42°C, 43°C, 44°C, 45°C, 46°C, 47°C, 48°C, 49°C, 50°C, 51°С, 52°C, 53°C, 54°C до 55°C. В других воплощениях температура выдерживания в термостате составляет от 30°C до 31°C, 32°C, 33°C, 34°C, 35°C, 36°C, 37°C, 38°C, 39°C, 40°C, 41°C, 42°C, 43°C, 44°C, 45°C, 46°C, 47°C, 48°C, 49°C, 50°C, 51°C, 52°C, 53°C, 54°C или 55°C. Другими словами, предусмотрены все комбинации температур в диапазоне от 30°C до 55°C. В некоторых воплощениях температура выдерживания в термостате предпочтительно составляет от 35°C до 50°C, более предпочтительно от 40°C до 48°C. В некоторых воплощениях температура выдерживания в термостате составляет около 45°C.
Когда период выдерживания в термостате истекает, т.е. проходит более 48 часов, можно позволить температуре понизиться до комнатной температуры. Действительно, стерилизованный сшитый биоматериал на основе коллагена может оставаться при комнатной температуре в течение некоторого времени после первоначальных 48 часов, как в данное время. После того, как стерилизованный сшитый биоматериал на основе коллагена был выдержан в термостате в пропиленоксиде в течение по меньшей мере 4 суток, пропиленоксид превращается в пропиленгликоль, и биоматериал на основе коллагена готов к использованию.
В некоторых воплощениях раствор для стерилизации содержит от 3,8% до 4,5% об./об. пропиленоксида. В других воплощениях раствор для стерилизации содержит примерно 4% об./об. пропиленоксида. В некоторых воплощениях раствор для стерилизации по существу состоит из 3%-6% об./об. пропиленоксида, более предпочтительно раствор для стерилизации состоит из 3%-6% об./об. пропиленоксида. В некоторых воплощениях раствор для стерилизации по существу состоит из 3,8%-4,5% об./об. пропиленоксида, более предпочтительно раствор для стерилизации состоит из 3,8%-4,5% об./об. пропиленоксида. В некоторых воплощениях раствор для стерилизации по существу состоит из примерно 4% об./об. пропиленоксида, более предпочтительно раствор для стерилизации состоит из примерно 4% об./об. пропиленоксида.
Следует понимать, что спирт, особенно этанол и/или изопропанол, не используется в растворе для стерилизации по настоящему изобретению.
Требуется, чтобы стадию стерилизации осуществляли в течение более 48 часов (2 суток); однако, ввиду того что раствор для стерилизации также может быть использован в качестве среды для хранения, стадию стерилизации можно осуществлять в течение 2, 3, 4, 5, 6, 7, 8, 9, 10 или более суток.
Сшитый биоматериал на основе коллагена может представлять собой любой материал, который содержит, по существу состоит из или состоит из коллагена. В некоторых воплощениях биоматериал на основе коллагена выделен непосредственно из животного. Биоматериал может быть выделен из любого животного, либо как того же вида, что и реципиент, либо из животного другого вида, чем реципиент. Предпочтительно животное происходит из одного из отрядов млекопитающих, т.е. Artiodactyla, Lagomorpha, Rodentia, Perissodactyla, Carnivora или Marsupialia. Более предпочтительно животное выбрано из группы, состоящей из овечьих, бычьих, козьих, лошадиных, свиных, сумчатых и человека.
Биоматериал может представлять собой любой тип клеточной ткани. Предпочтительно клеточная ткань выбрана из группы, состоящей из сердечнососудистой ткани, сердечной ткани, сердечного клапана, корней аорты, стенки аорты, створки аорты, ткани перикарда, соединительной ткани, твердой мозговой оболочки, кожной ткани, сосудистой ткани, хряща, перикарда, связки, сухожилия, кровеносных сосудов, пуповинной ткани, костной ткани, фасции и подслизистой ткани и кожи.
В некоторых воплощениях биоматериал представляет собой и/или содержит отделенный, т.е. выделенный, коллаген, а не встречающуюся в природе коллагенсодержащую ткань. Отделенный коллаген можно использовать в его выделенной форме или он может быть сформован в виде какого-нибудь медицинского устройства или изделия, известного в данной области.
В некоторых воплощениях биоматериал представляет собой культивированную ткань, протез, содержащий внеклеточную матрицу, полученную из животного, восстановленную ткань (например, коллагеновую матрицу) или тому подобное.
Также следует понимать, что биоматериал также может содержать синтетические аналоги, образованные из синтетических полимеров, биологических полимеров или обоих, включая полимеры, обычно встречающиеся в природных тканевых матрицах. Подходящие синтетические полимеры включают, например, полиамиды или полисульфоны. Биологические полимеры могут встречаться в природе или могут быть получены in vitro, например, посредством ферментации и тому подобного.
Во втором аспекте настоящего изобретения предложен способ стерилизации биоматериала на основе коллагена, включающий:
(а) обеспечение биоматериала на основе коллагена, промывку его ледяным 0,9% об./об. физиологическим раствором и помещение указанного биоматериала в ледяную смесь 0,9% об./об. физиологического раствора/фенилметилсульфонилфторида (PMSF);
(б) приведение указанного биоматериала на основе коллагена в контакт с 0,625% об./об. раствором глутарового альдегида и дигидрофосфата калия, pH 7,4, и выдерживание его в термостате при примерно 1-5°C в течение по меньшей мере 5 дней с получением сшитого биоматериала на основе коллагена;
(в) промывку указанного сшитого биоматериала на основе коллагена в стерильном 0,9% об./об. хлориде натрия при примерно 10°C и затем приведение сшитого биоматериала на основе коллагена в контакт с раствором для стерилизации, содержащим от 3,8% до 4,5% об./об. пропиленоксида, и выдерживание указанной ткани в термостате при температуре от 30°C до 55°C в течение более 48 часов; при условии, что раствор для стерилизации не содержит спирт.
В третьем аспекте настоящего изобретения предложен способ хранения стерилизованного сшитого биоматериала на основе коллагена, включающий приведение сшитого биоматериала на основе коллагена в контакт с раствором, содержащим от 3% до 6% об./об. пропиленоксида, и выдерживание указанного биоматериала в термостате при температуре от 30°C до 55°C в течение более 48 часов, и затем оставление биоматериала в контакте с указанным пропиленоксидом до тех пор, пока он не превратится в пропиленгликоль; при условии, что раствор для стерилизации не содержит спирт.
В четвертом аспекте настоящего изобретения предложен стерилизованный сшитый биоматериал на основе коллагена, полученный способом по первому, второму и третьему аспектам.
Следует понимать, что после получения стерилизованного сшитого биоматериала на основе коллагена способами по настоящему изобретению, он может быть включен в имплантируемые биологические устройства. Соответственно, в пятом аспекте настоящего изобретения предложено имплантируемое биологическое устройство, содержащее стерилизованный сшитый биоматериал на основе коллагена согласно четвертому аспекту.
В другом аспекте настоящего изобретения сшитый биоматериал на основе коллагена по настоящему изобретению содержится в наборе для лечения повреждения ткани. Таким образом, в шестом аспекте настоящего изобретения предложен набор для лечения повреждения ткани, включающий:
(а) стерильный контейнер, содержащий стерилизованный сшитый биоматериал на основе коллагена согласно четвертому аспекту или устройство согласно пятому аспекту; и
(б) инструкции по применению у субъекта с повреждениями. В седьмом аспекте настоящего изобретения предложен контейнер, содержащий стерилизованный сшитый биоматериал на основе коллагена и 3%-6% об./об. раствор пропиленгликоля, где указанный пропиленгликоль получен в результате превращения in situ 3%-6% об./об. раствора пропиленоксида в присутствии биоматериала.
Биоматериал на основе коллагена по настоящему изобретению может быть сшит любым способом, известным в области сшивания коллагена, включая, но без ограничения ими, способы, описанные в Eyre et al., 1984, Annu. Rev. Biochem. 537, 717-748; Eyre, 1982, In: Symposium on Heritable Disorder of Connective Tissue (Akeson et al. eds) pp. 43-58, Mosby, St. Louis, Missouri; Davison & Brennan, 1983, Connect. Tissue Res. 11, 135-151; Robins, 1982, Methods Biochem. Analysis, 28, 330-379; Reiser, 1991, Proc. Soc. Exp. Biol. Med. 196, 17-29; все из которых включены в данную заявку посредством ссылки во всей своей полноте. Однако предпочтительный способ сшивания биоматериала на основе коллагена по настоящему изобретению включает:
(а) воздействие на биоматериал на основе коллагена спиртосодержащего раствора в течение по меньшей мере 24 часов;
(б) воздействие на указанный в стадии (а) биоматериал сшивающего агента; и
(в) воздействие на указанный в стадии (б) биоматериал кислотного раствора;
где стадии (б) и (в) следуют после стадии (а).
Спиртосодержащий раствор, используемый на стадии (а), предпочтительно представляет собой водную жидкость, т.е. представляет собой водный раствор, содержащий более чем примерно 50% об./об. спирта и предпочтительно от 60% до 80% спирта по объему. Можно использовать или забуференный, или незабуференный спиртосодержащий раствор; однако предпочтительно использовать незабуференный спиртосодержащий раствор, так как было обнаружено, что забуференные спиртосодержащие растворы негативно влияют на последующие процедуры сшивания, что приводит к получению пожелтевшего биоматериала.
В предпочтительном способе сшивания в спиртосодержащем растворе возможно использовать любой спирт, известный в области техники. Предпочтительно спирт представляет собой C1-С6низший спирт в растворе, не содержащем буфера. Еще более предпочтительно спирт выбран из группы, состоящей из метанола, этанола, циклогексанола, изопропанола, пропанола, бутанола, пентанола, изобутанола, втор-бутанола и трет-бутанола.
В некоторых воплощениях спиртосодержащий раствор содержит смесь двух или более спиртов при условии, что общий объем спирта составляет более 50% об./об. Например, эффективной является смесь примерно 70% об./об. этанола и примерно 10% об./об. изобутанола.
Биоматериал на стадии (а) может быть подвергнут воздействию спиртосодержащего раствора в течение периода времени любой продолжительности при условии, что он является достаточным для придания биоматериалу устойчивости in vivo в отношении патогенной кальцификации. Предпочтительно биоматериал остается в контакте со спиртосодержащим раствором в течение достаточного периода времени для того, чтобы спирт диффундировал и проник в биоматериал. Более предпочтительно биоматериал подвергается воздействию спиртосодержащего раствора в течение по меньшей мере 24 часов, еще более предпочтительно по меньшей мере 36 часов и наиболее предпочтительно по меньшей мере 48 часов.
После воздействия спиртосодержащего раствора биоматериал извлекают и подвергают воздействию одного или более сшивающих агентов. Может быть использована любая форма сшивающего агента, известная в данной области техники, при условии, что она способна сшивать коллаген. Соответственно, следует понимать, что сшивающие агенты включают, без ограничения ими, дивинилсульфон (DVS), полиэтиленгликольдивинилсульфон (VS-PEG-VS), гидроксиэтилметакрилатдивинилсульфон (HEMA-DIS-HEMA), формальдегид, глутаровый альдегид, альдегиды, изоцианаты, алкил- и арилгалогениды, имидоэфиры, N-замещенные малеимиды, ацилирующие соединения, карбодиимид, хлоргидроокись, N-гидроксисукцинимид, свет (например, синий свет и УФ-свет), pH, температуру и их комбинации. Предпочтительно сшивающий агент представляет собой химический сшивающий агент, выбранный из группы, состоящей из карбодиимида, полиэпоксиэфиров, дивинилсульфона (DVS), полиальдегида и дифенилфосфорилазида (DPPA).
В некоторых воплощениях полиальдегид представляет собой би-, три- или диальдегид. Глутаровый альдегид является особенно предпочтительным.
В некоторых воплощениях после стадии сшивания (б) следует стадия (в) с промежуточной стадией промывки или без нее. Кислотный раствор, используемый на стадии (в), содержит любую кислоту, способную инактивировать и/или модифицировать группировки связанного и/или несвязанного сшивающего агента, присутствующие в биоматериале после стадии (б), для удаления или уменьшения количества доступных сайтов связывания кальция. Альтернативно или дополнительно, кислотный раствор, используемый на стадии (в), содержит любую кислоту, способную дополнительно сшивать активированные карбоксильные группы с активированными аминогруппами коллагена с образованием амидных связей. Предпочтительно кислота в кислотном растворе включает аминокарбоновую кислоту. Предпочтительно аминокарбоновая кислота представляет собой кислоту, имеющую по меньшей мере одну аминогруппу и по меньшей мере один карбоновокислотный заместитель. Более предпочтительно аминокарбоновая кислота выбрана из группы, состоящей из L-аргинина, L-лизина, L-гистидина, L-глутамата или L-аспартата.
Стадию промывки биоматериала осуществляют с использованием не содержащего фосфатов 0,9% об./об. физиологического раствора.
Хотя специалистам в данной области понятно, что температура, при которой осуществляется каждая из стадий способа сшивания, не является критичной, следует понимать, что предпочтительно температура составляет от 2°C до 40°C, более предпочтительно от 4°C до 30°C и наиболее предпочтительно от 5°C до 25°C.
В одном воплощении и спирт, и кислотный раствор, и промывной раствор, все не содержат буфера.
КРАТКОЕ ОПИСАНИЕ ГРАФИЧЕСКИХ МАТЕРИАЛОВ
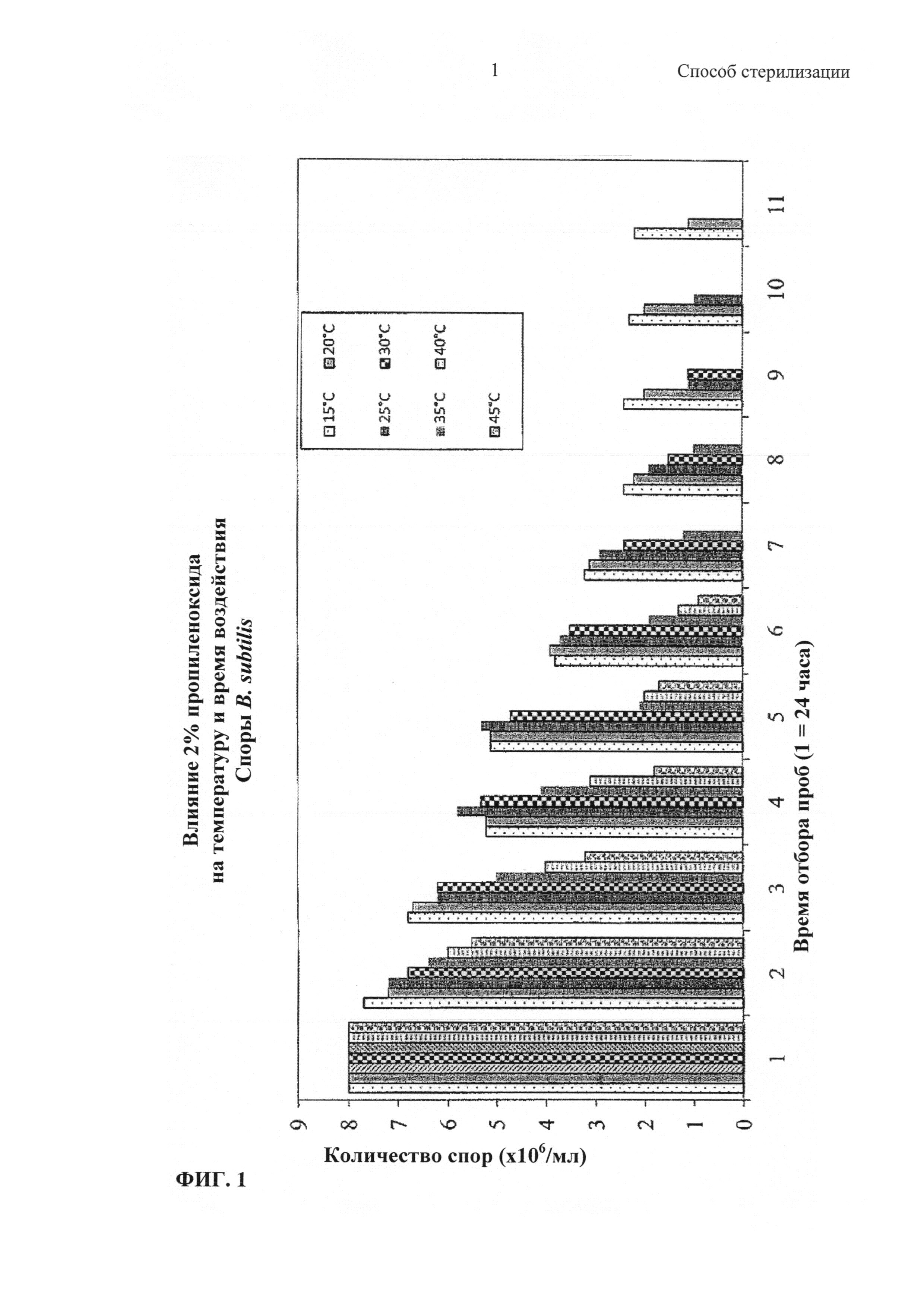
На Фиг. 1 показано влияние 2% пропиленоксида при различных температурах от 15°C до 45°C на споры В. subtilis в течение времени.
На Фиг. 2 показано влияние 4% пропиленоксида при различных температурах от 15°C до 45°C на споры В. subtilis в течение времени.
ПОДРОБНОЕ ОПИСАНИЕ ПРЕДПОЧТИТЕЛЬНЫХ ВОПЛОЩЕНИЙ
Перед подробным описанием настоящего изобретения следует понимать, что данное изобретение не ограничено конкретными приведенными в качестве примеров способами получения, которые, разумеется, могут изменяться. Следует также понимать, что терминология, использованная в данном описании изобретения, предназначена только для описания конкретных воплощений изобретения и не предназначена ограничивать то, что будет ограничено только прилагаемой формулой изобретения.
Все публикации, патенты и патентные заявки, указанные в данном описании изобретения, как выше, так и ниже, включены посредством ссылки в своей полноте. Однако публикации, упомянутые в данном описании изобретения, приведены для описания и раскрытия протоколов и реагентов, которые указаны в этих публикациях и которые могут быть использованы в связи с изобретением. Ничто в данном описании изобретения не следует истолковывать как признание того, что данное изобретение не имеет права предвосхищать такое раскрытие на основании предыдущего изобретения.
Кроме того, при практическом осуществлении настоящего изобретения, если не указано иное, используют традиционные иммунологические методики, химию и фармакологию в рамках компетенции специалиста в данной области. Такие методики хорошо известны специалисту или полностью пояснены в литературе. См., например, Coligan, Dunn, PIoegh, Speicherand Wingfield "Current protocols in Protein Science" (1999) Volume I and II (John Wiley & Sons Inc.); и Bailey, J.E. and Ollis, D.F., Biochemical Engineering Fundamentals, McGraw-Hill Book Company, NY, 1986; Immunochemical Methods In Cell And Molecular Biology (Mayer and Walker, eds., Academic Press, London, 1987); Handbook Of Experimental Immunology, Volumes I-IV (D.M. Weir and С.С. Blackwell, eds., 1986).
Следует отметить, что при использовании в данном описании изобретения и прилагаемой формуле изобретения, формы единственного числа включают ссылку на множественное число, если контекст явно не указывает иное. Таким образом, например, ссылка на "сшивающий агент" включает множество таких агентов, а ссылка на "спирт" является ссылкой на один или более спиртов, и т.д. Если не определено иное, все технические и научные термины, используемые в данном описании изобретения, имеют значения, являющиеся общепринятыми для обычного специалиста в области, к которой принадлежит данное изобретение. Хотя для практического осуществления или тестирования настоящего изобретения можно использовать любые вещества и способы, аналогичные или эквивалентные веществам и способам, описанным в данном описании изобретения, ниже описаны предпочтительные вещества и способы.
В одном из наиболее широких аспектов настоящее изобретение относится к способу стерилизации биоматериала на основе коллагена.
При использовании в данном описании изобретения термин "биоматериал" относится к любому коллагенсодержащему материалу, который возможно имеет биологическое применение. Коллаген может представлять собой любой тип коллагена из любого источника и может присутствовать отдельно или в комбинации с другими веществами. Соответственно, коллаген может представлять всего 1% масс./масс. от общей массы биоматериала или целых 100%.
Термин "коллаген", при использовании в данном описании изобретения, относится к внеклеточному семейству фибриллярных белков, отличающихся своей жесткой трехцепочечной спиральной структурой. Три коллагеновые полипептидные цепи ("α-цепи") обернуты вокруг друг друга с образованием этой спиральной молекулы. Предполагается, что этот термин также включает различные типы коллагена.
Основная часть спиральной части коллагена незначительно отличается у разных видов млекопитающих. Действительно, несколько типов коллагена имеют высокие степени гомологии нуклеотидных и аминокислотных последовательностей. Например, гомология нуклеотидной последовательности коллагена альфа I, тип II, составляет по меньшей мере 88% при сравнении человека, лошадиных и мышиных. Люди и лошадиные имеют 93%-ную гомологию последовательности на нуклеотидном уровне, в то время как мышиные и лошадиные имеют 89%-ную гомологию последовательности. Гомология нуклеотидной последовательности человека и мыши составляет 88% (см. учетные номера Национального центра биотехнологической информации (NCBI) U62528 (лошадиные), NM033150 (человек) и NM031163 (мышь) http://www.ncbi.nlm.nih.gov). Другие типы коллагена обладают аналогичными уровнями аминокислотной гомологии. Например, гомология нуклеотидной последовательности свиного коллагена альфа I, тип I, и овечьего коллагена альфа I, тип I, составляет 90% (см. учетные номера Национального центра биотехнологической информации (NCBI) AF29287 (Овечьи) и AF201723 (Свиные) http://www.ncbi.nlm.nih.gov).
Учитывая степень общего происхождения и биологии для многих вышеупомянутых животных, высокую степень гомологии аминокислотной и нуклеотидной последовательности коллагена у нескольких видов, таких как крупный рогатый скот, овцы, мыши и свиньи, специалисту в данной области будет понятно, что способы получения биоматериала, описанные в данном описании изобретения, применимы для коллагенового вещества, выделенного из всех млекопитающих животных.
Соответственно, в некоторых воплощениях биоматериал выделяют или собирают у животного из одного из отрядов млекопитающих, например Artiodactyla, Lagomorpha, Rodentia, Perissodactyla, Carnivora и Marsupialia. Это животное предпочтительно является овечьим, бычьим, козьим, лошадиным, свиным, сумчатым или человеком. Хотя биоматериал предпочтительно выделяют из животного того же вида, что и реципиент, предусматривается, что биоматериал может быть выделен из вида, отличного от вида реципиента.
Альтернативно, в некоторых воплощениях биоматериал содержит культивированную ткань, восстановленную ткань или тому подобное.
Биоматериал представляет собой любой тип клеточной ткани. Например, клеточная ткань может представлять собой сердечнососудистую ткань, ткань тазового дна, сердечную ткань, сердечный клапан, корень аорты, стенку аорты, створки аорты, ткань перикарда, соединительную ткань, матрикс мягких или твердых органов, кожную ткань, сосудистую ткань, твердую мозговую оболочку, хрящ, перикард, связки, сухожилие, кровеносные сосуды, ткань пуповины, костную ткань, фасции и подслизистую ткань или кожу, так как все они содержат некоторое количество коллагена.
Следует также иметь в виду, что биоматериал может дополнительно содержать синтетические аналоги, полученные из синтетических полимеров, очищенных биологических полимеров или обоих, включая те, которые обычно находятся в природных тканевых матриксах. Подходящие синтетические полимеры включают, например, полиамиды и полисульфоны. Биологические полимеры могут быть природными или полученными in vitro посредством, например, ферментации и тому подобного.
Очищенные биологические полимеры могут быть соответствующим образом сформированы в субстрат с помощью таких методик, как плетение, вязание, отливка, формовка, экструзия, клеточное выравнивание и магнитное выравнивание. Подходящие биологические полимеры включают, без ограничения ими, коллаген, эластин, шелк, кератин, желатин, полиаминокислоты, полисахариды (например, целлюлозу и крахмал) и сополимеры любого из них. Например, коллагеновые и эластиновые полимеры могут быть сформированы в синтетический имплантируемый материал посредством любой из множества методик, таких как переплетение и формовка. Синтетические аналоги ткани имитируют природный тканевый матрикс. Альтернативно, синтетические субстраты можно использовать для формирования тканевого аналога, либо отдельно, либо вместе с природными субстратами. Неограничивающие примеры включают полипропилен, полимолочную кислоту, полиэфир, нейлон, силикон и тому подобное.
Когда биоматериал приобретен, его сшивают. В сшивании можно использовать любую из известных методик, включая, но без ограничения ими, методики, описанные в Eyre et al., 1984, Annu. Rev. Biochem. 537, 717-748; Eyre, 1982, В: Symposium on Heritable Disorder of Connective Tissue (Akeson et al. eds) pp. 43-58, Mosby, St. Louis, Missouri; Davison & Brennan, 1983, Connect. Tissue Res. 11, 135-151; Robins, 1982, Methods Biochem. Analysis 28, 330-379; Reiser, 1991, Proc. Soc. Exp. Biol. Med. 196, 17-29.
Предпочтительный способ сшивания раскрыт в международной заявке на патент WO 2006/066327, которая включена в данную заявку во всей своей полноте посредством ссылки. В кратком изложении, начальная стадия в предпочтительном способе сшивания биоматериала на основе коллагена по настоящему изобретению включает приведение биоматериала в контакт со спиртосодержащим раствором. При использовании в данном описании изобретения термин "приведение в контакт" или "контактирование" относится к активной стадии погружения биоматериала на основе коллагена в раствор или агент, как описано в данном описании изобретения, или, как описано ниже, последующее приведение биоматериала в контакт со сшивающим агентом, кислотным раствором или другим веществом в течение периода времени достаточного для того, чтобы получить нужный выход. Способы приведения биоматериала в контакт, например, со спиртосодержащим раствором, хорошо известны в данной области. Например, обычно биоматериал можно привести в контакт путем распыления, погружения или окунания биоматериала в раствор или агент.
Термин "спирт" при использовании в данном описании изобретения относится к любому спирту, известному в данной области техники, который способен удалять или уменьшать количество триглицеридов и по меньшей мере частично этерифицировать карбоксильные группы, находящиеся на коллагене. Предпочтительно спирт представляет собой водорастворимый спирт. Более предпочтительно спирт представляет собой C1-С6низший спирт в растворе, не содержащем буфера. Еще более предпочтительно спирт выбран из группы, состоящей из метанола, этанола, циклогексанола, изопропанола, пропанола, бутанола, пентанола, изобутанола, втор-бутанола и трет-бутанола.
Не желая быть ограниченными конкретной теорией или гипотезой, авторы изобретения полагают, что спиртосодержащий раствор помогает в ослаблении тройной спирали и посредством этого экспонировании гидрофобных сайтов (см., Karube & Nishida, 1979, Biochim Biophys Acta., 23; 581(1): 106-13). Они также полагают, что карбоксильные и аминогруппы, находящиеся в коллагене, этерефицируются в присутствии спиртосодержащего раствора, так что они становятся доступными для сшивания на следующих стадиях. Таким образом, предпочтительный спиртовой раствор представляет собой раствор, содержащий по меньшей мере примерно 50% об./об., более предпочтительно по меньшей мере примерно 70% об./об., и наиболее предпочтительно по меньшей мере примерно 80% об./об. спирта в водном растворе, не содержащем буфера. В одном воплощении спиртовой раствор представляет собой 70% этанола об./об. в 0,9%-ном физиологическом растворе (содержащем 0,5 мМ PMSF).
В некоторых воплощениях спиртосодержащий раствор, а также другие растворы и реагенты, используемые в данном описании изобретения, "не содержат буфера", так как выдвинута гипотеза, что сшивающие агенты, содержащие альдегид, взаимодействуют с буфером в ходе фиксации, что вызывает деполимеризацию альдегида.
Стадия приведения биоматериала в контакт со спиртосодержащим раствором может быть осуществлена в течение любого периода времени при условии, что он является достаточным для придания биоматериалу устойчивости к патогенной кальцификации in vivo, и что большинство (т.е. большой процент) карбоксильных и аминогрупп, находящихся в коллагене, этерифицированы. Предпочтительно биоматериал остается в контакте со спиртосодержащим раствором в течение достаточного времени, чтобы обеспечить спирту возможность диффундировать и пропитать биоматериал. Более предпочтительно биоматериал подвергается воздействию спиртосодержащего раствора в течение по меньшей мере 24 часов, еще более предпочтительно по меньшей мере 36 часов, и наиболее предпочтительно по меньшей мере 48 часов.
После того, как биоматериал на основе коллагена был подвергнут воздействию спирта, его удаляют. В некоторых воплощениях биоматериал промывают после воздействия спирта в промывном растворе, содержащем 0,9% об./об. физиологический раствор, не содержащий фосфатов. Однако любой незабуференный физиологически приемлемый раствор можно использовать в качестве промывного раствора. Целью промывного раствора главным образом является удаление избытка спирта и поэтому это не критично.
После того, как биоматериал на основе коллагена подвергался воздействию спирта в течение более 24 часов, его приводят в контакт с одним или более сшивающими агентами, особенно бифункциональными сшивающими агентами. Термин "бифункциональный" при использовании в данном описании изобретения относится к двум функциональным альдегидным группам, присутствующим на обоих концах цепи из пяти атомов углерода. Сшивание может быть осуществлена посредством любой методики, известной в области техники, с любой формой сшивающего агента при условии, что он способен сшивать коллаген. Сшивающие агенты включают, без ограничения ими, ацилирующие соединения, адипилхлорид, альдегиды, алкил- и арилгалогениды, бисимидаты, карбодиимиды, дивинилсульфон (DVS), формальдегид, глутаровый альдегид, глиоксаль, гексаметилендиизоцианат, хлоргидроокись, гидроксиэтилметакрилатдивинилсульфон (HEMA-DIS-HEMA), имидоэфиры, изоцианаты, свет (например, синий свет и УФ-свет), N-гидроксисукцинимид, N-замещенные малеимиды, pH, полиальдегид, дифенилфосфорилазид (DPPA), полиэпоксисоединения, содержащие главную цепь из 17-25 атомов углерода и 4-5 эпоксигрупп, полиэпоксиэфиры, полиэтиленгликоль-дивинилсульфон (VS-PEG-VS), полиглицерин-полиглицидиловый эфир и температуру, и их комбинации
В некоторых воплощениях сшивающий агент представляет собой химический сшивающий агент, такой как карбодиимид, полиэпоксиэфиры, дивинилсульфон (DVS), генипин, глутаровый альдегид, формальдегид и дифенилфосфорилазид (DPPA).
Также было показано, что полиэпоксисоединения, содержащие главную цепь из 17-25 атомов углерода и 4-5 эпоксигрупп, демонстрируют высокую эффективность сшивания коллагена (см., например, заявку на патент США 20040059430 (S/N 10/618447). Также было показано, что токсичность полиэпоксисоединений является более низкой, чем токсичность глутарового альдегида, и антигенность или индукция иммунного ответа тканей уменьшается пропорционально времени взаимодействия в случае реакции со спиральными полипептидными молекулами, такими как коллаген. Как и следовало ожидать, он демонстрирует относительно хорошую биосовместимость (см., например, Lohre et al., (1992), Artif. Organs, 16:630-633; Uematsu et al., (1998), Artif. Organs, 22:909-913). Следовательно, полиэпоксисоединения, как описано, являются предпочтительным сшивающим агентом.
В некоторых воплощениях сшивающий агент содержит примерно 1% глутарового альдегида, и продолжительность воздействия составляет по меньшей мере примерно 24 часа. Следует понимать, что продолжительность воздействия на биоматериал сшивающего агента зависит от используемого агента, концентрации и температуры. Обычно продолжительность воздействия составляет от 24 часов до 28 суток. Определение точного времени воздействия сшивающего агента на биоматериал находится в рамках компетенции специалиста в данной области.
Снова, не желая ограничиваться какой-либо конкретной теорией или гипотезой, авторы изобретения полагают, что при воздействии сшивающего агента на биоматериал на основе коллагена, подвергнутый воздействию спирта, эстерифицированные карбоксильные группы и аминогруппы коллагена, присутствующие в материале, сшиваются.
Хотя специалистам в данной области очевидно, что температура, при которой осуществляется каждая стадия предпочтительного способа сшивания, не является критичной, следует понимать, что предпочтительно температура составляет от 2°C до 40°C, более предпочтительно от 4°C до 30°C и наиболее предпочтительно от 5°C до 25°C.
Еще раз, после стадии сшивания, биоматериал на основе коллагена предпочтительно промывают в промывном растворе, таком как раствор, используемый после стадии воздействия спирта (а). Однако снова следует понимать, что стадия промывки является лишь предпочтительной.
После стадии сшивания или, если используется, стадии промывки после стадии сшивания, биоматериал на основе коллагена может быть простерилизован для использования согласно способам, описанным в данном описании изобретения. Альтернативно, биоматериал на основе коллагена приводят в контакт с кислотным раствором, содержащим любую кислоту, способную инактивировать и/или модифицировать фиксированные и/или нефиксированные группировки сшивающего агента, присутствующие в биоматериале после стадии (б) для удаления или уменьшения доступных сайтов связывания кальция. Альтернативно или дополнительно, кислотный раствор, используемый на стадии (в), содержит любую кислоту, способную дополнительно сшивать активированные карбоксильные группы с активированными аминогруппами коллагена с образованием амидных связей.
Предпочтительно кислотный раствор содержит по меньшей мере одну аминокарбоновую кислоту. Термин "аминокарбоновая кислота" при использовании в данном описании изобретения означает любую кислоту, имеющую по меньшей мере одну аминогруппу и по меньшей мере один карбоксикислотный заместитель. Типичные примеры аминокарбоновых кислот, которые являются полезными в настоящем изобретении, включают, без ограничения ими, L-глутамат, L-аспартат, L-лизин, L-аргинин, L-гистидин. Цель кислотного раствора является двойной: во-первых, аминокарбоновая кислота способствует инактивации и/или модификации фиксированных или нефиксированных группировок сшивающего агента, посредством чего уменьшаются или облегчаются любые негативные биологические эффекты. Во-вторых, аминокарбоновая кислота дополнительно сшивает активированные карбоксильные группы с активированными аминогруппами коллагена с образованием амидных связей.
Концентрация аминокарбоновой кислоты будет зависеть от действительно используемой кислоты и других параметров, таких как общая масса используемого биоматериала и тому подобное. Кроме того, минимальное соотношение влажной массы аминокарбоновой кислоты к биоматериалу будет составлять примерно 1:4. Наиболее важным аспектом кислотного раствора является pH. pH должен быть ниже pH 7, предпочтительно ниже pH 6, более предпочтительно ниже pH 5, и наиболее предпочтительно ниже примерно pH 4,6.
В одном из воплощений кислотный раствор представляет собой 8 мг аминокарбоновой кислоты на миллилитр деионизированной воды, которая не содержит фосфатов, и pH составляет примерно 4.
Сшитый биоматериал на основе коллагена подвергают воздействию аминокарбоновой кислоты в течение по меньшей мере 6 часов, более предпочтительно по меньшей мере 24 часов, еще более предпочтительно более 48 часов. Хотя температура выдерживания в термостате не является критичной, предпочтительно она оставляет от 5°C до 55°C, более предпочтительно от 10°C до 45°C, наиболее предпочтительно около 45°C.
В некоторых воплощениях стадия (в) раскрытого способа сшивания заменена или сопровождается способом ингибирования образования металлопротеиназы на молекулах эластина, присутствующих в биоматериале. Конкретно, в ткани, такой как ткань аорты, присутствует больший процент эластина, чем в другой ткани. Эти молекулы эластина могут обеспечивать сайты для образования металлопротеиназы, и поэтому эти сайты следует сокращать, удалять или инактивировать.
Сшитый биоматериал на основе коллагена, перед или после стадии воздействия на биоматериал кислотного раствора и/или не содержащего буфера раствора, содержащего многовалентный катион, снова предпочтительно промывают в промывном растворе. Затем сшитый биоматериал на основе коллагена стерилизуют.
Стадия стерилизации биоматериала включает приведение сшитого биоматериала на основе коллагена в контакт с раствором для стерилизации, содержащим от 3% до 6% об./об. пропиленоксида, и выдерживание указанного биоматериала в термостате при температуре от 30°C до 55°C в течение более 48 часов; при условии, что раствор для стерилизации не содержит спирт.
Следует понимать, что спирт, особенно этанол и/или изопропанол, не используется в растворе для стерилизации по настоящему изобретению.
Было установлено, что при повышенных температурах, например выше 55°C, коллаген подвергается внутриклеточному разрушению. Действительно, было показано, что коллаген в фибробластах кожи человека начинает подвергаться ускоренному разрушению при температурах выше 41°C (Palotie, 1983, Coil Relat Res. Mar; 3(2); 105-13). Таким образом, в стерилизованном сшитом коллагеновом биоматериале по настоящему изобретению температура выдерживания в термостате является критическим фактором. Температура предпочтительно составляет не более 55°C, так как это увеличивает вероятность того, что коллаген начнет разрушаться. Однако как описано в Примере 9 и в других местах описания, важно, чтобы температура выдерживания в термостате была не менее 30°C, так как температура менее 30°C имеет пониженный потенциал стерилизации.
Специалистам в данной области следует понимать, что концентрации пропиленоксида ниже 3% не обеспечит достаточную стерилизацию, как она определена в данном описании изобретения. Концентрации пропиленоксида выше 6% являются токсичными и оказывают негативное влияние на целостность биоматериала. В некоторых воплощениях раствор для стерилизации содержит от 3,8% до 4,5% пропиленоксида. В других воплощениях раствор для стерилизации содержит примерно 4% пропиленоксида. В некоторых воплощениях раствор для стерилизации по существу состоит из 3%-6% пропиленоксида, более предпочтительно раствор для стерилизации состоит из 3%-6% пропиленоксида. В некоторых воплощениях раствор для стерилизации по существу состоит из 3,8%-4,5% пропиленоксида, более предпочтительно раствор для стерилизации состоит из 3,8%-4,5% пропиленоксида. В некоторых воплощениях раствор для стерилизации по существу состоит из примерно 4% пропиленоксида, более предпочтительно раствор для стерилизации состоит из примерно 4% пропиленоксида.
Термин "примерно", при использовании в данном описании изобретения относится к отклонению от значения, указанного после этого термина на 10% в большую или меньшую сторону. Например, ссылка на примерно 4% пропиленоксида включает диапазоны от 3,6% до 4,4%, т.е. на 10% меньше или больше значения 4%. Она включает 3,7%, 3,8%, 3,9%, 4,0%, 4,1%, 4,2%, 4,3% и 4,4% пропиленоксида.
Требуется, чтобы стадия стерилизации осуществлялась в течение более 48 часов; однако, как описано в данном описании изобретения, пропиленоксид также можно использовать как среду хранения, и поэтому стадия стерилизации может осуществляться в течение по меньшей мере 2, 3, 4, 5, 6, 7, 8, 9, 10 суток или более.
Одним из важнейших преимуществ способов, описанных в данном описании изобретения, является то, что раствор для стерилизации, используемый в данном описании изобретения, т.е. 3%-6% об./об. пропиленоксида, не только будет стерилизовать коллагенсодержащую ткань, не оказывая влияния на волокна коллагена, но так как пропиленоксид через примерно 4 суток контакта с биоматериалом превращается в пропиленгликоль (который не является токсичным), стерилизованный сшитый биоматериал на основе коллагена может оставаться в растворе для стерилизации в течение долгого времени после первоначальных 48 часов. Действительно, предусматривается, что сшитый биоматериал на основе коллагена будут стерилизовать, хранить и затем перевозить к конечному потребителю в одном и том же контейнере без необходимости в дополнительной обработке.
Термин "стерилизация" при использовании в данном описании означает, что сшитый биоматериал на основе коллагена удовлетворяет требованиям ISO 14160. ISO 14160 охватывает стерилизацию продуктов здравоохранения и относится к жидким химическим стерилизующим агентам для медицинских устройств однократного использования, использующих животные ткани и их производные. В кратком изложении, ISO 14160 требует, чтобы ткани были инокулированы спорами В. subtilis и затем обработаны для ликвидации инфицирования. Требования в отношении тестов по ISO 14160 описаны в Примере 6 ниже.
В некоторых воплощениях раствор для стерилизации не содержит буфер. В других воплощениях раствор содержит деионизованную воду.
После обработки способами, раскрытыми в данном описании изобретения, сшитый биоматериал на основе коллагена имеет высокий уровень устойчивости к кальцификации, т.е. является "устойчивым к кальцификации биоматериалом". Термин "кальцификация" при использовании в данном описании изобретения, относится к одной из крупнейших патологических проблем, связанных с традиционно производимым биоматериалом, содержащим белки соединительной ткани (т.е. коллаген и эластин). Ранее было показано, что эти материалы могут кальцинироваться после имплантации в организм. Такая кальцификация может приводить к нежелательному увеличению жесткости или к разрушению биоматериала. Известно, что в фиксированных коллагеновых биоматериалах имеют место два (2) типа кальцификации: внутренняя и внешняя, хотя точный(е) механизм(ы), посредством которого(ых) происходит такая кальцификация, неизвестен(ны). Внутренняя кальцификация характеризуется осаждением ионов кальция и фосфата в ткани фиксированного биопротеза, включая коллагеновую матрицу и остаточные клетки. Внешняя кальцификация характеризуется осаждением ионов кальция и фосфата в прилегающем тромбе, включая соседние к биоматериалу клетки (например, тромбоциты), и развитие содержащих фосфат кальция поверхностных бляшек на биоматериале.
Следовательно, выражение "высокий уровень устойчивости к кальцификации" и "устойчивый к кальцификации" при применении к биоматериалу по настоящему изобретению означает, что биоматериал после имплантации in vivo в течение по меньшей мере 200 суток показывает наличие менее чем 50 мкг, предпочтительно менее чем 20 мкг, и еще более предпочтительно менее чем 10 мкг кальция на мг высушенной ткани, после его извлечения.
Предпочтительно биоматериал по настоящему изобретению также устойчив к ферментативному разрушению. Термин "устойчив к ферментативному разрушению" при использовании в данном описании изобретения относится к способности биоматериала по настоящему изобретению противостоять ферментативному разрушению до уровня, сравнимого с традиционной фиксированной тканью.
После получения сшитый биоматериал на основе коллагена по настоящему изобретению можно затем использовать для лечения ряда состояний и/или расстройств.
В общем случае термины "лечить", "лечение" и тому подобные используются в данном описании изобретения для обозначения влияния на субъект или животное, их ткань или клетки для получения нужного фармакологического и/или физиологического эффекта. Эффект является главным образом терапевтическим в отношении частичного или полного излечения состояния и/или расстройства. "Лечение" при использовании в данном описании изобретения охватывает любое лечение состояния и/или расстройства у позвоночного, млекопитающего, в частности человека, и включает: (а) ингибирование этого состояния и/или расстройства, т.е. остановку его развития; или (б) улучшение или облегчение симптомов этого состояния и/или расстройства, т.е. регрессию симптомов ферментативного разрушения/состояния и/или расстройства.
Термины "состояние" и/или "расстройство" используются в данном описании изобретения взаимозаменяемо и относятся к аномальным состояниям, поражающим животных, включая людей, которые могут быть излечены с использованием биоматериала по настоящему изобретению. Соответственно, в настоящее изобретение включено лечение раны, повреждения, разрушения ткани, микробной инфекции, ожога, язвы, кожного состояния. Кроме того, также включена замена сердечных клапанов, корней аорты, стенки аорты, створок аорты, ткани перикарда, соединительной ткани, твердой мозговой оболочки, кожной ткани, сосудистой ткани, хряща, перикарда, связок, сухожилий, кровеносных сосудов, ткани пуповины, костной ткани, фасции и подслизистой ткани.
Устойчивый к кальцификации биоматериал по настоящему изобретению также может быть нанесен на любую из широкого множества контактирующих поверхностей медицинских устройств. Контактирующие поверхности включают, без ограничения ими, поверхности, которые предназначены для контакта с кровью, клетками или другими жидкостями организма или тканями животного, включая, в частности, человека. Подходящие поверхности контакта включают одну или более поверхностей медицинских устройств, которые предназначены для контакта с кровью или тканями. Медицинские устройства включают кольца для аневризмы, искусственные кровеносные сосуды, искусственные сердца, искусственные клапаны, искусственные почки, искусственные сухожилия и связки, пакеты для крови, оксигенаторы крови, заменители костей и сердечнососудистые заменители, протезы костей, костные воски, сердечнососудистые трансплантаты, устройства для замены хрящей, катетеры, контактные линзы, контейнеры для культивирования и регенерации клеток и тканей, частицы для эмболизации, системы фильтрации, трансплантаты, направляющие каналы, постоянные катетеры, лабораторные инструменты, сферические микрочастицы, направляющие роста нервов, офтальмологические имплантаты, ортопедические имплантаты, электроды кардиостимулятора, зонды, протезы, шунты, стенты, подложки для пептидов, хирургические инструменты, шовные материалы, шприцы, замены для мочевыводящих путей, раневые покрытия, раневые повязки, ранозаживляющие устройства и другие медицинские устройства, известные в данной области.
Другие примеры медицинских устройств, для которых будет полезным применение настоящего изобретения, будут очевидны специалистам в области хирургических и медицинских процедур, и поэтому предполагаются настоящим изобретением. Поверхность контакта может включать сетку, спираль, провод, надувной баллон или любую другую структуру, которая может быть имплантирована в целевой локализации, включая сердечнососудистые локализации, внутрипросветные локализации, локализации внутри твердой ткани и тому подобное. Имплантируемое устройство может быть предназначено для постоянной или временной имплантации. Такие устройства могут быть доставлены или включены во внутрисосудистые и другие медицинские катетеры.
Процесс нанесения покрытия на поверхности таких устройств может быть осуществлен при помощи метода плазменного нанесения, как описано в международной заявке на патент WO 96/24392.
Под словом "содержащий" понимают включающий то, что следует за словом "содержащий", но без ограничения им. Таким образом, использование термина "содержит" указывает на то, что перечисленные элементы являются необходимыми или обязательными, но что другие элементы возможны и могут присутствовать или не присутствовать. Под выражением "состоящий из" понимают включающий то, что следует за выражением "состоящий из" и ограниченный им. Таким образом, выражение "состоящий из" указывает на то, что перечисленные элементы являются необходимыми или обязательными, и что не могут присутствовать никакие другие элементы. Под "по существу состоящий из" понимают включающий любые элементы, перечисленные после этой фразы, и ограниченный теми элементами, которые не препятствуют или способствуют активности или действию, указанному в описании изобретения в отношении перечисленных элементов. Таким образом, выражение "по существу состоящий из" означает, что перечисленные элементы являются необходимыми или обязательными, но что другие элементы возможны и могут присутствовать или могут не присутствовать в зависимости от того, влияют они на активность или действие перечисленных элементов или нет.
Далее изобретение будет описано посредством ссылки только на следующие неограничивающие примеры. Однако следует понимать, что следующие примеры являются исключительно иллюстративными и не должны никоим образом рассматриваться как ограничение общего характера изобретения, описанного выше.
Пример 1. Основная обработка и хранение биоматериала
Сбор биоматериала, полученного из коллагена
Свиные сердца взрослых свиней были собраны на местной скотобойне и доставлены в лабораторию в пакетах со льдом в пределах 2-4 часов после смерти. Сердца дважды промывали ледяным 0,9% об./об. физиологическим раствором, тщательно очищали от прилипшего жира и отделяли соединительную ткань. Корни аорты с клапанами аорты иссекали из сердец и помещали в ледяной 0,9% об./об. физиологический/ фенилметилсульфонилфторидный (PMSF) раствор, и клапанные корни аорты промывали в течение 20 минут в 0,9% об./об. физиологическом растворе, содержащем PMSF. Створки клапанов извлекали из клапанного устья аорты и хранили в ледяном 0,9% об./об. физиологическом растворе.
Сшивание (фиксация) биоматериала
Готовили 0,625% об./об. раствор глутарового альдегида, содержащий 9,07 г/л калий-дигидрофосфатного буфера, в стерильной деионизированной воде. pH раствора глутарового альдегида доводили до 7,4 с помощью гидроксида натрия. Створки клапанов аорты сшивали в растворе глутарового альдегида при 1-5°C в течение минимального периода 5 суток, чтобы сшить белки, присутствующие в коллагене тканей.
Промывка сшитого биоматериала
Створки клапанов извлекали из раствора глутарового альдегида и промывали в стерильном 0,9% об./об. хлориде натрия в течение 15 минут. В период промывки температуру раствора для промывки поддерживали на уровне приблизительно 10°C.
Конечная стерилизация и хранение биоматериала
Створки клапанов аорты свиней погружали в 2,0% об./об. раствор глутарового альдегида, содержащий 29,02 г/л калий-дигидрофосфатного буфера в стерильной деионизированной воде. pH альдегидного раствора доводили до 7,4 с помощью гидроксида натрия. Процесс стерилизации осуществляли примерно при 25°C в течение 5 суток. Стерилизованные ткани делили на четыре группы и хранили в: (1) 0,625% об./об. глутаровом альдегиде, (5) 5,0% об./об. глутаровом альдегиде, (3) 10% об./об. глутаровом альдегиде; и (4) 2% об./об. пропиленоксиде до дальнейшего использования.
Пример 2. Влияние хранения раствора на профиль кальцификации биоматериала
Проводили экспериментальные исследования на моделях некрупных и крупных животных для оценки эффективности вышеописанного процесса стерилизации-хранения в уменьшении кальцификации обработанных коллагенсодержащих биоматериалов.
В первом исследовании на животных створки клапанов аорты свиней, стерилизованные и хранящиеся в соответствии со способами, описанными в Примере 1, использовали для оценки в модели некрупного животного.
Стерилизованные и хранящиеся створки клапанов аорты свиней всех четырех групп промывали в 0,9% об./об. физиологическом растворе в течение 5 минут. Промытые ткани хирургически имплантировали в подкожные карманы (один образец из каждой группы на крысу), созданные в центральной брюшной стенке растущих (в возрасте 6 недель) самцов крыс Вистар. Эти ткани удаляли через 60 суток, ткань хозяина удаляли и образцы сушили в инкубаторе Biotherm™ (Marcus Medical, JHB, RSA) при 90°C в течение 48 ч. Высушенные образцы взвешивали, и кальциевое содержимое экстрагировали 5,0 мл 6 н. ультрачистой соляной кислоты (Merck, JHB, RSA) при 75°C в течение 24 ч. Затем экстрагируемое содержание кальция измеряли с использованием атомно-абсорбционного спектрофотометра (Varian AA1275) и выражали в мкг кальция на мг ткани (сухая масса). Эти данные объединены в Таблице 1. Результаты (мкг кальция на мг сухой ткани) объединены в Таблице 1.
Пример 3. Влияние стерилизации и раствора для хранения на профиль кальцификации биоматериала
Отбор полученного из коллагена биоматериала
Во втором исследовании на животных свиные створки клапанов аорты собирали и выделяли согласно способу, описанному в Примере 1. Выделенные свиные створки клапанов аорты делили на три группы. Группа I получала обычную сшивающую обработку (контроль); Группа II получала запатентованный способ сшивания (см. WO2006/066327, включенную в данную заявку посредством ссылки); и Группа III получала такую же сшивающую обработку, что и Группа II, но за ней следовало выдерживание сшитого биоматериала в термостате с раствором для стерилизации, содержащим примерно 4% об./об. пропиленоксида, и выдерживание биоматериала в термостате при температуре от 30°C до 55°C в течение более 48 часов.
Сшивание (фиксация) створок клапанов аорты
В группе I свиные створки клапанов аорты сшивали в 0,625% растворе глутарового альдегида, содержащем 9,07 г/л калий-дигидрофосфатного буфера в стерильной деионизованной воде. pH раствора глутарового альдегида доводили до 7,4, используя гидроксид натрия. Створки клапанов аорты сшивали в растворе глутарового альдегида при 1-5°C в течение минимального периода 5 суток для сшивания белков, присутствующих в коллагене тканей.
В группе II и III готовили водорастворимый спиртосодержащий раствор 60-80% об./об. спирта этанола. Свиные створки клапанов аорты погружали в спиртовой раствор после хранения в течение ночи при 4°C. Клапанные корни аорты погружали в тот же спиртовой раствор немедленно после окончательной промывки в ледяном 0,9% об./об. физиологическом растворе (содержащем 0,5 мМ PMSF). Свиные створки клапанов аорты держали в спиртовом растворе при температуре примерно 5°C в течение минимум 24 часов.
Свиные створки клапанов аорты извлекали из спиртового раствора и промывали в течение примерно 10 минут 0,9% об./об. физиологическим раствором. В течение периода промывки поддерживали температуру промывного раствора примерно 10°C.
Створки клапанов аорты погружали в 0,625% об./об. раствор глутарового альдегида, содержащий 9,07 г/л калий-дигидрофосфатного буфера в стерильной деионизованной воде. pH раствора глутарового альдегида доводили до 7,4, используя гидроксид натрия. Перикард и клапанные корни аорты фиксировали в растворе глутарового альдегида при 1-5°C в течение минимального периода 24 часов для сшивания белков, присутствующих в коллагене тканей.
Свиные створки клапанов извлекали из раствора глутарового альдегида и промывали в стерильном 0,9% об./об. хлориде натрия в течение примерно 15 минут. Во время периода промывки температуру промывного раствора поддерживали равной примерно 10°C.
Затем свиные створки клапанов аорты погружали в не содержащий буфера раствор, содержащий 8 мг дикарбоновой кислоты на 1 мл деионизованной воды. pH раствора доводили до pH 4,5 с помощью некоторого объема разбавленной соляной кислоты. Перикард и клапанный корень аорты погружали в раствор при температуре примерно 45°C в течение примерно 48 часов.
Окончательная стерилизация и хранение биоматериала
Затем свиные створки клапанов аорты стерилизовали и хранили либо путем:
(1) погружения ткани в 0,25% об./об. раствор глутарового альдегида, содержащий 9,07 г/л калий-дигидрофосфатного буфера в стерильной деионизованной воде. pH альдегидного раствора доводили до 7,4, используя гидроксид натрия. Процесс стерилизации осуществляли при температуре примерно 45°C в течение примерно 120 минут (Обработка А); или
(2) свиные створки клапанов аорты стерилизовали в водном растворе, содержащем 4% об./об. пропиленоксида по массе, в комбинации с 20% об./об. этилового спирта при 37°C в течение примерно 24 часов и хранили в 4% об./об. растворе пропиленоксида (Обработка В-настоящее изобретение).
Стерилизованные и хранящиеся свиные створки клапанов аорты из всех трех групп промывали в 0,9% об./об. физиологическом растворе в течение 5 минут. Промытые ткани хирургически имплантировали в подкожные карманы (один образец каждой группы на крысу), созданные в области центральной абдоминальной стенки растущих (в возрасте 6 недель) самцов крыс Вистар. Эти ткани извлекали через 60 суток, ткань хозяина удаляли и образцы сушили в инкубаторе Bioterm™ (Selby Scientific, Perth, WA) при 90°C в течение 48 ч. Высушенные образцы взвешивали, и содержащийся кальций экстрагировали в 5,0 мл 6 н. ультрачистой соляной кислоты (Merck, Sydney, Australia) при 75°C в течение 24 ч. Затем содержание экстрагируемого кальция измеряли, используя атомно-абсорбционный спектрофотометр (Varian AA1275) и выражали в мкг кальция на мг ткани (сухая масса). Результаты (мкг кальция на мг сухой ткани) объединены в Таблице 2.
Пример 4. Влияние обработки В на профиль кальцификации бычьего перикарда
В третьем исследовании на животных потенциал кальцификации бычьих перикардов, подготовленных, сшитых и хранящихся как ткани в Примере 3 (0,625% забуференный глутаровый альдегид, Обработка А+0,2% глутаровый альдегид и Обработка В 4% об./об. пропиленоксид), сравнивали с потенциалом кальцификации имеющихся в продаже бычьих перикардов (перикард Хэнкока), хранящихся в 0,2% растворе глутарового альдегида.
Репрезентативные выборки из каждой группы обрезали до 1х1 см и промывали в 0,9% об./об. физиологическом растворе в течение 5 минут. Эти образцы хирургически имплантировали в подкожные карманы, созданные в области центральной дорсальной стенки растущих (в возрасте 6 недель) самцов крыс Вистар. Эти ткани извлекали через 60 суток, ткани хозяина удаляли, и содержание кальция определяли посредством атомно-абсорбционной спектрофотометрии. Результаты (мкг кальция на мг высушенной ткани) объединены в Таблице 3.
Пример 5. Влияние обработки В на профиль кальцификации свиной ткани клапана аорты (створки и стенка аорты) в модели крупного животного.
В четвертом исследовании на животных потенциал кальцификации подготовленной свиной ткани клапана аорты (створки и стенка аорты), сшитой в 0,625% забуференном глутаровом альдегиде и хранящейся в (1) 0,625% глутаровом альдегиде, (2) обработанный обработкой А (0,625% глутаровый альдегид) и (3) обработанного обработкой В (4% пропиленоксид).
Репрезентативные образцы из каждой группы обрезали до овальной формы размером примерно 1,2×1 см и промывали в 0,9% физиологическом растворе в течение 5 минут. Эти образцы хирургически имплантировали в яремную вену молодой овцы (масса тела 22-25 кг). Эти ткани извлекали через 150 суток, ткань хозяина удаляли и содержание кальция определяли посредством атомно-абсорбционной спектрофотометрии. Результаты (мкг кальция на мг сухой ткани) объединены в Таблице 4-А (створки клапана) и Таблицу 4-В (стенка аорты).
Пример 6. Валидация: стерилизация имеющегося в продаже сердечного клапана, инокулированного спорами Bacillus subtilise.
Эту валидацию осуществляли, чтобы протестировать применимость стерилизации ткани имеющегося в продаже сердечного клапана 4% пропиленоксидом через 48 часов при 45°C. Целью данного изучения применимости было исследовать, способен ли 3,8%-ный пропиленоксид (в качестве "наихудшего" уровня концентрации) стерилизовать имеющиеся в продаже сердечные клапаны Х ткань в "наихудших" условиях (инфицирование спорами Bacillus subtilis), как предписано инструкциями FDA. Условия тестирования:
- Клапаны извлекали из 0,5% глутарового альдегида и промывали в общей сложности 1000 мл стерильной дистиллированной воды в течение в общей сложности 6 минут.
- Держатель клапана и клапан асептически затем разделяли и затем сушили в течение приблизительно 30 минут до видимой сухости.
- Затем держатель клапана и клапан каждого устройства инокулировали в общей сложности 20 мкл суспензии спор Bacillus subtilis, полученных из STERIS Corporation, USA. Суспензия содержала 1,25×106 спор.
- Затем клапаны оставляли сушиться в течение приблизительно 1 часа при комнатной температуре.
- Затем эти устройства повторно собирали, как в инструкции, и помещали в стерильный сосуд.
- К десяти устройствам добавляли 160 мл свежеприготовленного 3,8% пропиленоксида.
- К последнему устройству добавляли 160 мл соево-казеиновой питательной среды (SCDM). Это являлось положительным контролем для оценки выживаемости суспензии спор. Положительный контроль выдерживали в термостате при 32°C в течение 48 часов.
- Затем десять тестируемых клапанов выдерживали в термостате при 42°C в течение 44 часов.
- После выдерживания в термостате для каждого клапана проводили тест на стерильность
- Клапаны разделяли, и каждый компонент переносили в пустой стерильный сосуд, в который добавляли SCDM.
- Затем сосуды выдерживали в термостате при 32°C в течение 14 суток.
- Сосуды ежедневно проверяли на наличие признаков помутнения.
Подробности тестирования:
Лабораторный номер: 7343042W
Способ: Способ согласно Test for Sterility, Appendix XVI, British Pharmacopoeia, 2010, и методике Pharmaceutical Testing Facility MB:PT:0110.
Пример 7. Влияние обработки В на профиль кальцификации ткани имеющейся в продаже ткани сердечного клапана (ткань бычьего перикарда) в модели некрупного животного
В Таблице 6 показаны результаты пятого исследования на животных, в котором потенциал кальцификации бычьего перикарда, сшитого и стерилизованного в 0,625% об./об. глутарового альдегида (который служит в качестве эталонного контроля - обозначен А), сравнивали с тканью имеющегося в продаже сердечного клапана (бычий перикард, сшитый и хранящийся согласно коммерческому запатентованному протоколу, который представляет собой сшивание 0,625% об./об. буферизованным глутаровым альдегидом + хранение в формальдегиде - обозначен В), и той же имеющейся в продаже тканью сердечного клапана, стерилизованной при 45°C в течение 48 часов в 4% об./об. пропиленоксиде и хранящейся в растворе 4% об./об. пропиленоксида - обозначена С.
Репрезентативные образцы из каждой группы обрезали до размера 1×1 см и промывали в 0,9% об./об. физиологическом растворе в течение 5 минут. Эти образцы хирургически имплантировали в подкожные карманы, созданные в области центральной дорсальной стенки растущих (в возрасте 6 недель) самцов крыс Вистар. Эти ткани извлекали через 8, 16 и 24 недель, ткань хозяина удаляли, и содержание кальция определяли посредством атомно-абсорбционной спектрофотометрии. Результаты (мкг кальция на мг сухой ткани) объединены в Таблице 6.
Пример 8. Влияние обработки В на профиль кальцификации имеющейся в продаже ткани сердечного клапана (бычий перикард) в модели быстрой кальцификации in vitro
При еще одной экспериментальной оценке потенциал кальцификации имеющейся в продаже ткани клапана (контрольная ткань) сравнивали с имеющейся в продаже тканью сердечного клапана, стерилизованной при 45°C в течение 48 часов в 4% пропиленоксиде и хранящейся в 4% растворе пропиленоксида (обработанная ткань) в модели быстрой кальцификации in vitro.
Стентированные имеющиеся в продаже сердечные клапаны (контрольные и обработанные) помещали в установку для испытаний на усталость Rowan Ash и подвергали воздействию физиологического раствора (с высоким содержанием кальция/фосфата) во время ускоренного потока (400 тестовых циклов в минуту) вплоть до 50 миллионов циклов.
После 50 миллионов тестовых циклов сердечные клапаны извлекали, и соответствующий образец ткани отдавали на гистологию. Оставшуюся ткань каждой из трех створок клапана в каждом клапане удаляли, и содержание кальция измеряли посредством атомно-абсорбционной спектрофотометрии. Результаты (мкг кальция на мг высушенной ткани) объединены в Таблице 7.
Пример 9. Влияние метода стерилизации и хранения на ткань, инокулированную спорами Bacillus subtilis
На Фиг. 1 и 2 показано влияние 2% об./об. и 4% об./об. пропиленоксида (соответственно) при различных температурах от 15°C до 45°C на споры В. subtilis с течением времени. Использованные условия эксперимента описаны в Примере 6. По существу, можно увидеть, что ни один из растворов для стерилизации (2% или 4%) не имеет небольшого стерилизационного эффекта до 48 часов. На Фиг. 2 также можно увидеть, что в пределах 48 часов эффект повышения температуры оказывает сильное влияние на стерилизацию. Например, при температуре 40°C и выше стерилизация происходила через 24 часа, и что к 48 часам стерилизация происходила даже при температуре 25°C и выше. На Фиг. 1 показано, что для того, чтобы обеспечить стерилизацию 2%-ным об./об. пропиленоксидом, ткань необходимо выдерживать в термостате по меньшей мере 6 суток при температуре выше 35°C. Даже выдерживание в термостате в течение 10 суток при 15-20°C не оказывает существенного влияния на стерилизацию 2%-ным об./об. пропиленоксидом.
Таким образом, на Фиг. 1 и 2 можно увидеть, что оптимальная стерилизация достигается путем выдерживания ткани в термостате с 4%-ным об./об. раствором пропиленоксида и выдерживании ткани в термостате при температуре примерно 45°C в течение более 48 часов.
Реферат
Группа изобретений относится к области стерилизации имплантируемых биоматериалов, в частности к способам стерилизации сшитого биоматериала на основе коллагена. Способ включает приведение указанного сшитого биоматериала на основе коллагена в контакт с раствором для стерилизации, содержащим 3%-6% об./об. пропиленоксида, и выдерживание указанного биоматериала в термостате в пропиленоксиде при температуре от 30°С до 55°С в течение более 48 часов. При этом раствор для стерилизации не содержит спирт. Также раскрывается способ стерилизации биоматериала на основе коллагена, способ хранения сшитого биоматериала на основе коллагена, а также варианты стерилизованного сшитого биоматериала на основе коллагена. Группа изобретений обеспечивает увеличение эффективности стерилизации, а также обеспечивает подходящую среду для хранения стерилизованного материала. 5 н. и 8 з.п. ф-лы, 2 ил. 7 табл., 9 пр.

Комментарии