Способ получения сополимеров сопряженных диенов в присутствии каталитической системы, включающей бисиминовый комплекс кобальта - RU2631657C2
Код документа: RU2631657C2
Чертежи

Описание
Настоящее изобретение относится к способу получения сополимеров сопряженных диенов.
В частности, настоящее изобретение относится к способу получения сополимеров сопряженных диенов, который включает полимеризацию по меньшей мере одного сопряженного диена в присутствии каталитической системы, включающей бис-иминовый комплекс кобальта.
Известно, что стереоспецифичная сополимеризация сопряженных диенов представляет собой чрезвычайно важный способ, применяемый в химической промышленности для получения продуктов, являющихся одними из наиболее широко используемых каучуков.
Также известно, что среди различных полимеров, которые могут быть получены стереоспецифичной полимеризацией 1,3-бутадиена (т.е. 1,4-цис-, 1,4-транс-, 1,2-синдиотактического, 1,2-изотактического, 1,2-атактического, смешанной 1,4-цис/1,2-структуры, имеющей различное содержание 1,2-звеньев), лишь 1,4-цис-полибутадиен и 1,2-синдиотактический полибутадиен производят в промышленных масштабах, и они коммерчески доступны. Дополнительные данные об этих полимерах имеются, например, в следующих публикациях: Takeuchi Y. с соавт., "New Industrial Polymers", "American Chemical Society Symposium Series" (1974), т. 4, стр. 15-25; Halasa A.F. с соавт., "Kirk-Othmer Encyclopedia of Chemical Technology" (1989), 4-ое изд., Kroschwitz J.I. под ред., John Wiley and Sons, New York, т. 8, стр. 1031-1045; Tate D. с соавт., "Encyclopedia of Polymer Science and Engineering (1989), 2-ое изд., Mark H.F. под ред., John Wiley and Sons, New York, т. 2, стр. 537-590; Kerns M. с соавт., "Butadiene Polymers" в "Encyclopedia of Polymer Science and Technology" (2003), Mark H.F. под ред., Wiley, т. 5, стр. 317-356.
1,4-цис-Полибутадиен представляет собой синтетический эластомер, обычно содержащий 96% - 97% 1,4-цис-звеньев, температура плавления (Tm) которого составляет приблизительно -2°С, температура кристаллизации (Tc) составляет приблизительно -25°С и температура стеклования (Tg) составляет менее -100°С; его свойства очень похожи на свойства натурального каучука, и в основном он используется в производстве шин обычных автомобилей и/или грузовых автомобилей. В частности, для изготовления шин используют полибутадиен с высоким содержанием 1,4-цис-звеньев.
1,4-цис-Полибутадиен обычно получают способами полимеризации, которые включают применение различных каталитических систем, включающих катализаторы на основе титана (Ti), кобальта (Со), никеля (Ni) и неодима (Nd). Каталитические системы, включающие катализаторы на основе кобальта, имеют высокую каталитическую активность и стереоспецифичность и могут считаться наиболее универсальными среди перечисленных выше катализаторов, поскольку при соответствующем изменении их состава они могут обеспечивать образование всех возможных перечисленных выше стереоизомеров полибутадиена, что рассмотрено, например, в следующих публикациях: Porri L. с соавт., "Comprehensive Polymer Science" (1989), Eastmond G.C. с соавт, под ред., Pergamon Press, Oxford, UK, т. 4, часть II, стр. 53-108; Thiele S.K.H. с соавт., "Macromolecular Science. Part С: Polymer Reviews" (2003), C43, стр. 581-628; Osakada, K. с соавт., "Advanced Polymer Science" (2004), т. 171, стр. 137-194; Ricci G. с соавт., "Advances in Organometallic Chemistry Research" (2007), Yamamoto K. под ред., Nova Science Publisher, Inc., USA, стр. 1-36; Ricci G. с соавт., "Coordination Chemistry Reviews" (2010), т. 254, стр. 661-676; Ricci G. с соавт., "Cobalt: Characteristics, Compounds, and Applications" (2011), Lucas J. Vidmar Ed., Nova Science Publisher, Inc., USA, стр. 39-81.
Например, с помощью каталитической системы бис-ацетилацетонат кобальта / хлорид диэтилалюминия /вода [Co(acac)2/AlEt2Cl/H2O] может быть получен полибутадиен, имеющий содержание 1,4-цис-звеньев, приблизительно равное 97%, и ее обычно применяют в промышленном получении этого полимера, как описано, например, в публикации Racanelli Р. с соавт., "European Polymer Journal" (1970), т. 6, стр. 751-761. С помощью каталитической системы трис-ацетилацетонат кобальта /метилалюмоксан [Со(асас)3/МАО] также может быть получен полибутадиен, имеющий содержание 1,4-цис-звеньев, приблизительно равное 97%, как указанно, например, в публикации: Ricci G. с соавт., "Polymer Communication" (1991), т. 32, стр. 514-517.
С другой стороны, применение каталитической системы трис-ацетилацетонат кобальта / триэтилалюминий / вода [Co(acac)3/AlEt3/H2O] обеспечивает получение полибутадиена, имеющего смешанную 1,4-цис/1,2 эквибинарную структуру, рассмотренную, например, в публикации: Furukawa J. с соавт., "Polymer Journal" (1971), т. 2, стр. 371-378. С другой стороны, эту каталитическую систему применяют в присутствии дисульфида углерода (GS2) в способах промышленного получения 1,2-синдиотактического полибутадиена с высокой степенью кристалличности; более подробно эти способы рассмотрены, например, в публикациях: Ashitaka Н. с соавт., "Journal of Polymer Science: Polymer Chemistry Edition" (1983), т. 21, стр. 1853-1860; Ashitaka H. с соавт., "Journal of Polymer Science: Polymer Chemistry Edition" (1983), т. 21, стр. 1951-1972; Ashitaka H. с соавт., "Journal of Polymer Science: Polymer Chemistry Edition" (1983), т. 21, стр. 1973-1988; Ashitaka H. с соавт., "Journal of Polymer Science: Polymer Chemistry Edition" (1983), т. 21, стр. 1989-1995.
Чрезвычайно активная и стереоспецифичная каталитическая система для получения 1,2-синдиотактического полибутадиена может быть получена комбинированием аллильного комплекса кобальта (η4-C4H6)(η5-C8H13)Co, рассмотренного, например, Natta G. с соавт., "Chemical Communications" (1967), вып. 24, стр. 1263-1265, с дисульфидом углерода (CS2), рассмотренным, например, в публикации: Ricci G. с соавт., "Polymer Communication" (1988), т. 29, стр. 305-307. Под действием этой каталитической системы может быть при комнатной температуре проведена димеризация 1,3-бутадиена, рассмотренная, например, в американском патенте US 5879805; но при низких температурах (-30°С) в этой реакции получается лишь 1,2-синдиотактические полимеры, как указано, например, в публикации: Ricci G. с соавт., "Polymer Communication" (1988), т. 29, стр. 305-307.
1,2-Синдиотактические полибутадиены также могут быть получены с помощью каталитических систем, получаемых комбинированием дихлорида кобальта (CoCl2) или дибромида кобальта (CoBr2) с органическими соединениями алюминия (например, алкильными соединениями алюминия), водой и фосфинами (например, трифенилфосфином), как указано, например, в следующих американских патентах: US 5879805, US 4324939, US 3966697, US 4285833, US 3498963, US 3522332, US 4182813, US 5548045 и US 7009013. Региорегулярность и кристалличность полибутадиенов, получаемых с использованием таких каталитических систем, гораздо ниже (например, от 80% до 90% 1,2-звенев, температура плавления (Tm) составляет от 75°С до 90°С) по сравнению с полибутадиенами, получаемыми с использованием каталитических систем, рассмотренных в публикации Ricci G. с соавт., "Polymer Communication" (1988), т. 29, стр. 305-307, упомянутой выше.
Дополнительные данные, относящиеся к полимеризации 1,3-бутадиена в присутствии каталитических систем, включающих комплексы кобальта с различными фосфинами, приведены, например, в следующих публикациях: Ricci G. с соавт., "Macromolecules" (2005), т. 38, стр. 1064-1070; Ricci G. с соавт., "Journal of Organometallic Chemistry" (2005), т. 690, стр. 1845-1854; Takeuchi М. с соавт., "Polymer International" (1992), т. 29, стр. 209-212; Takeuchi М. с соавт., "Polymer International" (1995), т. 36, стр. 41-45; Takeuchi М. с соавт., "Macromolecular Chemistry and Physics" (1996), т. 197, стр. 729-743; или в итальянских патентах IT 1349141, IT 1349142 и IT 1349143. Применение различных фосфинов основано на том хорошо известном факте, что стерические и электронные свойства фосфинов сильно зависят от типа заместителей у атома фосфора, как указано, например, в публикации: Dierkes Р. с соавт., "Journal of Chemical Society, Dalton Transactions" (1999), стр. 1519-1530; van Leeuwen P. с соавт., "Chemical Reviews" (2000), т. 100, стр. 2741-2769; Freixa Z. с соавт., "Dalton Transactions" (2003), стр. 1890-1901; Tolman C., "Chemical Reviews" (1977), т. 77, стр. 313-348.
Документы, относящиеся к рассмотренному выше применению фосфинов, указывают на то, что применение фосфиновых комплексов кобальта в комбинации с метилалюмоксаном (англ. methyaluminoxane, сокращенно МАО) позволяет регулировать микроструктуру полибутадиена, что позволяет получать полибутадиены с различными структурами в зависимости от типа фосфина, скоординированного с атомом кобальта.
Полимеризация 1,3-бутадиена в присутствии каталитических систем, включающих комплексы кобальта со стерически затрудненными алифатическими фосфинами (например, PtBu3, PiPr3, РtBu2Me, PCy3, РСyр3, где Р = фосфор,tBu = трет-бутил,iPr = изопропил, Cy = циклогексил и Cyp = циклопентил), приводит к получению полибутадиенов с преобладанием в структуре 1,4-цис-звеньев, в то время как полибутадиены, имеющие смешанную 1,4-цис/1,2-структуру были получены при использовании каталитических систем, включающих комплексы кобальта с фосфинами, имеющими меньшие стерические затруднения (например, PCy2H; PtBu2H; PEt3; PnPr3, где Р = фосфор, Cy = циклогексил,tBu = трет-бутил, Et = этил иnPr = н-пропил), как указано, например, в публикациях: Ricci G. с соавт., "Advances in Organometallic Chemistry Research" (2007), Yamamoto K. Ed., Nova Science Publisher, Inc., USA, стр. 1-36; Ricci G. с соавт., "Coordination Chemistry Reviews" (2010), т. 254, стр. 661-676; Ricci G. с соавт., "Journal of Molecular Catalysis A: Chemical" (2005), т. 226, стр. 235-241; и в итальянской патентной заявке IT 1349141.
Например, в публикациях: Ricci G. с соавт., "Advances in Organometallic Chemistry Researchʺ (2007), Yamamoto K. под ред., Nova Science Publisher, Inc., USA, стр. 1-36; Ricci G. с соавт., "Coordination Chemistry Reviews" (2010), т. 254, стр. 661-676; и в итальянской патентной заявке IT 1349141 рассмотрены полибутадиены с высоким содержанием 1,4-цис-звеньев (приблизительно 95%), которые были получены с использованием каталитических систем, включающих комплексы кобальта с бидентатными фосфинами [например, CoCl2[R2P(CH2)nPR2]/MAO, где Со = кобальт, Cl = хлор, R = метил, этил, фенил, n = 1 или 2, Р = фосфор и МАО = метилалюмоксан), независимо от типа бидентатного фосфина, координированного с атомом кобальта.
С другой стороны, было показано, что каталитические системы, включающие комплексы кобальта с лигандами, выбранными из ароматических фосфинов [например, CoCl2(PRPh2)2/MAO (где Со = кобальт, Cl = хлор, Р = фосфор, R = метил, н-пропил, этил, изопропил, циклогексил, Ph = фенил, МАО = метилалюмоксан] чрезвычайно активны в 1,2-полимеризации 1,3-бутадиена, что рассмотрено, например, в публикациях: Ricci G. с соавт., "Advances in Organometallic Chemistry Research" (2007), Yamamoto K. под ред., Nova Science Publisher, Inc., USA, стр. 1-36; Ricci G. с соавт., "Coordination Chemistry Reviews" (2010), т. 254, стр. 661-676; Ricci G. с соавт., "Macromolecules" (2005), т. 38, стр. 1064-1070; Ricci G. с соавт., "Journal of Organometallic Chemistry" (2005), т. 690, стр. 1845-1854; или в итальянской патентной заявке IT 1349143. Действительно, применение таких каталитических систем позволило поучить полибутадиены, имеющие по существу 1,2-структуру (в диапазоне от 70% до 88%), имеющие различное содержание 1,2-звеньев в зависимости от типа комплекса и условий полимеризации. Также было отмечено, что регулярность молекулярной структуры (тактичность) получаемых полибутадиенов сильно зависит от типа комплекса, т.е. типа фосфина, связанного с атомом кобальта, и что показатель синдиотактичности (выраженный в виде процентной доли синдиотактических триад "rr"), определяемый из ЯМР13С спектров, повышается с увеличением стерических требований алкильной группы, связанной с атомом фосфора.
Было показано, что 1,2-полибутадиены, получаемые в присутствии кобальтовых систем с менее стерически затрудненными фосфиновыми лигандами (например, PMePh2; PEtPh2; PnPrPh2, где P = фосфор, Me = метил, Ph = фенил,nPr = н-пропил), аморфны, в то время как полибутадиены, получаемые в присутствии каталитических систем, содержащих фосфиновые лиганды с более сильными стерическими затруднениями (например, PiPrPh2, PCyPh2, где Р = фосфор,iPr = изопропил, Ph = фенил, Cy = циклогексил), являются кристаллическими, и их температура плавления (Tm) составляет от 110°С до 120°С в зависимости от условий полимеризации.
Полимеризация 1,3-бутадиена с использованием каталитических систем, включающих комплексы кобальта с ароматическими фосфинами, имеющими формулу CoCl2(PR2Ph)2/MAO (где Со = кобальт, Cl = хлор, R = метил, этил, циклогексил, Ph = фенил, МАО = метилалюмоксан), также была изучена, и результаты опубликованы, например, в работах: Ricci G. с соавт., "Advances in Organometallic Chemistry Research" (2007), Yamamoto K. под ред., Nova Science Publisher, Inc., USA, стр. 1-36; Ricci G. с соавт., "Coordination Chemistry Reviews" (2010), т. 254, стр. 661-676; Ricci G. с соавт., "Journal of Organometallic Chemistry" (2005), т. 690, стр. 1845-1854; или в итальянской патентной заявке IT 1349143. С помощью таких каталитических систем в основном были получены 1,2-полибутадиены, но, как оказалось, показатель синдиотактичности таких полимеров в тех же условиях полимеризации обычно несколько ниже показателя 1,2-полибутадиенов, получаемых с использованием каталитических систем, включающих комплексы кобальта с ароматическими фосфинами, имеющими формулу CoCl2(PRPh)2/MAO, рассмотренную выше.
В последнее время после успеха, достигнутого при применении рассмотренных выше каталитических систем, включающих фосфиновые комплексы кобальта, также были изучены различные каталитические системы, включающие комплексы кобальта с лигандами, содержащими в качестве донорного атома атом азота или кислорода.
Например, Kim J.S. с соавт. в публикации "e-Polymer" (European Polymer Federation) (2006), No. 27 рассмотрена полимеризация 1,3-бутадиена под действием каталитической системы, включающей комплексы кобальта с такими лигандами, как бис(имин)пиридин и сесквихлорид этилалюминия [Al2Et3Cl3 (англ. ethylaluminiumsesquichloride, сокращенно EASC)]. Было показано, что эти каталитические системы особенно активны и обеспечивают получение высокомолекулярных полибутадиенов, в которых содержание 1,4-цис-звеньев составляет 96,4%.
Каталитические системы, включающие комплексы кобальта, имеющие формулу (Salen)Co(II) (где Salen = бис(салицилальдегид)этилендииминат, Со = кобальт), и метилалюмоксан (МАО), характеризующиеся высокой активностью и 1,4-цис селективностью, рассмотрены, например, Endo K. с соавт. в публикации "Journal of Polymer Science: Part A: Polymer Chemistry" (2006), т. 44, стр. 4088-4094.
Cariou R. с соавт. в публикации "Dalton Transactions" (2010), т. 39, стр. 9039-9045 рассмотрен синтез и характеристика серии комплексов кобальта (II) [Со(II)] с бис(бензимидазолом), которые в комбинации с метилалюмоксаном (МАО) обеспечивали высокую селективность 1,4-цис-полимеризации 1,3-бутадиена.
Синтез и характеристика серии комплексов кобальта (II) [Co(II)] с дибензимидазольными лигандами и их применение в комбинации с сесквихлоридом этилалюминия (EASC) в полимеризации 1,3-бутадиена рассмотрены Appukuttan с соавт. в публикации "Polymer" (2009), т. 50, стр. 1150-1158; полученные каталитические системы характеризуются высокой каталитической активностью, а также высокой 1,4-цис-селективностью (до 97%).
Комплексы кобальта с 2,6-бис[1-(иминофенил)этил]пиридиновыми лигандами были синтезированы и охарактеризованы Gong D. с соавт. в публикации "Polymer" (2009), т. 50, стр. 6259-6264. Эти комплексы в комбинации с метилалюмоксаном (МАО) испытывали в полимеризации 1,3-бутадиена, и было показано, что из них могут быть получены каталитические системы, обеспечивающие образование 1,4-цис- или 1,4-транс-полибутадиена в зависимости от отношения МАО/Со. Действительно, при использовании молярного отношения МАО/Со, равного 50, получался в основном 1,4-транс-полибутадиен (приблизительно 94,4%), в то время как, при использовании молярного отношения МАО/Со, равного 100, в основном был получен 1,4-цис-полибутадиен (приблизительно 79%).
В публикации "Journal of Molecular Catalysis A: Chemical (2010), т. 325, стр. 84-90, Appukuttan V. с соавт. рассмотрена серия комплексов, имеющих общую формулу [Py(Bm-R)2]CoCl2 (где Py = пиридил, Bm = бензимидазолил, R = водород, метил, бензимидазол, Со = кобальт, Cl = хлор), которые в комбинации с метилалюмоксаном (МАО) способствуют получению высокомолекулярного 1,4-цис-полибутадиена.
В публикации "Journal of Organometallic Chemistry" (2011), т. 696, стр. 1584-1590, Gong D. с соавт. рассмотрена серия 2,6-бис(имин)пиридиновых комплексов кобальта (II) [Со(II)], которые в комбинации с метилалюмоксаном (МАО), действующим как сокатализатор, показывают относительно высокую активность в полимеризации 1,3-бутадиена, позволяя получать полибутадиен, содержащий от 77,5% до 97% 1,4-цис-микроструктуры, а также позволяя регулировать как молекулярную массу, так и ее распределение.
Наконец, Jie S. с соавт. в публикации "Dalton Transactions" (2011), т. 40, стр. 10975-10982, и Ai Р. с соавт. в "Journal of Organometallic Chemistry" (2012), т. 705, стр. 51-58, недавно была рассмотрена возможность получения полибутадиена с высоким содержанием 1,4-цис-звеньев (>96%) с помощью каталитических систем, включающих катализаторы на основе комплексов кобальта с лигандами типа 3-арилиминометил-2-гидроксибензальдегида или с лигандами типа NNO (имино- или амино-пиридиловыми спиртами), соответственно.
Как уже было указано выше, поскольку сополимеры сопряженных диенов, в частности, полибутадиена, с высоким содержанием 1,4-цис-звеньев, представляют собой полимеры, наиболее широко применяемые в промышленном масштабе, в частности, для изготовления шин, поиск новых способов, обеспечивающих получение этих сополимеров, имеет огромную важность.
Авторы настоящего изобретения рассмотрели задачу создания нового способа получения сополимеров сопряженных диенов, таких как, например, полибутадиен, полиизопрен, в частности, неразветвленного (линейного) или разветвленного полибутадиена с высоким содержанием 1,4-цис-звеньев, т.е. с содержанием 1,4-цис-звеньев ≥98%.
Авторами было обнаружено, что получение сополимеров сопряженных диенов, таких как, например, полибутадиен, полиизопрен, в частности, неразветвленного (линейного) или разветвленного полибутадиена с высоким содержанием 1,4-цис-звеньев, т.е. содержанием 1,4-цис-звеньев ≥98%, может быть осуществлено в присутствии каталитической системы, включающей по меньшей мере один бис-иминовый комплекс кобальта, имеющий общую формулу (I), приведенную ниже.
Таким образом, задача настоящего изобретения относится к способу получения сополимеров сопряженных диенов, который включает полимеризацию по меньшей мере одного сопряженного диена в присутствии каталитической системы, включающей по меньшей мере один бис-иминовый комплекс кобальта, имеющий общую формулу (I):
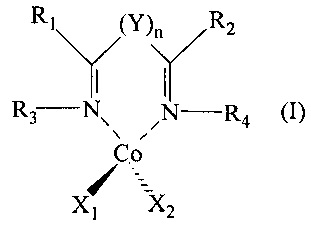
где:
- n равен 0 или 1;
- Y представляет собой группу -CR'Rʺ, в которой R' и Rʺ одинаковы или различны и представляют собой атом водорода или неразветвленную или разветвленную С1-С20, предпочтительно C1-C15, алкильную группу или необязательно замещенную двухвалентную ароматическую группу;
- R1 и R2 одинаковы или различны и представляют собой атом водорода, или они выбраны из неразветвленной или разветвленной C1-С20, предпочтительно C1-С15, необязательно галогенированной алкильной группы, необязательно замещенных циклоалкильных групп; или R1 и R2 необязательно могут быть соединены друг с другом, образуя вместе с другими атомами, к которым они присоединены, насыщенный, ненасыщенный или ароматический цикл, содержащий от 4 до 6 атомов углерода, необязательно замещенный неразветвленными или разветвленными С1-С20, предпочтительно C1-C15, алкильными группами; при этом цикл необязательно содержит такие гетероатомы, как, например, кислород, сера, азот, кремний, фосфор, селен;
- R3 и R4 одинаковы или различны и представляют собой атом водорода, или они выбраны из неразветвленной или разветвленной С1-С20, предпочтительно С1-С15, необязательно галогенированной алкильной группы, необязательно замещенных циклоалкильных групп, необязательно замещенных арильных групп;
- или R2 и R4 необязательно могут быть соединены друг с другом, образуя вместе с другими атомами, к которым они присоединены, насыщенный, ненасыщенный или ароматический цикл, содержащий от 3 до 6 атомов углерода, необязательно замещенный неразветвленными или разветвленными С1-С20, предпочтительно С1-С15, алкильными группами; при этом цикл необязательно содержит другие гетероатомы, такие как, например, кислород, сера, азот, кремний, фосфор, селен;
- или и R3 необязательно могут быть соединены друг с другом, образуя вместе с другими атомами, к которым они присоединены, насыщенный, ненасыщенный или ароматический цикл, содержащий от 3 до 6 атомов углерода, необязательно замещенный неразветвленными или разветвленными C1-C20, предпочтительно C1-C15, алкильными группами; при этом цикл необязательно содержит другие гетероатомы, такие как кислород, сера, азот, кремний, фосфор, селен;
- X1 и Х2 одинаковы или различны и представляют собой атом галогена, такого как, например, хлор, бром, йод; или они выбраны из неразветвленных или разветвленных С1-С20, предпочтительно С1-С15, алкильных групп, групп -OCOR5 или групп -OR5, где R5 выбран из неразветвленных или разветвленных С1-С20, предпочтительно С1-С15, алкильных групп.
Если не указано иное, в настоящем описании и прилагаемой формуле изобретения определения числовых интервалов обязательно включают крайние точки.
В настоящем описании и прилагаемой формуле изобретения термин "включающий" также охватывает термины "по существу состоящий из" или "состоящий из".
Согласно одному из предпочтительных примеров осуществления настоящего изобретения, каталитическая система может включать по меньшей мере один сокатализатор (b), выбранный из органических соединений элемента М' не являющегося углеродом, при этом элемент М' выбран из элементов групп 2, 12, 13 или 14 Периодической системы элементов, предпочтительно из: бора, алюминия, цинка, магния, галлия, олова, и более предпочтительно из алюминия и бора.
Получение каталитической системы, включающей бис-иминовый комплекс кобальта, имеющий общую формулу (I), и сокатализатор (b), обычно и предпочтительно выполняют в инертной жидкостной среде, более предпочтительно в углеводородном растворителе. Выбор бис-иминового комплекса кобальта, имеющего общую формулу (I), и сокатализатора (b), а также конкретного применяемого способа может быть различным в зависимости от молекулярных структур и требуемого результата, и может быть произведен на основании аналогичных данных, рассмотренных в доступной для специалистов в данной области техники специальной литературе на примере других комплексов переходных металлов и иминных лигандов, например, L.K. Johnson с соавт. в "Journal of the American Chemical Society" (1995), т. 117, стр. 6414-6415, и G. van Koten с соавт. в "Advances in Organometallic Chemistry" (1982), т. 21, стр. 151-239.
Согласно другому предпочтительному примеру осуществления настоящего изобретения, сокатализатор (b) может быть выбран из (b1) производных алкилалюминия, имеющих общую формулу (II):
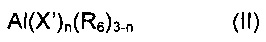
в которой X' означает атом галогена, такого как, например, хлор, бром, йод, фтор; R6 выбран из неразветвленных или разветвленных C1-C20 алкильных групп, циклоалкильных групп, арильных групп, и эти группы необязательно замещены одним или более атомами кремния или германия; и n представляет собой целое число, составляющее от 0 до 2.
Согласно другому предпочтительному примеру осуществления настоящего изобретения, сокатализатор (b) может быть выбран из (b2) органических кислородсодержащих соединений элемента М', не являющегося углеродом, который относится к группам 13 или 14 Периодической системы элементов, предпочтительно из органических кислородсодержащих соединений алюминия, галлия, олова. Органические кислородсодержащие соединения (b2) могут быть определены как органические соединения элемента М', в которых последний связан с по меньшей мере одним атомом кислорода и по меньшей мере одной органической группой, состоящей из алкильной группы, содержащей от 1 до 6 атомов углерода, предпочтительно метильной группы.
Согласно другому предпочтительному примеру осуществления настоящего изобретения, сокатализатор (b) может быть выбран из (b3) металлорганических соединений или смесей металлорганических соединений элемента М', не являющегося углеродом, которые могут реагировать с бис-иминовым комплексом кобальта, имеющим общую формулу (I), удаляя из него заместитель X1 или Х2, который формирует σ-связь, с образованием, с одной стороны, по меньшей мере одного нейтрального соединения и, с другой стороны, ионного соединения, состоящего из катиона, содержащего металл (Со), образующий координационные связи с лигандом, и не образующий координационных связей органический анион, содержащий металл М', в котором отрицательный заряд делокализован по многоцентровой структуре.
Следует отметить, что в настоящем описании и прилагаемой формуле изобретения термин "Периодическая таблица элементов" относится к той версии "Периодической таблицы элементов", которая утверждена IUPAC (Международный союз теоретической и прикладной химии, англ. International Union of Pure and Applied Chemistry) 22 июня 2007 г. и находится на следующем интернет-сайте:
www.iupac.org/fileadmin/user_upload/news/IUPAC_Periodic_Table-1Jun12.pdf.
Термин "двухвалентная ароматическая группа" относится к ароматической карбоциклической группе, содержащей один или более ароматических циклов. Двухвалентная ароматическая группа необязательно может быть замещена одной или более одинаковыми или различными группами, выбранными из: атомов галогенов, например, фтора, хлора, брома; гидроксильными группами; С1-С12 алкильными группами; C1-C12 алкоксильными группами; цианогруппами; аминогруппами; нитрогруппами. Конкретные примеры двухвалентных ароматических групп включают: орто-фенилен, мета-фенилен метилфенилен, триметилфенилен, метоксифенилен, гидроксифенилен, фенилоксифенилен, фторфенилен, хлорфенилен, бромфенилен, нитрофенилен, диметиламинофенилен, нафтилен, фенилнафтилен, фенантренилен, антраценилен.
Термин "С1-С20 алкильные группы" относится к неразветвленным или разветвленным алкильным группам, содержащим от 1 до 20 атомов углерода. Конкретные примеры С1-C20 алкильных групп включают: метил, этил, н-пропил, изопропил, н-бутил, втор-бутил, изобутил, трет-бутил, пентил, гексил, гептил, октил, н-нонил, н-децил, 2-бутилоктил, 5-метилгексил, 4-этилгексил, 2-этилгептил, 2-этилгексил.
Термин "необязательно галогенированные C1-C20 алкильные группы" относится к неразветвленным или разветвленным алкильным группам, содержащим от 1 до 20 атомов углерода, насыщенным или ненасыщенным, в которых по меньшей мере один из атомов водорода замещен атомом галогена, например, фтора, хлора, брома, предпочтительно фтора, хлора. Конкретные примеры необязательно галогенированных С1-С20 алкильных групп включают: фторметил, дифторметил, трифторметил, трихлорметил, 2,2,2-трифторэтил, 2,2,2-трихлорэтил, 2,2,3,3-тетрафторпропил, 2,2,3,3,3-пентафторпропил, перфторпентил, перфтороктил, перфтордецил.
Термин "циклоалкильные группы" относится к циклоалкильным группам, содержащим от 3 до 30 атомов углерода. Циклоалкильные группы необязательно могут быть замещены одной или более одинаковыми или различными группами, выбранными из: атомов галогенов; гидроксильных групп; С1-С12 алкильных групп; С1-С12 алкоксильных групп; цианогрупп; аминогрупп; нитрогрупп. Конкретные примеры циклоалкильных групп включают: циклопропил, 2,2-дифторциклопропил, циклобутил, циклопентил, циклогексил, гексаметил циклогексил, пентаметил-циклопентил, 2-циклооктилэтил, метилциклогексил, метоксициклогексил, фторциклогексил, фенилциклогексил.
Термин "арильные группы" относится к ароматическим карбоциклическим группам. Ароматические карбоциклические группы необязательно могут быть замещены одной или более группами, одинаковыми или различными, выбранными из: атомов галогенов, например, фтора, хлора, брома; гидроксилых групп; C1-C12 алкильных групп; С1-C12 алкоксильных групп; цианогрупп; аминогрупп; нитрогрупп. Конкретные примеры арильных групп включают: фенил, метилфенил, триметилфенил, метоксифенил, гидроксифенил, фенилоксифенил, фторфенил, хлорфенил, бромфенил, нитрофенил, диметиламинофенил, нафтил, фенилнафтил, фенантрен, антрацен.
Термин "цикло" относится к системе, включающей цикл, содержащий от 3 до 6 атомов углерода или от 4 до 6 атомов углерода, необязательно содержащий кроме атома азота другие гетероатомы, выбранные из азота, кислорода, серы, кремния, селена, фосфора. Конкретные примеры таких циклов включают: пиридин, тиадиазол.
Согласно другому предпочтительному примеру осуществления настоящего изобретения, сопряженный диен может быть выбран, например, из: 1,3-бутадиена, 2-метил-1,3-бутадиена (изопрена), 2,3-диметил-1,3-бутадиена, 1,3-пентадиена, 1,3-гексадиена, цикло-1,3-гексадиена или смесей перечисленных соединений. Предпочтительными являются 1,3-бутадиен и изопрен.
Согласно одному из предпочтительных примеров осуществления настоящего изобретения, в бис-иминовом комплексе кобальта, имеющем общую формулу (I):
- n равен 0;
- R1 и R2 одинаковы или различны и представляют собой атом водорода, или они выбраны из неразветвленных или разветвленных C1-C20 алкильных групп и предпочтительно представляют собой метильные группы;
- R3 и R4 одинаковы или различны и выбраны из фенильных групп, необязательно замещенных неразветвленными или разветвленными C1-C20 алкильными группами, предпочтительно замещенных одной или более метильными, этильными, изо-пропильными, трет-бутильными группами;
- X1 и Х2 представляют собой одинаковые группы, выбранные из атомов галогена, например, хлора, брома, йода, предпочтительно хлора.
Согласно другому предпочтительному примеру осуществления настоящего изобретения, в бис-иминовом комплексе кобальта, имеющем общую формулу (I):
- n равен 1;
- Y представляет собой группу CR'Rʺ, в которой R' и Rʺ одинаковы или различны и представляют собой атом водорода, или они выбраны из неразветвленных или разветвленных С1-С20 алкильных групп и предпочтительно представляют собой пропильные группы;
- R1 и R2 одинаковы или различны и представляют собой атом водорода, или они выбраны из неразветвленных или разветвленных C1-С20 алкильных групп и предпочтительно представляют собой метильные группы;
- R3 и R4 одинаковы или различны и выбраны из фенильных групп, необязательно замещенных неразветвленными или разветвленными С1-С20алкильными группами, предпочтительно замещенных одной или более метильными, этильными, изопропильными, трет-бутильными группами;
- X1 и Х2 представляют собой одинаковые группы, выбранные из атомов галогена, например, хлора, брома, йода, предпочтительно хлора.
Согласно другому предпочтительному примеру осуществления настоящего изобретения, в бис-иминовом комплексе кобальта, имеющем общую формулу (I):
- n равен 0;
- R1 и R3 соединены друг с другом и вместе с другими атомами, к которым они присоединены, образуют пиридиновый цикл;
- R2 представляет собой атом водорода или выбран из неразветвленных или разветвленных С1-С20 алкильных групп и предпочтительно представляет собой метильную группу;
- R4 выбран из фенильных групп, необязательно замещенных неразветвленными или разветвленными C1-C20 алкильными группами и предпочтительно представляет собой фенильную группу, замещенную одной или более метильными, этильными, изопропильными, трет-бутильными группами;
- X1 и Х2 представляют собой одинаковые группы, выбранные из атомов галогена, например, хлора, брома, йода, предпочтительно хлора.
Согласно другому предпочтительному примеру осуществления настоящего изобретения, в бис-иминовом комплексе кобальта, имеющем формулу (I):
- n равен 1;
- Y представляет собой двухвалентную ароматическую группу, необязательно замещенную, предпочтительно мета-фениленовую группу;
- R1 и R2 одинаковы или различны и представляют собой атомы водорода, или они выбраны из неразветвленных или разветвленных С1С20 алкильных групп и предпочтительно представляют собой метильные группы;
- R3 и R4 одинаковы или различны и выбраны из фенильных групп, необязательно замещенных неразветвленными или разветвленными C1-C20алкильными группами, и предпочтительно представляют собой фенильные группы, замещенные метильной группой;
- X1 и Х2, представляют собой одинаковые группы, выбранные из атомов галогена, например, хлора, брома, йода, предпочтительно хлора.
Настоящее изобретение относится к бис-иминовому комплексу кобальта, имеющему общую формулу (I), который может находиться в любой физической форме, например, в виде выделенного и очищенного твердого вещества, в виде раствора в подходящем растворителе или в виде, нанесенном на подходящие органические или неорганические твердые вещества, предпочтительно имеющие гранулированную или порошкообразную физическую форму.
Бис-иминовый комплекс кобальта, имеющий общую формулу (I), получают, используя в качестве исходных веществ лиганды, известные в данной области техники.
Конкретные примеры лигандов, которые могут быть применены для осуществления настоящего изобретения, представляют собой лиганды, имеющие следующие формулы (L1)-(L22):
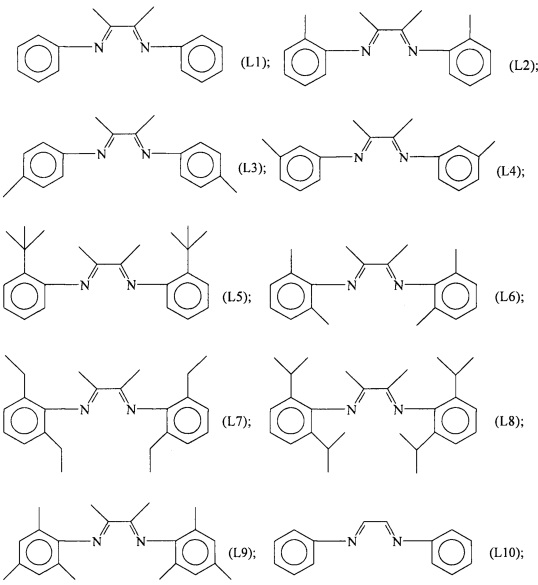
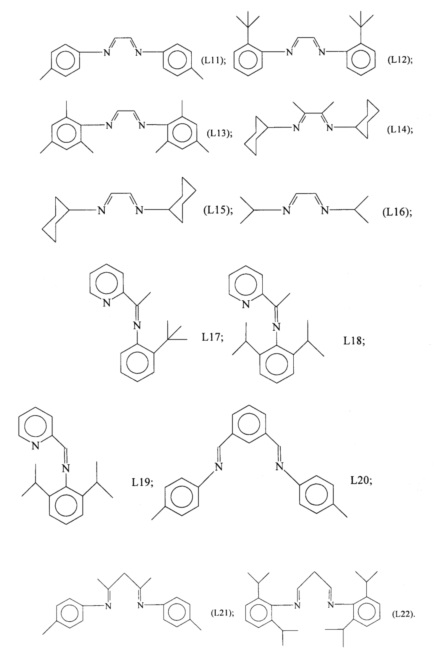
Лиганды, имеющие формулы (L1)-(L22), могут быть получены способами, известными в данной области техники. Лиганды, имеющие формулы (L1)-(L22), могут быть получены, например, следующими способами:
- в результате реакций конденсации между первичными аминами и α,β-дикетонами, которые рассмотрены, например: van der Poel Н. с соавт. в "Synthetic Communication" (1978), т. 8, стр. 305; Svoboda М. с соавт. в "Zeitschrift fuer Naturfoschung" (1981), Часть В, стр. 814-822; Dieck Н. с соавт. в "Zeitschrift fuer Naturfoschung" (1981), Часть В, стр. 823-832; Dieck Н. с соавт. в "Zeitschrift fuer Naturfoschung" (1975), Часть В, стр. 922-925;
- в результате реакций конденсации между первичными аминами и глиоксалями, которые рассмотрены, например: Kliegman J.М. с соавт. в "Tempahedron" (1970), т. 26, стр. 2555-2560; Kliegman J.М. с соавт. в "The Journal of Organic Chemistry" (1970), т. 35 (9), стр. 3140-3143; Barney V.С. с соавт. в "Journal of Chemical Society (1953), стр. 3610-3612; Horner L. с соавт. в "Chemische Berichte" (1957), т. 90, стр. 2184-2189; Carson J.F. с соавт. в "Journal of the American Chemical Society" (1953), т. 75, стр. 4337-4338;
- в результате реакций конденсации между первичными аминами и α-кетоальдегидами, которые рассмотрены, например: van der Poel Н. с соавт. в "Synthetic Communication" (1978), т. 8, стр. 305; Svoboda М. с соавт. в "Zeitschrift fuer Naturfoschung" (1981), Часть В, стр. 814-822; Dieck Н. с соавт. в "Zeitschrift fuer Naturfoschung" (1981), Часть В, стр. 823-832;
- в результате реакций конденсации между первичными аминами и β-дикетонами или β-диальдегидами, которые рассмотрены, например: Dove А.Р. с соавт. в "Dalton Transactions" (2004), вып. 4, стр. 570-578; Bourget-Merle L. с соавт. в "Chemical Reviews" (2002), т. 102, стр. 3031-3065; Budzelaar Р.Н. с соавт. в "European Journal of Inorganic Chemistry" (2000), вып. 4, стр. 753-769.
Бис-иминовый комплекс кобальта, имеющий общую формулу (I), может быть получен способами, известными в данной области техники. Бис-иминовый комплекс кобальта может быть получен, например, по реакции соединений кобальта, имеющих общую формулу Со(Х)2, где X - атом галогена, такого как, например, хлор, бром, йод, предпочтительно хлор, где названные соединения кобальта используют как таковые или в виде комплекса с простыми эфирами (например, простым диэтиловым эфиром, тетрагидрофураном (ТГФ), диметоксиэтаном), с лигандами, имеющими представленные выше формулы (L1)-(L22), при молярном отношении лиганд (L)/кобальт (Со), составляющем от 1 до 1,5, причем реакцию проводят при комнатной или более высокой температуре предпочтительно в присутствии по меньшей мере одного растворителя, который может быть выбран, например, из: хлорированных растворителей (например, метиленхлорида), растворителей из простых эфиров (например, тетрагидрофурана (ТГФ)), спиртовых растворителей (например, бутанола), углеводородных растворителей (например, толуола) или смесей перечисленных растворителей. Полученный таким образом бис-иминовый комплекс кобальта затем может быть извлечен способами, известными в данной области техники, например, осаждением нерастворителем (например, пентаном), с последующим отделением фильтрованием или декантацией и необязательным последующим растворением в подходящем растворителе и кристаллизацией при пониженной температуре.
В настоящем описании и прилагаемой формуле изобретения определение "комнатная температура" относится к температуре, составляющей от 20°С до 25°С.
Конкретные примеры производных алкилалюминия, имеющих общую формулу (II), особенно подходящих для осуществления настоящего изобретения, включают: триметилалюминий, три-(2,3,3-триметилбутил)алюминий, три-(2,3-диметилгексил)алюминий, три-(2,3-диметилбутил)алюминий, три-(2,3-диметилпентил)алюминий, три-(2,3-диметилгептил)алюминий, три-(2-метил-3-этилпентил)алюминий, три-(2-метил-3-этилгексил)алюминий, три-(2-метил-3-этилгептил)алюминий, три-(2-метил-3-пропилгексил)алюминий, триэтилалюминий, три-(2-этил-3-метилбутил)алюминий, три-(2-этил-3-метилпентил)алюминий, три-(2,3-диэтилпентил)алюминий, три-н-пропилалюминий, триизопропилалюминий, три-(2-пропил-3-метилбутил)алюминий, три-(2-изопропил-3-метилбутил)алюминий, три-н-бутилалюминий, триизобутилалюминий (англ. tri-isobutylaluninum, сокращенно TIBA), три-трет-бутилалюминий, три-(2-изобутил-3-метилпентил)алюминий, три-(2,3,3-триметилпентил)алюминий, три-(2,3,3-триметилгексил)алюминий, три-(2-этил-3,3-диметилбутил)алюминий, три-(2-этил-3,3-диметилпентил)алюминий, три-(2-изопропил-3,3-диметилбутил)алюминий, три-(2-триметилсилилпропил)алюминий, три-(2-метил-3-фенилбутил)алюминий, три-(2-этил-3-фенилбутил)алюминий, три-(2,3-диметил-3-фенилбутил)алюминий, три-(2-фенилпропил)алюминий, три-[2-(4-фторфенил)-пропил]-алюминий, три-[2-(4-хлорфенил)-пропил]-алюминий, три-[2-(3-изопропилфенил-три-(2-фенилбутил)]-алюминий, три-(3-метил-2-фенилбутил)алюминий, три-(2-фенилпентил)алюминий, три-[2-(пентафторфенил)-пропил]-алюминий, три-(2,2-дифенилэтил)алюминий, три-(2-фенилметилпропил)алюминий, трипентилалюминий, тригексилалюминий, трициклогексилалюминий, триоктилалюминий, гидрид диэтилалюминия, гидрид ди-н-пропилалюминия, гидрид ди-н-бутилалюминия, гидрид диизобутилалюминия (англ. diisobutylaluminum hydride, сокращенно DIBAH), гидрид дигексилалюминия, гидрид диизогексилалюминия, гидрид диоктилалюминия, гидрид диизооктилалюминия, дигидрид этилалюминия, дигидрид н-пропилалюминия, дигидрида изобутилалюминия, хлорид диэтилалюминия (англ. diethylaluminum chloride, сокращенно DEAC), дихлорид моноэтилалюминия (англ. monoethylaluminum dichloride, сокращенно EADC), хлорид диметилалюминия, хлорид диизобутилалюминия, дихлорид изобутилалюминия, сесквихлорид этилалюминия (англ. ethylaluminum sesquichloride, сокращенно EASC), а также соответствующие соединения, в которых один из углеводородных заместителей замещен атомом водорода, и соединения, в которых один или два углеводородных заместителя замещены изобутильной группой. Особенно предпочтительными являются хлорид диэтилалюминия (DEAC), дихлорид моноэтилалюминия (EADC) и сесквихлорид этилалюминия (EASC).
При использовании производных алкилалюминия, имеющих общую формулу (II), для получения системы каталитической сополимеризации согласно настоящему изобретению, их предпочтительно вводят в контакт с бис-иминовым комплексом кобальта, имеющим общую формулу (I), в таких пропорциях, чтобы молярное отношение количества кобальта, находящегося в бис-иминовом комплексе кобальта, имеющем общую формулу (I), к количеству алюминия, находящегося в алкилалюминии, имеющем общую формулу (II), могло составлять от 5 до 5000, предпочтительно от 10 до 1000. Последовательность ввода в контакт бис-иминового комплекса кобальта, имеющего общую формулу (I), с алкилалюминием, имеющим общую формулу (II), не особенно критична.
Дополнительные данные, относящиеся к производным алкилалюминия, имеющим общую формулу (II), имеются в международной патентной заявке WO 2011/061151.
Согласно особенно предпочтительному примеру осуществления, органические кислородсодержащие соединения (b2) могут быть выбраны из алюмоксанов, имеющих общую формулу (III):
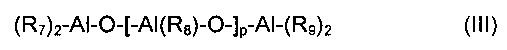
где R7, R8 и R9 одинаковы или различны и представляют собой атомы водорода, атомы галогена, например, хлора, брома, йода, фтора; или они выбраны из неразветвленных или разветвленных С1-С20 алкильных групп, циклоалкильных групп, арильных групп, и эти группы необязательно замещены одним или более атомами кремния или германия; и p представляет собой целое число, составляющее от 0 до 1000.
Как известно, алюмоксаны представляют собой соединения, содержащие связи AI-O-AI, имеющие различные отношения О/AI, которые могут быть получены способами, известными в данной области техники, например, в результате проводимой в регулируемых условиях реакции алкилалюминия или галогенида алкилалюминия с водой или другими соединениями, содержащими определенные количества доступной воды, например, как в случае реакции триметилалюминия с гексагидратом сульфата алюминия, пентагидратом сульфата меди или пентагидратом сульфата железа.
Рассматриваемые алюмоксаны и, в частности, метилалюмоксан (англ. methyl aluminoxane, сокращенно МАО), представляют собой соединения, которые могут быть получены известными в области металлорганической химии способами, например, добавлением триметилалюминия в суспензию гидрата сульфата алюминия в гексане.
При использовании алюмоксанов, имеющих общую формулу (III), для получения системы каталитической сополимеризации согласно настоящему изобретению, их предпочтительно вводят в контакт с бис-иминовым комплексом кобальта, имеющим общую формулу (I), в таких пропорциях, чтобы молярное отношение количества алюминия (Al), находящегося в алюмоксане, имеющем общую формулу (III), к количеству кобальта, находящегося в бис-иминовом комплексе кобальта, имеющем общую формулу (I), могло составлять от 10 до 10000, предпочтительно от 100 до 5000. Последовательность ввода в контакт бис-иминового комплекса кобальта, имеющего общую формулу (I), с алюмоксаном, имеющим общую формулу (III), не особенно критична.
Кроме перечисленных выше предпочтительных алюмоксанов, имеющих общую формулу (III), определение соединения (b2) согласно настоящему изобретению также может включать галлоксаны (англ. galloxane), в которых в общей формуле (III) вместо алюминия находится галлий, и станноксаны (англ. stannoxane), в которых в общей формуле (III) вместо алюминия находится олово, которые, как известно, применяются в качестве сокатализаторов в полимеризации олефинов в присутствии металлоценовых комплексов. Дополнительные данные, относящиеся к галлоксанам и станноксанам, имеются, например, в американских патентах US 5128295 и US 5258475.
Конкретные примеры алюмоксанов, имеющих общую формулу (III), которые особенно подходят для осуществления настоящего изобретения, включают: метилалюмоксан (МАО), этилалюмоксан, н-бутилалюмоксан, тетраизобутилалюмоксан (англ. tetra-i-butylaluminoxane, сокращенно TIBAO), трет-бутилалюмоксан, тетра-(2,4,4-триметилпентил)-алюмоксан (англ. tetra-(2,4,4-trimethylpentyl)-aluminoxane, сокращенно TIOAO), тетра-(2,3-диметилбутил)-алюмоксан (англ. tetra-(2,3-dimethylbutyl)-aluminoxane, сокращенно TDMBAO), тетра-(2,3,3-триметилбутил)-алюмоксан (англ. tetra-(2,3,3-trimethylbutyl)-aluminoxane, сокращенно ТТМВАО). Особенно предпочтительным является метилалюмоксан (МАО).
Дополнительные данные, относящиеся к алюмоксанам, имеющим общую формулу (III), имеются в международной патентной заявке WO 2011/061151.
Согласно одному из предпочтительных примеров осуществления настоящего изобретения, соединения или смеси соединений (b3) могут быть выбраны из органических соединений алюминия и, в частности, органических соединений бора, например, представленных следующими общими формулами:
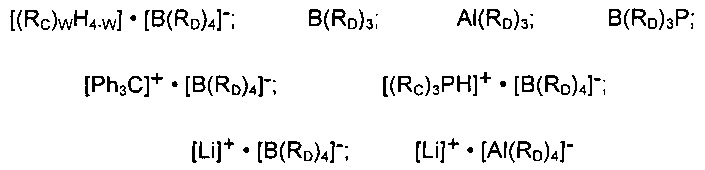
в которых w представляет собой целое число, составляющее от 0 до 3; каждая из групп RC независимо означает алкильную группу или арильную группу, содержащую от 1 до 10 атомов углерода; каждая из групп RD независимо означает частично или полностью, предпочтительно полностью, фторированную арильную группу, содержащую от 6 до 20 атомов углерода; и Р означает необязательно замещенный пиррольный радикал.
При использовании соединений или смесей соединений (b3) для получения системы каталитической сополимеризации согласно настоящему изобретению, их предпочтительно вводят в контакт с бис-иминовым комплексом кобальта, имеющим общую формулу (I), в таких пропорциях, чтобы молярное отношение количества металла (М'), находящегося в соединениях или смесях соединений (b3), к количеству кобальта, находящегося в бис-иминовом комплексе кобальта, имеющем общую формулу (I), составляло от 0,1 до 15, предпочтительно от 0,5 до 10, более предпочтительно от 1 до 6. Последовательность ввода в контакт бис-иминового комплекса кобальта, имеющего общую формулу (I), с соединением или смесью соединений (b3), не особенно критична.
Названные соединения или смеси соединений (b3), в частности, если Х1 и Х2 в бис-иминовом комплексе кобальта, имеющем общую формулу (I), не являются алкилами, должны быть использованы в комбинации с алюмоксаном, имеющим общую формулу (III), например, метилалюмоксаном (МАО) или, предпочтительно, с алкилалюминием, имеющим общую формулу (II), более предпочтительно с триалкилалюминием, содержащим от 1 до 8 атомов углерода в каждом алкильном остатке, например, триметилалюминием, триэтилалюминием, триизобутилалюминием (TIBA).
Примеры способов, обычно применяемых для получения системы каталитической сополимеризации согласно настоящему изобретению, если они включают применение соединений или смесей соединений (b3), качественно охарактеризованы ниже в виде перечня, который, тем не менее, никоим образом не ограничивает объем настоящего изобретения:
(m1) приведение бис-иминового комплекса кобальта, имеющего общую формулу (I), в котором по меньшей мере один из X1 и Х2 представляет собой алкильную группу, в контакт с по меньшей мере одним соединением или смесью соединений (b3), катион которых может реагировать с алкильной группой, образуя нейтральное соединение, и которые имеют объемный анион, не образующий координационных связей и способный делокализовывать отрицательный заряд;
(m2) реакция бис-иминового комплекса кобальта, имеющего общую формулу (I), с по меньшей мере одним алкилалюминием, имеющим общую формулу (II), предпочтительно триалкилалюминием, взятым в молярном избытке, составляющем от 10/1 до 300/1, с последующим введением в реакцию с сильной кислотой Льюиса, например, трис(пентафторфенил)бором [соединение (b3)], в почти стехиометрическом количестве или в небольшом избытке по отношению к кобальту (Со);
(m3) приведение в контакт и реакция бис-иминового комплекса кобальта, имеющего общую формулу (I), с молярным избытком, составляющим от 10/1 до 1000/1, предпочтительно от 100/1 до 500/1, по меньшей мере одного триалкилалюминия или галогенида алкилалюминия, имеющего формулу AIR'''mZ3-m где R''' представляет собой неразветвленную или разветвленную С1-С8 алкильную группу или их комбинацию, Z представляет собой галоген, предпочтительно хлор или бром, и m равен десятичному числу, составляющему от 1 до 3; после чего к полученной таким образом композиции добавляют по меньшей мере одно соединение или смесь соединений (b3) в таком количестве, чтобы отношение между количеством соединения или смеси соединений (b3) или алюминия в соединении или смеси соединений (b3) и количеством кобальта в бис-иминовом комплексе кобальта, имеющем общую формулу (I), составляло от 0,1 до 15, предпочтительно от 1 до 6.
Примеры соединений или смесей соединений (b3), из которых по реакции с бис-иминовым комплексом кобальта, имеющим общую формулу (I), согласно настоящему изобретению может быть получена ионная каталитическая система, рассмотрены, наряду со ссылками на образование ионных металлоценовых комплексов, в следующих публикациях, содержания которых включены в настоящее описание посредством ссылки:
- W. Beck с соавт., "Chemical Reviews" (1988), т. 88, стр. 1405-1421;
- S.Н. Stares, "Chemical Reviews" (1993), т. 93, стр. 927-942;
- Европейские патентные заявки ЕР 277003, ЕР 495375, ЕР 520732, ЕР 427697, ЕР 421659 и ЕР 418044;
- Опубликованные международные патентные заявки WO 92/00333 и WO 92/05208.
Конкретные примеры соединения или смеси соединений (b3), особенно подходящих для осуществления настоящего изобретения, включают: тетракис-пентафторфенилборат трибутиламмония, тетракис-пентафторфенилалюминат трибутиламмония, тетракис-[(3,5-ди-(трифторфенил)]борат трибутиламмония, тетракис-4-фторфенилборат трибутиламмония, тетракис-пентафторфенилборат N,N-диметилбензиламмония, тетракис-пентафторфенилборат N,N-диметилгексиламмония, тетракис-пентафторфенилборат N,N-диметиланилиния, тетракис-пентафторфенилалюминат N,N-диметиланилиния, тетракис-пентафторфенилборат дипропиламмония, тетракис-пентафторфенилборат дициклогексиламмония, тетракис-пентафторфенилборат трифенилкарбения, тетракис-пентафторфенилалюминат трифенилкарбения, трис(пентафторфенил)бор, трис(пентафторфенил)алюминий или смеси перечисленных соединений. Предпочтительными являются тетракис-пентафторфенилбораты.
В настоящем описании и прилагаемой формуле изобретения термины "моль" и "молярное отношение" относятся к соединениям, состоящим из молекул, а также к атомам и ионам, что для последних позволяет не использовать термины грамм-атом или атомное отношение, даже если по существу они более корректны.
Для соответствия рассмотренной выше каталитической системе конкретным практическим требованиям, к ней необязательно могут быть добавлены другие добавки или компоненты. Полученные таким образом каталитические системы также включены в объем настоящего изобретения. Добавки и/или компоненты, которые могут быть добавлены в процессе получения и/или приготовления рассмотренной выше каталитической системы, включают, например: инертные растворители, например, алифатические и/или ароматические углеводороды; алифатические и/или ароматические простые эфиры; добавки со слабыми координационными связями (например, основания Льюиса), выбранные, например, из неполимеризуемых олефинов; стерически затрудненные или электронно-обедненные простые эфиры; галогенирующие агенты, например, галогениды кремния, галогенированные, предпочтительно хлорированные, углеводороды; или смеси перечисленных веществ.
Как уже было отмечено выше, каталитическая система может быть получена способами, известными в данной области техники.
Например, каталитическая система согласно изобретению может быть получена отдельно (приготовлена предварительно) и затем введена в среду сополимеризации. В этом случае каталитическая система может быть получена по реакции по меньшей мере одного бис-иминового комплекса кобальта, имеющего общую формулу (I), с по меньшей мере одним сокатализатором (b), необязательно в присутствии других добавок или компонентов, выбранных из перечисленных выше, в присутствии растворителя, например, толуола, гептана, при температуре, составляющей от 20°С до 60°С, в течение времени, составляющего от 10 секунд до 10 часов, предпочтительно от 30 секунд до 5 часов. Дополнительные данные по получению каталитической системы имеются в приведенных ниже Примерах.
В альтернативном варианте каталитическая система может быть получена in situ, т.е. непосредственно в среде сополимеризации. В этом случае система может быть получена введением по отдельности бис-иминового комплекса кобальта, имеющего общую формулу (I), сокатализатора (b) и заранее выбранного подвергаемого сополимеризации сопряженного диена (диенов) в условиях проведения сополимеризации.
Для удобства осуществления способа согласно настоящему изобретению каталитическая система также может быть нанесена на инертный твердый носитель (подложку), предпочтительно состоящий из оксидов кремния и/или алюминия, например, на оксид кремния, оксид алюминия или алюмосиликаты. Известные методики нанесения на носитель, которые могут быть применены для нанесения на носитель каталитических систем, обычно включают осуществляемый в подходящей инертной жидкостной среде контакт между носителем, необязательно активированным нагреванием до температур, превышающих 200°С, и одним или обоими компонентами каталитической системы согласно настоящему изобретению, т.е. бис-иминовым комплексом кобальта, имеющим общую формулу (I), и сокатализатором (b). Для осуществления настоящего изобретения необязательно, чтобы на носитель были нанесены оба компонента, поскольку на поверхности носителя может находиться только бис-иминовый комплекс кобальта, имеющий общую формулу (I), или только сокатализатор (b). В последнем случае компонент, отсутствующий на поверхности, затем вводят в контакт с компонентом на носителе в подходящий момент, получая рабочий катализатор полимеризации.
Бис-иминовый комплекс кобальта, имеющий общую формулу (I), и каталитические системы на его основе, которые были нанесены на твердый носитель посредством функционализации последнего и образования ковалентной связи между твердым носителем и бис-иминовым комплексом кобальта, имеющим общую формулу (I), также включены в объем настоящего изобретения.
Количество бис-иминового комплекса кобальта, имеющего общую формулу (I), и сокатализатора (b), которое может быть применено в способе согласно настоящему изобретению, зависит от применяемого способа сополимеризации. В любом случае это количество должно быть достаточным для достижения такого молярного отношения количества кобальта, находящегося в бис-иминовом комплексе кобальта, имеющем общую формулу (I), к количеству металла, находящегося в сокатализаторе (b), например, алюминия, если сокатализатор (b) выбран из алкилалюминия (b1) или алюмоксанов (b2), бора, если сокатализатор (b) выбран из соединений или смесей соединений (b3), имеющих общую формулу (III), которое находится в пределах диапазонов, указанных выше.
Согласно одному из предпочтительных примеров осуществления настоящего изобретения способ может быть осуществлен в присутствии инертного органического растворителя, выбранного, например, из: насыщенных алифатических углеводородов, например, бутана, пентана, гексана, гептана или смесей перечисленных соединений; насыщенных циклоалифатических углеводородов, например, циклопентана, циклогексана или их смесей; моноолефинов, например, 1-бутена, 2-бутена или их смесей; ароматических углеводородов, например, бензола, толуола, ксилола или смесей перечисленных соединений; галогенированных углеводородов, например, метиленхлорида, хлороформа, четыреххлористого углерода, трихлорэтилена, перхлорэтилена, 1,2-дихлорэтана, хлорбензола, бромбензола, хлортолуола или смесей перечисленных соединений. Предпочтительно растворитель выбран из насыщенных алифатических углеводородов.
В альтернативном варианте способ может быть осуществлен с использованием в качестве растворителя того же сопряженного диена (диенов), который подвергают сополимеризации, согласно методике, известной как "полимеризация в массе".
Согласно одному из предпочтительных примеров осуществления настоящего изобретения, концентрация подвергаемого сополимеризации сопряженного диена в инертном органическом растворителе составляет от 5% масс. до 50% масс., предпочтительно от 10% масс. до 20% масс., в пересчете на общую массу смеси сопряженного диена и инертного органического растворителя.
Согласно одному из предпочтительных примеров осуществления настоящего изобретения, способ может быть осуществлен при температуре, составляющей от -70°С до +100°С, предпочтительно от -20°С до +80°С.
Что касается давления, то способ предпочтительно осуществлять при давлении компонентов сополимеризуемой смеси.
Способ может быть осуществлен как в непрерывном, так и в периодическом режиме.
Как указано выше, способ позволяет получать сополимеры сопряженных диенов, например, полибутадиена, полиизопрена, в частности, неразветвленный или разветвленный полибутадиен с высоким содержанием 1,4-цис-звеньев, т.е. содержанием 1,4-цис-звеньев составляющим ≥98%.
Для лучшего понимания настоящего изобретения и в качестве примеров его осуществления на практике ниже приведены некоторые иллюстративные и неограничивающие примеры.
ОПИСАНИЕ ПРИМЕРОВ ОСУЩЕСТВЛЕНИЯ ИЗОБРЕТЕНИЯ
Материалы и реактивы
Материалы и реактивы, применяемые в приведенных ниже примерах осуществления изобретения, перечислены в нижеследующем списке, в котором также указан тип необязательной предварительной обработки и поставщик:
- дихлорид кобальта (CoCl2) (Stream Chemicals); используется без очистки (в том виде, в котором он был получен);
- тетрагидрофуран (ТГФ) (Carlo Erba, RPE): кипятили в присутствии калия/бензофенона и затем перегоняли в атмосфере азота;
- муравьиная кислота (85%) (Carlo Erba, RPE): используется без очистки;
- 2,3-бутандион (Aldrich): используется без очистки;
- 2-трет-бутиланилин (Aldrich): используется без очистки;
- 2,6-диэтиланилин (Aldrich): используется без очистки;
- 2,4,6-триметиланилин (Aldrich): используется без очистки;
- 2,6-диизопропиланилин (Aldrich): используется без очистки;
- пара-толуидин (Aldrich): используется без очистки;
- бензол-1,3-карбоксальдегид (Aldrich): используется без очистки;
- ацетилпиридин (Aldrich): используется без очистки;
- глиоксаль (водный раствор концентрацией 40%) (Aldrich): используется без очистки;
- толуол (Aldrich): чистота ≥99,5%, перегоняли над натрием (Na) в инертной атмосфере;
- пентан (Aldrich): чистота ≥99,5%, перегоняли над натрием (Na) в инертной атмосфере;
- метилалюмоксан (МАО) (раствор в толуоле концентрацией 10% масс.) (Aldrich): используется без очистки;
- ацетилацетон (Aldrich): используется без очистки;
- 1,3-бутадиен (Air Liquide): чистота ≥99,5%, испаряли из контейнера перед каждым получением, сушили пропусканием через колонку с насадкой из молекулярных сит и конденсировали внутри реактора, заранее охлажденного до -20°С;
- соляная кислота в виде водного раствора концентрацией 37% (Aldrich): используется без очистки;
- пара-толуолсульфоновая кислота (Aldrich): используется без очистки;
- декагидрат карбоната натрия (Na2CO3⋅10H2O) (Aldrich): используется без очистки;
- сульфат магния (MgSO4) (Aldrich): используется без очистки;
- метанол (Carlo Erba, RPE): используется без очистки;
- этанол (Carlo Erba, RPE): используют без очистки или необязательно обезвоживают перегонкой над магнием (Mg);
- дихлорметан (Carlo Erba, RPE): используется без очистки;
- дейтерированный тетрахлорэтилен (C2D2Cl4) (Acros): используется без очистки;
- дейтерированный хлороформ (CDCl3) (Acros): используется без очистки.
Для анализов и получения характеристик применяли способы, рассмотренные ниже.
Элементный анализ
а) Определение Со
Для определения массового количества кобальта (Со) в бис-иминовых комплексах кобальта, используемых для осуществления настоящего изобретения, точно взвешенную в сухом боксе в токе азота аликвоту, приблизительно составляющую от 30 мг до 50 мг образца, помещали в платиновый тигель емкостью приблизительно 30 мл вместе со смесью, состоящей из 1 мл плавиковой кислоты (HF) концентрацией 40%, 0,25 мл серной кислоты (H2SO4) концентрацией 96% и 1 мл азотной кислоты (HNO3) концентрацией 70%. Затем тигель нагревали на плитке, повышая температуру до появления белых паров серной кислоты (приблизительно 200°С). Полученную таким образом смесь охлаждали до комнатной температуры (20°С - 25°С), добавляли 1 мл 70%-ной азотной кислоты (HNO3), и затем смесь нагревали до повторного появления паров. Последовательность повторяли еще два раза, получая прозрачный практически бесцветный раствор. Затем без нагревания добавляли 1 мл азотной кислоты (HNO3) и приблизительно 15 мл воды, и смесь затем нагревали до 80°С в течение приблизительно 30 минут. Полученный таким образом образец разбавляли водой чистоты MilliО до массы, составляющей приблизительно 50 г, точно взвешивали, получая раствор, который анализировали с помощью спектрометра ICP-OES (плазменное оптическое обнаружение) Thermo Optek IRIS Advantage Duo сравнением с растворами известных концентраций. Для этого для каждого анализируемого вещества строили калибровочную кривую в диапазоне от 0 частей на миллион до 10 частей на миллион, проводя измерения в растворах, имеющих известный титр, полученных массовым разбавлением растворов точно известной концентрации.
Перед проведением спектрофотометрического анализа растворы образцов, полученные, как описано выше, снова разбавляли, получая концентрации, близкие к эталонным. Для каждой концентрации готовили по два образца. Результаты считались приемлемыми, если результат одного из образцов не отличался более чем на 2% от среднего значения.
b) Определение хлора
Для этого образцы бис-иминовых комплексов кобальта, используемых для осуществления настоящего изобретения, массой приблизительно от 30 мг до 50 мг точно взвешивали в стаканах емкостью 100 мл в сухом боксе в токе азота. Вне сухого бокса добавляли 2 г карбоната натрия (Na2CO3) и 50 мл воды MilliQ. Смесь доводили до температуры кипения на плитке при перемешивании магнитной мешалкой в течение приблизительно 30 минут. Смесь оставляли охлаждаться, добавляли разбавленную 1/5 серную кислоту (H2SO4) до достижения кислой реакции, и смесь титровали 0,1н нитратом серебра (AgNO3) с помощью потенциометрического титрующего устройства.
с) Определение углерода, водорода и азота
Определение углерода, водорода и азота в бис-иминовых комплексах кобальта, используемых для осуществления настоящего изобретения, а также в лигандах, используемых для осуществления настоящего изобретения, проводили с помощью автоматического анализатора Carlo Erba, модель 1106.
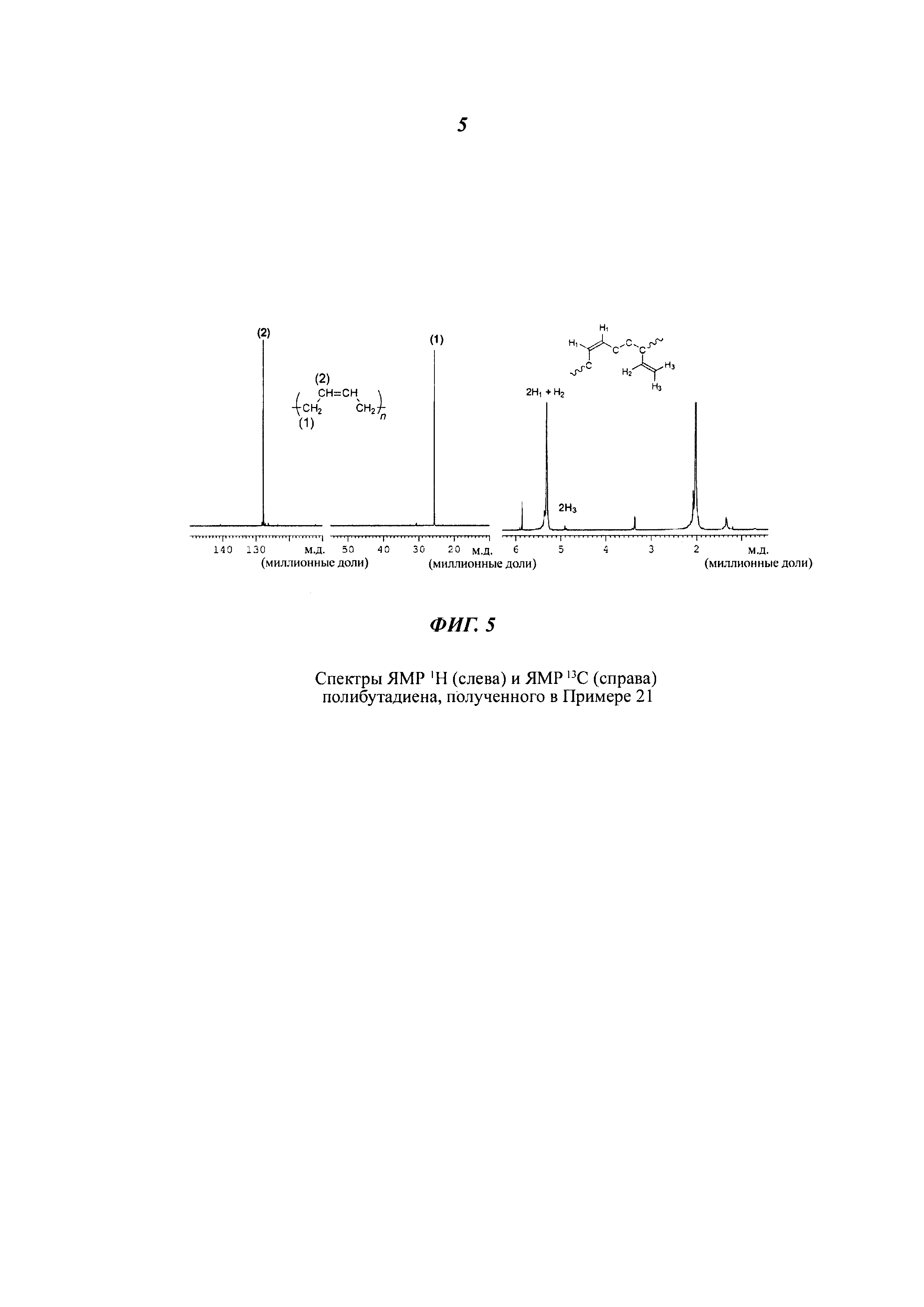
Спектры ЯМР13С и ЯМР1Н
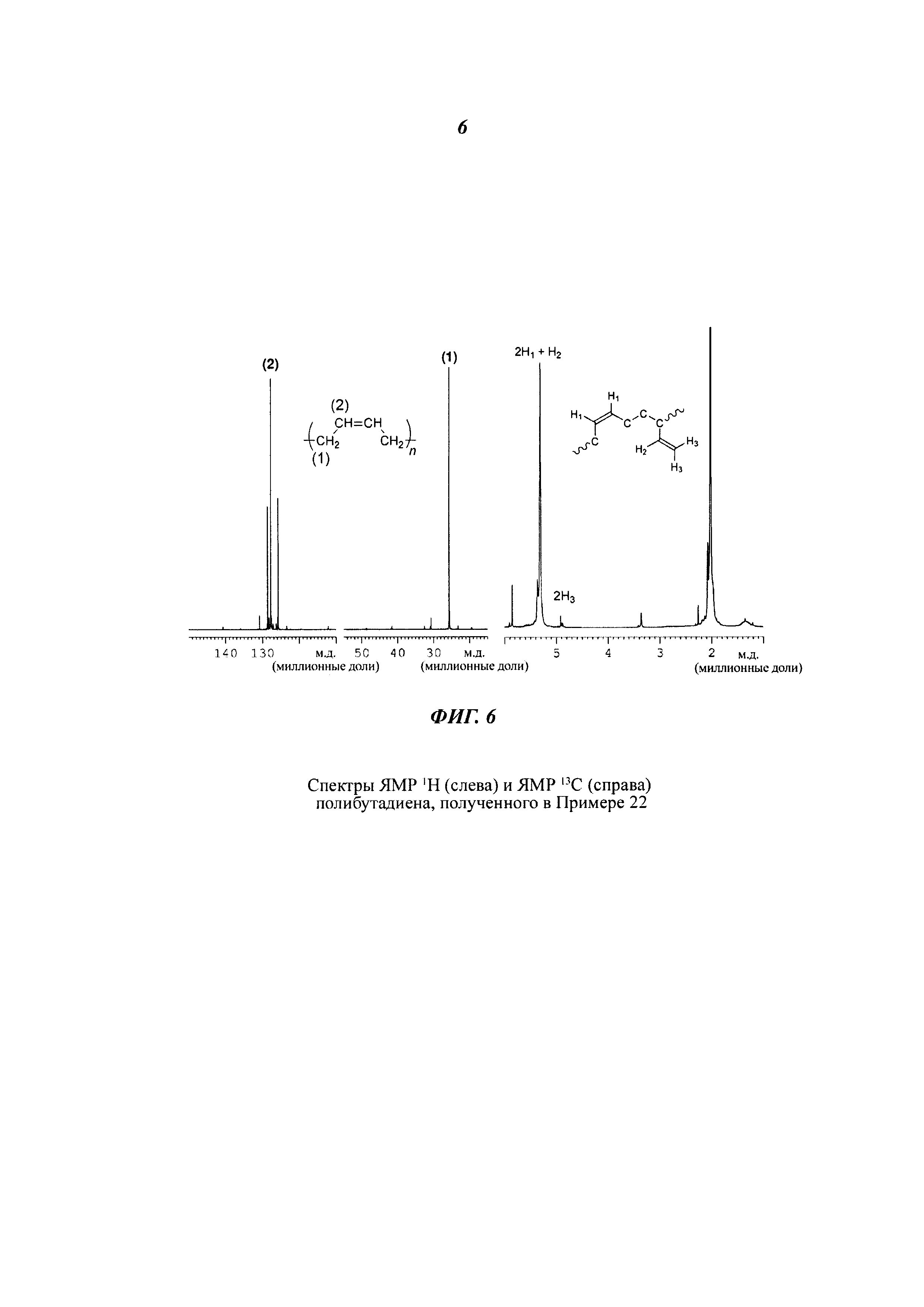
Спектры ЯМР13С и ЯМР1Н регистрировали с помощью ЯМР-спектрометра Bruker Avance 400, применяя в качестве внутренних стандартов дейтерированный тетрахлорэтилен (C2D2Cl4) при 103°С и гексаметилдисилоксан (англ. hexamethyldisilixane, сокращенно HDMS), или дейтерированный хлороформ (CDCl3) при 25°С и тетраметилсилан (англ. tetramethylsilane, сокращенно TMS). Для измерений использовали растворы полимера концентрацией 10% масс. в пересчете на общую массу раствора полимера.
Микроструктуру полимеров (т.е. содержание 1,4-цис-звеньев (%)) определяли, анализируя спектры, полученные как описано выше, на основании литературных данных, приведенных Mochel, V.D. в публикации "Journal of Polymer Science PartA-1: Polymer Chemistry" (1972), т. 10, вып. 4, стр. 1009-1018.
ИК спектры
ИК спектры (ИК спектроскопия с Фурье-преобразованием; англ. Fourier transform infrared spectroscopy, сокращенно FT-IR) регистрировали с помощью спектрофотометров Thermo Nicolet Nexus 670 и Bruker IFS 48.
ИК спектры (FT-IR) лигандов, применяемых для осуществления настоящего изобретения, были получены диспергированием анализируемого лиганда в безводном бромиде калия (KBr) (диски KBr) или в суспензии нуйола (нефтяного масла глубокой очистки).
ИК спектры (FT-IR) бис-иминовых комплексов кобальта, применяемых для осуществления настоящего изобретения, были получены диспергированием анализируемого бис-иминового комплекса кобальта в безводном бромиде калия (KBr) (диски KBr) или в суспензии нуйола.
ИК спектры (FT-IR) полимеров были получены анализом полимерных пленок на таблетках бромида калия (KBr); пленки были получены осаждением раствора анализируемого полимера в горячем орто-дихлорбензоле. Концентрации анализируемых растворов полимеров составляли 10% масс, в пересчете на общую массу раствора полимера.
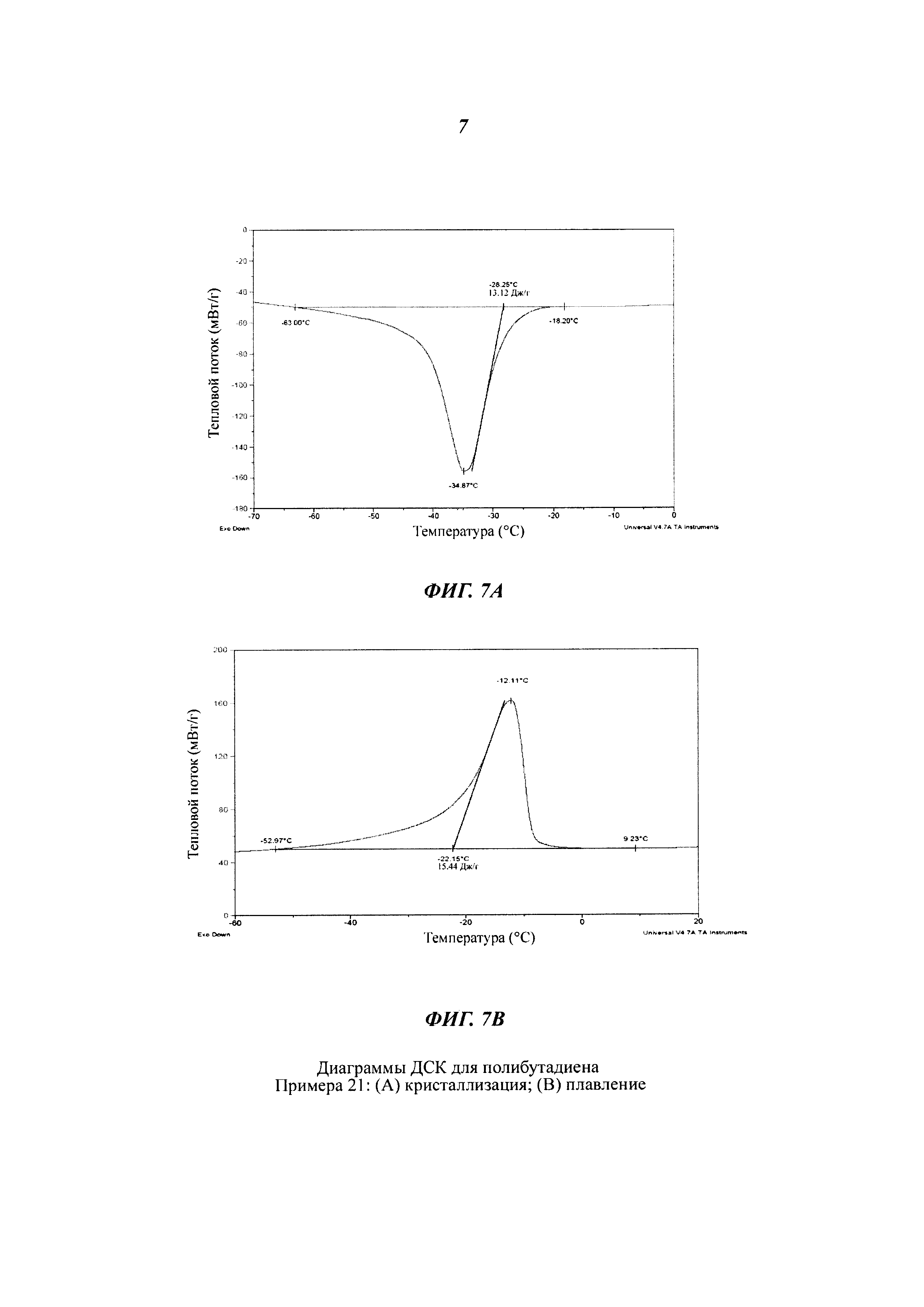
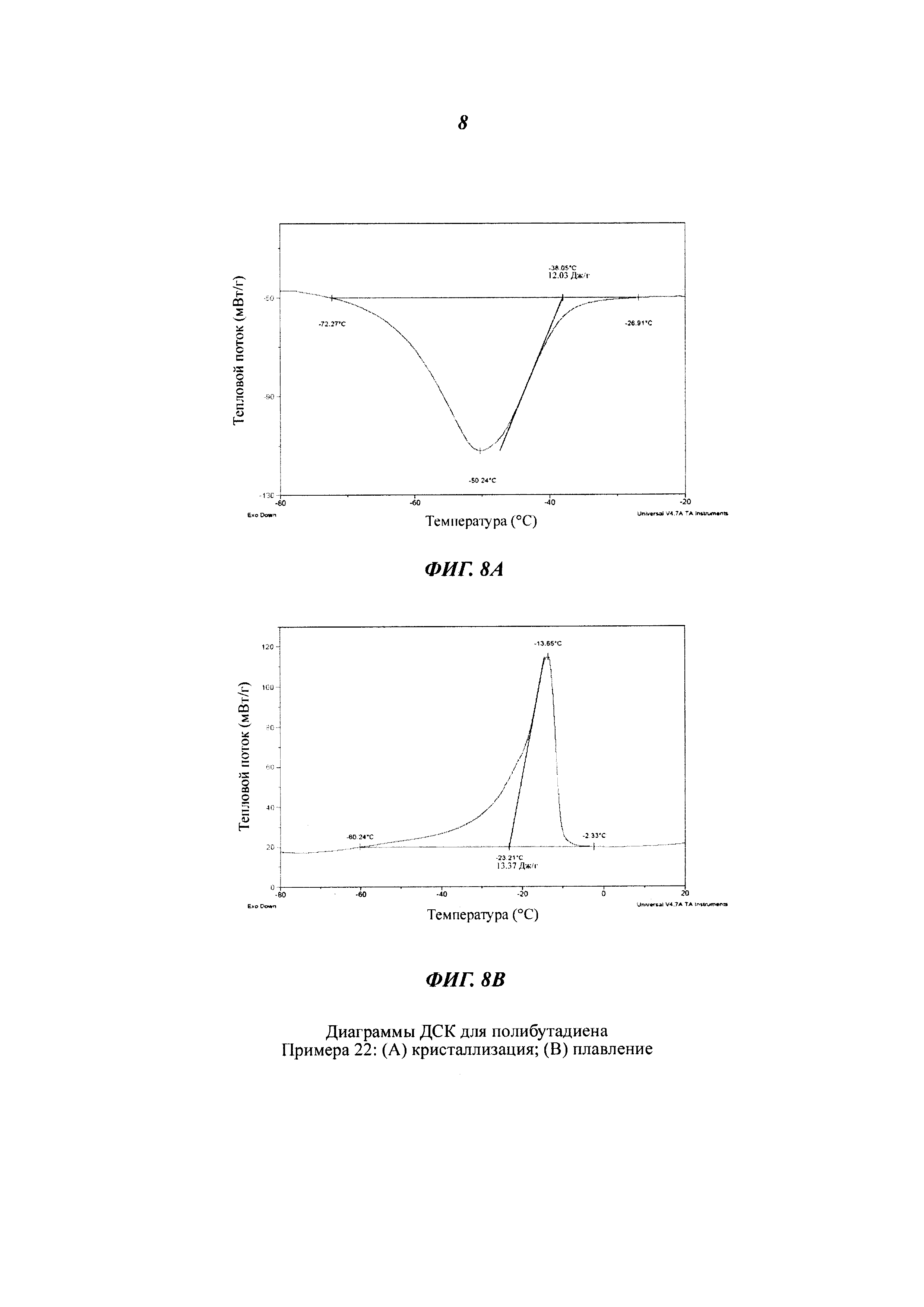
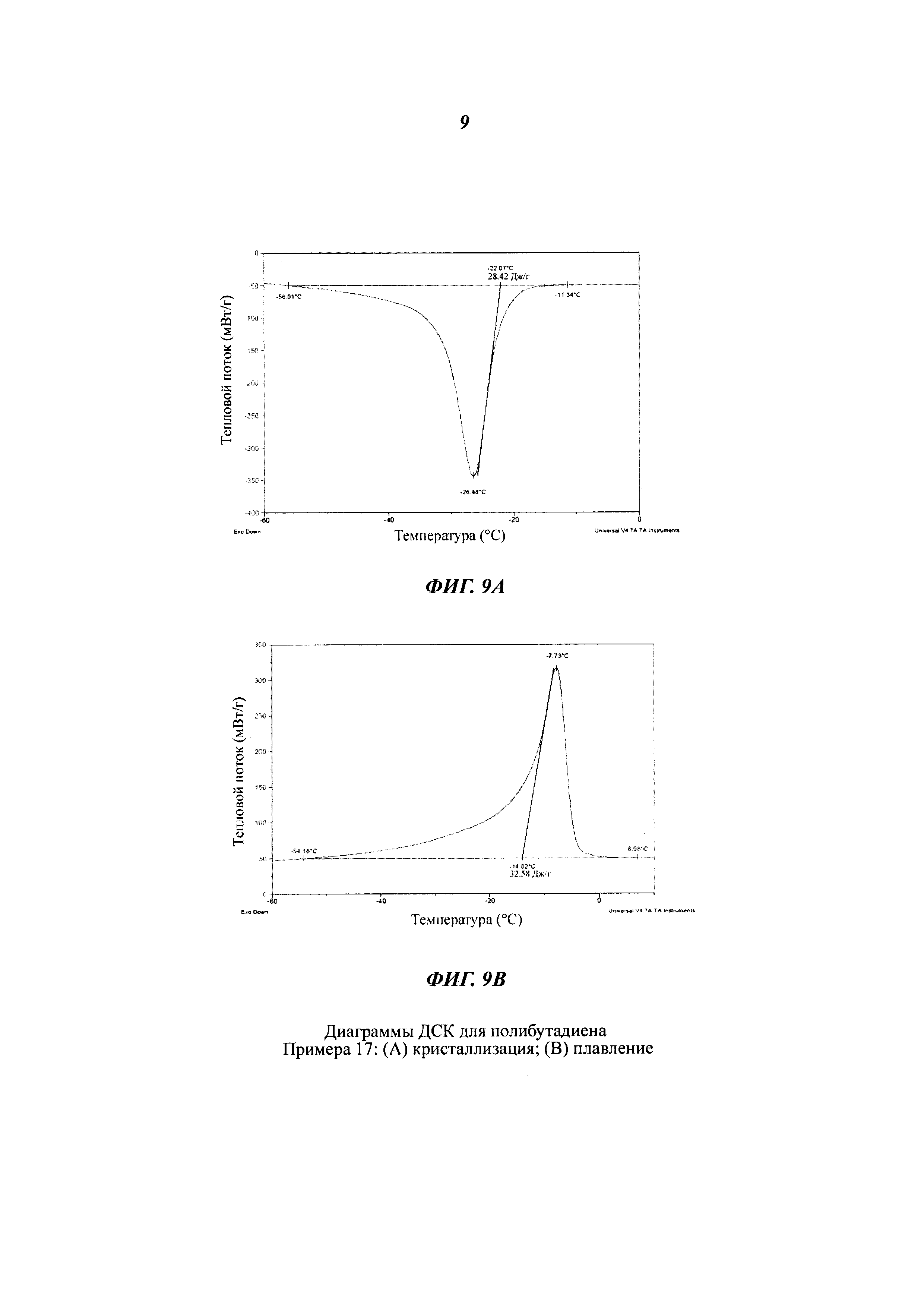
Термический анализ (ДСК)
Термический анализ посредством ДСК ("Дифференциальной Сканирующей Калориметрии") с целью определения температуры плавления (Tm) и температуры кристаллизации (Тс) полученных полимеров проводили с помощью дифференциального сканирующего калориметра Perkin Elmer Pyris. Для этого анализировали 5 мг полимера со скоростью сканирования, составляющей от 1°С/мин до 20°С/мин, в инертной атмосфере азота.
Термический анализ посредством ДСК ("Дифференциальной Сканирующей Калориметрии") с целью определения температуры стеклования (Тg) полученных полимеров проводили с помощью упомянутого выше калориметра, используя следующую температурную программу: выдержка при постоянной температуре в течение 3 минут при +70°С; охлаждение от +70°С до -90°С со скоростью 10°С/мин; выдержка при постоянной температуре в течение 3 минут при -90°С; нагревание от -90°С до +70°С со скоростью 10°С/мин.
Определение молекулярной массы
Молекулярную массу (MW) полученных полимеров определяли способом гель-проникающей хроматографии (англ. Gel Permeation Chromatography, сокращенно GPC) в следующих условиях:
- насос Agilent 1100;
- датчик ИК Agilent 1100;
- колонки PL Mixed А;
- растворитель/элюент: тетрагидрофуран (ТГФ);
- скорость течения: 1 мл/мин;
- температура: 25°С;
- вычисление молекулярной массы: способ Универсальной калибровки (англ. Universal Calibration).
Определяли среднемассовую молекулярную массу (Mw) и "показатель полидисперсности" (англ. polydispersion index, сокращенно PDI), который равен отношению Mw/Mn (где Мn = среднечисловая молекулярная масса).
Определение ветвления
Степень ветвления полученных полимеров определяли способом GPC/MALLS, который включал применение комбинации датчика многоракурсного рассеяния света (англ. multi-angle light scattering, сокращенно MALLS) и традиционного SEC/RI элюирования в следующих условиях:
- насос Agilent 1050;
- датчик ИК Agilent 1050;
- технология с применением датчика MALLS Dawn-DSP Wyatt, λ = 632,8 нм;
- колонки PL GEL Mixed-A (х4);
- растворитель/элюент: тетрагидрофуран (ТГФ);
- скорость течения: 1 мл/мин;
- температура: 25°С.
В рассмотренных выше условиях могут быть одновременно проведены абсолютные измерения молекулярной массы и радиуса вращения макромолекул, разделенных с помощью хроматографической системы: действительно, количество света, рассеянного макромолекулярной частицей в раствор, может быть непосредственно использовано для определения ее молекулярной массы, в то время как угловое отклонение рассеяния непосредственно связано с ее средними размерами. Соответствующий фундаментальный закон описывается следующим уравнением (1):
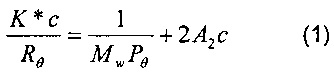
где:
- K* - оптическая постоянная, которая зависит от длины волны используемого света, показателя преломления (dn/dc) полимера и типа применяемого растворителя;
- Mw - среднемассовая молекулярная масса;
- с - концентрация раствора полимера;
- Rθ - интенсивность рассеянного света, измеренная при величине угла θ (избыточный коэффициент Релея);
- Рθ представляет собой функцию, описывающую зависимость рассеянного света от угла падения, которая равна 1 для угла θ, равного 0;
- А2 - второй вириальный коэффициент.
Для очень низких концентраций (типичных для GPC систем) приведенное выше уравнение (1) может быть упрощено до следующего уравнения (2):
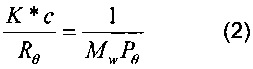
в котором K*, c, Rθ, Mw и Рθ имеют значения, указанные выше; проведение измерений при нескольких значениях угла позволяет произвести экстраполяцию функции K*c/Rθ на нулевой угол, и, принимая во внимание функцию sen2θ/2, молекулярную массу непосредственно находят как значение при пересечении указанных функций с осью ординат, и радиус вращения вычисляют из наклона.
Кроме того, поскольку рассмотренное определение осуществляют для каждого среза хроматограммы, следовательно, можно получить распределение молекулярной массы и радиуса вращения.
Размеры макромолекул в растворе непосредственно связаны с их степенью ветвления: чем меньше размеры макромолекулы в сравнении с ее неразветвленным изомером при одной и той же молекулярной массе, тем выше степень ее ветвления.
Информация, относящаяся к макроструктуре полимера, может быть качественно выведена из величины параметра α, который может быть определен из наклона графика зависимости радиуса вращения от молекулярной массы: если, при одинаковых условиях анализа, эта величина уменьшается для неразветвленной макроструктуры, то в ней присутствует полимер с макроструктурой разветвленного типа. Характерное значение параметра α для неразветвленного полибутадиена, имеющего высокое содержание 1,4-цис-звеньев, в тетрагидрофуране (ТГФ), составляет 0,58-0,60.
Пример 1
Синтез лиганда, имеющего формулу (L5)
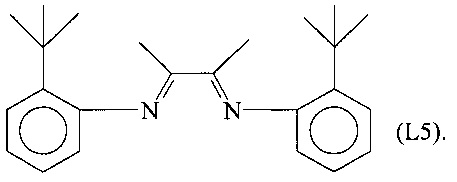
Несколько капель муравьиной кислоты добавляли в раствор 13,49 г (90 ммоль) 2-трет-бутиланилина в 50 мл метанола, получая желтый раствор. К этому раствору добавляли по каплям при перемешивании раствор 2,3-бутандиона (3,875 г, 45 ммоль) в 30 мл метанола.
Полученную смесь продолжали перемешивать при комнатной температуре в течение приблизительно 2 часов до появления желтого осадка. Смесь оставляли выдерживаться в течение 14 часов и затем фильтровали и сушили в вакууме при комнатной температуре, получая 14,1 г желтоватого твердого продукта (выход = 90%), соответствующего формуле (L5).
FT-IR (нуйол): 1636 см-1 v(C=N).
Молекулярная масса (MW): 348,53.
Элементный анализ [найдено (вычислено)]: С: 81,95% (82,71%); Н: 9,26% (9,25%); N: 8,02% (8,01%).
Пример 2
Синтез лиганда, имеющего формулу (L7)
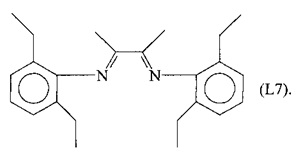
Несколько капель муравьиной кислоты добавляли в раствор 21,81 г (180 ммоль) 2,6-диэтиланилина в 80 мл метанола, получая желтый раствор. К этому раствору добавляли по каплям при перемешивании раствор 2,3-бутандиона (7,75 г, 90 ммоль) в 100 мл метанола.
Полученную смесь продолжали перемешивать при комнатной температуре в течение приблизительно 2 часов до появления желтого осадка. Смесь оставляли выдерживаться в течение 14 часов и затем фильтровали и сушили в вакууме при комнатной температуре, получая 27 г желтоватого твердого продукта (выход = 86%), соответствующего формуле (L7).
FT-IR (нуйол): 1644 см-1 v(C=N).
Молекулярная масса (MW): 348,53.
Элементный анализ [найдено (вычислено)]: С: 82,6% (82,71%); Н: 9,29% (9.25%): N: 8.04% (8.04%).
Пример 3
Синтез лиганда, имеющего Формулу (L8)
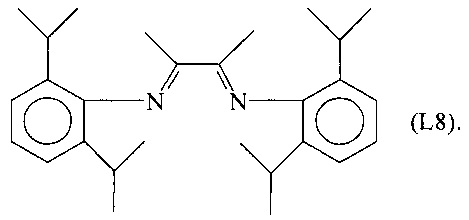
Несколько капель муравьиной кислоты добавляли в раствор 15,96 г (90 ммоль) 2,6-диизопропиланилина в 80 мл метанола, получая желтый раствор. К этому раствору добавляли по каплям при перемешивании раствор 2,3-бутандиона (3,875 г, 45 ммоль) в 80 мл метанола.
Полученную смесь продолжали перемешивать при комнатной температуре в течение приблизительно 2 часов до появления желтого осадка. Смесь оставляли выдерживаться в течение 14 часов и затем фильтровали и сушили в вакууме при комнатной температуре, получая 15,4 г желтоватого твердого продукта (выход = 84%), соответствующего формуле (L8).
FT-IR (нуйол): 1640 см-1 v(C=N).
Молекулярная масса (MW): 404,64.
Элементный анализ [найдено (вычислено)]: С: 82,86% (83,11%); Н: 9,97% (9,96%); N: 6,94% (6,92%).
Пример 4
Синтез лиганда, имеющего Формулу (L9)
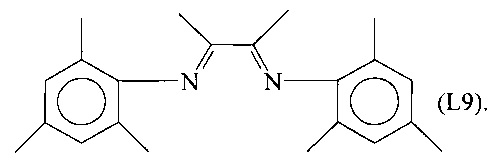
Несколько капель муравьиной кислоты добавляли в раствор 24,34 г (180 ммоль) 2,4,6-триметиланилина в 60 мл метанола, получая желтый раствор. К этому раствору добавляли по каплям при перемешивании раствор 2,3-бутандиона (7,75 г, 90 ммоль) в 100 мл метанола.
Полученную смесь продолжали перемешивать при комнатной температуре в течение приблизительно 2 часов до появления желтого осадка. Смесь оставляли выдерживаться в течение 14 часов и затем фильтровали и сушили в вакууме при комнатной температуре, получая 27,25 г желтоватого твердого продукта (выход = 94,5%), соответствующего формуле (L9).
FT-IR (нуйол): 1637 см-1 v(C=N).
Молекулярная масса (MW): 320,48.
Элементный анализ [найдено (вычислено)]: С: 81,62% (82,45%); Н: 8,80% (8,81%); N: 8,66% (8,74%).
Пример 5
Синтез лиганда, имеющего формулу (L12)
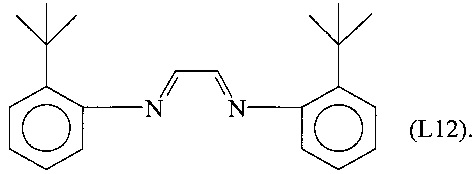
14,924 г (100 ммоль) 2-трет-бутиланилина растворяли в смеси метанола и дистиллированной воды (50 мл +100 мл). К полученному таким образом раствору, охлаждаемому до 0°С на водяной бане со льдом, добавляли при энергичном перемешивании 7,26 г (50 ммоль) глиоксаля (40% масс. водный раствор). Полученный желтый раствор выдерживали при перемешивании при комнатной температуре до получения твердого осадка, который отфильтровывали, промывали метанолом, перекристаллизовывали из пентана и сушили в вакууме при комнатной температуре, получая 12 г желтого микрокристаллического продукта (выход = 75%), соответствующего формуле (L12).
FT-IR (нуйол): 1608 см-1 v(C=N).
Молекулярная масса (MW): 320,47.
Элементный анализ [найдено (вычислено)]: С: 82,42% (82,45%); Н: 8,80% (8,81%); N: 8,76% (8,74%).
Пример 6
Синтез лиганда, имеющего формулу (L13)
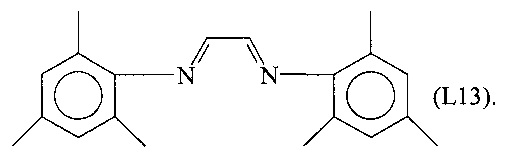
13,52 г (100 ммоль) 2,4,6-триметиланилина растворяли в смеси метанола и дистиллированной воды (50 мл + 100 мл). К полученному таким образом раствору, охлаждаемому до 0°С на водяной бане со льдом, добавляли при энергичном перемешивании 7,26 г (50 ммоль) глиоксаля (40% масс, водный раствор). Полученный желтый раствор выдерживали при перемешивании при комнатной температуре до получения твердого осадка, который отфильтровывали, промывали метанолом, перекристаллизовывали из пентана и сушили в вакууме при комнатной температуре, получая 12 г желтого микрокристаллического продукта (выход = 82%), соответствующего формуле (L13).
FT-IR (нуйол): 1616 см-1 v(C=N).
Молекулярная масса (MW): 292,42.
Элементный анализ [найдено (вычислено)]: С: 82,0% (82,15%); Н: 8,28% (8,27%); N: 9,5% (9,58%).
Пример 7
Синтез лиганда, имеющего формулу (L20)
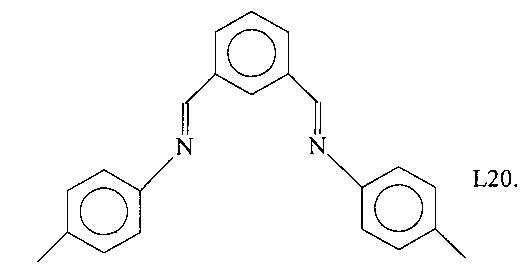
1 г (7,4 ммоль) бензол-1,3-карбоксиальдегида (диизофталальдегида) растворяли в 20 мл безводного этанола. В полученный таким образом раствор добавляли 1,75 г пара-толуидина (16,3 ммоль) и несколько капель муравьиной кислоты. Полученный желтый раствор выдерживали при перемешивании при комнатной температуре в течение 4 часов, получая твердый осадок, который отфильтровывали, промывали этанолом и пентаном и сушили в вакууме при комнатной температуре, получая 2 г твердого желтого продукта (выход = 86%), соответствующего формуле (L20).
FT-IR (нуйол): 1625 см-1 v(C=N).
Молекулярная масса (MW): 312,41.
Элементный анализ [найдено (вычислено)]: С:84,4% (84,58%); Н: 6,4% (6,45%); N: 9,0% (8,97%).
Пример 8
Синтез лиганда, имеющего формулу (L18)
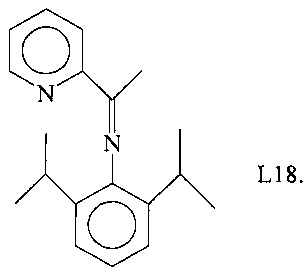
15,96 г (90 ммоль) 2,6-диизопропиланилина помещали в колбу совместно с 50 мл метанола и 0,25 мл муравьиной кислоты. К полученному таким образом раствору при комнатной температуре по каплям добавляли 50 мл метанола, содержащего 10,9 г (90 ммоль) ацетилпиридина. Полученный раствор выдерживали при перемешивании при комнатной температуре до получения твердого осадка, который отфильтровывали, промывали холодным метанолом и сушили в вакууме при комнатной температуре, получая 12,6 г белого микрокристаллического продукта (выход=53%), соответствующего формуле (L18).
FT-IR (нуйол): 1652 см-1 v(C=N).
Молекулярная масса (MW): 280,41.
Элементный анализ [найдено (вычислено)]: С: 81,52% (81,38%); Н: 8,57% (8,63%); N: 9,90% (9,99%).
Пример 9
Синтез лиганда, имеющего формулу (L21)
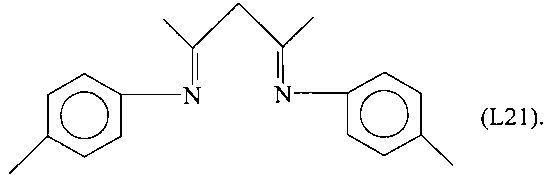
Смесь пара-толуидина (2,68 г, 25 ммоль), 2,4-пентандиона (1,24 г, 12 ммоль) и пара-толуолсульфоновой кислоты (2,13 г) в толуоле (35 мл) нагревали в аппарате Дина-Старка до температуры кипения в течение 24 часов. По окончании декантировали толуол, и полученный остаток обрабатывали простым диэтиловым эфиром (30 мл), водой (25 мл) и декагидратом карбоната натрия (Na2CO3⋅10H2O). Полученную смесь выдерживали при перемешивании при комнатной температуре в течение 30 минут, эфирный слой отделяли от водного слоя, и эфирный слой обезвоживали сульфатом магния (MgSO4). Растворитель затем удаляли испарением в вакууме. Полученный остаток сушили в вакууме при 100°С и затем перекристаллизовывали из гексана, получая 2,7 г микрокристаллического продукта (выход = 78%), соответствующего формуле (L21).
FT-IR (нуйол): 1611 см-1 v(C=N).
1Н-ЯМР (CDCl3): δ = 12,66 (s, 1Н), 7.10 (d, 4Н, ArH), 6,86 (d, 4Н), 4,85 (s, 1Н), 2,30 (s, 6Н), 1,98 (s, 6Н) м.д.
Молекулярная масса (MW): 278,41.
Элементный анализ [найдено (вычислено)]: С: 81,80% (81,97%); Н: 7,90% (7,96%); N: 10,20% (10,60%).
Пример 10
Синтез CoCl2(L8) [образец GL648]
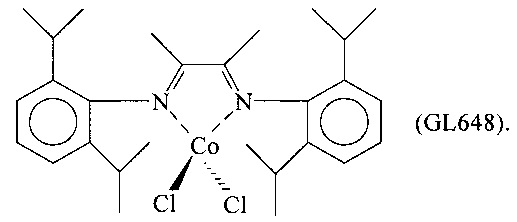
Дихлорид кобальта (CoCl2) (0,334 г; 2,577 ммоль) помещали в реакционную колбу емкостью 100 мл совместно с 70 мл тетрагидрофурана (ТГФ). Содержимое колбы перемешивали при комнатной температуре в течение нескольких минут, после чего добавляли лиганд, соответствующий формуле (L8) (1,25 г; 3,08 ммоль; молярное отношение L8/Co =1,2), полученный согласно процедуре Примера 3. Немедленно образовывалась зеленая суспензия, которую перемешивали при комнатной температуре в течение 24 часов. Затем растворитель испаряли в вакууме, полученный твердый темно-зеленый остаток сушили в вакууме при комнатной температуре и наносили на пористую пластину нагреваемого экстрактора для твердых веществ и экстрагировали пентаном в непрерывном режиме при температуре кипения в течение 24 часов для удаления непрореагировавшего лиганда. Оставшийся на пористой пластине остаток затем экстрагировали толуолом в непрерывном режиме при температуре кипения в течение 24 часов, получая зеленый раствор. Толуол испаряли в вакууме, оставшийся на пористой пластине твердый остаток извлекали и сушили в вакууме при комнатной температуре, получая 1,03 г светло-зеленого твердого продукта, соответствующего комплексу CoCl2(L8); степень превращения составляла 75% в пересчете на исходный дихлорид кобальта.
Элементный анализ [найдено (вычислено)]: С: 62,30% (62,92%); Н: 7,44% (7,54%); N: 5,36% (5,24%); Cl: 12,80% (13,27%); Со: 10,90% (11,03%).
Молекулярная масса (MW): 534,47.
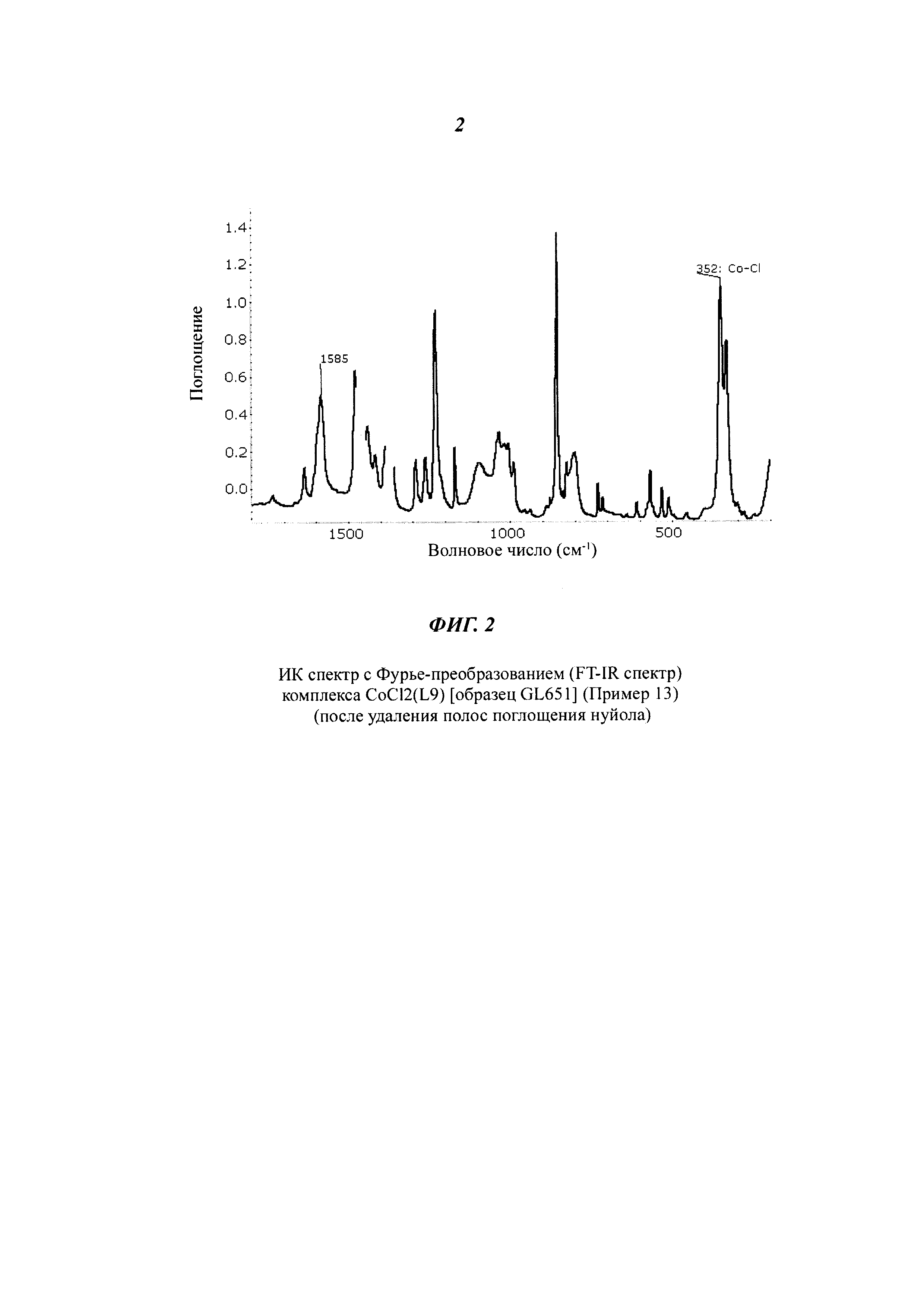
FT-IR (нуйол): 1639 см-1 v(C=N); 1585 см-1 v(C=N).
На Фиг. 1 представлен FT-IR спектр полученного комплекса CoCl2(L8) (после удаления полос поглощения нуйола).
Пример 11
Синтез CoCl2(L5) [образец GL649]
Дихлорид кобальта (CoCl2) (0,369 г; 2,84 ммоль) помещали в реакционную колбу емкостью 100 мл совместно с 70 мл тетрагидрофурана (ТГФ). Содержимое колбы перемешивали при комнатной температуре в течение нескольких минут, после чего добавляли лиганд, соответствующий формуле (L5) (1,14 г; 3,27 ммоль; молярное отношение L5/Co = 1,15), полученный согласно процедуре Примера 1. Полученную зеленую/светло-голубую суспензию перемешивали при комнатной температуре в течение 48 часов. Затем растворитель испаряли в вакууме, полученный твердый остаток сушили в вакууме при комнатной температуре, наносили на пористую пластину нагреваемого экстрактора для твердых веществ и экстрагировали пентаном в непрерывном режиме при температуре кипения в течение 24 часов для удаления непрореагировавшего лиганда. Оставшийся на пористой пластине остаток затем экстрагировали дихлорметаном в непрерывном режиме при температуре кипения в течение 24 часов, получая зеленый раствор. Дихлорметан испаряли в вакууме, оставшийся на пористой пластине твердый остаток извлекали и сушили в вакууме при комнатной температуре, получая 1,107 г твердого зеленого продукта, соответствующего комплексу CoCl2(L5); степень превращения составляла 81,5% в пересчете на исходный дихлорид кобальта.
Элементный анализ [найдено (вычислено)]: С: 59,80% (60,26%); Н: 6,60% (6,74%); N: 5,70% (5,86%); Cl: 14,20% (14,82%); Со: 11,90% (12,32%).
Молекулярная масса (MW): 478,36.
FT-IR (нуйол): 1633 см-1 v(C=N); 1587 см-1 v(C=N).
Пример 12
Синтез CoCl2(L7) [образец GL546]
Дихлорид кобальта (CoCl2) (0,439 г; 3,4 ммоль) помещали в реакционную колбу емкостью 100 мл совместно с 70 мл тетрагидрофурана (ТГФ). Содержимое колбы перемешивали при комнатной температуре в течение нескольких минут, после чего добавляли лиганд, соответствующий формуле (L7) (1,4 г; 4,08 ммоль; молярное отношение L7/Co = 1,2), полученный согласно процедуре Примера 2. Немедленно образовывалась темно-зеленая суспензия, которую перемешивали при комнатной температуре в течение 24 часов. Затем растворитель испаряли в вакууме, полученный твердый темно-зеленый остаток сушили в вакууме при комнатной температуре, наносили на пористую пластину нагреваемого экстрактора для твердых веществ и экстрагировали пентаном в непрерывном режиме при температуре кипения в течение 24 часов для удаления непрореагировавшего лиганда. Оставшийся на пористой пластине остаток затем экстрагировали в непрерывном режиме дихлорметаном при температуре кипения в течение 24 часов, получая зеленый раствор. Дихлорметан испаряли в вакууме, оставшийся на пористой пластине твердый остаток извлекали и сушили в вакууме при комнатной температуре, получая 0,921 г твердого зеленого продукта соответствующего комплексу CoCl2(L7); степень превращения составляла 56,6% в пересчете на исходный дихлорид кобальта.
Элементный анализ [найдено (вычислено)]: С: 60,0% (60,26%); Н: 6,30% (6,64%); N: 5,70% (5,86%); Cl: 13,90% (14,82%); Со: 12.10% (12,32%).
Молекулярная масса (MW): 478,36.
FT-IR (нуйол): 1642 см-1 v(C=N); 1585 см-1 v(C=N).
Пример 13
Синтез CoCl2(L9) [образец GL651]
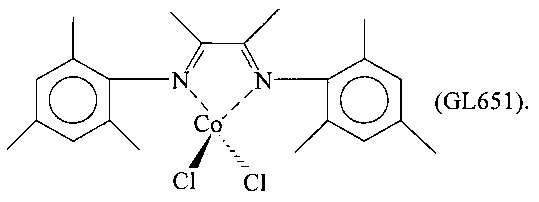
Дихлорид кобальта (СоСl2) (0,444 г; 3,46 ммоль) помещали в реакционную колбу емкостью 100 мл совместно с 70 мл тетрагидрофурана (ТГФ). Содержимое колбы перемешивали при комнатной температуре в течение нескольких минут, после чего добавляли лиганд, соответствующий формуле (L9) (1,33 г; 4,15 ммоль; молярное отношение L9/Co = 1,2), полученный согласно процедуре Примера 4. Немедленно образовывалась зеленая суспензия, которую перемешивали при комнатной температуре в течение 24 часов. Затем растворитель испаряли в вакууме, полученный твердый остаток сушили в вакууме при комнатной температуре, наносили на пористую пластину нагреваемого экстрактора для твердых веществ и экстрагировали пентаном в непрерывном режиме при температуре кипения в течение 24 часов для удаления непрореагировавшего лиганда. Оставшийся на пористой пластине остаток затем экстрагировали в непрерывном режиме дихлорметаном при температуре кипения в течение 24 часов, получая зеленый раствор. Дихлорметан испаряли в вакууме, оставшийся на пористой пластине твердый остаток извлекали и сушили в вакууме при комнатной температуре, получая 1,10 г твердого темно-зеленого продукта, соответствующего комплексу CoCl2(L9); степень превращения составляла 70% в пересчете на исходный дихлорид кобальта.
Элементный анализ [найдено (вычислено)]: С: 58,40% (58,68%); Н: 6,24% (6,27%); N: 6,45% (6,22%); CI: 16,30% (15,75%); Со: 12,70% (13,09%).
Молекулярная масса (MW): 450,31.
FT-IR (нуйол): 1635 см-1 v(C=N); 1585 см-1 v(C=N).
На Фиг. 2 представлен FT-IR спектр полученного комплекса CoCl2(L9) (после удаления полос поглощения нуйола).
Пример 14
Синтез CoCl2(L13) [образец GL769]
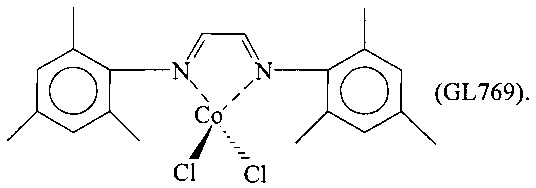
Дихлорид кобальта (CoCl2) (0,284 г; 2,19 ммоль) помещали в реакционную колбу емкостью 100 мл совместно с 50 мл тетрагидрофурана (ТГФ). Содержимое колбы перемешивали при комнатной температуре в течение нескольких минут, после чего добавляли лиганд, соответствующий формуле (L13) (0,690 г; 2,36 ммоль; молярное отношение L13/Co = 1,1), полученный согласно процедуре Примера 6. Немедленно образовывалась темно-зеленая суспензия, которую перемешивали при комнатной температуре в течение 24 часов. Затем растворитель испаряли в вакууме, полученный светло-зеленый твердый остаток сушили в вакууме при комнатной температуре, наносили на пористую пластину нагреваемого экстрактора для твердых веществ и экстрагировали пентаном в непрерывном режиме при температуре кипения в течение 24 часов для удаления непрореагировавшего лиганда. Оставшийся на пористой пластине остаток затем экстрагировали в непрерывном режиме дихлорметаном при температуре кипения в течение 24 часов, получая зеленый раствор. Дихлорметан испаряли в вакууме, оставшийся на пористой пластине твердый остаток извлекали и сушили в вакууме при комнатной температуре, получая 0,750 г бордово-коричневого твердого продукта, соответствующего комплексу CoCl2(L13); степень превращения составляла 81% в пересчете на исходный дихлорид кобальта.
Элементный анализ [найдено (вычислено)]: С: 56,20% (56,89%); Н: 5,60% (5,73%); N: 6,40% (6,63%); Cl: 16,20% (16,79%); Со: 13,40% (13,96%).
Молекулярная масса (MW): 422,26.
FT-IR (нуйол): 1612 см-1 v(C=N).
Пример 15
Синтез CoCl2(L18) [образец GL774]
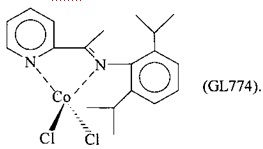
Дихлорид кобальта (СоСl2) (0,366 г; 2,82 ммоль) помещали в реакционную колбу емкостью 100 мл совместно с 50 мл тетрагидрофурана (ТГФ). Содержимое колбы перемешивали при комнатной температуре в течение нескольких минут, после чего добавляли лиганд, соответствующий формуле (L18) (0,908 г; 3,24 ммоль; молярное отношение L18/Co = 1,15), полученный согласно процедуре Примера 8. Немедленно образовывалась пурпурная суспензия, которую перемешивали при комнатной температуре в течение 24 часов. Затем растворитель испаряли в вакууме, полученный твердый остаток сушили в вакууме при комнатной температуре, наносили на пористую пластину нагреваемого экстрактора для твердых веществ и экстрагировали пентаном в непрерывном режиме при температуре кипения в течение 24 часов для удаления непрореагировавшего лиганда. Оставшийся на пористой пластине остаток затем экстрагировали в непрерывном режиме дихлорметаном при температуре кипения в течение 24 часов, получая зеленый раствор. Дихлорметан испаряли в вакууме, оставшийся на пористой пластине твердый остаток извлекали и сушили в вакууме при комнатной температуре, получая 0,824 г пурпурного твердого продукта, соответствующего комплексу CoCl2(L18); степень превращения составляла 71% в пересчете на исходный дихлорид кобальта.
Элементный анализ [найдено (вычислено)]: С: 54,90% (55,63%); Н: 5,80% (5,90%); N: 6.70% (6,83%); Cl: 16,90% (17,28%); Со: 13,90% (14,37%).
Молекулярная масса (MW): 410,25.
FT-IR (нуйол): 1648 см-1 v(C=N).
Пример 16
Синтез CoCl2(L20) [образец GL907]
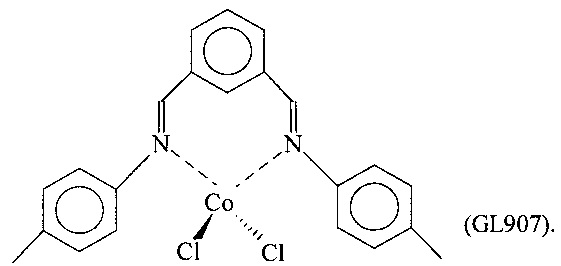
Дихлорид кобальта (CoCl2) (0,160 г; 1,23 ммоль) помещали в реакционную колбу емкостью 100 мл совместно с 50 мл тетрагидрофурана (ТГФ). Содержимое колбы перемешивали при комнатной температуре в течение нескольких минут, после чего добавляли лиганд, соответствующий формуле (L20) (0,416 г; 1,33 ммоль; молярное отношение L20/Co = 1,1), полученный согласно процедуре Примера 7. Немедленно образовывалась зеленая/светло-голубая суспензия, которую перемешивали при комнатной температуре в течение 24 часов. Затем растворитель испаряли в вакууме, полученный твердый остаток сушили в вакууме при комнатной температуре, наносили на пористую пластину нагреваемого экстрактора для твердых веществ и экстрагировали пентаном в непрерывном режиме при температуре кипения в течение 24 часов для удаления непрореагировавшего лиганда. Оставшийся на пористой пластине остаток затем экстрагировали в непрерывном режиме дихлорметаном при температуре кипения в течение 24 часов, получая зеленый раствор. Дихлорметан испаряли в вакууме, оставшийся на пористой пластине твердый остаток извлекали и сушили в вакууме при комнатной температуре, получая 0,435 г твердого зеленого продукта соответствующего комплексу CoCl2(L20); степень превращения составляла 80% в пересчете на исходный дихлорид кобальта.
Элементный анализ [найдено (вычислено)]: С: 59,50% (59,75%); Н: 4,40% (4,56%); N: 6,10% (6,33%); Cl: 15,60% (16,03%); Со: 13,0% (13,33%).
Молекулярная масса (MW): 442,25.
FT-IR (нуйол): 1622 см-1 v(C=N).
Пример 17 (GL659)
2 мл 1,3-бутадиена, что составляет приблизительно 1,4 г, подвергали конденсации при низкой температуре (-20°С) в пробирке емкостью 25 мл. Затем добавляли 7,05 мл толуола, и температуру полученного таким образом раствора доводили до 20°С. После этого добавляли метилалюмоксан (МАО) в растворе толуола (6,3 мл; 1×10-2 моль, что составляет приблизительно 0,58 г), а затем комплекс CoCl2(L8) [образец GL648] (2,65 мл толуольного раствора с концентрацией 2 мг/мл; 1×10-5 моль, что составляет приблизительно 5,3 мг), полученный согласно процедуре Примера 10. Содержимое колбы перемешивали магнитной мешалкой при 20°С в течение 30 минут. По истечении этого времени полимеризацию останавливали посредством добавления 2 мл метанола, содержащего несколько капель соляной кислоты. Затем полученный полимер подвергали коагуляции посредством добавления 40 мл метанольного раствора, содержащего 4% антиоксиданта Irganox® 1076 (Ciba), получая 0,985 г полибутадиена, в котором содержание 1,4-цис-звеньев составляло 98%: дополнительные характеристики способа и полученного полибутадиена представлены в Таблице 1.
На Фиг. 4 представлен FT-IR спектр полученного полибутадиена.
На Фиг. 9 представлены диаграммы ДСК полученного полибутадиена.
Пример 18 (GL661)
2 мл 1,3-бутадиена, что составляет приблизительно 1,4 г, подвергали конденсации при низкой температуре (-20°С) в пробирке емкостью 25 мл. Затем добавляли 7,3 мл толуола, и температуру полученного таким образом раствора доводили до 20°С. После этого добавляли метилалюмоксан (МАО) в растворе толуола (6,3 мл; 1×10-2 моль, что составляет приблизительно 0,58 г), а затем комплекс CoCl2(L5) [образец GL649] (2,4 мл толуольного раствора с концентрацией 2 мг/мл; 1×10-5 моль, что составляет приблизительно 4,8 мг), полученный согласно процедуре Примера 11. Содержимое колбы перемешивали магнитной мешалкой при 20°С в течение 30 минут. По истечении этого времени полимеризацию останавливали посредством добавления 2 мл метанола, содержащего несколько капель соляной кислоты. Затем полученный полимер подвергали коагуляции посредством добавления 40 мл метанольного раствора, содержащего 4% антиоксиданта Irganox® 1076 (Ciba), получая 1,4 г полибутадиена, в котором содержание 1,4-цис-звеньев составляло 98,1%; дополнительные характеристики способа и полученного полибутадиена представлены в Таблице 1.
На Фиг. 4 представлен FT-IR спектр полученного полибутадиена.
Пример 19 (GL640)
2 мл 1,3-бутадиена, что составляет приблизительно 1,4 г, подвергали конденсации при низкой температуре (-20°С) в пробирке емкостью 25 мл. Затем добавляли 7,3 мл толуола, и температуру полученного таким образом раствора доводили до 20°С. После этого добавляли метилалюмоксан (МАО) в растворе толуола (6,3 мл; 1×10-2 моль, что составляет приблизительно 0,58 г), а затем комплекс CoCl2(L7) [образец GL546] (2,4 мл толуольного раствора с концентрацией 2 мг/мл; 1×10-5 моль, что составляет приблизительно 4,8 мг), полученный согласно процедуре Примера 12. Содержимое колбы перемешивали магнитной мешалкой при 20°С в течение 90 минут. По истечении этого времени полимеризацию останавливали посредством добавления 2 мл метанола, содержащего несколько капель соляной кислоты. Затем полученный полимер подвергали коагуляции посредством добавления 40 мл метанольного раствора, содержащего 4% антиоксиданта Irganox® 1076 (Ciba), получая 0,56 г полибутадиена, в котором содержание 1,4-цис-звеньев составляло 98,1%: дополнительные характеристики способа и полученного полибутадиена представлены в Таблице 1.
На Фиг. 3 представлен FT-IR спектр полученного полибутадиена.
Пример 20 (GL662)
2 мл 1,3-бутадиена, что составляет приблизительно 1,4 г, подвергали конденсации при низкой температуре (-20°С) в пробирке емкостью 25 мл. Затем добавляли 7,45 мл толуола, и температуру полученного таким образом раствора доводили до 20°С. После этого добавляли метилалюмоксан (МАО) в растворе толуола (6,3 мл; 1×10-2 моль, что составляет приблизительно 0,58 г), а затем комплекс CoCl2(L9) [образец GL651] (2,25 мл толуольного раствора с концентрацией 2 мг/мл; 1×10"5 моль, что составляет приблизительно 4,5 мг), полученный согласно процедуре Примера 13. Содержимое колбы перемешивали магнитной мешалкой при 20°С в течение 30 минут. По истечении этого времени полимеризацию останавливали посредством добавления 2 мл метанола, содержащего несколько капель соляной кислоты. Затем полученный полимер подвергали коагуляции посредством добавления 40 мл метанольного раствора, содержащего 4% антиоксиданта Irganox® 1076 (Ciba), получая 0,77 г полибутадиена, в котором содержание 1,4-цис-звеньев составляло 98,2%: дополнительные характеристики способа и полученного полибутадиена представлены в Таблице 1.
На Фиг. 3 представлен FT-IR спектр полученного полибутадиена.
Пример 21 (GL779)
2 мл 1,3-бутадиена, что составляет приблизительно 1,4 г, подвергали конденсации при низкой температуре (-20°С) в пробирке емкостью 25 мл. Затем добавляли 7,6 мл толуола, и температуру полученного таким образом раствора доводили до 20°С. После этого добавляли метилалюмоксан (МАО) в растворе толуола (6,3 мл; 1×10-2 моль, что составляет приблизительно 0,58 г), а затем комплекс CoCl2(L13) [образец GL769] (2,1 мл толуольного раствора с концентрацией 2 мг/мл; 1×10-5 моль, что составляет приблизительно 4,2 мг), полученный согласно процедуре Примера 14. Содержимое колбы перемешивали магнитной мешалкой при 20°С в течение 140 минут. По истечении этого времени полимеризацию останавливали посредством добавления 2 мл метанола, содержащего несколько капель соляной кислоты. Затем полученный полимер подвергали коагуляции посредством добавления 40 мл метанольного раствора, содержащего 4% антиоксиданта Irganox® 1076 (Ciba), получая 0,59 г полибутадиена, в котором содержание 1,4-цис-звеньев составляло 98,2%: дополнительные характеристики способа и полученного полибутадиена представлены в Таблице 1.
На Фиг. 3 представлен FT-IR спектр полученного полибутадиена.
На Фиг. 5 представлены спектры ЯМР1Н и ЯМР13С полученного полибутадиена.
На Фиг. 7 представлены диаграммы ДСК полученного полибутадиена.
Пример 22 (GL820)
2 мл 1,3-бутадиена, что составляет приблизительно 1,4 г, подвергали конденсации при низкой температуре (-20°С) в пробирке емкостью 25 мл. Затем добавляли 7,6 мл толуола, и температуру полученного таким образом раствора доводили до 20°С. После этого добавляли метилалюмоксан (МАО) в растворе толуола (6,3 мл; 1×10-2 моль, что составляет приблизительно 0,58 г), а затем комплекс CoCl2(L13) [образец GL769] (2,1 мл толуольного раствора с концентрацией 2 мг/мл; 1×10-5 моль, что составляет приблизительно 4,2 мг), полученный согласно процедуре Примера 14. Содержимое колбы перемешивали магнитной мешалкой при 50°С в течение 240 минут. По истечении этого времени полимеризацию останавливали посредством добавления 2 мл метанола, содержащего несколько капель соляной кислоты. Затем полученный полимер подвергали коагуляции посредством добавления 40 мл метанольного раствора, содержащего 4% антиоксиданта Irganox® 1076 (Ciba), получая 1,4 г полибутадиена, в котором содержание 1,4-цис-звеньев составляло 98%: дополнительные характеристики способа и полученного полибутадиена представлены в Таблице 1.
На Фиг. 3 представлен FT-IR спектр полученного полибутадиена.
На Фиг. 6 представлены спектры ЯМР1Н и ЯМР13С полученного полибутадиена.
На Фиг. 8 представлены диаграммы ДСК полученного полибутадиена.
Пример 23 (GL781)
2 мл 1,3-бутадиена, что составляет приблизительно 1,4 г, подвергали конденсации при низкой температуре (-20°С) в пробирке емкостью 25 мл. Затем добавляли 7,65 мл толуола, и температуру полученного таким образом раствора доводили до 20°С. После этого добавляли метилалюмоксан (МАО) в растворе толуола (6,3 мл; 1×10-2 моль, что составляет приблизительно 0,58 г), а затем комплекс CoCl2(L18) [образец GL774] (2,05 мл толуольного раствора с концентрацией 2 мг/мл; 1×10-5 моль, что составляет приблизительно 4,1 мг), полученный согласно процедуре Примера 15. Содержимое колбы перемешивали магнитной мешалкой при 20°С в течение 360 минут. По истечении этого времени полимеризацию останавливали посредством добавления 2 мл метанола, содержащего несколько капель соляной кислоты. Затем полученный полимер подвергали коагуляции посредством добавления 40 мл метанольного раствора, содержащего 4% антиоксиданта Irganox® 1076 (Ciba), получая 0,91 г полибутадиена, в котором содержание 1,4-цис-звеньев составляло 98,1%: дополнительные характеристики способа и полученного полибутадиена представлены в Таблице 1.
На Фиг. 4 представлен FT-IR спектр полученного полибутадиена.
Пример 24 (GL980)
2 мл 1,3-бутадиена, что составляет приблизительно 1,4 г, подвергали конденсации при низкой температуре (-20°C) в пробирке емкостью 25 мл. Затем добавляли 7,5 мл толуола, и температуру полученного таким образом раствора доводили до 20°С. После этого добавляли метилалюмоксан (МАО) в растворе толуола (6,3 мл; 1×10-2 моль, что составляет приблизительно 0,58 г), и затем комплекс CoCl2(L20) [образец GL907] (2,2 мл толуольного раствора с концентрацией 2 мг/мл; 1×10-5 моль, что составляет приблизительно 4,4 мг), полученный согласно процедуре Примера 16. Содержимое колбы перемешивали магнитной мешалкой при 20°С в течение 120 минут. По истечении этого времени полимеризацию останавливали посредством добавления 2 мл метанола, содержащего несколько капель соляной кислоты. Затем полученный полимер подвергали коагуляции посредством добавления 40 мл метанольного раствора, содержащего 4% антиоксиданта Irganox® 1076 (Ciba), получая 0,83 г полибутадиена, в котором содержание 1,4-цис-звеньев составляло 98%: дополнительные характеристики способа и полученного полибутадиена представлены в Таблице 1.
На Фиг. 4 представлен FT-IR спектр полученного полибутадиена.
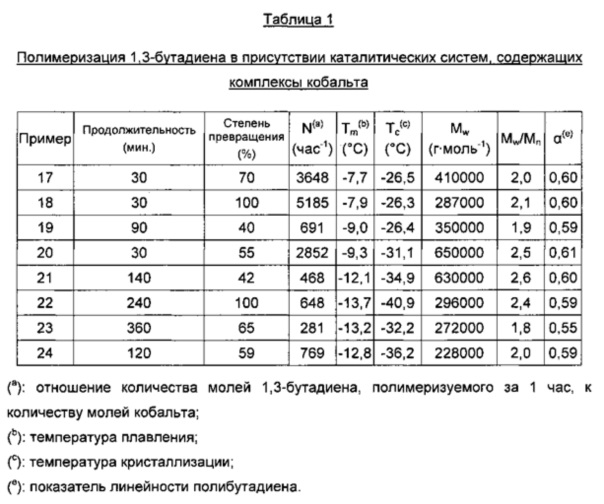
Реферат
Изобретение относится к способу получения полимеров сопряженных диенов. Способ получения полимеров сопряженных диенов включает полимеризацию по меньшей мере одного сопряженного диена в присутствии каталитической системы, включающей по меньшей мере один бис-иминовый комплекс кобальта, имеющий общую формулу (I):где: n равен 0 или 1, Y представляет собой незамещенную двухвалентную ароматическую группу, Rи Rодинаковы или различны и представляют собой атом водорода или метильную группу, Rи Rодинаковы или различны и представляют собой атом водорода, или они выбраны из неразветвленных или разветвленных С-Салкильных групп, циклоалкильных групп; необязательно замещенных неразветвленными или разветвленными С-Салкильными группами арильных групп, или Rи Rнеобязательно могут быть соединены друг с другом, образуя вместе с другими атомами, к которым они присоединены, незамещенный пиридиновый цикл, или Rи Rнеобязательно могут быть соединены друг с другом, образуя вместе с другими атомами, к которым они присоединены, незамещенный пиридиновый цикл, Хи Хпредставляют собой атом галогена, такого как хлор, бром, йод. Технический результат - способ обеспечивает получение полидиенов с высоким содержанием 1,4-цис-звеньев – не менее 98%. 15 з.п. ф-лы, 1 табл., 12 ил.
Формула

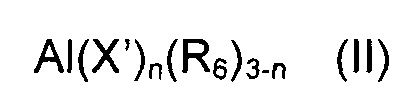
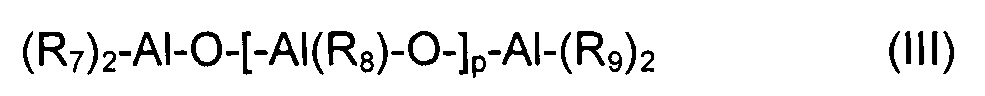

Комментарии