Композиция покрытия и медицинское устройство - RU2605291C2
Код документа: RU2605291C2
Чертежи
Описание
ОБЛАСТЬ ТЕХНИКИ
[0001] Настоящее изобретение относится к композиции покрытия для элюирующего лекарственное средство медицинского устройства, к слою лекарственного покрытия элюирующего лекарственное средство медицинского устройства и/или к элюирующему лекарственное средство медицинскому устройству, покрытому композицией покрытия.
УРОВЕНЬ ТЕХНИКИ
[0002] Примером терапии с локальной доставкой лекарственных средств является стент с лекарственным покрытием (drug-eluting stent, DES). Стент с лекарственным покрытием разрабатывается так, чтобы локально стабильным образом высвобождать лекарственное средство в течение длительного периода времени, предотвращая тем самым повторное сужение просвета, т.е. рестеноз кровеносного сосуда. Стабильное высвобождение лекарственного средства из стента с лекарственным покрытием достигается с помощью полимерного конъюгата, такого как полимолочная кислота (PLA). В этом случае, поскольку полимер остается в живом организме в течение длительного периода времени, существует проблема тяжелых осложнений, таких как хроническое воспаление или отсроченный тромбоз в той части поражения, которая подвергается воздействию.
[0003] Традиционно сообщалось, что замедленное высвобождение лекарственного средства в течение длительного периода времени необходимо для того, чтобы ограничить рестеноз. В последние годы, однако, стало ясно, что при быстрой передаче лекарственного средства к ткани-мишени даже кратковременного устойчивого воздействия препарата достаточно для того, чтобы успешно предотвратить рестеноз. Технология быстрой доставки лекарственных средств не нуждается в полимерной матрице, такой как PLA (полимолочная кислота) или PLGA (сополимер молочной кислоты и гликолевой кислоты), для замедленного высвобождения и поэтому является выгодной для избегания осложнений.
[0004] Кроме того, в последние годы были достигнуты положительные результаты в разработке баллонов, элюирующих лекарственное средство (DEB, Drug Eluting Balloons), в которых катетер с раздуваемым баллончиком на конце покрывается лекарственным средством, и, как сообщается, они являются эффективными при лечении и предотвращении рестеноза. Баллон покрывается покрытием, которое содержит лекарственное средство и добавки, и при расширении кровеносного сосуда баллон прижимается к стенке кровеносного сосуда для доставки лекарственного средства к ткани-мишени.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
ТЕХНИЧЕСКАЯ ПРОБЛЕМА
[0005] Однако, если лекарственное средство легко счищается с баллона в процессе доставки баллона к ткани-мишени, количество лекарственного средства, остающегося на баллоне, уменьшается до уровня, недостаточного для проявления терапевтического эффекта, прежде, чем баллон будет доставлен к месту поражения. В такой ситуации ожидаемый терапевтический эффект не может быть гарантирован. В дополнение к этому, лекарственное средство, легко счищаемое со стента во время процесса доставки, попадает в кровь, что также является нежелательным с точки зрения безопасности. Таким образом, существует потребность в слое лекарственного покрытия, который гарантировал бы, что катетер с раздуваемым баллончиком на конце, покрытым лекарственным средством, может быть доставлен к месту поражения без преждевременного счищения лекарственного средства, баллон может быть прижат к стенке кровеносного сосуда одновременно с расширением, и лекарственное средство тем самым может быть высвобождено быстро.
[0006] Кроме того, если низкомолекулярное соединение, используемое в покрытии вместе с лекарственным средством, является чрезмерно гидрофобным, его гидрофобное взаимодействие с нерастворимым в воде лекарственным средством было бы сильным, и их гидрофобные области имели бы высокое сродство к поверхности баллона. В результате высвобождение (передача) лекарственного средства от баллона к поврежденной части (к внутренней поверхности кровеносного сосуда) было бы затруднено, даже при контакте баллона с поврежденной частью. Кроме того, если гидрофобность низкомолекулярного соединения, смешанного с гидрофобным лекарственным средством, является значительной, гидрофобное взаимодействие между молекулами нерастворимого в воде лекарственного средства будет настолько сильным, что лекарственное средство сможет легко агрегироваться на поверхности медицинского устройства, затрудняя создание однородного покрытия. В дополнение к этому, лекарственное средство, нанесенное на поверхность медицинского устройства в агрегированном состоянии, будет легко отщепляться от поверхности баллона во время работы с ним, что является нежелательным с точки зрения безопасности и функциональности. Если, с другой стороны, низкомолекулярное соединение является чрезмерно гидрофильным, может оказаться затруднительным смешать соединение с нерастворимым в воде лекарственным средством. В таком случае может быть затруднительным приготовить стабильный раствор для слоя лекарственного покрытия, или низкомолекулярное соединение может легко смываться кровотоком вместе с лекарственным средством благодаря его сильной гидрофильности. Следовательно, желательно, чтобы низкомолекулярное соединение, используемое в покрытии вместе с лекарственным средством, имело как гидрофильную область для ослабления гидрофобного взаимодействия между молекулами нерастворимого в воде лекарственного средства и гарантирования однородной дисперсии лекарственного средства, так и гидрофобную область, которая имела бы сродство к нерастворимому в воде лекарственному средству; короче говоря, баланс между гидрофильной областью и гидрофобной областью является важным.
[0007] Принимая во внимание предшествующее, задачей настоящего изобретения является предложить такую композицию покрытия для элюирующих лекарственное средство медицинских устройств, которая гарантировала бы доставку лекарственного средства для лечения поражения кровеносного сосуда, такого как рестеноз, без легкого отшелушивания лекарственного средства от медицинского устройства в процессе его доставки к ткани-мишени, быстрое высвобождение лекарственного средства в поврежденную часть после доставки, а также усиливала бы перенос лекарственного средства к ткани-мишени.
ТЕХНИЧЕСКОЕ РЕШЕНИЕ
[0008] Авторы настоящего изобретения провели обширные и интенсивные исследования для того, чтобы решить вышеупомянутую проблему. В результате этих исследований авторы настоящего изобретения установили, что когда композиция покрытия содержит нерастворимое в воде лекарственное средство и по меньшей мере одно соединение, выбранное из группы, состоящей из сложноэфирных соединений аминокислот, которые имеют индекс гидрофобности (hydropathy index: HI) боковой цепи аминокислоты, равный нулю или меньше нуля, и используются его соли, возможно сформировать слой лекарственного покрытия на поверхности медицинского устройства, гарантирующий доставку лекарственного средства для лечения повреждения кровеносного сосуда, такого как рестеноз, без легкого отшелушивания лекарственного средства от медицинского устройства во время процесса его доставки к ткани-мишени. Настоящее изобретение основано на этом открытии.
[0009] В частности, в соответствии с настоящим изобретением предлагаются следующие п.п. (1)-(13).
(1) Композиция покрытия для элюирующего лекарственное средство медицинского устройства, содержащая нерастворимое в воде лекарственное средство и по меньшей мере одно соединение, выбранное из группы, состоящей из сложноэфирных соединений аминокислот, которые имеют индекс гидрофобности боковой цепи аминокислоты, равный нулю или меньше нуля, а также их солей.
(2) Композиция покрытия в соответствии с вышеприведенным п. (1),
в которой аминокислота является α-аминокислотой.
(3) Композиция покрытия в соответствии с вышеприведенным п. (1) или (2),
в которой сложноэфирное соединение является сложноэфирным соединением по меньшей мере одной аминокислоты и одноатомного спирта, содержащего вплоть до пяти атомов углерода, причем по меньшей мере одна аминокислота выбирается из группы, состоящей из глицина, серина, аспарагина, аспартовой кислоты, глютамина, глутаминовой кислоты, аргинина, треонина, гистидина, лизина, тирозина, триптофана, аминокислот, полученных путем замены по меньшей мере одного из водородных атомов аминогруппы в α-положении в вышеупомянутых аминокислотах алкильной группой, содержащей вплоть до пяти атомов углерода, бензильной группой или бензоильной группой, пролина и аминокислот, полученных путем замены водородного атома имино-группы пролина алкильной группой, содержащей вплоть до пяти атомов углерода, бензильной группой или бензоильной группой.
(4) Композиция покрытия в соответствии с любым из вышеупомянутых п.п. (1)-(3),
в которой сложноэфирное соединение представлено следующей формулой:
где R1 представляет собой водородный атом, гуанидинпропильную группу, карбамоилметильную группу, карбоксиметильную группу, метоксикарбонилметильную группу, этоксикарбонилметильную группу, 2-карбамоилэтильную группу, 2-карбоксиэтильную группу, 2-метоксикарбонилэтильную группу, 2-этоксикарбонилэтильную группу, (1H-имидазол-4-ил)метильную группу, 4-аминобутильную группу, гидроксиметильную группу, 1-гидроксиэтильную группу, (1H-индол-3-ил)метильную группу или 4-гидроксибензильную группу или образует триметиленовую группу с радикалом R2, R2 представляет собой водородный атом или формирует триметиленовую группу с радикалом R1, R3 представляет собой водородный атом, алкильную группу, содержащую до пяти атомов углерода, бензильную группу или бензоильную группу, и R4 представляет собой алкильную группу, содержащую до пяти атомов углерода.
(5) Композиция покрытия в соответствии с любым из вышеупомянутых п.п. (1)-(4),
в которой сложноэфирное соединение представляет собой по меньшей мере одно соединение, выбранное из группы, состоящей из сложного этилового эфира бензилглицина, сложного метилового эфира бензилглицина, сложного этилового эфира аргинина, сложного метилового эфира аргинина, сложного этилового эфира бензоиларгинина, сложного метилового эфира бензоиларгинина, диэтиласпартата, метиласпартата, диметиласпартата, сложного этилового эфира глицина, сложного метилового эфира глицина, сложного этилового эфира серина и сложного метилового эфира серина.
(6) Композиция покрытия в соответствии с любым из вышеупомянутых п.п. (1)-(5), дополнительно содержащая низший спирт.
(7) Композиция покрытия в соответствии с вышеприведенным п. (6),
в которой низший спирт является глицерином.
(8) Композиция покрытия в соответствии с любым из вышеупомянутых п.п. (1)-(7),
в которой нерастворимое в воде лекарственное средство является по меньшей мере одним лекарственным средством, выбранным из группы, состоящей из паклитаксела, рапамицина, доцетаксела и эверолимуса.
(9) Композиция покрытия в соответствии с любым из вышеупомянутых п.п. (1)-(8),
в которой медицинское устройство является медицинским устройством, которое является радиально расширяющимся в просвете.
(10) Композиция покрытия в соответствии с вышеприведенным п. (9),
в которой медицинское устройство, которое является радиально расширяющимся в просвете, является катетером или стентом с раздуваемым баллончиком на конце.
(11) Слой лекарственного покрытия, который формируется по меньшей мере на части поверхности медицинского устройства при помощи композиции покрытия в соответствии с любым из вышеупомянутых п.п. (1)-(10).
(12) Элюирующее лекарственное средство медицинское устройство, имеющее наружную поверхность, покрытую композицией покрытия в соответствии с любым из вышеупомянутых п.п. (1)-(10).
(13) Способ лечения, включающий в себя:
стадию доставки медицинского устройства в соответствии с вышеприведенным п. (12) в просвет;
стадию радиального расширения медицинского устройства в просвете; и
стадию элюирования лекарственного средства из слоя лекарственного покрытия, сформированного по меньшей мере на части поверхности медицинского устройства, и обеспечения воздействия лекарственного средства на просвет.
ПОЛЕЗНЫЙ ЭФФЕКТ
[0010] В соответствии с настоящим изобретением возможно обеспечить композицию покрытия для элюирующих лекарственное средство медицинских устройств, которая гарантирует доставку лекарственного средства для лечения повреждения кровеносного сосуда, такого как рестеноз, без легкого отшелушивания лекарственного средства от медицинского устройства в процессе его доставки к ткани-мишени, быстрое высвобождение лекарственного средства к месту повреждения после доставки, а также улучшение переноса лекарственного средства к ткани-мишени.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
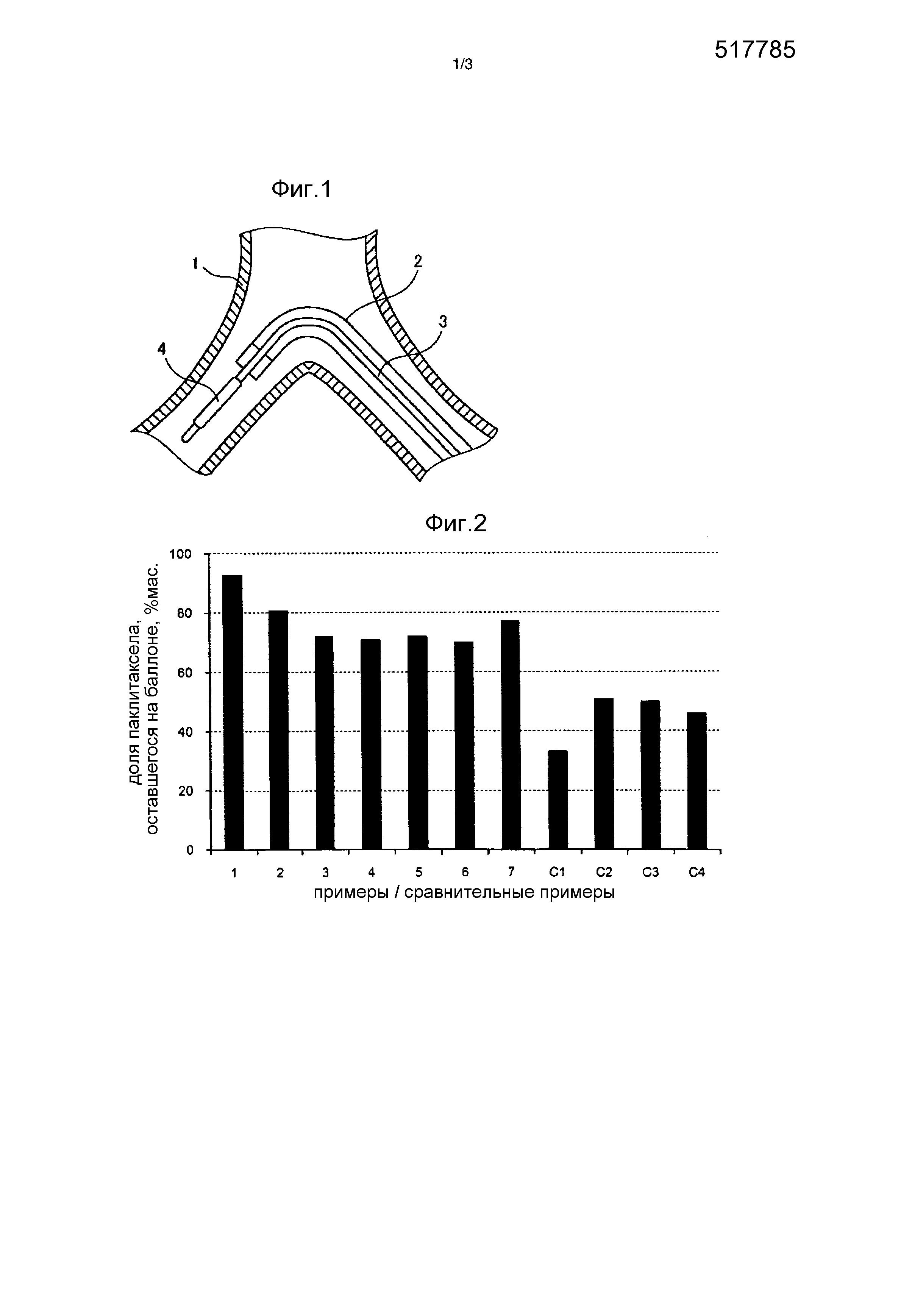
[0011] [Фиг. 1] Фиг. 1 представляет собой схематический вид в разрезе экспериментального устройства, используемого при оценке долговечности слоя лекарственного покрытия с использованием имитации кровеносного сосуда, в состоянии, в котором катетер с раздуваемым баллончиком на конце вставлен в направляющий катетер, расположенный в имитации кровеносного сосуда.
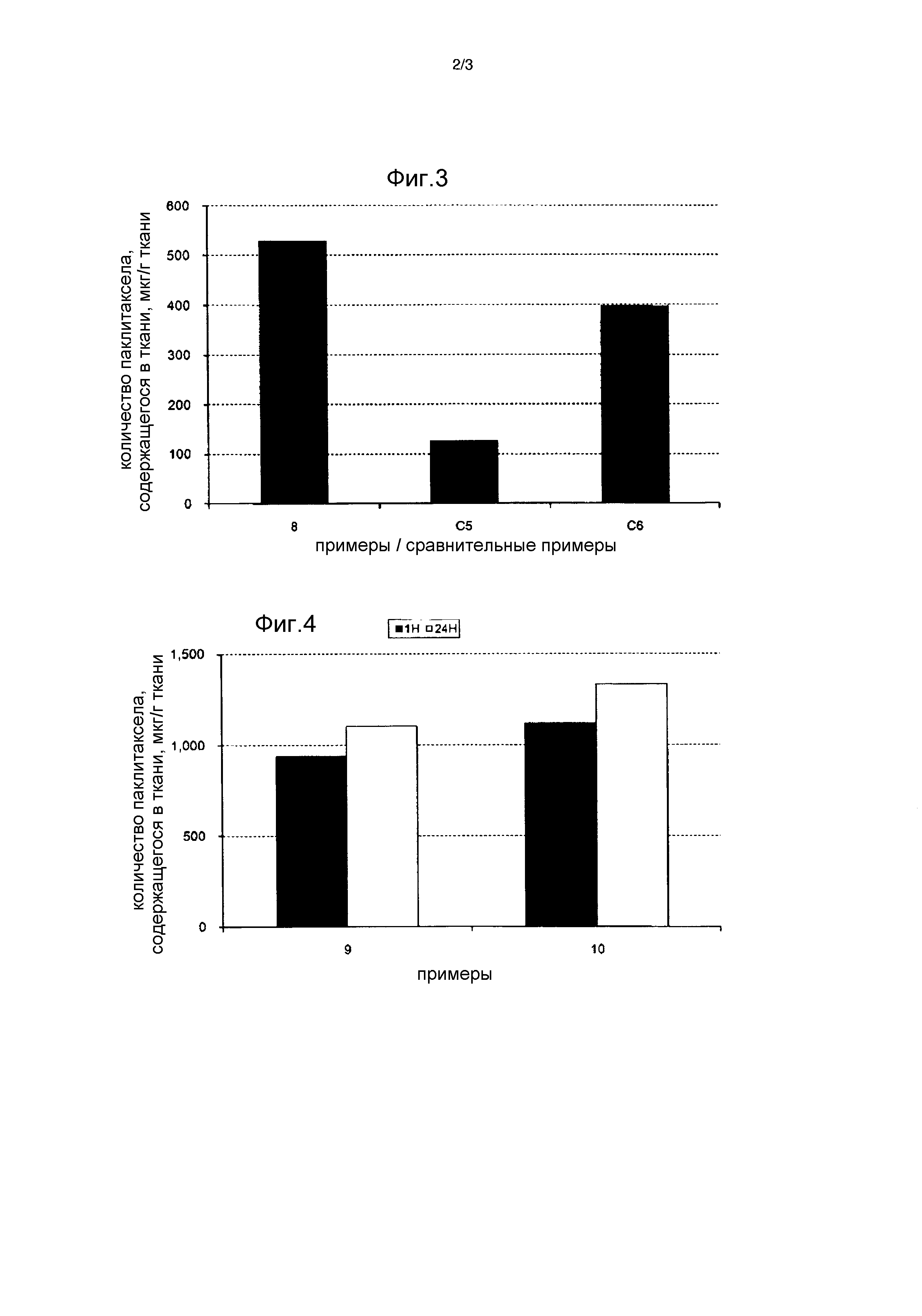
[Фиг. 2] Фиг. 2 представляет собой график, отражающий долю паклитаксела, остающегося на баллоне после операции доставки элюирующих лекарственное средство баллонов, в Примерах 1-7 и Сравнительных Примерах C1-C4 при оценке долговечности слоя лекарственного покрытия с использованием имитации кровеносного сосуда.
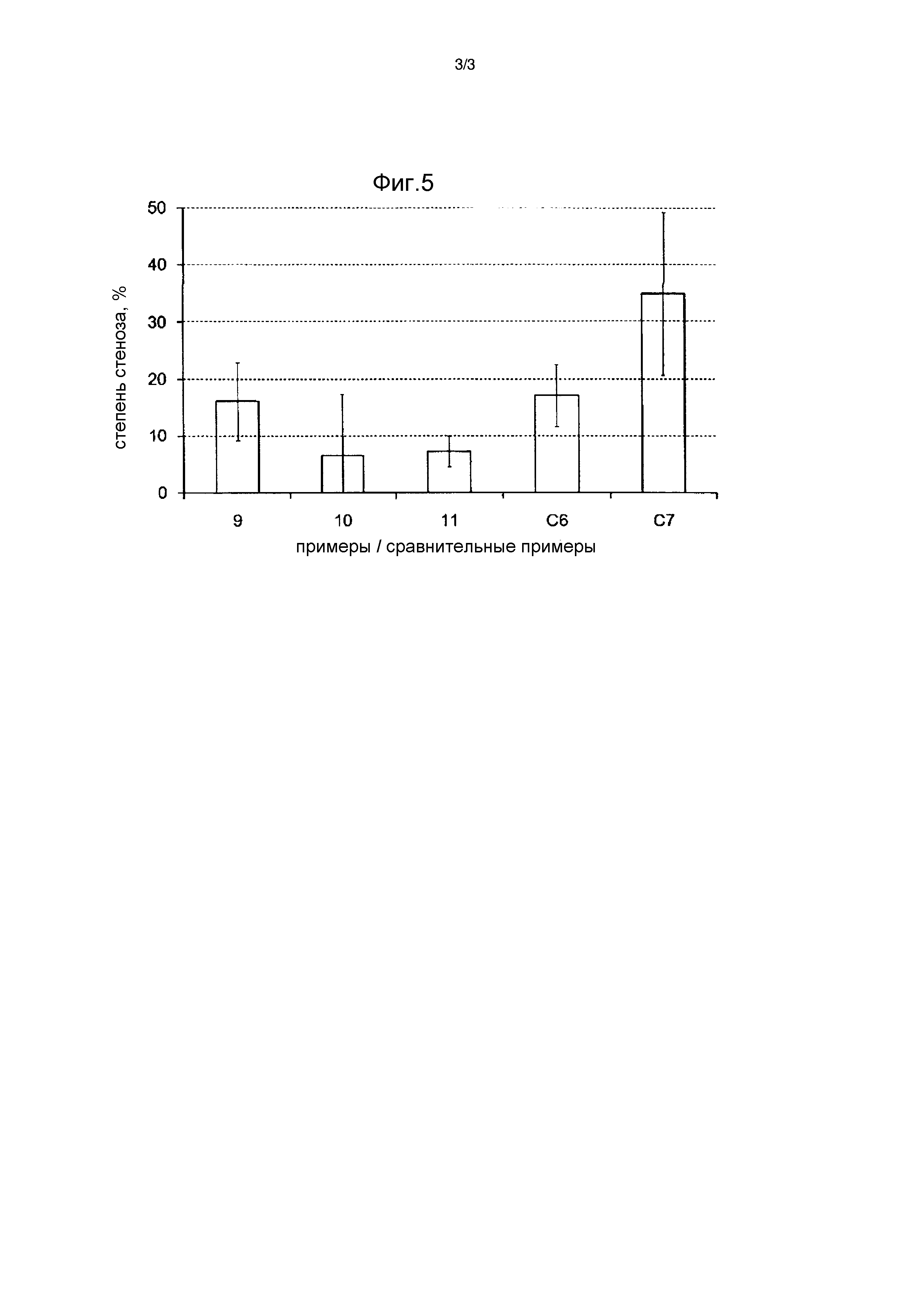
[Фиг. 3] Фиг. 3 представляет собой график, отражающий количество паклитаксела, содержащегося в ткани кровеносного сосуда, в Примере 8 и Сравнительных Примерах C5 и C6 при оценке переноса лекарственного средства к ткани в подвздошной артерии у кролика.
[Фиг. 4] Фиг. 4 представляет собой график, отражающий количество паклитаксела, остающегося в ткани кровеносного сосуда после одного часа и после 24 часов от расширения просвета кровеносного сосуда, в Примерах 9 и 10 при оценке задержания лекарственного средства в ткани брюшной аорты у кролика.
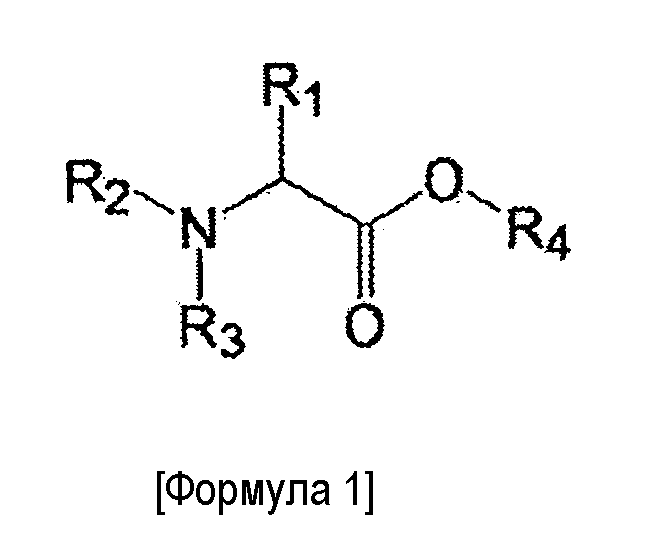
[Фиг. 5] Фиг. 5 представляет собой график, отражающий уровень стеноза в Примерах 9-11 и Сравнительных Примерах C6 и C7 при оценке эффективности в коронарной артерии свиньи.
СПОСОБ ОСУЩЕСТВЛЕНИЯ ИЗОБРЕТЕНИЯ
[0012] 1. Композиция покрытия
Композиция покрытия в соответствии с настоящим изобретением представляет собой композицию покрытия для элюирующих лекарственное средство медицинских устройств, которая содержит нерастворимое в воде лекарственное средство и по меньшей мере одно соединение, выбранное из группы, состоящей из сложноэфирных соединений аминокислот, которые имеют индекс гидрофобности боковой цепи аминокислоты, равный нулю или меньше нуля, а также их солей.
[0013] Композиция покрытия в соответствии с настоящим изобретением содержит нерастворимое в воде лекарственное средство и по меньшей мере одно соединение, выбранное из группы, состоящей из сложноэфирных соединений аминокислот, которые имеют индекс гидрофобности боковой цепи аминокислоты, равный нулю или меньше нуля, а также их солей, является смесью, в которой ингредиенты смешаны друг с другом, и является неполимерным покрытием. Эти ингредиенты не связаны друг с другом ковалентной связью.
Желательно, чтобы композиция покрытия в соответствии с настоящим изобретением наносилась равномерно, не отделялась во время доставки к пораженной части и эффективно высвобождала лекарственное средство в пораженную часть. Следовательно, является предпочтительным, чтобы низкомолекулярное соединение, смешиваемое с нерастворимым в воде лекарственным средством, являлось смешивающимся с водными и смешивающимися с водой органическими растворителями и также имело сродство к гидрофобному нерастворимому в воде лекарственному средству. С этой точки зрения низкомолекулярное соединение предпочтительно представляет собой сложноэфирное соединение аминокислоты, имеющей боковую цепь с индексом гидрофобности, равным нулю или меньшим нуля, и/или его соль.
С другой стороны, например, сложный эфир лимонной кислоты или ему подобные содержит в своей молекуле три карбоксильные группы, и предполагается, что этерификация части карбоксильных групп значительно понижает полярность сложного эфира лимонной кислоты или ему подобных. В результате, хотя сродство сложного эфира лимонной кислоты или ему подобных к нерастворимому в воде лекарственному средству увеличивается, сложный эфир лимонной кислоты или ему подобные уменьшает свою полярность и усиливает гидрофобное взаимодействие с нерастворимым в воде лекарственным средством, так что молекулы лекарственного средства становятся склонными к агрегированию. В дополнение к этому затрудняется высвобождение лекарственного средства с поверхности баллона в пораженную часть. Таким образом, предполагается, что благоприятная композиция покрытия не может быть получена.
[0014] (1) Нерастворимое в воде лекарственное средство
Нерастворимое в воде лекарственное средство означает лекарственное средство, которое нерастворимо или трудно растворимо в воде, в частности лекарственное средство, которое имеет растворимость в воде меньше, чем 5 мг/мл, при значении pH в диапазоне от 5 до 8. Растворимость может быть меньше, чем 1 мг/мл, или может даже быть меньше, чем 0,1 мг/мл. Нерастворимое в воде лекарственное средство включает в себя жирорастворимые лекарственные средства.
[0015] Предпочтительные примеры нерастворимого в воде лекарственного средства включают в себя иммунодепрессанты, например, циклоспорины, включающие в себя циклоспорин, иммуноусилители, такие как рапамицин и т.д., канцеростатические средства, такие как паклитаксел и т.д., противовирусные средства или бактерицидные добавки, противоопухолевые средства, болеутоляющие и противовоспалительные средства, антибиотики, антиэпилептики, анксиолитические вещества, антипаралитические средства, антагонисты, вещества, блокирующие нейроны, антихолинергические и холинергические вещества, антагонисты мускарина и мускариновые агенты, антиадренергические вещества, антиаритмические средства, гипотензивные средства, гормональные препараты и пищевые добавки.
[0016] Нерастворимое в воде лекарственное средство предпочтительно представляет собой по меньшей мере одно лекарственное средство, выбранное из группы, состоящей из рапамицина, паклитаксела, доцетаксела и эверолимуса. Рапамицин, паклитаксел, доцетаксел и эверолимус включают в себя их аналоги и/или производные при условии, что аналоги и/или производные обладают лекарственным действием, эквивалентным оригиналу. Например, паклитаксел и доцетаксел являются аналогами, тогда как рапамицин и эверолимус соотносятся друг с другом как производные. Среди этих лекарственных средств более предпочтительным является паклитаксел.
[0017] Композиция покрытия в соответствии с настоящим изобретением содержит нерастворимое в воде лекарственное средство предпочтительно в концентрации от 5 до 60 мг/мл, более предпочтительно от 20 до 50 мг/мл и еще более предпочтительно от 30 до 40 мг/мл.
[0018] (2) Сложноэфирные соединения аминокислот, которые имеют индекс гидрофобности боковой цепи аминокислоты, равный нулю или меньше нуля, и их соли
2-1) Индекс гидрофобности боковой цепи аминокислоты
Индекс гидрофобности (HI) боковой цепи аминокислоты представляет гидрофобность или гидрофильность боковой цепи аминокислоты. Чем выше численное значение индекса гидрофобности боковой цепи аминокислоты, тем более гидрофобной является аминокислота. В дальнейшем индекс гидрофобности боковой цепи аминокислоты может упоминаться просто как «индекс гидрофобности».
В настоящем изобретении индекс гидрофобности представляет собой индекс гидрофобности в соответствии с публикацией Kyte and Doolittle, J. Mol. Biol., 157, 105-132 (1982).
Индекс гидрофобности особенно не ограничивается при условии, что его значение не превышает нуля.
Таблица 1 показывает значения индекса гидрофобности типичных аминокислот. В таблице 1 «Аминокислота» означает аминокислоту, «номер по реестру CAS» означает регистрационный номер аминокислоты по реестру CAS, и «индекс гидрофобности» означает индекс гидрофобности HI.
[0019] [Таблица 1]

[0020] 2-2) Сложноэфирные соединения аминокислот и их соли
Аминокислоты особенно не ограничиваются при условии, что значение индекса гидрофобности их боковой цепи не превышает нуля; предпочтительно, однако, аминокислоты являются α-аминокислотами.
В дополнение к этому, сложноэфирные соединения особенно не ограничиваются при условии, что они являются сложноэфирными соединениями аминокислот, значение индекса гидрофобности боковой цепи которых не превышает нуля. Предпочтительно, однако, сложноэфирные соединения являются сложноэфирными соединениями α-аминокислот. Более предпочтительно сложноэфирные соединения представляют собой сложноэфирные соединения по меньшей мере одной аминокислоты и одноатомного спирта, содержащего до пяти атомов углерода, причем по меньшей мере одна аминокислота выбирается из группы, состоящей из глицина, серина, аспарагина, аспартовой кислоты, глютамина, глутаминовой кислоты, аргинина, треонина, гистидина, бетаина, тирозина, триптофана, аминокислот, полученных путем замены по меньшей мере одного из водородных атомов аминогруппы в α-положении в вышеупомянутых аминокислотах алкильной группой, содержащей вплоть до пяти атомов углерода, бензильной группой или бензоильной группой, пролина и аминокислот, полученных путем замены водородного атома имино-группы пролина алкильной группой, содержащей вплоть до пяти атомов углерода, бензильной группой или бензоильной группой. Дополнительно является предпочтительным, чтобы сложноэфирные соединения являлись сложноэфирными соединениями, представленными следующей формулой:
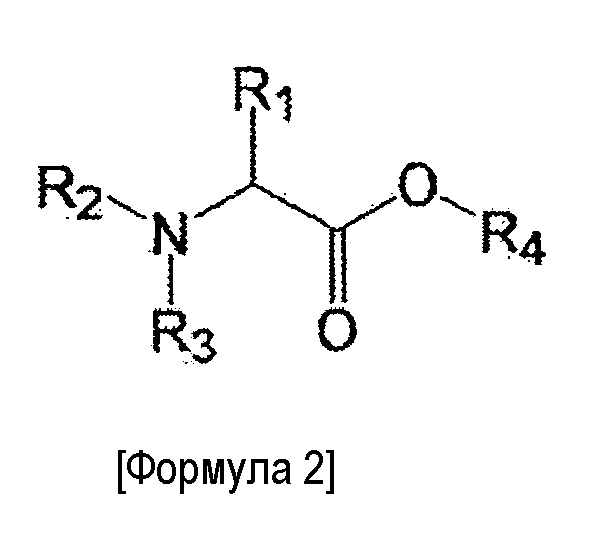
где R1 представляет собой водородный атом, гуанидинпропильную группу, карбамоилметильную группу, карбоксиметильную группу, метоксикарбонилметильную группу, этоксикарбонилметильную группу, 2-карбамоилэтильную группу, 2-карбоксиэтильную группу, 2-метоксикарбонилэтильную группу, 2-этоксикарбонилэтильную группу, (1H-имидазол-4-ил)метильную группу, 4-аминобутильную группу, гидроксиметильную группу, 1-гидроксиэтильную группу, (1H-индол-3-ил)метильную группу или 4-гидроксибензильную группу или образует триметиленовую группу с радикалом R2, R2 представляет собой водородный атом или формирует триметиленовую группу с радикалом R1, R3 представляет собой водородный атом, алкильную группу, содержащую до пяти атомов углерода, бензильную группу или бензоильную группу, и R4 представляет собой алкильную группу, содержащую до пяти атомов углерода. Еще более предпочтительно сложноэфирное соединение представляет собой по меньшей мере одно соединение, выбранное из группы, состоящей из сложного этилового эфира бензилглицина, сложного метилового эфира бензилглицина, сложного этилового эфира аргинина, сложного метилового эфира аргинина, сложного этилового эфира бензоиларгинина, сложного метилового эфира бензоиларгинина, диэтиласпартата, метиласпартата, диметиласпартата, сложного этилового эфира глицина, сложного метилового эфира глицина, сложного этилового эфира серина и сложного метилового эфира серина.
[0021] Соли сложноэфирных соединений особо не ограничиваются; однако, соли предпочтительно являются гидрохлоридами или ацетатами, более предпочтительно гидрохлоридами. Кроме того, в том случае, когда имеется свободная карбоксильная группа, которая не является частью сложноэфирной связи, соли сложноэфирных соединений могут быть солями щелочного металла, где щелочной металл предпочтительно является натрием.
[0022] Соль сложноэфирного соединения аминокислоты имеет увеличенную полярность (водорастворимость) за счет соли аминогруппы, например, гидрохлорида аминогруппы. В дополнение к этому, соль сложноэфирного соединения аминокислоты может обладать различными свойствами, такими как гидрофильность или гидрофобность, а также основными или кислотными свойствами, в зависимости от свойств боковой цепи или цепей аминокислоты. В настоящем изобретении сложноэфирные соединения аминокислот и их соли особенно не ограничиваются при условии, что у них есть боковая цепь, значение индекса гидрофобности которой не превышает нуля. Предпочтительно, однако, сложноэфирные соединения аминокислот и их соли являются полярными. Более предпочтительно, сложноэфирные соединения аминокислот и их соли являются полярными и нейтральными с точки зрения подавления разложения, такого как гидролиз, самих этих соединений и/или нерастворимого в воде лекарственного средства, сосуществующего с ними. Таким образом, в настоящем изобретении сложноэфирные соединения аминокислот и их соли могут иметь полярность согласно свойствам их боковых цепей и полярности аминогруппы. В дополнение к этому, они имеют различные виды полярности в зависимости от вида боковой цепи аминокислоты и могут давать благоприятные композиции покрытия.
[0023] Композиция покрытия в соответствии с настоящим изобретением содержит сложноэфирное соединение и/или его соли в общем количестве предпочтительно от 5 до 200 массовых частей, более предпочтительно от 8 до 150 массовых частей и еще более предпочтительно от 12 до 120 массовых частей на 100 массовых частей нерастворимого в воде лекарственного средства.
[0024] (3) Другие предпочтительные ингредиенты
Предпочтительно, композиция покрытия в соответствии с настоящим изобретением дополнительно содержит низший спирт. Когда композиция покрытия содержит низший спирт, способность нерастворимого в воде лекарственного средства проникать в кровеносные сосуды может быть увеличена, а также может быть увеличена однородность слоя лекарственного покрытия. Низший спирт особенно не ограничивается при условии, что он является спиртом, содержащим до пяти атомов углерода. Предпочтительно низший спирт представляет собой триол или тетраол, содержащий до пяти атомов углерода. Более предпочтительно низший спирт представляет собой глицерин (также называемый «пропан-1,2,3-триол»), 1,2,4-бутантриол (также называемый «бутан-1,2,4-триол») или эритрит (также называемый «(2R,3S)-бутан-1,2,3,4-тетраол»). Наиболее предпочтительно низший спирт представляет собой глицерин.
[0025] В случае, когда композиция покрытия в соответствии с настоящим изобретением содержит низший спирт, его содержание особенно не ограничивается. Содержание низшего спирта предпочтительно составляет от 10 до 500 массовых частей, более предпочтительно от 30 до 300 массовых частей и еще более предпочтительно от 50 до 200 массовых частей на 100 массовых частей нерастворимого в воде лекарственного средства.
[0026] (4) Другие ингредиенты, которые могут содержаться
В дополнение к вышеупомянутым ингредиентам композиция покрытия в соответствии с настоящим изобретением может содержать растворитель для этих ингредиентов, такой как вода, этанол, ацетон, тетрагидрофуран и т.д. Кроме того, композиция покрытия может содержать другие добавки при условии, что добавки не ухудшают эффект настоящего изобретения.
[0027] 2. Слой лекарственного покрытия
Слой лекарственного покрытия в настоящем изобретении представляет собой слой, сформированный по меньшей мере на части поверхности медицинского устройства при помощи композиции покрытия в соответствии с настоящим изобретением. Слой лекарственного покрытия представляет собой слой, который содержит нерастворимое в воде лекарственное средство и по меньшей мере одно соединение, выбранное из группы, состоящей из сложноэфирных соединений аминокислот, которые имеют индекс гидрофобности боковой цепи аминокислоты, равный нулю или меньше нуля, а также их солей.
[0028] Слой лекарственного покрытия может быть сформирован путем покрытия поверхности медицинского устройства композицией покрытия в соответствии с настоящим изобретением с последующей сушкой этого покрытия. Этот способ, однако, не является ограничивающим.
[0029] Количество лекарственного средства, содержащегося в слое лекарственного покрытия, особенно не ограничивается. Лекарственное средство предпочтительно содержится в слое лекарственного покрытия с плотностью от 0,1 до 10 мкг/мм2, более предпочтительно от 0,5 до 5 мкг/мм2 еще более предпочтительно от 0,5 до 3,5 мкг/мм2 и наиболее предпочтительно от 1,0 до 3,0 мкг/мм2.
[0030] 3. Элюирующее лекарственное средство медицинское устройство
Элюирующее лекарственное средство медицинское устройство в настоящем изобретении имеет слой лекарственного покрытия либо непосредственно на его поверхности, либо на его поверхности, предварительно обработанной органическим растворителем, обработанной распылением грунтовки, облученной ультрафиолетовыми лучами и т.п. Медицинское устройство предпочтительно представляет собой медицинское устройство, которое радиально (круговым образом) расширяется в просвете, таком как кровеносный сосуд, и более предпочтительно представляет собой катетер с раздуваемым баллончиком на конце или стент.
[0031] По меньшей мере на части поверхности элюирующего лекарственное средство медицинского устройства в настоящем изобретении формируется слой лекарственного покрытия, который содержит нерастворимое в воде лекарственное средство и по меньшей мере одно соединение, выбранное из группы, состоящей из сложноэфирных соединений аминокислот, которые имеют индекс гидрофобности боковой цепи аминокислоты, равный нулю или меньше нуля, а также их солей. Слой лекарственного покрытия имеет высокое сродство к поверхности медицинского устройства так, чтобы он был нечувствительным к отшелушиванию или отделению от поверхности медицинского устройства во время процесса доставки медицинского устройства. Кроме того, слой лекарственного покрытия также имеет высокое сродство к поврежденной ткани, так что ожидается, что лекарственное средство будет быстро элюироваться в ткань-мишень. В случае катетера с раздуваемым баллончиком на конце слой лекарственного покрытия формируется по меньшей мере на части наружной поверхности расширяющейся части (баллона). Кроме того, в случае стента слой лекарственного покрытия формируется по меньшей мере на части наружной поверхности расширяющейся части.
[0032] Материал расширяющейся части медицинского устройства предпочтительно представляет собой материал, который имеет определенную степень гибкости и имеет определенную степень жесткости, так что по прибытию в кровеносный сосуд, ткань и т.п. расширяющаяся часть растягивается так, чтобы лекарственное средство могло быть высвобождено из слоя лекарственного покрытия, присутствующего на поверхности расширяющейся части. В частности, поверхность расширяющейся части, на которой предусматривается слой лекарственного покрытия, формируется из смолы. Смола, составляющая поверхность расширяющейся части, особенно не ограничивается, и предпочтительные примеры материала включают в себя полиамиды. Другими словами, по меньшей мере часть поверхности расширяющейся части медицинского устройства, которая будет покрыта лекарственным средством, делается из полиамида. Полиамид особенно не ограничивается при условии, что он представляет собой полимер, имеющий амидную связь. Примеры полиамида включают в себя ароматические полиамиды, например, гомополимеры, такие как политетраметиленадипамид (нейлон 46), поликапролактам (нейлон 6), полигексаметиленадипамид (нейлон 66), полигексаметиленсебацамид (нейлон 610), полигексаметилендодекамид (нейлон 612), полиундеканолактам (нейлон 11), полидодеканолактам (нейлон 12) и т.д., сополимеры, такие как сополимер капролактама/лауриллактама (нейлон 6/12), сополимер капролактама/аминоундекановой кислоты (нейлон 6/11), сополимер капролактама/ω-аминононановой кислоты (нейлон 6/9), сополимер капролактама/гексаметилендиаммонийадипата (нейлон 6/66) и т.д., сополимер адипиновой кислоты с метаксилендиамином, а также сополимеры гексаметилендиамина с м-,п-фталевыми кислотами и т.д. Кроме того, эластомеры полиамида, которые являются блок-сополимерами, имеющими в качестве твердого сегмента нейлон 6, нейлон 66, нейлон 11, нейлон 12 и т.п. и имеющими в качестве мягкого сегмента полиалкиленгликоль, простой полиэфир, алифатический полиэфир и т.п., также могут использоваться в качестве основного материала для медицинского устройства в настоящем изобретении. Полиамиды могут использоваться по отдельности, либо в виде комбинации двух или более из них.
[0033] В дополнение к этому, для других частей, кроме расширяющейся части медицинского устройства, могут быть использованы термопластические смолы, например, полиолефины, такие как полиэтилен, полипропилен, сополимер этилена и пропилена и т.д., полиэфиры, такие как полиэтилентерефталат и т.д., поливинилхлорид, сополимер этилена и винилацетата, сшитый сополимер этилена и винилацетата, полиуретан и т.д., полиамиды, полиамидные эластомеры, силиконовые каучуки, латексные каучуки и так далее.
[0034] 4. Способ лечения, в котором используется элюирующее лекарственное средство медицинское устройство
Способ лечения, в котором используется элюирующее лекарственное средство медицинское устройство в соответствии с настоящим изобретением, включает в себя стадию элюирования лекарственного средства из слоя лекарственного покрытия, сформированного по меньшей мере на части поверхности медицинского устройства. Более конкретно, способ лечения, в котором используется элюирующее лекарственное средство медицинское устройство в соответствии с настоящим изобретением, предпочтительно включает в себя: стадию доставки медицинского устройства в просвет; стадию радиального расширения медицинского устройства в просвете; и стадию элюирования лекарственного средства из слоя лекарственного покрытия, сформированного по меньшей мере на части поверхности медицинского устройства, обеспечивающую тем самым действие лекарственного средства на просвет.
Стадия доставки элюирующего лекарственное средство медицинского устройства в соответствии с настоящим изобретением в просвет может быть выполнена тем же самым образом, что и в случаях традиционно известных баллонов и стентов. Например, в случае, куда элюирующий лекарственное средство баллон или стент в соответствии с настоящим изобретением должен быть доставлен к стенозной части коронарной артерии, трубчатый направляющий катетер вставляется через запястную или бедренную артерию пациента во входную часть сердечной коронарной артерии, направляющая проволока вставляется в направляющий катетер, и катетер с раздуваемым баллончиком на конце вставляется вдоль направляющей проволоки, посредством чего баллон или стент может быть доставлен к стенозной части.
Стадия радиального расширения элюирующего лекарственное средство медицинского устройства в соответствии с настоящим изобретением в просвете может быть выполнена тем же самым образом, что и в случаях традиционно известных баллонов и стентов.
Стадия элюирования лекарственного средства из слоя лекарственного покрытия, сформированного по меньшей мере на части поверхности элюирующего лекарственное средство медицинского устройства в соответствии с настоящим изобретением для того, чтобы лекарственное средство воздействовало на просвет, может быть выполнена способом, в котором медицинское устройство, расширенное в просвете, удерживается в течение от нескольких десятков секунд до нескольких минут в расширенном состоянии или в котором стент с лекарственным покрытием постоянно размещается в просвете. Это гарантирует, что просвет будет расширен, и лекарственное средство из слоя лекарственного покрытия будет воздействовать на ткани просвета.
Способ лечения, в котором используется элюирующее лекарственное средство медицинское устройство в соответствии с настоящим изобретением, может быть применен, например, при лечении стеноза сосуда. В соответствии с этим способом лечения возможно предотвратить рестеноз путем использования в качестве лекарственного средства подавляющего пролиферацию клеток средства, такого как канцеростатическое средство (например, паклитаксел), или иммунодепрессанта.
[0035] Сложноэфирные соединения аминокислот, имеющие индекс гидрофобности боковой цепи аминокислоты, равный нулю или меньше нуля, а также их соли, которые должны содержаться в композиции покрытия в соответствии с настоящим изобретением, обладают высокой биологической совместимостью (например, они не вызывают формирования тромба) и быстро разлагаются микроорганизмами. Следовательно, становится возможным обеспечить элюирующее лекарственное средство медицинское устройство, которое также является благоприятным и с точки зрения безопасности.
ПРИМЕРЫ
[0036] Далее настоящее изобретение будет описано более подробно путем показа примеров. Следует отметить, однако, что настоящее изобретение не ограничивается следующими примерами.
[0037] [Изготовление элюирующего лекарственное средство баллона или серийное изготовление баллона]
<Примеры приготовления раствора сложного эфира аминокислоты>
(Раствор сложного этилового эфира аргинина с концентрацией 30 мг/мл)
Дигидрохлорид сложного этилового эфира L-аргинина (CAS № 36589-29-4) в количестве 60 мг был взвешен, после чего был добавлен к смеси воды и этанола, содержащей 1 мл безводного этанола и 1 мл воды, очищенной при помощи обратного осмоса, и был растворен с тем, чтобы получить раствор сложного этилового эфира L-аргинина с концентрацией 30 мг/мл.
[0038] (Раствор сложного этилового эфира Nα-бензоил-L-аргинина с концентрацией 30 мг/мл)
Гидрохлорид сложного этилового эфира Nα-бензоил-L-аргинина (CAS № 2645-08-1) в количестве 60 мг был взвешен, после чего был добавлен к смеси воды и этанола, содержащей 1 мл безводного этанола и 1 мл воды, очищенной при помощи обратного осмоса, и был растворен с тем, чтобы получить раствор сложного этилового эфира Nα-бензоил-L-аргинина с концентрацией 30 мг/мл.
[0039] (Раствор диметил-L-аспартата с концентрацией 30 мг/мл)
Гидрохлорид диметил-L-аспартата (CAS № 32213-95-9) в количестве 60 мг был взвешен, после чего был добавлен к смеси воды и этанола, содержащей 1 мл безводного этанола и 1 мл воды, очищенной при помощи обратного осмоса, и был растворен с тем, чтобы получить раствор диметил-L-аспартата с концентрацией 30 мг/мл.
[0040] (Раствор диметил-L-аспартата с концентрацией 50 мг/мл)
Гидрохлорид диметил-L-аспартата в количестве 50 мг был взвешен, после чего был добавлен к смеси воды и этанола, содержащей 0,5 мл безводного этанола и 0,5 мл воды, очищенной при помощи обратного осмоса, и был растворен с тем, чтобы получить раствор диметил-L-аспартата с концентрацией 50 мг/мл.
[0041] (Раствор сложного этилового эфира L-серина с концентрацией 30 мг/мл)
Гидрохлорид сложного этилового эфира L-серина (CAS № 26348-61-8) в количестве 60 мг был взвешен, после чего был добавлен к смеси воды и этанола, содержащей 1 мл безводного этанола и 1 мл воды, очищенной при помощи обратного осмоса, и был растворен с тем, чтобы получить раствор сложного этилового эфира L-серина с концентрацией 30 мг/мл.
[0042] (Раствор 1 сложного этилового эфира L-серина с концентрацией 70 мг/мл)
Гидрохлорид сложного этилового эфира L-серина в количестве 140 мг был взвешен, после чего был добавлен к смеси воды и этанола, содержащей 1 мл безводного этанола и 1 мл воды, очищенной при помощи обратного осмоса, и был растворен с тем, чтобы получить раствор сложного этилового эфира L-серина с концентрацией 70 мг/мл.
[0043] (Раствор 2 сложного этилового эфира L-серина с концентрацией 70 мг/мл)
Гидрохлорид сложного этилового эфира L-серина в количестве 140 мг был взвешен, после чего был добавлен к смеси воды и этанола, содержащей 1,5 мл воды, очищенной при помощи обратного осмоса, и 0,5 мл безводного этанола, и был растворен с тем, чтобы получить раствор сложного этилового эфира L-серина с концентрацией 70 мг/мл.
[0044] (Раствор 3 сложного этилового эфира L-серина с концентрацией 70 мг/мл)
Гидрохлорид сложного этилового эфира L-серина в количестве 140 мг был взвешен, после чего был добавлен к 2 мл воды, очищенной при помощи обратного осмоса, и был растворен с тем, чтобы получить раствор сложного этилового эфира L-серина с концентрацией 70 мг/мл.
[0045] (Раствор сложного этилового эфира глицина с концентрацией 30 мг/мл)
Гидрохлорид сложного этилового эфира глицина (CAS № 623-33-6) в количестве 60 мг был взвешен, после чего был добавлен к смеси воды и этанола, содержащей 1 мл безводного этанола и 1 мл воды, очищенной при помощи обратного осмоса, и был растворен с тем, чтобы получить раствор сложного этилового эфира глицина с концентрацией 30 мг/мл.
[0046] (Раствор сложного этилового эфира N-бензилглицина с концентрацией 40 мг/мл)
Гидрохлорид сложного этилового эфира N-бензилглицина (CAS № 6344-42-9) в количестве 80 мг был взвешен, после чего был добавлен к смеси воды и этанола, содержащей 1 мл безводного этанола и 1 мл воды, очищенной при помощи обратного осмоса, и был растворен с тем, чтобы получить раствор сложного этилового эфира N-бензилглицина с концентрацией 40 мг/мл.
[0047] (Раствор сложного этилового эфира L-аланина с концентрацией 40 мг/мл)
Гидрохлорид сложного этилового эфира L-аланина (CAS № 1115-59-9) в количестве 80 мг был взвешен, после чего был добавлен к смеси воды и этанола, содержащей 1 мл безводного этанола и 1 мл воды, очищенной при помощи обратного осмоса, и был растворен с тем, чтобы получить раствор сложного этилового эфира L-аланина с концентрацией 40 мг/мл.
[0048] (Раствор сложного метилового эфира L-валина с концентрацией 30 мг/мл)
Гидрохлорид сложного метилового эфира L-валина (CAS № 6306-52-1) в количестве 54 мг был взвешен, после чего был добавлен к смеси воды и этанола, содержащей 1,5 мл безводного этанола и 0,3 мл воды, очищенной при помощи обратного осмоса, и был растворен с тем, чтобы получить раствор сложного метилового эфира L-валина с концентрацией 30 мг/мл.
[0049] (Раствор сложного метилового эфира L-валина с концентрацией 50 мг/мл)
Гидрохлорид сложного метилового эфира L-валина (CAS № 6306-52-1) в количестве 90 мг был взвешен, после чего был добавлен к смеси воды и этанола, содержащей 1,5 мл безводного этанола и 0,3 мл воды, очищенной при помощи обратного осмоса, и был растворен с тем, чтобы получить раствор сложного метилового эфира L-валина с концентрацией 50 мг/мл.
[0050] <Примеры приготовления раствора аминокислоты>
(Раствор L-аргинина с концентрацией 40 мг/мл)
Гидрохлорид L-аргинина (CAS № 1119-34-2) в количестве 80 мг был взвешен, после чего был добавлен к смеси воды и этанола, содержащей 1 мл безводного этанола и 1 мл воды, очищенной при помощи обратного осмоса, и был растворен с тем, чтобы получить раствор L-аргинина с концентрацией 40 мг/мл.
[0051] (Раствор L-серина с концентрацией 70 мг/мл)
L-серин (CAS № 56-45-1) в количестве 70 мг был взвешен и был добавлен к 1 мл воды, очищенной при помощи обратного осмоса, и был растворен с тем, чтобы получить раствор L-серина с концентрацией 70 мг/мл.
[0052] <Примеры приготовления раствора паклитаксела>
(Раствор паклитаксела с концентрацией 20 мг/мл)
Паклитаксел (CAS № 33069-62-4) в количестве 40 мг был взвешен, после чего был добавлен к смеси ацетона и этанола, содержащей 1 мл безводного этанола и 1 мл ацетона, и был растворен с тем, чтобы получить раствор паклитаксела с концентрацией 20 мг/мл.
[0053] (Раствор 1 паклитаксела с концентрацией 40 мг/мл)
Паклитаксел (CAS № 33069-62-4) в количестве 80 мг был взвешен, после чего был добавлен к смеси ацетона и этанола, содержащей 1 мл безводного этанола и 1 мл ацетона, и был растворен с тем, чтобы получить раствор 1 паклитаксела с концентрацией 40 мг/мл.
[0054] (Раствор 2 паклитаксела с концентрацией 40 мг/мл)
Паклитаксел в количестве 160 мг был взвешен, после чего был добавлен к 4 мл тетрагидрофурана (CAS № 109-99-9) и был растворен с тем, чтобы получить раствор 2 паклитаксела с концентрацией 40 мг/мл.
[0055] (Раствор 1 паклитаксела с концентрацией 56 мг/мл)
Паклитаксел в количестве 336 мг был взвешен, после чего был добавлен к 6 мл тетрагидрофурана и был растворен с тем, чтобы получить раствор 1 паклитаксела с концентрацией 56 мг/мл.
[0056] (Раствор 2 паклитаксела с концентрацией 56 мг/мл)
Паклитаксел в количестве 224 мг был взвешен, после чего был добавлен к смеси тетрагидрофурана и этанола, содержащей 2,66 мл тетрагидрофурана и 1,34 мл безводного этанола, и был растворен с тем, чтобы получить раствор 2 паклитаксела с концентрацией 56 мг/мл.
[0057] (Раствор 3 паклитаксела с концентрацией 56 мг/мл)
Паклитаксел в количестве 336 мг был взвешен, после чего был добавлен к смеси тетрагидрофурана и этанола, содержащей 4 мл тетрагидрофурана и 2 мл безводного этанола, и был растворен с тем, чтобы получить раствор 3 паклитаксела с концентрацией 56 мг/мл.
[0058] (Раствор 4 паклитаксела с концентрацией 56 мг/мл)
Паклитаксел в количестве 224 мг был взвешен, после чего был добавлен к смеси тетрагидрофурана и этанола, содержащей 2 мл тетрагидрофурана и 2 мл безводного этанола, и был растворен с тем, чтобы получить раствор 4 паклитаксела с концентрацией 56 мг/мл.
[0059] (Раствор 5 паклитаксела с концентрацией 56 мг/мл)
Паклитаксел в количестве 448 мг был взвешен, после чего был добавлен к смеси ацетона и этанола, содержащей 4 мл безводного этанола и 4 мл ацетона, и был растворен с тем, чтобы получить раствор 5 паклитаксела с концентрацией 56 мг/мл.
[0060] <Примеры приготовления раствора глицерина>
(Раствор 1 глицерина с концентрацией 50%)
Глицерин (CAS № 56-81-5) в количестве 100 мкл и безводный этанол в количестве 100 мкл были смешаны вместе для того, чтобы подготовить раствор 1 глицерина с концентрацией 50%.
[0061] (Раствор 2 глицерина с концентрацией 50%)
Глицерин в количестве 500 мкл и безводный этанол в количестве 500 мкл были смешаны вместе для того, чтобы подготовить раствор 2 глицерина с концентрацией 50%.
[0062] <ПРИМЕР 1>
(1) Подготовка пленкообразующего раствора 1
Раствор сложного этилового эфира N-бензилглицина с концентрацией 40 мг/мл в количестве 25 мкл был смешан со 150 мкл раствора 1 паклитаксела с концентрацией 40 мг/мл и 25 мкл безводного этанола для того, чтобы подготовить пленкообразующий раствор 1. Массовое отношение сложного этилового эфира бензилглицина к паклитакселу (BnGly-OEt/PTX) в пленкообразующем растворе 1 составляло 0,50.
(2) Покрытие баллона лекарственным средством
Был подготовлен катетер с раздуваемым баллончиком на конце (производства компании Terumo Corporation, материал баллона (расширяющаяся часть) - нейлоновый эластомер), расширяющаяся часть которого имеет 3,0 мм в диаметре и 20 мм в длину в раздутом состоянии. Баллон в его раздутом состоянии при помощи пипетки был покрыт пленкообразующим раствором 1 так, чтобы количество паклитаксела составляло приблизительно 2 мкг/мм2, после чего он был высушен для того, чтобы получить элюирующий лекарственное средство баллон.
[0063] <ПРИМЕР 2>
(1) Подготовка пленкообразующего раствора 2
Раствор сложного этилового эфира L-аргинина с концентрацией 30 мг/мл в количестве 50 мкл был смешан с 60 мкл раствора 1 паклитаксела с концентрацией 40 мг/мл для того, чтобы подготовить пленкообразующий раствор 2. Массовое отношение сложного этилового эфира аргинина к паклитакселу (Arg-OEt/PTX) в пленкообразующем растворе 2 составляло 0,63.
(2) Покрытие баллона лекарственным средством
Элюирующий лекарственное средство баллон был произведен тем же самым образом, что и в Примере 1, за исключением того, что вместо пленкообразующего раствора 1 использовался пленкообразующий раствор 2.
[0064] <ПРИМЕР 3>
(1) Подготовка пленкообразующего раствора 3
Раствор сложного этилового эфира Nα-бензоил-L-аргинина с концентрацией 30 мг/м в количестве 50 мкл был смешан с 50 мкл раствора 1 паклитаксела с концентрацией 40 мг/мл для того, чтобы подготовить пленкообразующий раствор 3. Массовое отношение сложного этилового эфира Nα-бензоил-L-аргинина к паклитакселу (BzArg-OEt/PTX) в пленкообразующем растворе 3 составляло 0,75.
(2) Покрытие баллона лекарственным средством
Элюирующий лекарственное средство баллон был произведен тем же самым образом, что и в Примере 1, за исключением того, что вместо пленкообразующего раствора 1 использовался пленкообразующий раствор 3.
[0065] <ПРИМЕР 4>
(1) Подготовка пленкообразующего раствора 4
Раствор диметил-L-аспартата с концентрацией 30 мг/мл в количестве 50 мкл был смешан с 75 мкл раствора 1 паклитаксела с концентрацией 40 мг/мл для того, чтобы подготовить пленкообразующий раствор 4. Массовое отношение диметил-L-аспартата к паклитакселу (Asp-DiOMe/PTX) в пленкообразующем растворе 4 составляло 0,63.
(2) Покрытие баллона лекарственным средством
Элюирующий лекарственное средство баллон был произведен тем же самым образом, что и в Примере 1, за исключением того, что вместо пленкообразующего раствора 1 использовался пленкообразующий раствор 4.
[0066] <ПРИМЕР 5>
(1) Подготовка пленкообразующего раствора 5
Раствор сложного этилового эфира глицина с концентрацией 30 мг/мл в количестве 50 мкл был смешан с 110 мкл раствора 1 паклитаксела с концентрацией 40 мг/мл для того, чтобы подготовить пленкообразующий раствор 5. Массовое отношение сложного этилового эфира глицина к паклитакселу (Gly-OEt/PTX) в пленкообразующем растворе 5 составляло 0,63.
(2) Покрытие баллона лекарственным средством
Элюирующий лекарственное средство баллон был произведен тем же самым образом, что и в Примере 1, за исключением того, что вместо пленкообразующего раствора 1 использовался пленкообразующий раствор 5.
[0067] <ПРИМЕР 6>
(1) Подготовка пленкообразующего раствора 6
Раствор сложного этилового эфира L-серина с концентрацией 30 мг/мл в количестве 50 мкл был смешан с 90 мкл раствора 1 паклитаксела с концентрацией 40 мг/мл для того, чтобы подготовить пленкообразующий раствор 6. Массовое отношение сложного этилового эфира L-серина к паклитакселу (Ser-OEt/PTX) в пленкообразующем растворе 6 составляло 0,42.
(2) Покрытие баллона лекарственным средством
Элюирующий лекарственное средство баллон был произведен тем же самым образом, что и в Примере 1, за исключением того, что вместо пленкообразующего раствора 1 использовался пленкообразующий раствор 6.
[0068] <ПРИМЕР 7>
(1) Подготовка пленкообразующего раствора 7
Раствор сложного этилового эфира L-аргинина с концентрацией 30 мг/мл в количестве 160 мкл был смешан с 200 мкл раствора 1 паклитаксела с концентрацией 40 мг/мл и 20 мкл раствора 1 глицерина с концентрацией 50% для того, чтобы подготовить пленкообразующий раствор 7. Массовое отношение сложного этилового эфира L-аргинина к паклитакселу (Arg-OEt/PTX) в пленкообразующем растворе 7 составляло 0,60.
Пленкообразующий раствор 7 является пленкообразующим раствором, который в дополнение к сложному этиловому эфиру L-аргинина (Arg-OEt; имеющему индекс гидрофобности боковой цепи аминокислоты, равный -4,5) и паклитакселу (PTX) содержит глицерин.
(2) Покрытие баллона лекарственным средством
Элюирующий лекарственное средство баллон был произведен тем же самым образом, что и в Примере 1, за исключением того, что вместо пленкообразующего раствора 1 использовался пленкообразующий раствор 7.
[0069] <ПРИМЕР 8>
(1) Подготовка пленкообразующего раствора 8
Раствор диметил-L-аспартата с концентрацией 50 мг/мл в количестве 90 мкл был смешан с 240 мкл раствора 2 паклитаксела с концентрацией 40 мг/мл для того, чтобы подготовить пленкообразующий раствор 8. Массовое отношение диметил-L-аспартата к паклитакселу (Asp-DiOMe/PTX) в пленкообразующем растворе 8 составляло 0,47.
(2) Покрытие баллона лекарственным средством
Элюирующий лекарственное средство баллон был произведен тем же самым образом, что и в Примере 1, за исключением того, что вместо пленкообразующего раствора 1 использовался пленкообразующий раствор 8, а также того, что покрытие проводилось так, чтобы количество паклитаксела составляло приблизительно 3 мкг/мм2.
[0070] <ПРИМЕР 9>
(1) Подготовка пленкообразующего раствора 9
Раствор 1 сложного этилового эфира L-серина с концентрацией 70 мг/мл в количестве 80 мкл был смешан с 240 мкл раствора 1 паклитаксела с концентрацией 56 мг/мл и 16 мкл раствора 2 глицерина с концентрацией 50% для того, чтобы подготовить пленкообразующий раствор 9. Массовое отношение сложного этилового эфира L-серина к паклитакселу (Ser-OEt/PTX) в пленкообразующем растворе 9 составляло 0,42.
(2) Покрытие баллона лекарственным средством
Элюирующий лекарственное средство баллон был произведен тем же самым образом, что и в Примере 1, за исключением того, что вместо пленкообразующего раствора 1 использовался пленкообразующий раствор 9, а также того, что покрытие проводилось так, чтобы количество паклитаксела составляло приблизительно 3 мкг/мм2.
[0071] <ПРИМЕР 10>
(1) Подготовка пленкообразующего раствора 10
Раствор 1 сложного этилового эфира L-серина с концентрацией 70 мг/мл в количестве 80 мкл был смешан с 240 мкл раствора 1 паклитаксела с концентрацией 56 мг/мл для того, чтобы подготовить пленкообразующий раствор 10. Массовое отношение сложного этилового эфира L-серина к паклитакселу (Ser-OEt/PTX) в пленкообразующем растворе 10 составляло 0,42.
(2) Покрытие баллона лекарственным средством
Элюирующий лекарственное средство баллон был произведен тем же самым образом, что и в Примере 1, за исключением того, что вместо пленкообразующего раствора 1 использовался пленкообразующий раствор 10, а также того, что покрытие проводилось так, чтобы количество паклитаксела составляло приблизительно 3 мкг/мм2.
[0072] <ПРИМЕР 11>
(1) Подготовка пленкообразующего раствора 11
Раствор 1 сложного этилового эфира L-серина с концентрацией 70 мг/мл в количестве 800 мкл был смешан с 2400 мкл раствора 2 паклитаксела с концентрацией 56 мг/мл для того, чтобы подготовить пленкообразующий раствор 11. Массовое отношение сложного этилового эфира L-серина к паклитакселу (Ser-OEt/PTX) в пленкообразующем растворе 11 составляло 0,42.
(2) Покрытие баллона лекарственным средством
Элюирующий лекарственное средство баллон был произведен тем же самым образом, что и в Примере 1, за исключением того, что вместо пленкообразующего раствора 1 использовался пленкообразующий раствор 11, а также того, что покрытие проводилось так, чтобы количество паклитаксела составляло приблизительно 3 мкг/мм2.
[0073] <ПРИМЕР 12>
(1) Подготовка пленкообразующего раствора 12
Раствор 1 сложного этилового эфира L-серина с концентрацией 70 мг/мл в количестве 600 мкл был смешан с 1800 мкл раствора 5 паклитаксела с концентрацией 56 мг/мл для того, чтобы подготовить пленкообразующий раствор 12. Массовое отношение сложного этилового эфира L-серина к паклитакселу (Ser-OEt/PTX) в пленкообразующем растворе 12 составляло 0,42.
(2) Покрытие баллона лекарственным средством
Элюирующий лекарственное средство баллон был произведен тем же самым образом, что и в Примере 1, за исключением того, что вместо пленкообразующего раствора 1 использовался пленкообразующий раствор 12, а также того, что покрытие проводилось так, чтобы количество паклитаксела составляло приблизительно 3 мкг/мм2.
[0074] <ПРИМЕР 13>
(1) Подготовка пленкообразующего раствора 13
Раствор 1 сложного этилового эфира L-серина с концентрацией 70 мг/мл в количестве 600 мкл был смешан с 1800 мкл раствора 3 паклитаксела с концентрацией 56 мг/мл для того, чтобы подготовить пленкообразующий раствор 13. Массовое отношение сложного этилового эфира L-серина к паклитакселу (Ser-OEt/PTX) в пленкообразующем растворе 13 составляло 0,42.
(2) Покрытие баллона лекарственным средством
Элюирующий лекарственное средство баллон был произведен тем же самым образом, что и в Примере 1, за исключением того, что вместо пленкообразующего раствора 1 использовался пленкообразующий раствор 13, а также того, что покрытие проводилось так, чтобы количество паклитаксела составляло приблизительно 3 мкг/мм2.
[0075] <ПРИМЕР 14>
(1) Подготовка пленкообразующего раствора 14
Раствор 2 сложного этилового эфира L-серина с концентрацией 70 мг/мл в количестве 500 мкл был смешан с 1500 мкл раствора 4 паклитаксела с концентрацией 56 мг/мл для того, чтобы подготовить пленкообразующий раствор 14. Массовое отношение сложного этилового эфира L-серина к паклитакселу (Ser-OEt/PTX) в пленкообразующем растворе 14 составляло 0,42.
(2) Покрытие баллона лекарственным средством
Элюирующий лекарственное средство баллон был произведен тем же самым образом, что и в Примере 1, за исключением того, что вместо пленкообразующего раствора 1 использовался пленкообразующий раствор 14, а также того, что покрытие проводилось так, чтобы количество паклитаксела составляло приблизительно 3 мкг/мм2.
[0076] <ПРИМЕР 15>
(1) Подготовка пленкообразующего раствора 15
Раствор 3 сложного этилового эфира L-серина с концентрацией 70 мг/мл в количестве 500 мкл был смешан с 1500 мкл раствора 4 паклитаксела с концентрацией 56 мг/мл для того, чтобы подготовить пленкообразующий раствор 15. Массовое отношение сложного этилового эфира L-серина к паклитакселу (Ser-OEt/PTX) в пленкообразующем растворе 15 составляло 0,42.
(2) Покрытие баллона лекарственным средством
Элюирующий лекарственное средство баллон был произведен тем же самым образом, что и в Примере 1, за исключением того, что вместо пленкообразующего раствора 1 использовался пленкообразующий раствор 15, а также того, что покрытие проводилось так, чтобы количество паклитаксела составляло приблизительно 3 мкг/мм2.
[0077] <СРАВНИТЕЛЬНЫЙ ПРИМЕР C1>
(1) Подготовка раствора 16 паклитаксела
Раствор сложного этилового эфира L-аланина с концентрацией 40 мг/мл в количестве 60 мкл был смешан с 50 мкл раствора 1 паклитаксела с концентрацией 40 мг/мл для того, чтобы подготовить раствор 16 паклитаксела. Массовое отношение сложного этилового эфира L-аланина к паклитакселу (Ala-OEt/PTX) в растворе 16 паклитаксела составляло 1,20.
(2) Покрытие баллона лекарственным средством
Элюирующий лекарственное средство баллон был произведен тем же самым образом, что и в Примере 1, за исключением того, что вместо пленкообразующего раствора 1 использовался пленкообразующий раствор 16.
[0078] <СРАВНИТЕЛЬНЫЙ ПРИМЕР C2>
(1) Подготовка раствора 17 паклитаксела
Раствор сложного метилового эфира L-валина с концентрацией 30 мг/мл в количестве 70 мкл был смешан с 50 мкл раствора 1 паклитаксела с концентрацией 40 мг/мл для того, чтобы подготовить раствор 17 паклитаксела. Массовое отношение сложного метилового эфира L-валина к паклитакселу (Val-OMe/PTX) в растворе 17 паклитаксела составляло 1,05.
(2) Покрытие баллона лекарственным средством
Элюирующий лекарственное средство баллон был произведен тем же самым образом, что и в Примере 1, за исключением того, что вместо пленкообразующего раствора 1 использовался пленкообразующий раствор 17.
[0079] <СРАВНИТЕЛЬНЫЙ ПРИМЕР C3>
(1) Подготовка раствора 18 паклитаксела
Раствор аргинина с концентрацией 40 мг/мл в количестве 60 мкл был смешан с 50 мкл раствора 1 паклитаксела с концентрацией 40 мг/мл для того, чтобы подготовить раствор 18 паклитаксела. Массовое отношение L-аргинина к паклитакселу (Arg/PTX) в растворе 18 паклитаксела составляло 1,05.
(2) Покрытие баллона лекарственным средством
Элюирующий лекарственное средство баллон был произведен тем же самым образом, что и в Примере 1, за исключением того, что вместо пленкообразующего раствора 1 использовался пленкообразующий раствор 18.
[0080] <СРАВНИТЕЛЬНЫЙ ПРИМЕР C4>
(1) Подготовка раствора 19 паклитаксела
Раствор паклитаксела с концентрацией 20 мг/мл был приготовлен в качестве раствора 19 паклитаксела. Раствор 19 паклитаксела представляет собой раствор паклитаксела (PTX), который не содержит сложный эфир аминокислоты или аминокислоту.
(2) Покрытие баллона лекарственным средством
Элюирующий лекарственное средство баллон был произведен тем же самым образом, что и в Примере 1, за исключением того, что вместо пленкообразующего раствора 1 использовался пленкообразующий раствор 19, а также того, что покрытие проводилось так, чтобы количество паклитаксела составляло приблизительно 3 мкг/мм2.
[0081] <СРАВНИТЕЛЬНЫЙ ПРИМЕР C5>
(1) Подготовка раствора 20 паклитаксела
Раствор сложного метилового эфира L-валина с концентрацией 50 мг/мл в количестве 80 мкл был смешан с 240 мкл раствора 2 паклитаксела с концентрацией 40 мг/мл для того, чтобы подготовить раствор 20 паклитаксела. Массовое отношение сложного метилового эфира L-валина к паклитакселу (Val-OMe/PTX) в растворе 20 паклитаксела составляло 0,42.
(2) Покрытие баллона лекарственным средством
Элюирующий лекарственное средство баллон был произведен тем же самым образом, что и в Примере 1, за исключением того, что вместо пленкообразующего раствора 1 использовался пленкообразующий раствор 20.
[0082] <СРАВНИТЕЛЬНЫЙ ПРИМЕР C6>
Был подготовлен серийный катетер с раздуваемым баллончиком на конце IN.PACT (производства компании Invatec). Баллон в Сравнительном Примере C6 является элюирующим лекарственное средство баллоном с поверхностью, покрытой паклитакселом.
[0083] <СРАВНИТЕЛЬНЫЙ ПРИМЕР C7>
Был подготовлен катетер с раздуваемым баллончиком на конце (производства компании Terumo C; сформированный из нейлонового эластомера), расширяющаяся часть которого составляет 3,0 мм в диаметре и 20 мм в длину в раздутом состоянии. Баллон в Сравнительном Примере C7 представляет собой непокрытый баллон, который не покрывается лекарственным средством.
[0084] <СРАВНИТЕЛЬНЫЙ ПРИМЕР C8>
(1) Подготовка пленкообразующего раствора 21
Раствор L-серина с концентрацией 70 мг/мл в количестве 300 мкл был смешан с 900 мкл раствора 3 паклитаксела с концентрацией 56 мг/мл для того, чтобы подготовить пленкообразующий раствор 21. Пленкообразующий раствор выглядел мутным.
(2) Покрытие баллона лекарственным средством
Так как пленкообразующий раствор 21 был мутным, покрыть им баллон оказалось невозможно. Соответственно, было установлено, что пленкообразующий раствор лекарственного средства не может быть подготовлен с использованием раствора L-серина.
[0085] Приготовленный пленкообразующий раствор, лекарственное средство и гидрохлорид сложного эфира аминокислоты или аминокислота, содержащаяся в пленкообразующем растворе, индекс гидрофобности гидрохлорида сложного эфира аминокислоты или аминокислоты, низший спирт (только в тех случаях, когда использовался низший спирт), а также растворители для Примеров 1-15 и Сравнительных Примеров C1-C5 и C8 показаны в таблице 2. В таблице 2 номера с 1 по 15 в столбце «Пример/Сравнительный пример» являются Примерами, в то время как номера C1-C5 и C8 являются Сравнительными примерами. «PTX» в столбце «Лекарственное средство» означает паклитаксел. В столбце «Сложный эфир аминокислоты/аминокислота» «Bn-Gly-Et» означает сложный этиловый эфир N-бензилглицина, «L-Arg-Et» означает сложный этиловый эфир L-аргинина, «Bnz-Arg-Et» означает сложный этиловый эфир Nα-бензоил-L-аргинина, «L-Asp-2Me» означает диметил-L-аспартат, «Gly-Et» означает сложный этиловый эфир глицина, «L-Ser-Et» означает сложный этиловый эфир L-серина, «L-Ala-Et» означает сложный этиловый эфир L-аланина, «L-Val-Me» означает сложный метиловый эфир L-валина, «L-Arg» означает L-аргинин, и «L-Ser» означает L-серин, соответственно. «Глицерин» в столбце «Низший спирт» означает глицерин. В столбце «Растворители» «EtOH» означает этанол, «RO-W» означает воду, очищенную при помощи обратного осмоса, «THF» означает тетрагидрофуран, и «AC» означает ацетон, соответственно.
[0086] [Таблица 2]
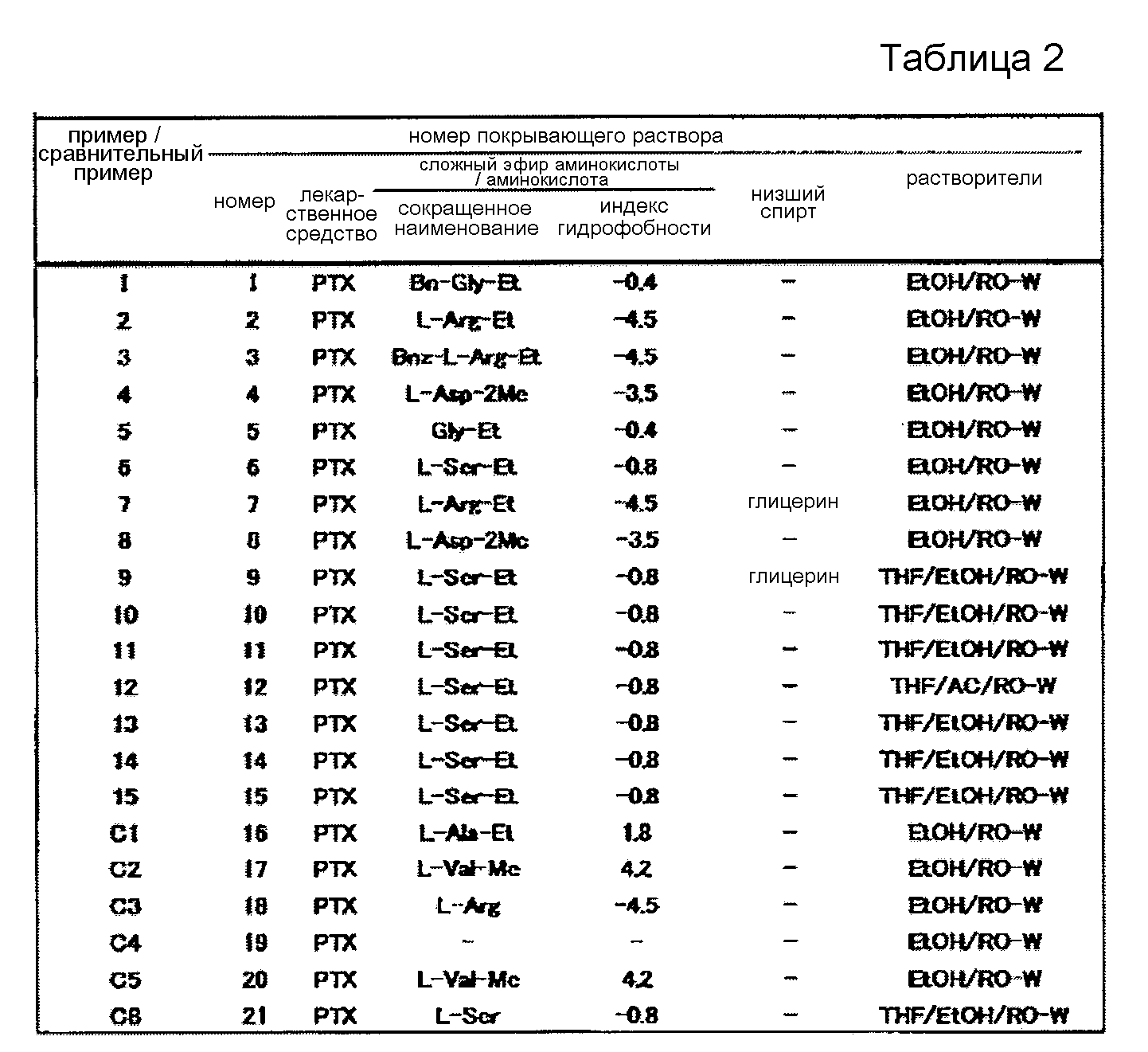
[0087] [Измерение количества паклитаксела в покрытии на баллоне]
Для элюирующих лекарственное средство баллонов в Примерах 1-15 и Сравнительных примерах C1-C5 количество паклитаксела в покрытии на баллоне было измерено при помощи следующей процедуры.
[0088] 1. Способ
Подготовленный элюирующий лекарственное средство баллон был погружен в раствор метанола, после чего он встряхивался при помощи аппарата для встряхивания в течение 10 минут, посредством чего паклитаксел был извлечен из покрытия на баллоне. Абсорбирующая способность раствора метанола, с помощью которого был извлечен паклитаксел, измерялась посредством высокоэффективной жидкостной хроматографии с использованием абсорбциометра, работающего в ультрафиолетовой и видимой частях спектра, и таким образом определялось количество паклитаксела на баллон ([мкг/баллон]). Кроме того, на основе определенного таким образом количества паклитаксела и площади поверхности баллона вычислялось количество паклитаксела на единицу площади ([мкг/мм2]).
[0089] 2. Результаты
Полученные результаты приведены в таблице 3. В таблице 3 номера с 1 по 15 в столбце «Пример/Сравнительный пример» являются Примерами, в то время как номера C1-C5 являются Сравнительными примерами. Кроме того, в таблице 3 в колонке «Площадь поверхности баллона» указана площадь поверхности баллона в растянутом состоянии (мм2), колонка «на штуку» в колонках «Количество PTX на баллоне» указывает количество паклитаксела на каждый баллон (мкг/баллон), а колонка «на единицу площади» в колонках «Количество PTX на баллоне» указывает количество паклитаксела на 1 мм2 площади поверхности баллона (блок: мкг/мм2), соответственно.
[0090] [Таблица 3]

[0091] Как показано в таблице 3, в каждом из Примеров 1-15 и Сравнительных Примеров C1-C5 количество паклитаксела в покрытии на баллоне составляло приблизительно 2 мкг/мм2 (Примеры 1-7, Сравнительные Примеры C1-C3) или приблизительно 3 мкг/мм2 (Примеры 8-15, Сравнительные Примеры C4-C5), что означает, что в покрытии поверхности баллона могло быть обеспечено намеченное количество паклитаксела.
[0092] [Оценка долговечности слоя лекарственного покрытия путем использования имитации кровеносного сосуда]
Для того чтобы оценить, насколько сильно слой лекарственного покрытия отделяется от баллона в процессе доставки баллона к поврежденной части, для элюирующих лекарственное средство баллонов Примеров 1-7 и Сравнительных Примеров C1-C4 было выполнено испытание на долговечность слоя лекарственного покрытия путем выполнения операции доставки с использованием имитации кровеносного сосуда и определения количества паклитаксела, остающегося на баллоне после доставки.
[0093] 1. Способ
(1) Была подготовлена полая имитация 1 кровеносного сосуда с поворотом на 90 градусов, и направляющий катетер 2 (наружный диаметр: 5 френч (5/3 мм)) был вставлен и проведен через имитацию 1 кровеносного сосуда (см. фиг. 1).
(2) Внутренняя часть направляющего катетера 2 была заполнена забуференным фосфатом физиологическим раствором, нагретым до температуры 37°C.
(3) Изготовленный элюирующий лекарственное средство баллон (3,0 мм в диаметре и 20 мм в длину в раздутом состоянии) был сложен с использованием оберточной машины.
(4) Катетер 3 с раздуваемым баллончиком на конце после обертывания был вставлен в направляющий катетер, заполненный забуференным фосфатом физиологическим раствором, и операция доставки баллона 4 к выходному отверстию направляющего катетера выполнялась в течение одной минуты.
(5) Баллон, снабженный в направляющем катетере, возвращался обратно, и количество паклитаксела, оставшегося на баллоне (количество оставшегося паклитаксела), определялось при помощи жидкостной хроматографии. Кроме того, на основе количества паклитаксела в покрытии элюирующего лекарственное средство баллона (количества паклитаксела, нанесенного на баллон) и количества паклитаксела, оставшегося на баллоне, была вычислена доля паклитаксела, оставшегося на баллоне (доля PTX, оставшегося на баллоне).
[0094] 2. Результаты
Полученные результаты приведены в таблице 4. В таблице 4 номера с 1 по 7 в столбце «Пример/Сравнительный пример» являются Примерами, в то время как номера C1-C4 являются Сравнительными примерами. Кроме того, в таблице 4 колонка «Количество PTX, нанесенное на баллон» содержит количество паклитаксела, обеспеченного в покрытии на каждом элюирующем лекарственное средство баллоне (мкг/баллон), колонка «Количество PTX, оставшегося на баллоне» содержит количество паклитаксела, оставшегося на каждом баллоне после операции доставки (мкг/баллон), а колонка «Доля PTX, оставшегося на баллоне» содержит долю паклитаксела, оставшегося на баллоне после операции доставки (% мас.).
[0095] В дополнение к этому фиг. 2 показывает гистограмму, показывающую долю паклитаксела, оставшегося на баллоне после операции доставки элюирующего лекарственное средство баллона, в Примерах 1-7 и Сравнительных Примерах C1-C4 в результате оценки долговечности слоя лекарственного покрытия с использованием имитации кровеносного сосуда. На фиг. 2 по оси абсцисс отложены номера Примеров или Сравнительных Примеров, где цифры 1-7 означают Примеры 1-7, соответственно, а буквенно-цифровые обозначения C1-C4 означают Сравнительные Примеры C1-C4, соответственно. Кроме того, по оси ординат отложена доля паклитаксела, оставшегося на баллоне после операции доставки (% мас.), где «% мас.» означает «массовые проценты».
[0096] [Таблица 4]

[0097] В этой оценочной системе, в случае, когда количество лекарственного средства, оставшегося на баллоне после операции доставки, равно или больше, чем 60% мас., способность удерживать лекарственное средство во время операции доставки является хорошей, и к поврежденной части может быть доставлено много лекарственного средства. С другой стороны, когда количество лекарственного средства, оставшегося на баллоне после операции доставки, ниже 60% мас., большая часть лекарственного средства счищается во время операции доставки, что также является нежелательным с точки зрения безопасности. Кроме того, в этом случае количество лекарственного средства, которое может быть доставлено к поврежденной части, является небольшим, и поэтому нельзя ожидать удовлетворительной передачи лекарственного средства к ткани. Соответственно, в этой оценочной системе, когда количество паклитаксела, оставшегося на баллоне после операции доставки, равно или больше, чем 60% мас., можно считать, что обеспечивается хорошая способность удерживать лекарственное средство во время процесса доставки.
[0098] Как показано в таблице 4, для элюирующих лекарственное средство баллонов, произведенных в Примерах 1-7, количество паклитаксела, оставшегося на баллоне после операции доставки, было равно или больше 60% мас. по массе покрытия. С другой стороны, для элюирующих лекарственное средство баллонов, произведенных в Сравнительных Примерах C1-C4, количество паклитаксела, оставшегося на баллоне, было меньше или равно 50% мас. На основе этих результатов было установлено, что гидрохлоридные соединения сложного эфира аминокислоты, имеющие индекс гидрофобности боковой цепи аминокислоты не больше нуля, которые использовались в Примерах 1-7, гарантируют равномерное покрытие паклитакселом, улучшают адгезию паклитаксела к баллону и усиливают способность удерживать лекарственное средство во время операции доставки. С другой стороны, в случаях гидрохлоридных соединений сложного эфира аминокислоты, имеющих индекс гидрофобности боковой цепи аминокислоты более 1 и поэтому имеющих сравнительно высокую гидрофобность, было затруднительно усилить способность удерживать лекарственное средство во время операции доставки. Кроме того, как показано в Сравнительном Примере C3, в случае аминокислоты, которая имеет индекс гидрофобности боковой цепи, равный нулю или меньше, чем ноль, но еще не является этерифицированной, удовлетворительные характеристики долговечности лекарственного средства не смогли быть получены.
[0099] [Оценка переносимости лекарственного средства к ткани в подвздошной артерии кролика]
Для элюирующих лекарственное средство баллонов в Примере 8 и Сравнительных Примерах C5 и C6 переносимость паклитаксела к ткани кровеносного сосуда после одного часа с момента расширения баллона в подвздошной артерии кролика была оценена с помощью следующей процедуры.
[0100] 1. Способ
(1) Направляющая проволока была вставлена в правую подвздошную артерию или левую подвздошную артерию кролика под рентгеноскопическим наблюдением. Затем элюирующий лекарственное средство баллон (с размерами расширяющейся части 3,0 мм в диаметре и 20 мм в длину в раздутом состоянии) был проведен вдоль направляющей проволоки к подвздошной артерии.
(2) Баллон был расширен и находился под давлением в 7 атм в течение одной минуты. Сразу после этого баллон был вытащен.
(3) После истечения 60 минут с момента расширения баллона был взят образец кровеносного сосуда (на расстоянии приблизительно 3,5 см от разветвления).
(4) К образцу кровеносного сосуда был добавлен метанол, после чего была осуществлена гомогенизация для того, чтобы получить гомогенат ткани.
(5) Гомогенат ткани был проанализирован с помощью высокоэффективной жидкостной хроматографии для того, чтобы определить количество паклитаксела, содержащегося в ткани (количество паклитаксела на 1 г ткани). Кроме того, на основе количества паклитаксела в покрытии элюирующего лекарственное средство баллона и количества паклитаксела, оставшегося на баллоне, была вычислена доля паклитаксела, оставшегося на баллоне.
[0101] 2. Результаты
Полученные результаты приведены в таблице 5. В таблице 5 цифра 8 в столбце «Пример/Сравнительный пример» означает Пример 8, а C5 и C6 - Сравнительные Примеры. В таблице 5 колонка «Количество PTX, содержащегося в ткани» представляет количество паклитаксела, содержащегося в 1 г ткани кровеносного сосуда (мкг/г), колонка «Доля PTX, переданного в ткань» представляет долю паклитаксела, переданного от покрытия на баллоне в ткань кровеносного сосуда (% мас.), и «Доля PTX, оставшегося на баллоне» представляет долю паклитаксела, оставшегося на баллоне (% мас.), соответственно.
[0102] В дополнение к этому фиг. 3 показывает гистограмму, представляющую количество паклитаксела, содержащегося в ткани кровеносного сосуда, в Примере 8 и Сравнительных Примерах C5 и C6, при оценке переноса лекарственного средства к ткани в подвздошной артерии кролика. На фиг. 3 по оси абсцисс отложены номера Примеров или Сравнительных Примеров, где цифра 8 означает Пример 8, а буквенно-цифровые обозначения C5 и C6 означают Сравнительные Примеры C5 и C6, соответственно. Кроме того, по оси ординат отложено количество паклитаксела, содержащегося в 1 г ткани кровеносного сосуда (в мкг/г, что означает количество микрограммов паклитаксела на грамм ткани).
[0103] [Таблица 5]

[0104] В Примере 8 количество паклитаксела на единицу площади баллона составляло 3,2 мкг/мм2, меньше, чем значение 4,1 мкг/мм2, для баллона IN.PACT (производства компании Invatec) в Сравнительном Примере C6. Однако, как показано в таблице 5 и на фиг. 3, количество паклитаксела, содержащегося в ткани, извлеченной после 60 минут с момента расширения кровеносного сосуда, было выше 500 мкг на 1 г ткани, что больше, чем значение для Сравнительного Примера C6, и означает благоприятную передачу паклитаксела к ткани кровеносного сосуда. С другой стороны, в случае элюирующего лекарственное средство баллона в Сравнительном Примере C5, где в качестве гидрофобного гидрохлорида сложного эфира аминокислоты использовался сложный метиловый эфир L-валина (имеющий индекс гидрофобности боковой цепи аминокислоты, равный 4,2), количество паклитаксела, оставшегося на баллоне, было большим, что соответствует низкому проценту передачи паклитаксела к ткани кровеносного сосуда. На основе полученных результатов было установлено, что паклитаксел, присутствующий в покрытии вместе с гидрохлоридом сложного эфира аминокислоты, имеющим индекс гидрофобности боковой цепи аминокислоты, равный нулю или меньше нуля, демонстрирует эффективную передачу лекарственного средства к ткани, то есть хороший перенос лекарственного средства.
[0105] [Оценка удержания лекарственного средства в ткани брюшной аорты кролика]
Для элюирующих лекарственное средство баллонов в Примерах 9 и 10 было определено количество паклитаксела, содержащегося в ткани после одного часа и после 24 часов с момента расширения баллона в брюшной аорте кролика, и таким образом удержание лекарственного средства было оценено с использованием следующей процедуры.
[0106] 1. Способ
(1) Элюирующий лекарственное средство баллон был подвергнут обертыванию, после чего на нем был предварительно смонтирован стент. Далее использовался элюирующий лекарственное средство баллон с предварительно смонтированным стентом.
(2) После того как направляющая проволока была вставлена в брюшную аорту кролика под рентгеноскопическим наблюдением, направляющий катетер был вытащен при сохранении положения направляющей проволоки. Затем элюирующий лекарственное средство баллон (с размерами расширяющейся части 3,0 мм в диаметре и 20 мм в длину в раздутом состоянии) с предварительно смонтированным стентом был проведен вдоль направляющей проволоки к брюшной аорте.
(3) Баллон был расширен и находился под давлением в 7 атм в течение одной минуты. Сразу после этого баллон был вытащен.
(4) После одного часа и после 24 часов с момента расширения баллона был взят образец кровеносного сосуда (на расстоянии приблизительно 3,5 см от разветвления).
(5) К образцу кровеносного сосуда был добавлен метанол, после чего была осуществлена гомогенизация для того, чтобы получить гомогенат ткани.
(6) Гомогенат ткани был проанализирован с помощью высокоэффективной жидкостной хроматографии для того, чтобы определить количество паклитаксела, содержащегося в ткани (количество паклитаксела на 1 г ткани) после одного часа и после 24 часов с момента расширения баллона. Кроме того, на основе количества паклитаксела в покрытии элюирующего лекарственное средство баллона и количеств паклитаксела, содержащегося в ткани после одного часа и после 24 часов с момента расширения баллона, были вычислены доли паклитаксела, переданного к ткани после одного часа и после 24 часов с момента расширения баллона, а также на основе количества паклитаксела, оставшегося на баллоне, была вычислена доля паклитаксела, оставшегося на баллоне.
[0107] 2. Результаты
Полученные результаты приведены в таблице 6. В таблице 6 цифры 9 и 10 в столбце «Примеры» означают номера Примеров. Кроме того, в таблице 6 колонка «Количество PTX, содержащегося в ткани» представляет количество паклитаксела, содержащегося в 1 г ткани кровеносного сосуда (в мкг/г), колонка «Доля PTX, переданного в ткань» представляет долю паклитаксела, переданного от покрытия на баллоне в ткань кровеносного сосуда (в % мас.), а колонка «Доля PTX, оставшегося на баллоне» представляет долю паклитаксела, оставшегося на баллоне (в % мас.). Кроме того, «через 1 час» и «через 24 часа» в столбцах «Количество PTX, содержащегося в ткани» и «Доля PTX, переданного в ткань» означают спустя один час после расширения просвета кровеносного сосуда и спустя 24 часа после расширения просвета кровеносного сосуда, соответственно.
[0108] Фиг. 4 показывает гистограмму, представляющую количество паклитаксела, оставшегося в ткани кровеносного сосуда после одного часа и после 24 часов с момента расширения просвета кровеносного сосуда, в Примерах 9 и 10 при оценке удержания лекарственного средства в ткани брюшной аорты кролика. На фиг. 4 ось абсцисс представляет Примеры, где цифры 9 и 10 означают Примеры 9 и 10, соответственно. Ось ординат представляет количество паклитаксела, содержащегося в 1 г ткани кровеносного сосуда (в мкг/г). В легенде «1H» и «24Н» означают спустя один час после расширения просвета кровеносного сосуда и спустя 24 часа после расширения просвета кровеносного сосуда, соответственно, а «мкг/г ткани» означает «микрограммов паклитаксела на грамм ткани».
[0109] [Таблица 6]

[0110] Как показано в таблице 6 в Примерах 9 и 10, количество паклитаксела, содержащегося в ткани кровеносного сосуда после одного часа и после 24 часов с момента расширения кровеносного сосуда, было приблизительно одинаковым, что позволяет предположить, что количество паклитаксела в ткани кровеносного сосуда убывает в незначительной степени с течением времени. На основе полученных результатов было установлено, что слой лекарственного покрытия, содержащий гидрохлорид сложного эфира аминокислоты, имеющий индекс гидрофобности боковой цепи аминокислоты, равный нулю или меньше нуля (в частности, гидрохлорид сложного этилового эфира L-серина, имеющий индекс гидрофобности боковой цепи аминокислоты, равный -0,8), и содержащий паклитаксел, гарантирует, что достаточное количество лекарственного средства сохранится в ткани в течение длительного периода времени после передачи лекарственного средства к ткани. Когда в слое лекарственного покрытия также содержится глицерин, может быть получено достаточное удержание лекарственного средства в ткани.
[0111] [Оценка эффективности в коронарной артерии свиньи]
Для элюирующих лекарственное средство баллонов в Примерах 9-11 и Сравнительном Примере C6, а также для не покрытого лекарственным средством баллона в Сравнительном Примере C7 эффективность в коронарной артерии свиньи была оценена в соответствии со следующей процедурой.
[0112] 1. Способ
(1) Направляющий катетер был вставлен через трубчатую оболочку диаметром 8 френч (8/3 мм) вместе с направляющей проволокой и был проведен к левым и правым отверстиям коронарной артерии свиньи под рентгеноскопическим наблюдением.
(2) Рентгеноангиография была применена к каждой коронарной артерии (коронарная артерия: левая передняя нисходящая коронарная артерия (left anterior descending, LAD), правая коронарная артерия (right coronary artery, RCA), левая огибающая коронарная артерия (left circumflex coronary artery, LCX)), и диаметр кровеносного сосуда коронарной артерии, полученный при помощи рентгеноангиографии, был измерен с использованием программного обеспечения QCA.
(3) Была выбрана та часть сосуда, где диаметр стента составлял 1,2 диаметра кровеносного сосуда, а диаметр элюирующего лекарственное средство баллона составлял 1,3 диаметра кровеносного сосуда, и дальнейшие операции после размещения стента проводились в этой части.
(4) Стент (3 мм в диаметре и 15 мм в длину) был расширен в 1,2 раза в выбранной коронарной артерии на 30 секунд, а затем катетер с раздуваемым баллончиком на конце для постоянного размещения стента был вытащен. В месте размещения стента элюирующий лекарственное средство баллон (3 мм в диаметре и 20 мм в длину) был расширен до диаметра, в 1,3 раза большего, чем диаметр кровеносного сосуда, на одну минуту, и затем катетер был вытащен.
(5) После того как расширение элюирующего лекарственное средство баллона было закончено, направляющий катетер и оболочка были вытащены, и центральная сторона сонной артерии была перевязана. После этого на внешнем отверстии раны шейной части трахеи рассеченные мышцы были зашиты хирургическим швом, и на кожу были наложены швы с использованием аппарата для наложения скобок.
(6) Через 28 дней после расширения баллона была проведена аутопсия. Во время аутопсии проводилась коронарная рентгеноангиография, посредством чего была проверена проходимость (уровень стеноза) в месте размещения стента и был измерен диаметр кровеносного сосуда. Уровень стеноза (%) был вычислен по среднему диаметру кровеносного сосуда непосредственно после расширения баллона и среднему диаметру кровеносного сосуда после 28 дней.
[0113] 2. Результаты
Полученные результаты приведены в таблице 7. В таблице 7 цифры 9-11 в столбце «Примеры/Сравнительные примеры» означают номера Примеров, а C6 и C7 - номера Сравнительных Примеров.
[0114] Фиг. 5 показывает гистограмму, представляющую уровень стеноза кровеносного сосуда в Примерах 9-11 и Сравнительных Примерах C6 и C7 при оценке эффективности в коронарной артерии свиньи. На фиг. 5 ось абсцисс представляет Примеры или Сравнительные Примеры, где цифры 9-11 означают Примеры 9-11, соответственно, тогда как метки C6 и C7 означают Сравнительные Примеры C6 и C7, соответственно. Кроме того, ось ординат представляет уровень стеноза кровеносного сосуда (в %).
[0115] [Таблица 7]

[0116] Уровень стеноза кровеносного сосуда, обработанного не покрытым лекарственным средством баллоном, подготовленным в качестве контрольного в Сравнительном Примере C7, составил 35,0%. Кроме того, уровень стеноза кровеносного сосуда, обработанного серийным элюирующим лекарственное средство баллоном (IN.PACT), подготовленным в Сравнительном Примере C6, составил 17,1%.
С другой стороны, уровни стеноза кровеносных сосудов, обработанных элюирующими лекарственное средство баллонами в соответствии с настоящим изобретением, подготовленными в Примерах 9-11, составили 16,1%, 6,5% и 7,3%, соответственно.
На основе полученных результатов было установлено, что слой лекарственного покрытия, содержащий гидрохлорид сложного эфира аминокислоты, имеющий индекс гидрофобности боковой цепи аминокислоты, равный нулю или меньше нуля (и глицерин), а также паклитаксел, демонстрирует хороший эффект сдерживания или подавления стеноза.
[0117] Когда используется медицинское устройство (например, катетер с раздуваемым баллончиком на конце), покрытое композицией покрытия в соответствии с настоящим изобретением лекарственное средство может быть эффективно доставлено к поврежденной части с ограниченным или подавленным отделением слоя лекарственного покрытия от медицинского устройства во время процесса доставки к поврежденной части. В дополнение к этому, может быть стимулировано быстрое высвобождение лекарственного средства из медицинского устройства в поврежденной части, и перенос лекарственного средства к ткани может быть увеличен.
[0118] ОПИСАНИЕ ССЫЛОЧНЫХ ЦИФР
1 - имитация кровеносного сосуда
2 - направляющий катетер
3 - катетер с раздуваемым баллончиком на конце
4 - баллон
Реферат
Группа изобретений относится к медицине. Описана композиция покрытия для элюирующих лекарственное средство медицинских устройств, которая содержит нерастворимое в воде лекарственное средство и по меньшей мере одно соединение, выбранное из группы, состоящей из сложноэфирных соединений аминокислот, которые имеют индекс гидрофобности боковой цепи аминокислоты, равный нулю или меньше нуля, а также их солей. Композиция позволяет доставить медицинское устройство к ткани-мишени с целью лечения повреждения кровеносного сосуда, такого как рестеноз, без легкого отделения лекарственного средства от медицинского устройства во время процесса доставки. 4 н. и 5 з.п. ф-лы, 5 ил., 7 табл., 15 пр.
Формула
при этом сложноэфирное соединение является сложноэфирным соединением по меньшей мере одной аминокислоты и одноатомного спирта, содержащего вплоть до пяти атомов углерода, причем по меньшей мере одна аминокислота выбирается из группы, состоящей из глицина, серина, аспарагина, аспартовой кислоты, глютамина, глутаминовой кислоты, аргинина, треонина, гистидина, лизина, тирозина, триптофана, аминокислот, полученных путем замены по меньшей мере одного из водородных атомов аминогруппы в α-положении в вышеупомянутых аминокислотах алкильной группой, содержащей вплоть до пяти атомов углерода, бензильной группой или бензоильной группой, пролина и аминокислот, полученных путем замены водородного атома имино-группы пролина алкильной группой, содержащей вплоть до пяти атомов углерода, бензильной группой или бензоильной группой, при этом сложноэфирное соединение представлено следующей формулой:
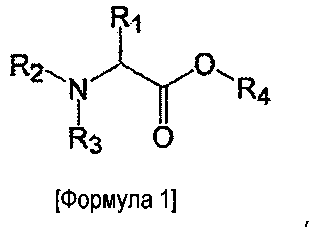
где R1 представляет собой водородный атом, гуанидинпропильную группу, карбамоилметильную группу, карбоксиметильную группу, метоксикарбонилметильную группу, этоксикарбонилметильную группу, 2-карбамоилэтильную группу, 2-карбоксиэтильную группу, 2-метоксикарбонилэтильную группу, 2-этоксикарбонилэтильную группу, (1Н-имидазол-4-ил)метильную группу, 4-аминобутильную группу, гидроксиметильную группу, 1-гидроксиэтильную группу, (1H-индол-3-ил)метильную группу или 4-гидроксибензильную группу или образует триметиленовую группу с радикалом R2, R2 представляет собой водородный атом или формирует триметиленовую группу с радикалом R1, R3 представляет собой водородный атом, алкильную группу, содержащую до пяти атомов углерода, бензильную труппу или бензоильную группу, и R4 представляет собой алкильную группу, содержащую до пяти атомов углерода.
в которой сложноэфирное соединение представляет собой по меньшей мере одно соединение, выбранное из группы, состоящей из сложного этилового эфира бензилглицина, сложного метилового эфира бензилглицина, сложного этилового эфира аргинина, сложного метилового эфира аргинина, сложного этилового эфира бензоиларгинина, сложного метилового эфира бензоиларгинина, диэтиласпартата, метиласпартата, диметиласпартата, сложного этилового эфира глицина, сложного метилового эфира глицина, сложного этилового эфира серина и сложного метилового эфира серина.
стадию доставки медицинского устройства по п. 8 в просвет;
стадию радиального расширения медицинского устройства в просвете; и
стадию элюирования лекарственного средства из слоя лекарственного покрытия, сформированного по меньшей мере на части поверхности медицинского устройства, и обеспечения воздействия лекарственного средства на просвет.

Комментарии