Стент из оголенного металла с резервуарами, выделяющими лекарственные препараты - RU2573107C2
Код документа: RU2573107C2
Чертежи
















































Описание
ПЕРЕКРЕСТНЫЕ ССЫЛКИ НА СМЕЖНЫЕ ЗАЯВКИ
Настоящая заявка истребует приоритет, заявленный в предварительной заявке на патент США с регистрационным № 61/307040 от 23 февраля 2010 года, и является частичным продолжением поданной ранее заявки № 12/500043 от 09 июля 2009 года.
ПРЕДПОСЫЛКИ ИЗОБРЕТЕНИЯ
Область изобретения
Настоящее изобретение относится к местному применению терапевтических средств и (или) комбинации терапевтических средств для профилактики и лечения сосудистых заболеваний, а более конкретно к внутрипросветным медицинским устройствам для локальной доставки терапевтических средств и (или) комбинаций терапевтических средств.
Обзор материалов, использованных при экспертизе заявки
Множество людей страдает болезнями органов кровообращения, причиной которых является прогрессирующая окклюзия кровеносных сосудов, перфузирующих сердце и другие важные органы. Более интенсивная окклюзия кровеносных сосудов у таких людей зачастую приводит к артериальной гипертензии, ишемическому повреждению, инсульту или инфаркту миокарда. Атеросклеротические поражения сосудов, ограничивающие или блокирующие коронарный кровоток, являются основной причиной ишемической болезни сердца. Медицинская процедура, целью которой является увеличение кровотока в артерии, называется чрескожной транслюминальной коронарной ангиопластикой. Чрескожная транслюминальная коронарная ангиопластика является предпочтительным методом лечения стеноза коронарных артерий. Все возрастающее применение этого метода обусловлено довольно высокой частотой успеха и минимальной инвазивностью по сравнению с операцией коронарного шунтирования. Недостатком чрескожной транслюминальной коронарной ангиопластики является риск внезапного закрытия сосуда, которое может произойти непосредственно после процедуры, и рестеноза, который развивается в поздние сроки после процедуры. Кроме того, рестеноз является частым осложнением у пациентов, которые перенесли аутовенозное шунтирование с использованием подкожной вены бедра. Механизм острой окклюзии включает несколько факторов и может быть следствием уменьшения просвета сосуда с результирующим закрытием артерии и (или) отложения тромбоцитов и фибрина вдоль поврежденного участка только что расширенного кровеносного сосуда.
Рестеноз после чрескожной транслюминальной коронарной ангиопластики - более постепенный процесс, вызванный повреждением сосуда. Каждый их множества процессов, включающих тромбоз, воспаление, выделение фактора роста и цитокина, пролиферацию клеток, клеточную миграцию и синтез внеклеточного матрикса, способствует развитию рестеноза.
Хотя точный механизм рестеноза недостаточно изучен, основные этапы этого процесса установлены. В нормальной артериальной стенке скорость пролиферации гладкомышечных клеток низкая, приблизительно менее 0,1% в день. Гладкомышечные клетки в стенках сосудов имеют в основном сократительный фенотип, характеризующийся тем, что от 80 до 90% объема цитоплазмы занимает сократительный аппарат. Доля эндоплазматического ретикулума, комплекса Гольджи и свободных рибосом невелика, и они локализованы в околоядерной области. Внеклеточный матрикс окружает гладкомышечные клетки; он богат гепариноподобными гликозаминогликанами, которые, как предполагается, отвечают за сохранение сократительного фенотипа гладкомышечных клеток (Campbell and Campbell, 1985).
В процессе ангиопластики при расширении коронарного баллонного катетера под давлением происходит повреждение гладкомышечных клеток и эндотелиальных клеток внутри стенок сосудов; в ответ на повреждение инициируется тромботическая и воспалительная реакция. Клеточные факторы роста, такие как тромбоцитарный фактор роста, основной фактор роста фибробластов, эпидермальный фактор роста, тромбин и т.д., высвобождающиеся тромбоцитами, мигрирующими макрофагами и (или) лейкоцитами или непосредственно гладкомышечными клетками, вызывают ответную пролиферацию и миграцию гладкомышечных клеток медии. Эти клетки претерпевают изменение фенотипа: сократительный фенотип меняется на синтетический фенотип, для которого характерно наличие незначительного количества пучков сократительных волокон, хорошо развитого гранулярного эндоплазматического ретикулума, аппарата Гольджи и свободных рибосом. Пролиферация/миграция, как правило, начинается в течение одного-двух дней после травмы и достигает максимума через несколько дней после начала (Campbell and Campbell, 1987; Clowes and Schwartz, 1985).
Дочерние клетки мигрируют в интимальный слой гладкой мускулатуры артерии и продолжают пролиферировать и секретировать значительное количество белков внеклеточного матрикса. Пролиферация, миграция и синтез внеклеточного матрикса продолжаются до того момента, пока не восстановится поврежденный эндотелиальный слой, после чего пролиферация внутри интимы замедляется, что происходит, как правило, в течение 7-14 дней после травмы. Новообразованная ткань называется неоинтима. Дальнейшее сужение сосуда, которое происходит в течение последующих 3-6 месяцев, главным образом, является следствием негативного или констриктивного ремоделирования.
Одновременно с локальной пролиферацией и миграцией клетки воспалительного инфильтрата адгезируются к месту повреждения сосуда. В течение 3-7 дней посттравматического периода клетки воспалительного инфильтрата мигрируют в более глубокие слои стенки сосуда. В экспериментальных моделях на животных, где применялось как введение баллонного катетера, так и имплантация стента, клетки воспалительного инфильтрата присутствовали в месте повреждения сосуда по меньшей мере в течение тридцати дней (Tanaka et al., 1993; Edelman et al., 1998). Таким образом, присутствующие клетки воспалительного инфильтрата могут способствовать развитию как острой, так и хронической фазы рестеноза.
Многочисленные препараты были протестированы на наличие предполагаемого антипролиферативного действия при рестенозе и продемонстрировали некоторый эффект в экспериментальных моделях на животных. К числу препаратов, эффективно сокращающих степень гиперплазии интимы в экспериментальных моделях на животных, относятся: гепарин и гепариновые фрагменты (Clowes, A.W. and Karnovsky M., Nature 265: 25-26, 1977; Guyton, J.R. et al., Circ. Res., 46: 625-634, 1980; Clowes, A.W. and Clowes, M.M., Lab. Invest. 52: 611-616, 1985; Clowes, A.W. and Clowes, M.M., Circ. Res. 58: 839-845, 1986; Majesky et al., Circ. Res. 61: 296-300, 1987; Snow et al., Am. J. Pathol. 137: 313-330, 1990; Okada, T. et al., Neurosurgery 25: 92-98, 1989), колхицин (Currier, J.W. et al., Circ. 80: 11-66, 1989), таксол (Sollot, S.J. et al., J. Clin. Invest. 95: 1869-1876, 1995), ингибиторы ангиотензинпревращающего фермента (АПФ) (Powell, J.S. et al., Science, 245: 186-188, 1989), ангиопептин (Lundergan, C.F. et al. Am. J. Cardiol. 17 (Suppl. B):132B-136B, 1991), циклоспорин A (Jonasson, L. et al., Proc. Natl., Acad. Sci., 85: 2303, 1988), козьи антитела к фактору роста тромбоцитов кролика (Ferns, G.A.A., et al., Science 253: 1129-1132, 1991), тербинафин (Nemecek, G.M. et al., J. Pharmacol. Exp. Thera. 248: 1167-1174, 1989), трапидил (Liu, M.W. et al., Circ. 81: 1089-1093, 1990), траниласт (Fukuyama, J. et al., Eur. J. Pharmacol. 318: 327-332, 1996), гамма интерферон (Hansson, G.K. and Holm, J., Circ. 84: 1266-1272, 1991), рапамицин (Marx, S.O. et al., Circ. Res. 76: 412-417, 1995), стероиды (Colburn, M.D. et al., J. Vasc. Surg. 15: 510-518, 1992), см. также Berk, B.C. et al., J. Am. Coll. Cardiol. 17: 111B-117B, 1991), ионизирующее облучение (Weinberger, J. et al., Int. J. Rad. Onc. Biol. Phys. 36: 767-775, 1996), гибридные токсины (Farb, A. et al., Circ. Res. 80: 542-550, 1997), антисмысловые олигонуклеотиды (Simons, M. et al., Nature 359: 67-70, 1992) и векторы гена (Chang, M.W. et al., J. Clin. Invest. 96: 2260-2268, 1995). Антипролиферативное действие в отношении гладкомышечных клеток in vitro продемонстрировали многие из вышеперечисленных препаратов, включая гепарин и конъюгаты гепарина, таксол, траниласт, колхицин, ингибиторы ангиотензинпревращающего фермента (АПФ), гибридные токсины, антисмысловые олигонуклеотиды, рапамицин и ионизирующее облучение. Таким образом, препараты с различными механизмами ингибирования гладкомышечных клеток могут иметь терапевтический эффект в отношении уменьшения интимальной гиперплазии.
Однако в отличие от экспериментов на животных, попытки предотвратить рестеноз у людей, перенесших ангиопластику, с помощью системных фармакологических препаратов до сих пор не увенчались успехом. Ни комбинация аспирин-дипиридамол, ни тиклопидин, ни антикоагулянтная терапия (гепарин для неотложного лечения, варфарин для длительного применения, гирудин или гирулог), ни блокада рецепторов тромбоксана, ни стероиды не обладают эффективностью при предотвращении рестеноза, хотя ингибиторы тромбоцитов оказались эффективны для предотвращения острой реокклюзии после ангиопластики (Mak and Topol, 1997; Lang et al., 1991; Popma et al., 1991). Антагонист ГП llb/llla рецепторов тромбоцита Reopro® до сих пор находится на стадии изучения, однако на сегодняшний день окончательного эффекта от применения Reopro® в плане снижения рестенозов после ангиопластики и стентирования не наблюдается. Другие препараты, также не показавшие эффективности в предотвращении рестеноза, включают блокаторы кальциевых каналов, миметики простациклина, ингибиторы ангиотензинпревращающего фермента, блокаторы серотониновых рецепторов и антипролиферативные препараты. Однако указанные препараты должны применяться системно, и достижение терапевтически эффективной дозы может оказаться невозможным. Это связано с тем, что концентрации, необходимые для антипролиферативного (или антирестенозного) эффекта, могут превышать известные токсические концентрации этих препаратов, так что уровень препарата в крови, достаточный для ингибирования гладких мышц, не может быть достигнут (Mak and Topol, 1997; Lang et al., 1991; Popma et al., 1991).
Дополнительные клинические испытания, в которых изучали эффективность использования пищевых добавок, содержащих диетический рыбий жир или холестеринпонижающие средства, в отношении профилактики рестенозов, дали противоречивые или отрицательные результаты. Таким образом, в настоящее время нет клинически доступного фармакологического препарата для предотвращения постангиопластического рестеноза (Mak and Topol, 1997; Franklin and Faxon, 1993: Serruys, P.W. et al., 1993). Современные исследования позволяют предположить, что гиполипидемический/антиоксидантный препарат пробукол может применяться для предотвращения рестеноза, однако данное исследование требует подтверждения (Tardif et al., 1997; Yokoi, et al., 1997). В настоящее время пробукол (Probucol) не утвержден для применения в США, а тридцатидневный период предварительного лечения исключает возможность его применения в случае неотложной ангиопластики. Кроме того, применение ионизирующего излучения показало многообещающие результаты в отношении уменьшения или предотвращения рестенозов после ангиопластики у пациентов с имплантированными стентами (Teirstein et al., 1997). Тем не менее, на сегодняшний день наиболее эффективными способами лечения рестеноза являются повторная ангиопластика, атерэктомия или аортокоронарное шунтирование, так как на данный момент ни одно терапевтическое средство не разрешено для использования с целью предотвращения постангиопластического рестеноза Управлением по контролю за качеством пищевых продуктов и медикаментов.
В отличие от системной терапии лекарственными препаратами, стенты доказали свою эффективность в плане значительного уменьшения рестенозов. Как правило, стенты представляют собой металлические трубочки ячеистой структуры (обычно, но не обязательно, изготовленные из нержавеющей стали), расширяемые при помощи баллона, которые после расширения внутри просвета коронарной артерии, подвергаемой ангиопластике, обеспечивают структурную опору благодаря жесткой поддержке стенки артерии. Эта поддержка способствует обеспечению проходимости просвета сосуда. В двух рандомизированных клинических испытаниях стенты способствовали ангиографическому успеху после чрескожной транслюминальной коронарной ангиопластики путем увеличения минимального диаметра просвета и уменьшения частоты возникновения, но не предотвращали рестеноз через шесть месяцев (Serruys et al., 1994; Fischman et al., 1994).
Кроме того, оказалось, что покрытие стентов гепарином дает дополнительный положительный эффект, выраженный в уменьшении подострых тромбозов после имплантации стента (Serruys et al., 1996). Таким образом, постоянное механическое расширение стенозированной коронарной артерии при помощи стента, как оказалось, в некоторой степени способствует предотвращению рестеноза, а покрытие поверхности стентов гепарином демонстрирует как целесообразность, так и клиническую эффективность локальной доставки лекарственных препаратов непосредственно к месту повреждения ткани.
Как было указано выше, применение гепаринового покрытия на стентах доказало пригодность и клиническую эффективность локальной доставки лекарственного препарата, однако эффективность такого лечения зависит от способа закрепления конкретного лекарственного препарата или комбинации препаратов на устройстве для локальной доставки. Например, способы и материалы, используемые для фиксации препарата/комбинации препаратов на устройстве для локальной доставки, не должны препятствовать действию препарата/комбинации препаратов. Кроме того, используемые процессы и материалы должны обладать биосовместимостью, а также должны удерживать препарат/комбинацию препаратов на устройстве для локальной доставки в процессе доставки и в течение заданного периода времени. Например, удаление препарата/комбинации препаратов в процессе доставки с поверхности устройства для локальной доставки потенциально может стать причиной нарушения работы устройства.
Таким образом, существует потребность в препарате/комбинации препаратов и соответствующих устройствах для локальной доставки с целью предотвращения и лечения повреждений сосудов, вызывающих утолщение интимы, которые имеют либо биологическую причину, например, атеросклероз, либо нанесены механическим путем, например, в результате чрескожной транслюминальной коронарной ангиопластики.
КРАТКОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Стент, выделяющий рапамицин и являющийся предметом настоящего изобретения, не обладает описанными выше ограничениями, свойственными ранним прототипам.
В соответствии с первым аспектом настоящее изобретение относится к стенту из оголенного металла с резервуарами, выделяющими лекарственный препарат, предназначенному для имплантации в полый орган живого организма. Стент из оголенного металла представляет собой продолговатую трубчатую конструкцию, имеющую люминальную поверхность и аблюминальную поверхность. Продолговатая трубчатая конструкция включает множество взаимосвязанных элементов; сегмент взаимосвязанных элементов включает по меньшей мере один резервуар, проходящий от люминальной поверхности к аблюминальной поверхности, по меньшей мере один основной слой композиции, в состав которого входит полимер, депонированный по меньшей мере в одном резервуаре, приближенном к люминальной поверхности продолговатой трубчатой конструкции, и по меньшей мере один покрывной слой композиции, в состав которого входит терапевтическое средство, депонированное в резервуаре поверх основного слоя композиции и ниже аблюминальной поверхности продолговатой трубчатой конструкции, при этом после имплантации приблизительно 75% аблюминальной поверхности представлено оголенным металлом и приблизительно 25% аблюминальной поверхности занято резервуарами, по меньшей мере частично заполненными по меньшей мере одним основным слоем композиции и по меньшей мере одним покрывным слоем композиции, и приблизительно через девяносто дней после имплантации по меньшей мере один основной слой композиции и по меньшей мере один покрывной слой композиции полностью исчезают.
В соответствии с другим аспектом настоящее изобретение относится к стенту из оголенного металла с резервуарами, выделяющими лекарственный препарат, предназначенному для имплантации в полый орган живого организма. Стент из оголенного металла включает продолговатую трубчатую конструкцию, имеющую люминальную поверхность и аблюминальную поверхность. Продолговатая трубчатая конструкция включает множество взаимосвязанных элементов; сегмент взаимосвязанных элементов включает по меньшей мере один резервуар, проходящий от люминальной поверхности к аблюминальной поверхности, по меньшей мере один основной слой композиции, в состав которого входит сополимер молочной и гликолевой кислот (PLGA), депонированный по меньшей мере в одном резервуаре, приближенном к люминальной поверхности продолговатой трубчатой конструкции, и по меньшей мере один покрывной слой композиции, в состав которого входят сополимер молочной и гликолевой кислот (PLGA), рапамицин и бутилокситолуол (BHT), депонированный в резервуаре поверх основного слоя композиции и ниже аблюминальной поверхности продолговатой трубчатой конструкции, при этом после имплантации приблизительно 75% аблюминальной поверхности представлено оголенным металлом и приблизительно 25% аблюминальной поверхности занято резервуарами, по меньшей мере частично заполненными по меньшей мере одним основным слоем композиции и по меньшей мере одним покрывным слоем композиции, и приблизительно через девяносто дней после имплантации по меньшей мере один основной слой композиции и по меньшей мере один покрывной слой композиции полностью исчезают.
Стент, являющийся предметом настоящего изобретения, обладает уникальной конструкцией, вкратце описанной выше, и может производиться из кобальто-хромового сплава. Стент сконструирован таким образом, чтобы поддерживать проходимость просвета сосуда и осуществлять доставку сиролимуса к окружающим артерию тканям в целях профилактики и лечения сосудистой патологии, включая рестеноз. Сиролимус входит в состав полимерной матрицы, предпочтительно в сочетании со стабилизирующим агентом, таким как бутилированный гидрокситолуен. Каждый резервуар в составе стента заполняется раствором, содержащим сиролимус, полимер, стабилизирующий агент и растворитель. Процесс заполнения осуществляется в несколько этапов, каждый из которых сопровождается стадией высушивания в целях удаления растворителя. Конструкция каждого резервуара минимизирует выделение сиролимуса в кровоток, при этом максимально способствуя его высвобождению в окружающие стент ткани артериальной стенки.
Стент, являющийся предметом настоящего изобретения, обеспечивает контролируемую, продолжительную и местную доставку сиролимуса непосредственно к окружающим его тканям, с минимальной потерей препарата в кровоток. Настоящий стент предпочтительнее изготавливать из кобальто-хромового сплава, который является менее хрупким и обладает большей эластичностью и прочностью, а также повышенной долговечностью в сравнении со стентами, изготовленными из других материалов.
Стенты с резервуарами, выделяющими лекарственные препараты, имеют ряд преимуществ по сравнению со стентами, выделяющими лекарственные препараты и имеющими стандартное покрытие. Например, резервуары защищают депонированный полимер и лекарственную матрицу или композицию от механического разрушения при прохождении стента по извитым анатомическим структурам и сильно обызвествленным отложениям, которые могут спровоцировать расслоение поверхности стентов со стандартным покрытием. Резервуары обеспечивают большую вместимость и позволяют повысить соотношение лекарственного препарата и полимера благодаря тому, что полимеры в резервуаре не подвергаются растягиванию и деформации, как в случае полимерных покрытий. Резервуары также позволяют использовать меньшую массу полимера и, таким образом, уменьшить опорную толщину на 10-30 микрон. Резервуары позволяют при помощи одного стента осуществить доставку нескольких лекарственных препаратов и (или) терапевтических средств с независимыми профилями высвобождения и выполнить обработку металлических поверхностей стента, не затрагивая при этом его лекарственные и полимерные составляющие. Кроме того, резервуары обеспечивают большую гибкость и вариабельность в отношении выборочной направленной доставки и позиционной и (или) направленной локализованной доставки. Помимо этого, наличие резервуаров обеспечивает лучшую биосовместимость стента и сосуда, так как при имплантации стенка сосуда контактирует с поверхностью стента, выполненной по существу из оголенного металла и практически не содержащей полимеров. Это актуально в том случае, если при заполнении резервуаров композиция располагается в лунке или имеющиеся резервуары используются не в полном объеме, как подробно описано ниже.
Стенты из оголенного металла обладают преимуществами, как вкратце описано выше. Стенты с резервуарами, выделяющими лекарственные препараты, составляющие предмет настоящего изобретения, объединяют в себе лучшие характеристики, присущие стентам из оголенного металла и стентам, выделяющим лекарственные препараты. В примерах осуществления, описанных в настоящем документе, у стентов с резервуарами, выделяющими лекарственные препараты, внешняя или аблюминальная поверхности представлены приблизительно на 75% оголенным металлом и на 25% полимером и лекарственным препаратом. Если при заполнении резервуаров используется не весь объем, и они заполнены таким образом, что слои или вкладки начинаются от люминальной стороны, как описано выше, то участок поверхности, относящийся к аблюминальной стороне, стентов с резервуарами, выделяющими лекарственные препараты, на 75% представлен оголенным металлом, а остальные 25% поверхности образованы открытыми резервуарами. Иными словами, общая площадь внешней поверхности стента приблизительно на 25% состоит из площади резервуаров, остальные 75% площади поверхности составляют несущие элементы конструкции и шарниры. Такое процентное соотношение является исходным значением. Иными словами, во время имплантации стента 75% площади поверхности стента, контактирующей со стенкой сосуда, выполнено из оголенного металла, а 25% площади поверхности стента образовано резервуарами, по меньшей мере частично заполненными полимером и лекарственным препаратом, как подробно описано ниже. Однако ввиду того, что сополимер молочной и гликолевой кислот (PLGA) подвержен биологическому разложению путем гидролиза его сложных эфирных связей, приблизительно через девяносто дней в резервуарах стента не остается полимера и (или) лекарственного препарата. Соответственно, через девяносто дней поверхность стента на 100% представлена оголенным металлом, так как резервуары полностью освобождаются от содержащегося в них лекарственного препарата и полимера. Более конкретно, вся площадь поверхности стента, соприкасающаяся с сосудом, состоит из оголенного металла, и в резервуарах не остается полимера и (или) полимера и лекарственного препарата. Таким образом, благодаря доставленному лекарственному препарату удается ликвидировать рестеноз, а стент из оголенного металла остается и функционирует в качестве поддерживающей конструкции, препятствующей сужению просвета сосуда. Такая конструкция стента из оголенного металла позволяет получить положительный эффект, а именно - снижение потенциального риска развития тромбоза и (или) эмболии и противорестенозное действие в результате локальной доставки лекарственного препарата.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
Вышеизложенные и прочие характеристики и преимущества изобретения станут очевидными после более подробного описания предпочтительных вариантов осуществления изобретения, проиллюстрированных с помощью прилагаемых чертежей.
На фиг.1 представлен продольный вид стента (концы не показаны) до расширения; видны наружная поверхность стента и характерная ячеистая структура стента.
На фиг.2 представлен общий продольный вид стента, показанного на фиг.1, который подвергли модификации с целью создания резервуаров.
На фиг.3 в виде диаграммы представлен первый пример осуществления настоящего изобретения, где стент покрыт смесью сиролимуса и цилостазола.
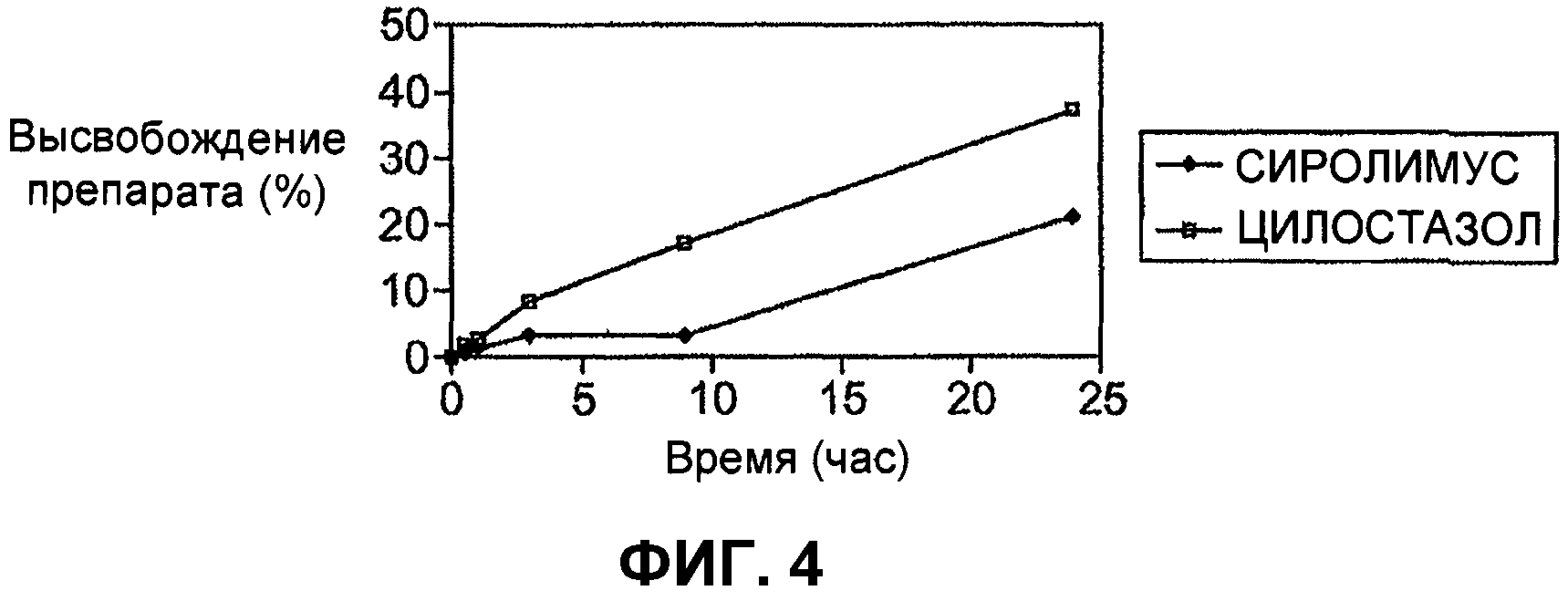
На фиг.4 графически представлена кинетика высвобождения сиролимуса и цилостазола in vitro, характерная для стента, рассматриваемого в первом примере осуществления настоящего изобретения.
На фиг.5 в виде диаграммы представлен второй пример осуществления настоящего изобретения, где стент покрыт смесью сиролимуса и цилостазола.
На фиг.6 графически представлена кинетика высвобождения сиролимуса и цилостазола in vitro, характерная для стента, рассматриваемого во втором примере осуществления настоящего изобретения.
На фиг.7 в виде диаграммы представлен третий пример осуществления настоящего изобретения, где стент покрыт смесью сиролимуса и цилостазола.
На фиг.8 представлены антитромботические свойства покрытий, содержащих смесь сиролимуса и цилостазола в экспериментальной модели кровообращения in vitro с использованием бычьей крови.
На фиг.9 графически представлена кинетика высвобождения сиролимуса и цилостазола in vivo из стента, показанного на фиг.11.
На фиг.10 графически представлена кинетика высвобождения сиролимуса и цилостазола in vitro из стента, показанного на фиг.11.
На фиг.11 в виде диаграммы представлен четвертый пример осуществления настоящего изобретения, где стент покрыт смесью сиролимуса и цилостазола.
На фиг.12 графически представлена кинетика высвобождения сиролимуса и цилостазола in vivo из стента, показанного на фиг.3.
На фиг.13 графически представлена кинетика высвобождения сиролимуса и цилостазола in vitro из стента, показанного на фиг.3.
На фиг.14 представлено изометрическое изображение расширяемого медицинского устройства с лечебным препаратом, размещенным на концах устройства.
На фиг.15 представлено изометрическое изображение расширяемого медицинского устройства с лечебным препаратом, размещенным в центральной части устройства, и без лечебного препарата на концах устройства.
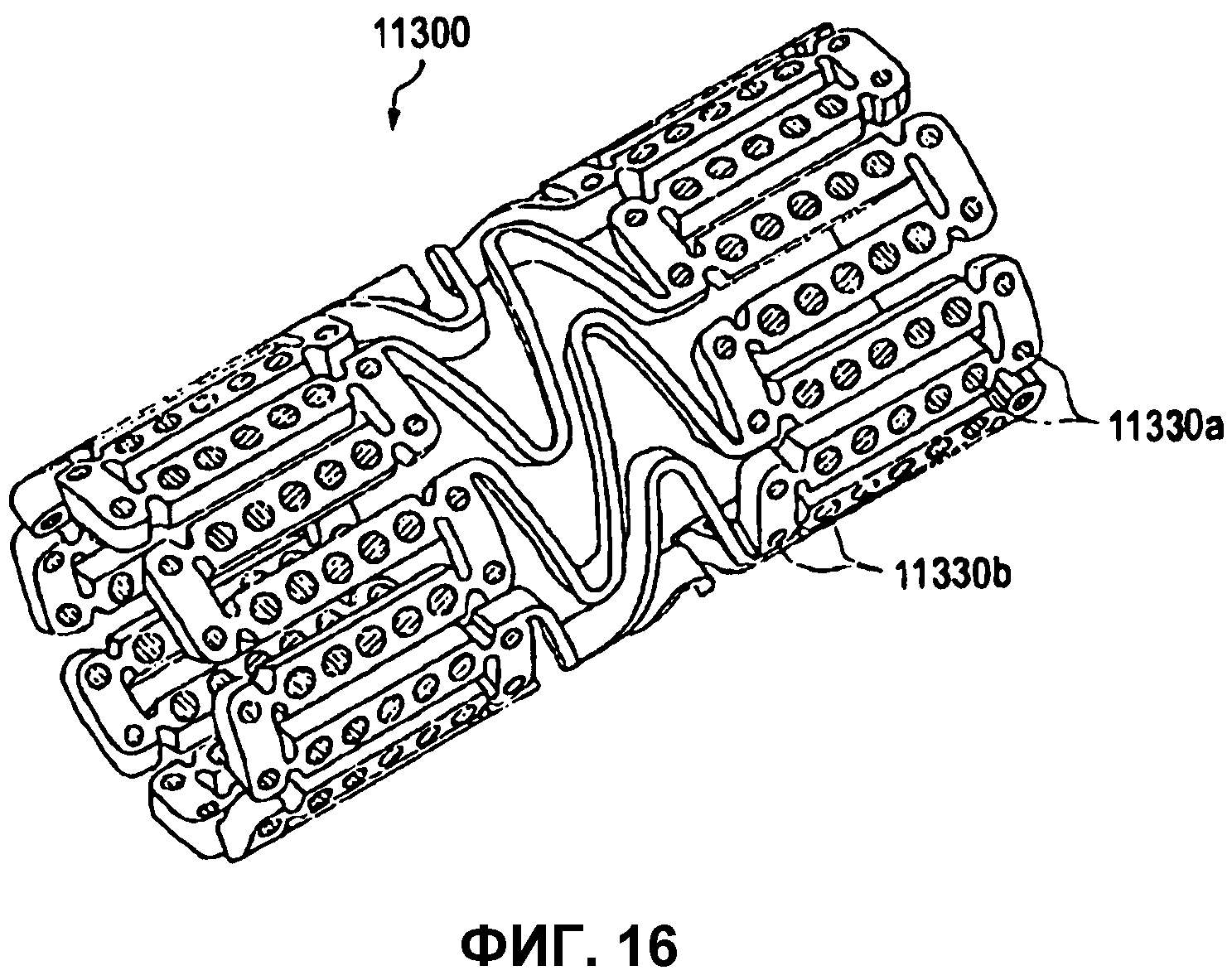
На фиг.16 представлено изометрическое изображение расширяемого медицинского устройства с различными лечебными препаратами, размещенными в различных отверстиях.
На фиг.17 представлено изометрическое изображение расширяемого медицинского устройства с различными лечебными препаратами, размещенными в перемежающихся отверстиях.
На фиг.18 представлено увеличенное боковое изображение расширяемого медицинского устройства с ячейками для лечебных препаратов, расположенными в соединительных элементах.
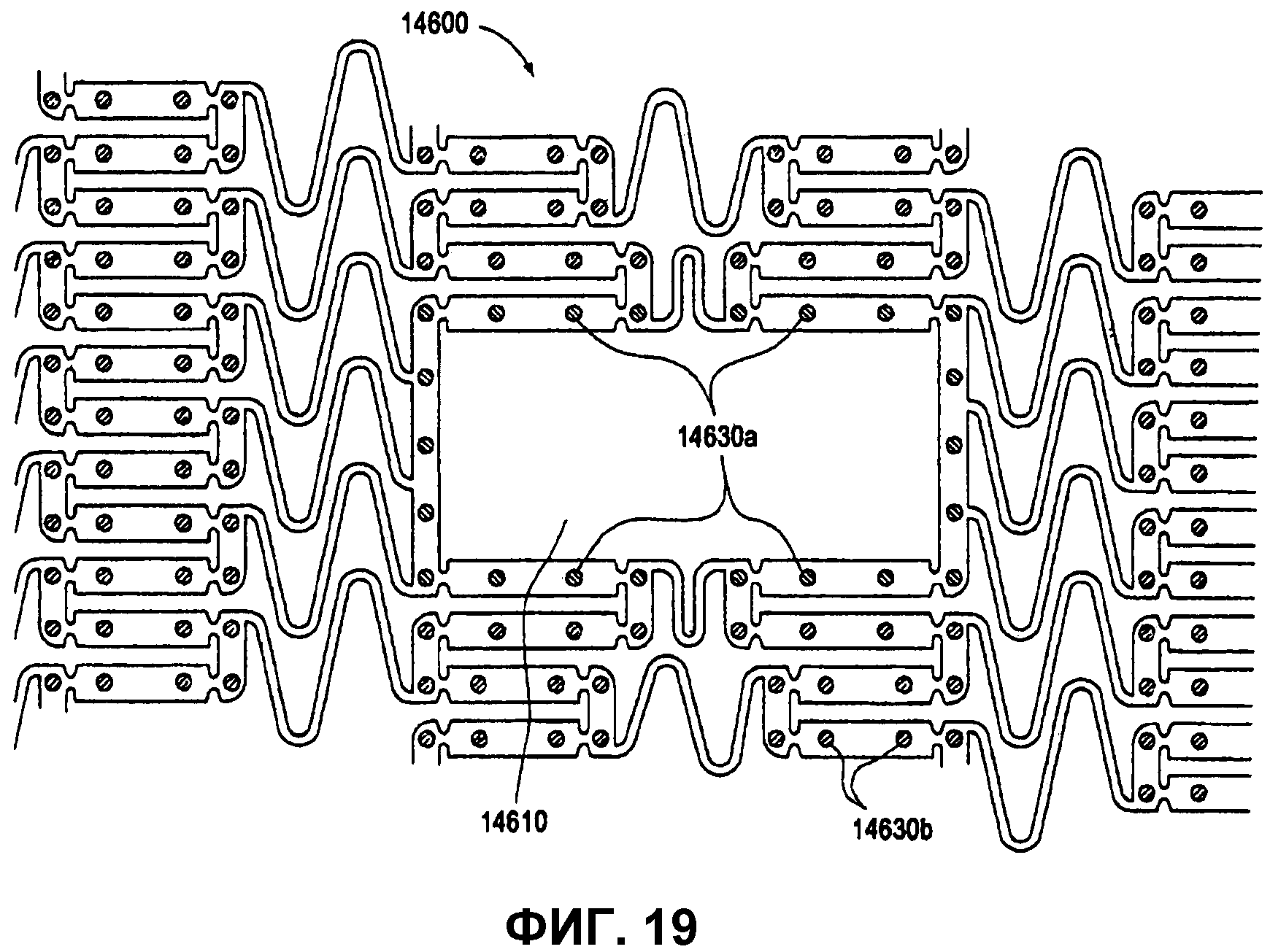
На фиг.19 представлено увеличенное боковое изображение участка расширяемого медицинского устройства с бифуркационной ячейкой.
На фиг.20 представлено изображение поперечного разреза расширяемого медицинского устройства, содержащего комбинацию первого лекарственного препарата, например, противовоспалительного агента, размещенного в первой группе ячеек, со вторым лекарственным препаратом, таким как антипролиферативный препарат, размещенным во второй группе ячеек.
На фиг.21 в качестве примера графически показана кинетика высвобождения противовоспалительного и антипролиферативного препаратов, доставляемых расширяемым медицинским устройством, представленным на фиг.20.
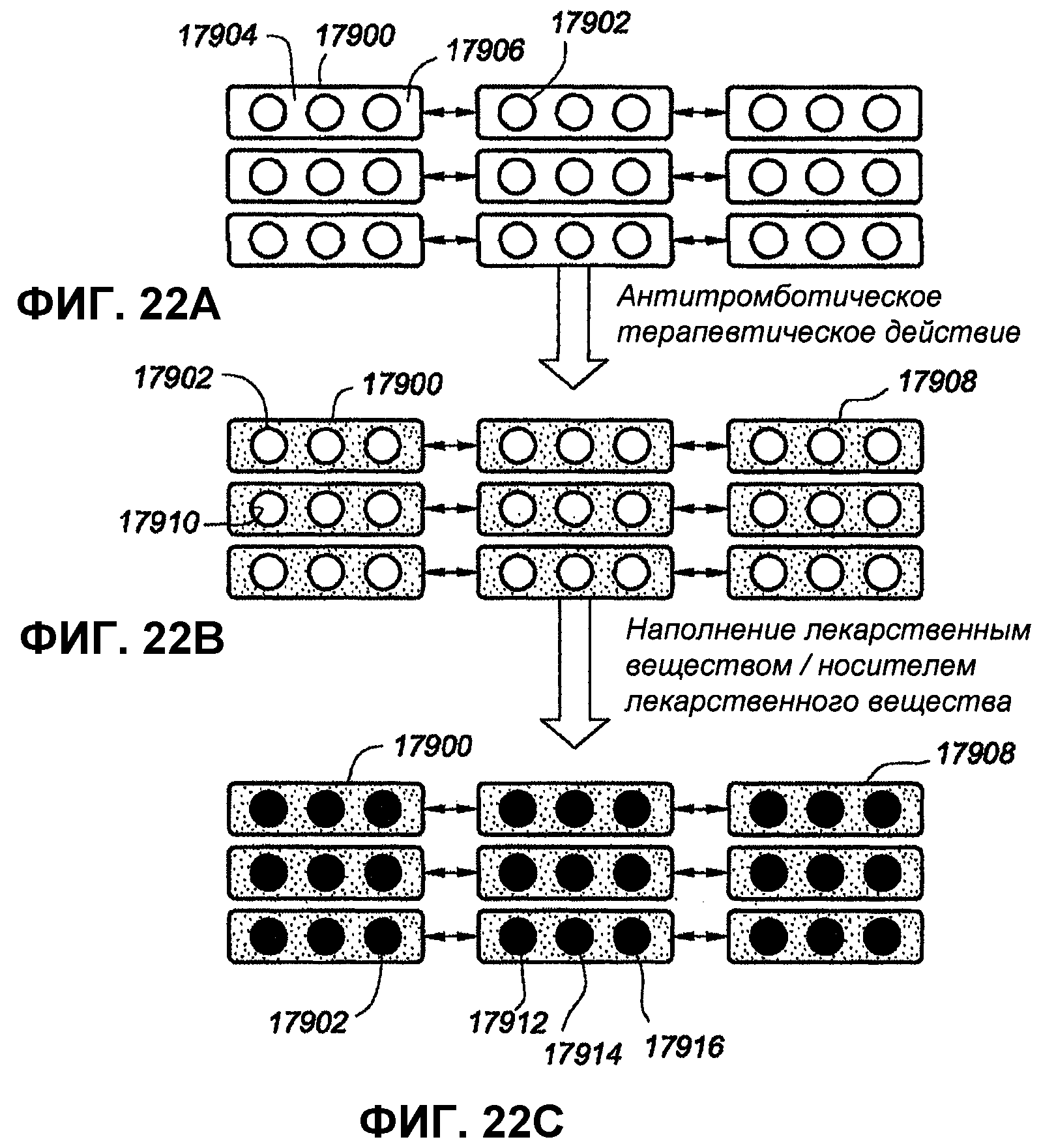
На фиг.22A, 22B и 22C представлены частично выполненные в форме диаграммы иллюстрации альтернативного варианта осуществления расширяемого медицинского устройства.
На фиг.23A, 23B и 23C представлены примеры лактидов (димеров), используемых в синтезе стереоспецифичных полилактидов.
На фиг.24 представлен поли-L-лактид.
На фиг.25 представлен поли-D-лактид.
На фиг.26A, 26B и 26C представлены схемы покрытия или депонирования с применением чередующихся слоев полимеров, имеющих идентичные терапевтическим средствам химические составы, но различные оптические свойства.
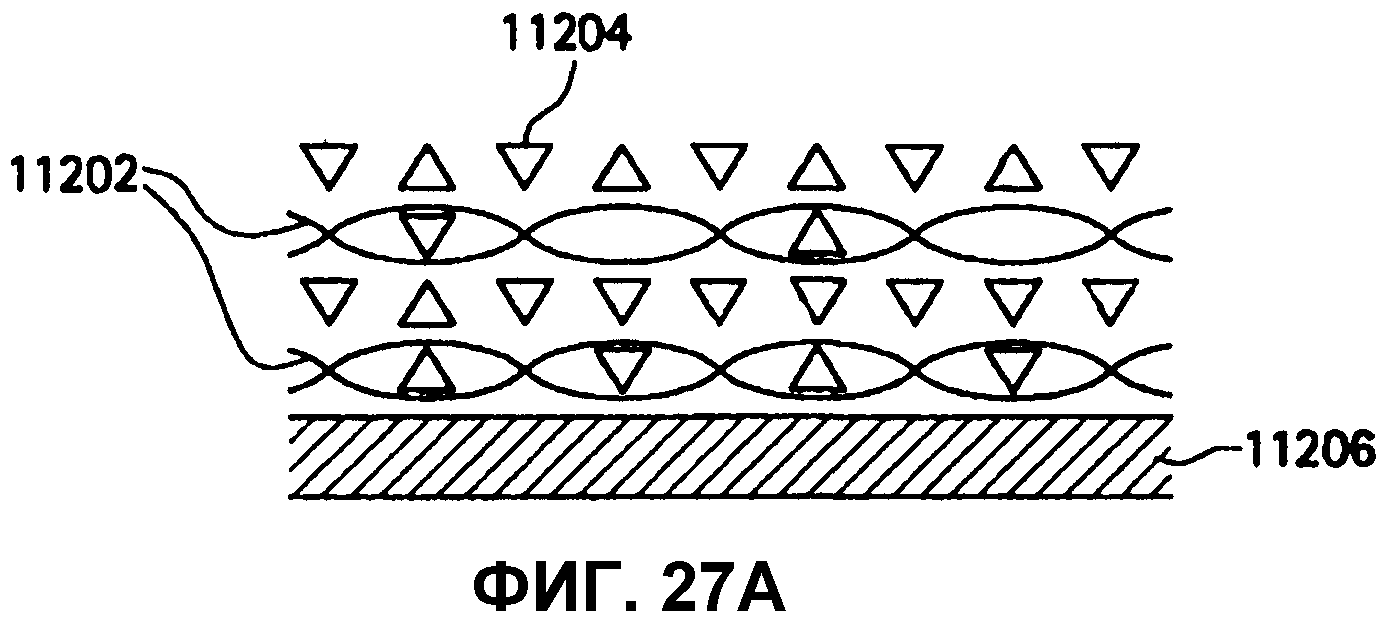
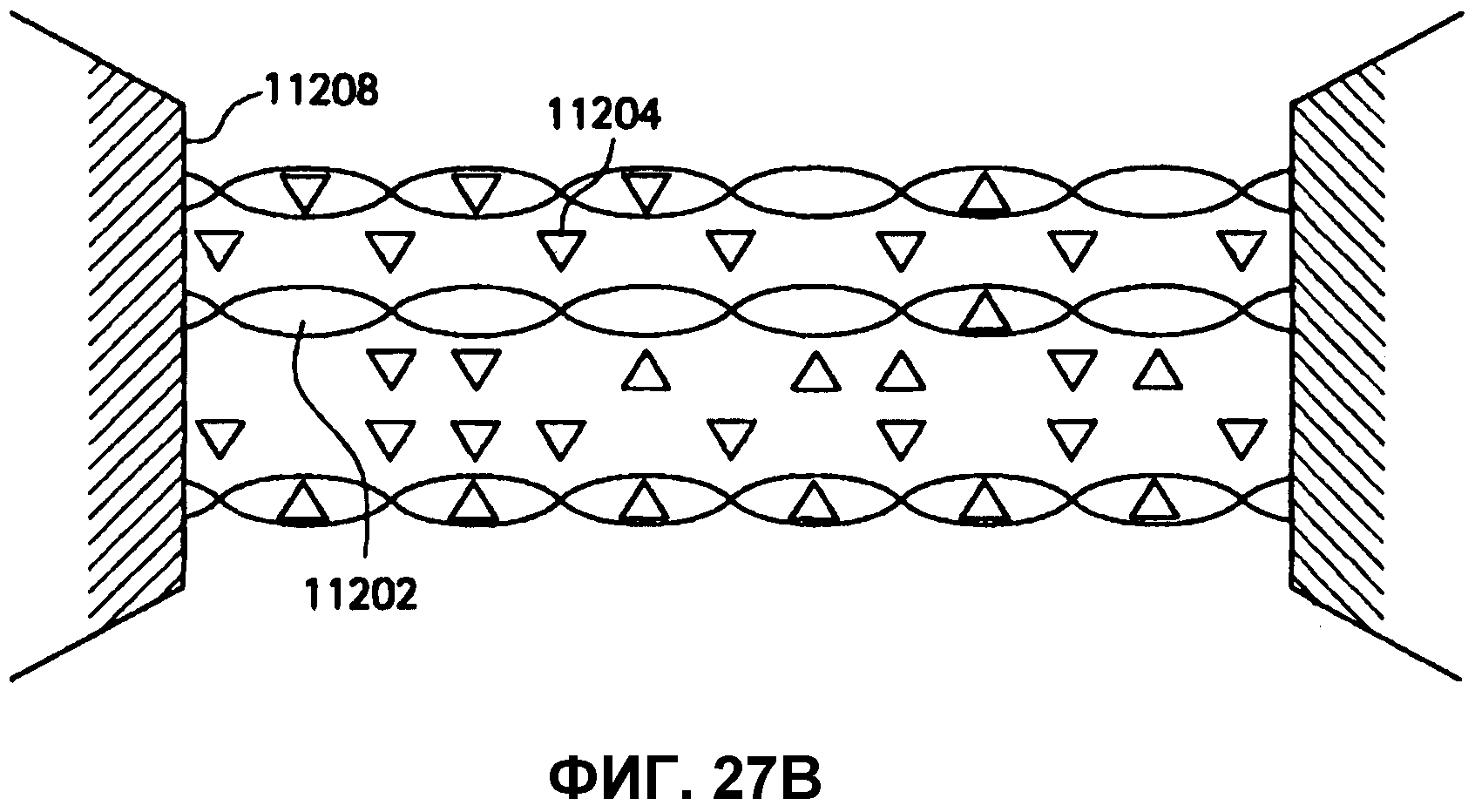
На фиг.27A и 27B представлены схемы покрытия или депонирования с применением растворов, содержащих как поли-D-молочную кислоту, так и поли-L-молочную кислоту в молярном отношении 1:1.
На фиг.28 представлено графическое боковое изображение части стента, выделяющего два лекарственных вещества.
На фиг.29 представлено графическое изображение общего высвобождения лекарственного вещества в процентном соотношении in vivo.
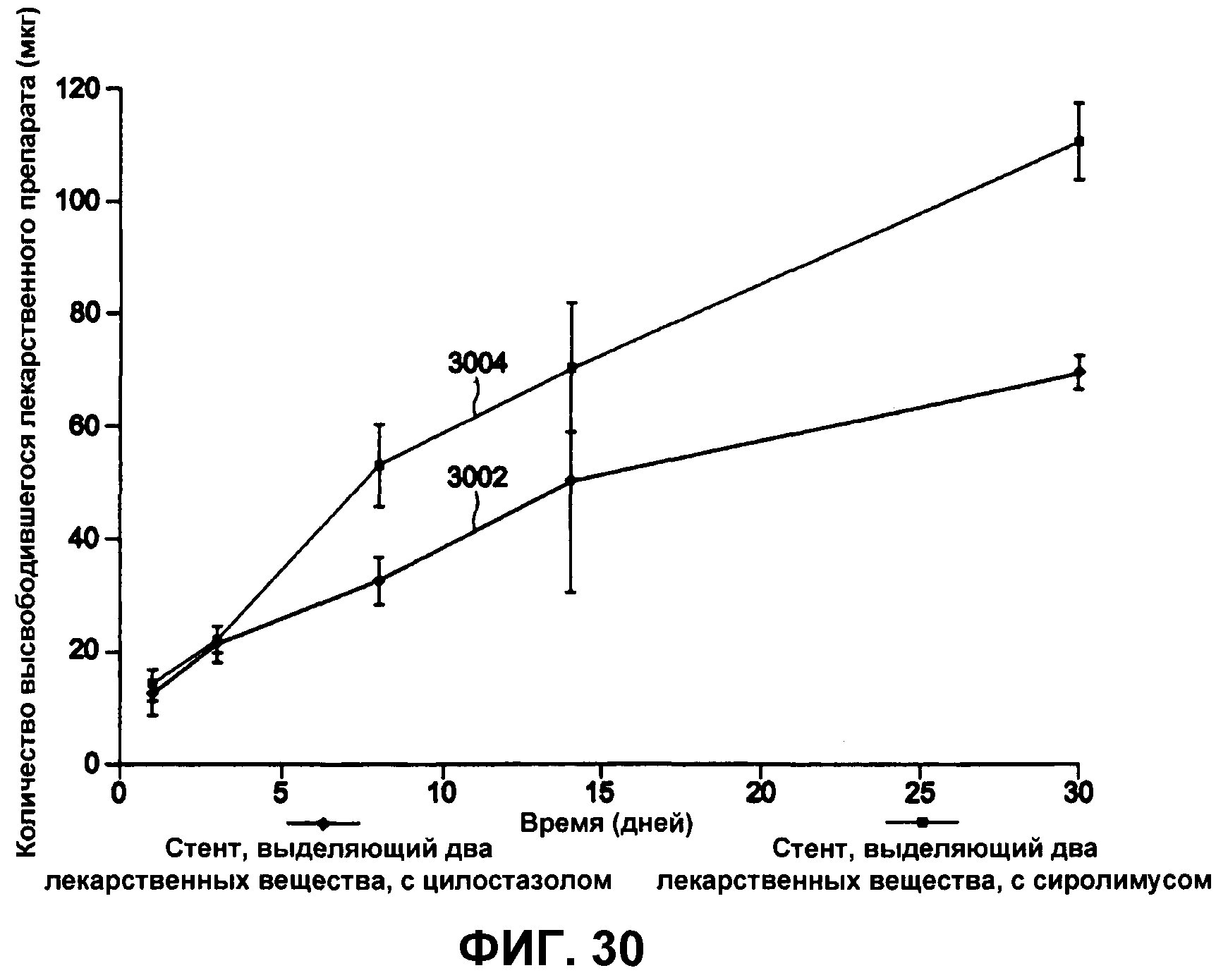
На фиг.30 графически представлено общее количество (вес.) высвободившихся сиролимуса и цилостазола in vivo.
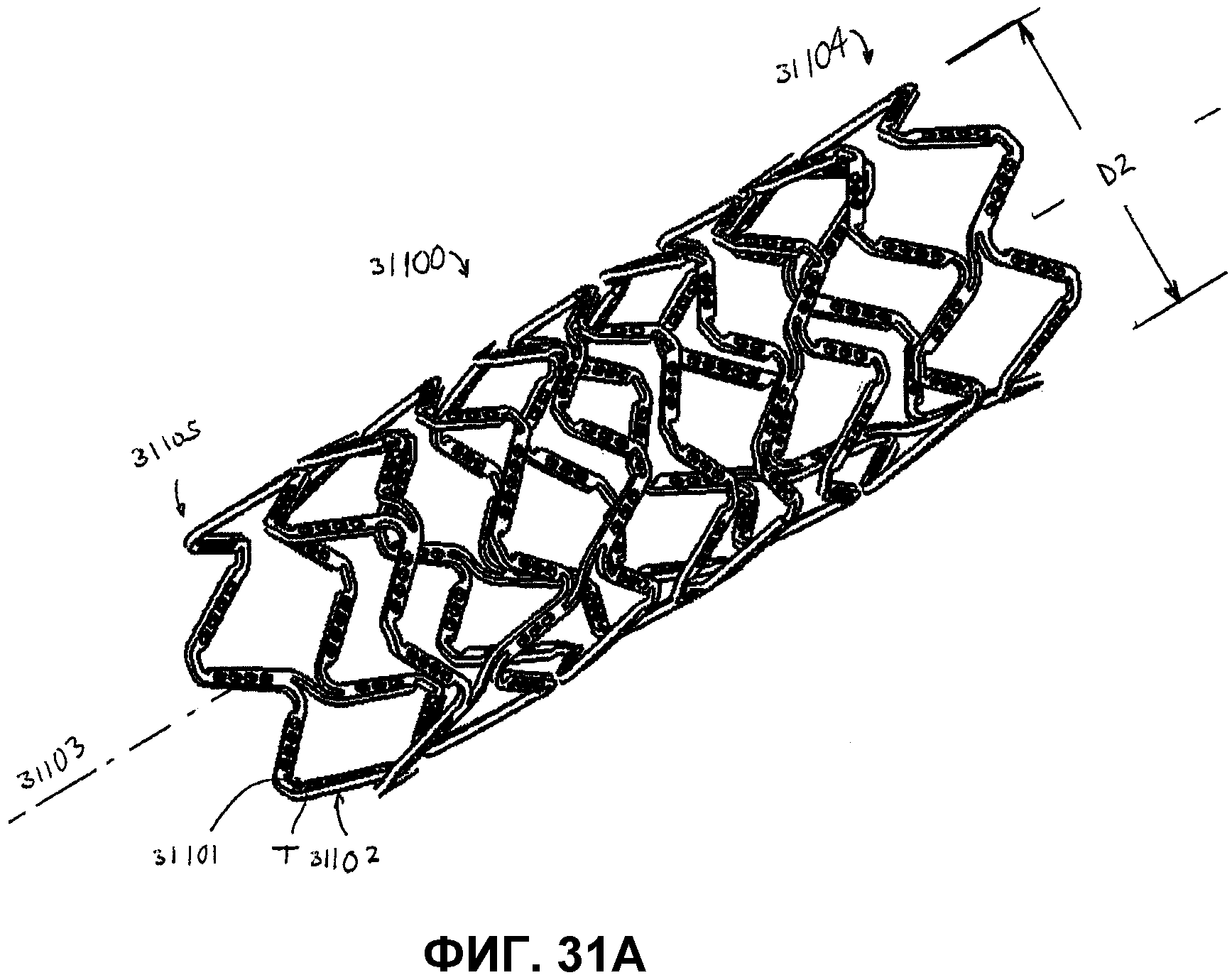
На фиг.31A представлен вид в перспективе гибкого стента в расширенном (развернутом) состоянии в соответствии с одним из вариантов осуществления настоящего изобретения.
На фиг.31B представлен вид в перспективе гибкого стента в сжатом состоянии в соответствии с одним из вариантов осуществления настоящего изобретения.
На фиг.31C представлен вид в перспективе гибкого стента в «вырезанном» (готовом) состоянии в соответствии с одним из вариантов осуществления настоящего изобретения.
На фиг.32 представлен вид в проекции на плоскость гибкого стента в соответствии с одним из вариантов осуществления настоящего изобретения.
На фиг.33 представлен вид в проекции на плоскость гибкого стента, показанного на фиг.32, с пространственным разделением компонентов.
На фиг.34A представлен приближенный вид в проекции на плоскость гибкого стента, выполненного в соответствии с одним из вариантов осуществления настоящего изобретения.
На фиг.34B представлен приближенный вид в проекции на плоскость несущего элемента конструкции гибкого стента, выполненного в соответствии с одним из вариантов осуществления настоящего изобретения.
На фиг.34C представлен приближенный вид в проекции на плоскость несущего элемента конструкции гибкого стента, выполненного в соответствии с одним из вариантов осуществления настоящего изобретения.
На фиг.34D представлен приближенный вид в проекции на плоскость органически оптимизированного несущего элемента конструкции гибкого стента, выполненного в соответствии с одним из вариантов осуществления настоящего изобретения.
На фиг.35A представлен приближенный вид в проекции на плоскость гибкого шарнира гибкого стента, выполненного в соответствии с одним из вариантов осуществления настоящего изобретения.
На фиг.35B представлен приближенный вид в проекции на плоскость гибкого шарнира гибкого стента, выполненного в соответствии с одним из вариантов осуществления настоящего изобретения.
На фиг.36A представлен приближенный вид в проекции на плоскость круглой шарнирной области гибкого стента, выполненного в соответствии с одним из вариантов осуществления настоящего изобретения.
На фиг.36B представлен приближенный вид в проекции на плоскость круглой шарнирной области гибкого стента, выполненного в соответствии с одним из вариантов осуществления настоящего изобретения.
На фиг.36C представлен приближенный вид в проекции на плоскость круглой шарнирной области гибкого стента, выполненного в соответствии с одним из вариантов осуществления настоящего изобретения.
На фиг.36D представлен приближенный вид в проекции на плоскость круглой шарнирной области гибкого стента, выполненного в соответствии с одним из вариантов осуществления настоящего изобретения.
На фиг.36E представлен приближенный вид в проекции на плоскость круглой шарнирной области гибкого стента, выполненного в соответствии с одним из вариантов осуществления настоящего изобретения.
На фиг.36F представлен приближенный вид в проекции на плоскость круглой шарнирной области гибкого стента, выполненного в соответствии с одним из вариантов осуществления настоящего изобретения.
На фиг.36G представлен приближенный вид в проекции на плоскость круглой шарнирной области гибкого стента, выполненного в соответствии с одним из вариантов осуществления настоящего изобретения.
На фиг.36H представлен приближенный вид в проекции на плоскость круглой шарнирной области гибкого стента, выполненного в соответствии с одним из вариантов осуществления настоящего изобретения.
На фиг.36I представлен приближенный вид в проекции на плоскость круглой шарнирной области гибкого стента, выполненного в соответствии с одним из вариантов осуществления настоящего изобретения.
На фиг.36J представлен приближенный вид в проекции на плоскость круглой шарнирной области гибкого стента, выполненного в соответствии с одним из вариантов осуществления настоящего изобретения.
На фиг.36K представлен приближенный вид в проекции на плоскость круглой шарнирной области гибкого стента, выполненного в соответствии с одним из вариантов осуществления настоящего изобретения.
На фиг.36L представлен приближенный вид в проекции на плоскость круглой шарнирной области гибкого стента, выполненного в соответствии с одним из вариантов осуществления настоящего изобретения.
На фиг.36M представлен приближенный вид в проекции на плоскость круглой шарнирной области гибкого стента, выполненного в соответствии с одним из вариантов осуществления настоящего изобретения.
На фиг.37 представлен приближенный вид в проекции на плоскость индексного шарнира гибкого стента, выполненного в соответствии с одним из вариантов осуществления настоящего изобретения.
На фиг.38 представлен приближенный вид в проекции на плоскость центральной зоны, изображенной на фиг.33, иллюстрирующий угол наклона спирали (витка).
На фиг.39A представлен приближенный вид в проекции на плоскость соединительного элемента конструкции, являющегося частью цикличной структуры, образующей центральную зону гибкого стента, показанного на фиг.32, и выполненного в соответствии с одним из вариантов осуществления настоящего изобретения.
На фиг.39B представлен приближенный вид в проекции на плоскость независимого элемента конструкции, являющегося частью цикличной структуры, образующей центральную зону гибкого стента, показанного на фиг.32, и выполненного в соответствии с одним из вариантов осуществления настоящего изобретения.
На фиг.40 представлен вид в проекции на плоскость гибкого стента, выполненного в соответствии с одним из вариантов осуществления настоящего изобретения.
На фиг.41 представлен вид в проекции на плоскость гибкого стента, представленного на фиг.40, в разобранном состоянии.
На фиг.42 представлен вид в проекции на плоскость гибкого стента, выполненного в соответствии с одним из вариантов осуществления настоящего изобретения.
На фиг.43 представлен вид в проекции на плоскость гибкого стента, представленного на фиг.42, в разобранном состоянии.
На фиг.44 представлен вид в проекции на плоскость гибкого стента, выполненного в соответствии с одним из вариантов осуществления настоящего изобретения.
На фиг.45 представлен вид в проекции на плоскость гибкого стента, представленного на фиг.44, в разобранном состоянии.
На фиг.46 представлен приближенный вид в проекции на плоскость независимого элемента конструкции и соединительного элемента конструкции, являющихся частью циклической структуры, образующей центральную зону гибкого стента, показанного на фиг.44 и выполненного в соответствии с одним из вариантов осуществления настоящего изобретения.
На фиг.47 представлен приближенный вид в проекции на плоскость независимого элемента конструкции и соединительного элемента конструкции, являющихся частью циклической структуры, образующей центральную зону гибкого стента, показанного на фиг.42 и выполненного в соответствии с одним из вариантов осуществления настоящего изобретения.
На фиг.48 представлен приближенный вид в проекции на плоскость независимого элемента конструкции и соединительного элемента конструкции, являющихся частью циклической структуры, образующей центральную зону гибкого стента, показанного на фиг.40 и выполненного в соответствии с одним из вариантов осуществления настоящего изобретения.
На фиг.49 представлен вид в проекции на плоскость гибкого стента без накопительных депо, выполненного в соответствии с одним из вариантов осуществления настоящего изобретения.
ПОДРОБНОЕ ОПИСАНИЕ ПРЕДПОЧТИТЕЛЬНЫХ ВАРИАНТОВ ОСУЩЕСТВЛЕНИЯ
Препарат (комбинация препаратов) и устройства доставки, охватываемые рамками настоящего изобретения, могут использоваться для эффективного предотвращения и лечения заболеваний сосудов, в частности, заболеваний сосудов, вызванных повреждениями сосудов. Различные медицинские устройства, используемые при лечении заболеваний сосудов, могут в итоге вызывать дальнейшие осложнения. Например, процедура баллонной ангиопластики используется для улучшения кровотока через артерию и является предпочтительным способом лечения стеноза коронарных сосудов. Однако, как описано выше, обычно эта процедура приводит к определенному повреждению стенки сосуда, тем самым потенциально усугубляя проблему в будущем. Хотя другие процедуры и заболевания также могут приводить к подобным повреждениям, примеры осуществления настоящего изобретения будут описаны применительно к лечению рестеноза и связанных с ним осложнений, возникающих в результате чрескожной транслюминальной коронарной ангиопластики и иных подобных манипуляций на артериальных/венозных сосудах, включая процедуру соединения артерий, вен и других сосудов, переносящих жидкость. Помимо этого, будут описаны различные способы и устройства для эффективной доставки медицинских устройств с покрытием.
Тогда как примеры осуществления настоящего изобретения будут описаны применительно к лечению рестеноза и сопутствующих осложнений, возникающих в результате чрескожной транслюминальной коронарной ангиопластики, важно отметить, что локальная доставка препарата (комбинации препаратов) может применяться для лечения широкого спектра патологических состояний с использованием любого количества медицинских устройств или для улучшения работы и (или) увеличения срока службы устройства. Например, искусственные хрусталики, имплантируемые для восстановления зрения после удаления катаракты, часто провоцируют развитие вторичной катаракты. Последняя, как правило, является результатом чрезмерного разрастания клеток на поверхности хрусталика, что потенциально можно свести к минимуму, если использовать устройство в сочетании с препаратом или препаратами. Для других медицинских устройств, которые часто выходят из строя вследствие врастания ткани или отложения белкового материала внутри, на поверхности или вокруг устройства, такого как шунты при гидроцефалии, катетеры для диализа, устройства для прикрепления калоприемников, ушные дренажные трубки, электроды кардиостимуляторов и имплантируемых дефибрилляторов, подход «комбинация «устройство доставки-препарат» также может быть полезным. Применение устройств, которые служат для улучшения структуры и функции ткани или органа, в сочетании с подходящим препаратом или препаратами также имеет больше преимуществ. Например, улучшенная остеоинтеграция протезов для повышения стабилизации имплантатов потенциально может быть достигнута путем их комбинирования с такими препаратами, как костный морфогенетический белок. Аналогичным образом другие хирургические средства и устройства, шовный материал, скобы, устройства для анастомоза позвоночные диски, костные стержни, фиксаторы шовного материала, гемостатические барьеры, скобки, винты, металлические пластинки для соединения костных отломков, обоймы сшивающих аппаратов, сосудистые протезы, тканевой клей и герметики, тканевые каркасы, различные виды перевязочного материала, заменители кости, внутрипросветные устройства и опоры для сосудов также могут обеспечивать значительный лечебный эффект для пациентов, если применить подход «комбинация «устройство доставки-препарат». В частности, эффективными могут быть периваскулярные обертывания сами по себе или в сочетании с другими медицинскими устройствами. Периваскулярные обертывания могут обеспечивать дополнительную доставку лекарственного препарата к месту лечения. В сущности, любое медицинское устройство может быть тем или иным способом покрыто лекарственным препаратом или комбинацией лекарственных препаратов, что улучшает результаты лечения по сравнению с применением устройства или фармацевтического препарата по отдельности.
Кроме того, различные медицинские устройства и покрытия этих устройств могут использоваться для доставки лечебных и фармацевтических препаратов, включая: антипролиферативные (антимиотические) препараты, в том числе натуральные продукты, такие как алкалоиды барвинка (а именно, винбластин, винкристин и винорелбин), паклитаксел, эпиподофиллотоксины (а именно, этопозид, тенипозид),антибиотики (дактиномицин (актиномицин D), даунорубицин, доксорубицин и идарубицин), антрациклины, митоксантрон, блеомицины, пликамицин (митрамицин) и митомицин,ферменты (L-аспарагиназа, которая систематически метаболизирует L-аспарагин и удаляет клетки, которые не способны синтезировать собственный аспарагин), антитромбоцитарные средства, такие как ингибиторы гликопротеина G(GP) llb/llla и антагонисты рецепторов витронектина; антипролиферативные/антимитотические алкилирующие агенты, такие как азотистые иприты (мехлоретамин, циклофосфамид и его аналоги, мелфалан, хлорамбуцил), этиленимины и метилмеламины (гексаметилмеламин и тиотепа), алкилсульфонаты - бусульфан, нитрозомочевины (кармустин (BCNU) и его аналоги, стрептозоцин), триазены - дакарбазин (DTIC), антипролиферативные/антимитотические антиметаболиты, такие как аналоги фолиевой кислоты (метотрексат), аналоги пиримидина (фторурацил, флоксуридин и цитарабин), аналоги пурина и соответствующие ингибиторы (меркаптопурин, тиогуанин, пентостатин и 2-хлородеоксиаденозин {кладрибин}), координационные комплексы платины (цисплатин, карбоплатин), прокарбазин, гидроксимочевина, митотан, аминоглутетимид, гормоны (а именно, эстроген), антикоагулянты (гепарин, синтетические гепариновые соли и другие ингибиторы тромбина), фибринолитические средства (такие как тканевой активатор плазминогена, стрептокиназа и урокиназа), аспирин, дипиридамол, тиклопидин, клопидогрел, абциксимаб; средства, препятствующие миграции, антисекреторные препараты (брефельдин), противовоспалительные средства, например, адренокортикальные стероиды (кортизол, кортизон, флудрокортизон, преднизон, преднизолон, 6α-метилпреднизолон, триамцинолон, бетаметазон и дексаметазон), нестероидные агенты (производные салициловой кислоты, а именно, аспирин), производные парааминофенола, а именно, ацетаминофен, индол- и инден-уксусные кислоты (индометацин, сулиндак и этодолак), гетероарил-уксусные кислоты (толметин, диклофенак и кеторолак), арилпропионовые кислоты (ибупрофен и его производные), антраниловые кислоты (мефенамовая кислота и меклофенамовая кислота), энолиевые кислоты (пироксикам, теноксикам, фенилбутазон и оксифентатразон), набуметон, соединения золота (ауранофин, ауротиоглюкоза, ауротиомалат натрия), иммуносупрессивные препараты (циклоспорин, такролимус (FK-506), сиролимус (рапамицин), азатиоприн, микофенолата мофетил), ангиогенные средства: фактор роста эндотелия сосудов (ФРЭС), фактор роста фибробластов (ФРФ), блокаторы рецепторов ангиотензина, доноры оксида азота, антисмысловые олигонуклеотиды и их комбинации, ингибиторы клеточного цикла, ингибиторы mTOR и ингибиторы киназы, передающей сигнал от рецептора фактора роста, ретиноиды, ингибиторы циклина/циклин-зависимой киназы, ингибиторы ГМГ-КоА редуктазы (статины) и ингибиторы протеазы.
Как указано в настоящем документе, имплантация коронарного стента в сочетании с баллонной ангиопластикой является высокоэффективным способом лечения острого закрытия сосудов и может сократить риск развития рестеноза. Интраваскулярные ультразвуковые исследования (Mintz et al., 1996) позволяют предположить, что коронарное стентирование эффективно предотвращает сужение сосудов, и что в большинстве случаев поздняя утрата люминального просвета после имплантации стента происходит вследствие разрастания бляшек, что в свою очередь может быть вызвано неоинтимальной гиперплазией. Частота поздней утраты люминального просвета после коронарного стентирования практически в два раза выше, чем после традиционной баллонной ангиопластики. Таким образом, поскольку стенты препятствуют развитию по меньшей мере части процесса образования рестеноза, то использование комбинаций лекарственных препаратов, веществ или соединений, которые препятствуют пролиферации гладкомышечных клеток, уменьшают воспаление, замедляют процесс коагуляции, или препятствуют пролиферации гладкомышечных клеток путем нескольких механизмов, уменьшают воспаление и замедляют процесс коагуляции, в сочетании со стентом может обеспечить более эффективную профилактику постангиопластического рестеноза. Систематическое применение препаратов, веществ и соединений в сочетании с локальной доставкой этих или других препаратов (комбинаций препаратов) также может обеспечить более эффективный способ лечения.
Локальная доставка лекарственного препарата (комбинации препаратов) посредством стента имеет ряд преимуществ, а именно: предотвращение сужения просвета сосудов и ремоделирования сосудов благодаря каркасной функции стента и предотвращение множества компонентов неоинтимальной гиперплазии или рестеноза, а также ослабление воспалительных процессов и снижение риска возникновения тромбоза. Локальное введение лекарственного препарата, веществ или соединений в стентированные коронарные артерии также может принести дополнительную терапевтическую пользу. Например, более высокие концентрации лекарственного препарата, агентов или соединений в ткани можно достичь скорее посредством локальной доставки, чем путем системного введения. Кроме того, локальная доставка, в отличие от системного введения, позволяет снизить общую токсичность, поддерживая при этом более высокие концентрации препарата в ткани. Кроме того, в случае использования локальной доставки с поверхности стента, в отличие от системного введения, для обеспечения хорошего комплайенса пациента может быть достаточно одной процедуры. Дополнительным преимуществом лечения с использованием комбинации лекарственного препарата, агентов или соединений может быть уменьшение дозы каждого лекарственного препарата, агента или соединения, благодаря чему снижается их токсичность, при этом все равно достигается уменьшение рестеноза, воспаления и тромбоза. Локальная терапия, основанная на применении стента, таким образом, является средством увеличения терапевтического индекса (эффективность/токсичность) антирестенозных, противовоспалительных, антитромботических препаратов, агентов или соединений.
Существует множество различных стентов, которые могут использоваться после чрескожной транслюминальной коронарной ангиопластики. Хотя в соответствии с настоящим изобретением может применяться любое количество стентов, для простоты в примерах осуществления настоящего изобретения будет описано ограниченное количество стентов. Специалистам в данной области будет понятно, что применительно к настоящему изобретению возможно использование любого количества стентов. Кроме того, как описано выше, возможно использование других медицинских устройств.
Стент обычно представляет собой трубчатую конструкцию, оставляемую в просвете канала для устранения окклюзии. Обычно стент вставляют в просвет в нерасширенной форме, а затем расширяют автономно или при помощи другого устройства in situ. Типичным способом расширения является расширение при помощи баллона для ангиопластики, установленного на катетере. Баллон раздувается внутри стенозированного сосуда или канала тела, для того чтобы рассечь и разрушить препятствия, связанные с элементами стенки сосуда, и расширить его просвет.
На фиг.1 представлен пример стента 100, который может использоваться в соответствии с примером осуществления настоящего изобретения. Расширяемый цилиндрический стент 100 включает в себя структуру с многочисленными отверстиями, предназначенную для помещения в кровеносный сосуд, канал или просвет для удержания сосуда, канала или просвета в открытом состоянии, более конкретно - для защиты сегмента артерии от рестеноза после ангиопластики. Стент 100 может расширяться по окружности и поддерживаться в расширенной конфигурации, то есть он остается жестким по окружности или по радиусу. Стент 100 является гибким в осевом направлении, и при сгибании по полосе стент 100 не будет содержать какие-либо выступающие наружу элементы.
Стент 100 обычно состоит из первого и второго концов с промежуточным участком между ними. Стент 100 имеет продольную ось и содержит множество продольно расположенных полос 102, где каждая полоса 102 определяет границы непрерывной волны вдоль сегмента, параллельного продольной оси. Множество связующих звеньев 104, расположенных по окружности, поддерживает прочную трубчатую структуру полос 102. Фактически каждая из продольно расположенных полос 102 с определенной периодичностью соединяется при помощи коротких соединительных звеньев 104, расположенных по окружности, с соседней полосой 102. Волна, образуемая каждой из полос 102, имеет практически одинаковую пространственную частоту в промежуточной части, а полосы 102 расположены таким образом, что образуемые ими волны по существу совпадают друг с другом по фазе. Как показано на чертеже, каждая продольно расположенная полоса 102 проходит приблизительно через два цикла до связующего звена, соединяющего ее со смежной полосой 102.
Стент 100 может быть изготовлен любым из множества способов. Например, стент 100 может быть изготовлен из полой или формованной трубки из нержавеющей стали, которая может быть механически обработана при помощи лазера, электроразрядной фрезеровки, путем химического травления или другими способами. Стент 100 вводится в тело и помещается на желаемом месте в нерасширенном виде. В одном примере осуществления изобретения расширение производится в кровеносном сосуде при помощи баллонного катетера, где конечный диаметр стента 100 - функция диаметра используемого баллонного катетера.
Следует учитывать, что стент 100 в соответствии с настоящим изобретением может быть выполнен из материала с эффектом запоминания формы, включая, например, подходящий сплав никеля и титана или нержавеющую сталь. Конструкции, выполненные из нержавеющей стали, могут быть саморасширяемыми, что обеспечивается заданной конфигурацией стали, например, определенным типом плетения. В данном примере осуществления изобретения после того, как стент 100 был сформирован, он может быть сжат таким образом, чтобы занимать достаточно небольшое место, для того чтобы его можно было вставить в кровеносный сосуд или другую ткань при помощи соответствующих средств, которые включают подходящий катетер или гибкий стержень. Выходя из катетера, стент 100 благодаря своей конфигурации расширяется, принимая необходимую форму, при этом расширение происходит автоматически или инициируется изменением давления, температуры или путем электрической стимуляции.
На фиг.2 представлен пример осуществления изобретения с использованием стента 100, показанного на фиг.1. Как показано на чертеже, стент 100 может быть модифицирован с целью создания одного или нескольких резервуаров 106. Каждый из резервуаров 106 может быть открыт или закрыт по мере необходимости. Эти резервуары 106 могут быть специально предназначены для удержания в них препарата (комбинации препаратов), который необходимо доставить. Независимо от конструкции стента 100, предпочтительно использовать специфическую дозу применяемого препарата (комбинации препаратов) и их достаточную концентрацию, для того чтобы обеспечить эффективную дозировку в зоне поражения. При этом размер резервуаров, расположенных в полосах 102, предпочтительно должен быть достаточным для размещения дозы препарата (комбинации препаратов) в необходимом месте и в требуемом количестве.
В другом примере осуществления изобретения внутренняя и наружная поверхности стента 100 могут быть полностью покрыты препаратом (комбинацией препаратов) в терапевтических дозировках. Подробное описание препарата для лечения рестеноза, а также примеры методов нанесения покрытия описаны ниже. Однако необходимо отметить, что способы нанесения покрытия могут быть различными в зависимости от препарата (комбинаций препаратов). Также способы нанесения покрытия зависят от материала стента или других внутрипросветных медицинских устройств.
Рапамицин - макроциклический триеновый антибиотик, продуцируемый бактериями Streptomyces hygroscopicus, как описано в патенте США № 3929992. Было установлено, что рапамицин, помимо прочего, подавляет пролиферацию гладкомышечных клеток сосудов in vivo. Таким образом, рапамицин или рапамицины могут применяться в лечении гиперплазии гладкомышечных клеток интимы, рестеноза и окклюзии сосудов у млекопитающего, в особенности после биологического или механического повреждения сосудов или в условиях, которые предрасполагают к таким сосудистым повреждениям у млекопитающего. Рапамицины выполняют функции ингибирования пролиферации гладкомышечных клеток и не препятствуют реэндотелизации стенок сосуда.
Рапамицины уменьшают сосудистую гиперплазию, противодействуя пролиферации клеток гладкой мускулатуры в ответ на митогенные сигналы, вырабатываемые во время повреждения в результате ангиопластики. Считается, что ингибирование пролиферации клеток гладкой мускулатуры, опосредованной фактором роста и цитокином, в поздней фазе G1 клеточного цикла является доминантным механизмом действия рапамицина. Однако известно, что при системном введении рапамицин предотвращает Т-клеточную пролиферацию и дифференциацию. На этом основано его иммуносупрессивное действие и его способность предотвращать отторжение имплантата.
В рамках настоящего изобретения рапамицин включает рапамицин и все его аналоги, производные и конъюгаты, которые связываются с FKBP12, и другими иммунофилинами, и обладает такими же фармакологическими свойствами, что рапамицин, включая ингибирование TOR или mTOR.
Хотя антипролиферативный эффект рапамицина может быть достигнут путем системного применения, лучших результатов можно достичь путем локальной доставки соединения. Рапамицин главным образом работает в тканях, находящихся в непосредственной близости от соединения, и по мере удаления от устройства доставки эффект снижается. Для того чтобы максимально использовать этот эффект, необходимо обеспечить непосредственный контакт рапамицина со стенками внутри сосуда. Поэтому в предпочтительном примере осуществления изобретения рапамицин помещен на поверхность стента или на его части. В предпочтительном варианте осуществления рапамицин инкорпорирован в стент 100, представленный на фиг.1, где стент 100 контактирует со стенкой просвета.
Рапамицин может быть нанесен на стент или прикреплен к стенту различными способами. В одном из примеров осуществления изобретения рапамицин инкорпорируют непосредственно в полимерную матрицу и распыляют по наружной поверхности стента. С течением времени рапамицин выделяется из полимерной матрицы и проникает в окружающую ткань. Предпочтительно, чтобы рапамицин оставался на поверхности стента по меньшей мере в течение периода от трех дней до шести месяцев, более предпочтительным вариантом является период от семи до тридцати дней.
Рапамициновые покрытия можно нанести на стент путем погружения, напыления или методом центрифугирования, и (или) комбинируя названные методы. Допустимо использование различных полимеров. Например, могут использоваться поли-(сополимер этилена и винилацетата) и полибутилметакрилат. Также могут применяться и другие полимеры, включая, помимо прочего, сополимер поливинилиденфторида и гексафторпропилена и сополимер полиэтилбутилметакрилата и гексилметакрилата. Барьерное или наружное покрытие также может применяться для модулирования выделения рапамицина из полимерной матрицы.
Необходимо отметить, что стент, как описано выше, может быть изготовлен из различных материалов, включая различные металлы, полимерные и керамические материалы. Следовательно, для фиксации различных лекарственных препаратов, агентов и комбинаций соединений могут применяться различные технологии. В частности, помимо полимерных матриц, описанных выше, могут применяться биополимеры. В большинстве случаев биополимеры можно отнести к естественным полимерам, тогда как вышеописанные полимеры относятся к синтетическим полимерам. Примеры биополимеров, которые могут быть использованы, включают агарозу, альгинат, желатин, коллаген и эластин. Кроме того, лекарственные препараты, агенты или соединения могут применяться в сочетании с другими медицинскими устройствами, вводимыми чрескожным путем, такими как имплантаты и перфузионные баллоны.
Молекулярные механизмы, отвечающие за действие рапамицина, известного антипролиферативного препарата, действие которого направлено на уменьшение выраженности проявления и продолжительности неоинтимальной гиперплазии, все еще изучаются. Однако известно, что рапамицин проникает в клетки и связывается с высокоаффинным цитозольным белком FKBP12. Комплекс рапамицина и FKPB12 в свою очередь связывает и ингибирует фосфоинозитидную (Pl)-3 киназу или «мишень рапамицина у млекопитающих» (TOR). TOR является протеинкиназой, которая играет ключевую роль в опосредовании сигнального пути, связанного с митогенными факторами роста и цитокинами в гладкомышечных клетках и T-лимфоцитах. Этот путь включает фосфорилирование p27, фосфорилирование p70 s6 киназы и фосфорилирование 4BP-1, важного регулятора трансляции белка.
Общепризнанным является тот факт, что рапамицин сокращает рестеноз путем ингибирования неоинтимальной гиперплазии. Однако существуют доказательства того, что рапамицин также может ингибировать другой важный компонент рестеноза, а именно, отрицательное ремоделирование. Ремоделирование представляет собой процесс, механизм которого еще недостаточно изучен, однако известно, что результатом ремоделирования у людей является истончение наружной эластической мембраны и сужение просвета сосуда в течение периода от трех до шести месяцев.
Отрицательное, или констриктивное, ремоделирование сосудов может быть выражено количественно ангиографически как процент сужения просвета сосуда в очаге поражения, где нет стента, препятствующего процессу. Если поздняя потеря просвета ликвидирована в месте поражения, можно предположить, что отрицательное ремоделирование подавлено. Другой способ определения степени ремоделирования включает измерение в месте повреждения наружной эластической мембраны при помощи интраваскулярного ультразвука (ИВУЗ). Интраваскулярный ультразвук представляет собой способ, который позволяет получить изображение наружной эластической мембраны, а также просвета сосуда. Изменения в наружной эластической мембране проксимально и дистально относительно стента, начиная с послеоперационного периода и далее до четырех и двенадцати месяцев динамического наблюдения, являются отражением ремоделирующих изменений.
Доказательства того, что рапамицин влияет на процесс ремоделирования, получены в ходе имплантологических исследований на человеке, в которых стенты с рапамициновым покрытием показали очень низкий уровень возникновения рестеноза как в месте повреждения, так и в месте имплантации стента. Под местом повреждения, как правило, понимается расстояние с обеих сторон имплантации стента, т.е. проксимально и дистально, равное приблизительно 5 мм. Поскольку в тех участках, где стента нет, но которые находятся под действием баллонного расширения, контроль процесса ремоделирования невозможен, можно предположить, что рапамицин предотвращает ремоделирование сосудов.
Данные в таблице 1, представленной ниже, демонстрируют, что в месте повреждения процент сужения просвета в группах пациентов, которым вводили рапамицин, ниже даже через двенадцать месяцев. Таким образом, результаты поддерживают предположение о том, что рапамицин замедляет ремоделирование.
Дополнительное доказательство, подтверждающее замедление отрицательного ремоделирования при помощи рапамицина, получено на основе данных интраваскулярного ультразвукового исследования, которые были получены в ходе клинической программы исследований, проводимых в случаях, когда впервые планируется вводить исследуемый препарат в организм человека, как представлено в таблице 2.0, приведенной ниже.
Данные исследования показали, что проксимальная или дистальная потеря области сосуда минимальна, что в свою очередь говорит о подавлении процесса отрицательного ремоделирования в сосудах, в которые были имплантированы стенты с рапамициновым покрытием.
За исключением самого стента нет других эффективных решений проблемы ремоделирования сосудов. Таким образом, рапамицин может представлять собой биологический подход к контролю феномена ремоделирования сосудов.
Можно предположить, что рапамицин способен уменьшать отрицательное ремоделирование несколькими способами. Путем специфической блокады пролиферации фибробластов в стенке сосуда в ответ на повреждение рапамицин может уменьшать образование рубцовой ткани в сосуде. Рапамицины также могут влиять на трансляцию ключевых белков, участвующих в образовании и метаболизме коллагена.
В предпочтительном варианте осуществления изобретения для доставки рапамицина, контролирующего процесс отрицательного ремоделирования сегмента артерии после баллонной ангиопластики путем уменьшения или предотвращения рестеноза, применяется устройство локальной доставки. Несмотря на то что может применяться любое средство доставки, в предпочтительном варианте устройство доставки включает в себя стент, имеющий покрытие или оболочку, которая элюирует или высвобождает рапамицин. Система доставки для такого устройства может включать в себя локальный инфузионный катетер, который доставляет рапамицин со скоростью, контролируемой специалистом, осуществляющим введение. В других вариантах осуществления может применяться инъекционная игла.
Рапамицины также могут доставляться системно в виде лекарственной формы для перорального применения или инъецируемой депонируемой лекарственной формы для длительного применения, или в виде пластыря для доставки рапамицина в течение периода времени в диапазоне от семи до сорока пяти дней, чтобы достичь в ткани сосуда уровней, достаточных для подавления отрицательного ремоделирования. Такой вид терапии следует применять для уменьшения или предотвращения рестеноза, осуществляя введение рапамицина за несколько дней до элективной ангиопластики с применением стента или без него.
Данные, полученные в результате исследований на экспериментальных моделях свиней и кроликов, показывают, что выделение рапамицина в сосудистую стенку из неподдающегося эрозии полимерного покрытия стента в диапазоне доз (35-430 мкг на коронарный стент размером 15-18 мм) обеспечивает уменьшения реакции неоинтимальной гиперплазии на 50-55%, что отражено в таблице 3, приведенной ниже. Такое уменьшение реакции, достигающее максимума на 28-30-й день, обычно не сохраняется в течение последующих 90-180 дней в моделях на свиньях, как отражено в таблице 4, приведенной ниже.
Выделение рапамицина из неподдающегося эрозии полимерного покрытия стента в стенку сосуда человека позволяет достичь превосходных результатов, учитывая интенсивность и продолжительность уменьшения реакции неоинтимальной гиперплазии внутри стента, по сравнению со стенками сосудов животных, как указано выше.
У людей, которым были имплантированы стенты с рапамициновым покрытием, содержащим рапамицин в такой же дозировке, что и в исследованиях на животных моделях, и с использованием такой же полимерной матрицы, как описано выше, наблюдалось более интенсивное уменьшение неоинтимальной гиперплазии, чем у экспериментальных животных, на основе интенсивности и продолжительности регресса неоинтимы. Клиническая реакция человека на рапамицин показывает практически полное устранение неоинтимальной гиперплазии внутри стента, что подтверждают ангиографическое и интраваскулярное ультразвуковое исследование. Результаты отслеживались по меньшей мере в течение одного года, как показано в таблице 5, приведенной ниже.
Рапамицины дают неожиданный положительный эффект у людей, если они доставляются к ткани с поверхности стента, вызывая значительное уменьшение реакции неоинтимальной гиперплазии внутри стента, при этом результат сохраняется по меньшей мере в течение одного года. Выраженность и продолжительность этого эффекта у людей нельзя было прогнозировать на основе данных исследований на животных моделях. Рапамицины, применяемые в этом контексте, включают в себя рапамицин и его аналоги, производные и конъюгаты, которые связывают FKBP12 и обладают такими же фармакологическими свойствами, как и рапамицин.
Эти результаты могут зависеть от множества факторов. Например, большая эффективность рапамицина в организме человека обусловлена большей восприимчивостью механизма (механизмов) его действия к патофизиологии повреждений сосудов человека по сравнению с патофизиологией животных моделей с ангиопластикой. Кроме того, комбинация дозы, используемой со стентом, и полимерного покрытия, контролирующего выделение лекарственного препарата, играет важную роль в эффективности препарата.
Как описано выше, рапамицины уменьшают сосудистую гиперплазию, противодействуя пролиферации клеток гладкой мускулатуры в ответ на митогенные сигналы, вырабатываемые во время повреждения в результате ангиопластики. Также известно, что при системном введении рапамицины предотвращают Т-клеточную пролиферацию и дифференциацию. Также установлено, что рапамицины оказывают местный противовоспалительный эффект в стенке сосуда при выделении с поверхности имплантированного стента в небольших дозах в течение продолжительного периода времени (примерно от двух до шести недель). Местное противовоспалительное действие препарата является сильным и непредсказуемым. В сочетании с антипролиферативным действием на гладкую мускулатуру этот двойной механизм действия рапамицина может обуславливать его исключительную эффективность.
Таким образом, рапамицин, доставляемый с платформы устройства локальной доставки, уменьшает неоинтимальную гиперплазию, сочетая противовоспалительное и антипролиферативное действие на гладкую мускулатуру. Платформы локальной доставки включают в себя покрытия стентов, оболочки стентов, имплантаты и инфузионные катетеры для локального медленного введения лекарственного препарата или пористые баллоны, или любые другие подходящие средства для локальной доставки лекарственных препаратов, агентов или соединений in situ.
Противовоспалительное действие рапамицина следует из данных эксперимента, приведенных в таблице 6. В ходе эксперимента действие рапамицина, доставляемого с поверхности стента, сравнивали с действием дексаметазона, доставляемого с поверхности стента. Дексаметазон, сильнодействующий стероидный противовоспалительный препарат, был использован в качестве эталонного образца. Хотя дексаметазон способен снизить результат оценки воспаления в баллах, рапамицин оказался значительно эффективнее, чем дексаметазон, в снижении результата оценки воспаления в баллах. Кроме того, рапамицин, в отличие от дексаметазона, существенно уменьшает неоинтимальную гиперплазию.
Установлено, что при доставке с поверхности стента рапамицины снижают уровень цитокина в сосудистой ткани. Данные на фиг.1 показывают, что рапамицин эффективно снижает уровень содержания моноцитарного хемотаксического белка (MCP-1) в стенке сосуда. MCP-1 представляет собой пример прововоспалительного/хемотаксического цитокина, который вырабатывается при повреждении сосуда. Снижение уровня MCP-1 подтверждает положительное действие рапамицина в отношении уменьшения экспрессии прововоспалительных посредников и способствования проявлению противовоспалительного свойства рапамицина, доставляемого локально с поверхности стента. Общепризнанным является тот факт, что сосудистое воспаление в ответ на повреждение является основным фактором развития неоинтимальной гиперплазии.
Так как рапамицины демонстрируют способность ингибировать локальные воспалительные процессы в сосудах, считается, что это может объяснить неожиданное преимущество рапамициновв ингибировании образования неоинтимы.
Как описано выше, рапамицин работает на нескольких уровнях для достижения таких желательных воздействий, как предотвращение Т-клеточной пролиферации, ингибирование отрицательного ремоделирования, уменьшение воспаления и предотвращение пролиферации гладкомышечных клеток. Тогда как точный механизм этих воздействий недостаточно изучен, можно более детально рассмотреть механизмы, которые были выявлены.
Исследования с применением рапамицина позволяют предположить, что предотвращение пролиферации гладкомышечных клеток путем блокады клеточного цикла является эффективной стратегией уменьшения неоинтимальной гиперплазии. Эффективное и стабильное сокращение поздней потери просвета и объема неоинтимальной бляшки исследовалось у пациентов, получавших рапамицин, доставляемый локально с поверхности стента. Настоящее изобретение выходит за рамки описания механизма действия рапамицинов, чтобы охватить дополнительные способы лечения с ингибированием клеточного цикла и уменьшением неоинтимальной гиперплазии, не обладающие токсичностью.
Клеточный цикл представляет собой жестко контролируемый каскад биохимических событий, регулирующих процесс репликации клетки. После стимуляции клеток подходящими факторами роста, они переходят от G0 (состояние покоя) к фазе G1 клеточного цикла. Селективное ингибирование клеточного цикла в фазе G1 перед репликацией ДНК (S-фаза) может дать преимущества терапевтическим средствам для сохранения и жизнеспособности клетки, сохраняя антипролиферативную эффективность по сравнению с терапией, которая действует позднее в клеточном цикле, а именно, в S-, G2- или M-фазе.
Таким образом, предотвратить интимальную гиперплазию в кровеносных сосудах и других сосудах, переносящих жидкость, в организме можно при помощи ингибиторов клеточного цикла, которые действуют селективно в фазе G1 клеточного цикла. Эти ингибиторы фазы G1 клеточного цикла могут представлять собой молекулы малого размера, пептиды, белки, олигонуклеотиды или последовательности ДНК. Более конкретно, эти препараты или агенты включают в себя ингибиторы циклин-зависимых киназ (cdk), стимулирующие прохождение фазы G1 клеточного цикла, а именно, cdk2 и cdk4.
Примерами препаратов, агентов или соединений, оказывающих селективное действие в фазе G1 клеточного цикла, могут служить препараты из малых синтетических молекул, такие как флавопиридол и его структурные аналоги, которые, как было обнаружено, ингибируют клеточный цикл в поздней фазе G1 путем антагонизма с циклин-зависимыми киназами. Могут применяться терапевтические средства, которые повышают уровень эндогенного белка-ингибитора киназыkip, иначе P27, иногда именуемый P27kip1, который селективно ингибирует циклин-зависимые киназы. К этой группе относятся низкомолекулярные препараты, пептиды и белки, которые либо блокируют расщепление P27, либо усиливают генерирование клеток P27, включая векторы генов, способные трансфектировать гены и спровоцировать продуцирование P27. Для этих целей может применяться стауроспорин и аффинные низкомолекулярные препараты, блокирующие клеточный цикл путем ингибирования протеинкиназ. Также могут применяться ингибиторы протеинкиназ, включая класс тирфостинов, которые селективно ингибируют протеинкиназы, для того чтобы противодействовать сигнальной трансдукции в клетках гладкой мускулатуры в ответ на широкий спектр факторов роста, таких как тромбоцитарный фактор роста (PDGF) и фактор роста фибробластов (FGF).
Любой препарат, агент или соединение, рассмотренный выше, может вводиться как системно, например, перорально, внутривенно, внутримышечно, подкожно, интраназально или внутрикожно, так и локально, например, выделяться из покрытия стента, из оболочки стента или доставляться при помощи катетера. Кроме того, лекарственные препараты или агенты, рассмотренные выше, могут быть произведены в виде лекарственных форм с быстрым высвобождением или медленным высвобождением с целью поддержания препаратов или агентов в контакте с тканями-мишенями в течение периода времени в диапазоне от трех дней до восьми недель.
Как описано выше, комплекс рапамицина и белка FKPB12 связывает и ингибирует фосфоинозитид-3-киназу, иначе называемую «мишень рапамицина у млекопитающего» (TOR). Антагонист каталитической активности TOR, функционирующий либо как ингибитор активного центра, либо как аллостерический модулятор, т.е. косвенный ингибитор, модулирующий аллостерически, имитирует действие рапамицина, но обходит требования в отношении к FKBP12. К потенциальным преимуществам прямого ингибитора TOR относится лучшая пенетрация ткани и лучшая физическая и химическая стабильность. Кроме того, прочие потенциальные преимущества включают большую селективность и специфичность действия, благодаря специфичности антагониста в отношении одной из множества изоформ TOR, которая может существовать в различных тканях, и потенциально различный спектр нисходящих эффектов, ведущих к повышению эффективности и (или) безопасности лекарственного препарата.
Ингибитором может являться малая органическая молекула (приблизительная молекулярная масса <1000), представляющая собой продукт, полученный синтетическим или естественным путем. В качестве агента, ингибирующего функцию данного класса белков, может применяться вортманин. Также это может быть пептид или олигонуклеотидная последовательность. Ингибитор может вводиться либо системно (перорально, внутривенно, внутримышечно, подкожно, интраназально или внутрикожно), либо локально (выделяться из покрытия стента, из оболочки стента или доставляться при помощи катетера). Например, ингибитор может выделяться в стенку сосуда человека из неподдающегося эрозии полимерного покрытия стента. Кроме того, ингибитор может быть произведен в виде лекарственной формы с быстрым высвобождением или медленным высвобождением с целью поддержания рапамицина или иного лекарственного препарата, агента или соединения в контакте с тканями-мишенями в течение периода времени в диапазоне от трех дней до восьми недель.
Как описано выше, имплантация коронарного стента в сочетании с баллонной ангиопластикой является высокоэффективным методом лечения острого закрытия сосуда и может сократить риск развития рестеноза. Интраваскулярные ультразвуковые исследования (Mintz et al., 1996) позволяют предположить, что коронарное стентирование эффективно предотвращает сужение сосудов, и что в большинстве случаев поздняя утрата люминального просвета после имплантации стента происходит вследствие разрастания бляшек, что в свою очередь может быть вызвано неоинтимальной гиперплазией. Частота поздней утраты люминального просвета после коронарного стентирования практически в два раза выше, чем после традиционной баллонной ангиопластики. Таким образом, поскольку стенты препятствуют развитию по меньшей мере части процесса образования рестеноза, то использование препаратов, агентов или соединений, которые препятствуют пролиферации гладкомышечных клеток, уменьшают воспаление и замедляют коагуляцию, или препятствуют пролиферации гладкомышечных клеток при помощи сложных механизмов, в сочетании со стентом может обеспечить более эффективное лечение постангиопластического рестеноза.
Более того, у больных инсулинозависимым диабетом, которым были имплантированы сосудистые устройства, выделяющие рапамицин, например, стенты, наблюдается более высокая частота возникновения рестеноза по сравнению с больными обычным или инсулиннезависимым диабетом. Таким образом, комбинирование лекарственных препаратов может принести дополнительную пользу.
Локальная доставка лекарственных препаратов, агентов или композиций посредством стента имеет ряд преимуществ, а именно, предотвращение сужения просвета сосудов и ремоделирования сосудов благодаря каркасной функции стента и предотвращение множества компонентов неоинтимальной гиперплазии. Локальное введение лекарственного препарата, веществ или соединений в стентированные коронарные артерии также может принести дополнительную терапевтическую пользу. Например, более высокие концентрации лекарственного препарата, веществ или соединений в ткани можно достичь скорее посредством локальной доставки, чем путем системного введения. Дополнительным преимуществом лекарственной терапии является возможность сокращения дозы терапевтических соединений, а следовательно снижение их токсичности, при этом эффект уменьшения рестеноза сохраняется.
В еще одном варианте осуществления изобретения рапамицин может применяться в комбинации с цилостазолом. Цилостазол {6[4-(1-циклогексил-1H-тетразол-5-ил)-бутокси]-3,4-дигидро-2-(1H)-хинолинон} является ингибитором фосфодиэстеразы III типа (ингибирующей циклический ГМФ) и обладает антиагрегантным и сосудорасширяющим свойством. Изначально цилостазол разрабатывался как селективный ингибитор фосфодиэстеразы 3 циклических нуклеотидов. Предполагалось, что ингибирование фосфодиэстеразы 3 в тромбоцитах и гладкомышечных клетках сосудов обеспечит антиагрегантный и сосудорасширяющий эффект, однако современные доклинические исследования показали, что цилостазол также обладает способностью ингибировать захват аденозина различными клетками. Это свойство отличает цилостазол от других ингибиторов фосфодиэстеразы 3, таких как, например, милринон. Таким образом, цилостазол демонстрирует уникальные антиагрегантные и сосудорасширяющие свойства, основанные на целом ряде новых механизмов действия. Другие лекарственные препараты класса ингибиторов фосфодиэстеразы 3 типа включают милринон, веснарионон, эноксимон, пимобендан и мерибендан.
Исследования также показали эффективность цилостазола в уменьшении рестеноза после имплантации стента. См., например, Matsutani M., Ueda H. et al.: Effect of cilostazol in preventing restenosis after percutaneous transluminal coronary angioplasty, Am. J. Cardiol 1997, 79:1097-1099, Kunishima T., Musha H., Eto F., et al.: A randomized trial of aspirin versus cilostazol therapy after successful coronary stent implantation, Clin Thor 1997, 19:1058-1066, and Tsuchikane E. Fukuhara A., Kobayashi T., et al.: Impact of cilostazol on restenosis after percutaneous coronary balloon angioplasty, Circulation 1999, 100:21-26.
В соответствии с настоящим изобретением цилостазол может быть произведен в виде лекарственной формы с продолжительным высвобождением из медицинского устройства или покрытия медицинского устройства с целью уменьшения отложения тромбоцитов и образования тромбоза на поверхности медицинского устройства. Как описано выше, данные медицинские устройства включают в себя любые кратковременные или долговременные имплантаты, постоянно контактирующие с кровью, такие как кардиоваскулярные, периферические и внутричерепные стенты. Дополнительно цилостазол может быть инкорпорирован в соответствующее полимерное покрытие или матрицу в сочетании с рапамицином или другими потенциальными агентами, препятствующими рестенозу.
Инкорпорирование и последующее продолжительное высвобождение цилостазола из медицинского устройства или покрытия медицинского устройства в предпочтительном варианте уменьшает отложения тромбоцитов и образование тромбоза на поверхности медицинского устройства. Как было указано выше, существуют доклинические и клинические данные, подтверждающие, что цилостазол также препятствует рестенозу, отчасти благодаря своему сосудорасширяющему действию. Таким образом, применение цилостазола эффективно по меньшей мере на двух видах устройств, контактирующих с кровью, таких как стенты, выделяющие лекарственные препараты. Следовательно, комбинации цилостазола с другими потенциально препятствующими рестенозу агентами, содержащими рапамицин, такими как сиролимус, его аналоги, производные, конгенеры и конъюгаты, или паклитаксел, его аналоги, производные, конгенеры и конъюгаты, могут применяться для локального лечения сердечно-сосудистых заболеваний и уменьшения отложения тромбоцитов и образования тромбоза на поверхности медицинского устройства. Хотя вышеизложенное описание приведено применительно к стентам, важно отметить, что комбинации лекарственных препаратов, описанные в рамках данного конкретного примера осуществления, могут также применяться в сочетании с различными медицинскими устройствами, некоторые из которых описаны в настоящем документе.
На фиг.3 представлен первый пример конфигурации комбинации цилостазола и рапамицина, покрывающей стент. В данном варианте осуществления изобретения использован стент Bx Velocity® компании Cordis Corporation. В данной конфигурации стент 7500 имеет трехслойное покрытие. Первый слой, или внутренний слой, 7502 включает 180 (сто восемьдесят) мкг сиролимуса, что эквивалентно 45% (сорока пяти) вес. от общего веса внеутреннего слоя 7502, и сополимерной матрицы, состоящей из сополимера полиэтилена и винилацетата и полибутилметакрилата (СЭВА/ПБМА), что эквивалентно 55% (пятидесяти пяти) вес. от общего веса внутреннего слоя 7502. Второй слой или внешний слой 7504 включает 100 (сто) мкг цилостазола, что эквивалентно 45% (сорока пяти) вес. от общего веса внешнего слоя 7504, и сополимерной матрицы СЭВА/ПБМА, что эквивалентно 55% (пятидесяти пяти) вес. от общего веса внешнего слоя 7504. Третий слой или диффузионное внешнее покрытие 7506 содержит 200 (двести) мкг ПБМА. Объем выхода содержимого составил 85% (восемьдесят пять) от номинального содержания лекарственного препарата для сиролимуса и 98% (девяносто восемь) от номинального содержания лекарственного препарата для цилостазола. Кинетика высвобождения in vitro цилостазола и сиролимуса показана на фиг.4 и подробно описана ниже.
На фиг.5 представлен второй пример конфигурации комбинации цилостазола и рапамицина, нанесенных на стент. Как было указано выше, использован стент Bx Velocity® компании Cordis Corporation. В данном варианте осуществления стент 7700 имеет трехслойное покрытие. Первый слой или внутренний слой 7702 включает 180 (сто восемьдесят) мкг сиролимуса, что эквивалентно 45% (сорока пяти) вес. от общего веса внеутреннего слоя 7702, и сополимерной матрицы СЭВА/ПБМА, что эквивалентно 55% (пятидесяти пяти) вес. от общего веса внутреннего слоя 7702. Второй слой или внешний слой 7704 включает 100 (сто) мкг цилостазола, что эквивалентно 45% (сорока пяти) вес. от общего веса внешнего слоя 7704, и сополимерной матрицы СЭВА/ПБМА, что эквивалентно 55% (пятидесяти пяти) вес. от общего веса внешнего слоя 7704. Третий слой или диффузионное внешнее покрытие 7706 содержит 100 (сто) мкг ПБМА. И снова объем выхода содержимого составил 85% (восемьдесят пять) от номинального содержания лекарственного препарата для сиролимуса и 98% (девяносто восемь) от номинального содержания лекарственного препарата для цилостазола. Кинетика высвобождения цилостазола и сиролимуса in-vitro показана на фиг.6 и подробно описана ниже.
Как видно при сравнении фиг.4 и 6, скорость высвобождения как сиролимуса, так и цилостазола из конфигурации, включающей более плотное диффузионное внешнее покрытие ПБМА, т.е. 200 мкг, относительно ниже по сравнению со скоростью высвобождения из конфигурации, включающей сто микрограмм диффузионного внешнего покрытия ПБМА. Таким образом, селективное применение диффузионных покрытий позволяет дополнительно контролировать скорость выделения обоих лекарственных препаратов, что более подробно описано в данном документе. При селективном применении диффузионных покрытий учитывается толщина нанесения, а также другие особенности, в том числе химическая совместимость.
На фиг.7 представлен третий вариант примера конфигурации комбинации цилостазола и рапамицина, нанесенных на стент. Эта конфигурация идентична по своей структуре конфигурации, представленной на фиг.3, однако количество цилостазола сокращено до 50 (пятидесяти) мкг. Так же, как и в предыдущем варианте осуществления, в данном случае присутствует стент 7900 и три дополнительных слоя 7902, 7904 и 7906. Процентное содержание по весу, однако, остается прежним.
Антиагрегантная эффективность трех конфигураций, описанных выше, отражена на фиг.8. На фиг.8 представлены антитромботические свойства вышеописанных покрытий, содержащих комбинацию сиролимуса и цилостазола в экспериментальной модели кровообращения in vitro с использованием бычьей крови. В экспериментальной модели кровеносной системы с использованием бычьей крови in vitro свежую бычью кровь гепаринизируют, чтобы активированное время свертывания крови (АВСК) составляло 200 (двести) секунд. Тромбоциты, содержащиеся в крови, маркируются при помощи индия 111. В процессе исследования стент помещается в силиконовую трубку, являющуюся частью замкнутой системы кровообращения. Гепаринизированная кровь циркулирует в замкнутой системе при помощи циркуляционного насоса. С течением времени на поверхности стента скапливаются сгустки крови и тромб, которые снижают скорость потока крови, циркулирующей в стентированной замкнутой системе. Поток останавливается, когда скорость потока снижается до 50% (пятидесяти) от первоначального значения или на 90 (девяносто) минут, если ни один из протестированных стентов не сократил поток на 50% (пятьдесят). Итоговая радиоактивность (In 111) на поверхности стента подсчитывается при помощи бета-счетчика и нормализуется при помощи контроллера, установленного в протоколе на 100% (сто). Меньшее значение говорит о том, что поверхность является менее тромбогенной. Все три группы двойных сиролимус/цилостазол лекарственных покрытий уменьшали отложение тромбоцитов и образование тромба на поверхности стента более чем на 90% (девяносто) по сравнению с контрольным стентом, выделяющим лекарственное вещество, не содержащим дополнительного соединения цилостазола. Столбец 8002 представляет собой контрольный стент, выделяющий лекарственное вещество, который был взят за 100% (сто). В качестве контрольного стента, выделяющего лекарственное вещество, был использован коронарный стент, выделяющий сиролимус, Cypher® компании Cordis Corporation. Столбец 8004 представляет HEPACOAT® стент, покрытый гепарином; поставляется компанией Cordis Corporation под торговой маркой коронарных стентов Bx Velocity®. Столбец 8006 представляет собой стент, имеющий конфигурацию с учетом структуры, представленной на фиг.3. Столбец 8008 представляет собой стент, имеющий конфигурацию с учетом структуры, представленной на фиг.5. Столбец 8010 представляет собой стент, имеющий конфигурацию с учетом структуры, представленной на фиг.7. Как видно на фиг.8, цилостазол в значительной степени снижает образование тромба.
Другим клиническим показателем тромборезистентности устройства, покрытого цилостазолом, является продолжительность высвобождения лекарственного препарата из покрытия. Это имеет большое значение в первые две недели после имплантации устройства. В фармакокинетических исследованиях высвобождения лекарственного препарата в моделях на свиньях как цилостазол, так и сиролимус медленно высвобождались из покрытия, результатом чего является продолжительный профиль высвобождения лекарственных препаратов. Цель фармакокинетического исследования в моделях на свиньях состоит в том, чтобы дать оценку локальной фармакокинетике стента, выделяющего лекарственный препарат в течение заданного периода имплантации стента. Как правило, имплантируют три стента в три различные коронарные артерии свиньи на заданный период времени, а затем извлекают стенты для анализа общего выведения лекарственного вещества. Стенты извлекают в заданные моменты времени, а именно, в 1, 3 и 8 дни. Стенты извлекают и определяют общее количество лекарственного вещества, оставшегося на стенте, путем анализа с использованием ВЭЖХ (высокоэффективной жидкостной хроматографии). Разница между изначальным количеством лекарственного вещества на стенте и количеством лекарственного вещества на момент извлечения стента представляет собой количество лекарственного вещества, выделившегося за этот период. Длительное выделение лекарственного вещества в окружающую ткань артерии является фактором, препятствующим разрастанию неоинтимы и образованию рестеноза в коронарной артерии. График нормального распределения представляет процентное соотношение общего объема высвобожденного лекарственного вещества (%, ось y) и периода имплантации (день, ось x). Как показано на фиг.9, приблизительно 80% (восемьдесят) двух лекарственных веществ осталось в лекарственном покрытии через 8 (восемь) дней после имплантации. Кроме того, оба лекарственных вещества высвобождались с одинаковой скоростью, несмотря на достаточно большую разницу соответствующих значений logP и различную водорастворимость. Кривая 8102 отображает цилостазол, а кривая 8104 отображает сиролимус. Их профили высвобождения in vitro представлены на фиг.10, соответственно. Аналогично профилю высвобождения in vivo, как сиролимус, обозначенный квадратами, так и цилостазол, обозначенный ромбами, высвобождались достаточно медленно. Высвобождение обоих лекарственных препаратов составило приблизительно 35% (тридцать пять). На фиг.9 и 10 представлены, соответственно, in vivo и in vitro скорости высвобождения лекарственных веществ из покрытия стента, нанесенного в соответствии с конфигурацией, представленной на фиг.11, где сиролимус и цилостазол содержатся в одном слое, а не в двух отдельных слоях. В данном примере конфигурации стент 8300 имеет двухслойное покрытие. Первый слой 8302 содержит композицию из сиролимуса, цилостазола и сополимерной матрицы СЭВА/ПБМА. Второй слой или диффузионное внешнее покрытие 8304 включает только ПБМА. Более конкретно, в данном варианте осуществления изобретения первый слой 8302 содержит комбинацию сиролимуса и цилостазола, которая в процентном весовом отношении составляет 45% (сорок пять) от общего веса первого слоя 8302, и сополимерную матрицу СЭВА/ПБМА, которая в процентном весовом отношении составляет 55% (пятьдесят пять) от общего веса первого слоя 8302. Диффузионное внешнее покрытие содержит 100 (сто) мкг ПБМА.
На фиг.12 и 13 представлены, соответственно, in vivo и in vitro скорости высвобождения лекарственных веществ из покрытия стента, нанесенного согласно конфигурации, представленной на фиг.3. Многослойное покрытие, выделяющее лекарственные вещества, показало относительно более высокую скорость высвобождения в тех же в моделях на свиньях по сравнению с базовым покрытием, содержащим два лекарственных вещества, что видно при сопоставлении фиг.12 и 9. На фиг.12 на кривой 8402 представлен цилостазол, а на кривой 8404 - сиролимус. Однако процентное отношение высвобождения обоих лекарственных веществ было сопоставимым в каждый момент времени. Соответствующие профили скорости высвобождения лекарственных веществ in vitro представлены на фиг.12, где ромбами обозначен цилостазол, а квадратами - сиролимус. По сравнению с базовым покрытием, содержащим два лекарственных вещества, оба лекарственных вещества высвобождались гораздо быстрее, что отражено в профилях быстрого высвобождения в фармакокинетическом исследовании in vivo. Таким образом, объединение лекарственных веществ в одном слое покрытия в результате дает возможность в большей степени контролировать скорость выделения лекарственного вещества.
Комбинация рапамицина (сиролимуса) и цилостазола, как описано выше, представляется более эффективной, чем использование одного лекарственного вещества для уменьшения пролиферации и миграции гладкомышечных клеток. Кроме того, как показано в настоящем документе, высвобождение цилостазола из комбинированного покрытия можно постоянно контролировать, для того чтобы достичь длительного предотвращения отложения тромбоцитов с образованием тромба на поверхности стента или поверхности другого медицинского устройства, контактирующего с кровью. В составе комбинированного покрытия цилостазол может быть инкорпорирован в один слой вместе с сиролимусом или в отдельный слой, вне слоя, содержащего сиролимус. Вследствие своей достаточно низкой растворимости в воде цилостазол потенциально может оставаться в покрытии в течение достаточно долгого периода времени, находясь в организме после введения стента или другого медицинского устройства. Относительно медленное выделение in vitro по сравнению с сиролимусом во внутренних слоях предполагает такую возможность. Цилостазол представляет собой стабильное соединение, растворимое в большинстве органических растворителей и совместимое с различными техниками нанесения покрытия, описанными здесь. Важно отметить, что как сиролимус, так и цилостазол может быть инкорпорирован в неабсорбируемую полимерную матрицу или абсорбируемую матрицу.
На фиг.14 представлен альтернативный вариант осуществления расширяемого медицинского устройства, имеющего множество отверстий, содержащих лекарственное вещество для доставки в ткань при помощи расширяемого медицинского устройства. Расширяемое медицинское устройство 9900, представленное на фиг.14, вырезано из материала цилиндрической формы, подходящего для изготовления цилиндрического расширяемого медицинского устройства. Расширяемое медицинское устройство 9900 имеет множество цилиндрических отсеков 9902, соединенных между собой при помощи множества соединительных элементов 9904. Соединительные элементы 9904 позволяют поддерживающему ткань устройству изгибаться в осевом направлении при прохождении по извитому пути сосудистой системы к месту имплантации, а также позволяют устройству изгибаться в осевом направлении, если этого требует изгиб просвета, требующего поддержки. Каждый из цилиндрических отсеков 9902 образован сетью вытянутых элементов конструкции 9908, соединенных между собой при помощи гибких шарниров 9910, и периферийных поперечных соединительных элементов 9912. В процессе развертывания медицинского устройства 9900 гибкие шарниры 9910 деформируются, тогда как элементы конструкции 9908 не подвергаются деформации. Более подробное описание примера расширяемого медицинского устройства приведено в патенте США № 6241762, полностью включенном в настоящий документ путем ссылки.
Как показано на фиг.14, вытянутые элементы конструкции 9908 и периферийные поперечные соединительные элементы 9912 включают в себя ячейки 9914, некоторые из которых содержат лечебный агент для доставки в просвет сосуда, куда имплантировано расширяемое медицинское устройство. Кроме того, другие элементы устройства 9900, такие как соединительные элементы 9904, могут включать в себя ячейки, как описано ниже с учетом конструкции, представленной на фиг.18. Предпочтительно, чтобы ячейки 9914 были расположены в недеформируемых частях устройства 9900, таких как вытянутые элементы конструкции 9908, с тем, чтобы ячейки не подвергались деформации, а доставляемое лекарственное вещество не подвергалось риску раздробления, выталкивания или иного повреждения в процессе развертывания устройства. Подробное описание примера способа размещения лечебного вещества внутри ячеек 9914 приведено в заявке на патент США № 09/948987 от 07 сентября 2001 г., полное содержание которой включено в настоящий документ путем ссылки.
Представленные варианты осуществления изобретения возможно усовершенствовать путем анализа методом конечных элементов и другими методами, позволяющими оптимизировать размещение лечебных агентов в ячейках 9914. По существу, форма и расположение ячеек 9914 могут быть изменены с целью максимального увеличения объема свободного пространства с сохранением относительно высокой упругости и жесткости несущих элементов конструкции относительно гибких шарниров 9910. В соответствии с одним предпочтительным вариантом осуществления настоящего изобретения ячейки имеют площадь, равную по меньшей мере 3,2E-5 см2 (5×10-6 квадратных дюймов), а предпочтительно - по меньшей мере 4,5E-5 см2 (7×10-6 квадратных дюймов). Обычно ячейки заполняют лечебным агентом на 50-95%.
Различные варианты осуществления настоящего изобретения, описанные в настоящем документе, предусматривают размещение различных лечебных веществ в различных ячейках расширяемого устройства или размещение лечебного агента только в некоторых ячейках. В других вариантах осуществления в одной ячейке могут применяться комбинации лечебных агентов или терапевтических средств. Индивидуальная структура расширяемого устройства может изменяться, не выходя за рамки характера изобретения. Поскольку каждая ячейка заполняется независимо, то в каждой ячейке лечебному агенту может сообщаться индивидуальный химический состав и фармакокинетические свойства.
Первый пример использования различных лечебных веществ в различных ячейках в расширяемом медицинском устройстве или лечебных веществ только в некоторых ячейках направлен на борьбу с краевым рестенозом. Как описано выше, проблемой стентов с современным покрытием является краевой рестеноз или рестеноз, образующийся непосредственно за краями стента и развивающийся вокруг стента и внутри просвета.
Причины краевого рестеноза при использовании стентов для доставки лекарственного препарата первого поколения в настоящее время недостаточно изучены. Возможно, область повреждения ткани вследствие ангиопластики и (или) имплантации стента продолжается за пределами диффузионного действия современных лечебных веществ, таких как паклитаксел и рапамицин, которые распределяются непосредственно в ткани. Подобный феномен наблюдается в лучевой терапии, где низкие дозы радиоактивного излучения по краям стента показали стимулирующее действие при наличии повреждения. В этом случае излучение на большую длину вплоть до облучения непораженной ткани решило проблему. В случае со стентами для доставки лекарственных веществ, размещение более высоких доз или более высоких концентраций лечебных веществ по длине концов стента, размещение различных веществ, которые быстрее проникают через ткань, на концах стента или размещение различных лечебных веществ или комбинаций лечебных веществ на концах устройства помогает устранить проблему краевого рестеноза.
На фиг.14 представлено расширяемое медицинское устройство 9900 с «горячими концами» или лечебным препаратом, размещенным в ячейках 9914a на концах устройства, для лечения и уменьшения выраженности краевого рестеноза. Оставшиеся ячейки 9914b в центральной части устройства могут быть пустыми (как показано) или могут содержать более низкую концентрацию лечебного вещества.
Другие механизмы краевого рестеноза могут быть обусловлены цитотоксичностью определенных лекарственных препаратов или комбинаций лекарственных препаратов. Такие механизмы могут охватывать физическое или механическое сжатие ткани подобно тому, что происходит при образовании рубцовой ткани; стент способен предотвратить реактивное сокращение в пределах своих границ, но не за пределами концов. Кроме того, механизм образования этой поздней формы рестеноза может быть связан с последствиями продолжительной и локальной доставки лекарственного препарата в ткани артериальной стенки, даже после того, как сам препарат больше не присутствует в тканях артериальной стенки. Значит, рестеноз может быть ответной реакцией на форму токсического поражения, вызванного лекарственным препаратом и (или) носителем лекарственного препарата. В этой ситуации было бы полезно отказаться от применения определенных веществ на концах устройства.
На фиг.15 представлен альтернативный вариант осуществления расширяемого медицинского устройства 10200, имеющего множество ячеек 10230, где ячейки 10230b в центральной части устройства заполнены лечебным веществом, а ячейки 10230a на концах устройства остаются пустыми. Устройство, представленное на фиг.15, относится к устройствам с «холодными концами».
Помимо использования в целях уменьшения краевого рестеноза, расширяемое медицинское устройство 10200, представленное на фиг.15, может применяться в сочетании с расширяемым медицинским устройством 9900, представленным на фиг.14, или другим стентом для доставки лекарственного вещества, если есть необходимость дополнить первичную процедуру стентирования дополнительным стентом. Например, в некоторых случаях устройство 9900 с «горячими концами», представленное на фиг.14, или устройство с равномерным распределением лекарственного препарата было имплантировано неправильно. Если врач установит, что устройство не занимает достаточной части просвета сосуда, потребуется присоединить дополняющее устройство к одному концу уже имплантированного устройства, немного перекрыв уже имплантированное устройство. После имплантации дополняющего устройства устройство 10200, представленное на фиг.15, функционирует таким образом, что «холодные концы» медицинского устройства 10200 предотвращают двойную дозировку лечебного вещества в области наложения сегментов устройств 9900 и 10200.
На фиг.16 представлен еще один альтернативный вариант осуществления изобретения, в котором различные лечебные препараты размещены в разных отверстиях расширяемого медицинского устройства 11300. Первый лечебный агент размещен в отверстиях 11330a на концах устройства, а второй лечебный агент размещен в отверстиях 11330b в центральной части устройства. Лечебное вещество может содержать различные лекарственные препараты, одинаковые лекарственные препараты в различных концентрациях, или различные варианты одного и того же лекарственного препарата. Пример исполнения, представленный на фиг.16, может быть использован для создания расширяемого медицинского устройства 11300 с «горячими концами» или с «холодными концами».
В предпочтительном варианте осуществления каждая конечная часть устройства 11300, содержащая отверстия 11330a, заполненные первым лечебным агентом, должна иметь отступ от края, равный по величине по меньшей мере одному отверстию и до приблизительно пятнадцати отверстий от края. Это расстояние соответствует от приблизительно 0,127 до приблизительно 2,54 мм (от приблизительно 0,005 до приблизительно 0,1 дюйма) от края устройства в нерасширенном состоянии. Расстояние от края устройства 11300, включающего в себя первый лечебный агент, предпочтительно должно соответствовать одной секции, причем под секцией понимается промежуток между соединительными элементами.
Различные лечебные агенты, содержащие различные лекарственные препараты, могут быть размещены в различных ячейках в стенте. Это позволяет доставлять два или несколько различных лечебных препаратов с одного стента по любой требуемой схеме. В альтернативном варианте различные лечебные агенты, содержащие одинаковый лечебный препарат в различных концентрациях, могут быть размещены в различных ячейках. Это позволяет равномерно распределить лекарственный агент в ткани при неравномерной структуре самого устройства.
Два или несколько различных лечебных агента, размещенных в устройстве, описанном в настоящем документе, могут содержать (1) различные лекарственные препараты; (2) различные концентрации одного и того же лекарственного препарата; (3) один и тот же лекарственный препарат с различной кинетикой высвобождения, то есть с различными скоростями эрозии матрицы; (4) различные формы одного и того же лекарственного препарата. Варианты различных лечебных веществ, содержащие один и тот же лекарственный препарат с различной кинетикой высвобождения, могут использоваться в сочетании с различными носителями для получения профилей элюирования различной формы. Некоторые примеры различных форм одного и того же лекарственного препарата включают формы лекарственного препарата, обладающие различными гидрофильностью и липофильностью.
В одном варианте осуществления устройства 11300, представленного на фиг.16, отверстия 11330a на концах устройства заполнены первым лечебным веществом, содержащим лекарственный препарат с высокой липофильностью, тогда как отверстия 11330b в центральной части устройства заполнены вторым лечебным веществом, содержащим лекарственный препарат с более низкой липофильностью. Первое высоколипофильное лечебное вещество на «горячих концах» гораздо быстрее диффундирует в окружающую ткань, уменьшая образование краевого рестеноза.
Устройство 11300 может иметь резкую переходную линию, где первое лечебное вещество сменяется вторым лечебным веществом. Например, все ячейки в пределах 1,27 мм (0,05 дюймов) от края устройства могут содержать первое вещество, тогда как остальные ячейки содержат второе вещество. В альтернативном варианте осуществления устройство может иметь постепенный переход между первым и вторым веществами. Например, концентрация лекарственного препарата в ячейках может прогрессивно увеличиваться (или уменьшаться) по направлению к концу устройства. В другом варианте количество первого препарата в ячейках увеличивается, тогда как количество второго препарата в ячейках уменьшается по направлению к концам устройства.
На фиг.17 представлен альтернативный вариант осуществления расширяемого медицинского устройства 12400, в котором различные лечебные агенты размещены в различных ячейках 12430a и 12430b в устройстве в перемежающемся или рассеянном порядке. Этот способ дает возможность доставлять множество лечебных агентов в ткань по всей области или только части области, поддерживаемой устройством. Этот пример осуществления может применяться для доставки нескольких лечебных веществ, где комбинирование нескольких веществ в составе одной композиции для размещения в устройстве невозможно вследствие реакции взаимодействия лечебных веществ между собой или проблем стабильности.
Помимо размещения различных лечебных агентов в различных ячейках для получения различных концентраций препарата в различных областях ткани, размещение различных лечебных агентов в различных ячейках может служить для улучшения пространственного распределения лечебного вещества в тех случаях, когда ячейки распределены на расширяемом медицинском устройстве в расширенном состоянии неравномерно.
Использование различных лекарственных препаратов в различных ячейках в чередующемся или рассеянном порядке позволяет осуществлять доставку двух различных лекарственных веществ, доставка которых в составе одной и той же матричной композиции полимер/лекарственный препарат невозможна. Например, в случае если сами лекарственные препараты взаимодействуют друг с другом нежелательным образом. Или же два лекарственных препарата не могут сочетаться с одним и тем же полимером для образования матрицы или с одними и теми же растворителями для доставки матрицы полимер/лекарственный препарат в ячейки.
Дополнительно вариант осуществления, представленный на фиг.17, с различными лекарственными веществами, размещенными в различных ячейках, расположенных в рассеянном порядке, позволяет доставлять различные лекарственные препараты с совершенно разной кинетикой высвобождения с одного и того же медицинского устройства или стента и оптимизировать кинетику высвобождения в зависимости от механизма действия и свойств каждого отдельного вещества. Например, водорастворимость вещества в значительной степени влияет на высвобождение вещества из полимерной или другой матрицы. Соединения с высокой степенью водорастворимости, как правило, доставляются из полимерной матрицы очень быстро, в то время как для доставки липофильного вещества из той же самой матрицы требуется более длительный период времени. Таким образом, если необходимо доставить гидрофильное вещество и липофильное вещество в виде двойной лекарственной комбинации с одного медицинского устройства, сложно получить требуемый профиль высвобождения двух таких веществ, доставляемых из одной и той же полимерной матрицы.
Система, представленная на фиг.17, позволяет легко доставлять гидрофильные и липофильные препараты при помощи одного стента. Кроме того, система, представленная на фиг.17, позволяет доставлять два препарата с различной кинетикой и (или) различными периодами введения. Первичное высвобождение каждого из препаратов в течение первых суток, скорость высвобождения через сутки, общий период введения препарата и любая другая характеристика высвобождения двух лекарственных препаратов может регулироваться отдельно. Например, скорость высвобождения первого лечебного агента можно установить таким образом, чтобы по меньшей мере 40% (в предпочтительном варианте - 50%) препарата было доставлено в течение первых двадцати четырех часов, а скорость высвобождения второго вещества можно установить так, чтобы в течение первых двадцати четырех часов было доставлено менее 20% (в предпочтительном варианте - менее 10%) препарата. Период введения первого лечебного вещества может составлять не более приблизительно трех недель (в предпочтительном варианте - не более двух недель), а период введения второго лечебного вещества может составлять не менее приблизительно четырех недель.
Рестеноз или повторение окклюзии после оперативного вмешательства включает в себя комбинацию или серию биологических процессов. Эти процессы включают активацию тромбоцитов и макрофагов. Цитокины и факторы роста способствуют пролиферации гладкомышечных клеток и повышающей регуляции экспрессии генов и металлопротеиназ, приводящих к росту клеток, ремоделированию внеклеточного матрикса и миграции гладкомышечных клеток. Медикаментозная терапия с использованием комбинирования лекарственных препаратов, направленная на все эти процессы, возможно, является наиболее эффективным средством борьбы с рестенозом. Настоящее изобретение предлагает средства для реализации такой эффективной комбинированной медикаментозной терапии.
Примеры, рассмотренные ниже, иллюстрируют некоторые системы с применением комбинированных лекарственных препаратов, которые будут оказывать наилучшее действие при использовании способности высвобождать различные лекарственные препараты в различных отверстиях или ячейках. Примером такой эффективной системы для доставки двух лекарственных веществ из отверстий, расположенных в рассеянном или чередующемся порядке, является доставка противовоспалительного агента или иммуносупрессанта в сочетании с антипролиферативным агентом или антимиграционным агентом. Другие комбинации этих агентов также могут использоваться для направленного воздействия на множественные биологические процессы, участвующие в формировании рестеноза. Противовоспалительный агент подавляет первичную воспалительную реакцию сосудов на ангиопластику и стентирование и доставляется на высокой скорости в начальном периоде введения; затем следует более медленная доставка в течение приблизительно двухнедельного периода для того, чтобы совпасть с пиком в реакции макрофагов, стимулирующих развитие воспалительной реакции. Антипролиферативный агент доставляется с достаточно ровной скоростью в течение длительного периода времени, для того чтобы сократить миграцию и пролиферацию гладкомышечных клеток.
Помимо примеров, приведенных ниже, следующая таблице 7.0 отражает некоторые варианты успешной терапии с использованием комбинаций двух лекарственных препаратов, где положительный эффект достигается путем размещения препаратов в различных ячейках медицинского устройства.
Размещение лекарственных препаратов в различных ячейках позволяет задать кинетику высвобождения каждого конкретного агента независимо от гидрофобных или липофобных свойств препарата. Примеры некоторых вариантов размещения для доставки липофильного препарата при по существу постоянной или линейной скорости высвобождения описаны в международной заявке на патент WO 04/110302, опубликованной 23 декабря 2004 г., которая полностью включена в настоящий документ путем ссылки. Примеры некоторых вариантов размещения для доставки гидрофильного препарата описаны в международной заявке на патент WO 04/043510, опубликованной 27 мая 2004 г., которая полностью включена в настоящий документ путем ссылки. Гидрофильные препараты, упомянутые выше, включают Кладрибин (2-хлородеоксиаденозин), Гливек, Вазоактивный интестинальный пептид (ВИП), инсулин и АпоA-1 Милан. Липофильные препараты, указанные выше, включают Паклитаксел, Эпотилон D, рапамицин, пимекролимус, PKC-412 (протеинкиназа С) и Дексаметазон. Фарглитазар является частично липофильным и частично гидрофильным препаратом.
Помимо доставки нескольких лекарственных препаратов, оказывающих направленное воздействие на различные биологические процессы, участвующие в формировании рестеноза, настоящее изобретение может служить для доставки одним стентом двух различных лекарственных препаратов для лечения различных заболеваний. Например, стент может служить для доставки антипролиферативного препарата, такого как Паклитаксел или препарата семейства лимусов, из одной группы ячеек для лечения рестеноза, одновременно доставляя препарат для профилактики инфаркта миокарда, такой как инсулин, из других ячеек для лечения острого инфаркта миокарда.
У многих известных расширяемых устройств, а также у устройства, представленного на фиг.18, покрытие устройства 13500 на участках с цилиндрическими отсеками 13512 устройства плотнее, чем на соединительных элементах 13514. Покрытие определяется отношением площади поверхности устройства к площади просвета, в котором размещено устройство. Когда для доставки лечебного агента, содержащегося в ячейках устройства, используется устройство с изменяемой покрывающей способностью, концентрация лечебного агента, доставляемого к ткани, прилегающей к участкам с цилиндрическими отсеками 13512, больше концентрации лечебного агента, доставляемого к ткани, прилегающей к соединительным элементам 13514. С целью преодоления продольной вариативности структуры устройства и других отклонений покрытия устройства, которые приводят к тому, что лечебный агент доставляется к тканям в неодинаковой концентрации, концентрация лечебного агента может варьироваться в ячейках, расположенных на различных участках устройства, благодаря чему достигается более равномерное распределение лечебного агента в ткани. В случае с вариантом осуществления изобретения, представленном на фиг.18, ячейки 13530a на участках с цилиндрическими отсеками 13512 включают лечебный агент с пониженной концентрацией лекарственного препарата, в отличие от ячеек 13530b, расположенных на соединительных элементах 13514. Равномерность доставки агента может быть достигнута различными способами, в том числе путем изменения концентрации лекарственного препарата, диаметра и формы ячеек, количества агента в ячейке (т.е. процентного наполнения ячейки), материала матрицы или лекарственной формы.
Другим примером осуществления изобретения для использования различных лекарственных агентов в различных ячейках является расширяемое медицинское устройство 14600, как показано на фиг.19, предназначенное для использования в месте бифуркации в сосуде. Бифуркационные устройства включают в себя боковое отверстие 14610, которое расположено таким образом, чтобы пропустить ток крови через боковое ответвление сосуда. Пример бифуркационного устройства описан в патенте США № 6293967, полностью включенном в настоящий документ путем ссылки. Бифуркационное устройство 14600 включает боковое отверстие 14610, прерывающее регулярную структуру поперечин, образующих остаток устройства. В силу того что область вокруг бифуркации является чрезвычайно проблематичной в плане возможного образования рестеноза, концентрацию антипролиферативного препарата можно увеличить в ячейках 14630a в области, окружающей боковое отверстие 14610 устройства 14600, для доставки повышенных концентраций лекарственного препарата, где это необходимо. Остальные ячейки 14630b в области, отдаленной от бокового отверстия, содержат лечебный агент с более низкой концентрацией антипролиферативного препарата. Повышения дозы антипролиферативного препарата, доставленного в область, окружающую отверстие бифуркации, можно достичь, используя различные лечебные агенты, содержащие различные препараты или лечебный агент, содержащий повышенную концентрацию одного препарата.
Помимо доставки различных лечебных агентов к пристеночной или аблюминальной стороне расширяемого медицинского устройства для лечебного воздействия на стенку сосуда, лечебные агенты могут быть доставлены к люминальной стороне расширяемого медицинского устройства для предотвращения или уменьшения тромбоза. Лекарственные препараты, которые доставляются в кровоток с люминальной поверхности устройства, могут быть размещены на проксимальном конце устройства или на дистальном конце устройства.
Способы размещения различных лечебных агентов в различных ячейках в расширяемом медицинском устройстве могут включать известные приемы, например, погружение и покрытие, а также известный метод пьезоэлектрического микроинъецирования. Микроинъекционные устройства могут иметь компьютерное управление для доставки известным способом точного количества двух или более жидких лечебных агентов к точно определенному месту размещения на расширяемом медицинском устройстве. Например, устройство инъецирования двойного агента может доставлять в ячейки два агента одновременно или последовательно. Когда лечебные агенты помещаются в сквозные ячейки расширяемого медицинского устройства, в процессе загрузки люминальную сторону сквозных ячеек можно закрыть при помощи гибкого мандрена, что позволит доставить лечебные агенты в жидкой форме, например, в форме растворителя. Загрузку лечебных агентов также можно выполнить при помощи ручного инъекционного устройства.
На фиг.20 представлен стент, выделяющий два лекарственных вещества, 15700, в котором доставка противовоспалительного агента и антипролиферативного агента осуществляется из различных отверстий в стенте для обеспечения независимой кинетики высвобождения каждого из двух лекарственных веществ, при этом кинетика высвобождения каждого лекарственного вещества специфически запрограммирована, чтобы совпадать по времени с биологическими процессами, приводящими к рестенозу. В соответствии с данным вариантом осуществления стент, выделяющий два лекарственных вещества, в первом комплекте ячеек 15710 содержит противовоспалительное средство пимекролимус в сочетании с антипролиферативным средством паклитакселом, содержащимся во втором комплекте ячеек 15720. Каждый лекарственный агент инкорпорирован в материал матрицы внутри ячеек стента в определенном мозаичном порядке, что позволяет достичь кинетики высвобождения, представленной на фиг.21. Каждое из лекарственных веществ доставляется, главным образом, в стенку сосуда для предотвращения рестеноза.
Как показано на фиг.20, пимекролимус помещается в стент для направленной доставки к пристеночной стороне стента путем применения барьера 15712 на люминальной стороне отверстия. Барьер 15712 образован из биоразлагаемого полимера. Пимекролимус загружается в отверстия таким способом, благодаря которому формируется двухфазная кинетика высвобождения. Первая фаза высвобождения пимекролимуса обеспечивается пристеночно лежащим слоем 15716 матрицы, который включает в себя быстро высвобождающееся соединение, включающее пимекролимус и биоразлагаемый полимер (сополимер молочной и гликолевой кислот (PLGA)), с высоким процентным содержанием лекарственного вещества - приблизительно 90% лекарственного вещества и приблизительно 10% полимера. Вторая фаза высвобождения пимекролимуса обеспечивается центральным слоем 15714 матрицы, содержащим пимекролимус и биоразлагаемый полимер (сополимер молочной и гликолевой кислот (PLGA)) в соотношении приблизительно 50% лекарственного вещества к 50% полимера. Как очевидно из графика на фиг.21, в результате первой фазы высвобождения пимекролимуса доставляется приблизительно 50% загруженного лекарственного препарата в течение первых двадцати четырех часов. В результате второй фазы высвобождения доставляются оставшиеся 50% в течение двух недель. Такой профиль высвобождения специально запрограммирован для того, чтобы добиться совпадения с прогрессированием воспалительного процесса, следующего за ангиопластикой и стентированием. В дополнение или в качестве альтернативы применению различных концентраций лекарственного вещества в двух слоях для достижения двухфазного высвобождения, для того чтобы получить разные скорости высвобождения в двух различных слоях, можно использовать различные соотношения полимеров или сополимеров одного и того же полимера.
Паклитаксел закладывается в ячейки 15720 таким образом, чтобы кинетика высвобождения была по существу линейной приблизительно по истечении первых двадцати четырех часов, как показано на фиг.21. Ячейки 15720, содержащие паклитаксел, заполняются таким образом, что образуются три области, в том числе базовая область 15722, состоящая по существу из полимера с минимальным содержанием лекарственного вещества, сконцентрированного на люминальной стороне ячейки, центральная область 15724, включающая паклитаксел и полимер (PLGA) с градиентом концентраций, и покрывающая область 15726, состоящая по существу из полимера, контролирующего высвобождение паклитаксела. Высвобождение паклитаксела осуществляется следующим образом: первоначальное высвобождение в первый день составляет от 5% до 15% от общего количества загруженного лекарственного вещества, затем следует по существу линейное высвобождение в течение от двадцати до девяноста дней. Дополнительные примеры порядка размещения паклитаксела в отверстиях с градиентом концентраций описаны в международной заявке на патент WO 04/110302, указанной выше.
На фиг.20 для облегчения понимания лекарственное вещество, барьер и покрывающие слои показаны как отдельные слои внутри ячейки. Необходимо понимать, что эти слои не имеют четких границ и образованы путем смешения различных областей. Таким образом, хотя барьерные слои, главным образом, состоят из полимера и не подразумевают наличия лекарственного вещества, в зависимости от применяемых технологий производства, некоторое количество лекарственного вещества из следующего слоя может попасть в барьерный слой.
Количество доставляемых лекарственных веществ может варьироваться в зависимости от размера стента. Для стента размером 3×6 мм количество пимекролимуса составляет от приблизительно 50 до приблизительно 3 мкг, в предпочтительном варианте - от приблизительно 100 до приблизительно 250 мкг. Количество паклитаксела, доставляемого с такого стента, составляет от приблизительно 5 до приблизительно 50 мкг, в предпочтительном варианте - от приблизительно 10 до приблизительно 30 мкг. В одном примере осуществления доставляется приблизительно 200 мкг пимекролимуса и приблизительно 20 мкг паклитаксела. Лекарственные препараты могут размещаться в чередующихся отверстиях стента. Однако, ввиду большой разницы в дозировке двух лекарственных препаратов, которые необходимо доставить, целесообразнее разместить паклитаксел в каждом третьем или каждом четвертом отверстии в стенте. В альтернативном варианте отверстия для доставки низких доз лекарственного вещества (паклитаксела) могут быть меньше, чем отверстия для высоких доз.
Прослойки полимера/лекарственного препарата формируют при помощи управляемой компьютером пьезоэлектрической инъекции, как описано в международной заявке на патент WO 04/026182, опубликованной 01 апреля 2004 г., полностью включенной в настоящий документ путем ссылки. Сначала формируют прослойки первого агента, затем, при помощи пьезоэлектрического инъектора, формируют прослойки из второго агента. В альтернативном варианте система, описанная в международной заявке на патент WO 04/02182, может быть оснащена двойным пьезоэлектрическим дозиметром для дозированного введения двух агентов одновременно.
В соответствии с настоящим вариантом осуществления изобретения стент, дозирующий два лекарственных вещества, в первом комплекте ячеек 15710 содержит Гливек в сочетании с антипролиферативным препаратом паклитакселом, содержащимся во втором комплекте ячеек 15720. Каждое лекарственное вещество инкорпорировано в материал матрицы внутри ячеек стента в определенном мозаичном порядке, что позволяет достичь кинетики высвобождения, представленной на фиг.21.
Гливек доставляется путем двухфазного высвобождения, изначально с высокой скоростью высвобождения в течение первого дня, а затем путем медленного высвобождения в течение периода в диапазоне от одной до двух недель. Первая фаза высвобождения Гливека обеспечивает доставку приблизительно 50% загруженного препарата в течение первых двадцати четырех часов. Вторая фаза высвобождения обеспечивает доставку оставшихся 50% в течение 1-2 недель. Паклитаксел размещается внутри ячеек 15720 способом, благодаря которому формируется кинетика высвобождения с по существу линейным высвобождением по истечении первых двадцати четырех часов, как показано на фиг.21 и как изложено выше.
Количество доставляемых лекарственных веществ может варьироваться в зависимости от размера стента. Для стента размером 3×6 мм количество Гливека составляет от приблизительно 200 до приблизительно 500 мкг, в предпочтительном варианте - от приблизительно 300 до приблизительно 400 мкг. Количество паклитаксела, доставляемого с такого стента, составляет от приблизительно 5 до приблизительно 50 мкг, в предпочтительном варианте - от приблизительно 10 до приблизительно 30 мкг. Как и в вышеописанном примере осуществления, лекарственные препараты могут быть размещены в чередующихся отверстиях стента или распределены в произвольном порядке. Прослойки полимера/лекарственного препарата формируются способом, описанным выше.
В соответствии с настоящим примером осуществления стент, выделяющий два лекарственных вещества, содержит PKC-412 (регулятор клеточного роста) в первой серии ячеек в комбинации с антипролиферативным агентом паклитакселом во второй серии ячеек. Каждый агент включен в матричный материал внутри отверстий стента в особом мозаичном порядке, разработанном для достижения кинетики высвобождения, рассмотренной выше.
PKC-412 доставляется с по существу постоянной скоростью высвобождения, достигаемой приблизительно после первых двадцати четырех часов, высвобождение происходит в течение периода в диапазоне от приблизительно 4 до приблизительно 16 недель, в предпочтительном варианте - от приблизительно 6 до приблизительно 12 недель. Паклитаксел размещается внутри ячеек особым способом, благодаря которому формируется кинетика высвобождения с по существу линейным высвобождением достигаемым примерно после первых двадцати четырех часов, после чего высвобождение продолжается в течение периода в диапазоне от приблизительно 4 до приблизительно 16 недель, в предпочтительном варианте - от приблизительно 6 до приблизительно 12 недель.
Количество доставляемых лекарственных препаратов может варьироваться в зависимости от размера стента. Для стента размером 3×6 мм количество PKC-412 составляет от приблизительно 100 до приблизительно 400 мкг, в предпочтительном варианте - от приблизительно 150 до приблизительно 250 мкг. Количество паклитаксела, доставляемого с такого стента, составляет от приблизительно 5 до приблизительно 50 мкг, в предпочтительном варианте - от приблизительно 10 до приблизительно 30 мкг. Как и в вышеописанном примере осуществления, лекарственные препараты могут быть размещены в чередующихся отверстиях стента или распределены в произвольном порядке. Прослойки полимера/лекарственного препарата формируются способом, описанным выше.
Некоторые из агентов, описанных в настоящем документе, могут комбинироваться с добавками, поддерживающими их активность. Например, добавки, содержащие поверхностно-активные вещества, антациды, антиоксиданты и детергенты, могут использоваться для предельно возможного сокращения денатурации и агрегации белковых препаратов. Возможно применение анионных, катионных или неионных поверхностно-активных веществ. Примеры неионных вспомогательных веществ включают, помимо прочего, сахара, включая сорбит, сахарозу, трегалозу; декстраны, включая декстран, карбоксиметилдекстран (КМД), диэтиламиноэтил (ДЭАЭ); производные сахаров, включая D-глюкозаминовую кислоту и D-глюкоза диэтилмеркаптан; синтетические полиэфиры, включая полиэтиленгликоль (ПЭГ) и поливинилпирролидон (ПВП); карбоновые кислоты, включая D-молочную кислоту, гликолиевую кислоту и пропионовую кислоту; поверхностно-активные вещества с аффинностью к гидрофобным поверхностям раздела, включая n-додецилсульфат-бета-D-мальтозид, n-октил-бета-D-глюкозид, ПЭО-эфиры жирных кислот (а именно, стеарат (myrj 59) или олеат), ПЭО-сорбитановые эфиры жирных кислот (а именно, Твин 80, ПЭО-20 сорбитан моноолеат), эфиры сорбита и жирной кислоты (например, СПЭН 60, сорбитан моностеарат), ПЭО-глицериновые эфиры жирных кислот; глицериновые эфиры жирных кислот (а именно, глицерилмоностеарат), ПЭО-гидрокарбоновые эфиры (а именно, ПЭО-10 олеилэфир); тритон X-100 и Луброл. Примеры ионных детергентов включают, помимо прочего, соли жирных кислот, включая стеарат кальция, стеарат магния и стеарат цинка; фосфолипиды, включая лецитин и фосфатидилхолин; (ПК) КМ-ПЭГ; холевую кислоту; додецилсульфат натрия (ДСН); докузат (AOT) и таурохолевую кислоту.
В соответствии с другим примером осуществления стент или внутрипросветный каркас, описываемый здесь, может быть покрыт антитромботическим веществом в дополнение к одному или нескольким терапевтическим агентам, размещенным в отверстиях или ячейках. В одном примере осуществления стент может содержать ячейки. Перед добавлением или депонированием терапевтических средств в ячейках на стенте или на какой-либо из его частей может быть закреплено антитромботическое вещество вместе с транспортным средством для доставки этого вещества (полимер или полимерная матрица) или без него. В данном варианте осуществления люминальная и аблюминальная поверхности стента могут быть покрыты антитромботическим веществом или покрытием, также как и поверхности стенок ячеек или отверстий. В альтернативном варианте осуществления стент сначала покрывают антитромботическим веществом или покрытием, после чего делают ячейки или отверстия. В данном варианте осуществления только люминальная и аблюминальная поверхности покрыты антитромботическим веществом или покрытием, но не стенки отверстий или ячеек. В каждом из этих вариантов осуществления любое количество антитромботического вещества может быть закреплено на поверхности всего стента или его частей. Кроме того, любое количество известных методик может применяться для закрепления антитромботического вещества на стенте, например, такие, как методика, используемая для закрепления вещества в покрытии под торговой маркой HEPACOAT™ на коронарном стенте Bx Velocity® компании Cordis Corporation. В альтернативном варианте поверхность стента может быть шероховатой или микропористой, что усиливает прикрепление клеток и эндотелизацию, независимо от или в дополнение к антитромботическому покрытию. Кроме того, любое количество терапевтических средств может быть депонировано внутри ячеек или отверстий, при этом различные средства могут применяться на различных частях стента.
Теперь обратимся к фиг.22A, 22B и 22C. На них представлено схематическое изображение части стента.
Как показано на фиг.22A, стент 17900 имеет множество по существу круглых ячеек 17902. В данном варианте осуществления множество по существу круглых ячеек 17902 проходит через стенку стента 17900. Иными словами, множество по существу круглых ячеек 17902 проходит от аблюминальной поверхности стента 17904 к аблюминальной поверхности стента 17906, при этом толщина стенки представляет собой расстояние между люминальной и аблюминальной поверхностями. В других вариантах осуществления, однако, ячейки не проходят через стенку стента 17900. Например, ячейки или резервуары могут частично исходить либо от люминальной, либо от аблюминальной поверхностей, либо от обеих поверхностей. Стент 17900 на фиг.22A имеет необработанные поверхности 17904 и 17906 и пустые ячейки 17902.
На фиг.22B по меньшей мере одна поверхность покрыта терапевтическим веществом 17908. Терапевтическое средство предпочтительно должно включать в свой состав антитромботическое вещество, например, гепарин. Впрочем, допускается использование любого другого антитромботического вещества. Антитромботическое вещество может быть зафиксировано посредством любого метода, как кратко описано выше. В данном примере осуществления как люминальная, так и аблюминальная поверхности покрыты зафиксированным на них антитромботическим веществом. Кроме того, так как множество по существу круглых ячеек 17902 на этом соединительном элементе не имеют наполнения, стенки ячеек 17902 также могут содержать некоторое количество антитромботического вещества, зафиксированного на них. Количество антитромботического вещества, зафиксированного на стенках ячеек 17910, зависит от способа фиксации этого вещества. Например, если вещество фиксируется путем погружения, на стенках ячеек зафиксируется большее количество вещества, чем в том случае, если для фиксации вещества применяется метод распыления. Согласно описанию, в данном варианте осуществления все открытые поверхности имеют по существу антитромботическое покрытие. Однако в альтернативных вариантах осуществления антитромботическое покрытие нанесено только на определенные поверхности. Например, в одном варианте осуществления только поверхность, контактирующая с кровью, может быть обработана антитромботическим веществом. В другом варианте осуществления одна или обе поверхности могут быть покрыты антитромботическим веществом, тогда как стенки ячеек такого покрытия не имеют. Этого можно добиться различными способами, в том числе, при помощи закупорки ячеек перед нанесением покрытия или, в том случае, если проделать отверстия после фиксации антитромботического вещества.
На фиг.22C представлен заполненный стент в соответствии с данным примером осуществления. Как показано на чертеже, множество по существу круглых ячеек 17902 заполнено одним или несколькими терапевтическими агентами для лечения патологических состояний сосудов, таких как рестеноз и воспаление, или любых других заболеваний, как описано в настоящем документе. Каждая ячейка 17902 может быть заполнена одним терапевтическим агентом или различными агентами, как подробно описано выше. Как показано на чертеже, различные вещества 17912, 17914 и 17916 нанесены определенным способом. Однако, как подробно описано выше, допускается использование любой комбинации веществ, а также использование одного вещества в разных концентрациях. Лекарственные вещества, такие как рапамицин, могут быть депонированы в ячейках 17902 любым подходящим способом. Методы депонирования лекарственного вещества включают метод дозирования микропипеткой и (или) метод струйного впрыска. В одном примере осуществления заполнение лекарственным веществом может быть выполнено таким образом, что уровень лекарственного вещества и (или) матрицы лекарственное вещество/полимер в ячейке будет ниже уровня поверхности стента так, что контакт с окружающей тканью отсутствует. В альтернативном варианте ячейки могут быть заполнены так, что лекарственное вещество и (или) матрица лекарственное вещество/полимер могут контактировать с окружающей тканью. Кроме того, если используется несколько лекарственных веществ, доза каждого лекарственного вещества может быть рассчитана в максимально широком диапазоне. Помимо этого, скорость высвобождения каждого лекарственного вещества можно контролировать индивидуально. Например, ячейки, лежащие ближе к концам, могут содержать большее количество лекарственного препарата для лечения краевого рестеноза.
В соответствии с настоящим примером осуществления, ячейки могут быть сконфигурированы не только для осуществления наиболее эффективной лекарственной терапии, но и для образования физического разделения различных лекарственных веществ. Такое физическое разделение может помочь в предотвращении взаимодействия различных лекарственных веществ друг с другом.
В соответствии с другим примером осуществления, полимерная конструкция, включающая послойное распределение стереоспецифических полимеров, может применяться в качестве транспортного депо лекарственного вещества или терапевтического агента, или в качестве покрытий, используемых в сочетании с медицинскими устройствами. Под медицинскими устройствами в настоящем контексте понимаются любые устройства для локальной или регионарной доставки лекарственного вещества, описанные здесь. Фактически такая полимерная конструкция может применяться с любыми описанными в настоящем документе терапевтическими средствами или комбинацией таковых, с любым описанным здесь устройством для доставки лекарственного вещества, и с любыми описанными в настоящем документе имплантируемыми медицинскими устройствами. Кроме того, как уже упоминалось выше, полимерная конструкция может использоваться в качестве покрытия для покрытия некоторых или всех поверхностей имплантируемого медицинского устройства, или в качестве транспортного средства для заполнения резервуаров в имплантируемых медицинских устройствах. Полимерная конструкция может принимать множество форм, как подробно описано ниже.
В одном примере осуществления конструкция образована чередующимися слоями идентичных по своему химическому составу биоразлагаемых полимеров с различными оптическими вращениями. В этом примере осуществления биоразлагаемые полимеры включают поли-D-молочную кислоту (PDLA) и поли-L-молочную кислоту (PLLA). Поли-D-молочная кислота синтезирована из стереоспецифического RR-димера лактида при помощи катализатора, который сохраняет хиральные конфигурации в процессе полимеризации с раскрытием кольца. И наоборот, поли-L-молочная кислота синтезирована из SS-димера лактида путем полимеризации с раскрытием кольца. Условия полимеризации с раскрытием кольца известны специалистам в данной области. Данные чередующиеся слои, лежащие в непосредственной близости друг к другу, образуют стереокомплекс, который обеспечивает достижение наилучших результатов в отношении локальной или регионарной доставки лекарственного вещества и (или) терапевтического средства. Иными словами, идентичные химические свойства двух стереоспецифических полимеров с различными физическими свойствами позволяют использовать широкий спектр средств контроля стабильности терапевтических агентов и их высвобождения. Кроме того, изменения реологических свойств этих стереокомплексных биоразлагаемых полимеров делают эти материалы более плотными и позволяют использовать более тонкую толщину покрытия и полимер с более низкой молекулярной массой, при этом достигаются аналогичные или лучшие результаты, чем при использовании нестереокомплексных полимеров. Такие более тонкие покрытия в предпочтительном варианте должны улучшить длительную биологическую совместимость покрытия и сократить период ресорбции. Фактически, расположенные слоями поли-D-молочная кислота и поли-L-молочная кислота образуют стереокомплексы in situ, которые обеспечивают лучший контроль фармакинетики высвобождения терапевтического средства с использованием меньшего количества матричного носителя лекарственных средств.
Полимер-полимерные комплексы могут быть образованы путем смешивания полимеров с различными химическими составами в подходящих условиях. Такие комплексы включают комплекс полиэлектролита между поликатионом и полианионом, комплекс с образованием водородной связи между поликарбоновой кислотой и полиэфиром или полиолом, и комплекс с переносом заряда между полимерным донором и акцептором. Однако известны только ограниченные примеры, где формирование комплекса может происходить между полимерами с идентичными формулами, но с различными пространственными структурами. Как предполагается, первый такой комплекс был получен Ikada, Y., et al., Sterocomplex formation Between Enantiomeric poly(lactides), Marcomolecter, 1987, 20, 904-906, в 1987 году, в результате взаимодействия между поли-L-молочной кислотой и поли-D-молочной кислотой. Известно, что полимеры, образованные от D, L-лактидов, являются неупорядоченными и оптически недеятельными, тогда как полимеры, образованные от L-лактида и D-лактида, являются частично кристаллизованными и оптически деятельными. L-лактидный полимер кристаллизирован в большей степени, чем полимер на основе D-лактида, и может быть более гидрофобным, следовательно, он медленнее разлагается. Исследование Ikada также показало, что если смешать одинаковые грамм-молекулы поли-L-молочной кислоты и поли-D-молочной кислоты, смесь полимеров имеет общую температуру плавления, равную двумстам тридцати градусам по Цельсию, которая выше температуры плавления каждого полимера, взятого в отдельности, приблизительно на сто восемьдесят градусов по Цельсию. Кристаллическая структура поли-L-лактида, образованная из SS-лактида, как показано на фиг.23A, состоит из левовращающихся спиральных цепей, а поли-D-лактид, образованный из RR-лактида, как показано на фиг.23B, имеет правовращающуюся спиральную кристаллическую структуру. На фиг.23C представлен мезо-лактид, который при полимеризации образует неупорядоченный, рацемический полимер.
Наблюдения, полученные Ikada et al., могут иметь большое значение, если такие димер-лактиды используются в синтезе стереоспецифического полилактида, как показано на фиг.24 поли-L-лактид и на фиг.25 поли-D-лактид. По причинам, описанным в настоящем документе, стереокомплекс, образованный между поли-D-молочной кислотой и поли-L-молочной кислотой, способствует реализации более эффективного контроля над элюированием лекарственного препарата, с применением сравнительно меньшего количества носителя или более тонкого, или, как вариант, низкомолекулярного покрытия. Стереокомплекс, образованный между поли-D-молочной кислотой и поли-L-молочной кислотой, в результате может обладать большей физической стабильностью благодаря своей общей более высокой температуре плавления, а также может способствовать лучшему депонированию терапевтического средства или средств, содержащихся в нем. Кроме того, более низкая молекулярная масса поли-D-молочной кислоты и поли-L-молочной кислоты, используемых в стереокомплексе, способна привести к сокращению времени резорбции и улучшению биологической совместимости по сравнению с более высокой молекулярной массой каждого отдельно взятого полимера.
Пример технологического процесса с применением таких стереокомплексов поли-D-молочной кислоты и поли-L-молочной кислоты включает смешивание одной из стереоспецифических и оптически чистых полимолочных кислот с терапевтическим агентом или комбинацией агентов и нанесение покрытия по меньшей мере на часть поверхности медицинского устройства посредством обычного способа нанесения покрытия, такого как нанесение покрытия методом распыления. Допустимо использование любых методов нанесения покрытия, например, таких, которые описаны в настоящем документе. Следующим шагом является смешивание другой стереоспецифической и оптически чистой полимолочной кислоты с обратным оптическим вращением с терапевтическим агентом или комбинацией агентов и нанесение этого покрытия поверх предыдущего слоя. В качестве варианта, наносить покрытие можно, не дожидаясь, пока высохнет предыдущий слой. Эти полимеры, обладающие противоположной стереоспецифичностью, свяжутся in situ для образования стереокомплекса и удержания терапевтического агента или комбинации терапевтических агентов на месте для локальной или регионарной доставки. Процесс, описанный выше, можно повторять любое количество раз до тех пор, пока не будет достигнут необходимый уровень содержания терапевтического агента или комбинации терапевтических агентов. Верхний слой или покрытие из любого из двух оптически деятельных полимеров или комбинации полимеров может применяться для последующего регулирования скорости высвобождения терапевтического агента или комбинации агентов из покрытий.
Эта технология может применяться по меньшей мере на части поверхности или поверхностей любого из медицинских устройств, описанных в настоящем документе, с использованием любого из терапевтических агентов, описанных в настоящем документе, или комбинаций этих агентов, при помощи любого из описанных в настоящем документе методов нанесения покрытия. Кроме того, вышеописанный технологический процесс может осуществляться как с применением терапевтических агентов, так и без них.
В альтернативном варианте осуществления терапевтические агенты можно добавлять после нанесения каждого слоя на поверхность устройства, а не смешивать терапевтические агенты с полимерными слоями.
В еще одном альтернативном варианте осуществления комбинацию оптически чистых полилактидов и (или) терапевтических агентов, описанную выше, можно смешать и поместить в резервуар, например, в ячейку, внутри медицинского устройства, чтобы сформировать послойную конфигурацию терапевтического агента.
Обратимся к фиг.26A, 26B и 26C, на которых приведен пример покрытия или схемы депонирования с использованием чередующихся слоев поли-D-молочной кислоты и поли-L-молочной кислоты, дополнительно с терапевтическим агентом или терапевтическими агентами, распыленными между ними. Конкретно, на фиг.26A показан участок 11102 медицинского устройства в разрезе с нанесенным послойным стереокомплексным покрытием. В этом примере осуществления один или несколько терапевтических агентов 11104 смешиваются с поли-D-молочной кислотой 11106 и фиксируются на поверхности участка 11102 медицинского устройства. Второй слой, содержащий поли-L-молочную кислоту 11108, фиксируется поверх первого слоя, образуя тем самым базовый структурный элемент послойной конструкции. Необходимо отметить, что возможно использование дополнительных слоев, содержащих те же самые или другие терапевтические агенты 11110, при условии, что применяются полимеры, идентичные по химическому составу, но обладающие различными физическими свойствами. Как показано на чертежах, один или несколько дополнительных терапевтических агентов 11110 фиксируются на полимерном слое базового конструктивного элемента, а затем поверх терапевтического агента или агентов фиксируется второй слой базового конструктивного элемента, содержащий поли-D-молочную кислоту 11106 и поли-L-молочную кислоту 11108.
На фиг.26B показан резервуар 11112 в разрезе 11114 медицинского устройства с послойным стереокомплексным покрытием, депонированным в нем. В этом примере осуществления первый самый нижний барьерный слой поли-D-молочной кислоты 11116 и поли-L-молочной кислоты 11118 нанесен стандартным методом осаждения, таким как струйный впрыск. Поли-D-молочную кислоту и поли-L-молочную кислоту предварительно смешивают в универсальном растворителе и помещают в резервуар в последовательном порядке, формируя, таким образом, стереокомплексный барьерный слой. Количество поли-D-молочной кислоты и поли-L-молочной кислоты предпочтительно должно быть одинаковым. Затем поли-D-молочную кислоту 11116, смешанную с терапевтическим агентом 11120 или комбинацией терапевтических агентов 11120, помещают в резервуар, с последующим помещением поли-D-молочной кислоты 11118 для формирования in situ стереокомплекса и полимерной матрицы с лекарственным препаратом. Второй слой стереокомплекса поли-D-молочной кислоты и поли-L-молочной кислоты, дополнительно смешанный с тем же самым или другим терапевтическим агентом 11122, может быть помещен на первый слой, в очередной раз формируя послойную конструкцию. Такие чередующиеся слои могут повторяться любое количество раз. Для контроля над высвобождением лекарственного препарата с верхней стороны резервуара могут быть нанесены дополнительные верхние барьерные слои, содержащие поли-D-молочную кислоту и поли-L-молочную кислоту 1118.
Как было указано выше, терапевтический агент или агенты могут быть смешаны с полимерами или просто депонированы, или нанесены в качестве покрытия между полимерами.
На фиг.26C представлено послойное депонирование поли-D-молочной кислоты 11130 и поли-L-молочной кислоты 11132, используемых в качестве лекарственного диффузионного барьера для терапевтического агента или комбинации агентов 11128 на поверхности сечения 11126 медицинского устройства.
На фиг.27A и 27B представлено покрытие или схема депонирования с использованием полимерных растворов 11202, содержащих как поли-D-молочную кислоту, так и поли-L-молочную кислоту в молярном отношении один к одному, дополнительно также содержащих терапевтический агент или агенты 11204, диспергированные в растворе и зафиксированные на поверхности 11206 устройства или депонированные в резервуаре 11208 устройства.
В соответствии с другим примером осуществления, настоящее изобретение относится к сосудистому стенту, выделяющему два лекарственных препарата, имеющему резервуары, как описано выше, где часть этих резервуаров содержит композицию, которая выделяет сиролимус (рапамицин) по существу во внутристеночном или аблюминальном направлении, а в остальной части резервуаров содержится композиция, выделяющая цилостазол по существу в люминальном направлении. Более конкретно, после имплантации стента, выделяющего два лекарственных препарата, в артерию пациента, сиролимус элюируется локально в ткани артерии, оказывает терапевтическое воздействие и подавляет развитие рестеноза в артерии, тогда как цилостазол элюируется непосредственно в кровоток и обеспечивает антитромботический эффект как в просвете стента, выделяющего два лекарственных препарата, так и локально в стенке артерии, прилегающей к стенту, выделяющему лекарственные препараты. Таким образом достигается двойной антитромботический эффект, то есть уменьшение тромбообразования в самом имплантированном стенте, выделяющем два лекарственных препарата, или около стента и ингибирование агрегации тромбоцитов и их отложение в самом имплантированном стенте, выделяющем два лекарственных препарата, или около стента. Кроме того, в случаях когда стент, выделяющий два лекарственных препарата, применяется для лечения пациента с острым инфарктом миокарда, цилостазол может обеспечить кардиопротективный эффект в отношении миокардиальной ткани, перфузируемой кровью из стентированной артерии, предотвращая развитие феномена «невосстановленного кровотока» после стентирования, уменьшая реперфузионное повреждение и (или) размер инфаркта. Стент, выделяющий два лекарственных препарата, также может улучшить исход болезни у пациентов, для которых характерно медленное заживление, например, у пациентов, страдающих диабетом.
В данном примере осуществления изобретения стент, выделяющий два лекарственных вещества, снабжен резервуарами, которые необходимы для направленной доставки двух различных терапевтических агентов или лекарственных препаратов из стента. Композиция, содержащая полимер и сиролимус, предназначена для контролируемой длительной локальной доставки сиролимуса из части резервуаров, находящихся на аблюминальном ребре стента, к тканям артерии пациента. Композиция, содержащая полимер и цилостазол, предназначена для контролируемой длительной доставки цилостазола люминально из различных и отдельных резервуаров стента либо непосредственно в кровоток стентируемой артерии, либо позднее, после имплантации стента, в биологическую ткань, покрывающую люминальную поверхность стента.
Необходимо отметить, что хотя здесь и описаны изолированные и отдельные резервуары, на практике может быть использован любой другой подходящий механизм направленной доставки.
На фиг.28 представлено графическое боковое изображение части стента, выделяющего, согласно условиям настоящего изобретения, два лекарственных препарата. Хотя схема доставки терапевтического агента или лекарственного препарата может быть индивидуально разработана для некоторого числа различных ситуаций или клинических сценариев, для простоты понимания представляется, что смежные резервуары содержат различные лекарственные препараты. Стент 2800, выделяющий два лекарственных препарата, на чертеже имеет два резервуара 2802 и 2804. Один резервуар заполнен композицией с сиролимусом 2806, а другой заполнен композицией с цилостазолом 2808.
Композиция с сиролимусом содержит сиролимус и матрицу из сополимера лактида и гликолида (PLGA). В примере осуществления смесь состоит из 162 микрограмм сиролимуса и 93 микрограмм сополимера лактида и гликолида (PLGA). Процесс смешивания и заполнения резервуара подробно описан ниже. Для обеспечения высвобождения большей части сиролимуса в направлении пристеночной или аблюминальной стороны стента 2800, выделяющего два лекарственных препарата, как указывает стрелка 2810, базовая структура 2812 используется в качестве пробки в отверстии резервуара 2802 с люминальной стороны. Эта базовая структура 2812 может состоять из любого подходящего биосовместимого материала. В примере осуществления базовая структура 2812 состоит из сополимера лактида и гликолида (PLGA). Формирование базовой структуры 2812 подробно описано далее.
Композиция с цилостазолом содержит цилостазол и матрицу из сополимера лактида и гликолида (PLGA). В примере осуществления смесь включает 120 мкг цилостазола и 120 мкг сополимера лактида и гликолида (PLGA). Процесс смешивания и заполнения резервуара подробно описан ниже. Для обеспечения высвобождения большей части цилостазола в люминальном направлении стента 2800, выделяющего два лекарственных вещества, как указывает стрелка 2814, верхняя покрывающая структура 2816 используется в качестве пробки в отверстии резервуара 2804 с аблюминальной стороны. Эта верхняя покрывающая структура 2816 может состоять из любого подходящего биосовместимого материала. В примере осуществления верхняя покрывающая структура 2816 состоит из сополимера лактида и гликолида (PLGA). Формирование верхней покрывающей структуры 2816 подробно описано далее.
Количества лекарственного препарата и полимера, как сказано выше, являются суммарными для стента размером 3,5×17 мм. Диапазон дозировок для каждого лекарственного препарата подробно описан в дальнейшем. Кроме того, вес полимера представляет собой сумму веса полимера в матрице и веса полимера в базовой или верхней порывающей структуре. Количество использованного полимера также подробно объясняется далее.
Как было указано выше, резервуары стента могут быть заполнены или загружены множеством способов. В настоящем примере осуществления резервуары или ячейки заполняются композициями в ходе двух отдельных и последовательных этапов, включая, во-первых, депонирование жидкой композиции раствора в резервуарах и, во-вторых, выпаривание большей части, если не всего, растворителя наполняющего раствора. Идеальной ситуацией является отсутствие какого-либо растворителя в составе окончательной композиции. Композиции, в соответствии с настоящим изобретением, как описано выше, представляют собой твердые материалы, которые остаются в резервуарах после удаления практически всего, а в предпочтительном варианте - всего растворителя из композиции наполняющего раствора.
Жидкие композиции, используемые для образования твердых композиций, содержащих сиролимус, включают саморассасывающийся или биоабсорбирумый полимер, в предпочтительном варианте - сополимер лактида и гликолида (PLGA), полимер, подходящий растворитель, такой как диметилсульфоксид (DMSO) или N-метилпирролидон (NMP), сиролимус и необязательно стабилизатор или антиоксидант, такой как бутилокситолуол (BHT). В предпочтительном варианте по меньшей мере одна из жидких композиций наполняющих растворов используется на этапе депонирования для создания финальной композиции с сиролимусом в резервуарах стента, содержащих бутилокситолуол (BHT). Альтернативные варианты для бутилокситолуола (BHT) включают бутилированный гидроксианизол (BHA), эфиры галловой кислоты, такие как пропилгаллат или эфиры аксорбата, такие как пальмитоил аскорбат. Предпочтительно использование бутилокситолуола (BHT) по причине высокого уровня его эффективности в стабилизации сиролимуса, его низкой токсичности и гидрофобности. Бутилокситолуол (BHT) элюируется из резервуаров приблизительно с такой же скоростью, что и сиролимус. Таким образом, вместе с сиролимусом всегда присутствует бутилокситолуол (BHT). Альтернативы диметилсульфоксида (DMSO) и N-метилпирролидона (NMP) включают диметилацетонид (DMAc) или диметилформамид (DMF). Предпочтительно использование диметилсульфоксида (DMSO), так как сиролимус в присутствии DMSO проявляет большую стабильность.
Каждая последовательно наносимая жидкая композиция может содержать одни и те же компоненты, или последовательно наносимые наполняющие растворы могут быть приготовлены из наполняющих растворов, состоящих из различных компонентов. В предпочтительном варианте первая серия отложений из наполняющих растворов содержит только полимер и растворитель, после каждого этапа заполнения растворы высушивают. Эта часть процесса направлена на формирование или построение базовой структуры 2812. После того как базовая структура 2812 сформирована, добавляются последующие растворы, содержащие полимер, растворитель, сиролимус и - предпочтительно - бутилокситолуол (BHT), после чего они также высушиваются. Благодаря такой технологической последовательности операций в резервуаре образуется композиция, в которой сиролимус в области люминальной поверхности резервуара присутствует в более низкой концентрации, а в области пристеночной поверхности каждого резервуара сиролимус присутствует в относительно высокой концентрации. Такая конфигурация, как подробно описано выше, образует более длинный путь или более высокую резистентность к элюированию лекарственного препарата в люминальном направлении по сравнению с элюированием лекарственного препарата в пристеночном направлении, и, таким образом, способствует тому, чтобы по существу весь сиролимус доставлялся к пристеночной стороне стента и в ткань артерии. Иными словами, часть резервуаров, которая доставляет сиролимус по существу пристеночно, будет иметь такую конструкцию, в которой емкость резервуара на люминальной поверхности стента или возле нее будет содержать по существу полимер и незначительное количество сиролимуса, тогда как емкость того же резервуара на пристеночной стороне стента или возле нее будет содержать по существу сиролимус и небольшую пропорцию полимера.
Композиция сиролимуса внутри резервуара по существу будет включать сиролимус, саморассасывающийся полимер, стабилизирующий агент и растворитель пропорционально друг другу. В предпочтительном варианте суммарная доза или количество сиролимуса, поступающего из стента, выделяющего лекарственный препарата, составляет от 0,6 до 3,2 мкг на квадратный миллиметр площади ткани артерии, где площадь ткани артерии определяется как площадь поверхности теоретического цилиндра, диаметр и длина которого соответствуют диаметру и длине расширяемого стента, имплантированного в артерию. В более предпочтительном варианте суммарная доза или количество сиролимуса, поступающего из стента, выделяющего лекарственное вещество, составляет от 0,78 до 1,05 мкг на квадратный миллиметр площади ткани артерии.
Как было указано выше, саморассасывающийся полимер, применяемый в композиции, включает сополимер лактида и гликолида (PLGA). В более предпочтительном варианте композиция включает сополимер лактида и гликолида (PLGA), при этом молярное отношение остатков лактида к остаткам гликолида (L:G) в полимерной цепи составляет от приблизительно 85:15 до приблизительно 65:35. В более предпочтительном варианте композиция должна включать сополимер лактида и гликолида (PLGA), при этом молярное отношение остатков лактида к остаткам гликолида (L:G) в полимерной цепи составляет от приблизительно 80:20 до приблизительно 70:30. Сополимер лактида и гликолида (PLGA) предпочтительно обладает собственной вязкостью в пределах от приблизительно 0,3 до приблизительно 0,9. В наиболее предпочтительном варианте сополимер лактида и гликолида (PLGA) должен обладать собственной вязкостью в пределах от приблизительно 0,6 до приблизительно 0,7. Весовое отношение сиролимуса к сополимеру лактида и гликолида (PLGA), обозначаемое как соотношение D/P, предпочтительно лежит в пределах от приблизительно 50/50 до приблизительно 70/30, а в более предпочтительном варианте - от приблизительно 54/46 до приблизительно 66/34. Все соотношения приведены в % вес. В альтернативном варианте относительные весовые соотношения сиролимуса и сополимера лактида и гликолида (PLGA) могут быть выражены в нормализованной форме, D:P. Таким образом, предпочтительное D:P соотношение находится в диапазоне от приблизительно 1:0,4 до приблизительно 1:1,2, а более предпочтительно - в пределах от приблизительно 1:0,52 до приблизительно 1:0,85.
Также, как описано выше, композиция сиролимуса предпочтительно содержит бутилокситолуол (BHT). Количество добавляемого бутилокситолуола (BHT) предпочтительно составляет от приблизительно 1% вес. до приблизительно 3% вес. от общего количества сиролимуса. В еще более предпочтительном варианте количество бутилокситолуола (BHT) составляет от приблизительно 1,2% вес. до приблизительно 2,6% вес. от общего количества сиролимуса.
Для приготовления раствора для заполнения из вышеописанных компонентов требуется подходящий растворитель. Диметилсульфоксид (DMSO) является предпочтительным растворителем и в предпочтительном варианте используется в количестве от приблизительно 1% до приблизительно 20% вес. к весу сиролимуса. В еще более предпочтительном варианте диметилсульфоксид (DMSO) используется в количестве от приблизительно 1% до приблизительно 15% вес. к весу сиролимуса. В еще более предпочтительном варианте количество используемого диметилсульфоксида (DMSO) составляет от приблизительно 4% до приблизительно 12% вес. к весу сиролимуса.
Жидкие композиции, используемые для формирования твердой композиции, содержащей цилостазол, включают саморассасывающийся или биоабсорбируемый полимер, предпочтительно сополимер лактида и гликолида (PLGA), полимер, соответствующий растворитель, такой как диметилсульфоксид (DMSO), N-метилпирролидон (NMP) или цилостазол. Допустимо использование в композиции тех же самых альтернатив диметилсульфоксида (DMSO) и N-метилпирролидона (NMP), однако предпочтительным является использование диметилсульфоксида (DMSO).
Каждая последовательно наносимая жидкая композиция может содержать одни и те же компоненты, или последовательно наносимые наполняющие растворы могут быть приготовлены из наполняющих растворов, состоящих из различных компонентов. В предпочтительном варианте первая серия отложений из наполняющих растворов содержит полимер, цилостазол и растворитель, после каждого этапа заполнения растворы высушивают, а последняя серия наполняющих растворов содержит только полимер и растворитель, также после каждого этапа заполнения растворы высушивают. Этот процесс направлен на формирование или построение покрывной структуры 2816. Такая технологическая последовательность позволяет создать в резервуаре композицию, включающую цилостазол в пониженной концентрации в области поверхности резервуара, обращенной к стенке сосуда, и цилостазол в относительно высокой концентрации в области люминальной поверхности каждого резервуара. Такая конфигурация, как подробно указано выше, образует более длинный путь или более высокую резистентность к элюированию лекарственного препарата в пристеночном направлении по сравнению с элюированием лекарственного препарата в люминальном направлении и, таким образом, способствует тому, чтобы по существу весь цилостазол доставлялся к люминальной стороне стента и в кровоток и (или) ткани артерий. Иными словами, часть резервуаров, которая доставляет цилостазол по существу в люминальном направлении, будет иметь такую конструкцию, в которой емкость резервуара на пристеночной поверхности стента или возле нее будет содержать по существу полимер и незначительное количество цилостазола, тогда как емкость того же резервуара на люминальной поверхности или возле нее будет содержать по существу цилостазол и небольшую пропорцию полимера.
Композиция цилостазола внутри резервуара по существу будет состоять из цилостазола, саморассасывающегося полимера и растворителя пропорционально друг к другу. В предпочтительном варианте суммарная доза или количество цилостазола, поступающего из стента, выделяющего лекарственный препарат, составляет от 0,4 до 2,5 мкг на квадратный миллиметр площади ткани артерии, где площадь ткани артерии определяется как площадь поверхности теоретического цилиндра, диаметр и длина которого соответствуют диаметру и длине расширяемого стента, имплантированного в артерию. В более предпочтительном варианте суммарная доза или количество цилостазола, поступающего из стента, выделяющего лекарственный препарат, составляет от 0,56 до 1,53 мкг на квадратный миллиметр площади ткани артерии.
Как было указано выше, саморассасывающийся полимер, применяемый в композиции, включает сополимер лактида и гликолида (PLGA). В более предпочтительном варианте композиция включает сополимер лактида и гликолида (PLGA), при этом молярное отношение остатков лактида к остаткам гликолида (L:G) в полимерной цепи составляет от приблизительно 90:10 до приблизительно 25:75. Более предпочтительно композиция должна включать сополимер лактида и гликолида (PLGA), при этом молярное отношение остатков лактида к остаткам гликолида (L:G) в полимерной цепи составляет от приблизительно 80:20 до приблизительно 45:55. Сополимер лактида и гликолида (PLGA) предпочтительно обладает собственной вязкостью в пределах от приблизительно 0,1 до приблизительно 0,9. В наиболее предпочтительном варианте сополимер лактида и гликолида (PLGA) должен обладать собственной вязкостью в пределах от приблизительно 0,4 до приблизительно 0,7. Весовое отношение цилостазола к сополимеру лактида и гликолида (PLGA), обозначаемое как соотношение D/P, предпочтительно лежит в пределах от приблизительно 35/65 до приблизительно 95/5, а в более предпочтительном варианте - от приблизительно 47/53 до приблизительно 86/14. Все соотношения приведены в % вес. В альтернативном варианте относительные весовые соотношения цилостазола и сополимера лактида и гликолида (PLGA) могут быть выражены в нормализованной форме, D:P. Таким образом, предпочтительное D:P соотношение лежит в пределах от приблизительно 1:0,05 до приблизительно 1:2,0, а более предпочтительно - в пределах от приблизительно 1:0,16 до приблизительно 1:1,20.
Для приготовления раствора для заполнения из вышеописанных компонентов требуется подходящий растворитель. Диметилсульфоксид (DMSO) является предпочтительным растворителем и в предпочтительном варианте используется в количестве от приблизительно 0,01% до приблизительно 20% вес. к весу цилостазола. В еще более предпочтительном варианте диметилсульфоксид (DMSO) используется в количестве от приблизительно 1% до приблизительно 15% вес. к весу цилостазола. В еще более предпочтительном варианте количество используемого диметилсульфоксида (DMSO) составляет от приблизительно 3% до приблизительно 12% вес. к весу цилостазола.
Как было указано выше, стенты могут быть изготовлены из любого подходящего биосовместимого материала. В данном примере осуществления стент предпочтительно изготовлен из кобальтохромового сплава. Кроме того, соотношение полимеров в составе сополимера лактида и гликолида (PLGA) может варьировать. Например, сополимер лактида и гликолида (PLGA) может иметь соотношение L:G от приблизительно 100:0 до приблизительно 0:100, в более предпочтительном варианте - от приблизительно 50:50 до приблизительно 85:15, а еще более предпочтительно - от приблизительно 60:40 до приблизительно 80:20.
Уникальное исполнение или конструкция стента, выделяющего два лекарственных вещества, описываемого в настоящем изобретении, обеспечивает абсолютно независимые скорости выделения сиролимуса и цилостазола. Кроме того, эта уникальная конструкция обеспечивает доставку сиролимуса по существу в пристеночном или аблюминальном направлении, и доставку цилостазола по существу в люминальном направлении.
Обратимся к фиг.29. На нем показаны суммарные данные, в процентном соотношении выражающие высвобождение каждого из лекарственных препаратов из стента, выделяющего лекарства in vivo. Кривая 2902 отображает профиль высвобождения цилостазола, тогда как кривая 2904 отображает профиль высвобождения сиролимуса. На фиг.30 графически отображается количество каждого лекарственного препарата в микрограммах, высвободившегося in vivo. Кривая 3002 отображает профиль цилостазола, а кривая 3004 отображает профиль сиролимуса. Кривые на чертежах показывают, что оба лекарственных вещества высвобождаются независимо друг от друга, при этом их взаимодействие друг с другом сведено к минимуму или вообще отсутствует. От приблизительно 60% (шестидесяти) до приблизительно 70% (семидесяти) высвобождения обоих препаратов наблюдалось в течение первых 30 (тридцати) дней. В силу того, что в соответствующих резервуарах содержится различное количество лекарственных веществ (вес.), суммарное количество высвободившегося в течение 30 (тридцати) дней лекарственного препарата выше для сиролимуса, чем для цилостазола.
Необходимо отметить, что закладывание препарата или дозировка для каждого препарата может определяться множеством способов, включая перечисленные выше. В предпочтительном варианте осуществления диапазоны доз могут быть выражены в виде сгруппированных абсолютных диапазонов веса лекарственного препарата, исходя из стандартного размера стента 3,5×17 мм. Таким образом, диапазон доз определяется размером стента и соответствует количеству резервуаров. Например, для стента размером 3,5×17 мм количество отверстий или резервуаров составляет 585. В других вариантах осуществления количество резервуаров для указанного размера стента может включать в себя 211 резервуаров для стента 2,5×8 мм, 238 резервуаров для стента 3,0×8 мм, 290 резервуаров для стента 3,5×8 мм, 311 резервуаров для стента 2,5×12 мм, 347 резервуаров для стента 3,0×12 мм, 417 резервуаров для стента 3,5×12 мм, 431 резервуар для стента 2,5×17 мм, 501 резервуар для стента 3,0×17 мм, 551 резервуар для стента 2,5×22 мм, 633 резервуара для стента 3,0×22 мм, 753 резервуара для стента 3,5×22 мм, 711 резервуаров для стента 2,5×28 мм, 809 резервуаров для стента 3,0×28 мм, 949 резервуаров для стента 3,5×28 мм, 831 резервуар для стента 2,5×33 мм, 963 резервуара для стента 3,0×33 мм и 1117 резервуаров для стента 3,5×33 мм. Диапазоны доз, указанные в настоящем документе, покрывают соотношение резервуаров, содержащих сиролимус, и резервуаров, содержащих цилостазол от 20%/80% до 80%/20%. Дозировка сиролимуса для применения на стенте размером 3,5×17 мм лежит в пределах от приблизительно 30 мкг до приблизительно 265 мкг, в более предпочтительном варианте - от приблизительно 130 мкг до приблизительно 200 мкг, еще более предпочтительна дозировка в пределах от приблизительно 150 мкг до приблизительно 180 мкг. Необходимо отметить, что в настоящем документе приведены примерные размеры и количество резервуаров. Дозировка цилостазола для стента размером 3,5×17 мм составляет от приблизительно 50 мкг до приблизительно 200 мкг, в более предпочтительном варианте - от приблизительно 90 мкг до приблизительно 200 мкг, еще более предпочтительна дозировка в пределах от приблизительно 100 мкг до приблизительно 150 мкг. Как было указано выше, диапазоны доз определяются размером стента и количеством резервуаров. Эти дозы даны для конечного продукта стерилизованного стента.
Стент, выделяющий два лекарственных препарата, рассматриваемый в рамках настоящего изобретения, может применяться для лечения ряда патологических состояний в соответствии с вышеизложенным описанием, в том числе рестеноз, тромбоз, острый инфаркт миокарда, реперфузионное повреждение, феномен невосстановленного капиллярного кровотока, ишемические заболевания и (или) для повышения эффекта при применении сиролимуса для предотвращения рестеноза у больных диабетом. Помимо сиролимуса и цилостазола, вместе с устройством могут использоваться другие лекарственные препараты. Например, как было указано выше, возможно добавление антитромботических веществ, таких как гепарин. Дополнительные препараты могут быть включены как в само покрытие, так и размещены в резервуарах. Необходимо отметить, что любое количество лекарственных препаратов и комбинаций резервуаров, а также покрытий, могут применяться для того, чтобы адаптировать устройство к конкретному патологическому состоянию.
Другие лекарственные препараты и класса цилостазола включают милринон, веснаринон, эноксимон, пимобендан, инамринон, цилостамид, сатеринон, мотапизон, ликсазинон, имазодан, Плетал, Примакор, Амринон Лактат и мерибендан.
Также необходимо отметить, что период высвобождения можно рассчитать индивидуально. Например, in vitro высвобождение сиролимуса лежит в пределах от приблизительно 7 до приблизительно 120 дней и более, предпочтительным является период от приблизительно 14 до приблизительно 90 дней, тогда как in vitro высвобождение цилостазола может варьировать от приблизительно 5 до приблизительно 61 дня. Состояние высвобождения может быть специально разработано для каждого отдельного лекарственного препарата.
В соответствии с другим примером осуществления настоящее изобретение относится к сосудистому стенту, изготавливаемому из кобальто-хромового сплава и выделяющему рапамицин, в котором резервуары содержат композицию, которая выделяет сиролимус (рапамицин) по существу в пристеночном или аблюминальном направлении. Соответственно, сиролимус будет выделяться местно и проникать в ткани артерии, оказывая лечебное действие и снижая возможность развития рестеноза артерии.
Как было указано выше, стент, описанный в настоящем документе в качестве примера, изготавливается из кобальто-хромового сплава. В соответствии с условиями настоящего изобретения, для изготовления стента может использоваться кобальто-хромовый сплав, такой как L605. Традиционный сплав на основе кобальта, такой как L605 (т.е. UNS R30605), который также широко используется в качестве материала для создания имплантируемых биосовместимых устройств, может содержать хром (Cr) в пределах от приблизительно 19 до приблизительно 21% вес., вольфрам (W) в пределах от приблизительно 14 до приблизительно 16% вес., никель (Ni) в пределах от приблизительно 9 до приблизительно 11% вес., железо (Fe) в пределах до 3% вес., марганец (Mn) в пределах до 2% вес., кремний(Si) в пределах до 1% вес., где кобальт (Co) составляет остаток (приблизительно 49% вес.) композиции.
В альтернативном варианте другой традиционный сплав на основе кобальта, такой как Haynes 188 (т.e. UNS R30188), который также широко используется в качестве материала для создания имплантируемых биосовместимых устройств, может содержать никель (Ni) в пределах от приблизительно 20 до приблизительно 24% вес., хром (Cr) в пределах от приблизительно 21 до приблизительно 23% вес., вольфрам (W) в пределах от приблизительно 13 до приблизительно 15% вес., железо (Fe) в пределах до 3% вес., марганец (Mn) в пределах до 1,25% вес., кремний (Si) в пределах от приблизительно 0,2 до приблизительно 0,5% вес., лантан (La) в пределах от приблизительно 0,02 до приблизительно 0,12% вес., бор (B) в пределах до 0,015% вес., где кобальт (Co) составляет остаток (приблизительно 38% вес.) композиции.
В целом, при необходимости к сплавам на основе железа и (или) кобальта использовались добавки из элементов, таких как хром (Cr), никель (Ni), вольфрам (W), марганец (Mn), кремний (Si) и молибден (Mo), что увеличивало или позволяло достигать требуемых технических характеристик, включая прочность, обрабатываемость материала и коррозионную устойчивость в условиях соответствующего клинического использования.
В данном примере осуществления изобретения, в котором рассматривается сосудистый стент, изготавливаемый из кобальто-хромового сплава и выделяющий рапамицин, композиция в составе полимера и сиролимуса обеспечивает контролируемую продолжительную местную доставку сиролимуса из резервуаров стента, по существу в пристеночном или аблюминальном направлении, к артериальным тканям пациента.
Эта композиция, в соответствии с формулой настоящего изобретения, закладывается в резервуары в ходе последовательных этапов, включающих депонирование жидкой композиции раствора в резервуары и выпаривание большей части, если не всего, растворителя наполняющего раствора. Идеальной ситуацией является отсутствие какого-либо растворителя в составе окончательной композиции. Следует учитывать, что любой подходящий процесс депонирования может использоваться в соответствии с описанным здесь порядком. Композиция, выполненная в соответствии с настоящим изобретением, как указано выше, представляет собой твердый материал, который остается в резервуаре после удаления практически всего, а в предпочтительном варианте - всего растворителя из композиции наполняющего раствора.
Жидкие композиции, используемые для образования твердых композиций, содержащих сиролимус, включают саморассасывающийся или биоабсорбирумый полимер, в предпочтительном варианте - сополимер лактида и гликолида (PLGA), полимер, подходящий растворитель, такой как диметилсульфоксид (DMSO) или N-метилпирролидон (NMP), сиролимус и дополнительно стабилизатор или антиоксидант, такой как бутилокситолуол (BHT). Альтернативное название BHT - бутилокситолуол. В предпочтительном варианте по меньшей мере одна из жидких композиций наполняющих растворов, используемых на этапе депонирования для создания финальной композиции с сиролимусом в резервуарах стента, содержит бутилокситолуол (BHT).
Альтернативные варианты для бутилокситолуола (BHT) включают бутилированный гидроксианизол (BHA), эфиры галловой кислоты, такие как пропилгаллат или эфиры аксорбата, такие как пальмитоил аскорбат. Предпочтительно использование бутилокситолуола (BHT) по причине его высокой эффективности в стабилизации сиролимуса, его низкой токсичности и гидрофобности. Бутилокситолуол (BHT) элюируется из резервуаров приблизительно с такой же скоростью, что и сиролимус. Таким образом, вместе с сиролимусом всегда предпочтительно присутствует бутилокситолуол (BHT). В альтернативном варианте вместо диметилсульфоксида (DMSO) и N-метилпирролидона (NMP) может использоваться диметилацетонид (DMAc) или диметилформамид (DMF). Предпочтительно использование диметилсульфоксида (DMSO), так как сиролимус в присутствии DMSO проявляет большую стабильность.
Каждая последовательно наносимая жидкая композиция может содержать одни и те же компоненты, или последовательно наносимые наполняющие растворы могут быть приготовлены из наполняющих растворов, состоящих из различных ингредиентов или компонентов. В предпочтительном варианте первая серия отложений из наполняющих растворов содержит только полимер и растворитель, после каждого этапа заполнения растворы высушивают. Эта часть процесса в результате приводит к формированию конструкции базовой структуры. В предпочтительном варианте осуществления выполняются пять отдельных этапов заполнения, причем после каждого этапа следует период высушивания, длящийся один час при температуре 55 градусов Цельсия с целью удаления растворителя из композиции. Как только базовая структура сформирована, добавляют следующие растворы, содержащие полимер, растворитель, сиролимус и BHT, эти растворы также высушивают после каждого этапа заполнения. В предпочтительном варианте осуществления выполняются четыре отдельных этапа заполнения раствором, содержащим лекарственный препарат, причем после каждого этапа следует период высушивания, длящийся один час при температуре 55 градусов Цельсия с целью удаления растворителя из композиции, содержащей лекарственный препарат. По завершении финального этапа заполнения стент подвергается сушке в течение двадцати четырех часов при температуре 55 градусов Цельсия. Такая технологическая последовательность позволяет создать в резервуаре композицию, включающую сиролимус в пониженной концентрации в области люминальной поверхности стента, и сиролимус в относительно высокой концентрации в области пристеночной или аблюминальной поверхности стента. Такая конфигурация образует более длинный путь или более высокую резистентность к элюированию лекарственного препарата в люминальном направлении по сравнению с элюированием лекарственного препарата в пристеночном направлении и, таким образом, способствует тому, чтобы практически весь сиролимус доставлялся к пристеночной стороне стента и в ткани артерии.
Композиция сиролимуса внутри резервуара по существу будет включать в себя сиролимус, саморассасывающийся полимер, стабилизирующий агент и растворитель, в определенном пропорциональном соотношении друг к другу. В предпочтительном варианте суммарная доза или количество сиролимуса, поступающего из стента, составляет от 0,15 до 2,7 мкг на квадратный миллиметр площади ткани артерии, где площадь ткани артерии определяется как площадь поверхности теоретического цилиндра, диаметр и длина которого соответствуют диаметру и длине расширяемого стента, имплантированного в артерию. В более предпочтительном варианте суммарная доза или количество сиролимуса, поступающего из стента, составляет от 0,7 до 1,2 мкг на квадратный миллиметр площади ткани артерии. В более предпочтительном варианте суммарная доза или количество сиролимуса, поступающего из стента, составляет от 0,87 до 1,1 мкг на квадратный миллиметр площади ткани артерии. Однако спецификация высвобождения для данного варианта осуществления находится в диапазоне от 90% до 110% заявленного содержания. Таким образом, суммарная доза или количество сиролимуса, поступающего из стента, составляет от 0,78 до 1,21 мкг на квадратный миллиметр площади ткани артерии.
Как было указано выше, саморассасывающийся полимер, применяемый в композиции, включает сополимер лактида и гликолида (PLGA). В более предпочтительном варианте композиция включает сополимер лактида и гликолида (PLGA), при этом молярное отношение остатков лактида к остаткам гликолида (L:G) в полимерной цепи составляет от приблизительно 100:0 до приблизительно 50:50. Более предпочтительно, композиция должна включать сополимер лактида и гликолида (PLGA), при этом молярное отношение остатков лактида к остаткам гликолида (L:G) в полимерной цепи составляет от приблизительно 80:20 до приблизительно 70:30. Весовое отношение сиролимуса к сополимеру лактида и гликолида (PLGA), обозначаемое как соотношение D/P, предпочтительно лежит в пределах от приблизительно 30/70 до приблизительно 60/40, а в более предпочтительном варианте - от приблизительно 42/58 до приблизительно 50/50, наиболее предпочтительно - 46/54. Все соотношения приведены в % вес. В альтернативном варианте относительные весовые соотношения цилостазола и сополимера лактида и гликолида (PLGA) могут быть выражены в нормализованной форме, D:P. Таким образом, предпочтительное D:P соотношение лежит в пределах от приблизительно 1:0,66 до приблизительно 1:2,3, более предпочтительно - от приблизительно 1:1,00 до приблизительно 1:1,38, наиболее предпочтительно - приблизительно 1:1,17. Собственная вязкость полимера составляет от приблизительно 0,66 до приблизительно 0,72 дл/г.
Также, как было указано выше, композиция сиролимуса предпочтительно содержит бутилокситолуол (BHT). Количество добавляемого BHT предпочтительно должно составлять менее приблизительно 3% вес. от количества сиролимуса. В еще более предпочтительном варианте количество бутилокситолуола (BHT) составляет от приблизительно 1,2% вес. до приблизительно 2,6% вес. от общего количества сиролимуса. В наиболее предпочтительном варианте количество бутилокситолуола (BHT) составляет от приблизительно 1,6% вес. до приблизительно 2,0% вес. от общего количества сиролимуса.
Для приготовления раствора для заполнения из вышеописанных компонентов требуется подходящий растворитель. Диметилсульфоксид (DMSO) является предпочтительным растворителем для использования в рамках настоящего изобретения. Он используется в количестве от приблизительно 0,01% до приблизительно 20% вес. к весу сиролимуса. В еще более предпочтительном варианте диметилсульфоксид (DMSO) используется в количестве от приблизительно 1% до приблизительно 15% вес. к весу сиролимуса. В еще более предпочтительном варианте диметилсульфоксид (DMSO) используется в количестве от приблизительно 4% до приблизительно 12% вес. к весу сиролимуса, в наиболее предпочтительном варианте - от приблизительно 7% до приблизительно 10% вес. к весу сиролимуса.
Необходимо отметить, что закладывание препарата или дозировка для каждого препарата может определяться множеством способов, включая перечисленные выше. В предпочтительном варианте осуществления диапазоны доз могут быть выражены в виде сгруппированных абсолютных диапазонов веса лекарственного препарата, исходя из стандартного размера стента 3,5×17 мм. Таким образом, диапазон доз определяется размером стента и соответствует количеству резервуаров. Например, для стента размером 3,5×17 мм количество отверстий или резервуаров составляет 585. В других вариантах осуществления количество резервуаров для указанного размера стента может включать в себя 211 резервуаров для стента 2,5×8 мм, 238 резервуаров для стента 3,0×8 мм, 290 резервуаров для стента 3,5×8 мм, 311 резервуаров для стента 2,5×12 мм, 347 резервуаров для стента 3,0×12 мм, 417 резервуаров для стента 3,5×12 мм, 431 резервуар для стента 2,5×17 мм, 501 резервуар для стента 3,0×17 мм, 551 резервуар для стента 2,5×22 мм, 633 резервуара для стента 3,0×22 мм, 753 резервуара для стента 3,5×22 мм, 711 резервуаров для стента 2,5×28 мм, 809 резервуаров для стента 3,0×28 мм, 949 резервуаров для стента 3,5×28 мм, 831 резервуар для стента 2,5×33 мм, 963 резервуара для стента 3,0×33 мм и 1117 резервуаров для стента 3,5×33 мм. Дозировка сиролимуса для применения на стенте размером 3,5×17 мм лежит в пределах от приблизительно 30 мкг до приблизительно 500 мкг, в более предпочтительном варианте - от приблизительно 130 мкг до приблизительно 200 мкг, а еще более предпочтительно - от приблизительно 140 мкг до приблизительно 185 мкг. Необходимо отметить, что в настоящем документе приведены примерные размеры и количество резервуаров. Как было указано выше, диапазоны доз определяются размером стента и количеством резервуаров. Эти дозы даны для конечного продукта стерилизованного стента.
Также необходимо отметить, что период высвобождения можно рассчитать индивидуально. Например, высвобождение сиролимуса in vivo может варьировать от приблизительно 7 до приблизительно 120 дней, более предпочтительно - в пределах от приблизительно 14 до приблизительно 90 дней.
Вариант осуществления стента, составляющего предмет настоящего изобретения, обладает хорошей гибкостью и маневренностью, но в то же время сохраняет радиальную стабильность, необходимую для поддержания свободной проходимости сосудов. Стент может быть изготовлен любым подходящим способом, включая лазерную резку трубки, выполненной из подходящего материала, такого как кобальтохромовые сплавы, нержавеющая сталь или никелево-титановые сплавы. Несмотря на то что коронарные гибкие стенты, составляющие предмет настоящего изобретения, описаны с целью иллюстрации одного варианта осуществления настоящего изобретения, специалист в данной области знает, что раскрытый вариант осуществления настоящего изобретения может быть также использован для имплантации в другие органы или просветы организма, например, в васкулярные, неваскулярные и периферические сосуды, каналы и т.п.
В соответствии с одним аспектом настоящего изобретения гибкий стент выполнен таким образом, что его можно сжать, уменьшив диаметр до минимального размера, и ввести через просвет организма к месту имплантации при помощи катетера. Местом имплантации может являться, например, коронарная артерия сердца. После установки гибкий стент поддерживает свободную проходимость сосуда и, если необходимо, доставляет контролируемые количества лекарственных препаратов или агентов.
На фиг.31A, 31B и 31C представлены виды гибкого стента 31100 в перспективе в расширенном (развернутом), сжатом и «вырезанном», или готовом, состоянии соответственно, в соответствии с одним из вариантов осуществления настоящего изобретения. При изготовлении стент 31100 имеет «вырезанный» диаметр D3, как показано на фиг.31C. Стент 31100 сжимается и его диаметр уменьшается до первого диаметра D1, как показано на фиг.31B. Такая конфигурация предназначена для введения в организм пациента и перемещения по сосудам, а второй диаметр D2, показанный на фиг.31A, предназначен для размещения в целевой области сосуда. Как видно, второй диаметр больше первого диаметра.
Гибкий стент 31100 представляет собой цилиндр с трубчатой конфигурацией структурных элементов и имеет люминальную и аблюминальную поверхности 31101 и 31102 соответственно, а также образующуюся между ними стенку (толщину стенки) T. Цилиндрическая форма стента задает продольную ось 31103 и имеет проксимальную и дистальную конечные части 31104 и 31105, соответственно.
Термины «проксимальный» и «дистальный» обычно используются для обозначения направления или положения относительно тела человека. Например, «проксимальный конец кости» служит для обозначения конца кости, расположенного ближе к центру тела. В противоположность этому термин «дистальный» может использоваться для обозначения кости, отдаленной от центра тела. В сосудистой системе термины «проксимальный» и «дистальный» иногда используются для обозначения направления потока крови к сердцу или от сердца соответственно. Поскольку гибкий стент, составляющий предмет настоящего изобретения, может использоваться в различных просветах организма, включая артериальную и венозную системы, термины «проксимальный» и «дистальный» используются в настоящем документе для обозначения взаимного расположения относительно направления доставки. Например, термин «дистальная конечная часть» в рамках настоящего документа используется для обозначения конечной части стента, которая первой вводится в сосудистую систему и находится дальше от точки введения в организм по отношению к пути доставки. В противоположность этому термин «проксимальная конечная часть» используется для обозначения задней конечной части стента, расположенной ближе к точке введения в организм по отношению к пути доставки.
На фиг.32 и 33 представлена проекция стента 31100 на плоскость в частично расширенном состоянии в соответствии с одним из вариантов осуществления настоящего изобретения. В рамках настоящего документа термин «проекция на плоскость» понимается как двухмерный (2-D) вид стента в разрезе, выполненном вдоль продольной оси, и расположенного на плоскости так, что нижний край может быть обернут вокруг цилиндра и соединен с верхним краем.
Конструкция стента 31100 в целом включает кольцеобразные концевые секции 31106 и 31107 вдоль проксимального и дистального концов 31104 и 31105, соответственно, и спиралевидную внутреннюю секцию 31108, расположенную между ними. Спиралевидная внутренняя секция 31108 также включает центральную зону 31111 и проксимальную и дистальную переходные зоны 31109 и 31110, соответственно. Переходные зоны 31109 и 31110 находятся в промежутке между центральной зоной 31111 и проксимальной и дистальной кольцеобразными секциями 31106 и 31107. На фиг.33 представлена развернутая проекция на плоскость стента 31100, на которой показаны различные секции и зоны.
Стент 31100 включает множество продольно ориентированных элементов конструкции 31113, соединенных между собой при помощи гибких шарниров 31114, ориентированных по периметру окружности. Прилегающие элементы конструкции 31113, ориентированные по периметру окружности, соединяются на противоположных концах при помощи шарниров 31114, образуя по существу S- или Z-образную синусоидальную структуру, формирующую ленту. Гибкие соединительные элементы 31112 распределены по поверхности стента 31100 для придания структурной стабильности при различных условиях нагружения. Конструкция стента, представленная на фиг.31A, 31B, 31C, 32 и 33, имеет гибкую геометрию соединения, однако предполагается, что допустимы различные варианты геометрии соединения. См. фиг.36B-36H.
Область стента 31100, в которой внутренняя спиралевидная секция 31108 сначала соединяется с кольцеобразными концевыми секциями 31106 и 31107, является опорной точкой, а шарнир 31114, расположенный в этом месте, является «опорным шарниром». Расположение такой «точки разветвлений» может изменяться, исходя из конструктивных ограничений. Кроме того, угол наклона, толщина несущих элементов конструкции, ширина несущих элементов конструкции, ширина шарнирного соединения, длина шарнирного соединения, расположение и размер резервуаров, а также длина соединений может варьировать в зависимости от требований оптимизации и конструктивных ограничений.
В рамках настоящего документа термины «продольно ориентированный», «ориентированный по периметру окружности» и «радиально ориентированный» используются для обозначения определенного направления относительно стента 31100 и продольной оси 31103. Продольно ориентированный элемент направлен от начала до конца (вдоль оси), как правило, в направлении продолговатой оси 31103. Как видно на чертежах, продольно направленный несущий элемент конструкции 31113 проходит практически параллельно продольной оси, когда стент 31100 находится в сжатом состоянии, как показано на фиг.31В и затем, когда стент 31100 находится в развернутом состоянии, как показано на фиг.31A. Независимо от состояния стента несущий элемент конструкции 31113 считается продольно ориентированным, так как ось несущего элемента конструкции 31113 по существу ориентирована в том же направлении, что и продольная ось. Элемент, ориентированный по периметру окружности, такой как шарнир 31114, направлен по существу вдоль окружности стента 31100, имеющего трубчатую конфигурацию. Аналогичным образом, радиальное направление или радиальная ориентация подразумевает направленность вдоль радиуса, обычно исходящего от продольной оси в направлении окружности трубчатого стента 31100 в поперечном сечении.
На фиг.34A, 34B и 34C представлены типичные несущие элементы конструкции 31113, выполненные в соответствии с различными вариантами осуществления настоящего изобретения. Каждый несущий элемент конструкции 31113 представляет собой по существу прямоугольный элемент с продольно проходящими длинными сторонами 31115 и проходящими по периметру окружности короткими сторонами 31116. Противоположные длинные стороны 31115 и короткие стороны 31116 могут быть по существу параллельными друг другу и образовывать практически правильный прямоугольник, как показано на примере элемента конструкции 31113 на фиг.34A, или они могут быть наклонены или проходить под углом по отношению друг к другу и образовывать конусообразный несущий элемент конструкции 31113, как показано на примере элемента конструкции 31113 на фиг.34B. Как показано на фиг.34A и 34B, шарниры 31114 присоединяются к несущему элементу конструкции 31113 вдоль коротких сторон 31116 несущего элемента, при этом ширина несущего элемента конструкции (длина короткой стороны 31116) больше ширины шарнира 31114 в предпочтительно варианте осуществления настоящего изобретения. Как показано на фиг.34B, гибкие соединительные элементы 31112 присоединяются к несущим элементам конструкции 31113 вдоль коротких сторон 31116 несущих элементов 31113, но не соединяются с шарнирами 31114.
На фиг.34C представлен оригинальный несущий элемент конструкции 31113, который используется в некоторых вариантах осуществления конструкции стента 31100. Несущий элемент конструкции 31113, представленный на фиг.34C, характеризуется наличием двух точек соединения с кольцеобразными шарнирами 31114 (как описано дальше) и двух точек соединения с гибкими соединительными элементами 31112. Этот элемент конструкции 31113 расширяется на проксимальном и дистальном концах (в точках соединения с шарнирами 31114 и гибкими соединительными элементами 31112) и сужается до минимальной ширины в области средней точки длины продольного элемента конструкции 31113. Другими словами, длина короткой стороны 31116 элемента конструкции 31113, представленного на фиг.34C, больше ширины в области центра продольной оси элемента конструкции 31113.
Несущие элементы конструкции 31113 могут иметь одно или несколько депо или резервуаров 31117, содержащих по меньшей мере один лечебный агент. Допускается использование любого из описанных в настоящем документе лечебных агентов. Депо 31117 могут иметь любую форму (углубление, канал, отверстие или полость), способную вместить и удерживать лечебное средство, в предпочтительном варианте депо имеют форму отверстий, выполненных в стенте 31100. В предпочтительном варианте сквозные отверстия проходят сквозь несущий элемент конструкции от люминальной к аблюминальной поверхности. Такая предпочтительная конфигурация позволяет осуществлять доставку агента или агентов как в радиальном направлении вовнутрь, так и наружу, вдоль люминальной и аблюминальной сторон стента 31100. Кроме того, депо 31117 могут включать в себя полимерную прослойку, состоящую из одного полимера или включающую один или несколько агентов в растворе или в другой форме. Различные депо 31117 в одном и том же стенте могут быть заполнены одним и тем же или различными агентами, а также могут содержать один или несколько агентов в различных концентрациях. Любое отдельное депо 31117 может иметь наполнение из одного или нескольких агентов, при этом агенты могут быть разделены барьерным слоем. Размещение барьерного слоя в депо 31117 может быть выполнено в различных конфигурациях, в зависимости от необходимости в разделении агентов. В предпочтительном варианте осуществления барьерный слой размещается параллельно люминальной поверхности стента.
Несущие элементы конструкции 31113 могут иметь симметричные депо 31117, как показано на фиг.34A-34C, или могут включать согласованно размещенные депо 31117, как показано на фиг.34D. Конструкция согласованно размещенных депо 31117 позволяет максимально использовать площадь любого несущего элемента конструкции 31113, снижая вероятность напряжения всего элемента вследствие добавления или удаления материала, необходимого для сохранения структурной целостности стента 31100 при его расширении.
Один или несколько терапевтических агентов, как описано выше, могут быть распределены в одном или нескольких депо 31117 по меньшей мере вдоль одного участка люминальной или аблюминальной поверхности стента 31100, или в любой комбинации депо и (или) поверхностей стента. В предпочтительном варианте осуществления агент распределен в депо 31117 таким образом, что открытая площадь поверхности агента ограничивается площадью поперечного сечения отверстия депо в поверхности стента 31100 (люминальной, аблюминальной или обеих поверхностей). Такая конструкция позволяет осуществить доставку агента из стента 31100, вводимого в организм пациента и имеющего по существу металлическую поверхность. В предпочтительном варианте оголенная металлическая поверхность стента 31100 находится в пределах от 40% до 95% после введения стента 31100 в организм пациента, более предпочтительно - приблизительно 75% после введения стента 31100 в организм пациента. То есть площадь поверхности стента 31100 приблизительно на 25% занята агентом и приблизительно на 75% представлена оголенным металлом. По мере высвобождения агента остается оголенная металлическая поверхность стента 31100, как подробно описано ниже.
В предпочтительном варианте депо 31117 распределены практически равномерно в структуре несущих элементов конструкции, обеспечивая, таким образом, равномерную дозировку агента на единицу площади поверхности развернутого стента 31100, независимо от диаметра или длины используемого стента. Несущие элементы конструкции 31113 могут иметь различную длину, угол наклона, конфигурацию депо и ширину, в зависимости от конструкции конечного продукта.
Гибкие шарниры 31114 используются в качестве соединительных элементов между соседними элементами конструкции 31113, ориентированными по периметру окружности. В стенте 31100 используются гибкие шарниры 31114 двух типов. На фиг.35A и 35B представлены два типа гибких шарниров, использованных в одном из вариантов осуществления настоящего изобретения. На фиг.35A представлен отдельный «независимый шарнир» 31114a, соединяющий два соседних элемента конструкции 31113, ориентированных по периметру окружности. В предпочтительном варианте этот независимый шарнир 31114a имеет С-образную форму и по существу симметричен относительно средней линии А, проходящей через верхушку изогнутой части. На фиг.35B представлен независимый шарнир 31114b, соединяющий два соседних элемента конструкции 31113, ориентированных по периметру окружности, где один из элементов конструкции также присоединяется к гибкому соединительному элементу 31112. Этот гибкий шарнир 31114b имеет больший изгиб, чем С-образный независимый шарнир 31114a, показанный на фиг.35A, и поэтому иногда в тексте упоминается как «круглый шарнир» 31114b. Хотя независимые шарниры 31114a и соединительные шарниры 31114b здесь определяются отдельно, иногда они обозначаются совместно как гибкие шарниры 31114. Области, окружающие круглые шарниры 31114b именуются в дальнейшем областями круглых шарниров. Хотя гибкий соединительный элемент 31112 и круглый гибкий шарнир 31114b присоединяются к одной и той же короткой стороне 31116 несущего элемента конструкции 31113 в области круглого шарнира, они не соединяются между собой.
На фиг.36A подробно показана «область круглого шарнира» 31118, которая является точкой соединения между двумя парами несущих элементов конструкции на соседних витках спиралевидной секции 31108. Эта область шарнирного соединения 31118 включает в себя несколько компонентов и образует гибкую область между соседними элементами конструкции 31113, ориентированными по периметру конструкции, которые образуют пару элементов конструкции, обеспечивая необходимое соединение между парой соседних продольных элементов конструкции при помощи гибкого соединительного элемента 31112. В совокупности пары соседних продольных элементов конструкции и связующий гибкий соединительный элемент 31112 образуют области, называемые «четырехугольные шарнирные области». Эти области включают четыре несущих элемента конструкции, напрямую или опосредованно соединенные при помощи круглых шарниров 31114b и гибких соединительных элементов 31112. Угол наклона, ширина шарнира 31114b, степень сужения, длина и рисунок размещения отверстий могут изменяться в зависимости от требуемой конструкции стента и с целью оптимизации эксплуатационных характеристик стента. На фиг.36B-36M представлены различные соединительные элементы 31112, которые могут быть использованы для соединения соседних пар несущих элементов конструкции в области круглого шарнира 31118.
На фиг.37 представлен другой ключевой элемент стента, требующий внимания в процессе производства стента 31100. Гибкий шарнир 31114, обведенный на чертеже, называется «индексный шарнир». Для этого «индексного шарнира» характерны элементы конструкции 31113 увеличенной длины, которая позволяет гибкому шарниру или верхушке несущего элемента конструкции 31113 выступать за пределы плоскости верхушек остальных несущих элементов конструкции 31113, образующих синусоидальное замыкающее кольцо. В иллюстративных целях линия отсчета A проведена перпендикулярно продольной оси 31103 и по касательной к изогнутым поверхностям обоих шарниров 31114, расположенными выше и ниже индексного шарнира. Линия отсчета B проходит перпендикулярно продольной оси 31103 и по касательной к изогнутой поверхности шарнира 31114, представляющего индексный шарнир. Расстояние между линиями отсчета A и B, проходящими вдоль продольной оси, определяется расстоянием смещения, образующимся благодаря индексу. Это смещение служит точкой отсчета, помогающей определить направление стента 31100. «Индексный шарнир» может быть размещен в любой точке вдоль проксимальной и дистальной кольцеобразных концевых секций 31106 и 31107.
Как правило, гибкие шарниры 31114 являются деформируемыми элементами, которые по существу имеют меньшую ширину, в отличие от окружающих его несущих элементов конструкции 31113. Это позволяет гибким шарнирам 31114 выдерживать пластическую деформацию и сохранять гибкость в деформированном состоянии. Несущие элементы конструкции 31113 являются значительно более жесткими, чем гибкие шарниры 31114. Таким образом, они не подвергаются какой-либо пластической деформации в процессе расширения стента. Несущие элементы конструкции 31113, являясь по существу жесткими деталями, вращаются, в то время как гибкие шарниры 31114 сконструированы таким образом, что способны выдерживать пластическую деформацию, связанную с расширением стента. Благодаря этому депо 31117, размещенные в несущих элементах конструкции 31113, защищены от воздействия чрезмерного давления, сопровождающего расширение стента, которое может нарушить или вытеснить агенты и (или) полимерные вкладки. В идеале депо 31117 не должны подвергаться воздействию давления в ходе установки стента.
В предпочтительном варианте осуществления настоящего изобретения гибкие шарниры 31114 оптимизированы за счет постепенного уменьшения ширины. Таким образом, они придают достаточную радиальную жесткость стенту 31100, одновременно гарантируя, что наибольшая пластическая деформация при полном расширении не превышает предельную резистентность материала к деформации. Уменьшение ширины оптимизировано для каждого типа шарниров 31114 с целью достижения плавного и равномерного распределения пластической деформации по длине гибкого шарнира 31114. Сглаживание распределения деформации, и, следовательно, исключение вероятности накопления деформации в гибких шарнирах 31114 позволяет максимально увеличить ширину, а вместе с тем и жесткость. Достижение максимальной жесткости гибкого шарнира 31114 имеет преимущество в том, что оно увеличивает радиальную жесткость и износоустойчивость стента 31100.
Как правило, ширина суженного гибкого шарнира 31114 постепенно увеличивается в направлении основания шарнира 31114, где шарнир 31114 резко переходит в более широкий несущий элемент конструкции 31113 (или в более жесткую структуру). Это препятствует накоплению пластической деформации в основаниях шарниров, так как суженное основание шарнира является более жестким и, следовательно, передает пластическую деформацию к центральной части шарнира 31114. Центральная часть гибкого шарнира 31114, которая охватывает верхушку изгиба, обычно имеет одинаковую ширину.
Возвращаясь к фиг.32 и 33, необходимо отметить, что кольцеобразные концевые секции 31106 и 31107 включают в себя множество расположенных по периметру окружности продольно ориентированных несущих элементов конструкции 31113, соединенных на противоположных концах при помощи множества ориентированных по периметру окружности гибких шарниров 31114, вместе образующих по существу синусоидальный S-образный или Z-образный рисунок, с тем чтобы сформировать из получившейся ленты бесконечное кольцо. В представленном варианте осуществления концевые секции 31106 и 31107 образованы несущими элементами конструкции 31113 различной длины, что необходимо для оптимизации конструкции стента и обеспечения требуемой геометрии соединений в опорной точке, где внутренняя спиралевидная секция 31108 изначально соединяется с кольцеобразными концевыми секциями 31106 и 31107.
Между кольцеобразными концевыми секциями 31106 и 31107 лежит внутренняя спиралевидная секция 31108 стента 31100, где лента синусоидально расположенных несущих элементов конструкции 31113 и шарниров 31114 следует по извитой траектории. Спиралевидная форма внутренней секции 31108 может обеспечиваться расположением элементов конструкции 31113 в повторяющемся порядке, образованном перемежающимися короткими и длинными участками. Спиралевидная внутренняя секция 31108 далее может разделяться на проксимальную и дистальную переходные зоны 31109 и 31110, соответственно, и центральную зону 31111.
Центральная зона 31111 состоит из цепочек (множеств), образованных группами перемежающихся несущих элементов конструкции 31113 и шарнирных элементов 31114, организованных в соответствующий рисунок. В одном из вариантов осуществления перемежающиеся цепочки имеют различные рисунки, а повторяющиеся цепочки расположены геометрически симметрично и образуют повторяющийся центральный рисунок. В предпочтительном варианте повторяющийся центральный рисунок состоит из двух различных повторяющихся цепочек. Таким образом, центральная зона 31111 имеет постоянный шаг и угол наклона.
В рамках настоящего документа термин «шаг» обозначает количество синусоидальных циклов на заданной площади. Значение аналогично значению термина «диаметральный шаг шестерни». Чем больше шаг, тем больше количество синусоидальных циклов, т.е. тем больше количество несущих элементов конструкции 31113 и гибких шарниров 31114 приходится на один виток синусоидальной ленты, расположенной вокруг продольной оси 31103. Благодаря этому образуется очень плотный рисунок из несущих элементов конструкции 31113 и шарниров 31114. И наоборот, чем меньше шаг, тем меньше количество синусоидальных циклов и, следовательно, тем меньше количество несущих элементов конструкции 31113 и гибких шарниров 31114 приходится на один виток синусоидальной ленты, расположенной вокруг продольной оси 31103. Термин «угол наклона» относится, в частности, к спиралевидной секции стента 31100 и служит для обозначения угла, под которым синусоидальная лента (виток) проходит к продольной оси.
На фиг.38 показаны вблизи двухмерные изображения центральной зоны 31111, представленной на фиг.33. Первая линия отсчета А проведена параллельно продольной оси 31103. Вторая линия отсчета В проведена для указания направления синусоидальной ленты. Угол наклона (α) - угол между линией отсчета A и линией отсчета B.
На фиг.39A и 39B представлены две цепочки несущих элементов конструкции, которые являются частью повторяющегося рисунка, составляющего центральную зону 31111 стента 31100, выполненного в соответствии с одним из вариантов осуществления настоящего изобретения. Как показано на фиг.33, 38, 39A и 39B, центральная зона 31111 начинается на проксимальном конце дистальной переходной зоны 31110 с независимой цепочки несущих элементов конструкции 31119, показанной на фиг.39B. Показанная независимая цепочка несущих элементов конструкции 31119 включает длинный несущий элемент конструкции с тремя депо 31113, каждый конец которого присоединен к короткому несущему элементу конструкции с двумя депо 31113 с помощью независимого шарнира 31114a. Независимая цепочка несущих элементов конструкции 31119 проксимальным концом присоединяется к дистальному концу соединительной цепочки несущих элементов конструкции 31120. Соединительная цепочка несущих элементов конструкции 31120 включает соединительный шарнир 31114b, расположенный на ее проксимальном и дистальном концах, и расположенные в шахматном порядке три длинных несущих элемента конструкции (с тремя депо) 31113 и два коротких несущих элемента конструкции (с двумя депо) 31113, соединенные посредством независимых шарниров 31114a. Этот рисунок чередующихся независимых цепочек несущих элементов конструкции 31119 и соединительных цепочек несущих элементов конструкции 31120 повторяется до перехода центральной зоны 31111 в проксимальную переходную зону 31109. Центральная зона варианта осуществления, представленного на фиг.33, включает в себя пять независимых цепочек несущих элементов конструкции 31119 и четыре соединительные цепочки несущих элементов конструкции 31120. Длина стента 31100 может быть изменена путем увеличения или сокращения центральной зоны 31111, а именно, путем добавления или удаления независимых цепочек несущих элементов конструкции 31119 или соединительных цепочек несущих элементов конструкции 31220 по мере необходимости, сохраняя повторяющийся рисунок, при этом проксимальная и дистальная переходные зоны 31109 и 31110, а также проксимальная и дистальная кольцеобразные концевые секции 31106 и 31107, как описано, остаются без изменений.
Проксимальная и дистальная переходные зоны 31109 и 31110 представляют собой секции с переменным шагом, для которых не характерна повторяемость и симметрия рисунка. Проксимальная и дистальная переходные зоны 31109 и 31110 выполнены таким образом, чтобы обеспечить постепенное уменьшение шага в переходе между центральной зоной 31111 и проксимальной и дистальной кольцеобразными концевыми секциями 31105 и 31107. Проксимальная и дистальная переходные зоны 31109 и 31110 присоединяются к проксимальной и дистальной кольцеобразным концевым секциям 31106 и 31107, соответственно, при помощи соединительных геометрических элементов, именуемых «опорными шарнирами».
Конструкции стентов 31100, представленные на указанных выше чертежах, относятся к конструкциям с открытыми ячейками. Это означает, что соединительные элементы между продольными соседними витками синусоидальных элементов присутствуют только периодически и разнесены по всей структуре, а не охватывают каждый продольный смежный шарнир 31114 или несущий элемент конструкции 31113. Конструкция, в которой соединяется каждый продольный смежный шарнир или несущий элемент конструкции, относится к конструкциям с закрытыми ячейками. Конструкция с открытыми ячейками, как правило, является более гибкой, в отличие от конструкции с закрытыми ячейками.
Как было указано выше, общая конструкция стента 31100 включает спиралевидную внутреннюю секцию 31108 с кольцеобразными концевыми секциями 31106 и 31107 на каждом конце, и соединительные элементы 31112, распределенные по конструкции для придания структурной стабильности при различных условиях нагрузки. В рамках спиралевидной внутренней секции 31108 дополнительно выделяется центральная зона 31111, имеющая постоянный шаг и угол наклона, и проксимальная и дистальная переходные зоны 31109 и 31110, соответственно. Такая конструкция остается неизменной для различных стентов разных размеров, однако геометрия и рисунок размещения элементов (несущих элементов конструкции, шарниров и гибких соединений) может изменяться, исходя из необходимости адаптации к конкретным диаметрам стентов.
На фиг.40-45 представлены различные варианты осуществления для стентов с различными диаметрами. На фиг.40, 42 и 44 представлены двухмерные проекции на плоскость, аналогичные фиг.32, на которых показаны стенты 40200, 42300 и 44000, соответственно, имеющие различные диаметры и рисунки. На фиг.41, 43 и 45 представлены проекции на плоскость с пространственным разделением деталей, аналогичные фиг.33, стентов 40200, 42300, 44400, соответственно, на которых показаны различные секции и зоны. Для простоты иллюстрации подобные цифровые обозначения соотнесены с подобными элементами стента 31100. Также подразумевается, что описание элементов в отношении стента 31100 аналогичным образом применимо к подобным элементам стентов 40200, 42300 и 44400.
Каждый образец рисунка стента адаптирован для достижения конечного оптимального результата, в основе которого лежит лечение сосудов, для чего и требуется установка стента. На фиг.40 и 41 представлен один из вариантов осуществления стента 40200, предназначенного для ликвидации патологических изменений сосудов со сверхмалым диаметром. Линейка стентов со сверхмалым диаметром, благодаря конструктивным особенностям, оптимизировано для сосудов со сверхмалыми диаметрами и изготавливается из трубок малого диаметра.
Настоящий пример осуществления сверхмалого стента включает синусоидальные проксимальную и дистальную кольцеобразные концевые секции 40206 и 40207, при этом каждая кольцеобразная концевая секция 40206 и 40207 состоит из десяти несущих элементов конструкции 40213. Между кольцеобразными концевыми секциями 40206 и 40207 расположена внутренняя спиралевидная секция 40208 стента 40200, при этом синусоидальное расположение несущих элементов конструкции 40213 и шарниров 40214 следует извитой траектории. Извитая траектория внутренней секции 40208 осуществляется путем расположения элементов конструкции 40213 в повторяющемся порядке, образованном перемежающимися короткими и длинными участками, образующими ленту. В каждой внутренней ленте содержится девять несущих элементов конструкции 40213 на виток. Меньшее количество несущих элементов конструкции позволяет повысить эффективность работы стента, сохраняя при этом основные рабочие характеристики. Спиралевидная внутренняя секция 40208 дополнительно может подразделяться на проксимальную и дистальную переходные зоны 40209 и 40210, соответственно, и центральную зону 40211, как показано на фиг.41.
Центральная зона 40211 включает повторяющиеся цепочки несущих элементов конструкции или множества несущих элементов конструкции, расположенных геометрически симметрично и образующих повторяющийся рисунок в ленте. Таким образом, центральная зона 40211 имеет постоянный шаг и угол наклона. Повторяющийся внутренний рисунок состоит из двух образуемых тремя несущими элементами конструкции рисунков, которые, чередуясь, образуют повторяющийся внутренний рисунок из девяти несущих элементов конструкции.
На фиг.48 представлены две цепочки несущих элементов конструкции 40219 и 40220, которые являются частью повторяющегося рисунка центральной зоны 40211 стента 40200, выполненного в соответствии с одним из вариантов осуществления настоящего изобретения. Как показано на фиг.40, 41 и 48, центральная зона 40211 начинается на дистальном конце проксимальной переходной зоны 40209 с независимой цепочки несущих элементов конструкции 40219, показанной на фиг.48. Показанная независимая цепочка несущих элементов конструкции 40219 включает длинный несущий элемент конструкции (четыре депо) 40213, каждый конец которого присоединен к короткому несущему элементу конструкции (два депо) 40213 с помощью независимого шарнира 40214a. Независимая цепочка несущих элементов конструкции 40219 дистальным концом присоединяется к проксимальному концу соединительной цепочки несущих элементов конструкции 40220. Соединительная цепочка несущих элементов конструкции 40220 включает соединительный шарнир 40214b, расположенный на ее проксимальном и дистальном концах, и расположенные в шахматном порядке два длинных несущих элемента конструкции (четыре депо) 40213 и один короткий несущий элемент конструкции (два депо) 40213, соединенные посредством независимых шарниров 40214a. Такой рисунок чередующихся независимых цепочек несущих элементов конструкции 40219 и соединительных цепочек несущих элементов конструкции 40220 повторяется до перехода центральной зоны 40211 в дистальную переходную зону 40210. Центральная зона варианта осуществления, представленного на фиг.40 и 41, включает шесть независимых цепочек несущих элементов конструкции 40219 и шесть соединительных цепочек несущих элементов конструкции 40220.
Настоящий пример осуществления стента среднего размера включает синусоидальные проксимальную и дистальную кольцеобразные концевые секции 42306 и 42307, включающие концевые кольца из двенадцати несущих элементов конструкции 42313. Между кольцеобразными концевыми секциями 42306 и 42307 расположена внутренняя спиралевидная секция 42308 стента 42300, в которой синусоидальное расположение несущих элементов конструкции 42313 и шарниров 42314 в ленте следует извитой траектории. Извитая траектория внутренней секции 42308 осуществляется расположением элементов конструкции 42313 в повторяющемся порядке, образованном перемежающимися короткими и длинными участками, образующими ленту. В каждой внутренней спиралевидной секции 42308 расположено по тринадцать несущих элементов конструкции 42313 на виток. Увеличенное количество несущих элементов конструкции позволяет повысить эффективность стента, сохраняя при этом основные рабочие характеристики. Спиралевидная внутренняя секция 42308 дополнительно может подразделяться на проксимальную и дистальную переходные зоны 42309 и 42310, соответственно, и центральную зону 42311, как показано на фиг.43.
Центральная зона 42311 включает повторяющиеся цепочки несущих элементов конструкции или множества несущих элементов конструкции, расположенных геометрически симметрично и образующих повторяющийся рисунок в ленте. Таким образом, центральная зона 42311 имеет постоянный шаг и угол наклона. Повторяющийся внутренний рисунок состоит из одного образуемого тремя несущими элементами конструкции рисунка и одного образуемого пятью несущими элементами конструкции рисунка, которые, чередуясь, образуют повторяющийся внутренний рисунок из тринадцати несущих элементов конструкции.
На фиг.47 представлены две цепочки несущих элементов конструкции 42319 и 42320, которые являются частью повторяющегося рисунка центральной зоны 42311 стента 42300, выполненного в соответствии с одним из вариантов осуществления настоящего изобретения. Как показано на фиг.42, 43 и 47, центральная зона 42311 начинается на дистальном конце проксимальной переходной зоны с соединительной цепочки несущих элементов конструкции 42320, показанной на фиг.47. Показанная соединительная цепочка несущих элементов конструкции 42320 включает соединительный шарнир 42314b на проксимальном и дистальном концах и структуру из трех длинных несущих элементов конструкции (с тремя депо) 42313, соединенных независимыми шарнирами 42314a. Независимая цепочка несущих элементов конструкции 42319 проксимальным концом присоединяется к дистальному концу соединительной цепочки несущих элементов конструкции 42320. Показанная независимая цепочка несущих элементов конструкции 42319 включает серию из трех длинных несущих элементов конструкции (три депо) 42313, соединенных друг с другом с помощью независимых шарниров 42314a. Каждый конец трех несущих элементов конструкции с тремя депо 42313 соединяется с коротким несущим элементом конструкции с двумя депо 42313 с помощью независимых шарниров 42314a. Этот рисунок чередующихся соединительных цепочек несущих элементов конструкции 42320 и независимых цепочек несущих элементов конструкции 42319 повторяется до перехода центральной зоны 42311 в дистальную переходную зону 42310. Центральная зона варианта осуществления, представленного на фиг.42 и 43, включает три соединительных цепочки несущих элементов конструкции 42320 и две независимые цепочки несущих элементов конструкции 42319. Длина стента 42300 может быть изменена путем увеличения или сокращения центральной зоны 42311, а именно, путем добавления или удаления соединительных цепочек несущих элементов конструкции 42320 или независимых цепочек несущих элементов конструкции 42319 по мере необходимости, сохраняя повторяющийся рисунок. При этом проксимальная и дистальная переходные зоны 42309 и 42310, а также проксимальная и дистальная кольцеобразные концевые секции 42306 и 42307, как указано, остаются без изменений.
На фиг.44 и 45 представлен один из вариантов осуществления стента 44400, предназначенного для коррекции патологических состояний сосудов большого диаметра. Семейство стентов с большим диаметром, благодаря конструктивным особенностям, оптимизировано для сосудов большего размера. По аналогии с предыдущими конструкциями, настоящий пример осуществления включает синусоидальные проксимальную и дистальную кольцеобразные концевые секции 44406 и 44407, состоящие из двенадцати несущих элементов конструкции 44413. Несущие элементы конструкции 44413 в концевых секциях 44406 и 44407 имеют различную длину, Однако, как правило, в конструкциях стентов с большим диаметром они длиннее, чем обычные несущие элементы конструкции эквивалентных конструкций стентов меньшего размера. Концевые секции 44406 и 44407 в нескольких точках соединяются с проксимальной и дистальной переходными зонами 44409 и 44410, как показано на фиг.45.
На фиг.46 представлены две цепочки несущих элементов конструкции, которые являются частью повторяющегося рисунка центральной зоны 44411 стента 44400, выполненного в соответствии с одним из вариантов осуществления настоящего изобретения. Как показано на фиг.44, 45 и 46, центральная зона 44411 начинается на проксимальном конце дистальной переходной зоны 44410 с независимой цепочки несущих элементов конструкции 44419, показанной на фиг.46. Показанная независимая цепочка несущих элементов конструкции 44419 включает чередующуюся структуру, состоящую из коротких (три депо) несущих элементов конструкции 44413 и длинных (четыре депо) несущих элементов конструкции, соединенных между собой независимыми шарнирами 44414a. Независимая цепочка несущих элементов конструкции 44419 проксимальным концом присоединяется к дистальному концу соединительной цепочки несущих элементов конструкции 44420. Соединительная цепочка несущих элементов конструкции 44420 состоит из трех несущих элементов конструкции 44413 и включает соединительные шарниры 44414b, расположенные на ее проксимальном и дистальном концах. Три несущих элемента конструкции в соединительной цепочке 44420 включают чередующуюся структуру, состоящую из длинных (четыре депо) несущих элементов конструкции 44413 и коротких (три депо) несущих элементов конструкции 44413, соединенных между собой независимыми шарнирами 44414a. Такой рисунок чередующихся независимых цепочек несущих элементов конструкции 44419 и соединительных цепочек несущих элементов конструкции 44420 повторяется до перехода центральной зоны 44411 в проксимальную переходную зону 44409. Центральная зона варианта осуществления, представленного на фиг.45, включает три независимые цепочки несущих элементов конструкции 44419 и две соединительных цепочки несущих элементов конструкции 44420.
Настоящее изобретение также предполагает использование цельных элементов конструкции, расположенных аналогично несущим элементам конструкции (шарнирам), представленным на фиг.32, 40, 42 и 44. На фиг.49 представлен стент 49500, имеющий аналогичную конструкцию без депо на несущих элементах конструкции 49513. Стент 49500 может использоваться без покрытия, а также может быть частично или полностью покрыт агентом и (или) подходящим носителем в соответствии с практикой в данной области техники.
Стенты с резервуарами, выделяющими лекарственные препараты, по ряду параметров превосходят стенты с обычным покрытием, выделяющие лекарственные препараты. Например, резервуары защищают полимер и лекарственный матрикс или композицию, размещенные внутри, от механических повреждений в процессе прохождения стента по извитым анатомическим структурам и сильно обызвествленным участкам, которые могут деформировать стенты с обычным покрытием. Резервуары способны вместить большую дозу лекарственного препарата и обеспечить большее количество лекарственного препарата по отношению к полимеру, так как полимеры в резервуаре не подвержены удлинению и деформации, связанными с нанесением полимерного покрытия на поверхность. Для наполнения резервуаров требуется меньшая масса полимера, чем для нанесения традиционного покрытия, благодаря этому толщина несущего элемента конструкции может сократиться на 10-30 микрон. Резервуары облегчают доставку из стента нескольких лекарственных препаратов и (или) терапевтических агентов с независимыми профилями высвобождения, а также позволяют осуществлять обработку металлических поверхностей стента, не оказывая влияния на содержащиеся в резервуарах лекарственные препараты и полимеры. Кроме того, резервуары обеспечивают большую гибкость и вариабельность в отношении выборочной направленной доставки и позиционной и (или) направленной локализованной доставки. Помимо этого, наличие резервуаров обеспечивает лучшую биосовместимость стента и сосуда, так как при имплантации стенка сосуда контактирует с поверхностью стента, выполненной по существу из оголенного металла и практически не содержащей полимеров. Это актуально в случае если при заполнении резервуаров композиция размещается в форме луночки или имеющиеся резервуары используются не в полном объеме, как подробно указано ниже.
Стенты из оголенного металла обладают преимуществами, как указано выше. Стенты с резервуарами, выделяющими лекарственные препараты, составляющие предмет настоящего изобретения, объединяют в себе лучшие характеристики, присущие стентам из оголенного метала и стентам, выделяющим лекарственные препараты. В примерах осуществления, описанных в настоящем документе, у стентов с резервуарами, выделяющими лекарственные препараты, внешняя или аблюминальная поверхности приблизительно на 75% состоят из оголенного металла и 25% из полимера и лекарственного препарата. Если при заполнении резервуаров используется не весь объем и они заполнены таким образом, что слои или вкладки начинаются от люминальной стороны, как указано выше, то участок поверхности, относящийся к аблюминальной стороне, стентов с резервуарами, выделяющими лекарственные препараты, на 75% представлен оголенным металлом, а остальные 25% поверхности образованы открытыми резервуарами. Иными словами, общая площадь внешней поверхности стента приблизительно на 25% состоит из площади резервуаров, оставшиеся 75% площади поверхности составляют несущие элементы конструкции и шарниры. Такое процентное соотношение является исходным значением. Иными словами, во время имплантации стента 75% площади поверхности стента, контактирующей со стенкой сосуда, выполнено из оголенного металла, а 25% площади поверхности стента образовано резервуарами, по меньшей мере частично заполненными полимером и лекарственным препаратом, как подробно указано ниже. Однако ввиду того, что сополимер молочной и гликолевой кислот (PLGA) подвержен биологическому разложению путем гидролиза его сложных эфирных связей, приблизительно через девяносто дней в резервуарах стента не остается полимера и (или) лекарственного препарата. Следовательно, через девяносто дней поверхность стента на 100% представлена оголенным металлом, так как резервуары полностью освобождаются от содержавшихся в них лекарственного препарата и полимера. Более конкретно, вся площадь поверхности стента, соприкасающаяся с сосудом, состоит из оголенного металла, и в резервуарах не остается полимера и (или) полимера и лекарственного препарата. Таким образом, благодаря доставленному лекарственному препарату удается ликвидировать рестеноз, а стент из оголенного металла остается и функционирует в качестве поддерживающей конструкции, препятствующей сужению просвета сосуда. Такая конструкция стента из оголенного металла позволяет получить положительный эффект, а именно, снижение потенциального риска развития тромбоза и (или) эмболии и противорестенозное действие в результате локальной доставки лекарственного препарата.
Как было указано выше, каждый вариант осуществления стента включает множество резервуаров, заполненных или по меньшей мере частично заполненных смесью, состоящей из сиролимуса (рапамицина), полимера (PLGA) и антиоксиданта (BHT). Каждый конкретный резервуар по существу содержит одно и то же количество смеси. Для обеспечения необходимой дозировки сиролимуса и достижения необходимой скорости элюирования или профиля кинетики высвобождения сиролимуса из стента, помещенного в артерию пациента, в резервуарах стента необходимо депонировать сиролимус, PLGA и BHT («композиция») в конкретном соотношении по количеству веса. Дозировки и кинетика высвобождения приведены выше. Необходимо, чтобы доступный общий объем всех резервуаров в стенте, а при расширении - доступный объем каждого отдельного резервуара в стенте, был равен или больше общего объема, необходимого для размещения композиции, которая обеспечит пациенту желаемый терапевтический эффект. Фактически, если требуемое количество композиции, которое равным образом может быть выражено в виде объема композиции, меньше общего доступного объема, то меньшее количество резервуаров стента будет заполнено требуемым количеством композиции. Фактически, в примере, выполненном в соответствии с принципами настоящего изобретения, для эффективного наполнения стента необходим объем меньше общего доступного объема. В предпочтительном варианте процентная доля общего доступного объема резервуаров, занятого композицией, составит от 40% до 70% от общего доступного объема, а в более предпочтительном варианте - от 50% до 61% от общего доступного объема. В таблице 8.0, представленной ниже, приведены данные для теоретического расчета максимального и минимального объемов процентного заполнения резервуаров. Так как резервуары заполняются с люминальной или проксимальной стороны несущего элемента конструкции стента, и композиция занимает места намного меньше, чем 100% от общего доступного объема, верхняя часть содержимого резервуара будет ниже аблюминальной или дистальной поверхности стента и, следовательно, содержимое резервуара с этой стороны поверхности образует лунку. Таким образом, даже если 75% площади аблюминальной поверхности представлено оголенным металлом, а 25% площади занимают резервуары, уровень полимера и (или) комбинации полимера и лекарственного препарата находится ниже поверхности. Это является дополнительным преимуществом, так как слои или вкладки полимера и лекарственного препарата защищены в процессе заполнения и размещения стента.
Также в таблице 8.0 содержатся данные по стенту, в котором заполнены не все резервуары, как указано выше, а каждый второй резервуар. В данном варианте осуществления для получения аналогичной общей дозировки объем, занимаемый композицией, в резервуарах, заполненных полностью или частично, составляет от 76% до 88%.
В таблице 9.0 и 10.0 ниже приведены отношения металлической поверхности готового устройства к поверхности сосуда, выраженные в процентах. Данные приведены для стентов с композицией полимер/лекарственный препарат и без композиции полимер/лекарственный препарат соответственно. Таким образом, площадь поверхности устройства, занимаемая полимером (композицией полимера и лекарственного препарата), составляет от приблизительно 4,1% до приблизительно 5,0% площади поверхности стентированного сосуда, тогда как отношение чисто металлической наружной поверхности стента к поверхности сосуда варьирует в пределах от 13,3% до 17,8%.
Несмотря на то, что представленные и описанные в настоящем документе варианты осуществления считаются наиболее практичными и предпочтительными, очевидно, что специалистам в данной области предоставляются возможности для отступления от установленного исполнения и способов, показанных и описанных в настоящем документе, которые могут найти практическое применение, не выходя за рамки формулы изобретения и не нарушая его сущности. Настоящее изобретение не ограничивается конкретными конструкциями, описанными и показанными в настоящем документе, однако все конструкции изобретения должны согласовываться с любыми модификациями, которые могут подпадать под формулу настоящего изобретения.
Реферат
Группа изобретений относится к области медицины, а именно к местному применению терапевтических средств и (или) комбинации терапевтических средств для профилактики и лечения сосудистых заболеваний, а более конкретно к внутрипросветным медицинским устройствам для локальной доставки терапевтических средств и (или) комбинаций терапевтических средств. Стент из оголенного металла с резервуарами, выделяющими лекарственные препараты, предназначенный для имплантации в трубчатый орган живого организма, включает продолговатую трубчатую конструкцию, по меньшей мере один основной слой композиции и по меньшей мере один покрывной слой композиции. Продолговатая трубчатая конструкция имеет люминальную поверхность и аблюминальную поверхность и включает множество взаимосвязанных элементов. Сегмент взаимосвязанных элементов включает по меньшей мере один резервуар, который открывается в люминальную поверхность и аблюминальную поверхность. В состав по меньшей мере одного основного слоя композиции входит полимер, депонированный в по меньшей мере одном резервуаре, приближенном к люминальной поверхности, и ниже аблюминальной поверхности продолговатой трубчатой конструкции. В состав по меньшей мере одного покрывного слоя композиции входит терапевтический агент, депонированный в резервуаре поверх основного слоя композиции и ниже аблюминальной поверхности продолговатой трубчатой конструкции. После имплантации приблизительно 75% аблюминальной поверхности представлено оголенным металлом и приблизительно 25% аблюминальной поверхности занято резервуарами, по меньшей мере частично заполненными указанным по меньш
Формула
продолговатую трубчатую конструкцию, имеющую люминальную поверхность и аблюминальную поверхность и включающую множество взаимосвязанных элементов, при этом сегмент взаимосвязанных элементов включает по меньшей мере один резервуар, который открывается в люминальную поверхность и аблюминальную поверхность;
по меньшей мере один основной слой композиции, в состав которого входит полимер, депонированный в указанном по меньшей мере одном резервуаре, приближенном к люминальной поверхности, и ниже аблюминальной поверхности продолговатой трубчатой конструкции; и
по меньшей мере один покрывной слой композиции, в состав которого входит терапевтический агент, депонированный в резервуаре поверх основного слоя композиции и ниже аблюминальной поверхности продолговатой трубчатой конструкции, при этом после имплантации приблизительно 75% аблюминальной поверхности представлено оголенным металлом и приблизительно 25% аблюминальной поверхности занято резервуарами, по меньшей мере частично заполненными указанным по меньшей мере одним основным слоем композиции и указанным по меньшей мере одним покрывным слоем композиции, при этом приблизительно через девяносто дней после имплантации по меньшей мере один основной слой композиции и по меньшей мере один покрывной слой композиции полностью исчезают, при этом верхняя поверхность слоя резервуара расположена ниже аблюминальной поверхности стента.
продолговатую трубчатую конструкцию, имеющую люминальную поверхность и аблюминальную поверхность и включающую множество взаимосвязанных элементов, при этом сегмент взаимосвязанных элементов включает по меньшей мере один резервуар, который открывается в люминальную поверхность и аблюминальную поверхность;
по меньшей мере один основной слой композиции, в состав которого входит сополимер молочной и гликолевой кислот (PLGA), депонированный в указанном по меньшей мере одном резервуаре, приближенном к люминальной поверхности, и ниже аблюминальной поверхности продолговатой трубчатой конструкции; и
по меньшей мере один покрывной слой композиции, в состав которого входят сополимер молочной и гликолевой кислот (PLGA), рапамицин и бутилокситолуол (ВНТ), депонированный в резервуаре поверх основного слоя композиции и ниже аблюминальной поверхности вытянутой трубчатой конструкции, при этом после имплантации приблизительно 75% аблюминальной поверхности представлено оголенным металлом и приблизительно 25% аблюминальной поверхности занято резервуарами, по меньшей мере частично заполненными указанным по меньшей мере одним основным слоем композиции и указанным по меньшей мере одним покрывным слоем композиции, при этом приблизительно через девяносто дней после имплантации по меньшей мере один основной слой композиции и по меньшей мере один покрывной слой композиции полностью исчезают, при этом верхняя поверхность слоя резервуара расположена ниже аблюминальной поверхности стента.
Документы, цитированные в отчёте о поиске
Расширяемый стент со сдвижными и фиксирующими радиальными элементами

Комментарии