Радиофармацевтическая композиция и способы ее получения - RU2095085C1
Код документа: RU2095085C1
Чертежи


Описание
Изобретение относится к рецептурам радиофармацевтических препаратов, методу их введения и способу получения. Радиофармацевтические рецептуры имеют различные применения при терапевтическом и/или диагностическом лечении животных при различных заболеваниях, особенно при раке.
Развитие костного метастаза является обычным и часто катастрофическим явлением для пациентов, больных раком. Боль, патологические переломы, частые неврологические расстройства и вынужденная неподвижность, вызываемые этими метастатическими костными поражениями, значительно усугубляют состояние больного раком. Число пациентов, страдающих от метастазирующей опухоли, велико, поскольку у приблизительно 50% всех больных, пораженных раком груди, легкого или простаты, в конечном итоге будет развиваться костный метастаз. Костный метастаз также наблюдается у пациентов, страдающих раком почек, щитовидной железы, мочевого пузыря, шейки матки и другими опухолями, но собранные вместе они представляют менее 20% больных, у которых развивается костный метастаз. Метастатический костный рак редко угрожает жизни, и пациенты иногда живут годы после обнаружения у них костных повреждений. В начальной стадии лечение нацелено на снижение боли, уменьшая таким образом использование наркотиков и повышая способность передвигаться. Существует, несомненно, надежда, что некоторые виды рака могут быть излечены.
Радиофармацевтические препараты, используемые в рецептурах по настоящему изобретению, получали в виде комплексов с металлами, в частности в виде соединения: самарий -153-этилендиаминтетраметилфосфоновой кислоты /153Sm EDTMP/, как описано в [1] Соединение -153Sm EDTMP особенно в виде его фармацевтической рецептуры пригодно для снятия болей в костях и для лечения кальцинозных опухолей, и его использование и получение были представлены в патенте США N 4898724, канадском патенте N 1243603 и в опубликованной европейской заявке N 164843. Дополнительное использование радиофармацевтических препаратов для угнетения костного мозга дается в патенте США N 4853209. Все эти ссылки описывают применение радиофармацевтических препаратов, используемых в настоящем изобретении, в частности153Sm - EDTMP, в рецептуре с подходящими фармацевтически приемлемыми носителями.
при введении любого радиофармацевтического препарата следует обращать внимание на возможность радиолитического расщепления органических молекул, присутствующих в рецептуре, которое может изменять биораспределение радиоизотопа или приводить к токсичным побочным продуктам. Ни одно из этих явлений нежелательно. Когда необходимы большие величины радиоактивности, то возрастает вероятность радиационного повреждения органической молекулы /например, EDTMP/. Более вероятно, что эта деструкция происходит, когда используют терапевтические радионуклиды /например,153Sm/, которые предназначены для обеспечения высоких доз радиации.
Подход, который стараются использовать для предотвращения радиолиза, заключается в добавлении в рецептуры свободнорадикального ингибитора. Однако этот ингибитор или продукты его деструкции могут быть токсичными или мешать биораспределению радиофармацевтического препарата. Использование ингибитора, такого как бензиловый спирт, обсуждается в следующих работах: H.Skebuchi и др. Radioisotopes 26, /7/, 451 457 /1977/, B.J.Floor и др. JPharm.Sci 74/2/, 197 200 /1985/, A.Rego и др. J.Pharm.Sci, 71 /11/, 1219 1223 /1982/.
В случае радиофармацевтических композиций, кроме того, следует учитывать /как показано в [1] и опубликованной европейской заявке N 164843/ то, что может быть использован молярный избыток лиганда /например, EDTMP/ по сравнению с количеством металла. Когда вводят большие количества ионов металла /например Sm+3/, то следовательно также вводят много большее количество свободного хелатообразователя /например, EDTMP/. Возникающий избыток лиганда может вызвать связывание в комплекс ионов металлов в токе крови, что может привести к осложнениям у пациента. Следовательно, желательно располагать рецептурой, которая содержит минимальное количество свободного хелатообразователя.
Другой проблемой при введении радиофармацевтических препаратов является форма инъекции. Как правило, все такие радиофармацевтические препараты вводят путем внутривенных инъекций /I.V./. Пациент может испытывать некоторый дискомфорт при внутривенном введении и иногда трудно найти у пациента подходящую для инъекции вену.
Следовательно, было бы целесообразным располагать рецептурой радиофармацевтических препаратов, которая характеризовалась бы минимальным радиолизом до использования, могла бы вводиться различными путями и в которой отсутствовал бы избыток свободного /или незакомплексованного/ лиганда.
Были найдены улучшенные рецептуры для введения радиофармацевтических препаратов, которые снижают радиолиз EDTMP без изменения характеристик радиофармацевтического препарата. Радиофармацевтические препараты, пригодные для использования в настоящих рецептурах по данному изобретению, включают комплексы, содержащие по крайней мере один радионуклид, заключенный в комплекс с лигандом или его физиологически приемлемую соль.
Примерами подходящих радионуклидов является самрий -153 /153Sm/, гольмий 166 /166Ho/, иттербий -175 /175Yb/, лютеций 177 /177Lu/, иттрий 90 /90Y/ или гадолиний 159 /159Gd/. Особенно предпочтительными радионуклидами являются153Sm и166Ho, где самым предпочтительным является153Sm.
Примеры подходящих лигандов включают этилендиаминтетраметиленфосфоновую кислоту /EDTMP/, диэтилентриаминпентаметиленфосфоновую кислоту /EDTMP/, гидроксиэтилендиаминтриметилфосфоновую кислоту /HEEDTMP/, нитрилотриметиленфосфоновую кислоту /NTMP/, трис/2-аминоэтил/амингексаметиленфосфоновую кислоту /TTHMP/, 1-карбоксиэтилендиаминтетраметиленфосфоновую кислоту /CEDTMP/, бис/аминоэтилпиперазин/тетраметиленфосфоновую кислоту /AETPMP/ и 1,4,7,10-тетраазациклододекантетраметиленфосфоновую кислоту /DOTMP/ и их физиологически приемлемые соли. Особенно предпочтительными лигандами являются EDTMP, DTPMP, HEEDTMP, TTHMP, AEPTMP, CEDTMP и DOTMP, где особенно предпочтительным является EDTMP. Особенно предпочтительным радиофармацевтическим препаратом для использования в настоящем изобретении является комплекс:153Sm-EDTMP и его физиологически приемлемые соли.
Настоящие рецептуры могут также содержать ионы двухвалентного металла в количестве от 0,25 до 5 моль иона двухвалентного металла на моль лиганда, которые не мешают образованию радиофармацевтического комплекса. Когда ион двухвалентного металла добавляют до радионуклида, то рецептура не требует замораживания до тех пор, пока не происходит добавление радионуклида, и ее замораживают только в случае значительных промежутков времени между образованием радиофармацевтической рецептуры и ее использованием.
К настоящему моменту также было обнаружено, что для получения желаемого биораспределения радионуклида при использовании радиофармацевтической композиции по настоящему изобретению не требуется внутривенной /"I.V."/ инъекции. Лучше аналогичные биораспределения обеспечивают при желании или необходимости внутрибрюшинные /"I.P."/, подкожные /"S.C."/ или внутримышечные /"I.M."/ инъекции.
Настоящие радиофармацевтические рецептуры, содержащие двухвалентный металл, сводят к минимуму присутствие свободного /или незакомплексованного/ лиганда /например, EDTMP/, который вводят в кровяное русло млекопитающего. Такой комплекс: двухвалентный металл-лиганд, снижает хелатообразование других металлов /например, кальций/ с лигандом в крови. Таким образом, снижается отрицательное воздействие избытка лиганда. Двухвалентные металлы однако не должны мешать образованию радиофармацевтического комплекса /например:153Sm EDTMP/. Подходящими двухвалентными металлами являются Fe+2 и Mn+2 и щелочноземельные металлы, например Mg+2, Ca+2, Sr+2 и Ba+2, где Ca+2 является самым предпочтительным. Эти радиофармацевтические рецептуры готовят таким образом, что на один моль лиганда приходится 0,25 5 моль двухвалентного металла, особенно предпочтительно 0,5 3 моль, еще предпочтительней 0,5 1 моль, еще более предпочтительней 0,75 1 моль и наиболее предпочтительно 0,9 1 моль.
Существует несколько путей получения таких радиофармацевтических рецептур, включающих двухвалентные металлы. Один путь /способ А/ состоит в приготовлении рецептуры двухвалентного металла, которую добавляют к комплексу: радиоактивный металл- лиганд. Комплекс: радиоактивный металл- лиганд необязательно может быть заморожен, затем разморожен для добавления двухвалентного металла и охлажден, если необходимо, то повторно заморожен и затем оттаян перед использованием. Второй путь состоит в совместном введении радиофармацевтического препарата, который может быть заморожен и оттаян для использования, и раствора иона двухвалентного металла, например глюконата кальция, путем двух отдельных внутривенных инъекции пациенту в приблизительно одно и тоже время. Предпочтительный путь /способ D/ заключается в добавлении двухвалентного металла в виде его хлорида или, более предпочтительно, в виде его гидроксида к лиганду и последующей регулировке pH, например добавлением гидроксида натрия /NaOH/, где полученный раствор необязательно подвергают лиофильной сушке для получения лиофилизованной рецептуры /набора/: двухвалентный металл- лиганд. Для получения окончательного состава набора используют подкисленный раствор иона радиоактивного металла, и получающаяся в результате фармацевтическая рецептура пригодна для применения при желаемом pH. Существует одна проблема, касающаяся любого из этих способов получения радиофармацевтической композиции, это период полураспада используемого радионуклида/например период полураспада/ /E 1/2/153Sm равен приблизительно времени, когда радионуклид находится в растворе с лигандом. Величина активности и время, в течение которого радионуклид находится в растворе с лигандом, будут определять необходимость замораживания радиофармацевтической рецептуры.
Были получены наборы, включающие рецептуры лиганда, где в предпочтительном варианте /метод D/ на один эквивалент лиганда приходится приблизительно один эквивалент двухвалентного металла. Раствор, содержащий двухвалентный металл и лиганд, также может быть подвергнут лиофильной сушке. Этот раствор при совмещении его с раствором радионуклида дает количественный комплекс с ионом радиоактивного металла и имеет pH 7 8,5. Рецептура двухвалентного металла особенно предпочтительна в том случае, когда используют большие дозы лиганда, обычно с более высокими дозами радионуклида, особенно при удалении костного мозга.
Таким образом, предпочтительными являются наборы, включающие лиганд, такой как EDTMP, необязательно содержащие двухвалентный металл, которые лиофильно высушивают таким способом, что добавление предопределенного количества раствора радионуклида в HCI подходящей концентрации/предпочтительно от приблизительно 0,001 до 1 NHCI или более предпочтительно 0,01 0,1 NHCI/ будет в результате давать с количественным выходом комплекс: радионуклидлиганд, например, Sm EDTMP, причем pH получающейся в результате системы будет лежать в интервале 7 8,5 Для радиофармацевтической рецептуры153 Sm EDTMP предпочтительная концентрация EDTMP составляет 35 мг/мл, а предпочтительная концентрация SM равна 3•10-4M /т.е. соотношение EDTMP Sm приблизительно равно 278 1/.
Настоящие радиофармацевтические рецептуры, особенно рецептуры153SmE DTMP, содержащие или несодержащие двухвалентный металл, могут быть заморожены для уменьшения радиолиза и затем оттаяны перед использованием. Замораживание может быть осуществлено любыми подходящими способами, которые сохраняют стерильность продукта /например, с помощью жидкого азота или сухого льда/, и затем, когда рецептуру нужно использовать, ей дают возможность оттаять. Способ введения настоящих рецептур может быть выбран из следующих способов: I.V. I.P. S.C. или I.M. Для всех этих способов введения настоящих радиофармацевтических рецептур биораспределение является идентичным.
Найден усовершенствованный способ получения радиофармацевтических препаратов, особенно системы153Sm EDTMP, который понижает радиолиз лиганда без изменения характеристик радиофармацевтического препарата. Радиофармацевтические препараты, пригодные для использования в настоящих рецептурах по данному изобретению, включают комплексы, содержащие по крайней мере один радионуклид, входящий в комплекс с лигандом или с его физиологически приемлемыми солями.
Примерами подходящих радионуклидов являются самарий -153 /153Sm/, гольмий -166 /166Ho/, иттербий 175 /175Yb/, лютеций 177 /177Lu/, иттрий 90 /90Y/ или гадолиний 159 /159Gd/. Особенно предпочтительными радионуклидами являются153Sm и166Ho, где наиболее предпочтителен153Sm.
Примеры подходящих лигандов включают этилендиаминтетраметиленфосфоновую кислоту /EDTMP, диэтилдентриаминпентаметиленфосфоновую кислоту /DTPMP/, гидроксиэтилендиаминтриметиленфосфоновую кислоту /HEEDTMP/, нитрилотриметиленфосфоновую кислоту /NTPM/, трис/2-аминоэтил/амингексаметиленфосфоновую кислоту /TTHMP/, 1-карбоксиэтилендиаминтетраметиленфосфоновую кислоту /CEDTMP/, бис/аминоэтилпиперазин/тетраметиленфосфоновую кислоту /AEPTMP/ и 1,4,7,10-тетраазациклододекантетраметиленфосфоновую кислоту /DOTMP/ и их физиологически приемлемые соли. Особенно предпочтительными лигандами являются EDTMP, DTPMP, HEEDTMP, TTHMP, CEDTMP и DOTMP, где наиболее предпочтителен EDTMP. Особенно предпочтительными радиофармацевтическим препаратом для использования в настоящем изобретении является153Sm EDTMP и его физиологически приемлемые соли. Подходящие физиологически приемлемые соли были определены в [1] и включают соли, получаемые добавлением кислот к тем основаниям, которые будут образовывать соль с по крайней мере кислотной группой используемого лиганда и которые не будут оказывать значительного вредного физиологического воздействия при введении их животным в дозах, соответствующих физиологической практике. Подходящие основания включают, например, гидроксиды щелочных и щелочноземельных металлов, их карбонаты и бикарбонаты, такие как гидроксид натрия, гидроксид калия, гидроксид кальция, карбонат калия, бикарбонат натрия, карбонат магния, аммиак, первичные, вторичные и третичные амины. Эти физиологически приемлемые соли могут быть получены взаимодействием кислоты с соответствующим основанием.
Определения.
Sm= самарий, все изотопы,
как радиоактивные, так и нерадиоактивные.7 /Аналогично для других радионуклидов по настоящему изобретению/.153Sm представляет собой радиоактивный изотоп самария, имеющий атомную массу 153.
/Аналогично для других радионуклидов по настоящему изобретению/
EDTMP этилендиаминтетраметиленфосфоновая кислота.
153Sm EDTCP это комплекс:153самарий - этилендиаминтетраметиленфосфоновая кислота, который находится в растворе, он содержит как радиоактивные, так и нерадиоактивные изотопы самария. "Зонд" представляет собой раствор153 SmCI3 или166HoCI3 с активностью 0,5 IпKи, добавляемый в качестве метки.
Радиофармацевтический препарат представляет собой радиоактивный фармацевтический препарат для диагностики и/или терапии, обычно это раствор, содержащий ион радиоактивного металла /например,153Sm/, связанный с органическим лигандом /например, EDTMP/ в водном растворе.
Набор это ампула, содержащая твердую рецептуру лиганда, необязательно включающую ион двухвалентного металла, куда с целью получения комплекса (радиоактивный металл лиганд) добавляют раствор иона радиоактивного металла.
X-мл-Набор это набор, предназначенный для принятия X-мл раствора иона радиоактивного металла с целью образования комплекса: радионуклид лиганд.
Повторное составление это добавление кислого раствора радионуклида к набору с целью получения комплекса радионуклид лиганд.
TBA
Тетрабутиламмонийгидроксид
BrOH бензиловый спирт
EtOH Этанол
Процент
HCI Хлористоводородная кислота
NaOH Гидроксид натрия
I.V. Внутривенная
инъекция
I.P. Внутрибрюшинная инъекция
I.M. Внутримышечная инъекция
S.C. Подкожная инъекция
MDP Метилендифосвонат
Общая экспериментальная часть
Для определения выхода комплексов использования метод катионообменного хроматографического разделения. Эта методика описана в [1]
HPLC это высокоэффективная жидкостная хроматография,
использовали колонку с обратной фазой типа "Hamilton PRP-1", элюент представлял собой 0,1 M ацетат натрия и 0,005 M TBA. Объемная скорость потока составляла 1 мл/мин, обнаружение осуществлялось с
помощью радиометрического детектора и Уф - детектора /240 нм/, соединенных последовательно.
EDTMP получали в чистом виде, пригодном для использования в качестве фармацевтического препарата, по методу, описанному в патенте США N 4937333 и в опубликованной европейской заявке N 411941.
153Sm получали с исследовательского реактора в университете шт.
Миссури, г. Колумбия. В качестве дистиллированной воды использовали воду типа "Barnstead NaNopure"
Ca/OH/2 в виде дигидрата получали от фирмы "MCB" или "Aldrich" с чистотой 95%
Все реагенты, если не указано особо, покупали и использовали в том виде, каком они были представлены.
Изобретение будет далее уточнено рассмотрением следующих примеров, которые, как предполагается, являются вполне типичными для настоящего изобретения.
Пример 1. Способ А, без добавки кальция.
Готовят 3 мл 8•10-2 M раствора DTMP, который содержит 3•10-4 M Sm. Удельная активность153Sm составляла 10 мКи/мл. Три 200 мкл аликвоты /образцы I, II и III помещают в пластиковые пробирки и замораживают на бане из ацетона с сухим льдом. Пластиковые пробирки держат в морозильнике. В стеклянную пробирку помещают другую 500 мкл порцию, куда добавляют 4,3 мкл бензилового спирта, получая в результате 0, 9%-ный [вес/объем] раствор /образец А/. В другую стеклянную пробирку помещают еще одну 500 мкл порцию раствора, куда добавляют 31,8 мкл этанола, получая в результате 5%-ный [вес/объем] раствор /образец B/.
Растворы анализируют с помощью метода HPLC и деструкцию регистрируют как функцию времени. Деструкция проявляется как появление на радиометрической хроматограмме пиков, не
принадлежащих Sm EDTMP. За время этого исследования одной пластиковой замороженной пробирке дают возможность оттаять при температуре окружающей среды, и порцию анализируют. Раствор выдерживают без
замораживания в течение 2 4 ч и проводят повторный его анализ. Две другие пластиковые пробирки используют для получения данных для более длительных промежутков времени аналогичным образом. Результаты
показывают только один радиометрический пик, соответствующий целевому продукту, в течение 60 ч для замороженных образцов. Контрольный /неингибированный образец/ и как образец, содержащий бензиловый
спирт, так и образец, содержащий этанол, обнаруживает несколько радиометрических пиков. Доля радиации, которая не соответствует целевому продукту, как функция времени от момента повторного составления
рецептуры, показана в табл.1
A: 0,9% BrOH, для сравнения
B: 5% EtOH, для сравнения
I: заморожен, оттаян при 8,25 ч и проанализирован, оставлен оттаянным до 10,9 ч для
анализа.
II: заморожен, оттаян при 21 ч, проанализирован по истечении 22,6 и 27 ч.
III: заморожен, оттаян при 48,2 ч, проанализирован, повторно заморожен, затем оттаян снова при 70,5 ч для анализа.
Образцы A и B не относятся к настоящему изобретению, образцы I, II и III являются предметом настоящего изобретения.
Пример A /сравнительный контроль/.
Образцы получают по методике, описанной в примере 1, за исключением того, что удельная активность153Sm составляет 30,30 и 50 мки/мл /образцы C, D и E, соответственно/.
Полученные результаты представлены в табл.А.
Пример 2. Способ A, без добавки кальция.
Два раствора готовят, как описано в примере 1, за исключением того, что они содержат153Sm с активностью 27 мКи/мл и замораживают аналогичным образом, как в примере 1. Образцы хранят в контейнере, наполненном порошкообразным сухим льдом. Образцы отбирают после того, как раствору дают возможностью оттаять, а затем раствор снова замораживают. Для анализа образцов используют метод HPLC из примера 1. Никаких радиометрических пиков, отличных от пика, соответствующего целевому продукту, не обнаружено после того, как образец пробыл в замороженном состоянии в течение 70 ч.
Пример 3. Способ A.
3 мл раствора, содержащего 70 мл/мл EDTMP, отмеряют пипеткой в стакан. pH раствора доводят до приблизительно 10,26 с помощью 50% /вес/вес/ NaOH. После помещения раствора в пробирку с сывороткой воду удаляют в вакуумной печи. Готовят три такие пробирки /EDTMP-наборы/.
Три 6,0 мл EDTMP-набора, полученные по вышеописанной методике, повторно составляют с помощью 3•10-4 М HoCI3 в 0,1 NHCL. Каждый набор метят с помощью 150 мкл166Ho. Для каждого образца измеряют pH раствора комплекса. Этот pH, как было обнаружено, лежит в интервале от 7,
6 до 7,7. К одному образцу /образец IV/ добавляют CaCl2, достигая молярного соотношения Ca: EDTMP, равного 1:1. К другому образцу /образец V/ добавляют CaCl2, достигая молярного
соотношения Ca: EDTMP 2:1. Третий образец был контрольным /без добавления CaCl2/. Образец IV после добавления CaCl2 имеет pH 7,06, который затем доводят до 7,5 с помощью 50%
/вес/вес/ NaOH. Образец V после добавления CaCl2 имеет pH 6,6, который затем доводят до 7,5 с помощью 50% /вес/вес/ NaOH. Обнаружено, что для всех трех образцов процент комплексообразования
составляет 99%
Крысам вида Sprague Dawley /три группы крыс по трем особям в каждой/ внутривенно вводят 100 мкл контроля, образец IV и образец V (каждой группе вводят свой препарат). Спустя 2
ч определяют биораспределение.
Результаты представлены в табл.2
Из этих данных следует, что биораспределение идентично для всех трех образцов.
Пример 4. Способ D.
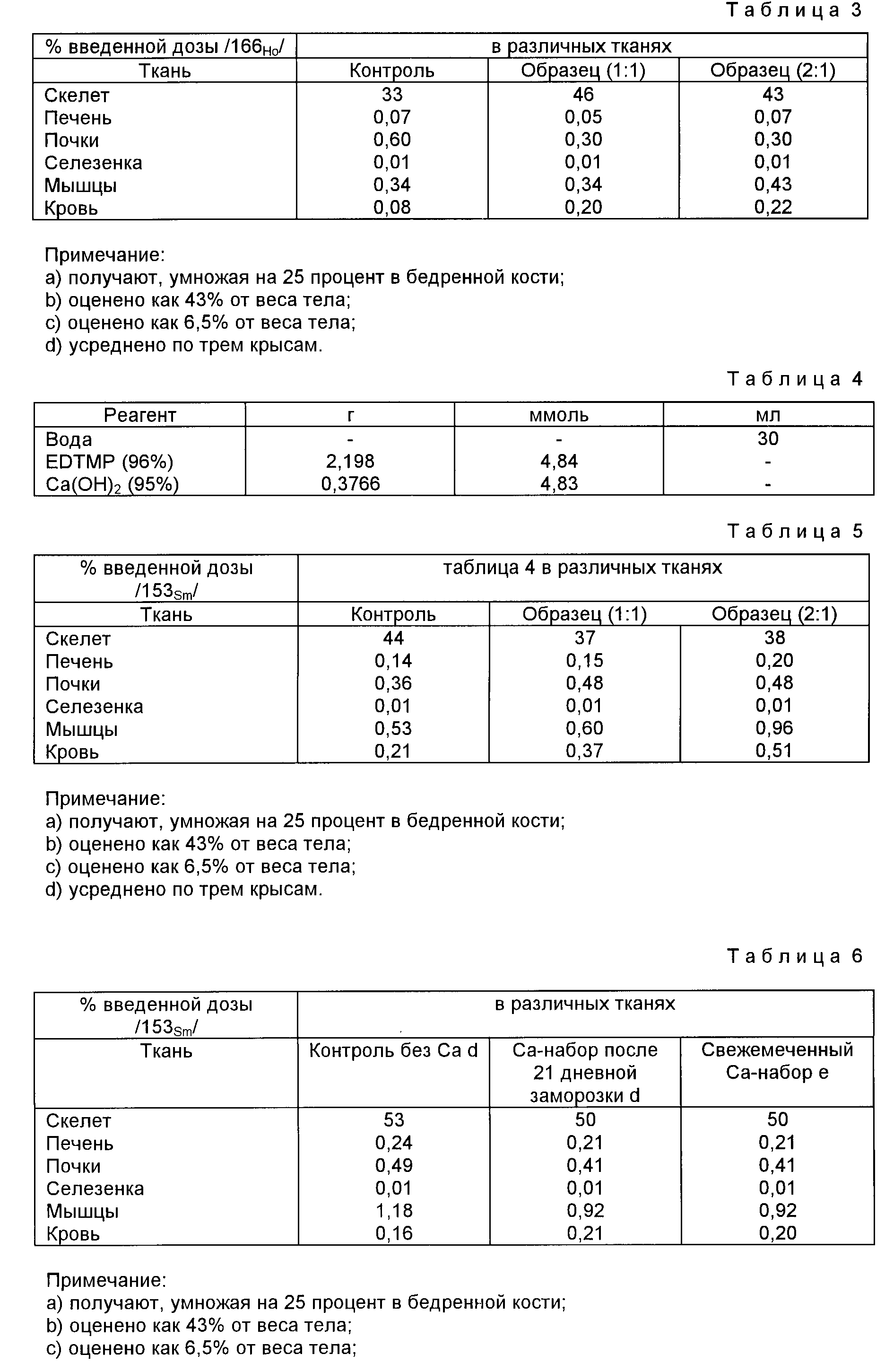
Ca-содержащий набор /Ca-набор/ Ca:EDTMP 1 1, моль/моль получают, перемешивая при pH 1,97 следующие реагенты (табл.3):
Величину pH затем регулируют с помощью 0,1 N, NaOH.
При pH 1,97 раствор является прозрачным. При pH 2,8 3 раствор мутный. При pH приблизительно 5,8 раствор прозрачный. При pH, равном приблизительно 10,5, раствор является прозрачным.
предпочтительный способ получения Ca-набора состоит в помещении в стакан навесок твердого Ca/OH2/ и EDTMP, добавлении воды и перемешивании до тех пор, пока система не станет прозрачной, доведении pH до приблизительно 6.
Затем pH может быть доведен до 9,2 и осуществлено лиофильное высушивание с целью получения требуемой рецептуры в форме набора.
Добавление к набору раствора Sm приводит к образованию комплекса153Sm EDTMP, который затем может быть введен.
Пример 5. Способ D.
Рецептуру153Sm
EDTMP получают повторным составлением 3 мл Ca-набора из примера 4/Ca EDTMP 1 1 моль/моль. Этот набор повторно составляют, используя 3•10-4 раствор Sm в 0,1 NHCL, меченый с помощью153Sm, и pH раствора затем доводят до 7,8 /образец VI/. Рецептуру153Sm EDTMP /Ca EDTMP 2 1/ готовят по модифицированной методике из примера 4. Набор повторно составляют с
использованием 3•10-4 M раствора в 0,1 NHCl, меченого153Sm, pH которого затем доводят до 7,2 /образец VII/. В качестве контроля /без кальция/ повторно составляют 6 мл
набор с помощью 6,0 мл 3•10-4 М раствора Sm в 0,1 NHCl, меченого153Sm, pH которого доводят до 7,5. Процент Sm /все изотопы Sm/ в виде комплекса определяют методом
катионообменной хроматографии. Эта величина превышает 99%
Трем крысам вида Sprague Dawley внутривенно вводят 100 мкл раствора153Sm EDTMP. Спустя 2 ч после инъекции крыс
умерщвляют. Величину активности в различных тканях определяют, сравнивая счет в тканях /измеренный с использованием NaI гамма-счетчика/ со счетом в стандартных 100 мкл объемах исходного раствора.
Полученные результаты в табл.4
Пример 6. Способ D.
3 мл Ca-набор, полученный как описано в примере 4, повторно составляют с 3,0 мл 3•10-4 М раствора SmCl3 в 0,1 M HCl. На образце раствора объемом 2 мл проверяют pH и обнаруживают, что величина pH лежит, как это следует из данных, полученных с помощью индикаторной бумаги типа "colorp Hast", в интервале между 7,0 и 8,0. Раствор метят с помощью 1 2 мкл раствора153Sm, используемого как радиоактивного индикатора. Аналогичным образом повторно составляют контрольный набор с Na /без Ca, приготовленный как в примере 3/. Повторно составленный Ca-набор, содержащий153Sm с активностью 48,3 мКи/мл, кроме того, замораживают на сухом льду. Спустя 21 день замороженную рецептуру оттаивают и используют.
Пяти крысам вида Sprague Dawley внутривенно водят по 10 мкл раствора контрольной рецептуры, пяти крысам вида Sprague Dawley вводят по 100 мкл свежеоттаянной, после 21 дневной выдержки рецептуры Ca-набора, а четырем крысам вида Sprague-Dawley вводят по 100 мкл раствора рецептуры Ca-набора /меченой153Sm/.
Спустя 2 ч после инъекции крыс умерщвляют. Величину активности в различных тканях определяют, сравнивая счет в тканях /измеренный с использованием NaI гамма-счетчика/ со счетчиком в стандартных 100 мкл объемах исходного раствора.
Дозы в различных тканях показаны в табл. 5.
Пример 7. Способ D.
В 600 мл стакан, содержащий магнитную мешалку, добавляют 18,210 г /40,126 ммоль/ EDTMP, 2,678 г /36,140 ммоль/ Ca/OH/2 и 400 мл воды. Смесь перемешивают в течение 1 ч при комнатной температуре, и большая часть твердого вещества при этом растворяется. pH системы медленно поднимают, используя 50% -ный раствор NaOH, и перемешивание продолжают до полного растворения твердого вещества. Когда смесь становится гомогенной, pH медленно повышают до 9,2 с помощью 50%-ного раствора NaOH /раствор становится мутным при pH 3,6 и снова становится гомогенным при pH 5,8. /Раствор переносят в мерную колбу объемом 500 мл и доводят до 500 мл водой, pH равно 9,17. Затем раствор фильтруют через фильтр с размерами пор в 0,45 мкм и распределяют по кратным 3,6 и 18 мл наборам. Наборы замораживают на бане с ацетоном и сухим льдом и затем помещают в аппарат для лиофильной сушки. Спустя 4 дня наборы удаляют, уплотняют, вакуумируют, метят и хранят.
Из этих наборов 3 мл Ca-набор наряду с контрольным /Na/ набором повторно составляют, используя 3 мл 3•10-4 М раствор Sm в 0,1 M HCl, меченного следовыми количествами153Sm /1 2 мкл/. Процентное содержание комплекса определяют с помощью катионообменной хроматографии, и в каждом случае этот процент превышает 99. В обоих случаях pH систем лежит в интервале между 7 и 8. Из каждого набора отбирают по три 100 мкл аликвоты, которые используют в качестве стандартов.
Пяти крысам вида Sprague-Dawley /массой 150 200 г/ внутривенно вводят по 100 мкл повторно составленного Ca-набора, а четырем крысам вида Sprague-Dawley вводят по 100 мкл повторно составленного контрольного набора. Спустя 2 ч крыс умерщвляют, и отбирают образцы тканей. Подсчитывают активность образцов тканей, а также стандартов и определяют биораспределение.
Полученные результаты представлены в табл. 6. Эти две рецептуры в табл.6 характеризуются одинаковыми диораспределениями.
Пример 8 и сравнительный пример B: способ D.
При сравнении рецептуры Ca-набора с рецептурой Na-набора, где обе рецептуры вводят крысам вида Sprague-Dawley путем быстрой внутривенной инъекции, Ca-набор характеризуется дозой, приводящей к смерти 50% особей, /LD50/, которая в 3,5 раза выше, чем аналогичная доза для Na-набора. Оба набора получают по методике, описанной в примере 5. Результаты биораспределения наборов идентичны. Из-за повышенной LD50 Ca-набор обеспечивает дополнительный фактор безопасности.
Пример 9. Способ D.
Рецептуру153Sm EDTMP получают повторным составлением 3 мл набора, приготовленного по методике из примера 3. Этот набор повторно составляют добавлением 3 мл раствора153Sm в 0,1 M HCl. Повторно составленный набор содержит 3•10-4 M Sm и 35 мг/мл EDTMP.
Процентное содержание Sm в виде комплекса определяют методом катионообменной хроматографии. Его величина превышает 99% Двум крысам вида Sprague-Dawley вводят внутримышечно в правое бедро, а еще двум крысам инъекцию осуществляют подкожно в область шеи над ключицей. Каждой крысе вводят по 100 мкл раствора153Sm EDTMP.
Крыс умерщвляют спустя 2 ч после инъекции. Величину активности в различных тканях определяют, сравнивая счет в ткани /измеренный с использованием NaI гамма-счетчиков/ со счетом в стандартных 100 мкл объемах исходного раствора.
Доза в различных тканях изображена в табл.7 и сравнена с вариантом осуществленных аналогично внутривенных инъекций.
Из данных табл.7 следует, что биораспределение является идентичным независимо от формы введения.
Пример 10. Пять 3 мл EDTMP-наборов, полученных по методике из примера 4, повторно составляют с помощью растворов, показанных в табл.8, и затем измеряют pH.
Рассмотрены растворы, содержащие153Sm активностью около 2 мКи/мл и имеющие полную концентрацию Sm, равную 3•10-4M, где для каждого образца в вышеупомянутой таблице указано содержание кальция. Для каждого образца определенный выход комплекса превышает 99% Кальций-содержащие кислые растворы, описанные в табл.8, используют для титрования имеющихся 3 мл EDTMP-наборов с целью изучения влияния объема раствора, используемого для повторного составления рецептуры, на окончательный pH. К каждому набору добавляют 2 мл каждого раствора и измеряют pH. Другие 2,0 мл добавляют в 200 мкл аликвоты измерениями pH после каждого добавления. Результаты показывают, что к 3 мл набору может быть добавлено вплоть до 3,6 мл любого из растворов без падения pH ниже 7,0. Определяют влияние добавленного кальция на осмолярность повторно составленных наборов. Для повторного составления 3 мл наборов на основе EDTMP используют растворы, указанные в табл. 8. Вслед за повторным составлением измеряют pH раствора и определяют осмолярность по понижению точки замерзания.
Полученные результаты представлены в табл.9.
Данные табл.9 показывают, что составленные таким образом наборы являются гипертоническими и его добавление кальция к радионуклидным растворам, используемым для повторного составления наборов, приведет к незначительному повышению гипертоничности. Из обсуждения влияния рецептуры на путь введения лекарств следует, что при внутривенном введении изотоничность растворов становится менее важным фактором, если введение осуществляют достаточно медленно, допуская разбавление или корректировку в крови /Смотри, например, P.P. Deluca и I.C.Boyla, "Составление перентеральных рецептур небольшого объема в фармацевтические дозировочные формы", Parenternal Medicationst т.1, с.140, редакторы: K.E.Avis, L.Lachman, H.A.Lieberman издательство "Marcel Dekker", Нью-Йорк, /1984/.
Пример 11. Способ D.
Для испытания острых воздействий153Sm Na EDTMP и153Sm [Ca/Na] EDTMP на частоту сердечных сокращений и пульс и уровни кальция в сыворотке сразу после внутривенного введения собакам породы "Beagle" проводят следующий эксперимент.
Измеряют также влияние скорости инфузии.
Препарат153Sm-a-EDTMP, образец VIII, получают из 630 мг EDTMP и 414 мг NaOH, состав лиофилизуют, стерилизуют и затем повторно составляют со стерильным 3•10-4 М раствором Sm в 0,1 M HCl.
Препарат153Sm[Ca/Na] EDTMP, образец IX, готовят из 630 мг EDTMP, 245 мг NaOH и 95 мг Ca/OH/2, состав лиофилизуют, стерилизуют и затем повторно составляют со стерильным 3•10-4 М раствором Sm в 0,01 M HCl.
Каждый используемый для инъекции комплекс получают добавлением 18,0 мл раствора Sm к соответствующей лиофилизованной EDTMP рецептуре. Окончательная концентрация в рецептуре составляет 35 мг/мл комплекса Sm-EDTMP. Эти рецептуры используют не более чем за 15 мин после приготовления, а оставшийся раствор замораживают для анализа. Анализ используемых для инъекций рецептур подтверждает, что инъекции делают ее заданными концентрациями.
Используют молодых взрослых самцов собак породы "Beagle" возрастом приблизительно в 33 недели и массой 8,1 10,9 кг. Собак отдают ветеринарам для полного физического обследования, дают им возможность привыкнуть к среде в лаборатории в течение по крайней мере 30 дней, проводят их повторную вакцинацию против собачьей чумы, аденовируса гепатита типа 2, парагриппа и парвовируса, используя препарат марки "Adenoimmune-7 -L" /изготовлен фирмой "Feach America, Biologics Corp. /.Каждую собаку идентифицируют с помощью номера, вытатуированного на ухе животного. Собак содержат в соответствии с методиками, установленными американской ассоциацией по уходу за лабораторными животными.
Лаборатория, где проводят эти испытания, была уполномочена на выполнение такого рода работ.
Одному случайно выбранному кобелю через катетер, введенный в головную вену, вводят дозу или образца VIII или IX из расчета 30 мг/кг веса тела. Место инъекции обривают и обрабатывают антисептиком до того, как ввести катетер. Дозу вводят со скоростью около 2,0 мл/мин /70 мг/мин/ так, что сама инъекция занимает приблизительно 4 мин.
Двум дополнительным самцам собак породы "Beagle" вводят такую же дозу или образца VIII, или IX так быстро, как это возможно, т.е. со скоростью около 15 мл/мин. Способы введения такие же, как и ранее. Это делают спустя приблизительно 2 недели после первой инъекции, чтобы проверить ранее сообщенные результаты, касающиеся скорости инфузии.
Для анализа сывороточного кальция и полного белка немедленно перед инъекцией и после ее завершения, а также спустя приблизительно 5, 15, 30 и 45 мин и 1, 2 и 4 ч образцы крови получают из яремной вены. Вентральную область шеи бреют и обрабатывают раствором антисептика как указано выше. В течение этого периода времени регистрируют проявление у собак клинических эффектов, и в каждой из этих временных точек записывают частоту сердечных сокращений и пульс.
Итоговые таблицы оказываются неподходящими, как только отдельных собак подвергают каждому из этих режимов обработки. Однако медленные внутривенные инъекции со скоростью 2 мл/мин/ 70 мг/мин комплекса Sm EDTMP при дозе в 30 мг/кг на вес тела или образца VIII, или IX не вызывают каких-либо клинических сигналов. Для каждой рецептуры частоты сердечных сокращений увеличивается на 7 10% Считается, однако, что этот результат только отражает реакцию на возбуждение, когда скорость сердечных сокращений у собаки может заметно изменяться в ответ на стимулы, обусловленные внешней средой. Хотя наблюдается незначительные изменения в полном сывороточном кальции, эти изменения трудно приписать обработке.
Когда скорость инъекции увеличивают до максимальной возможной на практике степени /около 15 мл/мин/, то в случае каждого образца отмечены клинические симптомы. Для собак, получивших дозу образца VIII, отмечены непроизвольные мускульные движения, главным образом дрожание всех мускулов, с учащенным дыханием и скулением. Эти эффекты первоначально замечены приблизительно через 20 с после начала инъекции и длятся в течение около 2 мин. Собака оказывается нормальной спустя приблизительно 5 мин после инъекции. В течение этого же периода времени частота сердечных сокращений увеличивается более чем на 50% За этот промежуток времени падет суммарный уровень сывороточного кальция, однако это падение сравнительно невелико и сопровождается аналогичными изменениями в суммарном сывороточном белке. Невозможно приписать какие-либо определенные воздействия на суммарный кальций, обусловленные инъекцией.
Хотя собака, получающая дозу образца IX, также проявляет клинические симптомы, не ясно, представляют ли эти симптомы непроизвольные движения, поскольку эти движения характеризуют сопротивление ограничителю, как это оказывается в случае собаки, которой вводят образец VIII. Период повышенной активности собаки длится лишь около 30 с, и собака оказывается нормальной спустя приблизительно 100 с после инъекции. Частота сердечных сокращений повышается лишь на приблизительно 13% Уровни сывороточного кальция возрастают в послеинъекционный период, однако сопутствующие изменения в суммарном белке делают эти результаты трудно интерпретируемыми.
Реферат
Изобретение относится к медицине, к рецептурам радиофармкомпозиций и способам ее получения. Композиция включает комплекс радионуклида153Sm или166Ho с лигандом (этилендиаминтетраметиленфосфоновая кислота) и соль двухвалентного металла, которая подлежит замораживанию. Композицию получают путем взаимодействия соли двухвалентного металла с комплексом радионуклид-лиганд с последующим замораживанием. Другой способ предусматривает добавление соли двухвалентного металла к лиганду, корректировке pH среды и добавления подкисленного раствора радионуклида с последующим замораживанием и оттаиванием перед использованием. Композиция содержит минимальное количество лиганда и не требует внутривенного введения. 3 с.и 7 з.п. ф-лы, 10 табл.

Комментарии