Комплексные соединения, содержащие в своем составе радионуклид227th, а также бисфосфонатный фрагмент, способы их получения, а также потенциальное применение в качестве действующего вещества в составе остеотропного радиофармацевтического лекарственного пре - RU2767567C1
Код документа: RU2767567C1
Описание
Настоящее изобретение относится к ядерной медицине и раскрывает структуру молекулы (комплексного соединения радионуклида227Th с транспортной молекулой – производной золедроновой кислоты) –действующего вещества в составе потенциального остеотропного терапевтического радиофармацевтического лекарственного препарата.
Одним из неблагоприятных последствий онкологических заболеваний различной локализация является губительное поражение костей: либо в виде нарушения нормального костеобразования (костная резорбция), либо за счет образования костных метастазов. В любом случае, кости подвергаются разрушению, приводящему к снижению уровня жизни пациентов.
В настоящее время в мировой клинической практике золотым стандартом при различных как доброкачественных, так и злокачественных заболеваниях, связанных с избыточной или нарушенной резорбцией костной ткани, является применение бисфосфонатов - специфических фосфорсодержащих соединений, представляющих собой стабильные аналоги природных неорганических пирофосфатов.
Механизмы, посредством которых бисфосфонаты ингибируют резорбцию костной ткани, пока не полностью выяснены. Установлено, что бисфосфонаты обладают высоким сродством к связыванию с гидроксиапатитными кристаллами костной ткани, способностью снижать обновление и резорбцию костной ткани, снижать уровни гидроксипролина или щелочных фосфатаз в крови и, кроме того, ингибировать образование, рекруитмент, активацию и активность остеокластов.
В настоящее время существует три поколения бисфосфонатов, нашедших свое применение в клинической практике (таблица 1):
Таблица 1: бисфосфонаты, применяемые в клинической практике:
Бисфосфонатом, проявляющим наибольшую антирезорбционную активность является молекула золедроновой кислоты. На территории Российской Федерации зарегистрировано по меньшей мере десять лекарственных препаратов на её основе в различных лекарственных формах.
Именно эта молекула была взята за основу в раскрываемом изобретении, т.к. имеет возможность селективно накапливаться в патологических очагах костной ткани, проявляя при этом с одной стороны свой терапевтический эффект (снижение резорбции костной ткани), с другой стороны - является потенциальным вектором (транспортной молекулой) для доставки радионуклида в непосредственную близость к патологическому очагу.
Данное решение – доставка радионуклида к костным метастазам с использованием золедроновой кислоты не ново. В патенте RU2407746 от 29.09.2008 раскрывается радиофармацевтическое средство для диагностики и лечения костных поражений скелета. В основе данной разработки лежит комплекс золедроновой кислоты с радионуклидами:99mTc или188Re. Основным недостатком данной разработки является тот факт, что активные центры молекулы золедроновой кислоты, ответственные за связывание с гидроксиапатитными кристаллами костной ткани, вовлечены в комплексообразование с радионуклидами99mTc или188Re, что, в свою очередь, может не лучшим образом сказаться на in vivo стабильности комплекса золедроновой кислоты с радионуклидом, другими словами, если бы радионуклид входил в состав молекулы золедроновой кислоты, не участвуя в комплексоообразовании с активными центрами молекулы золедроновой кислоты (фосфонатными фрагментами), ответственными за взаимодействие с костной тканью, можно было бы предположить, что in vivo стабильность такого радиофармпрепарата и величина связывания такого радиофармпрепарата с костной тканью были бы выше, чем в вышеуказанной разработке. Именно эта гипотеза и легла в основу заявляемой на защиту разработки.
В зарубежной разработке – патенте EP3206720 с датой приоритета 17.10.2014 заявляется молекула V, пригодная для комплексообразования изотопов металлов, содержащая хелатор X и один или несколько конъюгированных с ним таргетирующих векторов со структурой –L1-R1-L2-R2-L3-R3, а также фармацевтический препарат, состоящий из соединения V и образующего с ним комплекс изотопа металла M (44Sc,47Sc,55Со,62Cu,64Cu,67Cu,66Ga,67Ga,68Ga,89Zr86Y,90Y,90Nb,99mTc,111In,135Sm,159Gd,149Tb,160Tb,161Tb,165Er,166Dy,166Ho,175Yb,177Lu,186Re,188Re,213Bi и225Ac). В данной разработке активные центры молекулы золедроновой кислоты, ответственные за взаимодействие с костным матриксом не участвуют в комплексообразовании с радионуклидами металлов, а для этих целей происходит модификация молекулы золедроновой кислоты, заключающаяся во включении в её состав хелатообразователя, способного образовывать устойчивые комплексы с радионуклидами металлов, однако, в данной разработке не рассматривается возможность образования комплекса молекулы V с радионуклидом227Th, а именно этот радионуклид является одним из ключевых параметров выносимого в настоящей заявке на защиту решения. Дополнительно стоит отметить, что основная цель разработки из патента EP3206720 – это создание остетропного препарата, проявляющего свой терапевтический эффект за счет доставки радионуклида к патологическому очагу и последующего распада радионуклида в составе комплекса с образованием α- или β-частицы, обладающей цитотоксическим эффектом, в выносимом же на защиту решении из радионуклида227Th за счет α-распада тоже образуется α-частица, также обладающая цитотоксическим эффектом, но также дочерним продуктом распада является радионуклид223Ra, выходящий из состава комплекса с модифицированной молекулой золедроновой кислоты, имеющий сродство к костной ткани, способный инкорпорировать в состав костного матрикса уже вне комплекса с модифицированной молекулой золедроновой кислоты и являющийся также α-эмиттером. Таким образом, основным отличием выносимого на защиту решения от патента EP3206720 является не просто использование терапевтического радионуклида в составе комплекса с модифицированной молекулой золедроновой кислоты, продукты распада которого обладают цитотоксическим эффектом, а также обеспечение образования радионуклида223Ra в непосредственной близости от патологического очага с возможностью дальнейшего включения в костный матрикс и как следствие - потенциальное усиление терапевтического эффекта (большинство радионуклидов, описанных в патенте EP3206720 при распаде образуют стабильный нуклид), таким образом, комплекс радионуклида227Th с модифицированной молекулой золедроновой кислоты, помимо своих терапевтических свойств, дополнительно является in vivo генератором радионуклида223Ra в непосредственной близости от патологического очага. При этом, EP3206720 является наиболее близкой по своему содержанию разработкой к выносимому в рамках настоящей заявки на защиту решению.
Применение фосфорсодержащих хелатирующих агентов для комплексообразования с радионуклидом227Th с целью таргетной доставки к костным патологическим очагам уже рассматривалось ранее, например, в патенте EA004899 с датой приоритета 04.07.2000. В данном патенте описывается применение молекул DTMP (диэтилентриамин-N,N’,N”-пентамитиленфосфоновая кислота) и DOTMP (1,4,7,10-тетраазациклододекан-1,4,7,10-тетраметиленфосфоновая кислота) в комплексообразовании с радионуклидами актиния или тория с целью создания остеотропного хелата. При этом, в данном патенте активные центры молекулы комплексообразователя (в данном случае хелатора), участвующие в образовании связи с радионуклидом тория или актиния являются также активными центрами, участвующими во взаимодействии с костным матриксом, что является недостатком. Также в данном патенте рассматривается возможность получения хелата актиния или тория с последующим конъюгированием с молекулой, имеющей сродство к костной ткани, однако, в описании изобретения упоминаются лишь фосфорсодержащие хелаты, которые уступают в устойчивости амидным, либо кислотным хелаторам (например TCMC (1,4,7,10- тетраазациклододекан-1,4,7,10-тетраацетамид) или DOTA(1,4,7,10-тетраазациклододекан-1,4,7,10-тетрауксусная кислота)).
Помимо использования радионуклида227Th в составе комплексов для терапии костных заболеваний, был предложен на защиту метод терапии мягких тканей, при котором происходит образование223Ra - патент US2006/0228297. Данная разработка схожа с заявляемым на защиту в рамках данной заявки решением, однако, образование радионуклида223Ra в непосредственной близости от мягких тканей обладает некоторыми негативными последствиями, а именно: за счет своего достаточно длительного периода полураспада (11,4 суток), радионуклид223Ra, образовавшийся за счет распада материнского радионуклида227Th, с большой долей вероятности успеет локализоваться в костях, что может привести к необоснованным лучевым нагрузкам при отсутствии необходимости создания цитотоксической дозы ионизирующего излучения в костном матриксе. В разработке, которая выносится на защиту в рамках настоящей заявки – радионуклид223Ra образуется уже в непосредственной близости от патологического очага, в меньшей степени диффундирует по организму.
Вышеописанные четыре патента наиболее близки по своему уровню техники к заявляемой на защиту разработке, однако, уступают в некоторых аспектах, описанных выше.
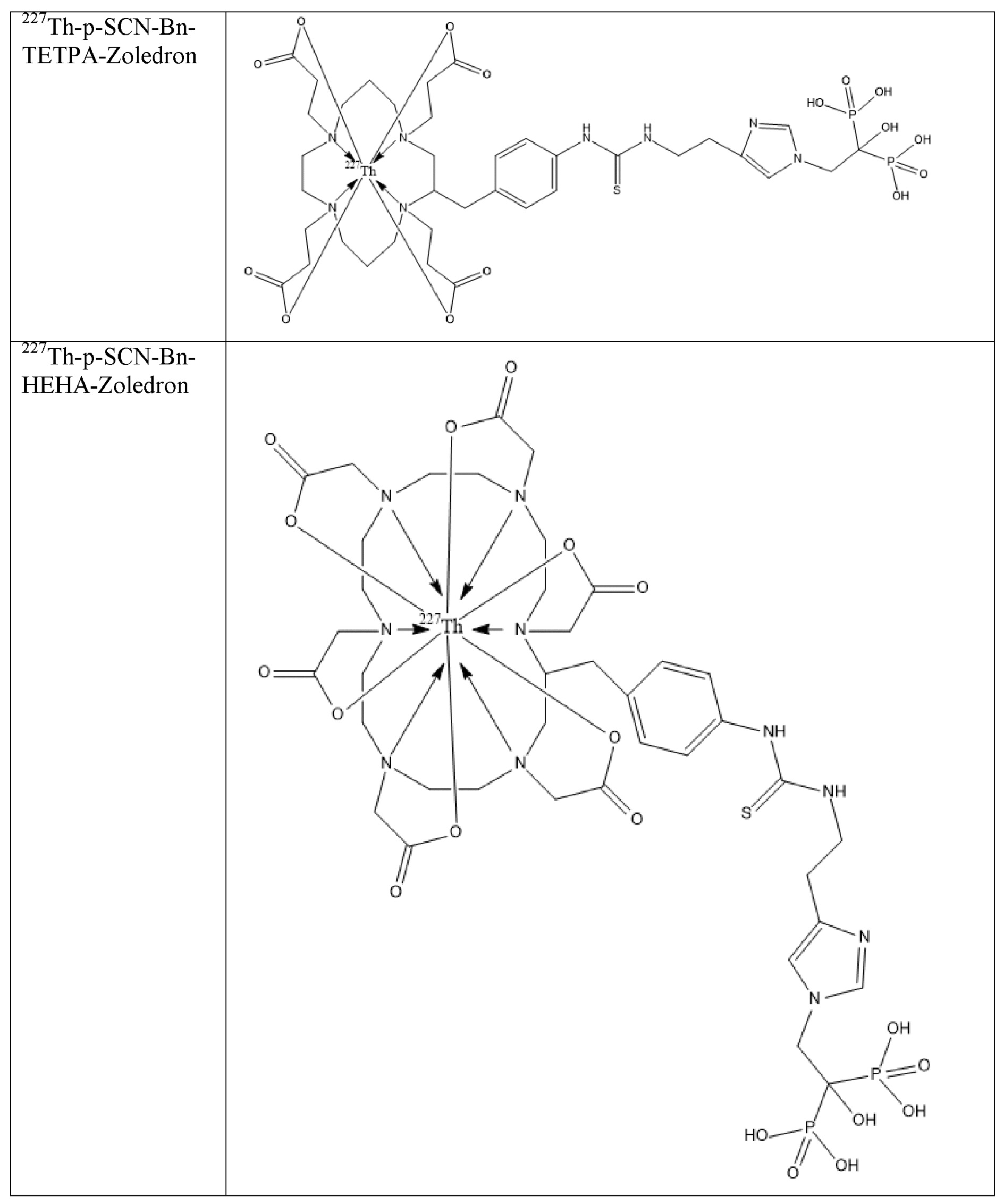
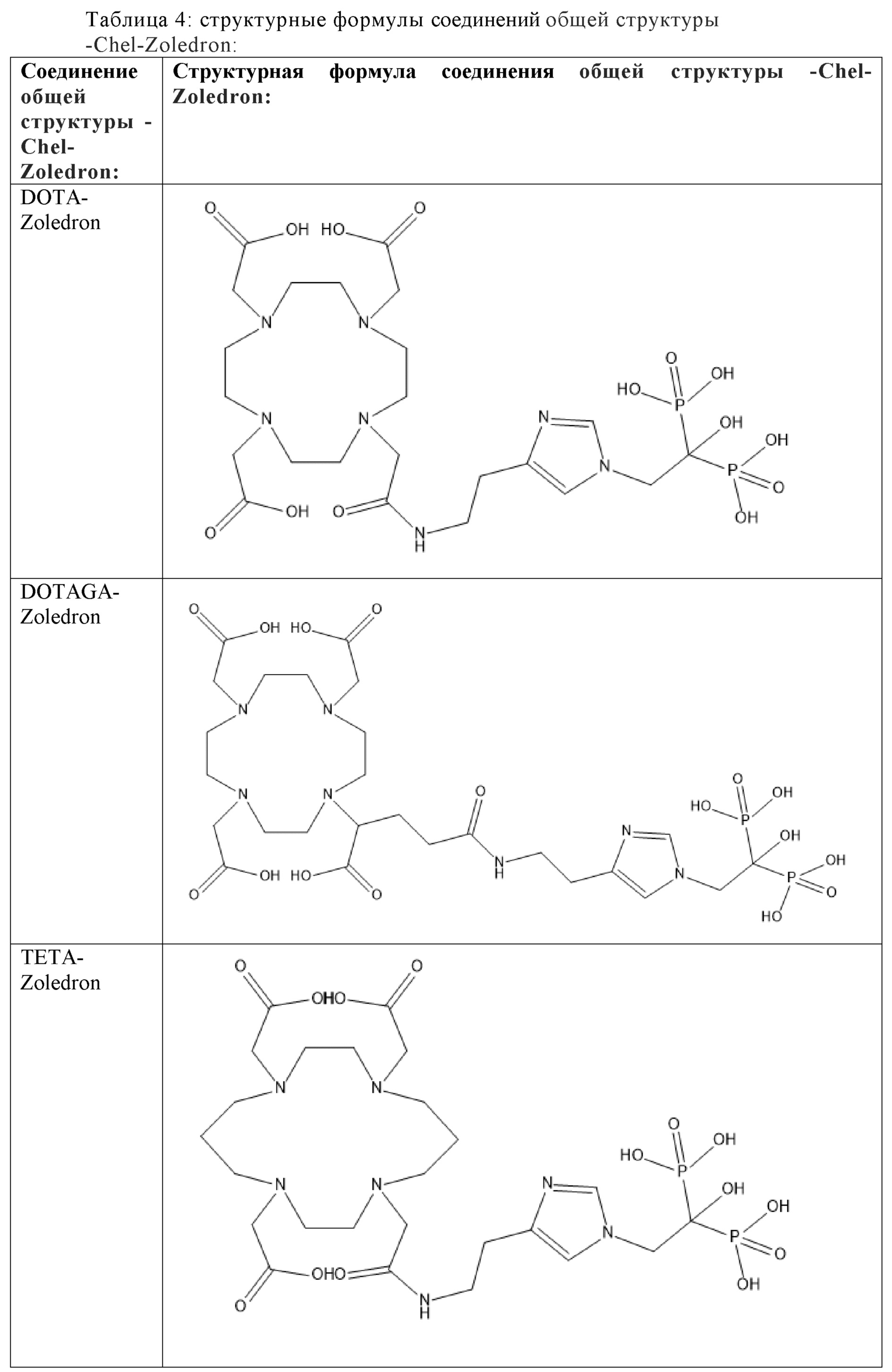
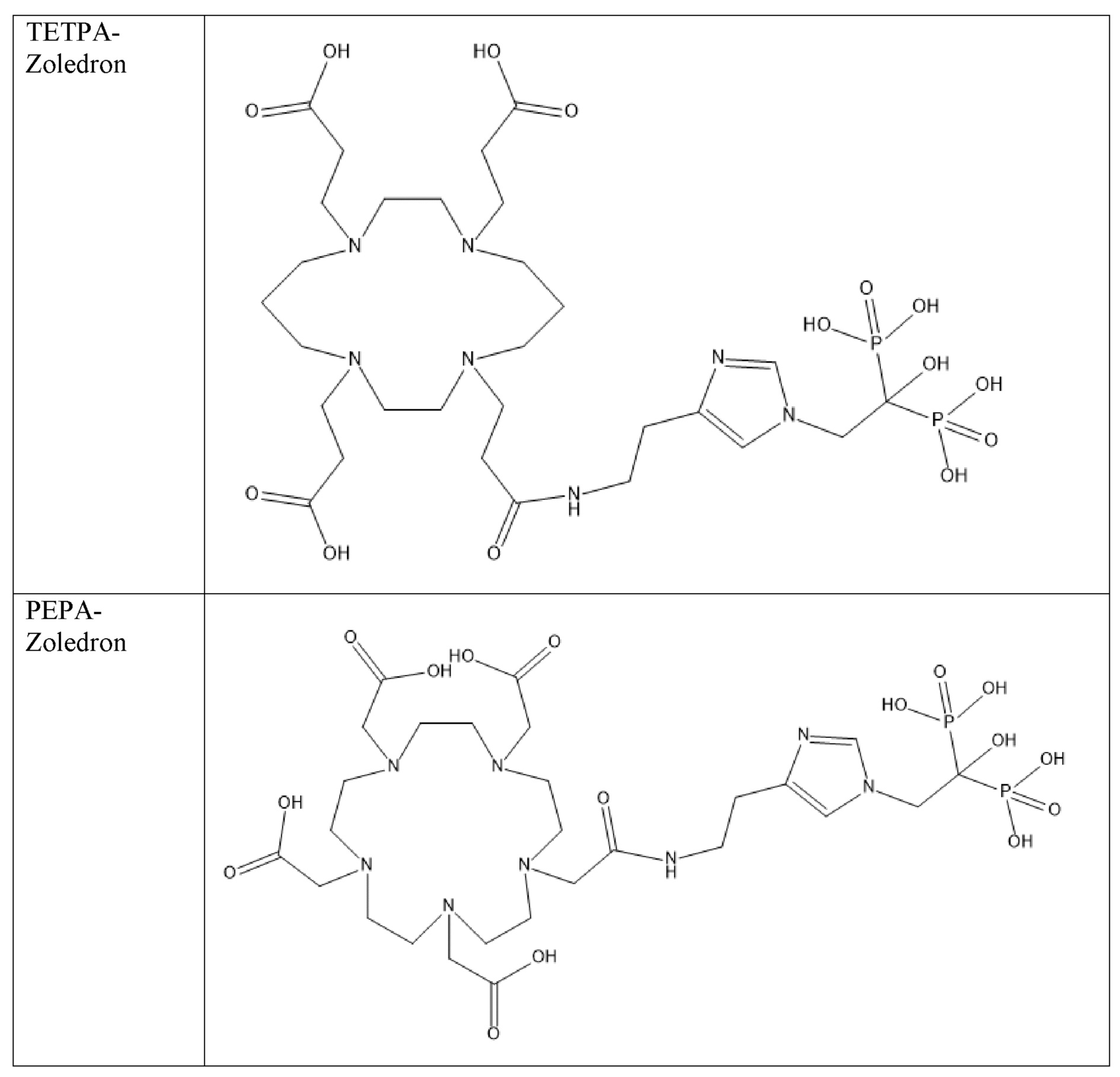
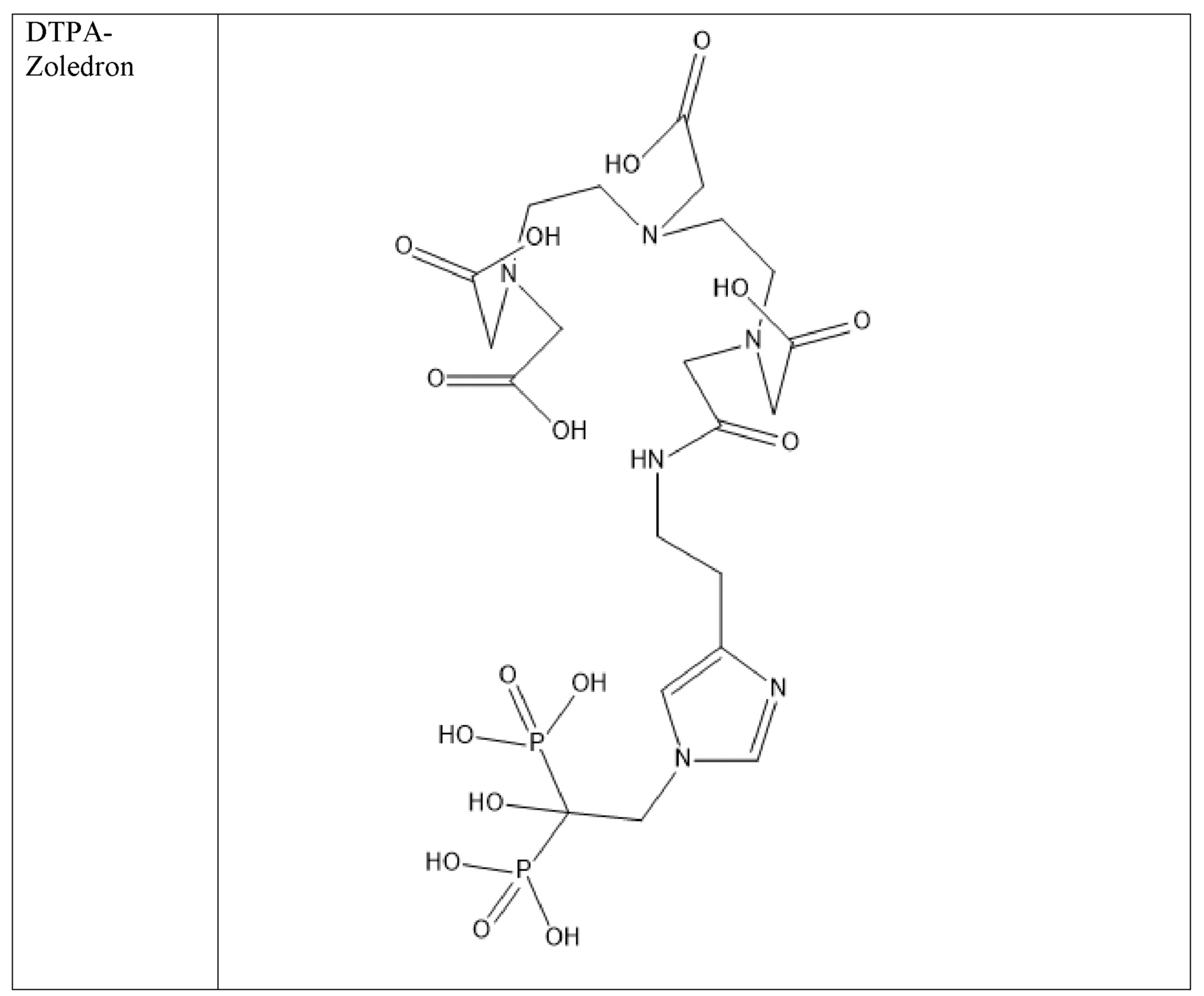
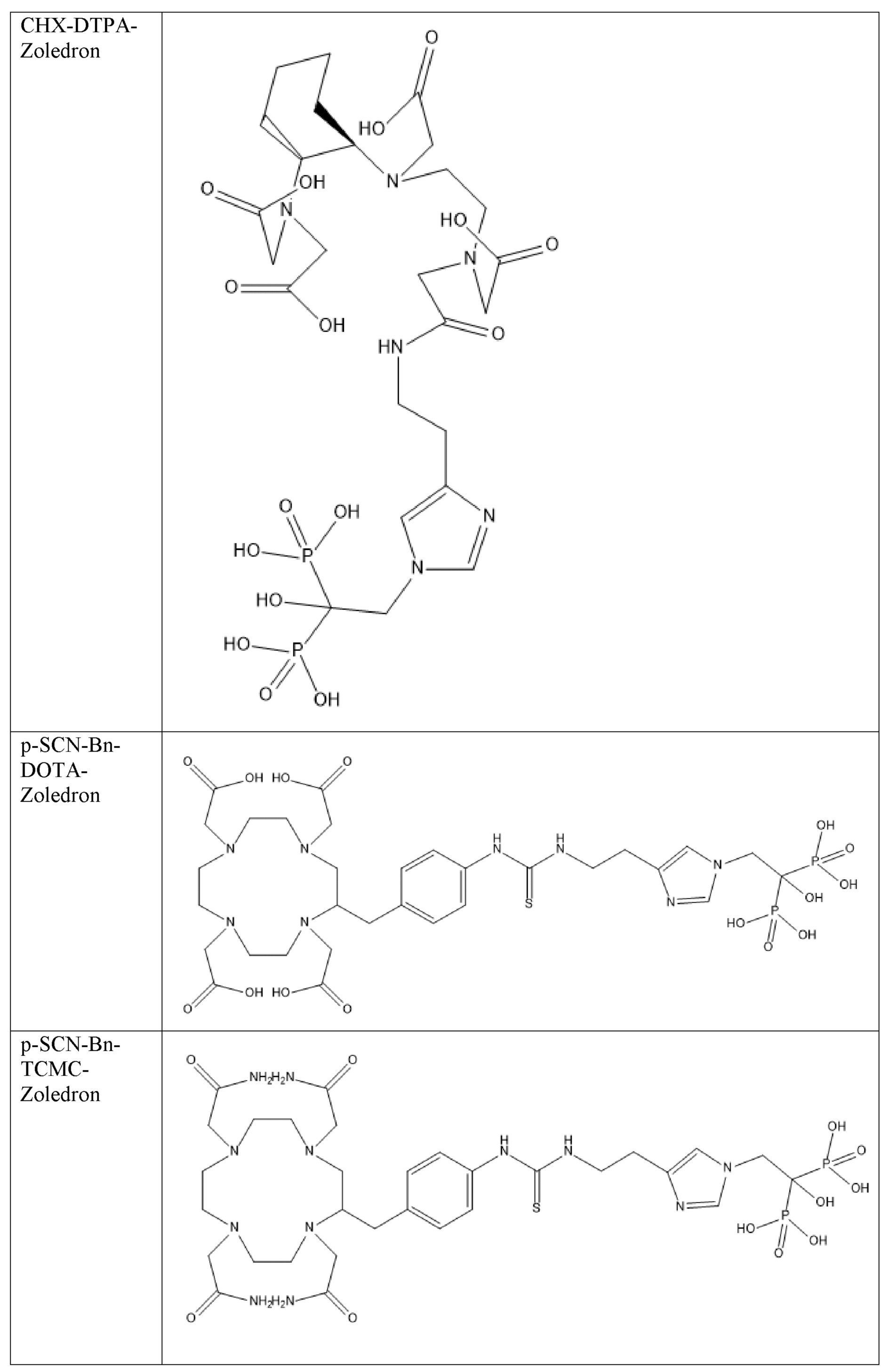
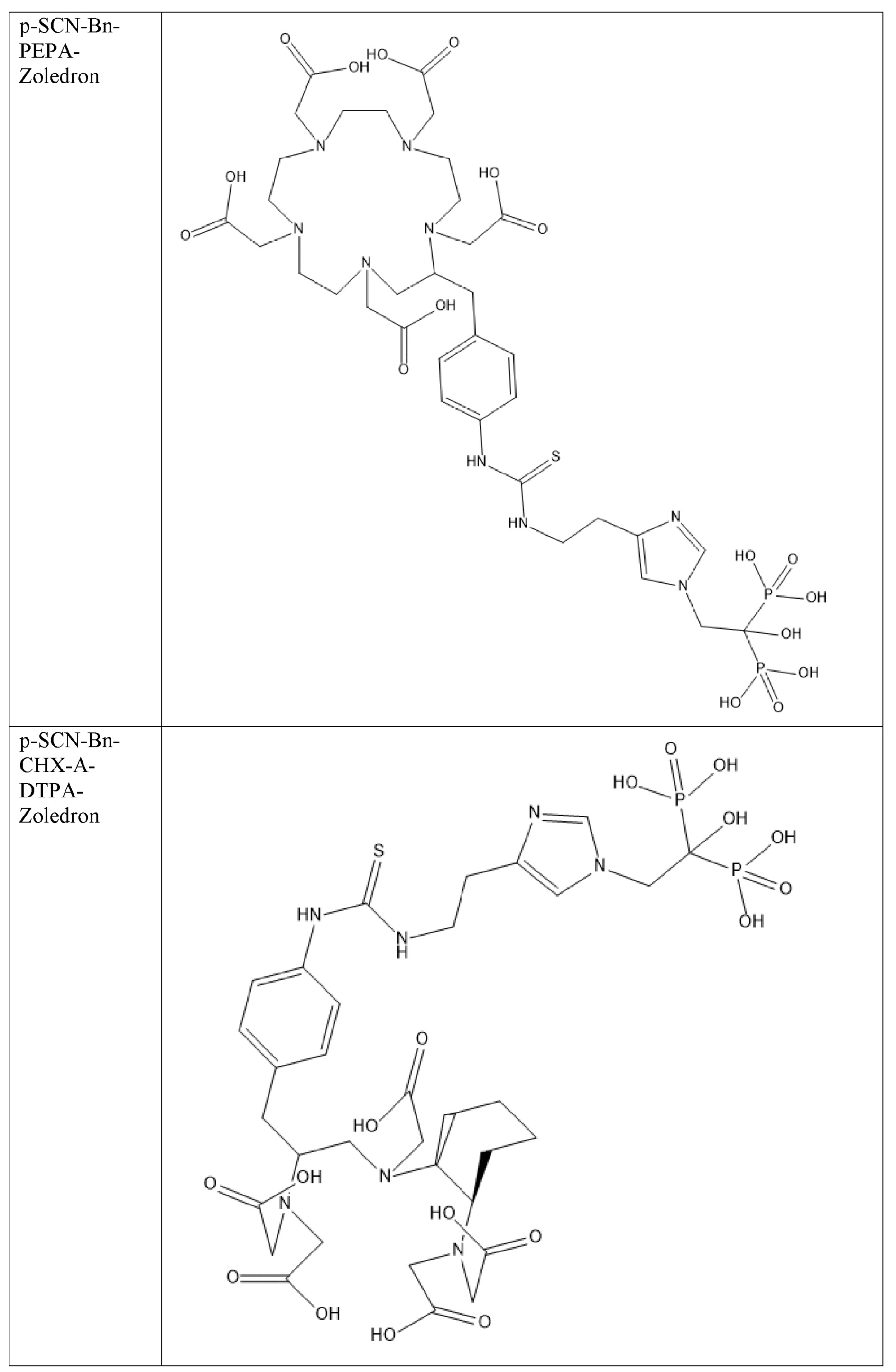
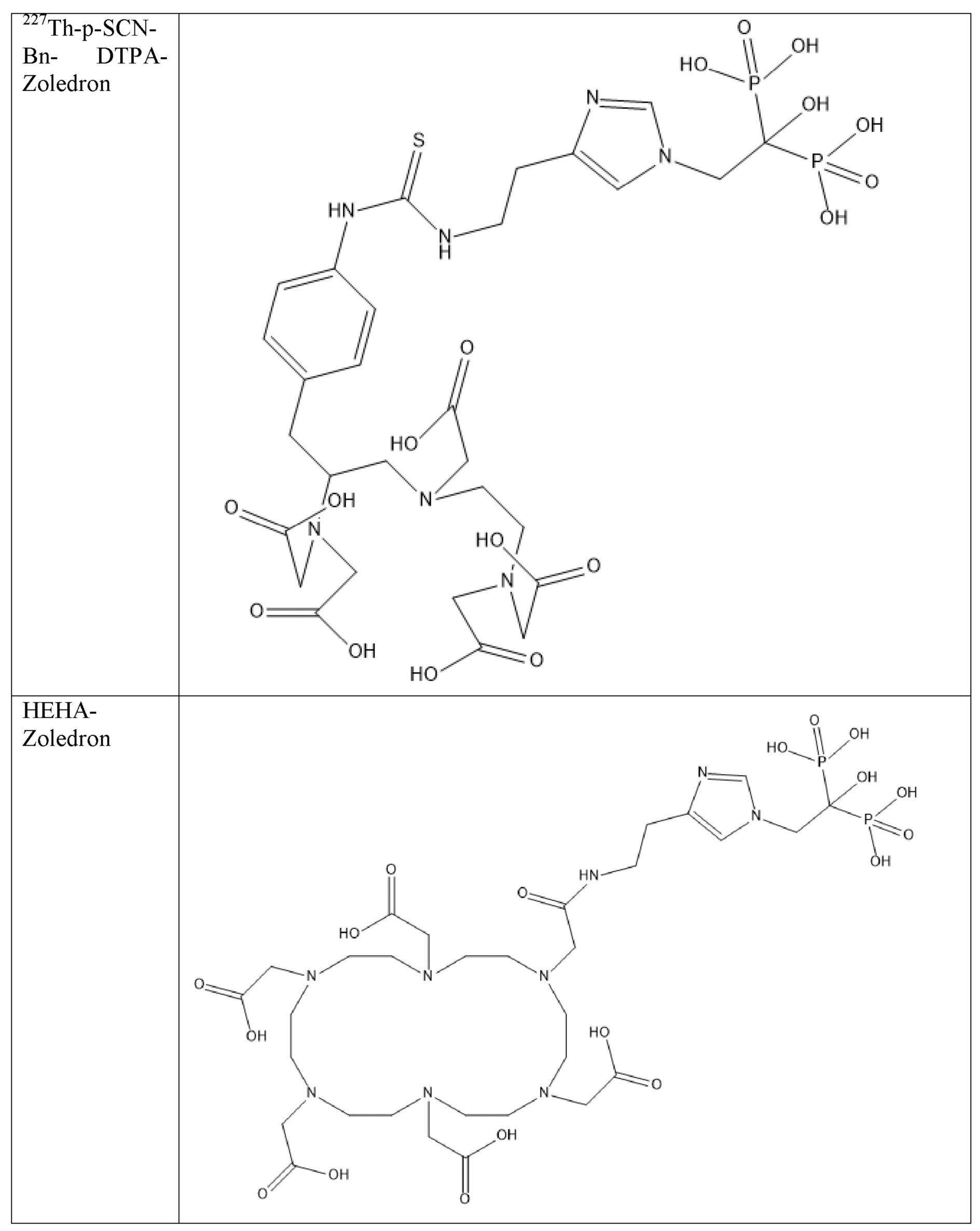
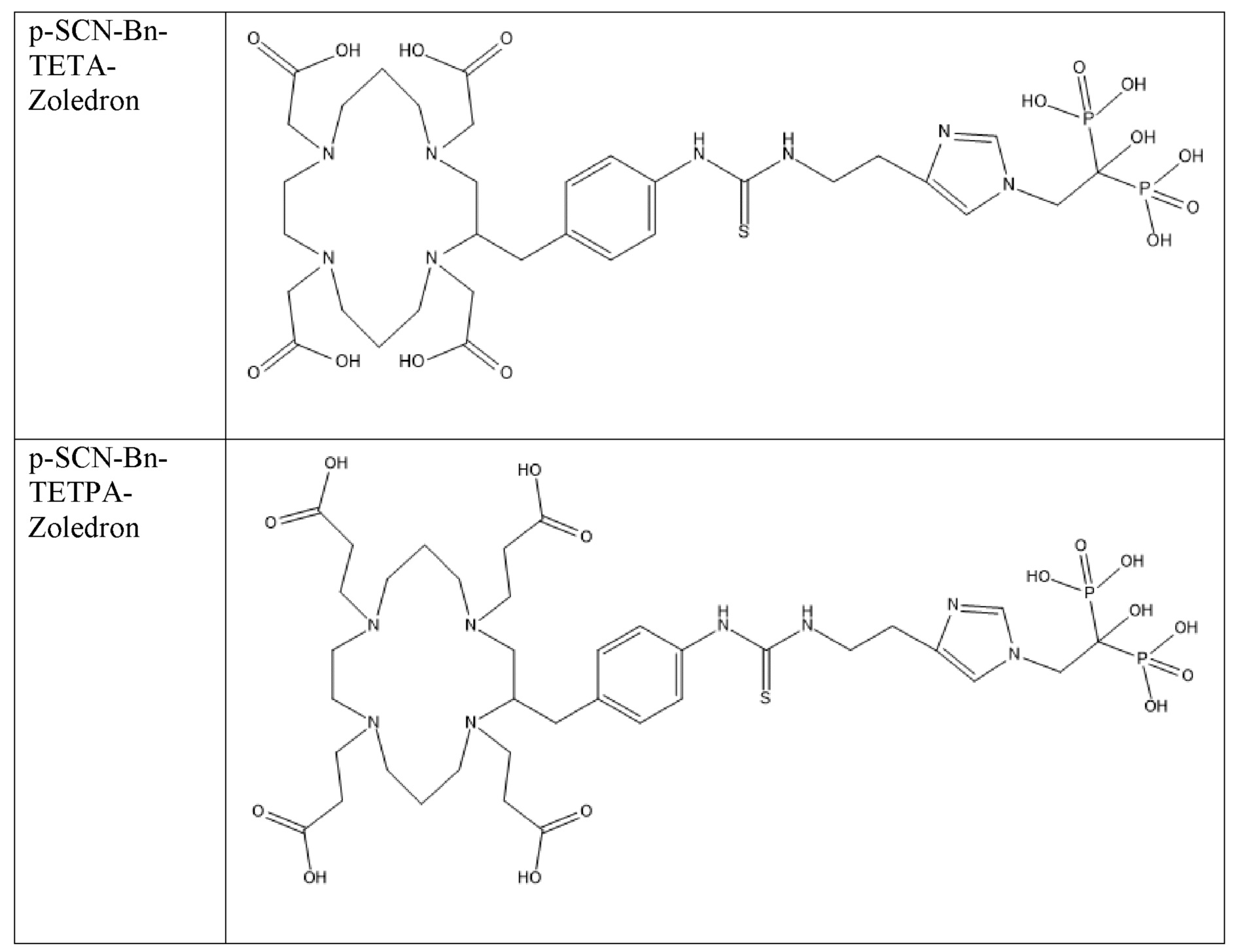
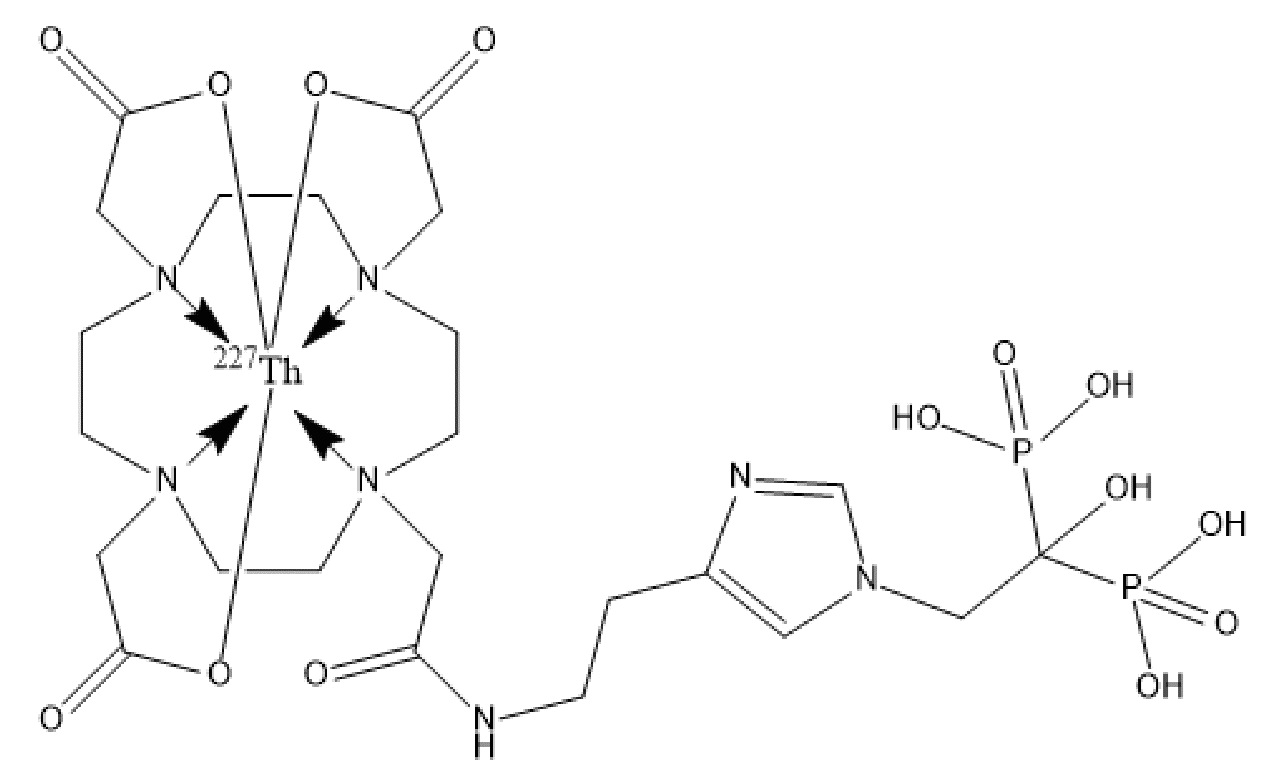
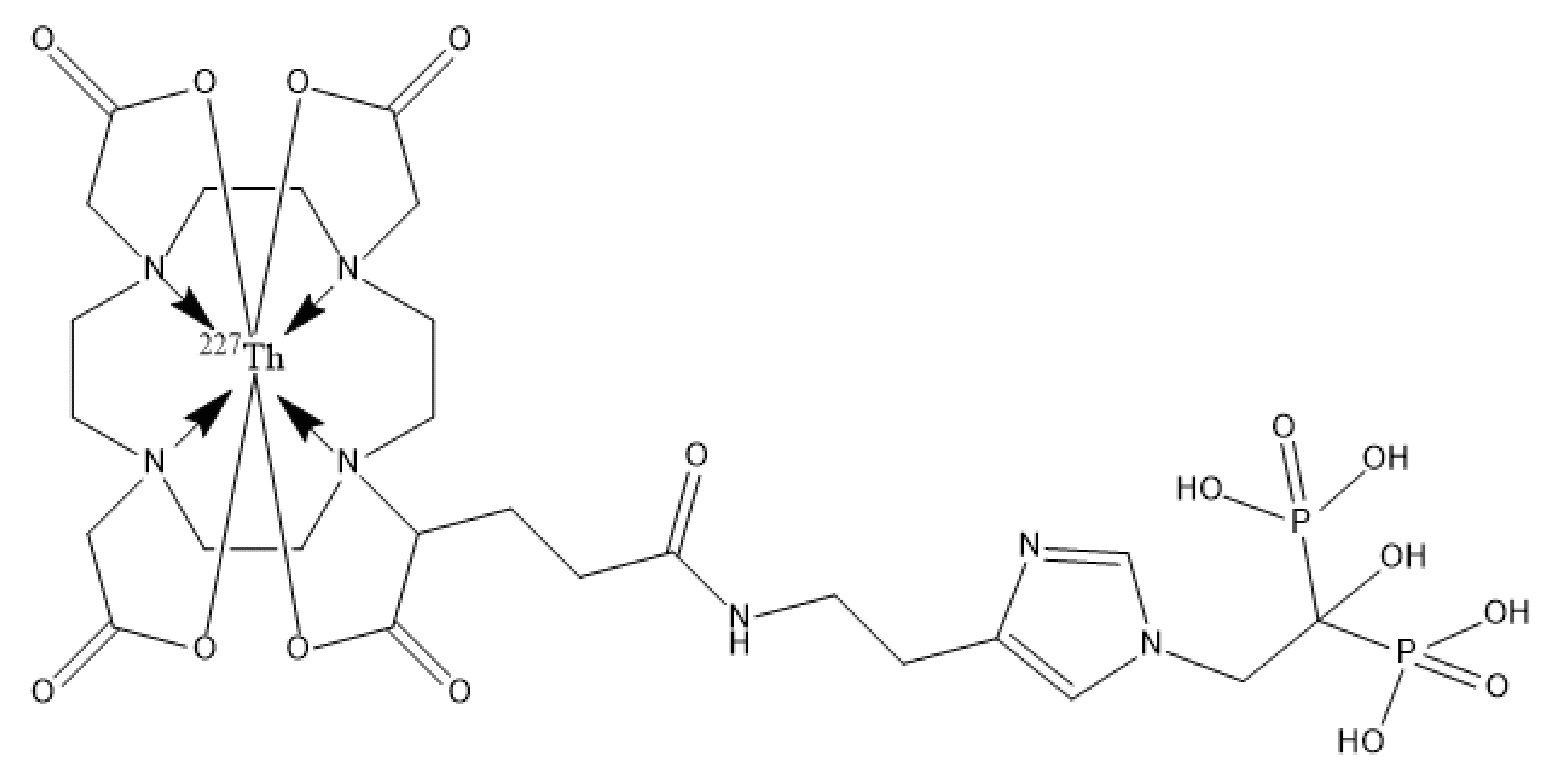
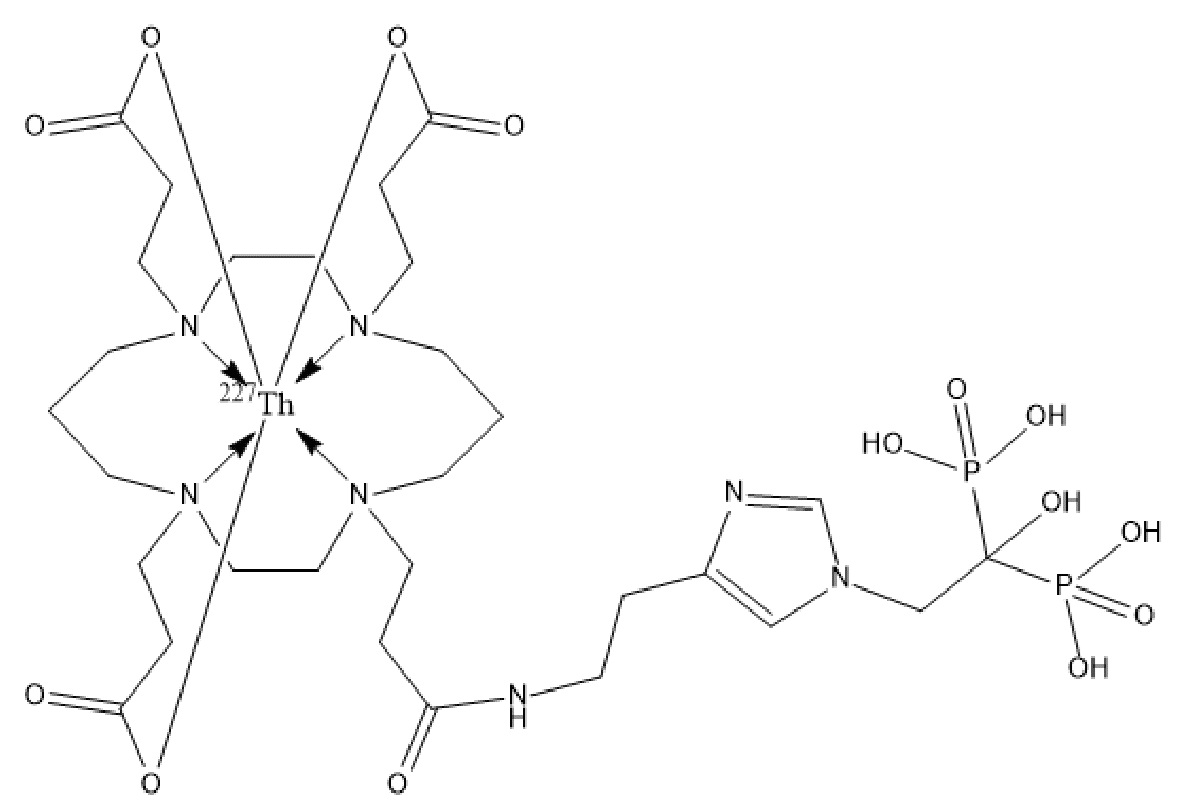
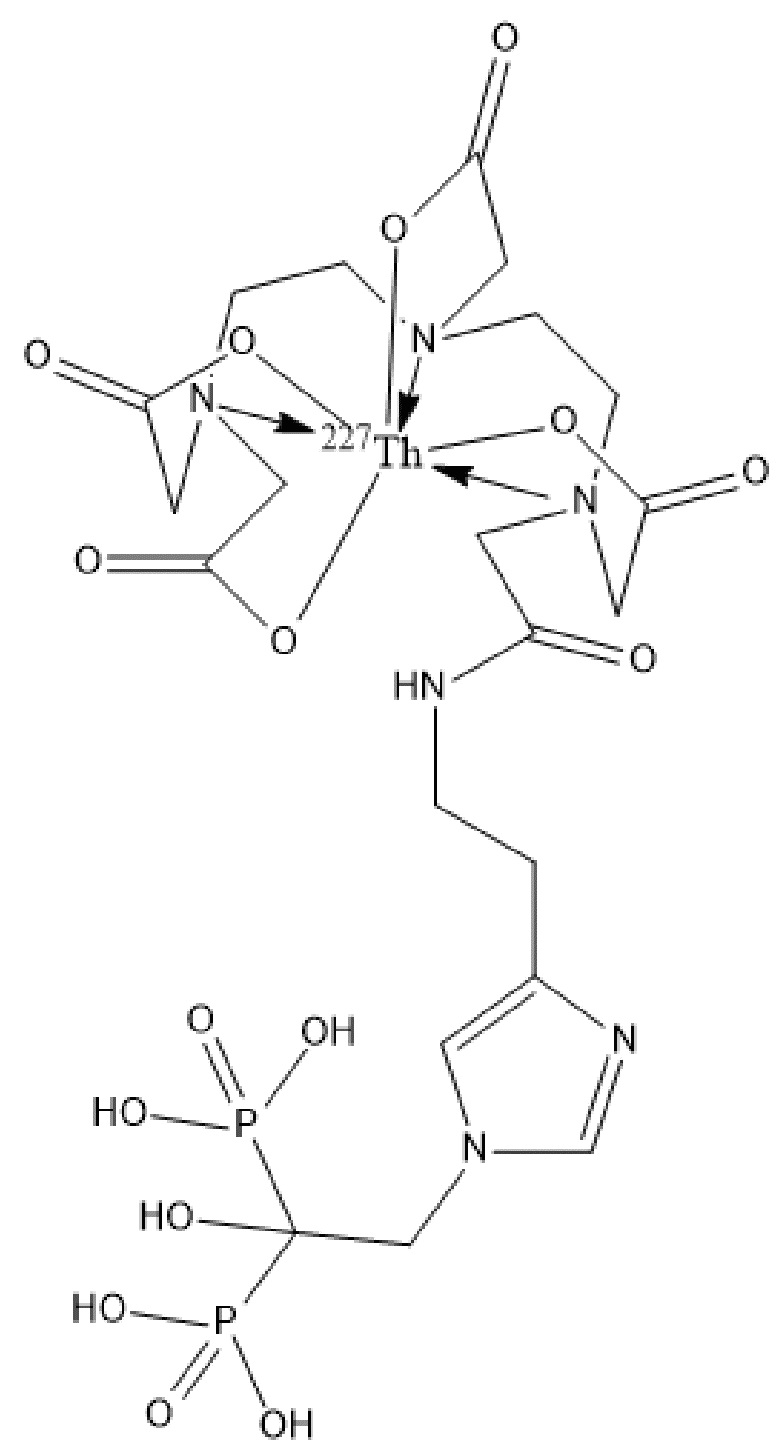
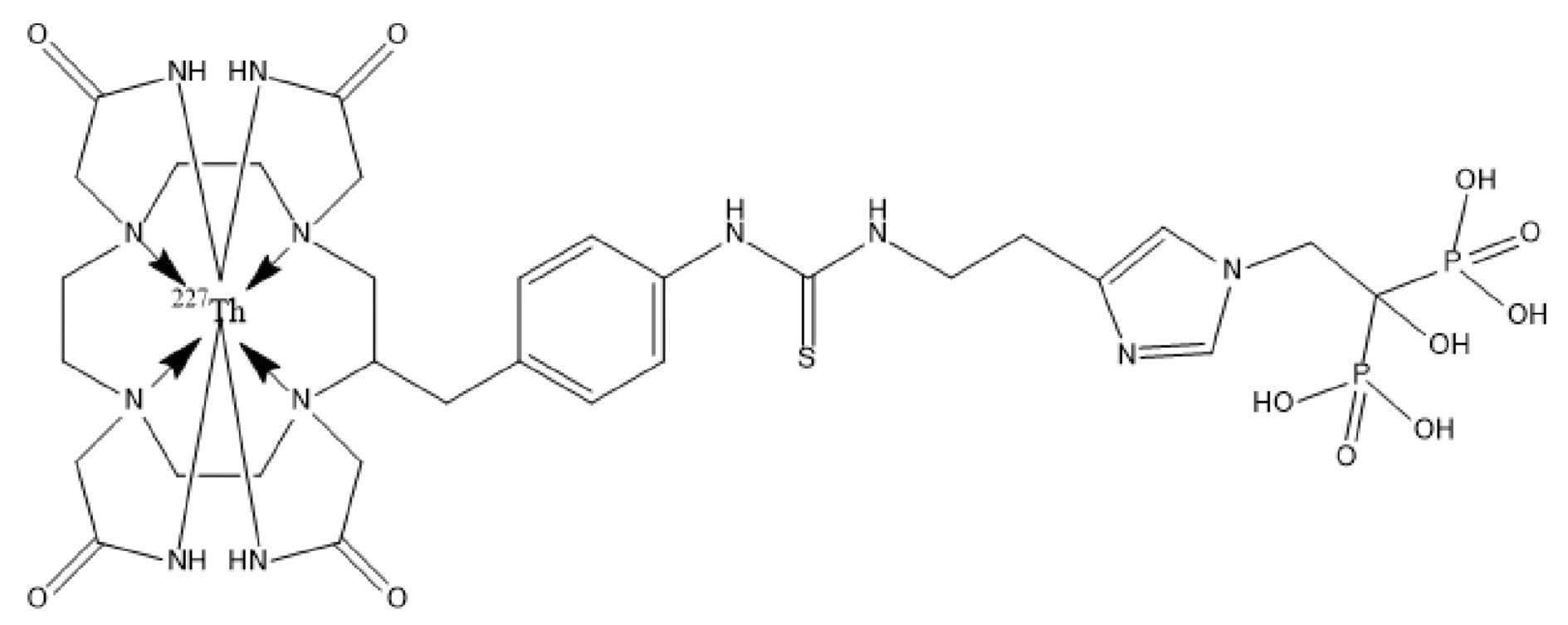
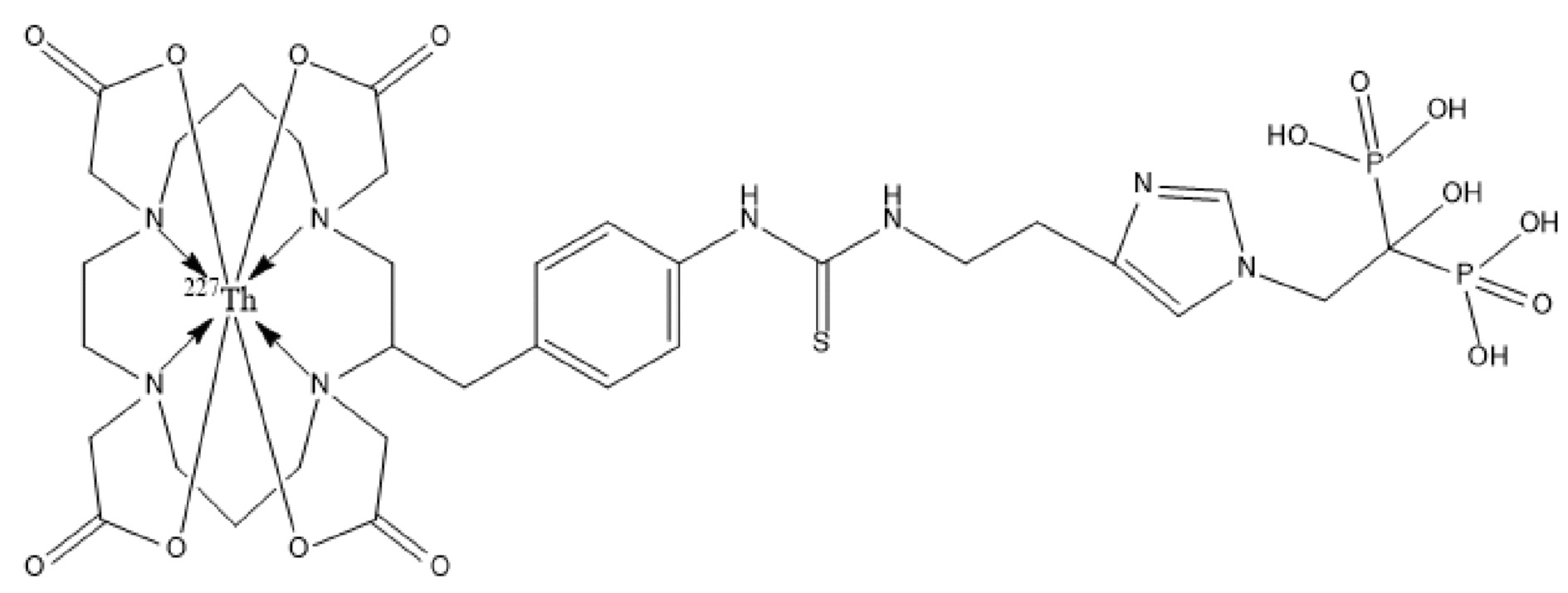
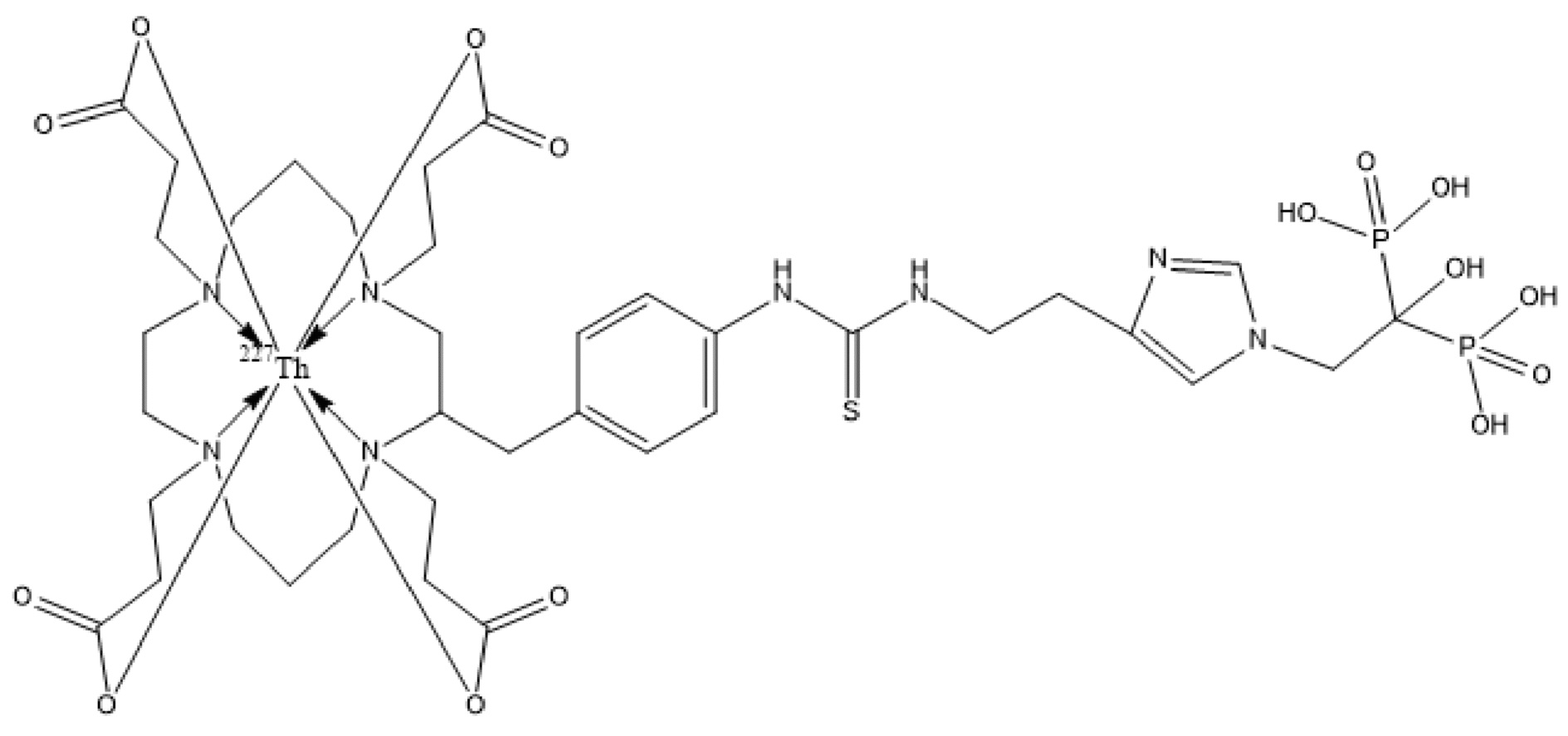
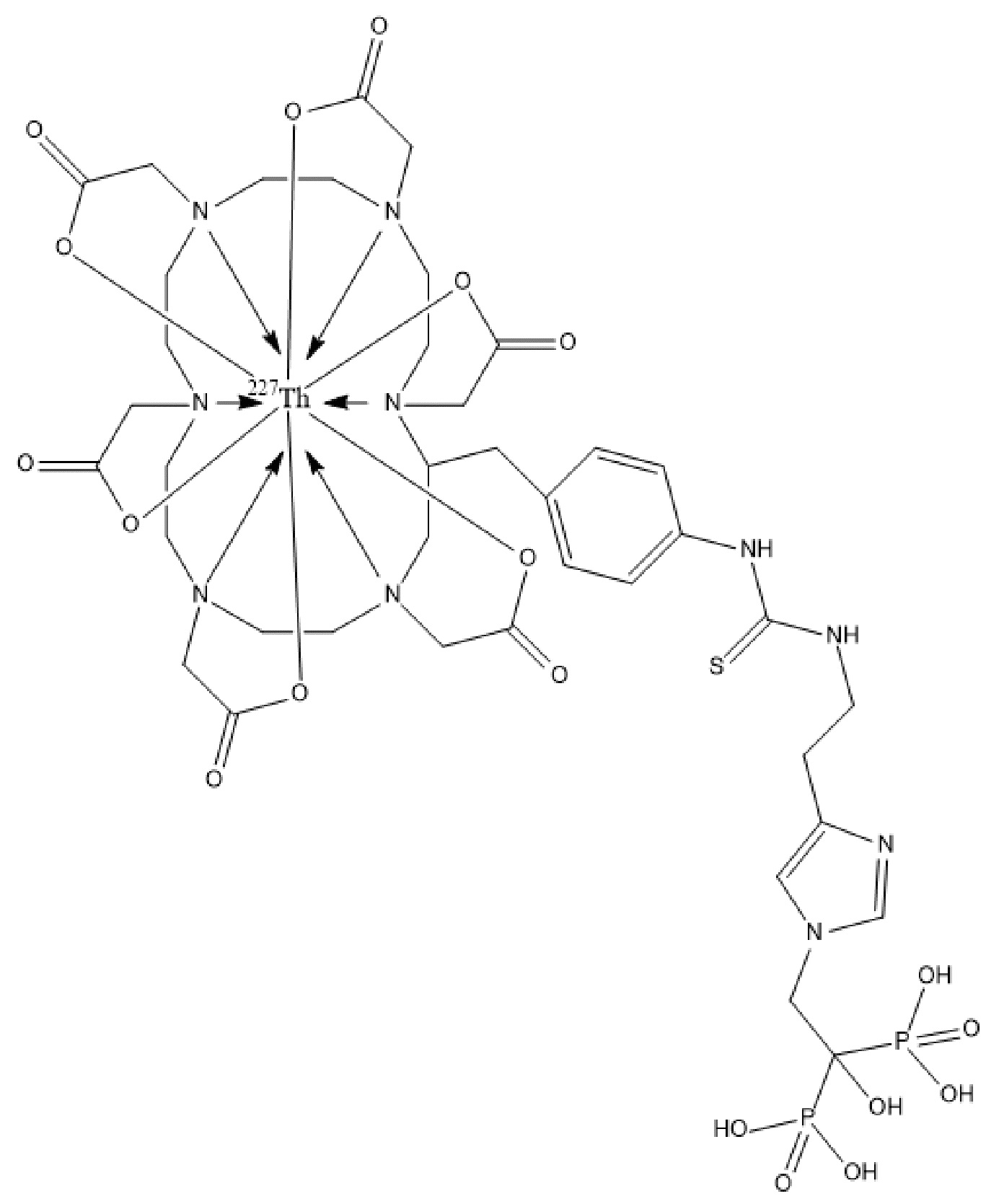
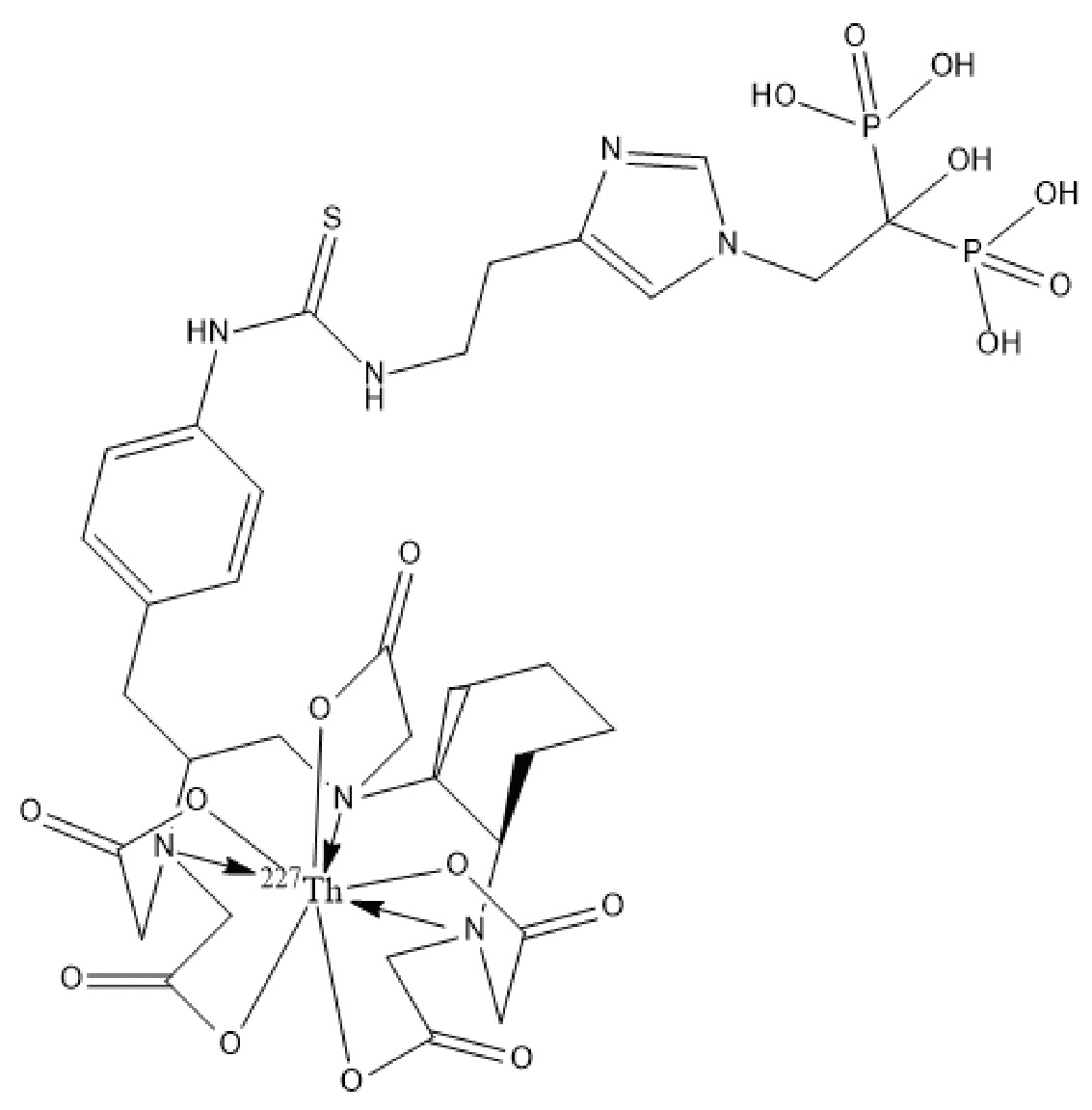
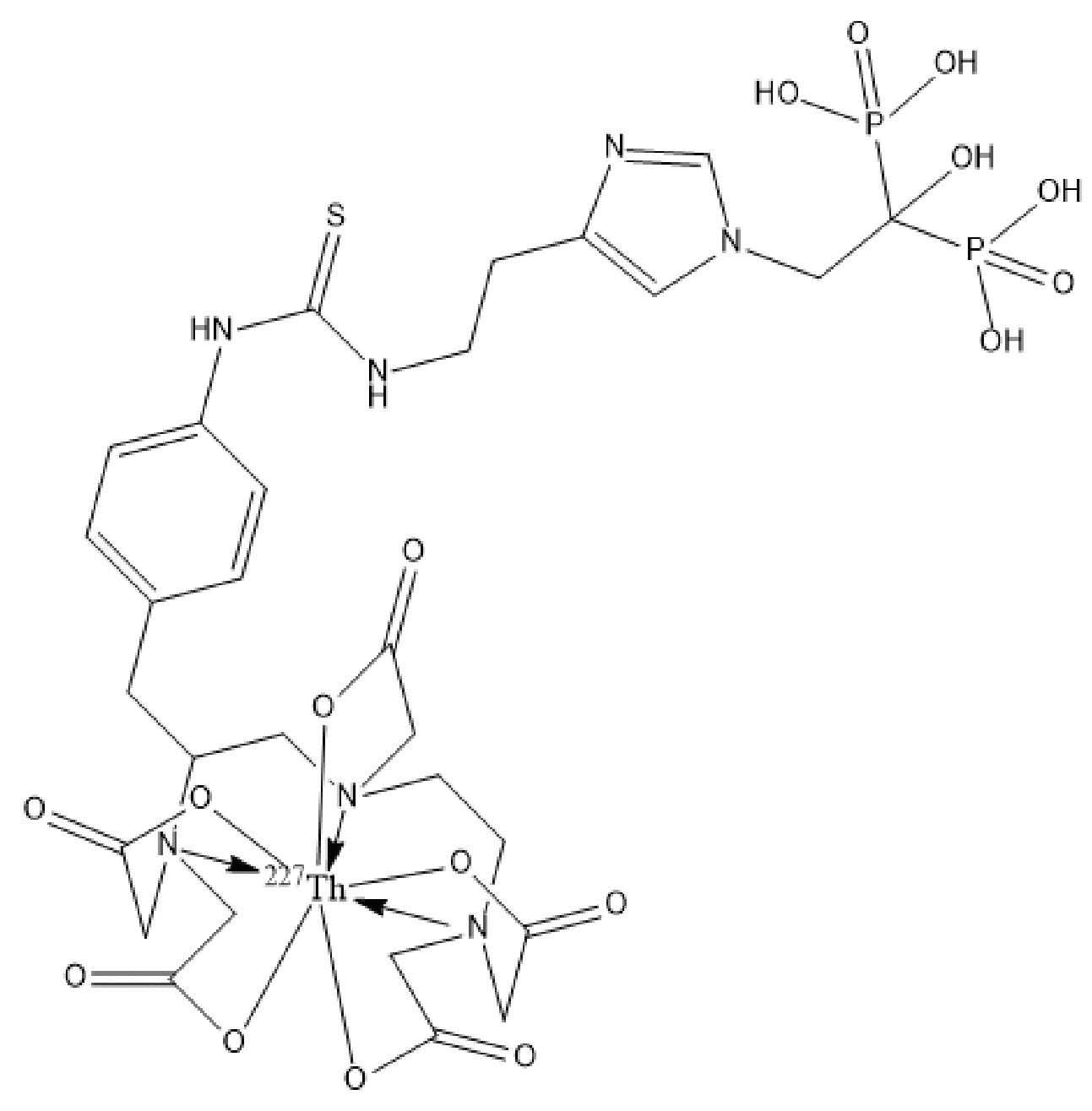
Первым объектом, выносящимся на защиту является комплексное соединение Y общей структуры227Th-Chel-Zoledron, в котором радионуклид227Th входит в состав соединения Y благодаря образованию устойчивых координационных связей с фрагментом Chel. Фрагмент Chel соответствует одному из бифункциональных хелатирующих агентов (DOTA; DOTAGA; TETA; TETPA; HEHA; PEPA; DTPA; CHX-DTPA; p-SCN-Bn-DOTA; p-SCN-Bn-CHX-A-DTPA; -p-SCN-Bn- DTPA;p-SCN-Bn-TCMC; p-SCN-Bn-TETA; p-SCN-Bn-TETPA; p-SCN-Bn-HEHA; p-SCN-Bn-PEPA) и ковалентно связан с аминогруппой фрагмента Zoledron (таблица 2).
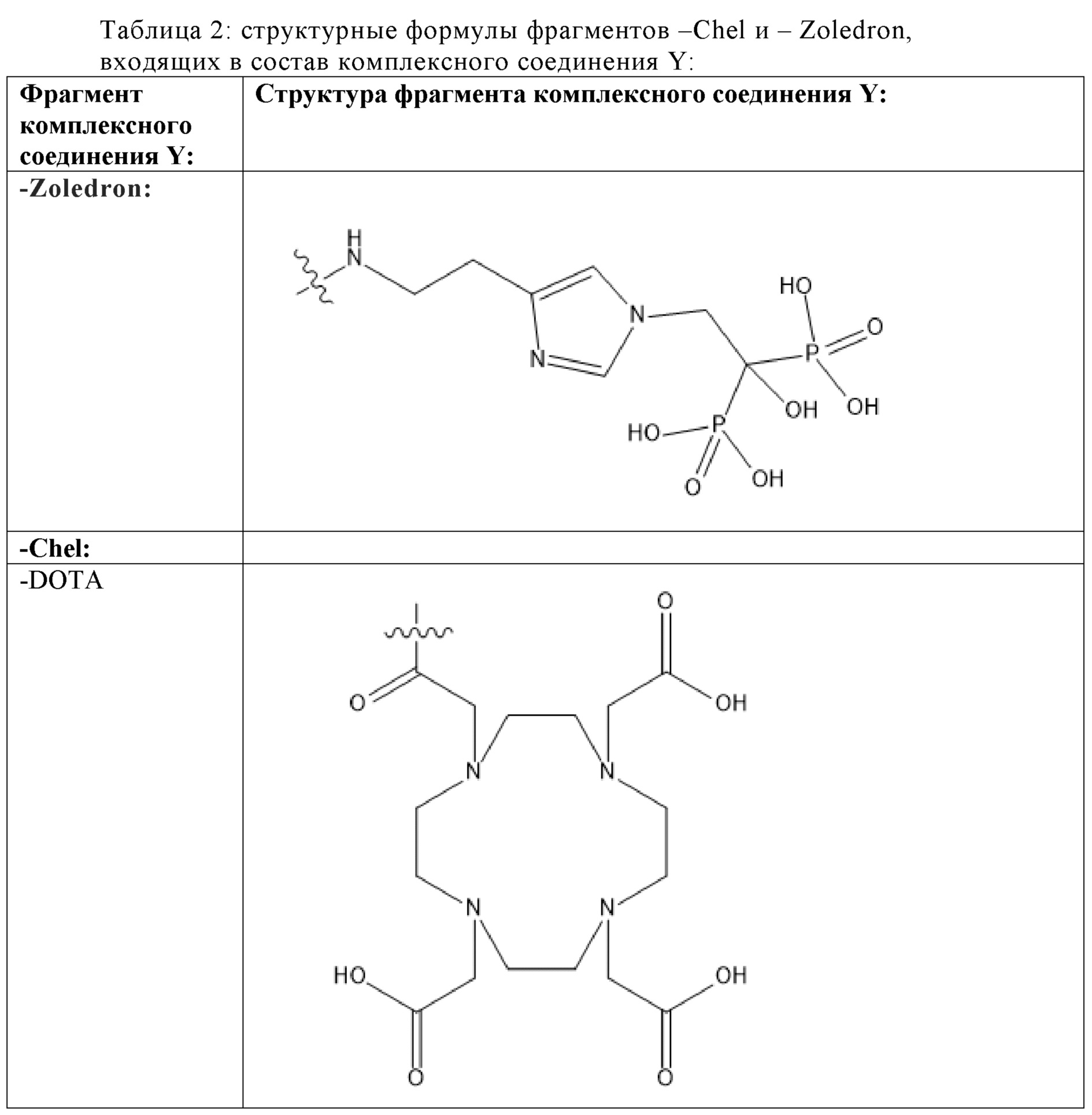
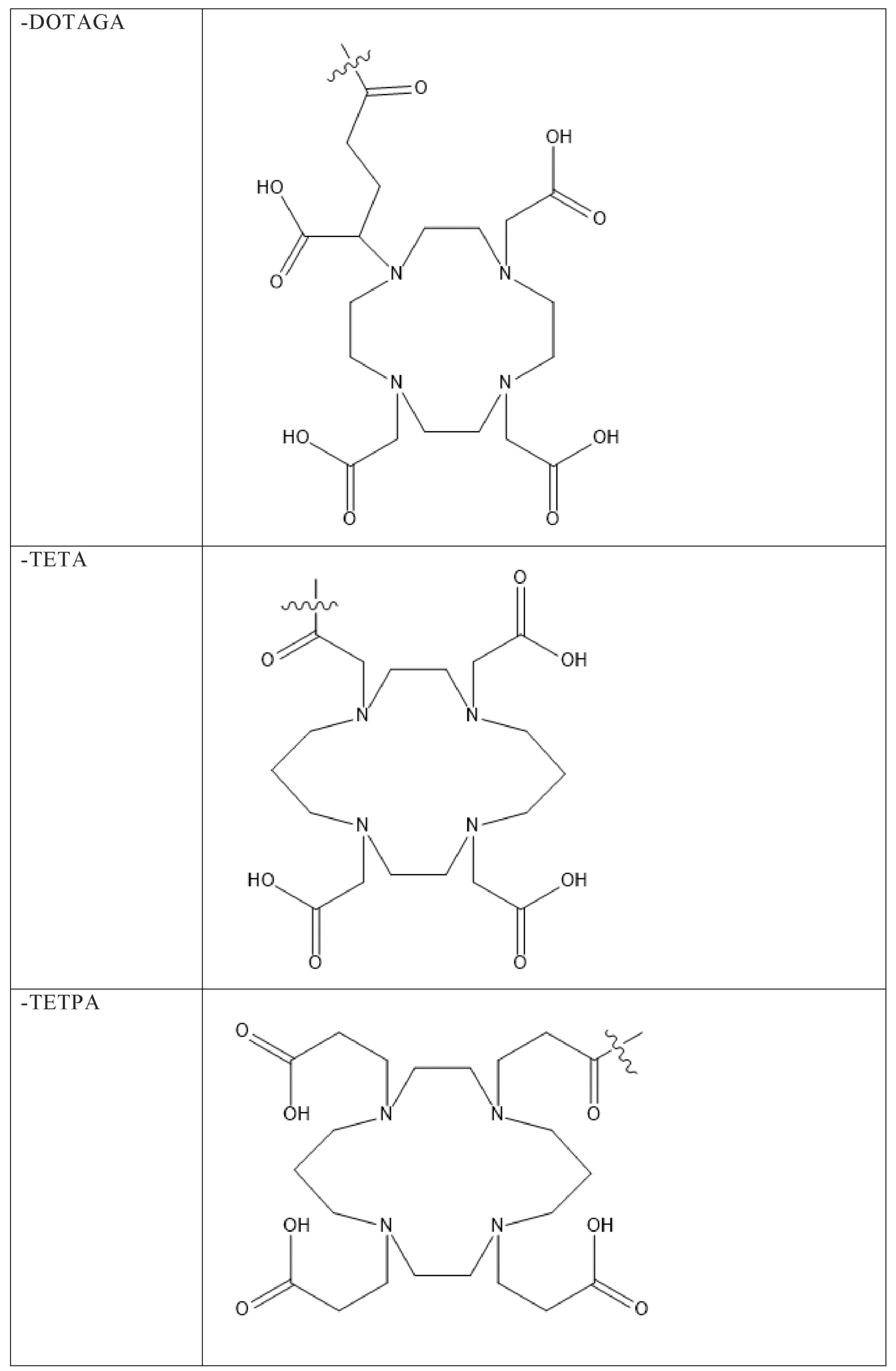
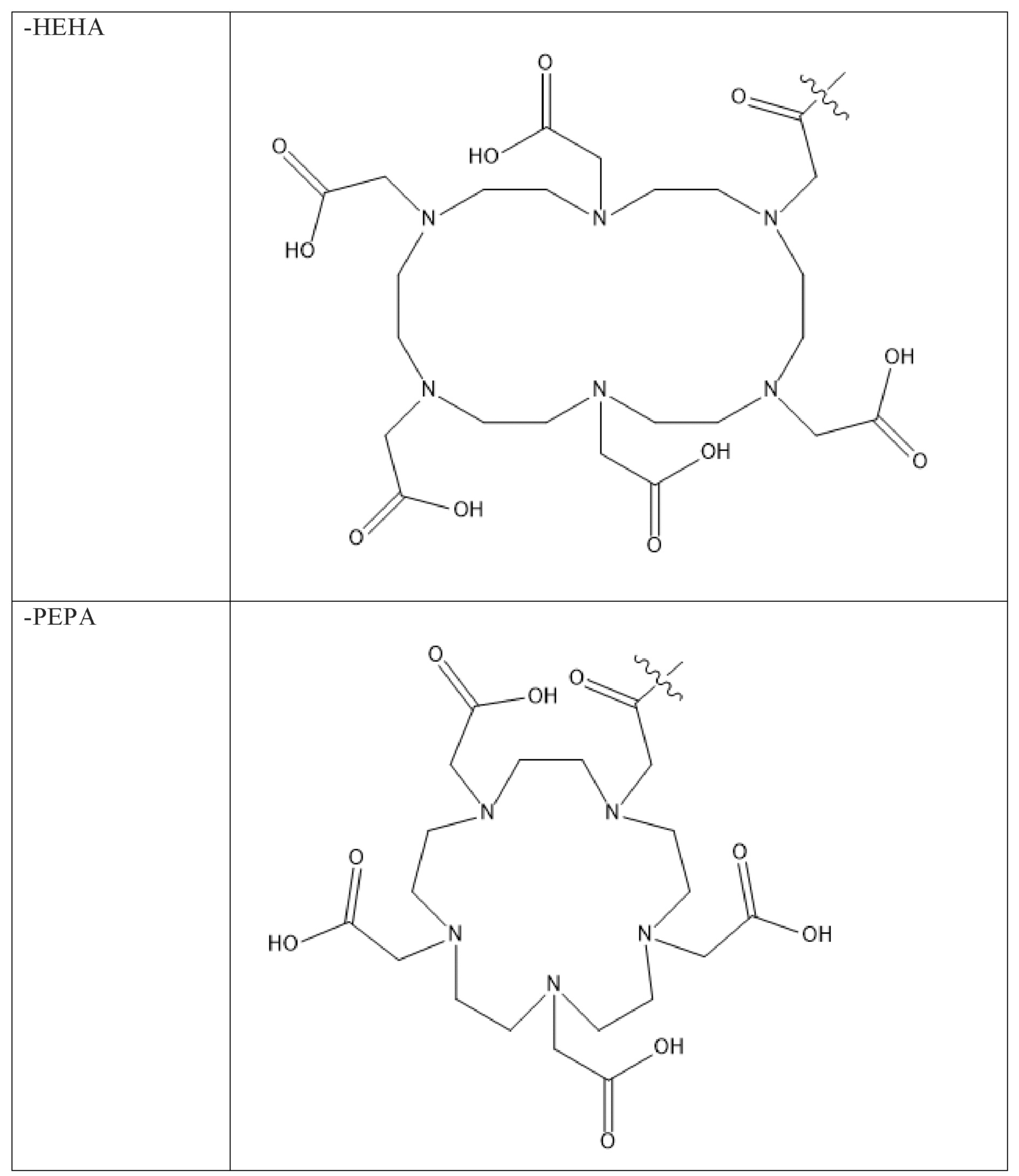

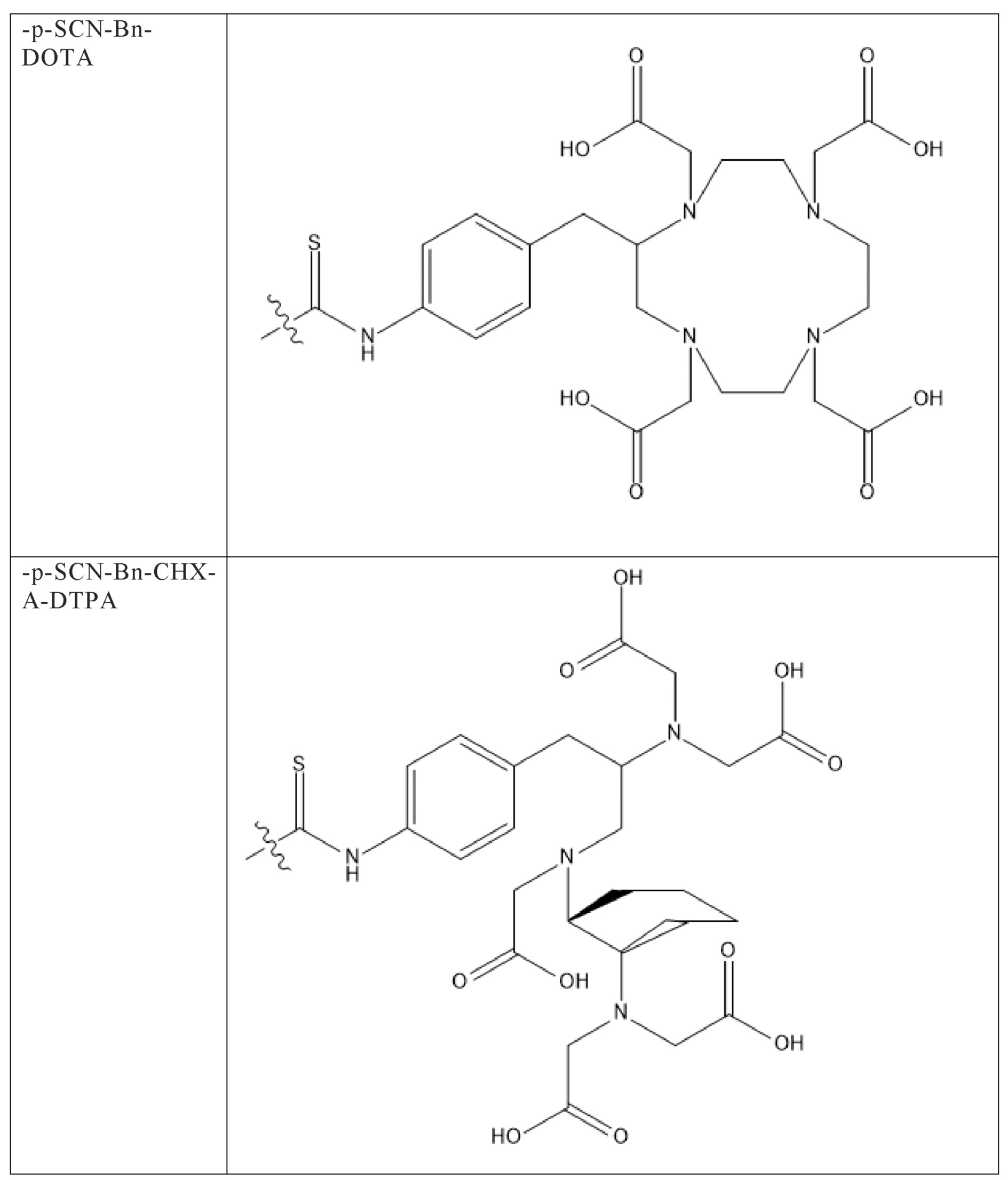
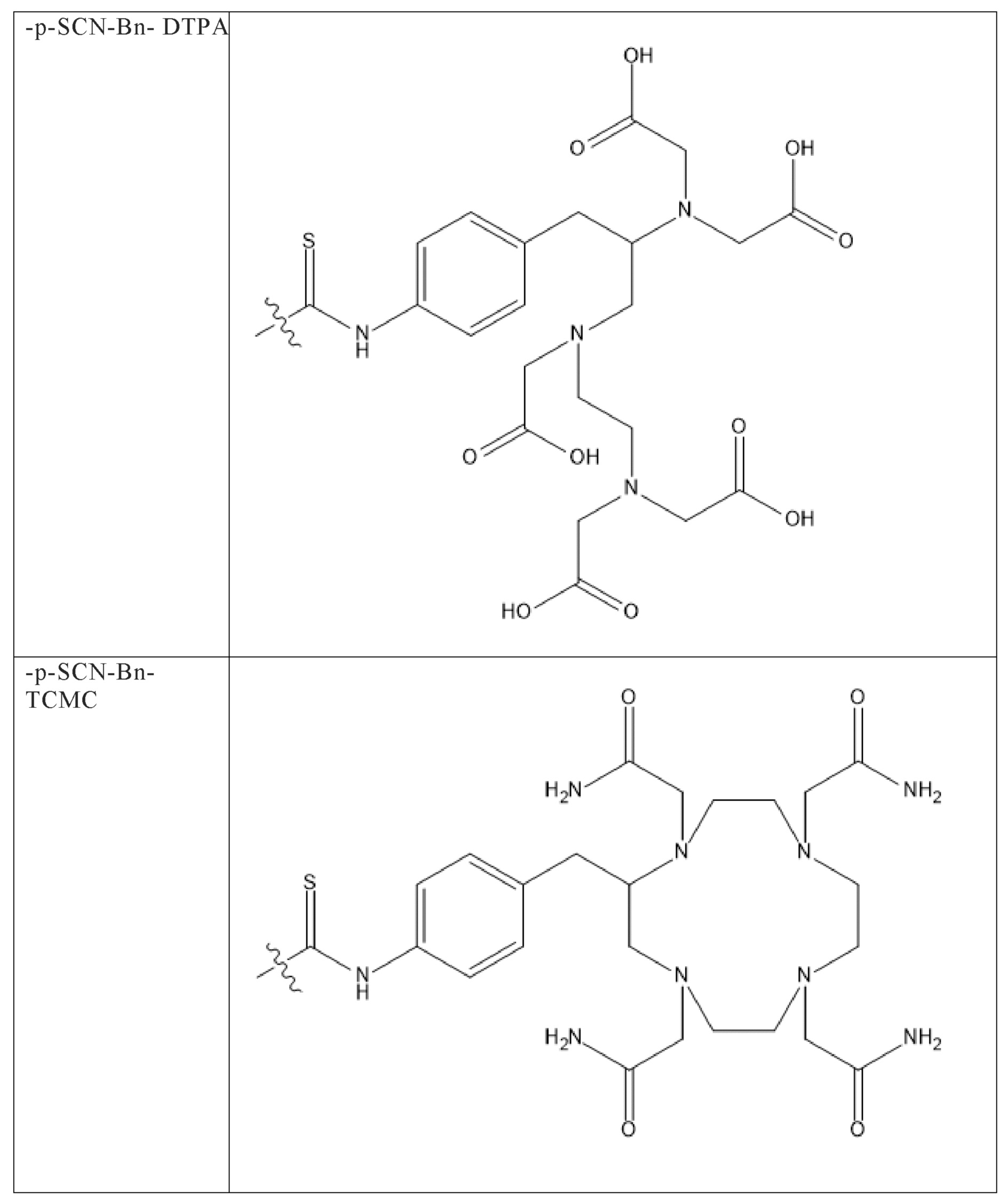
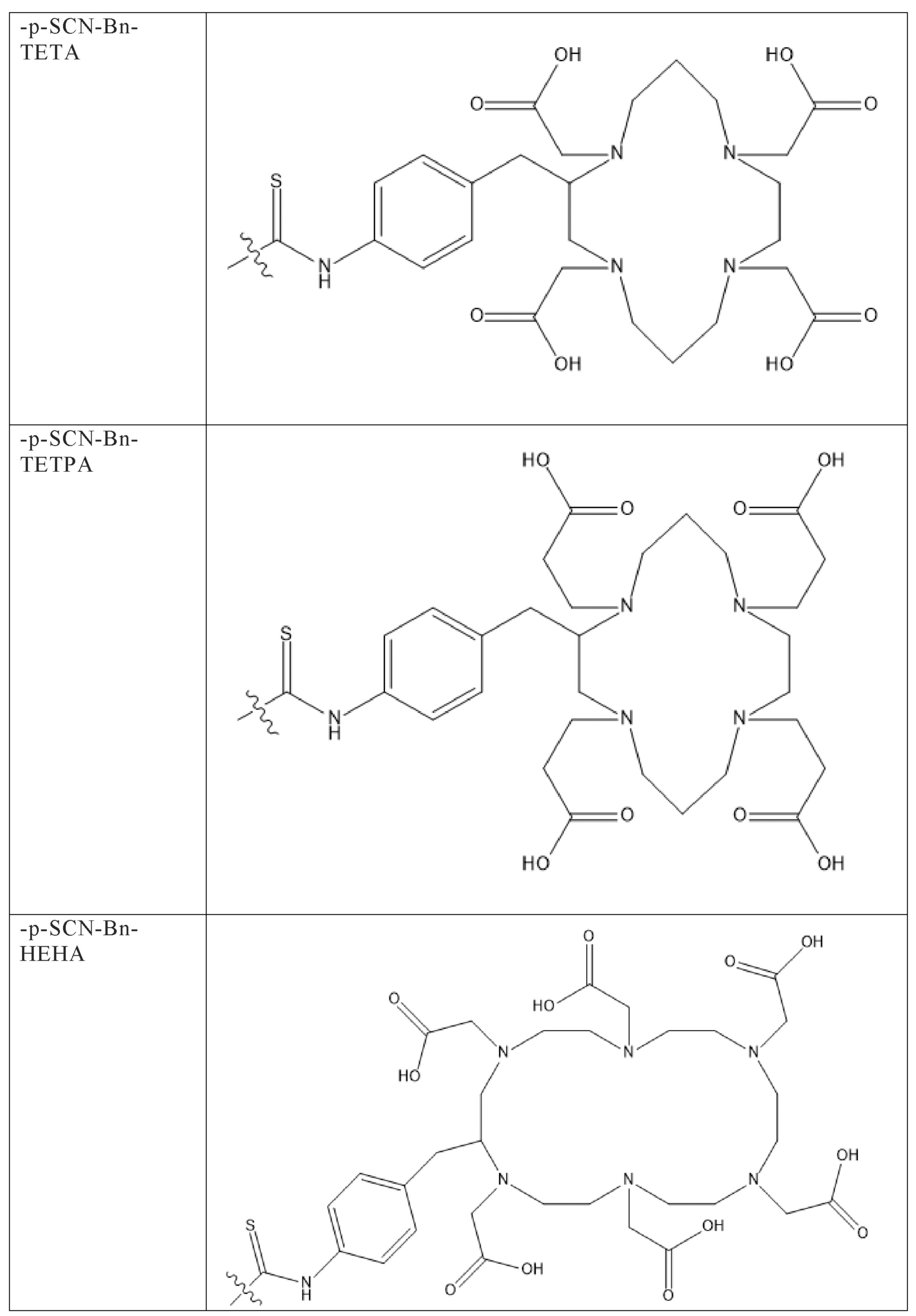
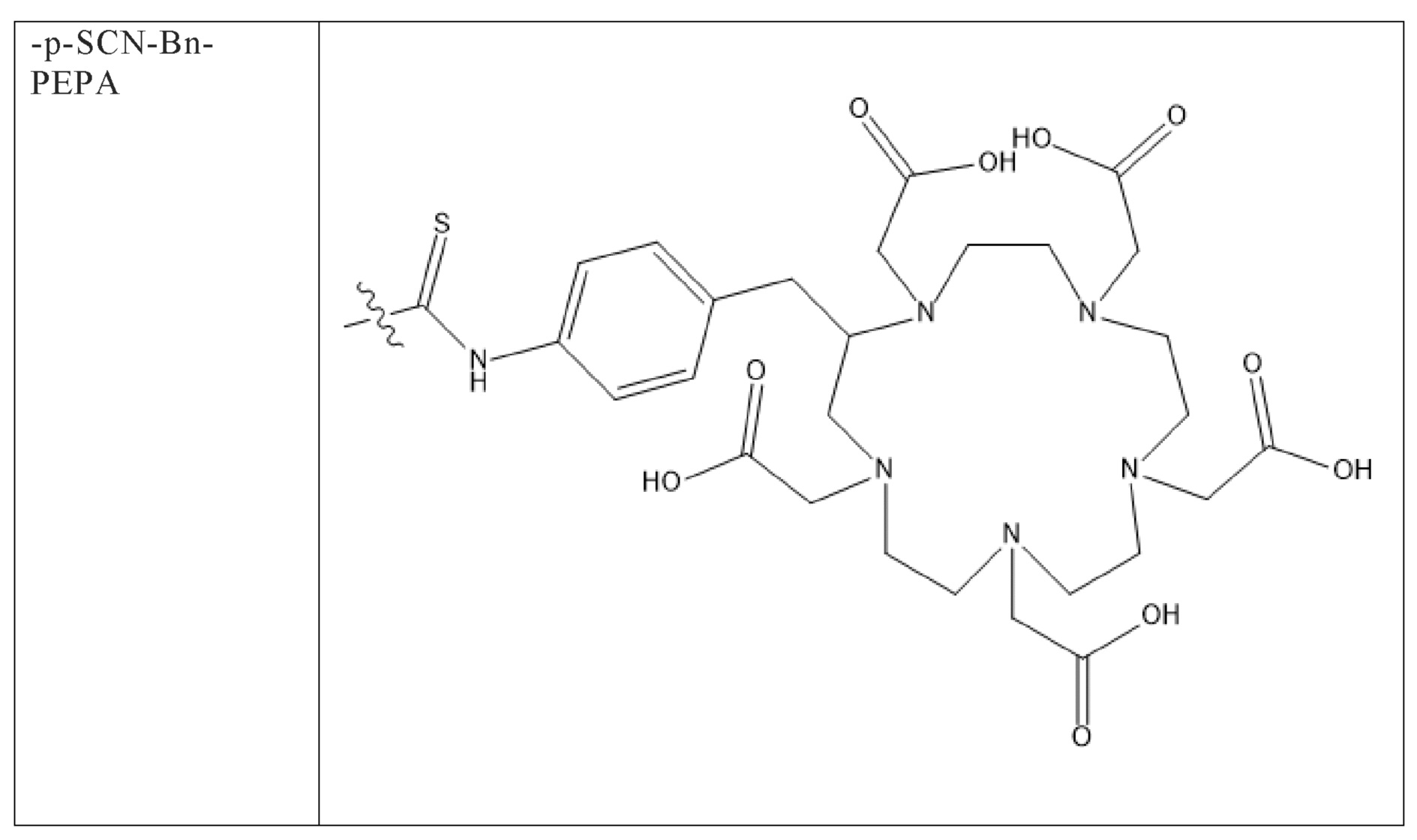
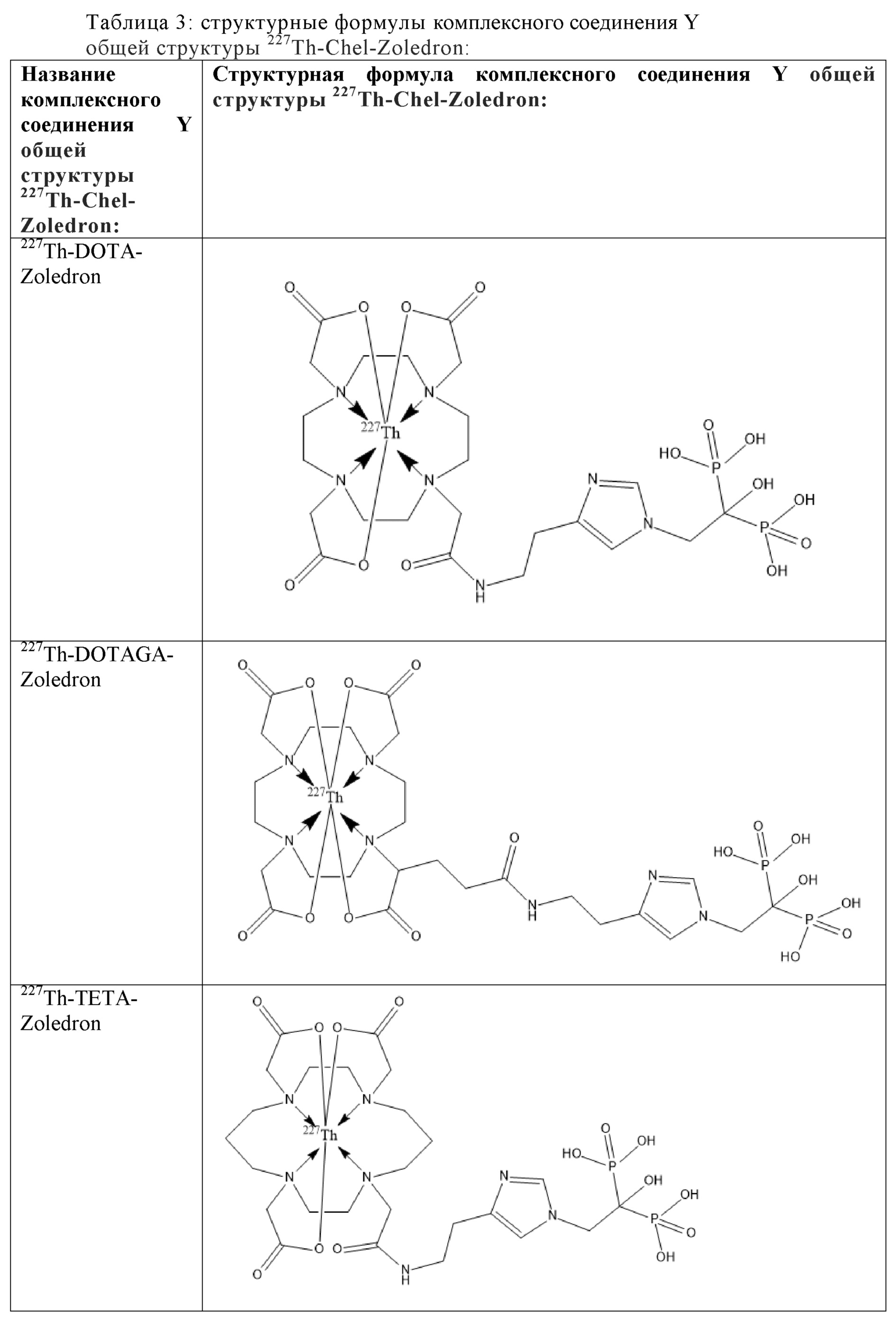
Все вышеуказанные фрагменты –Chel-Zoledron способны образовывать устойчивые комплексы с радионуклидами, в частности с радионуклидом227Th, формируя комплексное соединение Y общей структуры227Th-Chel-Zoledron (таблица 3):
Таким образом, заявляемое на защиту комплексное соединение Y представляет из себя молекулу, состоящую из фрагмента – Zoledron, содержащего в своем составе участок, соответствующий золедроновой кислоте, за счет которого осуществляется инкорпорирование комплексного соединения Y в состав костного матрикса, а также потенциальное антирезобрционное действие, фрагмента –Chel, соответствующего одному из бифункциональных хелатирующих агентов, представленных в таблице 2, и обеспечивающего включение в состав комплексного соединения Y радионуклида227Th и радионуклида227Th, эмиттирующего α-частицы и распадающегося в радионуклид223Ra с периодом полураспада 18,7 суток.
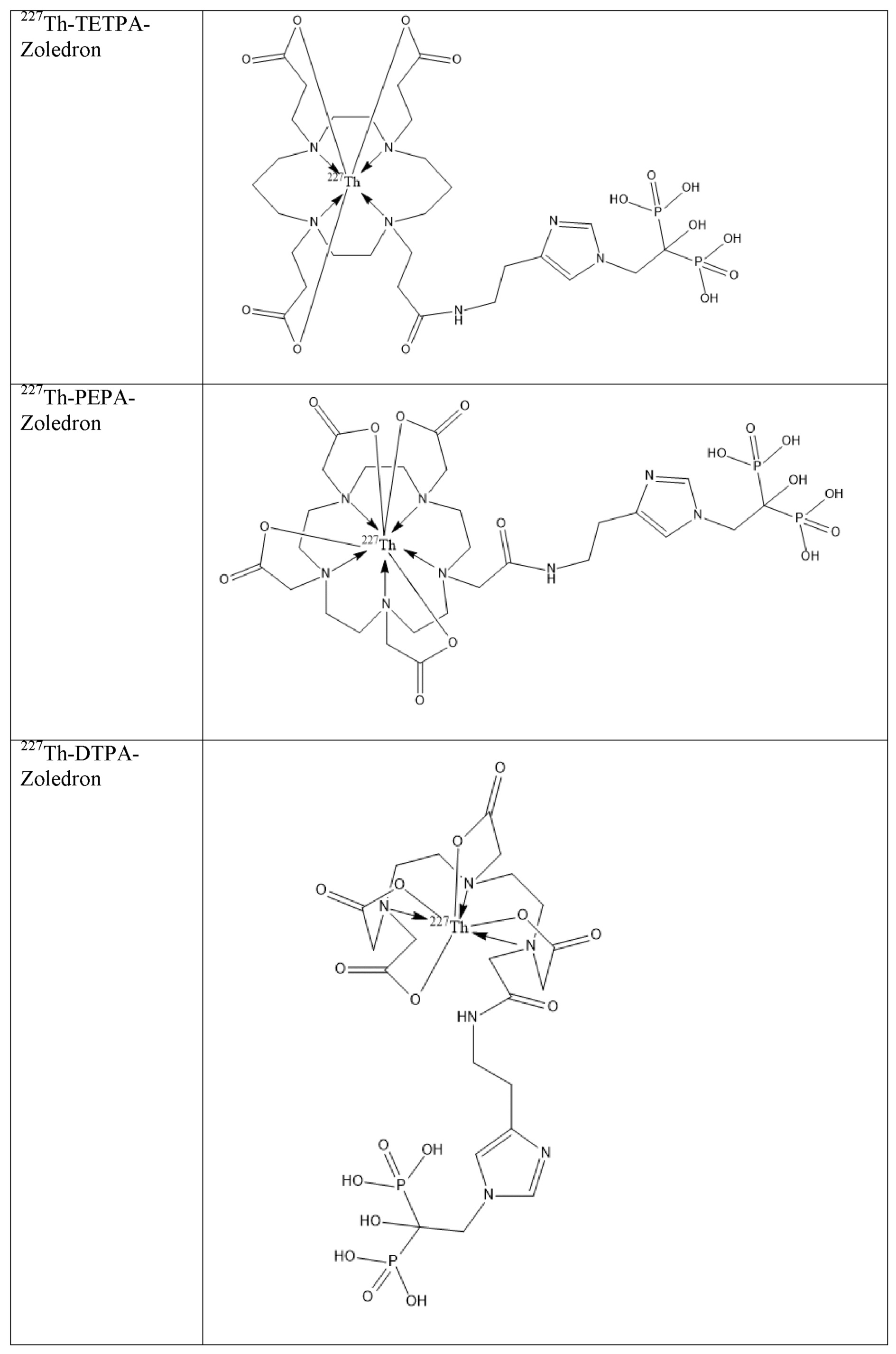
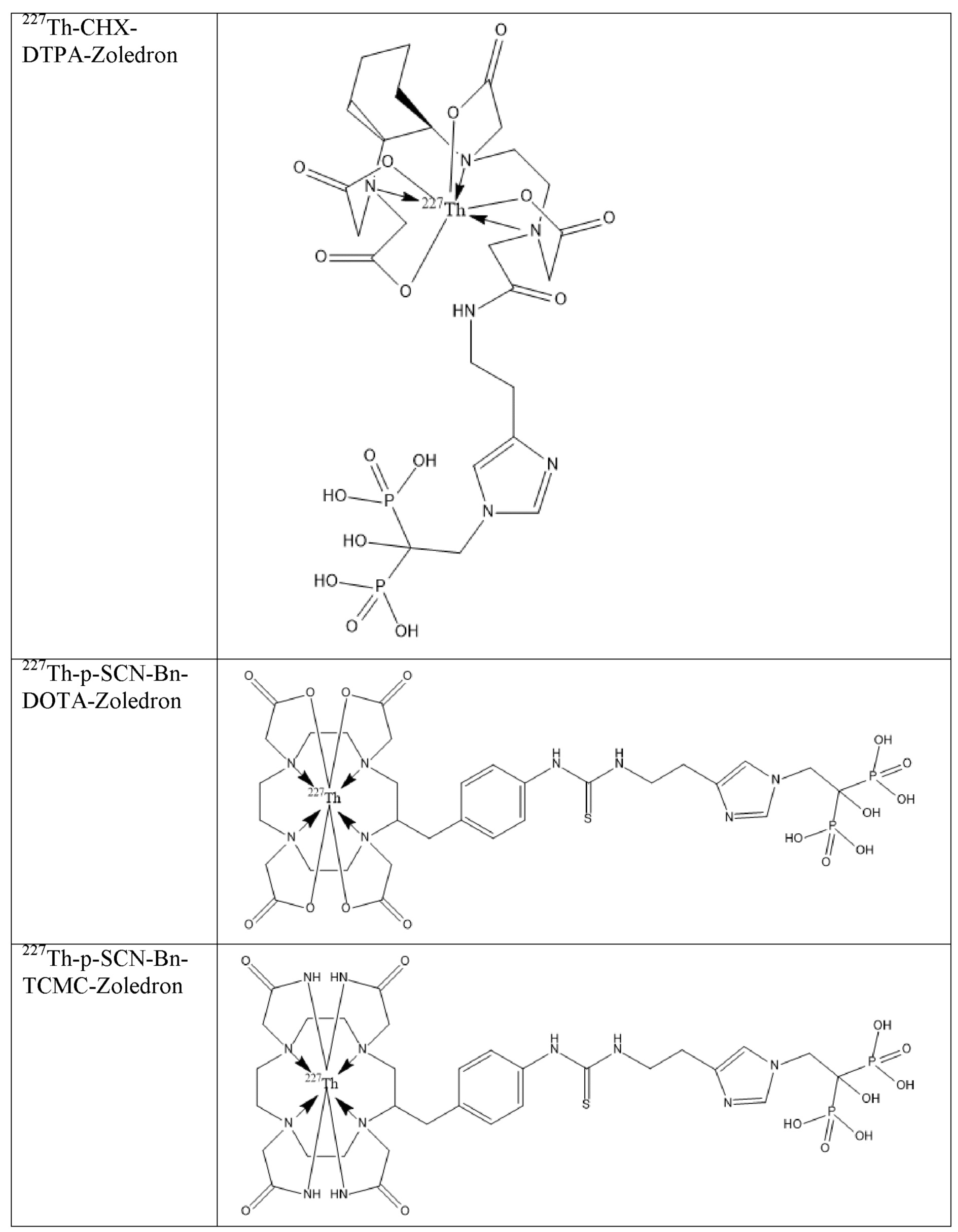
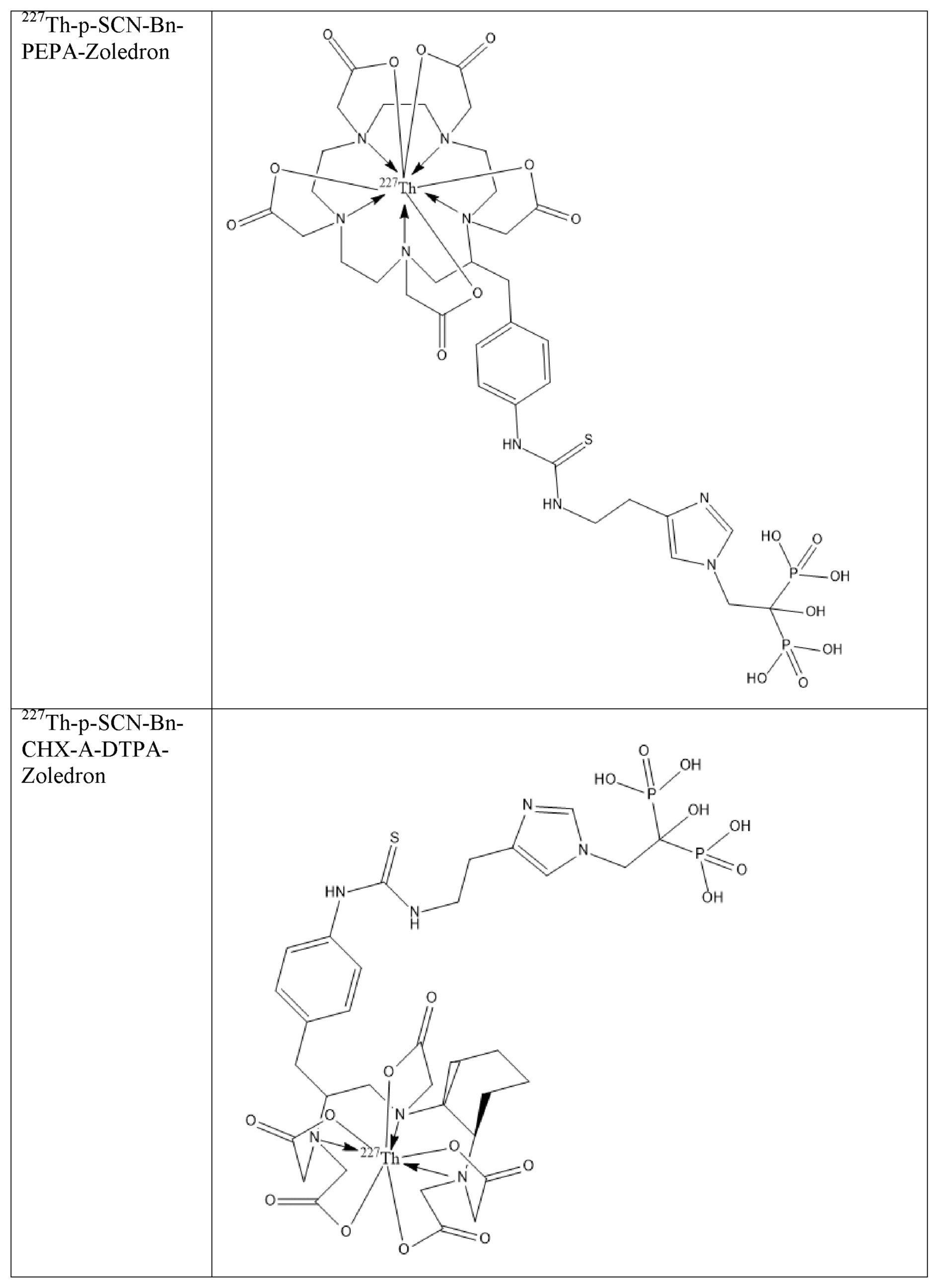
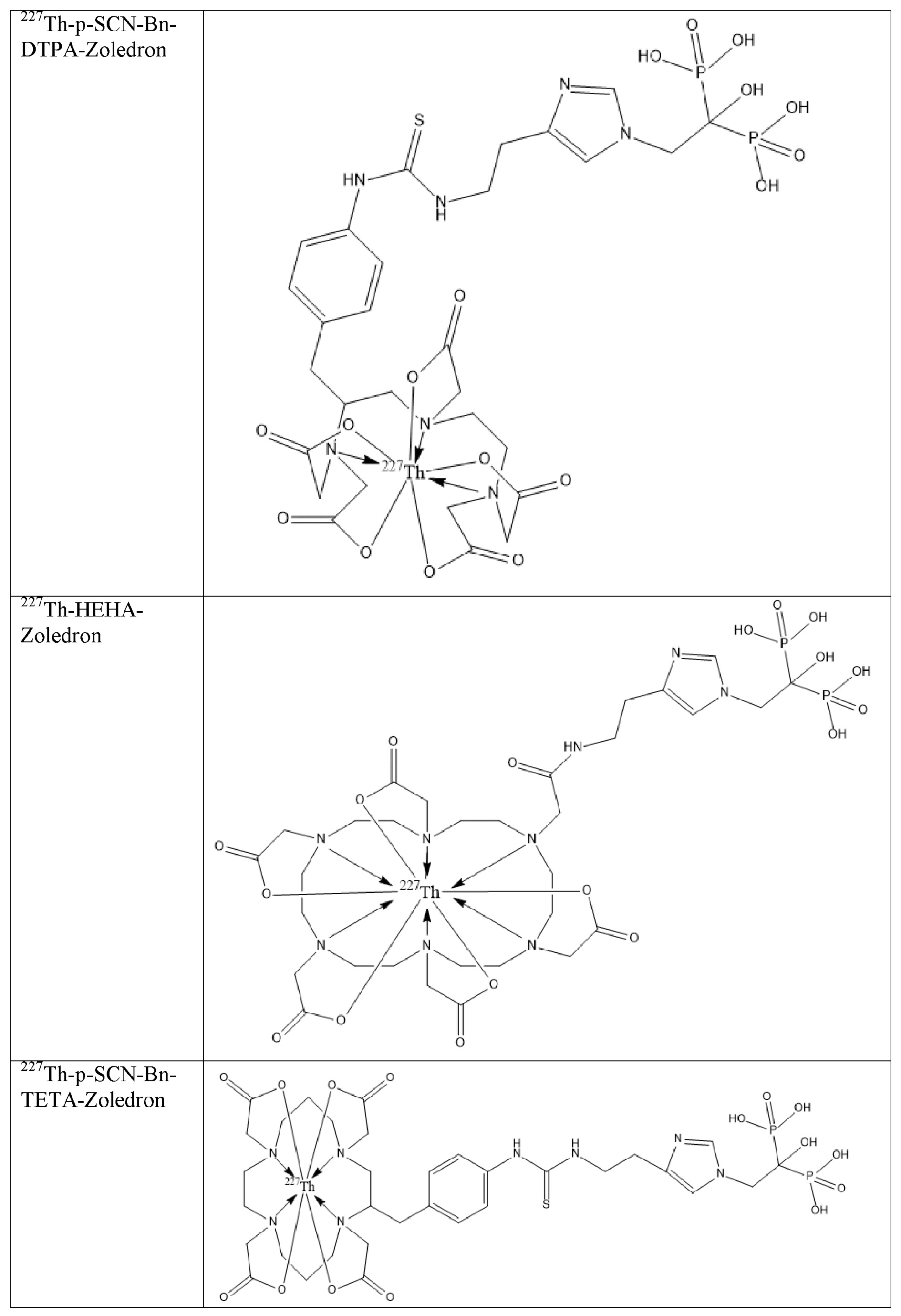
Заявляемое на защиту комплексное соединение Y может быть получено двумя разными способами:
1. взаимодействием бифункционального хелатирующего агента Chel с аминогруппой молекулы, соответствующей фрагменту Zoledron, с образованием молекулы Chel-Zoledron с последующим её радиомечением радионуклидом227Th;
2. радиомечением радионуклидом227Th молекулы бифункционального хелатирующего агента Chel с образованием молекулы227Th-Chel с последующим её взаимодействием с аминогруппой молекулы, соответствующей фрагменту Zoledron.
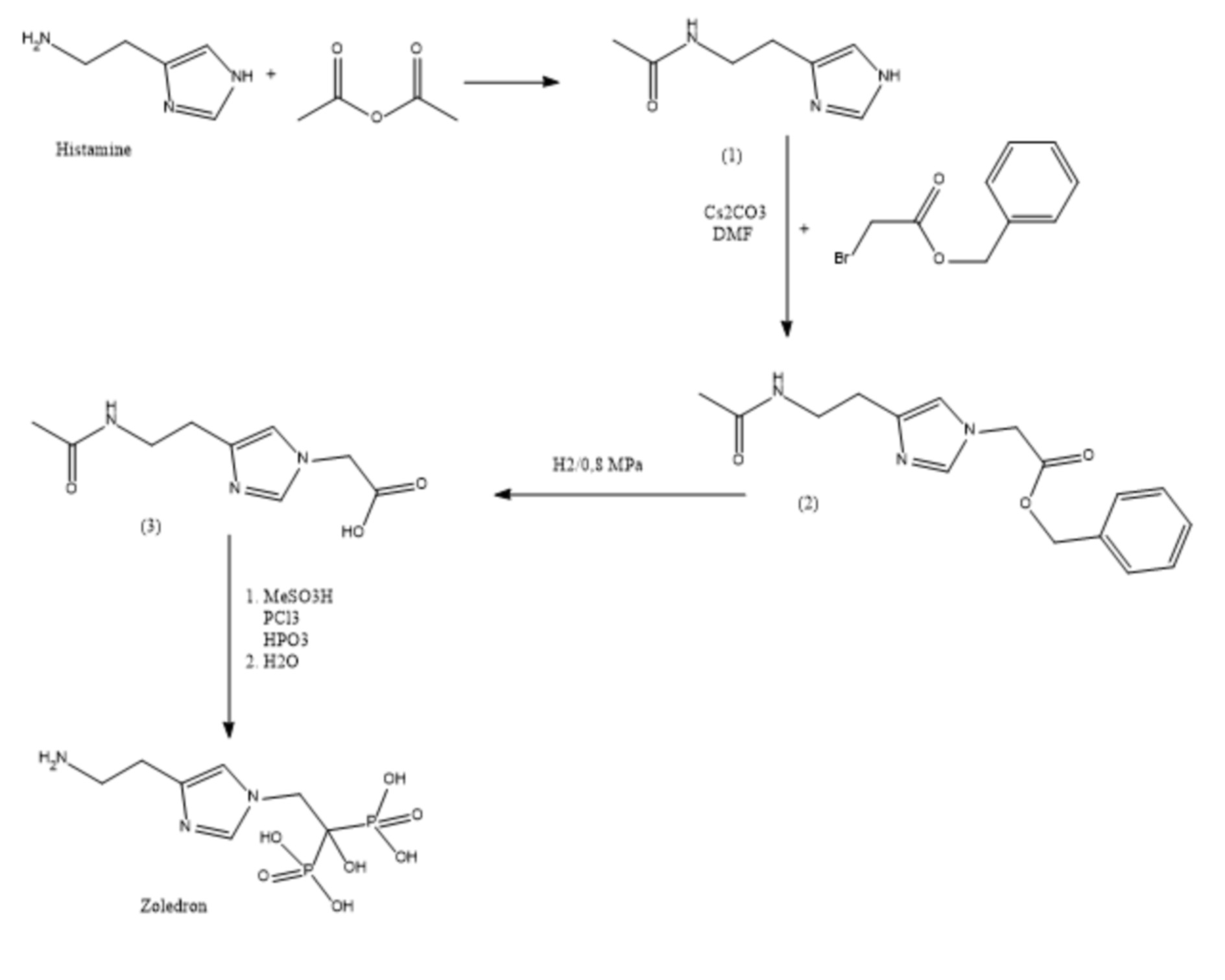
Способ получения фрагмента Zoledron с последующим формированием молекулы Chel-Zoledron с возможным использованием различных бифункциональных хелатирующих агентов Chel подробно описан в патенте EP3206720, схема синтеза приведена ниже (Рисунок 1).
Рисунок 1: схема синтеза соединения,соответствующего фрагменту Zoledron:
Все бифункциональные хелатирующие агенты, соответствующие фрагменту –Chel, коммерчески доступны и в самостоятельном синтезе не нуждаются, хотя это осуществимо при необходимости. Для формирования молекулы Chel-Zoledron возможно применение эфиров бифункциональных хелатирующих агентов –Chel, защищенных, либо нет – зависит от условий реакции, в любом случае, выбор подходящего метода синтеза зависит от временных рамок, необходимых условий, доступности реагентов и требуемого выхода реакции, конечный продукт, в любом случае, будет одинаков и соответствовать структуре -Chel-Zoledron (Таблица 4).

Дальнейшее радиомечение радионуклидом227Th, соединений, соответствующих структуре Chel-Zoledron проводилось.227Th для радиомечения находился в растворе 0,2 М HCl (для очистки.227Th от продуктов распада использовалась анионообменная колонка 2х30 мм, содержащая 50-90 мг анионообменной смолы нитратной формы) в объеме 100-200 мкл, к этому объему добавляли 400-800 мкг соединения Chel-Zoledron, 3 мг аскорбиновой кислоты, 10-20 мг тетраметиламмоний ацетата, либо другой буферной соли для достижения pH приблизительно 5,5. Флакон с вышеописанным содержимым помещался в термошейкер на 100 оборотов в минуту при 60оС на час. Конечный продукт растворяли в изотоническом растворе хлорида натрия 0,9%. Перед растворением в изотоническом растворе возможна очистка от223Ra при необходимости. Подтверждение подлинности продукта реакции, соответствующего структуре комплексного соединения227Th-Chel-Zoledron проводили по характеристическим гамма-линиям тория-227. Выход реакции радиомечения проверяли методом тонкослойной хроматографии с гамма-детектором.
Возможен и иной путь получения комплексного соединения227Th-Chel-Zoledron, где на первой стадии проводится радиомечение бифункционального хелатирующего агента Chel с последующимя присоединением образованного комплекса к молекуле Zoledron, однако этот способ имеет ряд недостатков – в первую очередь из-за долгого времени формирования связи Chel-Zoledron (более 6 часов), что приводит к увеличению потерь радионуклида227Th за счет распада, а также увеличению деструктивных процессов за счет радиолиза. Этот путь получения комплексного соединения227Th-Chel-Zoledron менее актуален, однако возможен.
Основным целевым использованием комплексного соединения227Th-Chel-Zoledron является применение в качестве действующего вещества в составе потенциального остеотропного радиофармацевтического лекарственного препарата.
Более 80% онкологических больных страдают костными метастазами, развивающимися преимущественно при раке молочной железы, предстательной железы или лёгких. Метастазы костной ткани губительно влияют на структуру костей, их минеральный обмен, приводят к повышению гиперкальциемии, а также негативно сказываются на качестве жизни больного, вызывая неврологические симптомы, приводящие к сильным болевым ощущениям [1].
Локальная лучевая терапия может быть использована при локальных метастазах, системная радиотерапия в сочетании с гормональными препаратами также может быть эффективна на ранних стадиях, однако не исключены серьезные побочные эффекты [2]. Для снижения резорбции костной ткани и как следствие – возможное снижение болевого синдрома в последнее время применяются производные дифосфоновых кислот [3]. При этом, вышеперечисленные методы являются малоэффективными на поздних стадиях заболевания.
В последние десятилетия широкое применение в клинической практике находит использование остеотропных РФЛП при:
• множественных метастазах в кость;
• болевом синдроме, вызванном костными метастазами;
• прогрессировании костных метастазов на фоне лечения [4].
Остеотропные РФЛП представляют собой радиоактивный раствор, содержащий терапевтический радионуклид (α или β-эмиттер), способный избирательно накапливаться в патологических очагах – костном матриксе (за счет тропности радионуклида к костной ткани, либо за счет использования комплекса молекулы-носителя с радионуклидом, обладающего повышенной тропностью к костной ткани).
Таким образом, одной из ключевых задач при поиске, разработке и оценке терапевтических свойств потенциального остеотропного РФЛП является выбор радионуклида с оптимальными ядерно-физическими характеристиками, а также (при необходимости их использования) специфических молекул-носителей для селективной доставки радионуклида к патологическому очагу.
32P был первым радионуклидом, использованным для паллиативного лечения костных метастазов [5]. Патологические костные очаги поглощают32P приблизительно в пять раз эффективнее, чем здоровый костный матрикс. Использование данного радионуклида приводило к снижению болевого синдрома приблизительно через неделю после введения препарата и эффект длился на протяжении нескольких месяцев.
Другим радионуклидом, обладающим сродством к патологическому костному очагу является89Sr [6], У 60-80% пациентов снижение болевой симптоматики происходит приблизительно через 2-4 недели после введения препарата и эффект продолжается в среднем в течение 3-5 месяцев. Что обусловлено большим периодом полураспада89Sr по сравнению с32P.
Вышеописанные радионуклиды обладают существенным недостатком – отсутствием γ-компоненты при распаде, что затрудняет контроль in vivo распределения препарата в организме пациента и следовательно – дозиметрический контроль. Этого недостатка лишены радионуклиды153Sm и188Re [7,8], имеющие γ-компоненту в спектре излучения, а также более короткие периоды полураспада, однако не обладающие повышенной тропностью к костной ткани, что приводит к необходимости использования этих радионуклидов в составе комплекса с молекулами-носителями (производными фосфоновых кислот).
153Sm нашел свое применение в составе комплекса с оксабифором [9]. А радионуклид188Re в составе комплекса с бисфосфонатом последнего поколения - золедроновой кислотой, применяемой отдельно в качестве лекарственного препарата, способствующего снижению резорбционных процессов в костной ткани, а также обладающей рядом преимуществ по сравнению с другими производными фосфоновых кислот в качестве молекулы-носителя радионуклида [10].
Таблица 5: ядерно-физические характеристики вышеописанных β-эмиттеров, используемых в составе остеотропных РФЛП [1].
При всём многообразии вышеописанных остеотропных препаратов, все они в своем составе имеют β-эмиттеры, уступающие α-эмиттерам по терапевтической эффективности и некоторым показателям безопасности [11].
Единственным используемым в клинической практике на территории России остеотропным РФЛП на основе α-эмиттера является дихлорид радия-223. Радионуклид223Ra обладает тропностью к костной ткани и избирательно накапливается в ней. Применяется без использования молекулы-носителя. И зарекомендовал себя в качестве эффективного средства при терапии костных метастазов при раке простаты [12].
Золедроновая кислота – бисфосфонат последнего поколения, обладающая сродством к костной ткани и проявляющая свою фармакологическую активность за счет ингибирования резорбции костной ткани. При образовании комплекса молекулы производной золедроновой кислоты Chel-Zoledron с радионуклидом227Th достигается синергетический терапевтический эффекта золедроновой кислоты и α-эмиттера227Th (помимо терапевтического эффекта, молекула производной золедроновой кислоты проявляет свойства транспортной молекулы), испускающего α-частицы в непосредственной близости к патологическому очагу, которые, в свою очередь, за счет высокой величины линейной передачи энергии (ЛПЭ) и малой длины пробега в биологической ткани (по сравнению с β-частицами) оказывают высокий локальный цитотоксический эффект при минимальном повреждении здорового тканевого окружения. Дочерним радионуклидом227Th является радионуклид223Ra, испускающий α-частицы, обладающий сродством к костной ткани, выходящий из состава комплекса с молекулой – производной золедроновой кислоты, способный к дальнейшей сорбции костной тканью и обладающий фармакологической активностью по отношению к костным метастазам.
Таким образом, основным объектом заявляемой разработки является комплексное соединение227Th-Chel-Zoledron– действующее вещество в составе потенциального остеотропного РФЛП, обладающего тройным терапевтическим эффектом:
1. молекула носитель радионуклида – производная золедроновой кислоты Chel-Zoledron помимо транспортной функции выполняет метаболическую функцию (снижение резорбции костной ткани),
2. радионуклид227Th, находящийся в непосредственной близости к патологическому очагу обеспечивает цитотоксический эффект за счет испускания α-частиц,
3. комплексное соединение227Th-Chel-Zoledron является in vivo генератором радионуклида223Ra, образованного в непосредственной близости к патологическому очагу, обладающего высокой тропностью к костной ткани, встраивающегося в костный матрикс и обеспечивающего цитотоксический эффект за счет испускания α-частиц,
4. имея данные о периоде полувыведения комплексного соединения227Th-Chel-Zoledron можно рассчитать активность потенциального РФЛП, требуемую для поддержания приблизительно постоянной терапевтической активности223Ra в непосредственной близости от патологического очага
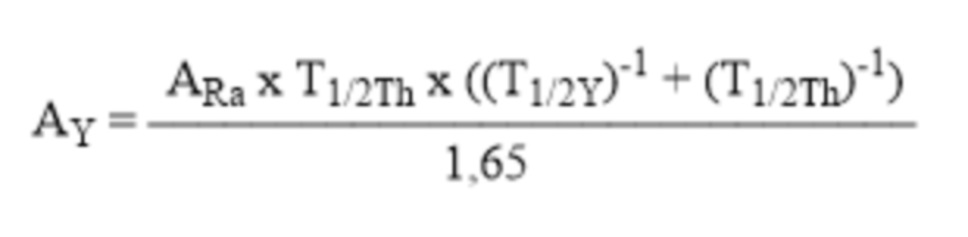
AY– активность комплексного соединения227Th-Chel-Zoledron (Бк) в составе одной терапевтической дозы потенциального остеотропного радиофармацевтического лекарственного препарата;
ARa – активность радионуклида223Ra, образующегося из радионуклида227Th, входящего в состав комплексного соединения Y;
T1/2Th– период полураспада радионуклида227Th, равный 18,7 суток;
T1/2Y– период полувыведения комплексного соединения227Th-Chel-Zoledron из организма.
[1] В.М. Петриев, Е.Л. Афанасьева, В.Г. Скворцов/Химико-фармацевтический журнал, том 42, №5 (2008).
[2] L. Trodella, G. Ausili-Cefaro, A. Turriziani. Pain, 18, 387-396 (1984).
[3] Р.В. Орлова, Н.В. Тюкавина/VII Российская онкологическая конференция.
[4]М.С. Белозерова, Т.Ю, Кочетова, В.В. Крылов, Практические рекомендации по радионуклидной терапии при метастазах в кости/ Злокачественные опухоли, спецвыпуск, 448-454 (2015).
[5]L.J. Morin, J.C. Stevens/ J.Umi, 97, 130-132 (1967).
[6]Э.В. Краснова, Возможности стронция-89 хлорида в комплексной терапии костных метастазов/диссертация (2006).
[7]А.Ф. Цыб, В.В. Крылов, Б.Я. Дроздовский, О.Б. Карякин, В.А. Бирюков, В.н. Медведев, И.А. Смирнов, С.Л, Воробьева/Сибирский онкологический журнал, № 3, 19 (2006).
[8]S. Dorovatovskiy, V. Petriev, V. Skvortsov, A. Zverev/ Czech Chem. Soc. Symp. Ser. 16, 234 (2018).
[9]А.О. Малышева, О.Е. Клементьева, Г.Е. Кодина, В.Н. Корсунский, М.Е. Назаренко, О.Р. Михайлов, С.В. Перминов, Н.А. Уваров, В.Е. Федоров, патент на изобретение RU2407746 от 29.09.2008.
[10]Г.Е. Кодина, Н.П. Громова, И.Н. Тронова, А.А. Инкин, Б.Я. Дроздовский, В.В. Крылов, патент на изобретение RU2162714 от 20.06.2000.
[11]L. Marcu, E. Bezak, B.J. Allen/Clinical Reviews in Oncology Hematology 123, 7-20 (2018).
[12]А.А. Костин, А.Г. Мурадян, А.О. Толкачев, С.В. Попов/ Исследования и практика в медицине, т.4, 79-88 (2017).
Реферат
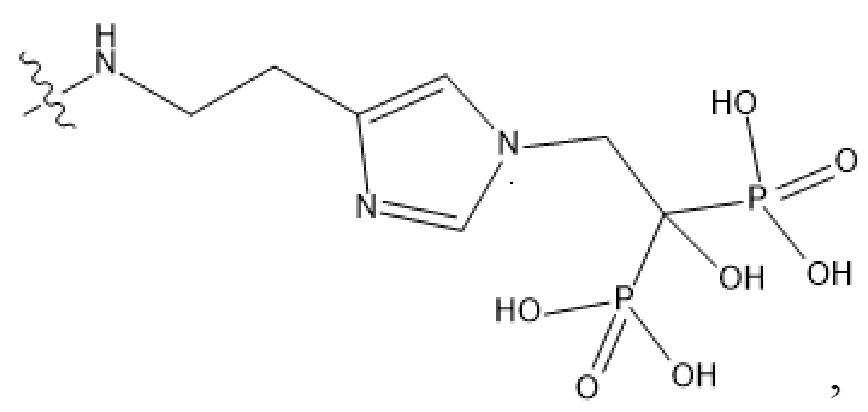
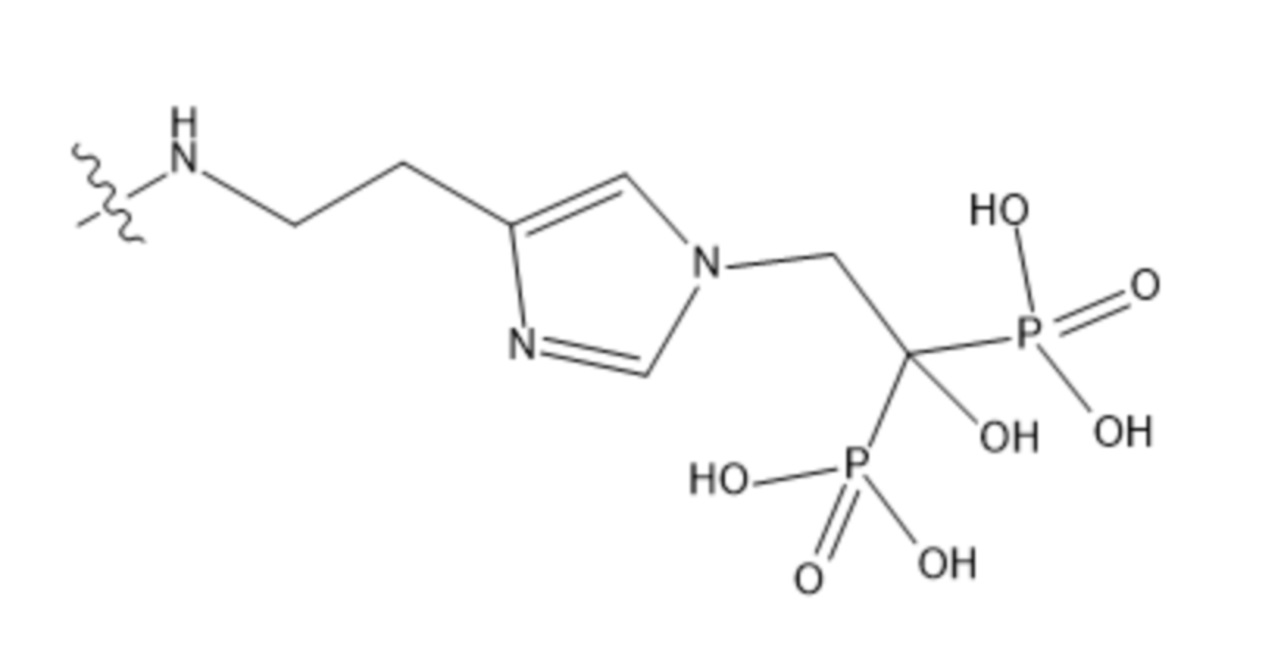
Изобретение относится к ядерной медицине, а именно к разработке потенциального остеотропного терапевтического радиофармацевтического препарата, действующим веществом в составе которого является комплексное соединение структуры Y:227Th-Chel-Zoledron, где Zoledron – фрагмент, соответствующий структуре:
Формула






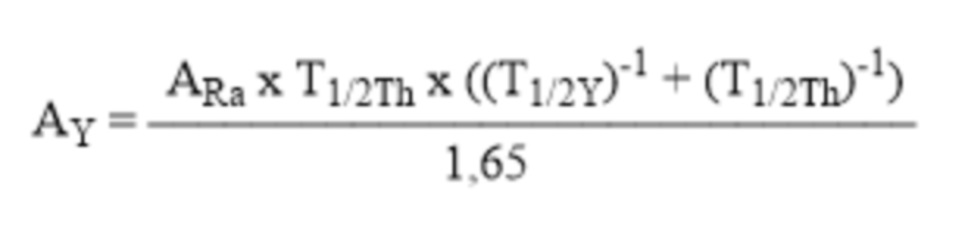

Комментарии