Теплоустойчивые препараты наночастиц и ассоциированные с ними способы - RU2649765C2
Код документа: RU2649765C2
Чертежи


Описание
ОБЛАСТЬ ИЗОБРЕТЕНИЯ
В целом данное изобретение относится к способам стабилизации препарата наночастиц. Такие препараты наночастиц являются полезными для различных терапевтических и диагностических применений.
ПРЕДШЕСТВУЮЩИЙ УРОВЕНЬ ТЕХНИКИ
Наночастицы, т.е. частицы, диаметры которых уместно измерять в нанометрах, рассматриваются для широкого спектра конечных применений. Наночастицы с подходящими для визуализации свойствами обычно основаны на оксидах переходных металлов и используются в качестве контрастных агентов для MP (магнитно-резонансной) и/или рентгеновской визуализации. Наночастицы оксида железа используются для различных терапевтических применений, таких как железозаместительная терапия, визуализация магнитных частиц (MPI), направленная доставка лекарственных средств или доставка генов. Обычно требуется, чтобы препараты, содержащие композиции наночастиц, предназначенные для применения in vivo у людей, были очищены и простерилизованы для предотвращения биологического загрязнения, и часто необходимо, чтобы они демонстрировали устойчивую стабильность суспензии в изотонической водной среде.
Существуют различные способы стерилизации наночастиц, включающие УФ-облучение, обработку этиленоксидом, обработку формальдегидом, стерильную фильтрацию, гамма-облучение и стерилизацию в автоклаве. Стерилизация в автоклаве инъецируемых контрастных агентов считается одним из наиболее надежных и недорогих методов стерилизации.
Композиции наночастиц в водной суспензии часто подвержены агломерации и осаждению в процессе применения методов тепловой стерилизации, таких как автоклавирование. Были предприняты попытки модифицировать поверхностные свойства таких наночастиц для повышения стабильности водных суспензий таких наночастиц путем добавления различных поверхностных модификаторов. Альтернативным подходом является использование модификатора температуры помутнения для изменения температуры, при которой происходит агрегация наночастиц, что позволяет осуществлять стерилизацию в автоклаве. Однако в некоторых случаях модификаторы температуры помутнения являются заряженными молекулами и отличаются от молекул, составляющих оболочку наночастиц, и это приводит к риску изменения поверхностной химии оболочки, а также композиции наночастиц.
Крайне желательными являются способы стабилизации композиции наночастиц при повышенных температурах в процессе стерилизации в автоклаве без изменения поверхностной химии наночастиц. Получение композиции наночастиц, включающее улучшенную стабильность, стерильность, повышенную безопасность и устойчивость к агрегации в процессе тепловой стерилизации, является полезным для различных применений.
КРАТКОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Одно или более воплощениий способа включает очистку композиции с получением очищенной композиции, где очищенная композиция содержит по меньшей мере одну наночастицу, находящуюся в жидком носителе, где наночастица содержит ядро и оболочку, присоединенную к ядру, где оболочка содержит лиганды; добавление некоторого количества лигандов к очищенной композиции с получением препарата, где по меньшей мере часть добавленного количества лигандов остается не присоединенной к ядру; и стерилизацию препарата.
Еще одно воплощение способа включает очистку композиции с получением очищенной композиции, где очищенная композиция содержит по меньшей мере одну наночастицу, находящуюся в жидком носителе, где наночастица содержит ядро и оболочку, присоединенную к ядру, где оболочка содержит лиганды и где очищенная композиция лишена какого-либо избытка лигандов; добавление некоторого количества лигандов к очищенной композиции с получением препарата, где по меньшей мере часть добавленного количества лигандов остается не присоединенной к ядру, и стерилизацию препарата посредством автоклавирования.
КРАТКОЕ ОПИСАНИЕ ГРАФИЧЕСКИХ МАТЕРИАЛОВ
Эти и другие признаки, аспекты и преимущества настоящего изобретения станут более понятными после ознакомления со следующим подробным описанием со ссылками на сопроводительные графические материалы, где одинаковые обозначения представляют одинаковые элементы на всех фигурах, где:
На фиг. 1 показана блок-схема, изображающая типичный способ получения стабилизированного препарата наночастиц в соответствии с одним из воплощений настоящего изобретения;
На фиг. 2 показана схематическая технологическая схема, изображающая типичный способ получения стабилизированного препарата наночастиц, включающая конфигурации идеализированного поперечного сечения наночастиц ядро-оболочка, в соответствии с одним из воплощений настоящего изобретения.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
В следующем описании изобретения и формуле изобретения будет сделана ссылка на ряд терминов, которые следует определить как имеющие следующие значения.
Формы единственного числа включают ссылки на множественное число, если из контекста однозначно не следует обратное.
Язык аппроксимации при использовании в данном описании изобретения во всем описании и формуле изобретения может применяться для модификации любого количественного представления, которое может допустимо варьироваться, не приводя к изменению основной функции, к которой оно относится. Соответственно значение, модифицированное термином или терминами, такими как "примерно", не следует ограничивать до точного указанного значения. В некоторых случаях язык аппроксимации может соответствовать точности прибора для измерения данного значения.
Воплощения настоящего изобретения включают способ, включающий очистку композиции с получением очищенной композиции, где очищенная композиция содержит по меньшей мере одну наночастицу, находящуюся в жидком носителе, где наночастица содержит ядро и оболочку, присоединенную к ядру, где оболочка содержит совокупность лигандов. После очистки добавляют некоторое количество лигандов к очищенной композиции с получением препарата, где по меньшей мере часть добавленного количества лигандов остается не присоединенной к ядру. Затем препарат подвергают стерилизации.
Более конкретно в одном или более воплощениях способ включает предоставление по меньшей мере одной наночастицы, содержащей по меньшей мере ядро и оболочку, где оболочка содержит совокупность лигандов, присоединенных к ядру. Композицию наночастиц очищают с получением очищенной композиции наночастиц, и препарат получают, используя очищенную композицию наночастиц, путем добавления некоторого количества лигандов, добавление которых может содействовать стабилизации препарата в процессе стерилизации в автоклаве при высокой температуре. Очистку осуществляют для удаления нежелательных посторонних веществ, присутствующих в композиции, включая, например, избыток аналогичного вещества или любые примеси. При очистке попутно удаляется любой избыток лигандов, то есть лигандов, не присоединенных к ядрам наночастиц, присутствующих в композиции наночастиц. В одном из примеров очистка наночастиц может включать фильтрацию, основанную на отсечении по молекулярной массе, где размер пор фильтрационной мембраны определяет предел прохождения молекул определенной молекулярной массы сквозь поры. В другом примере очистка наночастиц может включать промывку посредством центрифугирования с последующим повторным суспендированием в жидком носителе. Из-за разницы размера лигандов и композиции наночастиц (ядро-оболочка) очистка способствует удалению избытка лигандов из композиции наночастиц. Избыток лигандов добавляют к очищенной композиции наночастиц с получением препарата и последующей стерилизацией. В результате стерилизации препарата получают стерилизованный препарат.
Как указано, препарат содержит очищенную композицию наночастиц. В некоторых воплощениях композиция наночастиц содержит по меньшей мере ядро и оболочку. Оболочка содержит совокупность лигандов, присоединенных к ядру. Совокупность лигандов, присоединенных к ядру, может называться в данном описании изобретения "связанными лигандами".
В одном воплощении композиция наночастиц содержит структуру ядро-оболочка, где ядро содержит переходный металл, например ядро, содержащее оксид переходного металла. Конкретные примеры включают оксиды вольфрама, тантала, гафния, циркония, цинка, молибдена, серебра, железа, марганца, меди, кобальта, никеля или комбинаций двух или более вышеперечисленных оксидов переходных металлов. В одном воплощении ядро содержит суперпарамагнитный оксид железа. В одном или более воплощениях содержание металла в множестве наночастиц в препарате находится в диапазоне от 0,5 до 300 мг/мл. Структура и состав ядра описаны более подробно ниже, более конкретно со ссылкой на фиг. 2.
В одном или более воплощениях оболочка наночастиц содержит лиганды, содержащие структурную группировку, где структурная группировка содержит органический фосфат или фосфонат и одну или более гидрофильных групп. В одном воплощении совокупность лигандов содержит по меньшей мере одну фосфатную или фосфонатную группу и одну или более дополнительных групп, включающих группировки полиэтиленового эфира, группировки полипропиленового эфира, группировки полибутиленового эфира или комбинации двух или более вышеперечисленных группировок. В некоторых воплощениях оболочка наночастицы содержит лиганды, включающие по меньшей мере одну фосфатную группу или фосфонатную группу и одну или более гидрофильных групп, содержащих группировки полиэтиленового эфира. В некоторых воплощениях оболочка содержит один или более вид лигандов, содержащий фосфат, фосфонат или их комбинацию. Фосфат может включать монофосфат, дифосфат, полифосфат или их комбинацию. Фосфонат может включать альфа-гидроксифосфонат, монофосфонат, дифосфонат, полифосфонат или их комбинацию. В некоторых других воплощениях лиганд также содержит полиэтиленгликолевую (PEG) функциональную группу. В некоторых воплощениях оболочка содержит функционализированные полиэтиленгликолем (PEG) фосфаты, функционализированные PEG монофосфаты, функционализированные PEG α-гидроксифосфонаты, функционализированные PEG дифосфаты или их комбинации. PEG представляет собой гидрофильный полимер, и оболочка, изготовленная из функционализированных PEG лигандов, значительно увеличивает поверхностную гидратацию, тем самым повышая растворимость и совместимость частиц in vivo. Структура и состав оболочки более подробно описаны в данном описании изобретения ниже, более конкретно со ссылкой на фиг. 2.
В одном или более воплощениях способ включает добавление некоторого количества лигандов к очищенной композиции с получением препарата, который содержит избыток лигандов, не присоединенных к ядру. Лиганды, добавленные к очищенной композиции наночастиц для изготовления препарата, является структурно идентичными лигандам, присутствующим в оболочке и присоединенным к ядру наночастицы. Как отмечено, термин "по меньшей мере часть добавленного количества лигандов остается неприсоединенной к ядру" используется в данном описании изобретения взаимозаменяемо с терминами "свободные лиганды" или "избыток свободных лигандов". Свободные лиганды также является структурно идентичными лигандам, связанным с ядром наночастицы.
При повышенной температуре связанные лиганды могут отделяться от ядра, что увеличивает вероятность агрегации наночастиц. Агрегация наночастиц может быть уменьшена в присутствии свободных лигандов в препарате. Без связи с теорией, полагают, что лиганды, отделившееся от ядра, могут быть заменены свободными лигандами, данный механизм называется в данном описании изобретения "лигандным обменом". Присутствие свободных лигандов в препарате поддерживает целостность структуры ядро-оболочка у наночастиц даже при повышенной температуре.
В одном или более воплощениях свободные лиганды, присутствующие в препарате, могут заменять отделившееся от ядра лиганды, и, так как свободные и связанные лиганды являются структурно-идентичными, поверхностная химия наночастиц остается неизменной. В одном или более воплощениях свободные лиганды включают функционализированные полиэтиленгликолем (PEG) монофосфаты, функционализированные PEG альфа-гидроксифосфонаты, функционализированные PEG дифосфаты или их комбинации. В одном из примеров, если связанные лиганды композиции наночастиц представляет собой функционализированный PEG альфа-гидроксифосфонат, свободные лиганды, присутствующее в препарате, также представляет собой функционализированный PEG альфа-гидроксифосфонат, который поддерживает свойства поверхности наночастицы в процессе стерилизации. Концентрация свободных лигандов изменяется с изменением концентрации наночастиц в препарате. В одном или более воплощениях количество свободных лигандов, добавленных в препарат, находится в диапазоне от примерно 0,005 до 2 моль лиганда относительно количества моль металла, присутствующего в ядре наночастицы.
Как отмечено, препарат также содержит жидкий носитель. В одном или более воплощениях жидкий носитель включает воду, этанол или их комбинации. Структура ядро-оболочка наночастицы остается стабилизированной, то есть суспендированной без излишней агрегации в жидком носителе. В одном или более воплощениях добавление дополнительных соединений в жидкий носитель может увеличивать ионную силу препарата наночастиц. В одном или более воплощениях дополнительные соединения включают сахариды, такие как маннит, декстроза, сахароза, лактоза, сорбит, ксилит и мальтит; спирты, такие как пропиленгликоль; синтетические полимеры, такие как немодифицированные PEG и поливинилпирролидинон; поверхностно-активные вещества, такие как Tween, Cremaphor и Labasol; и любые физиологически совместимые соли (например хлорид натрия, бромид натрия, сульфат натрия, ацетат натрия, бикарбонат натрия, хлорид калия, бромид калия, сульфат калия, ацетат калия, бикарбонат калия) или их комбинации. В некоторых воплощениях жидкий носитель можно использовать для изготовления суспензии наночастиц. В одном из примеров в качестве жидкого носителя используется этанол, где этанол может быть выпарен на последней стадии изготовления препарата с получением водной суспензии наночастиц. В одном или более воплощениях жидкий носитель можно использовать в качестве разбавителя. Жидкий носитель также можно использовать для оптимизации или изменения концентрации наночастиц или избытка лигандов в препарате. В некоторых воплощениях, когда препарат используется в качестве контрастного агента, жидкий носитель используют в инъецируемой среде, содержащей препарат наночастиц. В одном или более воплощениях жидкий носитель может функционировать в качестве фармацевтического эксципиента. Когда препарат используется в качестве фармацевтического носителя лекарственного средства, жидкость можно использовать в качестве среды для носителя лекарственного средства.
В некоторых воплощениях способ также включает добавление некоторого количества жидкости к жидкому носителю. Это количество жидкости добавляют к композиции для корректировки концентрации металла в пределах определенного диапазона. Добавленное количество жидкости может содержать этанол, воду или их комбинацию. В некоторых других воплощениях способ также включает добавление некоторого количества фармацевтически приемлемых эксципиентов, таких как буферы, сахара, соли, или комбинации двух или более эксципиентов. Например, фармацевтически приемлемые соли включают хлорид натрия, бромид натрия, сульфат натрия, ацетат натрия, бикарбонат натрия, хлорид калия, бромид калия, сульфат калия, ацетат калия, бикарбонат калия. В некоторых других примерах фармацевтически приемлемые сахара могут включать маннит, декстрозу, сахарозу, лактозу, сорбит, ксилит и мальтит.
Как отмечено, в некоторых воплощениях препарат стерилизуют посредством тепловой стерилизации, где тепловая стерилизация может быть подразделена на стерилизацию сухим теплом и стерилизацию влажным теплом. В конкретном воплощении препарат подвергают тепловой стерилизации посредством автоклавирования.
В одном или более воплощениях способа препарат стерилизуют путем автоклавирования при высокой температуре. Стерилизация в автоклаве может осуществлена в соответствии с инструкциями для стандартных способов стерилизации в автоклаве. Термин "высокая температура" или "повышенная температура" в данном описании изобретения может означать температуру, которая является подходящей для автоклавирования, например выше 100°C. При тепловой стерилизации стерилизация зависит от температуры выдерживания и времени выдерживания. Бактерии, вирусы, грибы или споры могут быть уничтожены посредством автоклавирования обычно при 134°C в течение по меньшей мере 3 минут или при 121°C в течение по меньшей мере 15 минут. В одном или более воплощениях паровой стерилизации или стерилизации влажным теплом препарат наночастиц стерилизуют при температуре приблизительно 121°C в течение по меньшей мере 15 минут. В некоторых воплощениях условие 121°C в течение периода времени приблизительно 15 минут достигается путем использования пара при давлении 15 фунтов на кв. дюйм (фунт/кв.дюйм) (103,4 кПа) выше атмосферного давления при высоте вблизи уровня моря. Стерилизация сухим теплом также может быть осуществлена, хотя температуры, используемые для стерилизации сухим теплом, обычно составляют 160°C в течение от 1 до 2 часов. В одном или более воплощениях способа препарат стерилизуют автоклавированием. В некоторых воплощениях для автоклавирования температуру поддерживают при 121°C в течение 15 минут. В некоторых других воплощениях препарат стерилизуют при температуре примерно 256°C в течение по меньшей мере 5 минут.
В отличие от других способов тепловой стерилизации, где наночастицы обычно образуют агрегаты, в воплощениях настоящего изобретения наночастицы являются устойчивыми к агрегации в процессе тепловой стерилизации. В одном или более воплощениях способ может предотвращать агрегацию наночастиц благодаря замене одного или более из избыточных свободных лигандов одним или более лигандами, присоединенные к ядру, в процессе стерилизации. Лиганды образуют оболочку вокруг ядра наночастиц для стабилизации ядра.
Как отмечено, способ включает предоставление композиции, содержащей по меньшей мере одну наночастицу, содержащую ядро и оболочку, присоединенную к ядру. Затем композицию очищают с получением очищенной композиции, содержащей по меньшей мере одну наночастицу, находящуюся в жидком носителе. Также к очищенной композиции добавляют некоторое количество лигандов с получением препарата с последующей стерилизацией препарата. Типичное воплощение этого способа, которое обеспечивает получение стабилизированного препарата наночастиц, более подробно описано со ссылкой на фиг. 1.
В частности, на фиг. 1 показана блок-схема, изображающая типичный способ получения стабилизированных препаратов наночастиц, которые являются стабильными при высокой температуре. Множество наночастиц ядро-оболочка (8) образуется путем объединения по меньшей мере ядра и оболочки. Обычно способ изготовления композиции наночастиц включает приведение ядра наночастицы из оксида металла в контакт с композицией оболочки по настоящему изобретению, где оболочка содержит лиганды, включающие органический фосфат или фосфонат и одну или более гидрофильных групп. Обычно приведение в контакт выполняют в смеси, содержащей по меньшей мере один органический растворитель и воду. В результате очистки наночастиц получают очищенные наночастицы ядро-оболочка (10), при этом удаляются любые посторонние агенты, присутствующие в предшественниках оболочки ядра, любой избыток лигандов после обмена лигандов с получением наночастиц ядро-оболочка или другие вещества, неспецифично связанные с частицами. В одном или более примеров наночастицы очищают посредством фильтрации на основе принципа отсечения по молекулярной массе с последующей промывкой с помощью центрифугирования и последующим ресуспендированием очищенных наночастиц в жидком носителе. Избыток лигандов того же вещества оболочки и жидкий носитель добавляют к очищенным наночастицам с получением препарата наночастиц (12). Затем препарат 12 подвергают, например, тепловой стерилизации.
В некоторых воплощениях способа в стабилизированном препарате может иметься равновесие между лигандами, связанными с ядром наночастицы и свободными лигандами. При комнатной температуре композиция наночастиц может находиться в равновесии, так что абсолютное большинство связанных лигандов (молекул оболочки) взаимодействуют с ядром наночастицы, обеспечивая структуру из хорошо покрытого ядра/оболочки и предотвращая агрегация наночастиц.
Как было отмечено, в некоторых воплощениях в процессе стерилизации при повышенной температуре связанные лиганды отделяются от ядра, что может дестабилизировать структуру наночастицы ядро-оболочка и увеличить вероятность агрегации. Связанные лиганды могут находиться в равновесном состоянии с молекулами воды водной суспензии наночастиц. Ожидаемая скорость обмена лигандов с молекулами воды или с другими видами лигандов может быть выше при более высокой температуре. На основе теоретической оценки связанные лиганды могут отделяться от ядра с большей скоростью при высокой температуре, и молекулы воды могут замещать отделившиеся лиганды в отсутствие избытка свободных лигандов. Наночастицы с недостаточным покрытием оболочкой могут образовывать агрегаты. На основе другого теоретического предположения добавление избытка лигандов к препарату может смещать равновесие так, что лиганды, связанные с ядром, поддерживают целостность структуры ядро-оболочка при повышенных температурах. В одном предположении добавление лигандов в виде свободных лигандов к очищенной композиции наночастиц ядро-оболочка в процессе стерилизации в автоклаве (обычно 121°C) приводит к большему увеличению соотношения несвязанных лигандов к связанным лигандам и способствует обеспечению того, что лиганды, связанные с ядром, поддерживают целостность структуры ядро-оболочка при повышенных температурах.
Со ссылкой на фиг. 2, типичный способ иллюстрирует образование стабилизированного препарата наночастиц в процессе стерилизации в автоклаве, где изображены идеализированные поперечные сечения наночастиц, содержащие структуру ядро-оболочка. На фиг. 2 подробно изображено схематичное представление ряда стадий, используемых в типичном способе, где большинство наночастиц ядро-оболочка (8) образуется путем объединения по меньшей мере ядра 6 и оболочки 4. Оболочка 4 содержит лиганды 5, присоединенные к ядру 6. Наночастица 8 содержит избыток лигандов 9 и другие примеси 2, которые удаляют посредством очистки, что приводит к получению очищенной композиции наночастиц 10. Композиция наночастиц содержит по меньшей мере одну наночастицу, находящуюся в жидком носителе. После очистки наночастицы могут быть подвергнуты стерилизации в автоклаве с добавлением или без добавления некоторого количества лигандов, которые является таким же, как и вещество оболочки. Если очищенную композицию наночастиц 10 подвергают стерилизации в автоклаве в отсутствие добавленного количества лигандов, может происходить агрегация наночастиц 16. Другой путь иллюстрирует количество лигандов 18, добавленных к очищенной композиции 10 для получения препарата наночастиц 12, где добавленное количество лигандов является структурно-идентичным лигандам вещества оболочки. Затем препарат 12 подвергают стерилизации в автоклаве с получением препарата стабилизированных наночастиц 14, где препарат 14 устойчив к агрегации при повышенной температуре в процессе автоклавирования.
Наночастицы ядро-оболочка могут быть получены с использованием стандартных операций, известных в данной области техники. Суспензию наночастиц ядро-оболочка промывают для удаления избытка лигандов или других примесей, неспецифично присоединенных к наночастицам, с последующим концентрированием суспензии наночастиц для дальнейшего использования. Затем очищенную композицию наночастиц используют для получения препарата, содержащего очищенную композицию наночастиц, избыток лигандов, которые структурно идентичны веществу оболочки, и жидкий носитель. Затем препарат подвергают стерилизации в автоклаве. В экспериментальном разделе данного описания изобретения также приведено руководство по получению композиции наночастиц, предложенной в настоящем изобретении.
Одно или более воплощений изобретения связаны с композицией наночастиц 10, имеющей идеализированную структуру ядро-оболочка, показанную на фиг. 2. Композиция наночастиц 10 включает ядро наночастицы из оксида металла 6 и оболочку 4, как описано на фиг. 2. В одном воплощении в настоящем изобретении предложена композиция наночастиц, отличающаяся своей способностью образовывать водную суспензию, которая демонстрирует существенную стабильность в отношении тепловой стерилизации при высокой температуре.
Как отмечено, препарат содержит компоненты в виде наночастиц, и форма и размер этих наночастиц могут варьироваться в зависимости от способа получения наночастиц. Геометрия поперечного сечения наночастиц может быть разной и включает, но не ограничивается ими, сферу, стержень, трубку, хлопья, нить, плоскость, решетку, куб и волокно. В одном воплощении геометрия поперечного сечения частицы может представлять собой одну или более из круглой, эллипсоидной, треугольной, прямоугольной, многоугольной или неправильной форм. Несферические наночастицы альтернативно могут иметь форму конусов или удлиненных стержней. В одном воплощении наночастицы являются сферическими по форме.
Обычно наночастицы имеют средний размер частиц менее 1 микрометра. При использовании в данном описании изобретения термин "размер" относится к гидродинамическому диаметру (DH) наночастиц, измеренному посредством динамического светорассеяния. В одном воплощении композиция наночастиц, предложенная в настоящем изобретении, имеет DH в диапазоне от примерно 2 нм до примерно 500 нм. В альтернативном воплощении композиция наночастиц, предложенная в настоящем изобретении, имеет DH в диапазоне от примерно 10 нм до 25 нм. В одном воплощении композиция наночастиц, предложенная в настоящем изобретении, имеет DH менее 50 нм. В другом воплощении композиция наночастиц, предложенная в настоящем изобретении, имеет DH менее 10 нм. В еще одном воплощении композиция наночастиц, предложенная в настоящем изобретении, имеет DH менее 5 нм. Малый размер частиц может быть полезным, например, в облегчении выведения композиции наночастиц из почек и других органов субъекта после процедуры медицинской визуализации с использованием композиции наночастиц в качестве контрастного агента.
В одном или более воплощениях препарат может содержать наночастицы в различных формах, таких как кристаллическая форма или аморфная форма. В одном воплощении наночастицы, присутствующие в препарате, находятся в кристаллической форме. В некоторых альтернативных воплощениях наночастицы препарата присутствуют в аморфной форме. В некоторых воплощениях препарат может содержать наночастицы в виде смеси как кристаллической, так и аморфной форм.
В одном воплощении препарат содержит смесь наночастиц, где распределение наночастиц является гомогенным. Например, препарат может содержать один тип наночастиц, где форма и размер каждой наночастицы являются примерно одинаковыми. В альтернативном воплощении препарат содержит смесь наночастиц, где распределение наночастиц не является гомогенным. В некоторых других воплощениях препарат может содержать смесь разных типов наночастиц, где размер наночастиц или форма наночастиц может быть разной.
Относительно легкое диспергирование наночастиц в препарате может предотвращать агломерацию и/или агрегацию при комнатной температуре. Агрегат может включать более чем одну наночастицу в физическом контакте друг с другом, в то время как агломераты могут включать более чем один агрегат в физическом контакте друг с другом.
Ядро из диоксида металла в композиции наночастиц имеет размеры, подходящим образом измеренные в нанометрах. В различных воплощениях ядро из диоксида металла в форме наночастиц может быть получено в виде суспензии в разбавителе, и гидродинамический диаметр суспендированных частиц ядра наночастиц из оксида металла может быть измерен, например, посредством динамического светорассеяния. В одном воплощении размер ядра наночастиц из оксида металла измеряют посредством трансмиссионной электронной микроскопии (ТЕМ). Диаметр ядра наночастиц из оксида металла находится в диапазоне от 1 нм до примерно 100 нм. В альтернативном воплощении ядро наночастиц из оксида металла имеет диаметр от примерно 1 до 30 нм. В одном или более воплощениях ядро наночастиц из оксида металла содержит суперпарамагнитный оксид железа (SPIO) и имеет диаметр, измеренный посредством ТЕМ, менее чем примерно 25 нм.
В одном воплощении ядро содержит переходный металлический элемент. В некоторых воплощениях ядро содержит одно или более производных переходных металлических элементов, таких как оксиды, карбиды, сульфиды, нитриды, фосфиды, бор иды, галогениды, селен иды и теллуриды, которые содержат один или более из этих переходных металлических элементов. Термин "металл" означает наличие металлического или неметаллического вещества, которое содержит переходный металлический элемент в качестве компонента.
Как было отмечено ранее, в одном воплощении ядро наночастиц из оксида металла содержит оксид переходного металла, включающий оксиды вольфрама, тантала, гафния, циркония, цинка, молибдена, серебра, железа, марганца, меди, кобальта, никеля, или комбинаций двух или более вышеуказанный оксидов переходных металлов. В некоторых воплощениях ядро из оксида металла содержит переходный металл, который демонстрирует магнитные свойства, включая, например, суперпарамагнитные свойства. В некоторых воплощениях ядро из оксида металла содержит парамагнитный металл, выбранный из группы, состоящей из железа, марганца, меди, кобальта, никеля или их комбинаций. В конкретном воплощении ядро из оксида металла содержит суперпарамагнитный оксид железа (SPIO). В одном воплощении оксид железа имеет примесь другого металла. В одном или более воплощениях ядро наночастицы содержит суперпарамагнитный оксид железа и наночастица имеет размер частиц вплоть до примерно 50 нм.
В одном воплощении ядро наночастиц из оксида металла состоит из одного оксида переходного металла, например оксида тантала, оксида гафния, или только оксида железа. В другом воплощении ядро наночастиц из оксида металла содержит два или более оксидов переходных металлов. Так, в одном воплощении ядро наночастиц из оксида металла содержит как оксид тантала, так и оксид гафния, или оксид тантала и оксид железа. В одном воплощении ядро наночастиц из оксида металла содержит только оксид железа.
Обычно ядро наночастиц из оксида металла содержит по меньшей мере 30% по массе переходного металлического компонента оксида переходного металла. Относительно высокое содержание переходного металла в ядре наночастицы из оксида металла может обеспечивать композиции наночастиц с относительно повышенной степенью радионепрозрачности на единицу объема, тем самым обеспечивая более эффективное функционирование в качестве контрастного агента. Относительно высокое содержание переходного металла потенциально обеспечивает применимость частиц в качестве контрастных агентов для применений в рентгеновской визуализации, такой как компьютерная томография (СТ). Примеры переходных металлических элементов, которые могут обеспечивать это свойство, включают вольфрам, тантал, гафний, цирконий, молибден, серебро и цинк.
В некоторых воплощениях препарат наночастиц по настоящему изобретению можно применять в качестве контрастного агента для магнитного резонанса (MR). Для применения в качестве контрастных агентов для MR композиция наночастиц, предложенная в настоящем изобретении, предпочтительно содержит парамагнитные металлы, при этом особый интерес представляют композиции, которые содержат суперпарамагнитные металлы. Примеры возможных парамагнитных и суперпарамагнитных веществ включают вещества, содержащие один или более из железа, марганца, меди, кобальта, никеля или цинка. Особенно интересной группой веществ являются вещества на основе оксида железа, особенно SPIO, которые обычно составляют от примерно 65% до примерно 75% железа по массе для ядра. В одном воплощении ядро наночастиц из оксидов металлов содержит соединение железа, имеющее общую формулу где 1≥х≥0 и М2+ представляет собой катион металла, такой как катионы железа, марганца, никеля, кобальта, магния, меди, цинка и комбинация таких катионов. Примеры соединений железа, попадающих в объем данной общей формулы, включают магнетит (Fe3O4), когда катион металла (М2+) представляет собой ион закисного железа (Fe2+) и х=0; и маггемит (y-Fe2O3), когда х=1.
Композиция наночастиц 10 содержит оболочку 4, которая полностью покрывает ядро наночастицы из оксида металла 6, как показано на фФиг. 2. Таким образом, в некоторых воплощениях указано, что композиция наночастиц содержит оболочку, которая по существу закрывает ядро. Термин "по существу закрывает" означает, что процент покрытия поверхности ядра оболочкой составляет более чем примерно 20% по сравнению с ядром без оболочки. При использовании в данном описании изобретения термин "процент покрытия поверхности" относится к отношению поверхности ядра, покрытой оболочкой, к поверхности ядра, не покрытой оболочкой. В некоторых воплощениях процент покрытия поверхности наночастицы может составлять более чем примерно 40%.
В некоторых воплощениях оболочка 4 может облегчать улучшенную растворимость в воде, уменьшать образование агрегатов, предотвращать окисление наночастиц, поддерживать однородность объекта ядро-оболочка и/или обеспечивать биосовместимость композиций наночастиц.
Средняя толщина оболочки 4 обычно находится в диапазоне от примерно 1 до примерно 50 нм. В одном воплощении оболочка имеет среднюю толщину менее 50 нм. В другом воплощении оболочка имеет среднюю толщину менее 8 нм. В еще одном воплощении оболочка имеет среднюю толщину менее 5 нм.
В одном или более воплощениях композиции наночастиц могут содержать более одного слоя оболочки, расположенного на ядре наночастицы из оксида металла. Путем продуманного выбора условий обработки ядра наночастиц из оксида металла могут быть получены в виде суспензии в разбавителе и затем обработаны в первом совокупности условий одним или более стабилизаторами с получением первой композиции наночастиц, содержащей первую оболочку, а затем первую композицию наночастиц обрабатывают во второй совокупности условий одним или более отличными стабилизаторами, в результате чего образуется вторая композиция наночастиц, содержащая и первую оболочку и вторую оболочку.
Не подразумевается, что композиции наночастиц, предложенные в настоящем изобретении, предполагают стехиометрическое соотношение 1:1 ядра наночастицы из оксида металла к оболочке, содержащей лиганды, а лишь определяют композицию наночастиц как содержащую ядро наночастицы из оксида металла и оболочку, содержащую совокупность лигандов. Совокупность лигандов содержит по меньшей мере одну структурную группировку, содержащую органическую фосфатную или фосфонатную группу, содержащую одну или более гидрофильных групп. Как указано, органический фосфат или фосфонат, содержащий одну или более гидрофильных групп, может находиться в полностью протонированной форме или в ионизованной форме.
Обычно большая часть органического фосфата или фосфоната, содержащего одну или более гидрофильных групп, может находиться в ассоциации с поверхностью данной частицы, представляющей собой ядро наночастицы из оксида металла. В некоторых воплощениях совокупность лигандов связана с ядром наночастицы из оксида металла посредством водородных связей. В некоторых воплощениях совокупность лигандов связана с ядром наночастицы из оксида металла посредством по меньшей мере одной ковалентной связи. В других воплощениях совокупность лигандов может быть связана с ядром наночастицы из оксида металла посредством ионных связей.
Как указано, наночастицы содержат совокупность лигандов, содержащих органический фосфат или фосфонат и одну или более гидрофильных групп. Гидрофильная группа (или группы) выбрана(ы) из полиэтиленэфирных группировок. Полиэтиленэфирные группировки определены как группировки, содержащие структурные элементы оксиэтиленокси (-OCH2CH2O-), и/или замещенные структурные элементы оксиэтиленокси. Для удобства и из-за близкой структурной связи с термином полиэтиленгликоль (PEG) такие группировки иногда в данном описании изобретения могут быть упомянуты как PEG-группы или PEG-группировки, и характеризуются молекулярной массой группировки. Аналогично полипропиленэфирные группировки определены как группировки, содержащие структурные элементы оксипропиленокси (-ОСН2СН2СН2О-) и/или замещенные структурные элементы оксипропиленокси. Для удобства полипропиленэфирные группировки иногда в данном описании изобретения могут называться полипропиленгликолевыми группами или группировками. Аналогично полибутиленэфирные группировки определены как группировки, содержащие структурные элементы оксибутиленокси (-ОСН2СН2СН2СН2О-) и/или замещенные структурные элементы оксибутиленокси. Для удобства полибутиленэфирные группировки иногда могут называться поли-THF-группировками в данном описании изобретения.
В некоторых воплощениях оболочка содержит совокупность лигандов, содержащих одну фосфатную группу, альтернативно упоминаемых в данном описании изобретения как монофосфат. В одном или более воплощениях фосфат присоединен к PEG-группировке, где молекулярная масса PEG может составлять 350, 440, 750, 2000 или 5000 Да. Соответственно лиганды упоминаются в данном описании изобретения как mPP350, где mPP350 представляет собой монофосфат, связанный с PEG 350. Более конкретно, mPP350 определен как молекула PEG с молекулярной массой примерно 350 г/моль, где одна концевая гидроксильная группа метоксилирована, а другая концевая гидроксильная группа превращена в сложный фосфатный моноэфир. Аналогично mPP440, mPP750, mPP2000 или mPP5000 также можно использовать для препаратов наночастиц.
В воплощениях, где оболочка содержит лиганды, содержащие по меньшей мере две фосфатные группы, эти две фосфатные группы могут занимать положения, образующие пространственное расположение 1,2; 1,3; 1,4; 1,5 или 1,6 по отношению друг к другу. Пространственное расположение 1,2 по меньшей мере двух фосфатных групп включает воплощения, представляющие собой 1,2-дифосфаты; 2,3-дифосфаты; 3,4-дифосфаты; 4,5-дифосфаты, 5,6-дифосфаты и так далее. Специалистам обычной квалификации в данной области полностью понятно расширение данного принципа на пространственные расположения 1,3; 1,4; 1,5 и 1,6 по меньшей мере двух фосфатных групп. При использовании в данном описании изобретения в отношении композиций наночастиц, содержащих такие лиганды, обозначение "1,2-ВРР350" относится к структурной группировке, содержащей две фосфатные группы, находящихся в пространственном расположении 1,2, и полиэтиленэфирную группировку, имеющую молекулярную массу 350 дальтон. Аналогично обозначение "1,2-ВРР440" относится к лигандам, содержащим две фосфатные группы, находящиеся в пространственном расположениях 1,2, и полиэтиленэфирную группировку, имеющую молекулярную массу 440 Да.
В одном или более воплощениях оболочка содержит лиганды, содержащие монофосфонат, бисфосфонат или α-гидроксифосфонат. В одном воплощении оболочка наночастицы содержит фосфонат и PEG в качестве гидрофильной группировки, что дает совокупность лигандов, представляющую собой фосфонат, функционализированный PEG. В некоторых воплощениях оболочка наночастицы содержит α-гидроксифосфонат и гидрофильную группировку, которая присоединена через атом углерода, несущий α-гидроксигруппу. В одном или более воплощениях α-гидроксифосфонат присоединен к PEG-группировке, где молекулярная масса PEG может составлять 350, 440, 750, 2000, 5000, 10000 или 30000 Да. Соответственно лиганды упоминаются в данном описании изобретения как α-HmPP350, когда α-HmPP350 представляет собой α-гидроксифосфонат, связанный с PEG 350. Аналогично α-HmPP440, α-HmPP750, α-HmPP2000, α-HmPP5000, α-HmPP10000 или α-HmPP30000 также могут быть использованы для препаратов наночастиц. В наночастицах, предназначенных для применения в in vivo лечении людей, связь между α-гидроксифосфонатом и гидрофильной группировкой может представлять собой углеводород, что минимизирует вероятность какого-либо взаимодействия между такими обработанными наночастицами и человеческой тканью.
Как отмечено, лиганды содержат одну или более гидрофильных групп, содержащих полиэтиленэфирные группировки. Было обнаружено, что эффективность лигандов в стабилизации ядра наночастицы из оксида металла (и композиции наночастиц в целом) зависит от их структуры. В различных воплощениях эффективность лигандов в стабилизации ядра наночастицы из оксида металла зависит от размера гидрофильной группировки, который иногда в данном описании изобретения может быть описан в терминах групповой молекулярной массы этой гидрофильной группы.
Обычно структура лигандов может быть подобрана так, чтобы эффективно стабилизировать конкретное ядро наночастиц из оксида металла, и гидрофильная группа, присутствующая в лигандах, может иметь или относительно низкую молекулярную массу группы (например, менее 100 грамм на 1 моль) или относительно высокую молекулярную массу группы (например, более 10000 грамм на 1 моль). Так как гидрофильная группа содержит одну или более полиэтиленэфирных группировок, размер и молекулярные массы этих группировок, иногда в данном описании изобретения упоминаемые как молекулярная масса группировки, вносят вклад в групповую молекулярную массу гидрофильной группы в целом. В одном воплощении гидрофильная группа содержит полиэтиленэфирную группировку, имеющую молекулярную массу группировки в диапазоне от примерно 750 Да до примерно 20000 Да. В альтернативном воплощении гидрофильная группа содержит полиэтиленэфирную группировку, имеющую молекулярную массу группировки примерно 2000 Да. В еще одном воплощении гидрофильная группа содержит полиэтиленэфирную группировку, имеющую молекулярную массу группировки менее 20000 Да. В еще одном воплощении гидрофильная группа содержит полиэтиленэфирную группировку, имеющую молекулярную массу группировки менее 2000 дальтон. В еще одном воплощении гидрофильная группа содержит полиэтиленэфирную группировку, имеющую молекулярную массу группировки менее 350 дальтон. При использовании в данном описании изобретения "дальтон" и "грамм на моль" могут быть использованы как взаимозаменяемые термины, которые в приложении к групповой молекулярной массе гидрофильных групп или к групповой молекулярной массе полиэтиленэфирной группировки и замещенных вариантов такой группировки выражают массу в граммах этой группы или группировки, присутствующей в моле совокупности лигандов, которые их содержат.
В одном или более воплощениях лиганды композиции наночастиц могут, в некоторых воплощениях, содержать гидрофильную группу, содержащую группы, отличные от простых эфирных связей (-О-), находящихся в полиалкиленэфирных группировках. Так, в лигандах может присутствовать широкий ряд функциональных групп в дополнение к простым эфирным группам, например сложные эфирные группы, аминные группы, амидные группы, карбаматные группы, мочевинные группы, карбонатные группы, простые тиоэфирные группы, простые селеноэфирные группы, силоксановые группы, сульфинильные группы, сульфонильные группы и комбинации двух или более из вышеперечисленных групп. В некоторых воплощениях такие функциональные группы могут входить в состав самой гидрофильной группы или могут составлять часть лигандов, которая не идентифицирована как гидрофильная группа. Предполагаемое конечное назначение композиций наночастиц может влиять на выбор таких функциональных групп.
Предполагаемое целевое применение композиции наночастиц может влиять на выбор гидрофильных групп, используемых в лигандах. Например, когда композиции наночастиц предназначены для применения in vivo, в частности у людей, может быть желательно избежать гидрофильных групп, которые могли бы сильно связываться с компонентами ткани, такими как белки. Для применения in vivo особенный интерес представляют гидрофильные группы, у которых по существу отсутствует результирующий заряд, такие как полиалкиленовые эфиры. Кроме того, для применения у людей особенно желательными являются гидрофильные группы, которые позволяют легко и воспроизводимо охарактеризовать композиции наночастиц для оценки безопасности. Композиция наночастиц, предложенная в настоящем изобретении, обычно имеет дзета-потенциал в диапазоне от примерно -40 мВ до +40 мВ.
Как указано, композиция наночастиц, предложенная в настоящем изобретении, обычно содержит ядро из оксида переходного металла и оболочку, состоящую из совокупности лигандов, находящихся в жидком носителе. В композиции наночастиц соотношение оболочки к ядру может быть определено посредством элементного анализа. Из знания химического состава наночастиц из оксида металла и их среднего размера перед обработкой лигандами можно рассчитать количество лигандов на частицу ядра наночастиц из оксида металла. В одном воплощении в настоящем изобретении предложена композиция наночастиц, содержащая ядро наночастиц из оксида железа, и оболочку, содержащую совокупность лигандов, где молярное отношение совокупности лигандов к железу находится в диапазоне от примерно 0,01 до примерно 0,25.
Как указано, композиции наночастиц, предложенные в настоящем изобретении, могут быть использованы в качестве контрастных агентов для диагностический визуализации. При таком применении данные композиции наночастиц вводят субъекту, в некоторых воплощениях млекопитающему субъекту, и затем этого субъекта подвергают визуализации. Композиции наночастиц, предложенные в настоящем изобретении, могут быть особенно полезными в MR-визуализации, хотя они также могут найти применение в качестве контрастных агентов в ультразвуковой визуализации или визуализации с помощью радиоизотопной метки. Кроме того, композиции наночастиц, предложенные в настоящем изобретении, могут быть полезными в других областях, таких как инфузия культуры клеток. В некоторых воплощениях наночастицы содержат один или более терапевтических агентов или диагностических агентов. В некоторых воплощениях стерилизованные препараты используют в качестве контрастного агента или для терапевтических применений; примеры включают магнитно-резонансную визуализацию (MRI), доставку лекарственных средств, доставку генов, заместительную терапию или другое.
В одном воплощении настоящего изобретения предложена композиция диагностического агента, которая может быть доставлена к месту введения в виде стабильной водной коллоидной суспензии с подходящими осмоляльностью и рН, в виде концентрированной водной коллоидной суспензии, подходящей для разбавления перед введением субъекту. В альтернативном воплощении в настоящем изобретении предложена композиция диагностического агента в виде порошка, подходящего для восстановления, например, полученного путем лиофилизации.
В одном воплощении в настоящем изобретении предложен стерилизованный препарат, который может быть использован в качестве композиции диагностического агента, подходящей для инъецирования млекопитающему. Композиция диагностического агента содержит препарат наночастиц по настоящему изобретению и фармацевтически приемлемый носитель или эксципиент. В одном воплощении эксципиент представляет собой необязательный компонент композиции диагностического агента. Примерами подходящих эксципиентов являются, без ограничения ими, одна или более солей, разрыхлителей, связующих, наполнителей и смазывающих веществ. В одном воплощении фармацевтически приемлемый носитель по существу может представлять собой воду.
Композиции диагностического агента, предложенные в настоящем изобретении, могут быть получены путем приведения композиции наночастиц по настоящему изобретению в контакт с фармацевтически приемлемым носителем и/или эксципиентом.
При применении в диагностической визуализации, в частности у млекопитающих, и более конкретно у людей, композиции диагностического агента, предложенные в настоящем изобретении, обычно вводят в виде суспензии в фармацевтически приемлемом носителе, который может (но не обязательно) содержать один или более эксципиентов. Если предполагается введение посредством инъекции, в частности посредством парентеральной инъекции, носитель обычно представляет собой водную среду, которую сделали изотонической путем добавления примерно 150 мМ NaCl, 5% декстрозы, маннита или их комбинации. Также она обычно имеет подходящее (физиологическое) значение рН примерно от 7,3 до 7,4. Введение может быть внутрисосудистым (IM) подкожным (SQ) или чаще всего внутривенным (IV). Однако введение также может осуществляться путем имплантации депо, которое затем медленно высвобождает наночастицы в кровь или ткань субъекта. Альтернативно введение может быть осуществлено путем проглатывания для визуализации пищеварительного тракта или путем ингаляции для визуализации легких и воздушных путей.
Для введения людям, в частности внутривенного введения, требуется, чтобы композиция диагностического агента была нетоксичной в используемых количествах и не содержала никаких инфекционных агентов, таких как бактерии и вирусы, а также никаких пирогенов. Так, композиция наночастиц, присутствующая в композиции диагностического агента, должна быть стабильна в отношении необходимых процедур очистки и не терять гидрофильность или не изменять размер составляющих наночастиц.
В данном описании изобретения используются примеры для раскрытия изобретения, включая наилучшее воплощение, и также для обеспечения возможности любому специалисту в данной области осуществить изобретение на практике, включая получение и использование любых устройств или систем и осуществление любых включенных способов. Патентуемый объем изобретения определен формулой изобретения и может включать другие примеры, которые придут в голову специалистам в данной области. Предполагается, что такие другие примеры входят в объем формулы изобретения, если они имеют структурные элементы, которые не отличаются от буквального языка формулы изобретения, или если они включают эквивалентные структурные элементы с несущественными отличиями от буквального языка формулы изобретения.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Наночастицы ядро-оболочка синтезировали и очищали, используя методы, известные в данной области техники. Синтезировали избыток лигандов для изготовления препарата по изобретению и использовали в следующих ниже примерах. Получение таких лигандов и наночастиц ядро-оболочка можно найти в публикации патентной заявки US 20110104072 А1 и в патентной заявке 12/968645. Типичный способ синтеза лигандов, таких как α-гидрокси-PEG-350-моно(метиловый эфир)фосфонат, описан в данном описании изобретения. В данном описании изобретения описаны примеры синтеза PEG350 с альфа-гидроксифосфонатом, PEG5000 с альфа-гидроксифосфонатом, PEG5000 с бисфосфонатом и синтез очищенного SPIO, покрытого PEG5000 с альфа-гидроксифосфонатом.
Пример 1: Синтез избытка лигандов, таких как PEG350-альфа-гидроксифосфоната
Синтез конъюгата PEG-350:

Синтез PEG-350-моно(метиловый эфир)ацетальдегида: к раствору, содержащему PEG-350-моно(метиловый эфир) (3,438 г, 9,82 ммоль), растворенный в CH2Cl2 (98 мл), добавляли периодинан Десса-Мартина (5,00 г, 11,79 ммоль) и полученный раствор перемешивали при комнатной температуре в течение 20 ч. В ходе реакции образовывался мелкодисперсный белый осадок, который удаляли в конце реакции путем фильтрации через набивку целита. Растворитель удаляли из фильтрата в вакууме с получением белого твердого вещества, суспендированного в желтом масле. Твердое вещество растирали с диэтиловым эфиром, и твердое вещество удаляли путем фильтрации через набивку целита. В результате удаления растворителя из фильтрата в вакууме получали продукт - РЕЭ-350-моно(метиловый эфир)ацетальдегид (3,42 г, 100%) в виде желтого масла.1Н ЯМР (CDCl3) δ 9.73 (t, J=4 Hz, 1H), 4.16 (d, J=4 Hz, 2H), 3.65 (m, 24H), 3.38 (s, 3H) м.д. ИК (чистый) 2873, 1732, 1455, 1350, 1109, 1040, 948, 851, 749 см-1.

Синтез диэтил-α-гидрокси-PEG-350-моно(метиловый эфир)фосфоната: к раствору, содержащему PEG-350-моно(метиловый эфир)ацетальдегид (3,71 г, 10,7 ммоль), растворенный в тетрагидрофуране (53 мл), добавляли диэтилфосфит (1,77 г, 12,8 ммоль). Раствор охлаждали до 0°C и добавляли 1,8-диазабицикло[5.4.0]ундец-7-ен (1,94 г, 12,8 ммоль). После перемешивания при 0°C в течение 10 мин реакционную смесь нагревали до комнатной температуры и перемешивали в течение еще 24 ч. Растворитель удаляли в вакууме с получением темно-желтого масла, которое очищали посредством колоночной хроматографии (от 100% CH2Cl2 до 15% МеОН/85% CH2Cl2) с получением 3,30 г (64%) целевого продукта диэтил-α-гидрокси-PEG-350-моно(метиловый эфир)фосфоната в виде желтого масла.1Н ЯМР (CDCl3) δ 4.19 (m, 6H), 3.65 (m, 24H), 3.38 (s, 3H), 1.34 (m, 6H) м.д. 31P ЯМР (CDCl3) δ 23.1 м.д. ИК (чистый) 3343, 2872, 1725, 1453, 1248, 1105, 965, 850, 791 см-1.
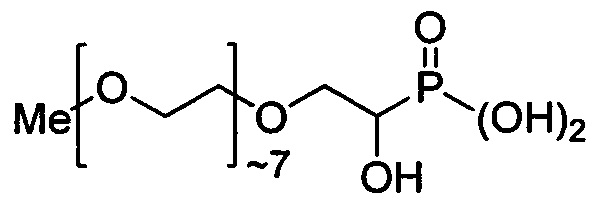
Синтез α-гидрокси-PEG-350-моно(метиловый эфир)фосфоновой кислоты: к раствору, содержащему диэтил-α-гидрокси-PEG-350-моно(метиловый эфир)фосфонат (3,61 г, 7,43 ммоль), растворенный в метиленхлориде (74 мл), добавляли триметилсилилбромид (3,41 г, 22,3 ммоль) и полученный раствор перемешивали при комнатной температуре в течение 2 ч. Растворитель удаляли в вакууме с получением коричневого масла. Полученное масло растворяли в ацетоне (74 мл) и воде (0,5 мл) и полученный раствор перемешивали при комнатной температуре в течение 1,5 ч. Затем растворитель удаляли в вакууме с получением целевого продукта - α-гидрокси-PEG-350 моно(метиловый эфир)фосфоновой кислоты (2,66 г, 84%) в виде золотистого масла.1Н ЯМР (CDCl3) δ 3.65 (m, 24Н), 3.38 (s, 3H).31Р ЯМР (CDCl3) δ 24.0 м.д. ИК (чистый) 3460, 2870, 1727, 1456, 1351, 945, 849 см-1.
Пример 2: Синтез избытка лигандов, таких как PEG5000-альфа-гидроксифосфонат

Синтез mPEG5000-эпоксида: воду (4,32 мл) суспендировали в эпихлоргидрине (84,68 мл, 1,080 моль) и добавляли NaOH (43,20 г, 1,080 ммоль), затем триэтиламмония гидрохлорид (1,18 г, 0,009 моль). Раствор перемешивали и нагревали до 70°C, в течение этого времени порциями добавляли PEG5000-моно(метиловый эфир) (500 г, 0,100 моль) по мере роста температуры. Полученную суспензию перемешивали при этой температуре в течение 4 ч и затем охлаждали до комнатной температуры. Добавляли воду (500 мл) и продукт экстрагировали CH2Cl2 (2×1000 мл). CH2Cl2 удаляли в вакууме (не досуха, только до вязкого масла) и полученное масло перекристаллизовывали из смеси THF (400 мл)/гексаны (200 мл) (добавляют THF, нагревают и затем добавляют гексаны, перемешивают путем вращения до исчезновения мутности примерно 30 сек) с получением 499,93 г (99% от теоретической массы) целевого продукта в виде не совсем белого твердого вещества:1Н ЯМР (CDCl3) δ 3.81 (m, 2Н), 3.64 (m, 422Н), 3.46 (m, 2Н), 3.38 (s, 3H), 3.17 (m, 1Н), 2.79 (m, 1Н), 2.61 (m, 1Н).13С ЯМР (CDCl3) δ 71.97, 71.89, 70.53, 59.00, 50.76, 44.22.

Синтез mPEG5000-диола: mPEG5000-эпоксид (499,93 г, 98,88 ммоль) растворяли в 0,5 М H2SO4 (2000 мл) и перемешивали при комнатной температуре в течение 1,5 ч (примерно 30 мин до полного растворения вещества и 1 дополнительный час реакции). Затем реакционную смесь экстрагировали CH2Cl2 (2×1000 мл). CH2Cl2 удаляли в вакууме (не досуха, только до вязкого масла) и полученное масло перекристаллизовывали из смеси THF/гексаны (400 мл: 200 мл) (добавляют THF, нагревают и затем добавляют гексаны, перемешивают путем вращения до исчезновения мутности примерно 30 сек) с получением 411,88 г (82% от теоретической массы) целевого продукта в виде не совсем белого твердого вещества:1Н ЯМР (CDCl3) δ 3.75 (m, 2Н), 3.57 (m, 422Н), 3.39 (m, 2Н), 3.31 (s, 3H).13С ЯМР (CDCl3) δ 72.88, 71.91, 70.55, 63.93, 59.02.

Синтез mPEG5000-альдегида: mPEG5000-диол (208 г, 40,99 ммоль) растворяли в воде (320 мл) и перемешивали при комнатной температуре в течение примерно 45 мин. К этому мутному раствору добавляли предварительно приготовленный раствор NalO4 (10,7 г, 50 ммоль) в воде (90 мл) равными порциями в течение примерно 30 мин. Мутность исчезала через примерно 1,5-2 ч после последнего добавления окислителя. Затем реакционную смесь перемешивали в течение 16 ч и гасили путем добавления пропиленгликоля (1,20 мл). Затем водную реакционную смесь экстрагировали CH2Cl2 (1×1000 мл, 1×500 мл). Органические слои объединяли и CH2Cl2 удаляли в вакууме (не досуха, только до вязкого масла). Полученное золотистое масло перекристаллизовывали из смеси THF/гексаны (400 мл: 200 мл) (добавляют THF, нагревают и затем добавляют гексаны, перемешивают путем вращения до исчезновения мутности примерно 30 сек) с получением 183,77 г (89% от теоретической массы) целевого продукта в виде белого твердого вещества:1Н ЯМР (CDCl3) δ 9.66 (m, 1Н), 4.10 (m, 2Н), 3.75 (m, 2Н), 3.58 (m, 422Н), 3.39 (m, 2H), 3.31 (s, 3H).13C ЯМР (CDCl3) δ 200.94, 71.90, 71.18, 70.54, 59.01, 53.56.

Синтез дибензил-αHmPP5000: mPE65000-альдегид (181,453 г, 35,97 ммоль) растворяли в CH2Cl2 (850 мл), добавляли триэтиламин (5,01 мл, 35,97 ммоль) и оставляли перемешиваться в течение примерно 30 мин. После этого медленно добавляли дибензилфосфит (9,43 г, 35,97 ммоль). После перемешивания при комнатной температуре в течение 48 ч растворитель удаляли в вакууме (не досуха, только до вязкого масла) и полученное масло перекристаллизовывали из смеси THF/гексаны (350 мл: 175 мл) (добавляют THF, нагревают и затем добавляют гексаны, перемешивают путем вращения до исчезновения мутности примерно 30 сек) с получением 175,59 г (92% от теоретической массы) целевого продукта в виде белого твердого вещества:1Н ЯМР (CDCl3) δ 7.34 (m, 10Н), 5.10 (m, 4Н), 3.79 (m, 1Н), 3.75 (m, 2Н), 3.64 (m, 460Н), 3.53 (m, 4Н), 3.37 (s, 3H).13С ЯМР (CDCl3) δ 136.40, 136.27, 128.74, 128.60, 128.43, 127.99, 71.98, 71.17, 70.61, 68.67, 68.13, 64.85, 67.59, 59.08.31Р ЯМР (CDCl3) δ 23.92.

Синтез aHmPP5000: сухой дибензил-αHmPP5000 (122,80 г, 23,15 ммоль) суспендировали в абсолютном этаноле (500 мл) и воде (25 мл) и медленно добавляли 10% Pd на угле (4,0 г). Затем реакционную смесь перемешивали в атмосфере Н2 (давление баллона) до окончания захвата. Pd на угле удаляли путем фильтрации через подушку целита, и растворитель удаляли из фильтрата в вакууме (не досуха, только до вязкого масла). Полученное масло перекристаллизовывали из смеси THF/гексаны (300 мл: 150 мл) с получением 109,7 г (94% от теоретической массы) целевого продукта в виде белого порошка:1Н ЯМР (CDCl3) δ 3.81 (m, 4Н), 3.64 (m, 366Н), 3.47 (m, 2Н), 3.38 (s, 3H) м.д.13С ЯМР (CDCl3) δ 72.00, 71.04, 70.54, 59.11 м.д.31Р ЯМР (CDCl3) δ 22.85 м.д.
Пример 4: Синтез PEGSk-дифосфата (ВРР5000):

Синтез mPEG5000-1,2-бис(дибензилфосфата): дибензил-N,N-диизопропилфосфорамидит (16,34 г, 97,3 ммоль) растворяли в CH2Cl2 (600 мл). Добавляли тетразол (0,45 М в ацетонитриле, 47,3 ммоль) и полученный раствор перемешивали при комнатной температуре в течение 30 мин. Затем добавляли mPEG5000-диол (60,0 г, 11,8 ммоль), растворенный в CH2Cl2 (100 мл), и полученный раствор перемешивали при 50°C в течение 48 ч. Затем реакционную смесь охлаждали до комнатной температуры и в реакционную смесь добавляли трет-бутилгидропероксид (4,26 г, 47,3 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 4,5 ч и затем промывали 10% (мас./об.) раствором сульфита натрия (200 мл). Затем полученный водный слой экстрагировали CH2Cl2 (500 мл). Органические слои объединяли и растворитель удаляли в вакууме с получением не совсем белого твердого вещества, которое очищали посредством колоночной хроматографии (от 100% CH2Cl2 до 20% МеОН/80% CH2Cl2) на силикагеле с получением 47,47 г (72%) целевого продукта в виде белого твердого вещества.1Н ЯМР (CDCl3) δ 7.31 (m, 20Н), 5.04 (m, 8Н), 4.63 (m, 1Н), 4.14 (m, 2Н), 3.74 (m, 3H), 3.65 (m, 440Н), 3.38 (s, 3H) м.д.31Р ЯМР (CDCl3) δ 0.03, -0.75 м.д.

Синтез PEGSk-дифосфата (ВРР5000): mPEG5000-1,2-бис(дибензилфосфат) (46,46 г, 8,33 ммоль) растворяли в этаноле (300 мл). Затем добавляли 10% Pd на углероде (2 г) и полученную суспензию перемешивали в атмосфере Н2 (1 атм (0,1 МПа)) в течение 48 ч. Катализатор удаляли фильтрацией через набивку целита и в результате удаления растворителя из фильтрата получали прозрачное масло. Масло перекристаллизовывали из смеси 2:1 THF/гексаны (300 мл). Кристаллы собирали посредством вакуумной фильтрации и промывали гексанами (2×50 мл) с получением 40,4 г (74%) целевого продукта в виде белого твердого вещества.1Н ЯМР (CDCl3) δ 4.71 (m, 1Н), 4.20 (m, 2Н), 3.65 (m, 440Н), 3.38 (s, 3H) м.д.13С ЯМР (CDCl3) 6 74.90, 71.70, 70.34, 65.86, 58.81 м.д.31Р ЯМР (CDCl3) δ 1.18, 0.53 м.д.
Пример 5: Синтез очищенных наночастиц SPIO, покрытых PEG5000-альфа-гидроксифосфонатом (aHmPP5000)
9,177 г лигандов αHmPP5000 помещали в 1 л колбу Эрленмейера, содержащую магнитную мешалку. Добавляли 8,955 мл раствора NaOH (0,2 М) вместе с 104 мл деионизованной воды и абсолютным ETOH (200 мл). Колбу накрывали часовым стеклом и перемешивали магнитной мешалкой при аккуратном нагревании до получения прозрачного бесцветного раствора. Указанный раствор помещали в 2 л реактор, снабженный рубашкой, с механической мешалкой, тефлоновой якорной мешалкой, термопарой, входом азота и барботером и с обратным холодильником. Колбу промывали абсолютным ETOH (2×25 мл), и промывочную жидкость добавляли в реактор. Прозрачный бесцветный раствор перемешивали при 100 об/мин. 330,6 мл раствора ядер наночастиц из оксида железа в бензиловом спирте (6,05 г Fe/мл) добавляли в реакционную смесь с помощью промытого основанием, ополоснутого DI (деионизованной) водой, высушенного в сушилке градуированного цилиндра через воронку для порошка. Градуированный цилиндр промывали абсолютным ETOH (2×25 мл) и промывочную жидкость добавляли в реактор. Наблюдали однофазный темный красно-коричневый раствор. Скорость перемешивания увеличивали до 200 об/мин и реактор закупоривали пробкой и нагревали в атмосфере азота при перемешивании в течение 18 ч при 50°C (внутренняя температура). После нагревания в течение 18 ч реактор охлаждали до 25°C. В реактор добавляли EtOAc (660 мл) и деионизованную воду (320 мл) и вставляли перегородки для усиленного перемешивания. Реакционную смесь перемешивали при 500 об/мин в течение 10 мин. Перемешивание останавливали и фазам давали разделиться. Мутная смесь начинала разделяться на фазы через менее чем 10 мин, и явное разделение фаз наблюдалось через примерно 30 мин. Нижнюю водную фазу (содержащую частицы SPIO), состоящую из 247 г темного красно-коричневого раствора, сливали из реактора в 2 л 24/40 круглодонную колбу. Раствор разбавляли водой до 800 мл (теоретически примерно 2,5 мг Fe/мл) и быстро выпаривали на роторном испарителе для удаления любых оставшихся органических летучих соединений. Затем раствор стерильно фильтровали (0,22 мкм) и очищали посредством фильтрования из тангенциального потока (TFF), используя мембрану 50 кДа PES Millipore 0,1 м2. Продукт промывали 24 л деионизованной воды в течение более чем примерно 3 ч при давлении примерно 10 фунтов на кв. дюйм (68,95 кПа), поддерживая объем 2,5 л в резервуаре для ретентата. По завершению промывки ретентат концентрировали до примерно 120 г (примерно 16 мг Fe/мл). Конечные частицы имели гидродинамический диаметр 19,2 нм при измерении в 150 мМ растворе хлорида натрия посредством динамического светорассеяния.
Пример 6: Стерилизации в автоклаве с избытком лигандов
Лиганды в виде мононатриевой соли (от 0,01 до 0,25 молярных эквивалентов Fe) растворяли в водном растворе, содержащем покрытые лигандами наночастицы SPIO. Дополнительно добавляли воду с получением раствора с конечной концентрацией железа 1-30 мг Fe/мл. Полученный раствор автоклавировали в герметично закрытом стеклянном контейнере, используя автоклав Tuttnauer 2340ЕА или Steris SV-148H в течение 15 мин при 121°C.
Пример 7: Стерилизации в автоклаве с избытком лигандов и другими добавками
Лиганды в виде мононатриевой соли (от 0,01 до 0,25 молярных эквивалентов Fe) растворяли в водном растворе, содержащем покрытые лигандами наночастицы SPIO. Дополнительно добавляли воду и другие добавки (ETOH, 10% от конечного объема; или d-маннит, 5% от конечного объема) с получением раствора с конечной концентрацией железа 1-30 мг Fe/мл. Полученный раствор автоклавировали в герметично закрытом стеклянном контейнере, используя автоклав Tuttnauer 2340ЕА или Steris SV-148Н, в течение 15 мин при 121°C.
Пример 8: Стерилизации в автоклаве без избытка лигандов
Наночастицы SPIO, покрытые лигандами, разбавляли дополнительно водой с получением раствора с конечной концентрацией железа 1-30 мг Fe/мл. Полученный раствор автоклавировали в герметично закрытом стеклянном контейнере, используя автоклав Tuttnauer 2340ЕА или Steris SV-148H, в течение 15 мин при 121°C.
Пример 9: Стерилизация в автоклаве с другими добавками и без избытка лигандов
Водный раствор, содержащий наночастицы SPIO, покрытые лигандами, дополнительно разбавляли водой и другими добавками (ETOH, 10% от конечного объема, или d-маннит, 5% от конечного объема) с получением раствора с конечной концентрацией железа 1-30 мг Fe/мл. Полученный раствор автоклавировали в герметично закрытом стеклянном контейнере, используя автоклав Tuttnauer 2340ЕА или Steris SV-148H, в течение 15 мин при 121°C.
Пример 10: Общая методика измерения размера наночастиц SPIO посредством динамического светорассеяния (DLS)
Аликвоту раствора SPIO (до или после автоклава) разбавляли до 0,1-0,3 мг Fe/мл 150 мМ водным NaCl. Полученный раствор пропускали через шприцевый фильтр 0,2 мкм Whatman Anotop 10 и фильтрат собирали в обеспыленную полистирольную кювету для DLS. Размер измеряли, используя прибор Brookhaven Instruments Inc. ZetaPALS, снабженный 90° детектором светорассеяния, и записывали эффективный диаметр.
Данные, представленные в Таблице 1, показывают размер наночастиц SPIO до и после стерилизации в автоклаве в присутствии и в отсутствие избытка лигандов. Наночастицы SPIO, содержащие альфа-гидроксил монофосфатные лиганды, такие как aHmPP350, aHmPP750, aHmPP2000, aHmPP5000 и aHmPP30000, демонстрируют практически одинаковый размер до и после стерилизации в автоклаве в присутствии избытка лигандов и добавок. Так, размер каждой из наночастиц составляет 10,9, 11,2, 15,3, 20,8 и 29,2 нм соответственно после стерилизации в автоклаве в присутствии избытка лигандов, в то время как наночастицы образуют агрегат с диаметром более 200 нм в отсутствие избытка лигандов во всех этих препаратах.
Наночастицы SPIO с mPP2000 и mPP5000 также демонстрируют похожий профиль агрегации в отсутствии каких-либо добавок. Аналогично наночастицы SPIO, содержащие монофосфатные лиганды, такие как mPP2000, демонстрируют практически одинаковый размер - примерно 23,5 и 24 нм до и после стерилизации в автоклаве соответственно в присутствии избытка лигандов и в отсутствие каких-либо добавок, в то время как наночастицы образуют агрегат с диаметром более 200 нм в отсутствие избытка лигандов в препарате.
Аналогичные наблюдения также были сделаны для наночастиц SPIO, содержащих дифосфатные лиганды, такие как ВРР5000, которые демонстрируют практически одинаковый размер, примерно 26,4 и 26,6 нм, до и после стерилизации в автоклаве, соответственно в присутствии избытка лигандов и этанольных добавок, в то время как наночастицы образуют частицу с диаметром примерно 47,8 нм, что больше, чем композиция одной наночастицы, в отсутствие избытка лигандов в препарате.


Хотя только некоторые признаки изобретения проиллюстрированы и описаны в данном описании изобретения, многие модификации и изменения будут ясны специалистам в данной области. Следовательно, следует понимать, что прилагаемая формула изобретения, как предполагается, охватывает все такие модификации и изменения, которые подпадают под сущность изобретения.
Реферат
Изобретение относится к способам стабилизации препарата наночастиц. Способ стабилизации препарата наночастиц включает стадии: а) очистки композиции с получением очищенной композиции, где очищенная композиция содержит по меньшей мере одну наночастицу, находящуюся в жидком носителе, где наночастица содержит ядро, включающее парамагнитный металл, представляющий собой железо, и оболочку, присоединенную к ядру, где оболочка содержит совокупность лигандов, включающую фосфат, фосфонат или их комбинацию и содержащую полиэтиленгликолевую (PEG) функциональную группу; б) добавления некоторого количества совокупности лигандов к очищенной композиции с получением препарата, где по меньшей мере часть добавленного количества лигандов остается не присоединенной к ядру, при этом лиганды оболочки и лиганды, добавленные к очищенной композиции, являются структурно-идентичными; и в) стерилизации препарата посредством автоклавирования. 12 з.п. ф-лы, 2 ил., 10 пр., 1 табл.
Формула
Документы, цитированные в отчёте о поиске
Стабилизация термопластичных нанокомпозитов

Комментарии