Контрастные агенты на основе наночастиц для диагностической визуализации - RU2526181C2
Код документа: RU2526181C2
Чертежи





Описание
ПРЕДШЕСТВУЮЩИЙ УРОВЕНЬ ТЕХНИКИ
Данная заявка в общем относится к контрастным агентам для диагностической визуализации, например для использования в рентгеновской/компьютерной томографии (КТ) или магнитно-резонансной визуализации (МРВ). Более конкретно, данная заявка относится к контрастным агентам на основе наночастиц и к способам изготовления и применения таких агентов.
Почти все клинически одобренные диагностические контрастные агенты имеют молекулы небольшого размера. Йодинированные ароматические соединения служат в качестве стандартных рентгеновских или КТ-контрастных агентов, а Gd-хелаты используют для магнитно-резонансной визуализации. Несмотря на то, что их обычно используют для диагностической визуализации, контрастные агенты, имеющие молекулы небольшого размера, могут иметь определенные недостатки, такие как фильтрация через стенки кровеносных сосудов и, следовательно, краткосрочная циркуляция в крови, пониженная чувствительность, высокая вязкость и высокая осмоляльность. С этими соединениями обычно связаны почечные осложнения у группы пациентов. Известно, что этот класс агентов, имеющих небольшие молекулы, быстро выводится из организма, ограничивая время, в течение которого они могут быть использованы для эффективного формирования изображения сосудистой системы, а также что касается других показателей, затрудняя направленную доставку этих агентов в болезненные участки. Таким образом, существует потребность в новом классе контрастных агентов.
Проводятся всесторонние исследования наночастиц для применения в медицине, как для диагностического, так и для терапевтического применения. Несмотря на то, что лишь несколько агентов на основе наночастиц клинически одобрены для применения в магнитно-резонансной визуализации и для доставки лекарственных средств, сотни таких агентов все еще находятся в разработке. Имеется существенное доказательство того, что наночастицы имеют преимущества по сравнению с используемыми в настоящее время агентами на основе молекул небольшого размера с точки зрения эффективности для диагностики и терапии. Однако влияние размера частиц, структуры и поверхностных свойств на биораспределение и клиренс in vivo агентов на основе наночастиц недостаточно хорошо осмыслено. Наночастицы, в зависимости от их размера, имеют тенденцию оставаться в организме в течение более длительных периодов времени по сравнению с небольшими молекулами. В случае контрастных агентов предпочтительно иметь максимальный почечный клиренс агентов из организма без краткосрочного или долгосрочного токсического действия на какие-либо органы.
Принимая во внимание вышесказанное, существует потребность в контрастных агентах или агентах визуализации на основе наночастиц с улучшенными свойствами, относящимися, в частности, к почечному клиренсу и токсическим эффектам.
КРАТКОЕ ОПИСАНИЕ СУЩНОСТИ ИЗОБРЕТЕНИЯ
Согласно настоящему изобретению предложен новый класс контрастных агентов на основе наночастиц для рентгеновской визуализации, КТ и МРВ. Авторы настоящего изобретения обнаружили, что наночастицы, функционализированные цвиттер-ионными группами, неожиданно улучшают визуализирующие характеристики по сравнению с контрастными агентами, имеющими молекулы небольшого размера. Наночастицы по настоящему изобретению имеют характеристики, обуславливающие минимальное удерживание частиц в организме по сравнению с другими наночастицами. Эти наночастицы могут обеспечивать улучшенные характеристики и имеют преимущество в одной или более следующих сферах: надежный синтез, пониженная стоимость, усиленный контраст изображения, увеличенный полупериод жизни в крови и пониженная токсичность.
Настоящее изобретение относится к наночастицам и к композиции, содержащей указанные наночастицы. Изобретение также относится к способу изготовления указанных наночастиц и к способам их применения, а также к их применению.
Таким образом, в одном аспекте данное изобретение относится к наночастице. Наночастица содержит ядро, имеющее поверхность ядра, по существу не содержащую диоксид кремния, и оболочку, присоединенную к поверхности ядра. Оболочка содержит по меньшей мере одну силан-функционализированную цвиттер-ионную группировку. В одном из воплощений ядро содержит переходный металл. В другом воплощении ядро содержит соединение переходного металла, выбранное из группы, состоящей из оксидов, карбидов, сульфидов, нитридов, фосфидов, боридов, галогенидов, селенидов, теллуридов или их комбинаций. В одном из воплощений ядро содержит металл с атомным номером ≥34.
В некоторых воплощениях наночастица содержит ядро на основе оксида тантала, имеющее поверхность ядра, по существу не содержащую диоксид кремния, и оболочку, присоединенную к поверхности ядра, где оболочка содержит по меньшей мере одну силан-функционализированную цвиттер-ионную группировку. Наночастица имеет средний размер частицы вплоть до примерно 6 нм.
В некоторых других воплощениях наночастица содержит суперпарамагнитное ядро на основе оксида железа, имеющее поверхность ядра, по существу не содержащую диоксид кремния, и оболочку, присоединенную к поверхности ядра, где оболочка содержит по меньшей мере одну силан-функционализированную цвиттер-ионную группировку. Наночастица имеет средний размер частицы вплоть до примерно 50 нм.
В одном или более воплощениях данное изобретение относится к композиции диагностического агента. Данная композиция содержит множество наночастиц, где по меньшей мере одна наночастица из этого множества содержит ядро, имеющее поверхность ядра, по существу не содержащую диоксид кремния, и оболочку, присоединенную к поверхности ядра. Оболочка содержит по меньшей мере одну силан-функционализированную цвиттер-ионную группировку. В некоторых воплощениях указанная композиция дополнительно содержит фармацевтически приемлемый носитель и возможно один или более эксципиентов.
В одном из аспектов данное изобретение относится к способам изготовления наночастиц. Этот способ включает (а) получение ядра, имеющего поверхность ядра, по существу не содержащую диоксид кремния, и (б) размещение оболочки, присоединенной к поверхности ядра, где оболочка содержит силан-функционализированную цвиттер-ионную группировку.
В другом аспекте данное изобретение относится к способу, включающему введение композиции диагностического агента субъекту и визуализацию субъекта с использованием рентгеновского устройства. Композиция диагностического агента содержит множество наночастиц, где по меньшей мере одна наночастица из этого множества содержит ядро и оболочку. Оболочка содержит по меньшей мере одну силан-функционализированную цвиттер-ионную группировку. В одном или более воплощениях ядро содержит оксид тантала.
В некоторых воплощениях данный способ включает введение композиции диагностического агента субъекту и визуализацию субъекта с использованием диагностического устройства. Композиция диагностического агента содержит множество наночастиц. По меньшей мере одна наночастица из этого множества содержит ядро, имеющее поверхность ядра, по существу не содержащую диоксид кремния, и оболочку, присоединенную к поверхности ядра. Оболочка содержит по меньшей мере одну силан-функционализированную цвиттер-ионную группировку.
В одном или более воплощениях способ применения дополнительно включает мониторинг доставки композиции диагностического агента субъекту с использованием диагностического устройства и диагностирование субъекта. В некоторых воплощениях диагностическое устройство осуществляет метод визуализации, выбранный из группы, состоящей из магнитно-резонансной визуализации, оптической визуализации, оптической когерентной томографии, рентгеновской визуализации, компьютерной томографии, позитронно-эмиссионной томографии или их комбинаций.
В еще одном аспекте данное изобретение относится к применению наночастиц 10, описанных выше, для изготовления композиции для использования в качестве композиции диагностического агента.
ГРАФИЧЕСКИЕ МАТЕРИАЛЫ
Эти и другие признаки, аспекты и преимущества настоящего изобретения станут лучше понятны после прочтения следующего далее подробного описания со ссылками на прилагаемые графические материалы, где одноименными символами обозначены одноименные компоненты на всех графических материалах.
На Фиг.1 изображен вид в поперечном сечении наночастицы, содержащей ядро и оболочку, в соответствии с некоторыми воплощениями настоящего изобретения.
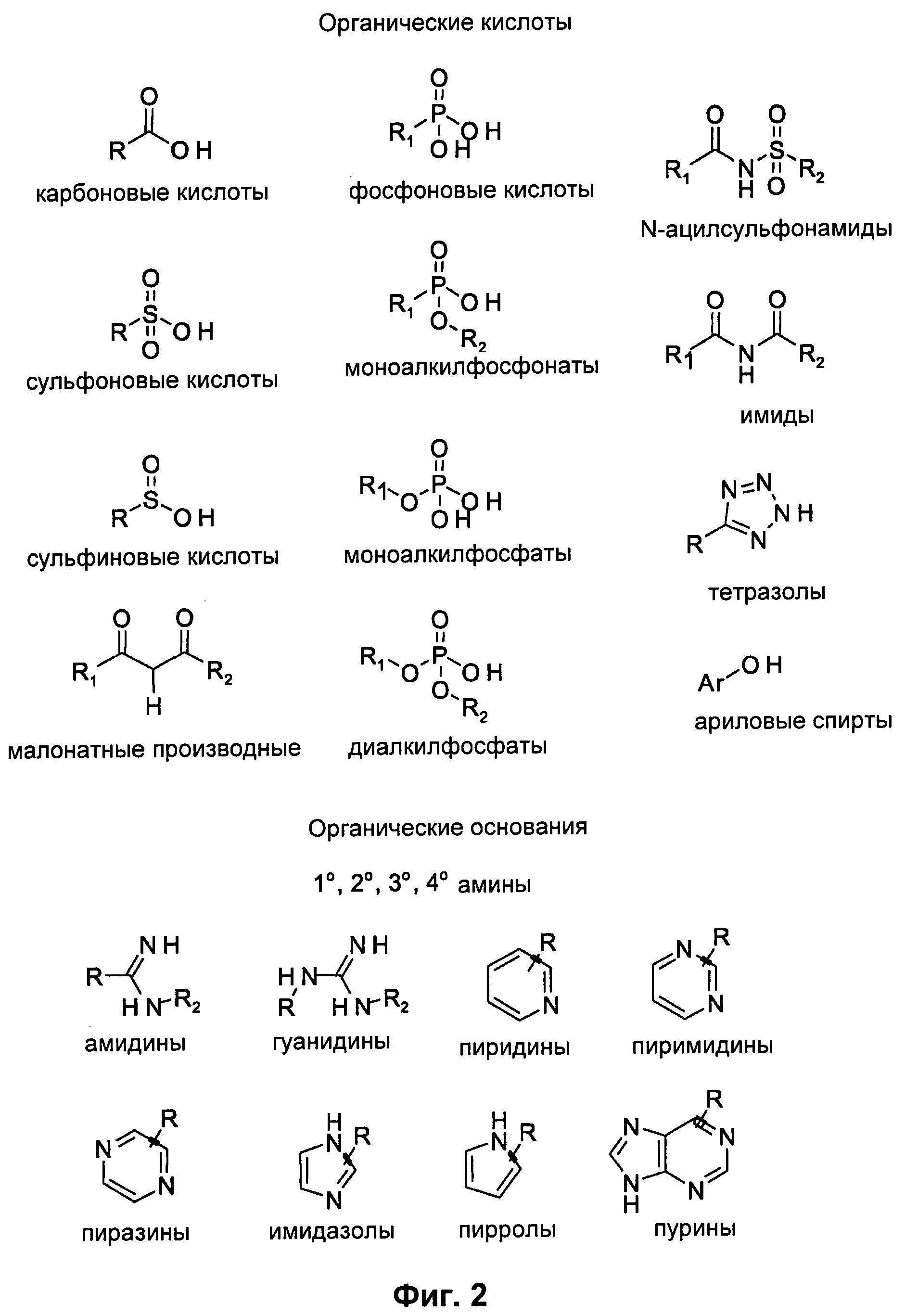
На Фиг.2 указаны органические кислоты и органические основания, из которых могут быть образованы цвиттер-ионные функциональные группы.
На Фиг.3A, 3B, 3C и 3D указаны силан-функционализированные цвиттер-ионные группировки, которые могут взаимодействовать с ядром, создавая оболочку, содержащую силановые функциональные цвиттер-ионные группировки.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Следующее далее подробное описание изобретения является иллюстративным и не должно рассматриваться как ограничивающее изобретение по данной заявке или использование данного изобретения. Кроме того, изобретение не ограничивается какой-либо теорией, представленной в предшествующем уровне техники или приведенном ниже подробном описании.
В последующем описании изобретения и в формуле изобретения дается ссылка на ряд терминов, имеющих указанные ниже значения. Формы единственного числа включают объекты во множественном числе, если контекст четко не диктует иное. Приблизительные формулировки, которые использованы в данной заявке по всему описанию изобретения и в формуле изобретения, могут быть применимы для модификации любого количественного представления, которое может в допустимых пределах варьировать без изменения основной функции, к которой оно относится. Соответственно, значение, модифицированное таким термином, как "примерно", не должно ограничиваться указанным точным значением. В некоторых случаях приблизительные формулировки могут соответствовать точности прибора для измерения данного значения. Аналогично, в сочетании с термином может быть использовано выражение "не содержащий", и оно может охватывать несущественное количество или следовые количества и при этом все еще считаться не содержащим данный модифицированный термин. Например, "не содержащий растворитель" или "свободный от растворителя" и подобные термины и фразы могут относиться к случаю, когда значительная часть растворителя, некоторая часть растворителя или весь растворитель удален(а) из сольватированного вещества.
Одно или более воплощений данного изобретения относятся к наночастице, как она представлена на Фиг.1. Наночастица 10 содержит ядро 20, имеющее поверхность ядра 30, по существу не содержащую диоксид кремния. В одном или более воплощениях ядро 20 содержит переходный металл, например соединение элемента, представляющего собой переходный металл. Наночастица 10 дополнительно содержит оболочку 40, которая также называется покрытием, присоединенную к поверхности ядра 30. Оболочка 40 содержит по меньшей мере одну силан-функционализированную цвиттер-ионную группировку. Поскольку поверхность ядра 30 по существу не содержит диоксид кремния, силан-функционализированные цвиттер-ионные группировки не связаны с диоксидом кремния, а связаны с ядром 20 у поверхности ядра 30 без какого-либо промежуточного слоя диоксида кремния. Силан-функционализированная цвиттер-ионная группировка содержит силановую группировку и цвиттер-ионную группировку. Используемый в данной заявке термин "цвиттер-ионная группировка" относится к группировке, которая является электронейтральной, но несет формальные положительные и отрицательные заряды на разных атомах. Цвиттер-ионы являются полярными ионами и обычно имеют высокую растворимость в воде и плохую растворимость в большинстве органических растворителей. В некоторых воплощениях "цвиттер-ионная группировка" относится к предшественнику цвиттер-ионной группировки. В таких воплощениях предшественник подвергается вторичной или последующей химической реакции с образованием цвиттер-ионной группировки.
"Наночастица" в данной заявке относится к частицам, имеющим нанометровый размер частицы, как правило, менее 1 микрона. В одном из воплощений наночастица имеет размер частицы вплоть до примерно 50 нм. В другом воплощении наночастица имеет размер частицы вплоть до примерно 10 нм. В еще одном воплощении наночастица имеет размер частицы вплоть до примерно 6 нм.
Одно или более воплощений настоящего изобретения относятся к композиции, содержащей множество наночастиц. Множество наночастиц может быть охарактеризовано одним или более средним размером частиц, средним диаметром или размером частиц, распределением частиц по размерам, средней площадью поверхности частиц, формой частиц или геометрией поперечного сечения частицы. Кроме того, множество наночастиц может иметь распределение частиц по размерам, которое может быть охарактеризовано как среднечисленным размером, так и средневзвешенным размером частиц. Среднечисленный размер частиц может быть представлен формулой SN=Σ(sini)/Σni, где ni означает число частиц, имеющих размер частицы si. Средневзвешенный размер частиц может быть представлен формулой SW=Σ(sini2)/Σ(sini). Когда все частицы имеют одинаковый размер, тогда SN и SW могут быть равными. В одном воплощении может иметь место распределение размеров и SN может отличаться от SW. Отношение средневзвешенного к среднечисленному может быть определено как коэффициент полидисперсности (SPDI). В одном из воплощений SPDI может быть равным примерно 1. В других воплощениях соответственно SPDI может находиться в диапазоне от примерно 1 до примерно 1,2, от примерно 1,2 до примерно 1,4, от примерно 1,4 до примерно 1,6 или от примерно 1,6 до примерно 2,0. В одном из воплощений SPDI может находиться в диапазоне, который больше примерно 2,0.
В одном из воплощений множество наночастиц может иметь распределение частиц по размерам, выбранное из группы, состоящей из нормального распределения, мономодального распределения и бимодального распределения. Некоторые распределения частиц по размерам могут быть полезны для обеспечения некоторых преимуществ. Мономодальное распределение может относиться к примерно однотипному распределению частиц по размерам. В другом воплощении в состав композиции могут быть включены совокупности частиц, имеющие два несовпадающих диапазона размеров в подмножестве (бимодальное распределение).
Наночастица может иметь множество форм и геометрий поперечного сечения, которые могут зависеть, частично, от способа, используемого для изготовления частиц. В одном из воплощений наночастица может иметь форму сферы, стержня, чешуйка, волокна, пластинки, проволоки, куба или уса. Наночастица может включать частицы, имеющие две или более вышеупомянутые формы. В одном из воплощений геометрия поперечного сечения частицы может представлять собой одну или более из следующих: круглая, эллипсоидная, треугольная, прямоугольная или многоугольная. В одном из воплощений наночастица может состоять по существу из несферических частиц. Например, такие частицы могут иметь форму эллипсоидов, которые могут иметь все три основные оси различной длины или могут представлять собой сплющенные или сжатые эллипсоиды вращения. Несферические наночастицы альтернативно могут быть ламинированными по форме, где термин "ламинированный" относится к частицам, у которых максимальный размер по одной оси значительно меньше максимального размера по каждой из двух других осей. Несферические наночастицы могут также иметь форму усеченной пирамиды, или усеченного конуса, или вытянутого стержня. В одном из воплощений наночастицы могут быть неоднородными по форме. В одном из воплощений множество наночастиц может состоять по существу из сферических наночастиц.
Совокупность наночастиц может иметь высокое соотношение поверхность/объем. Наночастица может быть кристаллической или аморфной. В одном из воплощений может быть использован один тип (размер, форма и т.п.) наночастиц или смеси разных типов наночастиц. Если используют смесь наночастиц, то в композиции они могут быть распределены равномерно или неравномерно.
В одном из воплощений наночастица может быть стабильной к образованию агрегатов или агломератов. Агрегат может включать в себя более чем одну наночастицу в физическом контакте с другой наночастицей, а агломераты могут включать в себя более чем один агрегат в физическом контакте с другим агрегатом. В некоторых воплощениях наночастицы могут быть несильно агломерированными и/или агрегированными, так что частицы относительно легко могут быть диспергированы в композиции.
В одном из воплощений ядро содержит переходный металл. Используемый в данной заявке термин "переходный металл" относится к элементам Групп 3-12 Периодической таблицы. В некоторых воплощениях ядро содержит одно или более соединений переходных металлов, таких как оксиды, карбиды, сульфиды, нитриды, фосфиды, бориды, галогениды, селениды и теллуриды, которые содержат один или более этих элементов, представляющих собой переходные металлы. Соответственно, в этом описании термин "металл" необязательно означает, что присутствует металл с нулевой валентностью; напротив, использование этого термина означает присутствие металлического или неметаллического вещества, которое содержит элемент, представляющий собой переходный металл, в качестве составной части.
В некоторых воплощениях наночастица может содержать единственное ядро. В некоторых других воплощениях наночастица может содержать множество ядер. В тех воплощениях, где наночастица содержит множество ядер, эти ядра могут быть одинаковыми или разными. В некоторых воплощениях композиция наночастицы содержит по меньшей мере два ядра. В других воплощениях каждая из композиций наночастицы содержит только одно ядро.
В некоторых воплощениях ядро содержит единственное соединение переходного металла. В другом воплощении ядро содержит два или более соединений переходного металла. В воплощениях, где ядро содержит два или более соединений переходного металла, элемент, представляющий собой переходный металл, или катион переходного металла может представлять собой один и тот же элемент или два или более разных элементов. Например, в одном из воплощений ядро может содержать единственное соединение металла, такое как оксид тантала или оксид железа. В другом воплощении ядро может содержать два или более разных металлических элементов, например оксид тантала и оксид гафния, или оксид тантала и нитрид гафния, или оксиды железа и марганца. В другом воплощении ядро может содержать два или более соединений одного и того же металлического элемента, например оксид тантала и сульфид тантала.
В одном из воплощений ядро создает усиление контраста в рентгеновской визуализации или компьютерной томографии (КТ). В обычном КТ-сканере используется широкий спектр энергии рентгеновского излучения от примерно 10 кэВ до примерно 150 кэВ. Специалисты в данной области осведомлены, что величину ослабления рентгеновского излучения, проходящего через конкретный материал, на единицу длины выражают в виде линейного коэффициента ослабления. В рентгеновском энергетическом спектре, типичном в КТ-визуализации, ослабление рентгеновского излучения веществами происходит в результате эффекта фотоэлектрического поглощения и эффекта комптоновского рассеяния. Кроме того, известно, что линейный коэффициент ослабления зависит от энергии падающего рентгеновского луча, плотности материала (связанной с молярной концентрацией) и атомного номера (Z) вещества. Для молекулярных соединений или смесей разных атомов "эффективный атомный номер", Zeff, может быть вычислен как функция атомного номера составляющих элементов.
Эффективный атомный номер соединения известной химической формулы определяют по уравнению:

где Zk означает атомный номер элементов-металлов, Р означает общее количество элементов-металлов и означает массовую долю элементов-металлов по отношению к общей молекулярной массе молекулы (связанной с молярной концентрацией). Выбор оптимальной энергии падающего рентгеновского луча для КТ-визуализации зависит от размера объекта, который визуализируют, и ожидается, что она не будет сильно отличаться от номинальных значений. Общеизвестно, что линейный коэффициент ослабления рентгеновского излучения веществом, представляющим собой контрастный агент, находится в линейной зависимости от плотности вещества, т.е. коэффициент линейного ослабления может увеличиваться с увеличением плотности вещества или с увеличением молярной концентрации контрастного вещества. Однако практические аспекты введения контрастного агента пациентам и ассоциированные токсические эффекты ограничивают молярную концентрацию, которая может быть достигнута. Поэтому разумно разделять вещества, представляющие собой контрастные агенты, по их эффективному атомному номеру. На основе моделирования усиления КТ контраста типичных веществ для типичного КТ энергетического спектра с молярной концентрацией приблизительно 50 мМ установлено, что вещества с эффективным атомным номером не менее 34 могут давать соответствующее усиление контраста примерно 30 единиц шкалы Хаунсфилда (HU), или контраст на 3% выше, чем дает вода. Таким образом, в некоторых воплощениях ядро содержит вещество, имеющее эффективный атомный номер не менее 34. Смотри, например, Главу 1 в Handbook of Medical Imaging, Volume 1. Physics и Psychophysics, Eds. J.Beutel, H.L.Kundel, R.L.Van Metter, SPIE Press, 2000.
Ядро, которое содержит переходные металлы с относительно высоким атомным номером, как описано выше, может обеспечивать воплощения, имеющие определенные желательные характеристики. В таких воплощениях ядро в значительной степени непроницаемо для рентгеновских лучей, то есть вещество ядра пропускает значительного меньше рентгеновского излучения, чем вещества, обычно находящиеся в живых организмах, что свидетельствует о полезности частиц в качестве контрастных агентов для применения в рентгеновской визуализации, такой как компьютерная томография (КТ). Примеры элементов, представляющих собой переходные металлы, которые могут обеспечивать это свойство, включают вольфрам, тантал, гафний, цирконий, молибден, серебро и цинк. Оксид тантала является одним из конкретных примеров подходящей композиции ядра для применения в рентгеновской визуализации. В одном или более воплощениях ядро наночастицы содержит оксид тантала и наночастица имеет размер частицы вплоть до примерно 6 нм. Это воплощение может быть особенно привлекательным для применения в методах визуализации с использованием рентгеновских лучей для формирования изображения благодаря высокой степени непроницаемости для рентгеновских лучей содержащего тантал ядра и небольшому размеру, что способствует, например, быстрому почечному клиренсу.
В некоторых воплощениях ядро наночастицы содержит по меньшей мере примерно 30 масс.% вещества на основе переходного металла. В некоторых воплощениях ядро содержит по меньшей мере примерно 50 масс.% вещества на основе переходного металла. В еще одном воплощении ядро содержит по меньшей мере примерно 75 масс.% вещества на основе переходного металла. Наличие в ядре высокого содержания вещества на основе переходного металла обеспечивает получение наночастицы с высокой степенью непроницаемости для рентгеновских лучей на единицу объема и, соответственно, более эффективными характеристиками в качестве контрастного агента.
В другом воплощении ядро содержит вещество, которое проявляет магнитные свойства, включая, например, суперпарамагнитные свойства. Используемый в данном описании термин "суперпарамагнитное вещество" относится к веществу, которое может демонстрировать поведение, сходное с парамагнетизмом, даже при температурах ниже температуры Кюри или температуры Нееля. Примеры потенциальных магнитных или суперпарамагнитных веществ включают вещества, содержащие одно или более из следующих: железо, марганец, медь, кобальт или никель. В одном из воплощений суперпарамагнитное вещество содержит суперпарамагнитный оксид железа. В некоторых воплощениях наночастицы по настоящему изобретению могут быть использованы в качестве магнитно-резонансных (MP) контрастных агентов. Эти наночастицы могут давать магнитно-резонансный сигнал Т2*, Т2 или Т1 под действие магнитного поля. В одном или более воплощениях ядро наночастицы содержит суперпарамагнитный оксид железа, и эта наночастица имеет размер частицы вплоть до примерно 50 нм.
В одном из воплощений наночастица 10 содержит оболочку 40, по существу покрывающую ядро 20. Эта оболочка 40 может служить для стабилизации ядра 20, т.е. оболочка 40 может препятствовать контакту одного ядра 20 с соседним ядром 20, предотвращая агрегацию или агломерацию множества таких наночастиц 10, как описано в данном описании, или предотвращая выщелачивание металла или оксида металла, например, по шкале времени экспериментов по визуализации in vivo. В одном из воплощений оболочка 40 может иметь толщину, достаточную для стабилизации ядра 20, и предотвращать такой контакт. В одном из воплощений оболочка 40 имеет среднюю толщину вплоть до примерно 50 нм. В другом воплощении оболочка 40 имеет среднюю толщину вплоть до примерно 3 нм.
Используемый в данном описании термин "по существу покрывающая" означает, что процент покрытия поверхности наночастицы составляет более примерно 20%. "Процент покрытия поверхности" относится к отношению площади поверхности наночастицы, покрытой оболочкой, к площади поверхности, не покрытой оболочкой. В некоторых воплощениях процент покрытия поверхности наночастицы может быть выше примерно 40%.
В некоторых воплощениях оболочка может способствовать улучшению водорастворимости, снижению образования агрегатов, снижению образования агломератов, предотвращению окисления наночастицы, поддержанию однородности объекта ядро-оболочка или обеспечению биосовместимости наночастиц. В другом воплощении вещество или вещества, составляющие оболочку, могут дополнительно содержать другие вещества, которые специализированы для конкретного применения, например, без ограничения, для диагностических применений. Например, в одном из воплощений наночастица может быть дополнительно функционализирована лигандом, обеспечивающим направленную доставку. Лиганд, обеспечивающий направленную доставку, может представлять собой молекулу или структуру, которая обеспечивает направленную доставку наночастицы в нужный орган, ткань или клетку. Лиганд, обеспечивающий направленную доставку, может включать, без ограничения, белки, пептиды, антитела, нуклеиновые кислоты, производные сахаров или их комбинации. В некоторых воплощениях наночастица дополнительно содержит агенты направленной доставки, чтобы при использовании в качестве контрастных агентов частицы могли быть доставлены в конкретные болезненные участки организма субъекта. В некоторых воплощениях наночастицы могут быть использованы в качестве агентов кровяного депо.
Ядра могут быть покрыты одной или более оболочками. В некоторых воплощениях множество ядер могут быть покрыты одинаковой оболочкой. В одном из воплощений единственная оболочка может покрывать все ядра, присутствующие в композиции наночастицы. В некоторых воплощениях индивидуальные ядра могут быть покрыты одной или более оболочками. В другом воплощении все ядра, присутствующие в наночастице, могут быть покрыты двумя или более оболочками. Индивидуальная оболочка может содержать одно и то же вещество или может содержать два или более разных веществ. В воплощениях, где ядро может быть покрыто более чем одной оболочкой, оболочки могут быть из одинакового вещества или из разных веществ.
В одном из воплощений оболочка содержит по меньшей мере одну силан-функционализированную цвиттер-ионную группировку, где силан-функционализированная цвиттер-ионная группировка содержит силановую группировку и цвиттер-ионную группировку. В некоторых воплощениях силановая группировка силан-функционализированной цвиттер-ионной оболочки непосредственно присоединена к ядру.
В одном из воплощений оболочка содержит множество силановых группировок, где по меньшей мере одна из множества силановых группировок функционализирована по меньшей мере одной цвиттер-ионной группировкой. В некоторых воплощениях оболочка содержит силан-функционализированные цвиттер-ионные группировки и силан-функционализированные нецвиттер-ионные группировки. В таких воплощениях соотношение силан-функционализированных цвиттер-ионных группировок и силан-функционализированных нецвиттер-ионных группировок составляет от примерно 0,01 до примерно 100. В некоторых других воплощениях соотношение силан-функционализированных цвиттер-ионных группировок и силан-функционализированных нецвиттер-ионных группировок составляет от примерно 0,1 до примерно 20.
В некоторых воплощениях оболочка содержит множество силан-функционализированных цвиттер-ионных группировок. Термин "множество силан-функционализированных цвиттер-ионных группировок" относится к многочисленным случаям одной конкретной силановой группировки, функционализированной по меньшей мере одной цвиттер-ионной группировкой. Силановые группировки могут быть одинаковыми или разными. В одном из воплощений каждое ядро окружено множеством силан-функционализированных цвиттер-ионных группировок, где все силановые группировки представляют собой силановые группировки одинакового типа. В другом воплощении каждое ядро окружено множеством силан-функционализированных цвиттер-ионных группировок, где силановые группировки представляют собой силановые группировки разных типов. В одном из воплощений каждое множество силановых группировок функционализированы по меньшей мере одной цвиттер-ионной группировкой. В одном из воплощений по меньшей мере одна из множества силановых группировок функционализирована цвиттер-ионной группировкой, так что каждая наночастица, в среднем, содержит по меньшей мере одну цвиттер-ионную группировку. В одном или более воплощениях каждая наночастица содержит множество цвиттер-ионных группировок.
В воплощениях, где оболочка содержит множество силан-функционализированных цвиттер-ионных группировок, силановые группировки и цвиттер-ионные группировки могут быть одинаковыми или разными. Например, в одном из воплощений все силановые группировки могут быть одинаковыми и все цвиттер-ионные группировки могут быть одинаковыми. В другом воплощении силановые группировки одинаковые, а цвиттер-ионные группировки разные. Например, оболочка может содержать две разные силан-функционализированные цвиттер-ионные группировки. Первая группировка содержит силановую группировку типа 1 и цвиттер-ионную группировку типа 1. Вторая группировка содержит силановую группировку типа 1 и цвиттер-ионную группировку типа 2, или силановую группировку типа 2, но цвиттер-ионную группировку типа 1, или силановую группировку типа 2 и цвиттер-ионную группировку типа 2. В одном или более воплощениях силан-функционализированная цвиттер-ионная группировка может содержать две или более цвиттер-ионных группировок. В воплощениях, где силан-функционализированная цвиттер-ионная группировка содержит две или более цвиттер-ионных группировок, цвиттер-ионные группировки могут быть одинаковыми или разными.
В некоторых воплощениях силан-функционализированная цвиттер-ионная группировка содержит положительно заряженную группировку, отрицательно заряженную группировку и первую спейсерную группу между положительно заряженной группировкой и отрицательно заряженной группировкой. Положительно заряженная группировка может иметь происхождение из органических оснований, а отрицательно заряженная группировка может иметь происхождение из органических кислот. На Фиг.2 представлен иллюстративный список органических кислот и оснований, из которых могут происходить отрицательно заряженная группировка и положительно заряженная группировка.
В некоторых воплощениях положительно заряженная группировка содержит протонированные первичные амины, протонированные вторичные амины, протонированные третичные алкиламины, протонированные амидины, протонированные гуанидины, протонированные пиридины, протонированные пиримидины, протонированные пиразины, протонированные пурины, протонированные имидазолы, протонированные пирролы, четвертичные алкиламины или их комбинации.
В некоторых воплощениях отрицательно заряженная группировка содержит депротонированные карбоновые кислоты, депротонированные сульфоновые кислоты, депротонированные сульфиновые кислоты, депротонированные фосфоновые кислоты, депротонированные фосфорные кислоты, депротонированные фосфиновые кислоты или их комбинации.
В одном или более воплощениях первая спейсерная группа содержит алкильные группы, арильные группы, замещенные алкильные и арильные группы, гетероалкильные группы, гетероарильные группы, карбоксильные группы, простые эфиры, амиды, сложные эфиры, карбаматы, мочевины, прямоцепочечные алкильные группы длиной от 1 до 10 атомов углерода или их комбинации.
В некоторых воплощениях атом кремния силан-функционализированной цвиттер-ионной группировки связан с положительно или отрицательно заряженной группировкой через вторую спейсерную группу. В некоторых воплощениях вторая спейсерная группа содержит алкильные группы, арильные группы, замещенные алкильные и арильные группы, гетероалкильные группы, гетероарильные группы, карбоксильные группы, простые эфиры, амиды, сложные эфиры, карбаматы, мочевины, прямоцепочечные алкильные группы длиной от 1 до 10 атомов углерода или их комбинации.
В некоторых воплощениях силан-функционализированная цвиттер-ионная группировка включает продукт гидролиза предшественника три-алкоксисилана, такой как продукты, проиллюстрированные на Фиг.3A-3D. В некоторых воплощениях предшественник три-алкоксисилан включает N,N-диметил-3-сульфо-N-(3-(триметоксисилил)пропил)пропан-1-аминий, 3-(метил(3-(триметоксисилил)пропил)амино)пропан-1-сульфоновую кислоту, 3-(3-(триметоксисилил)пропиламино)пропан-1-сульфоновую кислоту, 2-(2-(триметилсилил)этокси(гидрокси)фосфорилокси)-N,N,N-триметилэтанаминий, 2-(2-(триметоксисилил)этил(гидрокси)фосфорилокси)-N,N,N-триметилэтанаминий, N,N,N-триметил-3-(N-3-(триметоксисилил)-пропионилсульфамоил)пропан-1-аминий, N-((2Н-тетразол-5-ил)метил)-N,N-диметил-3-(триметоксисилил)пропан-1-аминий, N-(2-карбоксиэтил)-N,N-диметил-3-(триметоксисилил)пропан-1-аминий, 3-(метил(3-(триметоксисилил)-пропил)амино)пропионовую кислоту, 3-(3-(триметоксисилил)пропиламино)-пропионовую кислоту, N-(карбоксиметил)-N,N-диметил-3-(триметоксисилил)-пропан-1-аминий, 2-(метил(3-(триметоксисилил)пропил)амино)уксусную кислоту, 2-(3-(триметоксисилил)пропиламино)уксусную кислоту, 2-(4-(3-(триметоксисилил)пропилкарбамоил)пиперазин-1-ил)уксусную кислоту, 3-(4-(3-(триметоксисилил)пропилкарбамоил)пиперазин-1-ил)пропионовую кислоту, 2-(метил(2-(3-(триметоксисилил)пропилуреидо)этил)амино)уксусную кислоту, 2-(2-(3-(триметоксисилил)пропилуреидо)этил)аминоуксусную кислоту или их комбинации.
Композиция, содержащая множество наночастиц, может быть использована в качестве композиции диагностического агента. Таким образом, в другом аспекте данное изобретение относится к композиции диагностического агента. Композиция диагностического агента содержит множество наночастиц 10, описанных выше. В одном из воплощений композиция диагностического агента дополнительно содержит фармацевтически приемлемый носитель и возможно один или более эксципиентов. В одном из воплощений фармацевтически приемлемый носитель может представлять собой по существу воду. Возможные эксципиенты могут включать одну (один, одно) или более солей, разрыхлителей, связывающих веществ, наполнителей или смазывающих веществ.
Небольшой размер частицы может иметь преимущество, например, с точки зрения облегчения клиренса из почек и других органов. В одном из воплощений множество наночастиц может иметь средний размер частиц вплоть до примерно 50 нм. В другом воплощении множество наночастиц может иметь средний размер частиц вплоть до примерно 10 нм. В другом воплощении множество наночастиц может иметь средний размер частиц вплоть до примерно 6 нм.
В одном аспекте данное изобретение относится к способам изготовления наночастиц. В общем, один способ включает (а) получение ядра, имеющего поверхность ядра, по существу не содержащую диоксид кремния, и (б) размещение оболочки, присоединенной к поверхности ядра, где оболочка содержит силан-функционализированную цвиттер-ионную группировку.
В одном или более воплощениях стадия получения ядра включает получение первого вещества-предшественника, где первое вещество-предшественник содержит по меньшей мере один переходный металл. В одном из воплощений первое вещество-предшественник подвергают реакции с образованием ядра, содержащего по меньшей мере один переходный металл. В одном из воплощений первое вещество-предшественник разлагают с образованием ядра. В другом воплощении первое вещество-предшественник гидролизуют с образованием ядра. В другом воплощении первое вещество-предшественник подвергают реакции с образованием ядра. Способы синтеза наночастиц известны в данной области техники, и любой подходящий способ изготовления ядра наночастицы из подходящего вещества может быть использован в этом способе.
В одном или более воплощениях стадия размещения оболочки включает получение второго вещества-предшественника, такого как вещество, содержащее силановую группировку или предшественник силановой группировки. Силановая группировка может быть подвергнута взаимодействию с ядром с образованием оболочки, содержащей силановую группировку. В некоторых воплощениях перед взаимодействием с ядром предшественник может быть подвергнут реакции гидролиза. В некоторых воплощениях силановая группировка может быть функционализирована по меньшей мере одной цвиттер-ионной группировкой или по меньшей мере одним предшественником цвиттер-ионной группировки. В воплощениях, где силановая группировка функционализирована по меньшей мере одной цвиттер-ионной группировкой, оболочка, образованная таким образом, содержит силан-функционализированную цвиттер-ионную группировку. В воплощениях, где силановая группировка функционализирована предшественником цвиттер-ионной группировки, оболочка, полученная таким образом, может быть нецвиттер-ионной по природе, но может быть впоследствии подвергнута взаимодействию с соответствующим реагентом с превращением предшественника в цвиттер-ионную группировку. В одном или более воплощениях второе вещество-предшественник содержит силан-функционализированную цвиттер-ионную группировку или предшественник силан-функционализированной цвиттер-ионной группировки, такой как один или более предшественников три-алкоксисиланов, описанных выше.
Понятно, что порядок и/или комбинация стадий могут быть изменены. Таким образом, согласно некоторым воплощениям стадии (а) и (б) осуществляют как последовательные стадии, так что из ядра и второго вещества-предшественника образуется наночастица. В качестве примера и без ограничения, в некоторых воплощениях первое вещество-предшественник содержит по меньшей мере один переходный металл; ядро содержит оксид по меньшей мере одного переходного металла; и стадия (а) дополнительно включает гидролиз первого вещества-предшественника. Согласно некоторым воплощениям первое вещество-предшественник представляет собой алкоксид или галогенид переходного металла, и способ гидролиза включает объединение первого вещества-предшественника с кислотой и водой в спиртовом растворителе. В некоторых воплощениях силан может содержать полимеризуемые группы. Полимеризация может протекать как катализируемая кислотой поликонденсация. В некоторых других воплощениях силановая группировка может быть физически адсорбирована на ядро. В некоторых воплощениях силановая группировка может быть дополнительно функционализирована другими полимерами. Полимер может быть водорастворимым и биосовместимым. В одном из воплощений полимеры включают, без ограничения, полиэтиленгликоль (PEG), полиэтиленимин (PEI), полиметакрилат, поливинилсульфат, поливинилпирролидинон или их комбинации.
В некоторых воплощениях ядро содержит оксиды металлов. В одном из воплощений ядро, содержащее оксид металла, может быть синтезировано в результате гидролиза алкоксида металла в присутствии органической кислоты. В некоторых воплощениях алкоксид металла может представлять собой алкоксид тантала, например этоксид тантала, органическая кислота может представлять собой карбоновую кислоту, например изомасляную кислоту, пропионовую кислоту или уксусную кислоту, и реакция гидролиза может быть проведена в присутствии спиртового растворителя, такого как 1-пропанол или метанол.
В другом воплощении ядро и второе вещество-предшественник могут быть приведены в контакт друг с другом. В одном из воплощений второе вещество-предшественник может включать кремнийсодержащие вещества, такие как органофункциональный три-алкоксисилан или смесь органофункциональных три-алкоксисиланов. По меньшей мере один из органофункциональных три-алкоксисиланов может содержать по меньшей мере одну цвиттер-ионную группу или предшественник цвиттер-ионной группы, так что каждая наночастица, в среднем, может содержать по меньшей мере одну цвиттер-ионную группировку или предшественник цвиттер-ионной группировки. В одном из воплощений каждая наночастица может содержать, в среднем, множество цвиттер-ионных группировок или предшественников цвиттер-ионных группировок. В других воплощениях ядро может быть обработано смесью, содержащей по меньшей мере две силановые группировки. В одном из воплощений одна силановая группировка функционализирована цвиттер-ионной группировкой или предшественником цвиттер-ионной группировки, а вторая силановая группировка может не быть функционализирована цвиттер-ионной группировкой. Заряженные силановые группировки могут быть добавлены одновременно или последовательно. В некоторых воплощениях одна или более силановых группировок, функционализированных цвиттер-ионной группировкой или предшественником цвиттер-ионной группировки, могут быть добавлены в ядра, функционализированные нецвиттер-ионными силановыми группировками, либо одновременно, либо последовательно.
В одном из воплощений ядро на основе оксида тантала может быть подвергнуто взаимодействию с алкоксисиланом, который содержит как четвертичный азот, так и сульфоновую группу или карбоксильную группу, например сульфобетаиновую группу или бетаиновую группу. В одном из воплощений ядро на основе оксида тантала может быть подвергнуто взаимодействию с (RO)3Si(CH2)xNR⁄2(CH2)ySO3, где R представляет собой алкильную или арильную группу, х равно 1-10, у равно 1-10 и R' представляет собой Н, алкильную группу или арильную группу. В одном из воплощений R представляет собой алкильную группу, такую как метил или этил, х равно 3, у равно числу от 2 до 5, и R⁄ представляет собой H или алкильную группу, такую как метил.
В одном из воплощений сульфонбетаин-функционализированные силаны могут быть синтезированы в результате реакции раскрытия кольца алкилсультонов или смеси алкилсультонов с аминозамещенными силанами. В другом воплощении алкиллактоны или смеси алкиллактонов могут быть использованы вместо алкилсультонов. В некоторых воплощениях оболочка содержит смесь сульфобетаиновых и бетаиновых функциональных силанов. В другом воплощении ядро из оксида металла может быть подвергнуто взаимодействию с сульфобетаиновой или бетаиновой функциональной силановой группировкой, в которой сульфонатная или карбоксильная группа может быть химически защищена.
В другом воплощении ядро на основе оксида тантала может быть подвергнуто взаимодействию с аминосодержащим силаном, таким как амино-функциональный три-алкоксисилан, с образованием ядра на основе оксида тантала, функционализированного аминосодержащим силаном. На второй стадии ядро, функционализированное силаном, может быть выделено. В альтернативном воплощении ядро, функционализированное силаном, может быть использовано in situ. Ядро, функционализированное силаном, может быть подвергнуто взаимодействию с алкилсультоном, алкиллактоном, галогеноалкилкарбоновой кислотой или эфиром, смесями алкилсультонов, смесями алкиллактонов, смесями гелогеноалкилкарбоновых кислот или эфиров или смесями как алкилсультонов, так и алкиллактонов с образованием цвиттер-ионной группировки. Количество сультона, лактона или смеси сультонов и/или лактонов может быть достаточным для обеспечения присутствия, в среднем, по меньшей мере одной цвиттер-ионной группировки на наночастицу. Неограничительные примеры алкилсультонов включают пропансультон и бутилсультон. Неограничительные примеры лактонов включают пропанлактон и бутиллактон.
В одном из воплощений способ дополнительно включает фракционирование множества наночастиц. Стадия фракционирования может включать фильтрование наночастиц. В другом воплощении способ может дополнительно включать очистку множества наночастиц. Стадия очистки может включать использование методов диализа, тангенциальной поточной фильтрации, диафильтрации или их комбинации. В другом воплощении способ дополнительно включает выделение очищенных наночастиц.
В комбинации с любыми описанными выше воплощениями некоторые воплощения относятся к способу изготовления композиции диагностического агента для рентгеновской/компьютерной томографии или МРВ. Композиция диагностического агента содержит множество наночастиц. В некоторых воплощениях средний размер частиц множества наночастиц может составлять не более чем примерно 10 нм, например не более чем примерно 7 нм и в конкретных воплощениях не более чем примерно 6 нм. Понятно, что согласно некоторым воплощениям размер частиц множества наночастиц может быть выбран таким, чтобы сделать наночастицу по существу выводимой из организма почкой млекопитающего, например почкой человека, в дисперсной форме.
В некоторых воплощениях настоящее изобретение относится к способу применения композиции диагностического агента, содержащей множество наночастиц, описанных в данном документе. В некоторых воплощениях способ включает введение in vivo или in vitro композиции диагностического агента субъекту, который в некоторых случаях может быть живым субъектом, таким как млекопитающее, и последующее формирование изображения субъекта с использованием рентгеновского/КТ устройства. Наночастицы, как описано выше, содержат ядро и оболочку, где оболочка содержит по меньшей мере одну силан-функционализированную цвиттер-ионную группировку. В одном из воплощений ядро содержит оксид тантала. Наночастица может быть введена субъекту многими различными известными способами. Неограничительные примеры введения наночастицы субъекту включают внутривенное, внутриартериальное или пероральное введение, трансдермальное введение или прямую инъекцию в мышцу, кожу, брюшную полость или другие ткани или компартменты организма.
В другом воплощении способ включает введение композиции диагностического агента субъекту и визуализацию субъекта с использованием диагностического устройства. В диагностическом устройстве используется метод визуализации, примеры которого включают, без ограничения, МРВ, оптическую визуализацию, оптическую когерентную томографию, рентгеновскую, компьютерную томографию, позитронно-эмиссионную томографию или их комбинации. В данном способе применения в организм может быть также предварительно введена композиция диагностического агента. Данная композиция диагностического агента, как описано выше, содержит множество наночастиц 10.
В одном из воплощений описанные выше способы применения диагностического контрастного агента дополнительно включают мониторинг доставки композиции диагностического агента субъекту с использованием диагностического устройства и диагностирование субъекта. В этом способе данные могут быть компилированы и проанализированы в целом в соответствии с обычной эксплуатацией медицинского диагностического визуализирующего оборудования. Композиция диагностического агента может представлять собой рентгеновский или КТ-контрастный агент, например такой, как композиция, содержащая ядро на основе оксида тантала. Композиция диагностического агента может обеспечивать КТ-сигнал в диапазоне от примерно 100 единиц шкалы Хаунсфилда до примерно 5000 единиц Хаунсфилда. В другом примере композиция диагностического агента может представлять собой МРВ-контрастный агент, такой как агент, содержащий суперпарамагнитное ядро из оксида железа.
В одном из воплощений изобретения предложен способ определения степени, в которой наночастицы 10, описанные в данной заявке, например наночастицы, имеющие ядро из оксида тантала или оксида железа, распределены внутри субъекта. Субъект может представлять собой млекопитающее или биологический материал, содержащий образец ткани или клетку. Данный способ может представлять собой способ in vivo или in vitro. Наночастица может быть введена субъекту различными известными способами. Неограничительные примеры введения наночастицы субъекту включают любые известные способы, описанные выше. В одном из воплощений данный способ включает (а) введение наночастицы в субъект и (б) определение распределения наночастиц внутри субъекта. Распределение внутри субъекта может быть определено с использованием диагностических методов визуализации, таких как методы, упомянутые ранее. Альтернативно, распределение наночастицы в биологическом материале может быть определено элементным анализом. В одном из воплощений для определения концентрации наночастицы в биологическом материале может быть использована масс-спектрометрия с индуктивно связанной плазмой (ИСП-МС).
В другом аспекте данное изобретение относится к применению наночастиц 10, описанных выше, для изготовления композиции для использования в качестве композиции диагностического агента.
Приведенные ниже примеры включены в данное описание, чтобы продемонстрировать конкретные воплощения настоящего изобретения. Специалистам в данной области должно быть понятно, что способы, раскрытые в приведенных ниже примерах, представляют собой лишь иллюстративные воплощения настоящего изобретения. Однако специалисты в данной области должны понимать, в свете настоящего описания изобретения, что в описанных конкретных воплощениях может быть сделано много изменений, и при этом может быть получен сходный или аналогичный результат, без отклонения от замысла и объема настоящего изобретения.
ПРИМЕРЫ
Практическое осуществление данного изобретения станет еще более понятным из приведенных ниже примеров, которые приведены в данном описании только для иллюстрации и которые никоим образом не должны толковаться как ограничивающие данное изобретение.
Сокращения, использованные в разделе "Примеры", имеют следующие значения: "мг": миллиграммы; "мл": миллилитры; "мг/мл": миллиграммы на миллилитр; "моль": миллимоли; "мкл": микролитры; "ЖХ": жидкостная хроматография"; "ДРС": динамическое рассеяние света; "ДИ вода": деионизированная вода; "ИСП": индуктивно связанная плазма.
Если не указано иное, все химические реагенты использовали в том виде, в котором они получены, и для получения водных растворов использовали воду, фильтрованную через фильтр Millipore.
Синтез наночастиц на основе оксида тантала
Стадия 1: Синтез N,N-диметил-3-сульфо-г>1-(3-(триметоксисилил)пропил)-пропан-1-аминия
Толуол (безводный, 250 мл), N,N-диметиламинотриметоксисилан (25 г, 121 ммоль) и 1,3-пропансультон (13,4 г, 110 ммоль) добавляли в круглодонную колбу емкостью 500 мл с мешалкой. Эту смесь перемешивали при комнатной температуре в течение 4 суток. Затем смесь фильтровали с выделением выпавшего в осадок продукта, который затем промывали свежим безводным толуолом (2×60 мл). Выход белого порошка после сушки под вакуумом составил 23,6 г.
Стадия 2: Взаимодействие N,N-диметил-3-сульфо-N-(3-(триметоксисилил)пропил)пропан-1-аминия с ядром на основе оксида тантала
Способ 1: 1-пропанол в качестве растворителя
В трехгорлую круглодонную колбу емкостью 250 мл с мешалкой загружали 1-пропанол (73 мл), затем добавляли изомасляную кислоту (1,16 мл, 12,51 ммоль, 1,27 экв. по Та) и ДИ воду (1,08 мл, 59,95 ммоль, 6,09 экв. по Ta) с образованием реакционной смеси. Через эту реакционную смесь барботировали азот в течение 20 минут, затем в реакционную смесь по каплям добавляли этоксид тантала (Ta(OEt)5) (2,55 мл, 4 г, 9,84 ммоль) при комнатной температуре при перемешивании в течение 15 минут. Во время добавления Ta(OEt)5 продолжали барботировать азот через реакционную смесь. После окончания добавления Ta(OEt)5 вышеупомянутую реакционную смесь перемешивали при комнатной температуре в атмосфере азота в течение 16 часов.
Реакционную смесь перемешивали при комнатной температуре в течение 16 часов, затем из реакционной смеси отбирали аликвоту (1,5 мл), фильтровали ее через фильтрационную мембрану 20 нм и размер частиц измеряли (как гидродинамический радиус) в воде методом ДРС сразу после стадии фильтрования. По результатам измерений средний размер частиц составлял приблизительно 3,6 нм. N,N-диметил-3-сульфо-N-(3-(триметоксисилил)пропил)пропан-1-аминий (4,03 г, 12,23 ммоль, 1,24 экв. по Ta) растворяли в 50 мл ДИ воды. Этот раствор по каплям добавляли в вышеупомянутую реакционную смесь в течение нескольких минут. Бесцветная гомогенная реакционная смесь сразу превращалась в мутный белый раствор и к концу добавления силан-функционализированной цвиттер-ионной группировки становилась молочным раствором. После окончания добавления к колбе присоединяли конденсатор, и реакционную смесь содержали в атмосфере азота. Колбу помещали в масляную баню, предварительно нагретую до 75°C, и реакционную смесь перемешивали в течение 6 часов. Реакционная смесь становилась прозрачнее. Через 6 часов реакционную смесь охлаждали до комнатной температуры на воздухе. Гетерогенную реакционную смесь нейтрализовали до pH 6-7 добавлением 1М NH4OH. Реакционную смесь переносили во вторую круглодонную колбу на воздухе. При переносе реакционной смеси во вторую колбу в колбе оставалось некоторое количество белого вещества, которое не переносили во вторую колбу (неочищенный продукт A). Этот неочищенный продукт A сушили в потоке азота в течение ночи. В то же время, раствор, находящийся во второй колбе, упаривали на роторном испарителе при 50°C. Сухой белый остаток, полученный после упаривания раствора (неочищенный продукт B) оставляли стоять в атмосфере азота в течение ночи.
Неочищенный продукт A сушили в течение ночи. Это твердое вещество полностью растворяли в ДИ воде. Неочищенный продукт В также полностью растворяли в ДИ воде и эти два раствора (неочищенный продукт А и неочищенный продукт В) объединяли (общий объем составлял 60 мл). Водный раствор фильтровали последовательно через фильтрационные мембраны 450 нм, 200 нм и 100 нм и в конце через фильтрационную мембрану 20 нм. Раствор затем подвергали диализу при рН 7,0 с использованием буфера на основе фосфата натрия (трубка SnakeSkin из регенерированной целлюлозы, отсечка по молекулярной массе 10К) и затем три раза в ДИ воде.
В конце наночастицы выделяли лиофилизацией. Выход белого порошка=1,748 г (выход 38% в расчете на Ta). Дзета-потенциал: (-)8,18 мВ. Элементный анализ: 38,3±0,3% Та, 4,8±0,1% Si. Измеренный методом ДРС средний размер частицы составил 8,9 нм. Чистоту наночастиц измеряли методом жидкостной хроматографии (ЖХ)/индуктивно связанная плазма (ИСП).
Способ 2: Трифторэтанол в качестве растворителя
В трехгорлую круглодонную колбу емкостью 100 мл с мешалкой загружали трифторэтанол (42 мл). Через этот растворитель барботировали азот и одновременно через шприц добавляли изомасляную кислоту (0,53 мл, 5,7 ммоль), а затем воду (0,13 мл, 7,4 ммоль). Раствор перемешивали в течение последующих 15 минут при непрерывном барботировании азота. С использованием шприца по каплям добавляли этоксид тантала (Ta(OEt)5) (2 г, 4,9 ммоль). Слегка мутный раствор перемешивали при комнатной температуре в атмосфере азота в течение 17 часов. N,N-диметил-3-сульфо-N-(3-(триметоксисилил)пропил)пропан-1-аминий (Пример 1, 3,2 г, 9,8 ммоль) растворяли в воде (15 мл). Этот гомогенный бесцветный раствор по каплям добавляли в тантал-содержащую реакционную смесь, но быстро, на воздухе при перемешивании. К колбе присоединяли конденсатор и помещали ее в масляную баню, предварительно нагретую до 78°C. После перемешивания при этой температуре в течение 6 часов бесцветную гомогенную реакционную смесь охлаждали до комнатной температуры. Практически весь трифторэтанол удаляли на роторном испарителе после добавления воды (20 мл). Водный раствор нейтрализовали добавлением концентрированного гидроксида аммония и затем фильтровали последовательно через фильтры 200 нм, 100 нм и затем 20 нм. Раствор затем подвергали диализу 4 раза с использованием диализной трубки SnakeSkin, изготовленной из регенерированной целлюлозы, с отсечкой по молекулярной массе 3500. Первый диализ осуществляли в смеси 50:50 ДИ воды и фосфатного буфера с рН 7,0. Последующие диализы осуществляли в ДИ воде. Очищенный продукт в виде наночастиц не выделяли из воды. Процент твердого вещества при тестировании аликвоты использовали для определения выхода покрытых оболочкой наночастиц, который составил 1,55 г. Средний размер частиц, определенный методом динамического рассеяния света, составил 1,6 нм.
Синтез наночастицы на основе оксида тантала
Стадия 1: Синтез этил-2-(4-(3-(триметоксисилил)пропилкарбамоил)-пиперазин-1-ил)ацетата
(3-Изоцианатопропил)триметоксисилан (4,106 г) добавляли в раствор этилацетоксипиперазина (3,789 г) в метиленхлориде (20 мл). Раствор перемешивали в течение 16 часов, а затем растворитель удаляли при пониженном давлении с получением 8,37 г вещества, которое использовали без дополнительной очистки.
Стадия 2: Взаимодействие этил-2-(4-(3-(триметоксисилил)-пропилкарбамоил)пиперазин-1-ил)ацетата с ядром на основе оксида тантала
В круглодонную колбу емкостью 500 мл загружали н-пропанол (99 мл), изомасляную кислоту (1,4 мл) и воду (1,2 мл). Этот раствор перемешивали в течение 5 минут, затем в этот раствор по каплям добавляли Ta(OEt)s (5,37 г). Раствор перемешивали при комнатной температуре в атмосфере азота в течение 18 часов. 60 мл этого раствора затем добавляли в этил-2-(4-(3-(триметоксисилил)пропилкарбамоил)пиперазин-1-ил)ацетат (6,37 г) и раствор перемешивали в атмосфере азота в течение 2 часов при 100°C. Смесь затем охлаждали до комнатной температуры, добавляли воду (20 мл) и смесь перемешивали в течение 18 часов при комнатной температуре. Затем добавляли 75 мл 0,33 н. водного раствора соляной кислоты и этот раствор нагревали до 60°C в течение 6 часов. Смесь затем охлаждали до комнатной температуры, добавляли 250 мл 28%-ного водного раствора аммиака и эту смесь перемешивали в течение 5 суток. Аммиак и пропанол удаляли при пониженном давлении, затем вещество вливали в диализную трубку из регенерированной целлюлозы, отсечка по молекулярной массе 3000, и осуществляли диализ против дистиллированной воды в течение 48 часов, заменяя диализный буфер каждые 12 часов. Раствор затем фильтровали через центрифужные фильтры с отсечкой по молекулярной массе 30000 с получением частиц со средним размером 4,5 нм, измеренным методом ДРС.
Синтез наночастицы на основе оксида железа
Синтез наночастицы на основе суперпарамагнитного оксида железа
В трехгорлую круглодонную колбу емкостью 100 мл загружали 706 мг Fe(acac)3 и 20 мл безводного бензилового спирта. Через этот раствор барботировали азот и затем его нагревали до 165°C в течение 2 часов в атмосфере азота. Раствор затем охлаждали до комнатной температуры и хранили при комнатной температуре.
Взаимодействие этил-2-(4-(3-(триметоксисилил)пропилкарбамоил)-пиперазин-1-ил)ацетата с суперпарамагнитным оксидом железа
Аликвоту 10 мл наночастиц на основе суперпарамагнитного оксида железа в бензиловом спирте (5,58 мг Fe/мл) разбавляли 50 мл тетрагидрофурана. Добавляли 2,00 г этил-2-(4-(3-(триметоксисилил)-пропилкарбамоил)пиперазин-1-ил)ацетата и эту смесь нагревали до 60°C при перемешивании в течение 2 часов, затем охлаждали до комнатной температуры. Добавляли 50 мл 1,0 М водного раствора карбоната калия, после чего колбу герметично закрывали и нагревали при перемешивании до 60°C в течение 18 часов. Смесь затем охлаждали и центрифугировали, и водный слой вливали в диализную трубку из регенерированной целлюлозы с отсечкой по молекулярной массе 10000 и подвергали диализу против 4 литров 10 мМ цитрата натрия в течение 48 часов, заменяя диализный буфер каждые 12 часов. Конечный объем составил 94 мл с общим содержанием железа 0,416 мг на мл раствора. По результатам измерений методом динамического рассеяния света это вещество имело средний размер частиц 8,4 нм в 150 мМ водном цитрате натрия.
Взаимодействие N,N-диметил-3-сульфо-N-(3-(триметоксисилил)пропил)-пропан-1-аминия с суперпарамагнитным оксидом железа
Аликвоту 16,75 мл наночастиц на основе суперпарамагнитного оксида железа в бензиловом спирте (5,58 мг Fe/мл) добавляли в тетрагидрофуран до общего объема 94,5 мл. Этот раствор затем загружали в колбу для работы под давлением параллельно с 3,1 г N,N-диметил-3-сульфо-N-(3-(триметоксисилил)пропил)пропан-1-аминия и эту смесь нагревали до 50°C при перемешивании в течение 2 часов. После охлаждения до комнатной температуры добавляли 31 мл изопропанола и 76 мл концентрированного водного раствора гидроксида аммония (28% NH3 в воде). Колбу затем герметично закрывали и нагревали до 50°C при перемешивании в течение 18 часов. Смесь охлаждали и промывали гексанами (100 мл×3). Водный слой вливали в диализную трубку из регенерированной целлюлозы с отсечкой по молекулярной массе 10000 и подвергали диализу против 4 литров 10 мМ цитрата натрия в течение 18 часов. Конечный раствор имел общее содержание железа 0,67 мг на мл раствора. Это вещество имело размер частиц 9,2 нм.
Определение размера частиц и стабильности наночастиц в воде
Наночастицы, изготовленные Способом 1 (36,2 мг), растворяли в 2 мл ДИ воды. Раствор фильтровали через фильтрационную мембрану 20 нм. Средний размер частиц измеряли как гидродинамический радиус методом динамического рассеяния света (ДРС) сразу после стадии фильтрования. Образец хранили в течение 15 суток при 37°C, периодически осуществляя мониторинг методом ДРС. Результаты представлены в Таблице 1.
Исследования биораспределения наночастиц
Исследования in vivo проводили на самцах крысы Lewis с массой тела в пределах от 150 до 500 граммов. Крыс размещали в стандартном боксе с кормом и водой в неограниченном количестве и 12-часовым световым циклом день-ночь. Все животные, использованные для исследований биораспределения, во всех остальных отношениях были необработанными, нормальными субъектами.
Наночастицы вводили в виде стерилизованного посредством фильтрации раствора либо в воде, либо в физиологическом растворе. Введение выполняли под анестезией изофлураном (4% для индуцирования, 2% для поддерживания) через катетер 26 G, вставленный в латеральную хвостовую вену. Инъекционные объемы определяли исходя из концентрации наночастиц в инъецируемом растворе и массы крысы, но, как правило, они составляли менее 10% от объема крови грызуна. Целевая доза составляла 100 мг металла ядра (например, тантала) на кг массы тела. Сразу после инъекции животных выводили из анестезии и после некоторого периода наблюдения в отношении вредных эффектов возвращали в нормальные условия. В более поздний период, самое короткое от нескольких минут до самое длительное 6 месяцев, крыс умерщвляли и интересующие органы извлекали, взвешивали и анализировали в отношении общего содержания металла (например, тантала) анализом методом ИСП. Наряду с органами на рассмотрение представляли образец инъецируемого вещества для определения точной концентрации инъецируемого раствора. Эти совокупные данные дали возможность определить процент инъецированной дозы ("% ИД"), оставшейся в интересующей ткани. Эти данные представляли либо в виде % ИД/орган, либо % ИД/грамм ткани. Эксперименты обычно осуществляли с крысами в четырех повторах в каждый момент времени, что давало возможность определить погрешность эксперимента (± стандартное отклонение).
В Таблице 2 представлены результаты исследований биораспределения фракционированных наночастиц с нецвиттер-ионным покрытием (PHS) и с цвиттер-ионными покрытиями (SZWIS и CZWIS) в главных органах, осуществляющих клиренс, через 1 неделю после внутривенной инъекции. "ND" означает "не обнаруживается".
Количество остаточного тантала в органе представлено в Таблице 2 в виде доли от инъецированной дозы. Соразмерные наночастицы с нецвиттер-ионным покрытием остаются в организме в более высокой концентрации (почти один порядок величины), чем с любыми протестированными цвиттер-ионными покрытиями.
Несмотря на то, что только некоторые признаки изобретения проиллюстрированы и описаны в данной заявке, специалисты в данной области будут осуществлять многие модификации и изменения. Поэтому следует иметь в виду, что прилагаемая формула изобретения охватывает все такие модификации и изменения как подпадающие под истинный замысел данного изобретения.
Реферат
Изобретение относится к контрастному агенту на основе наночастицы, где наночастицы содержат ядро, поверхность которого не содержит диоксид кремния, и оболочку, которая присоединена к поверхности ядра и содержит силан-функционализированную цвиттер-ионную группировку. В одном варианте наночастица не содержит лиганда, обеспечивающего направленную доставку. В другом варианте наночастица содержит лиганд, обеспечивающий направленную доставку, при этом цвиттер-ионная группировка и лиганд, обеспечивающий направленную доставку, не являются одинаковыми. Изобретение также относится к способам изготовления указанных выше наночастиц, к композиции контрастного агента, содержащей множество наночастиц, а также к применению наночастиц в качестве диагностического агента. Также изобретение относится к способам применения композиции, которая содержит множество указанных выше наночастиц, для рентгеновской визуализации, компьютерной томографии (КТ) или магнитно-резонансной визуализации (МРВ), где способ включает введение субъекту композиции и визуализацию субъекта с использованием диагностического устройства. 9 н. и 14 з.п. ф-лы, 2 табл., 6 ил.
Формула
а) ядро, имеющее поверхность ядра, по существу не содержащую диоксида кремния, и
б) оболочку, присоединенную к поверхности ядра, где оболочка содержит по меньшей мере одну силан-функционализированную цвиттер-ионную группировку; и
где наночастица не содержит лиганда, обеспечивающего направленную доставку.
а) ядро, имеющее поверхность ядра, по существу не содержащую диоксида кремния, и
б) оболочку, присоединенную к поверхности ядра, где оболочка содержит по меньшей мере одну силан-функционализированную цвиттер-ионную группировку; и
в) лиганд, обеспечивающий направленную доставку;
где цвиттер-ионная группировка и лиганд, обеспечивающий направленную доставку, не являются одинаковыми.
а) ядро, имеющее поверхность ядра, по существу не содержащую диоксида кремния, и
б) оболочку, присоединенную к поверхности ядра, где оболочка содержит по меньшей мере одну силан-функционализированную цвиттер-ионную группировку и где силан-функционализированная цвиттер-ионная группировка включает продукт гидролиза предшественника три-алкоксисилана, где предшественник три-алкоксисилан включает N,N-диметил-3-сульфо-N-(3-(триметоксисилил)пропил)пропан-1-аминий, 3-(метил(3-(триметоксисилил)-пропил)амино)пропан-1-сульфоновую кислоту, 3-(3-(триметоксисилил)-пропиламино)пропан-1-сульфоновую кислоту, 2-(2-(триметилсилил)этокси-(гидрокси)фосфорилокси)-N,N,N-триметилэтанаминий, 2-(2-(триметоксисилил)-этил(гидрокси)фосфорилокси)-N,N,N-триметилэтанаминий, N,N,N-триметил-3-(N-3-(триметоксисилил)пропионилсульфамоил)пропан-1-аминий, N-((2H-тетразол-5-ил)метил)-N,N-диметил-3-(триметоксисилил)пропан-1-аминий, N-(2-карбоксиэтил)-N,N-диметил-3-(триметоксисилил)пропан-1-аминий, 3-(метил(3-(триметоксисилил)пропил)амино)пропионовую кислоту, 3-(3-(триметоксисилил)-пропиламино)пропионовую кислоту, N-(карбоксиметил)-N,N-диметил-3-(триметоксисилил)пропан-1-аминий, 2-(метил(3-(триметоксисилил)-пропил)амино)уксусную кислоту, 2-(3-(триметоксисилил)пропиламино)уксусную кислоту, 2-(4-(3-(триметоксисилил)пропилкарбамоил)пиперазин-1-ил)уксусную кислоту, 3-(4-(3-(триметоксисилил)пропилкарбамоил)пиперазин-1-ил)пропионовую кислоту, 2-(метил(2-(3-(триметоксисилил)пропилуреидо)этил)-амино)уксусную кислоту, 2-(2-(3-(триметоксисилил)пропилуреидо)этил)-аминоуксусную кислоту или их комбинации.
а) получение ядра, имеющего поверхность ядра, по существу не содержащую диоксида кремния, и
б) размещение оболочки, присоединенной к поверхности ядра, где оболочка содержит силан-функционализированную цвиттер-ионную группировку.
а) получение ядра, имеющего поверхность ядра, по существу не содержащую диоксида кремния, и
б) приведение ядра в контакт с подходящим органофункциональным три-алкоксисиланом, где органофункциональный три-алкоксисилан содержит по меньшей мере одну цвиттер-ионную группировку или предшественник цвиттер-ионной группировки.
введение композиции диагностического контрастного агента субъекту, где композиция диагностического агента содержит множество наночастиц, как они определены в п.1, и
визуализацию субъекта с использованием диагностического устройства.
введение композиции диагностического агента субъекту, где композиция диагностического агента содержит множество наночастиц, как они определены в п.1, и
визуализацию субъекта с использованием рентгеновского устройства.

Комментарии