Эффективный синтез хелаторов для ядерной томографии и радиотерапии: составы и применение - RU2512491C2
Код документа: RU2512491C2
Чертежи


















Описание
Это заявка базируется и имеет приоритеты американских заявок: предварительных патентных заявок серийный номер 60/828, 347, поданных 5 октября 2006, и серийный номер 11/770, 395, поданной 28 июня 2007, каждая из которых содержится здесь полностью.
Существующее изобретение имеет отношение в основном к областям химического синтеза, получению изображений, радиотерапии, введению меченых атомов, химиотерапии, медицинской терапии, лечению сердечно-сосудистых заболеваний и рака. Более подробно, изобретение касается новых способов синтезирования соединений хелатор-направленный лиганд. Органические методы синтеза, сформулированые здесь, позволяют производить соединения хелатор-направленный лиганд более высокой чистоты по сравнению с соединениями хелатор-направленный лиганд, приготовленными водными методами. Способы получения изображений участка, используя эти соединения, а также комплектов для приготовления этих соединений, также сформулированы здесь. Способы диагностики и лечения заболеваний (то есть раковых образований, сердечно-сосудистых заболеваний, инфекций и воспаления), используя составы, которые включают вышеупомянутые соединения, также здесь раскрыты.
Биомедицинское получение изображений включает различные способы, которые широко используются врачами и исследователями, чтобы помочь не только диагностировать заболевания, но также и получить большее понимание нормальной структуры и функции тела. Образцовые способы получения изображений включают PET (позитронно-эмиссионная томография), SPECT (однофотонная эмиссионная компьютерная томография), гамма камеры получения изображений, СТ (компьютерная томография), MRI (магнитно-резонансная томография), ультразвук, двойное изображение и оптическое изображение.
Во многих случаях, получение оптимального изображения специфического участка в пределах субъекта требует назначения специфического агента субъекту. Неорганические металлы, такие как технеций (99mТc), железо, гадолиний, рений, марганец, кобальт, индий, платина, медь, галлий или родий, оказываются подходящими компонентами многих агентов получения изображений.
Мечение молекул неорганическими металлами может быть достигнуто хелированием металла в комбинации кислорода, серы и атомов азота специфических соединений.
Хелаторы, такие как коллоид серы, диэтилентриаминпентауксусная кислота (DTPA, O4), этилендиаминтетрауксусная кислота (EDTA, O4) и 1,4,7,10-тетраазациклододекан-N,N',N'',N'''-тетрауксусная кислота (DOTA, N4), использовались с этой целью. Однако неорганические металлы, которые являются хелированными таким образом, имеют ограниченную полноценность для получения изображений из-за их быстрого выведения из тела.
Предпочтительным радиоактивным ярлыком для агентов получения изображений является технеций (99mТе) благодаря подходящему периоду его полураспада (6 часов), простоте производства, широкой пригодности, низкой энергии (140 кэВ) и низкой стоимости. Более длинный период полураспада изотопов, таких как99mТе, облегчает доставку меченых радиоактивным изотопом аминокислот в больницы без локального циклотрона или специальной радиохимической лаборатории. Однако присоединение99mТе к лекарственным препаратам с целью получения изображений является зачастую проблемой.
188Re имеет хорошие характеристики для получения изображений и для потенциального терапевтического использования из-за его высокой бета энергии (2.1 МэВ), короткого физического период полураспада (16.9 часов) и 155 кэВ эмиссии гамма лучей для дозиметрических целей и получения изображений. Короткий физический период полураспада188Re позволяет использовать более высокие дозы по сравнению с долговечными радионуклидами. Кроме того, короткий период полураспада уменьшает проблемы с использованием и хранением радиоактивных отходов. В частности,188Re является доступным от системы внутреннего генератора, подобной99mТе генератору.188Re может быть получен от188W/188Re генератора, который делает это очень удобным для клинического использования. И99mТе и188Re испускают гамма-лучи, таким образом, дозиметрия, основанная на получении изображения99mТе, как ожидают, будет более точной, чем дозиметрия, полученная с использованием потока стандартного радиоизотопа, Y-90.
При получении изображений, используя позитронно-эмиссионную томографию (PET), радиосинтез PET должен быть быстрым, потому что радиоизотоп распадется в течение длинного химического синтеза, и более высок риск облучения, которое может произойти в течение радиосинтеза. Трассирующие снаряды на основе циклотрона ограничены пригодностью локального циклотрона и его высокой стоимостью. Управление по санитарному надзору за качеством пищевых продуктов и медикаментов (FDA) разрешает производство радиоактивного медицинского препарата в центральной коммерческой установке в хорошо контролируемых условиях и распределяет их местным клиникам, где они назначаются. Точно так же системы генератора радионуклида, которые могут производиться в хорошо контролируемых условиях, контролируются соответствующими текущими процедурами FDA и имеют большую историю успешного клинического применения. Генератор использует пару родительско-дочернего нуклида, где относительно долговечный материнский изотоп распадается в недолговечный дочерний изотоп, который используется для получения изображений. Материнский изотоп, который произведен посредством циклотрона, может быть отправлен на клинический участок, и из которого дочерний изотоп может быть элюирован на участке для клинического использования.
68Ga имеет высокое количество излучаемых позитронов (89% от полного распада), поэтому главное, что рассматривают в связи этим радионуклидом, это его пространственная разрешающая способность, которая зависит от диапазона позитрона (энергии), неколинеарности уничтоженных фотонов, существенных свойств, размера и геометрии детектора и выбора алгоритма реконструкции. К аспектам конструкции детектора, физическим свойствам и их влиянию на систему пространственного разрешения обращалось много авторов, приводя к непрерывной оптимизации аппаратных средств. Хотя максимальная энергия позитрона68Ga (макс = 1.90 МэВ, средняя = 0.89 МэВ) является выше, чем максимальная энергия позитрона18F (Макс = 0.63 МэВ, средняя = 0.25 МэВ), исследование, использующее анализы Монте-Карло по пространственному разрешению, показало, что согласно предположению о пространственном разрешении 3 мм PET детекторов обычная полная ширина в половине максимума (FWHM)18F и68Ga неразличима в мягкой ткани (3.01 мм против 3.09 мм). Это означает, что с помощью 5-7 мм пространственной разрешающей способности клинических сканеров распада качество получения изображений, используя меченый атом на основе68Ga, может быть столь же хорошим как агенты на основе18F, и это стимулировало исследовать потенциал агентов получения изображений на основе68Ga. Далее, агенты на основе68Ga обладают существенным коммерческим потенциалом, потому что изотоп может быть произведен из генератора Германия (275-дневный период полураспада) на участке, и быть подходящей альтернативой базирующимся на основе циклотрона изотопам, таким как18F или13N.
Если рассматривать искусственное приготовление агентов получения изображений, то когда такие агенты готовятся в водных (влажных) условиях, очистка агентов может иногда представлять проблему. Очистка в водных условиях может быть достигнута, используя, например, хроматографию исключения размера, или диализ с мембранами специфических сокращений молекулярной массы; например, диализ является обычно самым эффективным, отделяя разновидности молекулярных масс для 1000 г/моль или выше. Однако этот метод очистки часто изолирует не только желательного агента, но также и любые другие разновидности, которые могут пройти через мембрану. Введение примесей в изображение агентов может быть проблематичным в будущих применениях агентов получения изображений, особенно это касается получения изображений и/или терапевтического использования. Например, если агент получения изображений, включающий радионуклид ("истинный" агент получения изображений), как думают, является чистым, но фактически содержит примеси, которые также включают радионуклид, надлежащее измерение или обнаружение "истинного" агента получения изображений могут быть затенены или быть ложными из-за присутствия примесей.
Способы синтезирования органических соединений в органической среде, когда применяют органические растворители и используют защитные группы, обычно предлагают усовершенствования очистки составов по сравнению с водной очисткой. Установка групп защиты позволяет различным функциональным группам посредников в течение синтеза быть защищенными и облегчает очистку этих посредников (промежуточных звеньев). Различные средства очистки, использующие органические растворители, позволяют разделять и изолировать желательные соединения, такие как агенты получения изображений, с очень небольшим количеством примесей. Далее разновидности молекулярных масс менее чем 1000 г/моль часто могут быть легко очищены, используя способы очистки органической химии. Ввиду выгод, предлагаемых органическим синтезом, и очисткой, используя водную очистку, способы органического синтезирования и очистки агентов получения изображений, вероятно, привели бы к получению агентов более высокой чистоты, чем агенты, полученные путем водной очистки.
До настоящего времени определенные агенты получения изображений приготавливались только путем водных средств. Примеси, представленные в этих агентах, могут ограничить их использование в качестве агентов получения изображения и/или терапевтических агентов. Таким образом, существует потребность приготовления этих и других агентов, используя синтетические органические методики, чтобы получить агенты более высокой чистоты.
В настоящем изобретении были идентифицированы новые способы синтезирования агентов, которые являются в определенных воплощениях сложными соединениями хелатора и направленного лиганда (также называемыми направленной частицей). Такие агенты могут использоваться, например, для получения изображений, в диагностических и/или терапевтических целях. И органический (растворитель) и влажный (водный) способы очистки здесь описаны, и показано, что органические синтетические способы очистки приводят к соединениям более высокой чистоты, чем соединения, приготовленные/очищенные влажной химией. Соединения высокой чистоты лучше подходят для клинического применения. Кроме того, определенные соединения и способы настоящего изобретения предлагают широкую гибкость и селективность, выражаясь в терминах этого изобретения: (1) подходящие участки присоединения хелатора к направленному лиганду и (2) атомы, подходящие для хелатообразования с ионом металла.
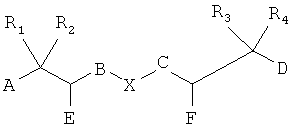
Соответственно, один общий аспект существующего изобретения рассматривает способ синтезирования сложного соединения хелатор-направленный лиганд, включающего:

по крайней мере один направленный лиганд, включающий по крайней мере одну функциональную группу, где:
A, D, Е и F каждый независимо являются Н, нижним алкилом, -СООН, защищенной карбоксильной кислотой, -NH2, защищенным амином, тиолом или защищенным тиолом, где по крайней мере в одной позиции есть -NH2 или тиол;
В и С каждый независимо являются вторичным амином, третичным амином, -S-, -S(O)- или - S(O)2-;
R1, R2, R3 и R4 каждый независимо являются Н или нижним алкилом;
Х выбран из группы, состоящей из -СН2-СН2-, -CH2-CH2-CH2-, -CH2-C(O)-, -С(O)-СН2-, -С(O)-СН2-СН2- и -СН2-СН2-С(O)-; и
Существует соединение между А, D, Е или F хелатора и по крайней мере одной незащищенной функциональной группой каждого направленного лиганда;
где по крайней мере один из А, D, Е, F или направленный лиганд включают защищенную функциональную группу, при условии, что по крайней мере одна функциональная группа направленного лиганда является незащищенной, и
при условии, что когда А и D являются каждый -NH2, то ни В, ни С не являются вторичным или третичным амином. Сложные соединения существующего изобретения могут включать один направленный лиганд или более, чем один направленный лиганд. В некоторых воплощениях сложное соединение включает два направленных лиганда. Направленные лиганды могут быть идентичными или могут быть разного типа. Типы направленных лигандов описаны подробно ниже.
Способы, описанные здесь, отличаются от способов, описанных в американской заявке №11/737, 694, поданной 19 апреля 2007, и отличаются от способов, описанных в международной заявке № PCT/US2006/016784, поданной 4 мая 2006.
Хелатор, изображенный выше, может также быть изображен как
Вообще, способы настоящего изобретения осуществляются в органической среде. Используемый здесь термин «органическая среда» относится к растворам и способам очистки, включающим один или более органических растворителей. Выбор растворителя для способов настоящего изобретения будет понятен специалисту в этой области. Выбор растворителей может зависеть от того, например, в каком растворителе(лях) будет легче происходить растворение всех реактивов, или, например, в каком растворителе(лях) будет легче всего происходить желательная реакция (особенно, если механизм реакции будет известен). Растворители могут включать, например, полярные растворители и/или неполярные растворители. Растворитель может быть полярным апротонным растворителем, таким как диметилсульфоксид. Выбор растворителей включает, но не ограничивается, диметилформамид, диметилсульфоксид, диоксан, метанол, этиловый спирт, гексан, хлорид метилена, тетрагидрофуран и/или ацетонитрил. В некоторых воплощениях, растворители включают этиловый спирт, диметилформамид и/или диоксан. Более одного растворителя может быть выбрано для любой специфической реакции или процедуры очистки. Также в любой растворитель можно добавить воду; это может быть сделано, например, для усиления растворимости одного или более реагентов.
В некоторых воплощениях только соединение между хелатором и направленным лигандом происходит через органический синтез (то есть в органической среде). В некоторых воплощениях только синтез хелатора имеет место через органический синтез. В некоторых воплощениях только хелатообразование иона валентного металла имеет место через органический синтез. В определенных воплощениях, любой или более одного из этих шагов имеют место через органический синтез.
Любой хелатор (то есть соединение, которое является способным к хелированию или связыванию одного или более ионов металла), известный специалистам, может быть применен, используя методологию настоящего изобретения, и образцы хелаторов детально описаны ниже. Хелаторы обычно связывают один или более ионов металла через ионную связь. В некоторых воплощениях, хелатор включает DTPA (диэтилентриамин-пентауксусную кислоту), одну или более одной аминокислот или любую комбинацию одной или более этих групп. В определенных воплощениях одну или более аминокислот выбирают из группы, состоящей из глицина и цистеина. В некоторых воплощениях хелатор выбран из группы, состоящей из дицистеина, триглицин цистеина и трицистеин глицина. Количество и выбор аминокислот могут быть ограничены их растворимостью в органической среде. В определенных воплощениях этилендицистеин (ЕС) является хелатором.
Направленные лиганды далее описаны детально. Хотя хелатор может соединен (то есть химически присоединен или связан) с направленным лигандом любым способом, известным специалистам (например, ковалентная связь, ионная связь, дативная связь, ионная пара), обычно соединение включает ковалентную связь.
Способы настоящего изобретения могут далее включать по крайней мере один шаг очистки. Любой состав настоящего изобретения может быть очищен любым способом, известным специалистам. Специалисты в данной области знакомы с такими способами, и им известно, когда эти способы могут использоваться. Например, в многошаговом синтезе, который нацелен на достижение специфического соединения, шаг очистки может быть выполнен после каждого синтетического шага, после каждых нескольких шагов, в различное время в течение синтеза и/или в самом конце синтеза. В некоторых способах один или более шагов очистки включают приемы, отобранные из группы, состоящей из колончатой хроматографии на силикагеле, HPLC (высокоэффективная жидкостная хроматография) и LC (жидкостная хроматография). В определенных воплощениях способы очистки определенно исключают вытеснительную по размеру хроматографию и/или диализ. Способы очистки описаны более подробно ниже.
В определенных воплощениях несоединенные хелаторы и/или сложное соединение хелатор-направленный лиганд получают синтетическими органическими способами с очень высокой чистотой по сравнению с составами, полученными водной методологией. Например, в некоторых воплощениях настоящего изобретения несоединенный хелатор, незащищенный хелатор, защищенный хелатор, сложное соединение хелатор-направленный лиганд или сложное соединение меченый ионом металла хелатор-направленный лиганд, полученные органическими средствами (или любой состав, включающий комбинацию хелатора, защитной группы, направленного лиганда и иона металла), являются чистыми от приблизительно 90% до приблизительно 99,9% по сравнению с составами, полученными водным способом, которые являются чистыми от приблизительно 50% до приблизительно 70%. В определенных воплощениях несоединенный хелатор, незащищенный хелатор, защищенный хелатор, сложное соединение хелатор-направленный лиганд или сложное соединение меченый ионом металла хелатор-направленный лиганд, полученные органическими средствами (или любой состав, включающий комбинацию хелатора, защитной группы, направленного лиганда и иона металла), являются чистыми приблизительно на или по крайней мере приблизительно на 60%, 61%, 62%, 63%, 64%, 65%, 66%, 67%, 68%, 69%, 70%, 71%, 72%, 73%, 74%, 75%, 76, 77%, 78%, 79%, 80%, 81%, 82%, 83%, 84%, 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99%, 99,5%, 99,9% или выше или в любом другом получаемом диапазоне. В определенных воплощениях диапазон чистоты находится в пределах от приблизительно 70% до приблизительно 99,9%. В определенных воплощениях диапазон чистоты находится в пределах от приблизительно 75% до приблизительно 99,9%. В определенных воплощениях диапазон чистоты находится в пределах от приблизительно 80% до приблизительно 99,9%. В определенных воплощениях диапазон чистоты находится в пределах от приблизительно 85% до приблизительно 99,9%. В определенных воплощениях диапазон чистоты находится в пределах от приблизительно 90% до приблизительно 99,9%. В определенных воплощениях диапазон чистоты находится в пределах от приблизительно 95% до приблизительно 99,9%.
В определенных воплощениях настоящего изобретения по крайней мере один из A, D, Е или F является защищенным по крайней мере на одном шаге, используя по крайней мере один защитный агент, и по крайней мере одна функциональная группа направленного лиганда защищена по крайней мере на одном шаге, используя по крайней мере один защитный агент. Функциональные группы, описанные здесь, могут быть любого типа, известного специалистам. Термин «функциональная группа» главным образом относится к таким группам, которые специалисты в технологии классифицируют как химически реактивные группы. Неограничивающие примеры их включают алкен, алкин, арил (например, фенил, пиридинил), спирт, альдегид, кетон, азид, галоген, эстер, -СООН, -NH2, тиол, вторичный амин, третичный амин, -S-, -S(O)- и -S(O)2-. В некоторых воплощениях по крайней мере одна функциональная группа включает атом, выбранный из группы, состоящей из С, Н, О, N, Р и S. Позиции А, В, С, D, Е и/или F могут включать одну или более функциональные группы (например, -СООН, -NH2, тиол, вторичный амин, третичный амин, -S-, -S(O)-, или -S(O)2-). В определенных воплощениях по крайней мере одна функциональная группа направленного лиганда включает атом, выбранный из группы, состоящей из О, N, S и Р. Функциональная группа направленного лиганда может быть, например, выбрана из группы, состоящей из амино, амидо, тиола, гидроксила, эфира, сложного эфира, карбонила, карбоксильной кислоты, сульфонамидо, тио-эфира, тиосложного эфира и тиокарбонила.
И направленный лиганд, и хелатор будут обычно иметь одну или более функциональные группы. Здесь описаны функциональные группы и защитные агенты, которые могут использоваться, чтобы получить защищенную функциональную группу. Специалистам будет понятно, что любая функциональная группа может быть защищена, используя защитный агент по мере необходимости, как описано здесь. Мы видим, что функциональная группа может быть защищена (например, защищенный амин, такой как -NH-CH2) или не защищена, которая также называется «свободной» (такая как -NH2). Как известно специалистам, защитные группы используются в органическом синтезе и в неводных синтезах.
Далее в определенных воплощениях одна или более защитных групп могут быть удалены. Удаление защитной группы может быть сделано в любое время в течение способа или синтеза, описанного здесь, но обычно выполняется, когда защитная группа больше не необходима, а функциональная группа, которая защищается, желательно, чтобы стала «показанной». В любом способе, описанном здесь, любой состав, включающий хелатор, описанный здесь (например, сложное соединение хелатор-направленный лиганд, сложное соединение меченый ионом металла хелатор-направленный лиганд), может не содержать никаких защитных групп или может включать одну или более защитных групп. Например, участок может быть изображен, используя сложное соединение меченый ионом металла хелатор-направленный лиганд, которое не содержит никаких защитных групп или содержит одну или более защитные группы.
В определенных воплощениях направленный лиганд включает уходящую группу. Термин «уходящая группа» обычно относится к группам, с готовностью переносимым нуклеофилом, таким как амин, спирт или нуклеофил тиола. Такие уходящие группы известны и включают, например, карбоксилаты, N-гидроксисукцинимид, N-гидроксибензотриазол, галогениды, трифлаты, тозилаты, мезилаты, алкокси, тиоалкокси, сульфонилы и т.п.
В дальнейших воплощениях три или более функциональные группы хелатора вместе формируют хелат. Как правило, три или четыре атома вместе формируют хелат. В определенных воплощениях хелат выбирают из группы, состоящей из NS2, N2S, S4, N2S2, N3S и NS3. Например, три тиоэфира и один вторичный амин могут формировать хелат NS3. В некоторых воплощениях, таких как с этилендицистеином, хелатом является хелат N2S2. Хелаты могут быть хелатами любого типа, известного специалистам, и далее описаны здесь. Другие атомы, помимо N и S, могут включать хелат, такой как кислород.
Используемый здесь термин «хелат» может использоваться как существительное или глагол. Как существительное, «хелат» относится к одному или более атомам, которые способны к хелированию одного или более ионов металла или являются хелированными в один или более ионов металла. Ионы металла описаны более подробно здесь. В некоторых воплощениях только один ион металла координируется в хелат. Неограничивающий пример «хелата» включает «N2S2» хелат: это означает, что два атома азота и два атома серы хелатора являются или а) способными к хелированию одного или более ионов металла или b) быть координированными с (или хелированными с) одним или более ионами металла. Соответственно, в некоторых воплощениях хелат - это N2S2. Состав, включающий хелат, является хелатором. Как правило, только один ион металла хелирован в хелатор.
В определенных воплощениях по крайней мере одна позиция из A, D, Е и F 10 является тиолом. Тиол может быть защищен по крайней мере на одном шаге, используя по крайней мере один защитный агент тиола. Защитный агент тиола может быть любым из известных специалистам. Например, защитный агент тиола может быть выбран из 10 оплопы, состоящей из алкил-галогенида, бензил-галогенида, бензоил-галогенида, сульфонил-галогенида, трифенилметил-галогенида, метокситрифенилметил-галогенида и цис-теина.
В определенных воплощениях по крайней мере одна позиция из А, D, Е и F включает первичный амин, или по крайней мере одна позиция из В и С включает 10 опричный амин. В определенных воплощениях по крайней мере один амин может быть защищен на одном или более шагах, используя по крайней мере один защитный агент амина. Защитный агент амина может быть любым из известных специалистам. Например, защитный агент амина может быть выбран из группы, состоящей из бензилхлор-формиата, p-нитро-хлорбензилформиата, этилхлорформиата, ди-тер-бутил-дикарбоната, трифенилметил хлорида и метокситрифенилметил хлорида.
В определенных воплощениях хелатор - это этилендицистеин. При использовании этилендицистеина в качестве хелатора в синтезе соединения этилендицистеин-направленный лиганд, две тиольные группы этилендицистеина защищены, используя по крайней мере один защитный агент тиола (например, используя два или более эквивалента защитного агента тиола), а на другом шаге две аминные группы этилендицистеина защищены, используя по крайней мере один защитный агент амина (например, используя два или более эквивалента защитного агента амина). С этих пор тиольные группы являются более реактивными, чем аминные группы, обычно тиольные группы защищают после того, как будут защищены аминные группы, если обе группы первоначально были не защищены («свободны»).
Как было упомянуто, соединение между хелатором и направленным лигандом может происходить любым способом и с помощью любой химической связи, известной специалистам в этой области. Таким образом, направленный лиганд может быть соединен или связан с одним или более хелаторами любым способом, известным специалистам в этой области. В определенных воплощениях соединение между хелатором и направленным лигандом имеет место только на одном шаге (то есть реакция «с одним резервуаром»), Как известно специалистам, реакции в один шаг желательны, поскольку они экономят время, помогают минимизировать ненужные реактивы и минимизируют потерю получаемого вещества. Любая позиция из А, В, С, D, Е и/или F может участвовать в соединении с направленным лигандом. Кроме того, любая позиция из А, В, С, D, Е и/или F может участвовать в хелировании. Далее, любая позиция из А, В, С, D, Е и/или F может участвовать и в хелировании и в соединении. Такая гибкость позволяет хелаторам настоящего изобретения использоваться в разнообразных целях, в зависимости от, например, реактивности выбранного направленного лиганда, селективности желательного соединения, растворимости реактивов, иона металла, требуемого для хелирования и т.д. Как правило, но не всегда, соединение происходит до хелирования.
Обычно один тип направленного лиганда соединен с одним хелатором, но многочисленные направленные лиганды могут соединяться с единственным хелатором. Обычно, в течение органического синтеза сложных соединений хелатор- направленный лиганд, между хелатором и направленным лигандом один действует как нуклеофил, а другой действует как электрофил так, что соединение происходит посредством ковалентной связи. Ковалентная связь может быть любого типа, известного специалистам. В некоторых воплощениях, ковалентная связь выбрана из группы, состоящей из амидной связи, эфирной связи, сложноэфирной связи, тиоэфирной связи, тиосложноэфирной связи, сульфонамидной связи и углерод-углеродистой связи. Углерод-углеродистая связь обычно является единственной связью, но может также быть двойной или тройной связью. Действуя как электрофилы, хелаторы и направленные лиганды могут включать функциональные группы, такие как галогены и сульфонилы, которые действуют как уходящие группы в течение соединения. В некоторых воплощениях соединение имеет место в одной или более функциональных группах хелатора, выбранных из группы, состоящей из карбоксильной кислоты, амина и тиола. Направленные лиганды могут также включать нуклеофильные группы, такие как -NH2, которые могут участвовать в соединении с электрофильным хелатором. Способы соединения обсуждены подробно ниже.
В определенных воплощениях сложное соединение хелатор-направленный лиганд далее включает линкер между хелатором и направленным лигандом. Такой линкер может, например, обеспечить более легкое соединение между хелатором и направленным лигандом, обеспечивая реактивную группу, которая облегчает реакцию соединения. Линкер может быть любого типа, известного специалистам. Первоначально линкер может быть присоединен к хелатору или к направленному лиганду. Линкер может быть присоединен к хелатору, в то время как другой линкер присоединен к направленному лиганду так, что эти два линкера могут быть затем соединены. Специалисты в этой области знакомы с такими типами линкеров, подходящих для способов настоящего изобретения. В некоторых воплощениях линкер выбирают из группы, состоящей из пептида, глутаминовой кислоты, аспарагиновой кислоты, бромзамещенного этилацетата, диамина этилена, лизина и любой комбинации одной или более этих групп.
В определенных воплощениях и Е и F являются независимо выбранными из группы, состоящей из -СООН, -NH2 или тиола. В некоторых воплощениях и Е и F, каждое, являются -СООН. В определенных воплощениях соединение по крайней мере одного направленного лиганда присутствует в Е и/или F. В определенных воплощениях каждое из А и D являются защищенными по крайней мере одной защитной группой до соединения.
Специалисты оценят по достоинству то, что при соединении хелатора с направленным лигандом по крайней мере одна функциональная группа хелатора и по крайней мере одна функциональная группа направленного лиганда должны быть «свободными» (то есть незащищенными защитной группой), так что два соединения могут быть объединены.
Хелатор далее может включать спейсер, позиция X. В определенных аспектах использование спейсера позволяет для надлежащего количества и должной ориентации хелированных атомов хелировать ион металла. Специалисты в этой области знакомы с такими спейсерами, которые могут использоваться для способов настоящего изобретения, и примеры спейсеров раскрыты ниже. Например, может использоваться спейсер алкил, такой как (-CH2-)n, где n находится в пределах от 1 до 100. Один тип хелатора, подходящий для способов настоящего изобретения, включает спейсер этилен, то есть этилендицистеин (ЕС). В определенных воплощениях, позиция Х является -СН2-С(O)-, -С(O)-СН2-, -СН2-СН2-С(O)- или -С(O)-СН2-СН2-, а позиция В и/или С - это вторичный амин. В этом воплощении обычно одно, или В или С, являются менее нуклеофильным, чем другое. Например, если вместе В, С и L будут изображены как -NH-C(O)-CH2-CH2-NH-, то вторичный амин позиции С будет больше нуклеофильным, чем вторичный амин В. Таким образом, С будет более реактивным, приводя к тому, что в выбранном соединении направленный лиганд находится в положении С. В определенных воплощениях, оба положения А и D или Е и F являются каждое защищенным по крайней мере одной защитной группой до соединения в С.
Одна особенность использования амидных связей состоит в том, что когда В, С и L вместе формируют -NH-C(O)-CH2-CH2-NH-, неправильно полагают, что реакции, где ион металла хелируется в хелатор, часто имеют место в кислой среде. Амидные связи являются относительно стойкими к разложению в кислой среде и поэтому обеспечивают структурную стабильность в хелаторе в течение подобных реакций хелирования. Таким образом, Х вместе с В и/или С может включать амидную связь.
Соединения хелатор-направленный лиганд, хелированные с ионом металла, могут функционировать как, например, агенты получения изображения и/или диагностики, как описано здесь. Они могут также функционировать как терапевтические агенты, агенты для диагностики и терапии или агенты получения изображений и терапии. Соответственно, в определенных воплощениях способы настоящего изобретения далее включают хелирование иона металла хелатором, чтобы получить сложное соединение меченый ионом металла-хелатор-направленный лиганд. Ион металла может быть любым из известных специалистам. Ион металла может быть «холодным» (нерадиоактивным) ионом металла или радионуклидом. В неограничивающих примерах ион металла может быть выбран из группы, состоящей из иона технеция, иона меди, иона индия, иона таллия, иона галлия, иона мышьяка, иона рения, иона гольмия, иона иттрия, иона самария, иона селена, иона стронция, иона гадолиния, иона висмута, иона железа, иона марганца, иона лютеция, иона кобальта, иона платины, иона кальция и иона родия. Холодный ион металла может быть, например, выбран из группы, состоящей из Cu-62, As-72, Re-187, Gd-157, Bi-213, Fe-56, Mn-55, иона железа, иона марганца, иона кобальта, иона платины и иона родия.
Ион металла может быть радионуклидом, любым радионуклидом, известным специалистам. Радионуклид в некоторых воплощениях может быть выбран из группы, состоящей из99mTc,188Re,186Re,153Sm,166Но,90Y,89Sr,67Gа,68Gа,111In,148Gd,55Fe,225Ac,212Bi,211At,45Ti,60Cu,61Cu,67Cu и64Cu. В некоторых воплощениях, ионом металла 14 оплоется99mТе.
Если выбран ион металла99mТе, например, способ может далее включать добавление восстанавливающего агента. Восстанавливающий агент может быть любым агентом, известным специалистам. В некоторых воплощениях восстанавливающий агент включает ион, выбранный из группы, состоящей из иона дитионита, иона, содержащего двухвалентное олово, и железистого иона. В некоторых воплощениях ион металла - это188Re. В других воплощениях, ион металла - это68Ga.
Когда ион металла используется в способе настоящего изобретения, ион металла может быть хелирован в любой хелат, известный специалистам, как описано здесь. Специалисты в этой области признают, что ионы металла хелируются в различное число атомов в зависимости от, например, типа металла, его валентности и атомов, способных к хелатообразованию. Например, три или четыре атома хелатора могут хелировать один ион металла. В определенных воплощениях хелированным ионом металла может быть99mТе. В определенных воплощениях хелированным ионом металла может быть186Re. В определенных воплощениях хелированным ионом металла может быть187Re.
В некоторых воплощениях хелат может быть выбран из группы, состоящей из NS2, N2S, S4, N2S2, N3S и NS3. В определенных воплощениях любой один или более из этих хелатов может не быть хелатом настоящего изобретения. В некоторых воплощениях N3S не является хелатом. В определенных воплощениях хелатом является N2S2, например, этилендицистеина. Способы настоящего изобретения могут далее включать синтез сложного соединения меченый ион металла-хелатор-направленный лиганд, где направленный лиганд участвует с А, В, С, D, Е, и/или F в хелировании иона металла. Ионы металла, хелирование и направленные лиганды описаны более подробно ниже. В некоторых воплощениях может быть получено изображение иона металла. Получение изображения может происходить любым способом, известным специалистам. Образцовые способы получения изображений обсуждены подробно в спецификации ниже и включают PET и SPECT.
Как говорилось выше, сложные соединения меченый ион металла-хелатор-направленный лиганд, полученные путем органического синтеза, обычно обладают более высокой чистотой, чем полученные водным способом приготовления. Например, в некоторых воплощениях настоящего изобретения сложное соединение меченый ион металла-хелатор-направленный лиганд, полученное органическим путем, имеет чистоту между приблизительно 90% и приблизительно 99,9% по сравнению с соединением, полученным водным путем, которое имеет чистоту между приблизительно 50% и приблизительно 70%. В определенных воплощениях сложное соединение меченый ион металла-хелатор-направленный лиганд, синтезированное органическим путем, имеет чистоту приблизительно или по крайней мере приблизительно 60%, 61%, 62%, 63%,64%, 65%, 66%, 67%, 68%, 69%, 70%, 71%, 72%, 73%, 74%, 75%, 76, 77%, 78%, 79%, 80%, 81%, 82%, 83%, 84%, 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99%, 99,5%, 99,9% или выше, или в любом получаемом диапазоне.
Любой хелатор, описанный здесь, может быть хелирован с ионом металла. Использоваться может защищенный хелатор или незащищенный хелатор. Хелатор может быть хелирован до или после очистки.
В определенных воплощениях генерация сложного соединения меченый ионом металла-хелатор-направленный лиганд включает:
(a) удаление по крайней мере одной защитной группы из сложного соединения хелатор-направленный лиганд, описанного здесь; и
(b) хелирование иона металла в хелатор сложного соединения хелатор-направленный лиганд.
В определенных воплощениях генерация сложного соединения меченый ионом металла-хелатор-направленный лиганд включает:
(а) получение хелатора со следующей формулой:

где А, В, С, D, Е, F, X, R1, R2, R3 и R4 определены выше, и по крайней мере одно из А, В, С, D, Е, F, X, R1, R2, R3 и R4 защищено по крайней мере одним защитным агентом;
(b) соединение хелатора с лигандом наведения, чтобы получить сложное соединение хелатор-направленный лиганд;
(c) удаление по крайней мере одной защитной группы из сложного соединения хелатор-направленный лиганд; и
(d) хелирование иона металла, описанного здесь, в хелатор сложного соединения хелатор-направленный лиганд.
Действительно, было рассмотрено, что любое соединение, описанное здесь, включающее одну или более защитных групп, может в любом специфическом способе подвергнуться удалению одной или более защитных групп. 3ащитная группа может быть удалена, например, из части хелатора, из части лиганда наведения или из обеих частей на одном или более шагах до или после того, как сложное соединение хелатор-направленный лиганд хелировано с ионом металла, как описано здесь. Защитные группы описаны здесь более подробно, включая их установку и удаление.
В других воплощениях генерация сложного соединения меченый ион металла-хелатор-направленный лиганд включает:
(a) хелирование иона металла в хелатор, как описано здесь, для получения меченого ионом металла хелатора;
(b) соединение меченого ионом металла хелатора с направленным лигандом; и
(c) удаление одной или более защитных групп из сложного соединения меченый ионом металла-хелатор-направленный лиганд.
Определенные воплощения настоящего изобретения рассматривают способ синтезирования защищенного хелатора, включающий:
(а) получение хелатора со следующей формулой:

где:
A, D, E и F каждый независимо является Н, нижним алкилом, -СООН, -NН2 или тиолом, где по крайней мере одна позиция является -СООН, -NH2 или тиолом;
В и С каждый независимо является вторичным амином, третичным амином, -S-, -S(O)- или - S(O)2-;
R1, R2, R3 и R4 каждый независимо является Н или нижним алкилом; и
Х выбран из группы, состоящей из -СН2-СН2-, -СН2-СН2СН2-, -СН2-С(O)-, -С(O)-СН2-, -С(O)-СН2-СН2- и -СН2-СН2-С(O)-; и
(b) защита -СООН, -NH2 или тиола, используя защитный агент карбоксильной кислоты, защитный агент амина, защитный агент тиола соответственно.
Любой синтетический способ настоящего изобретения может быть выполнен в органической среде. Защищенный хелатор может быть защищенным этилендицистеином. Далее способ может включать шаг очистки, шаг хелирования, включающий хелирование иона металла, удаление по крайней мере одной защитной группы или любую комбинацию этих шагов. (Действительно, любой способ, описанный здесь, может включать шаг очистки, шаг хелирования, включающий хелирование иона металла, удаление по крайней мере одной защитной группы или любую комбинацию этих шагов.) В этом или любом другом способе, описанном здесь, защищенный хелатор может быть чистым от приблизительно 80% до приблизительно 99,9%. Например, защищенный хелатор может быть чистым от приблизительно 80% до приблизительно 90%. В этом или любом другом способе, описанном здесь, включающем хелатор с основной структурой, показанной выше, когда А и D, каждый, являются -NH2, ни В, ни С не могут быть вторичным или третичным амином.
Определенные воплощения настоящего изобретения также рассматривают сложное соединение хелатор-направленный лиганд со следующей формулой:

где:
A, D, E и F каждый независимо включает Н, нижний алкил, -СООН, защищенную карбоксильную кислоту, -NHz, защищенный амин, тиол, защищенный тиол, незащищенный направленный лиганд или защищенный направленный лиганд,
где по крайней мере одно из А, D, Е и F включает защищенную карбоксильную кислоту, защищенный амин или защищенный тиол и по крайней мере одно из А, D, Е и F включает защищенный направленный лиганд или незащищенный направленный лиганд;
В и С каждый независимо является вторичным амином, третичным амином, -S-,-S(O)- или - S(O)2-;
R1, R2, R3 и R4 каждый независимо является Н или нижним алкилом;
Х выбирают из группы, состоящей из -СН2-СН2-, -СН2-СН2-СН2-, -СН2-С(O)-, -С (O)-СН2-, -С(O)-СН2-СН2- и -СН2-СН2-С(O)-; и
где сложное соединение хелатор-направленный лиганд является чистым от приблизительно 70% до приблизительно 99,9%.
Соединение может быть чистым от приблизительно 80% до приблизительно 99,9%. Соединение может быть чистым от приблизительно 90% до приблизительно 99,9%. Далее соединение может быть определено как сложное соединение меченый ион металла-хелатор-направленный лиганд. Соединение может быть далее определено как99mТс-ЕС-глюкозамин,187Rе-ЕС-глюкозамин или187Rе-ЕС-глюкозамин.
Как было упомянуто, направленный лиганд может быть любого типа, известного специалистам, и подобные лиганды обсуждаются здесь более подробно. "Направленный лиганд" определяется здесь как молекула или частью молекулы, которая связывает со специфичностью другую молекулу. Известны многочисленные агенты, которые могут использоваться как направленные лиганды в контексте настоящего изобретения. Направленный лиганд может быть любой подобной молекулой, известной специалистам.
Неограничивающие примеры направленных лигандов включают ткане-специфический лиганд, противомикробный, противогрибковый или агент получения изображений.
В некоторых воплощениях направленный лиганд является "тканеспецифическим лигандом." "Тканеспецифический лиганд" определен здесь как молекула или часть молекулы, которая может связываться или соединяться с одной или более тканей. Сцепление может происходить с помощью любого механизма связывания, известного специалистам.
Неограничивающие примеры тканеспецифических лигандов включают лекарственный препарат, ингибитор топоизомеразы ДНК, интеркалирующее вещество ДНК, антиметаболит, соединение наведения болезни клеточного цикла, маркер экспрессии генов, направленный лиганд развития кровеносных сосудов, маркер новообразования, направленный лиганд рецептора фолата, направленный лиганд утраченных клеток, направленный лиганд гипоксии, направленный лиганд рецептора заболевания, маркер рецептора, пептид, нуклеотид, антитело, антисмысловая молекула, малые интерферирующие РНК, пентепептид глутамата, агент, имитирующий глюкозу, амифостин, ангиоста-тин, моноклональное антитело С225, моноклональное антитело CD31, моноклональное антитело CD40, капецитабин, деоксицитидин, фуллерен, герцептин, человеческий сывороточный альбумин, лактоза, хиназолин, талидомид, трансферрин и лизин триметила.
В некоторых воплощениях тканеспецифический лиганд может быть лекарственным препаратом, таким как антираковый агент. Неограничивающие примеры антираковых агентов включают тамоксифен, топотекан, LHRH, подофиллотоксин, колхицин, эндостатин, томудекс, тиотепа, циклосфосфамид, бусульфан, импорсульфан, пипосульфан, бензодопа, карбоквон, метуредопа, уредопа, алтретамин, триэтиленмеламин, триэтиленфосфорамид, триэтилентиофосфорамид, триметилоломеламин, буллатацин, буллатацинон, бриостатин, каллистатин, СС-1065, адозелезин, карзелезин, бизелезин, криптофицин 1, криптофицин 8, доластатин, дуокармицин, KW-2189, CB1-TM1, элеутеробин, панкратистатин, саркодиктиин, спонжистатин, хлорамбуцил, хлорнафазин, холофосфамид, эстрамустин, ифостамид, мехлоретамин, гидрохлорид оксида мехлоретамина, мелфалан, новембихин, фенестерин, преднимустин, трофостамид, урацил мустард, кармустин, хлорзотоцин, фотемустин, ломустин, нимустин и ранимнустин, каличеамицин, динеми-цин, клодронат, эсперамицин, хромофор неокарциностатина, аклациномизин, актиномицин, authramycin, азасерин, блеомицин, кактиномицин, карабицин, карминомицин, кар-цинофилин, хромомицин, дактиномицин, даунорубицин, деторубицин, 6-диазо-5-оксо-L-норлейцин, эпирубицин, эзорубицин, идарубицин, марцелломицин, микофенольная кислота, ногаларницин, оливомицины, пепломицин, потфиромицин, пуромицин, квеламицин, родорубицин, стрептонигрин, стрептозоцин, туберцидин, убенимекс, зиностатин, зорубицин, 5-фторурацил (5-ФУ), деноптерин, метотрексат, птероптерин, триметрексат, 6-меркаптопурин, тиамиприн, тиогуанин, анцитабин, азацитидин, 6-азауридин, кармофур, цитарабин, дидеоксиуридин, доксифлюридин, эноцитабин, флоксуридин, калустерон, пропионат дромостанолона, эпитиостанол, мепитиостан, тестолактон, аминоглютетимид, митотан, трилостан, фолиновая кислота, ацеглатон, гликозид альдофосфамида, аминолевулиновая кислота, энилурацил, амсакрин, бестрабуцил, бизантрен, эдатраксат, дефофамин, демеколцин, диазиквон, элформитин, эллиптиниума ацетат, эпотилон, этоглюцид, нитрат галлия, гидроксиурия, лентинан, лонидаинин, майтанзиноид, митогуазон, мопиданмол, нитраэрин, пентостатин; фенамет; пирарубицин; лозоксантрон; кислота подофиллиновая; 2-этилгидразид; прокарбазин, полисахаридный комплекс ПСК, разоксан, ризоксин, сизофиран, спирогерманиум, тенуазоновая кислота, триазиквон, 2,2', 2''-трихлоротриэтиламин, трихотецин, уретан, виндезин, дакарбазин, манномустин, митобронитол, митолактол, пипоброман, гацитозин, арабинозид ("Аrа-С"), циклофосфамид, тиотепа, доксетаксел, хлорамбуцил, 6-тиогуанин, меркаптопурин, метотрексат, цисплатин, оксалиплатин, карбоплатин, винбластин, платина, ифостамид, митоксантрон, винкристин, винорелбин, новантрон, тенипосид, эдатрексат, дауномицин, аминопептерин, кселода, ибандронат, иринотекан, RFS 2000, дифторометилорнитин (ДФМО), ретинойная кислота и капецитабин.
Другие примеры лекарственных средств включают лекарственные средства для лечения сердечно-сосудистых заболеваний. Неограничивающие примеры таких лекарственных средств включают антигиперлипопротеинемический агент, антиартериосклеротический агент, антитромбический агент, фибринолитический агент, антитромбоцетарный агент, коагулянт крови, тромболитический агент, антиаритмический агент, противогипертонический агент, сосудосуживающий агент, агент антиангиотензин II, агент снижения нагрузки, преодолеваемой мышцой при сокращении/предварительной нагрузки, мочегонное средство и инотропный агент. Примеры лекарственных средств для лечения сердечно-сосудистых заболеваний включают мексилетин, токаинид, морицизин, прокаинамид, дизопирамид, хинидин, попафенон, флекаинид, энкаинид, бепридил, верапамил, дилтиазем, бретилий, соталол, амиодарон, ибутилид, пропранолол, атропин, аденозин и дигоксин. Большее количество примеров перечислено ниже.
В некоторых воплощениях направленный лиганд является ингибитором ДНК топоизомеразы. Неограничивающие примы включают антибиотик флюорохинолон, иринотекан, топотекан, этопосид, тенипосид, луртотекан, эксатекан и рубитекан. Неограниченные примеры интеркалирующего вещества ДНК включают 7-аминоактиномицин, этидий, профлавин, дауномицин, доксорубицин и талидомид.
В некоторых воплощениях, направленный лиганд является антиметаболитом. Неограничивающие примеры включают азатиоприн, меркаптопурин, пиримидин, препарат сульфаниламида, метотрексат, тетрагидрофолат, фолиевую кислоту, пеметрексед, ралтитрексед, тиогуанин, флударабин, пентостатин, кладрибин, фтороурацил, флоксуридин и гемцитабин.
Направленный лиганд может быть направленным лигандом заболевания клеточного цикла. Неограничивающие примеры включают аденозин, FIAU, FIRU, IVFRU, GCV, PCV, FGCV, FPCV, FHPG, FHBG и гуанин.
В некоторых воплощениях направленный лиганд - это маркер экспрессии гена. Например, маркер экспрессии гена может быть лигандом рецептора фактора эпидермального роста. В дальнейших воплощениях направленный лиганд является направленным лигандом ангиогенезиса. Неограничивающие примеры включают ингибитор COX-2, рецептор анти-EGF, герцептин, ангиостатин или талидомид. Примеры ингибиторов СОХ-2 включают целекоксиб, рофекоксиб и эторикоксиб.
Другие примеры направленных лигандов включают маркеры новообразования. Неограниченные примеры маркеров новообразования включают ПСА, ER, PR, СА-125, СА-199, СЕА (раковый эмбриональный антиген), АФП, интерферон, BRCA1, HER-2/neu, цитоксан, р53 и эндостатин. Направленный лиганд может также быть направленным лигандом рецептора фолата. Примеры включают фолат, метотрексат и томудекс.
Направленный лиганд может также быть направленным лигандом апоптической клетки. Например, направленный лиганд апоптической клетки может далее быть определен как направленный лиганд апоптической клетки новообразования. Неограничивающие примеры включают моноклональное антитело TRAIL, субстрат каспазы-3 и членов семьи Всl. Примеры субстрата каспазы-3 включают пептид или полипептид, включающий аминокислотную последовательность аспарагиновая кислота-глутаминовая кислота-валин-аспарагиновая кислота. Примеры членов семьи Всl включают Вах, Bcl-xL, Bid, Bad, Bak и Bcl-2.
В некоторых воплощениях направленный лиганд является направленным лигандом гипоксии. Например, направленный лиганд гипоксии может быть направленным лигандом гипоксии новообразования, маркером ишемии сердца, маркером жизнеспособности сердечной ткани, маркером застойной сердечной недостаточности или маркером покоя/нагрузки сердечный ткани. Неограничивающие примеры направленных лигандов гипоксии новообразования включают аннексии V, колчицин, нитроимидазол, митомицин, метронидазол,-99mТс-НL91 и Cu-ATSM. Неограничивающие примеры маркеров ишемии сердца включают интерлейкин-6, фактор альфа омертвения тканей, матрица металлопротеиназа 9, миэлопероксидаза, межклеточные и сосудистые молекулы адгезии, растворимый направленный направленный лиганд CD40, фактор роста плаценты, С-реактивный белок высокой чувствительности (hs-CRP), измененный ишемией альбумин (IMA), свободные жирные кислоты и холин. Неограничивающие примеры маркеров жизнеспособности сердечной ткани включают фосфолипазу С, фосфатазу легкой цепи миозина, окись азота, простациклин, эндотелии, тромбоксан, L-аргинин и L-цитрулин. Неограничивающие примеры маркеров застойной сердечной недостаточности включают интерлейкин 1, кардиотрофин-1, инсулин подобный фактор роста, фактор эпидермального роста, рецептор киназы тирозина, ангиотензин II и метронидазол. Неограничивающие примеры маркеров покоя/нагрузки сердечной ткани включают киназу активизированного митогеном белка, циклический аденозин монофосфат, фосфолипазу С, фосфатидилинозитол бисфосфат, трифосфат изоситол, диациглицерол, киназа тирозина и метронидазол.
Неограничивающие примеры пептидов, рассматриваемых как направленные лиганды, включают нейропептид Y, пептид, связанный с геном кальцитонина, вещество Р и вазоактивный кишечный пептид. Неограничивающие примеры нуклеотидов, рассматриваемых как направленные лиганды, включают аденин, тимин, гуанин, цитозин и урацил. Неограничивающие примеры антител, рассмотриваемых как направленные лиганды, включают антитело, которое связывает тропонин, тропомиозин, сарколемму, коллаген, матричную металлопротеиназу или тканевой ингибитор матричной металлопротеиназы.
В некоторых воплощениях, направленный лиганд - это антисмысловая молекула или сиРНК. Направленным лигандом может также быть глутамата пентапептид.
В специфических воплощениях направленным лигандом является агент, имитирующий глюкозу. Неограничивающие примеры агентов, имитирующих глюкозу, включают деоксиглюкозу, глюкозамин, тетраацетилированный глюкозамин, неомицин, канамицин, гентамицин, паромицин, амикацин, тобрамицин, нетилмецин, рибостамицин, сисомицин, микромицин, ливидомицин, дибекацин, изепамицин, астромицин и аминогликосид. В специфических воплощениях агент, имитирующий глюкозу, является глюкозамином.
В дальнейших воплощениях, направленный лиганд является направленным лигандом рецептора заболевания. Неограничивающие примеры направленных лигандов рецептора заболевания включают эстроген, андроген, лютеинизирующий гормон, лютеинизирующего гормона высвобождающий гормон (LHRH), трансферрин, прогестин, тетраацетата манноза, α - β - тирозин, тирозин, производная тирозина, эстрон, тамоксифен и α-метилтирозин.
Настоящее изобретение рассматривает состав, включающий сложное соединение меченый ион металла-хелатор-направленный лиганд, синтезируемое любым из способов, описанных здесь. В специфических воплощениях сложное соединение меченый ион металла-хелатор-направленный лиганд включает этилендицистеин, хелирующий ион металла, выбранный из группы, состоящей из99mТc,68Ga,188Re,187Re и186Re; направленный лиганд включает направленный лиганд, выбранный из группы, состоящей из глюкозамина, деоксиглюкозы, метронидазола, аннексина V, гуанина и LHRH; и соединение между хелатором и направленным лигандом имеет место через амидную связь или сложноэфирную связь.
Образцовые противораковые соединения включают хелатор, способный хелировать терапевтическое радиометаллическое вещество, такое как Re-188, Re-187, Re-186, Но-166, Y-90, Sr-89 или Sm-153, мышьяк, кобальт, медь, кальций, селен, таллий или платина. Другие образцовые противораковые лиганды включают, например, эпиподофиллотоксин, винкристин, доцетаксел, паклитаксел, дауномицин, доксорубицин, митоксантрон, топотекан, блеомицин, гемцитабин, флударабин и 5-FUDR. В определенных специфических воплощениях, противораковый лиганд является метотрексатом.
Другие аспекты настоящего изобретения рассматривают состав, включающий сложное соединение хелатор-направленный лиганд, синтезируемое любым из способов, описанных здесь. В определенных воплощениях, изобретение рассматривает состав, включающий сложное соединение меченый ион металла-хелатор-направленный лиганд, синтезируемое любым из способов, описанных здесь. В любом данном воплощении состава, сложное соединение хелатор-направленный лиганд может включать одну или более защитных групп в любом положении или хелатора или направленного лиганда, или и хелатора и направленного лиганда, или группы защиты нет вообще. Кроме того, хелатор или сложное соединение хелатор-направленный лиганд могут включать или, возможно, не включать ион металла.
Воплощения настоящего изобретения также включают состав, в который входит сложное соединение меченый ион металла-хелатор-направленный лиганд, синтезируемое любым из способов, сформулированных здесь. Состав может включить фармацевтически приемлемые курьеры, такие как глутаминовая кислота и другие умеренные кислоты и холодные металлы. В некоторых воплощениях состав включает (а) сложное соединение меченый ион металла-хелатор-направленный лиганд, в которое входит этилендицистеин, хелирующий ион металла, выбранный из группы, состоящей из99mТе,68Ga,188Re и187Re; (b) направленный лиганд, включающий лиганд, выбранный из группы, состоящей из глюкозамина, деоксиглюкозы, метронидазола, аннексина V, гуанина и LHRH; и (с) соединение между хелатором и направленным лигандом имеет место через амидную связь или сложноэфирную связь.
Дальнейшие воплощения настоящего изобретения включают реактив для приготовления агента получения изображений, терапевтического агента или радиотерапевтического агента, включающего сложное соединение меченый ион металла-хелатор, полученное любым из способов, сформулированных здесь. В определенных воплощениях реактив является реактивом для приготовления химиотерапевтического агента или радиохимиотерапевтического агента. В некоторых воплощениях сложное соединение меченый ион металла-хелатор-направленный лиганд является чистым между приблизительно 90% и приблизительно 99,9%. В определенных воплощениях сложное соединение меченый ион металла-хелатор-направленный лиганд включает этилендицистеин.
Настоящее изобретение также имеет отношение к комплектам для приготовления агента получения изображений, терапевтического агента или радиотерапевтического агента, включащим один или более герметичных контейнеров и предопределенное количество состава, включающего сложное соединение хелатор-направленный лиганд, полученное любым способом, описанным здесь, в одном или более герметичных контейнерах. В некоторых воплощениях комплект включает сложное соединение хелатор-направленный лиганд, которое является чистым между приблизительно 90% и приблизительно 99,9%. В некоторых воплощениях комплект включает сложное соединение хелатор-направленный лиганд, которое является чистым между приблизительно 80% и приблизительно 99,9%. В некоторых воплощениях комплект включает сложное соединение хелатор-направленный лиганд, которое является чистым между приблизительно 70% и приблизительно 99,9%. В специфических воплощениях комплект включает сложное соединение этилендицистеин-хелатор-направленный лиганд. В некоторых воплощениях комплект далее включает ион металла. Ион металла может быть, а может не быть радионуклидом. В специфических примерах ион металла является ионом холодного металла (не радионуклид). В специфических воплощениях холодный ион металла является Re-187. В других примерах ион металла является радионуклидом. Примеры ионов металла включают любой из тех ионов металла, которые были обсуждении выше. В некоторых воплощениях комплект включает одну или более емкостей, содержащих состав, в который входят дигидрат динатрия фосфат водорода, маннит, аскорбиновая кислота, натрия эдетат, содержащий двухвалентное олово дигидрат хлорида, винная кислота или калия дигидрогенфосфат и фармацевтически приемлемый курьер.
Дальнейшие воплощения настоящего изобретения рассматривают получение изображений, терапевтический или радиотерапевтический агенты, полученные способом, включающим любой из способов, сформулированных выше.
В некоторых воплощениях сложное соединение хелатор-направленный лиганд являются чистыми от приблизительно 90% до приблизительно 99,9%. В некоторых воплощениях сложное соединение хелатор-направленный лиганд являются чистыми от приблизительно 80% до приблизительно 99,9%. В некоторых воплощениях сложное соединение хелатор-направленный лиганд являются чистыми от приблизительно 70% до приблизительно 99,9%. В определенных воплощениях сложное соединение меченый ион металла-хелатор-направленный лиганд включает этилендицистеин. В специфических воплощениях сложным соединением меченый ион металла-хелатор-направленный лиганд является99mТс-ЕС-глюкозамин. В дальнейших специфических воплощениях сложным соединением меченый ион металла-хелатор-направленный лиганд является186Rе-ЕС-глюкозамин. В еще дальнейших воплощениях сложным соединением меченый ион металла-хелатор-направленный лиганд является187Re-EC-глюкозамин.
Дальнейшие воплощения рассматривают способ получения изображений, диагностики или лечения субъекта, включая назначение субъекту фармацевтически или диагностически эффективного количества сложного соединения меченый ион металла-хелатор-направленный лиганд, где сложное соединение хелатор-направленный лиганд получено способом, включающим любой из способов, сформулированных выше, и где получают изображение заболевания, диагностируют или лечат заболевание. В определенных воплощениях сложное соединение меченый ион металла-хелатор является чистым от приблизительно 90% до приблизительно 99,9%. В определенных воплощениях сложное соединение меченый ион металла-хелатор является чистым от приблизительно 80% до приблизительно 99,9%. В определенных воплощениях сложное соединение меченый ион металла-хелатор является чистым от приблизительно 70% до приблизительно 99,9%. В специфических воплощениях сложное соединение меченый ион металла-хелатор включает этилендицистеин. Ион металла, например, может быть любым из ионов металла, обсужденных выше.
Определенные воплощения рассматривают способ лечения субъекта с гиперпролиферативным заболеванием, включая назначение субъекту фармацевтически эффективного количества сложного соединения меченый ион металла-хелатор-направленный лиганд, полученного любым из способов, сформулированных здесь. В специфических воплощениях гиперпролиферативное заболевание является раком. Например, рак может быть раком молочной железы, раком легкого, раком простаты, раком яичника, раком мозга, раком печени, цервикальным раком, раком толстой кишки, раком почки, раком кожи, раком головы и шеи, раком кости, эзофагиальным раком, раком мочевого пузыря, маточным раком, лимфатическим раком, раком желудка, панкреатическим раком, тестикулярным раком, лимфомой или лейкемией. В определенных воплощениях способ далее опредялется как способ для выполнения двойной радио/химиотерапии. Некоторые воплощения далее включают назначение одной или более вторичных форм терапии ги-перпролиферативного заболевания. Например, вторичная форма терапии может быть химиотерапией, генотерапией, хирургической терапией, лучевой терапией или иммунотерапией. Определенные воплощения рассматривают способы выполнения двойного получения изображений и терапии.
Воплощения настоящего изобретения также рассматривают способы диагноза, оценки эффективности лечения или получение изображения субъекта с выявленным или подозреваемым сердечно-сосудистым заболеванием. Субъект может быть любым субъектом, таким как млекопитающее или модели животных, используемым для оценки наличия сердечно-сосудистого заболевания. Млекопитающее, например, может быть человеком или особью одной из разновидностей обезьян. Модели животных включают собак, котов, крыс, мышей или кроликов. В привилегированных воплощениях субъектом является человек с выявленным или подозреваемым сердечно-сосудистым заболеванием.
Сердечно-сосудистое заболевание может быть любой болезнью сердца или ткани, питаемой сосудистой системой. Сосудистая система включает коронарные артерии и все периферийные артерии, снабжающие питанием периферийную сосудистую систему и мозг. Сосудистая система включает артерии, вены, мелкие артерии, венулы и капилляры. Примерами сердечно-сосудистых заболеваний являются болезни сердца, такие как инфаркт миокарда, миокардиальная ишемия, стенокардия, застойная сердечная недостаточность, кардиомиопатия (врожденная или приобретенная), аритмия или порок клапана сердца. В специфических воплощениях у субъекта выявлена или подозревается миокардиальная ишемия.
Субъект, например, может быть пациентом, который представлен в клинике с признаками или симптомами, указывающими на вероятность наличия миокардиальной ишемии или инфаркта миокарда. Получение изображения сердца субъекта для диагностирования заболевания может включать назначение субъекту фармацевтически эффективного количества сложного соединения меченый ион металла-хелатор-направленный лиганд, синтезируемого, используя любой из способов, сформулированных здесь. Получение изображения может быть выполнено, используя любую модальность получения изображений, известную специалистам в данной области. В специфических воплощениях получение изображения включает использование технологии получения изображений на основе радионуклида, такой как PET или SPECT. В специфических воплощениях сложное соединение меченый ионом металла радионуклид-направленный лиганд является 99m-Тс-ЕС-глюкозамин. Глюкозамин неактивно принимается жизнеспособной миокардиальной тканью, а скорее является специфичной целью для определения областей ишемии. Серьезность ишемии может быть визуально оценена в зависимости от величины сигнала, который измеряется, используя любой способ, известный специалистам в этой области. В некоторых воплощениях получение изображений, использующих любой комплект соединений, описанный здесь, выполняется до, в течение, или после получения изображений сердца, используя второй агент получения изображений. Например, второй агент получения изображений может быть таллием, отображенным сцинтиграфией для определения области нормального кровоснабжения миокарда (неишемизированная ткани).
SPECT (MPS) кровоснабжения миокарда состоят из комбинации воздействия нагрузки (физической или фармакологической) и отдыха, назначения нагрузки и получение изображения радиоактивных медицинских препаратов. Таллий имеет превосходные физиологические свойства для получения изображений кровоснабжения миокарда. Будучи высоко экстрагированным, в течение первого прохождения по венечному обращению была показана линейная зависимость между кровотоком в жизнеспособном миокарде и поглощением таллия в течение упражнения, однако, на очень высоких уровнях потока происходит "скатывание" поглощения. Как несвязанный аналог калия, таллий перераспределяется в течение долгого времени. Его начальное распределение пропорционально региональному кровоснабжению миокарда, и в равновесии распределение таллия пропорционально региональному фонду калия, отражающему жизнеспособный миокард. Механизмы перераспределения таллия являются дифференциалом норм размывания между недостаточно снабжаемым кровью, но жизнеспособным миокардом и нормальными зонами, и нагнетания в первоначально недостаточно снабжаемых кровью зонах. Норма размывания таллия является градиентом концентрации между миокардиальной клеткой и кровью. Существует более медленное очищение крови от таллия после отдыха или низкого уровня нагрузки инъекцией. Диффузные медленные нормы размывания, подражающие диффузной ишемии, могут наблюдаться у здоровых пациентов, которые не достигают адекватных уровней нагрузки. Гиперинсуленемические состояния замедляют перераспределение, приводя к недооценке жизнеспособного миокарда; таким образом, рекомендуется голодание перед и в течение 4 часов после инъекции таллия. Это происходит потому, что если используется ЕС-G в качестве жизнеспособного агента в комбинации с таллием, то он будет направлен точно в интересующую область, которая будет ишемизированной, но жизнеспособной областью (Angello и др., 1987; Gutman и др., 1983; Pohost и др., 1977).
Получение иображений, использующее любое сложное соединение меченый ион металла-хелатор-направленный лиганд настоящего изобретения, может также быть выполнено в соединении с другими диагностическими способами, такими как измерение сердечных изозимов или сердечного зондирования. Получение изображений может быть выполнено с различными интервалами после начала симптомов, или может быть выполнено для оценки изменений миокардиальной перфузии в течение некоторого времени.
Дальнейшие воплощения рассматривают способ получения изображений участка в пределах субъекта, включая (а) назначение субъекту диагностически эффективного количества сложного соединения меченый ион металла-хелатор-направленный лиганд, где сложное соединение меченый ион металла-хелатор-направленный лиганд синтезируется любым из способов, сформулированных здесь; и (b), обнаружение сигнала сложного соединения меченый ион металла-хелатор-направленный лиганд, который локализуется в участке. В определенных исполнениях изобретения сложное соединение меченый ион металла-хелатор-направленный лиганд является чистым от приблизительно 90% до приблизительно 99,9%. В определенных воплощениях сложное соединение меченый ион металла-хелатор-направленный лиганд включает этилендицистеин.
Сигнал может быть обнаружен любым способом, известным специалистам. Неограничивающие примеры таких способов включают PET, PET/CT, CT, SPECT, SPECT/CT, MRI, оптическое изображение и ультразвук. Субъект может быть любым субъектом, таким как млекопитающего или разновидность птиц. В специфических воплощениях млекопитающее является человеком. Участок, который будет изображен, может быть любым участком субъекта и может включать, например, новообразование, сердце, легкое, пищевод, мускул, кишечник, грудь, простату, живот, мочевой пузырь, печень, селезенку, поджелудочную железу, почку, двенадцатиперстную кишку, тонкую кишку, подвздошную кишку, слепую кишку, толстую кишку, прямую кишку, слюнный сальник, желчный пузырь, трахею, гортань, зев, аорту, артерию, вену, вилочковую железу, лимфатический узел, кость, гипофизарный сальник, щитовидную железу, сальник паращитовидной железы, надпочечник, мозг, головной мозг, мозжечок, костный мозг, варолиев мост, спинной мозг, нерв, скелетную мышцу, гладкую мышцу, кость, яички, придаток яичка, простату, семенные пузырьки, пенис, яичник, матку, молочную железу, влагалище, кожу, глаза или глазной нерв. В специфических воплощениях участок, который будет изображен, является новообразованием. В дальнейших специфических воплощениях участок, который будет изображен, является сердцем.
В некоторых воплощениях способ получения изображений далее включает выполнение оцениваемому субъекту одной или более дополнительных диагностических или отображающих процедур. В дальнейших воплощениях способ получения изображений далее определяется как способ выполнения двойного получения изображений и терапии.
В определенных воплощениях заболевание, которое будет лечиться, является сердечно-сосудистым заболеванием. Неограничивающие примеры таких болезней включают инфаркт миокарда, порок клапана сердца, кардиомиопатию, врожденный порок сердца, аритмию, застойную сердечную недостаточность и стенокардию.
Существующее изобретение также относится к способам получения изображений мозга или спинного мозга (нейроэндокринной системы) субъекта, включая назначение субъекту одного или более соединений по настоящему изобретению. В некоторых воплощениях, например, хелат соединен с направленным лигандом, который способен преодолеть гемоэнцефалический барьер субъекта. Неограничивающим примером такого направленного лиганда является аминокислота, такая как тирозин или аналог тирозина, подобный альфа-метил тирозину. Другие примеры включают соматостатин, октреотид и триптофан.
Существующее изобретение также рассматривает способы лечения субъекта с расстройством центральной нервной системы. Расстройство центральной нервной системы может быть, например, нейродегенеративной болезнью, такой как болезнь Паркинсона, болезнью Хантингтона, боковым амиотрофическим склерозом, болезнью Альцгеймера или нейроэндокринным новообразованием. Примеры нейроэндокринных опухолей включают первичные и метастатические новообразования головного мозга. Примеры первичных опухолей головного мозга включают астроцитому, глиобластому, олигодендроглиому, эпендимому, смешанную глиому, смешанные глионейрональные новообразования (новообразования, показывающие как нейрональный, так и глиальный компонент, например ганглиоглиома, дизэмбриопластическое нейроэпиталиальное новообразование) и новообразования, происходящие от нейронных клеток (например, ганглиоцитома, центральная ганглиоцитома). Новообразование может быть метастатическим новообразованием. В некоторых воплощениях расстройство центральной нервной системы является воспалительным заболеванием. Например, заболевание может быть инфекционным заболеванием или иммунным заболеванием.
Настоящее изобретение также рассматривает способ определения чистоты состава, включающего сложные соединения меченый ион металла-хелатор-направленный лиганд неизвестной чистоты, упомянутый способ, включающий:
a) получение первого состава, включающего сложное соединение меченый ион металла-хелатор-направленный лиганд неизвестной чистоты;
b) получение второго состава, включающего сложное соединение меченый ион металла-хелатор-направленный лиганд, полученного любым из способов, описанных здесь;
c) выполнение количественного анализа образца первого состава для выполнения первого измерения;
d) выполнение количественного анализа второго состава для выполнения второго измерения; и
e) вычисление отношения первого измерения ко второму измерению, где отношение первого измерения ко второму измерению является мерой чистоты состава, включающего сложное соединение меченый ион металла-хелатор-направленный лиганд неизвестной чистоты.
Количественный анализ может быть выполнен любым способом, известным специалистам в данной области. В определенных воплощениях количественный анализ выполнен способом, выбранным из группы, состоящей из авторадиографии, диализа, массовой спектроскопии, определения точки плавления, ультрофиолетового исследования, колориметрического анализа, жидкостной хроматографии высокого разрешения, тонкослойной хроматографии и ядерного магнитного резонанса.
Другие аспекты настоящего изобретения рассматривают состав, включающий сложное соединение хелатор-направленный лиганд, где хелатор имеет следующую формулу:

где:
точка соединения между хелатором и направленным лигандом находится в одном или более положениях, выбранных из группы, состоящей из А, В, С, D, Е и F;
A, D, Е и F, каждый независимо является Н, нижним алкилом, -СООН, -NН2 или тиолом с условием, что по крайней мере в одном положении находится -NH2 или тиол;
В и С, каждый независимо являются вторичным амином, третичным амином, -S-, -S(O)- или -S(O)2-;
R1, R2, R3 и R4, каждый независимо являются Н или нижним алкилом; и
Х выбирают из группы, состоящей из -CH2-CH2-, -CH2-CH2-CH2-, -CH2-C(O)-, -С(O)-СН2-, -С(O)-СН2-СН2- и -СН2-СН2-С(O)-;
где по крайней мере одно из А, В, С, D, Е, F или одна функциональная группа направленного лиганда защищена защитной группой, и
где сложное соединение хелатор-направленный лиганд является чистым от приблизительно 75% до приблизительно 99,9%.
Защитная группа может быть любого типа, описанного здесь. Направленный лиганд может быть любого типа, описанного здесь. В определенных воплощениях для состава имеется условие, что когда А и D каждый является -NH2, то ни В, ни С не являются вторичным или третичным амином. Состав может включать сложное соединение хелатор-направленный лиганд, которое является чистым от приблизительно 70% до приблизительно 99,9%. Состав может включать соединение хелатор-направленный лиганд, которое является чистым от приблизительно 80% до приблизительно 99,9%. Состав может включать соединение хелатор-направленный лиганд, которое является чистым от приблизительно 85% до приблизительно 99,9%. Состав может включать соединение хелатор-направленный лиганд, которое является чистым от приблизительно 90% до приблизительно 99,9%. Состав может включать соединение хелатор-направленный лиганд, которое является чистым от приблизительно 95% до приблизительно 99,9%. Состав в определенных воплощениях может быть далее определен как сложное соединение меченый ион металла-хелатор-направленный лиганд, как было обсуждено выше.
Другой аспект настоящего изобретения рассматривает состав, включающий сложное соединение хелатор-направленный лиганд, где хелатор имеет следующую формулу:

где:
точка соединения между хелатором и направленным лигандом находится в одном или более положениях, выбранных из группы, состоящей из А, В, С, D, Е и F;
A, D, Е и F, каждый независимо является Н, нижним алкилом, -СООН, -NH2 или тиолом с условием, что по крайней мере в одном положении находится -NН2 или тиол;
В и С, каждый независимо являются вторичным амином, третичным амином, -S-, -S(O)- или -S(O)2-;
R1, R2, R3 и R4, каждый независимо являются Н или нижним алкилом; и
Х выбран из группы, состоящей из -СН2-СН2-, -СН2-СН2-СН2-, -СН2-С(O)-, -С(O)-СН2-, -С(O)-СН2-СН2- и -СН2-СН2-С(O)-;
где соединение хелатор-направленный лиганд является чистым от приблизительно 75% до приблизительно 99,9%.
Направленный лиганд может быть любого описанного здесь типа. В определенных воплощениях для состава имеется условие, что когда А и D, каждое, являются -NH2, то ни В, ни С не является вторичным или третичным амином. Состав может включать сложное соединение хелатор-направленный лиганд, которое является чистым от приблизительно 70% до приблизительно 99,9%. Состав может включать сложное соединение хелатор-направленный лиганд, которое является чистым от приблизительно 80% до приблизительно 99,9%. Состав может включать сложное соединение хелатор-направленный лиганд, которое является чистым от приблизительно 85% до приблизительно 99,9%. Состав может включать сложное соединение хелатор-направленный лиганд, которое является чистым от приблизительно 90% до приблизительно 99,9%. Состав может включать сложное соединение хелатор-направленный лиганд, который является чистым от приблизительно 95% до приблизительно 99,9%. Состав, в определенных воплощениях, может быть далее определен как сложное соединение меченый ион металла-хелатор-направленный лиганд, как было обсуждено выше. Состав может быть далее определен как99mTс-ЕС-глюкозамин. Состав может быть далее определен как186Re-ЕС-глюкозамин. Состав может быть далее определен как187Re-EC-глюкозамин.
Было рассмотрено, что любое воплощение, обсуждаемое в этой спецификации, может быть осуществлено, используя любой способ, состав или соединение изобретения, и наоборот. Кроме того, соединения и составы изобретения могут быть использованы для выполнения способов изобретения.
Специалист подтвердит, что с помощью химических модификаций могут быть получены составы настоящего изобретения, а также составы, используемые в способе настоящего изобретения, не отступая от настоящего изобретения. Заместители, производные или эквиваленты могут быть также использованы, все из которых рассматриваются как являющиеся частью настоящего изобретения.
Используемый здесь термин "органическая среда" относится к растворам (например, растворы реакции) и способам очистки, включающим один или более органических растворителей (также называемых здесь "растворители"). Выбор растворителя для способов настоящего изобретения известен любому специалисту. Выбор растворителя (растворителей) может зависеть, например, от того, какой (какие) из них облегчит растворение всех реактивов или, например, какой (какие) облегчит желательную реакцию (особенно, если механизм реакции будет известен). Растворители могут включать, например, полярные растворители и неполярные растворители. Выбор растворителей включает, но не ограничен, диметилформамид, диметилсульфоксид, диоксан, метанол, этиловый спирт, гексан, хлорид метилена и ацетонитрил. В некоторых привилегированных воплощениях, растворители включают этиловый спирт, диметилформамид и диоксан. Для любой специфической реакции или процедуры очистки может быть выбран боее чем один растворитель. Вода (то есть водный компанент) может быть также примешан в любой из выбранных растворителей; воду обычно добавляют для облегчения растворимости всех реактивов. В определенных воплощениях органический компонент органической среды по объему является или по крайней мере приблизительно является 20%, 25%, 30%, 35%, 40%, 45%, 50%, 55%, 60%, 65%, 70%, 75%, 80%, 85%, 90%, 95% или 100%-ным органическим растворителем по отношению к водному компоненту.
Понятия "соединение" и "соединенный" определены здесь как химическое соединение в пределах одной и той же молекулы. Например, две или более молекулы и/или атомы могут соединяться вместе через ковалентную связь, формируя отдельную молекулу. Эти две молекулы могут соединяться друг с другом через прямое соединение (например, когда соединения соединены непосредственно через ковалентную связь) или соединения могут соединяться через косвенное соединение (например, когда два соединения ковалентно связаны одним или более линкерами, формируя отдельную молекулу). В других образцах, атом металла может быть присоединен к молекуле посредством хелатообразующего взаимодействия.
Термин "функциональная группа" вообще относится к тому, как специалисты классифицируют химически реактивные группы. Неограничивающие примеры функциональных групп включают углерод-углеродистые связи (включая простую, двойную и тройную связи), гидроксильную (или спирта), аминную, сульфидрила (или тиольную), амидную, эфирную, сложноэфирную, тиоэфирную, тиосложноэфирную, карбоксильной кислоты и карбонильную группу. Используемые здесь термины "амин" и "амино" и другие подобные пары слов, такие как "гидрокси" и "гидроксил", относятся к одной и той же функциональной части и, таким образом, взаимозаменяемы. Используемый здесь термин "амин" может относиться к одному из -NH2 и -NH- или к ним обоим.
Употребляемый здесь термин "хелат" может использоваться как существительное. Как существительное "хелат" относится к одному или более атомам, которые или способны к хелатированию одного или более ионов металла или являются хелатированным с одним или более ионами металла. В привилегированных воплощениях только один ион металла координируется в хелат. Неограничивающий пример "хелата" включает хелат "N2S2": это означает, что два атома азота и два атома серы хелатора являются или а) способными к хелатированию с одним или более ионами металла, или b) координированными (или хелатированными) с одним или более ионов металла (предпочтительно только одним ионом металла). Как глагол, "хелатировать" относится к процессу координирования или хелатирования иона металла в, например, сложное соединение хелатор-направленный лиганд.
Используемый здесь термин "несоединенный хелатор" относится к хелатору, который не соединен с направленным лигандом.
Используемый здесь термин "незащищенный хелатор" относится к хелатору, который не включает никаких защитных групп.
Используемый здесь термин "защищенный хелатор" относится к хелатору, который включает по крайней мере одну защитную группу.
Используемый здесь термин "незащищенный направленный лиганд" относится к направленному лиганду, который не включает никаких защитных групп.
Используемый здесь термин "защищенный направленный лиганд" относится к направленному лиганду, который включает по крайней мере одну защитную группу.
Термин "нуклеофил" или "нуклеофильный" обычно относится к атомам, несущим одну или более неподеленных пар электронов. Такие термины широко известны в технологии и включают -NН2, тиолат, карбанион и алкоголат (также известный как гидро-ксил).
Термин "электрофил" или "электрофильный" обычно относится к разновидностям, которые реагируют с нуклеофилами. Электрофильные группы обычно имеют парциальный положительный заряд. Такой термин хорошо известен специалистам и включает углерод, углеродисто связанный с уходящей группой, такой как галогенной, сульфонильной или четвертичной аминной группой.
Термин "уходящая группа" обычно относится к группам, легко переносимым нуклеофилом, таким как нуклеофил амина, спирта или тиола. Уходящие группы широко известны и включают карбоксилаты, N-гидроксисукцинимид, N-гидроксибензотриазол, галоген (галогениды), трифлаты, тозилаты, мезилаты, алкокси, тиоалкокси, сульфонилы и т.п.
Используемый здесь термин "алкил" или "алк" относится к прямой, разветвленной или циклической углерод-углеродистой или углеводородной цепи, произвольно включающей алкеновую или алкиновую связь, содержащую 1-30 углеродов. "Нижний алкил" относится к алкиловым радикалам, включающим 1-4 углерода. Неограничивающие примеры нижних алкилов включают метил, этил, пропил, бутил и изопропил. "Замещенный алкил" относится к алкиловому радикалу, замещенному по крайней мере одним атомом, известным специалистам. В определенных воплощениях один или более заместителей могут быть выбраны из группы, состоящей из водорода, галогена, оксо (например, эфир), гидрокси, алкокси, силилокси, циклоалкил, ацил, арил, ацетил, карбонил, тиокарбонил, циано, азидо, амидо, аминокарбонил, амино, -NH-алкил, - N(алкил)2, -NH-циклоалкил, -N(циклоалкил)2, -N-арил, -N(арил)2, триалкилсилилокси, ацилокси, ациламино, бис-ациламино, сложный эфир, NO, NO2 и сульфо (например, тиоэфир, тио-сложный эфир, сульфонамидо, сульфонил).
Термин "арил" относится к карбоциклической ароматической группе, включающей примеры, которые не ограничивают группу: фенил, нафтил, инденил, инданил, азуленил, флуоренил и антраценил; или к гетероциклической ароматической группе, включающей, но не ограниченной примерами: фурил, фуранил, тиэнил, пиридил, пирролил, оксазолил, тиазолил, имидазолил, пиразолил, пиразолинил, пиразолидинил, изоксазолил, изотиазолил, оксадиазолил, триазолил, тиадиазолил, пиридазинил, пиримидинил, пиразинил, триазинил, тритианил, индолизинил, индолил, изоиндолил, индолинил, тиофенил, индазолил, бензимидазолил, бензтиазолил, пуринил, хинолизинил, хинолинил, изохинолинил, иннолинил, фталазинил, хиназолинил, хиноксалинил, нафтиридинил, птеридинила карбазолил, акридинил, феназинил, фенотиазонил, феноксазинил и любая комбинация или производное одной или более этих групп.
"Арильные" группы, как было определено в этом заявлении, могут независимо содержать одну или более функциональных групп в качестве заместителей. В определенных воплощениях заместители могут быть выбраны из группы, состоящей из водорода, алкила, галогена, оксо (например, эфира), гидрокси, алкокси, силилокси, циклоалкила, ацила, арила, ацетила, карбонила, тиокарбонила, циано, амидо, аминокарбонила, аминопласта, -NH-алкил, -N(алкил)2, -NH-циклоалкил, -N(пиклоалкил)2, -NH-арил, -N(арил)2, триалкилсилилокси, ацилокси, ациламино, бис-ациламино, сложного эфира, NO, NO2 и сульфо (например, тиоэфира, тиосложного эфира, сульфонамидо, сульфонила). В дальнейшем любой из этих заместителей может быть далее замещен заместителями, как было только что описано.
Используемый здесь термин "циклоалкил" относится к углеродным циклам или гетероциклам трех или больше атомов, кольцевые атомы которых могут быть произвольно замещены С, S, О или N и кольцевые атомы которых могут включать одну или более функциональных групп в качестве заместителей. Заместители могут быть выбраны в некоторых воплощениях из группы, состоящей из водорода, алкила, галогена, оксо (например, эфир), гидрокси, алкокси, силилокси, циклоалкила, ацила, арила, ацетила, карбонила, тиокарбонила, циано, азидо, амидо, аминокарбонила, амино, -NH-алкил, -N(алкил)2, -NH-циклоалкил, -N(циклоалкил)2, -NH-арил, -N(арил)2, триалкилсилилокси, ацилокси, ациламино, бис-ацилатто, сложного эфира, NO, NO2 и сульфо (например, тиоэфира, тиосложного эфира, сульфонамидо, сульфонила).
Термин "аминокислота" относится к любой из аминокислот естественного происхождения, а также синтетических аналогов (например, D-стереоизомеры аминокислот естественного происхождения, такие как D-треонин) и их производных. α-Аминокислоты включают атом углерода, с которым связаны аминогруппа, карбоксильная группа, атом водорода и отличительная группа, называемая "боковая цепь". Аминокислоты, включающие дополнительную метиленовую группу в основе, часто называют β - аминокислотами. Боковые цепи аминокислот естественного происхождения хорошо известны специалистам и включают, например, водород (например, как в глицине), алкил (например, как в аланине, валине, лейцине, изолейцине, пролине), замещенный алкил (например, как в треонине, серине, метионине, цистеине, аспарагиновой кислоте, аспарагине, глутаминовой кислоте, глутамине, аргинине и лизине), арилалкил (например, как в фенилаланине и триптофане), замещенный арилалкил (например, как в тирозине) и гетероарилалкил (например, как в гистидине). Искусственные аминокислоты также известны специалистам, они описываются, например, в Williams (1989); Evans и др. (1990); Pu и др. (1991); Williams и др. (1991); и все ссылки берутся оттуда. Существующее изобретение включает также боковые цепи искусственных аминокислот.
Термины "первичный амин," "вторичный амин" и "третичный амин" относятся к аминам, как производным аммиака (NH3), в котором онин (первичный), два (вторичный) или три (третичный) водорода были замещены углеродом, где упомянутый углерод может быть присоединен к любому другому атому. В определенных воплощениях, упомянутый углерод (С) содержится в элементе Х формулы, показанной выше, углеводородная группа (например, -СН2-), -CH(E)(CHAR1R2), -СН(F)(СНОR3R4) или - С(O)- группа, где A, D, Е, F, X, R1, R2, R3 и R4 определены здесь.
Соединения, описанные здесь, могут содержать один или более асимметричных центров и таким образом могут встречаться как рацематы и рацемические смеси, отдельные энантиомеры, диастереомерные смеси и индивидуальные диастереомеры. Все возможные стереоизомеры всех соединений, описанных здесь, если не сказано иначе, рассматриваются находящимися в рамках настоящего изобретения. Хиральные центры соединений настоящего изобретения могут иметь S-или R-конфигурацию, как определено в соответствии с Рекомендациями 1974 года Международного союза по теоретической и прикладной химии(IUРАС). Настоящее изобретение предназначено учесть все подобные изомерные формы сложных соединений изобретения.
Настоящее изобретение также охватывает соли любого из синтезируемых сложных соединений изобретения. Термин "соль (и)", используемый здесь, понимается как являющийся кислой и/или основной солью, полученной с неорганическими и/или органическими кислотами и основаниями. Цвиттереоны (внутренние соли) понимаются как включенные в пределы термина "соль (и)" и так же используются здесь как соли аммония четвертичные, например, соли алкиламмония. Предпочтительны нетоксичные, фармацевтически приемлемые соли, хотя другие соли также могут быть полезными, это касается примера при описании шагов очистки или выделения.
Неограничивающие примеры солей с введением кислоты включают ацетат, адипат, альгинат, аспартат, бензоат, бензенесульфонат, бисульфат, бутират, соль лимонной кислоты, камфорат, камфорсульфонат, циклопентанепропионат, диглюконат, додецилсульфат, этанесульфонат, фумарат, глюкогептаноат, глицерофосфат, гемисульфат, гептоноат, гексаноат, гидрохлорид, гидробромид, гидройодид, 2-гидроксиэтанесульфонат, лактат, малеат, метанесульфонат, 2-нафталенесульфонат, никотинат, оксалат, пектинат, персульфат, 3-фенилпропионат, пикрат, пивалат, пропионат, сакцинат, тартрат, тиоцианат, тозилат и ундеканоат.
Неограничивающие примеры основных солей включают соли аммония; щелочные металлические соли, такие как натрия, лития и соли калия; соли щелочноземельного металла, такого как кальция и соли магния; соли, включающие органические основания, такие как амины (например, дициклогексиламин, алкиламины, такие как t-бутиламин и t-амиламин, замещенные алкиламины, арил-алкиламины, такие как бензиламин, диалкиламины, замещенные диалкиламины, такие как N-метил глукамин (особенно N-метил D-глукамин), триалкиламины и замещенный триалкиламины); и соли, включающие аминокислоты, такие как аргинин, лизин и т.д. Основные азотсодержащие группы могут быть кватернизированы с агентами, такими как нижнего алкила галогениды (например, метил, этил, пропил и хлориды бутила, бромиды и йодиды), диалкил сульфаты (например, этан, диэтил, дибутил и сульфаты диамила), галогениды с длинной цепью (например, децил, лаурил, хлориды миртистила и стеарила, бромиды и йодиды), галогениды арилалкила (например, бромиды бензила и фенетила) и другие, известные специалистам.
Использование слова "включающий" в формулах и/или спецификации может означать "один", но также может означать "один или более", "по крайней мере один" и "один или более одного."
В тексте настоящей заявки термин "приблизительно" используется, чтобы указать, что значение включает погрешность, присущую любому устройству, способу, используемым для определения значения или изменения, которое происходит с исследуемым субъектом. Например, "приблизительно" может быть в пределах 10%, предпочтительно в пределах 5%, более предпочтительно в пределах 1% и наиболее предпочтительно в пределах 0,5%.
Использование термина "или" в формулах означает "и/или", если явно не сказано только "или", альтернативы взаимно исключаются, хотя раскрытие поддерживает определение, которое обращается к только альтернативам и "и/или".
Используемые термины "включающий" (и любые формы включать, такие как "включают" и "включает"), "имеющий" (и любые формы иметь, такие как "имеют" и "имеет") или "содержащий" (и любые формы содержать, такие как "содержит" и "содержат") являются содержащими или открытыми и не исключают дополнительные, нераскрытые элементы или шаги способа.
Другие объекты, особенности и преимущества настоящего изобретения станут очевидными из следующего детализированного описания. Однако должно быть понято, что детализированное описание и определенные примеры, указывая предпочтительные воплощения изобретения, даются только в качестве иллюстрации, так как различные изменения и модификации в духе и в пределах охвата изобретения станут очевидными специалистам из этого детализированного описания.
Следующие рисунки являются частью настоящей спецификации и включены в нее для дальнейшей демонстрации определенных аспектов настоящего изобретения. Изобретение может быть лучше понято со ссылками на один или более чертежей в комбинации с детализированным описанием определенных воплощений, представленных здесь.
Фиг.1. Неограничивающий пример органического синтеза этилендицистеин-глюкозамина (EC-G).
Фиг.2. Неограничивающий пример органического синтеза рений-этилендицистеин-глюкозамина(Rе-ЕС-О).
Фиг.3. Исследование внедрения [3H]тимидина, используя Re-EC-G и клеточную линию лимфомы.
Фиг.4. Сравнение клеточной восприимчивости EC-G в неочищенном виде или очищенном преп-HPLC (высокоэффективной жидкостной хроматографией) виде.
Фиг.5. Массовая спектрометрия EC-G.
Фиг.6. Радио-TLC (тонкослойная хроматография)68Ga-EC-G.
(a)68Ga-EC-G, синтезируемого органическими средствами;
(b)68Ga-EC-G, синтезируемого водными средствами;
(с)свободного68Ga.
Фиг.7. Аналитика радио-HPLC68Ga-EC-G.
(a) УФ обнаружение;
(b) NaI(сцинтилляционный кристалл) обнаружение.
Фиг.8А и Фиг.8В. Стабильность68Ga-EC-G в сыворотке собаки, показанная с помощью радио-TLC.
8А-(а)68Ga-EC-G (0.7 мг/0.7 мл, рН 7.5, 865 мкКи);
8A-(b) 100 мкл68Ga-EC-G в 100 мкл сыворотки собаки, время = 0;
8А-(с) время = 30 мин;
8В-(а) время = 60 мин;
8В-(b) время = 120 мин;
8В-(с)68Ga-EC-BSA.
Фиг.9. Стабильность68Ga-EC-G в сыворотке собаки, полученная в анализе связывания белка.
Фиг.10. Исследование восприимчивости In vitro меченых68Ga соединений в клеточной линии рака молочной железы 13762.
Фиг.11. Плоские изображения производной99mTc-EC-ESMOLOL (300 мкКи/крыса) у крыс-носителей рака молочной железы. H/UM = сердце/верхнее средостение коэффициенты плотности импульсов (импульс/пиксель) за 15-45 минут.
Фиг.12. PET изображение68Ga-EC-ТМЛ в новозеландском белом кролике. Фиг.13. Неограничивающий пример органического синтеза этилендицистеин-глюкозамина (EC-G).
Изобретатели идентифицировали новые синтетические способы для получения сложного соединения хелатор-направленный лиганд, произвольно хелатированым одним или более ионами металла. Существующее изобретение далее описывает синтез хелаторов, таких как несоединенные хелаторы, защищенные хелаторы (то есть хелаторы, где одна, или более функциональные группы защищены с помощью защитного агента) и соединений меченый ионом металла хелатор (то есть хелаторов, которые являются хелатированными с одним или более ионами металла). Эти синтетические способы включают обычно использование органических растворителей, синтетические органические технологические процессы и способы очистки. Также обеспечиваются способы, основанные на влажной (водной) химии. Сложные соединения настоящего изобретения, являющиеся результатом таких способов органической химии, являются высокой степени чистоты, особенно по сравнению с составами, полученными с помощью влажной химии. Предпочтительным хелатором является этилендицистеин. Направленный лиганд может быть, например, тканенаправленной частицей, диагностической частицей или терапевтической частицей. Ионы металла, хелатированные в сложные соединения настоящего изобретения, могут далее отдать сложное соединение, используемое для получения изображений, в диагностических или терапевтических целях. Сложные соединения настоящего изобретения, способы их синтеза и их дальнейшее использование описаны ниже.
А. Хелаторы
Специалисты знакомы с соединениями, способными к хелатированию одного или более ионов металла ("хелаторы"). Хелаторы, используемые в способе настоящего изобретения, обычно включают один или более атомов, способных к хелатированию с одним или более ионами металла. Предпочтительны хелаторы, включающие три или четыре атома, способные к хелатированию. Как правило, хелатор хелатирует один ион металла.
Хелатирование иона металла с хелатором может быть осуществлено любым способом, известным специалистам. Способы хелатирования (также называемые координированием) описаны более подробно ниже. Атомы, доступные для хелатирования, известны специалистам, и обычно включают О, N или S. В предпочтительных воплощениях, атомы, доступные для хелатирования, выбирают из группы, состоящей из N и S. В определенных предпочтительных воплощениях, ион металла хелатируется в группу атомов, упомянутых здесь как "хелаты", выбранные из NS2, N2S, S4, N2S2, N3S и NS3. Также может быть произведено хелатирование как хелатором, так и направленным лигандом, то есть оба и хелатор, и направленный лиганд могут отдавать атомы, которые хелатируют один и тот же ион металла.
В определенных воплощениях хелатор включает сложные соединения, включающие одну или более аминокислот. Аминокислоты обычно выбирают из группы, состоящей из цистеина и глицина. Например, хелатор может включать три цистеина и один глицин или три глицина и один цистеин. Как обсуждено ниже, спейсер может соединить одну аминокислоту с другой.
Специалистам известно, что хелаторы обычно включают разновидность функциональных групп. Неограничивающие примеры таких функциональных групп включают гидрокси, тиол, амин, амидо и карбоксильную кислоту.
1. Бис-аминоэтантиол (ВАТ) дикарбоновые кислоты.
Бис-аминоэтантиол (ВАТ) дикарбоновые кислоты могут составить хелатор, используемый в способе настоящего изобретения. В привилегированных воплощениях, ВАТ дикарбоновая кислота являетсмя этилендицистеином (ЕС). ВАТ дикарбоновые кислоты могут действовать как лиганды тетрадентата и также хорошо известны как сложные соединения диаминодитиола (DADT). Известно, что такие соединения формируют устойчивый Тс(V)O-комплексы на основе эффективной связи группы оксотехнеция с двумя атомами тиол-серы и двумя атомами амин-азота. Меченый99mTc диэтилсложный эфир (99mTc-L,L-ECD) известен как агент головного мозга.99mТс-L,L-этилендицистеин (99mTc-L,L-EC) является его наиболее полярным метаболитом и был открыт быстро и эффективно выделенным в моче. Таким образом,99mTc-L,L-EC использовалось как агент почечной функции. (Verburggen и др. 1992). Другие металлы, такие как индий, рений, галлий, медь, гольмий, платина, гадолиний, лютеций, иттрий, кобальт, кальций и мышьяк, могут также быть хелатированы в ВАТ дикарбоновые кислоты, такие как этилендицистеин (ЕС).
2. Спейсеры Хелаторы настоящего изобретения могут включать один или более спейсеров. Например, аминокислоты и их производные могут быть соединены одним или более спейсеров. Пример двух аминокислот, соединенных спейсером, включает этилендицистеин, описанный выше. Такие спейсеры известны специалистам в данной области. Эти спейсеры обычно обеспечивают дополнительную гибкость всему соединению, которая может облегчить хелатирование одного или более ионов металла хелатором. Неограничивающие примеры спейсеров включают алкильные группы любой длины, такие как этилен (-СН2-СН2-), эфирные связи, тиоэфирные связи, аминные связи и любая комбинация одной или более этих групп. Предполагается, что составные хелаторы (то есть два или более), соединенные вместе, являются способными к формованию общей молекулы, которая может хелатировать один или более, обычно два или более ионы металла. Таким образом, каждый хелатор, который составляет общую молекулу, может хелатировать единственный отдельный ион металла.
В. Защитная группа
Когда химическая реакция должна быть выполнена выборочно на одном активном участке многофункционального соединения, часто другие активные участки должны быть временно блокированы. Используемая здесь "защитная группа" определяется как группа, используемая с целью этой временной блокировки. Таким образом, функция защитной группы состоит в том, что она защищает одну или более функциональные группы (например, -NH2, -SH, -СООН) в течение последующих реакций, которые не прошли бы хорошо, если бы свободная (другими словами, незащищенная) функциональная группа вступила в реакцию и была использована, что является несогласованным с потребностью быть свободной для последующих реакций, или свободная функциональная группа вмешалась бы в реакцию. Специалисты признают, что использование защитной группы обычно для синтетической органической химии.
В течение синтеза соединений настоящего изобретения различные функциональные группы должны быть защищены, используя защитные агенты в различных стадиях синтеза. "Защитные агенты" используются для установления защитной группы. Таким образом, в обычной процедуре, защитный агент примешивают к соединениям, имеющим функциональную группу, которая должна быть защищена, и защитный агент формирует ковалентную связь с этой функциональной группой. Таким образом, функциональная группа "защищена" защитной группой (и эффективно сделана нереактивной) с помощью ковалентной связи, которая сформировалась с защитным агентом. Многочисленные функциональные группы могут быть защищены на одном или более шагах, используя должным образом выбранные защитные агенты. Специалистам известно, что такой выбор часто основан на изменяющейся активности защищаемых функциональных групп: более активные группы (такие, как сера/тиол) обычно защищаются до защиты менее активных групп (таких, как амин).
Есть множество известных специалистам способов для достижения этого шага. Информацию о защитных агентах, их активности, установке и использовании можно смотреть, например, у Green и Wuts (1999), полностью включенного ссылкой. Та же самая группа защиты может использоваться для защиты одной или более той же самой или различных функциональной(ных) группы. Неограничивающие примеры установки защитной группы описаны ниже.
Использование фразы "защищенная гидрокси" или "защищенный амин" и т.п. не означает, что каждая такая функциональная группа, способная быть защищенной, защищена. Точно так же используя термин "защищенный хелатор", мы не подразумеваем, что каждая функциональная группа хелатора защищена.
Сложные соединения настоящего изобретения, включая сложные соединения, используемые и сделанные в течение практики способа настоящего изобретения, рассматриваются и в защищенной, и в незащищенной (или "свободной") форме. Специалистам будет понятно, что функциональные группы, необходимые для желательной трансформации должны быть незащищенными.
Когда защитная группа больше не нужна, она удаляется способами, известными специалистам. Информацию о снимающих защиту агентах и их использовании можно увидеть у, например, Green и Wuts (1999). Агенты, используемые для удаления защитной группы, обычно называются снимающими защиту агентами. Защитные группы обычно являются легко удаляемыми (как известно специалистам) способами, использующими снимающие защиту агенты, которые являются известными специалистам. Например, защитные группы сложный эфир ацетата и карбамата могут быть легко удалены, используя слабо кислые или щелочные условия, хотя защитные группы бензила и сложный эфир бензоила нуждаются в намного более сильных кислых или щелочных условиях. Известно, что определенные снимающие защиту агенты удаляют некоторые защитные группы, но не все, в то время как другие снимающие защиту агенты удаляют несколько типов защитных групп от нескольких типов функциональных групп. Например, реакции восстановления по Берчу, использующие жидкий аммиак и натрий (как описано ниже), снимают защиту группы бензила от тиолов (или серы, более подробно) или группы карбамата от азота, но не ацетатные группы от кислорода. Таким образом, первый снимающий защиту агент может использоваться, чтобы удалить один тип защитной группы, следующим используется второй снимающий защиту агент, чтобы удалить второй тип защитной группы, и так далее.
Специалисты знакомы с необходимостью удаления защитной группы, используя снимающие защиту агенты. См. Green и Wuts (1999). Неограничивающие примеры снимающих защиту групп обсуждены ниже.
Защитные группы амина известны специалистам. См., например, Green и Wuts (1999), глава 7. Эти защитные группы могут быть установлены с помощью защитных агентов, известных специалистам. Удаление этих групп также известно специалистам.
В некоторых воплощениях защитная группа амина может быть выбрана из группы, в которую входят: t-бутоксикарбонил, бензилоксикарбонил, формил, тритил, ацетил, трихлорацетил, дихлорацетил, хлорацетил, трифтороацетил, дифтороацетил, фтороаце-тил, хлорформат бензила, 4-фенилбензилоксикарбонил, 2-метилбензилоксикарбонил, 4-этоксибензилоксикарбонил, 4-фторобензилоксикарбонил, 4-хлорбензилоксикарбонил, 3-хлорбензилоксикарбонил,2-хлорбензилоксикарбонил,2,4-дихлорбензилоксикарбонил, 4-бромбензилоксикарбонил, 3-бромбензилоксикарбонил, 4-нитробензилоксикарбонил, 4-цианобензилоксикарбонил, 2-(4-ксенил)изопропоксикарбонил, 1,1-дифенилэт-1-илоксисарбонил, 1,1-дифенилпроп-1-илоксисарбонил, 2-фенилпроп-2-илоксисарбонил, 2-(р-толуил)проп-2-илоксисарбонил, циклопентанилоксисарбонил, 1-метилциклопентанилоксисарбонил, циклогексанилоксисарбонил, 1-метилциклогексанилоксисарбонил,2-метилциклогексанилоксисарбонил, 2-(4-толуилсулфонил)этоксикарбонил, 2-(метилсульфонил) этоксикарбонил, 2-(трифенилфосфино)этоксикарбонил, флуоренилметоксикарбонил, 2-(триметилсилил)этоксикарбонил, аллилоксикарбонил, 1-(триметилсилилметил)проп-1-энилоксикарбонил, 5-бензисоксалилметоксикарбонил, 4-ацетоксибензилоксисарбонил, 2,2,2-трихлорэтоксикарбонил, 2-этинил-2-пропоксикарбонил,циклопропилметоксикар-бонил, 4-(децилоксил)бензилоксикарбонил, изобомилилоксикарбонил, 1-пиперидилоксикарбонил и 9-флуоренилметил карбонат.
В некоторых воплощениях защитный агент для защиты амина выбирают из группы, включающей бензилхлорформат, p-нитро-хлорбензилформат, этилхлорформат, ди-терт-бутил-дикарбонат, трифенилметила хлорид и метокси трифенилметила хлорид. В привилегированном воплощении защитная группа является бензилхлоркарбонилом, установленным с помощью защитного агента бензилоксихлорформат.
Защитные группы тиола известны специалистам. См., например, Green и Wuts (1999), глава 6. Эти защитные группы могут быть установлены с помощью защитных агентов, известных специалистам. Удаление этих групп также известно специалистам.
В некоторых воплощениях защитная группа тиола может быть выбрана из группы, включающей ацетамидометил, бензамидометил, 1-этоксиэтил, бензоил, трифенил-метил, t-бутил, бензил, адамантил, цианоэтил, ацетил и трифтороацетил.
В некоторых воплощениях защитный агент для защиты тиола выбирают из группы, состоящей из: алкил галогенида, бензил галогенида, бензоил галогенида, сульфонил галогенида, трифенилметил галогенида, метокситрифенилметил галогенида и цистеина. Неограничивающие примеры таких защитных агентов включают этил галогениды, пропил галогениды и ацетил галогениды. Галогениды могут включать хлор, бром или йод, например. В привилегированном воплощении защитная группа является бензилом, установленным с помощью защитного агента бензил хлорида.
Защитные группы гидрокси (или спирта) известны специалистам. См., например, Green и Wuts (1999), глава 2. Эти защитные группы могут быть установлены с помощью защитных агентов, известных специалистам. Удаление этих групп также хорошо известно специалистам.
Подходящая защитная группа гидрокси может быть выбрана из группы, состоящей из сложных эфиров или эфиров. Сложные эфиры, такие как ацетат, бензоил, третбутилкарбонил и трифтороацетил группы, могут быть удалены с помощью кислых или щелочных условий. Эфиры, такие как метокси, этокси и трибензилметил могут быть удалены с помощью более сильных кислых или щелочных условий. Предпочтительной защитной группой является ацетат сложного эфира.
Защитные группы карбонила известны специалистам. См., например, Green и Wuts (1999), глава 4. Такие защитные группы могут защитить, например, кетоны, или альдегиды, или карбонил, присутствующий в сложных эфирах, амидах и т.п. Эти защитные группы могут быть установлены с помощью защитных агентов, известных специалистам. Удаление этих групп также хорошо известно специалистам.
В некоторых воплощениях защитная группа карбонила может быть выбрана из группы, включающей диметилацетал, диметилкетал, диизопропилацетал, диизопропилкетал, енамины и енолэфиры.
Защитные группы карбоксильной кислоты известны специалистам. См., например, Green и Wuts (1999), глава 5. Удаление этих групп также хорошо известно специалистам.
Подходящая защитная группа карбоксильной кислоты может быть выбрана из группы, состоящей из амидов или эфиров, например. Амиды, такие как сульфонамид, пара-нитроанилин, бензиламид и бензоламид, могут быть гидролизованы в кислых условиях. Сложные эфиры, такие как сложный эфир метила, сложный эфир этила и сложный эфир бензила, могут быть гидролизированы при помощи кислых или щелочных условий. Предпочтительной защитной группой является амид.
С. Ионы металла
Как было сформулировано выше, определенные воплощения настоящего изобретения обращаются к составам, которые будут хелатировать один или более ионов металла. Направленные лиганды настоящего изобретения могут также участвовать в хелатировании одного или более ионов металла. Термин "ион металла", используемый здесь, относится к иону металла, который способен к формированию связи, такой как нековалентная связь, с одним или более атомами или молекулами. Другой атом(ы) или молекула(ы) могут быть отрицательно заряжены.
Любой ион металла, известный специалистам, рассмотривается возможным для включения в сложные соединения настоящего изобретения. Специалисты знакомы с ионами металла и их применением. В некоторых воплощениях, ион металла может быть выбран из группы, включающей Тс-99 т, Сu-60, Сu-61, Сu-62, Сu-67, In-111, Tl-201, Ga-67, Ga-68, As-72, Re-186, Re-187, Re-188, Ho-166, Y-90, Sm-153, Sr-89, Gd-157, Bi-212, Bi-213, Fe-56, Mn-55, Lu-177, ион железа, ион мышьяка, ион селена, ион таллия, ион марганца, ион кобальта, ион платины, ион рения, ион кальция и ион родия. Например, ион металла может быть радионуклидом. Радионуклид является изотопом искусственного или естественного происхождения, который показывает радиоактивность. В некоторых воплощениях радионуклид выбирают из группы, включающей99mТе,188Re,186Re,153Sm,166Но,90Y,89Sr,67Ga,68Ga,111In,148Gd,55Fe,225Ac,212Bi,211At,45Ti,60Cu,61Cu,67Cu и64Cu. В предпочтительных воплощениях ион металла - это рений или радионуклид, такой как99mТе,188Re или68Ga. Как описывается ниже, один из радионуклидов, такой как99mТе, возможно должен сопровождать восстановитель (восстанавливающий агент). Неограничивающие примеры восстановителей включают ион дитионита, ион, содержащий двухвалентное олово, и ион железа.
Для получения лучших характеристик изображений и снижения цены были сделаны попытки заменить меченые соединения123I,131I,67Ga и111In соответствующими мечеными соединениями99mТе, когда это возможно. Из-за благоприятных физических характеристик, а также чрезвычайно низкой цены ($0.21/мКи) был предпочтен99mТе для мечения радиоактивных медицинских препаратов.
Множество факторов должно быть рассмотрено для получения оптимального радиоизображения для человека. Чтобы максимизировать эффективность обнаружения, предпочтителен ион металла, который испускает гамма-энергию в диапазоне от 100 до 200 кэВ. "Гамма- излучатель" здесь определен как агент, который испускает гамма- энергию любого диапазона. Специалисты знакомы с различными ионами металла, которые являются гамма излучателями. Чтобы минимизировать поглощенную пациентом дозу облучения, физический период полураспада радионуклида должен быть таким же коротким, насколько позволит процедура получения изображений. Чтобы позволять выполнять экспертизы в любой день и в любое время дня, необходимо иметь источник радионуклида, всегда доступного на клиническом участке.99mТе является предпочтительным радионуклидом, потому что он испускает гамма-излучение 140 кэВ, имеет физический период полураспада 6 часов и является легко доступным при использовании генератора молибден-99/технеций-99m. Специалисты знакомы со способами определения получения оптимального радиоизображения для человека.
В определенных специфических воплощениях настоящего изобретения ионом металла является терапевтический ион металла. Например, в некоторых воплощениях, ионом металла является терапевтический радионуклид, который является излучателем бета-частиц. Здесь было определено, что излучателем бета-частиц является любой агент, который испускает бета-энергию любого диапазона. Примерами излучателей бета-частиц являются Re-188, Re-187, Re-186, Ho-166, Y-90, Bi-212, Bi-213 и Sn-153. Бета-излучатели могут также быть, а могут не быть гамма-излучателями. Специалисты знакомы с использованием бета-излучателей при лечении гиперпролиферативного заболевания, такого как рак.
В дальнейших воплощениях составов настоящего изобретения ионом металла является терапевтический ион металла, который не является излучателем бета- или гамма-частиц. Например, терапевтический ион металла может быть платиной, кобальтом, медью, мышьяком, селеном, кальцием или таллием. Соединения, включающие эти терапевтические ионы металла, могут быть применены в способах, направленных на лечение заболеваний, таких как гиперпролиферативные заболевания, сердечно-сосудистые заболевания, инфекции и воспаления. Примерами гиперпролиферативных заболеваний являются раковые образования. Способы выполнения двойной химиотерапии и лучевой терапии, которые включают соединения настоящего изобретения, описаны подробно ниже.
D. Направленные лиганды
"Направленный лиганд" определен здесь как молекула или часть молекулы, которая связана со специфичностью с другой молекулой. Специалистам знакомы многочисленные агенты, которые могут использоваться как направленные лиганды в контексте настоящего изобретения.
Примеры направленных лигандов включают направленные соединения заболевания клеточного цикла, направленные лиганды ангиогенезиса, направленные лиганды апоптоза опухоли, направленные лиганды заболевания рецептора, маркеры экспрессии гена, направленные лиганды на основе лекарственного препарата, антибактериальные препараты, направленные лиганды гипоксии новообразования, антисмысловые молекулы, агент, имитирующий глюкозу, амифостин, ангиостатин, направленные лиганды рецептора EGF, капецитабин, ингибиторы СОХ-2, деоксицитидин, фуллерен, герцептин, альбумин человечески сыворотки, лактоза, лютеинизирующий гормон, пиридоксал, хи-назолин, талидомид, трансферрин и триметил лизин. В дальнейших воплощениях настоящего изобретения, направленным лигандом является антитело.
Любое антитело в контексте настоящего изобретения рассматривается как направленный лиганд. Например, антитело может быть моноклональным антителом. Специалисты знакомы с моноклональными антителами, способами изготовления моноклональных антител и способами использования моноклональных антител в качестве направленных лигандов. В определенных воплощениях настоящего изобретения моноклональным антителом является антитело, направленное против маркера новообразования. В некоторых воплощениях моноклональное антитело - это моноклональное антитело С225, моноклональное антитело CD31 или моноклональное антитело CD40.
Отдельный направленный лиганд или более чем один направленный лиганд могут быть соединены с хелатором настоящего изобретения. В этих воплощениях любое число направленных лигандов может быть соединено с хелаторами, описанными здесь. В определенных воплощениях, сложное соединение по настоящему изобретению может включать единственный направленный лиганд. В других воплощениях, сложное соединение может включать только два направленных лиганда. В дальнейших воплощениях, направленный лиганд может включать три или более направленных лиганда. В любой ситуации, где сложное соединение включает два или более направленных лиганда, направленные лиганды могут быть одинаковыми или различными.
Направленные лиганды могут быть связаными с хелатором любым образом, включая, например, ковалентную связь, ионную связь и водородную связь. Например, направленный лиганд может быть связан с хелатором амидной связью, сложноэфирной связью или углерод-углеродистой связью любой длины. Если два или более направленных лиганда связаны с хелатором, способы связывания могут быть одинаковыми или различными. В других воплощениях связь включает линкер. Неограничивающими примерами таких линкеров являются пептиды, глутаминовая кислота, аспарагиновая кислота, бром этилацетат, диамин этилена, лизин и любая комбинация одной или более этих групп. Специалисты знакомы с химией этих агентов и способами конъюгирования этих агентов как лигандов с хелаторами заявленного изобретения. Способы синтезирования сложных соединений настоящего изобретения, включая способы соединения, подробно обсуждены ниже.
Информация, имеющая отношение к направленным лигандам и конъюгации со сложными соединениями, находится в американском патенте 6692724, американской патентной заявке серийный No 09/599, 152, американской патентной заявке серийный No 10/627, 763, американской патентной заявке серийный No 10/672, 142, американской патентной заявке серийный No 10/703, 405 и американской патентной заявке серийный No 10/732, 919, каждая из которых полностью включена в ссылки для этого раздела спецификации и всех других разделов спецификации.
В некоторых воплощениях составов настоящего изобретения направленным лигандом является тканеспецифический лиганд, соединенный с хелатором. "Тканеспецифический лиганд" определен здесь как молекула или часть молекулы, которая может быть связана или присоединена к одной или более тканям. Связывание может быть посредством любого механизма связывания, известного специалистам. Примеры включают терапевтические агенты, антиметаболиты, апоптические агенты, биоредуктивные агенты, терапевтические агенты трансдукции сигнала, агенты реактивного рецептора или специфические агенты клеточного цикла. Ткань может быть тканью любого типа, такой как клетка. Например, клетка может быть клеткой субъекта, такой как раковая клетка. В определенных воплощениях тканенаправленный лиганд является тканенаправленной последовательностью аминокислоты, которая соединена с хелатором, являющимся способным к связи с ионом металла. Примеры направленных лигандов обсуждены ниже.
1. Лекарственные средства
В некоторых воплощениях сложных соединений настоящего изобретения направленным лигандом является лекарственный препарат или "терапевтический лиганд", который определен здесь как любой терапевтический агент. "Терапевтический агент" или "лекарственный препарат" определен здесь для включения любого состава или вещества, которое может быть назначено субъекту, или входить в контакт с клеткой или тканью с целью лечения заболевания или расстройства, или предотвращения заболевания или расстройства, а также лечения или предотвращения изменения или разрушения нормального физиологического процесса. Например, терапевтический лиганд может быть антираковой частицей, такой как химиотерапевтический агент. В определенных воплощениях настоящего изобретения терапевтический лиганд является терапевтической последовательностью аминокислоты, которая соединена с терапевтической последовательностью аминокислоты. Подобные соединения обсуждены далее в других частях этой спецификации.
а. Химиотерапевтические агенты
Примеры антираковых лигандов включают любые химиотерапевтические агенты, известные специалистам. Примеры таких химиотерапевтических агентов включают, но не ограничены, цисплатин (CDDP), карбоплатин, прокарбазин, мехлоретамин, циклофосфамид, камптотецин, ифосфамид, мелфалан, хлорамбуцил, бусульфан, нитросуреаза, дактиномецин, даунорубицин, доксорубицин, блеомицин, пликомицин, митомицин, этопосид (VP 16), тамоксифен, ралоксифен, агенты связи рецептора эстрогена, таксол, гемцитабин, навелбин, ингибиторы трансферазы фарнезил-белка, трансплатина, 5 фторурацил, винкристин, винбластин и метотрексат или любой аналог или производный вариант перечисленного. В определенных специфических воплощениях антираковым лигандом является метотрексат.
Широкая разновидность химиотерапевтических агентов может использоваться в соответствии с существующим изобретением. Термин "химиотерапия" относится к использованию лекарственных средств для лечения рака. Термин "химиотерапевтический агент" используется для обозначения соединения или состава, который назначен при лечении рака. Эти агенты или лекарственные средства категоризированы их способом активности внутри клетки, например, на какой стадии клеточного цикла они действуют. Альтернативно, агент может быть характеризован, основываясь на его способности непосредственно поперечно связывать ДНК, вставляться в ДНК или вызывать хромосомные и митотические аберрации, воздействуя на синтез нуклеиновой кислоты. Большинство химиотерапевтических агентов попадают в следующие категории: алкилирующие агенты, антиметаболиты, противоопухолевые антибиотики, митотические ингибиторы и нитрозомочевины.
Примеры химиотерапевтических агентов включают алкилирующие агентов, таких как тиотепа и циклосфосфамид; алкилсульфонаты, такие как бусульфан, импросульфан и пипосульфан; азиридины, такие как бензодопа, карбоквон, метуредопа и уредопа; этиленимины и метиламеламины, включая алтретамин, триэтиленмеламин, триэтиленфосфорамид, триэтиленэтиофосфорамид и триметилоломеламин; ацетогенины (особенно буллатацин и буллатацинон); камптотецин (включая синтетический аналог топотекан); бриостатин; каллистатин; СС-1065 (включая его адозелезина, карзелезина и бизелезина синтетические аналоги); криптофицины (особенно криптофицин 1 и криптофицин 8); доластатин; дуокармицин (включая синтетические аналоги KW-2189 и СВ1-ТМ1); элеутеробин; панкратистатин; саркодиктиин; спонжистатин; мустарды азота, такие как хлорамбуцил, хлорнафазин, холофосфамид, эстрамустин, ифостамид, мехлорэтамин, гидрохлорид оксида мехлорэтамина, мелфалан, новембихин, фенестерин, преднимустин, трофосфамид, мустард урацила; нитрозомочевины, такие как кармустин, хлорзотоцин, фотемустин, ломустин, нимустин и ранимнустин; антибиотики, такие как ендииновые антибиотики (например, каличеамицин, особенно каличеамицин гаммаl1 и каличеамицин омегаl1; динемицин, включая динемицин А); бисфосфонаты, такие как клодронат; эсперамицин; а также хромофор неокарзиностатин и хромофоры антиобиотика связанного хромопротеина ендиин, аклациномизины, актиномицин, аутрамицин, азасерин, блеомицины, кактиномицин, карабицин, карминомицин, карцинофилин, хромомицины, дактиномицин, даунорубицин, деторубицин, 6-диазо-5-оксо-L-норлеуцин, доксорубицин (включая морфолинодоксорубицин, цианоморфолино-доксорубицин, 2-пирролинодоксорубицин и деоксидоксорубицин), эпирубицин, эзорубицин, идарубицин, марцелломициницин, митомицины, такие как митомицин С, микофенольная кислота, ногаларницин, оливомицин, пепломицин, потфиромицин, пуромицин, квеламицин, родорубицин, стрептонигрин, стрептозоцин, туберцидин, убенимекс, зиностатин, зорубицин; антиметаболиты, такие как метотрексата и 5 фторурацил (5-FU); аналоги фолиевой кислоты, такие как деноптерин, метотрексата, птероптерин, триметрексат; аналоги пурина, такие как флударабин, 6-меркаптопурин, тиамиприн, тиогуанин; аналоги пиримидина, такие как анцитабин, азацитидин, 6-азауридин, кармофур, цитарабин, дидеоксиуридин, доксифлюридин, эноцитабин, флоксуридин; андрогены, такие как калустерон, пропионат дромостанолона, эпитиостанол, мепитиостан, тестолактон; антиадреналы, такие как аминоглютетимид, митотан, трилостан; наполнитель фолиевой кислоты, такой как фролиновая кислот; ацеглатон; гликозид альдофосфамида; аминолевулиновая кислота; энилурацил; амсакрин; бестрабуцил; бизантрен; эдатраксат; дефофамин; демеколцин; диазиквон; элформитин; эллиптиниума ацетат; эпотилон; этоглюцид; нитрат галлия; гидроксиурия; лентинан; лонидаинин; майтанзиноиды, такие как майтанзин и ансамитоцины; митогуазон; митоксантрон; мопиданмол; нитраэрин; пентостатин; фенамет; пирарубицин; лозоксантрон; кислота подофиллиновая; 2-этилгидразид; прокарбазин; (комплексное соединение полисахарида) PSK; разоксан; ризоксин; сизофиран; спирогерманиум; кислота тенуазоновая; триазиквон; 2,2',2''-трихлоротриэтиламин; трихотецины (особенно токсин Т-2, веррацурин А, роридин А и ангуидин); уретан; виндезин; дакарбазин; манномустин; митобронитол; митолактол; пипоброман; гацитозин; ара-бинозид (Ага-С); циклофосфамид; тиотепа; таксоиды, например паклитаксел и доксетаксел; хлорамбуцил; гемцитабин; 6-тиогуанин; меркаптопурин; метотрексат; комплексы платиновой координации, такие как цисплатин, оксалиплатин и карбоплатин; винбластин; платина; этопосид (VP-16); ифостамид; митоксантрон; винкристин; винорелбин; новантрон; тенипосид; эдатрексат; дауномицин; аминопептерин; кселода; ибандронат; иринотекан (например, СРТ-11); ингибитор топоизомеразы RFS 2000; дифторометилорнитин (DMFO); ретиноиды, такие как ретиноевая кислота; капецитабин; и фармацевтически приемлемые соли, кислоты или производные любого из вышеупомянутых соединений.
Также включены в это определение антигормональные агенты, которые действуют, чтобы регулировать или замедлять действие гормонов на опухоли, такие как антиэстрогены и селективные модуляторы рецепторов эстрогенных (SERM), включая, например, тамоксифен, ралоксифен, дролоксифен, 4-гидрокситамоксифен, триоксифен, кеоксифен, ЛY117018, онапристон и торемифен; ингибиторы ароматазы, которые ингибируют фермент ароматазы, который регулирует производство эстрогена в надпочечниках, такие как, например, 4(5)-имидазолы, аминоглютетимид, мегестрола ацетат, эксеместан, форместан, фадрозол, ворозол, летрозол и анастрозол; и антиандрогены, такие как флутамид, нилутамид, бикалутамид, лейпрозолид и госерелин; а также троксаситабин (аналог 1,3-диоксолан нуклеозид цитозин); антисмысловые олигонуклеотиды, особенно те, которые ингибируют экспрессию генов в сигнализирующих путях, вовлеченных в пролиферацию клетки, такие как РКС-альфа, Ralfn H-Ras; рибозимы, такие как ингибитор экспрессии VEGF и ингибитор экспрессии HER2; вакцины, такие как вакцины генотерапии и фармацевтически приемлемые соли, кислоты или производные любого из вышеупомянутых.
Дополнительные примеры противораковых агентов включают лекарственные средства, перечисленные в Таблице 1, которые выбираются для химиотерапии рака:
ТАБЛИЦА 1
Лекарственные средства для химиотерапии рака.
Таблицы содержат список лекарственных средств, используемых для лечения рака в США и Канаде, и их основные неблагоприятные эффекты. Список лекарственных средств основан на мнениях Медицинских писменных консультантов. Некоторые лекарственные средства перечислены для указания, так как они не были одобрены американским Управлением по санитарному надзору за качеством пищевых продуктов и медикаментов. Противораковые лекарственные средства и их неблагоприятные эффекты следуют ниже. В целях настоящего изобретения эти списки приведены для образца и не являются исчерпывающими.
Лекарственные средства
Мегастрол и другие гормональные агенты могут быть эффективны для некоторых пациентов, потерпевших неудачу с тамоксифеном.3 После высокой дозы химиотерапии (Medical Letter, 34:79, 1982).
Термин "сердечно-сосудистые лекарственные препараты" относится к любому терапевтическому агенту, который может быть использован при лечении или предотвращении заболеваний сердца и/или кровеносных сосудов.
В определенных воплощениях сердечно-сосудистым препаратом является агент, который понижает концентрацию одного из более липидов крови и/или липопротеинов, известный здесь как "антигиперлипопротеинемический", который может быть использован при лечении атеросклероза и загустевания или закупорок сосудистых тканей. Примеры включают производную арилоксиалканоидной/фибриевой кислоты, сиквестерант камеди/желчной кислоты, ингибитор HMG СоА-редуктазы, производную никотиновой кислоты, гормон щитовидной железы или аналог гормона щитовидной железы, различные агены или комбинация перечисленных. Неограничивающими примерами производных арилоксиалканоидной/фибриевой кислоты являются беклобрат, энзафибрат, бинифибрат, ципрофибрат, клинофибрат, клофибрат (атромид-S), клофибриевая кислота, этофибрат, фенофибрат, гемфиброзил (лобид), никофибрат, пирифибрат, ронифибрат, симфибрат и теофибрат. Неограничивающие примеры сиквестеранта камеди/желчной кислоты включают холестирамин (холибар, квестран), колестипол (колестид) и полидексид. Неограничивающие примеры ингибитора HMG СоА-редуктазы включают ловастатин (мевакор), правастстин (правохол) или симвастатин (зокор). Неограничивающие примеры производной никотиновой кислоты включают никотинат, ацепимокс, ницеритрол, никоклонат, никомол и оксиниациновую кислоту. Неограничивающие примеры гормонов щитовидной железы и их аналогов включают этороксат, тиропропиевую кислоту и тироксин. Неограничивающие примеры различныз антигиперлипопротеинемических (антисклеротических лекарственных средств) включают ацифран, азакостерол, бенфлуорекс, бетабензалбутирамид, карнитин, хондроитин сульфат, кломестрон, детакстран, декстран сульфата натрия, 5,8,11,14,17-эйкозапентаэноидная кислота, эритаденин, фуразабол, меглутол, мелинамид, митатриэнедиол, орнитин, гамма-оризанол, пантетин, пентаэритритол тетраацетат, альфа-фенилбутарамид, пирозадил, пробукол (лорелсо), бета-ситостерол, сультокремниевая кислота-пиперазина соль, тиаденол, трипаранол и ксенбуцин.
Неограничивающие примеры антиартериосклеротических лекарственных средств включают пиридинол карбамат.
В определенных воплощениях сердечно-сосудистый препарат является агентом, который способствует удалению или предотвращению сгустков крови. Неограничивающие примеры антитромбических и/или фибринолитических агентов включают антикоагулянты, антагонисты антикоагулянтов, антитромбоцетарные агенты, тромболитические агенты, антагонисты тромболитических агентов или их комбинации. Примеры антитромбических агентов включают аспирин и вафарин (коумадин). Примеры антикоагулянтов включают аценокоумарол, анкрод, анисиндион, броминдион, клориндион, коуметарол, циклокумарол, натрия сульфат декстран, дикумарол, дифенадион, этил бискоумацетат, этилиден дикоумарол, флуиндион, гепарин, гиридин, лиаполат натрия, оксазидон, пентозан полисульфат, фениндион, фенпрокоумон, фосвитин, пикотамид, тиокломарол и варфарин. Неограничивающие примеры антитромбоцетарных агентов включают аспирин, декстран, дипиридамол (перзантин), гепарин, сульфинпиранон (антиран) и тиклопидин (тиклид). Неограничивающие примеры тромболитических агентов включают тканевый активатор пламиногена (активаза), плазмин, проурокиназа, урокиназа (аббокиназа) стрептокиназа (стрептаза), антистреплаза/APSAC (эминаза).
В некоторых воплощениях сердечнососудистым препаратом является коагулянт крови. Неограничивающие примеры агентов, поддерживающих свертывание крови, включают антагонисты тромболитического агента и антагонисты антикоагулянта. Неограничивающие примеры антагонистов антикоагулянта включают протамин и витамин К1.
Неограничивающие примеры антагонистов тромболитического агента включают аминокапроидную кислоту (амикар) и транексамовую кислоту (амстат). Неограничивающие примеры антитромботиков включают анагрелид, аргатробан, цилстазол, далтробан, дефибротид, эноксапарин, фраксипарин, индобуфен, ламопаран, озагрел, пикотамид, плафибрид, теделпарин, тиклопидин и трифлузал.
Сердечно-сосудистый препарат может быть антиаритмическим агентом. Неограничивающие примеры антиаритмических агентов включают Класс I антиаритмических агентов (блокаторы натриевых каналов). Класс II антиаритмических агентов (бета-адренергические блокаторы). Класс III антиаритмических агентов (лекарственные средства, замедляющие реполяризацию). Класс IV антиаритмические агенты (блокаторы кальциевых каналов) и разные антиаритмические агенты. Неограничивающие примеры блокаторов натриевых каналов включают Класс IA, Класс IB и Класс IC антиаритмических агентов. Неограничивающие примеры Класса IA антиаритмических агентов включают дизопирамид (норпейс), прокаинамид (пронестил) и хинидин (квинидекс). Неограничивающие примеры антиаритмических агентов Класса IB включают лидокаин (ксилокаин), токаинид (тонокард) и мексилетин (мекситил). Неограничивающие примеры антиаритмических агентов Класса IC включают энкаинид (энкаид) и флекаинид (тамбокор). Неограничивающие примеры бета-блокатора, иначе известного как бета-адренергический блокатор, бета-адренергический антагонист или антиаритмический агент Класса II, включают ацебутол (сектрал), алпренолол, амосулалол, аротинолол, ате-нолол, бефунолол, бетаксолол, бевантолол, бисопролол, бопиндолол, букумолол, буфетолол, буфуралол, бунитролол, бупранолол, бутидрина гидрохлорид, бутофилолол, каразолол, картеолол, карведилол, целипролол, цетамолол, клоранолол, дилевалол, эпанолол, эсмолол (бревиблок), инденолол, лабеталол, левобунолол, мепиндолол, метрипранолол, метопролол, мопролол, надолол, надоксолол, нифеналол, нипрадилол, окспренолол, пенбутолол, пиндолол, практолол, пронеталол, пропанолол (индерал), коталол (бетапас), сульфиналол, талинолол, тетратолол, тимолол, толипролол и ксибинолол. В определенных аспектах бета-блокатор включает производную арилоксипропаноламина. Неограничивающие примеры производных арилоксипропаноламина включают ацебутолол, алпренолол, аротинолол, атенолол, бетаксолол, бевантолол, бизопролол, бопиндолол, бунитролол, бутофилолол, каразолол, картеолол, карведилол, целипролол, цетамолол, эпанолол, инденолол, мепиндолол, метипранолол, метролол, мопролол, надолол, нипрадилол, окспренолол, пенбутолол, пиндолол, пропанолол, талинолол, тетратолол, тимолол и толипролол. Неограничивающие примеры агента, продлевающего реполяризацию, также известного как Класс III антиаритмических агентов, включают амиодарон (кордарон) и соталол (бетапас). Неограничивающие примеры блокатора кальциевого канала, иначе известного как Класс IV антиаритмических агентов, включают арилалкиламин (например, бепридиле, дилтиазем, фендилин, галлопамил, прениламин, теродилин, верапамил), производная дигидропиридина (фелопидин, исрадипин, никардипин, нифедипин, нимодипин, нисолдипин, нитрендипин) производная пиперазинда (например, циннаризин, флюнаризин, лидофлазин) или различные блокаторы кальциевого канала, такие как бенциклан, этафенон, магний, мибефрадил или пергексилин. В определенных воплощениях блокатор кальциевого канала включает антагонист кальция дигидропиридин длительного действия (типнифедипин). Неограничивающие примеры разных антиаритмических агентов включают аденозин (аденокард), дигоксин (ланоксин), ацекаинид, аймалин, амопроксан, априндин, бретилия тозилат, бунафтин, бутобендин, капобеновая кислота, цифенлин, дизопиранид, гидроквинидин, индекаинид, ипатропиума бромид, лидокаин, лораймин, лоркаинид, меобентин, морицизин, пирменол, праймалин, пропафенон, пиринолин, хинидина полигалактуронат, хинидин сульфат и виквидил.
Другие примеры сердечно-сосудистых лекарственных средств включают противогипертонические агенты. Неограничивающие примеры противогипертонических агентов включают симпатолитическое средство, альфа/бета-блокаторы, альфа-блокаторы, агенты антиангиотензина II, бета-блокаторы, блокаторы кальциевого канала, вазодилятаторы и различные антигипертенсивные средства. Неограничивающие примеры альфа-блокатора, также известного как альфа-адренергический блокатор или альфа-адренергический антагонист, включают амосулалол, аротинолол, дапипразол, доксазолин, мезилаты эрголоида, фенсипирид, индорамин, лабеталол, ницерголин, празосин, теразосин, толазолин, тримазосин и иохимбин. В определенных воплощениях альфа-блокатор может включать производную хиназолина. Неограничивающие примеры производных хиназолина включают альфузосин, буназосин, доксазосин, празосин, теразосин и тримазосин. В определенных воплощениях противогипертонический агент является и альфа и бета адренергическим антагонистом. Неограничивающие примеры альфа/бета-блокатора включают лабеталол (нормодин, трандат). Неограничивающие примеры агентов анти-ангиотензина II включают ингибиторы ангиотензин-превращенного фермента и антагонисты рецептора ангиотензина II. Неограничивающие примеры ингибиторов ангиотензин-превращенного фермента (ингибиторы АСЕ) включают алацеприл, эналаприл (васотек), каптоприл, цилазаприл, делаприл, эналаприлат, фосиноприл, лизиноприл, мовелтоприл, периндоприл, квинаприл и рамиприл. Неограничивающие примеры блокаторов рецептора ангиотензина II, также известных как антагонисты рецептора ангиотензина II, блокаторы рецептора ANG или блокаторы рецептора 1 типа ANG-II (ARBS), включают ангиокандесартан, эпросартан, ирбесартан, лосартан и валсартан. Неограничивающие примеры симпатолитических средств включают симпатолитические средства центрального действия или симпатолитические средства периферического действия. Неограничивающие примеры симпатолитические средства центрального действия, также известных как симпатолитические средства центральной нервной системы (CNS), включают клонидин (катапрес), гуанабенз (витензин), гуанфацин (тенекс) и метилдопа (алдомет). Неограничивающие примеры симпатолитических средств периферического действия включают блокирующий агент ганглия, блокирующий агент адренергического нейрона, бета-адренергический блокирующий агент или альфа 1-адренергический блокирующий агент. Неограничивающие примеры блокирующего агента ганглия включают мекамиламин (инверсии) и триметафан (арфонад). Неограничивающие примеры блокирующего агента адренергического нейрона включают гуанетидин (исмелин) и ресерпин (серпасил). Неограничивающие примеры бета-адренергического блокирующего агента включают аценитолол (сектрал), атенолол (тенормин), бетаксолол (керлон), картеолол (картрол), лабеталол (нормодин, трандат), метопролол (лопрессор), наданол (коргард), пенбуталол (леватол), пиндолол (вискен), про-пранолол (индерал) и тимолол (блокадрен). Неограничивающие примеры альфа 1-адренергического блокирующего агента включают празосин (минипресс), доксазоцин (кардура) и теразосин (гитрин). В определенных воплощениях сердечнососудистый терапевтический агент может включать вазодилятатор (например, мозговой вазодилятатор, коронарный вазодилятатор или периферийный вазодилятатор). В определенных привилегированных воплощениях, вазодилятатор включает коронарный вазодилятатор. Неограничивающие примеры коронарного вазодилятатора включают амотрифен, бендазол, бенфуродила гемисукцинат, бензиодарон, хлоракцизин, хромонар, кловенфурол, клонитрат, дилазеп, дипиридамол, дропрениламин, эфлоксат, эритритила тетранитран, этафенон, фендилин, флоредил, ганглефен, герестрол бис(бета-диэтиламиноэтила эфир), гексобендин, итрамина тозилат, келлин, лидофламин, маннита гексанитран, медибазин, никорглицерин, пентаэритритола тетранитрат, пентринитрол, пергексилин, пимефиллин, трапидил, трикромил, триметазидин, тролнитрата фосфат и виснадин. В определенных аспектах вазодилятатор может включать вазодилятатор хронической терапии или вазодилятатор критической гипертензии. Неограничивающие примеры вазодилятаторов хронической терапии включают гидралазин (апресолин) и миноксидил (лонитен). Неограничивающие примеры вазодилятатора критической гипертензии включают нитропруссид (ниприд), диазоксид (гиперстат IV), гидралазин (апресолин), миноксидил (лонитен) и верапамил.
Неограничивающие примеры различных противогипертонических средств включают аймалин, гамма-аминомасляную кислоту, буфениод, циклетаинин, циклосидомин, криптенамина таннат, фенолдопам, флозеквинан, кетансерин, мебутамат, мекамиламин, метилдопа, метил- 4-пиридил кетон тиосемикарбазон, музолимин, паргилин, пемпидин, пинацидил, пипероксан, примаперон, протовератрин, раубазин, ресциметол, римениден, сараласин, натрия нитрооксид, тикринафен, триметафана камсилат, тиросиназу и ура-пидил.
В определенных аспектах, противогипертоническое средство может включать производную арилэтаноламина, производную бензотиадиазина, производную N-карбоксиалкила (пептид/лактам), производную дигидропиридина, производную гуанидина, гидразины/фталазин, производную имидазола, соединение четвертичного аммония, производная ресеприна или производная сульфонамида. Неограничивающие примеры производных арилэтаноламина включают амосулалол, буфуралол, дилевалол, лабеталол, пронеталол, соталол и сульфиналол. Неограничивающие примеры производных бензотиадиазина включают алтизид, бендрофлуметиазид, бензтиазид, бензилгидрохлоротиазид, бутиазид, хлоротиазид, хлорталидон, циклопентиазид, циклотиазид, диазоксид, эпитиазид, этиазид, фенквизон, гидрохлоротизид, гидрофлуметизид, метиклотиазид, метикран, метолазон, парафлутизид, политизид, тетрахлорметиазид и трихлорметиазид. Неограничивающие примеры производных N-карбоксиалкила (пептид/лактам) включают алацеприл, каптоприл, цилазаприл, делаприл, эналаприл, эналаприлат, фосиноприл, лисиноприл, мовелтиприл, периндоприл. Неограничивающие примеры производных дигидропиридина включают амлодипин, фелодипин, исрадипин, никардипин, нифедипин, нилвадипин, нисолдипин и нитрендипин. Неограничивающие примеры производных гуанидина включают бетанидин, дебрисоквин, гуанабенз, гунаклин, гуанадрел, гуаназодин, гуанетидин, гуанфацин, гуанохлор, гуаноксабенз и гуаноксан. Неограничивающие примеры гидразин/фталазины включают будралазин, кадралазин, дигидралазин, эндралазин, гидракарбазин, гидралазин, фенипразин, пилдалазин и тодралазин. Неограничивающие примеры производных имидазола включают клонидин, лофексидин, фентоламин, тиаменидин и толонидин. Неограничивающие примеры соединений четвертичного аммония включают азаметониум бромид, хлорисондамин хлорид, гексаметониум, пентациния бис(метилсульфат), пентаметония бромид, пентолиния тартрат, фенактропиния хлорид и триметидиния метосульфат. Неограничивающие примеры производных резерпина включают биэтазерпин, дезерпедин, ресциннамин, резерпин и сиросингопин. Неограничивающие примеры производных сульфонамида включают амбусид, клопамид, фуросемид, индапамид, квинетазон, трипамид и ксипамид.
Другие примеры сердечно-сосудистых лекарственных средств включают сосудосуживающие средства. Сосудосуживающие средства обычно используются, чтобы увеличить кровяное давление во время шока, который может произойти в течение хирургической процедуры. Неограничивающие примеры сосудосуживающих средств, также известных как антигипотензивные средства, включают амезиния метилсульфат, амид ангиотензин, диметофрин, допамин, этифелмин, этилефрин, гепефрин, метараминол, мидодрин, норепинефрин, фоледрин и синефрин.
Другие примеры сердечно-сосудистых лекарственных средств включают агенты, которые могут быть использованы при лечении или предотвращении застойной сердечной недостаточности. Неограничивающие примеры агентов для лечения застойной сердечной недостаточности включают агенты антиангиотензина II, лечение снижением нагрузок мышцы при сокращении/предварительных нагрузок, мочегонные средства и инотропные агенты. Примеры агентов снижения нагрузок мышцы при сокращении/предварительных нагрузок включают гидралазин (апрезолин) и изосорбита динитрат (изордил, сорбитрат). Неограничивающие примеры мочегонных средств включают тиазид или производную бензотиадиазина (например, алтиазид, бендрофлуметазид, бензтиазид, бензилгидрохлоротиазид, бутиазид, хлоротиазид, хлорталидон, циклопентиазид, эпитиазид, этиазид, фенквизон, гидрохлоротиазид, гидрофлуметиазид, метиклотиазид, метикран, метолазон, парафлутизид, политизид, тетрахлорометиазид, трихлорметиазид), органортутные препараты (например, хлормеродрин, мераллурид, меркамфамид, меркаптомерин натрия, меркумаллиловая кислота, меркуматилин натрия, хлорид ртути, мерсалил), птеридин (например, фуртерен, триамтерен), пурины (например, ацефиллин, 7-морфолинометилтеофиллин, памобром, протеобромин, теобромин), стероиды, включая антагонисты альдостерона (например, канренон, олеандрин, спиронолактон), производные сульфонамида (например, ацетозоламид, амбусид, азосемид, буметамид, бутазоламид, хлораминофенамид, клофенамид, клопамид, клорексалон, дифенилметан-4,4'-дисульфонамид, дисульфамид, этоксзоламид, фуросемид, индапамид, мефрусид, метазоламид, пиретанид, квинетазон, торасемид, трипамид, ксипамид), урацил (например, аминометрадин, амисометрадин), антагонист калий-удаляющий (например, амило-рид, триамтерен) или различные мочегонные средства, такие как аминозин, арбутин, хлоразанил, этакриновая кислота, этозолин, гидрокарбазин, изосорбид, маннитол, метохалкон, музолимин, перхексилин, тикринафен и мочевина. Неограничивающие примеры положительного инотропного агента, также известного как кардиотоник, включают ацефиллин, ацетилдигитоксин, 2-амино-4-пиколин, амринон, бенфуродил гемисакцинат, букладесин, керберосин, камфотамид, конваллатоксин, цимарин, денопамин, деслано-сид, дигиталин, наперстянка, дигитоксин, дигоксин, добутамин, допамин, допексамин, эноксимон, эритрофлеин, феналкомин, гиталин, гитоксин, гликоциамин, гептаминол, гидрастинин, ибопамин, ланатосид, метамиван, милринон, нерифолин, олеандрин, уабаин, оксифедрин, преналтерол, просцилларидин, резибуфогенин, сцилларен, сцилларенин, стрефантин, сулмазол, теобромин и ксамотерол. В специфических аспектах intropic агентом является сердечный гликозид, бета-адренергический агонист или ингибитор фосфодиэстеразы. Неограничивающие примеры сердечного гликозида включают дигоксин (ланоксин) и дигитоксин (кристодигин). Неограничивающие примеры бета-адренергического агониста включают албутерол, бамбутерол, битолтерол, карбутерол, кленбутерол, клорпреналин, денопарамин, диокситедрин, добутамин (добутрекс), допамин (интропин), допексамин, эфедрин, этафедрин, этилнорепинефрин, фенотерол, фор-мотерол, гексопреналин, ибопамин, изоэтарин, изопротеренол, мабутерол, метапротеренол, метоксифенамин, оксифедрин, пирбутерол, прокатерол, протокилол, репротерол, римитерол, ритодрин, сотеренол, тербуталин, третоквинол, тулобутерол и ксамотерол. Неограничивающие примеры ингибитора фосфодиэстеразы включают ампринон (инокор). Противоангинные агенты могут включать органонитраты, блокаторы кальциевого канала, бета-блокаторы и их комбинации. Неограничивающие примеры органонитратов, также известных как нитровазодилаторы, включают нитроглицерин (нитро-бид, нитро-стат), изосорбида динитрат (изордил, сорбитрат) и нитрат амила (аспирол, вапорол).
2. Направленные соединения заболевания клеточного цикла
К направленным соединениям заболевания клеточного цикла относятся соединения, которые имеют целью агентов, регулируемых в пролиферирующих клетках. Соединения, используемые с этой целью, могут помочь измерить различные параметры в клетках, такие как содержание ДНК клетки новообразования.
Многие из этих агентов являются аналогами нуклеозида. Например, нуклеозид пиримидина (2'-фторо-2'-деокси-5-йодо-1-бета-D-арабинофураносилурацил [FIAU], 2'-фторо-2'-деокси-5-йодо-1-бета-D-рибофураносил-урацил [FIRU], 2'-фторо-2'-5-метил-1-бета-В-арабинофураносилурацил [FMAU], 2'-фторо-2'-деокси-5-йодовинил-1-бета-D-рибофураносилурацил [IVFRU ]) и ациклогуаносин: 9-[(2-гидрокси-1-(гидроксиметил) этокси)метил]гуанин (GCV) и 9-[4-гидрокси-3-(гидроксиметил)бутил]гуанин (PCV) (Tjuvaev и др., 2002; Gambhir и др., 1998; Gambhir и др., 1999) и другой18F-меченый аналоги ациклогуаносина, такие как 8-фторо-9-[(2-гидрокси-1-(гидроксиметил)этокси) метил]гуанин (FGCV) (Gambhir и др., 1999; Namavari и др., 2000), 8-фторо-9-[4-гидрокси-3-(гидроксиметил)бутил]гуанин (FPCV) (Gambhir и др., 2000; lyer и др., 2001), 9-[3-фторо-1-гидрокси-2-пропокси метил]гуанин (FHPG) (Alauddin и др., 1996; Alauddin и др., 1999), и 9-[4-фторо-3-(гидроксиметил)бутил]гуанин (FHBG) (Alauddin и Conti, 1998; Yaghoubi и др., 2001) были разработаны как субстраты репортера для получения изображений дикого типа и мутантов (Gambhir и др., 2000) экспрессии HSVl-тк. Специалисты знакомы с этими и другими агентами, которые используются для направления на заболевания клеточного цикла.
3. Ангиогенезис направленных лигандов
Термин ангиогенезис направленных лигандов относится к агентам, которые могут связываться с неоваскуляризацией или реваскуляризацией ткани. Например, неоваскуляризацией клеток новообразования или реваскуляризацией ткани миокарда. Агенты, которые используются с этой целью, известны специалистам для использования при выполнении различных измерений, включая измерение размера сосудистого слоя новообразования и измерение объема новообразования. Некоторые из этих агентов связываются со стенкой сосуда. Специалисты знакомы с агентами, которые являются доступными для использования с этой целью.
В этой заявке термин "направленный ангиогенезис" относится к использованию агента для связи с неоваскулярной тканью. Некоторые примеры агентов, которые используются с этой целью, известны специалистам для использования при выполнении различных измерений новообразования, включая измерение размера сосудистого слоя новообразования и измерение объема новообразования. Некоторые из этих агентов связываются со стенкой сосуда. Специалисты знакомы с агентами, которые являются доступными для использования с этой целью. Направленный лиганд ангиогенезиса новообразования является лигандом, который используется с целью направленного ангиогенезиса новообразования, как было определено выше. Примеры направленных лигандов ангиогенезиса включают ингибитор СОХ-2, лиганды рецептора анти-EGF, герцептин, ангиостатин, С225 и талидомид. Ингибиторы СОХ-2 включают, например, целекоксиб, рофекоксиб, эторикоксиб и аналоги этих агентов.
4. Направленные лиганды апоптоза новообразования.
Термин "нацеливание на апоптоз новообразования" относится к использованию агента для связи с клеткой, которая подвергается апоптозу или риску подвержения апоптозу. Эти агенты обычно используются для обеспечения индикатора степени или риска апоптоза или запрограммированной смерти клетки в популяции клеток, таких как новообразование и сердечная ткань. Специалисты знакомы с агентами, которые используются с этой целью. "Направленный лиганд апоптоза новообразования" является лигандом, который является способным к выполнению "нацеливания на апоптоз новообразования", как определено в этом параграфе. Направленный лиганд настоящего изобретения может включать моноклональное антитело TRAIL (лиганд, индуцирующий TNF-связанный апоптоз). TRAIL является членом семьи лигандов фактора некроза новообразования, который быстро вызывает апоптоз в разновидности линий трансформированных клеток. Направленный лиганд настоящего изобретения может также включать основание каспазы-3, такое как пептид или хелатор, который включает 4 аминокислотные последовательности глутаминовая кислота-аспарагиновая кислота-валин-аспарагиновая кислота, основание каспазы-3 (например, пептид или хелатор, который включает аминокислотную последовательность аспарагиновая кислота-глутаминовая кислота-валин-аспарагиновая кислота), и любой член семьи Всl. Примеры членов семьи Всl включают, например, Вах, Bcl-xL, Bid, Bad, Bak и Bcl-2. Специалисты знакомы с семьей Всl и их соответствующими основаниями.
Супрессоры апоптоза являются целью открытия препарата с идеей аннулировать их цитозащитные функции и восстановить чувствительность апоптоза к клеткам новообразования (Reed, 2003).
5. Направленные лиганды рецептора заболевания
В "направленном рецепторе заболевания" определенные агенты используются в связи с их способностью связываться с определенными клеточными рецепторами, которые сверхвыражены в состоянии заболевания, такого как рак, неврологические болезни и сердечно-сосудистые заболевания. Примеры таких рецепторов, которые являются нацеленными, включают рецепторы эстрогена, рецепторы андрогена, гипофизарные рецепторы, рецепторы трансферрина и рецепторы прогестерона. Примеры агентов, которые могут быть применены в наведении рецептора заболевания, включают андроген, эстроген, соматостатин, прогестерон, трансферрин, лютеинизирующий гормон и антитело лютеинизирующего гормона.
Меченные радиоактивным изотопом лиганды, такие как пентетреотид, октреотид, трансферрин и гипофизарного пептида, связываются с рецепторами клетки, некоторые из которых сверхвыражены на определенных клетках. Так как эти лиганды не являются вызывающими иммунитет и являются быстро очищаемыми от плазмы, получение изображения рецептора кажется более многообещающим по сравнению с получением изображения антитела.
Рецептор фолата включен здесь как другой пример рецептора болезни. Рецепторы фолата (FR) являются подверженными чрезмерному воздействию на многих относящихся к новообразованию типах клетки (например, легкого, груди, яичников, цервикальных, кишечника, носоглотки, аденокарциномы почки, злокачественной меланоме и эпендимомы), но первоначально выражали только несколько нормальных дифференцированных тканей (например, сосудистая оболочка, плацента, щитовидная железа и почка) (Weitman и др., 1992а; Campbell и др., 1991; Weitman и др., 1992b; Holm и др., 1994; Ross и др., 1994; Franklin и др., 1994; Weitman и др., 1994). FR использовались, чтобы доставить токсины фолатконъюгированного белка, препарат/антисмысловые олигонуклеотиды и липосомы в клетки новообразования, сверхвыражающие рецепторы фолата (Ginobbi и др., 1997; Leamon и Low, 1991; Leamon и Low, 1992; Leamon и др., 1993; Lee and Low, 1994). Кроме того, вторичные специфические антитела, которые содержат антитела анти-FR, связанные с антителами клеточного рецептора анти-Т, использовались, чтобы нацеливать Т клетки на FR-положительные клетки новообразования, и находятся в настоящее время в клинических испытаниях относительно карциномы яичников (Canevari и др., 1993; Bolhuis и др., 1992; Patrick и др/, 1997; Coney и др., 1994; Кranz и др., 1995).
Примеры направленных лигандов рецептора фолата включают фолиевую кислоту и аналоги фолиевой кислоты. Предпочтительные направленные лиганды рецептора фолата включают фолат, метотрексат и томудекс. Фолиевая кислота так же как антифолаты, такие как метотрексат, заходит в клетки благодаря рецепторам фолата высокого сродства (гликосульфосфатидилинозитол-соединенный мембранный фолат-связанный белок) в дополнение к классической системе с переносчиком фолат-ослабленным (WesterhoiH др., 1991; Orr и др., 1995; Hsueh и Donnick, 1993).
6. Маркеры сердечной ишемии
В некоторых воплощениях направленный лиганд является маркером сердечной ишемии. Маркер сердечной ишемии является лигандом, который является относительно селективным для ишемической сердечной ткани. Неограничивающие примеры маркеров сердечной ишемии включают интерлейкин-6, фактор альфа некроза новообразования, матричную металлопротеиназу 9, миэлопероксидазу, межклеточные и сосудистые молекулы адгезии, растворимый лиганд CD40, фактор роста плаценты, высокой чувствительности С-реактивный белок (hs-CRP), модифицированный альбумин ишемии (IMA), свободные жирные кислоты и холин.
7. Маркеры жизнеспособности сердечной ткани
В некоторых воплощениях, направленный лиганд является маркером жизнеспособности сердечной ткани. Маркер жизнеспособности сердечной ткани относится к лиганду, который является соответственно выбранным жизнеспособной сердечной тканью в отличие от нежизнеспособной сердечной ткани. Неограничивающие примеры маркеров жизнеспособности сердечной ткани включают маркеры, выбранные из группы, состоящей из фосфолипазы С, фосфатазы легких цепей миозина, окиси азота, простациклина, эндотелина, тромбоксана, Л-аргинина и Л-цитрулина.
8. Маркеры застойной сердечной недостаточности
В некоторых воплощениях направленный лиганд является маркером застойной сердечной недостаточности. Маркер застойной сердечной недостаточности - это лиганд, который является соответственно выбранным сердечной тканью сердца при застойной сердечной недостаточности по сравнению с нормальной здоровой сердечной тканью. Неограничивающие примеры маркеров застойной сердечной недостаточности включают маркеры, выбранные из группы, состоящей из интерлейкина-1, кардиотрофина-1, инсулин-подобного фактора роста, эпидермального фактора роста, рецептора киназы тирозина и ангиотензина II.
9. Маркеры отдыха/нагрузки (rest/stress) сердечной ткани
В некоторых воплощениях направленный лиганд является маркером отдыха/нагрузки (rest/stress) сердечной ткани. Маркер отдыха/нагрузки (rest/stress) сердечной ткани - это направленный лиганд, который является соответственно выбранным сердечной тканью, которая подвергнута напряжению, в отличие от неподвергнутой напряжению (в покое) сердечной ткани, или наоборот. Неограничивающие примеры маркеров отдыха/нагрузки (rest/stress) сердечной ткани включают выбранные из группы, состоящей из митоген-активируемых протеиновых киназ, циклического аденозинового монофосфата, фосфолипазы С, фосфатидилинозитол бисфосфата, изоситол трифосфат, диацилглицерола и тирозина киназы.
10. Оценка лекарственного средства
Определенные лиганды на основе лекарственного препарата могут быть применены в измерении фармакологического ответа субъекта на препарат. Широкий диапазон параметров может быть измерен при определении ответа субъекта на назначение лекарственного препарата. Специалисты знакомы с типами ответов, которые могут быть измерены. Эти ответы зависят частично от различных факторов, включая специфический лекарственный препарат, который оценивается, специфической болезни или условий, при которых субъект лечат, и особенности субъекта. Примерами лигандов на основе лекарственного препарата являются карнитин, пуромицин, верапамил, дигоксин, празосин, хинидин, дизопирамид, теофиллин, ингибиторы протеазы нидедипин, дилтиазем, флекаинид, амиодарон, соталол, аденозин, допамин добутамин, инамринон, милринон, спиронолактон, празосин, аспирин и варфарин.
11. Антибактериальные препараты
Любой антибактериальный препарат может быть рассмотрен как направленный лиганд. Предпочтительные антибактериальные препараты включают ампициллин, амоксициллин, пенициллин, клиндамицин, гентамицин, канамицин, неомицин, натамицин, нафциллин, рифампин, тетрациклин, ванкомицин, блеомицин, доксициклин, амикацин, нетилмецин, стрептомицин, тобрамицин, лоракарбеф, эртапенем, имипенем, меропенем, цефадроксил, цефазолин, цефалексин, цефаклор, цефамандол, цефокситин, цефпрозил, цефуроксим, цефиксим, цефдинир, цефдиторен, цефоперазон, цефотаксим, цефподоксим, цефтазидим, цефтибутен, цефтизоксим, цефтриаксон, цефепим, тейкопланин, азитромицин, кларитромицин, диритромицин, эритомицин, рокситромицин, тролеандоми-цин, азтреонам, азлоциллин, карбенициллин, клоксациллин, диклоксациллин, флуклоксациллин, мезлоциллин, пиперациллин, тикарциллин, бацитрацин, колистин, полимиксин b, ципрофлоксацин, эноксацин, гатифлоксацин, левофлоксацин, ломефлоксацин, моксифлоксацин, норфлоксацин, офлоксацин, тровафлоксацин, мафенид, пронтосил, сульфацетамид, сульфаметизол, сульфанилимид, сульфасалазин, сульфисоксазол, триметоприм, триметопримсульфаметоксазол, демеклоциклин, миноциклин, окситетрациклин, арсфенамин, хлорамфеникол, этамбутол, фосфомицин, фуразолидон, изониазид, линезолид, метронидазол, мупироцин, нитрофурантоин, платенсимицин, пиразинамид, хинупристин, далфопристин, спектиномицин и телитромицин.
Противогрибковые лекарственные препараты включают натамицин, римоцидин, филипин, нистатин, амфотерицин В, миназол, кетоконазол, клотримазол, эконазол, бифоназол, бутоканазол, финтиконазол, изоконазол, оксиконазол, сертаконазол, сулконазол, тиоконазол, флуконазол, итраконазол, равуконазол, росаконазол, ворконазол, терконазол, тербинафин, аморолфин, нафтифин, бутенафин, анидулафунгин, каспофунгин, микафунгин, циклопирокс, флуцитозин, грисеофулвин, фиолетовая горечавка, галопрогин, толнафтат, ундацикленовая кислота, амантадин, полимицин, ацикловир и ганцикловир для грибов. Специалисты знакомы с различными агентами, которые, как полагают, являются антибактериальными препаратами.
12. Агенты, имитирующие глюкозу
Агенты, имитирующие глюкозу также рассматриваются как направленные лиганды. Такие агенты могут также считаться "аналогами глюкозы" или "производными глюкозы".
Глюкоза используется живыми организмами через путь гликолиза. Соединения, такие как неомицин, канамицин, гентамицин, амикацин, тобрамицин, нетилмецин, рибостамицин, сисомицин, микромицин, ливидомицин, дибекацин, изепамицин и астромицин, принадлежат группе, названной аминогликозиды.
Агенты, имитирующие глюкозу, обычно имеют структуру кольца глюкозы. Исключения существуют, например пуромицин имеет структуру кольца пентозы, но может все же считаться агентом, имитирующим глюкозу.
Функционально аминогликозиды используются как антибиотики, которые блокируют путь гликолиза своим свойством быть структурно подобными глюкозе, и, таким образом, их функционально рассматривают как агенты, имитирующие глюкозу. Когда аминогликозиды используются в исследованиях получения изображения, нет никакого обнаруживаемого фармакологического эффекта.
Слово "имитирующий", как определено в американском Словаре Наследия четвертого выпуска, означает "иметь близкое сходство или быть подобным". Аминогликозиды функционально используются через путь гликолиза благодаря структурному подобию глюкозе и блокируют путь гликолиза. Следовательно, аминогликозиды, как полагают, подражают или моделируют глюкозу структурным и функциональным образом.
Неограничивающие примеры химических структур с номером CID идентификатора в базе данных PubChem (NCBI) следующие: Амикацин CID 37768; Аминогликосид CID 191574; Астромицин CID 65345; Деоксиглюкоза CID 439268; D-глюкозамин CID 441477; Дибекацин CID 3021; Гентамицин CID 3467; Глюкоза CID 5793; Изепамицин CID 456297; Канамицин CID 5460349; Ливидомицин CID 72394; Микромицин CID 107677; Неомицина CID 504578; Нетилмицин CID 441306; Пуромицин CID 439530; Рибостамицин CID 33042; Сисомицин CID 36119; и Тобрамицин CID 36294.
Ссылки, где описывается гликолиз, блокированный аминогликозидами, включают, например, Tachibana и др., 1976; Borodina и др., 2005; Murakami и др., 1996; Hoelscher и др., 2000; Yang и др., 2004; Michalik и др., 1989; Murakami и др., 1997; Diamond и др., 1978; Hostetler и Hall, 1982; Benveniste и Davies, 1973; Hu, 1998; Yanai и др., 2006; Myszka и др., 2003; Nakae и Nakae, 1982; Ozmen и др., 2005; и Tod и др., 2000.
Предпочтительные агенты, имитирующие глюкозу или сахар, включают неомицин, канамицин, гентамицин, паромицин, амикацин, тобрамицин, нетилмецин, рибостамицин, сисомицин, микромицин, ливидомицин, дибекацин, изепамицин, астромицин и глюкозу аминогликозидов и глюкозамин.
13. Направленные лиганды гипоксии
В некоторых воплощениях настоящего изобретения направленным лигандом является направленный лиганд гипоксии новообразования. Например, клетки новообразования более чувствительны к обычной радиации в присутствии кислорода, чем в его отсутствии; даже малый процент гипоксических клеток внутри новообразования может ограничить ответ на радиацию (Hall, 1988; Bush и др., 1978; Gray и др., 1958). Гипоксическая радиоустойчивость демонстрировалась во многих опухолях животных, но только в немногих типах новообразований людей (Dische, 1991; Gatenby и др., 1988; Nordsmark и др., 1996). Местонахождение гипоксии в опухолях людей в большинстве случаев было определено с помощью гистологических данных и при исследовании опухолей животных. В естественных условиях демонстрация гипоксии требует измерений ткани с помощью кислородных электродов, и агрессивность этих способов ограничила их клиническое применение.
Мизонидазол (MISO), пример направленного лиганда гипоксии новообразования, является сенсибилизирующим веществом гипоксической клетки, и MISO меченый различными радиоизотопами (например,18F,123I,99mТе) может быть использован для отличия гипоксического, но метаболически активного новообразования, от хорошо окисленного активного новообразования при помощи PET или плоской сцинтиграфии. [18F] фторомисонизадол (FMISO) использовался с PET для оценки гипоксии опухолей. Недавние исследования показали, что PET с его способностью контролировать содержание кислорода клетки через [F]FMISO имеет высокий потенциал для предсказывания ответа новообразования на радиацию (Koh и др., 1992; Valk и др., 1992; Martin и др., 1989; Rasey и др., 1989; Rasey и др., 1990; Yang и др., 1995). PET дает более высокое решение без коллимации, однако стоимость использования изотопов PET в клинических установках является препятствием.
14. Антисмысловые молекулы
Антисмысловые молекулы взаимодействуют с дополнительными нитями нуклеиновых кислот, изменяя экспрессию генов.
Некоторые области в пределах двойной нити ДНК кодируют соединяющие участки для генов, которые являются обычно инструкциями, определяющими порядок аминокислот в белке вместе с регулирующими последовательностями, не кодируя интроны и другие усложняющие детали. Чтобы использовать эту информацию для клетки, одна нить ДНК служит шаблоном для синтеза дополнительной нити РНК. Нить шаблона ДНК называют антисмысловой нитью, а РНК называется смысловой нитью (дополнение антисмысловой). Поскольку ДНК скручена из двух нитей, дополнительную нить к антисмысловой нити также называют смысловой, и она имеет ту же самую основную последовательность, как мРНК (хотя основания Т в ДНК замещены основаниями U в РНК).
Например:
Нить 1 ДНК: смысловая нить
Нить 2 ДНК: антисмысловая нить (скопирована) → нить РНК (смысловая).
Много форм антисмысловых молекул были разработаны и могут быть в общем распределены по двум категориям: фермент-зависимые антисмысловые молекулы и стерические блокирующие антисмысловые молекулы. Фермент-зависимые антисмысловые молекулы включают формы, зависящие от активности RNase H, чтобы деградировать цель мРНК, включая отдельно-скрученную ДНК, РНК и фосфоротиоата антисмысловую молекулу. Двойные скрученные РНК действуют как фермент-зависимые антисмысловые молекулы через путь интерференционная РНК/малая интерферирующая РНК (RNAi/siRNA), включая узнавание цели мРНК через спаривание нитей антисмысла/смысла, сопровождаемое деградацией цели мРНК с помощью комплекса деградации РНК (RISC). Стерическая блокирующая антисмысловая молекула (антисмысловая молекула, независимая от RNase-H) сталкивается с экспрессией гена или другими мРНК-зависимыми клеточными процессами, связываясь с целевой последовательностью мРНК и мешая другим процессам. Стерическая блокирующая антисмысловая молекула включает 2'-0 алкил (обычно в химерах с антисмысловой молекулой, зависимой от RNase-H), пептидно-нуклеиновую кислоту (PNA), замкнутую нуклеиновую кислоту (LNA) и антисмысловую молекулу Морфолино. Клетки могут произвести антисмысловую молекулу РНК естественным путем, когда взаимодействуют с дополнительными молекулами мРНК и замедляют их экспрессию.
Антисмысловые млекулы нуклеиновой кислоты экспериментально использовались для связи с мРНК и препятствовали экспрессии специфических генов. Антисмысловая терапия находится в развитии; FDA (американский департамент по контролю за качеством пищевых продуктов, медикаментов и косметических средств) одобрил антисмысловой олигомер фосфоротиоата, фомивирсен (Витравен) для использования в терапии человека.
15. Частицы получения изображений
В определенных воплощениях составов настоящего изобретения направленный лиганд является частицей получения изображений. Как определено здесь," частица получения изображений" является частью молекулы, которая является агентом или соединением, которые могут быть назначены субъекту, контактируя с тканью или применяя к клетке с целью облегчения визуализации специфических особенностей или аспектов субъекта, ткани или клетки с помощью способа воздействия получения изображений. Способы воздействия получения изображений обсуждены подробно ниже. Любой агент получения изображений, известный специалистам, рассматривается как частица получения изображений настоящего изобретения. Таким образом, например, в определенных воплощениях составов настоящего изобретения, сложные соединения могут быть применены во множестве способов получения изображений. Двойное получение изображений и множество способов получения изображений обсуждены подробно ниже.
В определенных воплощениях частицей получения изображений является контрастная среда. Примеры включают контрастную среду компьютерной томографии (СТ), контрастную среду магнитно-резонансной томографии (MRI), оптическую контрастную среду, ультразвуковую контрастную среду или любую другую контрастную среду, которая используется в любой другой форме способов получения изображений, известной специалистам. Примеры включают диатризоат (СТ контрастный агент), хелат гадолиния (MRI контрастный агент) и натрий флуоресцеин (оптическая контрастная среда). Дополнительные примеры контрастной среды обсуждены в спецификации подробно ниже. Специалисты знакомы с широким диапазоном типов агентов получения изображений, которые могут использоваться как частица получения изображений в хелаторах настоящего изобретения.
Е. Способы синтеза
1. Источник реактивов для составов настоящего изобретения.
Реактивы для подготовки составов настоящего изобретения могут быть получены из любого источника. Специалистам известен широкий диапазон источников реактивов. Например, реактивы могут быть получены из коммерческих источников, таких как Химическая компания Сигма-Алдрич (Miwaukee, WI), путем химического синтеза или из естественных источников. Например, одним из продавцов радионуклидов являются Кембриджские лаборатории изотопов (Andover, МА). Реактивы могут быть изолированы и очищены, любыми способами, известными специалистам. Свободные несвязанные ионы металлов могут быть удалены с помощью, например, ионообменной смолы или добавляя трансхелатор (например, глюкогептонат, глюконат, глюкорат или ацетилацетонат).
2. Использование промежуточного продукта в качестве активного фармацевтического ингредиента (API) Формирование дисульфида и нуклеофильное разрушение аномерического центра частицы глюкозамина определенных соединений настоящего изобретения может быть проблематичным. Например, нежелательные реакции могут произойти в тиольных группах и/или амино группах в ЕС-глюкозамине (EC-G): это основные побочные реакции, которые могут вызвать нестабильность EC-G. Кроме того, обычно низкая производительность шага снятия защиты с помощью Na/МНз для получения первичного продукта ЕС-глюкозамина может привести к низкой чистоте (см. Фиг.1 и Фиг.13). Соответственно, желательно использовать промежуточные продукты синтеза настоящего изобретения как активные фармацевтические ингредиенты (API). Например, аналоги ЕС-глюкозамина, такие как показано ниже, которые являются промежуточными продуктами для определенных препаратов, могут быть использованы как активные фармацевтические ингредиенты. Эти аналоги, в определенных воплощениях, могут достичь высокой чистоты в масштабе процесса.






3. Процедуры очистки и определения чистоты
Как было упомянуто выше, специалисты знакомы со способами очистки сложных соединений настоящего изобретения. Используемый здесь термин "очистка" относится к любому измеримому увеличению чистоты относительно чистоты материала перед очисткой. Очистка каждого состава настоящего изобретения обычно возможна, включая очистку промежуточных продуктов, а так же очистку конечных продуктов. Шаг очистки не всегда включается в основные методологии, объясненные ниже, но специалисты поймут, что соединения могут очищаться на любом шаге. Примеры способов очистки включают фильтрацию гелем, вытеснительную по размеру хроматографию (также называемую хроматографией гель-фильтрации, гель-проникающую хроматографию или молекулярно-ситовую), диализ, дистилляцию, рекристаллизацию, возгонку, дериватизацию, электрофорез, колончатую силикагель-хроматографию и высокоэффективную жидкостную хроматографию HPLC (ВЭЖХ), включая нормально-фазовую ВЭЖХ и обращенно-фазовую ВЭЖХ. В определенных воплощениях вытеснительная по размеру хроматография и/или диализ исключены как формы очистки сложных соединений настоящего изобретения. Очистка составов колончатой силикагель-хроматографией или ВЭЖХ, например, дает возможность получения желательных составов очень высокой чистоты, часто выше, чем при очистке другими способами. Радиохимическая чистота составов настоящего изобретения также может быть определена. Способы определения радиохимической чистоты известны и включают хроматографические способы в соединение со способами обнаружения радиоактивности (например, авторадиографические исследования). Примеры сравнения чистоты составов, полученных органическими и водными технологиями, и очистка различными способами описываются ниже.
Способы определения чистоты составов известны специалистам и включают, но не ограничиваются, авторадиографию, массовую спектроскопию, определение точки плавления, ультрафиолетовый анализ, колориметрический анализ, HPLC (ВЭЖХ), хроматографию тонкого слоя и ядерно-магнитный резонанс (ЯМР) (включая, но не ограничиваясь, 1Н и 13С ЯМР). В некоторых воплощениях колориметрический способ мог быть использован для титрования чистоты хелатора или сложного соединения хелатор-направленный лиганд. Например, генерация аддукта тиолбензила (то есть тиольной функциональной группы, защищенной группой бензила) или выполнение реакции окисления при использовании иода могли быть использованы для определения чистоты хелатора или сложного соединения хелатор-направленный лиганд. В одном воплощении чистота неизвестного состава может быть определена сравнением этого состава с составом известной чистоты: это сравнение может быть в форме отношения, измерение которого описывает чистоту неизвестного состава. Программное обеспечение на различных приборах (например, спектрофотометрах, ВЭЖХ, ЯМР), а также другие средства, известные специалистам, могут помочь в создании этих определений.
Следующие неограничивающие параметры могут использоваться в определенных воплощениях для определения чистоты составов настоящего изобретения:
Колонка: Primesep100, 4,6×150 мм, 5 мкм, температура окружающей среды
Подвижная фаза (А): Н2О с 0,025% TFA
Подвижная фаза (В): ацетонитрил с 0,025% TFA
Изократический режим: А/В (50/50) в 1,0 мл/мин
Обнаружение: ELSD, SEDEX75, 50С, 4,5 бар
В определенных воплощениях настоящего изобретения очистка состава не удаляет все примеси. В некоторых воплощениях такие примеси могут быть идентифицированы.
4. Получение хелатора
Способы приготовления и получения хелаторов известны специалистам. Например, хелаторы могут быть получены из коммерческих источников, химическим синтезом или из естественных источников. В одном воплощении, хелатор может включать этилендицистеин (ЕС). Приготовление этилендицистеина (ЕС) описано в американском патенте №6,692,724. Кратко, ЕС может быть приготовлен путем двухступенчатого синтеза, согласно предварительно описанным способам (Ratner и Clarke, 1937; Blondeau и др., 1967; все включены в ссылку). Исходное вещество, L-тиазолидин-4-карбоновая кислота, была синтезирована, а затем было приготовлено ЕС. Часто также важно включить антиоксидант в состав для предотвращения окисления этилендицистеина. Предпочтительный антиоксидант для использования в связи с существующим изобретением - это витамин С (аскорбиновая кислота). Однако, рассматриваются и другие антиоксиданты, такие как токоферол, пиридоксин, тиамин или рутин.
Хелаторы могут также включать аминокислоты, соединенные вместе спейсерами. Спейсер может включать, как было описано выше, алкилный спейсер, такой как этилен.
Амидные связи могут также соединять одну или более аминокислот вместе, чтобы сформировать хелатор. Примеры синтетических способов приготовления таких хелаторов включают синтез твердофазный и синтез жидкофазный. Такие способы описаны, например, у Bodansky, 1993 и Grant, 1992.
5. Органический синтез сложных соединений хелатор-направленный лиганд.
В предпочтительном воплощении настоящего изобретения далее обеспечивается способ органического синтезирования сложных соединений хелатор-направленный лиганд. Способ включает получение, например, хелатора, такого как этилендицистеин (ЕС), описанного выше, и примешивание в органической среде к ЕС тиольной защитной группы, чтобы защитить оба свободных тиола, получая в результате S-S'-бис-защищенный-ЕС, который затем смешивают с аминной защитной группой в органической/водной среде, чтобы защитить оба свободных амина, получая в результате S-S'-бис-защищенный-N,N'-бис-защищенный-ЕС. Тиольные группы являются более реактивными, чем азотные группы; таким образом, тиольные группы обычно защищают первыми. Как было описано выше, специалисты знакомы с надлежащим порядком установки защитных групп в зависимости от типов функциональных групп, имеющихся в хелаторе. Защищенный ЕС затем соединяют с направленным лигандом любого описанного здесь типа любым описанным здесь способом соединения, сопровождаемым удалением тиольных и аминных защитных групп, получая в результате сложное соединение хелатор-направленный лиганд.
В определенных воплощениях соединение между хелатором и направленным лигандом происходит за один шаг. В специфических воплощениях соединение включает ковалентное присоединение хелатора к направленному лиганду, где ковалентное присоединение происходит за один шаг. Как было упомянуто, такие процедуры в один шаг предпочтительны, так как они минимизируют время, реактивы, траты и потери продукта.
Сложное соединение хелатор-направленный лиганд, синтезируемое этим способом, может быть затем хелатировано с ионом металла любого типа, описанного здесь. Такие способы хелатирования известны специалистам и описаны здесь. Примеры способов хелатирования ионов металла сложными соединениями хелатор-направленный лиганд описаны, например, в американском патенте №6,692,724. Способы, описанные здесь, когда ион металла хелатируется хелатором, могут также служить примерами того, как хелатировать ион металла в сложное соединение хелатор-направленный лиганд.
Выгоды синтезирования сложных соединений хелатор-направленный лиганд способами настоящего изобретения, используя органический синтез, включают, например, получение соединения высокой чистоты относительно соединений, полученных путем водяного синтеза, и эффективный синтез и очистку маломолекулярных составов (например, 1000 г/моль или меньше). Эти преимущества важны для сложных соединений, которые могут использоваться в получении изображений, в диагностических целях и/или терапевтических экспериментах и/или клинических испытаниях.
6. Органический синтез сложных соединений хелатор-направленный лиганд, хелирующих ион металла В другом предпочтительном воплощении настоящего изобретения далее обеспечивается способ органического синтезирования сложных соединений хелатор-направленный лиганд, хелирующих ион металла для получения изображений, диагностического или терапевтического использования. Способ включает, например, сначала получение хелатора, такого как ЕС. К ЕС затем может быть примешан ион металла в органической среде, который может быть радионуклидом или любым другим ионом металла, описанным здесь, чтобы хелировать в ЕС через хелат N2S2. (Смотри, например, Фиг.2) Другие способы хелатообразования описаны здесь (например, хелаты любой комбинации О, N и S), и хелатообразование может происходить любым способом, описанным здесь. Неограничивающие примеры металлов, которые могут быть хелированы хелатором, таким как ЕС, включают технеций, индий, рений, галлий, медь, гольмий, платину, гадолиний, лютеций, иттрий, кобальт, кальций и мышьяк. ЕС, хелатированный с ионом металла ("хелированный ЕС"), затем смешивается в присутствии органической среды с направленным лигандом, произвольно защищенным одной или более защитными группами, для получения сложного соединения хелатор-направленный лиганд, хелированного с ионом металла. Соединение может происходить любым описанным здесь способом и может быть выполнено за один шаг или большее число шагов.
Преимуществами синтезирования сложных соединений меченный ионом металла хелатор-направленный лиганд способами настоящего изобретения, используя органический синтез, являются, например, получение соединений высокой чистоты относительно соединений, полученных путем водного синтеза, и эффективный синтез и очистка маломолекулярных составов (например, 1000 г/моль или меньше). Эти соединения могут использоваться в получении изображений, в диагностических целях и/или терапевтических экспериментах, и/или клинических испытаниях.
7. Водный синтез сложного соединения хелатор-направленный лиганд Существующее изобретение далее обеспечивает способ синтезирования сложного соединения хелатор-направленный лиганд в водной среде. Сложные соединения хелатор-направленный лиганд приготавливались обычно как средство сравнения относительной чистоты таких или подобных продуктов, синтезированных в органических средах. Способ включает, например, сначала получение хелатора, такого как ЕС. Затем ЕС растворяется в основном водном растворе и добавляются соединяющие агенты любого описанного здесь типа. Затем к этому раствору добавляется направленный лиганд, чтобы получить сложное соединение хелатор-направленный лиганд.
8. Водный синтез сложного соединения хелатор-направленный лиганд, хелирующего ион металла
Существующее изобретение далее обеспечивает способ синтезирования в водной среде сложных соединений хелатор-направленный лиганд, хелированных с ионом металла. Подобно упомянутому выше водному синтезу, сложные соединения хелатор-направленный лиганд, хелированные с ионом металла, готовились как средство сравнения относительной чистоты с такими же или подобными продуктами, синтезированными в органических средах. В одном воплощении выполнение способа начинается с получения хелатора, хелированного с ионом металла, как было описано выше ("Органический синтез сложных соединений хелатор-направленный лиганд, хелированных с ионом металла "). Хелатором, хелирующим ион металла, может быть, например, хелированный ЕС, как было описано выше. Хелатообразование может быть произведено любым способом, описанным здесь. Хелированный ЕС может быть растворен в основном водном растворе, и к нему добавлены связующие агенты, описанные здесь, а также направленный лиганд любого типа, описанного здесь, чтобы получить сложное соединение хелатор-направленный лиганд, хелированное с ионом металла.
9. Соединение хелатора с направленным лигандом
Существующее изобретение рассматривает способы сопряжения направленного лиганда с хелатором (произвольно хелированного с ионом металла). Направленный лиганд может быть любого описанного здесь типа. Специалисты знакомы со средствами сопряжения направленных лигандов с различными функциональными группами. Обычно при взаимодействии между хелатором и направленным лигандом один из них действует как нуклеофил, а другой действует как электрофил так, что происходит сопряжение через ковалентную связь. Неограничивающие примеры таких ковалентных связей включают амидную связь, сложноэфирную связь, тиосложноэфирную связь и углерод-углеродистую связь. В предпочтительных воплощениях сопряжение осуществляется через сложноэфирную связь или амидную. В некоторых воплощениях сопряжение происходит в одной или более функциональных группах хелатора, выбранных из карбоксильной кислоты, амина и тиола. Если хелаторы и направленные лиганды действуют как электрофилы, они могут включать функциональные группы, такие как галогены и сульфонилы, которые действуют как уходящие группы в течение соединения. Направленные лиганды могут также включать нуклеофильные группы, такие как -NH2, которые могут участвовать в сопряжении с электрофильным хелатором.
Связующий агент, используемый здесь, является реактивом, используемым для облегчения связи хелатора с направленным лигандом. Такие агенты известны специалистам и могут быть использованы в определенных воплощениях способов настоящего изобретения. Примеры связующих агентов включают, но не ограничиваются, сульфо-N-гидроксисукцинимид (сульфо-NHS), диметиламинопиридин (DMAP), диазабицикло [5.4.0]андек-7-эне (DBU), 1-этил-3-(3-диметиламинопропил) карбодиимид (EDAC) и дициклогексилкарбодиимид (DCC). Другие карбодиимиды также могут быть использованы как связующие агенты. Связующие агенты описаны, например, у Bodansky, 1993 и Grant, 1992. Такие связующие агенты могут использоваться отдельно или в комбинации друг с другом или другими агентами для облегчения связи. Когда направленный лиганд сопрягается с использованием связующего агента, обычно формируется мочевина. Побочный продукт мочевина может быть удален фильтрацией. Полученный продукт может затем быть очищен, например, с помощью колончатой силикагель-хроматографии или ВЭЖХ (HPLC).
Обычно лиганды для использования в соединении с настоящим изобретением будут обладать функциональными группами, которые способны соединяться с одной или более функциональным группам хелатора, такого как ЕС. Например, направленный лиганд может обладать галогенированным положением, будет реагировать со свободным амином хелатора, чтобы сформировать соединение. Если функциональные группы не доступны, или если оптимальная функциональная группа не доступна, желательный лиганд может все еще быть соединен с хелатором, таким как ЕС, добавляя линкер, такой как этилендиамин, аминопласт, пропанол, диэтилентриамин, аспарагиновая кислота, полиаспарагиновая кислота, глутаминовая кислота, полиглутаминовая кислота, цистеин, глицин или лизин. Например, американский Патент №6,737,247 раскрывает несколько линкеров, которые могут использоваться с существующим изобретением и включены в ссылку полностью без правовой оговорки. Американский Патент №5 605 672 раскрывает несколько "предпочтительных опор", которые могут использоваться в качестве линкеров в настоящем изобретении, и тем самым включены полностью в ссылки. В определенных воплощениях хелатор может соединяться с линкером, а линкер присоединяют к направленному лиганду. В других воплощениях может использоваться более чем один линкер; например, хелатор может быть соединен с линкером, а линкер соединен со вторым линкером, где второй линкер соединен с направленным лигандом. В определенных воплощениях два, три, четыре или большее количество линкеров, соединенные вместе, могут использоваться для соединения направленного лиганда и хелатора. Однако обычно предпочитают использовать только один линкер, чтобы соединить хелатор и направленный лиганд.
Некоторые хелаторы, такие как ЕС, являются растворимыми водой. В некоторых воплощениях соединение хелатор-направленный лиганд, хелированное с ионом металла изобретения, растворимо в воде. Многие направленные лиганды, используемые в соединении с настоящим изобретением, являются растворимыми в воде или формируют растворимые в воде соединения, когда соединяются с хелатором. Если направленный лиганд не является растворимым в воде, тогда может использоваться линкер, который увеличит растворимость направленного лиганда. Линкеры могут присоединяться к, например, алифатическому или ароматическому спирту, амину, пептиду или к карбоксильной кислоте. Линкеры могут быть, например, или полиаминокислотами (пептидами), или аминокислотами, такими как глутаминовая кислота, аспарагиновая кислота или лизин.
Таблица 2 иллюстрирует предпочтительные линкеры для функциональных групп специфического лекарственного препарата.
Преимущества синтезирования сложных соединений хелатор-направленный лиганд, произвольно хелирующих один или более валентных ионов металла способами настоящего изобретения, используя органический синтез, включают, например, получение соединений высокой чистоты по сравнению с соединениями, полученными путем водного синтеза, и эффективный синтез и очистку маломолекульных соединений (например, 1000 г/моль или меньше). Благодаря этим преимуществам соединение может использоваться в получении изображений, в диагностических целях, и/или терапевтических экспериментах, и/или клинических испытаниях.
10. Хелатообразование иона металла.
Настоящее изобретение далее рассматривает способы хелатообразования (также называемого координированием) одного или более ионов металла в хелатор или сложное соединение хелатор-направленный лиганд. Шаги хелатообразования могут иметь место в органической среде. В других воплощениях хелатообразование может производиться в водной среде. В определенных воплощениях хелатор и направленный лиганд, каждый, могут внести свой вклад в хелатообразование иона металла. В предпочтительных воплощениях ион металла хелируется только хелатором. Хелированный ион металла может быть связан через, например, ионную связь, ковалентную связь или координированную ковалентную связь (также называемую дативной связью). Способы такого координирования известны специалистам. В одном воплощении координирование может происходить примешиванием иона металла в раствор, содержащий хелатор. В другом воплощении координирование может произойти примешиванием иона металла в раствор, содержащий сложное соединение хелатор-направленный лиганд. В одном воплощении хелатообразование происходит с хелатором с или без направленного лиганда через хелат N2S2, формируемый хелатором, таким как этилендицистеин (ЕС). Хелатор и направленный лиганд каждый могут быть защищены одной или более защитными группами до или после хелирования ионом металла.
Хелатообразование может происходить в любом атоме или функциональной группе хелатора или направленного лиганда, которые являются доступными для хелатообразования. Хелатообразование может происходить, например, в одном или более атомах N, S, О или Р. Неограничивающие примеры хелатообразующих групп включают NS2, N2S, S4, N2S2, N3S и NS3 и O4. В привилегированных воплощениях, ион металла хелируется с тремя или четырьмя атомами. В некоторых воплощениях, хелатообразование происходит среди одной или более тиольных, аминных или карбоновой кислоты функциональных групп. Хелатообразование в специфических воплощениях может быть в карбоксильной части глутамата, аспартата, аналога глутамата или аналога аспартата. Эти воплощения могут включать множество ионов металла, хелированных в поли(глутамат) или поли(аспартат) хелаторы. В некоторых воплощениях хелатообразование иона металла происходит с направленным лигандом, таким как карбоксильные группы тканеспецифического лиганда. В предпочтительных воплощениях хелатообразование происходит между одной или более тиольными группами и одной или более аминными группами хелатора.
В некоторых неограничивающих примерах ион металла может быть технецием, индием, рением, галлием, медью, гольмием, платиной, гадолинием, лютецием, иттрием, кобальтом, кальцием, мышьяком или любым их изотопом. Любой описанный здесь ион металла может быть хелирован в сложное соединение настоящего изобретения.
11. Восстанавливающие агенты
В целях настоящего изобретения, когда ион металла является технецием, предпочтительно, чтобы Те находится в состоянии окисления +4. Предпочтительным восстанавливающим агентом для использования с этой целью является содержащий двухвалентное олово ион в форме хлорида, содержащего двухвалентное олово (SnCl2), чтобы восстановить Те до его состояния окисления +4. Однако другие восстанавливающие агенты, такие как ион дитионата или ион железа могут быть использованы в соединении с настоящим изобретением. Рассматривалось, что восстанавливающий агент может быть восстанавливающим агентом твердой фазы. Количество восстанавливающего агента может быть важно, поскольку необходимо избежать формирования коллоида. Предпочтительно, например, использовать от приблизительно 10 приблизительно до 100 мкг SnCl2 на от приблизительно 100 до приблизительно 300 мКи пертехнетата Те. Наиболее предпочтительное количество - приблизительно 0.1 мг SnCk на приблизительно 200 мКи пертехнетата Те и приблизительно 2 мл соли. Таким образом, получается достаточно сложного соединения Тс-ЕС-направленный лиганд для использования 5 пациентам.
F. Примеры способов получения изображений
1. Гамма-камеры получения изображений
Разновидности ядерных технологий медицины для получения изображений известны специалистам. Любая из этих технологий может быть применена в контексте способов получения изображений настоящего изобретения для измерения сигнала репортера. Например, гамма-камера получения изображений рассмотривается как способ получения изображения, которая может использоваться для измерения сигнала, полученного от репортера. Специалисты знакомы с технологиями для применения гамма-камеры получения изображений (например, Kundra и др., 2002, включенный ссылкой). В одном воплощении измерение сигнала может включить использование гамма-камеры получения изображений системы репортера 111-In-октреотид-SSRТ2А.
2. PET и SPECT
Способы получения изображений с помощью радионуклида (позитронно-эмиссионная томография (PET); однофотонная эмиссионная компьютерная томография (SPECT)) являются диагностическими технологиями получения изображений поперечного сечения, которые наносят на карту местоположение и концентрацию меченных радионуклидом радиоактивных меток. Хотя СТ (компьютерная томография) и MRI (магнитно-резонансная томография) обеспечивают значительную анатомическую информацию о местоположении и степени опухолей, эти способы получения изображений не могут адекватно дифференцировать агрессивные повреждения от отека, радиационного некроза, стадии или глиозы. PET и SPECT могут использоваться для определения локализации и характеристик новообразований измерением метаболической активности.
PET и SPECT обеспечивают информацию, имеющую отношение к информации на клеточном уровне, такую как клеточная жизнеспособность. В PET пациент принимает внутрь или ему вводится немного радиоактивного вещества, испускающего позитроны, которые могут быть отслежены как движение вещества через тело. В одной способе применения, например, пациентам дают глюкозу с присоединенными излучателями позитрона и их мозг контролируют, поскольку они выполняют различные задачи. Так как мозг использует глюкозу для работы, изображения PET показывают, где мозговая деятельность высока.
Тесно связана с PET однофотонная эмиссионная компьютерная томография, или SPECT. Главное различие между ними - то, что вместо испускающего позитрон вещества, SPECT использует радиоактивный трассирующий снаряд, который испускает фотоны низкой энергии. SPECT важен при диагностике заболевания коронарной артерии, и сейчас уже приблизительно 2,5 миллиона исследований сердца с помощью SPECT происходят в Соединенных Штатах каждый год.
Радиоактивные медицинские препараты PET для получения изображений обычно метятся излучателями позитрона, такими как11С,13N,15О,18F,82Rb,62Cu и68Ga. Радиоактивные медицинские препараты SPECT обычно маркируются излучателями позитрона, такими как99mТc,201Tl и67Ga. Относительно получения изображений мозга, радиоактивные медицинские препараты PET и SPECT классифицированы согласно проходимости кровемозгового барьера (ВВВ), мозговой перфузии и метаболизма связывания рецептора и антиген-антитело связывания (Saha и др., 1994). Агенты SPECT кровемозгового барьера, такие как99mTcO4-DTPA,201Tl, и [67Оа]цитрат, исключаются нормальными мозговыми клетками, но входят в клетки новообразования из-за измененного кровемозгового барьера. Агенты перфузии SPECT, такие как [123I] IMP, [99mТсHМРАО, [99mТc] ECD, являются липофильными агентами и поэтому рассеиваются в нормальный мозге. Важные рецептор-связывающие радиоактивные медицинские препараты SPECT включают [123I]QNE, [123I]IBZM и [123I]иомазенил. Эти радиоактивные индикаторы связываются со специфическими рецепторами и являются важными в оценке связанных с рецептором заболеваний.
3. Компьютерная томография (СТ)
Компьютерная томография (СТ) рассмотрена как модальность получения изображений в контексте настоящего изобретения. Производя серию рентгеновских снимков, иногда более тысячи под различными углами, и затем комбинируя их с помощью компьютера. Компьютерная томография позволяет создать трехмерное изображение любой части тела. Компьютер запрограммирован на показ двумерных слоев с любого угла и на любой глубине.
В компьютерной томографии внутривенная инъекция контрастного агента радиопага может помочь идентификации и прочерчивании линий мягких масс ткани, когда начальные просмотры результатов сканирования СТ не являются диагностическими. Точно так же контрастные агенты помогают в оценке наличия кровеносных сосудов мягкой ткани или повреждения кости. Например, использование контрастных агентов может помочь прочерчиванию линий зависимости новообразования и смежных сосудистых структур.
Контрастные агенты СТ включают, например, йодинированную контрастную среду. Примеры этих агентов включают иоталамат, иогексол, диатризоат, иопамидол, этиодол и иопаноат. Агенты гадолиния, как уже сообщалось, использовались в качестве контрастного агента СТ (см. Henson и др., 2004). Например, агенты гадопентата использовались в качестве контрастного агента СТ (обсуждено в Strunk и Schild, 2004).
4. Магнитно-резонансная томография (МРТ)
Магнитно-резонансная томография (МРТ) является способом получения изображений, более новым, чем СТ, который использует высокой интенсивности магнитные и радиочастотные сигналы для получения изображения. Самая обильная молекулярная разновидность в биологических тканях - это вода. Квантовый механический "спин" протонных ядер воды в конечном счете дает нарастание сигналу в экспериментах получения изображения. В МРТ, образец, который будет изображен, помещается в прочное статическое магнитное поле (1-12 тесл), и спины возбуждаются импульсом высокой частоты (ВЧ) радиации, чтобы произвести сетевое намагничивание образца. Различные градиенты магнитного поля и другие импульсы ВЧ затем действуют в спинах для кодирования пространственной информации в зарегистрированных сигналах. Собирая и анализируя эти сигналы, возможно воссоздать трехмерное изображение, тогда как изображение КТ обычно показывается в двумерных слоях.
Контрастные агенты, используемые в магнитно-резонансном получении изображений, отличаются от агентов, используемых в других технологиях получения изображений. Их цель состоит в том, чтобы помочь различить компоненты ткани с идентичными особенностями сигнала и сократить время релаксации (который произведет более сильный сигнал на T1-утяжеленное эхо спина магнитно-резонансных изображений и менее интенсивный сигнал на Т2-утяжеленных изображениях). Примеры контрастных агентов МРТ включают хелаты гадолиния, хелаты марганца, хелаты хрома и частицы железа.
Как КТ, так и МРТ обеспечивают анатомическую информацию, которые помогают различить границы ткани и сосудистой структуры. По сравнению с КТ неудобства МРТ залючаются в более низкой переносимости пациентами, противопоказаний для водителя ритма и определенных других имплантированных металлических устройств и артефакты, связанные с многочисленными причинами, немалое количество из которых - движение (Alberico и др., 2004). КТ, с другой стороны, является быстрой, хорошо переносимой и легко доступной, но имеет более низкое контрастное разрешение, чем МРТ, и требует насыщенный йодом контраст и ионизирующее излучение (Alberico и др., 2004). Неудобством и КТ, и МРТ является то, что никакой способ получения изображений не обеспечивает функциональную информацию на клеточном уровне. Например, никакой способ не обеспечивает информацию относительно клеточной жизнеспособности.
5. Оптическое получение изображений
Оптическое получение изображений является другой модальностью получения изображений, которая получила широкое распространение в специфических областях медицины. Примеры включают оптическое мечение клеточных компонентов и ангиографию, такую как флюоресцентная ангиография и ангиография индоцианином зеленым. Примеры оптических агентов получения изображений включают, например, флуоресцеин, производную флуоресцеина, индоцианин зеленый. Орегонский зеленый, производная Орегонского зеленого, зеленый родамин, производная зеленого родамина, эозин, эритрозин. Техасский красный, производная Техасского красного, малахитовый зеленый, нанозолото сульфосукцинимидил сложный эфир, каскадный синий, производная кумарина, нафталин, производная пиридилоксазола, каскадный желтый краситель или дапоксиловый краситель.
6. Ультразвук
Другой биомедицинский способ получения изображений, который получил широкое распространение, - это ультразвук. Ультразвуковое получение изображений использовалось неинвазивно для получения поперечных сечений в реальном времени и даже трехмерных изображений мягких структур ткани, а также информации о кровотоке в теле. Используя высокочастотные звуковые волны и компьютер, создается изображение кровеносных сосудов, тканей и органов.
Ультразвуковое получение изображений кровотока может быть ограничено множеством факторов, таких как размер и глубина кровеносного сосуда. Ультразвуковые контрастные агенты, относительно недавно используемые, включают перфлюорин и аналоги перфлюорина, которые разработаны, чтобы преодолеть эти ограничения, помогая усиливать изображения серой шкалы и допплеровские сигналы.
7. Процедура двойного получения изображений
Определенные воплощения настоящего изобретения рассматривают способы получения изображений участка в пределах предмета, используя два способа получения изображений, которые включают измерение первого сигнала и второго сигнала от комплекса частица получения изображений - хелаторион металла. Первый сигнал получают от иона металла, а второй сигнал получают от частицы получения изображений. Как было сформулировано выше, любой способ получения изображений, известный специалистам, может быть применен в воплощениях настоящего изобретения.
Способы получения изображений выполняются в любое время в течение или после назначения состава, включающего диагностически эффективное количество состава настоящего изобретения. Например, исследования получения изображений могут быть выполнены в течение назначения двойного состава получения изображений настоящего изобретения или в любое время после того. В некоторых воплощениях, первый способ получения изображений выполняется одновременно с назначением двойного агента получения изображений или спустя приблизительно 1 секунду, 1 час, 1 день или больший промежуток времени после назначения двойного агента получения изображений, или в любое время между любыми из этих установленных промежутков времени.
Второй способ получения изображений может быть выполнен одновременно с первым способом получения изображений или в любое время после выполнения первого способа получения изображений. Например, второй способ получения изображений может быть выполнен спустя приблизительно 1 секунду, приблизительно 1 час, приблизительно 1 день или больший промежуток времени после завершения первого способа получения изображений, или в любое время между любыми из этих установленных промежутков времени. В определенных воплощениях настоящего изобретения, первый и второй способы получения изображений выполняются одновременно так, что они начинаются в одно и то же время после назначения агента. Специалисты знакомы с выполнением различных способов получения изображений, рассмотренных в соответствии с существующим изобретением.
В некоторых исполнениях существующих способов двойного получения изображений, используется одно и то же устройство получения изображений для выполнения первого способа получения изображений и второго способа получения изображений. В других воплощениях используются различные устройства получения изображений, чтобы выполнить второй способ получения изображений. Специалисты знакомы с устройствами получения изображений, которые являются доступными для выполнения первого способа получения изображений и второго способа получения изображений, и квалифицированные работники знакомы с правилами использования этих устройств, чтобы получить изображения.
G. Агенты, меченные радиоактивным изотопом
Как сформулировано выше, определенные исполнения составов настоящего изобретения включают ион металла, хелированный с хелатором, как было сформулировано выше. В некоторых воплощениях ион металла является радионуклидом. Агенты, меченные радиоактивным изотопом, соединения и составы, обеспеченные в соответствии с настоящим изобретением, имеют подходящую величину радиоактивности. Например, при получении радиоактивного комплекса99mТc предпочтительно формировать радиоактивные комплексы в растворах, имеющих радиоактивность в концентрациях приблизительно от 0.01 мКи до приблизительно 300 мКи в мл.
Агенты получения изображения, меченные радиоактивным изотопом, обеспечиваемые в соответствии с настоящим изобретением, могут использоваться для визуализации участков в теле, относящемся к млекопитающим. В соответствии с этим изобретением, агенты получения изображений назначаются любым способом, известным специалистам. Например, назначение может быть в виде отдельной единицы дозы, вводимой инъекцией. Любой из общеизвестных носителей, известных специалистам, такие как стерильный раствор соли или плазма, могут использоваться после мечения радиоактивным изотопом для приготовления сложных соединений настоящего изобретения для инъекции. Вообще, назначаемая единичная доза имеет радиоактивность от приблизительно 0.01 мКи до приблизительно 300 мКи, предпочтительно от 10 мКи до приблизительно 200 мКи. Раствор, который будет введен в единичной дозе, имеет объем от приблизительно 0.01 мл до приблизительно 10 мл.
После внутривенного назначения диагностически эффективного количества состава настоящего изобретения может быть выполнено изображение. Получение изображения участка в пределах субъекта, такого как орган или новообразование, может быть произведено желательно через часы или еще дольше после того, как меченный радиоактивным изотопом реактив введен пациенту. В большинстве случаев достаточное количество назначенной дозы накопится в области, которая будет изображена, в промежутке приблизительно 0.1 часа. Как было сказано выше, изображение может быть выполнено, используя любой способ, известный специалистам. Примеры включают PET, SPECT и гамма-сцинтиграфию. В гамма-сцинтиграфии меченым радиоактивным изотопом является радионуклид, испускающий гамма-излучение, и определение расположения радиоактивной метки происходит с помощью гамма радиоактивной камеры обнаружения. Изображенный участок можно обнаружить благодаря тому, что радиоактивная метка выбирается или расположена в патологическом участке (называется положительным контрастом) или, альтернативно, радиоактивная метка выбирается специфически нелокализованной в таких патологических участках (называется рассеивающим контрастом).
Н. Комплекты
Определенные воплощения настоящего изобретения вообще касаются комплектов для приготовления агента получения изображения или диагностического агента. Например, в некоторых воплощениях комплект включает одну или более герметичные емкости, которые содержат предопределенное количество сложного соединения хелатор-направленный лиганд. В некоторых воплощениях комплект далее включает герметичный контейнер, содержащий ионы металла. Например, ион металла может быть радионуклидом или холодным ионом металла.
Комплект настоящего изобретения может включать герметичную емкость, содержащую предопределенное количество хелатора по настоящему изобретению и достаточное количество восстанавливающего агента, чтобы метить сложное соединение ионом металла. В некоторых воплощениях настоящего изобретения комплект включает ион металла, который является радионуклидом. В определенных дальнейших воплощениях радионуклидом является99mТc. В дальнейших воплощениях настоящего изобретения хелатор соединен с направленным лигандом, который может быть любым из направленных лигандов, обсужденных нами ранее.
Комплект может также содержать необходимые фармацевтические дополнительные материалы, такие как, например, фармацевтически приемлемые соли, чтобы регулировать осмотическое давление, буферы, консервирующие средства и т.п.
В определенных воплощениях в состав включают антиоксидант, чтобы предотвратить окисление частицы хелатора. В определенных воплощениях антиоксидантом является витамин С (аскорбиновая кислота). Однако было рассмотрено, что любой другой антиоксидант, известный специалистам, такой как токоферол, пиридоксин, тиамин или рутин, может также использоваться. Компоненты комплекта могут быть жидкими, замороженными или в сухом виде. В предпочтительном воплощении компоненты комплекта предоставляются в лиофилизированной форме.
Холодный (то есть содержащий нерадиоактивные компоненты) не требующий длительного приготовления комплект является коммерческим изделием. Холодный мгновенный комплект может выполнить радиодиагностичекую цель, если добавить пер-технетат в емкость с API и наполнителями (агенты, которые еще не тестировались). Технология известна специалистам, как способ "взбалтывания и взрыва". Время для подготовки радиоактивных медицинских препаратов должно быть меньше 15 мин. Тот же самый комплект мог также включать хелаторы или сложные соединения хелатор-направленный лиганд, которые могли быть хелированы с различными металлами для различных применений получения изображений. Например, медь-61 (полураспад 3.3-часа) для PET; гадолиний для МРТ. Сам холодный комплект может использоваться в качестве пропрепарата при лечении заболевания. Например, комплект может применяться в тканеспецифическом направленном получении изображения и терапии.
I. Гиперпролиферативные заболевания
Определенные аспекты настоящего изобретения рассматривают составы, где терапевтическая частица соединена с хелатором настоящего изобретения. Когда ион металла хелируется с хелатором, или как с хелатором, так и с соединенным с ним направленным лигандом, состав настоящего изобретения в определенных воплощениях может использоваться для получения двойного изображения и в терапии. В определенных специфических воплощениях терапевтическая частица - это частица, которая является агентом, известным или предполагаемым, помогающим при лечении или предотвращении гиперпролиферативной болезни субъекта. Субъект может быть животным, таким как млекопитающее. В определенных специфических воплощениях субъект является человеком.
В других воплощениях настоящего изобретения ион металла является терапевтическим ионом металла (например, Re-188, Re-187, Re-186, Ho-166, Y-90, Sr-89 и Sm-153), и хелат хелатор-ион металла является терапевтическим агентом (а не агентом получения изображений), который может быть применен при лечении или предотвращении гиперпролиферативной болезни.
Гиперпролиферативная болезнь здесь определена как любая болезнь, связанная с неправильным ростом клетки или неправильным оборотом клетки. Например, гиперпролиферативная болезнь может быть раком. Термин "рак", используемый здесь, определяется как нерегулируемый и прогрессивный рост клеток в ткани. Специалисту известно, что существуют другие синонимичные термины, такие как неоплазма или злокачественность или новообразование. Любой тип рака рассматривается при лечении способами настоящего изобретения. Например, рак может быть раком молочной железы, раком легкого, раком яичников, раком мозга, раком печени, цервикальным раком, раком толстой кишки, раком почки, раком кожи, раком головы и шеи, раком кости, раком, относящимся к пищеводу, раком мочевого пузыря, раком матки, раком живота, панкреатическим раком, тестикулярным раком, лимфомой или лейкозом. В других воплощениях настоящего изобретения рак является метастатическим раком.
J. Двойная химиотерапия и лучевая терапия (радиохимиотерапия)
В определенных воплощениях настоящего изобретения соединения настоящего изобретения являются подходящими для двойной химиотерапии и лучевой терапии (радиохимиотерапия). Например, хелатор, как было сформулировано здесь, может быть хелирован с ионом металла, который является терапевтическим ионом металла, так же как направленный лиганд может является терапевтической частицей (такой, как противораковая частица). В другом примере терапевтический ион металла может быть хелирован как с хелатором, так и с его соединением с направленным лигандом.
Например, ион металла может быть бета-излучателем. Как здесь было определено, бета-излучателем является любой агент, который испускает бета-энергию любого диапазона. Примеры бета-излучателей включают Re-188, Re-187, Re-186, Ho-166, Y-90 и Sn-153. Специалисты знакомы с этими агентами, использующимися при лечении гиперпролиферативной болезни, такой как рак.
Специалисты знакомы с оформлением химиотерапевтических протоколов и протоколов лучевой терапии, которые могут быть применены при назначении составов настоящего изобретения. Как было сформулировано ниже, эти агенты могут использоваться в комбинации с другими терапевтическими способами, направленными на лечение гиперпролиферативной болезни, такой как рак. Кроме того, специалисты знакомы с подбором соответствующей дозы для назначения к субъекту. Протокол может включать единственную дозу или многократные дозы. Пациент должен быть проверен на токсичность и реакцию на лечение, используя протоколы, знакомые специалистам.
К. Фармацевтические препараты
Фармацевтические соединения настоящего изобретения включают терапевтически или диагностически эффективное количество состава настоящего изобретения. Фразы "фармацевтически или фармакологически приемлемый", или "терапевтически эффективный", или " диагностически эффективный" относятся к молекулярным объектам и составам, которые не вызывают неблагоприятную, аллергическую или другую неблагоприятную реакцию при их назначении животному, такому как, например, человек. Приготовление терапевтически эффективных или диагностически эффективных составов будет понятно специалистам в свете настоящего раскрытия изобретения, как иллюстрируется в Фармацевтических науках Ремингтона, 18-я Ed. Mark Printing Company, 1990, включена здесь ссылкой. Кроме того, при назначении животному (например, человеку) имеется в виду, что препараты должны быть стерильными, пожаробезопасными, соответствовать общей безопасности и стандартам чистоты, как требует Департамент биологических стандартов FDA.
Используемое здесь понятие "состав, включающий терапевтически эффективное количество" или "состав, включающий диагностически эффективное количество", подразумевает любой и все растворители, дисперсионную среду, покрытия, поверхностно-активные вещества, антиоксиданты, консервирующие средства (например, антибактериальные агенты, противогрибковые агенты), изотонические агенты, агенты, задерживающие поглощение, соли, консервирующие средства, лекарственные средства, стабилизаторы лекарственных средств, гели, связующие компоненты, наполнители, агенты измельчения, смазки, подслащивающие агенты, корригенты, красители, им подобные материалы и их комбинации, известные специалистам. Кроме того, поскольку любой обычный курьер является совместимым с активным ингредиентом, его использование в существующих составах предусмотрено.
Сложные соединения настоящего изобретения могут включать различные типы курьеров в зависимости от того, назначены ли препараты в твердом, жидком виде или в форме аэрозоля, и необходима ли стерильность для такого способа назначения, как инъекция. Составы настоящего изобретения могут быть назначены внутривенно, внутрикожно, внутриартериально, внутрибрюшинно, внутриочагово, интракраниально, внутрисуставно, интрапростатикально, интраплеврально, интратрахеально, интраназально, интравитреально, интравагинально, внутриректально, местно, внутриопухолево, внутримышечно, внутрибрюшинно, подкожно, подконъюнктивально, интравезикулярно, через слизистую оболочку, внутриперикардиально, интраумбилекально, внутриглазно, орально, локально, инъекцией, вливанием, непрерывным вливанием, локализованной перфузией, омывающей непосредственно клетки-мишень, через катетер, через промывание, в липидных составах (например, липосомы) или другим способом или любой комбинацией предыдущих способов, известных специалистам.
Фактическое необходимое количество состава настоящего изобретения, назначенное пациенту, может определяться физическими и физиологическими факторами, такими как масса тела, серьезность состояния, ткань, которая будет изображена, тип заболевания, которое лечат, предыдущие или параллельно получаемые изображения или терапевтические вмешательства, болезнь неясного происхождения пациента и путь назначения. Практик, ответственный за назначение, в любом случае определит концентрацию активного ингредиента(ов) в составе и приспособит дозу(ы) для индивидуального субъекта.
В определенных воплощениях фармацевтические соединения могут включать, например, по крайней мере приблизительно 0,1% хелата хелаторион металла. В других воплощениях активное соединение может включать от приблизительно 2% до приблизительно 75% от веса единицы, или от приблизительно 25% до приблизительно 60%, например, и в любом получаемом диапазоне. В других неограничивающих примерах доза может также включать от приблизительно 0,1 мг/кг/массы тела до приблизительно 1000 мг/кг/массы тела или любое количество в пределах этого диапазона, или любое количество, большее чем 1000 мг/кг/массы тела на назначение.
В любом случае, состав может включать различные антиоксиданты для замедления окисления одного или более компонентов. Дополнительно, для предотвращения действия микроорганизмов могут быть использованы консервирующие средства, такие как различные антибактериальные и противогрибковые агенты, включая, но не ограничиваясь, парабены (например, метилпарабены, пропилпарабены), хлорбутанол, фенол, сорбиновая кислота, тимерозал или их комбинации.
Сложные соединения настоящего изобретения могут формулироваться со свободным основанием, нейтральными или в форме соли. Фармацевтически приемлемые соли включают соли, сформированные со свободными карбоксильными группами, полученными из неорганических оснований, таких как, например, натрий, калий, аммоний, кальций или гидрооксиды железа; или таких органических оснований, как изопропиламин, триметиламин, гистидин или прокаин.
В воплощениях, где состав находится в жидкой форме, курьер может быть растворителем или включением дисперсионной среды, неограничивающие примеры включают воду, этиловый спирт, полиол (например, глицерин, гликоль пропилена, жидкую гликоль полиэтилена и т.д.), липиды (например, триглицериды, растительные масла, липосомы) и их комбинации. Необходимая текучесть может быть получена, например, при помощи покрытия, такого как лецитин; получением частицы необходимого размера с помощью дисперсии курьеров, таких как, например, жидкий полиол или липиды; при помощи поверхностно-активных веществ, такие как, например, гидроксипропилцеллюлоза; или комбинацией этих способов. Во многих случаях желательно включать в состав изотонические агенты, такие как, например, сахар, хлористый натрий или их комбинацию.
Стерильно вводимые растворы могут быть приготовлены, используя такие способы, как очищающая стерилизация. Вообще, дисперсии готовятся включением различных стерилизованных активных ингредиентов в стерильный носитель, который содержит основную дисперсионную среду и/или другие ингредиенты. В случае стерильных порошков для приготовления стерильных вводимых инъекцией растворов, суспензий или эмульсии предпочтительными способами приготовления является вакуумная сушка или технология сушки холодом, которые позволяют получить порошок активного ингредиента плюс любой дополнительный желательный ингредиент из его предварительно стерильно фильтрованной жидкой среды. Жидкая среда должна быть соответственно буферизована в случае необходимости, и жидкий растворитель сначала приводят в изотоническое состояние до инъекции с достаточным количеством соли или глюкозы. Также рассматривается подготовка составов высокой концентрации для прямой инъекции, когда предполагается использование DMSO (диметилсульфоксида) в качестве растворителя, чтобы привести к чрезвычайно быстрому проникновению, снабжая малую область активными агентами высокой концентрации.
Состав должен быть устойчивым в условиях производства и хранения и защищен от загрязнения микроорганизмами, такими как бактерии и грибы. Важно, чтобы загрязнение эндотоксина было минимально, на безопасном уровне, например меньше чем 0.5 нг/мг белка.
В специфических воплощениях, продленное поглощение вводимого инъекцией состава может быть вызвано использованием в составах агентов, задерживающих поглощение, таких как, например, моностеарат алюминия, желатин или их комбинации.
L. Комбинационная терапия
Определенные аспекты настоящего изобретения относятся к составам, включающим хелатор, который соединен с направленным лигандом, который является терапевтической частицей. В других воплощениях хелатор включает аминокислотную последовательность, что является терапевтической аминокислотной последовательностью.
Эти соединения могут применяться при лечении заболеваний, таких как рак и сердечно-сосудистые заболевания, наряду с другим агентом или способом терапии. Лечение составами настоящего изобретения может предшествовать другому способу терапии или следовать за ним, с интервалами в пределах от минут до недель. В воплощениях, где назначен другой агент, желательно не делать большой промежуток между временем каждой доставки агента, так чтобы агенты могли проявить полезный комбинированный эффект на клетку. Например, было рассмотрено, что могут быть назначены две, три или более дозы одного агента в основном одновременно (то есть в пределах менее приблизительно минуты) с составами настоящего изобретения. В других аспектах, терапевтический агент или способ могут быть назначены в течение от приблизительно 1 минуты до приблизительно 48 часов или более до и/или после назначения терапевтического количества состава настоящего изобретения, или до и/или после любого количества времени, не установленного здесь. В других воплощениях состав настоящего изобретения может быть назначен от приблизительно 1 дня до приблизительно 21 дня до и/или после назначения другого терапевтического способа, такого как хирургическое вмешательство или генная терапия. Иногда может быть желательно значительно увеличить период времени для лечения, тогда между соответствующими назначениями проходят несколько недель (например, приблизительно 1-8 недель или больше).
Могут использоваться различные комбинации, как демонстрируется ниже, где соединение настоящего изобретения обозначается "А", вторичный агент, который может быть любым другим терапевтическим агентом или способом, обозначается "В":
А/В/А В/А/В В/В/А А/А/В А/В/В В/А/А А/В/В/В В/А/В/В
В/В/В/А В/В/А/В А/А/В/В А/В/А/В А/В/В/А В/В/А/А
В/А/В/А В/А/А/В А/А/А/В В/А/А/А А/В/А/А А/А/В/А
Назначение составов настоящего изобретения пациенту будет следовать за общими протоколами назначения химиотерапии, принимая во внимание токсичность этих агентов, если она имеется. Ожидается, что циклы лечения будут повторены по мере необходимости. Было рассмотрено, что различные стандартные терапии, а также хирургическое вмешательство могут быть применены в комбинации с описанным агентом. Эти терапии включают, но не ограничиваются дополнительное медикаментозное лечение (такое как химиотерапия при раке), дополнительную радиотерапию, иммунотерапию, генотерапию и хирургию.
1. Химиотерапия
Терапии рака также включают различные комбинации терапии как с химическим веществом, так и с лечением, основанным на радиации. Комбинации химиотерапии включают, например, цисплатин (CDDP), карбоплатин, прокарбазин, мехлортамин, циклофосфамид, камптотецин, ифосфамид, мелфалан, хлорамбуцил, бусульфан, нитрозмочевина, дактиномицин, даунорубицин, доксорубицин, блеомицин, пликомицин, митомицин, этопосид (VP 16), тамоксифен, ралоксифен, связующие агенты рецептора эстрогена, таксол, гемцитабин, навелбин, ингибиторы тансферазы фарнесил-белка, трансплатинум, 5-фторурацил, винкристин, винбластин и метотрексат, или их любой аналог или производный вариант.
2. Радиотерапия
Другие факторы, которые разрушают ДНК и используются экстенсивно, включают то, что обычно известно как гамма-лучи, рентгеновские лучи и/или направленная поставка радиоизотопов к клеткам новообразования. Другие формы разрушения ДНК также рассматриваются, например микроволны и ультрафиолетовая радиация. Наиболее вероятно, что все эти факторы приводят к широкому диапазону повреждений ДНК, предшественников ДНК, репликаций и репараций ДНК, набору и сохранению хромосом. Диапазон дозировки для рентгеновских лучей располагается от ежедневных доз 50-200 рентген для длительных промежутков времени (3-4 недели), до отдельных доз 2000-6000 рентген. Диапазоны дозировок для радиоизотопов изменяются широко и зависят от времени полураспада изотопа, силы и типа испускаемой радиации и восприимчивости клеток, относящихся к новообразованию. Используемые здесь термины "контактирующий" и "подверженный действию", когда относятся к клетке, используются для описания процесса, с помощью которого терапевтическая конструкция и химиотерапевтический или радиотерапевтический агент доставляются в клетку мишень или размещаются в непосредственном соприкосновении с клеткой мишенью. Для достижения уничтожения клетки или стаза оба агента доставляются в клетку в комбинированном эффективном количестве для уничтожения клетки или препятствия ее деления.
3. Иммунотерапия
Иммунотерапия, вообще, опирается на использование иммунного эффектора клеток и молекул, чтобы иметь целью и разрушать раковые клетки. Иммунный эффектор может быть, например, антителом, специфичным для некоторого маркера на поверхности клетки новообразования. Антитело одно может служить эффектором терапии или оно может вербовать другие клетки для фактического эффекта уничтожения клетки. Антитело также может быть соединено с лекарственным препаратом или токсином (химиотерапевтическим, радионуклеотидом, цепью рицина А, токсином холеры, токсином коклюша и т.д.) и служить просто как направленный агент. Альтернативно, эффектор может быть лимфоцитом, несущим поверхностную молекулу, которая взаимодействует прямо или косвенно с мишенью клетки новообразования. Различные клетки эффектора включают цитостатические Т-лимфоциты и НК клетки.
Иммунотерапия, таким образом, может использоваться как часть комбинированной терапии в соединении с генотерапией. Общий подход для комбинированной терапии обсужден ниже. Обычно клетка новообразования должна нести некоторый маркер, который является поддающимся наведению, то есть не представлен в большинстве других клеток. Существует много маркеров новообразования, и любой из них может быть подходящим для нацеливания в контексте настоящего изобретения. Общие маркеры новообразования включают канцероэмбриональный антиген, специфический антиген простаты, связывающий антиген мочевого новообразования, эмбриональный антиген, тиросиназа (р97), gp68, TAG-72, HMFG, антиген Сиалила Льюиса, MucA, MucB, PLAP, рецептор эстрогена, рецептор ламинина, erb В и р155.
4. Гены
В еще одном воплощении вторичным лечением является генотерапия, в которой терапевтический состав назначается до, после или одновременно с терапевтическими агентами настоящего изобретения. Доставка терапевтического количества состава настоящего изобретения в соединении с вектором, кодирующим генный продукт, будет иметь комбинированный антигиперпролиферативный эффект на ткани мишени.
5. Хирургия
Приблизительно 60% людей с раковым заболеванием подвергаются хирургическому вмешательству некоторого типа, которое бывает профилактическим, диагностическим или определяющим стадию заболевания, лечебным и временно облегчающим. Лечебная хирургия является лечением рака, которая может использоваться в соединении с другими видами терапии, такими как лечение по настоящему изобретению, химиотерапией, радиотерапией, гормональной терапией, генной терапией, иммунотерапией и/или альтернативными видами терапии. Лечебная хирургия включает резекцию, в которой вся или часть злокачественной ткани физически удаляются, вырезаются и/или разрушаются. Резекция новообразования относится к физическому удалению по крайней мере части новообразования. В дополнение к резекции новообразования лечение хирургией включает лазерную хирургию, криохирургию, электрохирургию и хирургические вмешательства под контролем микроскопа (хирургия по Mohs). Далее рассматривается, что существующее изобретение может использоваться в соединении с удалением поверхностных раковых образований, предраковых образований или случайных количеств нормальной ткани.
М. Другие воплощения настоящего изобретения
В одном аспекте существующее изобретение в основном рассматривает способ синтезирования хелатора, такого как ЕС, включающего по крайней мере три функциональные группы, способ, включающий получение хелатора, а также:
(a) защиту по крайней мере одной первой функциональной группы хелатора с помощью первого защитного агента для получения первично защищенного хелатора;
или
(b) хелирование хелатора с ионом металла для получения хелатора, меченного ионом металла.
Любой способ описанного здесь синтеза, такого как этот, может происходить в органической среде, как описано здесь. Способ может далее включать по крайней мере один шаг очистки, как было описано здесь. Хелаторы, функциональные группы, ионы металла, способы хелатообразования и сложное соединение, которое может использовано в способах настоящего изобретения, знакомы специалистам и описаны здесь. Хелатор может далее включать спейсер, как описано здесь, такой как этилен. Такие хелаторы являются полезными промежуточными звеньями для приготовления сложного соединения хелатор-направленный лиганд.
В некоторых воплощениях способ включает защиту по крайней мере одной первой функциональной группы хелатора с помощью первого защитного агента для получения первично защищенного хелатора. В определенных воплощениях первая функциональная группа является тиольной функциональной группой. В определенных воплощениях первый защитный агент является защитным агентом тиола. В дальнейших воплощениях защитный агент тиола выбирается из группы, состоящей из галида алкила, галида бензила, галида бензоила, галида сульфонила, галида трифенилметила, галида метокситрифенилметила и цистеина.
В некоторых воплощениях способ может включать защиту второй функциональной группы с помощью второго защитного агента, чтобы получить вторично защищенный хелатор. В определенных воплощениях первая функциональная группа включает по крайней мере одну тиольную функциональную группу, и вторая функциональная группа включает по крайней мере одну аминную функциональную группу. В некоторых воплощениях, тиольная функциональная группа является первично защищенной защитным агентом тиола и затем аминная функциональная группа защищена защитным агентом амина. В дальнейших воплощениях защитный агент амина выбирают из группы, состоящей из бензилхлороформата,p-нитро-хлоробензилформата, этилхлороформата, дитертбутилдикарбоната, трифенилметил хлорида и метокситрифенилметил хлорида.
Примером хелатора, который может быть приготовлен, является этилендицистеин, где две тиольные группы этилендицистеина защищены двумя эквивалентами защитного агента тиола, что следует за защитой двух аминных групп этилендицистеина двумя эквивалентами защищитного агента амина. С этих пор тиольные группы являются более реактивными, чем аминные группы, тиольные группы обычно защищаются прежде, чем аминные группы.
В других воплощениях способ далее включает удаление одной или более защитных групп из любого описанного здесь состава, включающего одну или более защитных групп. 3ащитные группы могут быть удалены, например, из частицы хелатора, частицы направленного лиганда или обеих частиц за один или более шагов до или после того, как сложное соединение хелатор-направленный лиганд хелировано с ионом металла, как было описано. Защитные группы описаны здесь более подробно, включая их установку и удаление.
Любой состав настоящего изобретения может быть очищен любым способом, известным специалистам. Способы очистки описаны здесь более подробно. В некоторых воплощениях первично защищенный хелатор является чистым от приблизительно 90% до приблизительно 99,9%. В некоторых воплощениях вторично защищенный хелатор является чистым от приблизительно 90% до приблизительно 99,9%.
В некоторых воплощениях способы настоящего изобретения далее включают соединение хелатора с направленным лигандом, где направленный лиганд и/или хелатор включают по крайней мере одну функциональную группу для формирования сложного соединения хелатор-направленный лиганд. В некоторых воплощениях функциональная группа направленного лиганда защищена по крайней мере одним защитным агентом до соединения с хелатором. В некоторых воплощениях по крайней мере одна функциональная группа является функциональной группой карбоксильной кислоты. В некоторых воплощениях функциональные группы хелатора и направленного лиганда вместе формируют хелат. Хелатообразование иона металла с хелатором может производиться любым способом, известным специалистам.
Сложное соединение хелатор-направленный лиганд настоящего изобретения может далее включать линкер между хелатором и направленным лигандом, как было описано. Упомяналось, что направленный лиганд может быть любого типа, известного специалистам, и подобные направленные лиганды были обсуждены нами более подробно ранее.
Другие общие аспекты настоящего изобретения рассматривают способ синтезирования сложного соединения меченый ион металла-хелатор-направленный лиганд, включающего:
(a) получение защищенного хелатора, включающего по крайней мере три функциональные группы, защищенные по крайней мере одним защитным агентом;
(b) соединение защищенного хелатора с направленным лигандом для получения сложного соединения хелатор-направленный лиганд;
(c) удаление по крайней мере одной защитной группы из сложного соединения хелатор-направленный лиганд;
(d) хелирование иона металла с хелатором сложного соединения хелатор-направленный лиганд; и
(e) удаление любых оставшихся защитных групп.
Хелатор, защитные агенты, функциональные группы, способ соединения, направленный лиганд, способ удаления защитной группы, способ хелатообразования и ион металла могут быть любого описанного здесь типа. Способ может быть осуществлен в органической среде, как было описано здесь. Способ может включать один или более шагов очистки, как было описано здесь. В некоторых воплощениях по крайней мере одна функциональная группа направленного лиганда защищена по крайней мере одним защитным агентом до соединения. В привилегированных воплощениях три или четыре атома хелатора доступны для хелатообразования. Другие общие аспекты настоящего изобретения рассматривают способ синтезирования сложного соединения меченый ион металла-хелатор-направленный лиганд, включающий:
(a) получение хелатора, включающего по крайней мере три функциональные группы;
(b) хелирование иона металла с хелатором, чтобы получить меченный ионом металла-хелатор;
(c) соединение меченного ионом металла-хелатора с направленным лигандом.
Хелатор, функциональные группы, способ соединения, направленный лиганд, способ хелатообразования и ион металла могут быть любого описанного здесь типа. Способ может осуществляться в органической среде, как было описано здесь. Способ может включать один или более шагов очистки, как было описано здесь. В некоторых воплощениях по крайней мере одна функциональная группа направленного лиганда защищена до соединения по крайней мере одним защитным агентом. Способ может далее включать удаление всех защитных групп из сложного соединения меченый ион металла-хелатор-направленный лиганд. Способ также рассматривает в определенных воплощениях, что по крайней мере одна функциональная группа направленного лиганда защищена до соединения по крайней мере одним защитным агентом.
Существующее изобретение также рассматривает комплекты для приготовления агента получения изображений, химиотерапевтического агента или радио/химиотерапевтического агента, включающие один или более герметичные емкости и предопределенное количество любого описанного здесь состава в одной или большем количестве герметичных емкостей. Существующее изобретение также рассматривает в некоторых воплощениях агент получения изображений, химиотерапевтический или радио/химиотерапевтический агент, включающие любой описанный здесь состав.
В некоторых воплощениях, существующее изобретение рассматривает способ получения изображений или лечения субъекта, включая назначение субъекту фармацевтически эффективного количества любого описанного здесь состава. Субъект может быть млекопитающим, таким как человек.
N. Способы диагноза, лечения или получения изображений субъекта с выявленным или предполагаемым заболеванием сердца
Воплощения настоящего изобретения также рассматривают способы диагноза, лечения или получения изображений субъекта с выявленным или предполагаемым заболеванием сердца. Субъект может быть любым субъектом, таким как млекопитающее или разновидность птиц. Млекопитающее, например, может быть собакой, котом, крысой, мышью или человеком. В привилегированных воплощениях субъект является человеком с выявленным или предполагаемым сердечно-сосудистым заболеванием.
Сердечно-сосудистое заболевание может быть любым заболеванием сердца или кровеносного сосуда. Кровеносный сосуд может быть коронарным сосудом или может быть другим сосудом, не коронарным. Сосуд может быть артерией, веной, мелкой артерией, венулой или капилляром.
Примеры сердечно-сосудистых заболеваний включают болезни сердца, такие как инфаркт миокарда, миокардиальная ишемия, стенокардия, застойная сердечная недостаточность, кардиомиопатия (врожденная или приобретенная), аритмия или порок клапана сердца. В специфических воплощениях у субъекта выявлена или предполагается миокардиальная ишемия.
Субъект, например, может быть пациентом, который представляет клинике признаки или симптомы, наводящие на предположение наличия у него миокардиальной ишемии или инфаркта миокарда. Получение изображения сердца субъекта для диагностирования заболевания может включать назначение субъекту фармацевтически эффективного количества сложного соединения меченый ион металла-хелатор-направленный лиганд, синтезированного с использованием любого сформулированного здесь способа. Получение изображения может быть выполнено, используя любой способ получения изображений, известный специалистам. В специфических воплощениях получение изображения включает использование технологии получения изображений на основе радионуклида, такой как PET или SPECT. В специфических воплощениях сложным соединением меченый ион металла-хелатор-направленный лиганд является 99m-Тс-ЕС-глюкозамином. Глюкозамин активно поглощается жизнеспособной миокардиальной тканью. Области ишемизированного миокарда поглощают глюкозамин меньше или не поглощают. Серьезность ишемии может быть визуально оценена в зависимости от величины измеренного сигнала, используя любой способ, известный специалистам. В некоторых воплощениях получение изображения, используя любое из соединений, сформулированных здесь, выполняется до, во время или после получения изображений сердца, используя второй способ получения изображений. Например, второй способ получения изображений может быть сцинтиграфия таллием.
Миокардиальная перфузия SPECT (MPS) состоит из комбинации воздействия нагрузки (упражнения или фармакологическая) и отдыха, назначения нагрузки и получение изображения радиоактивных медицинских препаратов. Таллий имеет превосходные физиологические свойства для получения изображений миокардиальной перфузии. В течение первого прохождения по венечному кровообращению таллий был высокоэкстрагирован и была показана линейная зависимость между кровотоком по жизнеспособному миокарду и восприимчивостью таллия; однако при очень высоких уровнях потока в восприимчивости происходит эффект скатывания. Как освобожденный аналог калия, таллий перераспределяется в течение долгого времени. Его начальное распределение пропорционально региональной миокардиальной перфузии, и в равновесии распределение таллия является пропорциональным региональному скоплению калия, показывающего жизнеспособный миокард. Механизмы перераспределения таллия являются дифференциальными нормами провала между недостаточно снабжаемым кровью, но жизнеспособным миокардом, и нормальными зонами, и размыто - к первоначально недостаточно снабжаемым кровью зонам. Норма провала таллия является градиентом концентрации между миокардиальной клеткой и кровью. Коэффициет очищения крови от таллия после отдыха или низкого уровня нагрузки инъекцией является более медленным. Рассеянные медленные нормы провала, подражающие диффузной ишемии, могут наблюдаться у нормальных пациентов, которые не достигают адекватных уровней нагрузки. Гиперинсуленемические состояния замедляют перераспределение, приводя к недооценке жизнеспособного миокарда; таким образом, рекомендуется не принимать пищу до 4 часов после инъекции таллия. Поэтому, если EC-G используется как жизнеспособный агент в комбинации с таллием, он будет нацелен точно в жизнеспособную область (Angello и др., 1987; Gutman и др., 1983; Pohost и др., 1977).
Получение изображений, используя любые сложные соединения меченый ион металла-хелатор-направленный лиганд настоящего изобретения, может также быть выполнено в соединении с другими диагностическими способами, такими как измерение сердечных изозимов или сердечного зондирования. Получение изображений может быть выполнено в различных интервалах после появления симптомов, или может быть выполнено для оценки изменений миокардиальной перфузии в течение долгого времени.
О. Примеры
Следующие примеры включены для демонстрирации определенных неограничивающих аспектов изобретения. Специалисты смогут оценить, что способы, раскрытые в следующих далее примерах, обнаруженные изобретателем, хорошо функционируют на практике. Однако специалисты в свете настоящего раскрытия должны оценить, что могут быть сделаны множество изменений в определенных раскрытых воплощениях, при которых можно получить похожий или подобный результат, не отступая от духа и охвата изобретения.
Следующие фигуры, химические структуры и синтетические элементы обеспечивают определенные соединения настоящего изобретения.
Пример 1
Неограничивающий пример органического синтеза N,N-этилендицистеин-глюкозамин (EC-G). См. Фиг.1
Шаг 1: Синтез S,S'-бис-бензил-N,N'-этилендицистеин (Bz-EC)
Цистеин-HCl (30 г) был растворен в воде (100 мл). В раствор был добавлен 37%-ный формальдегид (22,3 мл), и реакционная смесь была быстро перемешена при комнатной температуре. Затем был добавлен пиридин (25 мл) и сформирован осадок. Кристаллы были отделены и промыты этиловым спиртом (50 мл), затем фильтровались воронкой Бюхнера. Кристаллы были растерты в порошок с петролейным эфиром (150 мл), снова отфильтрованы и высушены. Предшественник L-тиазолидин-4-карбоновая кислота (точка плавления 195°C, сообщенная 196-197°C) весил 23,408 г. Предшественник (22 г) был растворен в жидком аммиаке (200 мл) и нагрет в колбе с обратным холодильником. Был добавлен металл натрий, пока не появился постоянный синий цвет в течение 15 мин. К синему раствору был добавлен нашатырный спирт, растворители были испарены до степени высушивания. Остаток был растворен в воде (200 мл), и рН был доведен до 2 концентрированной НСl. Сформировался осадок, он был отфильтрован и промыт водой (500 мл). Твердое вещество было высушено в дессикаторе хлорида кальция. Затем был приготовлен ЕС 10,7 г (точка плавления 237°C, сообщенная 251-253°C). Структура ЕС была подтверждена H-I и С-13 ЯМР. ЕС (2,684 г, 10 ммоль) был растворен в IN NaOH (40 мл). Хлорид бензила (5,063 г, 40 ммоль) был растворен в диоксане (30 мл) и перемешан. Реакция размешивалась 30 мин. РН фактор раствора был доведен до 2 с помощью концентрированной НСl. Осадок был отфильтрован и промыт водой, и рекристаллизован из трифторуксусной кислоты, выход продукции 79,0% (3,5454 г), точка плавления 227-229°C (дек.) (сообщенная 229-230°C). Структура Bz-EC была подтверждена H-I и С-13 ЯМР.
Шаг 2: Синтез S,S'-бис-бензил-N,N'-бис-СВZ этилендицистеин (Cbz-Bz-EC)
Bz-EC (2,243 г, 5 ммоль) был растворен в растворе карбоната натрия (1,20 г, 11,2 ммоль), и рН фактор был доведен до 10, используя IN NaOH. Заключительный объем жидкости был 30 мл. Хлороформат бензила (233 мл, 16,5 ммоль) был растворен в диоксане (0,75 мл) и перемешан. РН фактор был доведен до 10 добавлением твердого Na2CO3. Смесь реакции перемешивалась в течение 2 часов и была экстрагирована диэтиловым эфиром, чтобы удалить лишний хлороформат бензила (CBZ). РН фактор водного слоя был доведен до 2 с помощью IN НС1 и экстрагирован ацетатом этила. Органический слой был высушен через сульфат магния, и растворитель был испарен. Остаток был хроматографирован на колонке силикагеля, элюирован СН2Сl2: уксусная кислота (99:1) в СН2 Сl2: метанол:уксусная кислота (94:5:1), чтобы произвести желаемый продукт 87,2% (3,127 г). Структура Cbz-Bz-EC была подтверждена H-I и С-13 ЯМР.
Шаг 3: Синтез S,S'-бис-бензил-N,N'-бис-СВ2 этилендицистеин-глюкозамин (тетра ацетат) соединения (Cbz-Bz-EC-G-4-Ac)
В колбу с перемешиваемым дихлорметаном (22 мл) был добавлен Cbz-Bz-EC (2,1467 г, 3 ммоль). После этого были добавлены дициклогексилкарбодиимид (DCC) (2,476 г, 12 ммоль) и диметиламинопиридин (1,466 г, 12 ммоль). Гидрохлорид глюкозамина тетраацетилированный (2,533 г, 6,6 ммоль) (4-Ac-G-HCl) (производства Oakwood Products Inc, Западная Колумбия, штат Южная Каролина) был добавлен к смеси и перемешан до полного растворения. Структура 4-Ac-G-HCl была подтверждена H-I и С-13 ЯМР. Реакция была быстро перемешена при комнатной температуре. Была добавлена вода (0,5 мл), и твердое вещество было отфильтровано. Фильтрат был высушен через сульфат магния, и растворитель был испарен. Продукт был очищен хроматографией колонки силикагеля, используя дихлорометан:метанол:уксусная кислота (9,9:0:0,1) к 56,4:3:0,6 в качестве мобильной фазы. Изделие было изолировано, 66.4% выход продукта (2,7382 г). Н-1 и С-13 ЯМР Cbz-Bz-EC-G-4-Ac обеспечили подтверждение, а также и масс-спектрометрия.
Шаг 4: Синтез N,N'-этилендицистеин-глюкозамин (EC-G)
Cbz-Bz-EC-G-4-Ac (687,7 мг, 0.5 ммоль) был растворен в жидком аммиаке (20 мл), и были добавлены частицы натрия (223 мг, 10 ммоль). После добавления всего натрия смесь реакции выдержала темно-синий цвет в течение 20 минут. Медленно был добавлен нашатырный спирт (641,9 мг,12 ммоль), и раствор темно-синего цвета стал бесцветным. Жидкий аммиак был удален азотом. Остаточное твердое вещество было растворено в воде и быстро диализировано, используя MW <500. Неочищенный продукт был взвешан 206,7 мг (выход: 70%). Н-1 и С-13 ЯМР неочищенного соединения EC-G бис-ацетилированного были получены наряду с массовыми спектрами. Молекулярный ион был 861, который содержит матрицу 187 и материнский ион 674 (EC-G бис-ацетилированный). Главный ион (100%) был 656, который был из потерь воды. Соединение EC-G бис-ацетилированный (200 мг) далее было очищено путем растворения в карбонате натрия и перемешивания в течение 2 часов. Продукт EC-G был затем лиофилизирован, приводя к весу 70 мг. Затем были получены H-I ЯМР и С-13 ЯМР EC-G. С-13 ЯМР EC-G показал 16 главных углеродистых пиков. Массовые спектры EC-G были трудны для получения из-за его гидрофильности и его спутников, которые будут сохранены на массовой колонке спектрометрии. Однако соединение EC-G бис-ацетилированное является менее гидрофильным, чем EC-G; таким образом, массовые спектры EC-G бис-ацетилированного могли быть получены. Массовые спектры EC-G показали, что были малые примеси соединения EC-G бис-ацетилированного, происходящие из-за неполной процедуры гидролиза. H-I и С-13 ЯМР ЕС-G были близки к предположенным значениям EC-G. Хотя 10 углеродистых пиков предполагались для симметричной структуры EC-G, глюкозамин имеет 12 атомов углерода вместо 6, подсказывая, что глюкозамин имеет две конфигурации. Экспериментальные значения Н-1 ЯМР показали наличие нескольких различных профилей в отличие от предсказанных значений; однако экспериментальные значения С-13 ЯМР глюкозамина были близки к предсказанным значениям. Таким образом, оказалось, что EC-G имеет две конфигурации.
Пример 2
Неограничивающий пример органического синтеза Re-EC-G, используя Re-EC и защищенный глюкозамин. Смотри Фиг.2
187Re-EC-G использовался как стандарт для99mTс-ес благодаря подобию структуры и липофильности. Синтез холодного Re-EC-G показан на Фиг.2. К перемешиваемому раствору этанола были медленно добавлены маленькие чипсы металла натрия (144,8 мг, 6,3 ммоль), 10 мл этанола в 50 мл колбе под азотом. После того как металл натрия растворился, был добавлен ЕС (536,8 мг, 2,0 ммоль). Смесь реакции перемешивалась в течение 1 часа при комнатной температуре, чтобы сформировалась соль EC-Na. Был добавлен хлорид трифенилфосфин рений (RеОСl3(РРh3)2, 1,8329 г, 2,2 ммоль). Зеленый оливковый цвет RеОСl3(РРh3)2 изменился на темно-зеленый цвет. Смесь реакции перемешивалась в течение 1 часа и затем была рефлюксирована в течение 30 мин. Смесь реакции затем фильтровалась, а фильтрат был выпарен до сухого остатка, получая серо-фиолетовый порошок Re-EC (818,4 мг, 80%-ный выход продукта). Структура Re-EC была подтверждена H-I и С-13 ЯМР и масс-спектрометрией. Re имеет две изомерные молекулярные массы, которые равны 185 и 187. Это отчетливо показало наличие двух материнских ионов с соотношением 40:60.
К размешиваемому растворителю диметилформамид (4 мл) был добавлен Re-EC (116,9 мг, 0,25 ммоль), следом за ним 1,8-диазабицикло[5.4.0]ундек-7-эне (DBU) (150 мл, 1,0 ммоль). Затем был добавлен дициклогексилкарбодиимид (DCC) (123,8 мг, 0,6 ммоль). Смесь реакции перемешивалась в течение 1 часа. Был добавлен глюкозамин тетраацетилированный (4-Ac-G-HCl) (184,9 мг, 0,5 ммоль), и затем реакция была быстро перемешена при комнатной температуре. Была добавлена вода (1 мл), и реакция перемешивалась дополнительно в течение 1 часа при комнатной температуре. Смесь реакции была испарена при пониженном давлении. Была добавлена вода (5 мл), за ней следовал хлороформ (5 мл). Водный слой был отделен и лиофилизирован для получения неочищенного твердого вещества темно-коричневого цвета. Твердое вещество было очищено колончатой хроматографией, используя Sephadex G-50, чтобы получить холодный Re-EC-G (128,4 мг, 65%-ный выход продукта). Структура холодного Re-EC-G была подтверждена H-I и С-13 ЯМР и масс-спектрометрией. Снова Re-комплекс отчетливо показывал два материнских иона с соотношением 40:60.
Элементный анализ холодного Re-EC-G показал C2oH35N40i3ReS2 (С, Н, N) с расчетным значением С:30,41, Н:4,47, N:7,09; с найденным значением С:30,04, Н:4,93, N:6,09. H-I и С-13 ЯМР холодного Re-EC-G были подобны предсказанной спектрометрии ЯМР. EC-G (5 мг) был помечен """Те (пертехнетат) (1 мКи) в присутствии олова (II) хлорида (0.1 мг). Анализ HPLC показал, что холодный Re-EC-G имел время задержки подобное99mTc-EC-G.
Пример 3
Синтез EC-G в водной реакции, используя ЕС и глюкозамин
ЕС (107 мг, 0,4 ммоль) был растворен в NaHCO3 (IN, 12 мл). К этому бесцветному раствору были добавлены сульфо-N-гидроксисукцинимид (сульфо-NHS, 173,7 мг, 0,8 ммоль) и 1-этил-3-(3-диметиламинопропил) карбодиимид-НСl (EDAC) (Aldrich Chemical Со, Милуоки, Висконсин) (153,4 мг, 0,8 ммоль). Затем была добавлена соль гидрохлорида D-глюкозамина (Sigma Chemical Co., Сан-Луис, Миссури) (345 мг, 1,6 ммоль). РН фактор был измерен и равен 8. Смесь перемешивалась при комнатной температуре в течение 16 часов и затем была диализирована в течение 24 часов, используя молекулярную пористую мембрану Spectra/POR с частотой среза 500 (Spectrum Medical Industries Inc, Хьюстон, Техас). После диализа продукт фильтровался нейлоновым фильтром 0,45 мкм и затем был высушен сублимацией, используя лиофилизатор (Labconco, Канзас-Сити, Миссури). Сырой продукт был взвешен, и его вес составил 300-400 мг. H-I ЯМР EC-G показал подобные образцы; однако оказалось, что смесь не является чистой по сравнению с органическим EC-G. Элементный анализ показал, используя различные соотношения реакции между ЕС и глюкозамином, что чистота EC-G была 63-77%. Была использована жидкостная хромотография преп-HPLC (7,8 х 300 мм С-18 колонок, вода) (скорость потока: 0,5 мл/мин, 100%-ная вода, UV 235 нм) для очистки неочищенного продукта 180-240 мг (выход 60%). H-I и С-13 ЯМР EC-G после преп-НРЛС показали дополнительные пики, показывающие примеси в моно EC-G или ЕС-глюкозамине, сульфо-NHS и EDAC. Преп-HPLC очистка сырого EC-G привела к некоторому возрастанию химической чистоты; однако, если сырой EC-G был помечен99mТc в присутствии хлорида олова (II), большая, чем 95%-ная радиохимическая чистота99mTc-EC-G, может быть достигнута, используя глюконат как трансхелатор (как показано в радио-TLC и исследовании HPLC).
Пример 4
Исследование клеточной восприимчивости, сравнивая продукты, синтезированные водным способом и органическим способом
Для определения дальнейшей биологической активности EC-G были приготовлены пробы клеточной культуры в пробирке. Кратко, клеточная восприимчивость была определена в клетках новообразования (50 000 клеток/резервуар), выращенных с99mТс-EC-G (2 мкКи/резервуар) в различные интервалы времени. Исследование клеточной восприимчивости не показало никаких отмеченных различий между сырым (неочищенным) EC-G и преп-HPLC очищенным EC-G (Фиг.4). Исследования стабильности в пробирке были произведены, или используя клеточную культуру, или растворяя EC-G в воде. Происходило уменьшение клеточной восприимчивости99mTс-EC-G на 10-15% после 2-4 недель. Срок службы EC-G в воде оказался 17,26 дней. В естественных условиях исследования получения изображения не показали никаких отмеченных различий между EC-G, синтезированными водными и органическими реакциями.
Пример 5
Синтез холодного Re-EC-G. используя Re-EC и глюкозамин в водной реакции
Re-EC (255,8 мг, 0,5 ммоль) (из Примера 2) был растворен в NaOH (IN, 4,5 мл). В этот темно-фиолетового цвета раствор были добавлены сульфо-NHS (217,1 мг, 1 ммоль) и соль гидрохлорида D-глюкозамина (Sigma Chemical Co., Сент-Луис, Миссури) (431,3 мг, 2 ммоль). Затем был добавлен 1-этил-3-(3-диметиламинопропил)карбодиимид-НСl (EDAC) (Aldrich Chemical Co., Милуоки, Висконсин) (191,7 мг, 1 ммоль). РН фактор был больше, чем 8. Смесь перемешивалась при комнатной температуре в течение 16 часов. Смесь была диализирована в течение 24 часов, используя молекулярную пористую мембрану Spectra/POR с частотой среза 500 (Spectrum Medical IndusTpnes Inc, Хьюстон, Техас). После диализа продукт был отфильтрован и затем высушен сублимацией, используя лиофилизатор (Labconco, Канзас-Сити, Миссури). Неочищенный продукт был взвешен, и его вес составил 276 мг. H-I ЯМР водного Re-EC-G показал подобный рисунок; однако было доказательство наличия примесей по сравнению с органическим соединением Re-EC-G. Анализ HPLC органического холодного соединения Re-EC-G показал один пик на 272 нм; однако водный холодный Re-EC-G имел два пика. Один из пиков в водном холодном Re-EC-G соответствует органическому холодному соединению Re-EC-G (пики 12,216 и 12,375 соответственно). Оставшиеся пики были сульфо-NHS и другими незначительными примесями.
Пример 6
Количественный анализ глюкозамина (Активный фармацевтический ингредиент)
D-глюкозамин был извлечен для колориметрических пробирных анализов. Кратко, к раствору гидрохлорида D-глюкозамина (25 г, 0,12 моль) в свежеприготовленном водном растворе IN NaOH (120 мл) при перемешивании был добавлен p-анисовый алдегид (17 мл, 0,14 моль). Через 30 минут началась кристаллизация и смесь была быстро охлаждена. Осевший продукт затем был отфильтрован и промыт холодной водой (60 мл), после этого смесью EtOH-Et2O (1:1), чтобы получить 2-деокси-2-[p-метоксибензилиден (амино)]-D-глюкопираноза (D-глюкозамин-анисовый альдегид, 32,9408 г, 110,8 ммоль, выход 95,5%), точка плавления 165-166°C. H-I ЯМР подтвердил структуру.
Неочищенный EC-G (50 мг) был гидролизирован, используя IN NaOH. Анисовый альдегид был добавлен в раствор реакции. Спустя 2 часа смесь реакции была извлечена с помощью хлороформа. Слой хлороформа, который содержал нереагировавший анисовый альдегид, был испарен под азотом. Вес вступившего в реакцию анисового альдегида использовался для определения количества глюкозамина в аддукте глюкозамин-D-анисовый альдегид.
Пример 7
Количественный анализ ЕС в EC-G
Неочищенный EC-G (50 мг) был гидролизирован, используя IN NaOH. Хлорид бензила был растворен в диоксане (30 мл) и затем добавлен в перемешиваемую смесь. Реакция перемешивалась в течение 2 часов и затем была извлечена с помощью хлороформома. Слой хлороформа, который содержал нереагировавший хлорид бензила, был испарен под азотом. Вес реагировавшего хлорида бензила использовался для определения количества ЕС в EC-G (Таблица 3).
Пример 8
Количественный анализ сульфо-NHS и EDAC в EC-G
Стандартная кривая сульфо-NHS была получена при UV 272 нм. Неочищенный EC-G был растворен в воде. От стандартной кривой количество сульфо-NHS в EC-G было определено при UV 272 нм. Количество 1-этил-3-(3-диметиламинопропил) карбодии-мид-НСl (EDAC) было вычислено, вычитая ЕС, глюкозамин и сульфо-NHS от полного веса EC-G, показанного в Таблице 3.
Пример 9
Количественный анализ пробирного анализа фосфорилирования глюкозы.
Анализ гексокиназы в пробирке использовался, чтобы оценить процесс фосфорилирования глюкозы EC-G. Используя комплект (Sigma Cheemical Company.Миссури), фтородеоксиглюкоза (FDG, 1,0 мг), EC-G (1,0 мг), D-глюкозамин (G, 1,0 мг) и D-глюкоза (2,5 мг) были растворены в 1 мл (EC-G, G) или 2.5 мл (D-глюкоза) воды. Оттуда 200 мкл были удалены и разбавлены 2,5 мл воды. Кратные 100 мкл были затем удалены и комбинированы в растворе с 900 мкл реактива глюкозы Infinity™ и выдерживались при 37°C три мин. Фосфорилированная глюкоза и NADH были затем исследованы при длине волны 340 нм. Были получены пики FDG (340 и 347 нм), глюкозы (301 и 342 нм), EC-G (303 и 342 нм) и G (302 и 342 нм).
Пример 10
Пробирный анализ химической идентичности глюкозамина (активный фармацевтический ингредиент) в ЕС-G.(Синтезированного водной реакцией)
Колориметрический пробирный анализ использовался для определения количества глюкозамина. Раствор медного сульфата (6,93 г в 100 мл воды) и виннокислый калий натрий (34,6 г в 100 мл воды, содержащей 10 г NaOH) были приготовлены. EC-G (25 мг) и глюкозамин (стандартный) добавлялись в основной раствор тартрата меди до появления видимого красного осадка окисида меди. Количество глюкозамина в EC-G было 8,7 мг (35% процентное соотношение массы), определенное от объема титрования (Таблица 3).
Альтернативно, как описано в Примере 5, гидрохлорид D-глюкозамина (25 г, 0,12 моль) был добавлен в свежеприготовленный водный раствор IN NaOH (120 мл) при перемешивании, и затем p-анисовый альдегид (17 мл, 0,14 моль) был добавлен к смеси. Спустя 30 мин началась кристаллизация, и смесь была быстро охлаждена. Осажденный продукт был отфильтрован и промыт холодной водой (60 мл), затем смесью EtOH-Et2O (1:1), чтобы получить 2-деокси-2-[р-метоксибензилиден(амино)]-D-глюкопираноза (D-глюкозамин-анисовый альдегид, 32,9408 г, 110,8 ммоль, выход 95.5%), точка плавления 165-166°C. Неочищенный EC-G (50 мг) гидролизировался, используя IN NaOH. Анисовый альдегид был добавлен к раствору реакции. Спустя 30 мин началась кристаллизация, и смесь была быстро охлаждена. Осажденный продукт был отфильтрован и промыт холодной водой, была определена точка плавления 165-166°C (содержащий 18 мг глю-козамина).
Пример 11
Пробирный анализ химической идентичности этилендицистеина (хелатор) в EC-G (синтезированного водной реакцией)
Для определения чистоты EC-G были использованы два способа. В первом способе колориметрический пробирный анализ был использован для определения количества ЕС. Раствор иода (0,1 моль/л) (13 г наряду с 36 г KI в 1000 мл воды) был приготовлен, и ЕС (25,2 мг) и ЕС (25 мг) (стандартный) были добавлены к раствору иода. В стандартном ЕС было осаждено светло-белое твердое вещество, но никакой осадок не был отмечен в EC-G. Способ титрования использовался (желтоватый цвет (сохраняется больше чем 5 мин)) для определения количества ЕС в EC-G. Каждый 1 мл раствора иода, который использовался, равняется 13,4 мг ЕС. Количество ЕС в EC-G было 7,6 мг (30,2% процентное соотношение массы).
Во втором способе было выполнено измерение точки плавления аддукта тиол-EC-G. Пример 1 наметил синтез S,S'-Bis-benzyn-N,N'-этилендицистеина (Bz-EC). Кратко, ЕС (2,684 г, 10 ммоль) был растворен в В NaOH (40 мл). Хлорид бензила (5,063 г, 40 ммоль) был растворен в диоксане (30 мл) и добавлен к размешиваемой смеси. Спустя 30 мин рН фактор раствора был доведен до 2 концентрированной НСl. Осадок был профильтрован и промыт водой и рекристаллизован из трифторуксусной кислоты. Выход продукта был 79,0% (3,5454 г), точка плавления 227-229°C (сообщенная 229-230°C). Неочищенный EC-G (50 мг) был затем гидролизован, используя IN NaOH, и был добавлен хлорид бензила (40 мг). Смесь реакции перемешивалась 30 мин. РН фактор раствора был доведен до 2 концентрированной НСl. Осадок был профильтрован и промыт водой, чтобы получить аддукт ЕС-бензил, точка плавления 227-229°C (содержащий 16 мг ЕС).
Пример 12
Пробирный анализ химической идентичности сульфо-N-гидроксисукцинимид (сульфо-NHS) в EC-G (синтезированным от водной реакцией)
Пробирный анализ N-гидроксисукцинимид (сульфо-NHS) был определен UV (268 нм). Стандартная кривая сульфо-NHS была получена при UV 268 нм. При этой спектральной поглощательнсти способностью UV наблюдалась низкая спектральная поглощательная способность EC-G и EDAC. Неочищенный EC-G (50 мкг/мл) был растворен в воде, и его спектральная поглощательная способность была измерена при 268 нм. Предполагаемый сульфо-NHS был 35±5% (процентное соотношение массы).
Пример 13
Пробирный анализ радиохимической чистоты и идентичности
Тонкослойная хроматография (TLC) и высокоэффективная жидкостная хроматография (HPLC) использовались для определения радиохимической идентичности. Для пробирного анализа TLC EC-G, синтезируемый органическим способом, и ЕС-G, синтезируемый водным способом, были помечены99mТc и нанесены на полосу TLC, пропитанную колонкой силикагеля (ITLC-SG), сканированы, используя радио-TLC сканер. Значения фактора удерживания (Rf)99mTc-EC-G (от водного синтеза) и стандарта (99mTс-EC-G от органического синтеза) были 0,8 (определенные с помощью ацетат аммония (1М):метанол; 4:1) или соли). Для пробирного анализа HPLC химическая чистота органическим способом и водным способом синтезируемого EC-G была 95,64% и 90,52% соответственно. EC-G, синтезируемое органической реакцией, было более чистым, чем EC-G, синтезируемое водной реакцией. И органическим способом, и водным способом синтезируемый EC-G были помечены99mТc и загружены (20 мкл, 1 мг/мл EC-G) на С-18 колонку резервной фазы (воды, полуприготовительные, 7,8×300 мм). Значения времени удерживания (Rt)99mTc-EC-G и холодного Re-EC-G (ссылка на стандарт от органического синтеза) были между 11,7-13,5 мин (определено 100%-ной водой @ 0,5 мл/мин, UV 210 нм). И органическим и водным путем синтезируемый99mTc-EC-G были обнаружены длиной волны UV (210 нм), и подходящие обнаружения радиоактивного детектора были в пределах вышеупомянутых установленных диапазонов. Анализы клеточной культуры в пробирке показали, что Re-EC-G произвел кривую чуствительности к дозе (Фиг.3) и был эффективен против клеток лимфомы человека. Резюме:
- Радиохимическая чистота синтезируемого водным способом99mTc-EC-G, измеренная HPLC и TLC, является больше чем 95%, что близко приближается к радиохимической чистоте синтезируемого органическим способом EC-G.
- Химическая чистота немеченого водного EC-G, измеренная колориметрическим и элементным анализом, понижалась в диапазоне 60-70%. Все примеси, содержащиеся в составе EC-G (или водный или органический синтез), были ясно идентифицированы колориметрическим пробирным анализом и UV спектрометрией, это глюкозамин (35%), ЕС (30%), сульфо-NHS (34%) и EDAC (1%) на основании процентного соотношения массы.
- Измереннная HPLC в UV 210 нм химическая чистота немеченого водного EC-G является 90,52%, а химическая чистота немеченого органического EC-G равна 95,64%, поэтому он является более предпочтительным.
- Время удерживания водного99mTc-EC-G, измеренное HPLC в 272 нм, находится в диапазоне времени удерживания холодного Re-EC-G.
- ЯМР1Н,13С) водного EC-G находится в диапазоне холодного Re-EC-G.
- Немеченый органический EC-G, меченый органический EC-G и холодный Re-EC-G используются как ссылочные стандарты.
- Биологические пробирные анализы (восприимчивость в пробирке и получение изображений в естественных условиях) не показали никакого отмеченного различия между EC-G, синтезируемыми водным и органическим способами.
Пример 14
Исследование чистоты68Ga-EC-G
68Ga-EC-G, синтезированный и органическим и водным способами, были проанализированы радио-TLC (радиоактивной тонкослойной хромотографией ТСХ). Фиг.6 показывает более высокую чистоту органического продукта (а), водного продукта (b). Фиг.7 представляет очистку, выполненную на С-18 колонках (Puresil, 4,6×150 мм, воды, Милфорд, Миссури), и элюирование водой, используя скорость потока 0,5 мл/мин. Обнаружение было выполнено посредством UV и Nal.
Пример 15
Исследование стабильности68Ga-EC-G
Фиг.8 изображает результаты исследования стабильности68Ga-EC-G в сыворотке собаки, показанные радио-TLC. 100 мкл68Ga-EC-G (0,7 мг/0,7 мл, рН фактор 7,5, 865 мкКи) были добавлены к 100 мкл сыворотки собаки и выращивались в течение 0,30, 60 и 120 минут. Затем 200 мкл МеОН были добавлены к каждому образцу и встряхивались перед вымыванием, используя систему, включающую пиридин:ЕtOН: вода = 1:2:4; ватт-мановскую #1 бумагу.
(a)68Ga-EC-G (0,7 мг/0,7 мл, рН фактор 7,5, 865 мкКи);
(b) 100 мкл68Ga-EC-G в 100 мкл сыворотки собаки, время = 0;
(c) время = 30 мин;
(d) время = 60 мин;
(e) время = 120 мин;
(f)68Ga-EC-BSA.
Фиг.9 изображает результаты исследования стабильности68Ga-EC-G в сыворотке собаки, проанализированные пробирным анализом связывания белка. Контрольный образец был выращен с альбумином сыворотки68Gа-ЕС-бычий (BSA) в сыворотке собаки. 100 мкл68Ga-EC-G (0,7 мг/0,7 мл, рН фактор 7,5, 865 мкКи) были добавлены к 100 мкл сыворотки собаки и выращены в течение 0,30, 60 и 120 минут, активность была подсчитана, затем были добавлены 200 мкл МеОН и образец встряхнули, центрифугировали в течение 1 минуты, и затем были подсчитаны отдельно супернатант и осадок. Индексы, определенные для осадка, являются показателями степени связывания между68Ga-EC-G и белками в сыворотке собаки.
Коэффициет связывания белка увеличился с 18,6% до 51,5% после 2 часов, показывая потенциал направленности68Ga-EC-G.
Пример 16
Исследование in vitro поглощения соединений, меченных68Ga, клеточной линией рака молочной железы 13762
Фиг.10 показывает результаты пробирочных исследований поглощения соединений, меченных68Ga, клеточной линией рака молочной железы 13762. Клеточная восприимчивость68Ga-EC и68Ga-EC-G в клетках 13762 (1 мкКи/50 000 клеток на резервуар).
Клеточная восприимчивость68Ga-EC-G была значительно (р 0,01) выше, чем контрольного68Ga-EC через 0,5-2 часа.
Пример 17
Получение изображений сердечно-сосудистого заболевания.
На Фиг.11 показаны плоские изображения сцинтиграфии производной99mTс-ЕС-ESMOLOL (300 мкКи/особь) для крыс, носителей новообразования груди. Числа являются коэффициентами плотности импульса (импульс/пиксель) сердечного/верхнего средостения (H/UM) в промежутке 15-45 минут. Линейный профиль на Фиг.11 показывает высокий коэффициент импульс/пиксель области сердца по сравнению с расположенными сбоку тканями. Эти результаты демонстрируют, что99mTc-EC-ESMOЛОЛ удивительно эффективен при получении изображения области сердца. На Фиг.12 показаны результаты получения изображения PET68Ga-EC-TML белого кролика в Новой Зеландии.
Кролику назначили68Ga-EC-триметил лизин (EC-TML). Изображения венечного шва PET были получены через 45 минут после инъекции 0,66 мКи68Ga-EC-TML (спинная область к брюшной области). Была замечена высокая восприимчивость сердца, объясняющаяся тем, что ЕС-ТМЛ был вовлечен в метаболизм жирной кислоты.
Пример 18
Неограничивающий пример органического синтеза EC-G через промежуточное звено ЕС-бензгидрол-Сbz-глюкозамин (см. Фиг.13).
ЕС-бензгидрол-Сbz-глюкозамин может быть растворен в ацетате этила и осажден добавлением МТВЕ (метил-трет-бутиловый эфир) или n-гексана. Это может понадобиться для получения чистого предпоследнего вида в способе получения EC-G. Чистота ЕС-бензгидрол-Сbz-глюкозамина (HPLC) перед измельчением в порошок была приблизительно 64%. После измельчения в порошок чистота была приблизительно 68% (МТВЕ) или 65%-80% (n-гексан). Другой возможный способ очистки продукта предполагает использование картриджей BIOTAGE, так как силикагель в этих картриджах более активен, чем силикагель Inc. Flash Grade.
Были также выполнены другие способы и процедуры очистки, используя различные системы растворителя как альтернативу хроматографии, результаты которых показаны ниже в Таблице 4. Осаждение было предпринято в различных системах растворителя. ЕС-бензгидрол-Cbz был растворен в выбранном растворителе (А) и медленно загружен в больший объем сорастворителя (В). Однако результаты не показывали, что этот подход будет столь же эффективен, как другие способы, поскольку изменения чистоты были незначительными. Также была предпринята попытка измельчения в порошок, используя для выпадения осадка системы выбранных растворителей в различных отношениях. Результаты для порошков также дают возможность предположить, что материал недостаточно чист для определенных назначений. Была использована колончатая хроматография, а условия были изменены (15:1 кремнезем: неочищенный, положенный сухим на кремнезем). Этот способ позволил выполнить умеренную очистку материала (от 55А% д о75А%).
Все раскрытые соединения и способы, на которые заявлены права, могут быть сделаны и выполнены без неуместного экспериментирования в свете настоящего раскрытия. Хотя соединения и способы этого изобретения были описаны в терминах предпочтительных воплощений, специалистам будет очевидно, что могут быть произведены изменения составов и способов, шагов или последовательности шагов способа, описанного здесь, не отступая от понятий, духа и охвата изобретения. Очевидно, что определенные агенты, связанные химически и физиологически, можно заменить агентами, описанными здесь, и те же самые или подобные результаты будут достигнуты. Все подобные заместители и модификации, очевидные специалистам, находятся в пределах духа, охвата и понятий изобретения, что определено приложенными формулами.
Ссылки
Следующие ссылки дают образцовые процедурные или другие детали, дополнительные к сформулированным выше.
U.S. Patent 5,605,672
U.S. Patent 6,692,724
U.S. Patent 6,737,247
U.S. Patent Appln. 09/599,152
U.S. Patent Appln. 10/627,763
U.S. Patent Appln. 10/672,142
U.S. Patent Appln. 10/703,405
U.S. Patent Appln. 10/732,919
Alauddin and Conti, Nucl. Med. Biol., 25(3):175-180, 1998.
Alaviddmu6p.,Nucl. Med. Biol., 23:787-792, 1996.
Дpauddin и др., Nucl. Med. Biol., 26:371-376, 1999.
Дрbеriсо и др., Surg. Oncol. Clin. N. Am., 13(1):13-35, 2004.
Angello и др.. Am. J. Cardiol., 60:528-533, 1987.
Benveniste and Davies, Proc. Natl. Acad. Sci. USA, 70(8):2276-2280, 1973.
Blondeau и др.. Can. J. Chem., 45:49-52, 1967.
Bodansky, In: Peptide Chemistry, 2nd ed.. Springer-Verlag, New York, 1993.
Bolhuis и др., Int. J. Cancer Suppl., 7:78-81, 1992.
Borodina и др., Арр1. Environ. Microb., 71(5):2294-302, 2005.
Bush и др., Br. J. Cancer Suppl., 37(3):302-306, 1978.
CampbellyOp., Cancer Res., 51(19):5329-5338 1991.
Canevari и др., Hybridoma, 12(5):501-507, 1993.
Chasselle и др., Lancu, 34B:143, 1995.
Coney и др.. Cancer Res., 54(9):2448-2455, 1994.
Diamond и др., J. Biol. Chem. 253(3):866-871, 1978.
Dische, Int. J. Radiat. Oncol. Biol. Phys., 20(1):147-152, 1991.
Franklin и др., Int. J. Cancer Suppl., 8:89-95, 1994.
Gambhir и др., J. Nucl. Med., 39(11):2003-2011, 1998.
Gambhir и др., Proc. Natl. Acad. Sci. USA, 96(5):2333-2338, 1999.
Gambhir и др., Proc. Natl. Acad. Sci. USA, 97:2785-2790, 2000.
Gatenby и др., Int. J. Radiat. Oncol. Biol. Phys., 14(5):831-838, 1988.
Ginobbi и др., Anti-cancer Res., 17(1A):29-35,1997.
Grant, In: Synthuic Peptides, Freeman & Co., New York, 1992.
Gray и др., Nature, 182(4640):952-953, 1958.
Greene and Wuts, In: Protective Groups in Organic Synthesis, John Wiley & Sons, New York, 1999.
Gutman и др., Am. Heart J., 106: 989-995, 1983.
Ндрl и др., Radiat. Res., 114(3):415-424, 1988.
Henson и др., AJNRAm. J. Neuroradiol., 25(6):969-972, 2004.
Hoelscher и др.. Spine, 25(15):1871-7, 2000. Holm, и др., APMIS, 102(11):828-836, 1994.
Hosteler and Ндрl, PNAS, 79:1663-1667, 1982.
Hsueh and Dolnick, Biochem. Pharmacol., 45(12):2537-2545, 1993. Hu, Proc. Natl. Acad. Sci. USA, 95; 9791-95, 1998.
lyer и др., J. Nucl. Med., 42(1):96-105, 2001.
Koh и др.. Int. J. Radiat. Oncol. Biol. Phys., 22:199-212, 1992.
Kranz и др., Proc. Natl. Acad. Sci USA, 92(20):9057-61, 1995.
Kundra и др., J. Nucl. Med., 43(3):406-412, 2002.
Leamon and Low, Biochem. J., 291 (Pt 3):855-60, 1993.
Leamon and Low, J. Biol. Chem., 267(35):24966-71, 1992.
Leamon and Low, Proc. Natl. Acad. Sci. USA, 88(13):5572-76, 1991.
Lee and Low, J. Biol. Chem., 269(5):3198-3204, 1994.
Martin и др.,1 Nucl. Med., 30:194-201, 1989.
Medicnp Lnter, 34:78, 1992.
Mictwpik и др., Pharmacol Res. 21(4):405-414, 1989.
Murakami и др., J Orthop Res., 14(5):742-8, 1996.
Murakami и др.. Bone, 21(5):411-418, 1997.
Myszka и др., Carb. Res., 338:133-141, 2003.
Nakae and Nakae, Antimicrobi6p Agents and Chemo., Oct; 22(4):554-59, 1982.
Namavari и др., Nucl. Med. Biol., 27(2): 157-62, 2000.
Nordsmark и др., Radiother. Oncol., 41(1):31-39, 1996.
Orr и др., J. Natl. Cancer Inst., 87(4):299-303, 1995.
Ozmen и др.. Drug Chem Toxicol., 28(4):433-45, 2005.
Patrick и др., J. Neurooncol., 32(2):111-23, 1997.
Pohost и др., Circulation, 55:294-302, 1977.
Rasey и др.. Int. J. Radiat. Oncol. Biol. Phys., 17(5):985-91, 1989.
Rasey и др., Radiother. Oncol., 17(2): 167-73, 1990.
Remington's Рпаппасеийсдр Sciences, 18th Ed. Mack Printing Company, 1289-1329, 1990.
Ross и др., Cancer, 73(9):2432-43, 1994.
Saha и др., Semin. Nucl. Med., 24(4):324-49, 1994.
Strunk and Schild, Eur. Radiol., 14(6): 1055-1062, 2004.
Tachibana и др., Biochem. Pharmacol., 25(20):2297-301, 1976.
Tod и др., din Pharmacokinu., Mar;38(3):205-223, 2000.
Tjuvajev и др., J. Nucl. Med„ 43(8): 1072-1083, 2002.
Vдpk и др., J. Nucl. Med„ 33(12):2133-2137, 1992.
Verbruggen ubp.,J. Nucl. Med., 33:551-557, 1992.
Warrell, Jr и др., N. Engl. J. Med., 329(3): 177-189, 1993. Weitman и др., Cancer Res., 52(12):3396-3401, 1992b.
Weitman и др.. Cancer Res., 52(23):6708-6711, 1992а.
Weitman и др., J Neurooncol., 21(2):107-112, 1994.
WesterhofMOp., Cancer Res., 51(20):5507-5513, 1991.
Yaghoubi и др., J. Nucl. Med., 42:1225-1234, 2001.
Yanai и др., Proc. Natl. Acad. Sci. USA, 103(25):9661-9666, 2006.
Yang и др., Diabues, 53:67-73, 2004.
Реферат
Изобретение относится к новому способу синтеза сложных соединений хелатор-нацеливающий лиганд, которые могут быть использованы для лечения и диагностирования заболеваний, например, путем получения изображений новообразования или мио-кардиальной ишемии. Способ включает стадию:(а) конъюгирования в органической среде хелатора следующей формулы:с по крайней мере одним незащищенным нацеливающим лигандом, представляющим собой глюкозамин, где А и D каждый представляет собой защищенный тиол, В и С каждый представляет собой защищенный вторичный амин; Е и F каждый представляет собой группу -СООН; R, R, Rи Rкаждый представляет собой Н; Х означает -СН-СН-; и где конъюгирование происходит через образование амидной связи между Е или F хелатора и аминогруппой глюкозамина. В качестве органической среды используют обычно полярный или неполярный растворитель или их смесь. Способ может дополнительно включать (b) очистку конъюгата хелатор-нацеливающий лиганд; стадию:(c) хелатирования иона металла с конъюгатом хелатор-нацеливающий лиганд с образованием конъюгата меченый ион металла-хелатор-нацеливающий лиганд. При этом стадия с)включает стадии:(d) удаления по крайней мере одной защитной группы из конъюгата меченый ион металла-хелатор-нацеливающий лиганд или дополнительно (e) добавления восстанавливающего агента. Предпочтительными конъюгатами являютсяTc-этилендицистеин (ЕС)-глюкозамин,Re-ЕС-глюкозамин илиRe-ЕС-глюкозамин. Способы позволяет получить продукты высокой чистоты. 3 н. и 7 з.п.ф-лы, 13 ил.,4 табл., 18 пр.
Формула
(а) конъюгирования в органической среде хелатора следующей формулы:

с по крайней мере одним незащищенным нацеливающим лигандом, представляющим собой глюкозамин, где
А и D каждый представляет собой защищенный тиол,
В и С каждый представляет собой защищенный вторичный амин;
Е и F каждый представляет собой группу -СООН;
R1, R2, R3 и R4 каждый представляет собой Н;
Х означает -СН2-СН2-; и
где конъюгирование происходит через образование амидной связи между Е или F хелатора и аминогруппой глюкозамина.
(c) хелатирования иона металла с конъюгатом хелатор-нацеливающий лиганд по любому из пп.1-4 с образованием конъюгата меченый ион металла-хелатор-нацеливающий лиганд.
(d) удаления по крайней мере одной защитной группы из конъюгата меченый ион металла-хелатор-нацеливающий лиганд.
(e) добавления восстанавливающего агента.
(а) конъюгирования защищенного хелатора следующей формулы:
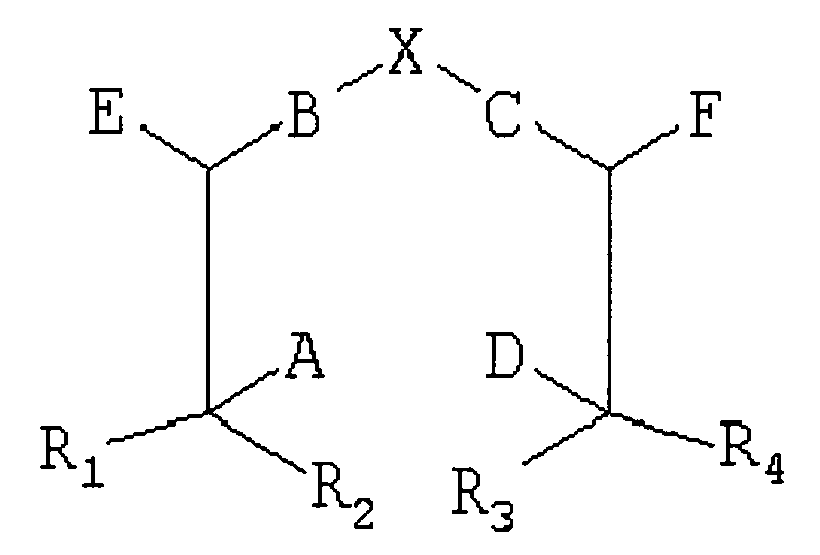
А и D каждый представляет собой защищенный тиол,
В и С каждый представляет собой защищенный вторичный амин;
Е и F каждый представляет собой группу -СООН;
R1, R2, R3 и R4 каждый представляет собой Н;
Х означает -CH2-CH2-;
с незащищенным нацеливающим лигандом с образованием защищенного конъюгата хелатор-нацеливающий лиганд, где незащищенный нацеливающий лиганд представляет собой глюкозамин с незащищенной аминогруппой, и в результате конъюгирования происходит образование амидной связи между -СООН группой Е или F и аминогруппой глюкозамина в органической среде.

Комментарии