Иммортализованные линии клеток птиц для получения вирусов - RU2359999C2
Код документа: RU2359999C2
Чертежи


















Описание
Настоящее изобретение относится к иммортализованным линиям клеток птиц, подходящим для получения биологических препаратов или вирусов для вакцинации. В частности, линии клеток получают из первичных клеток, которые трансформируют, по меньшей мере, двумя вирусными или клеточными генами, один из которых вызывает прогрессию клеточного цикла, тогда как другой препятствует врожденным защитным механизмам клетки, индуцированным дисрегуляцией репликации. Кроме того, изобретение относится к получению указанных иммортализованных линий клеток и их применению для получения биологических препаратов или вирусов для вакцинации.
Уровень техники
Яйца кур с эмбрионом по-прежнему представляют собой один из главных субстратов для получения вакцин для человека. Они способны поддерживать репликацию широкого спектра вирусов человека и животных. Этот спектр включает ослабленные вирусы, то есть дефектные вирусы, у которых ослаблена способность к репликации в клетках человека или млекопитающих и, таким образом, их можно использовать в качестве вакцин. Ослабление можно получать или поддерживать путем непрерывного пассирования в яйца с эмбрионом. Отсутствие определенного набора вирусного и бактериального заражения в яйцах кур, используемых для получения человеческой вакцины должно быть заверено сертификатом (без специфичного патогена или SPF). Яйца SPF поставляются промышленно. Широкая применимость и длительный международный опыт работы поддерживали эту стратегию, несмотря на очевидные недостатки.
SPF группы кур и яиц с эмбрионом являются дорогостоящими, и их стоимость может составлять до 40% стоимости вакцин. Кроме того, трудно непрерывно поддерживать группы SPF, полностью свободные от патогенов, для которых наблюдаются периодические вспышки заболевания в группах SPF. Партия вакцины не может быть выпущена до тех пор, пока поставщик SPF не удостоверится в том, что родительские куры для яиц с эмбрионом, используемые для производства партии вакцины, были полностью свободны от любого заболевания. Эта неопределенность значительно увеличивает стоимость получения данных вакцин. В ситуациях пандемии с внезапной потребностью в специфической вакцине (например, грипп) поставка яиц SPF может быть строго ограничена. Кроме того, крупномасштабные процессы для инфицирования яиц и поддержания роста вируса являются длительными и иногда неустойчивыми в различных сериях вакцин.
С развитием методик клеточной культуры производители вакцины заменили яйца с эмбрионом изолированными зародышевыми фибробластами курицы. В то время как применение первичных клеточных культур улучшает профиль безопасности, эффективность и надежность производственного процесса, оно также дополнительно увеличивает затраты: фибробласты кур получают из яиц SPF путем измельчения эмбрионов, для создания и амплификации жизнеспособных клеток. Как характерно для первичных клеток животных, фибробласты претерпевают старение: время удвоения при пассировании увеличивается и, в конечном счете, все клетки умирают. Этот процесс наблюдается приблизительно после 20 пассажей, намного раньше, чем в клеточных субстратах грызунов или в некоторых клеточных субстратах человека, используемых в настоящее время в производстве вакцин (таких как MRC-5 или WI-38). Культуры фибробластов необходимо поддерживать в присутствии 5-10% фетальной телячьей сыворотки, что привносит в производственный процесс дополнительные факторы риска. Они также требуют твердой поверхности для роста и не растут в суспензии, предпочтительном состоянии для применения в биореакторе. Даже с применением многослойных клеточных фабрик это значительно ограничивает процедуры в увеличенном масштабе. Вследствие ограниченного времени жизни для каждой партии фибробластов кур необходимо проводить полный набор тестов на безопасность.
Фибробласты представляют собой единственный тип клеток из широкого разнообразия различных тканей эмбриона курицы, которые хорошо размножаются. Преобладание фибробластов по сравнению с другими типами клеток в некоторых случаях уменьшало теоретический выход вируса, поскольку в яйцах главной областью для амплификации вируса обычно является хориоаллантоисная мембрана, слой эпителиальных клеток.
Рассмотренные проблемы внесли свой вклад в серьезный дефицит вакцины гриппа в последние два года (2003 и 2004). Для преодоления этих ограничений была бы высоко востребована постоянная линия клеток, растущая в искусственной среде определенного состава, предпочтительно в суспензии или, по меньшей мере, на носителях.
Некоторые из вирусов, обычно растущие в фибробластах кур, были адаптированы к определенным линиям клеток. Клетки BHK-21 (почки эмбриона хомяка) поддерживают рост различных штаммов вакцинии, гриппа и аутовакцины (Drexler I. et al., J. Gen. Virol. 79(Pt2):347-52 (1998); Gumusderelioglu M. et al., Biotechnol. Appl. Biochem. 33:167-72 (2001); Merten O.W. et al., Adv. Exp. Med. Biol. 397:141-51 (1996)) и беспрепятственно растут в больших ферментерах на носителях в бессывороточных условиях (Pay T.W. et al., Dev. Biol. Stand 60:171-4 (1985); Gallegos Gallegos R. M. et al., Arch. Med. Res. 26:59-63 (1995)). Для вакцинии это относится даже к сильно ослабленному штамму Анкара (MVA), который был получен в клетках кур. Линия клеток BHK-21 принята для получения определенных вакцин для домашнего скота (Lubiniecki A.S., Bioprocess Technol. 10:495-513 (1990)). Однако линия BHK-21 не удовлетворяет требованиям безопасности для живых вакцин для человека. Клетки BHK формировались спонтанно, они являются чрезвычайно онкогенными и об их истории сообщалось недостаточно.
Согласно обсуждению FDA, CBER от 12 мая 2000 клеточных субстратов, разработка "минимально очищенных живых ослабленных вирусных вакцин и вакцин на вирусных векторах" в опухолевых клетках, полученных из естественно встречающихся опухолей от людей и других млекопитающих, или из человеческих клеток и клеток млекопитающих, трансформированных за счет неизвестных механизмов, неприемлемо.
В качестве исключения из правила линия клеток VERO (происходящая от африканской зеленой обезьяны) приемлема в качестве клеточного субстрата для производства вакцины, что основано на доказанном профиле безопасности и на отсутствии трансформированного фенотипа при определенном количестве пассажей. Данную линию клеток широко использовали для производства вакцин против полиомиелита и оспы для клинического применения. Однако для клеток VERO необходимо прикрепление и они пригодны только для процессов, основанных на носителе.
Кроме того, в производстве вируса гриппа применялись клетки MDCK (спонтанная линия клеток из эпителия почки собаки) с описанной историей (Tree J. A. et al., Vaccine 19:3444-50 (2001)).
Позднее, как следствие разработки вакцины, основанной на векторе, и подходов генной терапии, интенсивно обсуждались новые, так называемые сконструированные линии клеток, полученные от человека, и они были включены в спектр потенциальных клеточных субстратов для получения вакцины (Vaccines and Related Biological Products advisory committee (совещательный комитет по вакцинам и связанным с ними биологическим продуктам), сессия от 16 мая, 2001). Были созданы новые постоянные линии клеток для обеспечения комплементарных генов для рекомбинантных вирусов с недостаточной репликацией вне системы продуцирования. Однако устойчивое введение комплементарных генов требует увеличения времени культивирования, которое либо превышает естественный предел количества пассажей, доступных для первичных клеток, либо возникает допустимый предел количества пассажей для клеток VERO до полной трансформации.
Сконструированные линии клеток производят in vitro с подробным документированием с применением охарактеризованных генов для трансформации. Например, комплементарные гены из области E1 аденовирусов непосредственно демонстрируют трансформирующие свойства и позволяли получать линии клеток человека, например, PER.C6 (Fallaux F.J. et al., Hum. Gene Ther. 9:1909-17 (1998)). Приложение этих линий клеток не ограничено вирусным вектором, для которого они разработаны, но может быть распространено на другие вирусы. Например, в PER.C6 можно размножать вирус гриппа (Pau M.G. et al., Vaccine 19:2716-21 (2001)). Однако этот вывод не относится ко всем вирусам, имеющим отношение к разработке вакцины, в частности к вирусам птиц, таким как вирусы заболевания Марека, инфекционного бурсита, болезни Ньюкастла, герпеса индеек или анемии кур. Несмотря на то что некоторые из этих вирусов хорошо реплицируются в линиях клеток млекопитающих, рост вируса часто является недостаточным. Для других вирусов репликация является недостаточной и ограничена отдельными, особенно адаптированными штаммами.
Кроме того, при адаптации к клеточному субстрату, полученному от примата, вероятно, сайты связывания рецептора на вирусе изменятся, что приведет к модифицированному антигенному рисунку и, таким образом, общему действию на иммуногенность. Данная генетическая адаптация может обратить ослабление для штаммов, которые выращивали путем пассирования в клетках птиц, таких как MVA, или адаптированный к курам вирус кори (Escoffier C., Gerlier D., J. Virol. 73:5220-4 (1999)), или создать новые штаммы, более эффективно реплицирующиеся в клетках человека по сравнению с изолятами дикого типа. Такие вирусы могут также достичь более высокого патогенного потенциала.
По указанным выше причинам производители вакцины отказываются переходить на линии клеток млекопитающих, и развилась потребность в бессмертных линиях клеток птиц.
Исследование индукции опухолей у птиц с помощью птичьих альфаретровирусов обеспечило первые данные на молекулярном уровне о трансформации клетки в целом. Ретровирусные онкогены получают из клеточных генов со значительной частью мутированных или делетированных регуляторных доменов. Некоторые из факторов, которые идентифицировали в ходе этих исследований, такие как v-myc или v-ras, непосредственно поражают компоненты путей как ретинобластомы (RB), так и p53. Другие белки, такие как v-src или v-erbB, представляют собой конститутивно активируемые (следовательно, дисрегулируемые) трансдукторы сигнала, которые имитируют проникающие внеклеточные митогены. Связанная с данными факторами проблема заключается в том, что их мишенью является только один из нескольких путей, необходимых для эффективной трансформации. Присутствие v-src или v-myc предрасполагает клетку к трансформации и требует дополнительных спонтанных и непредсказуемых изменений в клетке для полного превращения. Следовательно, трудно оценить риск для пациента, представляемый клетками, трансформированными одним из ретровирусных онкогенов.
В других случаях отдельный сильный опухолевый антиген (например, v-jun) может непосредственно вызвать формирование опухоли (Hartl M. et al., Curr. Cancer Drug Targets 3 :41-55 (2003)). Множество птичьих вирусных онкогенов сохраняют онкогенный потенциал в клетках млекопитающих.
Линии клеток, созданные этими вирусами, не подходят для производства вакцин. Ретровирус, несущий онкоген, можно активировать и перенести вместе с вакциной. Даже опухолевый антиген, не заключенный в вирусные LTRs, может представлять большой риск, если он может трансформировать клетки млекопитающих без помощи комплементарных антигенов. Данный риск обычно оценивают путем рассмотрения трансформирующего потенциала, количества вакцинируемых и количества клеточной нуклеиновой кислоты, перенесенной с вакцинным вирусом. Данное количество ограничено эффективностью процесса очистки и в настоящее время не может составлять менее чем 10 пг/доза. Данный критерий является особенно жестким для получения вакцины, где здоровую популяцию часто инокулируют в очень молодом возрасте.
Те же аргументы относятся к трансформации ДНК-вирусов, таких как папилломавирусы и полиомавирусы. Эти вирусы содержат агрессивные онкогены: большой T-антиген SV40 представляет собой многофункциональный белок, который воздействует как на контролирование контрольного пункта в G1 клеточного цикла, так и на активность p53. Поэтому большой T-антиген легко иммортализует и трансформирует множество тканей млекопитающих, полученных от грызуна и человека. С добавлением малого T-антигена (дополнительно усиливающего действие большого T-антигена и дополнительно модулирующего путь AKT3) было возможно иммортализовать клетки птиц (часть заявки на патент США 2001-0016348). Однако даже со сложными современными способами очистки большой T-антиген SV40 считают слишком агрессивным для применения в линиях клетки, полученных для применения в медицине человека. В отличие от приведенных выше, гены, предложенные в этом изобретении, нарушают контрольный пункт клеточного цикла и инактивацию p53 посредством раздельных факторов: необходимый одновременный перенос двух различных факторов для трансформации резко уменьшает любой теоретический риск для вакцинируемого.
Заявка на патент США 2001-0016348 описывает применение антиапоптотического пути, никак не связанного с настоящим изобретением. Он не обеспечивает второй ген, противостоящий внутреннему сигналу апоптоза, в виду принудительной прогрессии клеточного цикла, вызванной первым геном. Апоптоз также можно индуцировать различными внешними стимулами, например нехваткой факторов роста или откреплением от подложки. Передача данного типа проапоптотического сигнала может быть ингибирована генами семейства bcl-2, главными объектами заявки на патент США 2001-0016348.
Ввиду того, что 90% карцином шейки матки несут последовательности папилломавируса, полагают, что аденовирусы C-типа (которые включают типы 2 и 5) не индуцируют опухоли in vivo, и аденовирусные последовательности не были обнаружены в ткани опухоли человека.
Альтернативно была сделана попытка выведения линий клеток путем непрерывного пассирования фибробластов эмбрионов кур. Ввиду того, что клетки грызунов, как представляется, довольно легко претерпевают спонтанную иммортализацию (Curatolo et al., In Vitro 20:597-601 (1984)), клетки птиц и примата с этой точки зрения очень устойчивы (Harvey, et al., Genes and Development 5:2375-2385 (1991); Pereira-Smith, J. Cell Physiol. 144:546-9 (1990); Smith et al., Science 273:63-67 (1996)). Соматические клетки птиц или приматов испытывают недостаток в теломеразе, и старение вызвано укорачиванием концевых участков хромосом (теломеров). Тем не менее, линия фибробластов кур UMNSAH-DF1 была выведена с применением данного подхода (патенты США 5 672 485 и 6 207 415). Иммортализация с применением данного подхода вызвана спонтанными мутациями множества онкогенов или генов-супрессоров опухоли. Это редкое явление, вероятность повторения которого мала, особенно в клетках ткани другого происхождения. Что наиболее важно, такой подход противоречит подходу «Определенного Риска», который является общим правилом для живых вакцин человека и представляет подробную информацию о генах иммортализации для оценивания риска переноса онкогена. Кроме того, согласно FDA (Обсуждение CBER от 12 мая, 2000, клеточных субстратов), применение опухолевых клеток, полученных из естественно встречающихся опухолей или клеток, которые были трансформированы за счет неизвестных механизмов, не приемлемо для разработки минимально очищенных живых ослабленных вирусных вакцин и вакцин на вирусных векторах.
Спонтанно развившаяся линия фибробластов кур UMNSAH-DF1 демонстрирует изменения в активности E2F и p53 (Kim et al., Oncogene 20: 2671-82 (2001)). Это не является неожиданностью, поскольку увеличенная активность клеточного цикла требует активного E2F и поскольку из исследований клеток млекопитающих известно, что высокая активность E2F индуцирует апоптоз в присутствии активного p53. Исследование характеризует бессмертную стадию, не проясняя причинные явления: возможно, иммортализацию вызвали мутации в большом количестве генов.
Процесс спонтанной трансформации может быть усилен при помощи химических мутагенов (патент США 5 989 805). Отдельные линии клеток, полученные с применением этого подхода, преодолевали старение, но остались похожими на фибробласты и не являются онкогенными. Несмотря на то что это представляет важную особенность с точки зрения безопасности, эти клетки имеют малое значение для методик крупномасштабной ферментации. Кроме того, этот подход, основанный на случайном событии, также противоречит руководящим принципам «Определенного Риска».
Для биологического производства также были предложены линии клеток птиц, происходящие из естественно встречающихся опухолей, таких как фибросаркома перепела (WO 97/08307). Кроме того, руководящие принципы «Определенного Риска» для применения в получении вакцины для человека нарушаются способом, основанным на случайных событиях.
Подходы, предпринятые в исследованиях, описанных выше, отчетливо контрастируют с активным введением специфичных групп генов иммортализации в соответствии с настоящим изобретением, которое определяет причинные факторы иммортализации и позволяет оценивать риск, обеспечивает высокую гибкость в отношении выбора различных тканей и позволяет регулировать определенные характеристики получающейся линии клеток.
Несмотря на то что с яйцами и фибробластами кур работают давно, с ними также связан очень характерный фактор риска, которому только недавно стали уделять большее внимание: клетки кур высвобождают, по меньшей мере, два типа ретровирусных частиц, эндогенный ретровирус птицы (EAV) и эндогенный вирус лейкоза птицы (ALV-E). Проблема сходна с присутствием эндогенных ретровирусных частиц в клетках мыши, которые используются для производства рекомбинантных белков (таких как NS0). Однако в отличие от клеток мыши клетки кур продемонстрировали наличие обратной транскриптазы. Благодаря более эффективным методикам обнаружения, активность RT была также обнаружена в произведенных клетками кур вакцинах против кори, свинки и желтой лихорадки (Hussain A.I. et al., J. Virol. 77:1105-11 (2003); Shahabuddin M. et al., J. Clin. Microbiol. 39 :675-84 (2001)). Вопрос о том, приводит ли наличие активности обратной транскриптазы к передаваемым ретровирусам, остается спорным: более подробный анализ показал, что CEF (от белого леггорна) содержит пять локусов с интегрированными EAVs, два из которых могут экспрессировать инфекционный ALV-E, тогда как остальные три - дефектны (Johnson J.A., Heneine W., J. Virol. 75:3605-12 (2001)). Tsang S.X. и др., J. Virol. 73: 5843-51 (1999) также обнаружили активность RT и высвобождение вирусных частиц, но не наблюдали передачи после тщательного поиска последовательностей EAV в мононуклеарных клетках крови детей, получавших вакцину против свинки. В соответствии с Weekly Epidemiological Record, WHO (73) 28 (1998), независимые лаборатории исследовали инфекционность частиц для различных клеток человека и других млекопитающих путем обширного совместного культивирования и не могли обнаружить передачу активности RT или продуктивной инфекции. Эти сведения поддерживают эпидемиологические исследования, которые не выявили связи между применением произведенных клетками кур вакцин и частотой возникновения рака, в том числе и в детском возрасте.
Кроме того, в указанном Weekly Epidemiological Record, WHO подчеркивает значение клеток-хозяев кур для поддержания ослабления определенных штаммов вакцин. Альтернативные процессы получения в настоящее время не доступны, и данное отсутствие альтернатив является важной причиной для принятия известного и непрерывного источника вирусного загрязнителя.
Однако эпидемиологические исследования привносят популяции и не касаются случайных событий или детальных исследований. Эпидемиологические исследования не могут опровергнуть теоретические риски, например: допущенная эндогенная активность RT может маскировать активность RT от недопустимой экзогенной инфекции, и эндогенные вирусы могут быть мобилизованы и активированы, если в клетки введены конструкции оболочки (Ronfort C. et al., Virology 207:271-5 (1995)).
Однако было показано, что клетки уток и гусей не содержат последовательности, родственной EAV и ALV, а у японского перепела отсутствует обратная транскриптаза (Smith L.M. et al., J. Gen. Virol. 80(ptl):261-8 (1999); Brudno L.A. et al., Vopr. Virusol. 97-100 (1980)).
Аденовирусы (AdV) представляют собой хорошо охарактеризованные, голые (без оболочки) повсеместные вирусы. Для наиболее распространенных серотипов Ad2 и Ad5 доминирование среди населения приближается к 90%. Некомпетентные по репликации версии этих вирусов используют в качестве генной терапии и вакцинных векторов в исследованиях с пациентами-людьми. Гены из области E1 Аденовируса 5 человека использовали для трансформации некоторых специфических клеток человека in vitro (линии клеток 293 и PER.C6; Fallaux F.J. et al., Hum. Gene Ther. 9:1909-17 (1998); Graham F.L. et al., J. Gen. Virol. 36:59-74 (1977)). Общий процесс неэффективен по сравнению с более сильными многофункциональными онкогенами, такими как большой T-антиген SV40. На основании наблюдения, что 293 демонстрирует специфичные маркеры нейронов и PER.C6 имеют нейроэктодермальное происхождение, было выдвинуто предположение, что транформация Ad5, основанная на E1, ограничена нейронными клетками (Shaw et al. Faseb J 16(8): 869-71(2002)). Учитывая значительный видовой барьер между клетками человека и птиц, эффективная иммортализация множества тканей птиц за счет трансфекции ожидается в еще меньшей степени.
Линии клеток млекопитающих, трансформированные по E1, использовали для получения живых очищенных векторов аденовируса в клинических исследованиях. При тщательном контроле количества загрязняющей клеточной ДНК в препарате вакцины и ее размера трансформирующие гены Ad5 не рассматривают как защитный барьер (Vaccines and Related Biological Products advisory committee, session from May 16, 2001).
Аденовирусы реплицируются в ядре зараженной клетки. Поскольку неделящиеся клетки-хозяева не допускают полного жизненного цикла вируса, аденовирусы развили механизм, чтобы перевести клетки в S-фазу. Для увеличения размера вспышки дочерних вирусов до максимума они также развили механизм избегания апоптоза как реакции клетки-хозяина на проникновение капсида и репликацию вируса. Область генома, которая обеспечивает как прогрессию клеточного цикла, так и торможение апоптоза, представляет собой область E1.
E1 область фактически состоит из двух отдельных кассет экспрессии, E1A и E1B, выстроенных в тандеме, и каждая из которых наделена собственным промотором и сайтом полиаденилирования. По меньшей мере, три белка транслируются из первичного транскрипта E1A за счет альтернативного сплайсинга. Было обнаружено, что среди прочих белки E1A разрушают комплексы RB/E2F и противостоят коактиваторам транскрипции p300 и CBP. Освобождение E2Fs от репрессора RB индуцирует прогрессию клеточного цикла из фазы G1 в S в то время как комплекс E1A/p300 индуцирует апоптоз через несколько путей (Putzer B.M. et al., Cell Death Differ. 7:177-88 (2000)), включая репрессию транскрипции MdM2, отрицательного регулятора ключевого сенсора апоптоза, p53.
Поскольку E1A сенсибилизирует клетки к TNF-индуцированному апоптозу, он считается противоопухолевым агентом, и он используется в экспериментальных подходах для лечения опухолей (Lee W.P. et al., Cancer Res. 63:6229-36 (2003)).
Кроме того, действуя как модулятор транскрипции, он ведет клетки к де-дифференциации, особенности, предпочтительной для потенциального клеточного субстрата.
Guilhot и др. (Guilhot C. et al., Oncogene 8:619-24 (1993)) показали, что ретровирусная трансдукция белка 12S E1A из Ad5 может привести к иммортализации клеток перепела. По всей видимости это является следствием взаимодействия между RB птицы и E1A. Однако процесс не осуществляется, когда ген вводят путем трансфекции голой ДНК вместо инфекции ретровируса (собственное наблюдение). Авторы заявки предполагают, что чрезвычайно эффективная и устойчивая трансдукция путем инфекции ретровируса создала пул клеток, достаточно большой, чтобы накопить отдельные клетки со спонтанными геномными изменениями, которые блокировали апоптоз, который в норме индуцируется при инактивации RB. Эти необходимые, но неизвестные изменения увеличивают риск для вакцинируемых, и получающуюся линию клеток нельзя считать сконструированной линией клеток (результат определенных блоков в специфичных проводящих путях). Кроме того, трансформирующий ген, введенный посредством ретровирусов, фланкирован инвертированными концевыми повторами и, следовательно, может быть мобилизован. Такое явление может даже быть более выраженным в линиях клеток, которые экспрессируют обратную транскриптазу из эндогенных ретровирусов.
Сущность изобретения
Ввиду изложенного выше, по-прежнему требуется разработка линии клеток птицы с удобными свойствами роста для крупномасштабного производства, с применением определенного сочетания иммортализующих/трансформирующих генов. Кроме того, желательно, чтобы ни один из этих генов не мог трансформировать клетки млекопитающих, вне зависимости от других генов. Кроме того, отдельный ген не должен оказывать иммортализующего/трансформирующего действия или приводить к апоптозу клеток, экспрессирующих соответствующий ген. Риск сопряженного переноса реципиенту вакцины дополнительно должен быть сведен к минимуму путем размещения соответствующих генов на отдельных блоках экспрессии. Наконец, поскольку население обычно подвергнуто воздействию соответствующих генов, было бы желательно, чтобы эти гены не были связаны с формированием опухолей у людей. Производимая линия клеток не должна высвобождать инфекционные вирусные частицы из эндогенных ретровирусов или вообще не проявлять активность обратной транскриптазы.
Было обнаружено, что трансформация клеток птиц двумя специфическими вирусными и/или клеточными генами, один из которых действует на белки ретинобластомы, а другой действует на белок p53, обеспечивает линию клеток, хорошо подходящую для получения вирусов для вакцинации.
Таким образом, изобретение обеспечивает:
(1) линию клеток птиц, иммортализованную с помощью сочетания вирусных и/или клеточных генов (которые ниже будут коротко называться "ген (гены)"), по меньшей мере, одного первого гена, воздействующего на функцию белка ретинобластомы и, по меньшей мере, одного второго гена, воздействующего на белок p53 или представителя данного семейства, где, предпочтительно, первый ген подавляет контролирование контрольного пункта G1 и второй ген подавляет апоптоз, индуцированный первым геном;
(2) способ получения линии клеток, как определено выше в (1), содержащий трансформирование/трансфицирование исходной клетки первым и вторым геном;
(3) применение линии клеток, как определено в (1) выше, для получения биологических препаратов или вирусов, предпочтительно, для получения вакцины или для генотерапии; и
(4) способ получения вирусов или биологических препаратов, с применением линии клеток, как определено выше в (1).
Краткое описание чертежей
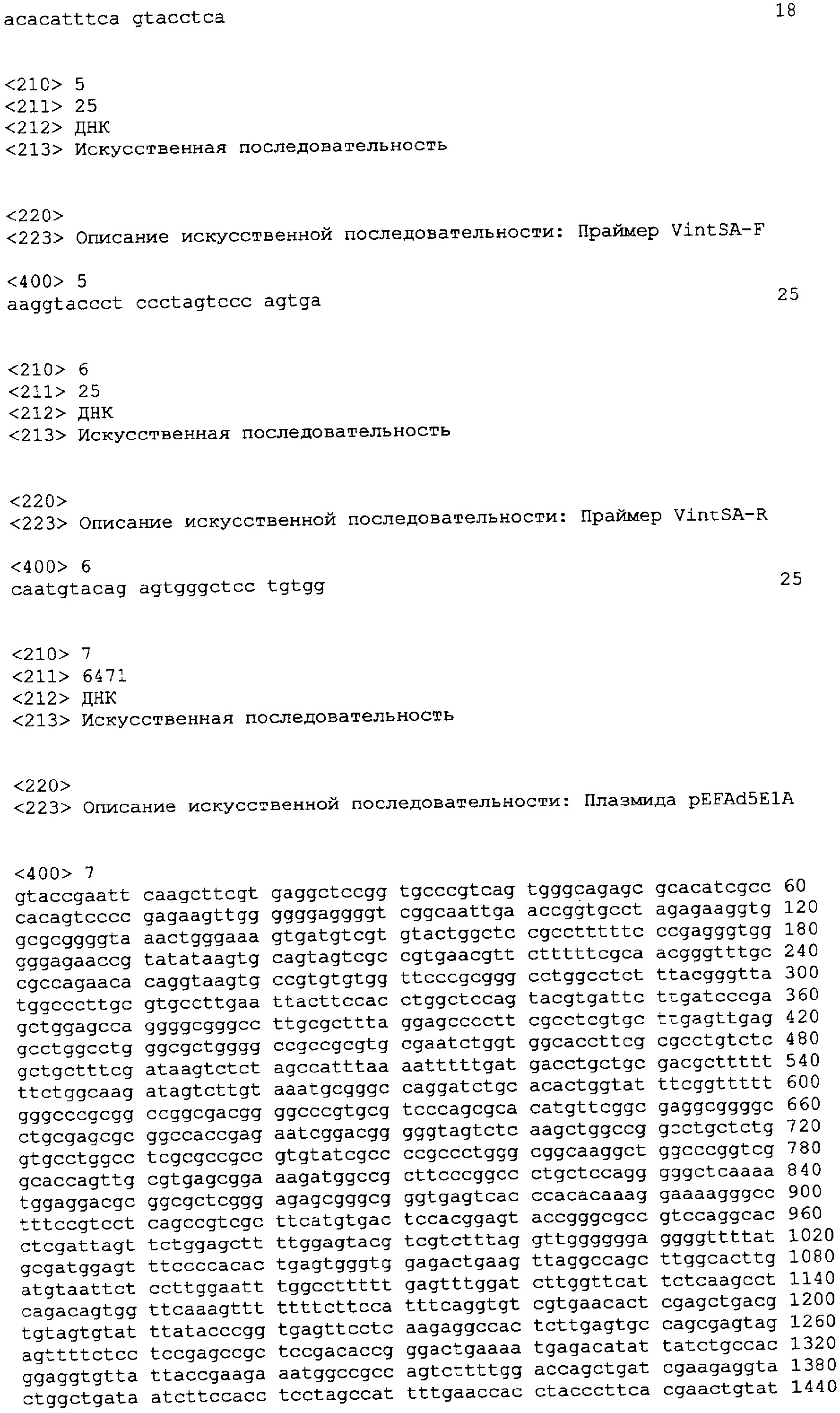
Фиг.1 - схематические отрезки плазмид экспрессии, используемые для усиленной иммортализации первичных клеток утки (пример 2). Сигналы полиаденилирования опущены для ясности. Буквенно-цифровые обозначения слева представляют собой короткие идентификаторы плазмид. mPGK и hPGK - промоторы фосфоглицераткиназы мыши и человека соответственно; ad5, E1-эндогенный промотор Ad5; moCMV, быстродействующий ранний промотор CMV мыши; tk - промотор киназы тимидина вируса простого герпеса; orf 22 и gam1 - гены вируса CELO; E1A и E1B - гены области E1 аденовируса 5.
Фиг.2 - изображения фазовоконтрастной микроскопии в качестве примера формирования очага в трансфицированных Ad5-E1 эмбриональных клетках печени утки (плазмида 49E). A - начальное увеличение 4 x, для отображения полного очага, заключенного в стареющих первичных клетках. B - начальное увеличение 20 x: периметр крупного округлого очага малых клеток, собранных в компактный монослой, видимый в правой части рамки, быстро стареющие первичные клетки ближе к левой части.
Фиг.3 - иммунофлюоресцентный анализ для белков E1A и E1B 55К (пример 3). Два верхних ряда - смесь иммортализованных плазмидой 49E и первичных клеток печени утки; нижние два ряда - клетки положительного контроля 293. Левый столбец - фазовоконтрастные изображения; средний столбец - иммунное окрашивание белков E1A или E1B 55К, как обозначено на фигурах; правый столбец- окрашивание DAPI. Белок E1B 55К характерным образом локализуется к цитоплазме и собирается в скопления, что дает неравномерное распределение пятнами. E1A является ядерным белком. Следует отметить уплотненные ядра, которые ярко окрашиваются DAPI в трансформированных клетках утки.
Фиг.4 - анализ Q-PERT (количественный анализ PERT) супернатанта клеток для обнаружения активности ретровирусов (пример 4). Полужирные квадраты - положительный контроль CHO; незаполненные квадраты - отрицательный контроль воды; полужирные ромбы - фибробласты эмбрионов кур; полужирные треугольники - отрицательный контроль линии клеток 293; серые круги - отрицательный контроль только с субстратом; незаполненные треугольники - клетки печени утки, иммортализованные плазмидой 49E; дельта Rn - излучение репортерного красителя над уровнем начальной фоновой флюоресценции.
Фиг.5 - амплификация MVA в некоторых из описанных линий клеток утки и CEFp (пример 5). Инфицирование было выполнено с MOI (множественностью заражения) 0,1. Титрование было выполнено на клетках VERO спустя 48 часов после инфицирования (Пример 2). CEFp - первичные фибробласты эмбрионов кур.
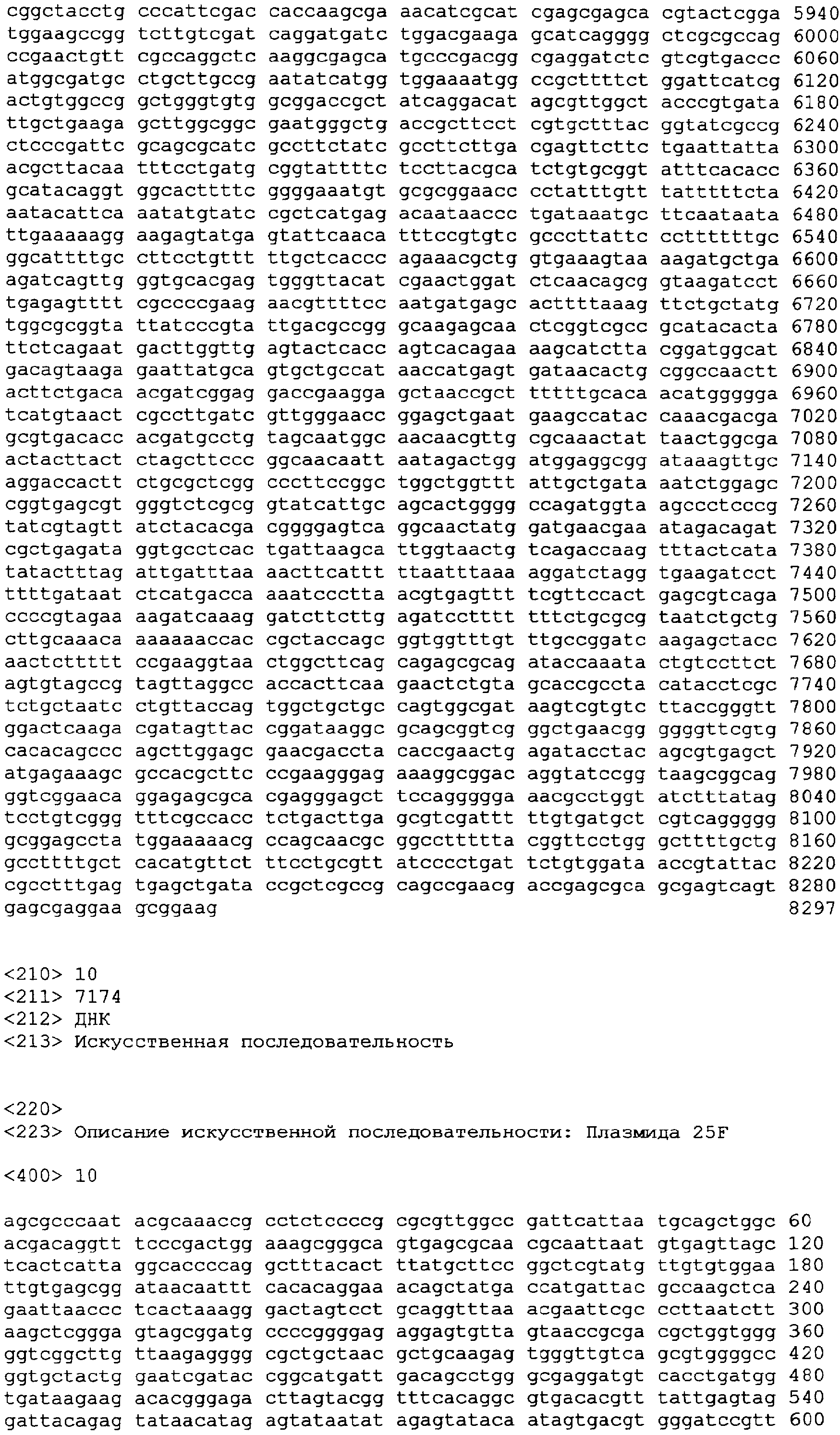
Фиг.6 - серийное пассирование MVA в клетки сетчатки утки, иммортализованные плазмидой 49E (пример 5). Полужирные квадраты - размер вспышки; столбцы - вводимое количество вируса, доведенное до MOI 0,1. Вводимое количество вируса дается как стандарт для демонстрации, что размер вспышки не зависит от экспериментальных флуктуаций в количестве клеток (которое в свою очередь определяет вводимое количество вируса посредством MOI).
Список последовательностей - текст в произвольной форме
Подробное описание изобретения
Термины "иммортализованный", "иммортализованные клетки" и "иммортализованная линия клеток" в соответствии с настоящим изобретением относятся к клетке или линии клеток, которую трансфицировали/трансформировали определенными функциональными последовательностями ДНК, придающими возможность, по меньшей мере, 200 пассажей, предпочтительно, неограниченного количества пассажей, то есть бессмертия, соответствующим исходным клеткам.
Термин "генная кассета" в соответствии с настоящим изобретением следует понимать как последовательность ДНК, содержащую ген, препятствующий функции белка ретинобластомы, то есть который прямо или косвенно (например, после экспрессии) добивается разрушения комплексов между белками ретинобластомы и факторами транскрипции E2F и который, кроме того, содержит ген вируса, предотвращающий индукцию торможения роста и апоптоза за счет p53, такой как белок аденовируса E1B 55К всех групп, белок E6 папилломавирусов, предпочтительно из папилломавирусов человека низкого риска (HPV) (таких как HPV1, HPV6 и HPV11, но не HPV16, HPV18), или клеточный ген, предотвращающий торможение роста и апоптоз за счет p53, такой как mdm2.
Более подробно описанная выше генная кассета содержит "первый ген", который в предпочтительном аспекте (1) прямо или косвенно (например, посредством клеточных индукторов) обеспечивает разрушение комплексов между белками ретинобластомы и факторами транскрипции E2F. Этот первый ген может представлять собой ген вируса, такой как E1A мастаденовируса, gam1 и orf22 CELO или E7 папилломавирусов, предпочтительно папилломавирусов человека низкого риска (таких как HPV1, HPV6 и HPV11, но не HPV16, HPV18), или клеточный ген, такой как конститутивно активный CDK4 или сверхэкспрессируемый циклин типа D. Активность первого гена обеспечивает прогрессию клеточного цикла обычно за счет индукции апоптоза или торможения роста при увеличении пассирования.
"Второй ген" присутствует в описанной выше генной кассете для противостояния данному эффекту первого гена. Он предотвращает апоптоз или торможение роста и предпочтительно действует путем ингибирования активации транскрипции за счет p53 посредством увеличения расщепления p53 или преобразования p53 из трансактиватора в репрессор транскрипции. Предпочтительно "второй ген" способен предотвращать активацию транскрипции за счет p53, в том числе подавлять функцию p53 и обеспечивать уменьшение стабильности p53. "Второй ген" может представлять собой ген вируса, такой как белок аденовируса E1B 55К всех групп, orf22 CELO, белок E6 папилломавирусов, предпочтительно папилломавирусов человека низкого риска (таких как HPV1, HPV6 и HPV11, но не HPV16, HPV18), или клеточный ген, предотвращающий торможение роста и апоптоз посредством p53, такой как mdm2. Предпочтительно "второй ген" представляет собой orf22 CELO или E1B 55k аденовируса.
Это полностью противоположно введению экзогенного активного p53 дикого типа, которое было связано с получением линии фибробластов кур, за счет неизвестного механизма (US 5 879 924).
"Биологические препараты" в контексте настоящего изобретения содержат терапевтические и рекомбинантные белки, включая антитела, ферменты, гормоны, рецепторы или их лиганды и продукты их слияния. Предпочтительными биологическими препаратами являются рекомбинантные белки.
Одним предпочтительным аспектом варианта выполнения (1) является применение линии клеток, полученной из эмбриона или вылупившейся курицы, утки, гуся, перепела и т.п., предпочтительно из курицы или утки. В особенно предпочтительном аспекте (1) данная линия клеток дополнительно не обладает активностью обратной транскриптазы, получена в результате иммортализации первичной клетки, происходящей из эмбрионов кур, вылупившейся курицы, эмбрионов уток или вылупившихся уток, получена из экстраэмбриональной оболочки и/или культивирована в среде определенного химического состава. Среда предпочтительно не содержит сыворотку животного.
Другим предпочтительным аспектом варианта выполнения (1) является то, что клетки, подвергнутые иммортализации, являются первичными клетками, включая фибробласты, клетки из выделенных сегментов тела (сомитов) или выделенные одиночные органы, включая ткани нейронов, мозга, сетчатки, почек, печени, сердца, мышц и экстраэмбриональные ткани и мембраны, предохраняющие эмбрион. Наиболее предпочтительно клетки из экстраэмбриональных мембран или сетчатки.
Иммортализацию, приводящую к клеткам варианта выполнения (1), предпочтительно проводят путем невирусной трансфекции, включая, без ограничений, трансфекцию, опосредованную липосомами, преципитатами дендримеров или гидроксиапатита ("фосфата кальция") и электропорацию.
Предпочтительно первый ген в варианте выполнения (1), представляет собой ген вируса, обеспечивающий разрушение комплексов между белками ретинобластомы и факторами транскрипции E2F. Он включает, без ограничений, ген E1A аденовируса из мастаденовирусов (предпочтительно из мастаденовирусов группы С), белок E7 папилломавирусов, предпочтительно из вируса папилломы человека низкого риска (HPV) (такого как HPV1, HPV6 и HPV11, но не HPV16, HPV18), ген orf 22 аденовирусов птиц и/или открытые рамки считывания E43 из атаденовируса овцы. Альтернативно первый ген варианта выполнения (1) представляет собой ген клетки, обеспечивающий разрушение комплексов между белками ретинобластомы и факторами транскрипции E2F. Он включает, без ограничений, циклин Dl, циклин D2, циклин D3 и/или мутированный CDK4, не восприимчивый к инактивации за счет p16INK4a.
Второй ген варианта выполнения (1) предпочтительно представляет собой ген вируса, кодирующий белок, предотвращающий индукцию торможения роста и апоптоз за счет p53. Он включает, без ограничений, гены, кодирующие белок E1B55K аденовируса всех групп, GAM-1 из CELO, белок E6 папилломавирусов, предпочтительно из HPV низкого риска (таких как HPV1, HPV6 и HPV11, но не HPV16, HPV18). Наиболее предпочтительными являются гены, кодирующие белок E1B55K аденовируса и GAM-1 из CELO. Альтернативно второй ген кодирует клеточный белок, предотвращающий торможение роста и апоптоз за счет p53, такой как mdm2.
Первый и второй гены варианта выполнения (1) предпочтительно пространственно разделены гетерогенными последовательностями или расположены на различных сегментах нуклеиновой кислоты или плазмидах.
В особенно предпочтительном аспекте варианта выполнения (1) первый ген представляет собой E1A, и второй ген представляет собой область E1B аденовируса рода Mastadenovirus, предпочтительно из аденовируса 5. Наиболее предпочтительно указанные области E1A содержат последовательность из п.о. 1193-2309, предпочтительно п.о. 1239-2309, из SEQ ID NO:7 или последовательность, комплементарную п.о. 4230-3113, из SEQ ID NO:9. Кроме того, наиболее предпочтительно указанные области E1B содержат последовательность из п.о. 1145-3007, предпочтительно п.о. 1197-2810, из SEQ ID NO:8 или последовательность, комплементарную п.о. 2345-550, из SEQ ID NO:9.
В дополнительно предпочтительном аспекте варианта выполнения (1) первый ген представляет собой orf22, и второй ген представляет собой GAM-1 из аденовируса, предпочтительно, рода aviadenovirus CELO, которые, предпочтительно, содержат последовательность, представленную последовательностью, комплементарной п.о. 1252-635, из SEQ ID NO:10, и последовательность, комплементарную п.о. 3138-2290, из SEQ ID NO:10.
В еще более предпочтительном аспекте варианта выполнения (1) и (2) для иммортализации клеток используют плазмиды 36E (SEQ ID NO: 19), 37E (фиг.1), 49E (SEQ ID NO:9), 25F (SEQ ID NO: 10) или 60E (SEQ ID NO: 18).
Кроме того, предпочтительными аспектами варианта выполнения (1) являются сочетания нуклеиновых кислот, кодирующих E1A и/или E1B с GAM-1 и/или Orf22, как определено выше.
Линия клеток в соответствии с вариантом выполнения (1) может дополнительно нести неприродные функциональные последовательности, включая, без ограничений, трансгены, такие как гены, комплементарные дефицитным вирусам (например, EBNA1 и т.д.), промоторы (например, PGK-, EF1.alpha-, CMV-промотор, E1-промоторы Ad5, tk-промотор и т.д.), энхансеры (например, RSV-LTR), селективные маркеры, такие как резистентности к неомицину, резистентности к пуромицину и т.д. В одном предпочтительном аспекте первый и второй гены находятся под контролем различных промоторов, независимо выбранных из PGK-, CMV-, E1- и tk-промоторов.
Линия клеток в соответствии с вариантом выполнения (1) входит в один предпочтительный аспект, еще более подходящий для получения биологических препаратов или вирусов, включая штаммы вакцин (вирусы заболевания Марека, инфекционного бурсита, болезни Ньюкастла, герпеса индеек, анемии кур, гриппа, вакцинии (MVA), краснухи, бешенства и т.д.) и рекомбинантные вирусные векторы (например, рекомбинантные MVA или альфавирусы). Большинство предпочтительных вирусов для вакцинации представляют собой вирусы гриппа и MVA. Самым предпочтительным рекомбинантным вирусным вектором является MVA.
В одном аспекте варианта выполнения (1) линия клеток представляет собой линию клеток 12A07-A10 (DSM ACC2695), полученную путем иммортализации клеток экстраэмбриональной мембраны утки плазмидой 49E (пример 2).
Кроме того, предпочтительным является получение линий клеток в соответствии с вариантом выполнения (1) при условиях cGMP, делающих их подходящими для фармацевтического применения.
Способ варианта выполнения (2) предпочтительно включает невирусную трансфекцию исходной клетки, такую как приведенные выше. Наиболее предпочтительной является липосомальная трансфекция, особенно трансфекция с помощью реактива Effectene.
Предпочтительным применением в соответствии с вариантом выполнения (3) является применение для получения вакцины или для генной терапии. Штамм вирусной вакцины или вектор генной терапии вводят в контакт с клетками линии клеток в соответствии с вариантом выполнения (1) так, что происходит инфицирование, и вирус амплифицируется указанными клетками. Непрерывное пассирование вируса (повторенные циклы инфицирования и сбора вируса на указанных клетках) приводит к ослаблению или адаптации вируса к данной частной линии клеток-хозяев. Таким образом, производят вирусный вектор или штамм вакцины с меньшей вирулентностью для предполагаемого вакцинируемого (который не является уткой, предпочтительно не является птицей). Ослабленные вирусы позволяют иммунной системе вакцинируемого запустить реакцию, которая является более эффективной защитой, чем вакцинация полностью инактивированными частицами, и менее тяжелой, чем инфекция инфекционным агентом дикого типа (естественным). Предпочтительными вирусами для данного варианта выполнения являются вирусы кори и бешенства.
Способ получения вирусов в соответствии с вариантом выполнения (4) предпочтительно содержит контактирование указанных вирусов с линией клетки в соответствии с вариантом выполнения (1) и/или культивирование указанных вирусов в указанной линии клеток. Особенно, этот способ может использоваться для получения вируса оспы, предпочтительно штамма MVA, в линии клеток утки, предпочтительно в линии клеток, происходящей из сомитов утки или нейронной ткани утки, еще более предпочтительно из сетчатки утки. Особенно клетки, происходящие из сетчатки и сомитов утки, полученные трансфекцией области Ad5-E1 при условиях cGMP, устойчиво поддерживают амплификацию MVA с эффективностью, сопоставимой или лучшей, чем первичные фибробласты эмбрионов кур (Пример 5).
Способ получения биологических препаратов, особенно рекомбинантных белков, в соответствии с вариантом выполнения (4) содержит введение гена, кодирующего рекомбинантный белок, функционально связанного с промотором, в линию клеток в соответствии с вариантом выполнения (1), культивирование указанной модифицированной линии клеток и сбор рекомбинантного белка.
Способ варианта выполнения (4) используется предпочтительно для получения вирусов и биологических препаратов, пригодных для вакцинации или генной терапии.
Исторически яйца кур и соответствующие клетки (фибробласты кур) являются доминирующим субстратом для производства вакцин. Для фармацевтических целей доступны куры из микроклимата с контролем доступа патогенов с обширной системой контроля. В многочисленной литературе яйца кур предлагаются как первичная цель для развития линий клеток. В связи с этим клетки кур являются предпочтительным источником для исходных клеток в соответствии с изобретением. Однако клетки и линии клеток, полученные из кур, наиболее вероятно являются RT-положительными. Литературные данные предлагают низкий уровень риска высвобождения инфекционного вируса. Однако отсутствие передающегося вируса следует контролировать для любой линии клеток, используемой в производстве. Действительно, большинство линий клеток птиц, устоявшихся до настоящего времени, получены из курицы (US 5 830 723, US 5 879 924). Несмотря на то что было возможно вывести ряд поколений курицы (линия 0), не содержащих вирус лейкоза птиц, эндогенные ретровирусы птиц (EAV-HP) (Boyce-Jacino et al., J. Virol 66(8):4919-29 (1992)) присутствуют в клетках кур, включая линию 0. EAVs, обеспечивают активную обратную транскриптазу, но уровни экспрессии существенно варьируют. В связи с этим, даже первичные клетки и линии клеток кур, такие как DF1, которые определены, как RT-отрицательные, в менее чувствительных анализах (Crittenden et al., Virology 57(1): 128-38 (1974)), по всей видимости, будут определены как RT-положительные в современных подходах ПЦР в реальном времени и могут скрывать ретровирусы, которые активируются при определенных условиях роста.
Альтернативно предпочтительными видами птиц в соответствии с настоящим изобретением для развития линии клеток являются не содержащие эндогенные ретровирусы или экспрессирующие обратную транскриптазу (RT). Они включают уток, которые являются подходящими по двум дополнительным причинам: яйца уток также доступны из контролируемых запасов без патогенов, и у уток, в отличие от гусей, меньше вероятность развития спонтанных опухолей. В то время, как известно, что многие из важных штаммов вакцин хорошо реплицируются в (эмбриональных) клетках уток, так же как и в (эмбриональных) клетках кур (например, вирус заболевания Марека (Witter R.L, Avian Dis. 46:925-37 (2002)) или краснуха (Rocchi G., Salvadori A., Nuovi Ann. Ig Microbiol. 21:336-40 (1970))), это еще следует продемонстрировать для штаммов вирусов, представляющих первостепенный интерес. Для других вакцин такие данные недоступны.
Насколько известно, новым и неожиданным открытием данного изобретения является то, что высоко ослабленный штамм вируса оспы MVA (измененная вакциния Анкара) реплицируется в линиях клеток утки с подобной или более высокой эффективностью, чем в обычно используемых первичных фибробластах эмбрионов кур. Один замысел изобретателей состоял в том, чтобы обеспечить безопасную и надежную альтернативу первичным клеткам для амплификации вирусов, которые нуждаются в организме птицы, или штаммов вакцин, где предпочтителен хозяин, не являющийся млекопитающим. Важным вирусом, для которого недоступны подходящие клетки-хозяева, является MVA (измененный вирус вакцинии Анкара). MVA представляет собой высокоослабленный вирус оспы и является чрезвычайно перспективным инструментом для терапевтических и защитных приложений вакцин. MVA выступает в роли модельного вируса для исследования клеток утки, но его не следует принимать в качестве единственного примера: описанные эксперименты могут также быть выполнены с рядом других вирусов или инфекционных агентов или терапевтических векторов, таких как вирусы кори, краснухи, бешенства или гриппа.
Фибробласты были выбраны в качестве предпочтительного типа клеток, главным образом, по историческим и практическим соображениям. Фибробласты представляют собой наиболее быстро растущие первичные клетки млекопитающих, а также птиц. Когда суспензию клеток от целых эмбрионов кур вносят в культуру, они являются не единственным, но преобладающим типом клеток. Однако растущие фибробласты чрезвычайно адгезивны и ослабляют это свойство только после полной (онкогенной) транформации. Этот процесс требует наличия сильных трансформирующих генов, таких как v-ras, нарушающих пути трансдукции сигналов. Раннее старение культур фибробластов частично вызвано полным отсутствием теломеразной активности у птиц и людей (Forsyth N. R. et al., Differentiation 69 (4-5): 188-97 (2002)).
Первичные фибробласты человека устойчивы к трансформации генами E1 аденовируса типа 5, которые непосредственно не нарушаются данными путями (собственное наблюдение). Эффективная иммортализация и рост в суспензионной культуре с большей вероятностью будут успешными для эпителиальных и нейронных клеток. Кроме того, эпителий, а не фибробласты, как представляется, является первичным сайтом для репликации вируса в яйце птицы. Интересно, что в отличие от ситуации с человеком, почка птицы действительно экспрессирует теломеразу в течение всей жизни, что делает клетки почки птицы хорошей мишенью для иммортализации. Взятые вместе эпителиальные клетки птиц, включая почечный эпителий и нейронные клетки, считают самыми перспективными мишенями для развития линии клеток с требуемыми свойствами.
Следовательно, разработка линии клеток птиц сосредоточена почти исключительно на фибробластах только в связи с простотой получения этих клеток (Cowen B.S., Braune M.O., Avian Dis 32(2):282-97 (1988); US 5,830,723). В некоторых случаях использовали целые эмбрионы (US 2001-0016348).
Вирусы демонстрируют специфичность не только по отношению к виду, но также и к органу и ткани, основанную на распределении рецепторов и клеточных факторов, способствующих репликации. Следовательно, в отличие от типичного подхода, предпочтительным способом выполнения настоящего изобретения является разделение органов до культивирования для получения наиболее предпочтительной клетки-хозяина.
Для вируса гриппа, адекватное вакцине продуцирование которого является главным приложением линий клеток в соответствии настоящим изобретением, типичным сайтом репликации является не эмбрион как таковой, а экстраэмбриональные мембраны. Следовательно, отдельная цель состояла также в разработке линии клеток от экстраэмбрионального материала, включая защитные мембраны эмбриона. Некоторые тканеспецифичные первичные культуры, включая таковые из экстраэмбриональных оболочек, обладают очень малым временем жизни по сравнению с фибробластами. Это дополнительно подчеркивает необходимость предумышленной иммортализации для получения улучшенных клеток-хозяев. Успешная иммортализация множества тканей в ограниченный промежуток времени требует определенного сочетания генов, используемых в рамках настоящего изобретения.
Не было известно, какая из тканей птицы обладает самым высоким потенциалом репликации для вирусов оспы, таких как MVA или оспа канареек. Для типичного производственного процесса для MVA требуется смесь клеток от эмбриона без головы, которую удаляют до измельчения. В связи с этим полной неожиданностью является то, что линия клеток нейронного происхождения, полученная из сетчатки, обладает такой высокой способностью к репликации MVA, в то время как другие ткани ею не обладают.
Такая же тканевая специфичность применяется для продуцирования белка. Способность к транскрипции зависит от доступного набора факторов транскрипции, и даже эффективные повсеместно распространенные вирусные и клеточные промоторы демонстрируют непостоянную эффективность в различных тканях. Кроме того, выход секретируемого белка сильно зависит от способности конкретного типа клетки к правильному сворачиванию и процессингу (например, гликозилат) белка.
Механизмы, приводящие к иммортализации и трансформации первичных клеток, были хорошо описаны (Harm W.C. et al., Nature 400:464-8 (1999)). Заданные элементы препятствуют (1) контролю прогрессии клеточного цикла, (2) запрограммированной гибели клеток, индуцированной нарушением регуляции клеточного цикла, (3) трансдукции сигнала фактора роста и для клеток человека и птиц (4) укорачиванию теломер, линейных концевых участков хромосом. Известно большое количество факторов, которые могут приводить первичные клетки к иммортализованному и трансформированному фенотипу, но иммортализация наступает за счет ингибирования клеточных контрольных пунктов, ответственных за сведение к минимуму формирования опухоли в организме. В связи с этим желательно выбрать трансформирующие факторы, которые могут произвести экспериментальное поколение линии клеток с минимальным риском индукции опухолевого роста у реципиентов биологических препаратов, полученных из сконструированных клеток. В связи с этим, требуется сбалансированная эффективность трансформирующих факторов: они должны быть достаточно эффективными, чтобы вызвать трансформацию без необходимости в накоплении дополнительных спонтанных мутаций, то есть молекулярный путь, приводящий к получающейся линии клеток, должен быть полностью известен (категории I и II в соответствии с заседанием совещательного комитета в мае 2000 офиса презентации вакцины FDA CBER). Кроме того, желательно выбрать синергичное сочетание факторов, которые по отдельности не могут трансформировать первичные клетки, таким образом, требуется согласованный перенос генофонда, который дополнительно сводит к минимуму риск самопроизвольной трансформации в вакцинах или у пациентов. Наконец, желательно, чтобы трансформирующий фактор выявил иммунный ответ у реципиента биологических препаратов так, чтобы в результате внесения продукта активизировался иммунологический надзор опухоли в маловероятном явлении формирования опухоли. Последний критерий можно осуществить, если используются не клеточные, а инородные, например вирусные, трансформирующие белки.
К настоящему времени обнаружено, что область E1 из аденовируса 5 человека (Ad5) идеально подходит для трансформации клеток так, чтобы получающаяся сконструированная клетка соответствовала всем приведенным выше критериям.
Область E1B кодирует две открытые рамки считывания на двуцистронной мРНК, белки 21К и 55К. Белок 55К связывается с p53 и, таким образом, преобразует проапоптотический активатор транскрипции в репрессор. Белок 21К дополняет данную антиапоптотическую активность путем связывания с Bax, таким образом, поддерживая целостность митохондриальной мембраны и предотвращая высвобождение цитохрома C. Этот белок является существенным для перехода адгезивных клеток в независимый от субстрата рост и, следовательно, существенным для процесса ферментации в суспензии.
До настоящего времени не было показано, может ли E1B 55К аденовируса человека воздействовать на птичьи гомологи p53. Кроме того, аденовирусы птиц не содержат генов, схожих с E1B, таким образом, это заключение также не было возможно. Вопреки всем ожиданиям изобретатели обнаружили, что E1B может обеспечить необходимые функции для обеспечения иммортализации E1A.
Новым и ключевым фактором для описанного в настоящем изобретении достижения было удаление E1B из неэффективного естественного контекста и размещение под контролем эффективного рекомбинантного промотора. Данная новая модификация и сочетание обеспечивали эффективную иммортализацию множества тканей утки и курицы путем трансфекции вместо трансдукции ретровируса.
Несмотря на то что механизм, лежащий в основе трасформации за счет E1, является сложным, один признак является наиболее желательным: E1A представляет собой сильный индуктор пролиферации и апоптоза клеток, тогда как белки E1B эффективно препятствуют апоптозу, но не могут ограничивать контроль клеточного цикла.
Следовательно, для поддержания экспериментально индуцированного трансформированного фенотипа необходим не единичный фактор, а непрерывное присутствие белков E1A и E1B.
С тех пор, как в 1970-х был описан v-src (Brugge J.S., Erikson R.L, Nature 269:346-8 (1977)), было открыто и охарактеризовано большое разнообразие трансформирующих факторов. В действительности, это было изучение индукции опухолей у птиц альфаретровирусами, которое обеспечило первые представления о молекулярной структуре (Martin G.S., Nature 227:1021-3 (1970)). Ретровирусные онкогены получают из клеточных генов с мутированными или делетированными важными регуляторными доменами. Некоторые из факторов, которые были идентифицированы в ходе этих изучений, такие как v-myc или v-ras, непосредственно воздействуют на компоненты путей RB и p53. Другие белки, такие как v-src или v-erbB, представляют собой конститутивно активируемые (следовательно, дисрегулируемые) трансдукторы сигнала, которые имитируют проникающие внеклеточные митогены. Проблема с данными факторами заключается в том, что их мишенью является только один из нескольких путей, необходимых для эффективной трансформации. Присутствие v-src или v-myc предрасполагает клетку к трансформации и требует дополнительных, спонтанных и непредсказуемых изменений в клетке для полного превращения. Следовательно, трудно оценить риск для пациента, представляемый клетками, трансформированными одним из ретровирусных онкогенов.
Известно, что другие ДНК-вирусы, такие как папилломавирусы и полиомавирусы, также трансформируют клетки in vitro. Однако выбранные трансгены не должны быть слишком агрессивными для сведения к минимуму риска индукции опухолевого роста у реципиентов биологических препаратов посредством непреднамеренно перенесенной клеточной ДНК. Этот критерий является особенно строгим для получения вакцины, которую часто прививают здоровой части населения в очень молодом возрасте. Даже со сложными современными способами очистки большой T-антиген полиомавируса считается слишком агрессивным для применения в линиях клетки, получаемых для применения в медицине человека. В виду того что 90% карцином шейки матки несут последовательности папилломавируса (Munoz N. et al., N. Engl., J. Med. 34816):518-27 (2003)), полагают, что аденовирусы C-типа (которые включают типы 2 и 5), не индуцируют опухоли in vivo, и аденовирусные последовательности не были обнаружены в ткани опухоли человека.
На основании дополнительных особенностей трансформирующих генов, показанных выше, было обнаружено, что сочетание генов, каждый из которых препятствует отдельному пути в клеточном цикле и апоптозе, должно получить генетически устойчивую линию клеток, растущую в суспензии.
Было показано, что полная область E1 аденовируса 5 может удовлетворить этим требованиям. Принимая во внимание, что было показано, что белок 12S E1A из Ad5 может взаимодействовать с RB птицы (Guilhot C. et al., Oncogene 8:619-24 (1993)), функциональная активность белков 55К и 21К в клетках птиц демонстрируется впервые в настоящем изобретении. Неудивительно, что некоторые клоны клеток перепела, экспрессирующие белок 12S из E1A, демонстрируют свойства трансформированных клеток (Guilhot C. et al., Oncogene 8:619-24 (1993)). Чрезвычайно эффективная и устойчивая трансдукция посредством инфекцирования ретровирусом создает достаточно большой пул клеток, чтобы позволить отдельным клеткам преодолеть блок клеточного цикла или индукцию апоптоза за счет спонтанных геномных изменений. Эти необходимые, но неизвестные изменения увеличивают медицинский риск, и получающуюся линию клетки нельзя считать сконструированной линией клеток, которая должна быть основана на известных генах. Кроме того, методики трансфекции недостаточны, чтобы создать большой пул клонов, необходимый для естественного отбора. Вместо этого была необходима трансдукция ретровируса. Трансформирующий ген, введенный с помощью данного подхода, будет фланкирован ITRs и, следовательно, может быть мобилизован, даже в большей степени в линии клеток, экспрессирующей обратную транскриптазу.
В последнее время аденовирус птиц, названный аденовирусом птиц типа 1 штамм CELO (что расшифровывается как смертельный сиротский вирус эмбрионов кур), был описан более детально (Chiocca S. et al., J. Virol. 70:2939-49 (1996)). Большие, центральные геномные отрезки CELO гомологичны Ad5, но отличаются по важным аспектам - CELO не содержит E1-гомологичную область среди других. Кроме того, CELO не может быть коплементарным Ad5, мутагенизированному в области E1A, и, наоборот, белки E1 Ad5 не могут трансактивировать транскрипцию замедленных ранних генов CELO (Li P. et al., J. Gen. Virol. 65(Pt 10): 1817-25 (1984)). Несмотря на это, CELO может трансформировать клетки хомяка in vitro (May J.T. et al., Virology 68:483-9 (1975)). В вирусе CELO были идентифицированы гены, препятствующие клеточному циклу и апоптозу, orf22 и GAM-1 (Lehrmann H., Cotton M., J. Virol. 73:6517-25 (1999)). Orf22 кодирует белок, который взаимодействуют с RB, и GAM-1 препятствует апоптозу в форме, подобной белку-прототипу 21К (Chiocca S. et al., J. Virol. 71:3168-77(1997)).
К настоящему времени обнаружено, что гены orf22 и GAM-1 из вируса CELO представляют собой подходящие замены E1A и E1B. Вследствие этого спектр доступных трансгенов для трансформации клеток птиц расширяется. Эти белки прежде не использовали для трансформации клеток птиц.
Кроме того, один из вирусных генов может быть замещен клеточным геном. Кандидатами на такую замену являются представители семейства E2F или циклины группы D для области E1A аденовируса и mdm2 для области E1B.
Следующие линии клеток были депонированы в DMSZ, Deutsche Sammlung von Mikroorganismen und Zellkulturen GmbH, Mascheroder Weg 1b, 38124 Braunschweig, Germany:
1. PBG04 как DSM ACC2577, депонированная 18 сентября, 2002;
2. 12A07-A10 как DSM ACC2695, депонированная 20 октября, 2004.
Изобретение будет более подробно пояснено со ссылкой на следующие примеры, которые, однако, не следует рассматривать как ограничивающие изобретение.
Примеры
Пример 1: Иммортализация первичных клеток утки посредством E1A, B аденовируса 5
Последовательности E1A и E1B аденовируса амплифицировали из культуры пассажа 8 первого поколения (E1 делетированный) аденовируса Admuc, выращиваемого в HEK 293, со значительными примесями вирусом дикого типа, с применением полимеразы provestart (Qiagen).
Использовали следующие праймеры:
VS182 ACTCGAGCTGACGTGTAGTGTATT (SEQ ID NO:l)
VS183 CACACGCAATCACAGGTT (SEQ ID NO:2)
для амплификации области E1A и
VS184 ACTCGAGTCATGGAGGCTTGGGAGT (SEQ ID NO:3)
VS185 ACACATTTCAGTACCTCA (SEQ ID NO:4)
для амплификации области E1B. Оба фрагмента сначала клонировали в pPCR4blunttopo (Invitrogene).
В конструкции E1B отсутствует акцепторная точка сплайсинга из первичного транскрипта E1B. В связи с этим ее заменяли синтетической последовательностью, амплифицированной с применением праймеров от лидерного интрона тяжелой цепи иммуноглобулина человека. В качестве матрицы использовали геномную ДНК от PBG04 (DMSZ ACC2577), гетерогибридомы мыши и человека.
Праймеры:
VintSA-F AAGGTACCCTCCCTAGTCCCAGTGA (SEQ ID NO:5)
VintSA-R CAATGTACAGAGTGGGCTCCTGTGG (SEQ ID NO:6)
Для создания составных белков данную акцепторную точку сплайсинга непосредственно клонировали в pEFmyc, содержащей альфа промотор aEFl и лидерный пептид myc. Область E1A удаляли из ptopoE1A с применением сайтов EcoR I и Xho I и непосредственно клонировали в pEFmyc, удаляя лидерную последовательность myc и связывая E1A с поли-A гормона роста быка. Область E1B повторно удаляли с помощью ферментов рестрикции EcoR I и Xho I и клонировали в pEFmycSA, содержащей ксеногенный сайт акцепторной точки сплайсинга. Получающиеся плазмиды назвали pEFAd5E1A (SEQ ID NO:7) и pEFAd5E1BSA (SEQ ID NO:8).
Яйца утки с эмбрионом инкубировали при 37°C, 60% влажности воздуха в течение 12 дней (более ранние эмбрионы давали больше клеток, но также содержали и большее количество загрязняющих, дифференцированных фибробластов). Скорлупу стерилизовали 70% изопропанолом, вскрывали на тупом конце, и эмбрион асептически переносили на стерильную чашку Петри. Эмбриональный мозг и почки удаляли, переносили на отдельные чашки Петри, заполненные трипсином/EDTA и измельчали. После краткосрочного инкубирования суспензию смешивали с избытком среды F12 (Gibco/Invitrogen), с добавкой 10% фетальной телячьей сыворотки (Biochrom) и 2% Ultroser G (Ciphergen). Данную суспензию перенесли в чашку Петри и проводили культивирование при 37°C (что ниже, чем 41,6°C, физиологическая температура курицы) и 5% CO2. Культуральную среду с неадгезивными остатками меняли на следующий день и продолжали культивирование до тех пор, пока, по меньшей мере, 5 x 105 клеток на каждую 3,5 см чашку не было доступно для трансфекции плазмид pEFAd5E1A и pEFAd5E1BSA.
Начальные эксперименты, сравнивающие реактивы для трансфекции с помощью липосом (Effectene; Qiagen) и дендромеров (Polyfect; Qiagen), продемонстрировали, что эффективность Effectene выше. Трансфекцию проводили с применением реактива Effectene; кратко: 2 мкг плазмидной ДНК разбавляли в 200 мкл буфера EC, содержащего 16 мкл энхансера. После инкубирования в течение 5 минут добавляли 16 мкл Effectene. После инкубирования в течение 10 минут из культуры в 3,5 см чашках удаляли супернатант и заменяли 1 мл свежей среды, содержащей смесь для трансфекции. После инкубирования в течение 2 часов при 37°C и 5% CO2 в культуру добавляли дополнительные 2,5 мл свежей среды.
Трансфицируемым клеткам позволяли достичь слияния, их трипсинизировали, ресуспендировали в среде F12 FCS/Ultroser с добавкой G и повторно высевали в две 6-луночные плашки (что соответствует 12-кратному размножению). По истечении 5 и 10 дней среду заменяли на F12 с добавкой только 5% FCS. Плашки просканировали на образование очагов клеток с измененной морфологией (уменьшение полного размера клетки, увеличенное ядро, повышенная видимость плазматических мембран в фазовом контрасте) и повышенным слиянием.
По истечении приблизительно 14 дней после трансфекции, когда очаги достигают в диаметре 1-3 мм, среду аспирировали и дважды промывали культуру трипсоном/EDTA (Gibco). Пропитанные трипсином диски для клонирования (Sigma) размещали на аспирированных культурах в течение 3 минут, затем переносили в лунки 24-луночной плашки, заполненной 500 мкл среды F12, с добавкой 5% FCS.
Клонированным, трансформированным клеткам позволяли расти до слияния, их трипсинизировали, ресуспендировали в среде F12 с добавкой 5% FCS и переносили в 6-луночные плашки. Как только культура достигала слияния в 6-луночной плашке, клетки переносили в колбы T25 для непрерывного пассирования.
Для криоконсервации в определенные интервалы клетки трипсинизировали, ресуспендировали в среде F12, содержащей 5% FCS, собирали путем центрифугирования при 100 g в течение 10 мин, ресуспендировали в среде F12, содержащей 50% FCS и 10% DMSO (Sigma) до концентрации приблизительно 3×106 клеток на мл, и размещали в криопробирках в охлаждающем устройстве на основе изопропанола при -75°C. Охлаждающее устройство обеспечивало постоянную скорость охлаждения 1°C в мин. По истечении 24 часов клетки переносили в жидкий азот для длительного хранения.
Пример 2: Улучшенное получение иммортализованных линий клеток птиц
a) Получение первичных клеток
Группа производителей утиных яиц была сертифицирована на отсутствие Salmonella enteritidis и S. typhimurium; Mycoplasma gallisepticum и M. synoviae; случай лейкоза, ретикуло-эндотелиоза, орнитоза, птичьего гриппа, гепатита уток и болезни Держи. Животных преднамеренно не вакцинировали против парвовируса, и случаи парвовирозов не были обнаружены. Животных в группе производителей вакцинировали против S. enteritidis и S. typhimurium; Pasteurella multicodica; метапневмовирус трахеит индейки и парамиксовируса, вызывающего болезнь Ньюкастла.
Яйцам позволяли прийти в равновесие без встряхивания при комнатной температуре и по истечении двух дней инкубировали при 38°C в часто вращающейся влажной камере, с чередованием +45° и -45°.
Эмбрионы уток умерщвляли для выделения первичных клеток по истечении одной или трех недель инкубирования. Яйца переносили в секцию cGMP (закрытую лабораторию, работающую, как отмечено Current Good Manufacturing Practices), и стерилизовали скорлупу путем протирания 70% изопропанолом в ламинарном вытяжном шкафу. Все последующие этапы выполняли в установке секции GMP в стерильных условиях с определенными растворами или средами.
Яйца осторожно вскрывали, эмбрионы переносили на большую чашку Петри и сразу умерщвляли путем декапитации. Извлекали образцы из следующих органов: мозг, сетчатка, печень, пищевод, сердце и экстраэмбриональные оболочки.
Кроме того, клетки из сомитов готовили из 8-дневного эмбриона.
Все образцы промывали PBS (фосфатно-буферным солевым раствором; Gibco/Invitrogen, США), обрабатывали трипсином (Gibco/Invitrogen, США) в течение 1-10 минут и измельчали в культуральной среде DMEM:F12 (Gibco/Invitrogen, США) с добавкой 10% FCS (Biochrom AG, Германия) путем повторного пассирования через шприц 18G. Гомогенизированные образцы выращивали при 37°C и 5% CO2. Остатки удаляли из адгезивных клеток путем замены среды на следующий день.
b) Плазмидные конструкции
Плазмиды экспрессии для E1A, E1B, Orf22 и Garni были сконструированы путем извлечения подходящих целевых областей из геномной ДНК аденовируса серотипа 5 или смертельного сиротского вируса эмбрионов кур (CELO) дикого типа соответственно с помощью ПЦР и вставки в векторы, содержащие промоторы фосфоглицераткиназы человека или мыши (hPGK или mPGK), CMV мыши (moCMV) или tk (фиг.1).
Последовательности аденовирусов для E1A и E1B амплифицировали из вируса дикого типа с применением полимеразы ProofStart (Qiagen, Германия). Использовали следующие праймеры:
VS182 ACTCGAGCTGACGTGTAGTGTATT (SEQ ID NO:1)
VS183 CACACGCAATCACAGGTT (SEQ ID NO:2)
для амплификации области E1A и
VS184 ACTCGAGTCATGGAGGCTTGGGAGT (SEQ ID NO:3)
VS185 ACACATTTCAGTACCTCA (SEQ ID NO:4)
для амплификации области E1B. Оба фрагмента сначала клонировали в pPCR4-Blunt-TOPO (Invitrogene, США).
В конструкции E1B отсутствует акцепторная точка сплайсинга из первичного транскрипта E1B. В связи с этим ее заменили синтетической последовательностью, амплифицированной с применением праймеров от лидерного интрона тяжелой цепи иммуноглобулина человека. В качестве матрицы использовали геномную ДНК от PBG04 (DMSZ ACC2577), гетерогибридомы мыши и человека.
Праймеры, используемые для амплификации:
VintSA-F MGGTACCCTCCCTAGTCCCAGTGA (SEQ ID NO:5)
VintSA-R CAATGTACAGAGTGGGCTCCTGTGG (SEQ ID NO:6)
Гены GAM-1 и ORF-22 амплифицировали из вируса CELO дикого типа с праймерами
V206 AAC CTC GAG ACC CCC CTG TAC ATT CTA (SEQ ID NO: 11)
и V207 GCC GTT AAC TTC AGG GAT TGG TTA CAG (SEQ ID NO: 12) и
V208 CAC CTC GAG TCC GGA TTA AGA TGA ACG (SEQ ID NO: 13) и
V209 CCA GTT AAC AGG TGA ACC ATT TAT ACA G (SEQ ID NO: 14) соответственно.
Репрезентативные примеры получающихся плазмид приводятся с плазмидой 49E (факторы аденовируса под контролем промоторов PGK человека и CMV мыши; SEQ ID NO:9), плазмида 25F (факторы CELO под контролем промоторов PGK мыши и человека; SEQ ID NO: 10), плазмида 60E (факторы аденовируса под контролем промоторов PGK и tk человека; SEQ ID NO: 18) и плазмида 36E (фактор CELO под контролем промотора PGK мыши; SEQ ID NO: 19) (см. также фиг.1).
Целостность плазмид экспрессии подтверждалась секвенированием. Плазмиды не наделены способностью экспрессировать факторы резистентности к антибиотикам (таким как ампициллин) в эукариотических клетках.
c) Трансфекция
Первичные культуры трансфицировали плазмидами экспрессии для E1 или Orf22/Gam1 вскоре после выделения или после единичного субкультивирования. В зависимости от эксперимента плазмиды трансфицировали в виде суперспиралей или после линеаризации с помощью фермента рестрикции Sca I (New Englands Biolabs, США). Начальные эксперименты для сравнения реактивов для трансфекции с помощью липосом (Effectene; Qiagen, Германия) и дендромеров (Polyfect; Qiagen, Германия) продемонстрировали, что эффективность Effectene выше. Трансфекцию проводили следующим образом: 2 мкг полной ДНК разбавили в 200 мкл предоставленного буфера EC и смешали с 16 мкл предоставленного энхансера. После инкубирования в течение 2-5 минут при комнатной температуре добавили 20 мкл реактива Effectene. По истечении 5-10 минут при комнатной температуре данную смесь использовали на клетках в 8 см2 чашке, покрытых 1 мл культуральной среды. По истечении 2-5 часов добавили дополнительные 1,5 мл культуральной среды. На следующий день среду заменяли 2 мл свежей культуральной среды и после этого раз в неделю. Успешная трансфекция была подтверждена в параллельном эксперименте с геном-репортером.
Клетки непрерывно пассировали в среде DMEM:F12, содержащей 10% FCS.
По истечении двадцати дней после трансфекции наблюдались изменения морфологии в определенных субпопуляциях (очаги; фиг.2) некоторых культур; в других культурах очаги не появлялись или были не в состоянии конкурировать с интенсивной пролиферацией первичных клеток; кроме того, другие культуры претерпевали массовую гибель и старение клеток вскоре после трансфекции.
Большое количество независимых очагов размножили из культур с клетками, полученными из печени, сетчатки и экстраэмбриональной мембраны, трансфицированными плазмидой 49E. При пассаже 10, например, линию клеток 12A07-A10, происходящую из клеток экстраэмбриональной мембраны утки, трансформированных плазмидой 49E, выделили и депонировали в DSMZ.
Очаги были также получены от культур с клетками из сетчатки и сомитов, трансфицированными плазмидой 60E.
В плазмиде 49E PGK и промоторы CMV мыши управляют экспрессией E1A и E1B соответственно. Плазмида 60E (SEQ ID NO: 18) также кодирует полную Ad5-E1 область, но экспрессия защитной области E1B управляется tk, то есть промотором, который не такой эффективный, как промотор CMV мыши (но более эффективный, чем нативный промотор E1B). По сравнению с результатами с плазмидой 49E с данной конструкцией было получено гораздо меньше очагов в меньшем количестве образцов клеток, что согласуется с защитным эффектом, придаваемым E1B.
В культурах печени, трансфицированных плазмидами CELO 36E (SEQ ID NO:19) и 25F (SEQ ID NO:10), также наблюдалось формирование очагов, выглядящих как первичные клетки и с трансформированным фенотипом.
Культуры с очагами размножали путем обработки трипсином в течение 2-3 минут и ресуспендирования в среде DMEM:F12 для переноса в свежие культуральные сосуды.
Для криоконсервации через регулярные промежутки времени клетки удаляли с помощью трипсина, ресуспендировали в среде DMEM:F12, содержащей 10% FCS, собирали путем центрифугирования при 200×g в течение 10 минут, ресуспендировали в среде DMEM:F12, содержащей 50% FCS и 10% DMSO (Sigma, США) до концентрации приблизительно 3×106 клеток на мл и охлаждали со скоростью 1°C в минуту до -80°C. По истечении 24 часов клетки переносили в жидкий азот для длительного хранения.
Пример 3: Иммунофлюоресцентный анализ для устойчивой трансфекции
Культуры потенциально иммортализованных клеток высевали на предметные стекла, и их оставляли делиться в течение нескольких дней перед фиксацией ледяным метанолом в течение 10 мин. Фиксированные клетки инкубировали с антителами против белков E1A и E1B 55K, вторичными антителами и флуоресцентным красителем, специфичным к последним в соответствии со стандартом иммунофлуоресцентных способов (Becton Dickinson, Великобритания, антитело #554155 против E1A, разбавленное 1:30; Oncogene, США, антитело #DP08-100UG против E1B 55K, разбавленное 1:30; вторичное антитело, направленное против мыши или крысы, соответственно, и конъюгированное с биотином, от Jackson Immuno Research, США, разбавленное 1:80; визуализация с помощью конъюгата стрептавидин-Texas Red #016-070-084 от Jackson Immuno Research, США, разбавленного 1:100). Первичные клетки, еще присутствующие в большом количестве в ранних, еще не полностью адаптированных, иммортализованных линиях клеток и легко различимые по морфологии, обеспечили удобный внутренний отрицательный контроль для специфичности антитела. Клетки 293 (клетки почек эмбрионов человека), которые устойчиво экспрессируют область E1 Ad5, служили положительным контролем. На конечном этапе инкубирования добавляли DAPI (4',6-диамидино-2-фенилиндол; Sigma, США) до концентрации 1 мкг/мл для окрашивания ядер клеток с целью ориентации.
Сильный сигнал для E1A и 55K наблюдался только в клетках, которые претерпевали типичные изменения морфологии, подтверждающие успешную иммортализацию за счет трансфицируемых плазмид (фиг.3). Кроме того, не наблюдалась спонтанная трансформация, формальная возможность, поскольку все клетки с измененным фенотипом были E1-положительными. Ни одна из клеток с первичным фенотипом не экспрессировала белки E1. Несмотря на возможность трансфекции суперспиралей, у которых линеаризация плазмиды в процессе интеграции происходит в произвольных положениях, ни один из исследованных очагов не продемонстрировал экспрессию E1A в отсутствие экспрессии E1B, что дополнительно подчеркивает необходимость в двойном разрыве путей для иммортализации.
Пример 4: Анализ на эндогенный и экзогенный ретровирусы
Обычной проблемой при продуцировании вакцин в первичных фибробластах курицы является заражение экзогенным или эндогенным ретровирусами. Многообразие семейства ретровирусов слишком велико, чтобы предсказать, является ли данный вид носителем ретровирусов. В связи с этим отчеты из литературы обычно ограничиваются субпопуляцией семейства ретровирусов, например, EAV-HP/ALV подгруппа J (Smith L.M. et al., J. Gen. Virol. 80(ptl):261-8 (1999)) и в дальнейшем только субпопуляцией вида птицы.
Следовательно, достоверное подтверждение наличия заражения ретровирусами должно сосредотачиваться на общем мотиве, присутствующем в этих вирусах. Разнообразие последовательностей препятствует способам обнаружения на основе нуклеиновых кислот. Однако общим для всех ретровирусов является наличие фермента обратной транскриптазы. В связи с этим супернатант размноженных очагов от клеток печени утки, иммортализованных плазмидой 49E, анализировали с помощью ПЦР, стимулированного продуктом, на основе количественной пробы для обратной транскриптазы (Q-PERT) и сравнивали с несколькими контрольными группами, среди прочего, CHO в качестве положительного контроля и клетками 293 в качестве отрицательного контроля (см. ниже и фиг.4) для обнаружения эндогенных ретровирусных активностей или примесей свободных ретровирусов. Анализ является модификацией метода из литературы (Lovatt A. et al., J. Virol. Methods 82(2): 185-200 (1999)). Кратко: ретровирусы концетрировали из супернатанта культуры путем ультрацентрифугирования при 100000×g через барьер 20% сахарозы в PBS для удаления продуктов разрушения клеток. Вирионы (если присутствуют) ресуспендировали в буфере для лизиса (50 мМ Трис pH 7,8, 80 мМ KCl, 2,5 мМ DTT, 0,75 мМ EDTA, 0,5% Triton X-100) и смешивали с субстратным буфером (по 10 мМ дАТФ, дЦТФ, цГТФ и дТТФ; 15 мкМ специфичного праймера [GCC TTT GAG AGT TAC TCT TTG; SEQ ID NO: 15]; и 0,5 мг/мл фрагментированной ДНК из спермы сельди [Promega Corp, #D1811]), содержащим модельную РНК (5 мкг/мл РНК вируса мозайки костра [Promega Corp, США, #D1541]), которая подвергается обратной транскрипции, если активность в образце присутствует RT. кДНК от модельной РНК амплифицировали с помощью ПЦР с праймерами (AAA CAC TGT ACG GCA CCC GCA TT; SEQ ID NO: 16) и (GCC TTT GAG AGT TAC TCT TTG; SEQ ID NO: 17) и регистрировали посредством зеленой флюоресценции SYBR в системе детекции последовательности AB 7000, использующей Смесь QPCR SYBR Green ROX #AB-1163 от Abgene, Великобритания, в соответствии с инструкциями производителя.
На фиг.4 продемонстрирована высокая активность RT в клетках CHO, как ожидалось в связи с отчетами в литературе (например, Anderson K.P. et al., Virology 181(1): 305-311 (1991)). С помощью этих клеток в качестве положительного контроля и клеток 293 человека, не содержащих ретровирусную активность, в качестве отрицательного контроля были определены рамки, которые позволяют интерпретировать неизвестную активность RT в супернатанте клеточных культур (фиг.4, полужирные квадраты и полужирные треугольники).
Авторы изобретения обнаружили умеренную активность RT в фибробластах эмбрионов кур (фиг.4, символы в виде полужирных ромбов).
Сигнал активности RT в супернатанте клеток утки был сравним с сигналом активности RT в клетках 293, и они оба были сравнимы с контролем, представляющим предел чувствительности анализа, состоящего из модельной РНК, не инкубированной с RT (фиг.4, ср. кривые с незаполненными и полужирными треугольниками и серыми кругами). Эквивалентные уровни интенсивности сигнала (дельта Rn) были разделены, по меньшей мере, двумя номерами циклов между образцами от клеток CHO и фибробластов эмбрионов кур (которые для этих экспериментов получены из источника, для которого известно, что он является лишь слабо RT - положительным), и, по меньшей мере, четырьмя номерами циклов между образцами от клеток CHO и отрицательного контроля 293 и культуры клеток утки. Таким образом, в противоположность клеткам кур описанные клетки уток не проявляют активности RT и, следовательно, обладают важным признаком для пригодности в фармацевтических применениях.
Пример 5: Модифицированный вирус вакцины Анкара (MVA)
Пригодность размноженных очагов в качестве субстрата для амплификации MVA определяли для линий печени, сетчатки, сомитов и экстраэмбриональной мембраны. В таблице и на фиг.5 показаны результаты, полученные путем инфекцирования линий клеток посевным материалом, приготовленным из массового препарата MVA (ATCC #VR-1508) на CEFp, первичных фибробластах эмбрионов кур. Данные в таблице, полученные путем инфекции с MOI (множественностью заражения или количеством инфекционных частиц на клетку-хозяина), равным 0,1, демонстрируют, что выход вируса в клетках сетчатки и сомитов (в бляшкообразующих единицах на мл) сопоставим или даже превышает выход, полученный с помощью клеток CEFp.
Таблица: Сравнение титров вирусов, полученных при параллельной инфекции 1 - 5×105 клеток в углублениях 24-луночных плашек. Количество введенного вируса было доведено до значения MOI 0,1. CEFp, свежие первичные фибробласты эмбрионов кур; мембрана, экстраэмбриональная мембрана.
Бляшкообразующие единицы для MVA на клетках утки определяли следующим образом: вирус MVA восстанавливали из зараженных клеток по истечении 48 часов из супернатанта и из адгезивных клеток, разрушаемых путем повторяемого замораживания-оттаивания. Клетки VERO (почки африканской зеленой обезьяны) высевали в 96-луночные плашки (2×104 клеток на лунку) и инфицировали путем серийных 10-кратных разбавлений суспензии, содержащей MVA, на следующий день. Через два дня после этого культуры фиксировали метанолом, и инфицированные клетки инкубировали с поликлональными антителами вируса вакцины (Quartett, Германия, #9503-2057, при разбавлении 1:1000 в PBS, содержащем 1% фетальной телячьей сыворотки) в течение 1 часа при 37°C. Два этапа промывки выполняли с PBS, содержащим 0,05% Tween 20 (Sigma Corp, США), и добавляли вторичное антитело к специфичному к вакцине антителу при разбавлении 1:1000 в PBS, содержащем 1% фетальной телячьей сыворотки. Данное вторичное антитело присоединено к ферменту пероксидазы, который катализирует цветовую реакцию при инкубировании с реактивом AEC (3-амино-9-этилкарбозол; 0,3 мг/мл в 0,1 М ацетатного буфера, pH 5,0, содержащего 0,015% H2O2). Инфицированные очаги идентифицировали с помощью световой микроскопии, и бляшкообразующие единицы рассчитывали из максимального разбавления суспензии MVA, которое дает положительную реакцию красителя.
На фиг.5 отображен выход вируса на клетку. Выход вируса на клетку коррелирует с пермиссивностью данной клетки-хозяина по отношению к конкретному вирусу. На пермиссивность влияют биохимические свойства, такие как плотность рецепторов или эффективность процессинга структурных белков вируса. На фиг.5 продемонстровано, что количество инфекционных частиц, выпущенных в каждую клетку сетчатки или в каждую клетку сомита, сравнимо с полученным количеством инфекционных частиц в каждом фибробласте эмбриона курицы.
Деление "выхода вируса на клетку" на "MOI" дает размер вспышки, отношение входного количества вируса к выходному количеству вируса. Размер вспышки эквивалентен степени амплификации вируса и, таким образом, является важным показателем для оценки стоимости и необходимых ресурсов для крупномасштабного продуцирования. Определенные размеры вспышки в описанном примере составили 374 для CEFp, 513 для клеток сетчатки и 1108 для клеток, полученных из сомитов. Клетки сетчатки и клетки сомитов дают лучшие значения, чем свежие первичные фибробласты эмбрионов кур, и, таким образом, должны предоставить лучшие субстраты для крупномасштабного продуцирования MVA.
Неудовлетворительные результаты амплификации MVA, полученные с клетками, происходящими из печени или экстраэмбриональной мембраны, нельзя применить к другим семействам вирусов: для специалиста в данной области очевидно, что амплификация других вирусов, например, относящихся к вакцине вирусов гриппа может быть чрезвычайно успешной в этих клетках.
Предположительно с последующим пассированием вируса в данной клетке-хозяине титр выхода уменьшается. Такие явления могут возникать, если клетки-хозяева поддерживают большую часть, но не все этапы в различных стадиях инфекционного цикла. Для рассмотрения этого вопроса на клетках сетчатки утки, трансформированных плазмидой 49E, провели серийное пассирование MVA. Данные на фиг.6 демонстрируют, что MVA не теряется при пассировании в этих клетках: при одинаковых уровнях вводимого вируса, доведенных до MOI 0,3 (показано столбцами на фиг.6), размер вспышки (полужирные квадраты) увеличивается в девять раз от 35 до 315. Причиной увеличения размера вспышки может быть улучшение свойств клетки-хозяина при увеличении количества пассажей.
В заключение, клетки сетчатки и клетки, производные сомитов утки, полученные путем трансфекции области Ad5-E1 при условиях cGMP, устойчиво поддерживают амплификацию MVA с эффективностью, сопоставимой или лучшей, чем первичные фибробласты эмбрионов кур. В связи с чрезвычайно ослабленной природой MVA обычные линии клеток не подходят для крупномасштабного производства вирусов. Неожиданным открытием является то, что сконструированные линии клеток утки лучше подходят для размножения MVA, чем первичные клетки кур и, таким образом, могут обеспечить новые платформы для получения этого важного вакцинного кандидата. Описанные линии получены при условиях cGMP и, следовательно, они подходят для фармацевтического применения.
Реферат
Изобретение относится к области биотехнологии и вирусологии. Линию клеток получают из первичных клеток, которые трансформируют, по меньшей мере, двумя вирусными или клеточными генами, один из которых вызывает прогрессию клеточного цикла, тогда как другой препятствует природным защитным механизмам клетки, индуцируемым дисрегуляцией репликации. Кроме того, раскрыто получение указанных линий клеток и их применение для получения биологических препаратов или вирусов для вакцинации. 5 н. и 8 з.п. ф-лы, 6 ил., 1 табл.
Формула
(i) линия клеток получена из эмбриона или вылупившейся курицы, утки, гуся, перепела и т.п., предпочтительно из курицы или утки; и/или
(ii) клетки, подвергаемые иммортализации, представляют собой первичные клетки, включающие фибробласты, клетки из выделенных сегментов тела (сомитов), или выделенные одиночные органы, включая ткани нейронов, мозга, сетчатки, почек, печени, сердца, мышц и экстраэмбриональные ткани и мембраны, предохраняющие эмбрион; и/или
(iii) иммортализация путем невирусной трансфекции включет, без ограничений, трансфекцию, опосредованную липосомами, дендримерами, и электропорацию; и/или
(iv) первый ген представляет собой ген вируса, обеспечивающий разрушение комплексов между белками ретинобластомы и факторами транскрипции E2F, такой как ген Е1А аденовируса из мастаденовирусов, предпочтительно из мастаденовирусов группы С, ген Е7 папилломавирусов, предпочтительно из вируса папилломы человека низкого риска (HPV) (такого как HPV1, HPV6 и HPV11, но не HPV16, HPVI8), ген orf 22 аденовирусов птиц, открытые рамки считывания Е43 из атаденовируса овцы и т.д.; или представляет собой ген клетки, обеспечивающий разрушение комплексов между белками ретинобластомы и факторами транскрипции E2F, такой как циклины D1, D2 или D3, мутированный CDK4, не восприимчивый к инактивации, посредством p16INK4a и т.д.; и/или
(v) второй ген представляет собой ген вируса, кодирующий белок, предотвращающий индукцию торможения роста и апоптоз, посредством р53, такой как белок E1B55K аденовируса всех групп, GAM-1 из CELO, белок Е6 папилломавирусов, предпочтительно из HPV низкого риска (таких как HPV1, HPV6 и HPV11, но не HPV16, HPV18), или клеточный белок, предотвращающий торможение роста и апоптоз, посредством р53, такой как mdm2 и т.д.; и/или
(vi) первый ген и второй ген пространственно разделены гетерогенными последовательностями, или расположены на различных сегментах нуклеиновой кислоты или плазмидах.
(ii) гены orf22 (первый ген) и GAM 1 (второй ген) из аденовируса, предпочтительно рода aviadenovirus CELO, которые предпочтительно содержат последовательность, представленную последовательностью, комплементарной 1252-635 п.о. из SEQ ID NO:10, и последовательность, комплементарную 3138-2290 п.о. из SEQ ID NO:10 соответственно; и/или (iii) сочетания нуклеиновых кислот, кодирующих Е1А и/или Е1В с GAM-1 и/или Orf22, как определено выше в (i) и (ii).
(i) дополнительно несет неприродные функциональные последовательности, включая, без ограничений, трансгены, такие как гены, комплементарные дефицитным вирусам (например, EBNA1 и т.д.), промоторы (например, PGK-, EF1.alpha-, CMV-промотор, tk-промотор и т.д.), энхансеры (например, RSV-LTR), селективные маркеры, такие как резистентности к неомицину, резистентности к пуромицину и т.д.; и/или
(ii) подходит для получения биологических препаратов или вирусов, включая вакцинные штаммы и рекомбинантные вирусные векторы.
(i) не обладает активностью обратной транскриптазы; и/или
(ii) получена в результате иммортализации первичной клетки, происходящей из эмбрионов уток или вылупившихся уток; и/или
(iii) получена из экстраэмбриональной оболочки; и/или
(iv) культивирована в среде определенного химического состава, которая предпочтительно не содержит сыворотку животного.
(i) контактирование указанных вирусов с линией клеток по любому из пп.1-7; и/или
(ii) культивирование указанных вирусов в указанной линии клеток;
(iii) выделение указанного вируса из супернатанта или из клеток.
(i) введение гена, кодирующего рекомбинантный белок, функционально связанного с промотором, в линию клеток по любому из пп.1-7,
(ii) культивирование указанной модифицированной линии клеток; и
(iii) сбор рекомбинантного белка.

Комментарии