Конструкции нуклеиновой кислоты и векторы для генотерапии для применения для лечения болезни вильсона и других состояний - RU2745567C2
Код документа: RU2745567C2
Чертежи





Описание
ОБЛАСТЬ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к конструкциям нуклеиновых кислот и векторам для генотерапии для применения для лечения болезни Вильсона и других состояний.
ПРЕДШЕСТВУЮЩИЙ УРОВЕНЬ ТЕХНИКИ
Существующий уровень техники относительно генной терапии болезни Вильсона был рассмотрен Merle et al. (Current Gene Therapy 2007; 7: 217-220) и в настоящем документе был обобщен и дополнен более поздними раскрытыми ссылками.
Болезнь Вильсона (БВ) представляет собой аутосомно-рецессивное наследственное нарушение метаболизма меди со средней распространенностью 1:30,000. БВ вызывают мутации в гене ATP7B, расположенном на хромосоме 13, который кодирует транспортирующую медь АТФазу P-типа. ATP7B, в основном, экспрессируется в гепатоцитах и участвует в трансмембранном транспорте меди. Отсутствие белка или сниженная функция белка ATP7B приводит к сниженной гепатоцеллюлярной экскреции меди в желчь и к накоплению меди сначала в печени, а затем в нервной системе и других тканях. Дополнительным следствием потери функционального белка ATP7B является неспособность включать медь в церулоплазмин.
БВ может присутствовать клинически как заболевание печени, как прогрессирующее неврологическое нарушение или как психиатрическое заболевание. Пациенты с печеночной БВ, как правило, находятся в позднем детском или подростковом возрасте, и демонстрируют признаки острого гепатита, молниеносной печеночной недостаточности или прогрессирующего острого заболевания печени. Неврологические проявления БВ, как правило, случаются позже, чем заболевание печени, наиболее часто во второй или третьей декаде жизни и включают экстрапирамидные, мозжечковые и церебральные симптомы.
Целью медицинского лечения БВ является удаление токсического накопления меди из организма и предотвращение ее повторного накопления. В настоящее время для БВ одобрены три лекарственных средства против меди: D-пеницилламин, триентин и соли цинка. Медицинское лечение эффективно у большинства, но не у всех пациентов с БВ. Вариантом терапии у пациентов с БВ с молниеносной печеночной недостаточностью или прогрессирующей печеночной недостаточностью является пересадка печени. Было показано, что она корректирует фенотип БВ и обеспечивает прекрасное длительное выживание.
Однако, прерывание терапии или несоответствующее лечение могут привести к летальным исходам в течении нескольких месяцев. Из-за того, что препараты при БВ следует принимать регулярно, режим лечения у некоторых пациентов, особенно у пациентов подросткового возраста с БВ, соблюдается плохо.
При терапии относительно распространены остаточные неврологические симптомы и даже могут возникать прогрессирующие симптомы. Поскольку текущие варианты лечения эффективны не у всех пациентов с БВ, и соблюдение режима представляет собой проблему, более кардинальное решение может включать генотерапию.
Теоретически, экспрессия ATP7B дикого типа в гепатоцитах могла бы обратить вспять все нарушения, связанные с заболеванием, спасти печень и избавить от неврологических симптомов. Конечной целью идеальной генотерапии для БВ была бы доставка ATP7B, в достаточном количестве, конкретно, в гепатоциты в течение всего срока жизни.
Все опубликованные исследования по аденовирусному переносу генов для БВ, использовали аденовирусные векторы ранних поколений, создающие только временную экспрессию трансгена. Terada et al. [Terada et al. J. Biol. Chem. 1998; 273:1815-1820; Terada et al. FEBS Lett. 1999; 448: 53-56] продемонстрировали успешный перенос гена при помощи доставки генов посредством аденовирусом на крысиной модели линии LEC. Было показано восстановление синтеза холоцерулоплазмина, активности сывороточной церулоплазминоксидазы и экскреции меди в желчь, что указывало на терапевтический эффект переноса генов. Эти воздействия имели ограниченный срок действия, с максимальным уровнем на сутки 3 и с последующим снижением. Ha-Hao et al. [Z. Gastroenterol. 2002; 40: 209-216] также продемонстрировали повышенное содержание меди в испражнениях крыс линии LEC после переноса гена ATP7B, опосредованного аденовирусом, что указывает на повышенную экскрецию меди в желчь. Кроме того, терапевтический эффект был продемонстрирован путем восстановления холоцерулоплазмина и его феррооксидазной активности. Однако снова продолжительность терапевтического эффекта в этих экспериментах была только временной с ограниченной длительностью в несколько суток.
До сих пор для этих целей не тестировали «выпотрошенные» аденовирусные векторы.
Другую широко используемую не интегрирующую векторную систему на основе вируса, аденоассоциированный вирус (AAV), также до сих пор никогда не тестировали для БВ, в основном, поскольку ген ATP7B (приблизительно величиной 4,4 т.п.н.) оставляет минимум пространства для размещения остальных необходимых последовательностей (например, промотора, сигнальной последовательности поли A, и т.п.) внутри вектора AAV, чья емкость упаковки составляет 4,4-4,7 т.п.н. Немецкая патентная заявка DE 100156121A1 (опубликована в 2003) предлагает рекомбинантный адено-ассоциированный вирусный вектор для генотерапии БВ, который обладает укороченным металло-чувствительным промотором (промотор металлотионеина-I) для получения экспрессии трансгена ATP7B, индуцируемой цинком или медью. Однако, ни в этом документе, ни позже не описано никакой информации относительно терапевтической эффективности и качеств вектора.
С другой стороны, на модели животных с БВ были исследованы несколько лентивирусных векторов, несущих ATP7B дикого типа. Merle et al. [Scan. J. Gastroenterol. 2006; 41: 974-982] описали системную генотерапию у крыс линии LEC при помощи лентивирусных векторов, экспрессирующих ATP7B под контролем фосфоглицерокиназного промотора. Через двадцать четыре недели после переноса гена в печень содержание меди было значительно снижено, а гистология печени улучшилась у обработанных крыс по сравнению с необработанными контролями, но эффект был только частичным. Активность церулоплазминоксидазы в сыворотке была повышена через две недели после переноса гена по сравнению с контролями, однако, она опустилась до нижних уровней через 24 недели после лечения. Относительно недавно, Roybal et al. [Gene Therapy 2012; 19: 1085-1094] описали перенос генов на ранней стадии беременности у мышей ATP7B-/- при помощи лентивируса, несущего ATP7B человека под транскрипционным контролем специфического для печени промотора, который содержал элемент аполипопротеина E и альфа-1 антитрипсина. Введение вектора в матку обеспечило снижение уровней меди в печени, сохранение нормальной гистологии печени, восстановление включения меди в церулоплазмин и улучшенный биосинтез холестерина. Однако эффективность лечения сильно отличалась от мышей к мышам и снижалась со временем, и никогда не приводила к полной коррекции различных патологически измененных параметров.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Авторы изобретения сконструировали и протестировали несколько вирусных векторов, несущих трансгены, которые кодируют различные укороченные формы фермента ATP7B: например, вектор AAV2/8-AAT-ATP7B(d223-366), кодирующий ATP7B(d223-366) [ATP7B-T1]; и вектор AAV2/8-AAT-ATP7B(d57-486), кодирующий ATP7B(d57-486) [ATP7B-T2]. При введении мышам, нокаутным по ATP7B, (известная модель болезни Вильсона на животных), вектор на основе AAV, несущий ATP7B-T2, корректировал основные патологические характеристики болезни Вильсона, по меньшей мере, в течение 24 недель после лечения, в то время как вектор на основе AAV, несущий ATP7B-T1, имел только частичный эффект. Экскреция Cu (содержание Cu в моче) и содержание Cu в печени были значительно снижены у мышей с болезнью Вильсона, которых лечили вектором AAV2/8-AAT-ATP7B(d57-486), а активность церулоплазмина была значительно восстановлена. С другой стороны, введение вектора привело к нормализации уровней трансаминаз в сыворотке и к нормализации гистологии печени, в совокупности со значительным уменьшением воспалительного инфильтрата, пролиферации в желчных протоках и фиброза.
Кроме того, было показано, что доза 1×1010 вирусных геномов/на мышь вектора AAV2/8-AAT-wtATP7B является «субоптимальной дозой» для конструкции с wt, как для получения нормализации активности церулоплазмина в сыворотке, так и для снижения накопления Cu в печени (фигуры 10A и 11A); в свою очередь было показано, что вектор, несущий укороченную форму, обеспечивает статистически значимые терапевтические эффекты (по сравнению с нелеченными) в указанной субоптимальной дозе (фигура 10B и 11B). Кроме того, было также показано, что наблюдаемые различия в активности между полноразмерным ATP7B и конструкциями T2 в дозе 1×1010 вирусных геномов/на мышь являются статистически значимыми для этих двух терапевтических эффектов (фиг. 12 и Фиг.14).
Эти наблюдения указывают на то, что и конструкция нуклеиновой кислоты, кодирующая укороченную форму ATP7B(d57-486), и несущие ее векторы, в частности, векторы на основе AAV, позволяют преодолеть наиболее важные патологические эффекты накопления меди, связанные с недостатком или нарушением функции ATP7B, и, таким образом, могут очень подходить для генотерапии, применяемой для состояния, связанного с недостаточностью или нарушенной функцией медь-транспортирующей АТФазы 2, такого как болезнь Вильсона, или заболевания и/или состояния, ассоциированного со снижением ATP7B-зависимого лизосомального экзоцитоза и накоплением меди. Кроме того, неожиданно было показано, что укороченная форма ATP7B(d57-486) и несущие ее векторы нормализуют некоторые из этих патологических проявлений заболевания в дозах, при которых полноразмерный белок ATP7B и кодирующие его векторы оказались менее эффективными.
Таким образом, в первом аспекте изобретение относится к конструкции нуклеиновой кислоты (далее в настоящем документе также обозначаемой как «конструкция нуклеиновой кислоты по изобретению»), которая содержит: a) нуклеотидную последовательность эукариотического промотора; b) нуклеотидную последовательность, кодирующую укороченную медь-транспортирующую АТФазу 2 (ATP7B), в которой N-концевые участки HMA1, HMA2, HMA3 и HMA4, ассоциированные с тяжелыми металлами, полностью удалены, а HMA 5 и HMA 6 оставлены неудаленными; и c) последовательность сигнала полиаденилирования.
В другом аспекте изобретение относится к экспрессирующему вектору (далее в настоящем документе обозначаемому как «экспрессирующий вектор по изобретению»), который содержит конструкцию нуклеиновой кислоты по изобретению.
В другом аспекте изобретение относится к клетке-хозяину, содержащей конструкцию нуклеиновой кислоты или экспрессирующий вектор по изобретению.
В другом аспекте изобретение относится к вирусной частице (далее в настоящем документе также обозначаемой как «вирусная частица по изобретению»), которая содержит нуклеиновую конструкцию или экспрессирующий вектор по изобретению. Предпочтительно, конструкция нуклеиновой кислоты составляет геномную последовательность вирусного вектора.
В другом аспекте изобретение относится к фармацевтической композиции, которая содержит продукт по изобретению, т.е. продукт, который содержит конструкцию нуклеиновой кислоты по изобретению, и фармацевтически приемлемый носитель. Как применяют в настоящем документе термин «продукт по изобретению» относится к любому из и неявно включает любое из: a) конструкции нуклеиновой кислоты по изобретению; b) экспрессирующего вектора по изобретению, c) клетки-хозяина по изобретению и d) вирусной частицы по изобретению.
В другом аспекте изобретение дополнительно относится к набору, содержащему конструкцию нуклеиновой кислоты, вектор, клетку-хозяина, вирусную частицу или фармацевтическую композицию по изобретению в одном или нескольких контейнерах.
В другом аспекте изобретение относится к продукту по изобретению для применения в медицине (в качестве лекарственного средства или медицинской композиции). Такое применение в медицине включает состояние, вызванное недостаточностью или нарушением функции медь-транспортирующей АТФазы 2. С другой стороны, изобретение относится к применению продукта по изобретению в препарате лекарственного средства для применения для лечения состояния, вызванного недостаточностью или нарушением функции медь-транспортирующей АТФазы 2; и к способу для лечения состояния, вызванного недостаточностью или нарушением функции медь-транспортирующей АТФазы 2 у индивидуума или пациента, который включает введение индивидууму или пациенту терапевтически эффективного количества продукта по изобретению. В более конкретном аспекте, продукт по изобретению применяют для лечения болезни Вильсона.
В другом аспекте изобретение дополнительно относится к фармацевтической композиции, содержащей продукт по изобретению, как описано выше, для предлагаемого использования в медицине и терапевтических способов, описанных в настоящем документе.
Еще в одном дополнительном аспекте, изобретение относится к способу получения вирусных частиц по изобретению, включающему стадии:
a) культивирования клетки-хозяина, содержащей конструкцию нуклеиновой кислоты или экспрессирующий вектор по изобретению в среде для культивирования; и
b) получения вирусных частиц в супернатанте клеточной культуры и/или внутри клеток.
В связанном аспекте, настоящее изобретение относится к применению конструкции нуклеиновой кислоты по изобретению или экспрессирующего вектора по изобретению для получения вирусных частиц.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
Фигура 1: Схематическое представление конструкции нуклеиновой кислоты вектора AAV2/8-AAT-wtATP7B, который несет ATP7B человека; вектора AAV2/8-AAT-ATP7B(d223-366), который несет укороченную форму ATP7B(d223-366) [ATP7B-T1]; и вектора AAV2/8-AAT-ATP7B(d57-486), который несет укороченный ATP7B(d57-486) [ATP7B-T2]. Элементы конструкций представляют собой: a) промотор гена альфа-1-антитрипсина (AAT); b) нуклеотидную последовательность, кодирующую соответственно ATP7B человека, ATP7B-T1, или ATP7B-T2; c) сигнал полиаденилирования (pA), и фланкирующий векторный геном d) инвертированные последовательности концевых повторов AAV2 (ITR).
Фигура 2: Уровни аланинтрансаминазы (ALT) в сыворотке у самцов мышей дикого типа [WT], самцов мышей, дефицитных по ATP7B [мыши с болезнью Вильсона, БВ], и самцов мышей с БВ, которых лечили векторами AAV2/8-AAT-wtATP7B [WD AAV-ATP7B], AAV2/8-AAT-ATP7B(d223-366) [WD AAV-T1]; или AAV2/8-AAT-ATP7B(d57-486) [WD AAV-T2]. Дозу вектора в 3×1010 векторных геномов/на мышь вводили животным в возрасте шести недель. Уровни ALT измеряли через 4, 9, 14 и 24 недели после лечения [Недели] и выражали в МЕ/л (МЕ: международные единицы). ns: не значимо; *: p<0,05, **: p<0,01; ***: p<0,001 [непарный тест Манна-Уитни].
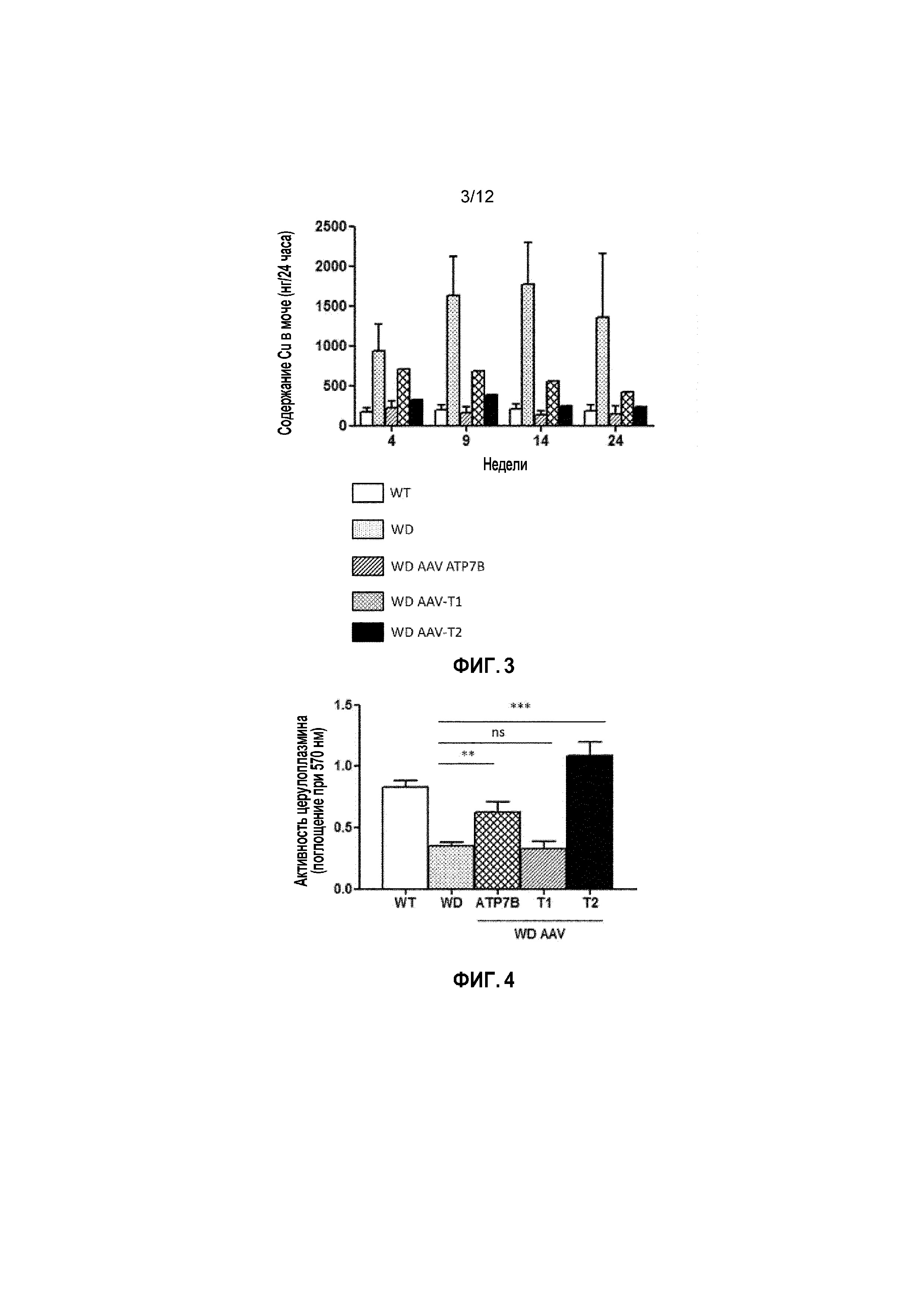
Фигура 3: Общее содержание меди в моче у самцов мышей дикого типа [WT], самцов мышей с болезнью Вильсона [БВ], и самцов мышей с БВ, которых лечили векторами AAV2/8-AAT-wtATP7B [WD AAV-ATP7B], AAV2/8-AAT-ATP7B(d223-366) [WD AAV-T1]; или AAV2/8-AAT-ATP7B(d57-486) [WD AAV-T2]. Доза вектора: 3×1010 векторных геномов/на мышь. Содержание меди измеряли через 4, 9, 14 и 24 недели после лечения [Недели] в моче за 24 часа и выражали в нанограммах Cu (нг/24 часа).
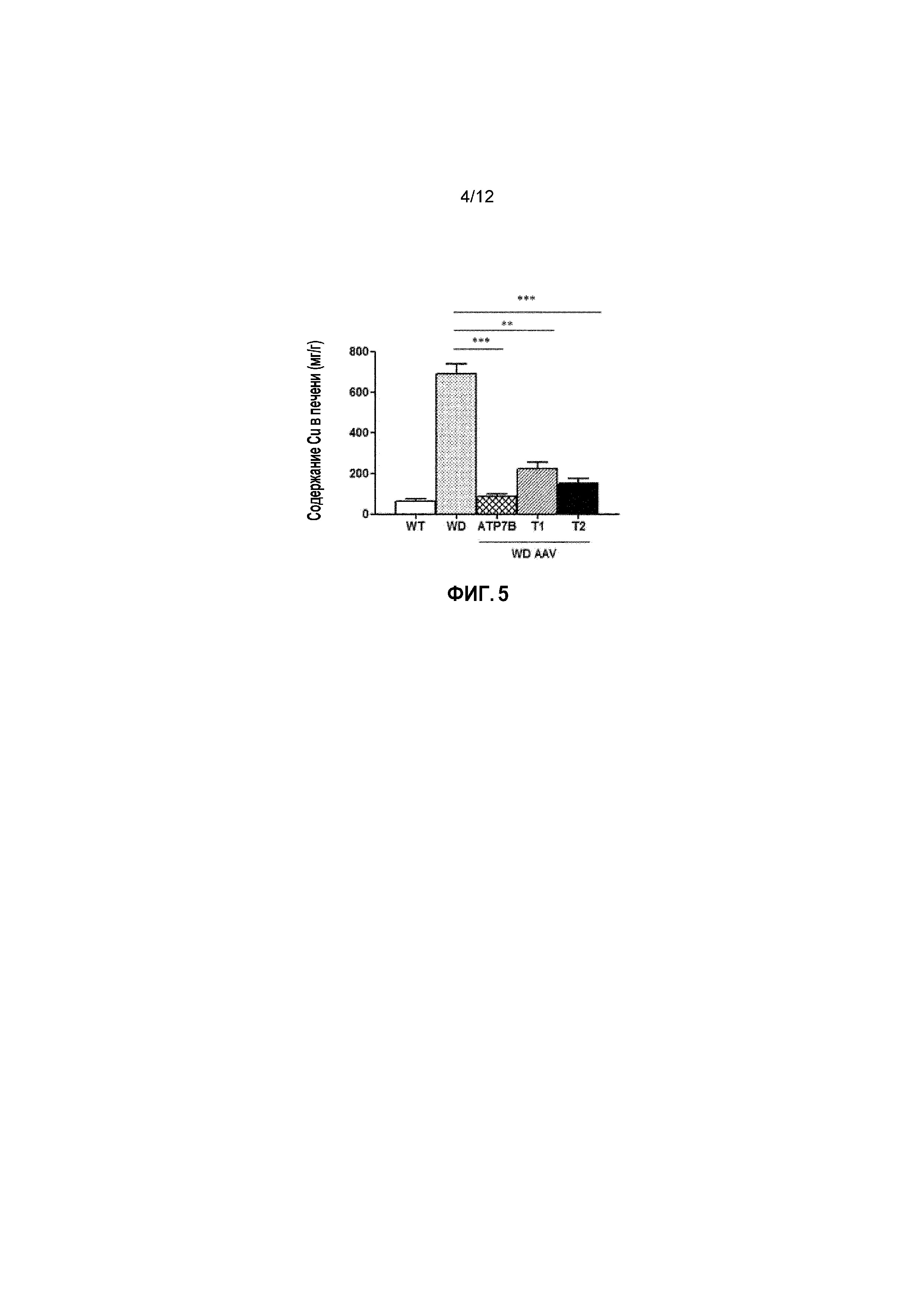
Фигура 4: Активность церулоплазмина в сыворотке у самцов мышей дикого типа [WT], самцов мышей с болезнью Вильсона [БВ], и самцов мышей с БВ, которых лечили векторами AAV2/8-AAT-wtATP7B [WD AAV-ATP7B], AAV2/8-AAT-ATP7B(d223-366) [WD AAV-T1]; или AAV2/8-AAT-ATP7B(d57-486) [WD AAV-T2]. Доза вектора: 3×1010 векторных геномов/на мышь. Активность церулоплазмина измеряли через 4 недели после лечения и выражали в виде оптической плотности, измеренной при длине волны 570 нм [Поглощение (570 нм)]. ns: не значимо; *: p<0,05, **: p<0,01; ***: p<0,001 [непарный тест Манна-Уитни].
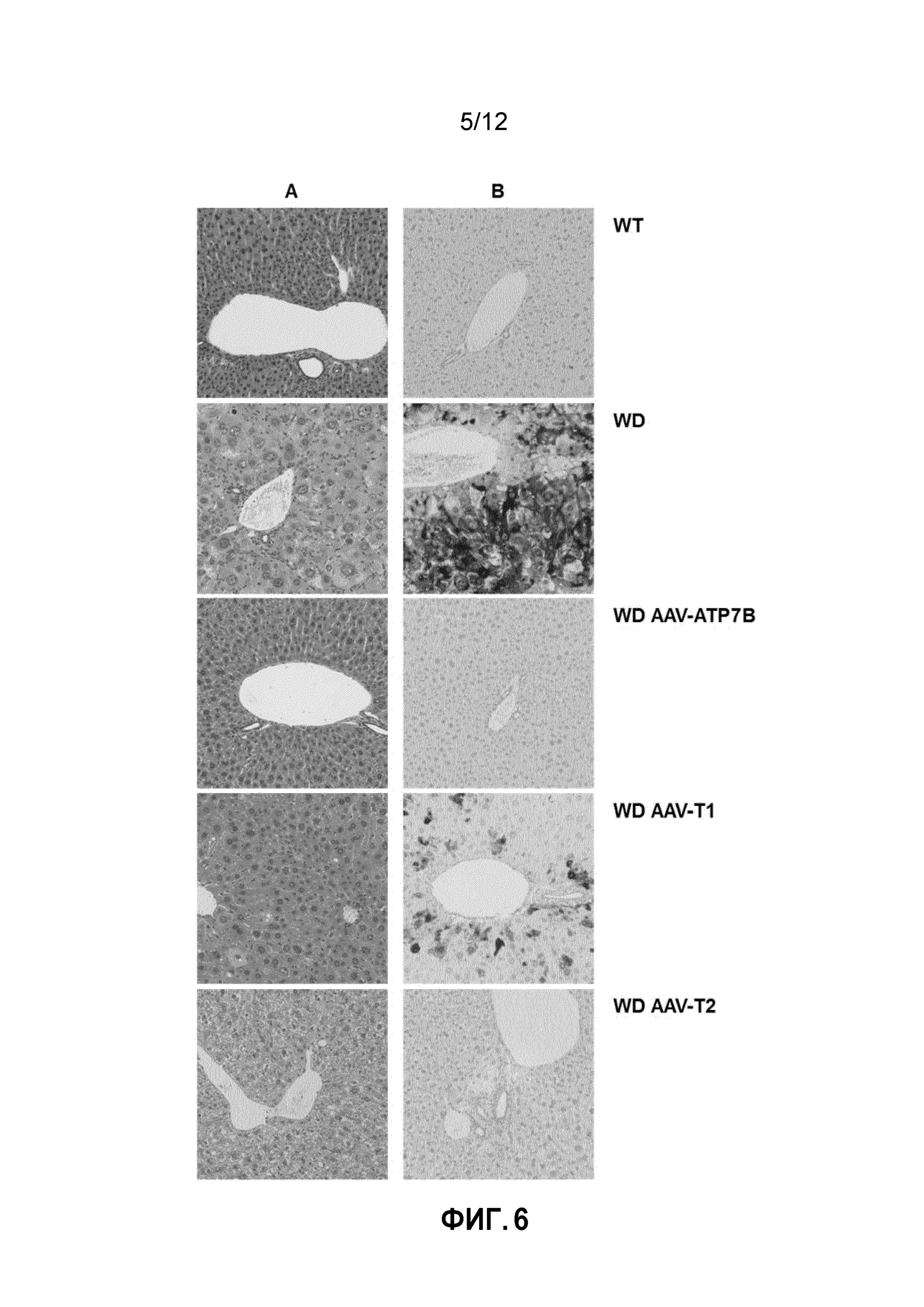
Фигура 5. Содержание Cu в печени у самцов мышей дикого типа [WT], самцов мышей с болезнью Вильсона [БВ], и самцов мышей с БВ, которых лечили векторами AAV2/8-AAT-wtATP7B [WD AAV-ATP7B], AAV2/8-AAT-ATP7B(d223-366) [WD AAV-T1]; или AAV2/8-AAT-ATP7B(d57-486) [WD AAV-T2]. Доза вектора: 3×1010 векторных геномов/на мышь. Содержание меди определяли после умерщвления животных через 24 недели после лечения при помощи атомно-абсорбционной спектроскопии; и выражали в мкг/г (мкг Cu/г сухой ткани печени). ns: не значимо; *: p<0,05, **: p<0,01; ***: p<0,001 [непарный тест Манна-Уитни].
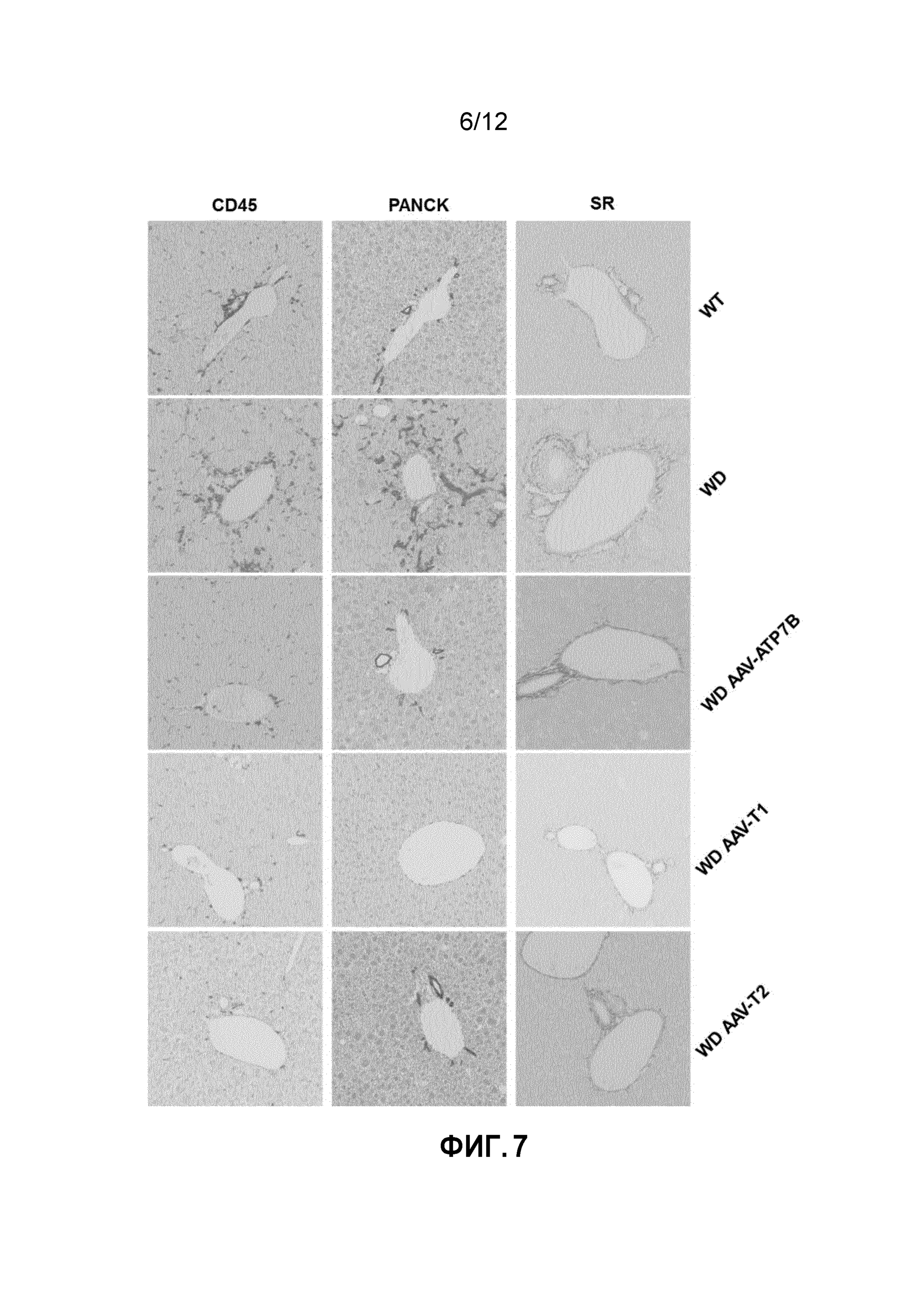
Фигура 6: Гистологические снимки печени самцов мышей дикого типа [WT], самцов мышей с болезнью Вильсона [БВ], и самцов мышей с БВ, которых лечили векторами AAV2/8-AAT-wtATP7B [WD AAV-ATP7B], AAV2/8-AAT-ATP7B(d223-366) [WD AAV-T1]; или AAV2/8-AAT-ATP7B(d57-486) [WD AAV-T2]. Доза вектора: 3×1010 векторных геномов/на мышь. Снимки были сделаны после умерщвления животных (в возрасте 30 недель). A: Снимки срезов печени, окрашенных гематоксилином и эозином. B: Снимки гистологических образцов, окрашенных способом с сульфидом серебра по Тимму для выявления отложений меди.
фигура 7: Анализ воспаления печени, пролиферации в желчных протоках и фиброза. Снимки печени самцов мышей дикого типа [WT], самцов мышей с болезнью Вильсона [БВ], и самцов мышей с БВ, которых лечили векторами AAV2/8-AAT-wtATP7B [WD AAV-ATP7B], AAV2/8-AAT-ATP7B(d223-366) [WD AAV-T1]; или AAV2/8-AAT-ATP7B(d57-486) [WD AAV-T2]. Доза вектора: 3×1010 векторных геномов/на мышь. Анализ проводили после умерщвления животных (в возрасте 30 недель). CD45: Снимки срезов печени, иммунологически окрашенных при помощи антитела к CD45 для выявления воспалительных инфильтратов в печени. PANCK: Снимки срезов печени, иммунологически окрашенных при помощи антитела к PANCK для выявления пролиферации в желчных протоках. SR: Снимки срезов печени, окрашенных Сириусом красным для выявления фиброза.
Фигура 8: Уровни аланинтрансаминазы (ALT) в сыворотке у самок мышей дикого типа [WT], самок мышей с БВ [БВ], и самок мышей с БВ, которых лечили вектором AAV2/8-AAT-ATP7B(d57-486) [WD AAV-T2]. Различным группам мыши самок мышей с БВ в возрасте 6 недель вводили различные дозы векторов (соответственно 1×1010, 3×1010, 1×1011 вирусных геномов/на мышь). Уровни ALT измеряли через 4, 9, 14 и 24 недели после лечения [Недели] и выражали в МЕ/л. ns: не значимо; *: p<0,05, **: p<0,01; ***: p<0,001 [непарный тест Манна-Уитни].
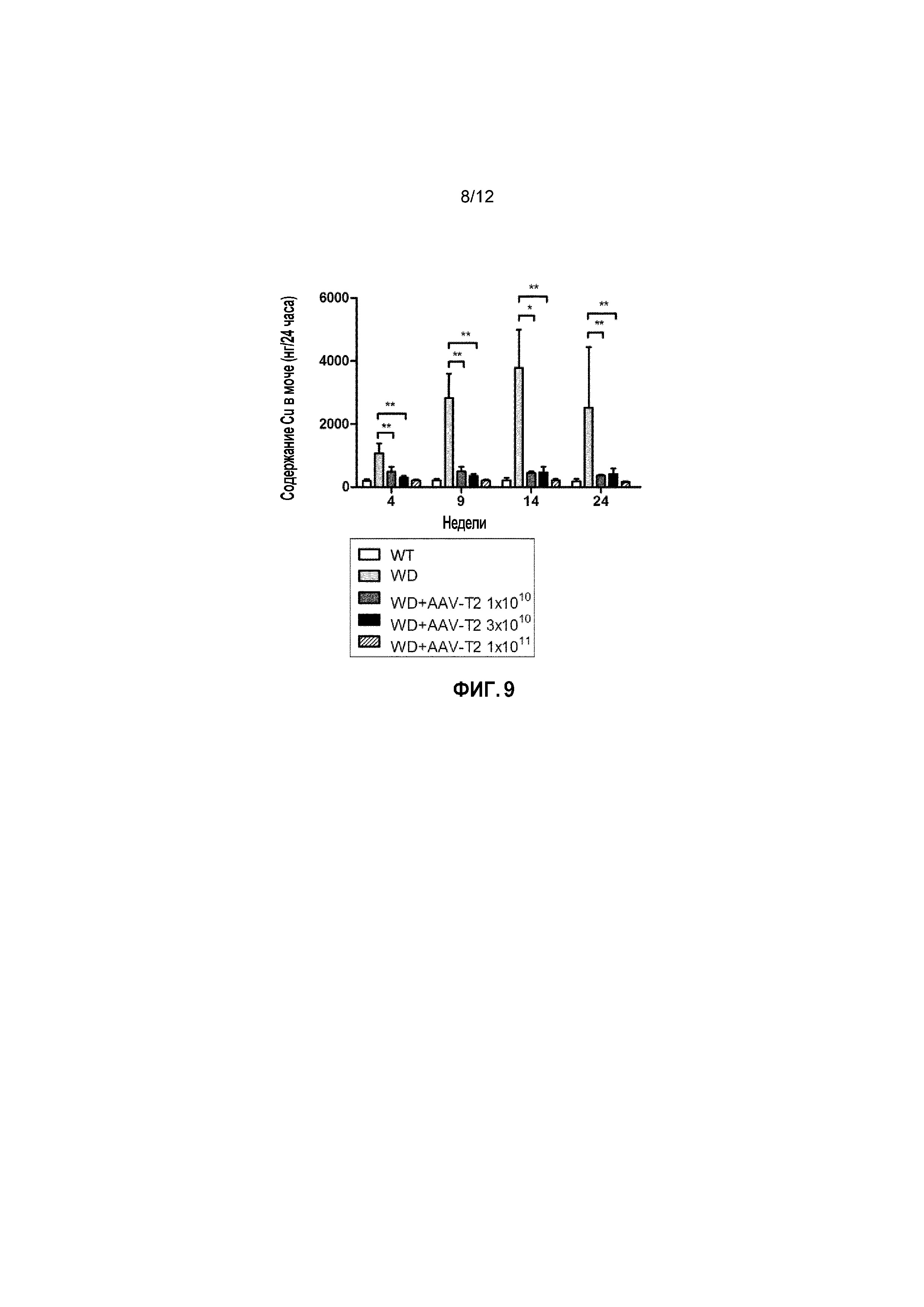
Фигура 9: Уровни содержания Cu в моче у самок мышей дикого типа [WT], самок мышей с БВ [БВ], и самок мышей с БВ, которых лечили вектором AAV2/8-AAT-ATP7B(d57-486) [WD AAV-T2]. Различным группам мыши самок мышей с БВ в возрасте 6 недель вводили различные дозы векторов (соответственно 1×1010, 3×1010, 1×1011 вирусных геномов/на мышь). Уровни меди в моче измеряли через 4, 9, 14 и 24 недели после лечения [Недели] за 24 часа и выражали в нанограммах Cu (нг/24 часа). ns: не значимо; *: p<0,05, **: p<0,01; ***: p<0,001 [непарный тест Манна-Уитни].
Фигура 10: Активность церулоплазмина в сыворотке измеряли у самок мышей дикого типа [WT], самок мышей с БВ [БВ], и самок мышей с БВ, которых лечили вектором AAV2/8-AAT-ATP7B(d57-486) [WD+AAV-T2] или вектором AAV2/8-AAT-wtATP7B [WD+AAV-ATP7B]. Для каждой экспериментальной группы, различным группам мыши самок мышей с БВ в возрасте 6 недель вводили различные дозы векторов (соответственно 1×1010, 3×1010, 1×1011 вирусных геномов/на мышь). Активность церулоплазмина измеряли через 4 недели после лечения и выражали в виде оптической плотности, измеренной при длине волны 570 нм [Поглощение (570 нм)]. ns: не значимо; *: p<0,05, **: p<0,01; ***: p<0,001 [непарный тест Манна-Уитни].
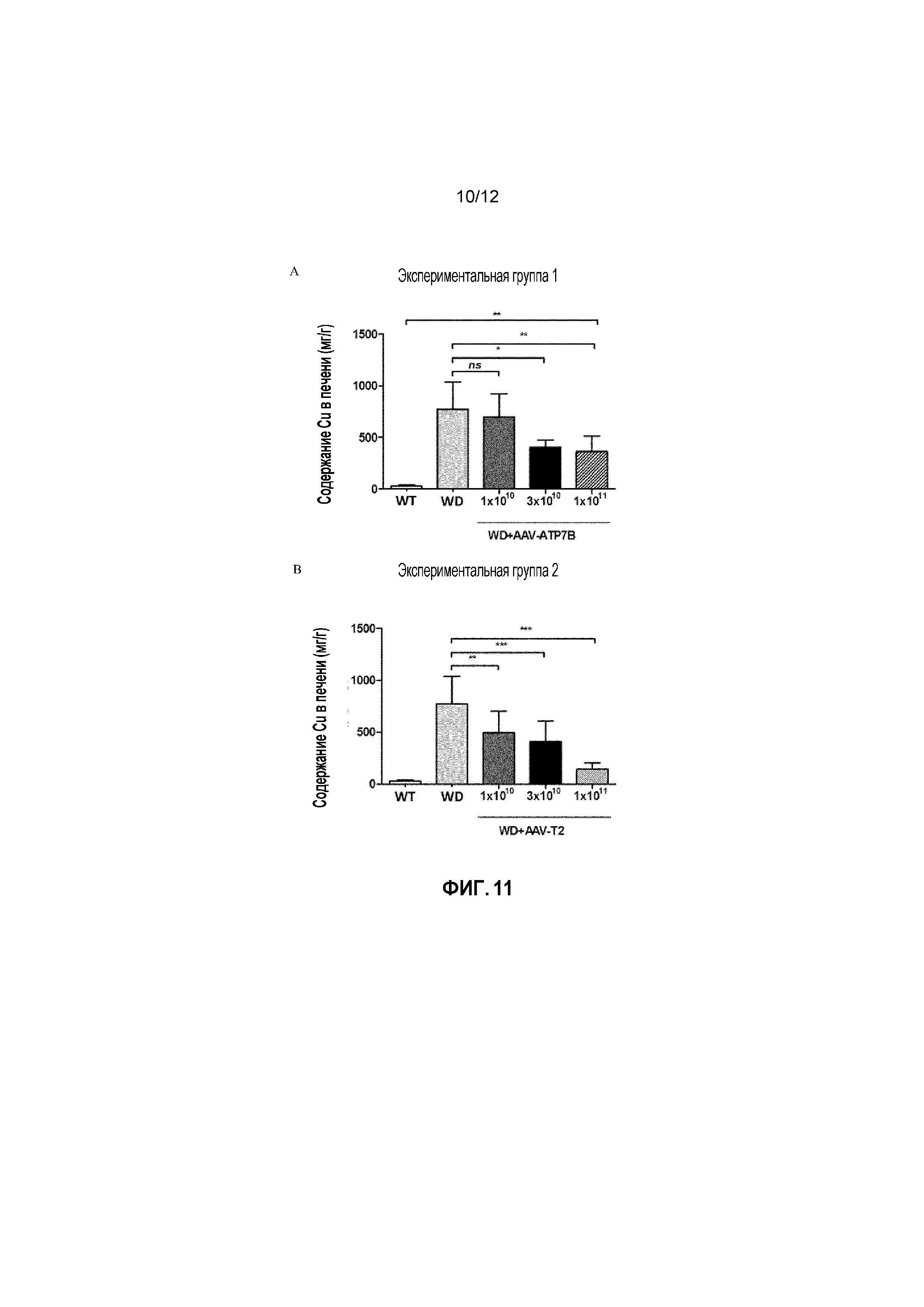
Фигура 11: Содержание Cu в печени измеряли у самок мышей дикого типа [WT], самок мышей с БВ [БВ], и самок мышей с БВ, которых лечили вектором AAV2/8-AAT-wtATP7B [WD AAV ATP7B] или вектором AAV2/8-AAT-ATP7B(d57-486) [WD AAV T2]. Для каждой экспериментальной группы, различным группам мыши самок мышей с БВ в возрасте 6 недель вводили различные дозы векторов (соответственно 1×1010, 3×1010, 1×1011 вирусных геномов/на мышь). Концентрацию меди измеряли через 24 недели после лечения и выражали в виде мкг/г сухой ткани. ns: не значимо; *: p<0,05, **: p<0,01; ***: p<0,001 [непарный тест Манна-Уитни].
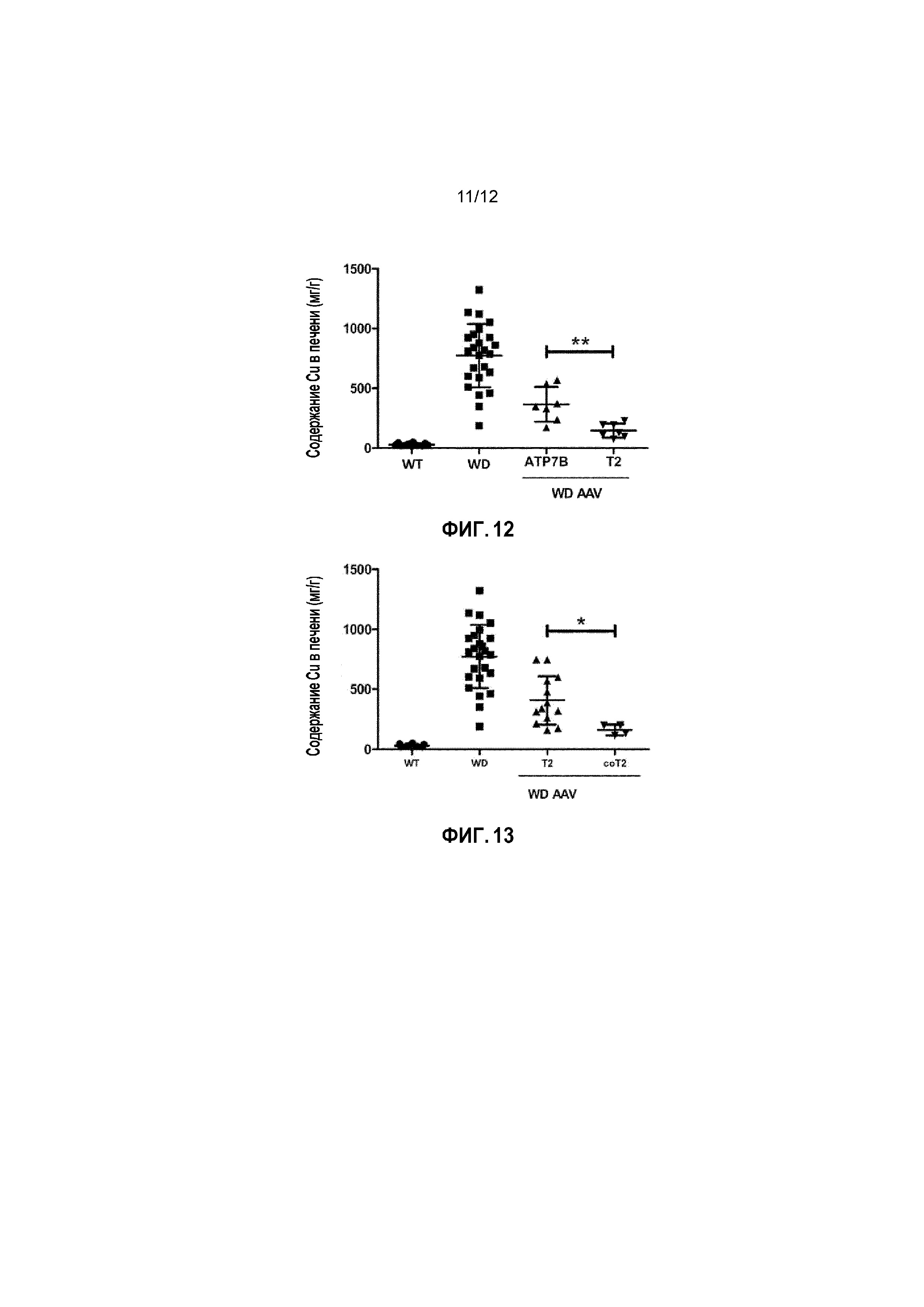
Фигура 12: Содержание Cu в печени у самцов мышей дикого типа [WT, n=15], самцов мышей с БВ [БВ; n=25], и самцов мышей с БВ, которых лечили вектором AAV2/8-AAT-wtATP7B [WD AAV ATP7B; n=7] или вектором AAV2/8-AAT-ATP7B(d57-486) [WD AAV T2; n=7]. Для каждой экспериментальной группы, мышам с БВ вводили субоптимальную дозу вектора (1×1010 вирусных геномов/на мышь), когда животным было 6 недель. Концентрацию меди измеряли через 24 недели после лечения и выражали в виде мкг/г сухой ткани. ns: не значимо; *: p<0,05, **: p<0,01; ***: p<0,001 [непарный тест Манна-Уитни].
Фигура 13: Содержание Cu в печени у самцов мышей дикого типа [WT, n=15], самцов мышей с БВ [БВ; n=25], и самцов мышей с БВ, которых лечили вектором AAV2/8-AAT-ATP7B(d57-486) [WD AAV T2; n=13] или вектором AAV2/8-AAT-coATP7B(d57-486) [WD AAV coT2; n=4]. Для каждой экспериментальной группы, мышам с БВ вводили субоптимальную дозу вектора (1×1010 вирусных геномов/на мышь), когда животным было 6 недель. Концентрацию меди измеряли через 24 недели после лечения и выражали в виде мкг/г сухой ткани. ns: не значимо; *: p<0,05, **: p<0,01; ***: p<0,001 [непарный тест Манна-Уитни].
Фигура 14: Активность церулоплазмина в сыворотке у самцов мышей дикого типа [WT, n=15], самцов мышей с БВ [БВ; n=25], и групп самцов мышей с БВ, которых лечили одним из векторов AAV2/8-AAT-wtATP7B [WD AAV ATP7B; n=10], AAV2/8-AAT-coATP7B [WD AAV coATP7B; n=8], AAV2/8-AAT-ATP7B(d57-486) [WD AAV T2; n=13] и AAV2/8-AAT-coATP7B(d57-486) [WD AAV coT2; n=4]. Для каждой экспериментальной группы, шестинедельным мышам с БВ вводили субоптимальную дозу вектора (1×1010 вирусных геномов/на мышь). Оксидазную активность церулоплазмина измеряли через 4 недели после лечения и выражали в виде оптической плотности, измеренной при длине волны 570 нм [Поглощение (570 нм)]. ns: не значимо; *: p<0,05, **: p<0,01; ***: p<0,001 [непарный тест Манна-Уитни].
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Все термины, применяемые в настоящем документе заявки, если не указано иначе, следует понимать в их обычном значении, известном в данной области. Другие более конкретные определения для некоторых терминов, использованных в настоящей заявке, представлены ниже и предназначены для единообразного использования во всем описании и формуле, если иное не указано прямо, и определение не предполагает более широкий смысл.
Термины «последовательность нуклеиновой кислоты» и «нуклеотидная последовательность» можно использовать взаимозаменяемо по отношению к любой молекуле, состоящей из мономерных нуклеотидов или содержащей мономерные нуклеотиды. Нуклеиновая кислота может быть олигонуклеотидом или полинуклеотидом. Нуклеотидная последовательность может быть ДНК или РНК. Нуклеотидная последовательность может быть химически модифицирована или может быть искусственной. Нуклеотидные последовательности включают пептидные нуклеиновые кислоты (ПНК), морфолиновые олигонуклеотиды и замкнутые нуклеиновые кислоты (ЗНК), а также гликолевые нуклеиновые кислоты (ГНК) и треозную нуклеиновую кислоту (ТНК). Каждая из этих последовательностей отличается от природной ДНК или РНК за счет изменений остова молекулы. Также можно использовать тиофосфатные нуклеотиды. Другие дезоксинуклеотидные аналоги, которые можно использовать в нуклеотиде по изобретению, включают метилфосфонаты, фосфорамидаты, фосфородитиоаты, N3'P5'-фосфорамидаты и олигорибонуклеотидные тиофосфаты и их 2'-0-аллильные аналоги и 2'-0-метилрибонуклеотидные метилфосфонаты.
Применяемый в настоящем документе термин «конструкция нуклеиновой кислоты» относится к искусственно созданной молекуле нуклеиновой кислоты, полученной при использовании технологии рекомбинантных ДНК. Конструкция нуклеиновой кислоты представляет собой молекулу нуклеиновой кислоты, или одно- или двухцепочечную, которая была модифицирована для включения сегментов последовательностей нуклеиновых кислот, которые были скомбинированы и помещены рядом таким образом, который в ином случае не существовал бы в природе. Конструкция нуклеиновой кислоты, как правило, представляет собой «вектор», т.е. молекулу нуклеиновой кислоты, которую применяют для доставки экзогенно созданной ДНК в клетку-хозяина.
Применяемый в настоящем документе термин «экспрессирующий вектор» или «вектор» относится к рекомбинантной нуклеотидной последовательности, которая способна осуществлять экспрессию гена (трансгена) в клетках-хозяевах или организмах-хозяевах, совместимых с такими последовательностями. Вместе с трансгеном экспрессирующие векторы, как правило, содержат, по меньшей мере, подходящие последовательности для регуляции транскрипции и, необязательно, 3'-сигналы терминации транскрипции. Могут также присутствовать дополнительные факторы, необходимые или полезные для осуществления транскрипции, такие как энхансерные элементы для экспрессии, способные отвечать на точный индуцирующий сигнал (эндогенные или химерные факторы транскрипции) или специфические для определенных клеток, органов или тканей.
Применяемый в настоящем документе термин «индивидуум» или «пациент» относится к млекопитающим. Виды млекопитающих, которым могут быть полезны описанные способы лечения, в качестве неограничивающих примеров включают людей, не являющиеся человеком приматов, таких как человекообразные обезьяны; шимпанзе; нечеловекообразных обезьян, и орангутанов, домашних животных, в том числе собак и кошек, а также домашний скот, такой как лошади, крупный рогатый скот, свиньи, овцы, и козы, или другие виды млекопитающих, в том числе без ограничений, мыши, крысы, морские свинки, кролики, хомяки, и т.п.
Применяемый в настоящем документе термин «упаковывающие клетки» относится к клетке или клеточной линии, которая может быть трансфецирована вектором-помощником или вирусом или конструкцией ДНК, и опосредованно обеспечивает все отсутствующие функции, которые необходимы для полной репликации и упаковки вирусного вектора. Как правило, упаковывающие клетки экспресируют конститутивным или индуцибельным образом одну или несколько из указанных отсуствующих вирусных функций.
конструкция нуклеиновой кислоты по изобретению
Нуклеотидная последовательность of эукариотическ промотор
Применяемый в настоящем документе, термин «эукариотический промотор» относится к области последовательности ДНК, которая инициирует транскрипцию конкретного гена, или одной или нескольких кодирующих последовательностей, в эукариотических клетках. Промотор может работать совместно с другими регуляторными областями или элементами для управления уровнем транскрипции гена или кодирующей последовательности/последовательностей. Эти регуляторные элементы в качестве неограничивающих примеров включают участки связывания фактора транскрипции, участки связывания белка-активатора и белка-репрессора, и любые другие последовательности нуклеотидов, известные специалисту в данной области, для прямого или опосредованного воздействия на регуляцию уровня транскрипции от промотора, включая, например, аттенюаторы, энхансеры, и сайленсеры. Промотор расположен рядом с участком начала транскрипции гена или кодирующей последовательности, с которой он функционально связан, на той же цепи и перед последовательностью ДНК (перед 5'-областью смысловой цепи). Промотор может быть приблизительно 100-1000 пар оснований в длину. Положения в промоторе обозначают относительно точки начала транскрипции промотор для конкретного гена (т.е., положения выше представляют собой отрицательные числа, которые отсчитываются назад от -1, например -100 представляет собой положение на 100 пар оснований выше).
Термин «основной промотор» или «минимальный промотор» относится к минимальной части последовательности промотора, необходимой для надлежащей инициации транскрипции. Он включает участок начала транскрипции (TSS) и элементы непосредственно выше; участок связывания для РНК-полимеразы (РНК-полимеразы II); и общие участки связывания для факторов транскрипции. Обычно промотор также включает проксимальную промоторную последовательность (выше основного промотора), которая содержит другие первичные регуляторные элементы (такие как энхансеры, сайленсеры, граничные элементы/инсуляторы); и дистальную промоторную последовательность (ниже основного промотора), которая может содержать дополнительные регуляторные элементы, обычно с более слабым влиянием на уровень транскрипции гена.
По изобретению последовательность эукариотического промотора функционально связана с нуклеотидной последовательностью, кодирующей укороченную медь-транспортирующую АТФазу 2. Применяемый в настоящем документе, термин «функционально связанный» относится к соединению полинуклеотидных (или полипептидных) элементов в функциональную связь. Нуклеиновая кислота является «функционально связанной», когда ее помещают в функциональную связь с другой последовательностью нуклеиновой кислоты. Например, промотор или последовательность для регуляции транскрипции функционально связаны с кодирующей последовательностью, если они возжействуют на транскрипцию кодирующей последовательности. Функционально связанный означает, что связанные последовательности ДНК, как правило, являются смежными; где необходимо соединить две белок-кодирующие области, они являются смежными и в рамке считывания.
По изобретению, последовательность эукариотического промотора из конструкции нуклеиновой кислоты содержит, по меньшей мере, основной промотор и, необязательно, другие регуляторные области или элементы того же гена или различных генов (т.е. гибридные или химерные промоторы).
В одном из вариантов осуществления необязательно в комбинации с одним или несколькими признаками различных вариантов осуществления, описанными выше или ниже, эукариотический промотор представляет собой конститутивный промотор, тканеспецифический промотор, или индуцибельный промотор.
Как применяют в настоящем документе, «конститутивный» промотор представляет собой промотор, который является активным в большинстве эукариотических тканей при большинстве физиологических условий и условий развития.
«Тканеспецифический промотор» представляет собой промотор, который активен только в специфических типах тканей или клеток. То есть тканеспецифический промотор, в контексте настоящего изобретения, является промотором, который более активен в одной или нескольких конкретных тканях (например, двух, трех или четырех), чем в других тканях (т.е. промотор способен управлять более высокой экспрессией кодирующей последовательности, с которой он функционально связан, в ткани/тканях, для которых он более специфичен, чем в остальных). Как правило, ген, расположенный после «тканеспецифического» промотора является активным в большей степени в ткани/тканях, для которых специфичен промотор, чем в любой другой ткани/тканях. В этом случае, активность промотора присутствует в малой степени или отсутствует в любой ткани, отличной от той/тех, для которых он специфичен.
«Индуцибельный» промотор представляет собой промотор, который регулируется физиологическим путем или при развитии, например, с применением химического индуктора.
В данной области известно множество промоторов [Sambrook and Russell (Molecular Cloning: A Laboratory Manual; Third Edition; 2001 Cold Spring Harbor Laboratory Press); и Green and Sambrook (Molecular Cloning: A Laboratory Manual, cuarta edición, 2012 Cold Spring Harbor Laboratory Press)].
Подходящие тканеспецифические промоторы можно найти в базе данных тканеспецифических промоторов, TiProD (Nucleic Acids Research 2006; J4: D104-D107).
В одном из вариантов осуществления необязательно в комбинации с одним или несколькими признаками различных вариантов осуществления, описанными выше или ниже, эукариотический промотор представляет собой печень-специфический промотор. В контексте настоящего изобретения, «печень-специфический промотор» представляет собой промотор, который более активен в печени, чем в любой другой ткани организма. Как правило, активность печень-специфического промотора будет значительно больше в печени, чем в других тканях. Например, такой промотор может быть, по меньшей мере, в 2, по меньшей мере, в 3, по меньшей мере, в 4, по меньшей мере, в 5 или, по меньшей мере, в 10 раз более активным (например, при определении его способностью управлять экспрессией в данной ткани по сравнению с его способностью управлять экспрессией в других клетках или тканиях). Таким образом, печень-специфический промотор позволяет связанному с ним гену активно экспрессироваться в печени и предотвращает его экспрессию в других клетках или тканях.
В одном из вариантов осуществления необязательно в комбинации с одним или несколькими признаками различных вариантов осуществления, описанными выше или ниже, эукариотический промотор представляет собой нуклеотидную последовательность промотора гена α1-антитрипсина (AAT), или последовательность химерного промотора EalbPa1AT, которая содержит последовательность промотора гена α1-антитрипсина (AAT или Pa1AT) в сочетании с энхансерным элементом гена альбумина (Ealb). Обе промоторные последовательности обладают свойствами печень-специфических промоторов.
В конкретном варианте осуществления необязательно в комбинации с одним или несколькими признаками различных вариантов осуществления, описанными выше или ниже, последовательность эукариотического промотора представляет собой последовательность, ограниченную основаниями 156-460 из SEQ.ID.NO.1 (AAT); или SEQ.ID.NO.5 (EalbPa1AT).
Укороченная медь-транспортирующая АТФаза 2 (ATP7B)
Медь-транспортирующая АТФаза 2 (ATP7B) представляет собой АТФазу P-типа для транспорта катионов, чья функция заключается в выведении меди из клеток.
Ген, который кодирует фермент человека, расположен на хромосоме 13 (расположение на хромосоме 13q14,3; название гена ATP7B). Информация о полипептиде ATP7B человека (аминокислотные последовательности, структура, домены и других признаки) доступна, например, на Uniprot по номеру доступа: P35670 (http://www.uniprot.org/uniprot/P35670; Entry version 168 (03 Sep 2014), Sequence version 4 (16 Jun 2009)). Информация о гене ATP7B, кодирующем этот фермент, доступна на Entrez по номеру доступа Gene ID: 540 (http://www.ncbi.nlm.nih.gov/ген/540; updated on 19-Sep-2014). Для ATP7B были описаны 4 изоформы, получаемые путем альтернативного сплайсинга; изоформа 1 (идентификатор P35670-1, 1465 аминокислот в длину) выбрана в качестве канонической последовательности.
В одном из вариантов осуществления необязательно в комбинации с одним или несколькими признаками различных вариантов осуществления, описанными выше или ниже, конструкция нуклеиновой кислоты по изобретению содержит нуклеотидную последовательность, которая кодирует укороченную форму ATP7B человека, предпочтительно ATP7B человека, чья аминокислотная последовательность представляет собой каноническую последовательность (SEQ.ID.NO.2), в настоящем документе также обозначаемую как wtATP7B.
В ATP7B присутствуют несколько консервативных мотивов, которые являются характерными для белкового семейства АТФаз P-типа. Эти мотивы необходимы для катализа АТФ и включают нуклеотид-связывающий домен (N-домен), домен фосфорилирования (P-домен) и домен-актуатор (A-домен). В этих мотивах присутствует высококонсервативная последовательность остатков; SEHPL в N-домене, DKTG в P-домене, и TGE в A-домене. Аминоконцевой хвост ATP7B человека содержит «шесть участков связывания металлов» (MBS), также нетипично называемых как «ассоциированные с тяжелыми металлами (HMA)» участки или домены, каждый содержащий коровую последовательность MxCxxC. Эти HMA связывают Cu(I) в соотношении атом Cu(I) на HMA. Эти аминоконцевые HMA ATP7B необходимы для нескольких аспектов его функционирования, включая перенос меди, включение меди в медь-содержащие ферменты, АТФазной активности, локализации и направленной миграции, и белок-белковых взаимодействий. Участки HMA идентифицируют, начиная с амино-конца, как домены HMA 1 (аминокислоты 59-125 в канонической последовательности), HMA 2 (аминокислоты 144-210), HMA 3 (258-327), HMA 4 (360-426), HMA 5 (489-555), и HMA 6 (565-631).
По изобретению, необязательно в комбинации с одним или несколькими признаками различных вариантов осуществления, описанными выше или ниже, конструкция нуклеиновой кислоты содержит нуклеотидную последовательность, которая кодирует укороченный ATP7B, в котором N-концевые участки, ассоциированные с тяжелым металлом, HMA 1, HMA 2, HMA 3, и HMA 4 полностью или частично удалены.
В одном из вариантов осуществления необязательно в комбинации с одним или несколькими признаками различных вариантов осуществления, описанными выше или ниже, нуклеотидная последовательность, которая кодирует укороченный ATP7B, сохраняет N-концевую сигнальную последовательность ATP7B из 56 аминокислот.
В одном из вариантов осуществления необязательно в комбинации с одним или несколькими признаками различных вариантов осуществления, описанными выше или ниже, делеция в укороченном ATP7B включает аминокислоты с 57 до 486 из канонической последовательности.
В одном из вариантов осуществления необязательно в комбинации с одним или несколькими признаками различных вариантов осуществления, описанными выше или ниже, нуклеотидная последовательность кодирует укороченный ATP7B, чья аминокислотная последовательность представляет собой SEQ.ID.NO.7.
Из-за вырожденности кодонов, существует несколько нуклеотидных последовательностей, которые можно получать, кодируя полипептиды ATP7B с одинаковой аминокислотной последовательностью.
В одном из вариантов осуществления необязательно в комбинации с одним или несколькими признаками различных вариантов осуществления, описанными выше или ниже, нуклеотидная последовательность, кодирующая укороченную медь-транспортирующую АТФазу 2, представляет собой кодирующую последовательность CDS из SEQ.ID.NO.6, основания 473.3580.
В другом варианте осуществления необязательно в комбинации с одним или несколькими признаками различных вариантов осуществления, описанными выше или ниже, нуклеотидная последовательность, кодирующая укороченную медь-транспортирующую АТФазу 2, представляет собой SEQ.ID.NO.8, последовательность с оптимизированным сдвигом использования кодонов для клеток человека.
В одном из вариантов осуществления необязательно в комбинации с одним или несколькими признаками различных вариантов осуществления, описанными выше или ниже, нуклеотидная последовательность, кодирующая укороченную медь-транспортирующую АТФазу 2, представляет собой последовательность, где, по меньшей мере, 827, по меньшей мере, 879, по меньшей мере, 931, или, по меньшей мере, 983 из кодонов, кодирующих укороченную медь-транспортирующую АТФазу 2, идентичны кодонам кодирующей последовательности SEQ.ID.NO.8.
Последовательность сигнала полиаденилирования
Применяемый в настоящем документе, термин «сигнал полиаденилирования» или «поли(A) сигнал» относится к специфической последовательности распознавания в пределах 3'-нетранслируемой области (3'UTR) гена, которая транскрибируется в составе молекулы-предшественника мРНК и направляет терминацию транскрипции гена. Поли(A) сигнал действует как сигнал для эндонуклеолитического расщепления новообразованного предшественника мРНК с его 3'-конца, и для добавления к его 3'-концу фрагмента РНК, состоящего только из адениновых оснований (процесс полиаденилирования; поли(A) хвост). Поли(A) хвост является важным для экспорта из ядра, трансляции и стабильности мРНК. В контексте изобретения, сигнал полиаденилирования представляет собой последовательность распознавания, которая может управлять полиаденилированием генов млекопитающих и/или вирусных генов, в клетках млекопитающих.
Поли(A) сигналы, как правило, состоят из a) консенсусной последовательности AAUAAA, для которой было показано, что она необходима и для 3'-концевого расщепления, и для полиаденилирования предшественника мРНК (пре-мРНК) а также она способствует терминации трнскрипции ниже, и b) дополнительных элементов выше и ниже AAUAAA, которые контролируют эффективность использования AAUAAA в качестве поли(A) сигнала. Существует значительная изменчивость в этих мотивах в генах млекопитающих.
В одном из вариантов осуществления необязательно в комбинации с одним или несколькими признаками различных вариантов осуществления, описанными выше или ниже, последовательность сигнала полиаденилирования из конструкции нуклеиновой кислоты по изобретению представляет собой последовательность сигнала подиаденилирования из гена млекопитающего или вирусного гена. Подходящие сигналы полиаденилирования включают, среди прочих, ранний сигнал полиаденилирования SV40, поздний сигнал полиаденилирования SV40, сигнал полиаденилирования тимидинкиназы HSV, сигнал полиаденилирования гена протамина, сигнал полиаденилирования EIb аденовируса 5, сигнал полиаденилирования гормона роста, сигнал полиаденилирования PBGD, сконструированный сигнал полиаденилирования in silico (синтетический) и т.п.
В одном из вариантов осуществления необязательно в комбинации с одним или несколькими признаками различных вариантов осуществления, описанными выше или ниже, последовательность сигнала полиаденилирования из конструкции нуклеиновой кислоты представляет собой синтетическую поли(A) сигнальную последовательность, которая также способна направлять и осуществлять эндонуклеолитическое расщепление и полиаденилирование предшественника мРНК, полученного при транскрипции нуклеотидной последовательности, кодирующей укороченный ATP7B.
В одном из вариантов осуществления необязательно в комбинации с одним или несколькими признаками различных вариантов осуществления, описанными выше или ниже, последовательность сигнала полиаденилирования из конструкции нуклеиновой кислоты представляет собой синтетическую поли(A) сигнальную последовательность, ограниченную основаниями 4877.4932 из SEQ.ID.NO.1.
Другие нуклеотидные элементы
В одном из вариантов осуществления конструкция нуклеиновой кислоты по изобретению составляет рекомбинантный геном экспрессирующего вектора для генотерапии, экспрессирующего вектора по изобретению; и, более конкретно, вирусного вектора для генотерапии.
Таким образом, в одном из вариантов осуществления необязательно в комбинации с одним или несколькими признаками различных вариантов осуществления, описанными выше или ниже, конструкция нуклеиновой кислоты по изобретению дополнительно содержит 5'ITR и 3'ITR вируса.
Применяемый в настоящем документе термин «инвертированный концевой повтор (ITR)» относится к нуклеотидной последовательности, расположенной на 5'-конце (5'ITR), и к нуклеотидной последовательности, расположенной на 3'-конце (3'ITR), вируса, которые содержат палиндромные последовательности и которые могут сворачиваться с образованием T-образных шпилечных структур, которые функционируют в качестве праймеров во время инициации репликации ДНК. Они также необходимы для интеграции вирусного генома в геном хозяина; для спасения из генома-хозяина; и для упаковки вирусной нуклеиновой кислоты в зрелые вирионы. ITR необходимы в цис-положении для репликации вирусного генома и его упаковки в вирусные частицы.
В одном из вариантов осуществления конструкция нуклеиновой кислоты содержит 5'ITR, сигнал упаковки ψ и 3'ITR вируса. «Сигнал упаковки ψ» представляет собой цис-действующую нуклеотидную последовательность вирусного генома, которая у некоторых вирусов (например, аденовирусов, лентивирусов) необходима для процесса упаковки вирусного генома в капсид вируса во время репликации.
В одном из вариантов осуществления необязательно в комбинации с одним или несколькими признаками различных вариантов осуществления, описанными выше или ниже, конструкция нуклеиновой кислоты содержит 5'ITR и 3'ITR вируса, выбранного из группы, состоящей из парвовирусов (в частности, аденоассоциированных вирусов), аденовирусов, альфавирусов, ретровирусов (в частности, гамма ретровирусов, и лентивирусов), герпесвирусов, и SV40; в предпочтительном варианте осуществления вирус представляет собой аденоассоциированный вирус (AAV), аденовирус (Ad), или лентивирус.
В одном из вариантов осуществления необязательно в комбинации с одним или несколькими признаками различных вариантов осуществления, описанными выше или ниже, конструкция нуклеиновой кислоты содержит 5'ITR и 3'ITR из AAV.
Геном AAV состоит из линейной одноцепочечной молекулы ДНК, которая содержит 4681 оснований (Berns и Bohenzky, (1987) Advances in Virus Research (Academic Press, Inc.) 32:243-307). Геном включает инвертированные концевые повторы (ITR) на каждом конце, которые функционируют в цис-положении как точки начала репликации ДНК и в качестве сигналов упаковки для вируса. ITR составляют приблизительно 145 п.н. в длину. Внутренняя не повторяющаяся часть генома включает две больших открытых рамки считывания, известных как гены AAV rep и cap, соответственно. Эти гены кодируют вирусные белки, участвующие в репликации и упаковке вириона. В частности, по меньшей мере, четыре вирусных белка синтезируются с гена AAV rep, Rep 78, Rep 68, Rep 52 и Rep 40, названные в соответствии с их наблюдаемой молекулярной массой. Ген AAV cap кодирует, по меньшей мере, три белка, VP1, VP2 и VP3. Для подробного описания генома AAV, см., например, Muzyczka, N. (1992) Current Topics in Microbiol. and Immunol. 158:97-129.
Конструирование рекомбинантных вирионов AAV, в основном, известно в данной области и описано например, в US 5173414 и US5139941; WO 92/01070, WO 93/03769, (Lebkowski et al. (1988) Molec. Cell. Biol. 8:3988-3996; Vincent et al. (1990) Vaccines 90 (Cold Spring Harbor Laboratory Press); Carter, B. J. (1992) Current Opinion in Biotechnology 3:533-539; Muzyczka, N. (1992) Current Topics in Microbiol. and Immunol. 158:97-129; и Kotin, R. M. (1994) Human Gene Therapy 5:793-801.
Изобретение можно осуществлять с использованием ITR из любого серотипа AAV, включая AAV1, AAV2, AAV3 (в том числе, типы 3A и 3B), AAV4, AAV5, AAV6, AAV7, AAV8, AAV9, AAV10, AAV11, AAV12, AAV птиц, бычий AAV, AAV собак, AAV лошадей, AAV овец, и любой другой серотип AAV, известный в настоящее время или открытый позднее.
В одном из вариантов осуществления необязательно в комбинации с одним или несколькими признаками различных вариантов осуществления, описанными выше или ниже, конструкция нуклеиновой кислоты содержит 5'ITR и 3'ITR из серотипа AAV, выбранного из группы, состоящей из AAV1, AAV2, и AAV4. В предпочтительном варианте осуществления конструкция нуклеиновой кислоты содержит последовательности ITR, ограниченные основаниями 1-141, и основаниями 4968-5107 из SEQ.ID.NO.1, которые представляют собой последовательности ITR из AAV2.
ITR представляют собой только вирусные элементы AAV, которые необходимы в цис-положении для репликации генома AAV и его упаковки в вирусные частицы.
В одном из вариантов осуществления необязательно в комбинации с одним или несколькими признаками различных вариантов осуществления, описанными выше или ниже, конструкция нуклеиновой кислоты содержит 5'ITR, сигнал упаковки ψ и 3'ITR аденовируса из любого серотипа в пределах любой классификации подгрупп (A-F). В конкретном варианте осуществления необязательно в комбинации с одним или несколькими признаками различных вариантов осуществления, описанными выше или ниже, эти последовательности 5'ITR, сигнала ψ и 3'ITR происходят из подгруппы C аденовируса, более предпочтительно от аденовируса серотипа 2 (Ad2) или серотипа 5 (Ad5).
С другой стороны, в других вариантах осуществления изобретение можно осуществлять с использованием синтетических 5'ITR и/или 3'ITR; и также с использованием 5'ITR и 3'ITR, которые получены от вирусов разных серотипов.
Все другие вирусные гены, необходимые для репликации вирусного вектора могут быть представлены в транс-ориентации в вирус-продуцирующих клетках (упаковывающих клетках), как описано ниже. Таким образом, их включение в конструкцию нуклеиновой кислоты генома вирусного вектора по изобретению является необязательным.
В одном из вариантов осуществления необязательно в комбинации с одним или несколькими признаками различных вариантов осуществления, описанными выше или ниже, экспрессирующий вектор представляет собой вектор на основе AAV.
В конкретном варианте осуществления конструкция нуклеиновой кислоты по изобретению представляет собой вектор на основе AAV, выбранный из группы комбинаций, состоящей из:
a) вектора, который содержит нуклеотидные последовательности 5'ITR и 3'ITR из AAV2, последовательность промотора AAT и нуклеотидную последовательность, кодирующую укороченный ATP7B человека(d57-486);
b) вектора, который содержит нуклеотидные последовательности 5'ITR и 3'ITR из AAV2, последовательность промотора AAT и нуклеотидную последовательность с оптимизированными кодонами из SEQ.ID.NO.8, кодирующую укороченный ATP7B человека(d57-486);
c) вектора, который содержит нуклеотидные последовательности 5'ITR и 3'ITR из AAV2, последовательность гибридного промотора EalbPa1AT и нуклеотидную последовательность, кодирующую укороченный ATP7B человека(d57-486); и
d) вектора, который содержит нуклеотидные последовательности 5'ITR и 3'ITR из AAV2, последовательность гибридного промотора EalbPa1AT и нуклеотидную последовательность с оптимизированными кодонами из SEQ.ID.NO.8, кодирующую укороченный ATP7B человека(d57-486).
Каждый из этих вариантов осуществления вектора на основе AAV также включает последовательность сигнала полиаденилирования, такую как синтетическая поли(A) сигнальная последовательность из SEQ.ID.NO.1 или любой другой подходящий поли(A) сигнал; вместе или раздельно с другими необязательными нуклеотидными элементами.
В другом варианте осуществления необязательно в комбинации с одним или несколькими признаками различных вариантов осуществления, описанными выше или ниже, экспрессирующий вектор представляет собой аденовирусный вектор. Этот аденовирусный вектор по изобретению может быть, в частности, аденовирусом первого, второго или третьего поколения [см. Adenovirus. Methods and Protocols. Chillón M. и Bosch A. (Eds); third Edition; 2014 Springer], или любой другой уже известной или описанной позже аденовирусной векторной системой.
В конкретном варианте осуществления необязательно в комбинации с одним или несколькими признаками различных вариантов осуществления, описанными выше или ниже, вирусный вектор по изобретению представляет собой «аденовирус третьего поколения», который также может быть обозначен как «выпотрошенный аденовирус», «аденовирус, зависимый от помощника (HD-Ad)», или «аденовирус с высокой емкостью (HC-Ad)». У аденовируса третьего поколения удалены все вирусные кодирующие области (выпотрошенный); он зависит от аденовируса-помощника для репликации (зависимый от помощника); и он может нести и лоставлять в клетку-хозяина вплоть до 36 Кб вставок чужеродного генетического материала (с высокой емкостью). Выпотрошенный аденовирус сохраняет инвернтированные концевые повторы ITR (5' и 3') и сигнал упаковки (ψ).
Конструкцию нуклеиновой кислоты и экспрессирующий вектор по изобретению, описанные в настоящем документе, можно получать общепринятыми способами, известными специалистам в данной области: Sambrook and Russell (Molecular Cloning: A Laboratory Manual; Third Edition; 2001 Cold Spring Harbor Laboratory Press); и Green and Sambrook (Molecular Cloning: A Laboratory Manual; Fourth Edition; 2012 Cold Spring Harbor Laboratory Press).
ВИРУСНАЯ ЧАСТИЦА ПО ИЗОБРЕТЕНИЮ ДЛЯ ГЕНОТЕРАПИИ
Термины «вирусная частица», и «вирион» используются в настоящем документе взаимозаменяемо и относятся к инфекционной вирусной частице, как правило, с дефектной репликацией, содержащей вирусный геном (т.е. конструкцию нуклеиновой кислоты экпрессирующего вирусного вектора) и упакованной в капсид и, соответственно, в липидную оболочку, окружающую капсид.
В одном из вариантов осуществления необязательно в комбинации с одним или несколькими признаками различных вариантов осуществления, описанными выше или ниже, вирион по изобретению представляет собой "рекомбинантный вирион AAV» или "вирион rAAV", полученный путем упаковки конструкции нуклеиновой кислоты вектора на основе AAV по изобретению в белковую оболочку.
Белки вирусного капсида аденоассоциированного вируса (капсидные белки VP1, VP2, и VP3) получают из одного вирусного гена (гена cap). Различия между последовательностями капсидных белков из разных серотипов AAV являются результатом использования различных рецепторов клеточной поверхности для прониконовения в клетку. В комбинации с альтернативными внутриклеточными путями обработки, это приводит к различной тропности к ткани для каждого серотипа AAV.
В конкретном варианте осуществления рекомбинантный вирион AAV по изобретению можно получать путем упаковки конструкции нуклеиновой кислоты вектора на основе AAV/генома AAV, полученной из конкретного серотипа AAV, в вирусную частицу, образованную природными белками Cap, соответствующими AAV того же конкретного серотипа. Однако были разработаны несколько способов для модификации и улучшения структурных и функциональных свойств вирусных частиц природных AAV (Bünning H et al. J Gene Med 2008; 10: 717-733). Таким образом, нуклеотидную конструкцию вирусного вектора, фланкированную ITR данного серотипа AAV, можно упаковывать в другую вирусную частицу AAV по изобретению, например, в: a) вирусную частицу, состоящую из капсидных белков, которые получены из того же или другого серотипа AAV [например, ITR AAV2 и капсидные белки AAV5; ITR AAV2 и капсидные белки AAV8; и т.п.]; b) мозаичную вирусную частицу, состоящую из смеси капсидных белков из различных серотипов или мутантов AAV [например, ITR AAV2 с капсидными белками AAV1 и AAV5]; c) химерную вирусную частицу, состоящую из капсидных белков, которые были укорочены путем обмена доменами между различными серотипами или вариантами AAV [например, ITR AAV2 с капсидными белками AAV5 с доменами AAV3]; или d) нацеленную вирусную частицу, сконструированную для расположения селективных связывающих доменов, позволяющих строгое взаимодействие со специфическими рецепторами клетки-мишени [например, ITR AAV4 с капсидными белками AAV2, генетически укороченными путем вставки пептидного лиганда; или капсидными белками AAV2, модифицированными не генетическим путем за счет присоединения пептидного лиганда к поверхности капсида].
Специалисту будет понятно, что вирион AAV по изобретению может содержать капсидные белки из любого серотипа AAV. В одном из вариантов осуществления необязательно в комбинации с одним или несколькими признаками различных вариантов осуществления, описанными выше или ниже, вирусная частица содержит капсидные белки AAV. В конкретном варианте осуществления необязательно в комбинации с одним или несколькими признаками различных вариантов осуществления, описанными выше или ниже, вирусная частица на основе AAV содержит капсидные белки из серотипа, выбранного из группы, состоящей из AAV1, AAV5, AAV7, AAV8, и AAV9, которые наиболее подходят для доставки в клетки печени (Nathwani et al. Blood 2007; 109: 1414-1421; Kitajima et al. Atherosclerosis 2006; 186:65-73). В конкретном варианте осуществления необязательно в комбинации с одним или несколькими признаками различных вариантов осуществления, описанными выше или ниже, вирусная частица содержит конструкцию нуклеиновой кислоты по изобретению, где последовательности 5'ITR и 3'ITR из конструкции нуклеиновой кислоты принадлежат серотипу AAV2, а капсидные белки принадлежат серотипу AAV8.
В конкретном варианте осуществления необязательно в комбинации с одним или несколькими признаками различных вариантов осуществления, описанными выше или ниже, вирусная частица на основе AAV содержит капсидные белки из Anc80, предсказанного предшественника вирусных серотипов AAV 1, 2, 8, и 9, который ведет себя как высоко мощный генотерапевтический вектор для нацеливания на печень, мышцу и сетчатку (Zinn et al. Cell Reports 2015; 12:1-13). В более конкретном варианте осуществления, вирусная частица содержит капсидный белок VP3 Anc80L65 (номер доступа GeneBank: KT235804).
Вирусно-гликановые взаимодействия являются решающими определяющими факторами для проникновения в клетку. В конкретном варианте осуществления необязательно в комбинации с одним или несколькими признаками различных вариантов осуществления, описанными выше или ниже, вирусная частица на основе AAV содержит капсидные белки, содержащие одну или несколько аминокислотных замен, где замены вводят новый участок связывания с гликанами в капсидный белок AAV. В более конкретном варианте осуществления, замены аминокислот происходят в аминокислоте 266, аминокислотах 463-475 и аминокислотах 499-502 в AAV2 или в соответствующих аминокислотных положениях в AAV1, AAV3, AAV4, AAV5, AAV6, AAV7, AAV 8, AAV9, AAV10 или любом другом серотипе AAV, также включающем Anc80 и Anc80L65.
Новый введенный участок связывания с гликанами может быть участком связывания с гексозой [например, участок связывания с галактозой (Gal), маннозой (Man), глюкозой (Glu) или фукозой (fuc)]; участок связывания с сиаловой кислотой (Sia) [например, с остатком Sia, таким как N-ацетилнейраминовая кислота (NeuSAc) или N-гликолилнейраминовая кислота (NeuSGc)]; или участок связывания с дисахаридом, где дисахарид представляет собой сиаловую кислоту, связанную с галактозой, например, в форме Sia(alpha2,3)Gal или Sia(alpha2,6)Gal. Подробное руководство по введению нового участка связывания из серотипа AAV в капсидный белок из другого серотипа AAV дано в международной патентной публикации WO2014144229 и у Shen et al. (J. Biol. Chem. 2013; 288(40):28814-28823). В конкретном варианте осуществления необязательно в комбинации с одним или несколькими признаками различных вариантов осуществления, описанными выше или ниже, участок связывания с Gal из AAV9 введен в остов VP3 AAV2, что приводит к штамму AAV с двойным гликановым связыванием, который способен использовать и HS и Gal рецепторы для проникновения в клетку. Предпочтительно, указанный штамм AAV с двойным гликановым связыванием представляет собой AAV2G9. Shen et al. создал AAV2G9 путем замены аминокислотных остатков непосредственно включенных в участок распознавания и непосредственно фланкирующих участок распознавания Gal на субъединице капсидного белка VP3 AAV9 на соответствующие остатки кодирующей области субъединицы капсидного белка VP3 AAV2 (нумерация VP3 AAV2 - Q464V, A467P, D469N, I470M, R471A, D472V, S474G, Y500F, и S501A).
В другом варианте осуществления необязательно в комбинации с одним или несколькими признаками различных вариантов осуществления, описанными выше или ниже, вирион по изобретению представляет собой аденовирусный вирион, такой как вирион Ad5. Также как и в случае с вирионами AAV, капсидные белки вирионов Ad также можно конструировать для изменения их тропности и свойств нацеливания на клетки, также можно использовать альтернативные серотипы аденовирусов.
Выработка вирусных частиц
Выработку вирусных частиц, несущих конструкцию нуклеиновой кислоты экспрессионного вирусного вектора по изобретению можно проводить путем общепринятых способов и протоколов, которые выбраны с учетом структурных признаков, выбранных для данного варианта осуществления конструкции нуклеиновой кислоты и вирусной частицы вектора, которую необходимо получить.
В кратком изложении, вирусные частицы можно получать в конкретной вирус-продуцирующей клетке (упаковывающей клетке), которую трансфецируют конструкцией нуклеиновой кислоты вектора, которую нужно упаковать, в присутствии вектора-помощника или вируса-помощника или другой конструкции/конструкций ДНК.
Таким образом, в одном из аспектов изобретение относится к использованию конструкции нуклеиновой кислоты или экспрессирующего вектора по изобретению для выработки вирусных частиц.
В связанном аспекте, изобретение относится к процессу выработки вирусных частиц по изобретению, включающему стадии:
a) культивирования клетки-хозяина, содержащей конструкцию нуклеиновой кислоты или экспрессирующего вектора по изобретению, в среде для культивирования; и
b) получения вирусных частиц в супернатанте клеточной культуры и/или внутри клеток.
Предпочтительно, указанная клетка-хозяин представляет собой упаковывающую клетку, как описано ниже. Подходящие среды для культивирования известны специалисту в данной области. Ингредиенты, которые составляют такую среду, могут варьировать в зависимости от типа культивируемой клетки. В дополнение к питательной композиции, осмолярность и pH считаются важными параметрами сред для культивирования. Среда для выращивания клеток содержит ряд ингредиентов, хорошо известных специалисту в данной области, в том числе аминокислоты, витамины, органические и неорганические соли, источники углевода, липиды, микроэлементы (CuSO4, FeSO4, Fe(NO3)3, ZnSO4), каждый ингредиент присутствует в количестве, которое поддерживает культивирование клетки in vitro (т.е., выживание и рост клеток). Ингредиенты также могут включать различные вспомогательные вещества, такие как буферные вещества (такие как бикарбонат натрия, Hepes, Tris), стабилизаторы окисления, стабилизаторы для противодействия механическому стрессу, ингибиторы протеаз, животные факторы роста, гидролизаты растений, антиагреганты, противовспениватели. Хараткетристики и композиции сред для выращивания клеток различаются в зависимости от конкретных требований для клеток. Примеры коммерчески доступных сред для выращивания клеток представляют собой MEM (минимальная поддерживающая среда), BME (минимальная среда Игла) DMEM (модифицированная Дульбекко среда Игла), Iscoves DMEM (среда Дульбекко, модифицированная по способу Исков), GMEM, RPMI 1640, Leibovitz L-15, CHO, McCoy's, Medium 199, HEK293, Ham (среда Хэм) F10 и производные, Ham F12, DMEM/F12, и т.д.
КЛЕТКА-ХОЗЯИН ПО ИЗОБРЕТЕНИЮ
В другом аспекте изобретение относится к клетке-хозяину, содержащей конструкцию нуклеиновой кислоты или экспрессирующий вектор по изобретению.
Применяемый в настоящем документе термин «клетка-хозяин» относится к любой клеточной линии, которая чувствительна к заражению интересующим вирусом и поддается культивированию in vitro.
Клетку-хозяина по изобретению можно использовать для целей генотерапии ex vivo. В таких вариантах осуществления клетки трансфецируют конструкцией нуклеиновой кислоты или вирусного вектора по изобретению и затем переносят пациенту или индивидууму. Трансплантированные клетки могут иметь аутологичное, аллогеничное или гетерологичное происхождение. Для клинического применения, выделение клеток проводят, как правило, в условиях Надлежащей практики организации производства (GMP). Перед пересадкой, как правило, проверяют качество клеток и отсутствие микробных или других загрязнений, и можно проводить предтрансплантационную подготовку печени, такую как обработка радиацией и/или иммуносупрессорами. Кроме того, клетки-хозяева можно пересаживать вместе с факторами роста для стимуляции клеточной пролиферации и/или дифференцировки, такими как фактор роста гепатоцитов (HGF).
В конкретном варианте осуществления клетку-хозяина применяют для генотерапии ex vivo в печени. Предпочтительно, указанные клетки представляют собой эукариотические клетки, такие как клетки млекопитающих, которые в качестве неограничивающих примеров включают, людей, не являющиеся человеком приматов, таких как человекообразные обезьяны; шимпанзе; нечеловекообразных обезьян, и орангутанов, домашних животных, в том числе собак и кошек, а также домашний скот, такой как лошади, крупный рогатый скот, свиньи, овцы, и козы, или другие виды млекопитающих, в том числе без ограничений, мыши, крысы, морские свинки, кролики, хомяки, и т.п. Специалист в данной области может подобрать наиболее подходящие клетки в соответсвии с пациентом или индивидуумом, которому они буду трансплантированы.
Указанная клетка-хозяин может быть клеткой со свойствами самоподдержания и плюрипотентности, такой как стволовые клетки или индуцированные плюрипотентные стволовые клетки. Стволовые клетки предпочтительно являются мезенхимальными стволовыми клетками. Мезенхимальные стволовые клетки (MSC) способны к дифференцировке, по меньшей мере, в один тип из остеобласта, хондроцита, адипоцита, или миоцита, и могут быть выделены из любого типа ткани. В основном, MSC выделяют из костного мозга, жировой ткани, пупочного канатика, или периферической крови. Способы для получения хорошо известны специалисту в данной области. Индуцированные плюрипотентные стволовые клетки (также известные как клетки iPS iPSC) представляют собой тип плюрипотентной стволовой клетки, который можно получать непосредственно из взрослых клеток. Yamanaka et al. индуцировали клетки iPS путем переноса генов Oct3/4, Sox2, Klf4 и c-Myc в фибробласты мыши и человека, и принуждения клеток к экспрессии генов (WO 2007/069666). Thomson et al. затем получили клетки iPS человека с использованием Nanog и Lin28 вместо Klf4 и c-Myc (WO 2008/118820).
Указанные клетки-хозяева могут также быть гепатоцитами. Способы пересадки гепатоцитов, включая выделение клеток и последующую трансплантацию человеку-реципиенту или мышам-реципиентам, описаны, например, у Filippi и Dhawan, Ann NY Acad Sci. 2014, 1315 50-55; Yoshida et al., Gastroenterology 1996, 111: 1654-1660; Irani et al. Molecular Therapy 2001, 3:3, 302-309; и Vogel et al. J Inherit Metab Dis 2014, 37:165-176. Способ для трансдукции вирусного вектора в гепатоциты ex vivo описан, например, у Merle et al., Scandinavian Journal of Gastroenterology 2006, 41:8, 974-982.
В другом конкретном варианте осуществления клетка-хозяин представляет собой упаковывающую клетку. Указанные клетки могут быть прикрепляющимися клетками или клетками в суспензии. Упаковывающая клетка и вектор-помощник или конструкции ДНК вместе обеспечивают в транс-положении все отсутствующие функции, которые необходимы для полной репликации и упаковки вирусного вектора.
Предпочтительно, указанные упаковывающие клетки представляют собой эукариотические клетки, такие как клетки млекопитающих, включая клетки обезьян, человека, собаки и грызуна. Примеры клеток человека представляют собой клетки PER.C6 (WO01/38362), MRC-5 (ATCC CCL-171), WI-38 (ATCC CCL-75), клетки HEK-293 (ATCC CRL-1573), клетки HeLa (ATCC CCL2), и клетки зародышевого легкого макаки резус (ATCC CL-160). Примеры клеток не являющегося человеком примата представляют собой клетки Vero (ATCC CCL81), клетки COS-1 (ATCC CRL-1650) или клетки COS-7 (ATCC CRL-1651). Примеры клеток собаки представляют собой клетки MDCK (ATCC CCL-34). Примеры клеток грызуна представляют собой клетки хомяка, такие как BHK21-F, клетки HKCC, или клетки CHO.
В качестве альтернативы источникам клеток из млекопитающих, клеточные линии для применения в изобретении можно получать из источников из птиц, таких как курица, утка, гусь, перепел или фазан. Примеры клеточных линий птиц включают эмбриональные стволовые клетки птиц (WO01/85938 и WO03/076601), иммортализованные клетки сетчатки утки (WO2005/042728), и клетки, полученные из эмбриональных стволовых клеток птиц, включая клетки курицы (WO2006/108846) или клетки утки, такие как клеточная линия EB66 (WO2008/129058 & WO2008/142124).
В другом варианте осуществления указанная клетка-хозяин представляет собой клетки насекомых, такие как клетки SF9 (ATCC CRL-1711), клетки Sf21 (IPLB-Sf21), клетки MG1 (BTI-TN-MG1) или клетки High Five™ (BTI-TN-5B1-4).
Таким образом, в конкретном варианте осуществления необязательно в комбинации с одним или несколькими признаками различных вариантов осуществления, описанными выше или ниже, клетка-хозяин содержит:
a) конструкцию нуклеиновой кислоты или экспрессирующий вектор по изобретению (т.е., рекомбинантный геном AAV), как правило, в виде плазмиды;
b) конструкцию нуклеиновой кислоты, как правило, плазмиду, кодирующую гены rep и/или cap AAV, которая не несет последовательности ITR; и/или
c) конструкцию нуклеиновой кислоты, как правило, плазмиду или вирус, содержащую вирусные гены-помощники.
Вирусные гены, необходимые для репликации AAV, в настоящем документе называются вирусные гены-помощники. Как правило, указанные гены, необходимые для репликации AAV, представляют собой аденовирусные гены-помощники, такие как РНК E1A, E1B, E2a, E4, или VA. Предпочтительно, аденовирусные гены-помощники относятся к серотипу Ad5 или Ad2.
Можно использовать общепринятые способы для получения вирусных частиц вектора на основе AAV, которые включают временную ко-трансфекцию клеток конструкцией нуклеиновой кислоты (например, плазмидой), несущей рекомбинантный вектор на основе AAV/геном AAV по изобретению; конструкцией нуклеиновой кислоты (например, плазмидой-помощником на основе AAV), которая кодирует гены rep и cap, но не несет последовательности ITR; и третьей конструкцией нуклеиновой кислоты (например, плазмидой), обеспечивающей аденовирусные функции, необходимые для репликации AAV.
Таким образом, в конкретном варианте осуществления необязательно в комбинации с одним или несколькими признаками различных вариантов осуществления, описанными выше или ниже, указанная клетка-хозяин характеризуется содержанием:
i) конструкции нуклеиновой кислоты или экспрессирующего вектора по изобретению (т.е., рекомбинантного генома AAV);
ii) конструкции нуклеиновой кислоты, кодирующей гены rep и cap AAV, которая не несет последовательности ITR; и
iii) конструкции нуклеиновой кислоты, содержащей аденовирусные гены-помощники.
Альтернативно, гены rep, cap и аденовирусные гены-помощники можно комбинировать в одной плазмиде (Blouin Vet al. J Gene Med. 2004; 6(suppl): S223-S228; Grimm D. et al. Hum. Gene Ther. 2003; 7: 839-850). Таким образом, в другом конкретном варианте осуществления необязательно в комбинации с одним или несколькими признаками различных вариантов осуществления, описанными выше или ниже, указанная клетка-хозяин характеризуется содержанием:
i) конструкции нуклеиновой кислоты или экспрессирующего вектора по изобретению (т.е., рекомбинантного генома AAV);
ii) конструкции нуклеиновой кислоты, кодирующей гены rep и cap AAV, которая не несет последовательности ITR и дополнительно содержит аденовирусные гены-помощники.
В дополнительном конкретном варианте осуществления необязательно в комбинации с одним или несколькими признаками различных вариантов осуществления, описанными выше или ниже, клетка-хозяин содержит:
a) конструкцию нуклеиновой кислоты или экспрессирующий вектор по изобретению (т.е., рекомбинантный геном AAV);
b) плазмиду, кодирующую гены rep и cap AAV, которая не несет последовательности ITR; и
c) плазмиду, содержащую аденовирусные гены-помощники РНК E2a, E4, и VA,
где ко-трансфекцию проводят в клетках, предпочтительно клетках млекопитающих, которые экспрессируют аденовирусный ген E1 и транскомплементарны ему, такие как клетки HEK-293 (ATCC CRL-1573).
Широкомасштабное производство векторов на основе AAV по изобретению можно также проводить, например, путем заражения клеток насекомых комбинацией рекомбинантных бакуловирусов (Urabe et al. Hum. Gene Ther. 2002; 13: 1935-1943). Клетки SF9 совместно заражают тремя бакуловирусными векторами, соответственно экспрессирующими rep AAV, cap AAV и вектор AAV, который предполагается упаковать. Рекомбинантные бакуловирусные векторы будут обеспечивать функции вирусного гена-помощника, необходимого для репликации и/или упаковки вируса.
С использованием плазмиды-помощника, кодирующей ORF rep (открытую рамку считывания) одного серотипа AAV и ORF cap из другого серотипа AAV, становится возможным упаковать вектор, фланкированный ITR определенного серотипа AAV, в вирионы, собранные из капсидных структурных белков другого серотипа. Также при помощи этого способа возможна упаковка мозаичного, химерного или нацеленного векторов.
С другой стороны, получение векторов с высокой емкостью HC-Ad по изобретению можно проводить при помощи клеток млекопитающих, которые постоянно экспрессируют аденовирусный ген E1 и транскомплементарны ему, а также рекомбиназу Cre (например, клетки 293Cre). Эти клетки трансфецируют геномом вектора HC-Ad и заражают аденовирусным вирусом-помощником первого поколения (E1-удален), в котором в котором сигнал для упаковки фланкирован последовательностями loxP. [Parks RJ et al. Proc. Natl. Acad. Sci. USA 1996; 13565-13570; для клеток 293Cre, см. Palmer и Engel. Mol. Ther. 2003; 8:846-852]. Были описаны несколько систем вирусов-помощников на основе Cre/loxP, которые можно использовать для упаковки векторов HC-Ad, такие как AdAdLC8cluc, или оптимизированный самоинактивирующийся вирус-помощник AdTetCre (EP2295591; Gonzalez-Aparicio et al. Gene Therapy 2011; 18: 1025-1033).
Дополнительное руководство по конструированию и получению вирусных векторов для генотерапии по изобретению можно найти в:
Viral Vectors for Gene Therapy, Methods and Protocols. Series: Methods in Molecular Biology, Vol. 737. Merten and Al-Rubeai (Eds.); 2011 Humana Press (Springer).
Gene Therapy. M. Giacca. 2010 Springer-Verlag.
Heilbronn R. and Weger S. Viral Vectors for Gene Transfer: Current Status of Gene Therapeutics. In: Drug Delivery, Handbook of Experimental Pharmacology 197; M. Schäfer-Korting (Ed.). 2010 Springer-Verlag; pp. 143-170.
Adeno-Associated Virus: Methods and Protocols. R.O. Snyder and P. Moulllier (Eds). 2011 Humana Press (Springer).
Bünning H. et al. Recent developments in adeno-associated virus technology. J. Gene Med. 2008; 10:717-733.
Adenovirus: Methods and Protocols. M. Chillón and A. Bosch (Eds.); Third Edition. 2014 Humana Press (Springer).
ТЕРАПЕВТИЧЕСКИЕ ПРИМЕНЕНИЯ
В дополнительном аспекте, изобретение относится к продукту по изобретению, определенному в пределах раздела Сущность изобретения, для применения в качестве лекарственного средства.
В дополнительном аспекте, изобретение относится к продукту по изобретению, определенному в пределах раздела Сущность изобретения, для применения для лечения состояния, вызванного недостаточностью или нарушением функции медь-транспортирующей АТФазы 2, и любых других состояний и заболеваний, при которых повышение экспрессии и активности медь-транспортирующей АТФазы 2 может принести терапевтическую выгоду или улучшение, в частности, заболевания или состояния, ассоциированного со снижением лизосомального ATP7B-зависимого экзоцитоза и накоплением меди в лизосомах, такого как холеостатические нарушения, болезнь Альцгеймера и/или злокачественная опухоль (Polishchuck et al. Dev Cell. 2014, 29(6), 686-700; Gupta and Lutsenko, Future Med. Chem. 2009, 1, 1125-1142).
Индивидуум, подлежащий лечению, может быть млекопитающим, и в частности, пациентом-человеком.
В конкретном варианте осуществления необязательно в комбинации с одним или несколькими признаками различных вариантов осуществления, описанными выше или ниже, состояние, вызванное недостаточностью или нарушением функции медь-транспортирующей АТФазы 2, представляет собой болезнь Вильсона (БВ, номер доступа в онлайн-каталоге фенетических маркеров человека OMIN 277900; http://www.omim.org/entry/277900).
В связанном аспекте, изобретение относится к использованию продукта по изобретению, определенного в пределах раздела Сущность изобретения, в препарате лекарственного средства для применения для лечения состояния, вызванного недостаточностью или нарушением функции медь-транспортирующей АТФазы 2, и любых других состояний и заболеваний, при которых повышение экспрессии и активности медь-транспортирующей АТФазы 2 может принести терапевтическую выгоду или улучшение, предпочтительно для применения для лечения болезни Вильсона.
В дополнительном аспекте, изобретение относится к лечению состояния, вызванного недостаточностью или нарушением функции медь-транспортирующей АТФазы 2, и любых других состояний и заболеваний, при которых повышение экспрессии и активности медь-транспортирующей АТФазы 2 может принести терапевтическую выгоду или улучшение, предпочтительно для применения для лечения болезни Вильсона, у пациента, которое включает введение пациенту терапевтически эффективного количества конструкции нуклеиновой кислоты, экспрессирующего вектора, клетки-хозяина, вирусной частицы или фармацевтической композиции по изобретению.
Лечение продуктом по изобретению может облегчать, улучшать или уменьшать тяжесть одного или нескольких симптомов БВ. Например, лечение может увеличивать и/или восстанавливать синтез холоцерулоплазмина, оксидазную активность церулоплазмина и /или экскрецию меди в желчь (таким образом, снижая накопление меди в сыворотке, печени, головном мозге и моче); и как следствие может облегчать, улучшать или уменьшать тяжесть боли в животе, усталость, желтуху, частоту неконтролируемых движений, ригидность мышц, проблемы с речью, глотанием или физической координацией.
Продукт по изобретению, как правило, будет включен в фармацевтическую композицию или лекарственное средство, необязательно в комбинации с фармацевтическим носителем, разбавителем и/или адъювантом. Такая композиция или медицинский продукт содержит продукт по изобретению в эффективном количестве, достаточном для того чтобы обеспечить желаемый терапевтический эффект, и фармацевтически приемлемый носитель или эксципиент.
Таким образом, в дополнительном аспекте, изобретение относится к фармацевтической композиции, которая содержит конструкцию нуклеиновой кислоты, экспрессирующий вектор, клетку-хозяина или вирусную частицу по изобретению, и фармацевтически приемлемый носитель.
В препарате фармацевтической композиции по изобретению можно использовать любой подходящий фармацевтически приемлемый носитель или эксципиент (См. например, Remington: The Science and Practice of Pharmacy, Alfonso R. Gennaro (Editor) Mack Publishing Company, April 1997). Фармацевтические композиции, как правило, являются стерильными и стабильны в условиях производства и хранения. Фармацевтические композиции можно формулировать в виде растворов (например, физиологический раствор, раствор декстрозы, или забуференный раствор, или другие фармацевтически приемлемые стерильные жидкости), микроэмульсий, липосом, или других организованных структур, подходящих для содержания высокой концентрации продукта (например, микрочастицы или наночастицы). Носитель может быть растворителем или диспергирующей средой, содержащей, например, воду, этанол, полиол (например, глицерин, пропиленгликоль, и жидкий полиэтиленгликоль, и т.п.), и их подходящие смеси. Надлежащую текучесть можно поддерживать, например, при помощи покрытия, такого как лецитин, путем сохранения необходимого размера частиц в случае дисперсии и путем использования поверхностно-активных веществ. Во многих случаях, будет предпочтительно включить в композицию средства для придания изотоничности, например, сахара, полиспирты, такие как маннит, сорбит, или хлорид натрия. Продолжительного всасывания инъекционных композиций можно достигать, включая в композицию средство, которое замедляет абсорбцию, например, соли моностеаратов и желатин. Продукт по изобретению можно вводить в состав с контролируемым высвобождением, например в композицию, которая включает полимер для замедленного высвобождения или другие носители, которые защищают продукт от быстрого высвобождения, в том числе имплантаты и микроинкапсулированные системы доставки. Можно, например, использовать биоразлагаемые и биосовместимые полимеры, такие как этиленвинилацетат, полиангидриды, полигликолевая кислота, коллаген, полиортоэфиры, полимолочная кислота и сополимеры полимолочной/полигликолевой кислот (PLG). Предпочтительно, указанную фармацевтическую композицию формулируют в виде раствора, более предпочтительно необязательно в виде забуференного физиологического раствора.
В фармацевтические композиции по изобретению можно также включать дополнительные активные соединения. Руководство по совместному введению дополнительных терапевтических средств можно, например, найти в Справочнике фармацевтических препаратов и специализированных средств (CPS) Канадской ассоциации фармацевтов.
В одном из вариантов осуществления необязательно в комбинации с одним или несколькими признаками различных вариантов осуществления, описанными выше или ниже, фармацевтическая композиция по изобретению представляет собой парентеральную фармацевтическую композицию, в том числе композицию, подходящую для внутривенного, внутриартериального, подкожного, интраперитонеального или внутримышечного введения. Эти фармацевтические композиции приведены только в качестве примера и не ограничивают фармацевтические композиции, подходящие для других парентеральных и непарентеральное путей введения.
В контексте изобретения, "эффективное количество" означает терапевтически эффективное количество.
Применяемый в настоящем документе "терапевтически эффективное количество" относится к количеству, эффективном в дозировках и в течение периодов времени, необходимых для достижения желаемого терапевтического результата, такого как повышение активности, связанной с перемещением меди, таким образом, повышение медь в желчи и снижение меди в сыворотке, печени, головном мозге и моче. Терапевтически эффективное количество продукта по изобретению или фармацевтической композиции, которая его содержит, может меняться в соответствии с такими факторами, как состояние болезни, возраст, пол, и масса индивидуума, и способность продукта или фармацевтической композиции вызывать желаемый ответ у индивидуума. Режимы дозирования можно корректировать для того чтобы обеспечить оптимальный терапевтический ответ. Терапевтически эффективное количество также, как правило, представляет собой количество, при котором любой токсическое или вредное воздействие продукта или фармацевтической композиции перевешивается терапевтически положительным воздействием.
В одном из вариантов осуществления необязательно в комбинации с одним или несколькими признаками различных вариантов осуществления, описанными выше или ниже, фармацевтическую композицию, содержащую продукт по изобретению, вводят индивидууму или пациенту парентеральным путем.
В одном из вариантов осуществления необязательно в комбинации с одним или несколькими признаками различных вариантов осуществления, описанными выше или ниже, фармацевтическую композицию вводят внутривенным, внутриартериальным, подкожным, интраперитонеальным или внутримышечным путем.
В одном из вариантов осуществления необязательно в комбинации с одним или несколькими признаками различных вариантов осуществления, описанными выше или ниже, фармацевтическую композицию, содержащую продукт по изобретению, вводят интерстициальным путем, т.е. путем инъекции к интерстицию или в интерстиций ткани. Ткань-мишень может быть конкретной, например, ткань печени, или может быть сочетанием нескольких тканей, например, ткани мышц и печени. Примеры тканей-мишеней могут включать печень, скелетную мышцу, сердечную мышцу, жировые отложения, почку, легкое, сосудистый эндотелий, эпителиальные и/или гематопоэтические клетки. В предпочтительном варианте осуществления необязательно в комбинации с одним или несколькими признаками различных вариантов осуществления, описанными выше или ниже, композицию вводят путем внутрипеченочной инъекции, т.е. инъекции в межклеточное пространство печеночной ткани.
Количество продукта по изобретению, которое вводят индивидууму или пациенту может варьировать в зависимости от конкретных обстоятельств индивидуума или пациента, включая возраст, пол и массу индивидуума; характер и стадию заболевания, агрессивность заболевания; путь введение; и/или сопутствующее медикаментозное лечение, которое было прописано индивидууму или пациенту. Режимы дозирования можно корректировать для того чтобы обеспечить оптимальный терапевтический ответ.
Для любого конкретного индивидуума, конкретные режимы дозирования можно корректировать с течением времени в соответствии с потребностями индивидуума и профессиональной оценкой о назначении композиций или надзора за введением композиций. Диапазоны доз, представленные в настоящем документе. Приведены только для примера и не ограничивают диапазоны доз, которые могут выбирать врачи-терапевты.
В одном из вариантов осуществления вектор по изобретению на основе AAV можно вводить индивидууму или пациенту для лечения болезни Вильсона в количестве или дозе, находящимся в пределах диапазона от 5×1011 до 1×1014 вг/кг (вг: вирусные геномы; кг: масса тела индивидуума или пациента). В более конкретном варианте осуществления, вектор на основе AAV вводят в количестве, находящемся в пределах диапазона 1×1012 до 1×1013 вг/кг.
В другом варианте осуществления вектор HC-Ad по изобретению можно вводить индивидууму или пациенту для лечения болезни Вильсона в количестве или дозе, находящимся в пределах диапазона от 1×109 до 1×1011 ие/кг (ие: инфекционные единицы вектора).
В другом аспекте изобретение дополнительно относится к набору, содержащему конструкцию нуклеиновой кислоты, вектор, клетку-хозяина, вирусную частицу или фармацевтическую композицию по изобретению в одном или нескольких контейнерах. Набор по изобретению может включать инструкции или упаковочные материалы, которые описывают, как вводить пациенту конструкцию нуклеиновой кислоты, вектор, клетку-хозяина или вирусную частицу по изобретению, содержащиеся в наборе. Контейнеры из набора могут быть из любого подходящего материала, например, стекла, пластика, металла, и т.д., и любого подходящего размера, формы, или конфигурации. В определенных вариантах осуществления наборы могут включать одну или несколько ампул или шприцов, которые содержат конструкцию нуклеиновой кислоты, вектор, клетку-хозяина, вирусную частицу или фармацевтическую композицию по изобретению в подходящей жидкости или в форме раствора.
На всем протяжении описания и формулы изобретения слово "содержит" и его варианты, не предназначено для исключения других технических признаков, добавок, компонентов или этапов. Кроме того, слово «содержит» включает случай «состоит из». Дополнительные объекты, преимущества и признаки изобретения станут понятны специалистам в данной области при рассмотрении описания или могут быть изучены при практиковании изобретения. Следующие примеры приведены в качестве иллюстрации, и они не предназначены для ограничения настоящего изобретения. Кроме того, настоящее изобретение охватывает все возможные комбинации конкретных и предпочтительных вариантов осуществления, описываемых в настоящем документе.
ПРИМЕРЫ
Пример 1. Конструирование рекомбинантных экспрессирующих векторов
Были разработаны и произведены пять различных векторов на основе AAV, которые несут и экспрессируют ATP7B человека, или укороченную форму ATP7B человека, для проведения генотерапии болезни Вильсона (БВ): AAV2/8-AAT-wtATP7B, AAV2/8-AAT-coATP7B, AAV2/8-AAT-ATP7B(d223-366), AAV2/8-AAT-ATP7B(d57-486) и AAV2/8-AAT-coATP7B(d57-486).
1.1 Вектор AAV2/8-AAT-wtATP7B [в настоящем документе также называется AAV-wtATP7B]
Геномная последовательность этого вектора идентифицирована как SEQ.ID.NO.1.
Сначала, плазмида pUC-ATP7B была собрана по запросу (GenScript) путем клонирования конструкции нуклеиновой кислоты в плазмиду pUC57. Конструкция нуклеиновой кислоты содержала последовательность кДНК, кодирующую ATP7B человека (трансген), вместе с синтетической последовательностью сигнала подиаденилирования (Levitt N. et al. Genes & Development 1989; 3(7):1019-1025) ниже трансгена.
Затем, в плазмиду pUC-ATP7B был введен минимальный промотор гена альфа1-антитрипсина (AAT), выше гена ATP7B. Минимальный промотор включает последовательность от нуклеотида -261 до нуклеотида +44 относительно сайта кэпирования промотора AAT (Kramer M.G. et al. Mol. Therapy 2003; 7(3): 375-385) и содержит тканеспецифический элемент (TSE), необходимый для функционирования в печени, и дистальную область (DRI), необходимую для активность полного промотора. Промотор AAT получали путем ПЦР-амплификации с использованием в качестве матрицы плазмиды pEnhAlbAAT-люцифераза (предоставленной M.G. Kramer) и следующих праймеров:
Праймер AAT-прямой
5' CTGGTCTAGAACGCGTCGCCACCCCCTCCACCTTGG 3' (SEQ.ID.NO.10); и
Праймер AAT-обратный
5' ATCATGATGCGGCCGCTTCACTGTCCCAGGTCAGTG 3' (SEQ.ID.NO.11).
Праймер AAT-Прямой имеет участок рестрикции для XbaI и MluI и праймер AAT-обратный имеет участок рестрикции для NotI.
Таким образом, для того чтобы получить плазмиду pUC-AAT-ATP7B, плазмиду pUC-ATP7B расщепляли XbaI и NotI и лигировали с промотором AAT, предварительно расщепленным этими же ферментами.
Экспрессирующую кассету затем субклонировали в плазмиду для переноса на основе AAV pAAV-MCS (Agilent technologies) путем расщепления рестрикционными ферментами PmlI и MluI, таким образом, получая плазмиду pAAV2-AAT-wtATP7B.
После конструирования плазмиды, производили вектор на основе AAV путем двойной трансфекции клеток 293 плазмидой pAAV2-AAT-ATP7B и плазмидой pDP8 (полученной от PlasmidFactory, Bielefeld, Germany; плазмида pDP8 экспрессирует капсидный белок AAV8, белок rep AAV2 и аденовирусные молекулы, необходимые для продукции и упаковки AAV).
Наконец, вектор очищали в градиенте йодиксанола и титровали путем количественной ПЦР.
1.2 Вектор AAV2/8-AAT-coATP7B [в настоящем документе также называется AAV-coATP7B]
Геномная последовательность этого вектора идентифицирована как SEQ.ID.NO.3.
Для получения вектора на основе AAV, экспрессирующего версию гена ATP7B с оптимизированными кодонами (coATP7B), сначала собирали по запросу плазмиду pUC-coATP7B (GenScript) путем клонирования конструкции нуклеиновой кислоты в плазмиду pUC57. Затем coATP7B вырезали из pUC-coATP7B путем расщепления рестрикционными ферментами NotI и KpnI и субклонировали в плазмиду pAAV2-AAT-wtATP7B, предварительно расщепленную этими же ферментами, NotI и KpnI, для получения плазмиды pAAV2-AAT-coATP7B.
После конструирования плазмиды, продукцию вирусного генома и упаковку вирусных частиц проводили, как было описано ранее для вектора AAV2/8-AAT-wtATP7B: двойная трансфекция ранее полученной плазмидой pAAV2-AAT-coATP7B с плазмидой pDP8, очистка (в градиенте йодиксанола) и титрование.
1.3 Вектор AAV2/8-AAT-ATP7B(d223-366) [в настоящем документе также называется AAV-T1]
Этот вектор несет в качестве последовательности трансгена последовательность нуклеиновой кислоты (SEQ.ID.NO.12), кодирующей ATP7B(d223-366), укороченную форму ATP7B человека, в которой были удалены аминокислоты с 223 до 366. Удаленная последовательность содержит домен HMA 3 и семь аминокислот домена HMA 4.
Для получения вектора, плазмиду pUC57-wtATP7B расщепляли рестрикционными ферментами MfeI и Nae I, для получения плазмиды pUC57-ATP7B-T1. Этим способом размер кодирующей области был уменьшен на 432 нуклеотида, а размер белка на 144 аминокислоты.
После конструирования плазмиды pUC57-ATP7B-T1, продукцию вирусного генома и упаковку вирусных частиц проводили, как было описано ранее для вектора AAV2/8-AAT-wtATP7B: лигирование с промотором AAT, субклонирование в плазмиду pAAV-MCS, двойная трансфекция ранее полученной плазмидой pAAV2-AAT-T1 с плазмидой pDP8, очистка вируса (в градиенте йодиксанола) и титрование.
1.4 Вектор AAV2/8-AAT-ATP7B(d57-486) [в настоящем документе также называется AAV-T2]
Геномная последовательность этого вектора идентифицирована как SEQ.ID.NO.6.
Этот вектор несет в качестве последовательности трансгена последовательность нуклеиновой кислоты, кодирующей ATP7B(d57-486) [также называется ATP7B-T2], укороченную форму ATP7B человека, в которой были удалены аминокислоты с 57 до 486. Этим способом были удалены первые четыре домена HMA, с одновременным сохранением сигнальной последовательности, которая содержит 56 аминокислот аминоконцевой области, уменьшая кодирующую область на 1,29 Кб и белок на 430 аминокислот.
Нуклеотидную последовательность ATP7B(d57-486) получали путем ПЦР-амплификации с использованием pUC57-wtATP7B в качестве матрицы и двух наборов праймеров;
первый набор праймеров, амплифицирующий аминоконцевую последовательность:
Праймер F1:
5'CTAGATGCGGCCGCCACCATGCCTG3' (SEQ.ID.NO.14), и
Праймер R1:
5'CTGAGAAGAAGGGCCCAGGCC3' (SEQ.ID.NO.15); и
второй набор праймеров, амплифицирующий карбоксиконцевую область:
Праймер F2:
5'GGCCCTTCTTCTCAGCCGCAGAAGTGCTTCTTACAG3' (SEQ.ID.NO.16), и
Праймер R2:
5'ACCAAAATCGATAAAACCGATTACAATCC 3' (SEQ.ID.NO.17).
5'-концевые последовательности праймеров R1 и F2 комплементарны. Проводили ПЦР для получения нуклеотидной последовательности, кодирующей ATP7B(d57-486), с использованием эквимолярных количеств очищенных фрагментов из двух ПЦР и праймеров F1 и R2. Продукт ПЦР затем расщепляли NotI и ClaI и клонировали в плазмиду pUC57-AAT-wtATP7B, предварительно расщепленную обоими ферментами, и получали плазмиду pUC57-ATP7B-T2.
После конструирования плазмиды pUC57-ATP7B-T2, продукцию вирусного генома и упаковку вирусных частиц проводили, как было описано ранее для вектора AAV2/8-AAT-wtATP7B: лигирование с промотором AAT, субклонирование в плазмиду pAAV-MCS, двойная трансфекция ранее полученной плазмидой pAAV2-AAT-T2 с плазмидой pDP8, очистка вируса (в градиенте йодиксанола) и титрование.
1.5 Вектор AAV2/8-AAT-coATP7B(d57-486) [в настоящем документе также называется AAV-AAT-coT2]
Этот вектор несет в качестве трансгена последовательность нуклеиновой кислоты с оптимизированными кодонами [SEQ.ID.NO.8; coATP7B(d57-486) или coATP7B-T2], которая также кодирует ATP7B(d57-486).
Нуклеотидную последовательность coATP7B(d57-486) получали путем ПЦР-амплификации с использованием pUC57-coATP7B wtATP7B в качестве матрицы и двух наборов праймеров;
первый набор праймеров, амплифицирующий аминоконцевую последовательность:
Праймер F3:
5' ACGCGTGCGGCCGCCACCATGCCAG 3' (SEQ.ID.NO.18), и
Праймер R3:
5' CTGGGAGCTAGGTCCCAGTCC 3' (SEQ.ID.NO.19); и
второй набор праймеров, амплифицирующий карбоксиконцевую область:
Праймер F4:
5' GGACCTAGCTCCCAGCCTCAGAAGTGTTTTCTGCAG 3' (SEQ.ID.NO.20), и
паймер R4:
5' TGTTCCTCGCGAATGATCAGGTTGTCCTC 3' (SEQ.ID.NO.21).
5'-концевые последовательности праймеров R3 и F4 комплементарны. Проводили ПЦР для получения нуклеотидной последовательности с оптимизированными кодонами, кодирующей ATP7B(d57-486), с использованием эквимолярных количеств очищенных фрагментов из двух ПЦР и праймеров F3 и R4. Продукт ПЦР затем расщепляли NotI и NruI и клонировали в плазмиду pUC57-AAT-wtATP7B, предварительно расщепленную обоими ферментами, и получали плазмиду pUC57-coATP7B-T2.
После конструирования плазмиды pUC57-coATP7B-T2, продукцию вирусного генома и упаковку вирусных частиц проводили, как было описано ранее для вектора AAV2/8-AAT-wtATP7B: лигирование с промотором AAT, субклонирование в плазмиду pAAV-MCS, двойная трансфекция ранее полученной плазмидой pAAV2-AAT-coT2 с плазмидой pDP8, очистка вируса (в градиенте йодиксанола) и титрование.
Пример 2. Модель болезни Вильсона на животных: ATP7B KO
Терапевтические свойства векторов AAV2/8-AAT-ATP7B-T1 и AAV2/8-AAT-ATP7B-T2 тестировали на мышах с нокаутом ATP7B (ATP7B KO, ATP7B-/-или мыши с БВ), которые являются типичной моделью БВ на животных. Эта модель на животных была разработана Buiakova et al., путем введения кодона ранней терминации в мРНК ATP7B мыши за счет конструирования замены части экзона 2 ATP7B неомициновой кассетой, ориентированной в противоположной транскрипционной рамке (Buikova O.I. et al. Human Molecular Genetics 1999; 8(9): 1665-1671). Мыши с нокаутом ATP7B показывают отсутствие экспрессии ATP7B в печени и высокую экскрецию Cu в мочу, низкие уровни холоцерулоплазмина в сыворотке, высокие уровни трансаминаз, высокую концентрацию Cu в печени и патологическую гистологию печени. Эти мыши демонстрируют типичные биохимические характеристики болезни Вильсона у человека, за исключением неврологической аффектации (Lutsenko S. Biochemical Society Transactions 2008; 36(Pt 6): 1233-1238).
Пример 3. Определение терапевтического эффекта of вирусных векторов AAV2/8-AAT-ATP7B-T1 и AAV2/8-AAT-ATP7B-T2 у мышей с болезнью Вильсона
Шестинедельных (6w) самцов мышей ATP7B-/- делили на 4 группы по 5 мышей в каждой: первую из групп лечили внутривенно вектором AAV2/8-AAT-wtATP7B в дозе 3×1010 вг/на мышь (вг: вирусные геномы); вторую группу лечили такой же дозой вектора AAV2/8-AAT-ATP7B-T1; третью группу лечили такой же дозой вектора AAV2/8-AAT-ATP7B-T2; и четвертую группу оставили нелеченной. Дополнительную группу мышей дикого типа оставляли нелеченной в качестве контрольной группы (контроль). Животных умерщвляли через двадцать четыре недели после введения вектора (w30).
Через четыре недели после введения вектора и каждые пять недель после этого, вплоть до недели 30 у всех групп определяли уровни трансаминаз в сыворотке (ALT) и содержание Cu в моче. Активность церулоплазмина в сыворотке измеряли через 4 недели после лечения.
Уровни трансаминаз в сыворотке (ALT) определяли способом с DGKC (Roche Diagnostics, Mannheim, Germany) с использованием клинического анализатора Hitachi 747 (Hitachi, Tokyo, Japan).
Активность церулоплазмина в сыворотке определяли с использованием в качестве субстрата ο-дианизидин дигидрохлорида (4,4'-диамино-3,3'-диметокси-бифенила) (Sigma-Aldrich, San Louis, MO, United States), как описано у Schosinsky и коллег. (Clinical Chemistry 1974; 20(12): 1556-1563). Оптическую плотность измеряли при 540 нм на спектрофотометре.
Содержание меди в моче определяли при помощи атомно-абсорбционной спектроскопии (SIMAA 6000, from Perkin-Elmer GmbH, Bodenseewerk).
После умерщвления печень вырезали для гистологического анализа.
Содержание меди в печени определяли в сухой ткани печени при помощи атомно-абсорбционной спектроскопии (SIMAA 6000, от Perkin-Elmer GmbH, Bodenseewerk), и способом окрашивания серебром по Тимму (Danscher G. и Zimmer J. Histochemistry 1978; 55(1): 27-40).
Структуру печени оценивали на срезах, окрашенных гематоксилином и эозином.
Проводили иммуногистохимию с антителом к мышиному CD45 (BioLegend, San Diego, USA; каталожный номер 103102) для выявления воспалительной инфильтрации в печени.
Также проводили иммуногистохимию с антителом к мышиному PanCk (Invitrogen/Life Technologies, 18-0132, клон AE1/AE3) для выявления клеток желчевыводящих путей.
Для выявления фиброза использовали общепринятое окрашивание Сириусом красным в качестве способа для определения коллагена.
Как показано на фигуре 2, уровни трансаминаз нормализовались у мышей, получавших AAV2/8-AAT-wtATP7B или AAV2/8-AAT-ATP7B-T2, но не у животных, которых лечили AAV2/8-AAT-ATP7B-T1. Кроме того, концентрация Cu в моче была значимо ниже у животных, которые получили AAV2/8-AAT-wtATP7B, AAV2/8-AAT-ATP7B-T1, или AAV2/8-AAT-ATP7B-T2; однако AAV2/8-AAT-ATP7B-T1 был менее эффективен для снижения концентрации Cu в моче (фигура 3). Активность церулоплазмина восстановилась через четыре недели после лечения у животных, получающих AAV2/8-AAT-wtATP7B или AAV2/8-AAT-ATP7B-T2, но не у животных, которых лечили AAV2/8-AAT-ATP7B-T1 (фигура 4). Это результат был подкреплен анализом вестерн-блоттинга. Холоцерулоплазмин был выявлен у мышей, которых лечили AAV2/8-AAT-wtATP7B или AAV2/8-AAT-ATP7B-T2, но не у животных, которых лечили AAV2/8-AAT-ATP7B-T1, где, как и у необработанных мышей с БВ, можно было выявить только форму апоцерулоплазмина.
С другой стороны, введение AAV2/8-AAT-wtATP7B, AAV2/8-AAT-ATP7B-T1, или AAV2/8-AAT-ATP7B-T2 значимо снизило содержание Cu в печени; однако, AAV2/8-AAT-ATP7B-T1 был менее эффективен для снижения концентрации Cu в печени (фигура 5). Результаты подтвердились на снимке, полученном после окрашивания по Тимму (фигура 6B). Что касается гистологии печени, животные без лечения демонстрировали нарушенную архитектуру печени с огромными гепатоцитами, содержащими ненормальные ядра. Введение векторов AAV2/8-AAT-wtATP7B или AAV2/8-AAT-ATP7B-T2, но не AAV2/8-AAT-ATP7B-T1, привело к нормализации гистологии печени (фигура 6A). Кроме того, у животных с БВ присутствует сильный печеночный инфильтрат, в основном, состоящий из CD45-положительных клеток; инфильтрат исчез после лечения рекомбинантными вирусными векторами (фигура 7). Таким образом, введение вектора на основе AAV привело к заметному уменьшению воспалительного инфильтрата. Кроме того, были также значимо снижены пролиферация в желчных протоках и фиброз печениу мышей с БВ, которых лечили AAV2/8-AAT-wtATP7B, AAV2/8-AAT-ATP7B-T2, и AAV2/8-AAT-ATP7B-T1 (фигура 7).
Пример 4. Терапевтический эффект вирусного вектора AAV2/8-AAT-ATP7B(d57-486) у самок мышей с болезнью Вильсона
Шестинедельных (6w) самок мышей ATP7B-/- делили на 4 группы по 5 мышей в каждой: животных из групп 1-3 обрабатывали внутривенно вирусным вектором AAV2/8-AAT-ATP7B(d57-486), каждая группа получала различную дозу (соответственно, 1×1010, 3×1010 и 1×1011 вирусных геномов/на мышь); четвертую группу оставили нелеченной. Дополнительную группу мышей дикого типа оставляли нелеченной в качестве контрольной группы (WT).
Через четыре недели после введения вектора и каждые пять недель после этого, вплоть до 24 недель после лечения (когда мышам было 30 недель) у всех групп определяли уровни трансаминаз в сыворотке (ALT) и содержание Cu в моче, теми же способами, как описано в примере 3.
Как показано на фигуре 8, AAV2/8-AAT-ATP7B(d57-486) нормализовал уровни трансаминаз у самок с БВ мыши при двух самых высоких дозах (3×1010 и 1×1011вирусных геномов/на мышь); самая низкая доза 1×1010вирусных геномов/на мышь значимо снизила уровни трансаминаз, но не смогла прекратить повреждение печени. Однако, лечение тремя различными дозами значимо снизило экскрецию Cu с мочой, достигнув уровней, которые были получены у мышей WT (фигура 9).
Пример 5. Сравнение терапевтического эффекта вирусных векторов AAV2/8-AAT-wtATP7B и AAV2/8-AAT-ATP7B(d57-486) у самок мышей с болезнью Вильсона.
Были созданы две экспериментальные группы. Для каждой экспериментальной группы шестинедельных (6w) самок мышей ATP7B-/- делили на 4 группы по 5 мышей в каждой: 3 из групп обрабатывали внутривенно тестируемым вирусным вектором, каждая группа получала различную дозу (соответственно, 1×1010, 3×1010 и 1×1011 вирусных геномов/на мышь); четвертую группу оставили нелеченной. Дополнительную группу мышей дикого типа оставляли нелеченной в качестве контрольной группы (WT).
В первой экспериментальной группе (экспериментальная группа 1), мышам с БВ, получавшим лечение, вводили вектор AAV2/8-AAT-wtATP7B; во второй экспериментальной группе (экспериментальная группа 2) им вводили вектор AAV2/8-AAT-ATP7B(d57-486).
Активность церулоплазмина в сыворотке определяли через 4 недели после лечения, а содержание Cu в печени определяли через 24 недели после лечения, при помощи тех же способов, как описано в примере 3.
Активность церулоплазмина в сыворотке
Активность церулоплазмина в сыворотке была скорректирована только при введении самой высокой дозы вектора AAV2/8-AAT-wtATP7B (фигура 10A, экспериментальная группа 1); при введении двух самых низких доз не наблюдали никакого эффекта.
Напротив, вектор AAV2/8-AAT-ATP7B(d57-486) значимо повысил уровни церулоплазмина в самой низкой дозе 1×1010вирусных геномов/на мышь; введение средней дозы вектора нормализовало уровни церулоплазмина, и самая высокая доза увеличила уровни церулоплазмина выше нормальных уровней (фигура 10B, экспериментальная группа 2).
Концентрация Cu в печени
Кроме того, концентрация Cu в печени была снижена, но не нормализовалась при введении двух самых высоких доз AAV2/8-AAT-wtATP7B; и при самой низкой дозе не наблюдали никакого эффекта (фигура 11A, экспериментальная группа 1). Напротив, было показано, что концентрация Cu снизилась после введения вектора AAV2/8-AAT-ATP7B(d57-486) во всех исследуемых дозах, и при самой высокой дозе уровни были близки к нормальным (фигура 11B, экспериментальная группа 2).
Таким образом, было показано, что доза 1×1010вирусных геномов/на мышь вектора AAV2/8-AAT-wtATP7B является «субоптимальной дозой» для нормализации активности церулоплазмина в сыворотке и снижения накопления Cu в печени; в то время как вектор, несущий укороченную форму, неожиданно обеспечил статистически значимые терапевтические эффекты в указанной субоптимальной дозе.
Пример 6. Сравнение терапевтического эффекта вирусных векторов AAV2/8-AAT-wtATP7B и AAV2/8-AAT-ATP7B(d57-486) у мышей с БВ
Шестинедельных (6w) самцов мышей ATP7B-/- делили на три группы мышей: 2 группы животных соответственно лечили субоптимальной внутривенной дозой (1×1010 вирусных геномов/на мышь) вектора AAV2/8-AAT-wtATP7B или вектор AAV2/8-AAT-ATP7B(d57-486); третью группу оставляли нелеченной. Дополнительную группу мышей дикого типа оставляли нелеченной в качестве контрольной группы (WT).
Содержание Cu в печени измеряли тем же способом, как описано в примере 3.
Как показано на фигуре 12, хотя оба вектора AAV2/8-AAT-wtATP7B и AAV2/8-AAT-ATP7B(d57-486), полученные в субоптимальной дозе, снизили накопление меди в печени мышей с БВ, AAV2/8-AAT-ATP7B(d57-486) обеспечил снижение содержания меди в печени, которое было значимо больше, чем снижение обеспеченное AAV2/8-AAT-wtATP7B.
Пример 7. Сравнение терапевтического эффекта вирусных векторов AAV2/8-AAT-ATP7B(d57-486) и AAV2/8-AAT-coATP7B(d57-486) у мышей с БВ.
Шестинедельных (6w) самцов мышей ATP7B-/- делили на три группы мышей: 2 группы животных соответственно лечили субоптимальной внутривенной дозой (1×1010 вирусных геномов/на мышь) вектора AAV2/8-AAT-ATP7B(d57-486) и AAV2/8-AAT-coATP7B(d57-486), третью группу оставляли не леченной. Дополнительную группу мышей дикого типа оставляли не леченной в качестве контрольной группы (WT).
Содержание Cu в печени измеряли тем же способом, как описано в примере 3.
Как показано на фигуре 13, хотя оба вектора AAV2/8-AAT-ATP7B(d57-486) и AAV2/8-AAT-coATP7B(d57-486), полученные в субоптимальной дозе, снизили накопление меди в печени мышей с БВ, AAV2/8-AAT-coATP7B(d57-486) обеспечил снижение содержания меди в печени, которое было значимо больше, чем снижение обеспеченное AAV2/8-AAT-ATP7B(d57-486).
Пример 8. Терапевтический эффект вирусного вектора с оптимизированными кодонами AAV2/8-AAT-coATP7B(d57-486) у мышей с БВ.
Шестинедельных (6w) самцов мышей ATP7B-/- делили на 5 групп мышей: 4 группы животных соответственно лечили субоптимальной внутривенной дозой (1×1010 вирусных геномов/на мышь) векторов AAV2/8-AAT-wtATP7B, AAV2/8-AAT-coATP7B, AAV2/8-AAT-ATP7B(d57-486) или AAV2/8-AAT-coATP7B(d57-486); пятую групп оставляли нелеченной Дополнительную группу мышей дикого типа оставляли нелеченной в качестве контрольной группы (WT).
Активность церулоплазмина в сыворотке измеряли тем же способом, как описано в примере 3.
Как показано на фигуре 14, два вектора, несущих нуклеотидную последовательность укороченного ATP7B-T2, восстановили оксидазную активность церулоплазмина при введении мышам с БВ в субоптимальной дозе, в то время как векторы, несущие нуклеотидные последовательности, кодирующие полный ATP7B человека, не обеспечили никакого значимого улучшения активности церулоплазмина при введении при аналогичных условиях лечения.
--->
СПИСОК ПОСЛЕДОВАТЕЛЬНОСТЕЙ
<110> FUNDACION PARA LA INVESTIGACION MEDICA APLICADA
<120> Конструкции нуклеиновой кислоты и векторы для генотерапии для применения для лечения болезни Вильсона и других состояний
<130> 2014005EP00
<160> 21
<170> BiSSAP 1.3
<210> 1
<211> 5107
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Конструкция нуклеиновой кислоты экспрессирующего вектора AAV2-AAT-wtATP7B
<220>
<221> область повторов
<222> 1..141
<223> /примечание="5' ITR из серотипа 2 аденоассоциированного вируса"
<220>
<221> промотор
<222> 156..460
<223> /примечание="альфа 1 антитрипсин"
<220>
<221> CDS
<222> 473..4870
<223> /примечание="последовательность, кодирующая ATP7B (медь-транспортирующую АТФазу 2)"
/таблица трансляции=1
<220>
<221> полиA_сигнал
<222> 4877..4932
<220>
<221> область повторов
<222> 4968..5107
<223> /стандартное название="3' ITR из серотипа 2 аденоассоциированного вируса "
<400> 1
cctgcaggca gctgcgcgct cgctcgctca ctgaggccgc ccgggcaaag cccgggcgtc 60
gggcgacctt tggtcgcccg gcctcagtga gcgagcgagc gcgcagagag ggagtggcca 120
actccatcac taggggttcc tgcggccgca cgcgtcgcca ccccctccac cttggacaca 180
ggacgctgtg gtttctgagc caggtacaat gactcctttc ggtaagtgca gtggaagctg 240
tacactgccc aggcaaagcg tccgggcagc gtaggcgggc gactcagatc ccagccagtg 300
gacttagccc ctgtttgctc ctccgataac tggggtgacc ttggttaata ttcaccagca 360
gcctcccccg ttgcccctct ggatccactg cttaaatacg gacgaggaca gggccctgtc 420
tcctcagctt caggcaccac cactgacctg ggacagtgaa gcggccgcca cc atg cct 478
Met Pro
1
gag cag gag aga cag atc aca gcc aga gaa ggg gcc agt cgg aaa atc 526
Glu Gln Glu Arg Gln Ile Thr Ala Arg Glu Gly Ala Ser Arg Lys Ile
5 10 15
tta tct aag ctt tct ttg cct acc cgt gcc tgg gaa cca gca atg aag 574
Leu Ser Lys Leu Ser Leu Pro Thr Arg Ala Trp Glu Pro Ala Met Lys
20 25 30
aag agt ttt gct ttt gac aat gtt ggc tat gaa ggt ggt ctg gat ggc 622
Lys Ser Phe Ala Phe Asp Asn Val Gly Tyr Glu Gly Gly Leu Asp Gly
35 40 45 50
ctg ggc cct tct tct cag gtg gcc acc agc aca gtc agg atc ttg ggc 670
Leu Gly Pro Ser Ser Gln Val Ala Thr Ser Thr Val Arg Ile Leu Gly
55 60 65
atg act tgc cag tca tgt gtg aag tcc att gag gac agg att tcc aat 718
Met Thr Cys Gln Ser Cys Val Lys Ser Ile Glu Asp Arg Ile Ser Asn
70 75 80
ttg aaa ggc atc atc agc atg aag gtt tcc ctg gaa caa ggc agt gcc 766
Leu Lys Gly Ile Ile Ser Met Lys Val Ser Leu Glu Gln Gly Ser Ala
85 90 95
act gtg aaa tat gtg cca tcg gtt gtg tgc ctg caa cag gtt tgc cat 814
Thr Val Lys Tyr Val Pro Ser Val Val Cys Leu Gln Gln Val Cys His
100 105 110
caa att ggg gac atg ggc ttc gag gcc agc att gca gaa gga aag gca 862
Gln Ile Gly Asp Met Gly Phe Glu Ala Ser Ile Ala Glu Gly Lys Ala
115 120 125 130
gcc tcc tgg ccc tca agg tcc ttg cct gcc cag gag gct gtg gtc aag 910
Ala Ser Trp Pro Ser Arg Ser Leu Pro Ala Gln Glu Ala Val Val Lys
135 140 145
ctc cgg gtg gag ggc atg acc tgc cag tcc tgt gtc agc tcc att gaa 958
Leu Arg Val Glu Gly Met Thr Cys Gln Ser Cys Val Ser Ser Ile Glu
150 155 160
ggc aag gtc cgg aaa ctg caa gga gta gtg aga gtc aaa gtc tca ctc 1006
Gly Lys Val Arg Lys Leu Gln Gly Val Val Arg Val Lys Val Ser Leu
165 170 175
agc aac caa gag gcc gtc atc act tat cag cct tat ctc att cag ccc 1054
Ser Asn Gln Glu Ala Val Ile Thr Tyr Gln Pro Tyr Leu Ile Gln Pro
180 185 190
gaa gac ctc agg gac cat gta aat gac atg gga ttt gaa gct gcc atc 1102
Glu Asp Leu Arg Asp His Val Asn Asp Met Gly Phe Glu Ala Ala Ile
195 200 205 210
aag agc aaa gtg gct ccc tta agc ctg gga cca att gat att gag cgg 1150
Lys Ser Lys Val Ala Pro Leu Ser Leu Gly Pro Ile Asp Ile Glu Arg
215 220 225
tta caa agc act aac cca aag aga cct tta tct tct gct aac cag aat 1198
Leu Gln Ser Thr Asn Pro Lys Arg Pro Leu Ser Ser Ala Asn Gln Asn
230 235 240
ttt aat aat tct gag acc ttg ggg cac caa gga agc cat gtg gtc acc 1246
Phe Asn Asn Ser Glu Thr Leu Gly His Gln Gly Ser His Val Val Thr
245 250 255
ctc caa ctg aga ata gat gga atg cat tgt aag tct tgc gtc ttg aat 1294
Leu Gln Leu Arg Ile Asp Gly Met His Cys Lys Ser Cys Val Leu Asn
260 265 270
att gaa gaa aat att ggc cag ctc cta ggg gtt caa agt att caa gtg 1342
Ile Glu Glu Asn Ile Gly Gln Leu Leu Gly Val Gln Ser Ile Gln Val
275 280 285 290
tcc ttg gag aac aaa act gcc caa gta aag tat gac cct tct tgt acc 1390
Ser Leu Glu Asn Lys Thr Ala Gln Val Lys Tyr Asp Pro Ser Cys Thr
295 300 305
agc cca gtg gct ctg cag agg gct atc gag gca ctt cca cct ggg aat 1438
Ser Pro Val Ala Leu Gln Arg Ala Ile Glu Ala Leu Pro Pro Gly Asn
310 315 320
ttt aaa gtt tct ctt cct gat gga gcc gaa ggg agt ggg aca gat cac 1486
Phe Lys Val Ser Leu Pro Asp Gly Ala Glu Gly Ser Gly Thr Asp His
325 330 335
agg tct tcc agt tct cat tcc cct ggc tcc cca ccg aga aac cag gtc 1534
Arg Ser Ser Ser Ser His Ser Pro Gly Ser Pro Pro Arg Asn Gln Val
340 345 350
cag ggc aca tgc agt acc act ctg att gcc att gcc ggc atg acc tgt 1582
Gln Gly Thr Cys Ser Thr Thr Leu Ile Ala Ile Ala Gly Met Thr Cys
355 360 365 370
gca tcc tgt gtc cat tcc att gaa ggc atg atc tcc caa ctg gaa ggg 1630
Ala Ser Cys Val His Ser Ile Glu Gly Met Ile Ser Gln Leu Glu Gly
375 380 385
gtg cag caa ata tcg gtg tct ttg gcc gaa ggg act gca aca gtt ctt 1678
Val Gln Gln Ile Ser Val Ser Leu Ala Glu Gly Thr Ala Thr Val Leu
390 395 400
tat aat ccc tct gta att agc cca gaa gaa ctc aga gct gct ata gaa 1726
Tyr Asn Pro Ser Val Ile Ser Pro Glu Glu Leu Arg Ala Ala Ile Glu
405 410 415
gac atg gga ttt gag gct tca gtc gtt tct gaa agc tgt tct act aac 1774
Asp Met Gly Phe Glu Ala Ser Val Val Ser Glu Ser Cys Ser Thr Asn
420 425 430
cct ctt gga aac cac agt gct ggg aat tcc atg gtg caa act aca gat 1822
Pro Leu Gly Asn His Ser Ala Gly Asn Ser Met Val Gln Thr Thr Asp
435 440 445 450
ggt aca cct aca tct gtg cag gaa gtg gct ccc cac act ggg agg ctc 1870
Gly Thr Pro Thr Ser Val Gln Glu Val Ala Pro His Thr Gly Arg Leu
455 460 465
cct gca aac cat gcc ccg gac atc ttg gca aag tcc cca caa tca acc 1918
Pro Ala Asn His Ala Pro Asp Ile Leu Ala Lys Ser Pro Gln Ser Thr
470 475 480
aga gca gtg gca ccg cag aag tgc ttc tta cag atc aaa ggc atg acc 1966
Arg Ala Val Ala Pro Gln Lys Cys Phe Leu Gln Ile Lys Gly Met Thr
485 490 495
tgt gca tcc tgt gtg tct aac ata gaa agg aat ctg cag aaa gaa gct 2014
Cys Ala Ser Cys Val Ser Asn Ile Glu Arg Asn Leu Gln Lys Glu Ala
500 505 510
ggt gtt ctc tcc gtg ttg gtt gcc ttg atg gca gga aag gca gag atc 2062
Gly Val Leu Ser Val Leu Val Ala Leu Met Ala Gly Lys Ala Glu Ile
515 520 525 530
aag tat gac cca gag gtc atc cag ccc ctc gag ata gct cag ttc atc 2110
Lys Tyr Asp Pro Glu Val Ile Gln Pro Leu Glu Ile Ala Gln Phe Ile
535 540 545
cag gac ctg ggt ttt gag gca gca gtc atg gag gac tac gca ggc tcc 2158
Gln Asp Leu Gly Phe Glu Ala Ala Val Met Glu Asp Tyr Ala Gly Ser
550 555 560
gat ggc aac att gag ctg aca atc aca ggg atg acc tgc gcg tcc tgt 2206
Asp Gly Asn Ile Glu Leu Thr Ile Thr Gly Met Thr Cys Ala Ser Cys
565 570 575
gtc cac aac ata gag tcc aaa ctc acg agg aca aat ggc atc act tat 2254
Val His Asn Ile Glu Ser Lys Leu Thr Arg Thr Asn Gly Ile Thr Tyr
580 585 590
gcc tcc gtt gcc ctt gcc acc agc aaa gcc ctt gtt aag ttt gac ccg 2302
Ala Ser Val Ala Leu Ala Thr Ser Lys Ala Leu Val Lys Phe Asp Pro
595 600 605 610
gaa att atc ggt cca cgg gat att atc aaa att att gag gaa att ggc 2350
Glu Ile Ile Gly Pro Arg Asp Ile Ile Lys Ile Ile Glu Glu Ile Gly
615 620 625
ttt cat gct tcc ctg gcc cag aga aac ccc aac gct cat cac ttg gac 2398
Phe His Ala Ser Leu Ala Gln Arg Asn Pro Asn Ala His His Leu Asp
630 635 640
cac aag atg gaa ata aag cag tgg aag aag tct ttc ctg tgc agc ctg 2446
His Lys Met Glu Ile Lys Gln Trp Lys Lys Ser Phe Leu Cys Ser Leu
645 650 655
gtg ttt ggc atc cct gtc atg gcc tta atg atc tat atg ctg ata ccc 2494
Val Phe Gly Ile Pro Val Met Ala Leu Met Ile Tyr Met Leu Ile Pro
660 665 670
agc aac gag ccc cac cag tcc atg gtc ctg gac cac aac atc att cca 2542
Ser Asn Glu Pro His Gln Ser Met Val Leu Asp His Asn Ile Ile Pro
675 680 685 690
gga ctg tcc att cta aat ctc atc ttc ttt atc ttg tgt acc ttt gtc 2590
Gly Leu Ser Ile Leu Asn Leu Ile Phe Phe Ile Leu Cys Thr Phe Val
695 700 705
cag ctc ctc ggt ggg tgg tac ttc tac gtt cag gcc tac aaa tct ctg 2638
Gln Leu Leu Gly Gly Trp Tyr Phe Tyr Val Gln Ala Tyr Lys Ser Leu
710 715 720
aga cac agg tca gcc aac atg gac gtg ctc atc gtc ctg gcc aca agc 2686
Arg His Arg Ser Ala Asn Met Asp Val Leu Ile Val Leu Ala Thr Ser
725 730 735
att gct tat gtt tat tct ctg gtc atc ctg gtg gtt gct gtg gct gag 2734
Ile Ala Tyr Val Tyr Ser Leu Val Ile Leu Val Val Ala Val Ala Glu
740 745 750
aag gcg gag agg agc cct gtg aca ttc ttc gac acg ccc ccc atg ctc 2782
Lys Ala Glu Arg Ser Pro Val Thr Phe Phe Asp Thr Pro Pro Met Leu
755 760 765 770
ttt gtg ttc att gcc ctg ggc cgg tgg ctg gaa cac ttg gca aag agc 2830
Phe Val Phe Ile Ala Leu Gly Arg Trp Leu Glu His Leu Ala Lys Ser
775 780 785
aaa acc tca gaa gcc ctg gct aaa ctc atg tct ctc caa gcc aca gaa 2878
Lys Thr Ser Glu Ala Leu Ala Lys Leu Met Ser Leu Gln Ala Thr Glu
790 795 800
gcc acc gtt gtg acc ctt ggt gag gac aat tta atc atc agg gag gag 2926
Ala Thr Val Val Thr Leu Gly Glu Asp Asn Leu Ile Ile Arg Glu Glu
805 810 815
caa gtc ccc atg gag ctg gtg cag cgg ggc gat atc gtc aag gtg gtc 2974
Gln Val Pro Met Glu Leu Val Gln Arg Gly Asp Ile Val Lys Val Val
820 825 830
cct ggg gga aag ttt cca gtg gat ggg aaa gtc ctg gaa ggc aat acc 3022
Pro Gly Gly Lys Phe Pro Val Asp Gly Lys Val Leu Glu Gly Asn Thr
835 840 845 850
atg gct gat gag tcc ctc atc aca gga gaa gcc atg cca gtc act aag 3070
Met Ala Asp Glu Ser Leu Ile Thr Gly Glu Ala Met Pro Val Thr Lys
855 860 865
aaa ccc gga agc act gta att gcg ggg tct ata aat gca cat ggc tct 3118
Lys Pro Gly Ser Thr Val Ile Ala Gly Ser Ile Asn Ala His Gly Ser
870 875 880
gtg ctc att aaa gct acc cac gtg ggc aat gac acc act ttg gct cag 3166
Val Leu Ile Lys Ala Thr His Val Gly Asn Asp Thr Thr Leu Ala Gln
885 890 895
att gtg aaa ctg gtg gaa gag gct cag atg tca aag gca ccc att cag 3214
Ile Val Lys Leu Val Glu Glu Ala Gln Met Ser Lys Ala Pro Ile Gln
900 905 910
cag ctg gct gac cgg ttt agt gga tat ttt gtc cca ttt atc atc atc 3262
Gln Leu Ala Asp Arg Phe Ser Gly Tyr Phe Val Pro Phe Ile Ile Ile
915 920 925 930
atg tca act ttg acg ttg gtg gta tgg att gta atc ggt ttt atc gat 3310
Met Ser Thr Leu Thr Leu Val Val Trp Ile Val Ile Gly Phe Ile Asp
935 940 945
ttt ggt gtt gtt cag aga tac ttt cct aac ccc aac aag cac atc tcc 3358
Phe Gly Val Val Gln Arg Tyr Phe Pro Asn Pro Asn Lys His Ile Ser
950 955 960
cag aca gag gtg atc atc cgg ttt gct ttc cag acg tcc atc acg gtg 3406
Gln Thr Glu Val Ile Ile Arg Phe Ala Phe Gln Thr Ser Ile Thr Val
965 970 975
ctg tgc att gcc tgc ccc tgc tcc ctg ggg ctg gcc acg ccc acg gct 3454
Leu Cys Ile Ala Cys Pro Cys Ser Leu Gly Leu Ala Thr Pro Thr Ala
980 985 990
gtc atg gtg ggc acc ggg gtg gcc gcg cag aac ggc atc ctc atc aag 3502
Val Met Val Gly Thr Gly Val Ala Ala Gln Asn Gly Ile Leu Ile Lys
995 1000 1005 1010
gga ggc aag ccc ctg gag atg gcg cac aag ata aag act gtg atg ttt 3550
Gly Gly Lys Pro Leu Glu Met Ala His Lys Ile Lys Thr Val Met Phe
1015 1020 1025
gac aag act ggc acc att acc cat ggc gtc ccc agg gtc atg cgg gtg 3598
Asp Lys Thr Gly Thr Ile Thr His Gly Val Pro Arg Val Met Arg Val
1030 1035 1040
ctc ctg ctg ggg gat gtg gcc aca ctg ccc ctc agg aag gtt ctg gct 3646
Leu Leu Leu Gly Asp Val Ala Thr Leu Pro Leu Arg Lys Val Leu Ala
1045 1050 1055
gtg gtg ggg act gcg gag gcc agc agt gaa cac ccc ttg ggc gtg gca 3694
Val Val Gly Thr Ala Glu Ala Ser Ser Glu His Pro Leu Gly Val Ala
1060 1065 1070
gtc acc aaa tac tgt aaa gag gaa ctt gga aca gag acc ttg gga tac 3742
Val Thr Lys Tyr Cys Lys Glu Glu Leu Gly Thr Glu Thr Leu Gly Tyr
1075 1080 1085 1090
tgc acg gac ttc cag gca gtg cca ggc tgt gga att ggg tgc aaa gtc 3790
Cys Thr Asp Phe Gln Ala Val Pro Gly Cys Gly Ile Gly Cys Lys Val
1095 1100 1105
agc aac gtg gaa ggc atc ctg gcc cac agt gag cgc cct ttg agt gca 3838
Ser Asn Val Glu Gly Ile Leu Ala His Ser Glu Arg Pro Leu Ser Ala
1110 1115 1120
ccg gcc agt cac ctg aat gag gct ggc agc ctt ccc gca gaa aaa gat 3886
Pro Ala Ser His Leu Asn Glu Ala Gly Ser Leu Pro Ala Glu Lys Asp
1125 1130 1135
gca gtc ccc cag acc ttc tct gtg ctg att gga aac cgt gag tgg ctg 3934
Ala Val Pro Gln Thr Phe Ser Val Leu Ile Gly Asn Arg Glu Trp Leu
1140 1145 1150
agg cgc aac ggt tta acc att tct agc gat gtc agt gac gct atg aca 3982
Arg Arg Asn Gly Leu Thr Ile Ser Ser Asp Val Ser Asp Ala Met Thr
1155 1160 1165 1170
gac cac gag atg aaa gga cag aca gcc atc ctg gtg gct att gac ggt 4030
Asp His Glu Met Lys Gly Gln Thr Ala Ile Leu Val Ala Ile Asp Gly
1175 1180 1185
gtg ctc tgt ggg atg atc gca atc gca gac gct gtc aag cag gag gct 4078
Val Leu Cys Gly Met Ile Ala Ile Ala Asp Ala Val Lys Gln Glu Ala
1190 1195 1200
gcc ctg gct gtg cac acg ctg cag agc atg ggt gtg gac gtg gtt ctg 4126
Ala Leu Ala Val His Thr Leu Gln Ser Met Gly Val Asp Val Val Leu
1205 1210 1215
atc acg ggg gac aac cgg aag aca gcc aga gct att gcc acc cag gtt 4174
Ile Thr Gly Asp Asn Arg Lys Thr Ala Arg Ala Ile Ala Thr Gln Val
1220 1225 1230
ggc atc aac aaa gtc ttt gca gag gtg ctg cct tcg cac aag gtg gcc 4222
Gly Ile Asn Lys Val Phe Ala Glu Val Leu Pro Ser His Lys Val Ala
1235 1240 1245 1250
aag gtc cag gag ctc cag aat aaa ggg aag aaa gtc gcc atg gtg ggg 4270
Lys Val Gln Glu Leu Gln Asn Lys Gly Lys Lys Val Ala Met Val Gly
1255 1260 1265
gat ggg gtc aat gac tcc ccg gcc ttg gcc cag gca gac atg ggt gtg 4318
Asp Gly Val Asn Asp Ser Pro Ala Leu Ala Gln Ala Asp Met Gly Val
1270 1275 1280
gcc att ggc acc ggc acg gat gtg gcc atc gag gca gcc gac gtc gtc 4366
Ala Ile Gly Thr Gly Thr Asp Val Ala Ile Glu Ala Ala Asp Val Val
1285 1290 1295
ctt atc aga aat gat ttg ctg gat gtg gtg gct agc att cac ctt tcc 4414
Leu Ile Arg Asn Asp Leu Leu Asp Val Val Ala Ser Ile His Leu Ser
1300 1305 1310
aag agg act gtc cga agg ata cgc atc aac ctg gtc ctg gca ctg att 4462
Lys Arg Thr Val Arg Arg Ile Arg Ile Asn Leu Val Leu Ala Leu Ile
1315 1320 1325 1330
tat aac ctg gtt ggg ata ccc att gca gca ggt gtc ttc atg ccc atc 4510
Tyr Asn Leu Val Gly Ile Pro Ile Ala Ala Gly Val Phe Met Pro Ile
1335 1340 1345
ggc att gtg ctg cag ccc tgg atg ggc tca gcg gcc atg gca gcc tcc 4558
Gly Ile Val Leu Gln Pro Trp Met Gly Ser Ala Ala Met Ala Ala Ser
1350 1355 1360
tct gtg tct gtg gtg ctc tca tcc ctg cag ctc aag tgc tat aag aag 4606
Ser Val Ser Val Val Leu Ser Ser Leu Gln Leu Lys Cys Tyr Lys Lys
1365 1370 1375
cct gac ctg gag agg tat gag gca cag gcg cat ggc cac atg aag ccc 4654
Pro Asp Leu Glu Arg Tyr Glu Ala Gln Ala His Gly His Met Lys Pro
1380 1385 1390
ctg acg gca tcc cag gtc agt gtg cac ata ggc atg gat gac agg tgg 4702
Leu Thr Ala Ser Gln Val Ser Val His Ile Gly Met Asp Asp Arg Trp
1395 1400 1405 1410
cgg gac tcc ccc agg gcc aca cca tgg gac cag gtc agc tat gtc agc 4750
Arg Asp Ser Pro Arg Ala Thr Pro Trp Asp Gln Val Ser Tyr Val Ser
1415 1420 1425
cag gtg tcg ctg tcc tcc ctg acg tcc gac aag cca tct cgg cac agc 4798
Gln Val Ser Leu Ser Ser Leu Thr Ser Asp Lys Pro Ser Arg His Ser
1430 1435 1440
gct gca gca gac gat gat ggg gac aag tgg tct ctg ctc ctg aat ggc 4846
Ala Ala Ala Asp Asp Asp Gly Asp Lys Trp Ser Leu Leu Leu Asn Gly
1445 1450 1455
agg gat gag gag cag tac atc tga ggtaccaata aagacctctt attttcattc 4900
Arg Asp Glu Glu Gln Tyr Ile
1460 1465
atcaggtgtg gttggttttt ttgtgtgggg gcggatccat cggatcccgt gcggaccgag 4960
cggccgcagg aacccctagt gatggagttg gccactccct ctctgcgcgc tcgctcgctc 5020
actgaggccg ggcgaccaaa ggtcgcccga cgcccgggct ttgcccgggc ggcctcagtg 5080
agcgagcgag cgcgcagctg cctgcag 5107
<210> 2
<211> 1465
<212> Белок
<213> Искусственная последовательность
<220>
<223> [CDS]:473..4870 из SEQ ID NO 1
<400> 2
Met Pro Glu Gln Glu Arg Gln Ile Thr Ala Arg Glu Gly Ala Ser Arg
1 5 10 15
Lys Ile Leu Ser Lys Leu Ser Leu Pro Thr Arg Ala Trp Glu Pro Ala
20 25 30
Met Lys Lys Ser Phe Ala Phe Asp Asn Val Gly Tyr Glu Gly Gly Leu
35 40 45
Asp Gly Leu Gly Pro Ser Ser Gln Val Ala Thr Ser Thr Val Arg Ile
50 55 60
Leu Gly Met Thr Cys Gln Ser Cys Val Lys Ser Ile Glu Asp Arg Ile
65 70 75 80
Ser Asn Leu Lys Gly Ile Ile Ser Met Lys Val Ser Leu Glu Gln Gly
85 90 95
Ser Ala Thr Val Lys Tyr Val Pro Ser Val Val Cys Leu Gln Gln Val
100 105 110
Cys His Gln Ile Gly Asp Met Gly Phe Glu Ala Ser Ile Ala Glu Gly
115 120 125
Lys Ala Ala Ser Trp Pro Ser Arg Ser Leu Pro Ala Gln Glu Ala Val
130 135 140
Val Lys Leu Arg Val Glu Gly Met Thr Cys Gln Ser Cys Val Ser Ser
145 150 155 160
Ile Glu Gly Lys Val Arg Lys Leu Gln Gly Val Val Arg Val Lys Val
165 170 175
Ser Leu Ser Asn Gln Glu Ala Val Ile Thr Tyr Gln Pro Tyr Leu Ile
180 185 190
Gln Pro Glu Asp Leu Arg Asp His Val Asn Asp Met Gly Phe Glu Ala
195 200 205
Ala Ile Lys Ser Lys Val Ala Pro Leu Ser Leu Gly Pro Ile Asp Ile
210 215 220
Glu Arg Leu Gln Ser Thr Asn Pro Lys Arg Pro Leu Ser Ser Ala Asn
225 230 235 240
Gln Asn Phe Asn Asn Ser Glu Thr Leu Gly His Gln Gly Ser His Val
245 250 255
Val Thr Leu Gln Leu Arg Ile Asp Gly Met His Cys Lys Ser Cys Val
260 265 270
Leu Asn Ile Glu Glu Asn Ile Gly Gln Leu Leu Gly Val Gln Ser Ile
275 280 285
Gln Val Ser Leu Glu Asn Lys Thr Ala Gln Val Lys Tyr Asp Pro Ser
290 295 300
Cys Thr Ser Pro Val Ala Leu Gln Arg Ala Ile Glu Ala Leu Pro Pro
305 310 315 320
Gly Asn Phe Lys Val Ser Leu Pro Asp Gly Ala Glu Gly Ser Gly Thr
325 330 335
Asp His Arg Ser Ser Ser Ser His Ser Pro Gly Ser Pro Pro Arg Asn
340 345 350
Gln Val Gln Gly Thr Cys Ser Thr Thr Leu Ile Ala Ile Ala Gly Met
355 360 365
Thr Cys Ala Ser Cys Val His Ser Ile Glu Gly Met Ile Ser Gln Leu
370 375 380
Glu Gly Val Gln Gln Ile Ser Val Ser Leu Ala Glu Gly Thr Ala Thr
385 390 395 400
Val Leu Tyr Asn Pro Ser Val Ile Ser Pro Glu Glu Leu Arg Ala Ala
405 410 415
Ile Glu Asp Met Gly Phe Glu Ala Ser Val Val Ser Glu Ser Cys Ser
420 425 430
Thr Asn Pro Leu Gly Asn His Ser Ala Gly Asn Ser Met Val Gln Thr
435 440 445
Thr Asp Gly Thr Pro Thr Ser Val Gln Glu Val Ala Pro His Thr Gly
450 455 460
Arg Leu Pro Ala Asn His Ala Pro Asp Ile Leu Ala Lys Ser Pro Gln
465 470 475 480
Ser Thr Arg Ala Val Ala Pro Gln Lys Cys Phe Leu Gln Ile Lys Gly
485 490 495
Met Thr Cys Ala Ser Cys Val Ser Asn Ile Glu Arg Asn Leu Gln Lys
500 505 510
Glu Ala Gly Val Leu Ser Val Leu Val Ala Leu Met Ala Gly Lys Ala
515 520 525
Glu Ile Lys Tyr Asp Pro Glu Val Ile Gln Pro Leu Glu Ile Ala Gln
530 535 540
Phe Ile Gln Asp Leu Gly Phe Glu Ala Ala Val Met Glu Asp Tyr Ala
545 550 555 560
Gly Ser Asp Gly Asn Ile Glu Leu Thr Ile Thr Gly Met Thr Cys Ala
565 570 575
Ser Cys Val His Asn Ile Glu Ser Lys Leu Thr Arg Thr Asn Gly Ile
580 585 590
Thr Tyr Ala Ser Val Ala Leu Ala Thr Ser Lys Ala Leu Val Lys Phe
595 600 605
Asp Pro Glu Ile Ile Gly Pro Arg Asp Ile Ile Lys Ile Ile Glu Glu
610 615 620
Ile Gly Phe His Ala Ser Leu Ala Gln Arg Asn Pro Asn Ala His His
625 630 635 640
Leu Asp His Lys Met Glu Ile Lys Gln Trp Lys Lys Ser Phe Leu Cys
645 650 655
Ser Leu Val Phe Gly Ile Pro Val Met Ala Leu Met Ile Tyr Met Leu
660 665 670
Ile Pro Ser Asn Glu Pro His Gln Ser Met Val Leu Asp His Asn Ile
675 680 685
Ile Pro Gly Leu Ser Ile Leu Asn Leu Ile Phe Phe Ile Leu Cys Thr
690 695 700
Phe Val Gln Leu Leu Gly Gly Trp Tyr Phe Tyr Val Gln Ala Tyr Lys
705 710 715 720
Ser Leu Arg His Arg Ser Ala Asn Met Asp Val Leu Ile Val Leu Ala
725 730 735
Thr Ser Ile Ala Tyr Val Tyr Ser Leu Val Ile Leu Val Val Ala Val
740 745 750
Ala Glu Lys Ala Glu Arg Ser Pro Val Thr Phe Phe Asp Thr Pro Pro
755 760 765
Met Leu Phe Val Phe Ile Ala Leu Gly Arg Trp Leu Glu His Leu Ala
770 775 780
Lys Ser Lys Thr Ser Glu Ala Leu Ala Lys Leu Met Ser Leu Gln Ala
785 790 795 800
Thr Glu Ala Thr Val Val Thr Leu Gly Glu Asp Asn Leu Ile Ile Arg
805 810 815
Glu Glu Gln Val Pro Met Glu Leu Val Gln Arg Gly Asp Ile Val Lys
820 825 830
Val Val Pro Gly Gly Lys Phe Pro Val Asp Gly Lys Val Leu Glu Gly
835 840 845
Asn Thr Met Ala Asp Glu Ser Leu Ile Thr Gly Glu Ala Met Pro Val
850 855 860
Thr Lys Lys Pro Gly Ser Thr Val Ile Ala Gly Ser Ile Asn Ala His
865 870 875 880
Gly Ser Val Leu Ile Lys Ala Thr His Val Gly Asn Asp Thr Thr Leu
885 890 895
Ala Gln Ile Val Lys Leu Val Glu Glu Ala Gln Met Ser Lys Ala Pro
900 905 910
Ile Gln Gln Leu Ala Asp Arg Phe Ser Gly Tyr Phe Val Pro Phe Ile
915 920 925
Ile Ile Met Ser Thr Leu Thr Leu Val Val Trp Ile Val Ile Gly Phe
930 935 940
Ile Asp Phe Gly Val Val Gln Arg Tyr Phe Pro Asn Pro Asn Lys His
945 950 955 960
Ile Ser Gln Thr Glu Val Ile Ile Arg Phe Ala Phe Gln Thr Ser Ile
965 970 975
Thr Val Leu Cys Ile Ala Cys Pro Cys Ser Leu Gly Leu Ala Thr Pro
980 985 990
Thr Ala Val Met Val Gly Thr Gly Val Ala Ala Gln Asn Gly Ile Leu
995 1000 1005
Ile Lys Gly Gly Lys Pro Leu Glu Met Ala His Lys Ile Lys Thr Val
1010 1015 1020
Met Phe Asp Lys Thr Gly Thr Ile Thr His Gly Val Pro Arg Val Met
1025 1030 1035 1040
Arg Val Leu Leu Leu Gly Asp Val Ala Thr Leu Pro Leu Arg Lys Val
1045 1050 1055
Leu Ala Val Val Gly Thr Ala Glu Ala Ser Ser Glu His Pro Leu Gly
1060 1065 1070
Val Ala Val Thr Lys Tyr Cys Lys Glu Glu Leu Gly Thr Glu Thr Leu
1075 1080 1085
Gly Tyr Cys Thr Asp Phe Gln Ala Val Pro Gly Cys Gly Ile Gly Cys
1090 1095 1100
Lys Val Ser Asn Val Glu Gly Ile Leu Ala His Ser Glu Arg Pro Leu
1105 1110 1115 1120
Ser Ala Pro Ala Ser His Leu Asn Glu Ala Gly Ser Leu Pro Ala Glu
1125 1130 1135
Lys Asp Ala Val Pro Gln Thr Phe Ser Val Leu Ile Gly Asn Arg Glu
1140 1145 1150
Trp Leu Arg Arg Asn Gly Leu Thr Ile Ser Ser Asp Val Ser Asp Ala
1155 1160 1165
Met Thr Asp His Glu Met Lys Gly Gln Thr Ala Ile Leu Val Ala Ile
1170 1175 1180
Asp Gly Val Leu Cys Gly Met Ile Ala Ile Ala Asp Ala Val Lys Gln
1185 1190 1195 1200
Glu Ala Ala Leu Ala Val His Thr Leu Gln Ser Met Gly Val Asp Val
1205 1210 1215
Val Leu Ile Thr Gly Asp Asn Arg Lys Thr Ala Arg Ala Ile Ala Thr
1220 1225 1230
Gln Val Gly Ile Asn Lys Val Phe Ala Glu Val Leu Pro Ser His Lys
1235 1240 1245
Val Ala Lys Val Gln Glu Leu Gln Asn Lys Gly Lys Lys Val Ala Met
1250 1255 1260
Val Gly Asp Gly Val Asn Asp Ser Pro Ala Leu Ala Gln Ala Asp Met
1265 1270 1275 1280
Gly Val Ala Ile Gly Thr Gly Thr Asp Val Ala Ile Glu Ala Ala Asp
1285 1290 1295
Val Val Leu Ile Arg Asn Asp Leu Leu Asp Val Val Ala Ser Ile His
1300 1305 1310
Leu Ser Lys Arg Thr Val Arg Arg Ile Arg Ile Asn Leu Val Leu Ala
1315 1320 1325
Leu Ile Tyr Asn Leu Val Gly Ile Pro Ile Ala Ala Gly Val Phe Met
1330 1335 1340
Pro Ile Gly Ile Val Leu Gln Pro Trp Met Gly Ser Ala Ala Met Ala
1345 1350 1355 1360
Ala Ser Ser Val Ser Val Val Leu Ser Ser Leu Gln Leu Lys Cys Tyr
1365 1370 1375
Lys Lys Pro Asp Leu Glu Arg Tyr Glu Ala Gln Ala His Gly His Met
1380 1385 1390
Lys Pro Leu Thr Ala Ser Gln Val Ser Val His Ile Gly Met Asp Asp
1395 1400 1405
Arg Trp Arg Asp Ser Pro Arg Ala Thr Pro Trp Asp Gln Val Ser Tyr
1410 1415 1420
Val Ser Gln Val Ser Leu Ser Ser Leu Thr Ser Asp Lys Pro Ser Arg
1425 1430 1435 1440
His Ser Ala Ala Ala Asp Asp Asp Gly Asp Lys Trp Ser Leu Leu Leu
1445 1450 1455
Asn Gly Arg Asp Glu Glu Gln Tyr Ile
1460 1465
<210> 3
<211> 5107
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Конструкция нуклеиновой кислоты экспрессирующего вектора AAV2-AAT-coATP7B
<220>
<221> область повторов
<222> 1..141
<223> /примечание="5' ITR из серотипа 2 аденоассоциированного вируса "
<220>
<221> промотор
<222> 156..460
<223> /примечание="альфа 1 антитрипсин"
<220>
<221> CDS
<222> 473..4870
<223> /примечание="последовательность с оптимизированными кодонами, кодирующая ATP7B"
/таблица трансляции=1
<220>
<221> поли A_сигнал
<222> 4877..4932
<220>
<221> область повторов
<222> 4968..5107
<223> /примечание="3' ITR из серотипа 2 аденоассоциированного вируса"
<400> 3
cctgcaggca gctgcgcgct cgctcgctca ctgaggccgc ccgggcaaag cccgggcgtc 60
gggcgacctt tggtcgcccg gcctcagtga gcgagcgagc gcgcagagag ggagtggcca 120
actccatcac taggggttcc tgcggccgca cgcgtcgcca ccccctccac cttggacaca 180
ggacgctgtg gtttctgagc caggtacaat gactcctttc ggtaagtgca gtggaagctg 240
tacactgccc aggcaaagcg tccgggcagc gtaggcgggc gactcagatc ccagccagtg 300
gacttagccc ctgtttgctc ctccgataac tggggtgacc ttggttaata ttcaccagca 360
gcctcccccg ttgcccctct ggatccactg cttaaatacg gacgaggaca gggccctgtc 420
tcctcagctt caggcaccac cactgacctg ggacagtgaa gcggccgcca cc atg cca 478
Met Pro
1
gaa cag gaa cgc cag atc aca gca aga gag gga gca agt cgg aaa atc 526
Glu Gln Glu Arg Gln Ile Thr Ala Arg Glu Gly Ala Ser Arg Lys Ile
5 10 15
ctg agc aaa ctg agc ctg cca acc aga gca tgg gaa ccc gca atg aag 574
Leu Ser Lys Leu Ser Leu Pro Thr Arg Ala Trp Glu Pro Ala Met Lys
20 25 30
aaa agc ttc gcc ttt gac aac gtg gga tac gag gga ggg ctg gat gga 622
Lys Ser Phe Ala Phe Asp Asn Val Gly Tyr Glu Gly Gly Leu Asp Gly
35 40 45 50
ctg gga cct agc tcc cag gtg gcc acc tct aca gtc cga atc ctg ggc 670
Leu Gly Pro Ser Ser Gln Val Ala Thr Ser Thr Val Arg Ile Leu Gly
55 60 65
atg act tgc cag agt tgc gtg aaa tca att gaa gac cgg atc agt aat 718
Met Thr Cys Gln Ser Cys Val Lys Ser Ile Glu Asp Arg Ile Ser Asn
70 75 80
ctg aag gga atc att agc atg aaa gtg tcc ctg gag cag ggc tca gcc 766
Leu Lys Gly Ile Ile Ser Met Lys Val Ser Leu Glu Gln Gly Ser Ala
85 90 95
acc gtg aag tat gtc cct agc gtg gtc tgc ctg cag cag gtg tgc cac 814
Thr Val Lys Tyr Val Pro Ser Val Val Cys Leu Gln Gln Val Cys His
100 105 110
cag atc ggc gat atg ggg ttc gag gcc tcc att gct gaa ggg aaa gcc 862
Gln Ile Gly Asp Met Gly Phe Glu Ala Ser Ile Ala Glu Gly Lys Ala
115 120 125 130
gct tct tgg cct agc cgg tcc ctg cca gca cag gaa gca gtg gtc aag 910
Ala Ser Trp Pro Ser Arg Ser Leu Pro Ala Gln Glu Ala Val Val Lys
135 140 145
ctg aga gtg gag gga atg aca tgc cag agc tgc gtg agc agt atc gaa 958
Leu Arg Val Glu Gly Met Thr Cys Gln Ser Cys Val Ser Ser Ile Glu
150 155 160
gga aag gtc cga aaa ctg cag ggc gtg gtc cgg gtg aag gtc tct ctg 1006
Gly Lys Val Arg Lys Leu Gln Gly Val Val Arg Val Lys Val Ser Leu
165 170 175
agt aac cag gag gcc gtg att acc tac cag ccc tat ctg atc cag cct 1054
Ser Asn Gln Glu Ala Val Ile Thr Tyr Gln Pro Tyr Leu Ile Gln Pro
180 185 190
gaa gac ctg agg gat cac gtg aat gac atg ggc ttc gag gca gcc atc 1102
Glu Asp Leu Arg Asp His Val Asn Asp Met Gly Phe Glu Ala Ala Ile
195 200 205 210
aag tcc aaa gtg gcc cca ctg tct ctg ggg ccc att gat atc gaa aga 1150
Lys Ser Lys Val Ala Pro Leu Ser Leu Gly Pro Ile Asp Ile Glu Arg
215 220 225
ctg cag tcc acc aac cca aag agg ccc ctg tca agc gcc aac cag aac 1198
Leu Gln Ser Thr Asn Pro Lys Arg Pro Leu Ser Ser Ala Asn Gln Asn
230 235 240
ttc aac aat agt gag acc ctg gga cac cag ggc tca cat gtg gtc aca 1246
Phe Asn Asn Ser Glu Thr Leu Gly His Gln Gly Ser His Val Val Thr
245 250 255
ctg cag ctg agg att gac ggc atg cac tgc aag tct tgc gtg ctg aac 1294
Leu Gln Leu Arg Ile Asp Gly Met His Cys Lys Ser Cys Val Leu Asn
260 265 270
att gag gaa aat atc ggc cag ctg ctg ggg gtg cag tct atc cag gtc 1342
Ile Glu Glu Asn Ile Gly Gln Leu Leu Gly Val Gln Ser Ile Gln Val
275 280 285 290
agt ctg gag aac aag act gct cag gtg aaa tac gat cct tca tgc acc 1390
Ser Leu Glu Asn Lys Thr Ala Gln Val Lys Tyr Asp Pro Ser Cys Thr
295 300 305
agc cca gtg gca ctg cag cgc gct atc gaa gca ctg ccc cct gga aat 1438
Ser Pro Val Ala Leu Gln Arg Ala Ile Glu Ala Leu Pro Pro Gly Asn
310 315 320
ttc aag gtg agc ctg cct gac gga gca gag gga tcc gga acc gat cac 1486
Phe Lys Val Ser Leu Pro Asp Gly Ala Glu Gly Ser Gly Thr Asp His
325 330 335
agg tcc tct agt tca cat tcc cca ggg tct cca cca cga aac cag gtg 1534
Arg Ser Ser Ser Ser His Ser Pro Gly Ser Pro Pro Arg Asn Gln Val
340 345 350
cag gga aca tgt tcc acc aca ctg att gca atc gcc ggc atg act tgc 1582
Gln Gly Thr Cys Ser Thr Thr Leu Ile Ala Ile Ala Gly Met Thr Cys
355 360 365 370
gcc tca tgc gtg cac agc att gaa ggg atg atc tct cag ctg gag gga 1630
Ala Ser Cys Val His Ser Ile Glu Gly Met Ile Ser Gln Leu Glu Gly
375 380 385
gtg cag cag atc tca gtc agc ctg gcc gag ggc act gct acc gtg ctg 1678
Val Gln Gln Ile Ser Val Ser Leu Ala Glu Gly Thr Ala Thr Val Leu
390 395 400
tac aat ccc agt gtc atc tca cct gag gaa ctg cgg gct gca att gag 1726
Tyr Asn Pro Ser Val Ile Ser Pro Glu Glu Leu Arg Ala Ala Ile Glu
405 410 415
gac atg ggg ttc gaa gct tcc gtg gtc tcc gaa tct tgc agt acc aac 1774
Asp Met Gly Phe Glu Ala Ser Val Val Ser Glu Ser Cys Ser Thr Asn
420 425 430
ccc ctg ggg aat cat tcc gcc gga aac tct atg gtg cag act acc gac 1822
Pro Leu Gly Asn His Ser Ala Gly Asn Ser Met Val Gln Thr Thr Asp
435 440 445 450
ggg aca cct act tct gtg cag gag gtc gca cca cac aca gga cgc ctg 1870
Gly Thr Pro Thr Ser Val Gln Glu Val Ala Pro His Thr Gly Arg Leu
455 460 465
cca gcc aat cat gct ccc gat atc ctg gcc aaa agc ccc cag tcc act 1918
Pro Ala Asn His Ala Pro Asp Ile Leu Ala Lys Ser Pro Gln Ser Thr
470 475 480
cga gct gtg gca cct cag aag tgt ttt ctg cag atc aaa ggc atg acc 1966
Arg Ala Val Ala Pro Gln Lys Cys Phe Leu Gln Ile Lys Gly Met Thr
485 490 495
tgc gcc tct tgc gtg agc aac att gag cgg aat ctg cag aag gaa gct 2014
Cys Ala Ser Cys Val Ser Asn Ile Glu Arg Asn Leu Gln Lys Glu Ala
500 505 510
ggg gtg ctg agc gtg ctg gtc gca ctg atg gcc gga aag gct gag atc 2062
Gly Val Leu Ser Val Leu Val Ala Leu Met Ala Gly Lys Ala Glu Ile
515 520 525 530
aag tac gac cct gaa gtg atc cag cca ctg gag att gcc cag ttc atc 2110
Lys Tyr Asp Pro Glu Val Ile Gln Pro Leu Glu Ile Ala Gln Phe Ile
535 540 545
cag gat ctg ggc ttt gag gcc gct gtg atg gaa gac tat gct ggg agc 2158
Gln Asp Leu Gly Phe Glu Ala Ala Val Met Glu Asp Tyr Ala Gly Ser
550 555 560
gat gga aac att gaa ctg acc atc acc gga atg act tgt gcc tct tgc 2206
Asp Gly Asn Ile Glu Leu Thr Ile Thr Gly Met Thr Cys Ala Ser Cys
565 570 575
gtg cac aac atc gag agt aaa ctg act aga acc aat ggg att acc tac 2254
Val His Asn Ile Glu Ser Lys Leu Thr Arg Thr Asn Gly Ile Thr Tyr
580 585 590
gcc agt gtg gcc ctg gct aca tca aag gct ctg gtg aaa ttc gac ccc 2302
Ala Ser Val Ala Leu Ala Thr Ser Lys Ala Leu Val Lys Phe Asp Pro
595 600 605 610
gag atc att gga cct agg gat atc att aag atc att gag gaa atc ggc 2350
Glu Ile Ile Gly Pro Arg Asp Ile Ile Lys Ile Ile Glu Glu Ile Gly
615 620 625
ttt cac gca agc ctg gcc cag cgc aac cca aat gcc cac cat ctg gac 2398
Phe His Ala Ser Leu Ala Gln Arg Asn Pro Asn Ala His His Leu Asp
630 635 640
cat aag atg gag atc aag cag tgg aag aaa agt ttc ctg tgc tca ctg 2446
His Lys Met Glu Ile Lys Gln Trp Lys Lys Ser Phe Leu Cys Ser Leu
645 650 655
gtg ttt gga atc ccc gtc atg gcc ctg atg atc tac atg ctg atc cct 2494
Val Phe Gly Ile Pro Val Met Ala Leu Met Ile Tyr Met Leu Ile Pro
660 665 670
agc aac gag cca cac cag tcc atg gtg ctg gat cat aac atc att cct 2542
Ser Asn Glu Pro His Gln Ser Met Val Leu Asp His Asn Ile Ile Pro
675 680 685 690
ggc ctg tcc atc ctg aat ctg att ttc ttt atc ctg tgc aca ttc gtg 2590
Gly Leu Ser Ile Leu Asn Leu Ile Phe Phe Ile Leu Cys Thr Phe Val
695 700 705
cag ctg ctg gga ggc tgg tac ttt tat gtg cag gca tat aaa tca ctg 2638
Gln Leu Leu Gly Gly Trp Tyr Phe Tyr Val Gln Ala Tyr Lys Ser Leu
710 715 720
cga cac cgg agc gcc aat atg gac gtg ctg att gtc ctg gca acc tct 2686
Arg His Arg Ser Ala Asn Met Asp Val Leu Ile Val Leu Ala Thr Ser
725 730 735
atc gcc tac gtg tat agt ctg gtc atc ctg gtg gtc gca gtg gca gag 2734
Ile Ala Tyr Val Tyr Ser Leu Val Ile Leu Val Val Ala Val Ala Glu
740 745 750
aag gca gaa cgg agc cca gtg act ttc ttt gat acc cct cca atg ctg 2782
Lys Ala Glu Arg Ser Pro Val Thr Phe Phe Asp Thr Pro Pro Met Leu
755 760 765 770
ttc gtg ttt atc gct ctg ggc aga tgg ctg gaa cat ctg gca aag tca 2830
Phe Val Phe Ile Ala Leu Gly Arg Trp Leu Glu His Leu Ala Lys Ser
775 780 785
aaa acc agc gag gct ctg gca aag ctg atg agc ctg cag gct acc gaa 2878
Lys Thr Ser Glu Ala Leu Ala Lys Leu Met Ser Leu Gln Ala Thr Glu
790 795 800
gca aca gtg gtc act ctg gga gag gac aac ctg atc att cgc gag gaa 2926
Ala Thr Val Val Thr Leu Gly Glu Asp Asn Leu Ile Ile Arg Glu Glu
805 810 815
cag gtg cct atg gaa ctg gtc cag cga ggc gat atc gtg aag gtg gtc 2974
Gln Val Pro Met Glu Leu Val Gln Arg Gly Asp Ile Val Lys Val Val
820 825 830
cca ggg gga aaa ttc ccc gtg gac ggc aag gtc ctg gag ggg aat act 3022
Pro Gly Gly Lys Phe Pro Val Asp Gly Lys Val Leu Glu Gly Asn Thr
835 840 845 850
atg gcc gat gaa tcc ctg atc acc ggc gag gct atg cct gtg aca aag 3070
Met Ala Asp Glu Ser Leu Ile Thr Gly Glu Ala Met Pro Val Thr Lys
855 860 865
aaa cca gga tca act gtc att gct ggc agc atc aac gca cac ggg tcc 3118
Lys Pro Gly Ser Thr Val Ile Ala Gly Ser Ile Asn Ala His Gly Ser
870 875 880
gtg ctg atc aag gcc aca cat gtc ggg aat gac aca act ctg gct cag 3166
Val Leu Ile Lys Ala Thr His Val Gly Asn Asp Thr Thr Leu Ala Gln
885 890 895
att gtg aaa ctg gtc gag gaa gcc cag atg tcc aag gct cct atc cag 3214
Ile Val Lys Leu Val Glu Glu Ala Gln Met Ser Lys Ala Pro Ile Gln
900 905 910
cag ctg gcc gat cgg ttc tcc ggc tac ttc gtg ccc ttc atc att atc 3262
Gln Leu Ala Asp Arg Phe Ser Gly Tyr Phe Val Pro Phe Ile Ile Ile
915 920 925 930
atg tct aca ctg act ctg gtg gtc tgg att gtg atc gga ttc att gac 3310
Met Ser Thr Leu Thr Leu Val Val Trp Ile Val Ile Gly Phe Ile Asp
935 940 945
ttt ggc gtg gtc cag aga tat ttt ccc aac cct aat aag cac atc agc 3358
Phe Gly Val Val Gln Arg Tyr Phe Pro Asn Pro Asn Lys His Ile Ser
950 955 960
cag acc gaa gtg atc atc agg ttc gca ttt cag acc agt att aca gtg 3406
Gln Thr Glu Val Ile Ile Arg Phe Ala Phe Gln Thr Ser Ile Thr Val
965 970 975
ctg tgc atc gcc tgc cca tgt tca ctg ggg ctg gct acc ccc aca gca 3454
Leu Cys Ile Ala Cys Pro Cys Ser Leu Gly Leu Ala Thr Pro Thr Ala
980 985 990
gtg atg gtc gga aca gga gtg gca gca cag aac gga att ctg atc aag 3502
Val Met Val Gly Thr Gly Val Ala Ala Gln Asn Gly Ile Leu Ile Lys
995 1000 1005 1010
ggc ggg aaa ccc ctg gag atg gcc cac aag atc aaa act gtg atg ttt 3550
Gly Gly Lys Pro Leu Glu Met Ala His Lys Ile Lys Thr Val Met Phe
1015 1020 1025
gac aaa act ggg acc att aca cat gga gtg ccc cgc gtc atg cga gtg 3598
Asp Lys Thr Gly Thr Ile Thr His Gly Val Pro Arg Val Met Arg Val
1030 1035 1040
ctg ctg ctg ggc gat gtg gca acc ctg cct ctg aga aag gtc ctg gca 3646
Leu Leu Leu Gly Asp Val Ala Thr Leu Pro Leu Arg Lys Val Leu Ala
1045 1050 1055
gtg gtc gga aca gca gag gct agc tcc gaa cac cca ctg ggg gtg gcc 3694
Val Val Gly Thr Ala Glu Ala Ser Ser Glu His Pro Leu Gly Val Ala
1060 1065 1070
gtc aca aag tac tgc aaa gag gaa ctg ggc act gag acc ctg ggg tat 3742
Val Thr Lys Tyr Cys Lys Glu Glu Leu Gly Thr Glu Thr Leu Gly Tyr
1075 1080 1085 1090
tgt act gac ttc cag gca gtg ccc gga tgc gga atc gga tgt aaa gtc 3790
Cys Thr Asp Phe Gln Ala Val Pro Gly Cys Gly Ile Gly Cys Lys Val
1095 1100 1105
tct aac gtg gaa ggg att ctg gct cac agt gag cgg ccc ctg agc gca 3838
Ser Asn Val Glu Gly Ile Leu Ala His Ser Glu Arg Pro Leu Ser Ala
1110 1115 1120
cct gca tcc cat ctg aat gaa gca gga agc ctg cca gca gag aag gac 3886
Pro Ala Ser His Leu Asn Glu Ala Gly Ser Leu Pro Ala Glu Lys Asp
1125 1130 1135
gct gtg cct cag acc ttt tcc gtc ctg atc ggc aac aga gaa tgg ctg 3934
Ala Val Pro Gln Thr Phe Ser Val Leu Ile Gly Asn Arg Glu Trp Leu
1140 1145 1150
cgg aga aat ggg ctg aca att tct agt gac gtg tcc gat gcc atg aca 3982
Arg Arg Asn Gly Leu Thr Ile Ser Ser Asp Val Ser Asp Ala Met Thr
1155 1160 1165 1170
gat cac gag atg aaa ggc cag act gca att ctg gtg gcc atc gac gga 4030
Asp His Glu Met Lys Gly Gln Thr Ala Ile Leu Val Ala Ile Asp Gly
1175 1180 1185
gtc ctg tgc ggc atg att gct atc gca gat gcc gtg aag cag gag gct 4078
Val Leu Cys Gly Met Ile Ala Ile Ala Asp Ala Val Lys Gln Glu Ala
1190 1195 1200
gca ctg gcc gtc cat acc ctg cag tct atg ggc gtg gac gtg gtc ctg 4126
Ala Leu Ala Val His Thr Leu Gln Ser Met Gly Val Asp Val Val Leu
1205 1210 1215
atc acc ggg gat aac cgg aaa aca gct aga gca att gcc act caa gtg 4174
Ile Thr Gly Asp Asn Arg Lys Thr Ala Arg Ala Ile Ala Thr Gln Val
1220 1225 1230
ggc atc aat aag gtg ttc gct gaa gtc ctg cct agc cac aag gtc gca 4222
Gly Ile Asn Lys Val Phe Ala Glu Val Leu Pro Ser His Lys Val Ala
1235 1240 1245 1250
aaa gtg cag gag ctg cag aac aag ggc aag aaa gtc gcc atg gtg gga 4270
Lys Val Gln Glu Leu Gln Asn Lys Gly Lys Lys Val Ala Met Val Gly
1255 1260 1265
gac ggc gtg aat gat agc cca gct ctg gca cag gca gac atg gga gtc 4318
Asp Gly Val Asn Asp Ser Pro Ala Leu Ala Gln Ala Asp Met Gly Val
1270 1275 1280
gct att ggg aca gga act gac gtg gca atc gag gcc gct gat gtg gtc 4366
Ala Ile Gly Thr Gly Thr Asp Val Ala Ile Glu Ala Ala Asp Val Val
1285 1290 1295
ctg att agg aat gac ctg ctg gat gtg gtc gct tct att cat ctg agt 4414
Leu Ile Arg Asn Asp Leu Leu Asp Val Val Ala Ser Ile His Leu Ser
1300 1305 1310
aag agg aca gtg agg cgc att cgc atc aac ctg gtg ctg gcc ctg atc 4462
Lys Arg Thr Val Arg Arg Ile Arg Ile Asn Leu Val Leu Ala Leu Ile
1315 1320 1325 1330
tac aat ctg gtg gga att cca atc gca gcc ggc gtg ttt atg cca att 4510
Tyr Asn Leu Val Gly Ile Pro Ile Ala Ala Gly Val Phe Met Pro Ile
1335 1340 1345
ggg atc gtc ctg cag ccc tgg atg ggc tca gct gca atg gcc gct tca 4558
Gly Ile Val Leu Gln Pro Trp Met Gly Ser Ala Ala Met Ala Ala Ser
1350 1355 1360
agc gtg agc gtg gtc ctg tcc tct ctg cag ctg aaa tgc tac aag aaa 4606
Ser Val Ser Val Val Leu Ser Ser Leu Gln Leu Lys Cys Tyr Lys Lys
1365 1370 1375
cca gac ctg gag cgg tac gaa gct cag gca cac gga cat atg aag ccc 4654
Pro Asp Leu Glu Arg Tyr Glu Ala Gln Ala His Gly His Met Lys Pro
1380 1385 1390
ctg acc gct tcc cag gtg tct gtc cac atc ggc atg gac gat aga tgg 4702
Leu Thr Ala Ser Gln Val Ser Val His Ile Gly Met Asp Asp Arg Trp
1395 1400 1405 1410
agg gac agc cca agg gcc act cca tgg gat cag gtc agt tac gtg agc 4750
Arg Asp Ser Pro Arg Ala Thr Pro Trp Asp Gln Val Ser Tyr Val Ser
1415 1420 1425
cag gtc agc ctg agt tca ctg acc agc gac aag ccc tcc cgc cat tct 4798
Gln Val Ser Leu Ser Ser Leu Thr Ser Asp Lys Pro Ser Arg His Ser
1430 1435 1440
gca gcc gct gat gac gac ggg gac aag tgg agc ctg ctg ctg aac gga 4846
Ala Ala Ala Asp Asp Asp Gly Asp Lys Trp Ser Leu Leu Leu Asn Gly
1445 1450 1455
agg gac gaa gaa cag tat atc taa ggtaccaata aagacctctt attttcattc 4900
Arg Asp Glu Glu Gln Tyr Ile
1460 1465
atcaggtgtg gttggttttt ttgtgtgggg gcggatccat cggatcccgt gcggaccgag 4960
cggccgcagg aacccctagt gatggagttg gccactccct ctctgcgcgc tcgctcgctc 5020
actgaggccg ggcgaccaaa ggtcgcccga cgcccgggct ttgcccgggc ggcctcagtg 5080
agcgagcgag cgcgcagctg cctgcag 5107
<210> 4
<211> 1465
<212> Белок
<213> Искусственная последовательность
<220>
<223> [CDS]:473..4870 из SEQ ID NO 3
<400> 4
Met Pro Glu Gln Glu Arg Gln Ile Thr Ala Arg Glu Gly Ala Ser Arg
1 5 10 15
Lys Ile Leu Ser Lys Leu Ser Leu Pro Thr Arg Ala Trp Glu Pro Ala
20 25 30
Met Lys Lys Ser Phe Ala Phe Asp Asn Val Gly Tyr Glu Gly Gly Leu
35 40 45
Asp Gly Leu Gly Pro Ser Ser Gln Val Ala Thr Ser Thr Val Arg Ile
50 55 60
Leu Gly Met Thr Cys Gln Ser Cys Val Lys Ser Ile Glu Asp Arg Ile
65 70 75 80
Ser Asn Leu Lys Gly Ile Ile Ser Met Lys Val Ser Leu Glu Gln Gly
85 90 95
Ser Ala Thr Val Lys Tyr Val Pro Ser Val Val Cys Leu Gln Gln Val
100 105 110
Cys His Gln Ile Gly Asp Met Gly Phe Glu Ala Ser Ile Ala Glu Gly
115 120 125
Lys Ala Ala Ser Trp Pro Ser Arg Ser Leu Pro Ala Gln Glu Ala Val
130 135 140
Val Lys Leu Arg Val Glu Gly Met Thr Cys Gln Ser Cys Val Ser Ser
145 150 155 160
Ile Glu Gly Lys Val Arg Lys Leu Gln Gly Val Val Arg Val Lys Val
165 170 175
Ser Leu Ser Asn Gln Glu Ala Val Ile Thr Tyr Gln Pro Tyr Leu Ile
180 185 190
Gln Pro Glu Asp Leu Arg Asp His Val Asn Asp Met Gly Phe Glu Ala
195 200 205
Ala Ile Lys Ser Lys Val Ala Pro Leu Ser Leu Gly Pro Ile Asp Ile
210 215 220
Glu Arg Leu Gln Ser Thr Asn Pro Lys Arg Pro Leu Ser Ser Ala Asn
225 230 235 240
Gln Asn Phe Asn Asn Ser Glu Thr Leu Gly His Gln Gly Ser His Val
245 250 255
Val Thr Leu Gln Leu Arg Ile Asp Gly Met His Cys Lys Ser Cys Val
260 265 270
Leu Asn Ile Glu Glu Asn Ile Gly Gln Leu Leu Gly Val Gln Ser Ile
275 280 285
Gln Val Ser Leu Glu Asn Lys Thr Ala Gln Val Lys Tyr Asp Pro Ser
290 295 300
Cys Thr Ser Pro Val Ala Leu Gln Arg Ala Ile Glu Ala Leu Pro Pro
305 310 315 320
Gly Asn Phe Lys Val Ser Leu Pro Asp Gly Ala Glu Gly Ser Gly Thr
325 330 335
Asp His Arg Ser Ser Ser Ser His Ser Pro Gly Ser Pro Pro Arg Asn
340 345 350
Gln Val Gln Gly Thr Cys Ser Thr Thr Leu Ile Ala Ile Ala Gly Met
355 360 365
Thr Cys Ala Ser Cys Val His Ser Ile Glu Gly Met Ile Ser Gln Leu
370 375 380
Glu Gly Val Gln Gln Ile Ser Val Ser Leu Ala Glu Gly Thr Ala Thr
385 390 395 400
Val Leu Tyr Asn Pro Ser Val Ile Ser Pro Glu Glu Leu Arg Ala Ala
405 410 415
Ile Glu Asp Met Gly Phe Glu Ala Ser Val Val Ser Glu Ser Cys Ser
420 425 430
Thr Asn Pro Leu Gly Asn His Ser Ala Gly Asn Ser Met Val Gln Thr
435 440 445
Thr Asp Gly Thr Pro Thr Ser Val Gln Glu Val Ala Pro His Thr Gly
450 455 460
Arg Leu Pro Ala Asn His Ala Pro Asp Ile Leu Ala Lys Ser Pro Gln
465 470 475 480
Ser Thr Arg Ala Val Ala Pro Gln Lys Cys Phe Leu Gln Ile Lys Gly
485 490 495
Met Thr Cys Ala Ser Cys Val Ser Asn Ile Glu Arg Asn Leu Gln Lys
500 505 510
Glu Ala Gly Val Leu Ser Val Leu Val Ala Leu Met Ala Gly Lys Ala
515 520 525
Glu Ile Lys Tyr Asp Pro Glu Val Ile Gln Pro Leu Glu Ile Ala Gln
530 535 540
Phe Ile Gln Asp Leu Gly Phe Glu Ala Ala Val Met Glu Asp Tyr Ala
545 550 555 560
Gly Ser Asp Gly Asn Ile Glu Leu Thr Ile Thr Gly Met Thr Cys Ala
565 570 575
Ser Cys Val His Asn Ile Glu Ser Lys Leu Thr Arg Thr Asn Gly Ile
580 585 590
Thr Tyr Ala Ser Val Ala Leu Ala Thr Ser Lys Ala Leu Val Lys Phe
595 600 605
Asp Pro Glu Ile Ile Gly Pro Arg Asp Ile Ile Lys Ile Ile Glu Glu
610 615 620
Ile Gly Phe His Ala Ser Leu Ala Gln Arg Asn Pro Asn Ala His His
625 630 635 640
Leu Asp His Lys Met Glu Ile Lys Gln Trp Lys Lys Ser Phe Leu Cys
645 650 655
Ser Leu Val Phe Gly Ile Pro Val Met Ala Leu Met Ile Tyr Met Leu
660 665 670
Ile Pro Ser Asn Glu Pro His Gln Ser Met Val Leu Asp His Asn Ile
675 680 685
Ile Pro Gly Leu Ser Ile Leu Asn Leu Ile Phe Phe Ile Leu Cys Thr
690 695 700
Phe Val Gln Leu Leu Gly Gly Trp Tyr Phe Tyr Val Gln Ala Tyr Lys
705 710 715 720
Ser Leu Arg His Arg Ser Ala Asn Met Asp Val Leu Ile Val Leu Ala
725 730 735
Thr Ser Ile Ala Tyr Val Tyr Ser Leu Val Ile Leu Val Val Ala Val
740 745 750
Ala Glu Lys Ala Glu Arg Ser Pro Val Thr Phe Phe Asp Thr Pro Pro
755 760 765
Met Leu Phe Val Phe Ile Ala Leu Gly Arg Trp Leu Glu His Leu Ala
770 775 780
Lys Ser Lys Thr Ser Glu Ala Leu Ala Lys Leu Met Ser Leu Gln Ala
785 790 795 800
Thr Glu Ala Thr Val Val Thr Leu Gly Glu Asp Asn Leu Ile Ile Arg
805 810 815
Glu Glu Gln Val Pro Met Glu Leu Val Gln Arg Gly Asp Ile Val Lys
820 825 830
Val Val Pro Gly Gly Lys Phe Pro Val Asp Gly Lys Val Leu Glu Gly
835 840 845
Asn Thr Met Ala Asp Glu Ser Leu Ile Thr Gly Glu Ala Met Pro Val
850 855 860
Thr Lys Lys Pro Gly Ser Thr Val Ile Ala Gly Ser Ile Asn Ala His
865 870 875 880
Gly Ser Val Leu Ile Lys Ala Thr His Val Gly Asn Asp Thr Thr Leu
885 890 895
Ala Gln Ile Val Lys Leu Val Glu Glu Ala Gln Met Ser Lys Ala Pro
900 905 910
Ile Gln Gln Leu Ala Asp Arg Phe Ser Gly Tyr Phe Val Pro Phe Ile
915 920 925
Ile Ile Met Ser Thr Leu Thr Leu Val Val Trp Ile Val Ile Gly Phe
930 935 940
Ile Asp Phe Gly Val Val Gln Arg Tyr Phe Pro Asn Pro Asn Lys His
945 950 955 960
Ile Ser Gln Thr Glu Val Ile Ile Arg Phe Ala Phe Gln Thr Ser Ile
965 970 975
Thr Val Leu Cys Ile Ala Cys Pro Cys Ser Leu Gly Leu Ala Thr Pro
980 985 990
Thr Ala Val Met Val Gly Thr Gly Val Ala Ala Gln Asn Gly Ile Leu
995 1000 1005
Ile Lys Gly Gly Lys Pro Leu Glu Met Ala His Lys Ile Lys Thr Val
1010 1015 1020
Met Phe Asp Lys Thr Gly Thr Ile Thr His Gly Val Pro Arg Val Met
1025 1030 1035 1040
Arg Val Leu Leu Leu Gly Asp Val Ala Thr Leu Pro Leu Arg Lys Val
1045 1050 1055
Leu Ala Val Val Gly Thr Ala Glu Ala Ser Ser Glu His Pro Leu Gly
1060 1065 1070
Val Ala Val Thr Lys Tyr Cys Lys Glu Glu Leu Gly Thr Glu Thr Leu
1075 1080 1085
Gly Tyr Cys Thr Asp Phe Gln Ala Val Pro Gly Cys Gly Ile Gly Cys
1090 1095 1100
Lys Val Ser Asn Val Glu Gly Ile Leu Ala His Ser Glu Arg Pro Leu
1105 1110 1115 1120
Ser Ala Pro Ala Ser His Leu Asn Glu Ala Gly Ser Leu Pro Ala Glu
1125 1130 1135
Lys Asp Ala Val Pro Gln Thr Phe Ser Val Leu Ile Gly Asn Arg Glu
1140 1145 1150
Trp Leu Arg Arg Asn Gly Leu Thr Ile Ser Ser Asp Val Ser Asp Ala
1155 1160 1165
Met Thr Asp His Glu Met Lys Gly Gln Thr Ala Ile Leu Val Ala Ile
1170 1175 1180
Asp Gly Val Leu Cys Gly Met Ile Ala Ile Ala Asp Ala Val Lys Gln
1185 1190 1195 1200
Glu Ala Ala Leu Ala Val His Thr Leu Gln Ser Met Gly Val Asp Val
1205 1210 1215
Val Leu Ile Thr Gly Asp Asn Arg Lys Thr Ala Arg Ala Ile Ala Thr
1220 1225 1230
Gln Val Gly Ile Asn Lys Val Phe Ala Glu Val Leu Pro Ser His Lys
1235 1240 1245
Val Ala Lys Val Gln Glu Leu Gln Asn Lys Gly Lys Lys Val Ala Met
1250 1255 1260
Val Gly Asp Gly Val Asn Asp Ser Pro Ala Leu Ala Gln Ala Asp Met
1265 1270 1275 1280
Gly Val Ala Ile Gly Thr Gly Thr Asp Val Ala Ile Glu Ala Ala Asp
1285 1290 1295
Val Val Leu Ile Arg Asn Asp Leu Leu Asp Val Val Ala Ser Ile His
1300 1305 1310
Leu Ser Lys Arg Thr Val Arg Arg Ile Arg Ile Asn Leu Val Leu Ala
1315 1320 1325
Leu Ile Tyr Asn Leu Val Gly Ile Pro Ile Ala Ala Gly Val Phe Met
1330 1335 1340
Pro Ile Gly Ile Val Leu Gln Pro Trp Met Gly Ser Ala Ala Met Ala
1345 1350 1355 1360
Ala Ser Ser Val Ser Val Val Leu Ser Ser Leu Gln Leu Lys Cys Tyr
1365 1370 1375
Lys Lys Pro Asp Leu Glu Arg Tyr Glu Ala Gln Ala His Gly His Met
1380 1385 1390
Lys Pro Leu Thr Ala Ser Gln Val Ser Val His Ile Gly Met Asp Asp
1395 1400 1405
Arg Trp Arg Asp Ser Pro Arg Ala Thr Pro Trp Asp Gln Val Ser Tyr
1410 1415 1420
Val Ser Gln Val Ser Leu Ser Ser Leu Thr Ser Asp Lys Pro Ser Arg
1425 1430 1435 1440
His Ser Ala Ala Ala Asp Asp Asp Gly Asp Lys Trp Ser Leu Leu Leu
1445 1450 1455
Asn Gly Arg Asp Glu Glu Gln Tyr Ile
1460 1465
<210> 5
<211> 695
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Гибридный промотор EalbPa1AT
<220>
<221> энхансер
<222> 1..382
<223> /примечание="энхансер гена альбумина"
<220>
<221> промотор
<222> 391..695
<223> /примечание="промотор альфа 1 антитрипсина"
<400> 5
ctcgaggttc ctagattaca ttacacattc tgcaagcata gcacagagca atgttctact 60
ttaattactt tcattttctt gtatcctcac agcctagaaa ataacctgcg ttacagcatc 120
cactcagtat cccttgagca tgaggtgaca ctacttaaca tagggacgag atggtacttt 180
gtgtctcctg ctctgtcagc agggcacagt acttgctgat accagggaat gtttgttctt 240
aaataccatc attccggacg tgtttgcctt ggccagtttt ccatgtacat gcagaaagaa 300
gtttggactg atcaatacag tcctctgcct ttaaagcaat aggaaaaggc caacttgtct 360
acgtttagta tgtggctgta gatctgtacc cgccaccccc tccaccttgg acacaggacg 420
ctgtggtttc tgagccaggt acaatgactc ctttcggtaa gtgcagtgga agctgtacac 480
tgcccaggca aagcgtccgg gcagcgtagg cgggcgactc agatcccagc cagtggactt 540
agcccctgtt tgctcctccg ataactgggg tgaccttggt taatattcac cagcagcctc 600
ccccgttgcc cctctggatc cactgcttaa atacggacga ggacagggcc ctgtctcctc 660
agcttcaggc accaccactg acctgggaca gtgaa 695
<210> 6
<211> 3817
<212> ДНК
<213> Искусственная последовательность
<220>
<223> конструкция нуклеиновой кислоты экспрессирующего вектора AAV2-AAT-ATP7B(d57-486)
<220>
<221> область повторов
<222> 1..141
<223> /примечание="5' ITR из серотипа 2 аденоассоциированного вируса"
<220>
<221> промотор
<222> 156..460
<223> /примечание="альфа 1 антитрипсин"
<220>
<221> CDS
<222> 473..3580
<223> /примечание="Укороченный ATP7B (медь-транспортирующая АТФаза 2)"
/примечание="последовательность, кодирующая укороченный ATP7B (медь-транспортирующую АТФазу 2), с делецией аминокислот 57..486"
/таблица трансляции=1
<220>
<221> полиA_сигнал
<222> 3587..3642
<220>
<221область повторов
<222> 3678..3817
<223> /примечание="3' ITR из серотипа 2 аденоассоциированного вируса "
<400> 6
cctgcaggca gctgcgcgct cgctcgctca ctgaggccgc ccgggcaaag cccgggcgtc 60
gggcgacctt tggtcgcccg gcctcagtga gcgagcgagc gcgcagagag ggagtggcca 120
actccatcac taggggttcc tgcggccgca cgcgtcgcca ccccctccac cttggacaca 180
ggacgctgtg gtttctgagc caggtacaat gactcctttc ggtaagtgca gtggaagctg 240
tacactgccc aggcaaagcg tccgggcagc gtaggcgggc gactcagatc ccagccagtg 300
gacttagccc ctgtttgctc ctccgataac tggggtgacc ttggttaata ttcaccagca 360
gcctcccccg ttgcccctct ggatccactg cttaaatacg gacgaggaca gggccctgtc 420
tcctcagctt caggcaccac cactgacctg ggacagtgaa gcggccgcca cc atg cct 478
Met Pro
1
gag cag gag aga cag atc aca gcc aga gaa ggg gcc agt cgg aaa atc 526
Glu Gln Glu Arg Gln Ile Thr Ala Arg Glu Gly Ala Ser Arg Lys Ile
5 10 15
tta tct aag ctt tct ttg cct acc cgt gcc tgg gaa cca gca atg aag 574
Leu Ser Lys Leu Ser Leu Pro Thr Arg Ala Trp Glu Pro Ala Met Lys
20 25 30
aag agt ttt gct ttt gac aat gtt ggc tat gaa ggt ggt ctg gat ggc 622
Lys Ser Phe Ala Phe Asp Asn Val Gly Tyr Glu Gly Gly Leu Asp Gly
35 40 45 50
ctg ggc cct tct tct cag ccg cag aag tgc ttc tta cag atc aaa ggc 670
Leu Gly Pro Ser Ser Gln Pro Gln Lys Cys Phe Leu Gln Ile Lys Gly
55 60 65
atg acc tgt gca tcc tgt gtg tct aac ata gaa agg aat ctg cag aaa 718
Met Thr Cys Ala Ser Cys Val Ser Asn Ile Glu Arg Asn Leu Gln Lys
70 75 80
gaa gct ggt gtt ctc tcc gtg ttg gtt gcc ttg atg gca gga aag gca 766
Glu Ala Gly Val Leu Ser Val Leu Val Ala Leu Met Ala Gly Lys Ala
85 90 95
gag atc aag tat gac cca gag gtc atc cag ccc ctc gag ata gct cag 814
Glu Ile Lys Tyr Asp Pro Glu Val Ile Gln Pro Leu Glu Ile Ala Gln
100 105 110
ttc atc cag gac ctg ggt ttt gag gca gca gtc atg gag gac tac gca 862
Phe Ile Gln Asp Leu Gly Phe Glu Ala Ala Val Met Glu Asp Tyr Ala
115 120 125 130
ggc tcc gat ggc aac att gag ctg aca atc aca ggg atg acc tgc gcg 910
Gly Ser Asp Gly Asn Ile Glu Leu Thr Ile Thr Gly Met Thr Cys Ala
135 140 145
tcc tgt gtc cac aac ata gag tcc aaa ctc acg agg aca aat ggc atc 958
Ser Cys Val His Asn Ile Glu Ser Lys Leu Thr Arg Thr Asn Gly Ile
150 155 160
act tat gcc tcc gtt gcc ctt gcc acc agc aaa gcc ctt gtt aag ttt 1006
Thr Tyr Ala Ser Val Ala Leu Ala Thr Ser Lys Ala Leu Val Lys Phe
165 170 175
gac ccg gaa att atc ggt cca cgg gat att atc aaa att att gag gaa 1054
Asp Pro Glu Ile Ile Gly Pro Arg Asp Ile Ile Lys Ile Ile Glu Glu
180 185 190
att ggc ttt cat gct tcc ctg gcc cag aga aac ccc aac gct cat cac 1102
Ile Gly Phe His Ala Ser Leu Ala Gln Arg Asn Pro Asn Ala His His
195 200 205 210
ttg gac cac aag atg gaa ata aag cag tgg aag aag tct ttc ctg tgc 1150
Leu Asp His Lys Met Glu Ile Lys Gln Trp Lys Lys Ser Phe Leu Cys
215 220 225
agc ctg gtg ttt ggc atc cct gtc atg gcc tta atg atc tat atg ctg 1198
Ser Leu Val Phe Gly Ile Pro Val Met Ala Leu Met Ile Tyr Met Leu
230 235 240
ata ccc agc aac gag ccc cac cag tcc atg gtc ctg gac cac aac atc 1246
Ile Pro Ser Asn Glu Pro His Gln Ser Met Val Leu Asp His Asn Ile
245 250 255
att cca gga ctg tcc att cta aat ctc atc ttc ttt atc ttg tgt acc 1294
Ile Pro Gly Leu Ser Ile Leu Asn Leu Ile Phe Phe Ile Leu Cys Thr
260 265 270
ttt gtc cag ctc ctc ggt ggg tgg tac ttc tac gtt cag gcc tac aaa 1342
Phe Val Gln Leu Leu Gly Gly Trp Tyr Phe Tyr Val Gln Ala Tyr Lys
275 280 285 290
tct ctg aga cac agg tca gcc aac atg gac gtg ctc atc gtc ctg gcc 1390
Ser Leu Arg His Arg Ser Ala Asn Met Asp Val Leu Ile Val Leu Ala
295 300 305
aca agc att gct tat gtt tat tct ctg gtc atc ctg gtg gtt gct gtg 1438
Thr Ser Ile Ala Tyr Val Tyr Ser Leu Val Ile Leu Val Val Ala Val
310 315 320
gct gag aag gcg gag agg agc cct gtg aca ttc ttc gac acg ccc ccc 1486
Ala Glu Lys Ala Glu Arg Ser Pro Val Thr Phe Phe Asp Thr Pro Pro
325 330 335
atg ctc ttt gtg ttc att gcc ctg ggc cgg tgg ctg gaa cac ttg gca 1534
Met Leu Phe Val Phe Ile Ala Leu Gly Arg Trp Leu Glu His Leu Ala
340 345 350
aag agc aaa acc tca gaa gcc ctg gct aaa ctc atg tct ctc caa gcc 1582
Lys Ser Lys Thr Ser Glu Ala Leu Ala Lys Leu Met Ser Leu Gln Ala
355 360 365 370
aca gaa gcc acc gtt gtg acc ctt ggt gag gac aat tta atc atc agg 1630
Thr Glu Ala Thr Val Val Thr Leu Gly Glu Asp Asn Leu Ile Ile Arg
375 380 385
gag gag caa gtc ccc atg gag ctg gtg cag cgg ggc gat atc gtc aag 1678
Glu Glu Gln Val Pro Met Glu Leu Val Gln Arg Gly Asp Ile Val Lys
390 395 400
gtg gtc cct ggg gga aag ttt cca gtg gat ggg aaa gtc ctg gaa ggc 1726
Val Val Pro Gly Gly Lys Phe Pro Val Asp Gly Lys Val Leu Glu Gly
405 410 415
aat acc atg gct gat gag tcc ctc atc aca gga gaa gcc atg cca gtc 1774
Asn Thr Met Ala Asp Glu Ser Leu Ile Thr Gly Glu Ala Met Pro Val
420 425 430
act aag aaa ccc gga agc act gta att gcg ggg tct ata aat gca cat 1822
Thr Lys Lys Pro Gly Ser Thr Val Ile Ala Gly Ser Ile Asn Ala His
435 440 445 450
ggc tct gtg ctc att aaa gct acc cac gtg ggc aat gac acc act ttg 1870
Gly Ser Val Leu Ile Lys Ala Thr His Val Gly Asn Asp Thr Thr Leu
455 460 465
gct cag att gtg aaa ctg gtg gaa gag gct cag atg tca aag gca ccc 1918
Ala Gln Ile Val Lys Leu Val Glu Glu Ala Gln Met Ser Lys Ala Pro
470 475 480
att cag cag ctg gct gac cgg ttt agt gga tat ttt gtc cca ttt atc 1966
Ile Gln Gln Leu Ala Asp Arg Phe Ser Gly Tyr Phe Val Pro Phe Ile
485 490 495
atc atc atg tca act ttg acg ttg gtg gta tgg att gta atc ggt ttt 2014
Ile Ile Met Ser Thr Leu Thr Leu Val Val Trp Ile Val Ile Gly Phe
500 505 510
atc gat ttt ggt gtt gtt cag aga tac ttt cct aac ccc aac aag cac 2062
Ile Asp Phe Gly Val Val Gln Arg Tyr Phe Pro Asn Pro Asn Lys His
515 520 525 530
atc tcc cag aca gag gtg atc atc cgg ttt gct ttc cag acg tcc atc 2110
Ile Ser Gln Thr Glu Val Ile Ile Arg Phe Ala Phe Gln Thr Ser Ile
535 540 545
acg gtg ctg tgc att gcc tgc ccc tgc tcc ctg ggg ctg gcc acg ccc 2158
Thr Val Leu Cys Ile Ala Cys Pro Cys Ser Leu Gly Leu Ala Thr Pro
550 555 560
acg gct gtc atg gtg ggc acc ggg gtg gcc gcg cag aac ggc atc ctc 2206
Thr Ala Val Met Val Gly Thr Gly Val Ala Ala Gln Asn Gly Ile Leu
565 570 575
atc aag gga ggc aag ccc ctg gag atg gcg cac aag ata aag act gtg 2254
Ile Lys Gly Gly Lys Pro Leu Glu Met Ala His Lys Ile Lys Thr Val
580 585 590
atg ttt gac aag act ggc acc att acc cat ggc gtc ccc agg gtc atg 2302
Met Phe Asp Lys Thr Gly Thr Ile Thr His Gly Val Pro Arg Val Met
595 600 605 610
cgg gtg ctc ctg ctg ggg gat gtg gcc aca ctg ccc ctc agg aag gtt 2350
Arg Val Leu Leu Leu Gly Asp Val Ala Thr Leu Pro Leu Arg Lys Val
615 620 625
ctg gct gtg gtg ggg act gcg gag gcc agc agt gaa cac ccc ttg ggc 2398
Leu Ala Val Val Gly Thr Ala Glu Ala Ser Ser Glu His Pro Leu Gly
630 635 640
gtg gca gtc acc aaa tac tgt aaa gag gaa ctt gga aca gag acc ttg 2446
Val Ala Val Thr Lys Tyr Cys Lys Glu Glu Leu Gly Thr Glu Thr Leu
645 650 655
gga tac tgc acg gac ttc cag gca gtg cca ggc tgt gga att ggg tgc 2494
Gly Tyr Cys Thr Asp Phe Gln Ala Val Pro Gly Cys Gly Ile Gly Cys
660 665 670
aaa gtc agc aac gtg gaa ggc atc ctg gcc cac agt gag cgc cct ttg 2542
Lys Val Ser Asn Val Glu Gly Ile Leu Ala His Ser Glu Arg Pro Leu
675 680 685 690
agt gca ccg gcc agt cac ctg aat gag gct ggc agc ctt ccc gca gaa 2590
Ser Ala Pro Ala Ser His Leu Asn Glu Ala Gly Ser Leu Pro Ala Glu
695 700 705
aaa gat gca gtc ccc cag acc ttc tct gtg ctg att gga aac cgt gag 2638
Lys Asp Ala Val Pro Gln Thr Phe Ser Val Leu Ile Gly Asn Arg Glu
710 715 720
tgg ctg agg cgc aac ggt tta acc att tct agc gat gtc agt gac gct 2686
Trp Leu Arg Arg Asn Gly Leu Thr Ile Ser Ser Asp Val Ser Asp Ala
725 730 735
atg aca gac cac gag atg aaa gga cag aca gcc atc ctg gtg gct att 2734
Met Thr Asp His Glu Met Lys Gly Gln Thr Ala Ile Leu Val Ala Ile
740 745 750
gac ggt gtg ctc tgt ggg atg atc gca atc gca gac gct gtc aag cag 2782
Asp Gly Val Leu Cys Gly Met Ile Ala Ile Ala Asp Ala Val Lys Gln
755 760 765 770
gag gct gcc ctg gct gtg cac acg ctg cag agc atg ggt gtg gac gtg 2830
Glu Ala Ala Leu Ala Val His Thr Leu Gln Ser Met Gly Val Asp Val
775 780 785
gtt ctg atc acg ggg gac aac cgg aag aca gcc aga gct att gcc acc 2878
Val Leu Ile Thr Gly Asp Asn Arg Lys Thr Ala Arg Ala Ile Ala Thr
790 795 800
cag gtt ggc atc aac aaa gtc ttt gca gag gtg ctg cct tcg cac aag 2926
Gln Val Gly Ile Asn Lys Val Phe Ala Glu Val Leu Pro Ser His Lys
805 810 815
gtg gcc aag gtc cag gag ctc cag aat aaa ggg aag aaa gtc gcc atg 2974
Val Ala Lys Val Gln Glu Leu Gln Asn Lys Gly Lys Lys Val Ala Met
820 825 830
gtg ggg gat ggg gtc aat gac tcc ccg gcc ttg gcc cag gca gac atg 3022
Val Gly Asp Gly Val Asn Asp Ser Pro Ala Leu Ala Gln Ala Asp Met
835 840 845 850
ggt gtg gcc att ggc acc ggc acg gat gtg gcc atc gag gca gcc gac 3070
Gly Val Ala Ile Gly Thr Gly Thr Asp Val Ala Ile Glu Ala Ala Asp
855 860 865
gtc gtc ctt atc aga aat gat ttg ctg gat gtg gtg gct agc att cac 3118
Val Val Leu Ile Arg Asn Asp Leu Leu Asp Val Val Ala Ser Ile His
870 875 880
ctt tcc aag agg act gtc cga agg ata cgc atc aac ctg gtc ctg gca 3166
Leu Ser Lys Arg Thr Val Arg Arg Ile Arg Ile Asn Leu Val Leu Ala
885 890 895
ctg att tat aac ctg gtt ggg ata ccc att gca gca ggt gtc ttc atg 3214
Leu Ile Tyr Asn Leu Val Gly Ile Pro Ile Ala Ala Gly Val Phe Met
900 905 910
ccc atc ggc att gtg ctg cag ccc tgg atg ggc tca gcg gcc atg gca 3262
Pro Ile Gly Ile Val Leu Gln Pro Trp Met Gly Ser Ala Ala Met Ala
915 920 925 930
gcc tcc tct gtg tct gtg gtg ctc tca tcc ctg cag ctc aag tgc tat 3310
Ala Ser Ser Val Ser Val Val Leu Ser Ser Leu Gln Leu Lys Cys Tyr
935 940 945
aag aag cct gac ctg gag agg tat gag gca cag gcg cat ggc cac atg 3358
Lys Lys Pro Asp Leu Glu Arg Tyr Glu Ala Gln Ala His Gly His Met
950 955 960
aag ccc ctg acg gca tcc cag gtc agt gtg cac ata ggc atg gat gac 3406
Lys Pro Leu Thr Ala Ser Gln Val Ser Val His Ile Gly Met Asp Asp
965 970 975
agg tgg cgg gac tcc ccc agg gcc aca cca tgg gac cag gtc agc tat 3454
Arg Trp Arg Asp Ser Pro Arg Ala Thr Pro Trp Asp Gln Val Ser Tyr
980 985 990
gtc agc cag gtg tcg ctg tcc tcc ctg acg tcc gac aag cca tct cgg 3502
Val Ser Gln Val Ser Leu Ser Ser Leu Thr Ser Asp Lys Pro Ser Arg
995 1000 1005 1010
cac agc gct gca gca gac gat gat ggg gac aag tgg tct ctg ctc ctg 3550
His Ser Ala Ala Ala Asp Asp Asp Gly Asp Lys Trp Ser Leu Leu Leu
1015 1020 1025
aat ggc agg gat gag gag cag tac atc tga ggtaccaata aagacctctt 3600
Asn Gly Arg Asp Glu Glu Gln Tyr Ile
1030 1035
attttcattc atcaggtgtg gttggttttt ttgtgtgggg gcggatccat cggatcccgt 3660
gcggaccgag cggccgcagg aacccctagt gatggagttg gccactccct ctctgcgcgc 3720
tcgctcgctc actgaggccg ggcgaccaaa ggtcgcccga cgcccgggct ttgcccgggc 3780
ggcctcagtg agcgagcgag cgcgcagctg cctgcag 3817
<210> 7
<211> 1035
<212> Белок
<213> Искусственная последовательность
<220>
<223> [CDS]:473..3580 из SEQ ID NO 6
<400> 7
Met Pro Glu Gln Glu Arg Gln Ile Thr Ala Arg Glu Gly Ala Ser Arg
1 5 10 15
Lys Ile Leu Ser Lys Leu Ser Leu Pro Thr Arg Ala Trp Glu Pro Ala
20 25 30
Met Lys Lys Ser Phe Ala Phe Asp Asn Val Gly Tyr Glu Gly Gly Leu
35 40 45
Asp Gly Leu Gly Pro Ser Ser Gln Pro Gln Lys Cys Phe Leu Gln Ile
50 55 60
Lys Gly Met Thr Cys Ala Ser Cys Val Ser Asn Ile Glu Arg Asn Leu
65 70 75 80
Gln Lys Glu Ala Gly Val Leu Ser Val Leu Val Ala Leu Met Ala Gly
85 90 95
Lys Ala Glu Ile Lys Tyr Asp Pro Glu Val Ile Gln Pro Leu Glu Ile
100 105 110
Ala Gln Phe Ile Gln Asp Leu Gly Phe Glu Ala Ala Val Met Glu Asp
115 120 125
Tyr Ala Gly Ser Asp Gly Asn Ile Glu Leu Thr Ile Thr Gly Met Thr
130 135 140
Cys Ala Ser Cys Val His Asn Ile Glu Ser Lys Leu Thr Arg Thr Asn
145 150 155 160
Gly Ile Thr Tyr Ala Ser Val Ala Leu Ala Thr Ser Lys Ala Leu Val
165 170 175
Lys Phe Asp Pro Glu Ile Ile Gly Pro Arg Asp Ile Ile Lys Ile Ile
180 185 190
Glu Glu Ile Gly Phe His Ala Ser Leu Ala Gln Arg Asn Pro Asn Ala
195 200 205
His His Leu Asp His Lys Met Glu Ile Lys Gln Trp Lys Lys Ser Phe
210 215 220
Leu Cys Ser Leu Val Phe Gly Ile Pro Val Met Ala Leu Met Ile Tyr
225 230 235 240
Met Leu Ile Pro Ser Asn Glu Pro His Gln Ser Met Val Leu Asp His
245 250 255
Asn Ile Ile Pro Gly Leu Ser Ile Leu Asn Leu Ile Phe Phe Ile Leu
260 265 270
Cys Thr Phe Val Gln Leu Leu Gly Gly Trp Tyr Phe Tyr Val Gln Ala
275 280 285
Tyr Lys Ser Leu Arg His Arg Ser Ala Asn Met Asp Val Leu Ile Val
290 295 300
Leu Ala Thr Ser Ile Ala Tyr Val Tyr Ser Leu Val Ile Leu Val Val
305 310 315 320
Ala Val Ala Glu Lys Ala Glu Arg Ser Pro Val Thr Phe Phe Asp Thr
325 330 335
Pro Pro Met Leu Phe Val Phe Ile Ala Leu Gly Arg Trp Leu Glu His
340 345 350
Leu Ala Lys Ser Lys Thr Ser Glu Ala Leu Ala Lys Leu Met Ser Leu
355 360 365
Gln Ala Thr Glu Ala Thr Val Val Thr Leu Gly Glu Asp Asn Leu Ile
370 375 380
Ile Arg Glu Glu Gln Val Pro Met Glu Leu Val Gln Arg Gly Asp Ile
385 390 395 400
Val Lys Val Val Pro Gly Gly Lys Phe Pro Val Asp Gly Lys Val Leu
405 410 415
Glu Gly Asn Thr Met Ala Asp Glu Ser Leu Ile Thr Gly Glu Ala Met
420 425 430
Pro Val Thr Lys Lys Pro Gly Ser Thr Val Ile Ala Gly Ser Ile Asn
435 440 445
Ala His Gly Ser Val Leu Ile Lys Ala Thr His Val Gly Asn Asp Thr
450 455 460
Thr Leu Ala Gln Ile Val Lys Leu Val Glu Glu Ala Gln Met Ser Lys
465 470 475 480
Ala Pro Ile Gln Gln Leu Ala Asp Arg Phe Ser Gly Tyr Phe Val Pro
485 490 495
Phe Ile Ile Ile Met Ser Thr Leu Thr Leu Val Val Trp Ile Val Ile
500 505 510
Gly Phe Ile Asp Phe Gly Val Val Gln Arg Tyr Phe Pro Asn Pro Asn
515 520 525
Lys His Ile Ser Gln Thr Glu Val Ile Ile Arg Phe Ala Phe Gln Thr
530 535 540
Ser Ile Thr Val Leu Cys Ile Ala Cys Pro Cys Ser Leu Gly Leu Ala
545 550 555 560
Thr Pro Thr Ala Val Met Val Gly Thr Gly Val Ala Ala Gln Asn Gly
565 570 575
Ile Leu Ile Lys Gly Gly Lys Pro Leu Glu Met Ala His Lys Ile Lys
580 585 590
Thr Val Met Phe Asp Lys Thr Gly Thr Ile Thr His Gly Val Pro Arg
595 600 605
Val Met Arg Val Leu Leu Leu Gly Asp Val Ala Thr Leu Pro Leu Arg
610 615 620
Lys Val Leu Ala Val Val Gly Thr Ala Glu Ala Ser Ser Glu His Pro
625 630 635 640
Leu Gly Val Ala Val Thr Lys Tyr Cys Lys Glu Glu Leu Gly Thr Glu
645 650 655
Thr Leu Gly Tyr Cys Thr Asp Phe Gln Ala Val Pro Gly Cys Gly Ile
660 665 670
Gly Cys Lys Val Ser Asn Val Glu Gly Ile Leu Ala His Ser Glu Arg
675 680 685
Pro Leu Ser Ala Pro Ala Ser His Leu Asn Glu Ala Gly Ser Leu Pro
690 695 700
Ala Glu Lys Asp Ala Val Pro Gln Thr Phe Ser Val Leu Ile Gly Asn
705 710 715 720
Arg Glu Trp Leu Arg Arg Asn Gly Leu Thr Ile Ser Ser Asp Val Ser
725 730 735
Asp Ala Met Thr Asp His Glu Met Lys Gly Gln Thr Ala Ile Leu Val
740 745 750
Ala Ile Asp Gly Val Leu Cys Gly Met Ile Ala Ile Ala Asp Ala Val
755 760 765
Lys Gln Glu Ala Ala Leu Ala Val His Thr Leu Gln Ser Met Gly Val
770 775 780
Asp Val Val Leu Ile Thr Gly Asp Asn Arg Lys Thr Ala Arg Ala Ile
785 790 795 800
Ala Thr Gln Val Gly Ile Asn Lys Val Phe Ala Glu Val Leu Pro Ser
805 810 815
His Lys Val Ala Lys Val Gln Glu Leu Gln Asn Lys Gly Lys Lys Val
820 825 830
Ala Met Val Gly Asp Gly Val Asn Asp Ser Pro Ala Leu Ala Gln Ala
835 840 845
Asp Met Gly Val Ala Ile Gly Thr Gly Thr Asp Val Ala Ile Glu Ala
850 855 860
Ala Asp Val Val Leu Ile Arg Asn Asp Leu Leu Asp Val Val Ala Ser
865 870 875 880
Ile His Leu Ser Lys Arg Thr Val Arg Arg Ile Arg Ile Asn Leu Val
885 890 895
Leu Ala Leu Ile Tyr Asn Leu Val Gly Ile Pro Ile Ala Ala Gly Val
900 905 910
Phe Met Pro Ile Gly Ile Val Leu Gln Pro Trp Met Gly Ser Ala Ala
915 920 925
Met Ala Ala Ser Ser Val Ser Val Val Leu Ser Ser Leu Gln Leu Lys
930 935 940
Cys Tyr Lys Lys Pro Asp Leu Glu Arg Tyr Glu Ala Gln Ala His Gly
945 950 955 960
His Met Lys Pro Leu Thr Ala Ser Gln Val Ser Val His Ile Gly Met
965 970 975
Asp Asp Arg Trp Arg Asp Ser Pro Arg Ala Thr Pro Trp Asp Gln Val
980 985 990
Ser Tyr Val Ser Gln Val Ser Leu Ser Ser Leu Thr Ser Asp Lys Pro
995 1000 1005
Ser Arg His Ser Ala Ala Ala Asp Asp Asp Gly Asp Lys Trp Ser Leu
1010 1015 1020
Leu Leu Asn Gly Arg Asp Glu Glu Gln Tyr Ile
1025 1030 1035
<210> 8
<211> 3108
<212> ДНК
<213> Искусственная последовательность
<220>
<223> последовательность с оптимизированными кодонами coATP7B(d57-486), кодирующая укороченный ATP7B, с делецией аминокислот 57-486
<220>
<221> CDS
<222> 1..3108
<223> /таблица трансляции=1
<400> 8
atg cca gaa cag gaa cgc cag atc aca gca aga gag gga gca agt cgg 48
Met Pro Glu Gln Glu Arg Gln Ile Thr Ala Arg Glu Gly Ala Ser Arg
1 5 10 15
aaa atc ctg agc aaa ctg agc ctg cca acc aga gca tgg gaa ccc gca 96
Lys Ile Leu Ser Lys Leu Ser Leu Pro Thr Arg Ala Trp Glu Pro Ala
20 25 30
atg aag aaa agc ttc gcc ttt gac aac gtg gga tac gag gga ggg ctg 144
Met Lys Lys Ser Phe Ala Phe Asp Asn Val Gly Tyr Glu Gly Gly Leu
35 40 45
gat gga ctg gga cct agc tcc cag cct cag aag tgt ttt ctg cag atc 192
Asp Gly Leu Gly Pro Ser Ser Gln Pro Gln Lys Cys Phe Leu Gln Ile
50 55 60
aaa ggc atg acc tgc gcc tct tgc gtg agc aac att gag cgg aat ctg 240
Lys Gly Met Thr Cys Ala Ser Cys Val Ser Asn Ile Glu Arg Asn Leu
65 70 75 80
cag aag gaa gct ggg gtg ctg agc gtg ctg gtc gca ctg atg gcc gga 288
Gln Lys Glu Ala Gly Val Leu Ser Val Leu Val Ala Leu Met Ala Gly
85 90 95
aag gct gag atc aag tac gac cct gaa gtg atc cag cca ctg gag att 336
Lys Ala Glu Ile Lys Tyr Asp Pro Glu Val Ile Gln Pro Leu Glu Ile
100 105 110
gcc cag ttc atc cag gat ctg ggc ttt gag gcc gct gtg atg gaa gac 384
Ala Gln Phe Ile Gln Asp Leu Gly Phe Glu Ala Ala Val Met Glu Asp
115 120 125
tat gct ggg agc gat gga aac att gaa ctg acc atc acc gga atg act 432
Tyr Ala Gly Ser Asp Gly Asn Ile Glu Leu Thr Ile Thr Gly Met Thr
130 135 140
tgt gcc tct tgc gtg cac aac atc gag agt aaa ctg act aga acc aat 480
Cys Ala Ser Cys Val His Asn Ile Glu Ser Lys Leu Thr Arg Thr Asn
145 150 155 160
ggg att acc tac gcc agt gtg gcc ctg gct aca tca aag gct ctg gtg 528
Gly Ile Thr Tyr Ala Ser Val Ala Leu Ala Thr Ser Lys Ala Leu Val
165 170 175
aaa ttc gac ccc gag atc att gga cct agg gat atc att aag atc att 576
Lys Phe Asp Pro Glu Ile Ile Gly Pro Arg Asp Ile Ile Lys Ile Ile
180 185 190
gag gaa atc ggc ttt cac gca agc ctg gcc cag cgc aac cca aat gcc 624
Glu Glu Ile Gly Phe His Ala Ser Leu Ala Gln Arg Asn Pro Asn Ala
195 200 205
cac cat ctg gac cat aag atg gag atc aag cag tgg aag aaa agt ttc 672
His His Leu Asp His Lys Met Glu Ile Lys Gln Trp Lys Lys Ser Phe
210 215 220
ctg tgc tca ctg gtg ttt gga atc ccc gtc atg gcc ctg atg atc tac 720
Leu Cys Ser Leu Val Phe Gly Ile Pro Val Met Ala Leu Met Ile Tyr
225 230 235 240
atg ctg atc cct agc aac gag cca cac cag tcc atg gtg ctg gat cat 768
Met Leu Ile Pro Ser Asn Glu Pro His Gln Ser Met Val Leu Asp His
245 250 255
aac atc att cct ggc ctg tcc atc ctg aat ctg att ttc ttt atc ctg 816
Asn Ile Ile Pro Gly Leu Ser Ile Leu Asn Leu Ile Phe Phe Ile Leu
260 265 270
tgc aca ttc gtg cag ctg ctg gga ggc tgg tac ttt tat gtg cag gca 864
Cys Thr Phe Val Gln Leu Leu Gly Gly Trp Tyr Phe Tyr Val Gln Ala
275 280 285
tat aaa tca ctg cga cac cgg agc gcc aat atg gac gtg ctg att gtc 912
Tyr Lys Ser Leu Arg His Arg Ser Ala Asn Met Asp Val Leu Ile Val
290 295 300
ctg gca acc tct atc gcc tac gtg tat agt ctg gtc atc ctg gtg gtc 960
Leu Ala Thr Ser Ile Ala Tyr Val Tyr Ser Leu Val Ile Leu Val Val
305 310 315 320
gca gtg gca gag aag gca gaa cgg agc cca gtg act ttc ttt gat acc 1008
Ala Val Ala Glu Lys Ala Glu Arg Ser Pro Val Thr Phe Phe Asp Thr
325 330 335
cct cca atg ctg ttc gtg ttt atc gct ctg ggc aga tgg ctg gaa cat 1056
Pro Pro Met Leu Phe Val Phe Ile Ala Leu Gly Arg Trp Leu Glu His
340 345 350
ctg gca aag tca aaa acc agc gag gct ctg gca aag ctg atg agc ctg 1104
Leu Ala Lys Ser Lys Thr Ser Glu Ala Leu Ala Lys Leu Met Ser Leu
355 360 365
cag gct acc gaa gca aca gtg gtc act ctg gga gag gac aac ctg atc 1152
Gln Ala Thr Glu Ala Thr Val Val Thr Leu Gly Glu Asp Asn Leu Ile
370 375 380
att cgc gag gaa cag gtg cct atg gaa ctg gtc cag cga ggc gat atc 1200
Ile Arg Glu Glu Gln Val Pro Met Glu Leu Val Gln Arg Gly Asp Ile
385 390 395 400
gtg aag gtg gtc cca ggg gga aaa ttc ccc gtg gac ggc aag gtc ctg 1248
Val Lys Val Val Pro Gly Gly Lys Phe Pro Val Asp Gly Lys Val Leu
405 410 415
gag ggg aat act atg gcc gat gaa tcc ctg atc acc ggc gag gct atg 1296
Glu Gly Asn Thr Met Ala Asp Glu Ser Leu Ile Thr Gly Glu Ala Met
420 425 430
cct gtg aca aag aaa cca gga tca act gtc att gct ggc agc atc aac 1344
Pro Val Thr Lys Lys Pro Gly Ser Thr Val Ile Ala Gly Ser Ile Asn
435 440 445
gca cac ggg tcc gtg ctg atc aag gcc aca cat gtc ggg aat gac aca 1392
Ala His Gly Ser Val Leu Ile Lys Ala Thr His Val Gly Asn Asp Thr
450 455 460
act ctg gct cag att gtg aaa ctg gtc gag gaa gcc cag atg tcc aag 1440
Thr Leu Ala Gln Ile Val Lys Leu Val Glu Glu Ala Gln Met Ser Lys
465 470 475 480
gct cct atc cag cag ctg gcc gat cgg ttc tcc ggc tac ttc gtg ccc 1488
Ala Pro Ile Gln Gln Leu Ala Asp Arg Phe Ser Gly Tyr Phe Val Pro
485 490 495
ttc atc att atc atg tct aca ctg act ctg gtg gtc tgg att gtg atc 1536
Phe Ile Ile Ile Met Ser Thr Leu Thr Leu Val Val Trp Ile Val Ile
500 505 510
gga ttc att gac ttt ggc gtg gtc cag aga tat ttt ccc aac cct aat 1584
Gly Phe Ile Asp Phe Gly Val Val Gln Arg Tyr Phe Pro Asn Pro Asn
515 520 525
aag cac atc agc cag acc gaa gtg atc atc agg ttc gca ttt cag acc 1632
Lys His Ile Ser Gln Thr Glu Val Ile Ile Arg Phe Ala Phe Gln Thr
530 535 540
agt att aca gtg ctg tgc atc gcc tgc cca tgt tca ctg ggg ctg gct 1680
Ser Ile Thr Val Leu Cys Ile Ala Cys Pro Cys Ser Leu Gly Leu Ala
545 550 555 560
acc ccc aca gca gtg atg gtc gga aca gga gtg gca gca cag aac gga 1728
Thr Pro Thr Ala Val Met Val Gly Thr Gly Val Ala Ala Gln Asn Gly
565 570 575
att ctg atc aag ggc ggg aaa ccc ctg gag atg gcc cac aag atc aaa 1776
Ile Leu Ile Lys Gly Gly Lys Pro Leu Glu Met Ala His Lys Ile Lys
580 585 590
act gtg atg ttt gac aaa act ggg acc att aca cat gga gtg ccc cgc 1824
Thr Val Met Phe Asp Lys Thr Gly Thr Ile Thr His Gly Val Pro Arg
595 600 605
gtc atg cga gtg ctg ctg ctg ggc gat gtg gca acc ctg cct ctg aga 1872
Val Met Arg Val Leu Leu Leu Gly Asp Val Ala Thr Leu Pro Leu Arg
610 615 620
aag gtc ctg gca gtg gtc gga aca gca gag gct agc tcc gaa cac cca 1920
Lys Val Leu Ala Val Val Gly Thr Ala Glu Ala Ser Ser Glu His Pro
625 630 635 640
ctg ggg gtg gcc gtc aca aag tac tgc aaa gag gaa ctg ggc act gag 1968
Leu Gly Val Ala Val Thr Lys Tyr Cys Lys Glu Glu Leu Gly Thr Glu
645 650 655
acc ctg ggg tat tgt act gac ttc cag gca gtg ccc gga tgc gga atc 2016
Thr Leu Gly Tyr Cys Thr Asp Phe Gln Ala Val Pro Gly Cys Gly Ile
660 665 670
gga tgt aaa gtc tct aac gtg gaa ggg att ctg gct cac agt gag cgg 2064
Gly Cys Lys Val Ser Asn Val Glu Gly Ile Leu Ala His Ser Glu Arg
675 680 685
ccc ctg agc gca cct gca tcc cat ctg aat gaa gca gga agc ctg cca 2112
Pro Leu Ser Ala Pro Ala Ser His Leu Asn Glu Ala Gly Ser Leu Pro
690 695 700
gca gag aag gac gct gtg cct cag acc ttt tcc gtc ctg atc ggc aac 2160
Ala Glu Lys Asp Ala Val Pro Gln Thr Phe Ser Val Leu Ile Gly Asn
705 710 715 720
aga gaa tgg ctg cgg aga aat ggg ctg aca att tct agt gac gtg tcc 2208
Arg Glu Trp Leu Arg Arg Asn Gly Leu Thr Ile Ser Ser Asp Val Ser
725 730 735
gat gcc atg aca gat cac gag atg aaa ggc cag act gca att ctg gtg 2256
Asp Ala Met Thr Asp His Glu Met Lys Gly Gln Thr Ala Ile Leu Val
740 745 750
gcc atc gac gga gtc ctg tgc ggc atg att gct atc gca gat gcc gtg 2304
Ala Ile Asp Gly Val Leu Cys Gly Met Ile Ala Ile Ala Asp Ala Val
755 760 765
aag cag gag gct gca ctg gcc gtc cat acc ctg cag tct atg ggc gtg 2352
Lys Gln Glu Ala Ala Leu Ala Val His Thr Leu Gln Ser Met Gly Val
770 775 780
gac gtg gtc ctg atc acc ggg gat aac cgg aaa aca gct aga gca att 2400
Asp Val Val Leu Ile Thr Gly Asp Asn Arg Lys Thr Ala Arg Ala Ile
785 790 795 800
gcc act caa gtg ggc atc aat aag gtg ttc gct gaa gtc ctg cct agc 2448
Ala Thr Gln Val Gly Ile Asn Lys Val Phe Ala Glu Val Leu Pro Ser
805 810 815
cac aag gtc gca aaa gtg cag gag ctg cag aac aag ggc aag aaa gtc 2496
His Lys Val Ala Lys Val Gln Glu Leu Gln Asn Lys Gly Lys Lys Val
820 825 830
gcc atg gtg gga gac ggc gtg aat gat agc cca gct ctg gca cag gca 2544
Ala Met Val Gly Asp Gly Val Asn Asp Ser Pro Ala Leu Ala Gln Ala
835 840 845
gac atg gga gtc gct att ggg aca gga act gac gtg gca atc gag gcc 2592
Asp Met Gly Val Ala Ile Gly Thr Gly Thr Asp Val Ala Ile Glu Ala
850 855 860
gct gat gtg gtc ctg att agg aat gac ctg ctg gat gtg gtc gct tct 2640
Ala Asp Val Val Leu Ile Arg Asn Asp Leu Leu Asp Val Val Ala Ser
865 870 875 880
att cat ctg agt aag agg aca gtg agg cgc att cgc atc aac ctg gtg 2688
Ile His Leu Ser Lys Arg Thr Val Arg Arg Ile Arg Ile Asn Leu Val
885 890 895
ctg gcc ctg atc tac aat ctg gtg gga att cca atc gca gcc ggc gtg 2736
Leu Ala Leu Ile Tyr Asn Leu Val Gly Ile Pro Ile Ala Ala Gly Val
900 905 910
ttt atg cca att ggg atc gtc ctg cag ccc tgg atg ggc tca gct gca 2784
Phe Met Pro Ile Gly Ile Val Leu Gln Pro Trp Met Gly Ser Ala Ala
915 920 925
atg gcc gct tca agc gtg agc gtg gtc ctg tcc tct ctg cag ctg aaa 2832
Met Ala Ala Ser Ser Val Ser Val Val Leu Ser Ser Leu Gln Leu Lys
930 935 940
tgc tac aag aaa cca gac ctg gag cgg tac gaa gct cag gca cac gga 2880
Cys Tyr Lys Lys Pro Asp Leu Glu Arg Tyr Glu Ala Gln Ala His Gly
945 950 955 960
cat atg aag ccc ctg acc gct tcc cag gtg tct gtc cac atc ggc atg 2928
His Met Lys Pro Leu Thr Ala Ser Gln Val Ser Val His Ile Gly Met
965 970 975
gac gat aga tgg agg gac agc cca agg gcc act cca tgg gat cag gtc 2976
Asp Asp Arg Trp Arg Asp Ser Pro Arg Ala Thr Pro Trp Asp Gln Val
980 985 990
agt tac gtg agc cag gtc agc ctg agt tca ctg acc agc gac aag ccc 3024
Ser Tyr Val Ser Gln Val Ser Leu Ser Ser Leu Thr Ser Asp Lys Pro
995 1000 1005
tcc cgc cat tct gca gcc gct gat gac gac ggg gac aag tgg agc ctg 3072
Ser Arg His Ser Ala Ala Ala Asp Asp Asp Gly Asp Lys Trp Ser Leu
1010 1015 1020
ctg ctg aac gga agg gac gaa gaa cag tat atc taa 3108
Leu Leu Asn Gly Arg Asp Glu Glu Gln Tyr Ile
1025 1030 1035
<210> 9
<211> 1035
<212> Белок
<213> Искусственная последовательность
<220>
<223> [CDS]:1..3108 из SEQ ID NO 8
<400> 9
Met Pro Glu Gln Glu Arg Gln Ile Thr Ala Arg Glu Gly Ala Ser Arg
1 5 10 15
Lys Ile Leu Ser Lys Leu Ser Leu Pro Thr Arg Ala Trp Glu Pro Ala
20 25 30
Met Lys Lys Ser Phe Ala Phe Asp Asn Val Gly Tyr Glu Gly Gly Leu
35 40 45
Asp Gly Leu Gly Pro Ser Ser Gln Pro Gln Lys Cys Phe Leu Gln Ile
50 55 60
Lys Gly Met Thr Cys Ala Ser Cys Val Ser Asn Ile Glu Arg Asn Leu
65 70 75 80
Gln Lys Glu Ala Gly Val Leu Ser Val Leu Val Ala Leu Met Ala Gly
85 90 95
Lys Ala Glu Ile Lys Tyr Asp Pro Glu Val Ile Gln Pro Leu Glu Ile
100 105 110
Ala Gln Phe Ile Gln Asp Leu Gly Phe Glu Ala Ala Val Met Glu Asp
115 120 125
Tyr Ala Gly Ser Asp Gly Asn Ile Glu Leu Thr Ile Thr Gly Met Thr
130 135 140
Cys Ala Ser Cys Val His Asn Ile Glu Ser Lys Leu Thr Arg Thr Asn
145 150 155 160
Gly Ile Thr Tyr Ala Ser Val Ala Leu Ala Thr Ser Lys Ala Leu Val
165 170 175
Lys Phe Asp Pro Glu Ile Ile Gly Pro Arg Asp Ile Ile Lys Ile Ile
180 185 190
Glu Glu Ile Gly Phe His Ala Ser Leu Ala Gln Arg Asn Pro Asn Ala
195 200 205
His His Leu Asp His Lys Met Glu Ile Lys Gln Trp Lys Lys Ser Phe
210 215 220
Leu Cys Ser Leu Val Phe Gly Ile Pro Val Met Ala Leu Met Ile Tyr
225 230 235 240
Met Leu Ile Pro Ser Asn Glu Pro His Gln Ser Met Val Leu Asp His
245 250 255
Asn Ile Ile Pro Gly Leu Ser Ile Leu Asn Leu Ile Phe Phe Ile Leu
260 265 270
Cys Thr Phe Val Gln Leu Leu Gly Gly Trp Tyr Phe Tyr Val Gln Ala
275 280 285
Tyr Lys Ser Leu Arg His Arg Ser Ala Asn Met Asp Val Leu Ile Val
290 295 300
Leu Ala Thr Ser Ile Ala Tyr Val Tyr Ser Leu Val Ile Leu Val Val
305 310 315 320
Ala Val Ala Glu Lys Ala Glu Arg Ser Pro Val Thr Phe Phe Asp Thr
325 330 335
Pro Pro Met Leu Phe Val Phe Ile Ala Leu Gly Arg Trp Leu Glu His
340 345 350
Leu Ala Lys Ser Lys Thr Ser Glu Ala Leu Ala Lys Leu Met Ser Leu
355 360 365
Gln Ala Thr Glu Ala Thr Val Val Thr Leu Gly Glu Asp Asn Leu Ile
370 375 380
Ile Arg Glu Glu Gln Val Pro Met Glu Leu Val Gln Arg Gly Asp Ile
385 390 395 400
Val Lys Val Val Pro Gly Gly Lys Phe Pro Val Asp Gly Lys Val Leu
405 410 415
Glu Gly Asn Thr Met Ala Asp Glu Ser Leu Ile Thr Gly Glu Ala Met
420 425 430
Pro Val Thr Lys Lys Pro Gly Ser Thr Val Ile Ala Gly Ser Ile Asn
435 440 445
Ala His Gly Ser Val Leu Ile Lys Ala Thr His Val Gly Asn Asp Thr
450 455 460
Thr Leu Ala Gln Ile Val Lys Leu Val Glu Glu Ala Gln Met Ser Lys
465 470 475 480
Ala Pro Ile Gln Gln Leu Ala Asp Arg Phe Ser Gly Tyr Phe Val Pro
485 490 495
Phe Ile Ile Ile Met Ser Thr Leu Thr Leu Val Val Trp Ile Val Ile
500 505 510
Gly Phe Ile Asp Phe Gly Val Val Gln Arg Tyr Phe Pro Asn Pro Asn
515 520 525
Lys His Ile Ser Gln Thr Glu Val Ile Ile Arg Phe Ala Phe Gln Thr
530 535 540
Ser Ile Thr Val Leu Cys Ile Ala Cys Pro Cys Ser Leu Gly Leu Ala
545 550 555 560
Thr Pro Thr Ala Val Met Val Gly Thr Gly Val Ala Ala Gln Asn Gly
565 570 575
Ile Leu Ile Lys Gly Gly Lys Pro Leu Glu Met Ala His Lys Ile Lys
580 585 590
Thr Val Met Phe Asp Lys Thr Gly Thr Ile Thr His Gly Val Pro Arg
595 600 605
Val Met Arg Val Leu Leu Leu Gly Asp Val Ala Thr Leu Pro Leu Arg
610 615 620
Lys Val Leu Ala Val Val Gly Thr Ala Glu Ala Ser Ser Glu His Pro
625 630 635 640
Leu Gly Val Ala Val Thr Lys Tyr Cys Lys Glu Glu Leu Gly Thr Glu
645 650 655
Thr Leu Gly Tyr Cys Thr Asp Phe Gln Ala Val Pro Gly Cys Gly Ile
660 665 670
Gly Cys Lys Val Ser Asn Val Glu Gly Ile Leu Ala His Ser Glu Arg
675 680 685
Pro Leu Ser Ala Pro Ala Ser His Leu Asn Glu Ala Gly Ser Leu Pro
690 695 700
Ala Glu Lys Asp Ala Val Pro Gln Thr Phe Ser Val Leu Ile Gly Asn
705 710 715 720
Arg Glu Trp Leu Arg Arg Asn Gly Leu Thr Ile Ser Ser Asp Val Ser
725 730 735
Asp Ala Met Thr Asp His Glu Met Lys Gly Gln Thr Ala Ile Leu Val
740 745 750
Ala Ile Asp Gly Val Leu Cys Gly Met Ile Ala Ile Ala Asp Ala Val
755 760 765
Lys Gln Glu Ala Ala Leu Ala Val His Thr Leu Gln Ser Met Gly Val
770 775 780
Asp Val Val Leu Ile Thr Gly Asp Asn Arg Lys Thr Ala Arg Ala Ile
785 790 795 800
Ala Thr Gln Val Gly Ile Asn Lys Val Phe Ala Glu Val Leu Pro Ser
805 810 815
His Lys Val Ala Lys Val Gln Glu Leu Gln Asn Lys Gly Lys Lys Val
820 825 830
Ala Met Val Gly Asp Gly Val Asn Asp Ser Pro Ala Leu Ala Gln Ala
835 840 845
Asp Met Gly Val Ala Ile Gly Thr Gly Thr Asp Val Ala Ile Glu Ala
850 855 860
Ala Asp Val Val Leu Ile Arg Asn Asp Leu Leu Asp Val Val Ala Ser
865 870 875 880
Ile His Leu Ser Lys Arg Thr Val Arg Arg Ile Arg Ile Asn Leu Val
885 890 895
Leu Ala Leu Ile Tyr Asn Leu Val Gly Ile Pro Ile Ala Ala Gly Val
900 905 910
Phe Met Pro Ile Gly Ile Val Leu Gln Pro Trp Met Gly Ser Ala Ala
915 920 925
Met Ala Ala Ser Ser Val Ser Val Val Leu Ser Ser Leu Gln Leu Lys
930 935 940
Cys Tyr Lys Lys Pro Asp Leu Glu Arg Tyr Glu Ala Gln Ala His Gly
945 950 955 960
His Met Lys Pro Leu Thr Ala Ser Gln Val Ser Val His Ile Gly Met
965 970 975
Asp Asp Arg Trp Arg Asp Ser Pro Arg Ala Thr Pro Trp Asp Gln Val
980 985 990
Ser Tyr Val Ser Gln Val Ser Leu Ser Ser Leu Thr Ser Asp Lys Pro
995 1000 1005
Ser Arg His Ser Ala Ala Ala Asp Asp Asp Gly Asp Lys Trp Ser Leu
1010 1015 1020
Leu Leu Asn Gly Arg Asp Glu Glu Gln Tyr Ile
1025 1030 1035
<210> 10
<211> 36
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Праймер AAT-прямой
<400> 10
ctggtctaga acgcgtcgcc accccctcca ccttgg 36
<210> 11
<211> 36
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Праймер AAT-обратный
<400> 11
atcatgatgc ggccgcttca ctgtcccagg tcagtg 36
<210> 12
<211> 3966
<212> ДНК
<213> Искусственная последовательность
<220>
<223> последовательность, кодирующая укороченный ATP7B(d223-366), которая кодирует ATP7B, с делецией аминокислот 223..366
<220>
<221> CDS
<222> 1..3966
<223> /таблица трансляции=1
<400> 12
atg cct gag cag gag aga cag atc aca gcc aga gaa ggg gcc agt cgg 48
Met Pro Glu Gln Glu Arg Gln Ile Thr Ala Arg Glu Gly Ala Ser Arg
1 5 10 15
aaa atc tta tct aag ctt tct ttg cct acc cgt gcc tgg gaa cca gca 96
Lys Ile Leu Ser Lys Leu Ser Leu Pro Thr Arg Ala Trp Glu Pro Ala
20 25 30
atg aag aag agt ttt gct ttt gac aat gtt ggc tat gaa ggt ggt ctg 144
Met Lys Lys Ser Phe Ala Phe Asp Asn Val Gly Tyr Glu Gly Gly Leu
35 40 45
gat ggc ctg ggc cct tct tct cag gtg gcc acc agc aca gtc agg atc 192
Asp Gly Leu Gly Pro Ser Ser Gln Val Ala Thr Ser Thr Val Arg Ile
50 55 60
ttg ggc atg act tgc cag tca tgt gtg aag tcc att gag gac agg att 240
Leu Gly Met Thr Cys Gln Ser Cys Val Lys Ser Ile Glu Asp Arg Ile
65 70 75 80
tcc aat ttg aaa ggc atc atc agc atg aag gtt tcc ctg gaa caa ggc 288
Ser Asn Leu Lys Gly Ile Ile Ser Met Lys Val Ser Leu Glu Gln Gly
85 90 95
agt gcc act gtg aaa tat gtg cca tcg gtt gtg tgc ctg caa cag gtt 336
Ser Ala Thr Val Lys Tyr Val Pro Ser Val Val Cys Leu Gln Gln Val
100 105 110
tgc cat caa att ggg gac atg ggc ttc gag gcc agc att gca gaa gga 384
Cys His Gln Ile Gly Asp Met Gly Phe Glu Ala Ser Ile Ala Glu Gly
115 120 125
aag gca gcc tcc tgg ccc tca agg tcc ttg cct gcc cag gag gct gtg 432
Lys Ala Ala Ser Trp Pro Ser Arg Ser Leu Pro Ala Gln Glu Ala Val
130 135 140
gtc aag ctc cgg gtg gag ggc atg acc tgc cag tcc tgt gtc agc tcc 480
Val Lys Leu Arg Val Glu Gly Met Thr Cys Gln Ser Cys Val Ser Ser
145 150 155 160
att gaa ggc aag gtc cgg aaa ctg caa gga gta gtg aga gtc aaa gtc 528
Ile Glu Gly Lys Val Arg Lys Leu Gln Gly Val Val Arg Val Lys Val
165 170 175
tca ctc agc aac caa gag gcc gtc atc act tat cag cct tat ctc att 576
Ser Leu Ser Asn Gln Glu Ala Val Ile Thr Tyr Gln Pro Tyr Leu Ile
180 185 190
cag ccc gaa gac ctc agg gac cat gta aat gac atg gga ttt gaa gct 624
Gln Pro Glu Asp Leu Arg Asp His Val Asn Asp Met Gly Phe Glu Ala
195 200 205
gcc atc aag agc aaa gtg gct ccc tta agc ctg gga cca att ggc atg 672
Ala Ile Lys Ser Lys Val Ala Pro Leu Ser Leu Gly Pro Ile Gly Met
210 215 220
acc tgt gca tcc tgt gtc cat tcc att gaa ggc atg atc tcc caa ctg 720
Thr Cys Ala Ser Cys Val His Ser Ile Glu Gly Met Ile Ser Gln Leu
225 230 235 240
gaa ggg gtg cag caa ata tcg gtg tct ttg gcc gaa ggg act gca aca 768
Glu Gly Val Gln Gln Ile Ser Val Ser Leu Ala Glu Gly Thr Ala Thr
245 250 255
gtt ctt tat aat ccc tct gta att agc cca gaa gaa ctc aga gct gct 816
Val Leu Tyr Asn Pro Ser Val Ile Ser Pro Glu Glu Leu Arg Ala Ala
260 265 270
ata gaa gac atg gga ttt gag gct tca gtc gtt tct gaa agc tgt tct 864
Ile Glu Asp Met Gly Phe Glu Ala Ser Val Val Ser Glu Ser Cys Ser
275 280 285
act aac cct ctt gga aac cac agt gct ggg aat tcc atg gtg caa act 912
Thr Asn Pro Leu Gly Asn His Ser Ala Gly Asn Ser Met Val Gln Thr
290 295 300
aca gat ggt aca cct aca tct gtg cag gaa gtg gct ccc cac act ggg 960
Thr Asp Gly Thr Pro Thr Ser Val Gln Glu Val Ala Pro His Thr Gly
305 310 315 320
agg ctc cct gca aac cat gcc ccg gac atc ttg gca aag tcc cca caa 1008
Arg Leu Pro Ala Asn His Ala Pro Asp Ile Leu Ala Lys Ser Pro Gln
325 330 335
tca acc aga gca gtg gca ccg cag aag tgc ttc tta cag atc aaa ggc 1056
Ser Thr Arg Ala Val Ala Pro Gln Lys Cys Phe Leu Gln Ile Lys Gly
340 345 350
atg acc tgt gca tcc tgt gtg tct aac ata gaa agg aat ctg cag aaa 1104
Met Thr Cys Ala Ser Cys Val Ser Asn Ile Glu Arg Asn Leu Gln Lys
355 360 365
gaa gct ggt gtt ctc tcc gtg ttg gtt gcc ttg atg gca gga aag gca 1152
Glu Ala Gly Val Leu Ser Val Leu Val Ala Leu Met Ala Gly Lys Ala
370 375 380
gag atc aag tat gac cca gag gtc atc cag ccc ctc gag ata gct cag 1200
Glu Ile Lys Tyr Asp Pro Glu Val Ile Gln Pro Leu Glu Ile Ala Gln
385 390 395 400
ttc atc cag gac ctg ggt ttt gag gca gca gtc atg gag gac tac gca 1248
Phe Ile Gln Asp Leu Gly Phe Glu Ala Ala Val Met Glu Asp Tyr Ala
405 410 415
ggc tcc gat ggc aac att gag ctg aca atc aca ggg atg acc tgc gcg 1296
Gly Ser Asp Gly Asn Ile Glu Leu Thr Ile Thr Gly Met Thr Cys Ala
420 425 430
tcc tgt gtc cac aac ata gag tcc aaa ctc acg agg aca aat ggc atc 1344
Ser Cys Val His Asn Ile Glu Ser Lys Leu Thr Arg Thr Asn Gly Ile
435 440 445
act tat gcc tcc gtt gcc ctt gcc acc agc aaa gcc ctt gtt aag ttt 1392
Thr Tyr Ala Ser Val Ala Leu Ala Thr Ser Lys Ala Leu Val Lys Phe
450 455 460
gac ccg gaa att atc ggt cca cgg gat att atc aaa att att gag gaa 1440
Asp Pro Glu Ile Ile Gly Pro Arg Asp Ile Ile Lys Ile Ile Glu Glu
465 470 475 480
att ggc ttt cat gct tcc ctg gcc cag aga aac ccc aac gct cat cac 1488
Ile Gly Phe His Ala Ser Leu Ala Gln Arg Asn Pro Asn Ala His His
485 490 495
ttg gac cac aag atg gaa ata aag cag tgg aag aag tct ttc ctg tgc 1536
Leu Asp His Lys Met Glu Ile Lys Gln Trp Lys Lys Ser Phe Leu Cys
500 505 510
agc ctg gtg ttt ggc atc cct gtc atg gcc tta atg atc tat atg ctg 1584
Ser Leu Val Phe Gly Ile Pro Val Met Ala Leu Met Ile Tyr Met Leu
515 520 525
ata ccc agc aac gag ccc cac cag tcc atg gtc ctg gac cac aac atc 1632
Ile Pro Ser Asn Glu Pro His Gln Ser Met Val Leu Asp His Asn Ile
530 535 540
att cca gga ctg tcc att cta aat ctc atc ttc ttt atc ttg tgt acc 1680
Ile Pro Gly Leu Ser Ile Leu Asn Leu Ile Phe Phe Ile Leu Cys Thr
545 550 555 560
ttt gtc cag ctc ctc ggt ggg tgg tac ttc tac gtt cag gcc tac aaa 1728
Phe Val Gln Leu Leu Gly Gly Trp Tyr Phe Tyr Val Gln Ala Tyr Lys
565 570 575
tct ctg aga cac agg tca gcc aac atg gac gtg ctc atc gtc ctg gcc 1776
Ser Leu Arg His Arg Ser Ala Asn Met Asp Val Leu Ile Val Leu Ala
580 585 590
aca agc att gct tat gtt tat tct ctg gtc atc ctg gtg gtt gct gtg 1824
Thr Ser Ile Ala Tyr Val Tyr Ser Leu Val Ile Leu Val Val Ala Val
595 600 605
gct gag aag gcg gag agg agc cct gtg aca ttc ttc gac acg ccc ccc 1872
Ala Glu Lys Ala Glu Arg Ser Pro Val Thr Phe Phe Asp Thr Pro Pro
610 615 620
atg ctc ttt gtg ttc att gcc ctg ggc cgg tgg ctg gaa cac ttg gca 1920
Met Leu Phe Val Phe Ile Ala Leu Gly Arg Trp Leu Glu His Leu Ala
625 630 635 640
aag agc aaa acc tca gaa gcc ctg gct aaa ctc atg tct ctc caa gcc 1968
Lys Ser Lys Thr Ser Glu Ala Leu Ala Lys Leu Met Ser Leu Gln Ala
645 650 655
aca gaa gcc acc gtt gtg acc ctt ggt gag gac aat tta atc atc agg 2016
Thr Glu Ala Thr Val Val Thr Leu Gly Glu Asp Asn Leu Ile Ile Arg
660 665 670
gag gag caa gtc ccc atg gag ctg gtg cag cgg ggc gat atc gtc aag 2064
Glu Glu Gln Val Pro Met Glu Leu Val Gln Arg Gly Asp Ile Val Lys
675 680 685
gtg gtc cct ggg gga aag ttt cca gtg gat ggg aaa gtc ctg gaa ggc 2112
Val Val Pro Gly Gly Lys Phe Pro Val Asp Gly Lys Val Leu Glu Gly
690 695 700
aat acc atg gct gat gag tcc ctc atc aca gga gaa gcc atg cca gtc 2160
Asn Thr Met Ala Asp Glu Ser Leu Ile Thr Gly Glu Ala Met Pro Val
705 710 715 720
act aag aaa ccc gga agc act gta att gcg ggg tct ata aat gca cat 2208
Thr Lys Lys Pro Gly Ser Thr Val Ile Ala Gly Ser Ile Asn Ala His
725 730 735
ggc tct gtg ctc att aaa gct acc cac gtg ggc aat gac acc act ttg 2256
Gly Ser Val Leu Ile Lys Ala Thr His Val Gly Asn Asp Thr Thr Leu
740 745 750
gct cag att gtg aaa ctg gtg gaa gag gct cag atg tca aag gca ccc 2304
Ala Gln Ile Val Lys Leu Val Glu Glu Ala Gln Met Ser Lys Ala Pro
755 760 765
att cag cag ctg gct gac cgg ttt agt gga tat ttt gtc cca ttt atc 2352
Ile Gln Gln Leu Ala Asp Arg Phe Ser Gly Tyr Phe Val Pro Phe Ile
770 775 780
atc atc atg tca act ttg acg ttg gtg gta tgg att gta atc ggt ttt 2400
Ile Ile Met Ser Thr Leu Thr Leu Val Val Trp Ile Val Ile Gly Phe
785 790 795 800
atc gat ttt ggt gtt gtt cag aga tac ttt cct aac ccc aac aag cac 2448
Ile Asp Phe Gly Val Val Gln Arg Tyr Phe Pro Asn Pro Asn Lys His
805 810 815
atc tcc cag aca gag gtg atc atc cgg ttt gct ttc cag acg tcc atc 2496
Ile Ser Gln Thr Glu Val Ile Ile Arg Phe Ala Phe Gln Thr Ser Ile
820 825 830
acg gtg ctg tgc att gcc tgc ccc tgc tcc ctg ggg ctg gcc acg ccc 2544
Thr Val Leu Cys Ile Ala Cys Pro Cys Ser Leu Gly Leu Ala Thr Pro
835 840 845
acg gct gtc atg gtg ggc acc ggg gtg gcc gcg cag aac ggc atc ctc 2592
Thr Ala Val Met Val Gly Thr Gly Val Ala Ala Gln Asn Gly Ile Leu
850 855 860
atc aag gga ggc aag ccc ctg gag atg gcg cac aag ata aag act gtg 2640
Ile Lys Gly Gly Lys Pro Leu Glu Met Ala His Lys Ile Lys Thr Val
865 870 875 880
atg ttt gac aag act ggc acc att acc cat ggc gtc ccc agg gtc atg 2688
Met Phe Asp Lys Thr Gly Thr Ile Thr His Gly Val Pro Arg Val Met
885 890 895
cgg gtg ctc ctg ctg ggg gat gtg gcc aca ctg ccc ctc agg aag gtt 2736
Arg Val Leu Leu Leu Gly Asp Val Ala Thr Leu Pro Leu Arg Lys Val
900 905 910
ctg gct gtg gtg ggg act gcg gag gcc agc agt gaa cac ccc ttg ggc 2784
Leu Ala Val Val Gly Thr Ala Glu Ala Ser Ser Glu His Pro Leu Gly
915 920 925
gtg gca gtc acc aaa tac tgt aaa gag gaa ctt gga aca gag acc ttg 2832
Val Ala Val Thr Lys Tyr Cys Lys Glu Glu Leu Gly Thr Glu Thr Leu
930 935 940
gga tac tgc acg gac ttc cag gca gtg cca ggc tgt gga att ggg tgc 2880
Gly Tyr Cys Thr Asp Phe Gln Ala Val Pro Gly Cys Gly Ile Gly Cys
945 950 955 960
aaa gtc agc aac gtg gaa ggc atc ctg gcc cac agt gag cgc cct ttg 2928
Lys Val Ser Asn Val Glu Gly Ile Leu Ala His Ser Glu Arg Pro Leu
965 970 975
agt gca ccg gcc agt cac ctg aat gag gct ggc agc ctt ccc gca gaa 2976
Ser Ala Pro Ala Ser His Leu Asn Glu Ala Gly Ser Leu Pro Ala Glu
980 985 990
aaa gat gca gtc ccc cag acc ttc tct gtg ctg att gga aac cgt gag 3024
Lys Asp Ala Val Pro Gln Thr Phe Ser Val Leu Ile Gly Asn Arg Glu
995 1000 1005
tgg ctg agg cgc aac ggt tta acc att tct agc gat gtc agt gac gct 3072
Trp Leu Arg Arg Asn Gly Leu Thr Ile Ser Ser Asp Val Ser Asp Ala
1010 1015 1020
atg aca gac cac gag atg aaa gga cag aca gcc atc ctg gtg gct att 3120
Met Thr Asp His Glu Met Lys Gly Gln Thr Ala Ile Leu Val Ala Ile
1025 1030 1035 1040
gac ggt gtg ctc tgt ggg atg atc gca atc gca gac gct gtc aag cag 3168
Asp Gly Val Leu Cys Gly Met Ile Ala Ile Ala Asp Ala Val Lys Gln
1045 1050 1055
gag gct gcc ctg gct gtg cac acg ctg cag agc atg ggt gtg gac gtg 3216
Glu Ala Ala Leu Ala Val His Thr Leu Gln Ser Met Gly Val Asp Val
1060 1065 1070
gtt ctg atc acg ggg gac aac cgg aag aca gcc aga gct att gcc acc 3264
Val Leu Ile Thr Gly Asp Asn Arg Lys Thr Ala Arg Ala Ile Ala Thr
1075 1080 1085
cag gtt ggc atc aac aaa gtc ttt gca gag gtg ctg cct tcg cac aag 3312
Gln Val Gly Ile Asn Lys Val Phe Ala Glu Val Leu Pro Ser His Lys
1090 1095 1100
gtg gcc aag gtc cag gag ctc cag aat aaa ggg aag aaa gtc gcc atg 3360
Val Ala Lys Val Gln Glu Leu Gln Asn Lys Gly Lys Lys Val Ala Met
1105 1110 1115 1120
gtg ggg gat ggg gtc aat gac tcc ccg gcc ttg gcc cag gca gac atg 3408
Val Gly Asp Gly Val Asn Asp Ser Pro Ala Leu Ala Gln Ala Asp Met
1125 1130 1135
ggt gtg gcc att ggc acc ggc acg gat gtg gcc atc gag gca gcc gac 3456
Gly Val Ala Ile Gly Thr Gly Thr Asp Val Ala Ile Glu Ala Ala Asp
1140 1145 1150
gtc gtc ctt atc aga aat gat ttg ctg gat gtg gtg gct agc att cac 3504
Val Val Leu Ile Arg Asn Asp Leu Leu Asp Val Val Ala Ser Ile His
1155 1160 1165
ctt tcc aag agg act gtc cga agg ata cgc atc aac ctg gtc ctg gca 3552
Leu Ser Lys Arg Thr Val Arg Arg Ile Arg Ile Asn Leu Val Leu Ala
1170 1175 1180
ctg att tat aac ctg gtt ggg ata ccc att gca gca ggt gtc ttc atg 3600
Leu Ile Tyr Asn Leu Val Gly Ile Pro Ile Ala Ala Gly Val Phe Met
1185 1190 1195 1200
ccc atc ggc att gtg ctg cag ccc tgg atg ggc tca gcg gcc atg gca 3648
Pro Ile Gly Ile Val Leu Gln Pro Trp Met Gly Ser Ala Ala Met Ala
1205 1210 1215
gcc tcc tct gtg tct gtg gtg ctc tca tcc ctg cag ctc aag tgc tat 3696
Ala Ser Ser Val Ser Val Val Leu Ser Ser Leu Gln Leu Lys Cys Tyr
1220 1225 1230
aag aag cct gac ctg gag agg tat gag gca cag gcg cat ggc cac atg 3744
Lys Lys Pro Asp Leu Glu Arg Tyr Glu Ala Gln Ala His Gly His Met
1235 1240 1245
aag ccc ctg acg gca tcc cag gtc agt gtg cac ata ggc atg gat gac 3792
Lys Pro Leu Thr Ala Ser Gln Val Ser Val His Ile Gly Met Asp Asp
1250 1255 1260
agg tgg cgg gac tcc ccc agg gcc aca cca tgg gac cag gtc agc tat 3840
Arg Trp Arg Asp Ser Pro Arg Ala Thr Pro Trp Asp Gln Val Ser Tyr
1265 1270 1275 1280
gtc agc cag gtg tcg ctg tcc tcc ctg acg tcc gac aag cca tct cgg 3888
Val Ser Gln Val Ser Leu Ser Ser Leu Thr Ser Asp Lys Pro Ser Arg
1285 1290 1295
cac agc gct gca gca gac gat gat ggg gac aag tgg tct ctg ctc ctg 3936
His Ser Ala Ala Ala Asp Asp Asp Gly Asp Lys Trp Ser Leu Leu Leu
1300 1305 1310
aat ggc agg gat gag gag cag tac atc tga 3966
Asn Gly Arg Asp Glu Glu Gln Tyr Ile
1315 1320
<210> 13
<211> 1321
<212> Белок
<213> Искусственная последовательность
<220>
<223> [CDS]:1..3966 из SEQ ID NO 12
<400> 13
Met Pro Glu Gln Glu Arg Gln Ile Thr Ala Arg Glu Gly Ala Ser Arg
1 5 10 15
Lys Ile Leu Ser Lys Leu Ser Leu Pro Thr Arg Ala Trp Glu Pro Ala
20 25 30
Met Lys Lys Ser Phe Ala Phe Asp Asn Val Gly Tyr Glu Gly Gly Leu
35 40 45
Asp Gly Leu Gly Pro Ser Ser Gln Val Ala Thr Ser Thr Val Arg Ile
50 55 60
Leu Gly Met Thr Cys Gln Ser Cys Val Lys Ser Ile Glu Asp Arg Ile
65 70 75 80
Ser Asn Leu Lys Gly Ile Ile Ser Met Lys Val Ser Leu Glu Gln Gly
85 90 95
Ser Ala Thr Val Lys Tyr Val Pro Ser Val Val Cys Leu Gln Gln Val
100 105 110
Cys His Gln Ile Gly Asp Met Gly Phe Glu Ala Ser Ile Ala Glu Gly
115 120 125
Lys Ala Ala Ser Trp Pro Ser Arg Ser Leu Pro Ala Gln Glu Ala Val
130 135 140
Val Lys Leu Arg Val Glu Gly Met Thr Cys Gln Ser Cys Val Ser Ser
145 150 155 160
Ile Glu Gly Lys Val Arg Lys Leu Gln Gly Val Val Arg Val Lys Val
165 170 175
Ser Leu Ser Asn Gln Glu Ala Val Ile Thr Tyr Gln Pro Tyr Leu Ile
180 185 190
Gln Pro Glu Asp Leu Arg Asp His Val Asn Asp Met Gly Phe Glu Ala
195 200 205
Ala Ile Lys Ser Lys Val Ala Pro Leu Ser Leu Gly Pro Ile Gly Met
210 215 220
Thr Cys Ala Ser Cys Val His Ser Ile Glu Gly Met Ile Ser Gln Leu
225 230 235 240
Glu Gly Val Gln Gln Ile Ser Val Ser Leu Ala Glu Gly Thr Ala Thr
245 250 255
Val Leu Tyr Asn Pro Ser Val Ile Ser Pro Glu Glu Leu Arg Ala Ala
260 265 270
Ile Glu Asp Met Gly Phe Glu Ala Ser Val Val Ser Glu Ser Cys Ser
275 280 285
Thr Asn Pro Leu Gly Asn His Ser Ala Gly Asn Ser Met Val Gln Thr
290 295 300
Thr Asp Gly Thr Pro Thr Ser Val Gln Glu Val Ala Pro His Thr Gly
305 310 315 320
Arg Leu Pro Ala Asn His Ala Pro Asp Ile Leu Ala Lys Ser Pro Gln
325 330 335
Ser Thr Arg Ala Val Ala Pro Gln Lys Cys Phe Leu Gln Ile Lys Gly
340 345 350
Met Thr Cys Ala Ser Cys Val Ser Asn Ile Glu Arg Asn Leu Gln Lys
355 360 365
Glu Ala Gly Val Leu Ser Val Leu Val Ala Leu Met Ala Gly Lys Ala
370 375 380
Glu Ile Lys Tyr Asp Pro Glu Val Ile Gln Pro Leu Glu Ile Ala Gln
385 390 395 400
Phe Ile Gln Asp Leu Gly Phe Glu Ala Ala Val Met Glu Asp Tyr Ala
405 410 415
Gly Ser Asp Gly Asn Ile Glu Leu Thr Ile Thr Gly Met Thr Cys Ala
420 425 430
Ser Cys Val His Asn Ile Glu Ser Lys Leu Thr Arg Thr Asn Gly Ile
435 440 445
Thr Tyr Ala Ser Val Ala Leu Ala Thr Ser Lys Ala Leu Val Lys Phe
450 455 460
Asp Pro Glu Ile Ile Gly Pro Arg Asp Ile Ile Lys Ile Ile Glu Glu
465 470 475 480
Ile Gly Phe His Ala Ser Leu Ala Gln Arg Asn Pro Asn Ala His His
485 490 495
Leu Asp His Lys Met Glu Ile Lys Gln Trp Lys Lys Ser Phe Leu Cys
500 505 510
Ser Leu Val Phe Gly Ile Pro Val Met Ala Leu Met Ile Tyr Met Leu
515 520 525
Ile Pro Ser Asn Glu Pro His Gln Ser Met Val Leu Asp His Asn Ile
530 535 540
Ile Pro Gly Leu Ser Ile Leu Asn Leu Ile Phe Phe Ile Leu Cys Thr
545 550 555 560
Phe Val Gln Leu Leu Gly Gly Trp Tyr Phe Tyr Val Gln Ala Tyr Lys
565 570 575
Ser Leu Arg His Arg Ser Ala Asn Met Asp Val Leu Ile Val Leu Ala
580 585 590
Thr Ser Ile Ala Tyr Val Tyr Ser Leu Val Ile Leu Val Val Ala Val
595 600 605
Ala Glu Lys Ala Glu Arg Ser Pro Val Thr Phe Phe Asp Thr Pro Pro
610 615 620
Met Leu Phe Val Phe Ile Ala Leu Gly Arg Trp Leu Glu His Leu Ala
625 630 635 640
Lys Ser Lys Thr Ser Glu Ala Leu Ala Lys Leu Met Ser Leu Gln Ala
645 650 655
Thr Glu Ala Thr Val Val Thr Leu Gly Glu Asp Asn Leu Ile Ile Arg
660 665 670
Glu Glu Gln Val Pro Met Glu Leu Val Gln Arg Gly Asp Ile Val Lys
675 680 685
Val Val Pro Gly Gly Lys Phe Pro Val Asp Gly Lys Val Leu Glu Gly
690 695 700
Asn Thr Met Ala Asp Glu Ser Leu Ile Thr Gly Glu Ala Met Pro Val
705 710 715 720
Thr Lys Lys Pro Gly Ser Thr Val Ile Ala Gly Ser Ile Asn Ala His
725 730 735
Gly Ser Val Leu Ile Lys Ala Thr His Val Gly Asn Asp Thr Thr Leu
740 745 750
Ala Gln Ile Val Lys Leu Val Glu Glu Ala Gln Met Ser Lys Ala Pro
755 760 765
Ile Gln Gln Leu Ala Asp Arg Phe Ser Gly Tyr Phe Val Pro Phe Ile
770 775 780
Ile Ile Met Ser Thr Leu Thr Leu Val Val Trp Ile Val Ile Gly Phe
785 790 795 800
Ile Asp Phe Gly Val Val Gln Arg Tyr Phe Pro Asn Pro Asn Lys His
805 810 815
Ile Ser Gln Thr Glu Val Ile Ile Arg Phe Ala Phe Gln Thr Ser Ile
820 825 830
Thr Val Leu Cys Ile Ala Cys Pro Cys Ser Leu Gly Leu Ala Thr Pro
835 840 845
Thr Ala Val Met Val Gly Thr Gly Val Ala Ala Gln Asn Gly Ile Leu
850 855 860
Ile Lys Gly Gly Lys Pro Leu Glu Met Ala His Lys Ile Lys Thr Val
865 870 875 880
Met Phe Asp Lys Thr Gly Thr Ile Thr His Gly Val Pro Arg Val Met
885 890 895
Arg Val Leu Leu Leu Gly Asp Val Ala Thr Leu Pro Leu Arg Lys Val
900 905 910
Leu Ala Val Val Gly Thr Ala Glu Ala Ser Ser Glu His Pro Leu Gly
915 920 925
Val Ala Val Thr Lys Tyr Cys Lys Glu Glu Leu Gly Thr Glu Thr Leu
930 935 940
Gly Tyr Cys Thr Asp Phe Gln Ala Val Pro Gly Cys Gly Ile Gly Cys
945 950 955 960
Lys Val Ser Asn Val Glu Gly Ile Leu Ala His Ser Glu Arg Pro Leu
965 970 975
Ser Ala Pro Ala Ser His Leu Asn Glu Ala Gly Ser Leu Pro Ala Glu
980 985 990
Lys Asp Ala Val Pro Gln Thr Phe Ser Val Leu Ile Gly Asn Arg Glu
995 1000 1005
Trp Leu Arg Arg Asn Gly Leu Thr Ile Ser Ser Asp Val Ser Asp Ala
1010 1015 1020
Met Thr Asp His Glu Met Lys Gly Gln Thr Ala Ile Leu Val Ala Ile
1025 1030 1035 1040
Asp Gly Val Leu Cys Gly Met Ile Ala Ile Ala Asp Ala Val Lys Gln
1045 1050 1055
Glu Ala Ala Leu Ala Val His Thr Leu Gln Ser Met Gly Val Asp Val
1060 1065 1070
Val Leu Ile Thr Gly Asp Asn Arg Lys Thr Ala Arg Ala Ile Ala Thr
1075 1080 1085
Gln Val Gly Ile Asn Lys Val Phe Ala Glu Val Leu Pro Ser His Lys
1090 1095 1100
Val Ala Lys Val Gln Glu Leu Gln Asn Lys Gly Lys Lys Val Ala Met
1105 1110 1115 1120
Val Gly Asp Gly Val Asn Asp Ser Pro Ala Leu Ala Gln Ala Asp Met
1125 1130 1135
Gly Val Ala Ile Gly Thr Gly Thr Asp Val Ala Ile Glu Ala Ala Asp
1140 1145 1150
Val Val Leu Ile Arg Asn Asp Leu Leu Asp Val Val Ala Ser Ile His
1155 1160 1165
Leu Ser Lys Arg Thr Val Arg Arg Ile Arg Ile Asn Leu Val Leu Ala
1170 1175 1180
Leu Ile Tyr Asn Leu Val Gly Ile Pro Ile Ala Ala Gly Val Phe Met
1185 1190 1195 1200
Pro Ile Gly Ile Val Leu Gln Pro Trp Met Gly Ser Ala Ala Met Ala
1205 1210 1215
Ala Ser Ser Val Ser Val Val Leu Ser Ser Leu Gln Leu Lys Cys Tyr
1220 1225 1230
Lys Lys Pro Asp Leu Glu Arg Tyr Glu Ala Gln Ala His Gly His Met
1235 1240 1245
Lys Pro Leu Thr Ala Ser Gln Val Ser Val His Ile Gly Met Asp Asp
1250 1255 1260
Arg Trp Arg Asp Ser Pro Arg Ala Thr Pro Trp Asp Gln Val Ser Tyr
1265 1270 1275 1280
Val Ser Gln Val Ser Leu Ser Ser Leu Thr Ser Asp Lys Pro Ser Arg
1285 1290 1295
His Ser Ala Ala Ala Asp Asp Asp Gly Asp Lys Trp Ser Leu Leu Leu
1300 1305 1310
Asn Gly Arg Asp Glu Glu Gln Tyr Ile
1315 1320
<210> 14
<211> 25
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Праймер F1
<400> 14
ctagatgcgg ccgccaccat gcctg 25
<210> 15
<211> 21
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Праймер R1
<400> 15
ctgagaagaa gggcccaggc c 21
<210> 16
<211> 36
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Праймер F2
<400> 16
ggcccttctt ctcagccgca gaagtgcttc ttacag 36
<210> 17
<211> 29
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Праймер R2
<400> 17
accaaaatcg ataaaaccga ttacaatcc 29
<210> 18
<211> 25
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Праймер F3
<400> 18
acgcgtgcgg ccgccaccat gccag 25
<210> 19
<211> 21
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Праймер R3
<400> 19
ctgggagcta ggtcccagtc c 21
<210> 20
<211> 36
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Праймер F4
<400> 20
ggacctagct cccagcctca gaagtgtttt ctgcag 36
<210> 21
<211> 29
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Праймер R4
<400> 21
tgttcctcgc gaatgatcag gttgtcctc 29
<---
Реферат
Изобретение относится к области биотехнологии, а именно к конструкции нуклеиновой кислоты для генотерапии, которая содержит вариант ATP7B, в которой N-концевые участки HMA1, HMA2, HMA3 и HMA4 отсутствуют, а HMA5 и HMA6 присутствуют. Также раскрыты экспрессирующий вектор, клетка-хозяин, вирион, набор, фармацевтическая композиция и их применения для лечения состояния, вызванного недостаточностью или нарушением функции медь-транспортирующей АТФазы 2. Изобретение также относится к способу получения вириона и способу лечения состояния у пациента, вызванного недостаточностью или нарушением функции медь-транспортирующей АТФазы. Изобретение применяют для лечения состояний, ассоциированных с недостаточностью или нарушением функции медь-транспортирующей АТФазы 2, в частности для лечения болезни Вильсона. 11 н. и 17 з.п. ф-лы, 14 ил., 8 пр.

Комментарии