Генная терапия для рецессивного дистрофического буллезного эпидермолиза с использованием генетически корректированных аутологичных кератиноцитов - RU2753248C2
Код документа: RU2753248C2
Чертежи











Описание
Спонсируемые на федеральном уровне исследования и разработки
Данное изобретение разработано при государственной поддержке по контракту AR055914, предоставленному Национальными институтами здравоохранения. Правительство обладает определенными правами на изобретение.
Перекрестная ссылка на родственные заявки
Данная заявка заявляет приоритет в соответствии с ч. 35 Свода законов США (U.S.C.) 119 (e) по заявке США № 62/274700, поданной 04 января 2016 года; и заявке США № 62/414533, поданной 28 октября 2016 г., содержание каждой из которых включено в данный документ посредством ссылки.
Область техники
Данное описание, как правило, относится к способам и композициям для лечения буллезного эпидермолиза (БЭ) и эрозии роговицы.
Уровень техники
Рецессивный дистрофический буллезный эпидермолиз (РДБЭ) представляет собой наследственное генетическое пузырное заболевание кожи, вызванное мутациями в гене COL7A1 (коллаген VII, C7), что приводит к недостаточному функционированию C7. Пациенты с данным расстройством характеризуются широко распространенными пузырями и эрозиями кожи и тканей слизистой оболочки, включая ротоглотку, конъюнктиву, пищевод, а также дистальные стороны мочеполового и желудочно-кишечного тракта. Болезненные вздутия и эрозии являются основой нетрудоспособности; однако, рубцы от заживших ран также вызывают патологические осложнения, включая деформации кисти руки (псевдосиндактилия), симблефарон глаз, стриктуры пищевода, микростому, анкилоглоссию и деформации конечностей. Известно, что хроническое повреждение и рубцевание предрасполагают к появлению плоскоклеточной карциномы, и это представляет собой серьезную проблему при РДБЭ, при этом плоскоклеточная карцинома является основной причиной смерти у этой группы людей, начиная со второго десятилетия жизни. Поэтому оптимальной терапией для данного заболевания будет та, которую можно было бы внедрить на раннем этапе, чтобы предотвратить недостаточное рубцевание, а также предотвратить образование пузырей. Кроме того, способность к системной коррекции тканей кожи и слизистых оболочек была бы весьма желательной в терапевтическом подходе при РДБЭ.
Коллаген VII типа (C7) представляет собой большую гомотримерную тройную спиральную коллагеновую молекулу, которая подвергается формированию антипараллельного димера на своем NC2-конце, за которым следует супрамолекулярная сборка в крепящие структуры, называемые якорными фибриллами, которые соединяют темную пластинку базальной мембраны (БМ) с сосочковым слоем. C7 содержит большой домен NC1, который связывает ламинин-332 в темной пластинке, и коллагеновый домен, который обертывается вокруг интерстициальных коллагеновых фибрилл в сосочковом слое. Таким образом, недостаток C7 при РДБЭ вызывает образование пузырей между сосочковым слоем и темной пластинкой.
Несмотря на достижения в молекулярной диагностике данного заболевания, текущая терапия ограничивается паллиативной помощью. Хотя для замены C7 было предложено несколько подходов, все они имеют свои ограничения. При местном применении, rC7 не может проникать в неповрежденную кожу и ограничивается очагами повреждения. Интрадермальные инъекции белка rC7 для пациентов с РДБЭ представляют собой еще одну альтернативу; однако ограниченная диффузия при инъекции обычной иглой требует доставки rC7 набором микроиг, которая пока недоступна для клинического применения.
Для терапевтических целей желательна местная доставка С7 в кожу. Данное изобретение относится к этой проблеме. Системная терапия С7 может вызывать системную токсичность (См. Hou et al. (2015), Journal of Investigative Dermatology 135, 3060-3067).
Сущность изобретения
Композиции и способы предназначены для лечения буллезного эпидермолиза (БЭ) у человека. В способах лечения по изобретению, популяция кератиноцитов человека модифицирована для экспрессии C7 путем интеграции генетической конструкции, кодирующей дикий тип C7 человека. В некоторых вариантах реализации, уровень экспрессии больше, чем уровни экспрессии у нормального кератиноцита человека. В некотором варианте реализации, уровень экспрессии является меньшим, сходным или одинаковым с уровнем экспрессии нормального кератиноцита человека. В изобретение включена изолированная популяция кератиноцитов, модифицированных способами по изобретению, для экспрессии C7 дикого типа, которые могут предлагаться в составе фармацевтической единичной дозы. В некоторых вариантах реализации, субъект представляет собой человека, страдающего от генетического дефекта в C7, вызывающего буллезный эпидермолиз (БЭ). В вариантах реализации, генетический дефект представляет собой РДБЭ.
В некоторых вариантах реализации, кератиноциты, используемые в лечении, являются аутологичными кератиноцитами. Способы модифицирования ex vivo могут быть выбраны, без ограничений, на основе вирусов, включая, но не ограничиваясь ими, ретровирус (например, гаммаретровирус), AAV-вирус (аденоассоциированный вирус) и лентивирус или безвирусных комплексных способов, которые включают невирусные векторы, транспозоны, интеграцию мини-кольца, систему редактирования генома CRISPR/Cas9 и тому подобное. В некоторых вариантах реализации, гаммаретровирус включает, состоит по существу из или еще дополнительно состоит из вируса лейкемии мыши (MLV или MuLV), вируса лейкоза кошек (FeLV), вируса лейкоза гиббонов (GALV) и ксенотропного вируса мышиной лейкемии (XMRV). В некоторых вариантах реализации, невирусные векторы содержат, состоят по существу из или еще дополнительно состоят из эписомных векторов или интегрирующего вектора со способностью функций редактирования генома. В некоторых вариантах реализации, псевдотипированный GalV вирус LZRSE-COL7A1 стандарта GMP, содержащий функциональную кДНК COL7A1 под контролем MLTR LTR, используют для интеграции гена C7 в кератиноциты. В некоторых вариантах реализации, функциональная кДНК COL7A1 представляет собой полноразмерную кДНК человеческого COL7A1 дикого типа. В одном варианте реализации, функциональная кДНК COL7A1 включает генетическую модификацию из полноразмерной кДНК человеческого COL7A1 дикого типа. В некоторых вариантах реализации, вирусную трансдукцию выполняют путем покрытия вирусным супернатантом культуры клеток. В некоторых вариантах реализации, кератиноциты, обработанные таким образом, отвечают критериям до высвобождения по эффективности трасдукции вируса (VTE)> 50% и числу копии провирусного генома (PGCN) ≤ 3. В некоторых вариантах реализации, PGCN составляет более 3, 10, 20, 40 или 60. В некотором варианте реализации, PGCN составляет менее 2, 1,5, 1 или 0,5.
В некотором варианте реализации, эндогенный мутированный, дисфункциональный или усеченный ген С7 заменен с использованием системы CRISPR/Cas (или вектора, кодирующего указанную систему CRIPSR/Cas), как описано в данном документе, и «донорной» последовательности (например, функциональной кДНК COL7A1 или C7), которая вводится в ген после целевого расщепления.
В некоторых вариантах реализации изобретения, предлагается способ лечения БЭ, включающий, состоящий по существу, или еще дополнительно состоящий из получения популяции кератиноцитов от субъекта, страдающего БЭ, модификации кератиноцитов с помощью ретровирусной трансдукции для экспрессии человеческого С7 дикого типа и повторного введения кератиноцитов человеку. В некоторых вариантах реализации, кератиноциты кожи, полученные биопсией пунша, культивируют in vitro в среде для кератиноцитов с сывороткой или без нее. В некоторых вариантах реализации, кератиноциты культивируют в среде с или без фидерного слоя клеток. Эпидермис отделяют от дермального слоя, и кератиноциты получают из эпидермального слоя. По меньшей мере около 106 клеток, по меньшей мере около 2 × 106, и/или по меньшей мере 4×106 клеток используют для трансдукции, чтобы обеспечить популяцию генетически корректированных клеток. Клетки культивируют для получения слоя от примерно 25 см2 до примерно 100 см2 для пересадки. Генетически корректированные слои кератиноцитов помещают на неинфицированные, эродированные и/или рубцующиеся раневые участки, которые не имеют клинических проявлений плоскоклеточной карциномы (ПКК). Раневые участки могут составлять примерно около 50 см2, примерно около 100 см2 и/или примерно около 200 см2. В некоторых вариантах реализации для пересадки формируют раны. В некоторых таких вариантах реализации, рану подвергают электрокаутеризации для удаления остаточных некорректированных кератиноцитов из раневой поверхности. Трансплантат прикрепляют к раневым поверхностям через растворяемые швы после обработки раневой поверхности.
В другом варианте реализации, в описании предлагается композиция, включающая, по существу состоящая из или еще дополнительно состоящая из популяции кератиноцитов, генетически корректированных для экспрессии человеческого С7 дикого типа с дозой, эффективной для уменьшения симптомов БЭ и фармацевтически приемлемого носителя. В одном аспекте описания, композицию замораживают. В некоторых вариантах реализации, кератиноциты являются аутологичными по отношению к субъекту, выбранному для лечения.
В другом варианте реализации, в изобретении предлагается фармацевтическая композиция, содержащая, состоящая по существу из или еще дополнительно состоящая из слоя кератиноцитов, который содержит, по существу состоит, из или еще дополнительно состоит из клеток кожи, интегрированных ex vivo с генетической конструкцией, кодирующей функциональный белок COL7A1. В некоторых вариантах реализации, слой кератиноцитов помещают на биосконструированный эквивалент кожи. В некоторых вариантах реализации, слой кератиноцитов помещают на бесклеточный матрикс, коллагеновый матрикс, белок ВКМ или химический слой или биосовместимый волокнистый материал. В одном варианте реализации, бесклеточный матрикс изготовлен из дермы человека и/или животных. В некоторых вариантах реализации, биосовместимый волокнистый материал изготавливают из термопластичной смолы, полиэтилена, полиэтилена с ультравысокой молекулярной массой, полиолефина с высокой молекулярной массой, непокрытого моноволокна полипропилена, полиэфирэфиркетона, полиэтилентерефталата, политетрафторэтилена, вспененного политетрафторэтилена, нейлона, силикона или любой их комбинации.
В данном документе показано, что аутологичные кератиноциты РДБЭ выделяют из биопсий кожи и трансдуцируют с помощью ретровируса, несущего функциональный (например, полноразмерный) COL7A1 человека. Для каждого субъекта, изготавливали аутологичные эпидермальные слои (~ 35 см2) и пересаживали на подготовленные раневые поверхности. Результаты включали безопасность, эффективность в процентах от заживления ран по сравнению с исходным уровнем, а также подтверждение экспрессии C7 через 3 и 6 месяцев после трансплантации. Все трансплантаты хорошо переносились всеми субъектами, и никаких серьезных побочных эффектов не сообщалось (системная вирусная инфекция, аутоиммунитет, появление рака кожи в пределах трансплантатов). Через 3-6 месяцев большинство трансплантатов показали 75% заживления. Биопсии из мест трансплантатов показали устойчивую экспрессию C7 на дермально-эпидермальном соединении, через 3 месяца, и через 6 месяцев присутствовали нормальные якорные фибриллы. Передача гена COL7A1 ex-vivo имела благоприятный профиль безопасности и демонстрировала обнадеживающую эффективность у субъектов с унаследованным РДБЭ.
Краткое описание чертежей
Фиг. 1. (A) Блок-схема генетической коррекции РДБЭ. KЦ - эпидермальные кератиноциты, LEAES - модифицированные LZRSE-COL7A1 аутологичные трансплантаты эпидермального слоя. (B) Непрямая иммунофлуоресценция (НИФ) вируса LZRSE-COL7A1, трансдуцированного РДБЭ KЦ. Поликлональное анти-коллагеновое VII типа антитело (оранжевое); Хехст 33342, ядра (голубые). Масштаб, 100 мкм. (C) Количественная оценка эффективности трансдукции вируса (VTE) в корректированных KЦ 4 субъектов с РДБЭ. (D) Количественная оценка среднего числа копий провирусов (PGCN) в корректироваанных KЦ 4 субъектов с РДБЭ. (E) Клиническое проявление генетического заболевания РДБЭ до и после пересадки трансплантата. Обратите внимание на пузыри до корректированной пересадки кожи и на необработанные раны, по сравнению с 3 и 6 месяцами после LEAES-пересадки. (F) НИФ-анализ экспрессии коллагена VII типа в трансплантатах кожи. Анти-NC2 мкАТ LH24 и NC1 пкАТ FNC1 (зеленый) к коллагену VII типа; Хехст 33342, ядра (синие); обратите внимание на линейное зеленое окрашивание коллагена VII типа на дермально-эпидермальном соединении корректированных тканей трансплантатов. Масштаб, 100 мкм. (G) Иммунно-ЭМ анализ корректированных кожных трансплантатов при РДБЭ. Срезы тканей метили en bloc анти-NC2 Mab LH24 к коллагену VII типа, с последующим анти-мышиным IgM, конъюгированным с частицами золота (черные точки, обозначенные стрелками). Масштаб, 200 нм.
Фиг. 2. Схема распределения участников исследования, включенных в I стадию испытаний.
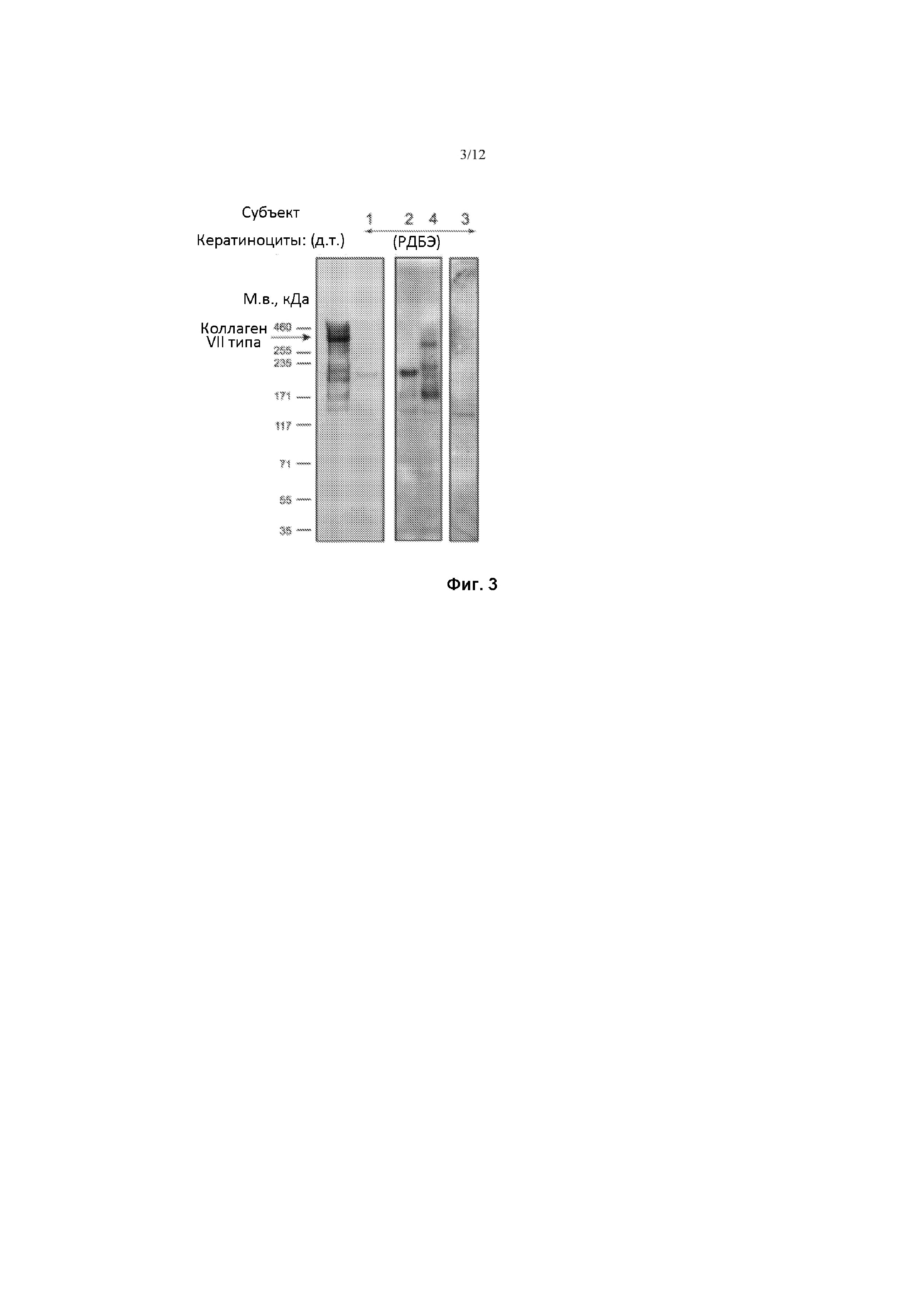
Фиг. 3. Вестерн-блот-анализ культивируемого супернатанта KЦ с использованием поликлонального анти-коллагенового VII типа антитела, специфического для домена NC1. Обратите внимание на усеченную экспрессию белка C7, содержащего домен NC1 у всех субъектов, включенных в исследование.
Фиг. 4. Показаны зрелые LEAES до сбора, синтезированные и готовые к пересадке LEAES.
Фиг. 5. (А) Клиническое проявление генетического заболевания РДБЭ до и после пересадки трансплантата. (B) НИФ-анализ экспрессии коллагена VII типа в трансплантатах кожи. Анти-NC2 мкАТ LH24 к коллагену VII типа (зеленый); Хехст 33342, ядра (синий); кератин 14 (анти-K14 пкАТ, оранжевый); кератин 1 (анти-K1 пкАТ, оранжевый) и лорикрин (анти-лорикриновые пкАТ, оранжевый). Обратите внимание на линейное зеленое окрашивание коллагена VII типа на дермально-эпидермальном переходе корректированных тканей трансплантатов во всех временных точках. Масштаб, 100 мкм.
Фиг. 6. Раны 2-го субъекта до и после пересадки. (А) Клиническое проявление генетического заболевания РДБЭ до и после пересадки трансплантата. (B) НИФ-анализ экспрессии коллагена VII типа в трансплантатах кожи. Анти-NC2 мкАТ LH24 к коллагену VII типа (зеленый); Хехст 33342, ядра (синий); кератин 14 (анти-K14 пкАТ, оранжевый); кератин 1 (анти-K1 пкАТ, оранжевый) и лорикрин (анти-лорикриновые пкАТ, оранжевый). Обратите внимание на линейное зеленое окрашивание коллагена VII типа на дермально-эпидермальном соединении корректированных тканей трансплантатов через 3 месяца. Масштаб, 100 мкм.
Фиг. 7. Раны 3-го субъекта до и после пересадки. (А) Клиническое проявление генетического заболевания РДБЭ до и после пересадки трансплантата. (B) НИФ-анализ экспрессии коллагена VII типа в трансплантатах кожи. Анти-NC2 мкАТ LH24 к коллагену VII типа (зеленый); Хехст 33342, ядра (синий); кератин 14 (анти-K14 пкАТ, оранжевый); кератин 1 (анти-K1 пкАТ, оранжевый) и лорикрин (анти-лорикриновые пкАТ, оранжевый). Обратите внимание на линейное зеленое окрашивание коллагена VII типа на дермально-эпидермальном переходе корректированных тканей трансплантатов во всех временных точках. Масштаб, 100 мкм.
Фиг. 8. Раны 4-го субъекта до и после пересадки. (А) Клиническое проявление генетического заболевания РДБЭ до и после пересадки трансплантата. (B) НИФ-анализ экспрессии коллагена VII типа в трансплантатах кожи. Анти-NC2 мкАТ LH24 к коллагену VII типа (зеленый); Хехст 33342, ядра (синий); кератин 14 (анти-K14 пкАТ, оранжевый); кератин 1 (анти-K1 пкАТ, оранжевый) и лорикрин (анти-лорикриновые пкАТ, оранжевый). Обратите внимание на линейное зеленое окрашивание коллагена VII типа на дермально-эпидермальном переходе корректированных тканей трансплантатов через 3 месяца с LH24 мкАТ и 6 месяцев с NC1 пкАТ. Масштаб, 100 мкм.
Фиг. 9. Характеристика анти-C7 LH24 моноклональных антител. Вестерн-блот-анализ ферментативно расщепленного C7, демонстрирующего перекрестную реактивность LH24 мкАТ к карбокси-концу пептида, содержащего домен NC2. Присутствие домена NC2 в расщепленной пепсином фракции C7 подтверждено NC2-специфическим пкАТ (NC2-10)5. Домен NC1 в расщепленной коллагеназой фракции C7 идентифицировали с использованием FNC1 пкАТ 6.
Фиг. 10. Клиническое проявление некорректированных ран у 4-го субъекта. Признаки спонтанного развития пузырей в необработанных ранах.
Фиг. 11. Реактивная способность сыворотки 4-го субъекта к коллагену VII типа. (А) Вестерн-блот-анализ, изображающий кросс-реактивность сыворотки 4-го субъекта к полноразмерному C7 до и после трансплантации (3 месяца). (B) Сыворотка 4-го субъекта, полученная до и после 3 месяцев после пересадки, специфична к ферментативному (пепсин) расщеплению белка C7, содержащего домен NC2. Контроль (правая полоса) подтверждает присутствие домена NC2 в расщепленной фракции C7 с использованием NC2-специфического пкАТ (NC2-10) 5.
Фиг. 12. Раны 1-го субъекта перед и спустя 12 месяцев после пересадки. Клиническое проявление ран вначале и через 12 месяцев после пересадки. НИФ-анализ экспрессии коллагена VII типа в трансплантатах кожи. Анти-NC1 пкАТ к коллагену VII типа (зеленый); Хехст 33342, ядра (синий); кератин 14 (анти-K14 пкАТ, оранжевый); кератин 1 (анти-K1 пкАТ, оранжевый) и лорикрин (анти-лорикриновые пкАТ, оранжевый). Обратите внимание на линейное зеленое окрашивание коллагена VII типа на дермально-эпидермальном соединении корректированных тканей трансплантата. Масштаб, 100 мкм.
На фиг. 13 изображена карта ретровирусной плазмиды pLZRSE-COL7A1.
Подробное описание сущности изобретения
Следует понимать, что данное изобретение не ограничено конкретной методологией, протоколами, клеточными линиями, видами или родами животных и описанными реагентами, как таковыми, и может изменяться. Следует также понимать, что используемая в данном документе терминология предназначена только для описания конкретных вариантов реализации и не предназначена для ограничения объема данного изобретения, которое будет ограничено только прилагаемой формулой изобретения.
Использованные в данном документе формы единственного числа включают ссылки на множественное число, если из контекста явно не следует иное. Так, например, ссылка на «клетку» включает в себя множество таких клеток, и ссылка на «культуру» включает ссылку на одну или несколько культур и их эквивалентов, известных специалистам в данной области техники, и так далее. Если не указано иное, все другие используемые в данной области научные и технические термины имеют то же значение, которое обычно понимается специалистом в данной области техники, к которому относится изобретение.
Любой вариант реализации, любого из данных способов, устройств и систем может состоять или состоять по существу - более, чем включать в себя/включать/содержать /иметь-описанные этапы и/или признаки. Таким образом, в любом пункте формулы изобретения термин «состоящий из» или «состоящий по существу из» может быть заменен любым неограничивающим глаголом, приведенным выше, с тем чтобы изменить объем данной формулы изобретения, в которой в ином случае использовали неограничивающий глагол.
Использование термина «или» в формуле изобретения используется для обозначения «и/или», если только явно не указано другое, или альтернативы являются взаимоисключающими, хотя описание поддерживает определение, которое относится только к альтернативам и "и/или".
Во всем тексте данной заявки термин «около» используется для обозначения того, что значение включает стандартное отклонение ошибки для устройства или метода, используемых для определения значения.
Состояния, представляющие интерес для лечения модифицированными кератиноцитами по данному изобретению, включают, без ограничения, различные формы буллезного эпидермолиза, включая приобретенные и врожденные формы, последние из которых могут быть рецессивными или доминантными.
На основании недавней системы классификации дистофический буллезный эпидермолиз (ДБЭ) включает три подтипа: рецессивный ДБЭ, тяжелый генерализованный (РДБЭ-тяжелый генерализированный) (ранее называемый типом Аллопо-Сименса (РДБЭ-Аллопо-Сименса), рецессивный ДБЭ, генерализированный другой (РДБЭ-другой) (ранее называемый типом не-Аллопо-Сименса (РДБЭ-не-Аллопо-Сименса) и доминантный ДБЭ (ДДБЭ). При РДБЭ-тяжелом генерализированном, пузыри, влияющие на весь организм, могут присутствовать в неонатальном периоде. Вовлечение в процесс полости рта может приводить к образованию пузырей в ней, срастанию языка с дном полости рта и постепенному уменьшению размера полости рта. Эрозия пищевода может привести к появлению мембранозной атрезии и стриктур, которые могут вызвать тяжелую дисфагию. Следовательно, серьезный дефицит питания и вторичные проблемы являются распространенными. Разрушения роговицы могут привести к образованию рубцов и потере зрения. Пузыри на руках и ногах, сопровождаемые рубцами, приводят к тому, что пальцы рук и ног превращаются в «рукавицу», что является признаком данного расстройства. Жизненный риск агрессивной плоскоклеточной карциномы составляет более 90%. При ДДБЭ пузыри часто мягкие и ограничены руками, ногами, коленями и локтями, но, тем не менее, заживают с рубцами. Дистрофические ногти, особенно ногти на ногах, являются распространенными и могут быть единственным проявлением ДДБЭ.
Обычное лечение проявлений в первую очередь является поддерживающим, включая перевязку ран и диетологическую поддержку. Профессиональная терапия может помочь предотвратить контракции рук. Хирургическое разделение пальцев часто необходимо повторять.
Кератиноциты, модифицированные для экспрессии C7 дикого типа могут найти применение в терапии дистрофического буллезного эпидермолиза.
В дополнение к наследованным формам БЭ, приобретенная форма булезного эпидермолиза (ПБЭ) включает патологию коллагена VII типа и может лечиться модифицированными кератиноцитами описания. Циркулирующие аутоантитела у пациентов с ПБЭ распознают эпитопы в молекулах коллагена VII типа и молекулярное клонирование кДНК коллагена VII типа предоставляло средства для идентификации преобладающих иммуноэпитопов в аминоконцевом домене NC-1 коллагена VII типа. Антигенные свойства домена NC-1 (VII) дополнительно подчеркиваются тем фактом, что моноклональные антитела, такие как H3A и L3D, которые находятся в клиническом применении для картирования коллагена VII типа в коже пациентов с наследованными формами БЭ, также идентифицируют эпитопы в этой части белка. В дополнение к циркулирующим аутоантителам, распознающим эпитопы коллагена VII типа при ПБЭ, буллезные поражения у некоторых пациентов с системной красной волчанкой также были связаны с анти-коллагеновыми VII типа антителами.
Коллаген. Используемый в данном документе термин «коллаген» относится к композициям, в которых по меньшей мере около 50%, по меньшей мере около 60%, по меньшей мере около 70%, по меньшей мере около 80%, по меньшей мере около 90%, по меньшей мере около 95% или больше присутствующего белка представляет собой коллаген тройной спиральной конфигурации. Фолдинг отдельных α-цепей в тройную спиральную конформацию основан на характерной первичной последовательности, включая повторение триплетных последовательностей Gly-X-Y. Коллагены широко встречаются у позвоночных видов и были секвенированы для многих различных видов. Из-за высокой степени сходства последовательностей между видами, коллаген от различных видов может быть использован для биомедицинских целей, например, между видами млекопитающих, хотя человеческий белок может быть предпочтительным.
FACIT-коллагены (фибриллформирующие, тройные спиралевидные фибриллассоциированные) включают типы IX, XII, XIV, XIX, XX и XXI. Некоторые из последних типов коллагенов ассоциируются с более крупными волокнами коллагена и служат в качестве молекулярных мостиков, стабилизируя организацию внеклеточного матрикса. Коллаген VII, (COL7A1, Хромосома 3, NC_000003.10 (48576510.48607689, комплемент)) представляет особый интерес. Коллаген VII типа является основным компонентом якорных фибрилл.
Коллаген VII типа представляет собой длинный, 424 нм, тройной спиральный домен с фланкирующими неколлагеновыми последовательностями. Молекулы коллагена VII типа включают центральный коллагеновый, тройной спиральный сегмент, окруженный неколлагеновыми доменами NC-1 и NC-2. В отличие от промежуточных коллагенов, повторяющаяся последовательность Gly-X-Y прерывается 19 нарушениями из-за вставок или делеций аминокислот в повторяющейся последовательности Gly-X-Y. Наиболее заметно, что в середине тройного спирального домена имеется 39-аминокислотная неколлагеновая «шарнирная» область, которая восприимчива к протеолитическому расщеплению пепсином. Аминоконйцевой домен NC-1 VII типа, размером приблизительно 145 кДа, включает субмодули с гомологией к известным адгезивным белкам, включая сегменты с гомологией к белку матрикса хряща (CMP), девять последовательных типов подобных фибронектину III типа (FN -III), сегмент с гомологией к домену А фактора фон Виллебранда и короткую область с цистеином и обогащенную пролином. Карбоксильный конец неколлагенового домена NC-2 относительно небольшого размера, ~ 30 кДа, и содержит сегмент с гомологией к молекуле ингибитора протеазы Кунитца.
Ген коллагена VII типа человека COL7A1 имеет сложную структуру с общим количеством 118 отдельных экзонов. Ген, однако, относительно компактен, и большинство интронов относительно малы; следовательно, размер всего человеческого гена COL7A1 составляет всего ~ 32 т.п.о., кодирующих матричную РНК ~ 8,9 т.п.о. COL7A1 был картирован на коротком плече хромосомы 3 человека, область 3p21.1. Структура гена коллагена VII типа и кодирующая первичная последовательность белка хорошо сохраняются, и, например, ген мыши показывает 84,7% гомологии по нуклеотиду и 90,4% идентичности на уровне белка.
Коллаген VII типа синтезируется как эпидермальными кератиноцитами, так и дермальными фибробластами в культуре. После синтеза полных про-α1 (VII) полипептидов три полипептида связываются через их карбокси-концевые концы с молекулой тримера, которая в своей коллагеновой части складывается в тройную спиральную формацию. Затем тройные спиральные молекулы выделяются во внеклеточную среду, где два типа молекул коллагена VII выстраиваются в антипараллельный димер с аминоконцевыми доменами, присутствующими на обоих концах молекулы. Это формирование димера сопровождается протеолитическим удалением части карбокси-конца в том числе молекул коллагена VII типа, и стабилизацией путем образования межмолекулярных дисульфидных связей. Впоследствии большое количество этих антипараллельных димеров объединяется латерально с образованием якорных фибрилл.
Мутации замены глицина в тройном спиральном домене COL7A1 (особенно в экзонах 73, 74 и 75) преобладают в доминантном дистрофическом буллезном эпидермолизе (ДДБЭ). Мутации p.Gly2034Arg и p.Gly2043Arg являются наиболее распространенными мутациями, вызывающими ДДБЭ, составляя 50% доминирующих мутаций, зарегистрированных в самой крупной американской когорте. В доминантном ДБЭ также могут быть обнаружены замены глицина, а также другие замены аминокислот и мутации границ сплайсинга вне этой области.
Более 400 рецессивных мутаций, вызвающих ДБЭ, охватывающих весь ген, были описаны для всех форм ДБЭ. Однако каждая мутация составляет не более 1% -2% от общего числа мутаций. В РДБЭ преобладают нулевые мутации, хотя описаны глициновые замены и другие замены аминокислот. Более мягкие формы РДБЭ часто вызываются мутациями границ сплайсинга или другими миссен-мутациями.
Полипептид с «нативной последовательностью» представляет собой полипептид с той же аминокислотной последовательностью, что и полипептид, полученный из природы. Такие полипептиды с нативной последовательностью могут быть получены рекомбинантными средствами в соответствии со способами, изложенными в данном документе. Таким образом, полипептид с нативной последовательносью может иметь аминокислотную последовательность, например, природного полипептида человека, мышиного полипептида или полипептида из любых других видов млекопитающих и тому подобное. Термин «нативная последовательность белка коллагена VII» включает нативные белки с или без инициирующего N-концевого метионина (Met).
«Вариантный» полипептид означает биологически активный полипептид, как определено ниже, имеющий менее 100% идентичности последовательности с полипептидом нативной последовательности. Такие варианты включают полипептиды, в которых один или несколько аминокислотных остатков добавляют на N- или С-конце или на протяжении нативной последовательности; от примерно одного до сорока аминокислотных остатков удаляют и опционально замещают одним или несколькими аминокислотными остатками; и дериваты вышеуказанных полипептидов, где аминокислотный остаток ковалентно модифицирован так, что полученный продукт имеет неприродную аминокислоту. Обычно биологически активный вариант коллагена VII будет иметь аминокислотную последовательность, имеющую по меньшей мере примерно 90% идентичности аминокислотной последовательности с полипептидом нативной последовательности коллагена VII, предпочтительно по меньшей мере примерно 95%, более предпочтительно, по меньшей мере, около 99%.
«Функциональный дериват» нативной последовательности полипептида коллагена VII представляет собой соединение, обладающее качественным биологическим свойством, общим с нативной последовательностью полипептида коллагена VII. «Функциональные дериваты» включают, но не ограничиваются ими, фрагменты нативной последовательности и дериваты нативной последовательности полипептида коллагена VII и его фрагменты при условии, что они имеют общую биологическую активность с соответствующей нативной последовательностью полипептида коллагена VII. Термин «дериват» охватывает как варианты аминокислотной последовательности полипептида коллагена VII, так и их ковалентные модификации.
Термин «раневая поверхность» относится к самому верхнему жизнеспособному слою раны. В одном варианте реализации, раневая поверхность покрывается отторгающимися некротическими массами или эшарой. В другом варианте реализации, раневую поверхность можно оценить на присутствие отторгающихся масс грануляционной ткани фибрина, эшара, кости, сухожилия и/или других подстилающих структур.
Термин «тест на эффективность трансдукции вируса (VTE)» представляет собой тест для измерения отношения количества вирусных трансдуцированных клеток к общим клеткам, подверженным трансдукции. В одном варианте реализации, VTE измеряют путем иммунофлуоресцентного окрашивания антителом, нацеленным на белок, экспрессируемый на трансдуцированном вирусе. В другом варианте реализации, VTE измеряется ПЦР в реальном времени или количественной ПЦР.
Термин «число копий провирусного генома» или «PGCN» относится к числу копий провирусной ДНК в клетках, трансдуцированных вирусом. Таким образом, тест PGCN измеряет количество копий провирусной ДНК в клетке после вирусной трансдукции или инфекции. В одном варианте реализации, число копии измеряется ПЦР в реальном времени или количественной ПЦР. В другом варианте реализации, PGCN измеряется саузерн-блоттингом или высокопродуктивным скринингом. В некотором варианте реализации, PGCN составляет менее 3, 2, 1, 0,5. В некотором варианте реализации, PGCN составляет более 3, 10, 100 или 1000.
Термин «тест на стерильность» относится к тесту, которым пытаются выявить наличие или отсутствие жизнеспособных контаминирующих микроорганизмов в образце и часто используются для устранения ложноположительных результатов. В одном варианте реализации, ложноположительные результаты происходят из-за контаминации окружающей среды или ошибок.
Термин «эндотоксин» относится к токсину, связанному с наружными мембранами некоторых грамотрицательных бактерий, включая, но не ограничиваясь ими, виды Brucella, Neisseria и Vibrio. В одном варианте реализации, эндотоксины не секретируются, а высвобождаются только тогда, когда клетки разрушаются. Эндотоксин можно измерить или протестировать гель-тромб методом, хромогенным методом, турбидиметрическим методом или их комбинацией.
Термин «микоплазма» относится к популяции бактерий, которые не имеют клеточной стенки вокруг клеточной мембраны, так что бактерии менее подвержены воздействию или не подвержены влиянию определенных типов антибиотиков. Тест на микоплазму включает, но не ограничивается ими, метод агарового питательного бульона, детектирование ДНК, ферментативные и ИФА-методы, и ПЦР.
Термин «тест на стерильность окрашиванием по Граму» относится к процедуре обнаружения бактерий и/или грибов в образце. В одном варианте реализации, тест на стерильность окрашиванием по Граму может свидетельствовать о наличии или отсутствии бактерий или грибов в образце и/или их общих типов.
Термин «тест на жизнеспособность» относится к тесту, для определения способности органов, клеток или тканей поддерживать или восстанавливать жизнеспособность, который включает, но не ограничивается ими, механическую активность, подвижность, сокращение, митотическую активность органов, клеток или тканей. В одном варианте реализации, тест на жизнеспособность модифицированных LZRSE-COL7A1 аутологичных трансплантатов эпидермального слоя (LEAES) предназначен для проверки способности клеток или тканей LEAES поддерживать или восстанавливать жизнеспособность.
Термин «репликационно-компетентный ретровирус (RCR)» в данном описании относится к ретровирусу, который способен к репликации, даже несмотря на то, что ретровирусные векторы разработаны как репликативно-дефективные. В одном варианте реализации, RCR генерируется во время изготовления посредством гомологичной или негомологичной рекомбинации между вектором-переносчиком, компонентами упаковки и эндогенными ретровирусными элементами в клетках-продуцентах. Тест RCR используется для обнаружения RCR в образце.
Термин «анализ Т-клеточной цитотоксичности» относится к анализу для оценки иммунных функций, опосредованных клетками.
Термин «тест после высвобождения» в данном описании относится к одному или нескольким тестам после высвобождения эпидермального слоя из планшета, включая, но не ограничиваясь этим, тест на стерильность, тест RCR, тест на микоплазму, тест на жизнеспособность, и тест на стерильность окрашиванием по Граму.
Термин «генетическая модификация» относится к процессу изменения гена организма или введению гена из одного организма в другой организм. В одном варианте реализации, генетическая модификация включает, состоит по существу из или еще состоит из вставки, делеции и/или мутации. Термин «вставка» означает добавление одной или нескольких пар оснований нуклеотидов в нуклеотидную последовательность. Термин «делеция» относится к части хромосомы или нуклеотидной последовательности, которая удалена или отсутствует. Термин «мутация» представляет собой изменение нуклеотидной последовательности (например, последовательности ДНК). Мутация может происходить в различных пределах, включая, но не ограничиваясь ими, одну пару оснований (то есть точечная мутация), несколько пар оснований или в пределе большего сегмента хромосомы.
Термин «консервативная генетическая модификация» относится к генетической модификации, которая поддерживает те же или подобные биохимические свойства полипептида, кодируемого генетически модифицированным геном. Например, как аспарагиновая кислота, так и глутаминовая кислота представляют собой небольшие, отрицательно заряженные остатки. В некотором варианте реализации, это консервативная генетическая модификация мутируется посредством аспарагиновой кислоты на глутаминовую кислоту в полипептиде.
Пролил-4-гидроксилаза (P4HA, EC 1.14.11.2) играет центральную роль в синтезе коллагена. Он катализирует образование 4-гидроксипролина в коллагенах путем гидроксилирования остатков пролина в пептидных связях. Остатки 4-гидроксипролина необходимы для фолдинга вновь синтезированной цепи полипептида проколлагена в тройные спиральные молекулы. Активный фермент представляет собой тетрамер 2-альфа- и 2-бета-субъединиц с молекулярной массой около 240 000. Бета-субъединица (P4HB) идентична ферменту дисульфидизомеразе (EC 5.3.4.1) и основному клеточному тиреоид-связывающему белку. Альфа-субъединица имеет значение для большей части каталитического участка фермента. Полипептид представляет собой 517 аминокислотных остатков и сигнальный пептид из 17 аминокислот.
Ген P4HA охватывает более 69 т.п.о. и состоит из 16 экзонов. Доказательства ранее были представлены для взаимоисключающего альтернативного сплайсинга транскриптов РНК гена. Приведенные данные показали, что взаимоисключающие последовательности, обнаруженные в мРНК, кодируются 2 последовательными гомологичными экзонами с 71 п.о., 9 и 10. Эти экзоны идентичны по первым 5 пар оснований, а общая идентичность между ними составляет 61% на уровне нуклеотидов и 58% на уровне кодированных аминокислот. Обнаружено, что оба типа мРНК экспрессируются во всех исследованных тканях, но в некоторых тканях тип, кодирующий последовательности экзона 9 или экзона 10, был более множественным, чем другой тип.
Под «конструкцией нуклеиновой кислоты» подразумевается последовательность нуклеиновой кислоты, которая была сконструирована так, чтобы содержать одну или несколько функциональных единиц, не встречающихся вместе в природе. Примеры включают круговые, линейные, двухцепочечные, внехромосомные молекулы ДНК (плазмиды), космиды (плазмиды, содержащие COS-последовательности из лямбда-фага), вирусные геномы, содержащие неродные последовательности нуклеиновых кислот и тому подобное.
В данных способах, коллаген VII получают путем введения в популяцию клеток интегрирующей, обычно вирусной экспрессионной конструкции. ДНК, кодирующая полипептид коллагена VII, может быть получена из любой библиотеки кДНК, полученной из ткани, экспрессирующей полипептидную мРНК коллагена VII, полученную из различных источников. Ген, кодирующий полипептид коллагена VII, также может быть получен из банка генов или путем синтеза олигонуклеотидов. Альтернативным средством для выделения кодирующего гена является использование метода ПЦР.
Нуклеиновую кислоту (например, кДНК или геномную ДНК), кодирующую полипептид коллагена VII, встраивают в конструкцию для экспрессии, функционально связанную с элементами, необходимыми для экспрессии. Многие такие конструкции являются доступными. Компоненты обычно включают, но не ограничиваются ими, одно или несколько из следующего: последовательность кодирования, один или несколько маркерных генов, энхансерный элемент, промотор и последовательность терминации транскрипции.
«Вектор» способен переносить последовательности нуклеиновых кислот в клетки-мишени. Например, вектор может содержать кодирующую последовательность, способную к экспрессиии в клетке-мишени. В рамках данного изобретения «векторная конструкция», «вектор экспрессии» и «вектор переноса гена», как правило, относятся к любой конструкции нуклеиновой кислоты, способной направлять экспрессию, представляющего интерес гена, и которая полезна при переносе интересующего гена в клетки-мишени. Таким образом, термин включает носители для клонирования и экспрессии, а также интегрирующие векторы.
«Экспрессионная кассета» включает любую конструкцию нуклеиновой кислоты, способную направлять экспрессию любого транскрипта РНК, включая интересующий ген/кодирующую последовательность, а также нетранслируемые РНК, такие как shРНК (малые шпилечные РНК), microРНК (микроРНК), siРНК (малые интерферирующие РНК), антисмысловые РНК, и тому подобное. Такие кассеты могут быть сконструированы в «векторе», «векторной конструкции», «векторе экспрессии» или «векторе переноса гена», чтобы перенести кассету экспрессии в клетки-мишени. Таким образом, термин включает носители для клонирования и экспрессии, а также вирусные векторы.
Нуклеиновые кислоты «функционально связаны» в случае установления функционального родства с другой последовательностью нуклеиновой кислоты. Например, ДНК сигнальной последовательности функционально связана с ДНК полипептида, если он экспрессируется как препротеин, который участвует в секреции полипептида; промотор или энхансер функционально связан с кодирующей последовательностью, если он влияет на транскрипцию последовательности; или сайт связывания рибосом функционально связан с кодирующей последовательностью, если он расположен так, чтобы способствовать трансляции. Как правило, «функционально связанный» означает, что связанные с ним последовательности ДНК являются непрерывными, а в случае лидерной последовательности секретируемого пептида - смежными и в фазе считывания. Однако энхансеры не должны быть смежными. Связывание осуществляют путем лигирования подходящих сайтов рестрикции. Если таких сайтов не существует, синтетические олигонуклеотидные адаптеры или линкеры используются в соответствии с обычной практикой.
Векторы экспрессии будут содержать промотор, который распознается аутологичным лейкоцитом или клеткой-хозяином экспрессии мРНК, и функционально связан с кодирующей последовательностью коллагена VII. Промоторы представляют собой нетранслируемые последовательности, расположенные дальше (5') от инициирующего кодона структурного гена (обычно в пределах от 100 до 1000 п.о.), которые контролируют транскрипцию и трансляцию определенной последовательности нуклеиновой кислоты, с которой они функционально связаны. Такие промоторы обычно делятся на два класса, индуцируемые и конститутивные. Индуцируемые промоторы являются промоторами, которые инициируют повышение уровней транскрипции из ДНК под их контролем в ответ на некоторое изменение условий культивирования, например, наличие или отсутствие питательного вещества или изменение температуры. Известно большое количество промоторов, распознаваемых различными потенциальными клетками-хозяевами. Предпочтительны гетерологичные промоторы, так как они обычно обеспечивают большую транскрипцию и более высокие выходы.
Транскрипцию в векторах в клетках-хозяевах млекопитающих можно контролировать, например, промоторами, полученными из геномов вирусов, таких как полиомавирус, вирусный оспы кур, аденовирус (такой как аденовирус 2), вирус папилломы крупного рогатого скота, вирус саркомы птиц, цитомегаловирус, ретровирус, вирус гепатита В, вирус обезьян 40 (SV40), в гетерологичных промоторов млекопитающих, например промоторами актина, PGK (фосфоглицераткиназа) или промоторами иммуноглобулина, промоторами теплового шока, при условии, что такие промоторы совместимы с системами клеток-хозяев. Ранние и поздние промоторы вируса SV40 обычно получают в виде рестрикционного фрагмента SV40, который также содержит вирусную точку начала репликации SV40. Непосредственный ранний промотор цитомегаловируса человека обычно получают в виде рестрикционного фрагмента HindIII E.
Транскрипцию высших эукариот часто увеличивают путем вставки энхансерной последовательности в вектор. Энхансеры представляют собой цис-действующие элементы ДНК, обычно примерно от 10 до 300 п.о., которые действуют на промотор, чтобы увеличить его транскрипцию. Энхансеры относительно независимо ориентированы и расположены, обнаруживаются на 5' и 3' транскрипционных единицах, внутри интрона, а также внутри самой кодирующей последовательности. На данный момент, известны многие энхансерные последовательности из генов млекопитающих (глобин, эластаза, альбумин, α-фетопротеин и инсулин). Обычно, при этом, можно использовать энхансер вируса эукариотической клетки. Примеры включают энхансер SV40 на участке поздней точки начала репликации, ранний энхансер-промотор цитомегаловируса, энхансер полиомы на участке поздней точки начала репликации и энхансер аденовируса. Энхансер можно подвергнуть сплайсингу в векторе экспрессии в положении 5 'или 3' к кодирующей последовательности, но предпочтительно располагать на участке 5 'от промотора.
Векторы экспрессии, используемые в эукариотических клетках-хозяевах, также будут содержать последовательности, необходимые для терминации транскрипции и для стабилизации мРНК. Такие последовательности обычно доступны на 5' и иногда на 3', нетранслируемых областях эукариотических или вирусных ДНК или кДНК. Эти области содержат нуклеотидные сегменты, транскрибируемые как полиаденилированные фрагменты в нетранслируемой части мРНК.
Векторы и системы для интеграции экспрессионной кассеты в клетку известны в данной области техники и могут включать, без ограничения, ретровирусные векторы. Доступны многие векторы, полезные для переноса экзогенных генов в клетки-мишени млекопитающих. Было показано, что векторы на основе ретровируса особенно полезны. Могут использоваться комбинации ретровирусов и подходящие пакующие линии, где капсидные белки будут функционировать для инфицирования клеток-мишеней. Обычно клетки и вирус инкубируют в течение, по меньшей мере, около 24 часов в культуральной среде. Затем, в некоторых технологиях, предусматривается рост клеток в культуральной среде с короткими интервалами, например, 24-73 часа или, по меньшей мере, на две недели, и может быть предусмотрен рост в течение пяти недель или более, перед анализом. Обычно используемые ретровирусные векторы являются «дефектными», то есть неспособными продуцировать вирусные белки, необходимые для эффективной инфекции. Репликация вектора требует роста в пакующей клеточной линии.
Специфичность ретровируса к клетке-хозяину определяется белком оболочки, env (p120). Белок оболочки обеспечивается упаковочной клеточной линией. Белки оболочек представляют собой по меньшей мере три типа: экотропный, амфотропный и ксенотропный. Ретровирусы, содержащие амфотропной белок оболочки, например 4070A (Danos et al., выше), способны инфицировать большинство типов клеток млекопитающих, включая человека, собаку и мышь. Amphotropic packaging cell lines include PA12 (Miller et al. (1985) Mol. Cell. Biol. 5:431B437); PA317 (Miller et al. (1986) Mol. Cell. Biol. 6:2895B2902); GRIP (Danos et al. (1988) PNAS 85:6460B6464). Ретровирусы, упакованные с белком ксенотропной оболочки, например, AKR env, способны инфицировать большинство типов клеток млекопитающих, за исключением мышиных клеток. Последовательности на 5 'и 3' концах ретровируса являются длинными концевыми повторами (LTR). Ряд последовательностей LTR известен в данной области техники и может быть использован, включая MMLV-LTR; ВИЧ-LTR; АКР-LTR; FIV-LTR; ALV-LTR; и т.п. 5' -LTR действует как сильный промотор, управляя транскрипцией введенного гена после интеграции в геном клетки-мишени.
Кератиноциты. Недавно полученные первичные кератиноциты могут отбираться, выделяться из штанцевой биопсии и трансдуцироваться после периода культивирования для выделения кератиноцитов из дермальных клеток. Эпителиальные кератиноциты, растущие in vitro могут образовывать слой. В некоторых вариантах реализации, трансдуцированные клетки вводят пациенту в течение от 1 до 100 дней, от 1 до 50 дней, от 1 до 20 дней, от 1 до 10 дней, от 1 до 5 дней, от 1 до 3 дней, от 1 до 2 дней или 1 дня с момента трансдукции клеток.
Любая из множества культуральных сред может быть использована в данных способах, как известно специалисту (см., например, Current Protocols in Cell Culture, 2000-2009 by John Wiley & Sons, Inc.). Приведенные среды также включают, но не ограничиваются ими, среду для кератиноцитов, которая может быть бессывороточной и может содержать соответствующие добавки для кератиноцитов.
В данном описании предлагается способ лечения буллезного эпидермолиза (БЭ) у субъекта, причем способ включает, в альтернативном варианте по существу состоит из или еще дополнительно состоит из получения популяции клеток кожи от субъекта; коррекции клеток кожи ex vivo путем интеграции генетической конструкции, кодирующей функциональный (например, полноразмерный дикого типа) белок коллагена VII (COL7A1) человека; культивирование генетически исправленных клеток с образованием слоя кератиноцитов; и пересадку трансплантата в виде слоя кератиноцитов на раневую поверхность кожи. Описание также относится к использованию популяции клеток кожи для лечения буллезного эпидермолиза (БЭ) у субъекта, при этом популяция клеток кожи корректируется путем трансдукции вирусом, содержащим генетическую конструкцию, кодирующую полноразмерный человеческий белок коллагена типа VII (COL7A1), для получения популяции трансдуцированных клеток кожи, имеющих число копий провирусного генома (PGCN) и, при этом PGCN трансдуцированной популяции клеток кожи составляет не более 3. В некоторых вариантах реализации, генетически корректированные клетки культивируют в среде DFF31, в альтернативном варианте, по существу состоящей или еще дополнительно состоящую из среды Игла в модификации Дульбекко и среды F12. В одном варианте реализации, клетки кожи корректируются путем трансдукции вируса, содержащего, в альтернативном варианте по существу состоящего из или, еще дополнительно состоящего из экспрессионной конструкции, причем вирус содержит, в альтернативном варианте по существу состоит из, или еще дополнительно состоит из ретровируса, AAV (адено-ассоциированного вируса) или лентивируса. В другом варианте реализации, ретровирус представляет собой LZRSE-вирус. В одном варианте реализации, ретровирус псевдотипирован GalV. В дополнительном варианте реализации, кератиноциты, трансдуцированные таким образом, отвечают критериям до высвобождения по эффективности вирусной трансдукции (VTE)> 50% и числу копий провирусного генома (PGCN) ≤ 3. В некоторых вариантах реализации, PGCN составляет менее 2,5, 2, 1,5 или 1. В другом варианте реализации, PGCN находится между 3-20, 20-40, 40-60, 60-80 или 80-100. В другом варианте реализации, PGCN составляет более 100. В некоторых вариантах реализации, слой кератиноцитов отличается по размеру. Специалист в данной области техники может определить размер слоя кератиноцитов.
В некотором варианте реализации, эндогенный мутированный, дисфункциональный или усеченный ген С7 заменен с использованием системы CRISPR/Cas (или вектора, кодирующего указанную систему CRIPSR/Cas), как описано в данном документе, и «донорная» последовательность (например, функциональной кДНК COL7A1 или гена C7 или полназазмерной кДНК COL7A1 дикого типа или гена), вставляется в ген после целевого расщепления. Системы CRISPR/Cas обнаружены у 40% бактерий и 90% архей и отличаются многокомпонентностью своих систем. См., например, U.S. Pat. № 8697359, который включен в качестве ссылки в полном объеме. Локусы CRISPR (короткие палиндромные повторы, регулярно расположенные группами) представляют собой область в геноме организма, где короткие сегменты чужеродной ДНК интегрированы между последовательностями коротких палиндромных повторов. Эти локусы транскрибируются и транскрипты РНК («пре-crРНК») обрабатываются в короткие РНК CRISPR (crРНК). Существует три типа систем CRISPR/Cas, которые включают эти РНК и белки, известные как белки «Cas» (ассоциированные с CRISPR). Оба типы I и III имеют эндонуклеазы Cas, которые процессируют пре-crРНК, которые при полном прооцессинге в crРНК формируют комплекс мульти-Cas белка, который способен расщеплять нуклеиновые кислоты, которые являются комплементарными к crРНК. Система CRISPR/Cas, которая связывается с целевым сайтом в интересующей области эндогенного гена (например, эндогенного или гена безопасности или регуляторного гена или его ДНК-мишени) в геноме, причем система CRISPR/Cas содержит одну или более сконструированных единых гидовых РНК, которые распознают ген-мишень и функциональный домен (например, регуляторный домен транскрипции и/или нуклеазный домен). В некотором варианте реализации, система CRISPR/Cas, как описано в данном документе, может связываться и/или расщеплять интересующую область (например, эндогенный ген C7 в ткани БЭ) в кодирующей или некодирующей области внутри или рядом с геном, такой как, например, лидерной последовательности, трейлерной последовательности или интрона, или внутри нетранскрибируемой области, либо расположенной выше, либо расположенной ниже кодирующей области. В некоторых вариантах реализации, CRISPR/Cas связывает и/или расщепляет ген, например мутированный, дисфункциональный или усеченный ген C7.
В одном аспекте рана свободна от не корректированных кератиноцитов раневой поверхности. В одном варианте реализации, рану обрабатывают для удаления некорректированных кератиноцитов раневой поверхности. В другом аспекте, субъект страдает рецессивным дистрофическим буллезным эпидермолизом (РДБЭ). В другом аспекте, субъект является человеком.
В другом варианте реализации, слой кератиноцитов подвергают одному или нескольким тестам, выбранным из группы, состоящей из теста VTE, теста PGCN, теста на стерильность, теста на эндотоксин, теста на микоплазму, теста на стерильность окрашиванием по Граму, теста на жизнеспособность LEAES, тестирования до высвобождения, теста RCR, анализа Т-клеточной цитотоксичности, характеристики анти-C7 LH24 мкАТ, электронной микроскопии, иммуноэлектронной микроскопии, иммунофлуоресцентного окрашивания, экспрессии C7 и анализа ЯФ. В одном аспекте, иммунофлуоресцентное окрашивание включает, в альтернативном варианте, состоит по существу из или еще дополнительно состоит из прямого или непрямого иммунофлуоресцентного окрашивания.
В некоторых вариантах реализации, слой кератиноцитов помещают на бесклеточный матрикс, коллагеновый матрикс или биосовместимый волокнистый материал. В некотором варианте реализации, биосовместимый волокнистый материал изготавливают из термопластичной смолы, полиэтилена, полиэтилена с ультравысокой молекулярной массой, полиолефина с высокой молекулярной массой, непокрытого моноволокна полипропилена, полиэфирэфиркетона, полиэтилентерефталата, политетрафторэтилена, вспененного политетрафторэтилена, нейлона, силикона или любой их комбинации.
В некоторых вариантах реализации, клетки кожи содержат, в альтернативном варианте, по существу состоят из или еще дополнительно состоят из кератиноцитов. В одном варианте реализации, клетки кожи содержат, в альтернативном варианте по существу состоят из или еще дополнительно состоят из стволовых клеток. В другом варианте реализации, способ дополнительно включает, в альтернативном варианте по существу состоит из или еще дополнительно состоит из стволовых клеток, дифференцирующихся в кератиноциты. В одном аспекте, стволовые клетки дифференцируются до, после или во время трансдукции. В некоторых вариантах реализации, стволовые клетки дифференцируются (например, в кератиноциты или эпителиальные клетки роговицы) перед трансдукцией. В некоторых вариантах реализации, стволовые клетки дифференцируются после трансдукции. В еще одном варианте реализации, стволовые клетки дифференцируются во время трансдукции.
У пациентов с РДБЭ может часто развиваться истощающая, болезненная эрозия роговицы. Таким образом, в описании также предлагается способ лечения эрозии роговицы у субъекта, причем способ включает, в альтернативном варианте по существу состоит из или еще дополнительно состоит из получения от субъекта популяции клеток роговицы; коррекции клеток роговицы ex vivo путем интеграции генетической конструкции, кодирующей функциональный (например, полноразмерный дикого типа) белок коллагена VII (COL7A1) человека; культивирования генетически корректированных клеток с образованием слоя клеток роговицы; и пересадки трансплантата в виде слоя клеток роговицы на поверхность роговицы. В некотором аспекте, клетки роговицы содержат, в альтернативном варианте по существу состоят из или еще дополнительно состоят из эпителиальных клеток роговицы. В другом аспекте, клетки роговицы содержат, в альтернативном варианте по существу состоят из или дополнительно состоят из стволовых клеток. В некотором варианте реализации, способ дополнительно включает, в альтернативном варианте по существу состоит или еще дополнительно состоит из стволовых клеток, дифференцирующихся в эпителиальные клетки роговицы.
В некотором аспекте, клетки роговицы корректируют путем трансдукции вируса, содержащего генетическую конструкцию, при этом вирус содержит, в альтернативном варианте по существу состоит из или еще дополнительно состоит из ретровируса, лентивируса или AAV. В одном варианте реализации, ретровирус представляет собой LZRSE-вирус. В некоторых вариантах реализации, ретровирус псевдотипирован GalV. В некоторых вариантах реализации, трансдуцированные таким клетки роговицы отвечают критериям до высвобождения по эффективности вирусной трансдукции (VTE)> 50% и числу копий провирусного генома (PGCN) ≤ 3. В некоторых вариантах реализации, PGCN составляет менее 2,5, 2, 1,5 или 1. В другом варианте реализации, PGCN находится между 3-20, 20-40, 40-60, 60-80 или 80-100. В другом варианте реализации, PGCN составляет более 100. В некотором аспекте, субъект страдает рецессивным дистрофическим буллезным эпидермолизом (РДБЭ). В другом аспекте, субъект является человеком.
В одном аспекте, слой клеток роговицы подвергают одному или нескольким тестам, выбранным из группы, состоящей из теста VTE, теста PGCN, теста на стерильность, теста на эндотоксин, теста на микоплазму, теста на стерильность окрашиванием по Граму, теста на жизнеспособность LEAES, тестирования до высвобождения, теста RCR, анализа Т-клеточной цитотоксичности, характеристики анти-C7 LH24 мкАТ, электронной микроскопии, иммуноэлектронной микроскопии, иммунофлуоресцентного окрашивания, экспрессии C7 и анализ AF. В одном аспекте, иммунофлуоресцентное окрашивание включает, в альтернативном варианте по существу состоит из или еще дополнительно состоит из прямого или непрямого иммунофлуоресцентного окрашивания. В некоторых вариантах реализации, слой клеток роговицы помещают на бесклеточный матрикс, коллагеновый матрикс или биосовместимый волокнистый материал.
В одном аспекте биосовместимый волокнистый материал может быть изготовлен из нерассасывающихся материалов, включая, но не ограничиваясь ими, биосовместимые металлы, такие как титановые сплавы, нержавеющая сталь, сплавы кобальт-хром и сплавы никель-титан. В другом аспекте, слой биосовместимого волокнистого материала может быть изготовлен из нерассасывающихся полимерных материалов, включая, но не ограничиваясь ими, термопластичные смолы, полиэтилены, полиэтилен с ультравысокой молекулярной массой, полиолефинов с высокой молекулярной массой, непокрытого моноволокна полипропилена, полиэфирэфиркетона, полиэтилентерефталата, политетрафторэтилена, вспененного политетрафторэтилена, нейлон, любого полимера или алифатического углеводорода, содержащего одну или несколько двойных связей, любых других подходящих пористых материалов или любых других подходящих пористых материалов, которые могут сгибаться или иным образом принимать форму.
В другом аспекте, биосовместимый волокнистый материал может состоять из синтетического или биологического рассасывающегося полимерного материала, включая, но не ограничиваясь ими, полигликолевую кислоту, поли-L-молочную кислоту (PLLA), поли-D,L-молочную кислоту (PDLA), триметиленкарбонат (TMC), поли-α-капролактон, поли-п-диоксанон, сополимеры лактида и гликолида (PLGA), полигидрокси-3-бутират, коллаген, гиалуроновую кислоту, шелк, биоцеллюлозу, другие белковые полимеры, полисахариды, поли(DTE карбоната) (поли(карбонат дезаминотирозилтирозинэтилового эфира), полиарилаты, смеси PLLA, PLDA или PLGA с TMC и другие комбинации этих полимеров.
В одном варианте реализации, биосовместимый волокнистый материал изготавливают из термопластичной смолы, полиэтилена, полиэтилена с ультравысокой молекулярной массой, полиолефина с высокой молекулярной массой, непокрытого моноволокна полипропилена, полиэфирэфиркетона, полиэтилентерефталата, политетрафторэтилена, вспененного политетрафторэтилена, нейлона, силикона или любой их комбинации.
Кроме того, в данном описании представлена композиция, содержащая, в альтернативном варианте по существу состоящая из или еще дополнительно состоящая из слоя кератиноцитов, причем слой кератиноцитов получают способом, включающим, в альтернативном варианте по существу состоящим или еще дополнительно состоящим из этапов: получения популяции клеток кожи от субъекта; коррекции клеток кожи ex vivo путем интеграции генетической конструкции, кодирующей функциональный (например, полноразмерного дикого типа) белка коллагена VII (COL7A1) человека; культивирования генетически корректированных клеток с образованием слоя кератиноцитов. В некоторых вариантах реализации, клетки кожи содержат, в альтернативном варианте по существу состоят из или еще дополнительно состоят из кератиноцитов. В одном варианте реализации, клетки кожи содержат, в альтернативном варианте по существу состоят из или еще дополнительно состоят из стволовых клеток. В другом варианте реализации, стволовые клетки дифференцируются в кератиноциты. В некоторых вариантах реализации, стволовые клетки дифференцируются до, после или во время трансдукции.
Кроме того, предлагается фармацевтическая композиция, содержащая, в альтернативном варианте по существу состоящая из или еще дополнительно состоящая из слоя кератиноцитов, при этом указанный слой кератиноцитов, в альтернативном варианте по существу состоит из или еще дополнительно состоит из клеток кожи, интегрированных ex vivo с генетической конструкцией, кодирующей функциональный белок COL7A1. В одном аспекте клетки кожи получают от субъекта. В некоторых вариантах реализации субъект является человеком. В некоторых вариантах реализации, клетки кожи дифференцируются из стволовых клеток, интегрированных ex vivo с генетической конструкцией, кодирующей функциональный белок COL7A1. В одном варианте реализации, субъект страдает от РДБЭ. В некотором варианте реализации, клетки кожи или стволовые клетки трансдуцируют вирусом, содержащим генетическую конструкцию, при этом вирус содержит ретровирус, лентивирус или AAV.
В одном варианте реализации, функциональный белок COL7A1 представляет собой полноразмерный белок человека COL7A1 дикого типа. В одном аспекте, функциональный белок COL7A1 включает, в альтернативном варианте по существу состоит из или еще дополнительно состоит из генетической модификации из полноразмерного белка человека COL7A1 дикого типа. В другом аспекте, функциональный белок COL7A1 включает, в альтернативном варианте по существу состоит из или еще дополнительно состоит из генетической модификации из полноразмерного белка человека COL7A1 дикого типа, при этом генетическая модификация является консервативной. В дополнительном аспекте, генетическая модификация включает, в альтернативном варианте по существу состоит из или еще дополнительно состоит из вставки, делеции и/или мутации.
Кроме того, в данном описании предлагается фармацевтическая композиция, включающая, в альтернативном варианте по существу состоящая из или еще дополнительно состоящая из слоя клеток роговицы, при этом указанные клетки роговицы содержат клетки роговицы, интегрированные ex vivo с генетической конструкцией, кодирующей функциональный белок COL7A1. В некоторых вариантах реализации, клетки роговицы дифференцируются из стволовых клеток, интегрированных ex vivo с генетической конструкцией, кодирующей функциональный белок COL7A1. В другом варианте реализации, клетки роговицы получают от субъекта. В одном варианте реализации, субъект страдает от РДБЭ. В некоторых вариантах реализации субъект является человеком. В некотором варианте реализации, клетки роговицы или стволовые клетки трансдуцируют вирусом, содержащим генетическую конструкцию, при этом вирус содержит ретровирус, лентивирус или AAV. В одном варианте реализации, ретровирус представляет собой LZRSE-вирус. В некотором варианте реализации, ретровирус псевдотипирован GalV. В дополнительном варианте реализации, трансдуцированные клетки отвечают критериям до высвобождения по эффективности вирусной трансдукции (VTE)> 50% и числу копий провирусного генома (PGCN) ≤ 3.
В одном аспекте, функциональный белок COL7A1 представляет собой полноразмерный белок человека COL7A1 дикого типа.
В некоторых вариантах реализации, клетки культивируют в течение 1-21 дня. В дополнительных вариантах реализации, клетки культивируют 7, 14, 21 день или дольше. Таким образом, клетки могут культивироваться при соответствующих условиях 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29 или более дней. Клетки пересеивают, и среды и добавки могут добавляться или изменяться по мере необходимости с использованием методов, известных в данной области техники.
В некоторых вариантах реализации, генетически измененные кератиноциты могут быть культивированы в условиях и в течение достаточных периодов времени, так что по меньшей мере 5%, 10%, 15%, 20%, 25%, 30%, 35%, 40%, 45 %, 50%, 55%, 60%, 65%, 70%, 75%, 80%, 85%, 90%, 95%, 96%, 97%, 98%, 99% или 100% клеток экспрессируют С7-трансген.
В одном варианте реализации, композиции клеток по данному описанию содержат, в альтернативном варианте по существу состоят из или еще дополнительно состоят из генетически измененной популяции аутологичных кератиноцитов, экспрессирующих нативный C7-белок человека в количестве, эффективном для лечения БЭ. Целевые популяции клеток выращивают в слоях для трансплантации субъекту в сочетании с одним или несколькими фармацевтически или физиологически приемлемыми носителями, разбавителями или наполнителями. Такие композиции могут включать буферы, такие как нейтральный забуференый физиологический раствор, забуференый фосфатом физиологический раствор и тому подобное; углеводы, такие как глюкоза, манноза, сахароза или декстран, маннит; белки; полипептиды или аминокислоты, такие как глицин; антиоксиданты; хелатирующие агенты, такие как ЭДТА или глутатион; адъюванты (например, гидроксид алюминия); и консерванты.
Композиции клеток по данному изобретению вводят способом, соответствующим лечению БЭ. Количество и частота введения будут определяться такими факторами, как состояние пациента, тип и тяжесть заболевания пациента, хотя соответствующие дозы могут определяться клиническими испытаниями.
Клетки могут вводиться субъекту способами, хорошо известными специалистам в данной области техники, как правило, в виде кожного трансплантата. Практикующий врач сможет определить подходящий способ введения для конкретного субъекта, основываясь, в частности, на типе и локализации заболевания. Трансфицированные клетки можно вводить локально на место раны.
Фармацевтическое приготовление модифицированных клеток для введения субъекту рассматривается в данном изобретении. Специалист в данной области техники будет знаком с методами введения клеток субъекту. Кроме того, специалист в данной области техники будет знаком с методами и фармацевтическими реагентами, необходимыми для приготовления этих слоев клеток перед введением субъекту.
В некоторых вариантах реализации данного изобретения, фармацевтическое приготовление представляет собой водную композицию, которая включает, в альтернативном варианте по существу состоит из или еще дополнительно состоит из модифицированных клеток, которые были модифицированы для серхэкспрессии С7 и опционально пролил-4-гидроксилазы. В некоторых вариантах реализации, трансдуцированную клетку получают с использованием клеток, которые были получены от субъекта (то есть аутологичных клеток).
Фармацевтические композиции по данному изобретению содержат эффективное количество раствора трансфицированных клеток в фармацевтически приемлемом носителе или водной среде. Используемый в данном документе термин «фармацевтическое приготовление» или «фармацевтическая композиция» включает любые и все растворители, дисперсионные среды, покрытия, антибактериальные и противогрибковые агенты, изотонические агенты и вещества, задерживающие всасывание и тому подобное. Использование таких сред и агентов для фармацевтически активных веществ хорошо известно в данной области техники. За исключением того, что любые обычные носители или агент несовместимы с клетками, их применение в терапевтических композициях предполагается. Дополнительные активные компоненты также могут быть включены в композиции. Для введения человеку, приготовления должны соответствовать стандартам стерильности, пирогенности, общей безопасности и чистоте, как того требует Центр управления по контролю пищевых продуктов и лекарственных средств.
Специалист в данной области техники знаком с методами получения стерильных растворов для применения любым другим способом. Определение размера клеточного трансплантата и количество клеток трансплантата будет определяться специалистом в данной области техники. В некоторых аспектах, многократные дозы могут вводиться в течение нескольких дней, недель, месяцев или лет. Субъект может получать, например, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19 или 20 единиц трансплантата в той же области или в другой области. В одном варианте реализации, субъекту можно повторно пересаживать трансплантат в ту же область или в другую область. В другом варианте реализации, биологический образец субъекта (например, кератиноциты или клетки роговицы) хранится в соответствующих условиях. Если биологический образец сохраняется, биопсия пунша не требуется, если субъекту необходим новый трансплантат. Сохраненные биологические образцы могут предоставить достаточную или дополнительную информацию для определения необходимого трансплантата для субъекта.
Когда указывается «эффективное количество» или «терапевтическое количество», точное количество композиций данного изобретения, которое должно быть введено, может быть определено врачом с учетом индивидуальных различий в возрасте, весе и состоянии пациента (субъекта). Обычно можно утверждать, что клеточная композиция, содержащая описанные в данном документе клетки, может вводиться в количестве 1-100, 1-103, 1-104, 1-105, 1-106, 1-107 или более 107 клеток, включая все целые значения в пределах этих диапазонов. Композиции клеток также можно вводить многократно в этих дозировках. Клетки можно вводить с использованием инфузионных методов, которые широко известны в иммунотерапии (см., например, Rosenberg et al., New Eng. J. of Med. 319:1676, 1988). Оптимальная дозировка и схема лечения для конкретного пациента могут быть легко определены специалистом в области медицины путем наблюдения за симптомами заболевания пациента и соответственной корректировки лечения.
В некоторых вариантах реализации данного описания, кератиноциты, которые генетически модифицированы с применением способов, описанных в данном документе, или других способов, известных в данной области техники, вводятся пациенту в соответствии с (например, до, одновременно или после) любым количеством соответствующих способов лечения.
Примеры
Следующие примеры приведены, чтобы предоставить специалистам в данной области техники полное пояснение и описание того, как выполнять и применять данное изобретение, и не предназначены для ограничения объема того, что изобретатели считают собственным изобретением, и не предназначены для ограничения примеров, приведенных ниже, которые являются всеми или единственными выполненными экспериментами. Были предприняты усилия для обеспечения точности в отношении используемых чисел (например, количества, температуры и т.д.), но следует учитывать некоторые экспериментальные ошибки и отклонения. Если не указано иное, части представляют собой части по весу, молекулярная масса представляет собой среднюю молекулярную массу, температура представлена в градусах Цельсия, и давление представлено как атмосферное или близкого к атмосферному.
Все публикации и патентные заявки, упомянутые в данном описании изобретения, включены в данный документ посредством ссылки в той же степени, как если бы каждая отдельная публикация или патентная заявка была конкретно и отдельно указаны для включения посредством ссылки.
Данное изобретение было описано с точки зрения конкретных вариантов реализации, найденных или предложенных автором данного изобретения, чтобы включить предпочтительные способы для реализации изобретения. Специалистам в данной области техники будет понятно, что с учетом данного описания, могут быть сделаны многочисленные модификации и изменения в конкретных вариантах реализации, не отступающих от предполагаемого объема изобретения. Например, из-за избыточности кодонов изменения могут быть сделаны в исходной последовательности ДНК, не затрагивая последовательность белка. Более того, из-за соображений биологической функциональной эквивалентности, изменения могут быть внесены в структуру белка, не влияя на биологическое действие в натуральном выражении или количество. Все такие модификации предназначены для включения в объем прилагаемой формулы изобретения.
Пример 1
Перепрограммирование аутологичных клеток как лечение рецессивного дистрофического буллезного эпидермолиза (РДБЭ).
Рецессивный дистрофический буллезный эпидермолиз (РДБЭ) представляет собой тяжелое пузырное заболевание кожи, вызванное потерей функциональных мутаций COL7A1, гена, кодирующего коллаген VII типа (C7). C7 является основным компонентом якорных фибрилл (ЯФ), которые прикрепляют зону эпидермальной базальной мембраны (ЗБМ) к дерме. C7 выполняет эту функцию за счет использования нескольких доменов, включая аминоконцевой неколлагенный NC1-домен, который связывает лиганды БМ, центральный коллагеновый домен, который собирается в тройную спираль, и домен NC2, который катализирует сборку C7 в ЯФ. Потеря этих функциональных доменов C7 в РДБЭ приводит к значительному отделению БМ. Это вызывает обширные и болезненные пузыри, эрозии и рубцевание, что, в свою очередь, может привести к агрессивной и часто летальной форме ПКК, появляющейся на втором третьем десятилетии жизни. Несмотря на достижения в молекулярной диагностике данного заболевания, текущая терапия ограничивается паллиативной помощью. Клинические испытания аллогенных фибробластов (Venugopal et al, J. Am. Acad. Dermatol. 2013;69(6):898-908), пересадка костного мозга (Wagner et al, N. Engl. J. Med. 2010;363(7):629-639), внутрикожное и внутривенное лечение мезенхимальными стволовыми клетками костного мозга (Conget et al, Cytotherapy 2010;12(3):429-431; Petrof et al, J Investig. Dermatol. 2015;135 (9):2319-2321; Gorell et al, Pediatr. Dermatol. 2015;32 (2):220-225) и замены кожи (Falabella et al, Arch Dermatol. 2000; 136 (10): 1225-342) были проведены с различными показателями эффективности и безопасности. В доклинических исследованиях были изучены возможные методы лечения, включая внутривенные и местные С7, индуцированные плюрипотентные стволовые клетки и аминогликозиды.
Генная терапия является потенциально мощным инструментом для лечения моногенных заболеваний, таких как РДБЭ. Тем не менее, серьезные проблемы безопасности были подняты после переноса генов пациентам с тяжелым комбинированным иммунодефицитом и синдромом Вискотта-Олдрича. Хотя инсерционный мутагенез по-прежнему остается потенциальной проблемой, преимуществом кожной генной терапии является способность легкой клинической оценки новообразования из-за поверхностного размещения пересаженной ткани. Кроме того, генетически модифицированные трансплантаты кожи успешно использовали для лечения одного пациента с пограничным ЭБ с длительной коррекцией и без нежелательных побочных эффектов. Платформа для долгосрочной экспрессии C7 в регенерированном эпидермисе человека была установлена для пересадки иммунодефицитным мышам (Siprashvili et al., Hum. Gene Ther., 2010, 21(10):1299-1310). Данное описание на сегодня предлагает результаты клинического испытания стадии I по переносу гена ex vivo, в модифицированных LZRSE-COL7A1 аутологичных трансплантатах эпидермального слоя (LEAES), пересаженных субъектам с тяжелым РДБЭ.
Клинические результаты
Субъекты и лечение. Из 38 осмотренных испытуемых, 8 дали согласие на исследование и 4 пациента были включены в исследование, и получили трансплантаты (фиг. 2). Субъекты имели различные сложные гетерозиготные мутации COL7A1, приводящие к экспрессии усеченного C7 (домен NC1), который был обнаружен в среде кератиноцитов с помощью Вестерн-блоттинга (фиг. 3), но не в ткани с помощью НИФ (фиг. 1F, фиг. 5B, 6B, 7B, 8B, 12). Все испытуемые были мужчинами со средним возрастом 23 года (диапазон 18-32) и поражением общей площади поверхности тела от 4% -30%. У каждого из них было тяжелое заболевание с внекожными проявлениями, включая анемию в анамнезе, стриктуры пищевода и псевдосиндактилию (таблица 1).
Первичные кератиноциты РДБЭ выделяли из неповрежденной кожи и трансдуцировали ретровирусным вектором LZRSE-COL7A1 со средней эффективностью 70% и 0,8 провирусных геномов на клетку (фиг. 1B-D). У каждого пациента на пять рубцующихся и/или эродирующих поверхностей и одну формирующуюся рану пересаживались трансплантаты. Большинство хронических ран для пересадки присутствовали в течение> 5 лет (таблица 3). Все 24 трансплантата были подвергнуты продолжительному наблюдению на процент заживления ран, инфекции, боли и зуда.
Эффективность. Все пациенты сообщили об улучшении заживления ран и упругости кожи, а также о снижении боли и зуда в местах пересадки. Трансплантаты демонстрировали уменьшение пузырей по сравнению с исходным уровнем; представлены иллюстративные изображения от каждого субъекта (фиг. 1Е, фиг. 5А, 6А, 7А, 8А, 12). Напротив, необработанные раны демонстрировали непрерывное образование пузырей (фиг. 10).
Через 1 месяц после трансплантации 20/24 раны (83%) показали ≥75% заживления, тогда как только 4 раны показали исцеление на 50-74% (таблица 3). Через 3 месяца раны 21/24 (87%) заживились на ≥75%, в то время как 3/24 (13%) - на 50-74% (таблица 3). Через 6 месяцев, 16/24 (67%) заживились на ≥75%, 5/24 (21%) заживились на 50% -75%, и только 3/24 (13%) пересаженных участков демонстрировали пузыри и рассматривались как неудачные пересадки (0% -49% заживились).
Молекулярный анализ трансплантатов LEAES показал достоверную экспрессию C7 в 9/10 (90%) образцах через 3 месяца и 8/12 (66%) через 6 месяцев. Анализ НИФ для LEAES показал соответствующую локализацию C7 на эпидермально-дермальном соединении (фиг. 1F, фиг. 5B, 6B, 7B, 8B, 12) в отличие от нескорректированного контроля кожи. LEAES-трансплантаты показали полностью дифференцированный эпидермис с остистыми и гранулированными слоями, которые были положительны для эпидермальных маркеров кератина 14, кератина 1 и лорикрина, напоминали нормальную кожу (фиг. 1F, фиг. 5В, 6В, 7В, 8В, 12). Среди отрицательных образцов, C7 не обнаруживался в анализируемых биопсиях, полученных у субъекта 2 через 6 месяцев; однако якорные фибриллы (ЯФ) присутствовали в параллельной биопсии. Через 6 месяцев, C7 идентифицировали у субъекта 4 с использованием антител, специфичных к домену NC1 (фиг. 1F).
Для оценки молекулярной структуры БМ в корректированных образцах, биопсии, полученные из трансплантатов LEAES, также анализировали с помощью трансмиссионной электронной микроскопии (Способы). Через 3 месяца 5/7 образцов (71%) выявили морфологически нормальный внешний вид и частоту NC2 реактивных ЯФ (фиг. 1G). Через 6 месяцев ЯФ детектировались в 4/12 (33%) биопсиях, при этом ЯФ не детектировались в биопсиях, полученных от субъекта 4 (фиг. 1G).
Безопасность. О серьезных побочных явлениях не сообщалось. Зуд в месте пересадки (n = 3), следуемый за дренированием пересаженных участков (n = 2) были наиболее частыми побочными эффектами (1 или 2 степени) и никаких клинических признаков злокачественных образований не отмечено. Анализы RCR и Т-клеточной цитотоксичности были отрицательными во всех временных точках (таблица 2).
Увеличенное дренирование раны наблюдалось в 2/24 ранах, однако, на участках отмечено отсутствие признаков инфекции, включая отсутствие эритемы, отеков, боли или болезненных ощущений. Через 6 месяцев сайт Z у субъекта 3 имел колонизацию раны (степень 2) и считался неудачной пересадкой (таблица 3). Зуд был отмечен на 3/24 пересаженных участках и 2 отечных участка (1 степень).
Иммунные ответы C7 тщательно контролировались на протяжении всего исследования. Ни у кого из субъектов не было системных аутоиммунных симптомов или увеличения пузырей за пределами пересаженных областей. У субъекта 1 никакие циркулирующие или тканеспецифические антитела не выявлялись с помощью НИФ или ПИФ (таблица 2). Субъект 2 через 3 месяца показал 1+ (слабый) линейный IgG, IgM, IgA, без дополнительного ПИФ-анализа раны 2 (A и E). Эти иммунореактанты не наблюдались через 6 месяцев после пересадки. Субъект 3 показал переходное повышение линейного сывороточного IgA (1: 320) на 3-й месяц с НИФ с прослеживанием только 1+ окрашиванием ткани линейным IgM и IgA на 6-м месяце при ПИФ. В противоположность этому, у субъекта 4 был выявлен титр циркулирующих линейных антител IgG 1:160 на 1 и 3 месяце с НИФ вместе с окрашиванием 1 - 2+ IgG, IgA, C3 и IgM, детектированными в 3-х трансплантатах на 3-м месяце с ПИФ (таблица 2). Тем не менее, никаких системных аутоиммунных симптомов или увеличения пузырей вне трансплантатов не отмечалось, и результаты анализа C7-специфической Т-клеточной цитотоксичности были отрицательными. На 6-м месяце уровни сывороточного антитела IgG и С3 снижались (1:40) при отсутствии детекции в трансплантатах связанных с тканью имунных комплексов (таблица 2). После обнаружения субэпидермальных линейных иммунных комплексов у субъекта 4, мы повторно проанализировали исходные уровни анти-C7 антител субъекта 4, используя Вестерн-блот-анализ очищенного белка C7. В противоположность негативным исходным данным НИФ, анализ вестерн-блоттинга показал, что как исходная (1: 300), так и сыворотка после 3 месяцев после пересадки (1: 1000) была реактивной к очищенному С7, что указывает на то, что субъект 4 был сенсибилизирован к экзогенному С7 до размещения трансплантата (фиг. 11A). Реакционная способность антител сыворотки субъекта 4 к ранее охарактеризованному карбокси-концевому пепсиновому фрагменту C7 была подтверждена как до, так и после размещения трансплантата (фиг. 11B).
Обсуждение. Генетическая коррекция РДБЄ порождает серьезную задачу, так как требует эффективной доставки большого количества трансгена, содержащего кДНК COL7A1> 9 т.п.о. В данном документе, описание предлагает исследование на людях генетически корректированных аутологичнных трансплантатов эпидермального слоя кератиноцитов с обнадеживающей эффективностью и приемлемой безопасностью у 4 субъектов с РДБЭ. Генетически корректированные эпидермальные клетки регенерировали функциональный, самовосстанавливающийся эпидермис более чем в 67% пересаженных участков, которые были протестированы через 6 месяцев после пересадки с C7, детектируемого до одного года для одного субъекта (фиг. 12). Это стало заметным улучшением по сравнению с трансплантатами аллогенных кератиноцитов, где только 2/9 (22%) хронических ран заживали через 18 недель. LEAES также улучшали результаты заживления ран по сравнению с инъекциями аллогенных фибробластов, которые показали некоторое первоначальное улучшение заживления ран, но не имели долгосрочных отличительных признаков по сравнению с плацебо или внутрикожными или внутривенными инъекциями МСККМ. В отчете о случаях генной терапии для пограничного буллезного эпидермолиза с использованием аналогичной методики, указывалась коррекция сроком до 6 лет, что обеспечивает приоритет долгосрочного терапевтического эффекта. Экспрессия C7 на протяжении шести месяцев, которую мы наблюдаем в наших трансплантатах LEAES перекрывает по времени продолжительность 6 циклов обновления эпидермиса, что говорит о том, что мы успешно модифицировали стволовые клетки посредством нашего способа переноса генов.
В нашем исследовании, улучшенное заживление ран и повышенная устойчивость кожи были непосредственно связаны с детектируемым синтезом полноразмерного C7 и формированием ЯФ в БМ. Принимая во внимание отсутствие до пересадки, вместе они присутствовали в каждый контрольный момент времени исследования, несмотря на детектирование с переменной эффективностью: 66-90% экспрессии C7 и 33-71% формирования ЯФ. Изменчивость образцов биопсии может быть связана либо с гетерогенной популяцией корректированных эпидермальных клеток, либо с частичным приживлением трансплантата. В некоторых вариантах реализации, область трансплантата может быть областью, где субъект чувствовал бы полезность для его качества жизни. Тем не менее, в течение критических первых нескольких дней размещения трансплантата, некоторые из областей были трудно иммобилизовать или защитить от механического трения (например, участок Е поясницы субъекта 2, участок B левого плеча, таблица 3, задний участок D заднего плеча, фиг. 6A). Кроме того, более короткое время иммобилизации после пересадки, как наблюдалось, может отрицательно влиять на приживление трансплантата, о чем свидетельствует снижение заживления ран и отсутствие детектируемого С7 посредством ИФ в пробных биопсиях у субъекта 2 на шестой месяц, поскольку у субъекта была наиболее короткая иммобилизация после трансплантации по сравнению с другими участниками исследования (таблица 1). Более того, хотя индуцированные раны проявляют хорошую заживляющую способность, они показали наименьшую экспрессию C7. Возможно, что без метода деструкции, такого как электрокаутеризация, остаточные не корректированные кератиноциты раневой кровати могли бы нарушить восстановление вышележащих LEAES трансплантатов. Эти данные свидетельствуют о том, что улучшенные методы подготовки раневого слоя, которые более эффективно удаляют кератиноциты раневой поверхности, могут улучшить приживление трансплантата.
Что касается безопасности, сообщалось о нескольких нежелательных явлений, и те, которые были замечены, были слабыми. Ни у одного из субъектов не было доказательств наличия RCR в крови или плоскоклеточной карциномы при трансплантации в любой контрольный момент времени, однако длительное наблюдение нежелательных явлений продолжается. Все молекулярные подходы замещения, включая перенос генов, представляют риск нежелательных иммунных ответов против терапевтического средства, особенно у субъектов с нулевыми мутациями. В этом исследовании все субъекты экспрессировали усеченную молекулу С7, содержащую домен NC1, который считается антигенной частью белка, что сводит к минимуму риск потенциальной иммунной реакции. Никаких доказательств активной Т-клеточной цитотоксичности, ассоциированной с C7, не наблюдалось в любой контрольный момент времени у всех субъектов во время исследования. Тем не менее, исследования НИФ и ПИФ у субъекта 4 выявили БМ-реактивный IgG на первом и третьем месяце, дополненный C3-фиксацией через три месяца с более низким титром сывороточного IgG на шестом месяце после трансплантации (таблица 2). Хотя сообщалось, что домен NC1 является самой антигенной частью C7, домен NC2 карбоксильного конца также содержит незначительные антигенные эпитопы, и наличие анти-C7-аутоантител у пациентов с РДБЭ было широко описано в предыдущих работах. Доказательства того, что субъект 4 имел детектируемые анти-С7 антитела до трансплантации с использованием Вестерн-блот-анализа, что не было установлено в процессе скрининга с помощью анализа, проведенного CLIA-сертифицированным НИФ, предполагает, что необходимо разработать более чувствительные стандартизированные методы для оценки исходной иммунной перекрестной реактивности в будущих терапевтических исследованиях.
В заключение необходимо отметить, что генетически корректированные аутологичные трансплантаты кожного эпидермиса продемонстрировали повышенное депонирование С7 и уменьшенное образование пузырей у пациентов с тяжелым РДБЭ, группы пациентов, имеющей несколько другие специфические варианты лечения. Большие исследования, с участием более молодых субъектов с РДБЭ, планируются для оценки долгосрочной эффективности и безопасности этого подхода.
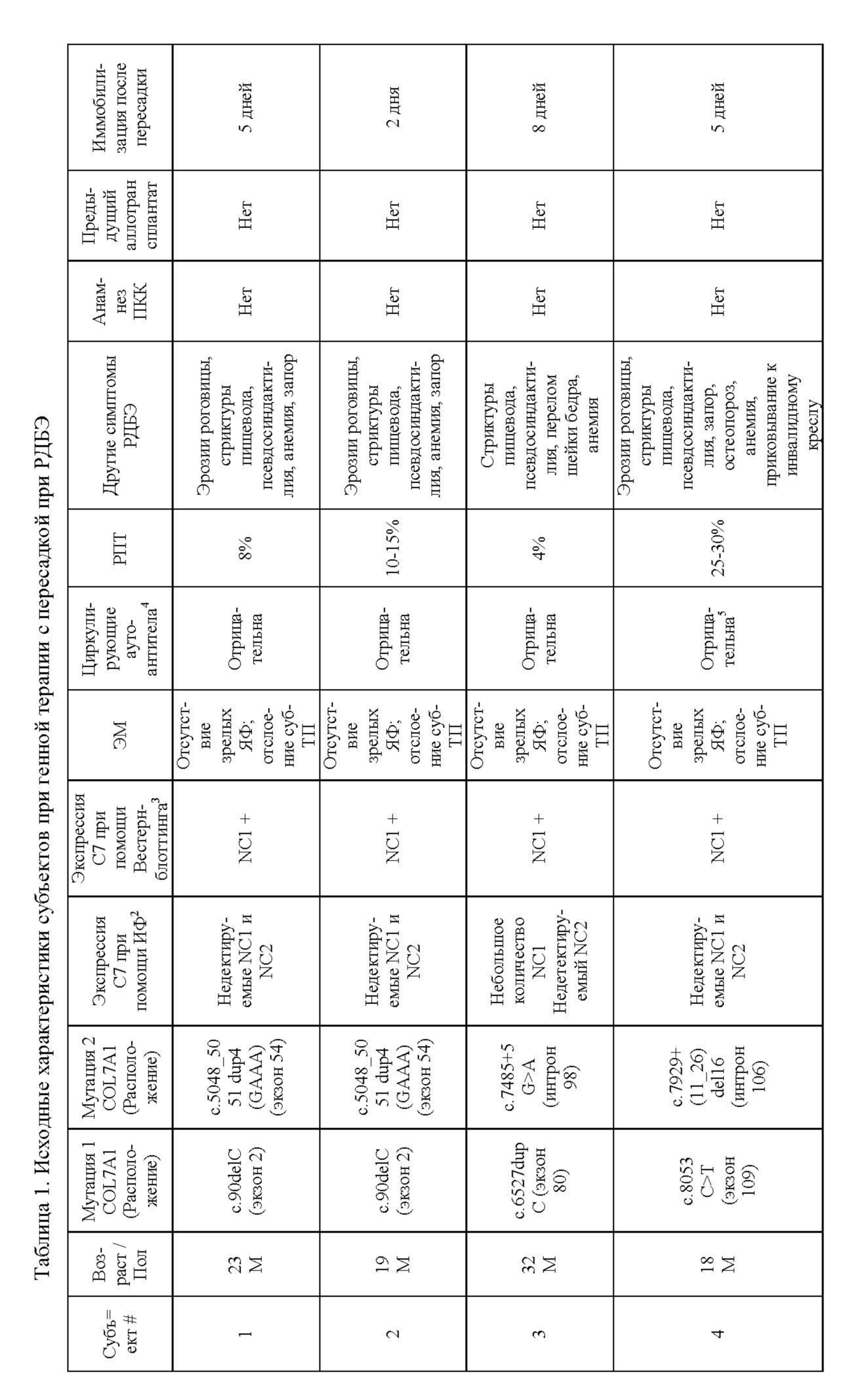
1РПТ обозначает предполагаемую площадь раневой поверхности тела, ППК обозначает плоскоклеточную карциному, ИФ обозначает иммунофлуоресцентный анализ биопсии кожи, ЭМ обозначает электронную микроскопию биопсии кожи, ЯФ обозначает якорные фибриллы, ТП обозначает темную пластинку, а C7 обозначает коллаген VII типа
2 Оценка NC1 с использованием LH7.2 и NC2 с LH24
3 Образец биопсии кожи, оценивали с использованием антитела FNC1
4Определяется с помощью непрямой иммунофлуоресценции с сывороткой на пищеводе обезьян
5Циркулирующие аутоантитела, наблюдаемые на вестерн-блоттинге в начале исследования; исследовали следующие признаки иммунного ответа после пересадки
Таблица 2. Результаты генной терапии с применением трансплантатов и системной безопасности
1 С использованием непрямой иммунофлуоресценции из образца сыворотки на пищеводе обезьян, аутоантитела, локализированные в зоне базальной мембраны
2 RCR-репликация компетентного ретровируса, присутствующего в крови
3 Клинические подтверждения плоскоклеточной карциномы или другого новообразования на участках трансплантата
4Прямая иммунофлуоресценция, выполняемая на биопсии кожи, аутоантитела, локализированные в зоне базальной мембраны
5НП означает, что не проводили
Таблица 3. Исходные характеристики места трансплантата, клинический ответ и результаты последующей биопсии кожи1

1Серый означает, что трансплантат заживился на ≥75%, горизонтальная штриховка указывает на 50-74% заживления, черный означает <49% заживления на основании клинической и фотографической оценки исследователей
2 ± 3 недели
Методы
План клинического исследования. Это I стадия открытого клинического исследования (NCT01263379). Основные цели исследования заключались в получении данных по безопасности и эффективности у субъектов РДБЭ с модифицированными аутологичными кератиноцитами, трансдуцированными ретровирусным вектором, содержащим полноразмерную кодирующую последовательность COL7A1 (фигура 1A). В период с октября 2013 года по февраль 2015 года 4-м взрослым субъектам пересадили LEAES. Данные по всем субъектам собирались по меньшей мере последующие шесть месяцев. Это исследование было одобрено Управлением по контролю пищевых продуктов и лекарственных средств (IND # 13708) и Стэнфордским международным реестром биологической безопасности (Protocol #14563).
Субъекты. Субъекты были 18 лет и старше, с клинически диагностированным РДБЭ, имели участки от 100 до 200 см2 открытых эрозий, подходящих для пересадки LEAES. Субъекты также могли переносить общую анестезию и отбирались на основе протокола скрининга, в котором РДБЭ был подтвержден с помощью генетического тестирования (GeneDx, Гейтесберг, Mерилэнд). Присутствие NC1-домена C7 оценивали с помощью Вестерн-блоттинга супернатанта культивируемых кератиноцитов (KЦ) и методом непрямой иммунофлуоресцентной микроскопии (НИФ) образцов биопсии кожи. Отсутствие полноразмерных C7 и зрелых ЯФ в образцах биопсии было подтверждено НИФ и иммуноэлектронной микроскопией (ИЭМ) с использованием антитела LH24, специфичного к карбоксильному концевому домену NC2 С7 (фиг. 9). Циркулирующие и связанные в ткани IgG, IgA, IgM и C3 анализировали с помощью НИФ с использованием сыворотки на пищеводе приматов и прямой иммунофлуоресценции (ПИФ) участков биопсии субъекта, соответственно. Субъекты со значительными медицинскими осложнениями, не связанными с RDEB, включая ВИЧ, гепатит, системную инфекцию или аномалии сердца, были исключены. Анемию с клиническим проявлением лечили до пересадки.
Лечение в рамках исследования. Для приготовления LEAES были получены две 8-ми мм биопсии пунша из неповрежденных участков кожи без рубцов. Исходные образцы крови были получены для ОАК, развернутого биохимического анализа крови (БАК), а также для репликации компетентного ретровируса (RCR) и C7-чувствительного цитотоксического Т-клеточного анализа. Аутологичные кератиноциты, полученные при биопсии кожи трансдуцировали с помощью LZRSE-COL7A1 и использовали для получения восьми трансплантатов LEAES (фиг. 4). Шесть трансплантатов применены к неинфицированным, эродированным и/или рубцующимся участкам раны, в которых не было клинических доказательств ППК. Из шести ран с пересаженными участками (A, B, C, D, E, Z, таблица 3), одну рану сформировали у каждого пациента во время операции путем механического трения («сайт Z»). Под общей анестезией, раневые поверхности каутеризировали для сведения к минимуму вероятности сохранения эпидермальных стволовых клеток. После подготовки раневой поверхности, трансплантаты LEAES прикрепляли к раневым поверхностям посредством рассасывающихся швов. Субъекты 3 и 4 согласились иметь небольшие рисованные индийские татуировки, расположенные в углу каждого трансплантата, как вспомогательное средство при идентификации последующих трансплантатов. Трансплантаты покрыли стандартным перевязочным материалом с местным применением мупироцина, и удалили через 5-7 дней после пересадки.
Результаты и оценки. Субъектов наблюдали через 1, 3, 6 и 12 месяцев после пересадки. При каждом визите, предусмотренным исследованием, образцы сыворотки оценивались на циркулирующие аутоантитела с помощью НИФ, C7-чувствительного цитотоксического Т-клеточного анализа, CBC и CMP. Присутствие RCR в сыворотке оценивали через 3 и 6 месяцев. При каждом визите, представленные трансплантаты подвергались биопсии для оценки связанных в тканях иммуноглобулинов и комплемента с помощью ПИФ, экспрессии C7 с помощью НИФ и присутствие фибрилл с помощью ИЭМ. Раны оценивались клинически и рассматривались как: Зажившие на 100% -75% (определяемых как значительное заживление ран), заживление на 74% -50%, заживление на 49% -25%, заживление менее 25% по сравнению с исходным уровнем с использованием цифровой фотографии и/или камеры Canfield Vectra.
Материалы и реагенты
Все материалы и реагенты, используемые во время изготовления LEAES, были свободны от адвентивных вирусов на основе сертификации анализов, предоставленных производителем. Каждая среда для культуры тканей, которая включала реагенты, полученные из крупного рогатого скота, тестировали с помощью коммерческого теста 9CFR на гемадсорбцию для адвентивных вирусов (American BioResearch, Пулман, Вашингтон) и обнаружили отрицательный результат.
Изоляция и рост кератиноцитов РДБЭ. Образцы кожи были получены в виде двух 8-ми мм биопсий пунша и перенесены в 35 мл среды для биопсии 50/50А (50% среды 154 для кератиноцитов с ростовой добавкой для кератиноцитов человека (Life Technologies, Карлсбад, Калифорния) и 50% определенной безсывороточной среды для кератиноцитов (Life Technologies, Карлсбад, Калифорния)) с амикацином 30 мкг/мл (HIkma Pharmaceuticals, Лондон, Великобритания), 20 мкг/мл ванкомицина (Sigma Aldrich, Сент-Луис, Миссури) и 0,5 мкг/мл амфотерицина B (USBiological, Салем, Массачусетс). Чтобы отделить эпидермис от дермы, образец кожи помещали в раствор диспазы, содержащий 25 казеинолитических единиц/мл диспазы (Life Technologies, Карлсбад, Калифорния) на 16-20 часов при 5°C. На следующий день эпидермис тщательно очищали от дермы и помещали в раствор TrypLE Select 10X (Life Technologies, Карлсбад, Калифорния) при 37°C в течение 20-30 минут. Раствор центрифугировали при 1200 об/мин для получения конгломерата кератиноцитов. Клетки промывали один раз физиологическим раствором, забуференным фосфатом (PBS, Life Technologies, Карлсбад, Калифорния), а кератиноциты высевали на PureCoat Collagen I Mimetic Cultureware (Corning Life Sciences, Тьюксбери, Mассачусетс) в средах 50/50A. После того, как кератиноциты достигли 60-70% слияния, клетки обрабатывали TrypLE Select 10X и пересеивали для вирусной трансдукции. Для инициирования процесса трансдукции потребовалось по меньшей мере 4×106 клеток.
Коррекция кератиноцитов. псевдотипированный GalV вирус LZRSE-COL7A1 стандарта GMP, содержащий полноразмерную кДНК COL7A1 под контролем MLV LTR, был сконструирован в Индианском университете на Факультете производства векторов с использованием действующих Правила организации производства и контроля качества лекарственных средств как описано Siprashvili et al., 2010. Карта плазмиды pLZRSE-COL7A1 изображена на фиг. 13 с ее полной последовательностью, показанной в SEQ ID NO: 1. Вирусную трансдукцию проводили путем внесения 12 мл вирусного супернатанта в каждую чашку и центрифугирования клеток при 1250 об/мин и 32°С в течение 1 часа. После центрифугирования вирусный супернатант удаляли промыванием PBS и средой 50/50V, используемой для роста корректированных кератиноцитов. Трансдукция повторялась по мере необходимости, пока корректированные KЦ продолжали отвечать критериям до высвобождения по эффективности вирусной трансдукции (VTE)> 50% и числу копий провирусного генома (PGCN) ≤ 3.
Тестирование до высвобождения. Тест VTE. Тест VTE проводили с использованием ИФ-методов с моноклональным антителом NP32, NP185 к коллагену VII типа или анти-коллагеновым VII типа поликлональным антителом FNC1. Клетки фиксировали в смеси растворов метанол/ацетон, пермеабилизировали в детергенте и инкубировали с анти-C7-первичным антителом в течение 1 часа при комнатной температуре. После длительных промывок, добавляли вторичные антитела, конъюгированные с красителем Alexa Fluor 555, и инкубировали еще 1 час. Ядра клеток, метили Хехст 33342 в течение 10 минут, промывали и заключали в средство, препятствующее выгоранию флюоресценции Prolong gold antifade reagent (Life Technologies, Карлсбад, Калифорния). VTE определяли путем подсчета отношения синих ядер к С7-положительным клеткам. Чтобы отвечать критериям до высвобождения, по меньшей мере 50% клеток были позитивными по экспрессии C7.
Тест PGCN. Тест PGCN проводили с помощью анализа количественной ПЦР геномной ДНК, выделенной из корректированных КЦ РДБЭ после трансдукции ретровирусом. Геномную ДНК выделяли из 3х106 корректированных клеток с использованием набора Qiagen DNeasy Blood & Tissue Kit (Qiagen, Germany)(Qiagen, Германия). ДНК определяли количественно с использованием стандартных спектрофотометрических методов и использовали для анализа количественной ПЦР. Провирусную дозу определяли с использованием порогового цикла (Ct) матрицы и стандартной кривой зависимости Ct от количества контроля плазмидной ДНК. Средняя PGCN была рассчитана из: PGCN = (TPCN x 6.16pg) / (Ctempl. x 103pg), где, TPCN = Сумароное число провирусных копий. 6.16pg = Количество геномной ДНК в соматических клетках. Ctempl. = Количество матриц, используемых в ПЦР в нанограммах. Чтобы отвечать критериям до высвобождения, не более 3 чисел копий провирусного генома было представлено в среднем для каждого генома кератиноцитов.
Тест на стерильность. Образец супернатанта культуры тестировали на стерильность с помощью мембранной фильтрации с использованием системы Millipore Steritest, предназначенной для устранения потенциальных ложноотрицательных антибиотиков, присутствующих в культуральной среде (Pacific BioLabs, Геркулес, Калифорния). После фильтрации и промывки образец помещали в казеин-соевую питательную среду и жидкую тиогликолевую среду и инкубировали в течение 14 дней. Образцы наблюдались ежедневно для подтверждения микробной контаминации.
Тест на эндотоксин. Образец культивированного супернатанта оценивали с помощью анализа с лизатом амебоцитов Limulus (LAL) QCL-1000 (Lonza, Базель, Швейцария) в соответствии с рекомендациями производителя. Результаты этого теста были <1,0 ЕЭ/мл, для удовлетворения требований высвобождения продукта.
Тест на микоплазму. Супернатант клеточной культуры тестировали на микоплазму с использованием набора MycoAlert Mycoplasma Detection Kit (Lonza, Базель, Швейцария) в соответствии с требованиями производителя. Результаты этого теста были <0,9 для удовлетворения требований высвобождения продукта.
Инициирование и изготовление LEAES. После того, как корректированные кератиноциты достигли 100% -ного слияния, начинали процесс инициирования LEAES, и ростовую среду 50/50V заменяли на среду DFF31 для образования эпидермального слоя, которая состоит из среды Игла в модификации Дульбекко (Life Technologies, Карлсбад, Калифорния) и среды F12 (Lonza, Базель, Швейцария), содержащую 10% фетальную бычью сыворотку (Lonza, Базель, Швейцария), 36 нг/мл гидрокортизона (Spectrum, Нью-Брансуик, Нью-Джерси), 25 мкг/мл аденина (Sigma Aldrich, Сент-Луис, Миссури), 5 мкг/мл рекомбинантного человеческого инсулина (Sigma Aldrich, Сент-Луис, Миссури), 2 нг/мл лиотиронина (Spectrum, Нью-Брансуик, Нью-Джерси), 5 мкг/мл бычьего трансферрина (Millipore, Биллерика, Массачусетс), 10 нг/мл рекомбинантного эпидермальный фактор роста (R & D Systems, Миннеаполис, Миннесота) и 30 мкг/мл амикацина (Hikma Pharmaceuticals, Лондон, Великобритания) и 20 мкг/мл ванкомицина (Sigma Aldrich, Сент-Луис, Миссури).
Формирование и транспортировка LEAES. Формирование LEAES начинали в день пересадки. Эпидермальные слои высвобождались с поверхности чашки путем ферментативного расщепления диспазой (Life Technologies, Карлсбад, Калифорния) в течение 20-30 мин при 37°C. Для удаления остаточных количеств среды и диспазы, эпидермальные слои промывали по меньшей мере 5 раз 50/50VC. Они были прикреплены к соответствующим размерам вазелиновой салфетки при помощи хирургических сосудистых клипс, а базальная сторона была отмечена стерильным черным швом. Сформированные LEAES были погружены в транспортную среду 50/50VC и герметизированы газопроницаемой стерильной пленкой. Затем эпидермальные трансплантаты LEAES переносили в операционную для трансплантации.
Тестирование высвобождения. Тест на стерильность окрашиванием по Граму. В день высвобождения LEAES, образец культуральной среды был отправлен в клиническую лабораторию Стэнфордской больницы для экспресс-теста окрашиванием по Граму. Отрицательный результат теста был использован как критерий высвобождения LEAES.
Тест на жизнеспособность LEAES. Проводили тестирование на жизнеспособность, в котором образец LEAES инкубировали со смесью ядерного красителя, содержащего Хехст 33342 и краситель SYTOX Green, окрашивание в течение 20 минут. Соотношение окрашивания SYTOX Green к окрашиванию Хехст 33342 рассчитывали на уровне ≥70% для высвобождения образца.
Тестирование после высвобождения. Образцы культуральной среды и трансплантата LEAES были отправлены для тестирования в другие лаборатории, с ожиданием того, что результаты теста будут получены после пересадки трансплантата из-за длительной процедуры тестирования. Был разработан план обеспечения безопасности, если эти результаты теста после высвобождения не соответствуют техническим требованиям. Критерии после высвобождения включали дополнительное тестирование на стерильность (см. тест на стерильность при тестировании перед высвобождением), тестирование RCR (Индианский университет Факультет производства векторов) и тестирование на микоплазму (Тестирующая лаборатория по бионике, Саранак Лейк, Нью-Йорк).
Тест RCR. Образец LEAES и супернатант культивированных LEAES подвергали расширенному анализу на образование бляшек с помощью PG-4 S + L-клеток в Индианском университете Факультете производства векторов в соответствии с их рекомендациями и результат теста «отсутствие доказательств RCR», использовался в качестве критерия высвобождения. На начальном этапе, через 3 месяца и 6 месяцев образцы крови анализировали в Индианском университете Факультете производства векторов для определения уровня последовательностей оболочки GALV (GALV-E) с использованием количественной полимеразной цепной реакции (Q-PCR). Соответствие количества образца крови оценивали вторым зондом и набором праймеров для последовательностей генов аполипопротеина В человека. В качестве положительного контроля использовали стандартную кривую с использованием геномной ДНК 12/22/15 8, содержащей 105, 104, 103, 102 и 10 копий последовательности GALV-E на 0,12 мкг геномной ДНК. Отрицательный контроль включал нетрансдуцированную человеческую геномную ДНК и воду.
Анализ Т-клеточной цитотоксичности. 15 мл цельной крови собирали в начале, 1 месяц, 3 месяца и 6 месяцев для анализа Т-клеточной цитотоксичности. Мононуклеарные клетки периферической крови выделяли из лейкоцитарной пленки или цельной крови с использованием центрифугирования с градиентом плотности фиколл-пак (GE Healthcare). Слипшиеся моноциты затем восстанавливали после 2-часовой инкубации в чашках Петри. CD4 + и CD8 + Т-лимфоциты выделяли вместе с использованием наборов MACS магнитного сортинга клеток (Miltenyi Biotech) путем инкубации неприкрепленных клеток с анти-CD4 и анти-CD8-антителами, конъюгированными с парамагнитными микрогранулами. 96-луночные ПВДФ-фильтрующие плашки (Millipore) покрывали моноклональным антителом против ИФ-γ (BD Pharmingen) или ИЛ-4 (BD Pharmingen), блокировали с использованием среды RPMI с 5% сывороткой человека AB и промывали сывороткой - без RPMI. CD4 + и CD8 + Т-лимфоциты (2x105 клеток/лунка) и γ-облученные моноциты (2,5×104 клеток/ лунка) совместно инкубировали на плашках в присутствии 20 МЕ/мл ИЛ-2 в течение 40 часов при 37°C, в увлажненном, газовом инкубаторе с 5% CO2. Среда содержала 10 мк/гмл рекомбинантного коллагена VII типа или 3 мкг/мл конканавалин А (Sigma) для стимуляции лимфоцитов. Плашки промывали и ИФ-γ или ИЛ-4, секретируемые отдельными клетками, детектировали in situ путем последовательного реагирования каждой лунки с биотинилированным анти-ИФ-γ или анти-ИЛ-4 моноклональным антителом (BD Pharmingen) при 1 мкг/мл, с последующим разведением 1:1000 стрептавидин-конъюгированной щелочной фосфатазы (Roche). Детектирование проводили с использованием хромогенного субстрата BCIP/NBT (Promega). Реакцию останавливали промыванием водой, и бляшки подсчитывали с использованием ридера CTL ELISPOT. Отрицательные контроли проводились параллельно с использованием Т-клеток без антигена, и соответствующие оценки были вычтены из значений неизвестных.
Характеристика анти-C7 LH24 мкАТ. МкАТ LH24 было идентифицировано ранее для реакции с эпидермальной базальной мембраной 2. Его специфическое отсутствие в коже ДРБЭ-пациента с нулевым C7 в нашем исследовании показало, что оно распознал эпитоп на C7. Для дальнейшего определения реакционной способности LH24 на молекуле C7, реактивность LH24 к ферментативным расщеплениям C7, содержащего домены NC1 и NC2, тестировали с использованием Вестерн-блота. NC1-домен, содержащий C7-фрагмент, получали путем расщепления выделенного C7 с высокоочищенной бактериальной коллагеназой (Worthington), как описано ранее. 3 NC2 12/22/15 9, содержащие фрагмент C7, получали после расщепления пепсином очищенного C7, как описано выше.
Электронная микроскопия. 3 мм образец кожи после биопсии пунша был приготовлен для электронной микроскопии путём погружения в смесь 1,5% глутаральдегида/1,5% параформальдегида в бессывороточной среде Дюльбекко (SFM), содержащей 0,05% таниновую кислоту в течение как минимум одного часа, с последующей интенсивной промывкой в SFM, и пост-фиксацией в 1% OsO4 в течение 60 минут. Образцы промывали в SFM, затем обезвоживали в этаноле возрастающих концентраций до 100%, промывали в пропиленоксиде и пропитывали смесью эпоксидных смол Spurr в сумме в течение двух часов, ускоряя через микроволновую энергию. Образцы полимеризовали при 70°С в течение 18 часов.
Иммуноэлектронная микроскопия. 3 мм образец кожи после биопсии пунша был приготовлен для иммуноэлектронной микроскопии путем интенсивной промывки в SFM, затем погружения в мышиное антитело IgM LH24, специфичное к области NC2 коллагена VII, разведенного 1:5 в SFM, в течение ночи при 4°C, интенсивно промывали в SFM, затем инкубировали в течение ночи при 4°С в козьем анти-мышином IgM, конъюгированным с ультрамалым коллоидным золотом, разбавленным 1:3 в SFM. После интенсивной промывки в SFM образцы подвергали воздействию раствора для усиления действия золота (gold enhancement solution (Nanoprobes) 15 минут на льду, затем быстро нагревали до 25°C и инкубировали еще 5 минут. Образцы затем промывали ледяным SFM, затем фиксировали и пропитывали, как указано выше. Непрямая иммунофлуоресценция (НИФ): Сыворотки человека помещали в пищевод обезьян и окрашивали антителами, направленными против IgA человека, IgM, IgG и C3. Сигнал, детектированный при разведении антител 1:40 и более, рассмотрен выше в уровне технике.
Прямая иммунофлуоресценция (ПИФ). Ткань 12/22/15 10 нарезали по 5 микрометров и окрашивали конъюгированными с флуорофором антителами к человеческому IgA, IgM, IgG, C3 и фибриногену. Стандартный контроль проводили параллельно. Экспрессия C7 и анализ ЯФ: 3 мм образец кожи после биопсии пунша нарезали по 8 микрометров и анализировали с помощью НИФ с использованием поликлонального антитела FNC1 против коллагена VII типа (направленного против домена NC1 C7) или моноклонального антитела LH24 (NC2-домен C7). Кратко, срезы фиксировали в растворе смеси метанол/ацетон, пермеабилизировали в детергенте и инкубировали с анти-C7-первичным антителом в течение 1 часа при комнатной температуре (25°C). После интенсивных промывок добавляли вторичные антитела, конъюгированные с красителем Alexa Fluor 555 или 488, и инкубировали в течение 1 часа. Ядра клеток, метили Хехст 33342 в течение 10 минут, промывали и заключали в средство, препятствующее выгоранию флюоресценции Prolong gold antifade reagent (Life Technologies, Карлсбад, Калифорния). Эпидермальные маркеры кератин 1, кератин 14 и лорикриновые антитела получали из Covance (Эмервилл, Калифорния). Биопсия оценивалась положительной для экспрессии C7, если было обнаружено непрерывное линейное окрашивание коллагена VII типа в дермально-эпидермальном соединении. Биопсии оценивались как положительные для якорных фибрилл (ЯФ), если обнаруживались частицы золотого конъюгата, представляющие специфические для домена NC2 антитела LH24 на ультраструктурах с отличительными чертами ЯФ, включая плотность, толщину, кривизну, изгиб форму и сворачивание.
Фотографирование. Для субъектов 2-4, использовали 3D-камера Canfield Vectra для получения ~ 5 изображений каждого места трансплантата с нескольких ракурсов. Затем эти изображения соединялись вместе, чтобы создать комплексное 3D изображение. Используя программное обеспечение Mirror (Canfield, Фэрфилд, Нью-Джерси), были выбраны и пронумерованы опознавательные точки для идентификации соответствующих местоположений на каждом изображении, а затем объединены в одно изображение. Чтобы точно отслеживать границы трансплантата, объединенные изображения после последующих посещений сравнивались с исходным изображением с наложением контуров трансплантата с 0-го дня. Анатомические опознавательные точки (например, точки татуировки) были снова идентифицированы, чтобы правильно разместить контуры. Дополнительные снимки для субъектов 2-4 и все изображения для субъекта 1 получали по мере необходимости при помощи цифрового фотографирования (Canon Powershot).
Эквиваленты
Следует понимать, что, хотя описание и рассматривалось в сочетании с вышеупомянутыми вариантами реализации, приведенное выше описание и примеры предназначены для иллюстрации и не ограничивают объем описания. Другие аспекты, преимущества и модификации в пределах объема описания будут очевидны для специалистов в данной области техники, к которой относится описание.
Если не указано иное, все технические и научные термины, используемые в данном документе, имеют то же значение, которое обычно понимается специалистом в данной области техники, к которой относится это изобретение. Все нуклеотидные последовательности, предлагаемые в данном документе, представлены в направлении 5'-3'.
Варианты реализации, наглядно описанные в данном документе, могут быть соответствующим образом реализованы на практике в отсутствие какого-либо элемента или элементов, ограничения или ограничений, которые конкретно не указаны в данном документе. Таким образом, например, термины «содержащий», «включающий», «имеющий» и т.д. должны толковаться широко и без ограничений. Кроме того, используемые в данном документе термины и выражения, использовались как термины описания, а не ограничения, и нет намерения использовать такие термины и выражения для исключения любых эквивалентов характеристик, приведенных и описанных, или их частей, но признается возможность различных модификаций в пределах объема описания.
Таким образом, следует понимать, что, хотя данное описание было конкретно описано конкретными вариантами реализации и необязательными характеристиками, модификация, улучшение и изменение вариантов реализации, раскрытых в данном описании, могут быть использованы специалистами в данной области техники, и такие изменения, улучшения и варианты рассматриваются в пределах объема данного описания. Материалы, способы и примеры, предложенные в данном документе, являются репрезентативными для конкретных вариантов реализации, являются примерными и не предназначены для ограничения объема описания.
Объем описания полно и точно изложен в данном документе. Каждый из более узких типов и субродовых группирований, находящийся в пределах основного описания, также является частью описания. Это включает в себя общее описание с условием или отрицательным ограничением удаления любого значимого субъект из рода, независимо от того, был ли или нет, удаленный материал конкретно перечислен в данном документе.
Кроме того, если признаки или аспекты описания рассмотрены в терминах групп Маркуша, специалисты в данной области техники поймут, что варианты реализации описания могут также таким образом рассматриваться в терминах любого отдельного члена или подгруппы членов группы Маркуша.
Все публикации, патентные заявки, патенты и другие ссылки, упомянутые в данном документе, явным образом включены в качестве ссылки во всей их полноте, в той же степени, как если бы каждая из них была включена посредством ссылки отдельно. В случае конфликта, данное описание изобретения, включая определения, будет контролироваться.
--->
СПИСОК ПОСЛЕДОВАТЕЛЬНОСТЕЙ
<110> Siprashvili, Zurab
Nguyen, Ngon T.
Marinkovich, M. Peter
Tang, Jean
Lane, Alfred T.
Khavari, Paul A.
<120> ГЕННАЯ ТЕРАПИЯ ДЛЯ РЕЦЕССИВНОГО ДИСТРОФИЧЕСКОГО БУЛЛЕЗНОГО ЭПИДЕРМОЛИЗА
С ИСПОЛЬЗОВАНИЕМ ГЕНЕТИЧЕСКИ КОРРЕКТИРОВАННЫХ АУТОЛОГИЧНЫХ КЕРАТИНОЦИТОВ
<130> STAN-1295WO
<150> 62/274,700
<151> 2016-01-04
<150> 62/414,533
<151> 2016-10-28
<160> 1
<170> FastSEQ для Windows версии 4.0
<210> 1
<211> 20326
<212> ДНК
<213> Homo sapiens
<400> 1
cccgaaaagt gccaccagct ttgctcttag gagtttccta atacatccca aactcaaata 60
tataaagcat ttgacttgtt ctatgcccta gggggcgggg ggaagctaag ccagcttttt 120
ttaacattta aaatgttaat tccattttaa atgcacagat gtttttattt cataagggtt 180
tcaatgtgca tgaatgctgc aatattcctg ttaccaaagc tagtataaat aaaaatagat 240
aaacgtggaa attacttaga gtttctgtca ttaacgtttc cttcctcagt tgacaacata 300
aatgcgctgc tgagaagcca gtttgcatct gtcaggatca atttcccatt atgccagtca 360
tattaattac tagtcaatta gttgattttt atttttgaca tatacatgtg aaagacccca 420
cctgtaggtt tggcaagcta gcttaagtaa cgccattttg caaggcatgg aaaaatacat 480
aactgagaat agaaaagttc agatcaaggt caggaacaga tggaacagct gaatatgggc 540
caaacaggat atctgtggta agcagttcct gccccggctc agggccaaga acagatggaa 600
cagctgaata tgggccaaac aggatatctg tggtaagcag ttcctgcccc ggctcagggc 660
caagaacaga tggtccccag atgcggtcca gccctcagca gtttctagag aaccatcaga 720
tgtttccagg gtgccccaag gacctgaaat gaccctgtgc cttatttgaa ctaaccaatc 780
agttcgcttc tcgcttctgt tcgcgcgctt ctgctccccg agctcaataa aagagcccac 840
aacccctcac tcggcgcgcc agtcctccga ttgactgagt cgcccgggta cccgtgtatc 900
caataaaccc tcttgcagtt gcatccgact tgtggtctcg ctgttccttg ggagggtctc 960
ctctgagtga ttgactaccc gtcagcgggg gtctttcatt tgggggctcg tccgggatcg 1020
ggagacccct gcccagggac caccgaccca ccaccgggag gtaagctggc cagcaactta 1080
tctgtgtctg tccgattgtc tagtgtctat gactgatttt atgcgcctgc gtcggtacta 1140
gttagctaac tagctctgta tctggcggac ccgtggtgga actgacgagt tcggaacacc 1200
cggccgcaac cctgggagac gtcccaggga cttcgggggc cgtttttgtg gcccgacctg 1260
agtccaaaaa tcccgatcgt tttggactct ttggtgcacc ccccttagag gagggatatg 1320
tggttctggt aggagacgag aacctaaaac agttcccgcc tccgtctgaa tttttgcttt 1380
cggtttggga ccgaagccgc gccgcgcgtc ttgtctgctg cagcatcgtt ctgtgttgtc 1440
tctgtctgac tgtgtttctg tatttgtctg aaaatttggg cccgggccag actgttacca 1500
ctcccttaag tttgacctta ggtcactgga aagatgtcga gcggatcgct cacaaccagt 1560
cggtagttgt caagaagaga cgttgggtta ccttctgctc tgcagaatgg ccaaccttta 1620
acgtcggatg gccgcgagac ggcaccttta accgagacct catcacccag gttaagatca 1680
aggtcttttc acctggcccg catggacacc cagaccaggt cccctacatc gtgacctggg 1740
aagccttggc ttttgacccc cctccctggg tcaagccctt tgtacaccct aagcctccgc 1800
ctcctcttcc tccatccgcc ccgtctctcc cccttgaacc tcctcgttcg accccgcctc 1860
gatcctccct ttatccagcc ctcactcctt ctctaggcgc ccccatatgg ccatatgaga 1920
tcttatatgg ggcacccccg ccccttgtaa acttccctga ccctgacttg acaagagtta 1980
ctaacagccc ctctctccaa gctcacttac aggctctcta cttagtccag cacgaagtct 2040
ggagacctct ggcggcagcc taccaagaac aactggaccg accggtggta cctcaccctt 2100
accgagtcgg cgacacagtg tgggtccgcc gacaccagac taagaaccta gaacctcgct 2160
ggaaaggacc ttacacagtc ctgctgacca cccccaccgc cctcaaagta gacggcatcg 2220
cagcttggat acacgccgcc cacgtgaagg ctgccgaccc cgggggtgga ccatcctcta 2280
gactgccgga tcccagtgtg gtggtacggg aattcaagct taggatgacg ctgcggcttc 2340
tggtggccgc gctctgcgcc gggatcctgg cagaggcgcc ccgagtgcga gcccagcaca 2400
gggagagagt gacctgcacg cgcctttacg ccgctgacat tgtgttctta ctggatggct 2460
cctcatccat tggccgcagc aatttccgcg aggtccgcag ctttctcgaa gggctggtgc 2520
tgcctttctc tggagcagcc agtgcacagg gtgtgcgctt tgccacagtg cagtacagcg 2580
atgacccacg gacagagttc ggcctggatg cacttggctc tgggggtgat gtgatccgcg 2640
ccatccgtga gcttagctac aaggggggca acactcgcac aggggctgca attctccatg 2700
tggctgacca tgtcttcctg ccccagctgg cccgacctgg tgtccccaag gtctgcatcc 2760
tgatcacaga cgggaagtcc caggacctgg tggacacagc tgcccaaagg ctgaaggggc 2820
agggggtcaa gctatttgct gtggggatca agaatgctga ccctgaggag ctgaagcgag 2880
ttgcctcaca gcccaccagt gacttcttct tcttcgtcaa tgacttcagc atcttgagga 2940
cactactgcc cctcgtttcc cggagagtgt gcacgactgc tggtggcgtg cctgtgaccc 3000
gacctccgga tgactcgacc tctgctccac gagacctggt gctgtctgag ccaagcagcc 3060
aatccttgag agtacagtgg acagcggcca gtggccctgt gactggctac aaggtccagt 3120
acactcctct gacggggctg ggacagccac tgccgagtga gcggcaggag gtgaacgtcc 3180
cagctggtga gaccagtgtg cggctgcggg gtctccggcc actgaccgag taccaagtga 3240
ctgtgattgc cctctacgcc aacagcatcg gggaggctgt gagcgggaca gctcggacca 3300
ctgccctaga agggccggaa ctgaccatcc agaataccac agcccacagc ctcctggtgg 3360
cctggcggag tgtgccaggt gccactggct accgtgtgac atggcgggtc ctcagtggtg 3420
ggcccacaca gcagcaggag ctgggccctg ggcagggttc agtgttgctg cgtgacttgg 3480
agcctggcac ggactatgag gtgaccgtga gcaccctatt tggccgcagt gtggggcccg 3540
ccacttccct gatggctcgc actgacgctt ctgttgagca gaccctgcgc ccggtcatcc 3600
tgggccccac atccatcctc ctttcctgga acttggtgcc tgaggcccgt ggctaccggt 3660
tggaatggcg gcgtgagact ggcttggagc caccgcagaa ggtggtactg ccctctgatg 3720
tgacccgcta ccagttggat gggctgcagc cgggcactga gtaccgcctc acactctaca 3780
ctctgctgga gggccacgag gtggccaccc ctgcaaccgt ggttcccact ggaccagagc 3840
tgcctgtgag ccctgtaaca gacctgcaag ccaccgagct gcccgggcag cgggtgcgag 3900
tgtcctggag cccagtccct ggtgccaccc agtaccgcat cattgtgcgc agcacccagg 3960
gggtggagcg gaccctggtg cttcctggga gtcagacagc attcgacttg gatgacgttc 4020
aggctgggct tagctacact gtgcgggtgt ctgctcgagt gggtccccgt gagggcagtg 4080
ccagtgtcct cactgtccgc cgggagccgg aaactccact tgctgttcca gggctgcggg 4140
ttgtggtgtc agatgcaacg cgagtgaggg tggcctgggg acccgtccct ggagccagtg 4200
gatttcggat tagctggagc acaggcagtg gtccggagtc cagccagaca ctgcccccag 4260
actctactgc cacagacatc acagggctgc agcctggaac cacctaccag gtggctgtgt 4320
cggtactgcg aggcagagag gagggccctg ctgcagtcat cgtggctcga acggacccac 4380
tgggcccagt gaggacggtc catgtgactc aggccagcag ctcatctgtc accattacct 4440
ggaccagggt tcctggcgcc acaggataca gggtttcctg gcactcagcc cacggcccag 4500
agaaatccca gttggtttct ggggaggcca cggtggctga gctggatgga ctggagccag 4560
atactgagta tacggtgcat gtgagggccc atgtggctgg cgtggatggg ccccctgcct 4620
ctgtggttgt gaggactgcc cctgagcctg tgggtcgtgt gtcgaggctg cagatcctca 4680
atgcttccag cgacgttcta cggatcacct gggtaggggt cactggagcc acagcttaca 4740
gactggcctg gggccggagt gaaggcggcc ccatgaggca ccagatactc ccaggaaaca 4800
cagactctgc agagatccgg ggtctcgaag gtggagtcag ctactcagtg cgagtgactg 4860
cacttgtcgg ggaccgcgag ggcacacctg tctccattgt tgtcactacg ccgcctgagg 4920
ctccgccagc cctggggacg cttcacgtgg tgcagcgcgg ggagcactcg ctgaggctgc 4980
gctgggagcc ggtgcccaga gcgcagggct tccttctgca ctggcaacct gagggtggcc 5040
aggaacagtc ccgggtcctg gggcccgagc tcagcagcta tcacctggac gggctggagc 5100
cagcgacaca gtaccgcgtg aggctgagtg tcctagggcc ggctggagaa gggccctctg 5160
cagaggtgac tgcgcgcact gagtcacctc gtgttccaag cattgaacta cgtgtggtgg 5220
acacctcgat cgactcggtg actttggcct ggactccagt gtccagggca tccagctaca 5280
tcctatcctg gcggccactc agaggccctg gccaggaagt gcctgggtcc ccgcagacac 5340
ttccagggat ctcaagctcc cagcgggtga cagggctaga gcctggcgtc tcttacatct 5400
tctccctgac gcctgtcctg gatggtgtgc ggggtcctga ggcatctgtc acacagacgc 5460
cagtgtgccc ccgtggcctg gcggatgtgg tgttcctacc acatgccact caagacaatg 5520
ctcaccgtgc ggaggctacg aggagggtcc tggagcgtct ggtgttggca cttgggcctc 5580
ttgggccaca ggcagttcag gttggcctgc tgtcttacag tcatcggccc tccccactgt 5640
tcccactgaa tggctcccat gaccttggca ttatcttgca aaggatccgt gacatgccct 5700
acatggaccc aagtgggaac aacctgggca cagccgtggt cacagctcac agatacatgt 5760
tggcaccaga tgctcctggg cgccgccagc acgtaccagg ggtgatggtt ctgctagtgg 5820
atgaaccctt gagaggtgac atattcagcc ccatccgtga ggcccaggct tctgggctta 5880
atgtggtgat gttgggaatg gctggagcgg acccagagca gctgcgtcgc ttggcgccgg 5940
gtatggactc tgtccagacc ttcttcgccg tggatgatgg gccaagcctg gaccaggcag 6000
tcagtggtct ggccacagcc ctgtgtcagg catccttcac tactcagccc cggccagagc 6060
cctgcccagt gtattgtcca aagggccaga agggggaacc tggagagatg ggcctgagag 6120
gacaagttgg gcctcctggc gaccctggcc tcccgggcag gaccggtgct cccggccccc 6180
aggggccccc tggaagtgcc actgccaagg gcgagagggg cttccctgga gcagatgggc 6240
gtccaggcag ccctggccgc gccgggaatc ctgggacccc tggagcccct ggcctaaagg 6300
gctctccagg gttgcctggc cctcgtgggg acccgggaga gcgaggacct cgaggcccaa 6360
agggggagcc gggggctccc ggacaagtca tcggaggtga aggacctggg cttcctgggc 6420
ggaaagggga ccctggacca tcgggccccc ctggacctcg tggaccactg ggggacccag 6480
gaccccgtgg ccccccaggg cttcctggaa cagccatgaa gggtgacaaa ggcgatcgtg 6540
gggagcgggg tccccctgga ccaggtgaag gtggcattgc tcctggggag cctgggctgc 6600
cgggtcttcc cggaagccct ggaccccaag gccccgttgg cccccctgga aagaaaggag 6660
aaaaaggtga ctctgaggat ggagctccag gcctcccagg acaacctggg tctccgggtg 6720
agcagggccc acggggacct cctggagcta ttggccccaa aggtgaccgg ggctttccag 6780
ggcccctggg tgaggctgga gagaagggcg aacgtggacc cccaggccca gcgggatccc 6840
gggggctgcc aggggttgct ggacgtcctg gagccaaggg tcctgaaggg ccaccaggac 6900
ccactggccg ccaaggagag aagggggagc ctggtcgccc tggggaccct gcagtggtgg 6960
gacctgctgt tgctggaccc aaaggagaaa agggagatgt ggggcccgct gggcccagag 7020
gagctaccgg agtccaaggg gaacggggcc cacccggctt ggttcttcct ggagaccctg 7080
gccccaaggg agaccctgga gaccggggtc ccattggcct tactggcaga gcaggacccc 7140
caggtgactc agggcctcct ggagagaagg gagaccctgg gcggcctggc cccccaggac 7200
ctgttggccc ccgaggacga gatggtgaag ttggagagaa aggtgacgag ggtcctccgg 7260
gtgacccggg tttgcctgga aaagcaggcg agcgtggcct tcggggggca cctggagttc 7320
gggggcctgt gggtgaaaag ggagaccagg gagatcctgg agaggatgga cgaaatggca 7380
gccctggatc atctggaccc aagggtgacc gtggggagcc gggtccccca ggacccccgg 7440
gacggctggt agacacagga cctggagcca gagagaaggg agagcctggg gaccgcggac 7500
aagagggtcc tcgagggccc aagggtgatc ctggcctccc tggagcccct ggggaaaggg 7560
gcattgaagg gtttcgggga cccccaggcc cacaggggga cccaggtgtc cgaggcccag 7620
caggagaaaa gggtgaccgg ggtccccctg ggctggatgg ccggagcgga ctggatggga 7680
aaccaggagc cgctgggccc tctgggccga atggtgctgc aggcaaagct ggggacccag 7740
ggagagacgg gcttccaggc ctccgtggag aacagggcct ccctggcccc tctggtcccc 7800
ctggattacc gggaaagcca ggcgaggatg gcaaacctgg cctgaatgga aaaaacggag 7860
aacctgggga ccctggagaa gacgggagga agggagagaa aggagattca ggcgcctctg 7920
ggagagaagg tcgtgatggc cccaagggtg agcgtggagc tcctggtatc cttggacccc 7980
aggggcctcc aggcctccca gggccagtgg gccctcctgg ccagggtttt cctggtgtcc 8040
caggaggcac gggccccaag ggtgaccgtg gggagactgg atccaaaggg gagcagggcc 8100
tccctggaga gcgtggcctg cgaggagagc ctggaagtgt gccgaatgtg gatcggttgc 8160
tggaaactgc tggcatcaag gcatctgccc tgcgggagat cgtggagacc tgggatgaga 8220
gctctggtag cttcctgcct gtgcccgaac ggcgtcgagg ccccaagggg gactcaggcg 8280
aacagggccc cccaggcaag gagggcccca tcggctttcc tggagaacgc gggctgaagg 8340
gcgaccgtgg agaccctggc cctcaggggc cacctggtct ggcccttggg gagaggggcc 8400
cccccgggcc ttccggcctt gccggggagc ctggaaagcc tggtattccc gggctcccag 8460
gcagggctgg gggtgtggga gaggcaggaa ggccaggaga gaggggagaa cggggagaga 8520
aaggagaacg tggagaacag ggcagagatg gccctcctgg actccctgga acccctgggc 8580
cccccggacc ccctggcccc aaggtgtctg tggatgagcc aggtcctgga ctctctggag 8640
aacagggacc ccctggactc aagggtgcta agggggagcc gggcagcaat ggtgaccaag 8700
gtcccaaagg agacaggggt gtgccaggca tcaaaggaga ccggggagag cctggaccga 8760
ggggtcagga cggcaacccg ggtctaccag gagagcgtgg tatggctggg cctgaaggga 8820
agccgggtct gcagggtcca agaggccccc ctggcccagt gggtggtcat ggagaccctg 8880
gaccacctgg tgccccgggt cttgctggcc ctgcaggacc ccaaggacct tctggcctga 8940
agggggagcc tggagagaca ggacctccag gacggggcct gactggacct actggagctg 9000
tgggacttcc tggacccccc ggcccttcag gccttgtggg tccacagggg tctccaggtt 9060
tgcctggaca agtgggggag acagggaagc cgggagcccc aggtcgagat ggtgccagtg 9120
gaaaagatgg agacagaggg agccctggtg tgccagggtc accaggtctg cctggccctg 9180
tcggacctaa aggagaacct ggccccacgg gggcccctgg acaggctgtg gtcgggctcc 9240
ctggagcaaa gggagagaag ggagcccctg gaggccttgc tggagacctg gtgggtgagc 9300
cgggagccaa aggtgaccga ggactgccag ggccgcgagg cgagaagggt gaagctggcc 9360
gtgcagggga gcccggagac cctggggaag atggtcagaa aggggctcca ggacccaaag 9420
gtttcaaggg tgacccagga gtcggggtcc cgggctcccc tgggcctcct ggccctccag 9480
gtgtgaaggg agatctgggc ctccctggcc tgcccggtgc tcctggtgtt gttgggttcc 9540
cgggtcagac aggccctcga ggagagatgg gtcagccagg ccctagtgga gagcggggtc 9600
tggcaggccc cccagggaga gaaggaatcc caggacccct ggggccacct ggaccaccgg 9660
ggtcagtggg accacctggg gcctctggac tcaaaggaga caagggagac cctggagtag 9720
ggctgcctgg gccccgaggc gagcgtgggg agccaggcat ccggggtgaa gatggccgcc 9780
ccggccagga gggaccccga ggactcacgg ggccccctgg cagcagggga gagcgtgggg 9840
agaagggtga tgttgggagt gcaggactaa agggtgacaa gggagactca gctgtgatcc 9900
tggggcctcc aggcccacgg ggtgccaagg gggacatggg tgaacgaggg cctcggggct 9960
tggatggtga caaaggacct cggggagaca atggggaccc tggtgacaag ggcagcaagg 10020
gagagcctgg tgacaagggc tcagccgggt tgccaggact gcgtggactc ctgggacccc 10080
agggtcaacc tggtgcagca gggatccctg gtgacccggg atccccagga aaggatggag 10140
tgcctggtat ccgaggagaa aaaggagatg ttggcttcat gggtccccgg ggcctcaagg 10200
gtgaacgggg agtgaaggga gcctgtggcc ttgatggaga gaagggagac aagggagaag 10260
ctggtccccc aggccgcccc gggctggcag gacacaaagg agagatgggg gagcctggtg 10320
tgccgggcca gtcgggggcc cctggcaagg agggcctgat cggtcccaag ggtgaccgag 10380
gctttgacgg gcagccaggc cccaagggtg accagggcga gaaaggggag cggggaaccc 10440
caggaattgg gggcttccca ggccccagtg gaaatgatgg ctctgctggt cccccagggc 10500
cacctggcag tgttggtccc agaggccccg aaggacttca gggccagaag ggtgagcgag 10560
gtccccccgg agagagagtg gtgggggctc ctggggtccc tggagctcct ggcgagagag 10620
gggagcaggg gcggccaggg cctgccggtc ctcgaggcga gaagggagaa gctgcactga 10680
cggaggatga catccggggc tttgtgcgcc aagagatgag tcagcactgt gcctgccagg 10740
gccagttcat cgcatctgga tcacgacccc tccctagtta tgctgcagac actgccggct 10800
cccagctcca tgctgtgcct gtgctccgcg tctctcatgc agaggaggaa gagcgggtac 10860
cccctgagga tgatgagtac tctgaatact ccgagtattc tgtggaggag taccaggacc 10920
ctgaagctcc ttgggatagt gatgacccct gttccctgcc actggatgag ggctcctgca 10980
ctgcctacac cctgcgctgg taccatcggg ctgtgacagg cagcacagag gcctgtcacc 11040
cttttgtcta tggtggctgt ggagggaatg ccaaccgttt tgggacccgt gaggcctgcg 11100
agcgccgctg cccaccccgg gtggtccaga gccaggggac aggtactgcc caggactgag 11160
aattcgcggc cgccagcaca gtggtcgacg ataaaataaa agattttatt tagtctccag 11220
aaaaaggggg gaatgaaaga ccccacctgt aggtttggca agctagctta agtaacgcca 11280
ttttgcaagg catggaaaaa tacataactg agaatagaga agttcagatc aaggtcagga 11340
acagatggaa cagctgaata tgggccaaac aggatatctg tggtaagcag ttcctgcccc 11400
ggctcagggc caagaacaga tggaacagct gaatatgggc caaacaggat atctgtggta 11460
agcagttcct gccccggctc agggccaaga acagatggtc cccagatgcg gtccagccct 11520
cagcagtttc tagagaacca tcagatgttt ccagggtgcc ccaaggacct gaaatgaccc 11580
tgtgccttat ttgaactaac caatcagttc gcttctcgct tctgttcgcg cgcttctgct 11640
ccccgagctc aataaaagag cccacaaccc ctcactcggg gcgccagtcc tccgattgac 11700
tgagtcgccc gggtacccgt gtatccaata aaccctcttg cagttgcatc cgacttgtgg 11760
tctcgctgtt ccttgggagg gtctcctctg agtgattgac tacccgtcag cgggggtctt 11820
tcacatgcag catgtatcaa aattaatttg gttttttttc ttaagtattt acattaaatg 11880
gccatagttg cattaatgaa tcggccaacg cgcggggaga ggcggtttgc gtattggcgc 11940
tcttccgctt cctcgctcac tgactcgctg cgctcggtcg ttcggctgcg gcgagcggta 12000
tcagctcact caaaggcggt aatacggtta tccacagaat caggggataa cgcaggaaag 12060
aacatgtgag caaaaggcca gcaaaaggcc aggaaccgta aaaaggccgc gttgctggcg 12120
tttttccata ggctccgccc ccctgacgag catcacaaaa atcgacgctc aagtcagagg 12180
tggcgaaacc cgacaggact ataaagatac caggcgtttc cccctggaag ctccctcgtg 12240
cgctctcctg ttccgaccct gccgcttacc ggatacctgt ccgcctttct cccttcggga 12300
agcgtggcgc tttctcatag ctcacgctgt aggtatctca gttcggtgta ggtcgttcgc 12360
tccaagctgg gctgtgtgca cgaacccccc gttcagcccg accgctgcgc cttatccggt 12420
aactatcgtc ttgagtccaa cccggtaaga cacgacttat cgccactggc agcagccact 12480
ggtaacagga ttagcagagc gaggtatgta ggcggtgcta cagagttctt gaagtggtgg 12540
cctaactacg gctacactag aagaacagta tttggtatct gcgctctgct gaagccagtt 12600
accttcggaa aaagagttgg tagctcttga tccggcaaac aaaccaccgc tggtagcggt 12660
ggtttttttg tttgcaagca gcagattacg cgcagaaaaa aaggatctca agaagatcct 12720
ttgatctttt ctacggggtc tgacgctcag tggaacgaaa actcacgtta agggattttg 12780
gtcatgagat tatcaaaaag gatcttcacc tagatccttt tgcggccgaa ttagatccag 12840
acatgataag atacattgat gagtttggac aaaccacaac tagaatgcag tgaaaaaaat 12900
gctttatttg tgaaatttgt gatgctattg ctttatttgt aaccattata agctgcaata 12960
aacaagttaa caacaacaat tgcattcatt ttatgtttca ggttcagggg gaggtgtggg 13020
aggtttttta aagcaagtaa aacctctaca aatgtggtat ggctgattat gatcctctag 13080
agtcggtggg cctcgggggc gggtgcgggg tcggcggggc cgcccgggtc ggcttcggtc 13140
ggagccatgg ggtcgtgcgc tcctttcggt cgggcgctgc gggtcgtggg gcgggcgtca 13200
ggcaccgggc ttgcgggtca tgcaccaggt cgcgcggtcc ttcgggcact cgacgtcggc 13260
ggtgacggtg aagccgagcc gctcgtagaa ggggaggttg cggggcgcgg aggtctccag 13320
gaaggcgggc accccggcgc gctcggccgc ctccactccg gggagcacga cggcgctgcc 13380
cagacccttg ccctggtggt cgggcgagac gccgacggtg gccaggaacc acgcgggctc 13440
cttgggccgg tgcggcgcca ggaggccttc catctgttgc tgcgcggcca gccgggaacc 13500
gctcaactcg gccatgcgcg ggccgatctc ggcgaacacc gcccccgctt cgacgctctc 13560
cggcgtggtc cagaccgcca ccgcggcgcc gtcgtccgcg acccacacct tgccgatgtc 13620
gagcccgacg cgcgtgagga agagttcttg cagctcggtg acccgctcga tgtggcggtc 13680
cgggtcgacg gtgtggcgcg tggcggggta gtcggcgaac gcggcggcga gggtgcgtac 13740
ggcccggggg acgtcgtcgc gggtggcgag gcgcaccgtg ggcttgtact cggtcatgga 13800
aggtcgtctc cttgtgaggg gtcaggggcg tgggtcaggg gatggtggcg gcaccggtcg 13860
tggcggccga cctgcaggtc gaaaggcccg gagatgagga agaggagaac agcgcggcag 13920
acgtgcgctt ttgaagcgtg cagaatgccg ggcctccgga ggaccttcgg gcgcccgccc 13980
cgcccctgag cccgcccctg agcccgcccc cggacccacc ccttcccagc ctctgagccc 14040
agaaagcgaa ggagcaaagc tgctattggc cgctgcccca aaggcctacc cgcttccatt 14100
gctcagcggt gctgtccatc tgcacgagac tagtgagacg tgctacttcc atttgtcacg 14160
tcctgcacga cgcgagctgc ggggcggggg ggaacttcct gactagggga ggagtagaag 14220
gtggcgcgaa ggggccacca aagaacggag ccggttggcg cctaccggtg gatgtggaat 14280
gtgtgcgagg ccagaggcca cttgtgtagc gccaagtgcc cagcggggct gctaaagcgc 14340
atgctccaga ctgccttggg aaaagcgcct cccctacccg gtagaattaa ttctcatgtt 14400
tgacagctta tcatcgatag atcctcacag gccgcaccca gcttttcttc cgttgcccca 14460
gtagcatctc tgtctggtga ccttgaagag gaagaggagg ggtcccgaga atccccatcc 14520
ctaccgtcca gcaaaaaggg ggacgaggaa tttgaggcct ggcttgaggc tcaggacgca 14580
aatcttgagg atgttcagcg ggagttttcc gggctgcgag taattggtga tgaggacgag 14640
gatggttcgg aggatgggga attttcagac ctggatctgt ctgacagcga ccatgaaggg 14700
gatgagggtg ggggggctgt tggagggggc aggagtctgc actccctgta ttcactgagc 14760
gtcgtctaat aaagatgtct attgatctct tttagtgtga atcatgtctg acgaggggcc 14820
aggtacagga cctggaaatg gcctaggaga gaagggagac acatctggac cagaaggctc 14880
cggcggcagt ggacctcaaa gaagaggggg tgataaccat ggacgaggac ggggaagagg 14940
acgaggacga ggaggcggaa gaccaggagc cccgggcggc tcaggatcag ggccaagaca 15000
tagagatggt gtccggagag gggaaaaacg tccaagttgc attggctgca aagggaccca 15060
cggtggaaca ggagcaggag caggagcggg aggggcagga gcaggagggg caggagcagg 15120
aggaggggca ggagcaggag gaggggcagg aggggcagga ggggcaggag gggcaggagc 15180
aggaggaggg gcaggagcag gaggaggggc aggaggggca ggaggggcag gagcaggagg 15240
aggggcagga gcaggaggag gggcaggagg ggcaggagca ggaggagggg caggaggggc 15300
aggaggggca ggagcaggag gaggggcagg agcaggagga ggggcaggag gggcaggagc 15360
aggaggaggg gcaggagggg caggaggggc aggagcagga ggaggggcag gagcaggagg 15420
ggcaggaggg gcaggagggg caggagcagg aggggcagga gcaggaggag gggcaggagg 15480
ggcaggaggg gcaggagcag gaggggcagg agcaggaggg gcaggagcag gaggggcagg 15540
agcaggaggg gcaggagggg caggagcagg aggggcagga ggggcaggag caggaggggc 15600
aggaggggca ggagcaggag gaggggcagg aggggcagga gcaggaggag gggcaggagg 15660
ggcaggagca ggaggggcag gaggggcagg agcaggaggg gcaggagggg caggagcagg 15720
aggggcagga ggggcaggag caggaggagg ggcaggagca ggaggggcag gagcaggagg 15780
tggaggccgg ggtcgaggag gcagtggagg ccggggtcga ggaggtagtg gaggccgggg 15840
tcgaggaggt agtggaggcc gccggggtag aggacgtgaa agagccaggg ggggaagtcg 15900
tgaaagagcc agggggagag gtcgtggacg tggagaaaag aggcccagga gtcccagtag 15960
tcagtcatca tcatccgggt ctccaccgcg caggccccct ccaggtagaa ggccattttt 16020
ccaccctgta ggggaagccg attattttga ataccaccaa gaaggtggcc cagatggtga 16080
gcctgacgtg cccccgggag cgatagagca gggccccgca gatgacccag gagaaggccc 16140
aagcactgga ccccggggtc agggtgatgg aggcaggcgc aaaaaaggag ggtggtttgg 16200
aaagcatcgt ggtcaaggag gttccaaccc gaaatttgag aacattgcag aaggtttaag 16260
agctctcctg gctaggagtc acgtagaaag gactaccgac gaaggaactt gggtcgccgg 16320
tgtgttcgta tatggaggta gtaagacctc cctttacaac ctaaggcgag gaactgccct 16380
tgctattcca caatgtcgtc ttacaccatt gagtcgtctc ccctttggaa tggcccctgg 16440
acccggccca caacctggcc cgctaaggga gtccattgtc tgttatttca tggtcttttt 16500
acaaactcat atatttgctg aggttttgaa ggatgcgatt aaggaccttg ttatgacaaa 16560
gcccgctcct acctgcaata tcagggtgac tgtgtgcagc tttgacgatg gagtagattt 16620
gcctccctgg tttccaccta tggtggaagg ggctgccgcg gagggtgatg acggagatga 16680
cggagatgaa ggaggtgatg gagatgaggg tgaggaaggg caggagtgat gtaacttgtt 16740
aggagacgcc ctcaatcgta ttaaaagccg tgtattcccc cgcactaaag aataaatccc 16800
cagtagacat catgcgtgct gttggtgtat ttctggccat ctgtcttgtc accattttcg 16860
tcctcccaac atggggcaat tgggcatacc catgttgtca cgtcactcag ctccgcgctc 16920
aacaccttct cgcgttggaa aacattagcg acatttacct ggtgagcaat cagacatgcg 16980
acggctttag cctggcctcc ttaaattcac ctaagaatgg gagcaaccag caggaaaagg 17040
acaagcagcg aaaattcacg cccccttggg aggtggcggc atatgcaaag gatagcactc 17100
ccactctact actgggtatc atatgctgac tgtatatgca tgaggatagc atatgctacc 17160
cggatacaga ttaggatagc atatactacc cagatataga ttaggatagc atatgctacc 17220
cagatataga ttaggatagc ctatgctacc cagatataaa ttaggatagc atatactacc 17280
cagatataga ttaggatagc atatgctacc cagatataga ttaggatagc ctatgctacc 17340
cagatataga ttaggatagc atatgctacc cagatataga ttaggatagc atatgctatc 17400
cagatatttg ggtagtatat gctacccaga tataaattag gatagcatat actaccctaa 17460
tctctattag gatagcatat gctacccgga tacagattag gatagcatat actacccaga 17520
tatagattag gatagcatat gctacccaga tatagattag gatagcctat gctacccaga 17580
tataaattag gatagcatat actacccaga tatagattag gatagcatat gctacccaga 17640
tatagattag gatagcctat gctacccaga tatagattag gatagcatat gctatccaga 17700
tatttgggta gtatatgcta cccatggcaa cattagccca ccgtgctctc agcgacctcg 17760
tgaatatgag gaccaacaac cctgtgcttg gcgctcaggc gcaagtgtgt gtaatttgtc 17820
ctccagatcg cagcaatcgc gcccctatct tggcccgccc acctacttat gcaggtattc 17880
cccggggtgc cattagtggt tttgtgggca agtggtttga ccgcagtggt tagcggggtt 17940
acaatcagcc aagttattac acccttattt tacagtccaa aaccgcaggg cggcgtgtgg 18000
gggctgacgc gtgcccccac tccacaattt caaaaaaaag agtggccact tgtctttgtt 18060
tatgggcccc attggcgtgg agccccgttt aattttcggg ggtgttagag acaaccagtg 18120
gagtccgctg ctgtcggcgt ccactctctt tccccttgtt acaaatagag tgtaacaaca 18180
tggttcacct gtcttggtcc ctgcctggga cacatcttaa taaccccagt atcatattgc 18240
actaggatta tgtgttgccc atagccataa attcgtgtga gatggacatc cagtctttac 18300
ggcttgtccc caccccatgg atttctattg ttaaagatat tcagaatgtt tcattcctac 18360
actagtattt attgcccaag gggtttgtga gggttatatt ggtgtcatag cacaatgcca 18420
ccactgaacc ccccgtccaa attttattct gggggcgtca cctgaaacct tgttttcgag 18480
cacctcacat acaccttact gttcacaact cagcagttat tctattagct aaacgaagga 18540
gaatgaagaa gcaggcgaag attcaggaga gttcactgcc cgctccttga tcttcagcca 18600
ctgcccttgt gactaaaatg gttcactacc ctcgtggaat cctgacccca tgtaaataaa 18660
accgtgacag ctcatggggt gggagatatc gctgttcctt aggacccttt tactaaccct 18720
aattcgatag catatgcttc ccgttgggta acatatgcta ttgaattagg gttagtctgg 18780
atagtatata ctactacccg ggaagcatat gctacccgtt tagggttaac aagggggcct 18840
tataaacact attgctaatg ccctcttgag ggtccgctta tcggtagcta cacaggcccc 18900
tctgattgac gttggtgtag cctcccgtag tcttcctggg cccctgggag gtacatgtcc 18960
cccagcattg gtgtaagagc ttcagccaag agttacacat aaaggcaatg ttgtgttgca 19020
gtccacagac tgcaaagtct gctccaggat gaaagccact cagtgttggc aaatgtgcac 19080
atccatttat aaggatgtca actacagtca gagaacccct ttgtgtttgg tccccccccg 19140
tgtcacatgt ggaacagggc ccagttggca agttgtacca accaactgaa gggattacat 19200
gcactgcccg tgaccaatac aaaacaaaag cgctcctcgt accagcgaag aaggggcaga 19260
gatgccgtag tcaggtttag ttcgtccggc ggcgggggat ctggccgctt taaatcaatc 19320
taaagtatat atgagtaaac ttggtctgac agttaccaat gcttaatcag tgaggcacct 19380
atctcagcga tctgtctatt tcgttcatcc atagttgcct gactccccgt cgtgtagata 19440
actacgatac gggagggctt accatctggc cccagtgctg caatgatacc gcgagaccca 19500
cgctcaccgg ctccagattt atcagcaata aaccagccag ccggaagggc cgagcgcaga 19560
agtggtcctg caactttatc cgcctccatc cagtctatta attgttgccg ggaagctaga 19620
gtaagtagtt cgccagttaa tagtttgcgc aacgttgttg ccattgctgc aggcatcgtg 19680
gtgtcacgct cgtcgtttgg tatggcttca ttcagctccg gttcccaacg atcaaggcga 19740
gttacatgat cccccatgtt gtgcaaaaaa gcggttagct ccttcggtcc tccgatcgtt 19800
gtcagaagta agttggccgc agtgttatca ctcatggtta tggcagcact gcataattct 19860
cttactgtca tgccatccgt aagatgcttt tctgtgactg gtgagtactc aaccaagtca 19920
ttctgagaat agtgtatgcg gcgaccgagt tgctcttgcc cggcgtcaac acgggataat 19980
accgcgccac atagcagaac tttaaaagtg ctcatcattg gaaaacgttc ttcggggcga 20040
aaactctcaa ggatcttacc gctgttgaga tccagttcga tgtaacccac tcgtgcaccc 20100
aactgatctt cagcatcttt tactttcacc agcgtttctg ggtgagcaaa aacaggaagg 20160
caaaatgccg caaaaaaggg aataagggcg acacggaaat gttgaatact catactcttc 20220
ctttttcaat attattgaag catttatcag ggttattgtc tcatgagcgg atacatattt 20280
gaatgtattt agaaaaataa acaaataggg gttccgcgca catttc 20326
<---
Реферат
Изобретение относится к области медицинской биотехнологии. Предлагается применение слоя кератиноцитов для лечении рецессивного дистрофического Буллезного Эпидермолиза (РДБЭ). Слой кератиноцитов, произошедший из популяции клеток кожи, для заживления ран у субъекта с рецессивным дистрофическим Буллезным Эпидермолизом. Клетки кожи трансдуцированы вирусом, содержащим генетическую конструкцию. Конструкция кодирует функциональный белок коллагена VII (COL7A1). Способ получения слоя кератиноцитов. Изобретение позволяет проводить генетическую коррекцию РДБЭ с помощью улучшенной методики местной доставки и экспрессии функционального и полноразмерного коллагена YII человека дикого типа в пораженной коже. Эффективная доставка и экспрессия COL7AI в кератиноцитах позволяет применять эти клетки в лечении буллезного эпидермолиза. 4 н. и 22 з.п. ф-лы, 13 ил., 3 табл., 1 пр.

Комментарии