Генотерапевтический днк-вектор на основе генотерапевтического днк-вектора vtvaf17, несущий целевой ген, выбранный из группы генов nos2, nos3, vip, kcnma1, cgrp, для повышения уровня экспрессии этих целевых генов, способ его получения и применения, штамм e - RU2731513C2
Код документа: RU2731513C2
Чертежи








Описание
Генотерапевтический ДНК-вектор на основе генотерапевтического ДНК-вектора VTvaf17, несущий целевой ген, выбранный из группы генов NOS2, NOS3, VIP, KCNMA1, CGRP, для повышения уровня экспрессии этих целевых генов, способ его получения и применения, штамм Escherichia coli SCS110-AF/VTvaf17-NOS2 или Escherichia coli SCS110-AF/VTvaf17-NOS3 или Escherichia coli SCS110-AF/VTvaf17-VIP или Escherichia coli SCS110-AF/VTvaf17-KCNMA1 или Escherichia coli SCS110-AF/VTvaf17-CGRP, несущий генотерапевтический ДНК-вектор, способ его получения, способ производства в промышленных масштабах генотерапевтического ДНК-вектора.
Область техники
Изобретение относится к генной инженерии и может быть использовано в биотехнологии, медицине и сельском хозяйстве для создания препаратов генной терапии.
Уровень техники
Генная терапия - это современный медицинский подход, направленный на лечение наследственных и приобретенных заболеваний путем введения нового генетического материала в клетки пациента с целью компенсации или подавления функции мутантного гена и/или исправления генетического дефекта. Конечным продуктом экспрессии гена может являться молекула РНК или белка. Однако осуществление большей части физиологических процессов в организме связано с функциональной активностью белковых молекул, тогда как молекулы РНК являются либо промежуточным продуктом в синтезе белков, либо осуществляют регуляторные функции. Таким образом целью генной терапии является, в большинстве случаев, введение в организм генов, обеспечивающих транскрипцию и последующую трансляцию белковых молекул, кодируемых этими генами. В рамках описания настоящего изобретения под экспрессией гена подразумевается продукция белковой молекулы, аминокислотная последовательность которой кодируется этим геном.
Гены NOS2, NOS3, KCNMA1, VIP и CGRP, входящие в группу генов, играют ключевую роль в ряде процессов в организме человека и животных. Показана связь низких/недостаточных концентраций этих белков с различными заболеваниями человека, которая, в ряде случаев, подтверждена нарушениями в нормальной экспрессии генов, кодирующих эти белки. Таким образом, генотерапевтическое повышение экспрессии гена, выбранного из группы генов NOS2, NOS3, KCNMA1, VIP и CGRP, обладает потенциалом для коррекции различных состояний человека и животных.
Ген NOS2 кодирует белок - индуцибельную синтазу оксида азота 2 (синонимичные названия: NOS2, или NOS2A, или iNOS, или NOS II). Белок NOS2 участвует в синтезе оксида азота, который в свою очередь является медиатором ряда сигнальных путей в организме человека и животных, в число которых входят ERK и Apelin сигнальные каскады. К процессам, в которых NOS2 играет важную роль, относятся нейротрансмиссия, антимикробный и противоопухолевый иммунитет, вазомоторика различных органов и тканей. Обнаружена связь полиморфизма и отклонения от нормальной экспрессии гена NOS2 с предрасположенностью к различным заболеваниям и патологическим состояниям.
Например, было показано, что относительно низкий уровень экспрессии NOS2 у младенцев является одной из причин высокой частоты развития STEC-ассоциированной формы гемолитического-уремического синдрома (ГУС), приводящего к почечной недостаточности (Tsuji S et al. // Tohoku J Exp Med. 2012 Nov;228(3):247-52). При этом в экспериментах in vivo стимулирование синтеза оксида азота оказывало протективный эффект на мышиной модели Stx-индуцированного ГУС (Dran GI et al. // Kidney Int. 2002 Oct;62(4):1338-48). В другой работе было показано, что у мышей с пониженной экспрессией NOS2 наблюдается повышение вероятности гибели от сепсиса (Cobb J et al. // Surgery 126 (1999) 438-442).
Известно, что у детей с отитом среднего уха, сопровождающегося выпотом, наблюдается сниженная экспрессия NOS2 в аденоидах, а индукция экспрессии NOS2 обсуждается как перспективный терапевтический подход (Granath A et al. // Pediatr Allergy Immunol. 2010 Dec;21(8):1151-6).
Несмотря на имеющие сведения о противоречивом вкладе активности NOS2 в патогенез сердечно-сосудистых заболеваний, в работе на кроликах с экспериментальной гиперлипидемией и предрасположенностью к атеросклерозу было показано, что введение рекомбинантного аденовирусного вектора, экспрессирующего ген NOS2, приводило к улучшению вазомоторной функции, а атеропротективный эффект этого подхода проявлялся в значительном снижении аккумуляции липидов на стенках сосудов и воспаления в клетках эндотелия (Jiang B et al. // Hum Gene Ther. 2012 Nov;23(11):1166-75). Повышение экспрессии гена NOS2, в том числе с использованием вирусных векторов, может уменьшить или исключить гиперплазию интимы после ангиопластики (Barbato JE, Tzeng E. // Trends Cardiovasc Med. 2004 Oct;14(7):267-72).
Было показано, что генотерапевтический подход с использованием рекомбинантного аденовирусного вектора, экспрессирующего saRNA, который повышает экспрессию гена NOS2, восстанавливал эректильную функцию у крыс (Wang T et al. // J Urol. 2013 Aug;190(2):790-8).
В отношении рака было показано, что у мышей, которым был введен вектор, экспрессирующий NOS2, происходило снижение скорости роста и метастазирования опухолей (Schwentker A, Billiar TR. // World J Surg. 2002 Jul;26(7):772-8). При ингибировании NOS2 значительно снижается эффективность БЦЖ терапии рака мочевого пузыря, а увеличение экспрессии NOS2 может рассматриваться как стратегия повышения эффективности БЦЖ терапии (Shah G et al. // Urol Oncol. 2014 Jan;32(1):45. e1-9).
Также, NOS2 может быть применен для лечения обструктивной нефропатии (Chevalier RL. // Kidney Int. 2004 Oct;66(4):1709-10) и повреждений скелетной мускулатуры (Igamonti E et al. // J Immunol. 2013 Feb 15;190(4):1767-77).
Ген NOS3 кодирует белок - эндотелиальную синтазу оксида азота 3 (синонимичные названия: NOS3, или eNOS, или NOS III). Белок NOS3, как и белок NOS2, участвует в синтезе оксида азота, но характеризуется конститутивной экспрессией в клетках эндотелия сосудов и является одним из основных факторов, обеспечивающих тонус сосудов. Основные сигнальные каскады, в которых участвует NOS3, включают Act и EGF/EGFR сигнальные пути.
Было показано, что при введении векторов, экспрессирующих ген NOS3, у крыс наблюдалось снижение гипертензии и отсутствие гиперинсулинемии (Zhao CX et al. // J Pharmacol Exp Ther. 2009 Feb;328(2):610-20). Введение внутритрахеально векторов, экспрессирующих гены NOS3, простациклинсинтазы и VEGF приводило к снижению легочного артериального давления у экспериментальных животных с легочной артериальной гипертензией. Аналогичные положительные результаты были получены с введением аутологичных клеток, трансфицированных рекомбинантными векторами и экспрессирующих NOS3 (Chen et al. // Heart Lung Circ. 2017 May;26(5):509-518; Wei L et al. // Hypertens Res. 2013 May;36(5):414-21).
Также генотерапевтический подход с использованием рекомбинантного аденовирусного вектора, экспрессирующего NOS3, восстанавливал эректильную функцию, вызванную возрастными изменениями у крыс (Bivalacqua T et al. // Int J Impot Res. 2000 Sep;12 Suppl 3: S8-17).
Ген KCNMA1 кодирует белок - порообразующую субъединицу MaxiK кальций-зависимых калиевых каналов мембраны клеток, которые играют фундаментальную роль, прежде всего, в функционировании гладкой мускулатуры и возбудимости нейронов. Также показана связь полиморфизма этого гена с различными заболеваниями, в частности сердечно-сосудистыми. Например, вариабельность в гене KCNMA1 является фактором риска развития инфаркта миокарда и гипертензии (Tabarki B et al. // Hum Genet. 2016 Nov;135(11):1295-1298).
Экспрессия гена KCNMA1 связана с секреторной функцией слизистых оболочек. Было показано, что IFN-γ опосредованное снижение мукоцилиарного клиренса, лежащего в основе патогенеза ХОБЛ, астмы и, вероятно, эмфиземы легких, может быть скорректировано за счет повышения экспрессии гена KCNMA1 (Manzanares D et al. // Am J Physiol Lung Cell Mol Physiol. 2014 Mar 1;306(5): L453-62).
При эректильной дисфункции терапия ДНК-вектором, экспрессирующий KCNMA1, успешно завершила I фазу клинических испытаний, в результате которой было отмечено, что у пациентов наблюдалось заметное улучшение эректильной функции, которое, в некоторых случаях, сохранялось на протяжении 24 недель (Melman, Aetal. // Hum Gene Ther. 2006 Dec;17(12):1165-76). Более того, с использованием экспериментальной модели на крысах, введение аутологичных клеток, трансфицированных вектором, экспрессирующим KCNMA1, приводило к значительному улучшению эректильной функции (He Y et al. // Andrologia. 2014 Jun;46(5):479-86).
В некоторых типах опухолевых клеток, в частности в клетках рака кишечника, происходит гиперметилирование промоторной области гена KCNMA1, что приводит к снижению его экспрессии и, вероятно, играет роль в росте и метастазировании опухоли. Повышение экспрессии гена KCNMA1 за счет введения трансгена KCNMA1 в эти клетки может изменить ход течения онкологического процесса (Ma G et al. // Mol Cancer. 2017 Feb 23;16(1):46).
Известно, что механизм действия токсина западно-азиатского скорпиона (Buthus martensi Karsch) заключается в блокировании субъединиц кальциевых каналов. Вероятно, использование KCNMA1 в качестве конкурента с эндогенными молекулами за связывание с токсином может быть использовано при создании антидотов к этому и другим токсинам с аналогичным механизмом действия (Tao J et al. // Toxins (Basel). 2014 Apr 22;6(4):1419-33).
Гена VIP кодирует белок VIP, вазоактивный интестинальный пептид, который относится к семейству глюкагонов. Он стимулирует сократительную функцию миокарда, вызывает вазодилатацию, увеличивает гликогенолиз, снижает артериальное давление и расслабляет гладкие мышцы трахеи, желудка и желчного пузыря. Белок VIP действует как противомикробный пептид с антибактериальной и противогрибковой активностью (Karim IA et al. // J Neuroimmunol. 2008 Aug 30;200(1-2):11-6). Также для него характерны иммуномодулирующие свойства, проявляющиеся в снижении эффекта провоспалительных и повышении эффекта противовоспалительных медиаторов, что делает его перспективной молекулой для терапии ревматоидного артрита и других аутоиммунных заболеваний (Delgado M et al. // Nat Med. 2001 May;7(5):563-8).
Было показано увеличение секреции инсулина в ответ на повышение уровня глюкозы у крыс, экспрессирующих человеческий VIP в бета-клетках поджелудочной железы (Kato I at al. // Ann N Y Acad Sci. 1996 Dec 26;805:232-42). Генотерапевтический подход с использованием вирусного вектора, экспрессирующего VIP, показал свою эффективность в экспериментальной модели диабета II типа у мышей (Tasyurek HM et al. // Gene Ther. 2018 Jul;25(4):269-283).
При легочной артериальной гипертензии у крыс монотерапия рекомбинантным белком VIP была более эффективна, чем терапия бозентаном (Hamidi SA et al. // Respir Res. 2011 Oct 26;12:141).
В отношении онкологических заболеваний было показано, что экспрессия VIP подавляет пролиферацию клеток карциномы почки (Vacas E et al. // Biochim Biophys Acta. 2012 Oct;1823(10):1676-85).
Также было продемонстрировано, что VIP оказывает положительное действие на заживление механических повреждений легочного эпителия (Guan CX et al. // Peptides. 2006 Dec;27(12):3107-14).
Препарат интракавернозного введения Invicorp (Plethora Solutions, London, UK), представляющий собой смесь рекомбинантного белка VIP и фентонамина мезилата, предназначен для терапии эректильной дисфункции и эффективен в 70% случаев нарушений эрекции, не поддающихся инъекционному лечению другими препаратами (Wyllie MG // BJU Int. 2010 Sep;106(5):723-4).
Ген CGRP кодирует белок CGRP, кальцитонин-ген родственный пептид, относящийся к семейству белков, которое включает также кальцитонин, адреномедуллин и амилин. Функции CGRP включают вазодилатацию и действие в качестве антимикробного пептида. CGRP принимает участие в развитии преэклампсии и обладает защитным эффектом по отношению к сердечно-сосудистой системе (Márquez-Rodas I et al. // J Physiol Biochem. 2006 Mar;62(1):45-56.). При повреждениях сосудов при гиперэкспрессии CGRP в очаге поражения увеличивается количество апоптотических клеток и предотвращается гиперплазия неоинтимы. Эти свойства могут быть применены в профилактике рестенозов после различных хирургических манипуляций на сосудах (Wang W, Sun W, Wang X. // Am J Physiol HeartCirc Physiol. 2004 Oct;287(4):H1582-9).
Также, CGRP играет роль в развитии кости, метаболизме и ремоделирования тканей вокруг имплантов, а введение вирусного вектора, экспрессирующего CGRP, приводило к положительному эффекту на остеоинтеграцию имплантов у мышей (Xiang L et al. // Bone. 2017 Jan; 94:135-140). Введение аутологичных клеток, трансфицированных вирусным вектором, экспрессирующим ген CGRP, ускоряло регенерацию у крыс с дефектами периферических костей (Fang Z et al. // PLoS One. 2013 Aug 30;8(8): e72738).
Введение плазмидного вектора, экспрессирующего ген CGRP, приводило к снижению заболеваемости сахарным диабетом у мышей и существенно понижало уровень гипергликемии в экспериментальной модели индуцированного аутоиммунного диабета (She F et al. // Sheng Li Xue Bao. 2003 Dec 25;55(6):625-32). Было показано, что введение вирусного вектора, экспрессирующего ген CGRP, приводило к восстановлению эректильной функции у крыс (Bivalacqua TJ et al. // Biol Reprod. 2001 Nov;65(5):1371-7).
Таким образом предшествующий уровень техники свидетельствует о том, что мутации в генах NOS2, NOS3, KCNMA1, VIP и CGRP, или недостаточная экспрессия белков, кодируемых этими генами, связаны с развитием спектра заболеваний, включающих в себя, но не ограничивающихся, сердечно-сосудистыми заболеваниями, метаболическими расстройствами, эректильной дисфункцией, аутоиммунными заболеваниями, наследственными и приобретенными патологическими состояниями, онкологическими, инфекционными заболеваниями и другими состояниями. Этим обусловлено объединение генов NOS2, NOS3, KCNMA1, VIP и CGRP в рамках данного патента в группу генов. Генетические конструкции, обеспечивающие экспрессию белков, кодируемых генами NOS2, NOS3, KCNMA1, VIP и CGRP, входящими в группу генов, в составе того или иного вектора для генной терапии, могут быть использованы для разработки лекарственных препаратов для терапии различных заболеваний, включающих в себя, но не ограничивающихся, сердечно-сосудистыми заболеваниями, метаболическими расстройствами, эректильной дисфункцией, аутоиммунными заболеваниями, наследственными и приобретенными патологическими состояниями, онкологическими, инфекционными заболеваниями и другими состояниями.
Более того, приведенные данные свидетельствуют о том, что недостаточная экспрессия белков, кодируемых генами NOS2, NOS3, KCNMA1, VIP и CGRP, входящими в группу генов, связана не только с патологическими состояниями, но и с предрасположенность к их развитию. Также приведенные данные свидетельствуют о том, что недостаточная экспрессия данных белков может не проявляться в явном виде в форме патологии, которая может быть однозначно описана в рамках существующих стандартов клинической практики (например, с применением кода МКБ), однако при этом вызывать состояния, которые неблагоприятны для человека и животных и связанны с ухудшением качества жизни.
Анализ подходов для повышения экспрессии целевых генов подразумевает возможность использования различных генотерапевтических векторов.
Генотерапевтические векторы разделяют на вирусные, клеточные и ДНК-векторы (Guideline on the quality, non-clinical and clinical aspects of gene therapy medicinal Products
EMA/CAT/80183/2014). В последнее время в генной терапии всё большее внимание уделяется разработке невирусных систем доставки генетического материала, среди которых лидируют плазмидные векторы. Плазмидные векторы лишены недостатков, присущих клеточным и вирусным векторам. В клетке-мишени они существуют в эписомальной форме, не интегрируют в геном, производство их достаточно дешево, отсутствие иммунного ответа и побочных реакций на введение плазмидного вектора делают их удобным инструментом генной терапии и генетической профилактики (ДНК-вакцины) (Li L, Petrovsky N. // Expert Rev Vaccines. 2016;15(3):313-29).
Тем не менее, ограничениями для использования плазмидных векторов для генной терапии являются: 1) наличие генов устойчивости к антибиотикам для наработки в бактериальных штаммах, 2) наличие различных регуляторных элементов, представленных последовательностями вирусных геномов 3) размер терапевтического плазмидного вектора, определяющий эффективность проникновения вектора в клетку-мишень.
Известно, что Европейское агентство по лекарственным средствам считает необходимым избегать введения маркеров антибиотикорезистентности в разрабатываемые плазмидные векторы для генной терапии (Reflection paper on design modifications of gene therapy medicinal products during development / 14 December 2011 EMA/CAT/GTWP/44236/2009 Committee for advanced therapies). Данная рекомендация связана, в первую очередь, с потенциальной опасностью проникновения ДНК-вектора или горизонтального переноса генов антибиотикорезистентности в клетки бактерий, представленных в организме в составе нормальной или оппортунистической микрофлоры. Помимо этого, наличие генов антибиотикорезистентности значительно увеличивает размер ДНК-вектора, что приводит к снижению эффективности его проникновения в эукариотические клетки.
Необходимо отметить, что гены антибиотикорезистентности также вносят принципиальный вклад в способ получения ДНК-векторов. В случае наличия генов антибиотикорезистентности штаммы для наработки ДНК-векторов обычно культивируются в среде, содержащей селективный антибиотик, что создает риск наличия следовых количеств антибиотика в недостаточно очищенных препаратах ДНК-векторов. Таким образом, получение ДНК-векторов для генной терапии, в которых отсутствуют гены антибиотикорезистентности, связано с получением штаммов, обладающих такой отличительной особенностью как способность к стабильной амплификации целевых ДНК-векторов в среде без содержания антибиотиков.
Кроме того, Европейское Медицинское Агентство рекомендует избегать наличия в составе терапевтических плазмидных векторов регуляторных элементов для повышения экспрессии целевых генов (промоторов, энхансеров, посттрансляционных регуляторных элементов), являющихся нуклеотидными последовательностями геномов различных вирусов (Draft Guideline on the quality, non-clinical and clinical aspects of gene therapy medicinal products,http://www.ema.europa.eu/docs/en_GB/document_library/Scientific_guideline/2015/05/WC500187020.pdf). Данные последовательности, хотя и могут увеличивать уровень экспрессии целевого трансгена, однако создают риск рекомбинации с генетическим материалом вирусов дикого типа и интеграции в геном эукариотической клетки. Более того, целесообразность гиперэкспрессии того или иного гена в целях терапии остается нерешенным вопросом.
Также, существенным моментом является размер терапевтического вектора. Известно, что современные плазмидные векторы зачастую перегружены нефункциональными участками, серьезно увеличивающими размер вектора (Mairhofer J, Grabherr R. // Mol Biotechnol. 2008.39(2):97-104). Например, ген устойчивости к ампициллину в векторах серии pBR322, как правило, состоит из не менее чем 1000 п. н., что составляет более 20% от размера самого вектора. При этом наблюдается обратная зависимость между размером вектора и его способностью проникать в эукариотические клетки - ДНК-векторы с небольшим размером эффективней проникаю в клетки человека и животных. Так, например, в серии экспериментов по трансфекции клеток HELA ДНК-векторами с размером от 383 до 4548 п. н. было показано, что разница в эффективности проникновения может достигать двух порядков (отличаться в 100 раз) (Hornstein BD et al. // PLoS ONE. 2016;11(12): e0167537.).
Таким образом при выборе ДНК-вектора в целях безопасности и наибольшей эффективности следует отдавать предпочтение тем конструкциям, в которых не содержатся гены устойчивости к антибиотикам, последовательности вирусного происхождения и размер которых позволяет эффективно проникать в эукариотические клетки. Штамм для получения такого ДНК-вектора в количествах, достаточных для целей генной терапии, должен обеспечивать возможность стабильной амплификации ДНК-вектора с использованием питательных сред, не содержащих антибиотики.
Примером использования рекомбинантных ДНК-векторов для генной терапии является способ получения рекомбинантного вектора для генетической иммунизации по патенту US 9550998 В2. Плазмидный вектор представляет собой суперскученный плазмидный ДНК-вектор и предназначен для экспрессии клонированных генов в клетках животных и человека. Вектор состоит из ориджина репликации, регуляторных элементов, включающих промотор и энхансер цитомегаловируса человека, регуляторные элементы из Т-лимфотропного вируса человека.
Накопление вектора проводят в специальном штамме E.coli без использования антибиотиков за счет антисенс-комплементации гена sacB, введенного в штамм посредством бактериофага. Недостатком данного изобретения является наличие в составе ДНК-вектора регуляторных элементов, представляющих собой последовательности вирусных геномов.
Прототипами настоящего изобретения в части использования генов NOS2, NOS3, VIP, KCNMA1, CGRP для повышения уровня экспрессии этих целевых генов методом генной терапии являются следующие примеры.
Патент US5594032A описывает способ терапии эректильной дисфункции путем введения в организм кДНК гена NOS2, которая обеспечивает повышение экспрессии NOS2. В данном изобретении также описывается способ доставки кДНК гена NOS2 в организм с использованием генетически модифицированных клеток, в которые была введена кДНК гена NOS2. Недостатком данного изобретения является ограниченность использования изобретения терапией эректильной дисфункции и отсутствие генотерапевтического подхода с использованием различных векторов, обеспечивающих экспрессию кДНК гена NOS2.
Заявка US20040120930A1 описывает способ терапии острой ишемии конечностей путем введения в организм рекомбинантного белка NOS3 или вектора, экспрессирующего ген NOS3. Недостатком данного изобретения является ограниченность использования изобретения терапией острой ишемии конечностей и отсутствие определенных требований к векторам, обеспечивающим экспрессию кДНК гена NOS2.
Патент US8536146B2, в котором описывается способ модулирования функционирования нервных клеток путем изменения экспрессии гена KCNMA1. Данный способ подразумевает снижение экспрессии гена KCNMA1 путем введения в клетки siRNA. Недостатком данного изобретения является ограниченность дальнейшего внедрения изобретения состояниями, связанными с патологически высокой экспрессией гена KCNMA1, способ регулирования экспрессии гена путем использования siRNA отсутствие генотерапевтического подхода с использованием различных векторов, обеспечивающих регулирование экспрессии гена KCNMA1.
Заявка WO1994016718A1 описывает генетически модифицированные нейрональные стволовые клетки для терапии заболеваний центральной нервной системы. Генетически модифицированные нейрональные стволовые клетки могут содержать рекомбинантную конструкцию, обеспечивающую экспрессию гена, выбранного из группы генов, включающей ген VIP и ген CGRP. Недостатком данного изобретения является ограниченность дальнейшего внедрения изобретения терапией заболеваний нервной системы, а также использование генетически модифицированных клеток для увеличения экспрессии генов VIP и CGRP, но не ДНК-векторов, экспрессирующих эти гены.
Раскрытие изобретения
Задачей изобретения является конструирование генотерапевтических ДНК-векторов для повышения уровня экспрессии группы генов NOS2, NOS3, VIP, KCNMA1, CGRP в организме человека и животных, сочетающих в себе следующие свойства:
I) Эффективность генотерапевтического ДНК-вектора для повышения уровня экспрессии целевых генов в эукариотических клетках.
II) Возможность безопасного применения для генетической терапии человека и животных за счет отсутствия в составе генотерапевтического ДНК-вектора регуляторных элементов, представляющих собой нуклеотидные последовательности вирусных геномов.
III) Возможность безопасного применения для генетической терапии человека и животных за счет отсутствия в составе генотерапевтического ДНК-вектора генов антибиотикорезистентности.
IV) Технологичность получения и возможность наработки генотерапевтического ДНК-вектора в промышленных масштабах.
Пункты II и III предусмотрены в данном техническом решении в соответствии с рекомендациями государственных регуляторов к лекарственным средствам для генной терапии, в частности, Европейского Агентства по лекарственным средствам касательно отказа от введения маркеров антибиотикорезистентности в разрабатываемые плазмидные векторы для генной терапии (Reflection paper on design modifications of gene therapy medicinal products during development / 14 December 2011,
EMA/CAT/GTWP/44236/2009 Committee for advanced therapies) и касательно отказа от введения в разрабатываемые плазмидные векторы для генной терапии элементов вирусных геномов (Guideline on the quality, non-clinical and clinical aspects of gene therapy medicinal products / 23 March 2015, EMA/CAT/80183/2014, Committee for Advanced Therapies).
Задачей изобретения также является конструирование штаммов, несущих эти генотерапевтические ДНК-вектора, для наработки и производства в промышленных масштабах генотерапевтических ДНК-векторов.
Поставленная задача решается за счет того, что создан генотерапевтический ДНК-вектор на основе генотерапевтического ДНК-вектора VTvaf17, несущий целевой ген, выбранный из группы генов NOS2, NOS3, VIP, KCNMA1, CGRP, для повышения уровня экспрессии этого целевого гена в организме человека и животных, при этом генотерапевтический ДНК-вектор VTvaf17-NOS2, или VTvaf17-NOS3, или VTvaf17-VIP, или VTvaf17-KCNMA1, или VTvaf17-CGRP имеет нуклеотидную последовательность SEQ ID №1 или SEQ ID №2 или SEQ ID №3 или SEQ ID №4 или SEQ ID №5 соответственно. При этом каждый из созданных генотерапевтических ДНК-векторов: VTvaf17-NOS2, или VTvaf17-NOS3, или VTvaf17-VIP, или VTvaf17-KCNMA1, или VTvaf17-CGRP за счет ограниченного размера векторной части VTvaf17, не превышающей 3200 п. н., обладает способностью эффективно проникать в клетки и экспрессировать клонированный в него целевой ген, выбранный из группы генов NOS2, NOS3, VIP, KCNMA1, CGRP соответственно. В составе генотерапевтического ДНК-вектора отсутствуют нуклеотидные последовательности вирусного происхождения и отсутствуют гены антибиотикорезистентности, обеспечивая возможность его безопасного применения для генетической терапии человека и животных.
Создан также способ получения генотерапевтического ДНК-вектора на основе генотерапевтического ДНК-вектора VTvaf17, несущего целевой ген, выбранный из группы генов: ген NOS2, ген NOS3, ген VIP, ген KCNMA1, ген CGRP, который заключается в том, что каждый из генотерапевтических ДНК-векторов: VTvaf17-NOS2, или VTvaf17-NOS3, или VTvaf17-VIP, или VTvaf17-KCNMA1, или VTvaf17-CGRP получают следующим образом: кодирующую часть целевого гена из группы NOS2, или NOS3, или VIP, или KCNMA1, или CGRP клонируют в ДНК-вектор VTvaf17 и получают генотерапевтический ДНК-вектор VTvaf17-NOS2, SEQ ID №1, или VTvaf17-NOS3, SEQ ID №2 или VTvaf17-VIP, SEQ ID №3, или VTvaf17-KCNMA1, SEQ ID №4, или VTvaf17-CGRP, SEQ ID №5 соответственно.
Способ применения созданного генотерапевтического ДНК-вектора на основе генотерапевтического ДНК-вектора VTvaf17, несущего целевой ген, выбранный из группы генов: ген NOS2, ген NOS3, ген VIP, ген KCNMA1, ген CGRP, для повышения уровня экспрессии этих целевых генов, заключается во введении выбранного генотерапевтического ДНК-вектора или нескольких выбранных генотерапевтических ДНК-векторов в клетки, органы и ткани человека или животного, и/или во введении в органы и ткани человека или животного аутологичных клеток человека или животного, трансфицированных выбранным генотерапевтическим ДНК-вектором или несколькими выбранными генотерапевтическими ДНК-векторами, или в сочетании обозначенных способов.
Способ получения штамма Escherichia coli SCS110-AF/VTvaf17-NOS2, или штамма Escherichia coli SCS110-AF/VTvaf17-NOS3, или штамма Escherichia coli SCS110-AF/VTvaf17-VIP, или штамма Escherichia coli SCS110-AF/VTvaf17-KCNMA1 или штамма Escherichia coli SCS110-AF/VTvaf17-CGRP заключается в электропорации компетентных клеток штамма Escherichia coli SCS110-AF созданным генотерапевтическим ДНК-вектором и последующей селекцией стабильных клонов штамма с использованием селективной среды.
Заявлен штамм Escherichia coli SCS110-AF/VTvaf17-NOS2, или штамм Escherichia coli SCS110-AF/VTvaf17-NOS3, или штамм Escherichia coli SCS110-AF/VTvaf17-VIP, или штамм Escherichia coli SCS110-AF/VTvaf17-KCNMA1, или штамм Escherichia coli SCS110-AF/VTvaf17-CGRP, несущий генотерапевтический ДНК-вектор для его наработки с возможностью культивирования штамма без использования антибиотиков.
Способ производства в промышленных масштабах генотерапевтического ДНК-вектора заключается в масштабировании бактериальной культуры штамма до количеств, необходимых для наращивания бактериальной биомассы в промышленном ферментере, после чего биомассу используют для выделения фракции, содержащей целевой ДНК-продукт - генотерапевтический ДНК-вектор VTvaf17-NOS2 или VTvaf17-NOS3 или VTvaf17-VIP или VTvaf17-KCNMA1 или VTvaf17-CGRP многостадийно фильтруют и очищают хроматографическими методами.
Изобретение поясняется чертежами, где:
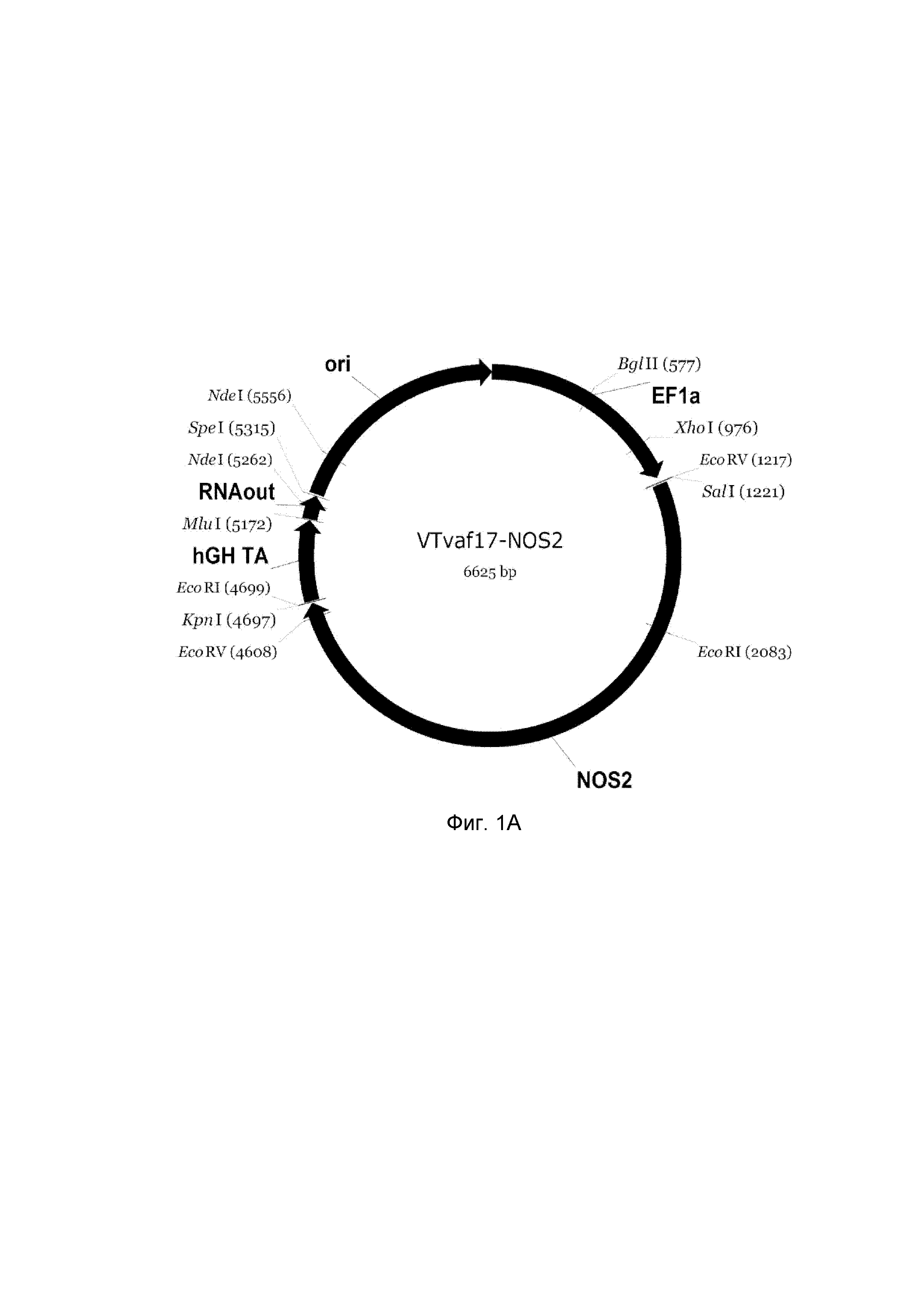
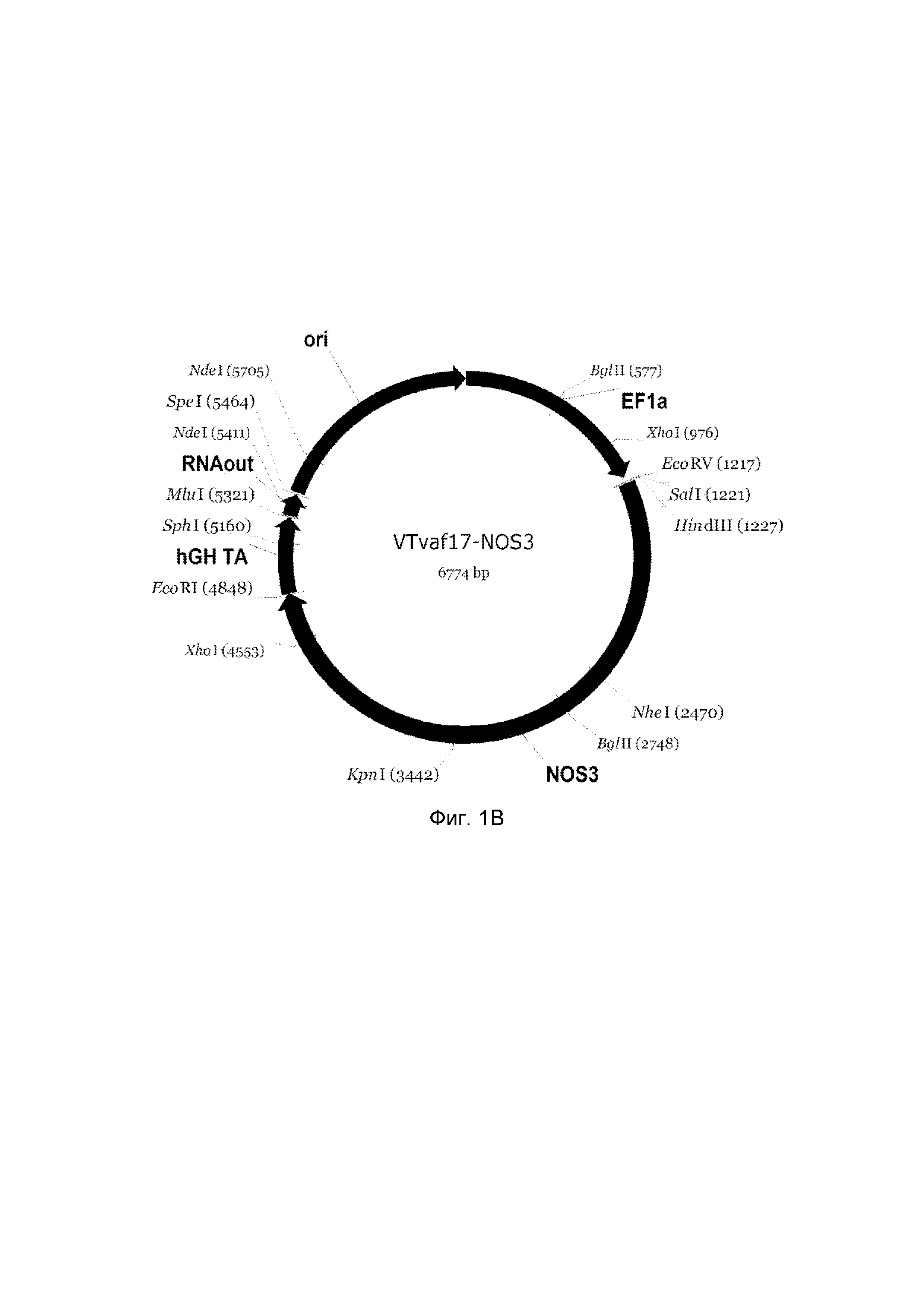
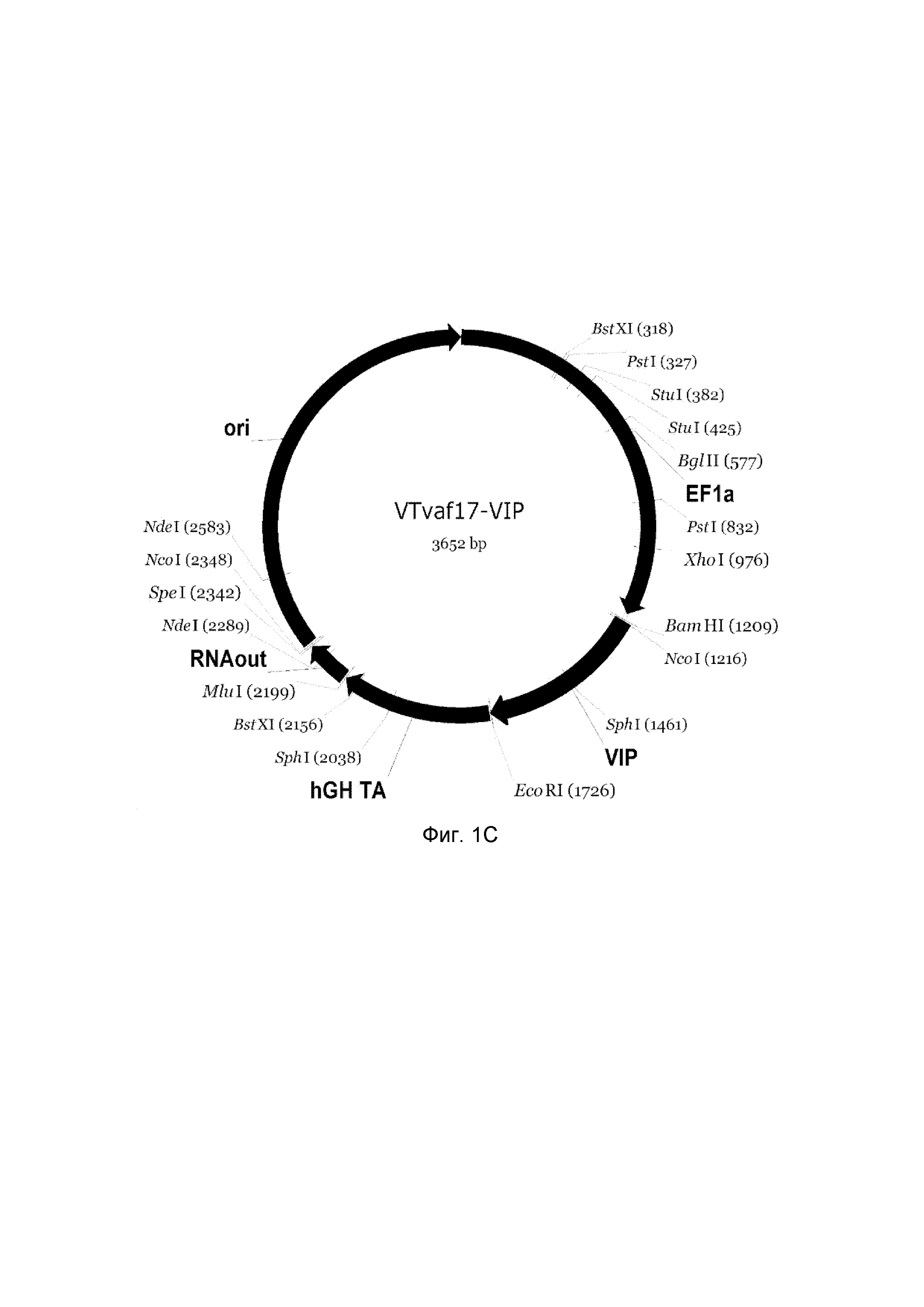
На фиг. 1
приведена схема генотерапевтического ДНК-вектора VTvaf17, несущего целевой ген, выбранный из группы генов NOS2, NOS3, VIP, KCNMA1, CGRP, который представляет собой кольцевую двуцепочечную молекулу ДНК, способную к автономной репликации в клетках бактерии Escherichia coli.
На фиг. 1 приведены схемы, соответствующие:
A - генотерапевтический ДНК-вектор VTvaf17-NOS2,
B - генотерапевтический ДНК-вектор VTvaf17-NOS3,
C - генотерапевтический ДНК-вектор VTvaf17-VIP,
D - генотерапевтический ДНК-вектор VTvaf17-KCNMA1,
E - генотерапевтический ДНК-вектор VTvaf17-CGRP.
На схемах отмечены следующие структурные элементы вектора:
EF1a - промоторная область гена человеческого фактора элонгации EF1A с собственным энхансером, содержащимся в первом интроне гена. Служит для обеспечения высокого уровня транскрипции рекомбинантного гена в большинстве тканей человека;
Рамка считывания целевого гена, соответствующая кодирующей части гена NOS2 (фиг. 1A), или NOS3 (фиг. 1B), или VIP (фиг. 1C), или KCNMA1 (фиг. 1D), или CGRP (фиг. 1E) соответственно;
hGH-TA - терминатор транскрипции и сайт полиаденилирования гена фактора роста человека;
ori - ориджин репликации, служащий для автономной репликации с однонуклеотидной заменой щдля повышения копийности плазмиды в клетках большинства штаммов Escherichia coli;
RNA-out - регуляторный элемент РНК-out транспозона Tn 10, обеспечивающий возможность положительной селекции без использования антибиотиков при использовании штамма Escherichia coli SCS 110.
Отмечены уникальные сайты рестрикции.
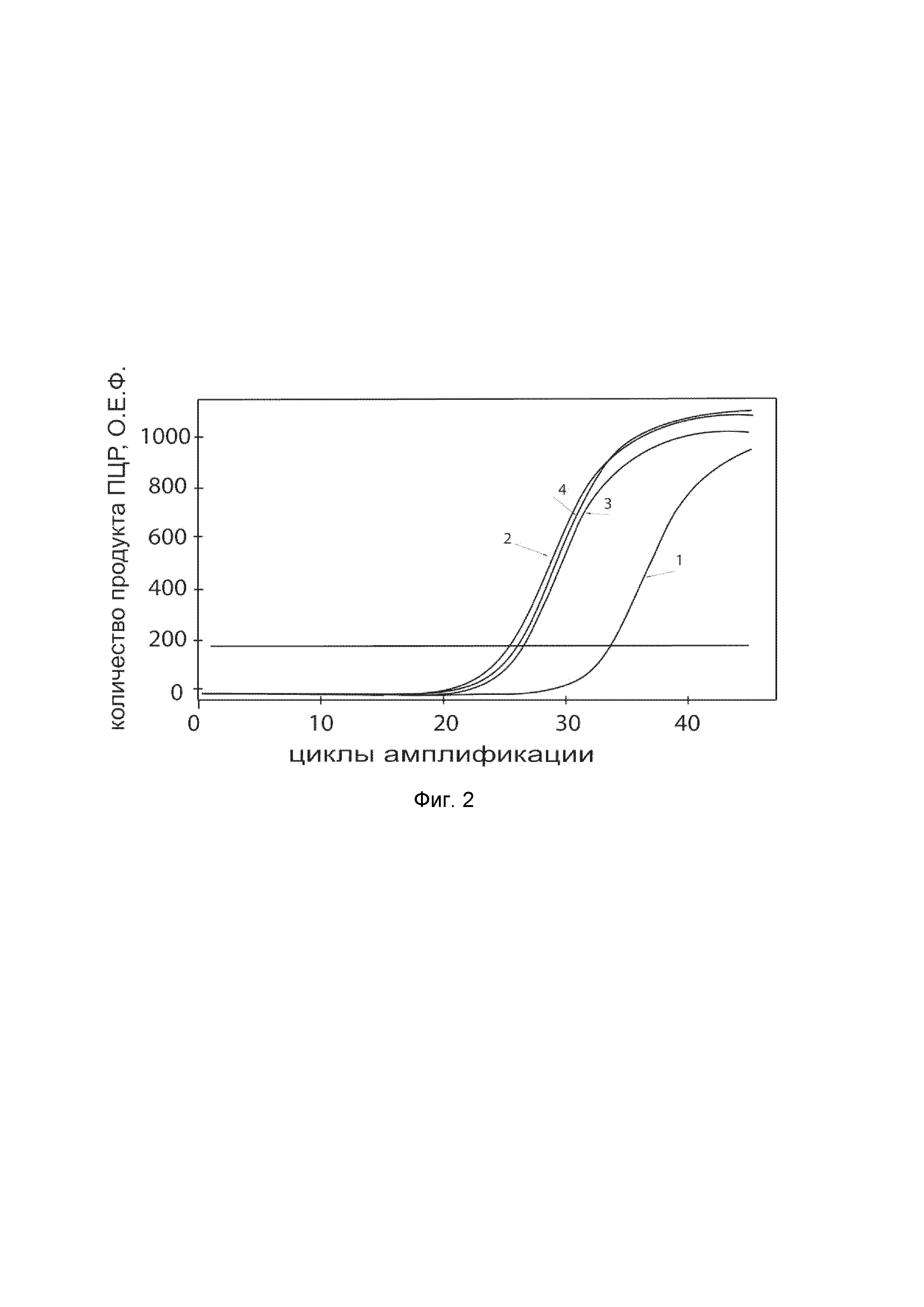
На фиг. 2
показаны графики накопления ампликонов кДНК целевого гена, а именно, гена NOS2, в первичной культуре гладкомышечных клеток мочевого пузыря человека HBdSMC (ATCC PCS-420-012) до их трансфекции и через 48 часов после трансфекции этих клеток генотерапевтическим ДНК-вектором VTvaf17-NOS2 с целью оценки способности проникать в эукариотические клетки и функциональной активности, то есть экспрессии целевого гена на уровне мРНК.
На фиг. 2 отмечены следующие кривые накопления ампликонов в ходе реакции, соответствующие:
1 - кДНК гена NOS2 в первичной культуре гладкомышечных клеток мочевого пузыря человека HBdSMC до трансфекции ДНК-вектором VTvaf17-NOS2;
2 - кДНК гена NOS2 в первичной культуре гладкомышечных клеток мочевого пузыря человека HBdSMC после трансфекции ДНК-вектором VTvaf17-NOS2;
3 - кДНК гена B2M в первичной культуре гладкомышечных клеток мочевого пузыря человека HBdSMC до трансфекции ДНК-вектором VTvaf17-NOS2;
4 - кДНК гена B2M в первичной культуре гладкомышечных клеток мочевого пузыря человека HBdSMC после трансфекции ДНК-вектором VTvaf17-NOS2.
В качестве референтного гена использовали ген B2M (Бета-2-микроглобулин) приведенный в базе данных GenBank под номером NM 004048.2.
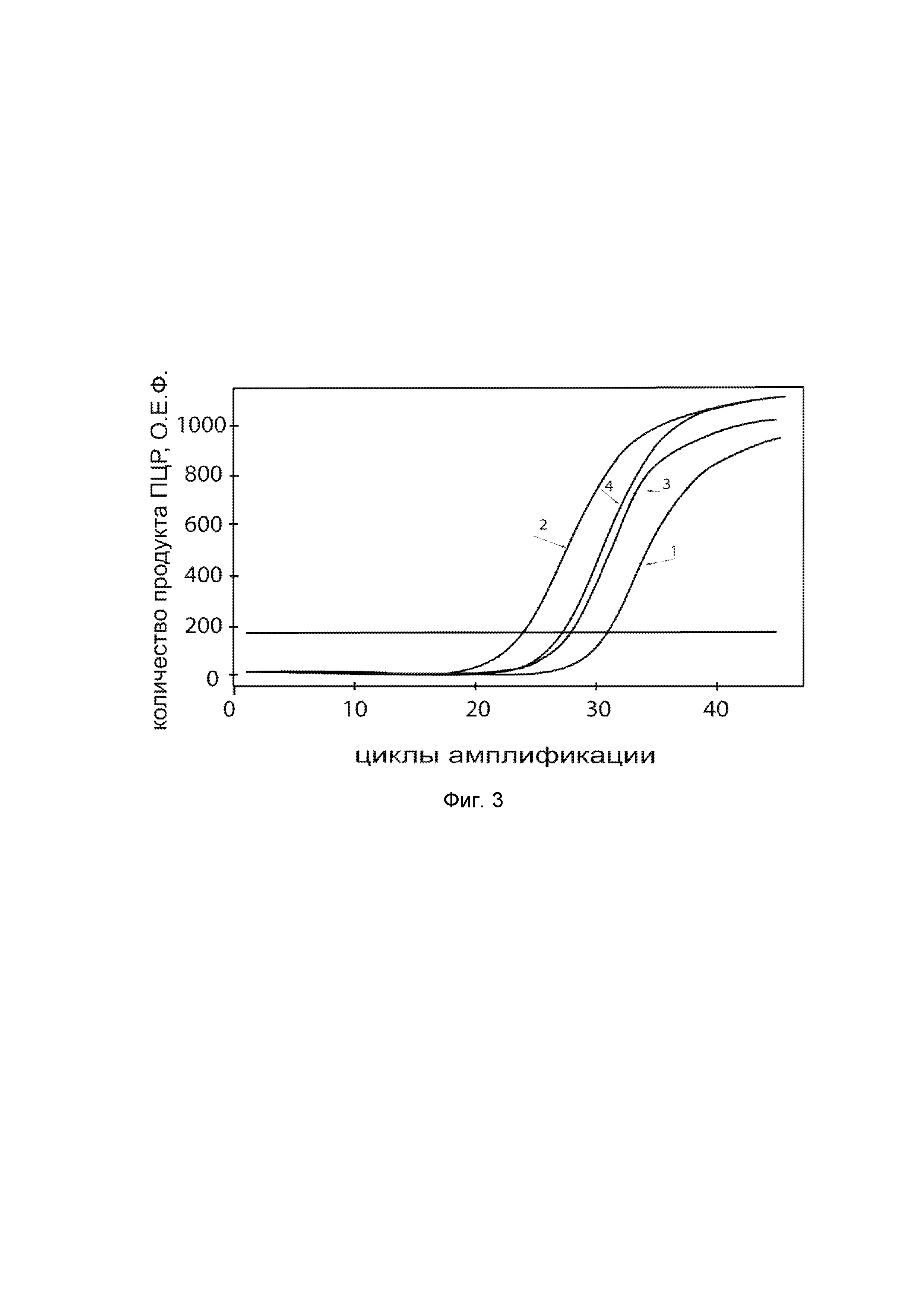
На фиг. 3
показаны графики накопления ампликонов кДНК целевого гена, а именно гена NOS3, в первичной культуре гладкомышечных клеток аорты человека T/G HA-VSMC (ATCC CRL-1999™) до их трансфекции и через 48 часов после трансфекции этих клеток ДНК-вектором VTvaf17-NOS3 с целью оценки способности проникать в эукариотические клетки и функциональной активности, то есть экспрессии целевого гена на уровне мРНК.
На фиг. 3 отмечены следующие кривые накопления ампликонов в ходе реакции, соответствующие:
1 - кДНК гена NOS3 в первичной культуре гладкомышечных клеток аорты человека T/G HA-VSMC до трансфекции ДНК-вектором VTvaf17-NOS3;
2 - кДНК гена NOS3 в первичной культуре гладкомышечных клеток аорты человека T/G HA-VSMC после трансфекции ДНК-вектором VTvaf17-NOS3;
3 - кДНК гена B2M в первичной культуре гладкомышечных клеток аорты человека T/G HA-VSMC до трансфекции ДНК-вектором VTvaf17-NOS3;
4 - кДНК гена B2M в первичной культуре гладкомышечных клеток аорты человека T/G HA-VSMC после трансфекции ДНК-вектором VTvaf17-NOS3.
В качестве референтного гена использовали ген B2M (Бета-2-микроглобулин) приведенный в базе данных GenBank под номером NM 004048.2.
На фиг. 4
показаны графики накопления ампликонов кДНК целевого гена, а именно гена VIP в первичной культуре гладкомышечных клеток мочевого пузыря человека HBdSMC (ATCC PCS-420-012) до их трансфекции и через 48 часов после трансфекции этих клеток ДНК-вектором VTvaf17-VIP с целью оценки способности проникать в эукариотические клетки и функциональной активности, то есть экспрессии целевого гена на уровне мРНК.
На фиг. 4 отмечены следующие кривые накопления ампликонов в ходе реакции, соответствующие:
1 - кДНК гена VIP в первичной культуре гладкомышечных клеток мочевого пузыря человека HBdSMC до трансфекции ДНК-вектором VTvaf17-VIP;
2 - кДНК гена VIP в первичной культуре гладкомышечных клеток мочевого пузыря человека HBdSMC после трансфекции ДНК-вектором VTvaf17-VIP;
3 - кДНК гена B2M в первичной культуре гладкомышечных клеток мочевого пузыря человека HBdSMC до трансфекции ДНК-вектором VTvaf17-VIP;
4 - кДНК гена B2M в первичной культуре гладкомышечных клеток мочевого пузыря человека HBdSMC после трансфекции ДНК-вектором VTvaf17-VIP.
В качестве референтного гена использовали ген B2M (Бета-2-микроглобулин) приведенный в базе данных GenBank под номером NM 004048.2.
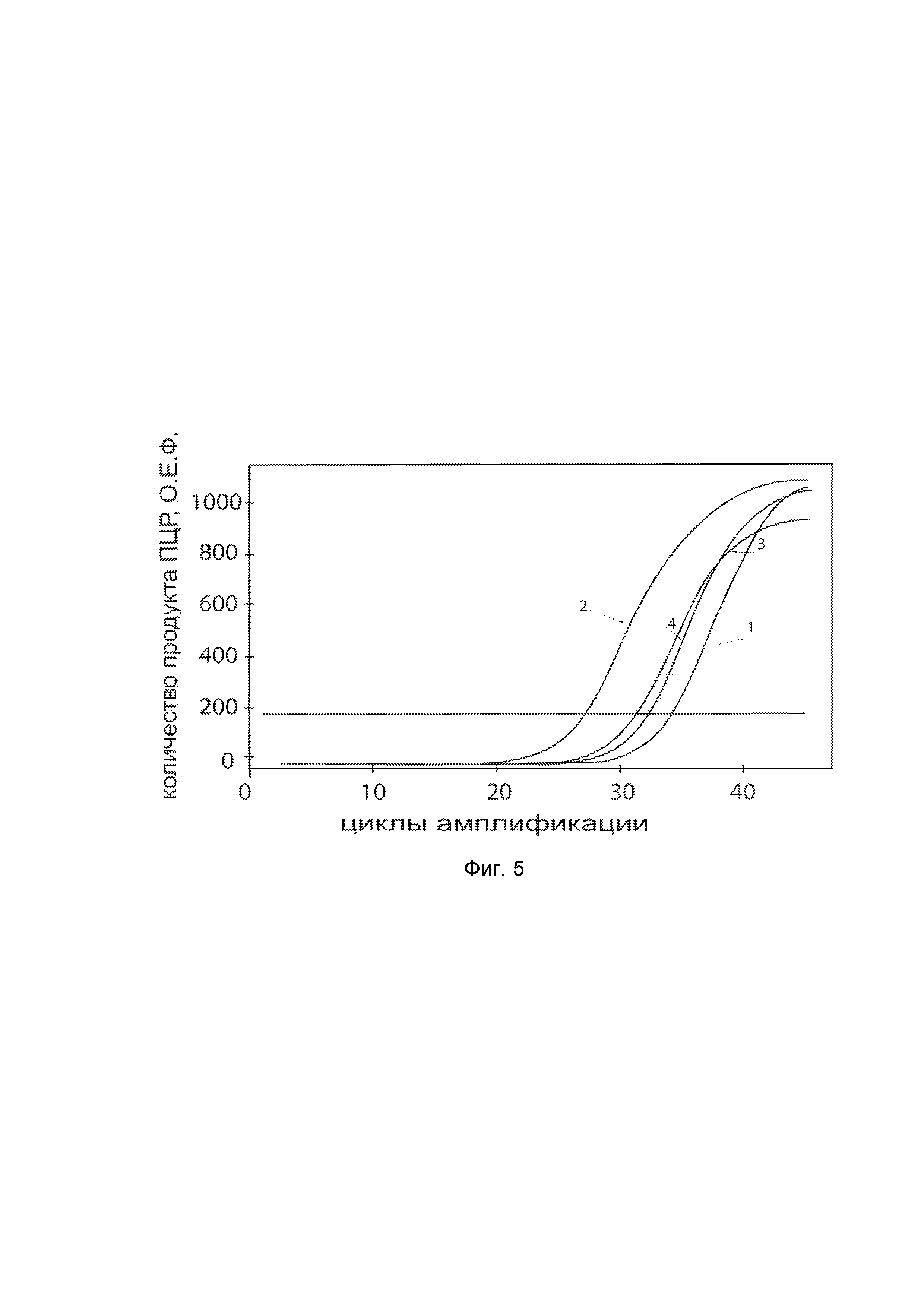
На фиг. 5
показаны графики накопления ампликонов кДНК целевого гена, а именно гена KCNMA1, в первичной культуре гладкомышечных клеток пещеристого тела мужского полового члена человека до их трансфекции и через 48 часов после трансфекции этих клеток ДНК-вектором VTvaf17-KCNMA1 с целью оценки способности проникать в эукариотические клетки и функциональной активности, то есть экспрессии целевого гена на уровне мРНК.
На фиг. 5 отмечены следующие кривые накопления ампликонов в ходе реакции, соответствующие:
1 - кДНК гена KCNMA1 в первичной культуре гладкомышечных клеток пещеристого тела мужского полового члена человека до трансфекции ДНК-вектором VTvaf17-KCNMA1;
2 - кДНК гена KCNMA1 в первичной культуре гладкомышечных клеток пещеристого тела мужского полового члена человека после трансфекции ДНК-вектором VTvaf17-KCNMA1;
3 - кДНК гена B2M в первичной культуре гладкомышечных клеток пещеристого тела мужского полового члена человека до трансфекции ДНК-вектором VTvaf17-KCNMA1;
4 - кДНК гена B2M в первичной культуре гладкомышечных клеток пещеристого тела мужского полового члена человека после трансфекции ДНК-вектором VTvaf17-KCNMA1.
В качестве референтного гена использовали ген B2M (Бета-2-микроглобулин) приведенный в базе данных GenBank под номером NM 004048.2.
На фиг. 6
показаны графики накопления ампликонов кДНК целевого гена, а именно гена CGRP, в первичной культуре гладкомышечных клеток мочевого пузыря человека HBdSMC (ATCC PCS-420-012) до их трансфекции и через 48 часов после трансфекции этих клеток ДНК-вектором VTvaf17-CGRP с целью оценки способности проникать в эукариотические клетки и функциональной активности, то есть экспрессии целевого гена на уровне мРНК.
На фиг. 6 отмечены следующие кривые накопления ампликонов в ходе реакции, соответствующие:
1 - кДНК гена CGRP в первичной культуре гладкомышечных клеток мочевого пузыря человека HBdSMC до трансфекции ДНК-вектором VTvaf17-CGRP;
2 - кДНК гена CGRP в первичной культуре гладкомышечных клеток мочевого пузыря человека HBdSMC после трансфекции ДНК-вектором VTvaf17-CGRP;
3 - кДНК гена B2M в первичной культуре гладкомышечных клеток мочевого пузыря человека HBdSMC до трансфекции ДНК-вектором VTvaf17-CGRP;
4 - кДНК гена B2M в первичной культуре гладкомышечных клеток мочевого пузыря человека HBdSMC после трансфекции ДНК-вектором VTvaf17-CGRP.
В качестве референтного гена использовали ген B2M (Бета-2-микроглобулин) приведенный в базе данных GenBank под номером NM_004048.2.
На фиг. 7
показана диаграмма концентрации белка NOS2 в лизате клеток первичной культуры гладкомышечных клеток мочевого пузыря человека HBdSMC (ATCC PCS-420-012) после трансфекции этих клеток ДНК-вектором VTvaf17-NOS2 с целью оценки функциональной активности, то есть экспрессии на уровне белка, по изменению количества белка NOS2 в лизате клеток.
На фиг. 7 отмечены следующие элементы:
культура А - первичная культура гладкомышечных клеток мочевого пузыря человека HBdSMC, трансфицированная водным раствором дендримеров без плазмидной ДНК (контроль);
культура B - первичная культура гладкомышечных клеток мочевого пузыря человека HBdSMC, трансфицированных ДНК-вектором VTvaf17;
культура C - первичная культура гладкомышечных клеток мочевого пузыря человека HBdSMC, трансфицированных ДНК-вектором VTvaf17-NOS2.
На фиг. 8
показана диаграмма концентрации белка NOS3 в лизате первичной культуры гладкомышечных клеток мочевого пузыря человека HBdSMC (ATCC PCS-420-012) после трансфекции этих клеток ДНК-вектором VTvaf17-NOS3 с целью оценки функциональной активности, то есть экспрессии целевого гена на уровне белка, и возможности повышения уровня экспрессии белка с помощью генотерапевтического ДНК-вектора на основе генотерапевтического ДНК-вектора VTvaf17, несущего целевой ген NOS3.
На фиг. 8 отмечены следующие элементы:
культура А - первичная культура гладкомышечных клеток мочевого пузыря человека HBdSMC, трансфицированная водным раствором дендримеров без плазмидной ДНК (контроль);
культура B - первичная культура гладкомышечных клеток мочевого пузыря человека HBdSMC, трансфицированная ДНК-вектором VTvaf17;
культура C - первичная культура гладкомышечных клеток мочевого пузыря человека HBdSMC, трансфицированных ДНК-вектором VTvaf17-NOS3.
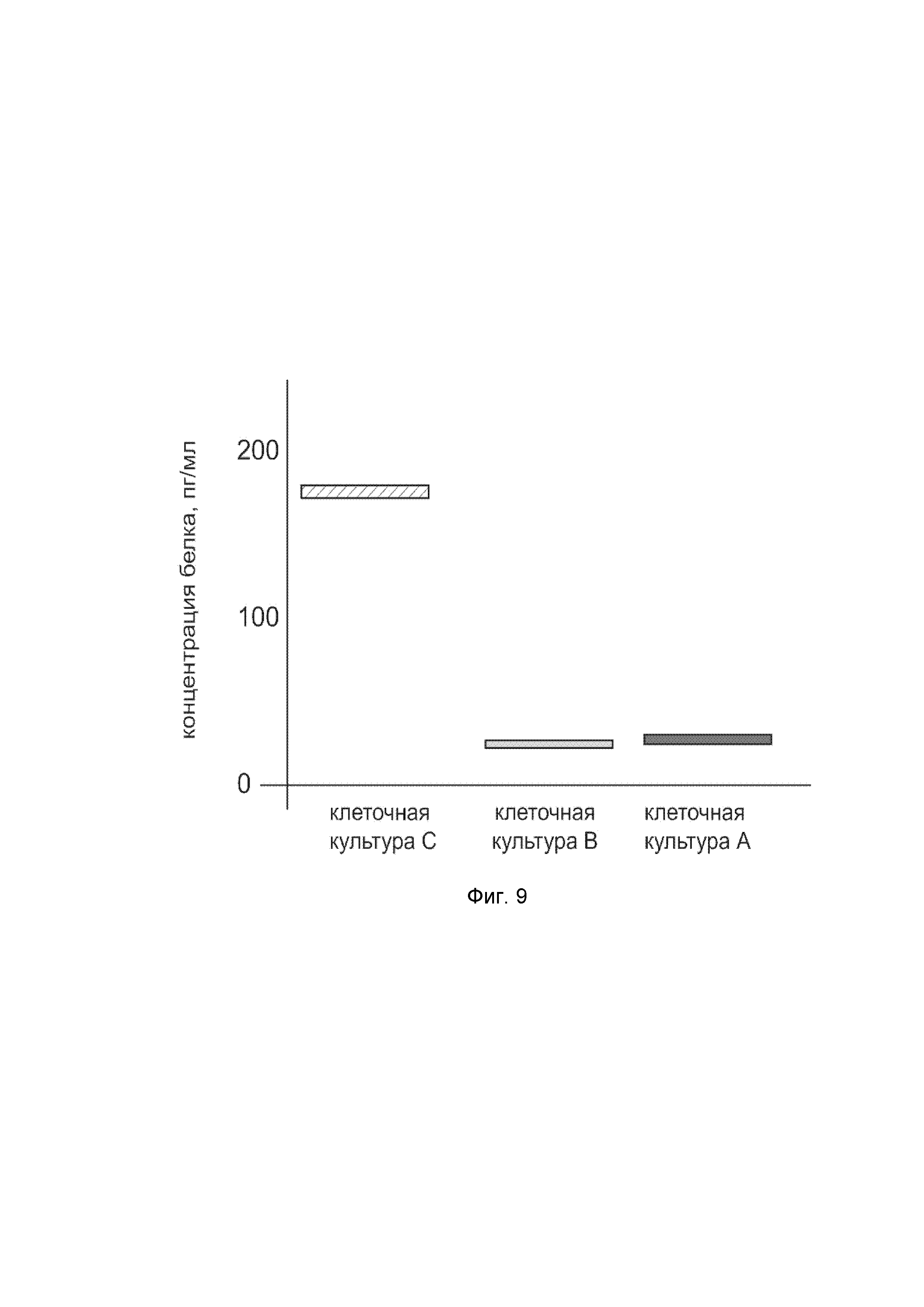
На фиг. 9
показана диаграмма концентрации белка VIP в кондиционированной среде с первичной культуры гладкомышечных клеток мочевого пузыря человека HBdSMC (ATCC PCS-420-012) после трансфекции этих клеток ДНК-вектором VTvaf17-VIP с целью оценки функциональной активности, то есть экспрессии целевого гена на уровне белка, и возможности повышения уровня экспрессии белка с помощью генотерапевтического ДНК-вектора на основе генотерапевтического ДНК-вектора VTvaf17, несущего целевой ген VIP.
На фиг. 9 отмечены следующие элементы:
культура А - кондиционированная среда с культуры гладкомышечных клеток мочевого пузыря человека HBdSMC, трансфицированных водным раствором дендримеров без плазмидной ДНК (контроль);
культура B - кондиционированная среда с культуры гладкомышечных клеток мочевого пузыря человека HBdSMC, трансфицированных ДНК-вектором VTvaf17;
культура C - кондиционированная среда с культуры гладкомышечных клеток мочевого пузыря человека HBdSMC, трансфицированных ДНК-вектором VTvaf17-VIP.
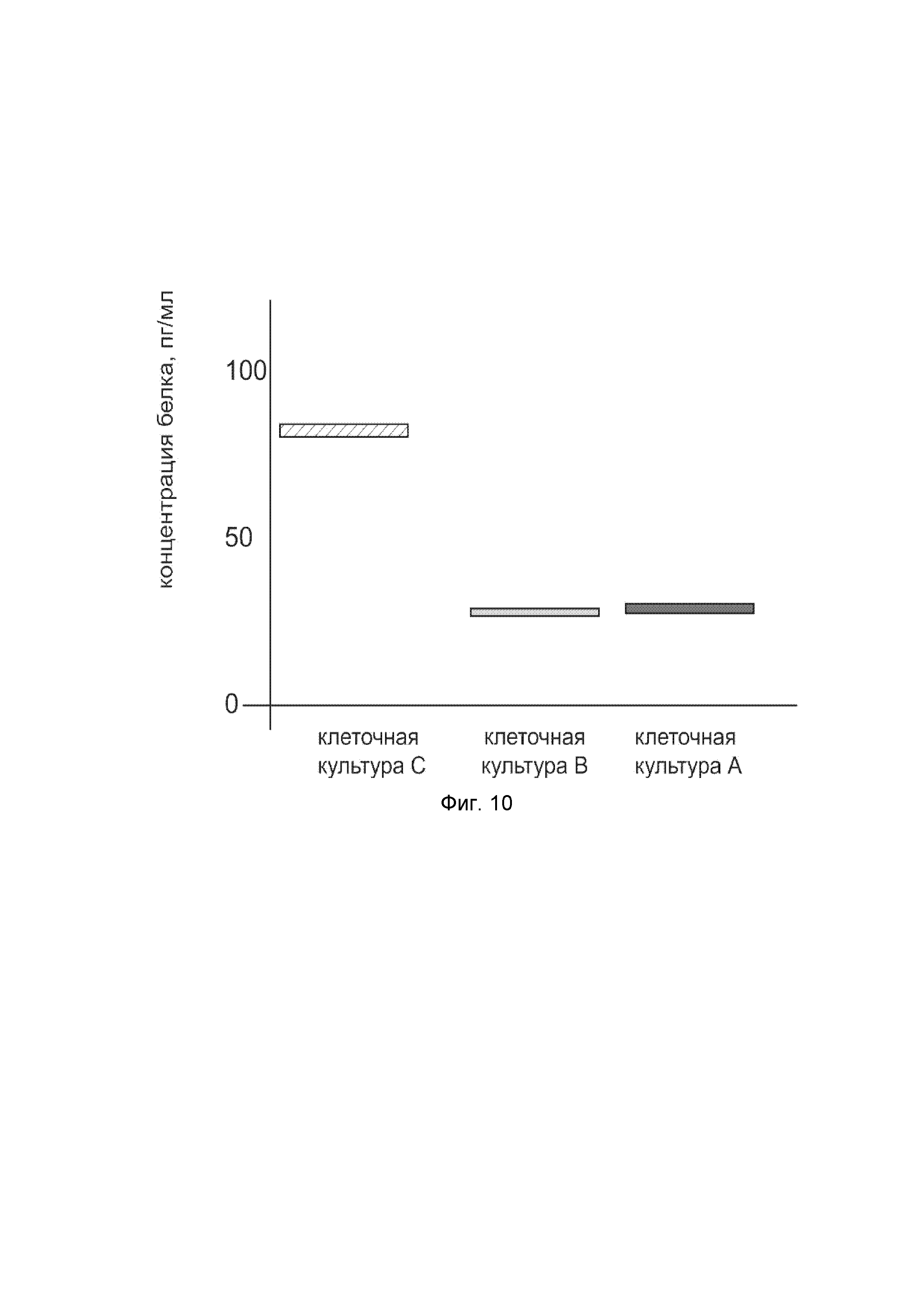
На фиг. 10
показана диаграмма концентрации белка KCNMA1 в клеточном лизате первичной культуры гладкомышечных клеток мочевого пузыря человека HBdSMC (ATCC PCS-420-012) после трансфекции этих клеток ДНК-вектором VTvaf17-KCNMA1 с целью оценки функциональной активности, то есть экспрессии целевого гена на уровне белка, и возможности повышения уровня экспрессии белка с помощью генотерапевтического ДНК-вектора на основе генотерапевтического ДНК-вектора VTvaf17, несущего целевой ген KCNMA1.
На фиг.10 отмечены следующие элементы:
культура А - первичная культура гладкомышечных клеток мочевого пузыря человека HBdSMC, трансфицированных водным раствором дендримеров без плазмидной ДНК (контроль);
культура B - первичная культура гладкомышечных клеток мочевого пузыря человека HBdSMC, трансфицированных ДНК-вектором VTvaf17;
культура C - первичная культура гладкомышечных клеток мочевого пузыря человека HBdSMC, трансфицированных ДНК-вектором VTvaf17-KCNMA1.
На фиг. 11
показана диаграмма концентрации белка CGRP в клеточном лизате первичной культуры гладкомышечных клеток пещеристого тела мужского полового члена человека после трансфекции этих клеток ДНК-вектором VTvaf17-CGRP с целью оценки функциональной активности, то есть экспрессии целевого гена на уровне белка, и возможности повышения уровня экспрессии белка с помощью генотерапевтического ДНК-вектора на основе генотерапевтического ДНК-вектора VTvaf17, несущего целевой ген CGRP.
На фиг. 11 отмечены следующие элементы:
культура А - первичная культура гладкомышечных клеток пещеристого тела мужского полового члена человека, трансфицированных водным раствором дендримеров без плазмидной ДНК (контроль);
культура B - культура гладкомышечных клеток пещеристого тела мужского полового члена человека, трансфицированных ДНК-вектором VTvaf17;
культура C - культура гладкомышечных клеток пещеристого тела мужского полового члена человека, трансфицированных ДНК-вектором VTvaf17-CGRP.
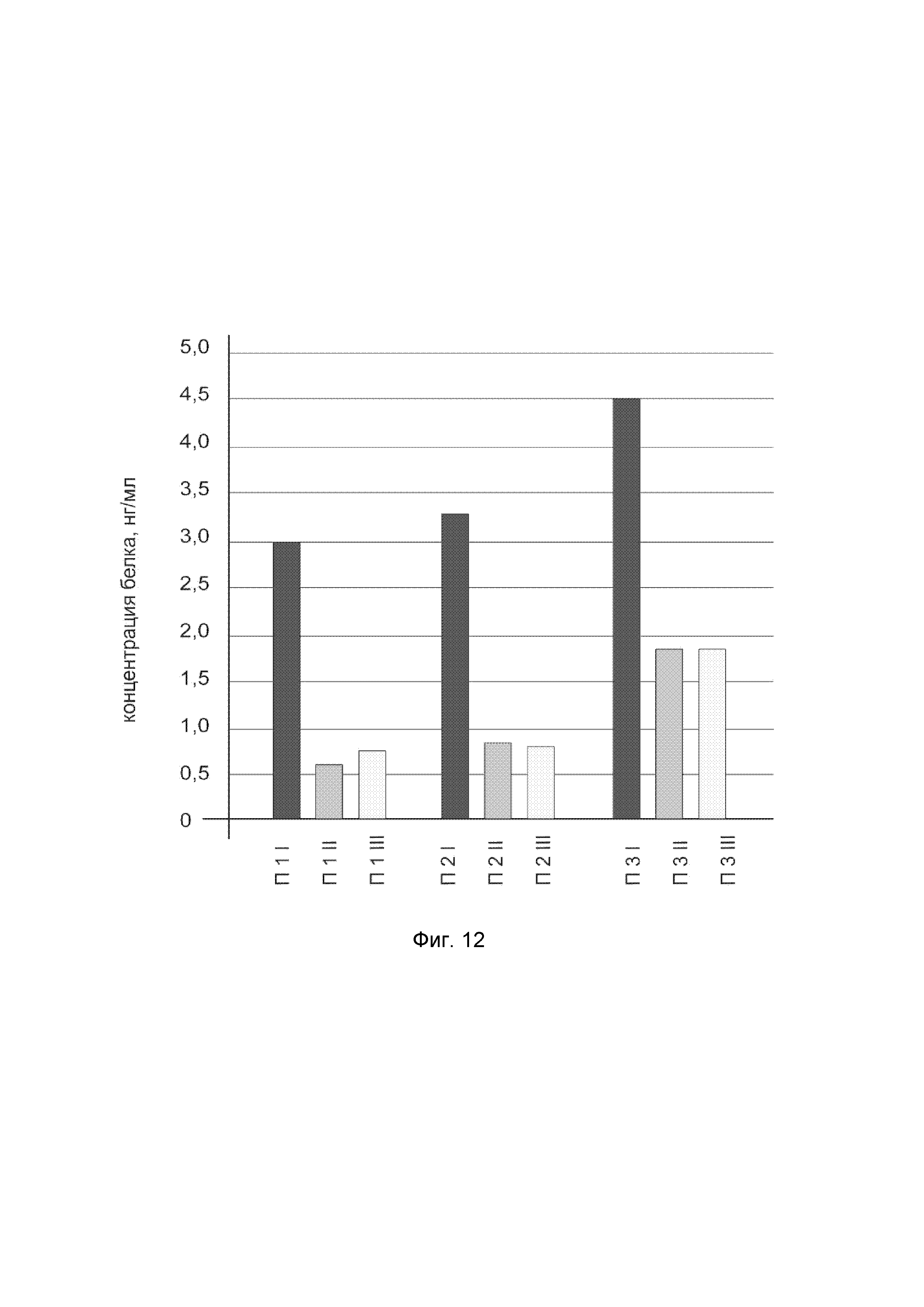
На фиг. 12
показана диаграмма концентрации белка NOS2 в биоптатах кожи трех пациентов после введения в кожу этих пациентов генотерапевтического ДНК-вектора VTvaf17-NOS2 с целью оценки функциональной активности, то есть экспрессии целевого гена на уровне белка, и возможности повышения уровня экспрессии белка с помощью генотерапевтического ДНК-вектора на основе генотерапевтического ДНК-вектора VTvaf17, несущего целевой ген NOS2.
На фиг.12 отмечены следующие элементы:
П1I - биоптат кожи пациента П1 в зоне введения генотерапевтического ДНК вектора VTvaf17-NOS2;
П1II - биоптат кожи пациента П1 в зоне введения генотерапевтического ДНК вектора VTvaf17 (плацебо);
П1III - биоптат кожи пациента П1 из интактного участка;
П2I - биоптат кожи пациента П2 в зоне введения генотерапевтического ДНК вектора VTvaf17-NOS2;
П2II - биоптат кожи пациента П2 в зоне введения генотерапевтического ДНК вектора VTvaf17 (плацебо);
П2III - биоптат кожи пациента П2 из интактного участка;
П3I - биоптат кожи пациента П3 в зоне введения генотерапевтического ДНК вектора VTvaf17-NOS2;
П3II - биоптат кожи пациента П3 в зоне введения генотерапевтического ДНК вектора VTvaf17 (плацебо);
П3III - биоптат кожи пациента П3 из интактного участка.
На фиг 13
показана диаграмма концентрации белка NOS3 в биоптатах икроножной мышцы трех пациентов после введения в икроножную мышцу этих пациентов генотерапевтического ДНК-вектора VTvaf17-NOS3, с целью оценки функциональной активности, то есть экспрессии целевого гена на уровне белка, и возможности повышения уровня экспрессии белка с помощью генотерапевтического ДНК-вектора на основе генотерапевтического ДНК-вектора VTvaf17, несущего целевой ген NOS3.
На фиг.13 отмечены следующие элементы:
П1I - биоптат икроножной мышцы пациента П1 в зоне введения генотерапевтического ДНК вектора VTvaf17-NOS3;
П1II - биоптат икроножной мышцы пациента П1 в зоне введения генотерапевтического ДНК вектора VTvaf17 (плацебо);
П1III - биоптат интактного участка икроножной мышцы пациента П1;
П2I - биоптат икроножной мышцы пациента П2 в зоне введения генотерапевтического ДНК вектора VTvaf17-NOS3;
П2II - биоптат икроножной мышцы пациента П2 в зоне введения генотерапевтического ДНК вектора VTvaf17 (плацебо);
П2III - биоптат интактного участка икроножной мышцы пациента П2;
П3I - биоптат икроножной мышцы пациента П3 в зоне введения генотерапевтического ДНК вектора VTvaf17-NOS3;
П3II - биоптат икроножной мышцы пациента П3 в зоне введения генотерапевтического ДНК вектора VTvaf17 (плацебо);
П3III - биоптат интактного участка икроножной мышцы пациента П3.
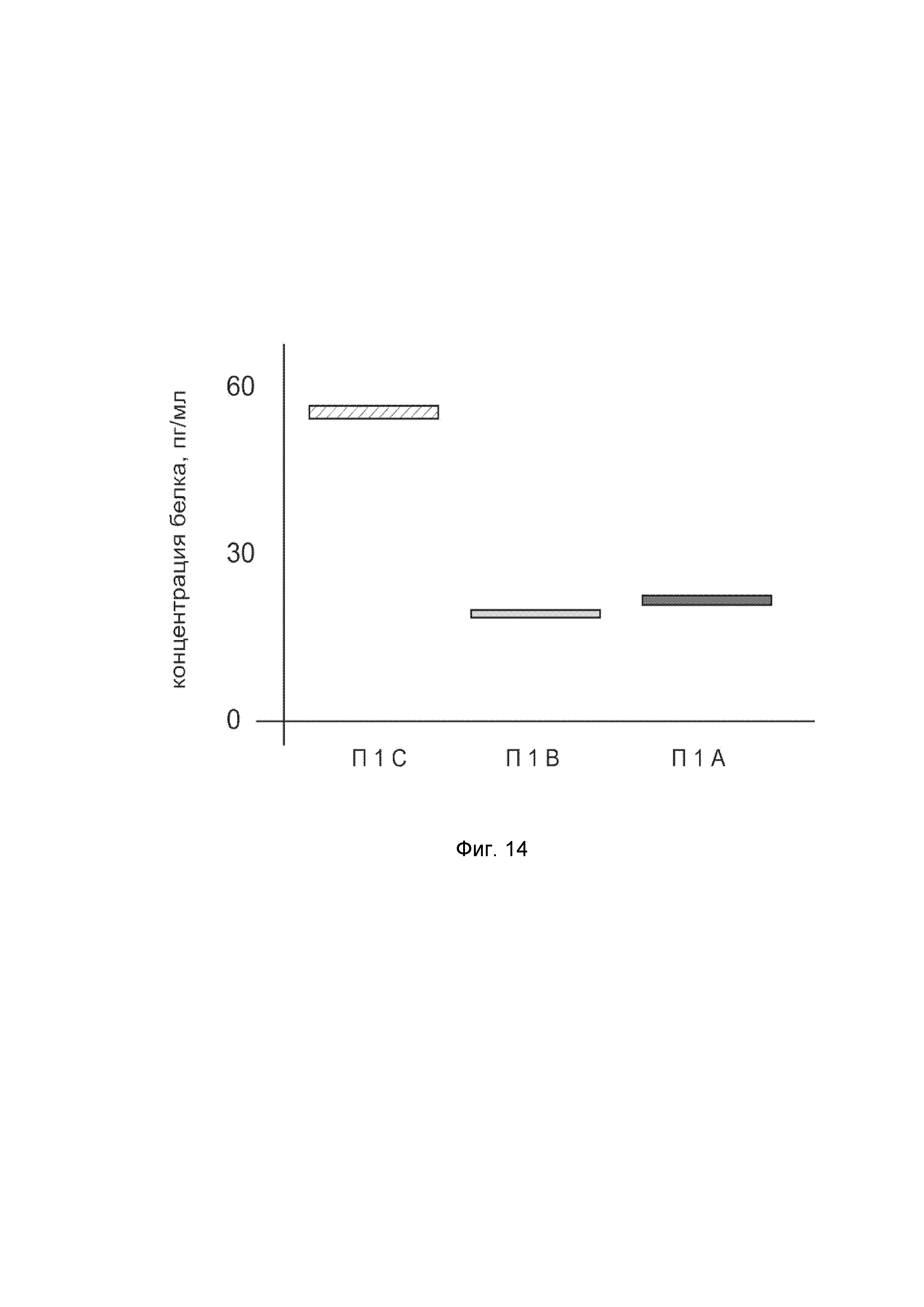
На фиг. 14
показана диаграмма концентраций белка KCNMA1 человека в биоптатах пещеристого тела полового члена пациента при интракавернозном введении в пещеристое тело полового члена генотерапевтического ДНК-вектора VTvaf17-KCNMA1 с целью демонстрации способа применения путем интракавернозного введения генотерапевтического ДНК-вектора.
На фиг. 14 отмечены следующие элементы:
П1I - биоптат пещеристого тела полового члена пациента из зоны введения генотерапевтического ДНК-вектора VTvaf17-KCNMA1;
П1II - биоптат пещеристого тела полового члена пациента из зоны введения генотерапевтического ДНК-вектора VTvaf17 (плацебо);
П1III - биоптат пещеристого тела полового члена пациентов из зоны, не подвергавшейся каким-либо манипуляциям.
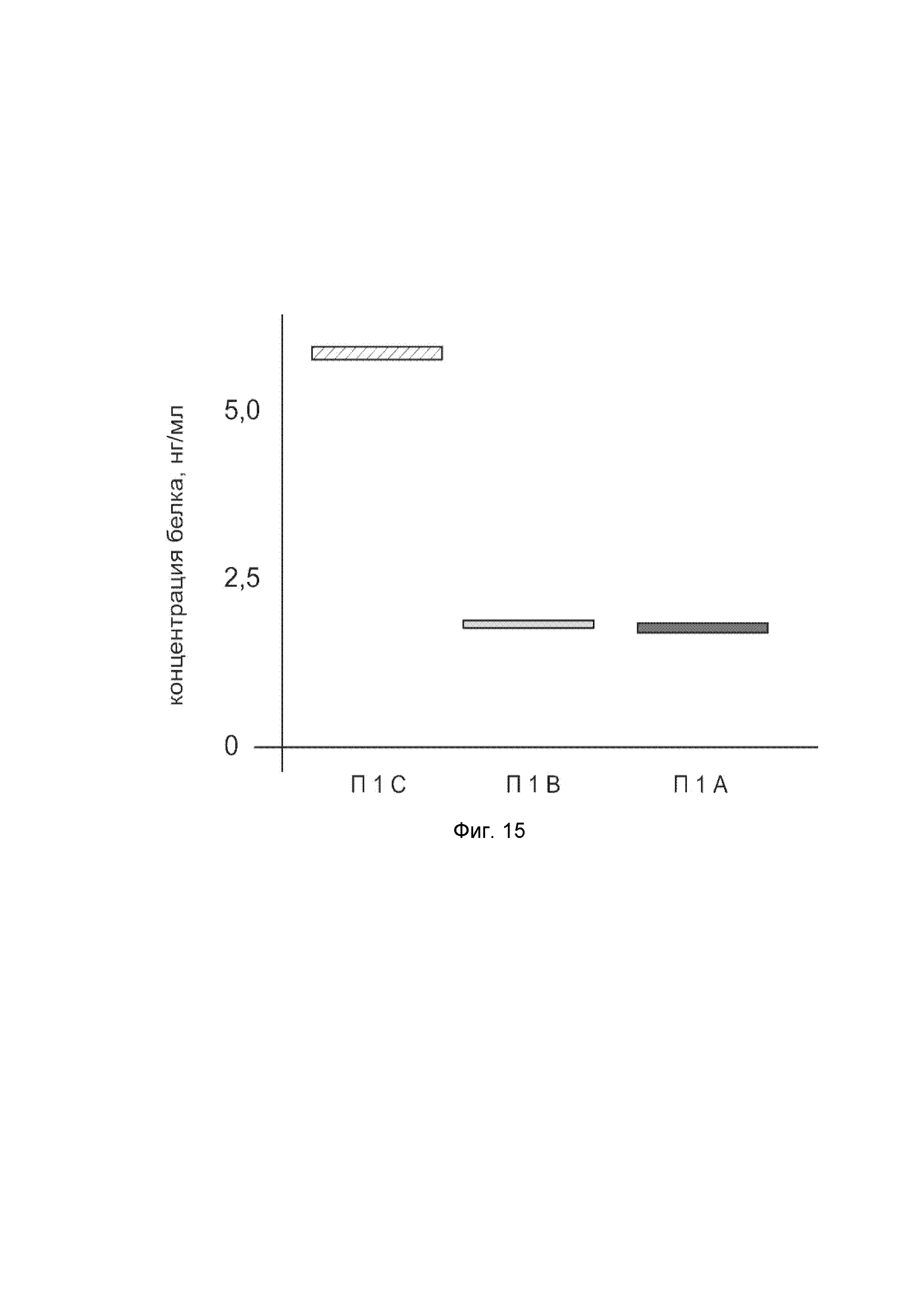
Фиг. 15.
показана диаграмма концентрации белка NOS2 в биоптатах кожи человека после введения в кожу культуры аутологичных фибробластов, трансфицированных генотерапевтическим ДНК-вектором VTvaf17-NOS2 с целью демонстрации способа применения путем введения аутологичных клеток, трансфицированных генотерапевтическим ДНК-вектором VTvaf17-NOS2.
На фиг. 15 отмечены следующие элементы:
П1А - биоптат кожи пациента П1 в зоне введения культуры аутологичных фибробластов пациента, трансфицированных генотерапевтическим ДНК-вектором VTvaf17-NOS2;
П1B - биоптат кожи пациента П1 в зоне введения аутологичных фибробластов пациента, трансфицированных генотерапевтическим ДНК-вектором VTvaf17;
П1C - биоптат кожи пациента П1 из интактного участка.
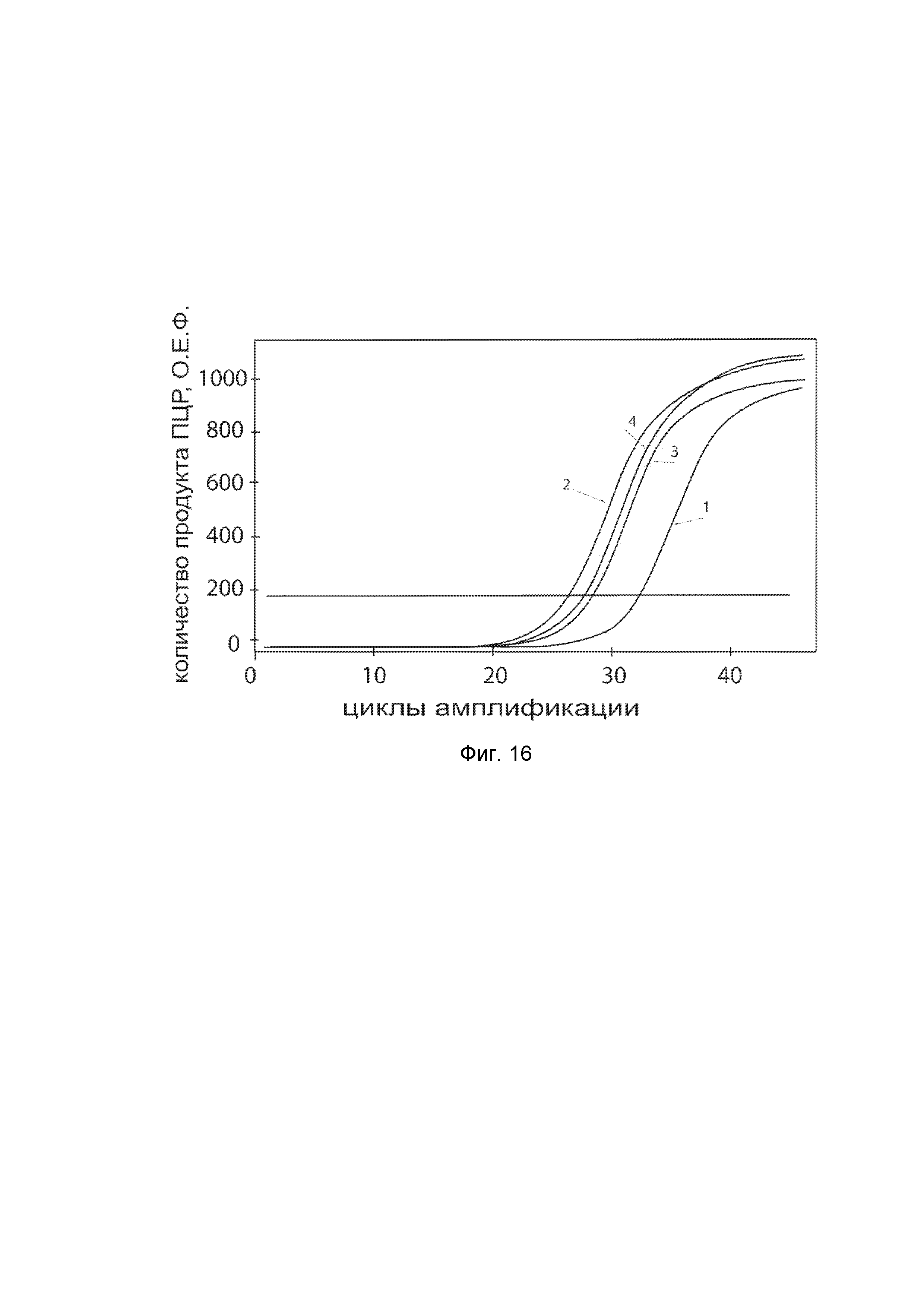
На фиг. 16
показаны графики накопления ампликонов кДНК целевого гена KCNMA1 в клетках гладкой мускулатуры аорты быка BAOSMC (Genlantis) до и через 48 часов после трансфекции этих клеток ДНК-вектором VTvaf17-KCNMA1 с целью демонстрации способа применения путем введения генотерапевтического ДНК-вектора в клетки животных.
На фиг. 16 отмечены следующие кривые накопления ампликонов в ходе реакции, соответствующие:
1 - кДНК гена KCNMA1 в клетках гладкой мускулатуры аорты быка BAOSMC до трансфекции генотерапевтическим ДНК-вектором VTvaf17-KCNMA1;
2 - кДНК гена KCNMA1 в клетках гладкой мускулатуры аорты быка BAOSMC после трансфекции генотерапевтическим ДНК-вектором VTvaf17-KCNMA1;
3 - кДНК гена B2M в клетках гладкой мускулатуры аорты быка BAOSMC до трансфекции генотерапевтическим ДНК-вектором VTvaf17-KCNMA1;
4 - кДНК гена B2M в клетках в клетках гладкой мускулатуры аорты быка BAOSMC после трансфекции генотерапевтическим ДНК-вектором VTvaf17-KCNMA1.
В качестве референтного гена использовали ген актина быка/ коровы (АСТ), приведенного в базе данных GenBank под номером AH001130.2.
Реализация изобретения
На основе ДНК-вектора VTvaf17 размером 3165 п. н. созданы генотерапевтические ДНК-векторы, несущие целевые гены человека, предназначенные для повышения уровня экспрессии этих целевых генов в тканях человека и животных. При этом способ получения каждого генотерапевтического ДНК-вектора, несущего целевые гены, заключается в том, что в полилинкер генотерапевтического ДНК-вектора VTvaf17 клонируют белок-кодирующую последовательность целевого гена, выбранного из группы генов: ген NOS2, ген NOS3, ген VIP, ген KCNMA1, ген CGRP человека. Известно, что способность ДНК-векторов проникать в эукариотические клетки обусловлена, главным образом, размером вектора. При этом ДНК-вектора с наименьшим размером обладает более высокой проникающей способностью. Таким образом, предпочтительным является отсутствие в составе вектора элементов, которые не несут функциональной нагрузки, но при этом увеличивают размер ДНК вектора. Данные особенности ДНК-векторов были учтены при получении генотерапевтического ДНК-вектора на основе генотерапевтического ДНК-вектора VTvaf17, несущего целевой ген, выбранный из группы генов NOS2, NOS3, VIP, KCNMA1, CGRP, путем отсутствия в составе вектора крупных нефункциональных последовательностей и генов антибиотикорезистентности, что позволило, помимо технологических преимуществ и преимуществ в плане безопасности применения, значительно уменьшить размер полученного генотерапевтического ДНК-вектора VTvaf17, несущего целевой ген, выбранный из группы генов NOS2, NOS3, VIP, KCNMA1, CGRP. Таким образом, способность проникать в эукариотические клетки полученного генотерапевтического ДНК-вектора обусловлена его небольшими размерами.
Каждый из генотерапевтических ДНК-векторов: ДНК-вектор VTvaf17-NOS2, или VTvaf17-NOS3, или VTvaf17-VIP, или VTvaf17-KCNMA1 или VTvaf17-CGRP получали следующим образом: кодирующую часть целевого гена NOS2, или NOS3, или VIP, или KCNMA1, или CGRP клонировали в генотерапевтический ДНК-вектор VTvaf17 и получали генотерапевтический ДНК-вектор VTvaf17-NOS2, SEQ ID №1, или VTvaf17-NOS3, SEQ ID №2 или VTvaf17-VIP, SEQ ID №3, или VTvaf17-KCNMA1, SEQ ID №4, или VTvaf17-CGRP, SEQ ID №5 соответственно. Кодирующую часть гена NOS2 размером 3466 п. н., или гена NOS3 размером 3615 п. н., или гена VIP размером 511 п. н., или гена KCNMA1 размером 3578 п. н. или гена CGRP размером 454 п. н. получали путем выделения суммарной РНК из биологического образца ткани здорового человека. Для получения первой цепи кДНК генов NOS2, NOS3, VIP, KCNMA1, CGRP человека использовали реакцию обратной транскрипции. Амплификацию проводили с использованием созданных для этого методом химического синтеза олигонуклеотидов. Расщепление продукта амплификации специфическими эндонуклеазами рестрикции проводили с учетом оптимальной процедуры дальнейшего клонирования, причем клонирование в генотерапевтический ДНК-вектор VTvaf17 проводили по сайтам рестрикции SalI, KpnI, BamHI, EcoRI, HindIII, расположенными в полилинкере вектора VTvaf17. Выбор сайтов рестрикции проводили таким образом, чтобы клонированный фрагмент попадал в рамку считывания экспрессионной кассеты вектора VTvaf17, при этом белок-кодирующая последовательность не содержала сайты рестрикции для выбранных эндонуклеаз. При этом специалистам в данной области техники понятно, что методическая реализация получения генотерапевтического ДНК-вектора VTvaf17-NOS2, или VTvaf17-NOS3, или VTvaf17-VIP, или VTvaf17-KCNMA1, или VTvaf17-CGRP может варьировать в рамках выбора известных методов молекулярного клонирования генов, при этом эти способы подпадают под объем настоящего изобретения. Так, например, могут быть использованы различные последовательности олигонуклеотидов для амплификации гена NOS2, или NOS3, или VIP, или KCNMA1, или CGRP, различные эндонуклеазы рестрикции или такие лабораторные техники как безлигазное клонирование генов.
Генотерапевтический ДНК-вектор VTvaf17-NOS2, или VTvaf17-NOS3, или VTvaf17-VIP, или VTvaf17-KCNMA1, или VTvaf17-CGRP обладает нуклеотидной последовательностью SEQ ID №1 или SEQ ID №2 или SEQ ID №3 или SEQ ID №4 или SEQ ID №5 соответственно. При этом специалистам в данной области техники известно свойство вырожденности генетического кода, из которого следует, что под объем настоящего изобретения также подпадают варианты нуклеотидных последовательностей, отличающихся инсерцией, делецией или заменой нуклеотидов, которые не приводят к изменению полипептидной последовательности, кодируемой целевым геном, и/или не приводят к потере функциональной активности регуляторных элементов вектора VTvaf17. При этом специалистам в данной области техники известно явление генетического полиморфизма, из которого следует, что под объем настоящего изобретения также подпадают варианты нуклеотидных последовательностей генов из группы генов NOS2, NOS3, VIP, KCNMA1 или CGRP, которые при этом кодируют различные варианты аминокислотных последовательностей белков NOS2, NOS3, VIP, KCNMA1 или CGRP не отличающихся от приведенных по своей функциональной активности при физиологических условиях.
Способность проникать в эукариотические клетки и функциональную активность, то есть способность экспрессировать целевой ген, полученного генотерапевтического ДНК-вектора VTvaf17-NOS2, или VTvaf17-NOS3, или VTvaf17-VIP, или VTvaf17-KCNMA1, или VTvaf17-CGRP подтверждают путем введения в эукариотические клетки полученного вектора и последующим анализом экспрессии специфической мРНК и/или белкового продукта целевого гена. Наличие специфической мРНК в клетках, в которые был введен генотерапевтический ДНК-вектор VTvaf17-NOS2, или VTvaf17-NOS3, или VTvaf17-VIP, или VTvaf17-KCNMA1, или VTvaf17-CGRP свидетельствует как о способности полученного вектора проникать в эукариотические клетки, так и о его способности экспрессировать мРНК целевого гена. При этом, как известно специалистам в данной области техники, наличие мРНК гена является обязательным условием, но не доказательством трансляции белка, кодируемого целевым геном. Поэтому для подтверждения свойства генотерапевтического ДНК-вектора VTvaf17-NOS2, или VTvaf17-NOS3, или VTvaf17-VIP, или VTvaf17-KCNMA1, или VTvaf17-CGRP экспрессировать целевой ген на уровне белка в эукариотических клетках, в которые был введен генотерапевтический ДНК-вектор, проводят анализ концентрации белков, кодируемых целевыми генами, с использованием иммунологических методов. Наличие белка NOS2, или NOS3, или VIP, или KCNMA1, или CGRP подтверждает эффективность экспрессии целевых генов в эукариотических клетках и возможность повышения уровня концентрации белка с помощью генотерапевтического ДНК-вектора на основе генотерапевтического ДНК-вектора VTvaf17, несущего целевой ген, выбранный из группы генов NOS2, NOS3, VIP, KCNMA1, CGRP. Для подтверждения эффективности экспрессии созданного генотерапевтического ДНК-вектора VTvaf17-NOS2, несущего целевой ген, а именно, ген NOS2, генотерапевтического ДНК-вектора VTvaf17-NOS3, несущего целевой ген, а именно, ген NOS3, генотерапевтического ДНК-вектора VTvaf17-VIP, несущего целевой ген, а именно, ген VIP, генотерапевтического ДНК-вектора VTvaf17-KCNMA1, несущего целевой ген, а именно, ген KCNMA1, генотерапевтического ДНК-вектора VTvaf17-CGRP, несущего целевой ген, а именно, ген CGRP использовали следующие методы:
А) ПЦР в реальном времени - изменение накопления ампликонов кДНК целевых генов в лизате клеток человека и животного, после трансфекции различных клеточных линий человека и животного генотерапевтическим ДНК-векторами;
B) Иммуноферментный анализ - изменение количественного уровня целевых белков в лизате клеток человека, после трансфекции различных клеточных линий человека генотерапевтическими ДНК-векторами;
C) Иммуноферментный анализ - изменение количественного уровня целевых белков в супернатанте биоптатов тканей человека и животного, после введения в эти ткани генотерапевтических ДНК-векторов;
D) Иммуноферментный анализ - изменение количественного уровня целевых белков в супернатанте биоптатов тканей человека, после введения в эти ткани аутологичных клеток этого человека, трансфицированных генотерапевтическими ДНК-векторами;
Для подтверждения реализуемости способа применения созданного генотерапевтического ДНК-вектора VTvaf17-NOS2, несущего целевой ген, а именно, ген NOS2, генотерапевтического ДНК-вектора VTvaf17-NOS3, несущего целевой ген, а именно, ген NOS3, генотерапевтического ДНК-вектора VTvaf17-VIP, несущего целевой ген, а именно, ген VIP генотерапевтического ДНК-вектора VTvaf17-KCNMA1, несущего целевой ген, а именно, ген KCNMA1, генотерапевтического ДНК-вектора VTvaf17-CGRP, несущего целевой ген, а именно, ген CGRP выполняли:
А) трансфекцию генотерапевтическими ДНК-векторами различных клеточных линий человека и животного;
B) введение генотерапевтических ДНК-векторов в различные ткани человека и животного;
С) введение в ткани человека аутологичных клеток, трансфицированных генотерапевтическими ДНК-векторами.
Указанные способы применения характеризуются отсутствием потенциальных рисков для генетической терапии человека и животных за счет отсутствия в составе генотерапевтического ДНК-вектора регуляторных элементов, представляющих собой нуклеотидные последовательности вирусных геномов и за счет отсутствия в составе генотерапевтического ДНК-вектора генов устойчивости к антибиотикам, что подтверждается отсутствием участков, гомологичных вирусным геномам и генам антибиотикорезистентности в нуклеотидных последовательностях генотерапевтического ДНК-вектора VTvaf17-NOS2, или генотерапевтического ДНК-вектора VTvaf17-NOS3, или генотерапевтического ДНК-вектора VTvaf17-VIP, или генотерапевтического ДНК-вектора VTvaf17-KCNMA1, или генотерапевтического ДНК-вектора VTvaf17-CGRP (SEQ ID №1 или SEQ ID №2 или SEQ ID №3 или SEQ ID №4 или SEQ ID №5 соответственно).
Как известно специалистам в данной области техники, гены антибиотикорезистентности в составе генотерапевтических ДНК-векторов используются с целью получения этих векторов в препаративных количествах путем наращивания бактериальной биомассы в питательной среде, содержащей селективный антибиотик. В рамках настоящего изобретения в целях возможности безопасного применения генотерапевтического ДНК-вектора VTvaf17, несущего целевой ген NOS2 или NOS3, или VIP или KCNMA1, или CGRP, использование селективных питательных сред, содержащих антибиотик, не представляется возможным. В качестве технологического решения для получения генотерапевтического ДНК-вектора VTvaf17, несущего целевой ген, выбранный из группы генов NOS2, NOS3, VIP, KCNMA1, CGRP для возможности масштабирования до промышленных масштабов получения генотерапевтических векторов предлагается способ получения штаммов для наработки указанных генотерапевтических векторов на основе бактерии Escherichia coli SCS110-AF. Способ получения штамма Escherichia coli SCS110-AF/VTvaf17-NOS2 или штамма Escherichia coli SCS110-AF/VTvaf17-NOS3, или штамма Escherichia coli SCS110-AF/VTvaf17-VIP, или штамма Escherichia coli SCS110-AF/VTvaf17-KCNMA1 или штамма Escherichia coli SCS110-AF/VTvaf17-CGRP заключается в получении компетентных клеток штамма Escherichia coli SCS110-AF с введением в эти клетки генотерапевтического ДНК-вектора VTvaf17-NOS2, или ДНК-вектора VTvaf17-NOS3, или ДНК-вектора VTvaf17-VIP, или ДНК-вектора VTvaf17-KCNMA1, или ДНК-вектора VTvaf17-CGRP соответственно с помощью методов трансформации (электропорации), общеизвестных специалистам в данной области техники. Полученный штамм Escherichia coli SCS110-AF/VTvaf17-NOS2, или штамм Escherichia coli SCS110-AF/VTvaf17-NOS3, или штамм Escherichia coli SCS110-AF/VTvaf17-VIP, или штамм Escherichia coli SCS110-AF/VTvaf17-KCNMA1, или штамм Escherichia coli SCS110-AF/VTvaf17-CGRP используется для наработки генотерапевтического ДНК-вектора VTvaf17-NOS2, или VTvaf17-NOS3, или VTvaf17-VIP, или VTvaf17-KCNMA1, или VTvaf17-CGRP соответственно с возможностью использования сред без содержания антибиотиков.
Для подтверждения технологичности получения и возможности масштабирования до промышленного производства генотерапевтического ДНК-вектора VTvaf17-NOS2, несущего целевой ген, а именно, ген NOS2, генотерапевтического ДНК-вектора VTvaf17-NOS3, несущего целевой ген, а именно, ген NOS3, генотерапевтического ДНК-вектора VTvaf17-VIP, несущего целевой ген, а именно, ген VIP генотерапевтического ДНК-вектора VTvaf17-KCNMA1, несущего целевой ген, а именно, ген KCNMA1, генотерапевтического ДНК-вектора VTvaf17-CGRP, несущего целевой ген, а именно, ген CGRP выполняли ферментацию в промышленном масштабе штамма Escherichia coli SCS110-AF/VTvaf17-NOS2 или штамма Escherichia coli SCS110-AF/VTvaf17-NOS3 или штамма Escherichia coli SCS110-AF/VTvaf17-VIP, или штамма Escherichia coli SCS110-AF/VTvaf17-KCNMA1, или штамма Escherichia coli SCS110-AF/VTvaf17-CGRP, каждый из которых содержит генотерапевтический ДНК-вектор VTvaf17, несущий целевой ген, а именно NOS2, или NOS3, или VIP, или KCNMA1, или CGRP.
Способ масштабирования получения бактериальной массы до промышленных масштабов для выделения генотерапевтического ДНК-вектора VTvaf17, несущего целевой ген, выбранный из группы генов NOS2, NOS3, VIP, KCNMA1, CGRP, подтверждали тем, что затравочную культуру штамма Escherichia coli SCS110-AF/VTvaf17-NOS2, или штамма Escherichia coli SCS110-AF/VTvaf17-NOS3, или штамма Escherichia coli SCS110-AF/VTvaf17-VIP, или штамма Escherichia coli SCS110-AF/VTvaf17-KCNMA1, или штамма Escherichia coli SCS110-AF/VTvaf17-CGRP инкубируют в объеме питательной среды без содержания антибиотика обеспечивающим подходящую динамику накопления биомассы, по достижению достаточного количества биомассы в логарифмической фазе роста, бактериальную культуру переносят в промышленный ферментер, после чего растят до достижения стационарной фазы роста, затем выделяют фракцию, содержащую целевой ДНК-продукт - генотерапевтический ДНК-вектор VTvaf17-NOS2, или генотерапевтический ДНК-вектор VTvaf17-NOS3, или генотерапевтический ДНК-вектор VTvaf17-VIP, или генотерапевтический ДНК-вектор VTvaf17-KCNMA1, или генотерапевтический ДНК-вектор VTvaf17-CGRP, многостадийно фильтруют и очищают хроматографическими методами. При этом специалистам в данной области техники понятно, что условия культивирования штаммов, состав питательных сред (за исключением содержания антибиотиков), используемое оборудование, методы очистки ДНК могут варьировать в рамках стандартных операционных процедур в зависимости от отдельно взятой производственной линии, но известные подходы к масштабированию, промышленному получению и очистке ДНК-векторов с использованием штамма Escherichia coli SCS110-AF/VTvaf17-NOS2, или штамма Escherichia coli SCS110-AF/VTvaf17-NOS3, или штамма Escherichia coli SCS110-AF/VTvaf17-VIP, или штамма Escherichia coli SCS110-AF/VTvaf17-KCNMA1, или штамма Escherichia coli SCS110-AF/VTvaf17-CGRP подпадают под объем настоящего изобретения.
Описанное раскрытие изобретения подтверждается примерами реализации настоящего изобретения.
Изобретение поясняется следующими примерами.
Пример 1.
Получение генотерапевтического ДНК-вектора VTvaf17-NOS2, несущего целевой ген, а именно, гена NOS2.
Генотерапевтический ДНК-вектор VTvaf17-NOS2 конструировали клонированием кодирующей части гена NOS2 размером 3466 п. н. в ДНК-вектор VTvaf17 размером 3165 п. н. по сайтам рестрикции SalI и KpnI. Кодирующую часть гена NOS2 размером 3466 п. н. получали путем выделения суммарной РНК из биологического образца ткани человека с последующим проведением реакции обратной транскрипции с использованием коммерческого набора Mint-2 (Евроген, Россия) и ПЦР-амплификации с использованием олигонуклеотидов:
NOS2_F ATCGTCGACCACCATGGCCTGTCCTTGGAAATTTC
NOS2_R CGGTACCTCAGAGCGCTGACATCTCCAGG
и коммерческого набора Phusion® High-Fidelity DNA Polymerase (New England Biolabs, США).
Генотерапевтический ДНК-вектор VTvaf17 конструировали объединением шести фрагментов ДНК, полученных из разных источников:
(а) ориджин репликации получали путем ПЦР-амплификации участка коммерческой плазмиды pBR322 с внесением точечной мутации;
(б) промоторный регион EF1а получали путем ПЦР-амплификации участка геномной ДНК человека;
(в) терминатор транскрипции hGH-TA получали путем ПЦР-амплификации участка геномной ДНК человека;
(г) регуляторный участок транспозона Tn10 РНК-out получали путем синтеза из олигонуклеотидов;
(д) ген устойчивости к канамицину получали путем ПЦР-амплификации участка коммерческой плазмиды pET-28 человека;
(е) полилинкер получали отжигом двух синтетических олигонуклеотидов.
ПЦР-амплификацию проводили с использованием коммерческого набора Phusion® High-Fidelity DNA Polymerase (New England Biolabs, США) в соответствии с инструкцией производителя. Фрагменты имеют перекрывающиеся области для возможности их объединения с последующей ПЦР-амплификацией. Объединяли фрагменты (а) и (б) с использованием олигонуклеотидов Ori-F и EF1-R, а также фрагменты (в), (г) и (д) с использованием олигонуклеотидов hGH-F и Kan-R. Далее, полученные участки объединяли путем рестрикции с последующим лигированием по сайтам BamHI и NcoI. В результате получали плазмиду, пока еще не содержащую полилинкер. Для его введения проводили расщепление плазмиды по сайтам BamHI и EcoRI, и лигирование с фрагментом (е). Таким образом, получали вектор размером 4182 п. н., несущий ген устойчивости к канамицину, который фланкирован сайтами рестрикции SpeI. Далее этот участок выщепляли по сайтам рестрикции SpeI, после чего оставшийся фрагмент лигировали сам на себя. Таким образом получали генотерапевтический ДНК-вектор VTvaf17 размером 3165 п. н., который является рекомбинантным, с возможностью селекции без антибиотиков.
Расщепление продукта амплификации кодирующей части гена NOS2 и ДНК-вектора VTvaf17 проводили эндонуклеазами рестрикции SalI и KpnI (New England Biolabs, США).
В результате получали ДНК-вектор VTvaf17-NOS2 размером 6625 п. н. с нуклеотидной последовательностью SEQ ID №1 и общей структурой изображенной на фиг. 1.
Пример 2.
Получение генотерапевтического ДНК-вектора VTvaf17-NOS3, несущего целевой ген, а именно, гена NOS3.
Генотерапевтический ДНК-вектор VTvaf17-NOS3 конструировали клонированием кодирующей части гена NOS3 размером 3615 п. н. в ДНК-вектор VTvaf17 размером 3165 п. н. по сайтам рестрикции HindIIII и EcoRI. Кодирующую часть гена NOS3 размером 3615 п. н. получали путем выделения суммарной РНК из биологического образца ткани человека с последующим проведением реакции обратной транскрипции с использованием коммерческого набора Mint-2 (Евроген, Россия) и ПЦР-амплификации с использованием олигонуклеотидов:
NOS3_F GACAAGCTTCCACCATGGGCAACTTGAAGAG
NOS3_R GGAATTCAGGGGCTGTTGGTGTCTGAGCCG
и коммерческого набора Phusion® High-Fidelity DNA Polymerase (New England Biolabs, США), расщепление продукта амплификации и ДНК-вектора VTvaf17 проводили эндонуклеазами рестрикции HindIIII и EcoRI (New England Biolabs, США).
В результате получали ДНК-вектор VTvaf17-NOS3 размером 6774 п. н. с нуклеотидной последовательностью SEQ ID №2 и общей структурой изображенной на фиг. 1.
При этом генотерапевтический ДНК-вектор VTvaf17 конструировали по Примеру 1.
Пример 3
Получение ДНК-вектора VTvaf17-VIP, несущего целевой ген, а именно, гена VIP человека.
Генотерапевтический ДНК-вектор VTvaf17-VIP конструировали клонированием кодирующей части гена VIP размером 511 п. н. в ДНК-вектор VTvaf17 размером 3165 п. н. по сайтам рестрикции BamHI и EcoRI. Кодирующую часть гена VIP размером 511 п. н. получали путем выделения суммарной РНК из биологического образца ткани человека с последующим проведением реакции обратной транскрипции с использованием коммерческого набора Mint-2 (Евроген, Россия) и ПЦР-амплификации с использованием олигонуклеотидов:
VIP_F AGGATCCACCATGGACACCAGAAATAAGGCCCAG
VIP_R GGAATTCATTTTTCTAACTCTTCTGGAAAG
и коммерческого набора Phusion® High-Fidelity DNA Polymerase (New England Biolabs, США), расщепление продукта амплификации и ДНК-вектора VTvaf17 проводили эндонуклеазами рестрикции BamHI и EcoRI (New England Biolabs, США).
В результате получали ДНК-вектор VTvaf17-VIP размером 3652 п. н. с нуклеотидной последовательностью SEQ ID №3 и общей структурой изображенной на фиг.1.
При этом генотерапевтический ДНК-вектор VTvaf17 конструировали по Примеру 1.
Пример 4.
Получение генотерапевтического ДНК-вектора VTvaf17-KCNMA1, несущего целевой ген, а именно, гена KCNMA1.
Генотерапевтический ДНК-вектор VTvaf17-KCNMA1 конструировали клонированием кодирующей части гена KCNMA1 размером 3578 п. н. в ДНК-вектор VTvaf17 размером 3165 п. н. по сайтам рестрикции BamHI и EcoRI. Кодирующую часть гена KCNMA1 размером 3578 п. н. получали путем выделения суммарной РНК из биологического образца ткани человека с последующим проведением реакции обратной транскрипции с использованием коммерческого набора Mint-2 (Евроген) и ПЦР-амплификации с использованием олигонуклеотидов:
KCNMA1_F AGGATCCGGTACCGAGGAGATCTGCCGCCGCGATCGCCATG
KCNMA1_R ACCAAGCTTATCTGTAAACCATTTCTTTTCTG
и коммерческого набора Phusion® High-Fidelity DNA Polymerase (New England Biolabs, США), расщепление продукта амплификации и ДНК-вектора VTvaf17 проводили эндонуклеазами рестрикции BamHI и EcoRI (New England Biolabs).
В результате получали ДНК-вектор VTvaf17-KCNMA1 размером 6731 п. н. с нуклеотидной последовательностью SEQ ID №4 и общей структурой изображенной на фиг. 1.
При этом генотерапевтический ДНК-вектор VTvaf17 конструировали по Примеру 1.
Пример 5.
Получение генотерапевтического ДНК-вектора VTvaf17-CGRP, несущего целевой ген, а именно, гена CGRP.
Генотерапевтический ДНК-вектор VTvaf17-CGRP конструировали клонированием кодирующей части гена CGRP размером 454 п. н. в ДНК-вектор VTvaf17 размером 3165 п. н. по сайтам рестрикции BamHI и EcoRI. Кодирующую часть гена CGRP размером 454 п. н. получали путем выделения суммарной РНК из биологического образца ткани человека с последующим проведением реакции обратной транскрипции с использованием коммерческого набора Mint-2 (Евроген, Россия) и ПЦР-амплификации с использованием олигонуклеотидов:
CGRP_F AGGATCCGGACGTCATGGAAGTGAAGGATGCCAATT
CGRP_R GGAATTCCTATGCTGGGTCCTCTTCGTCCATTG
и коммерческого набора Phusion® High-Fidelity DNA Polymerase (New England Biolabs, США), расщепление продукта амплификации и ДНК-вектора VTvaf17 проводили эндонуклеазами рестрикции BamHI и EcoRI (New England Biolabs).
В результате получали ДНК-вектор VTvaf17-CGRP размером 3595 п. н. с нуклеотидной последовательностью SEQ ID №5 и общей структурой изображенной на фиг. 1.
При этом генотерапевтический ДНК-вектор VTvaf17 конструировали по Примеру 1.
Пример 6.
Подтверждение способности генотерапевтического ДНК-вектора VTvaf17-NOS2, несущего целевой ген, а именно, ген NOS2, проникать в эукариотические клетки и подтверждение его функциональной активности на уровне экспрессии мРНК целевого гена. Данный пример также демонстрирует реализуемость способа применения генотерапевтического ДНК-вектора, несущего целевой ген.
Оценивали изменения накопления мРНК целевого гена NOS2, в первичной культуре гладкомышечных клеток мочевого пузыря человека HBdSMC (ATCC PCS-420-012) через 48 часов после их трансфекции генотерапевтическим ДНК-вектором VTvaf17-NOS2, несущим ген NOS2 человека. Количество мРНК определяли по динамике накопления ампликонов кДНК в реакции ПРЦ в реальном времени.
Первичную культуру гладкомышечных клеток мочевого пузыря человека HBdSMC выращивали среде с ростовыми добавками, приготовленной с использованием набора Vascular Smooth Muscle Cell GroCGRPh Kit (ATCC® PCS-100-042™) в стандартных условиях (37°С, 5% СО2). Для получения 90% конфлюэнтности, за 24 часа до постановки трансфекции клетки высевали в 24-луночный планшет из расчета 5×104 клеток/лунку. Трансфекцию генотерапевтическим ДНК-вектором VTvaf17-NOS2, экспрессирующим ген NOS2 человека, проводили с использованием Lipofectamine 3000 (ThermoFisher Scientific, США). В пробирке №1 к 25 мкл среды Opti-MEM (Gibco, США) добавляли 1 мкл раствора ДНК-вектора VTvaf17-NOS2 (концентрация 500 нг/мкл) и 1 мкл реагента Р3000. Аккуратно перемешивали легким встряхиванием. В пробирке №2 к 25 мкл среды Opti-MEM (Gibco, США) добавляли 1 мкл раствора Lipofectamin 3000. Аккуратно перемешивали легким встряхиванием. Добавляли содержимое пробирки №1 к содержимому пробирки №2, инкубировали 5 мин при комнатной температуре. Полученный раствор по каплям добавляли к клеткам в объеме 40 мкл.
В качестве контроля использовали клетки, трансфицированные генотерапевтическим ДНК-вектором VTvaf17, не содержащим вставку целевого гена. Подготовку контрольного вектора VTvaf17 для трансфекции проводили как описано выше.
Суммарную РНК из трансфицированных клеток выделяли с использованием Trizol Reagent (Invitrogen, США). В лунку с клетками добавляли 1 мл Trizol Reagent и гомогенизировали с последующим прогреванием в течении 5 мин при 65°С.Далее образец центрифугировали при 14 000g в течении 10 мин и снова прогревали в течении 10 мин при 65 0С.Далее добавляли 200 мкл хлороформа, плавно перемешивали и центрифугировали при 14 000g в течении 10 мин. Затем отбирали водную фазу, добавляли к ней 1/10 объема 3М ацетата натрия, рН 5.2 и равный объем изопропилового спирта. Инкубировали образец при -20°С в течении 10 мин с последующим центрифугированием при 14 000g в течении 10 мин. Осадок промывали 1 мл 70% этилового спирта, высушивали на воздухе и растворяли в 10 мкл воды, свободной от РНКаз. Определение уровня экспрессии мРНК гена NOS2 после трансфекции проводили путем оценки динамики накопления ампликонов кДНК методом ПЦР в режиме реального времени. Для получения и амплификации кДНК, специфичной для гена NOS2 человека, использовали олигонуклеотиды NOS2_SF и NOS2_SR:
NOS2_SF AACGTGTTCACCATGAGGCT
NOS2_SR CTCTCAGGCTCTTCTGTGGC.
Длина продукта амплификации - 377 п. н.
Реакцию обратной транскрипции и ПЦР-амплификацию проводили с помощью набора реагентов SYBR GreenQuantitect RT-PCR Kit (Qiagen, США) для ПЦР в режиме реального времени. Реакцию проводили в объеме 20 мкл, содержащих: 25 мкл QuantiTect SYBR Green RT-PCR MasterMix, 2,5 мM хлорида магния, по 0,5 мкМ каждого праймера, 5 мкл РНК. Реакцию осуществляли на амплификаторе CFX96 (Bio-Rad, США) при следующих условиях: 1 цикл обратной транскрипции при 42°С - 30 минут, денатурация 98°С - 15 мин, затем 40 циклов, включающих денатурацию 94°С - 15 сек, отжиг праймеров 60°C - 30 сек и элонгацию 72°С - 30 сек. В качестве референтного гена использовали ген B2M (Бета-2-микроглобулин) приведенный в базе данных GenBank под номером NM 004048.2. В качестве положительного контроля использовали ампликоны, получаемых при ПЦР на матрицах, представляющих собой плазмиды в известных концентрациях, содержащие последовательности кДНК генов NOS2 и B2M. В качестве отрицательного контроля использовали деионизированную воду. Количество динамику накопления ампликонов кДНК генов NOS2 и B2M оценивали в режиме реального времени с помощью программного обеспечения амплификатора Bio-RadCFXManager 2.1 (Bio-Rad, США). Графики, полученные в результате анализа представлены на фиг. 2.
Из фигуры 2 следует, что в результате трансфекции первичной культуры гладкомышечных клеток мочевого пузыря человека HBdSMC генотерапевтическим ДНК-вектором VTvaf17-NOS2, накопление ампликонов кДНК происходило быстрее, чем в контрольных образцах клеток, что свидетельствует о большем уровне мРНК гена NOS2 человека в клетках после трансфекции генотерапевтическим ДНК-вектором VTvaf17-NOS2, подтверждает способность вектора проникать в эукариотические клетки и экспрессировать ген NOS2 на уровне мРНК. Представленные результаты также подтверждают реализуемость способа применения генотерапевтического ДНК-вектора VTvaf17-NOS2 для повышения уровня экспрессии гена NOS2 в эукариотических клетках.
Пример 7.
Подтверждение способности генотерапевтического ДНК-вектора VTvaf17-NOS3, несущего целевой ген, а именно, ген NOS3, проникать в эукариотические клетки и подтверждение его функциональной активности на уровне экспрессии мРНК целевого гена. Данный пример также демонстрирует реализуемость способа применения генотерапевтического ДНК-вектора, несущего целевой ген.
Оценивали изменения накопления мРНК целевого гена NOS3, в первичной культуре гладкомышечных клеток аорты человека T/G HA-VSMC (ATCC CRL-1999™) через 48 часов после их трансфекции генотерапевтическим ДНК-вектором VTvaf17-NOS3, несущим ген NOS3 человека. Количество мРНК определяли по динамике накопления ампликонов кДНК в реакции ПРЦ в реальном времени.
Первичную культуру гладкомышечных клеток аорты человека T/G HA-VSMC выращивали среде F-12K Medium (АТСС) с добавлением 0.05 мг/мл аскорбиновой кислоты, 0.01 мг/мл инсулина, 0.01 мг/мл трансферрина, 10 нг/мл селенита натрия, 0.03 мг/мл Endothelial Cell Growth Supplement (ECGS), 10% сыворотки эмбрионов коров в атмосфере 5% CO2 при 37°С.Для получения 90% конфлюэнтности, за 24 часа до постановки трансфекции клетки высевали в 24-луночный планшет из расчета 5×104 клеток/лунку. Для трансфекции использовали реагент Lipofectamine 3000 (ThermoFisher Scientific, США). Трансфекцию генотерапевтическим ДНК-вектором VTvaf17-NOS3, экспрессирующим ген NOS3 человека, проводили как описано в примере 6. В качестве контроля использовали первичную культуру гладкомышечных клеток аорты человека T/G HA-VSMC человека, трансфицированных генотерапевтическим ДНК-вектором VTvaf17, не несущим целевой ген. Выделение РНК, реакцию обратной транскрипции и ПЦР в реальном времени проводили как описано в примере 6, за исключением олигонуклеотидов с отличающимися от примера 6 последовательностями. Для амплификации кДНК, специфичной для гена NOS3 человека, использовали олигонуклеотиды NOS3_SF и NOS3_SR:
NOS3_SF GACCCACTGGTGTCCTCTTG
NOS3_SR CTCCGTTTGGGGCTGAAGAT.
Длина продукта амплификации - 329 п. н.
В качестве референтного гена использовали ген B2M (Бета-2-микроглобулин) приведенный в базе данных GenBank под номером NM 004048.2. В качестве положительного контроля использовали ампликоны, получаемых при ПЦР на матрицах, представляющих собой плазмиды в известных концентрациях, содержащие последовательности кДНК генов NOS3 и B2M. В качестве отрицательного контроля использовали деионизированную воду. Количество ПЦР продуктов - кДНК генов NOS3 и B2M, полученных в результате амплификации, оценивали в режиме реального времени с помощью программного обеспечения амплификатора Bio-RadCFXManager 2.1 (Bio-Rad, США). Графики, полученные в результате анализа представлены на фиг. 3.
Из фигуры 3 следует, что в результате трансфекции первичной культуры гладкомышечных клеток аорты человека T/G HA-VSMC генотерапевтическим ДНК-вектором VTvaf17-NOS3, накопление ампликонов кДНК происходило быстрее, чем в контрольных образцах клеток, что свидетельствует о большем уровне мРНК гена NOS3 человека в клетках после трансфекции генотерапевтическим ДНК-вектором VTvaf17-NOS3, подтверждает способность вектора проникать в эукариотические клетки и экспрессировать ген NOS3 на уровне мРНК. Представленные результаты также подтверждают реализуемость способа применения генотерапевтического ДНК-вектора VTvaf17-NOS3 для повышения уровня экспрессии гена NOS3 в эукариотических клетках.
Пример 8.
Подтверждение способности генотерапевтического ДНК-вектора VTvaf17-VIP, несущего целевой ген, а именно, ген VIP, проникать в эукариотические клетки и подтверждение его функциональной активности на уровне экспрессии мРНК целевого гена. Данный пример также демонстрирует реализуемость способа применения генотерапевтического ДНК-вектора, несущего целевой ген.
Оценивали изменения накопления мРНК целевого гена VIP, в первичной культуре гладкомышечных клеток мочевого пузыря человека HBdSMC (ATCC PCS-420-012) через 48 часов после их трансфекции генотерапевтическим ДНК-вектором VTvaf17-VIP, несущим ген VIP человека. Количество мРНК определяли по динамике накопления ампликонов кДНК в реакции ПРЦ в реальном времени.
Первичную культуру гладкомышечных клеток мочевого пузыря человека HBdSMC выращивали среде с ростовыми добавками, приготовленной с использованием набора Vascular Smooth Muscle Cell GroCGRPh Kit (ATCC® PCS-100-042™) в стандартных условиях (37°С, 5% СО2). Для получения 90% конфлюэнтности, за 24 часа до постановки трансфекции клетки высевали в 24-луночный планшет из расчета 5×104 клеток/лунку. Для трансфекции использовали реагент Lipofectamine 3000 (ThermoFisher Scientific, США). Трансфекцию генотерапевтическим ДНК-вектором VTvaf17-VIP, экспрессирующим ген VIP человека, проводили как описано в примере 6. В качестве контроля использовали первичную культуру гладкомышечных клеток мочевого пузыря человека HBdSMC, трансфицированных генотерапевтическим ДНК-вектором VTvaf17, не несущим целевой ген. Выделение РНК, реакцию обратной транскрипции и ПЦР в реальном времени проводили как описано в примере 6, за исключением олигонуклеотидов с отличающимися от примера 6 последовательностями. Для амплификации кДНК, специфичной для гена VIP человека, использовали олигонуклеотиды VIP_SF и VIP_SR:
VIP_SF CCTTCTGCTCTCAGGTTGGG
VIP_SR CCCTCACTGCTCCTCTTTCC.
Длина продукта амплификации - 380 п. н.
В качестве референтного гена использовали ген B2M (Бета-2-микроглобулин) приведенный в базе данных GenBank под номером NM 004048.2. В качестве положительного контроля использовали ампликоны, получаемых при ПЦР на матрицах, представляющих собой плазмиды в известных концентрациях, содержащие последовательности кДНК генов VIP и B2M. В качестве отрицательного контроля использовали деионизированную воду. Количество ПЦР продуктов - кДНК генов VIP и B2M, полученных в результате амплификации, оценивали в режиме реального времени с помощью программного обеспечения амплификатора Bio-RadCFXManager 2.1 (Bio-Rad, США). Графики, полученные в результате анализа представлены на фиг. 4.
Из фигуры 4 следует, что в результате трансфекции первичной культуры гладкомышечных клеток мочевого пузыря человека HBdSMC генотерапевтическим ДНК-вектором VTvaf17-VIP, накопление ампликонов кДНК происходило быстрее, чем в контрольных образцах клеток, что свидетельствует о большем уровне мРНК гена VIP человека в клетках после трансфекции генотерапевтическим ДНК-вектором VTvaf17-VIP, подтверждает способность вектора проникать в эукариотические клетки и экспрессировать ген VIP на уровне мРНК. Представленные результаты также подтверждают реализуемость способа применения генотерапевтического ДНК-вектора VTvaf17-VIP для повышения уровня экспрессии гена VIP в эукариотических клетках.
Пример 9.
Подтверждение способности генотерапевтического ДНК-вектора VTvaf17-KCNMA1, несущего целевой ген, а именно, ген KCNMA1, проникать в эукариотические клетки и подтверждение его функциональной активности на уровне экспрессии мРНК целевого гена. Данный пример также демонстрирует реализуемость способа применения генотерапевтического ДНК-вектора, несущего целевой ген.
Оценивали изменения накопления мРНК целевого гена KCNMA1, в первичной культуре клеток пещеристого тела мужского полового члена человека через 48 часов после их трансфекции генотерапевтическим ДНК-вектором VTvaf17-KCNMA1, несущим ген KCNMA1 человека. Количество мРНК определяли по динамике накопления ампликонов кДНК в реакции ПРЦ в реальном времени.
Клетки линии первичной культуры пещеристого тела мужского полового члена человека выращивали следующим образом. Отбирали биопсийный образец из участков пещеристого тела полового члена пациента используя устройство для взятия биопсии MAGNUM (BARD, США). Кожу пациента в зоне отбора биоптата предварительно промывали стерильным физиологическим раствором и анестезировали раствором лидокаина. Размер биопсийного образца составлял около 10 куб. мм, масса - около 11 мг.Образец помещали в буферный раствор, содержащий 0,05% трипсин (Gibco, США), 10 мМ ЭДТА. Клетки инкубировали при помешивании на магнитной мешалке при 37°С. Далее суспензию клеток фильтровали, используя фильтры с диаметром пор 100 мкм (Nalgen, США), центрифугировали в течении 10 мин 130g, осадок ресуспендировали в 15 мл среды DMEM (Gibco, США), содержащей 10% сыворотки эмбрионов коров (Gibco, США), 2 мМ глутамина, 10 мкг/мл гентамицина, помещали во флакон площадью 75 см2 (Eppendorf) и инкубировали в течение 36-72 часов при 37°С в атмосфере 5% СО2. Для получения 90% конфлюэнтности, за 24 часа до постановки трансфекции клетки высевали в 24-луночный планшет из расчета 5×104 клеток/лунку.
Для трансфекции использовали реагент Lipofectamine 3000 (ThermoFisher Scientific, США). Трансфекцию генотерапевтическим ДНК-вектором VTvaf17-KCNMA1, экспрессирующим ген KCNMA1 человека, проводили как описано в примере 6. В качестве контроля использовали культуру клеток иммортализированных фибробластов человека T HESCs, трансфицированных генотерапевтическим ДНК-вектором VTvaf17, не несущим целевой ген. Выделение РНК, реакцию обратной транскрипции и ПЦР в реальном времени проводили как описано в примере 6, за исключением олигонуклеотидов с отличающимися от примера 6 последовательностями. Для амплификации кДНК, специфичной для гена KCNMA1 человека, использовали олигонуклеотиды KCNMA1_SF и KCNMA1_SR:
KCNMA1_SF GAGAGAGCCGAAGCCGAAAG
KCNMA1_SR ACCCTTGGGAATTAGCCTGC.
Длина продукта амплификации - 825 п. н.
В качестве референтного гена использовали ген B2M (Бета-2-микроглобулин) приведенный в базе данных GenBank под номером NM 004048.2. В качестве положительного контроля использовали ампликоны, получаемых при ПЦР на матрицах, представляющих собой плазмиды в известных концентрациях, содержащие последовательности кДНК генов KCNMA1 и B2M. В качестве отрицательного контроля использовали деионизированную воду. Количество ПЦР продуктов - кДНК генов KCNMA1 и B2M, полученных в результате амплификации, оценивали в режиме реального времени с помощью программного обеспечения амплификатора Bio-RadCFXManager 2.1 (Bio-Rad, США). Графики, полученные в результате анализа представлены на фиг. 5.
Из фигуры 5 следует, что в результате трансфекции первичной культуре клеток пещеристого тела мужского полового члена человека генотерапевтическим ДНК-вектором VTvaf17-KCNMA1, накопление ампликонов кДНК происходило быстрее, чем в контрольных образцах клеток, что свидетельствует о большем уровне мРНК гена KCNMA1 человека в клетках после трансфекции генотерапевтическим ДНК-вектором VTvaf17-KCNMA1, подтверждает способность вектора проникать в эукариотические клетки и экспрессировать ген KCNMA1 на уровне мРНК. Представленные результаты также подтверждают реализуемость способа применения генотерапевтическим ДНК-вектором VTvaf17-KCNMA1 для повышения уровня экспрессии гена KCNMA1 в эукариотических клетках.
Пример 10.
Подтверждение способности генотерапевтического ДНК-вектора VTvaf17-CGRP, несущего целевой ген, а именно, ген CGRP, проникать в эукариотические клетки и подтверждение его функциональной активности на уровне экспрессии мРНК целевого гена. Данный пример также демонстрирует реализуемость способа применения генотерапевтического ДНК-вектора, несущего целевой ген.
Оценивали изменения накопления мРНК целевого гена CGRP, в первичной культуре гладкомышечных клеток мочевого пузыря человека HBdSMC (ATCC PCS-420-012) через 48 часов после их трансфекции генотерапевтическим ДНК-вектором VTvaf17-CGRP, несущим ген CGRP человека. Количество мРНК определяли по динамике накопления ампликонов кДНК в реакции ПРЦ в реальном времени.
Первичную культуру гладкомышечных клеток мочевого пузыря человека HBdSMC выращивали среде с ростовыми добавками, приготовленной с использованием набора Vascular Smooth Muscle Cell GroCGRPh Kit (ATCC® PCS-100-042™) в стандартных условиях (37°С, 5% СО2). Для получения 90% конфлюэнтности, за 24 часа до постановки трансфекции клетки высевали в 24-луночный планшет из расчета 5×104 клеток/лунку. Для трансфекции использовали реагент Lipofectamine 3000 (ThermoFisher Scientific, США). Трансфекцию генотерапевтическим ДНК-вектором VTvaf17-CGRP, экспрессирующим ген CGRP человека, проводили как описано в примере 6. В качестве контроля использовали первичную культуру гладкомышечных клеток мочевого пузыря человека HBdSMC, трансфицированных генотерапевтическим ДНК-вектором VTvaf17, не несущим целевой ген. Выделение РНК, реакцию обратной транскрипции и ПЦР в реальном времени проводили как описано в примере 6, за исключением олигонуклеотидов с отличающимися от примера 6 последовательностями. Для амплификации кДНК, специфичной для гена CGRP человека, использовали олигонуклеотиды CGRP_SF и CGRP_SR:
CGRP_SF ACTGATCTGAAAGAGCAGCGT
CGRP_SR AGAATGCTGGTGACGGTGTG.
Длина продукта амплификации - 311 п. н.
В качестве референтного гена использовали ген B2M (Бета-2-микроглобулин) приведенный в базе данных GenBank под номером NM 004048.2. В качестве положительного контроля использовали ампликоны, получаемых при ПЦР на матрицах, представляющих собой плазмиды в известных концентрациях, содержащие последовательности кДНК генов CGRP и B2M. В качестве отрицательного контроля использовали деионизированную воду. Количество ПЦР продуктов - кДНК генов CGRP и B2M, полученных в результате амплификации, оценивали в режиме реального времени с помощью программного обеспечения амплификатора Bio-RadCFXManager 2.1 (Bio-Rad, США). Графики, полученные в результате анализа представлены на фиг. 6.
Из фигуры 6 следует, что в результате трансфекции первичной культуры гладкомышечных клеток мочевого пузыря человека HBdSMC генотерапевтическим ДНК-вектором VTvaf17-CGRP, накопление ампликонов кДНК происходило быстрее, чем в контрольных образцах клеток, что свидетельствует о большем уровне мРНК гена CGRP человека в клетках после трансфекции генотерапевтическим ДНК-вектором VTvaf17-CGRP, подтверждает способность вектора проникать в эукариотические клетки и экспрессировать ген CGRP на уровне мРНК. Представленные результаты также подтверждают реализуемость способа применения генотерапевтического ДНК-вектора VTvaf17-CGRP для повышения уровня экспрессии гена CGRP в эукариотических клетках.
Пример 11.
Подтверждение эффективности и реализуемости способа применения генотерапевтического ДНК-вектора VTvaf17-NOS2, несущего ген NOS2, для повышения экспрессии белка NOS2 в клетках млекопитающих.
Оценивали изменение количества белка NOS2 в лизате первичной культуры гладкомышечных клеток мочевого пузыря человека HBdSMC (ATCC PCS-420-012) после трансфекции этих клеток ДНК-вектором VTvaf17-NOS2, несущим ген NOS2 человека.
Первичную культуру гладкомышечных клеток мочевого пузыря человека HBdSMC выращивали среде с ростовыми добавками, приготовленной с использованием набора Vascular Smooth Muscle Cell GroCGRPh Kit (ATCC® PCS-100-042™) в стандартных условиях (37°С, 5% СО2). Для получения 90% конфлюэнтности, за 24 часа до постановки трансфекции клетки высевали в 24-луночный планшет из расчета 5×104 клеток/лунку. Для трансфекции использовали реагент SuperFect Transfection Reagent 6-го поколения (Qiagen, Германия). В качестве контроля использовали водный раствор дендримеров без ДНК-вектора (А), ДНК-вектор VTvaf17, не содержащий кДНК гена NOS2 (В), в качестве трансфицируемых агентов - ДНК-вектор VTvaf17-NOS2, несущий ген NOS2 человека. Приготовление комплекса ДНК/ дендример проводили по методике производителя (QIAGEN, SuperFect Transfection Reagent Handbook, 2002) с некоторыми изменениями. Для трансфекции клеток в одной лунке 24-луночного планшета к 1 мкг ДНК-вектора, растворенного в буфере ТЕ, добавляли среду McCoy's 5A Medium до конечного объема 60 мкл, затем добавляли 5 мкл SuperFect Transfection Reagent и осторожно перемешивали пятикратным пипетированием. Комплекс инкубировали при комнатной температуре в течении 10-15 мин. Далее отбирали из лунок культуральную среду, лунки промывали 1 мл буфера PBS. К образовавшемуся комплексу добавляли 350 мкл среды McCoy's 5A Medium, содержащей 10 мкг/мл гентамицина, осторожно перемешивали и добавляли к клеткам. Клетки инкубировали с комплексом 2-3 часа при 37°С в атмосфере, содержащей 5% СО2.
Затем осторожно удаляли среду, промывали клеточный монослой 1 мл буфера PBS. Затем добавляли среду McCoy's 5A Medium, содержащую 10 мкг/мл гентамицина и инкубировали 24-48 часов при 37°С в атмосфере 5% СО2.
После трансфекции клетки промывали три раза PBS, далее к клеткам добавляли 1 мл PBS и подвергали трехкратному замораживанию/оттаиванию. Далее суспензию центрифугировали при 15 000 об/мин в течение 15 мин, отбирали супернатант и использовали его для количественного определения целевого белка.
Количественное определение белка NOS2 проводили методом твердофазного иммуноферментного анализа (ELISA), используя набор ELISA Kit for Nitric Oxide Synthase 2, Inducible (NOS2) (Cloud-Clone Corp.Кат.SEA837Hu, США) согласно методике производителя с детекцией оптической плотности при помощи автоматического биохимического и иммуноферментного анализатора ChemWell (Awareness Technology Inc., США).
Численное значение концентрации определяли с помощью калибровочной кривой, построенной по стандартным образцам с известной концентрацией белка NOS2, входящим в состав набора. Чувствительность метода составляла не менее 54 пг/мл (0,057 нг/мл), диапазон измерения - от 156 пг/мл до 10000 пг/мл (0,156-10 нг/мл). Статистическую обработку полученных результатов осуществляли с помощью программного обеспечения для статистической обработки и визуализации данных R, версия 3.0.2 (https://www.r-project.org/). Графики, полученные в результате анализа представлены на фиг. 7.
Из фигуры 7 следует, что в результате трансфекции гладкомышечных клеток мочевого пузыря человека HBdSMC генотерапевтическим ДНК-вектором VTvaf17-NOS2 белка NOS2 увеличивается по сравнению с контрольными образцами, что подтверждает способность вектора проникать в эукариотические клетки и экспрессировать ген NOS2 на уровне белка. Представленные результаты также подтверждают реализуемость способа применения генотерапевтического ДНК-вектора VTvaf17-NOS2 для повышения уровня экспрессии NOS2 в эукариотических клетках.
Пример 12.
Подтверждение эффективности и реализуемости способа применения генотерапевтического ДНК-вектора VTvaf17-NOS3, несущего ген NOS3, для повышения экспрессии белка NOS3 в клетках млекопитающих.
Оценивали изменение количества белка NOS3 в лизате первичной культуры гладкомышечных клеток мочевого пузыря человека HBdSMC (ATCC PCS-420-012) после трансфекции этих клеток ДНК-вектором VTvaf17-NOS3, несущим ген NOS3 человека.
Первичную культуру гладкомышечных клеток мочевого пузыря человека HBdSMC выращивали среде с ростовыми добавками, приготовленной с использованием набора Vascular Smooth Muscle Cell GroCGRPh Kit (ATCC® PCS-100-042™) в стандартных условиях (37°С, 5% СО2). Для получения 90% конфлюэнтности, за 24 часа до постановки трансфекции клетки высевали в 24-луночный планшет из расчета 5×104 клеток/лунку. Для трансфекции использовали реагент SuperFect Transfection Reagent 6-го поколения (Qiagen, Германия). В качестве контроля использовали водный раствор дендримеров без ДНК-вектора (А), ДНК-вектор VTvaf17, не содержащий кДНК гена NOS3 (В), в качестве трансфицируемых агентов - ДНК-вектор VTvaf17-NOS3, несущий ген NOS3 человека. Приготовление комплекса ДНК/дендример проводили по методике производителя (QIAGEN, SuperFect Transfection Reagent Handbook, 2002) с некоторыми изменениями. Для трансфекции клеток в одной лунке 24-луночного планшета к 1 мкг ДНК-вектора, растворенного в буфере ТЕ, добавляли среду McCoy's 5A Medium до конечного объема 60 мкл, затем добавляли 5 мкл SuperFect Transfection Reagent и осторожно перемешивали пятикратным пипетированием. Комплекс инкубировали при комнатной температуре в течении 10-15 мин. Далее отбирали из лунок культуральную среду, лунки промывали 1 мл буфера PBS. К образовавшемуся комплексу добавляли 350 мкл среды McCoy's 5A Medium, содержащей 10 мкг/мл гентамицина, осторожно перемешивали и добавляли к клеткам. Клетки инкубировали с комплексом 2-3 часа при 37°С в атмосфере, содержащей 5% СО2.
Затем осторожно удаляли среду, промывали клеточный монослой 1 мл буфера PBS. Затем добавляли среду McCoy's 5A Medium, содержащую 10 мкг/мл гентамицина и инкубировали 24-48 часов при 37°С в атмосфере 5% СО2.
После трансфекции клетки промывали три раза PBS, далее к клеткам добавляли 1 мл PBS и подвергали трехкратному замораживанию/оттаиванию. Далее суспензию центрифугировали при 15 000 об/мин в течение 15 мин, отбирали супернатант и использовали его для количественного определения целевого белка.
Количественное определение белка NOS3 проводили методом твердофазного иммуноферментного анализа (ELISA), используя набор ELISA Kit for Nitric Oxide Synthase 3, Endothelial (NOS3) (Cloud -Clone Corp.Кат.SEA868Hu, США) согласно методике производителя с детекцией оптической плотности при помощи автоматического биохимического и иммуноферментного анализатора ChemWell (Awareness Technology Inc., США).
Численное значение концентрации определяли с помощью калибровочной кривой, построенной по стандартным образцам с известной концентрацией белка NOS3, входящим в состав набора. Чувствительность метода составляла не менее 57 пг/мл (0,057 нг/мл), диапазон измерения - от 156 пг/мл до 10000 пг/мл (0,156-10 нг/мл). Статистическую обработку полученных результатов осуществляли с помощью программного обеспечения для статистической обработки и визуализации данных R, версия 3.0.2 (https://www.r-project.org/). Графики, полученные в результате анализа представлены на фиг. 8.
Из фигуры 8 следует, что в результате трансфекции гладкомышечных клеток мочевого пузыря человека HBdSMC генотерапевтическим ДНК-вектором VTvaf17-NOS3 белка NOS3 увеличивается по сравнению с контрольными образцами, что подтверждает способность вектора проникать в эукариотические клетки и экспрессировать ген NOS3 на уровне белка. Представленные результаты также подтверждают реализуемость способа применения генотерапевтического ДНК-вектора VTvaf17-NOS3 для повышения уровня экспрессии NOS3 в эукариотических клетках.
Пример 13.
Подтверждение эффективности и реализуемости способа применения генотерапевтического ДНК-вектора VTvaf17-VIP, несущего ген VIP, для повышения экспрессии белка VIP в клетках млекопитающих.
Оценивали изменение количества белка VIP в кондиционированной среде с первичной культуры гладкомышечных клеток мочевого пузыря человека HBdSMC (ATCC PCS-420-012) после трансфекции этих клеток ДНК-вектором VTvaf17-VIP, несущим ген VIP человека.
Первичную культуру гладкомышечных клеток мочевого пузыря человека HBdSMC выращивали среде с ростовыми добавками, приготовленной с использованием набора Vascular Smooth Muscle Cell GroCGRPh Kit (ATCC® PCS-100-042™) в стандартных условиях (37°С, 5% СО2). Для получения 90% конфлюэнтности, за 24 часа до постановки трансфекции клетки высевали в 24-луночный планшет из расчета 5×104 клеток/лунку. Для трансфекции использовали реагент SuperFect Transfection Reagent 6-го поколения (Qiagen, Германия). В качестве контроля использовали водный раствор дендримеров без ДНК-вектора (А), ДНК-вектор VTvaf17, не содержащий кДНК гена VIP (В), в качестве трансфицируемых агентов - ДНК-вектор VTvaf17-VIP, несущий ген VIP человека. Приготовление комплекса ДНК/дендример проводили по методике производителя (QIAGEN, SuperFect Transfection Reagent Handbook, 2002) с некоторыми изменениями. Для трансфекции клеток в одной лунке 24-луночного планшета к 1 мкг ДНК-вектора, растворенного в буфере ТЕ, добавляли среду McCoy's 5A Medium до конечного объема 60 мкл, затем добавляли 5 мкл SuperFect Transfection Reagent и осторожно перемешивали пятикратным пипетированием. Комплекс инкубировали при комнатной температуре в течении 10-15 мин. Далее отбирали из лунок культуральную среду, лунки промывали 1 мл буфера PBS. К образовавшемуся комплексу добавляли 350 мкл среды McCoy's 5A Medium, содержащей 10 мкг/мл гентамицина, осторожно перемешивали и добавляли к клеткам. Клетки инкубировали с комплексом 2-3 часа при 37°С в атмосфере, содержащей 5% СО2.
Затем осторожно удаляли среду, промывали клеточный монослой 1 мл буфера PBS. Затем добавляли среду McCoy's 5A Medium, содержащую 10 мкг/мл гентамицина и инкубировали 24-48 часов при 37°С в атмосфере 5% СО2.
После трансфекции к 0,5 мл культуральной жидкости добавляли 0,1 мл 1N HCl, тщательно перемешивали и инкубировали 10 минут при комнатной температуре. Затем нейтрализовали смесь, добавляя 0,1 мл 1.2М NaOH/0.5M HEPES (pH 7-7,6) и тщательно перемешивали. Отбирали супернатант и использовали его для количественного определения целевого белка.
Количественное определение белка VIP проводили методом твердофазного иммуноферментного анализа (ELISA), используя набор ELISA Kit for Vasoactive Intestinal Peptide (VIP) (Cloud-Clone Corp.Кат.CEA380Hu, США) согласно методике производителя с детекцией оптической плотности при помощи автоматического биохимического и иммуноферментного анализатора ChemWell (Awareness Technology Inc., США).
Численное значение концентрации определяли с помощью калибровочной кривой, построенной по стандартным образцам с известной концентрацией белка VIP, входящим в состав набора. Чувствительность метода составляла не менее 2.63 пг/мл (0,00263 нг/мл), диапазон измерения - от 6.17 пг/мл до 500 пг/мл (0,00617-0,5 нг/мл). Статистическую обработку полученных результатов осуществляли с помощью программного обеспечения для статистической обработки и визуализации данных R, версия 3.0.2 (https://www.r-project.org/). Графики, полученные в результате анализа представлены на фиг. 9.
Из фигуры 9 следует, что в результате трансфекции гладкомышечных клеток мочевого пузыря человека HBdSMC генотерапевтическим ДНК-вектором VTvaf17-VIP белка VIP увеличивается по сравнению с контрольными образцами, что подтверждает способность вектора проникать в эукариотические клетки и экспрессировать ген VIP на уровне белка. Представленные результаты также подтверждают реализуемость способа применения генотерапевтического ДНК-вектора VTvaf17-VIP для повышения уровня экспрессии VIP в эукариотических клетках.
Пример 14.
Подтверждение эффективности и реализуемости способа применения генотерапевтического ДНК-вектора VTvaf17-KCNMA1, несущего ген KCNMA1, для повышения экспрессии белка KCNMA1 в клетках млекопитающих.
Оценивали изменение количества белка KCNMA1 в лизате первичной культуры гладкомышечных клеток мочевого пузыря человека HBdSMC (ATCC PCS-420-012) после трансфекции этих клеток ДНК-вектором VTvaf17-KCNMA1, несущим ген KCNMA1 человека.
Первичную культуру гладкомышечных клеток мочевого пузыря человека HBdSMC выращивали среде с ростовыми добавками, приготовленной с использованием набора Vascular Smooth Muscle Cell GroCGRPh Kit (ATCC® PCS-100-042™) в стандартных условиях (37°С, 5% СО2). Для получения 90% конфлюэнтности, за 24 часа до постановки трансфекции клетки высевали в 24-луночный планшет из расчета 5×104 клеток/лунку. Для трансфекции использовали реагент SuperFect Transfection Reagent 6-го поколения (Qiagen, Германия). В качестве контроля использовали водный раствор дендримеров без ДНК-вектора (А), ДНК-вектор VTvaf17, не содержащий кДНК гена KCNMA1 (В), в качестве трансфицируемых агентов - ДНК-вектор VTvaf17-KCNMA1, несущий ген KCNMA1 человека. Приготовление комплекса ДНК/дендример проводили по методике производителя (QIAGEN, SuperFect Transfection Reagent Handbook, 2002) с некоторыми изменениями. Для трансфекции клеток в одной лунке 24-луночного планшета к 1 мкг ДНК-вектора, растворенного в буфере ТЕ, добавляли среду McCoy's 5A Medium до конечного объема 60 мкл, затем добавляли 5 мкл SuperFect Transfection Reagent и осторожно перемешивали пятикратным пипетированием. Комплекс инкубировали при комнатной температуре в течении 10-15 мин. Далее отбирали из лунок культуральную среду, лунки промывали 1 мл буфера PBS. К образовавшемуся комплексу добавляли 350 мкл среды McCoy's 5A Medium, содержащей 10 мкг/мл гентамицина, осторожно перемешивали и добавляли к клеткам. Клетки инкубировали с комплексом 2-3 часа при 37°С в атмосфере, содержащей 5% СО2.
Затем осторожно удаляли среду, промывали клеточный монослой 1 мл буфера PBS. Затем добавляли среду McCoy's 5A Medium, содержащую 10 мкг/мл гентамицина и инкубировали 24-48 часов при 37°С в атмосфере 5% СО2.
После трансфекции клетки промывали три раза PBS, далее к клеткам добавляли 1 мл PBS и подвергали трехкратному замораживанию/оттаиванию. Далее суспензию центрифугировали при 15 000 об/мин в течение 15 мин, отбирали супернатант и использовали его для количественного определения целевого белка.
Количественное определение белка KCNMA1 проводили методом твердофазного иммуноферментного анализа (ELISA), используя набор Human KCNMA1 / BK ELISA Kit (Sandwich ELISA) (LifeSpan BioScieces Кат.LS-F38925, США) согласно методике производителя с детекцией оптической плотности при помощи автоматического биохимического и иммуноферментного анализатора ChemWell (Awareness Technology Inc., США).
Численное значение концентрации определяли с помощью калибровочной кривой, построенной по стандартным образцам с известной концентрацией белка KCNMA1, входящим в состав набора. Чувствительность метода составляла не менее 0.65 пг/мл (0,00065 нг/мл), диапазон измерения - от 1.23 пг/мл до 100 пг/мл (0,00123-0.1 нг/мл). Статистическую обработку полученных результатов осуществляли с помощью программного обеспечения для статистической обработки и визуализации данных R, версия 3.0.2 (https://www.r-project.org/). Графики, полученные в результате анализа представлены на фиг. 10.
Из фигуры 10 следует, что в результате трансфекции гладкомышечных клеток мочевого пузыря человека HBdSMC генотерапевтическим ДНК-вектором VTvaf17-KCNMA1 белка KCNMA1 увеличивается по сравнению с контрольными образцами, что подтверждает способность вектора проникать в эукариотические клетки и экспрессировать ген KCNMA1 на уровне белка. Представленные результаты также подтверждают реализуемость способа применения генотерапевтического ДНК-вектора VTvaf17-KCNMA1 для повышения уровня экспрессии KCNMA1 в эукариотических клетках.
Пример 15.
Подтверждение эффективности и реализуемости способа применения генотерапевтического ДНК-вектора VTvaf17-CGRP, несущего ген CGRP, для повышения экспрессии белка CGRP в клетках млекопитающих.
Оценивали изменение количества белка CGRP в лизате в лизате первичной культуры гладкомышечных клеток пещеристого тела мужского полового члена человека после трансфекции этих клеток ДНК-вектором VTvaf17-CGRP, несущим ген CGRP человека. Клетки получали и культивировали как описано в примере 9.
Для трансфекции использовали реагент SuperFect Transfection Reagent 6-го поколения (Qiagen, Германия). В качестве контроля использовали водный раствор дендримеров без ДНК-вектора (А), ДНК-вектор VTvaf17, не содержащий кДНК гена CGRP (В), в качестве трансфицируемых агентов - ДНК-вектор VTvaf17-CGRP, несущий ген CGRP человека (С). Приготовление комплекса ДНК-дендример и трансфекцию клеток первичной культуры гладкомышечных клеток пещеристого тела мужского полового члена человека проводили как описано в примере 11.
После трансфекции клетки промывали три раза PBS, далее к клеткам добавляли 1 мл PBS и подвергали трехкратному замораживанию/оттаиванию. Далее суспензию центрифугировали при 15 000 об/мин в течение 15 мин, отбирали супернатант и использовали его для количественного определения целевого белка.
Количественное определение белка CGRP проводили методом твердофазного иммуноферментного анализа (ELISA), используя набор ELISA Kit for Calcitonin Gene Related Peptide (CGRP) (Cloud-Clone Corp.Кат.CEA876Hu, США) согласно методике производителя с детекцией оптической плотности при помощи автоматического биохимического и иммуноферментного анализатора ChemWell (Awareness Technology Inc., США).
Численное значение концентрации определяли с помощью калибровочной кривой, построенной по стандартным образцам с известной концентрацией белка CGRP, входящим в состав набора. Чувствительность метода составляла не менее 5,35 пг/мл (0,00535 нг/мл), диапазон измерения - от 12,35 пг/мл до 1000 пг/мл (0,001235-1 нг/мл). Статистическую обработку полученных результатов осуществляли с помощью программного обеспечения для статистической обработки и визуализации данных R, версия 3.0.2 (https://www.r-project.org/). Графики, полученные в результате анализа, представлены на фиг. 11.
Из фигуры 11 следует, что трансфекция первичной культуры гладкомышечных клеток пещеристого тела мужского полового члена человека генотерапевтическим ДНК-вектором VTvaf17-CGRP приводит к увеличению количества белка CGRP по сравнению с контрольными образцами, что подтверждает способность вектора проникать в эукариотические клетки и экспрессировать ген CGRP на уровне белка. Представленные результаты также подтверждают реализуемость способа применения генотерапевтического ДНК-вектора VTvaf17-CGRP для повышения уровня экспрессии CGRP в эукариотических клетках.
Пример 16.
Подтверждение эффективности и реализуемости способа применения генотерапевтического ДНК-вектора VTvaf17-NOS2, несущего ген NOS2, для повышения экспрессии белка NOS2 в тканях человека.
Для подтверждения эффективности генотерапевтического ДНК-вектора VTvaf17-NOS2, несущего целевой ген, а именно, ген NOS2 и реализуемости способа его применения оценивали изменения количества белка NOS2 в коже человека при введении в кожу человека генотерапевтического ДНК-вектора VTvaf17-NOS2, несущего ген NOS2 человека.
С целью анализа изменения количества белка NOS2 трем пациентам вводили в кожу предплечья генотерапевтический ДНК-вектор VTvaf17-NOS2, несущий ген NOS2 и параллельно вводили плацебо, представляющее собой генотерапевтический ДНК-вектор VTvaf17, не содержащий кДНК гена NOS2.
Пациент 1, мужчина 66 лет (П1); пациент 2, женщина 67 лет (П2); пациент 3, мужчина, 62 года (П3). В качестве транспортной системы использовали полиэтиленимин Transfection reagent cGMP grade in-vivo-jetPEI (Polyplus Transfection, Франция). Генотерапевтический ДНК-вектор VTvaf17-NOS2, который содержит кДНК гена NOS2 и генотерапевтический ДНК-вектор VTvaf17, используемый в качестве плацебо, который не содержит кДНК гена NOS2, каждый из которых растворяли в стерильной воде степени очистки Nuclease-Free. Для получения генетической конструкции готовили комплексы ДНК- cGMP grade in-vivo-jetPEI в соответствии с рекомендациями производителя.
Генотерапевтический ДНК-вектор VTvaf17 (плацебо) и генотерапевтический ДНК вектор VTvaf17-NOS2, несущий ген NOS2 вводили в количестве 1 мг для каждой генетической конструкции тоннельным методом иглой 30G на глубину 1,5 мм. Объем вводимого раствора генотерапевтического ДНК-вектора VTvaf17 (плацебо) и генотерапевтического ДНК вектора VTvaf17-NOS2, несущего ген NOS2 - не более 0,3 мл для каждой генетической конструкции. Очаги введения каждой генетической конструкции располагались на участке предплечья на расстоянии 8-10 см друг от друга.
Биопсийные образцы отбирали на 2-е сутки после введения генетических конструкций генотерапевтических ДНК-векторов. Взятие биопсии осуществляли из участков кожи пациентов в зоне введения генотерапевтического ДНК вектора VTvaf17-NOS2, несущего ген NOS2 (I), генотерапевтического ДНК-вектора VTvaf17 (плацебо) (II), а также из интактных участков кожи (III), используя устройство для взятия биопсии Epitheasy 3.5 (Medax SRL, Италия). Кожу пациентов в зоне отбора биоптата предварительно промывали стерильным физиологическим раствором и анестезировали раствором лидокаина. Размер биопсийного образца составлял около 10 куб. мм, масса - около 11 мг.Образец помещали в буферный раствор, содержащий 50 мМ Трис-HCl рН 7.6, 100 мМ NaCl, 1 мМ ЭДТА и 1 мМ фенилметилсульфонилфторид, и гомогенизировали до получения однородной суспензии. Полученную суспензию центрифугировали в течение 10 мин при 14000g. Отбирали супернатант и использовали его для количественного определения целевого белка методом твердофазного иммуноферментного анализа (ELISA), используя набор ELISA Kit for Nitric Oxide Synthase 2, Inducible (NOS2) (Cloud-Clone Corp.Кат.SEA837Hu, США) согласно методике производителя с детекцией оптической плотности при помощи автоматического биохимического и иммуноферментного анализатора ChemWell (Awareness Technology Inc., США).
Численное значение концентрации определяли с помощью калибровочной кривой, построенной по стандартным образцам с известной концентрацией белка NOS2, входящим в состав набора. Чувствительность метода составляла не менее 54 пг/мл (0,057 нг/мл), диапазон измерения - от 156 пг/мл до 10000 пг/мл (0,156-10 нг/мл).
Из фигуры 12 следует, что в коже всех трех пациентов в области введения генотерапевтического ДНК вектора VTvaf17-NOS2, несущего целевой ген NOS2 человека, произошло увеличение количества белка NOS2 в сравнении с количеством белка NOS2 в области введения генотерапевтического ДНК-вектора VTvaf17 (плацебо), не содержащего ген NOS2 человека, что свидетельствует об эффективности генотерапевтического ДНК-вектора VTvaf17-NOS2 и подтверждает реализуемость способа его применения, в частности при внутрикожном введении генотерапевтического ДНК-вектора в ткани человека.
Пример 17.
Подтверждение эффективности и реализуемости способа применения генотерапевтического ДНК-вектора VTvaf17-NOS3, несущего ген NOS3, для повышения экспрессии белка NOS3 в тканях человека.
Для подтверждения эффективности генотерапевтического ДНК-вектора VTvaf17-NOS3, несущего целевой ген NOS3 и реализуемости способа его применения оценивали изменение количества белка NOS3 в мышечной ткани человека при введении генотерапевтического ДНК-вектора VTvaf17-NOS3, несущего целевой ген, а именно, ген NOS3 человека.
С целью анализа изменения количества белка NOS3 трем пациентам вводили в ткань икроножной мышцы генотерапевтический ДНК-вектор VTvaf17-NOS3, несущий ген NOS3 с транспортной молекулой, и параллельно вводили плацебо, представляющее собой генотерапевтический ДНК-вектор VTvaf17, не содержащий кДНК гена NOS3 с транспортной молекулой.
Пациент 1, женщина 60 лет (П1); пациент 2, мужчина 62 года (П2); пациент 3, мужчина, 63 года (П3). В качестве транспортной системы использовали полиэтиленимин Transfection reagent cGMP grade in-vivo-jetPEI (Polyplus Transfection, Франция), пробоподготовку проводили в соответствии с рекомендациями производителя.
Генотерапевтический ДНК-вектор VTvaf17 (плацебо) и генотерапевтический ДНК вектор VTvaf17-NOS3, несущий ген NOS3 вводили в количестве 1 мг для каждой генетической конструкции тоннельным методом иглой 30G на глубину около 10 мм. Объем вводимого раствора генотерапевтического ДНК-вектора VTvaf17 (плацебо) и генотерапевтического ДНК вектора VTvaf17-NOS3, несущего ген NOS3 - 0,3 мл для каждой генетической конструкции. Очаги введения каждой генетической конструкции располагали медиально на расстоянии 8-10 см друг от друга.
Биопсийные образцы отбирали на 2-е сутки после введения генетических конструкций генотерапевтических ДНК-векторов. Взятие биопсии осуществляли из участков мышечной ткани пациентов в зоне введения генотерапевтического ДНК вектора VTvaf17-NOS3, несущего ген NOS3 (I), генотерапевтического ДНК-вектора VTvaf17 (плацебо) (II), а также из интактного участка икроножной мышцы (III), используя устройство для взятия биопсии MAGNUM (BARD, США). Кожу пациентов в зоне отбора биоптата предварительно промывали стерильным физиологическим раствором и анестезировали раствором лидокаина. Размер биопсийного образца составлял около 20 куб. мм, масса - около 22 мг.Образец помещали в буферный раствор, содержащий 50 мМ Трис-HCl рН 7.6, 100 мМ NaCl, 1 мМ ЭДТА и 1 мМ фенилметилсульфонилфторид, и гомогенизировали до получения однородной суспензии. Полученную суспензию центрифугировали в течение 10 мин при 14000g. Отбирали супернатант и использовали его для количественного определения целевого белка.
Количественное определение белка NOS3 проводили методом твердофазного иммуноферментного анализа (ELISA) как это описано в примере 12 с детекцией оптической плотности при помощи автоматического биохимического и иммуноферментного анализатора ChemWell (Awareness Technology Inc., США).
Графики, полученные в результате анализа представлены на фиг. 13.
Из фигуры 13 следует, что в икроножной мышце всех трех пациентов в области введения генотерапевтического ДНК вектора VTvaf17-NOS3, несущего целевой ген, а именно, ген NOS3 человека, произошло увеличение количества белка NOS3 в сравнении с количеством белка NOS3 в области введения генотерапевтического ДНК-вектора VTvaf17 (плацебо), не содержащего ген NOS3 человека, что свидетельствует об эффективности генотерапевтического ДНК-вектора VTvaf17-NOS3 и подтверждает реализуемость способа его применения, в частности при внутримышечном введении генотерапевтического ДНК-вектора в ткани человека.
Пример 18.
Подтверждение эффективности и реализуемости способа применения генотерапевтического ДНК-вектора VTvaf17-KCNMA1, несущего ген KCNMA1, для повышения уровня экспрессии белка KCNMA1 в тканях млекопитающих.
Оценивали изменение количества белка KCNMA1 в биоптате пещеристого тела мужского полового члена человека при интракавернозном введении в половой член человека генотерапевтического ДНК-вектора VTvaf17-KCNMA1.
Раствор для введения, представляющий собой смесь ДНК-вектора с транспортной системой на основе полиэтиленимина Transfection reagent cGMP grade in-vivo-jetPEI (Polyplus Transfection, Франция) готовили согласно инструкции производителя. Объем вводимого раствора составлял 0,75 мл с концентрацией ДНК 1 мкг/мкл. Генотерапевтический ДНК-вектор VTvaf17-KCNMA1, несущий ген KCNMA1, вводили интракавернозно в правое пещеристое тело полового члена тремя инъекциями, очаги введения которых располагались проксимально на расстоянии 1 см друг от друга иглой 30G. Генотерапевтический ДНК-вектор VTvaf17 (плацебо), вводили интракавернозно в левое пещеристое тело полового члена тремя инъекциями, очаги введения которых располагались проксимально на расстоянии 1 см друг от друга иглой 30G. После введения генотерапевтического ДНК вектора VTvaf17- KCNMA1 и плацебо для обеспечения максимально возможного времени нахождения плазмиды в области введения на основание полового члена на 20 минут накладывался стягивающий турникет.
Биопсийные образцы отбирали на 2 сутки после введения генотерапевтических ДНК-векторов. Взятие биопсии осуществляли из участков пещеристого тела полового члена пациента в зоне введения генотерапевтического ДНК вектора VTvaf17-KCNMA1, несущего ген KCNMA1 (I), генотерапевтического ДНК-вектора VTvaf17 (плацебо) (II), а также из интактных участков пещеристого тела (III), используя устройство для взятия биопсии MAGNUM (BARD, США). Кожу пациента в зоне отбора биоптата предварительно промывали стерильным физиологическим раствором и анестезировали раствором лидокаина. Размер биопсийного образца составлял около 10 куб. мм, масса - около 11 мг. Образец помещали в буферный раствор, содержащий 50 мМ Трис-HCl рН 7.6, 100 мМ NaCl, 1 мМ ЭДТА и 1 мМ фенилметилсульфонилфторид, и гомогенизировали до получения однородной суспензии. Полученную суспензию центрифугировали в течение 10 мин при 14000g. Отбирали супернатант и использовали его для количественного определения целевого белка как это описано в примере 14.
Графики, полученные в результате анализа, представлены на фиг. 14.
Из фигуры 14 следует, что в биоптате пещеристого тела полового члена человека из места введения генотерапевтического ДНК-вектора VTvaf17- KCNMA1, несущего ген KCNMA1, наблюдается увеличение количества белка KCNMA1 по сравнению с контрольной группой II (плацебо) и контрольной группой III (интактный участок). Полученные результаты свидетельствуют об эффективности интракавернозного введения генотерапевтического ДНК-вектора и подтверждают реализуемость способа применения для повышения уровня экспрессии целевого белка в тканях млекопитающих.
Пример 19.
Подтверждение эффективности генотерапевтического ДНК-вектора VTvaf17-NOS2, несущего ген NOS2 и реализуемости способа его применения для повышения уровня экспрессии белка NOS2 в тканях человека путем введения аутологичных фибробластов, трансфицированных генотерапевтическим ДНК-вектором VTvaf17-NOS2.
Для подтверждения эффективности генотерапевтического ДНК-вектора VTvaf17-NOS2, несущего ген NOS2 и реализуемости способа его применения оценивали изменения количества белка NOS2 в коже человека при введении в кожу пациента культуры аутологичных фибробластов этого пациента, трансфицированных генотерапевтическим ДНК-вектором VTvaf17-NOS2.
Пациенту вводили в кожу предплечья соответствующую культуру аутологичных фибробластов, трансфицированных генотерапевтическим ДНК-вектором VTvaf17-NOS2, несущим ген NOS2, и параллельно вводили плацебо, представляющее собой культуру аутологичных фибробластов пациента, трансфицированных генотерапевтическим ДНК-вектором VTvaf17, не несущим ген NOS2.
Первичную культуру фибробластов человека выделяли из биоптатов кожи пациента. Используя устройство для взятия биопсии кожи Epitheasy 3.5 (Medax SRL, Италия) брали образец биоптата кожи из зоны, защищенной от действия ультрафиолета, а именно за ушной раковиной или с боковой внутренней поверхности в зоне локтевого сустава, размером около 10 кв. мм, массой - около 11 мг.Кожу пациента предварительно промывали стерильным физиологическим раствором и анестезировали раствором лидокаина. Культивирование первичной культуры клеток осуществляли при 37 0С в атмосфере, содержащей 5% СО2 в среде DMEM с 10% фетальной телячьей сывороткой и ампициллином 100 Ед/мл. Пересев культуры и смену культуральной среды осуществляли каждые 2 дня. Общая продолжительность роста культуры не превышала 25-30 дней. Из культуры клеток отбирали аликвоту, содержащую 5×104 клеток. Культуру фибробластов пациента трансфицировали генотерапевтическим ДНК-вектором VTvaf17-NOS2, несущим ген NOS2 или плацебо - вектор VTvaf17, не несущий целевой ген NOS2.
Трансфекцию осуществляли с помощью катионного полимера полиэтиленимина JETPEI (Polyplus Transfection, Франция), согласно инструкции фирмы-производителя. Клетки культивировали 72 часа и затем вводили пациенту. Введение пациенту культуры аутологичных фибробластов этого пациента, трансфицированных генотерапевтическим ДНК-вектором VTvaf17-NOS2, и плацебо, представляющее собой культуру аутологичных фибробластов пациента, трансфицированных генотерапевтическим ДНК-вектором VTvaf17, осуществляли туннельным методом в область предплечья иглой 30G длиной 13 мм на глубину около 3 мм. Концентрация модифицированных аутологичных фибробластов в вводимой суспензии составляла примерно 5 млн клеток на 1 мл суспензии, количество вводимых клеток не превышало 15 млн. Очаги введения культуры аутологичных фибробластов располагались на расстоянии 8-10 см друг от друга.
Биопсийные образцы отбирали на 4-е сутки после введения культуры аутологичных фибробластов, трансфицированных генотерапевтическим ДНК-вектором VTvaf17-NOS2, несущим целевой ген, а именно, ген NOS2 и плацебо. Взятие биопсии осуществляли из участков кожи пациента в зоне введения культуры аутологичных фибробластов, трансфицированных генотерапевтическим ДНК-вектором VTvaf17-NOS2, несущим целевой ген, а именно, ген NOS2 (C), культуры аутологичных фибробластов, трансфицированных генотерапевтическим ДНК-вектором VTvaf17, не несущим целевой ген NOS2 (плацебо) (B), а также из участков интактной кожи (A), используя устройство для взятия биопсии Epitheasy 3.5 (Medax SRL, Италия). Кожу в зоне отбора биоптата пациентов предварительно промывали стерильным физиологическим раствором и анестезировали раствором лидокаина. Размер биопсийного образца составлял около 10 куб. мм, масса - около 11 мг. Образец помещали в буферный раствор, содержащий 50 мМ Трис-HCl рН 7.6, 100 мМ NaCl, 1 мМ ЭДТА и 1 мМ фенилметилсульфонилфторид, и гомогенизировали до получения однородной суспензии. Полученную суспензию центрифугировали в течение 10 мин при 14000g. Отбирали супернатант и использовали его для количественного определения целевого белка как это описано в примере 11.
Графики, полученные в результате анализа, представлены на фиг. 15.
Из фигуры 15 следует, что в коже пациента в области введения культуры аутологичных фибробластов, трансфицированных генотерапевтическим ДНК-вектором VTvaf17-NOS2, несущим ген NOS2, произошло увеличение количества белка NOS2 в сравнении с количеством белка NOS2 в области введения культуры аутологичных фибробластов, трансфицированных генотерапевтическим ДНК-вектором VTvaf17, не несущим ген NOS2 (плацебо), что свидетельствует об эффективности генотерапевтического ДНК-вектора VTvaf17-NOS2 и подтверждает реализуемость способа его применения для повышения уровня экспрессии NOS2 в тканях человека, в частности при введении аутологичных фибробластов, трансфицированных генотерапевтическим ДНК-вектором VTvaf17-NOS2.
Пример 20.
Подтверждение эффективности генотерапевтического ДНК-вектора VTvaf17-KCNMA1, несущего ген KCNMA1 и реализуемости способа его применения для повышения уровня экспрессии белка KCNMA1 в клетках млекопитающих.
Для подтверждения эффективности генотерапевтического ДНК-вектора VTvaf17-KCNMA1, несущего ген KCNMA1 оценивали изменение накопления мРНК целевого гена KCNMA1 в клетках в клетках гладкой мускулатуры аорты быка BAOSMC (Genlantis) через 48 часов после их трансфекции генотерапевтическим ДНК-вектором VTvaf17-KCNMA1, несущим ген KCNMA1 человека по сравнению с контрольными клетками BEND, трансфицированными генотерапевтическим ДНК-вектором VTvaf17, не несущим ген KCNMA1 человека (плацебо).
Культуру клеток гладкой мускулатуры аорты быка BAOSMC (Genlantis) выращивали в среде Bovine Smooth Muscle Cell Growth Mediumm (Sigma B311F-500) с добавлением сыворотки рогатого скота до 10% (Панэко, Россия). Трансфекцию генотерапевтическим ДНК-вектором VTvaf17-KCNMA1, несущим ген KCNMA1 человека и ДНК-вектором VTvaf17, выделение РНК, реакцию обратной транскрипции, ПЦР амплификацию и анализ данных проводили как описано в примере 9. В качестве референтного гена использовали ген актина быка/ коровы (АСТ), приведенного в базе данных GenBank под номером AH001130.2.
Графики, полученные в результате анализа представлены на фиг. 16.
Из фигуры 16 следует, что в результате трансфекции клеток гладкой мускулатуры аорты быка BAOSMC генотерапевтическим ДНК-вектором VTvaf17-KCNMA1, накопление ампликонов кДНК происходило быстрее, чем в контрольных образцах клеток, что свидетельствует о большем уровне мРНК гена KCNMA1 человека в клетках после трансфекции генотерапевтическим ДНК-вектором VTvaf17-KCNMA1. Представленные результаты подтверждают реализуемость способа применения генотерапевтическим ДНК-вектором VTvaf17-KCNMA1 для повышения уровня экспрессии гена KCNMA1 в клетках млекопитающих.
Пример 21.
Штамм Escherichia coli SCS110-AF/VTvaf17-NOS2 или штамм Escherichia coli SCS110-AF/VTvaf17-NOS3 или штамм Escherichia coli SCS110-AF/VTvaf17-VIP или штамм Escherichia coli SCS110-AF/VTvaf17-KCNMA1 или штамм Escherichia coli SCS110-AF/VTvaf17-CGRP, несущий генотерапевтический ДНК-вектор, и способ его получения.
Конструирование штамма для наработки в промышленных масштабах генотерапевтического ДНК-вектора на основе генотерапевтического ДНК-вектора VTvaf17, несущего целевой ген, выбранный из группы генов: NOS2, NOS3, VIP, KCNMA1, CGRP, а именно штамма Escherichia coli SCS110-AF/VTvaf17-NOS2, или штамма Escherichia coli SCS110-AF/VTvaf17-NOS3, или штамма Escherichia coli SCS110-AF/VTvaf17-VIP, или штамма Escherichia coli SCS110-AF/VTvaf17-KCNMA1, или штамма Escherichia coli SCS110-AF/VTvaf17-CGRP, несущего генотерапевтический ДНК-вектор VTvaf17-NOS2, или VTvaf17-NOS3, или VTvaf17-VIP, или VTvaf17-KCNMA1, или VTvaf17-CGRP соответственно для его наработки с возможностью селекции без использования антибиотиков заключается в получении электрокомпетентных клеток штамма Escherichia coli SCS110-AF с проведением электропорации этих клеток генотерапевтическим ДНК-вектором VTvaf17-NOS2, или ДНК-вектором VTvaf17-NOS3, или ДНК-вектором VTvaf17-VIP, или ДНК-вектором VTvaf17-KCNMA1 или ДНК-вектором VTvaf17-CGRP, после чего клетки высеваются на чашки Петри с агаризованной селективной средой, содержащей дрожжевой экстракт, пептон, 6% сахарозы, а также 10 мкг/мл хлорамфеникола. При этом штамм Escherichia coli SCS110-AF для наработки генотерапевтического ДНК-вектора VTvaf17 или генотерапевтических ДНК-векторов на его основе с возможностью положительной селекции без использования антибиотиков получали путем конструирования линейного фрагмента ДНК, содержащего регуляторный элемент RNA-in транспозона Tn10 для селекции без применения антибиотиков размером 64 п.н., ген левансахаразы sacB, продукт которого обеспечивает селекцию на сахарозо-содержащей среде размером 1422 п. н., ген устойчивости к хлорамфениколу catR, необходимый для отбора клонов штамма, в которых прошла гомологичная рекомбинация размером 763 п.н. и две гомологичные последовательности, обеспечивающие процесс гомологичной рекомбинации в области гена recA с одновременной его инактивацией размером 329 п.н. и 233 п.н., после чего проводили трансформацию клеток Escherichia coli путем электропорации и отбирали клоны, выжившие на среде, содержащей 10 мкг/мл хлорамфеникола. Полученные штаммы для наработки были внесены в коллекции Национального биоресурсного центра - Всероссийская коллекция промышленных микроорганизмов (НБЦ ВКПМ), РФ и NCIMB Patent Deposit Service, UK с присвоением регистрационных номеров: штамм Escherichia coli SCS110-AF/VTvaf17-NOS2 - регистрационный №ВКПМ В-13323, дата депонирования 12.12.2018, INTERNATIONAL DEPOSITARY AUTHORITY №NCIMB 43244, дата депонирования 08.11.2018, штамм Escherichia coli SCS110-AF/VTvaf17-NOS3 - регистрационный №ВКПМ В-13255, дата депонирования 24.09.2018, INTERNATIONAL DEPOSITARY AUTHORITY №NCIMB 43206, дата депонирования 20.09.2018, штамм Escherichia coli SCS110-AF/VTvaf17-VIP - регистрационный №ВКПМ В-13252, дата депонирования 24.09.2018, INTERNATIONAL DEPOSITARY AUTHORITY №NCIMB 43204, дата депонирования 20.09.2018, штамм Escherichia coli SCS110-AF/VTvaf17-KCNMA1 - регистрационный №ВКПМ В-13257, дата депонирования 24.09.2018, INTERNATIONAL DEPOSITARY AUTHORITY №NCIMB 43205, дата депонирования 20.09.2018, штамм Escherichia coli SCS110-AF/VTvaf17-CGRP - регистрационный №ВКПМ В-13277, дата депонирования 16.10.2018, INTERNATIONAL DEPOSITARY AUTHORITY №NCIMB 43306 дата депонирования 13.12.2018.
Пример 22.
Способ масштабирования получения генотерапевтического ДНК-вектора на основе генотерапевтического ДНК-вектора VTvaf17, несущего целевой ген, выбранный из группы генов: NOS2, NOS3, VIP, KCNMA1, CGRP до промышленного масштаба.
Для подтверждения технологичности получения и возможности производства в промышленных масштабах генотерапевтического ДНК-вектора VTvaf17-NOS2 (SEQ ID №1), или VTvaf17-NOS3 (SEQ ID №2), или VTvaf17-VIP (SEQ ID №3), или VTvaf17-KCNMA1 (SEQ ID №4), или VTvaf17-CGRP (SEQ ID №5) проводили масштабную ферментацию штамма Escherichia coli SCS110-AF/VTvaf17-NOS2, или штамма Escherichia coli SCS110-AF/VTvaf17-NOS3, или штамма Escherichia coli SCS110-AF/VTvaf17-VIP, или штамма Escherichia coli SCS110-AF/VTvaf17-KCNMA1, или штамма Escherichia coli SCS110-AF/VTvaf17-CGRP, каждый из которых содержит генотерапевтический ДНК-вектор VTvaf17, несущий целевой ген, а именно NOS2, или NOS3, или VIP, или KCNMA1, или CGRP. Каждый штамм Escherichia coli SCS110-AF/VTvaf17-NOS2, или Escherichia coli SCS110-AF/VTvaf17-NOS3, или Escherichia coli SCS110-AF/VTvaf17-VIP, или Escherichia coli SCS110-AF/VTvaf17-KCNMA1, или Escherichia coli SCS110-AF/VTvaf17-CGRP получали на базе штамма Escherichia coli SCS110-AF (Cell and Gene Therapy LLC, Великобритания) по примеру 21 путем электропорации компетентных клеток этого штамма генотерапевтическим ДНК-вектором VTvaf17-NOS2, или VTvaf17-NOS3, или VTvaf17-VIP, или VTvaf17-KCNMA1, или VTvaf17-CGRP, несущим целевой ген, а именно, NOS2, или NOS3, или VIP, или KCNMA1, или CGRP с последующим высевом трансформированных клеток на чашки Петри с агаризованной селективной средой, содержащей дрожжевой экстракт, пептон, 6% сахарозы и отбором отдельных клонов.
Ферментацию полученного штамма Escherichia coli SCS110-AF/VTvaf17-NOS2, несущего генотерапевтический ДНК-вектор VTvaf17-NOS2 проводили в ферментере объемом 10 л с последующим выделением генотерапевтического ДНК-вектора VTvaf17-NOS2.
Для ферментации штамма Escherichia coli SCS110-AF/VTvaf17-NOS2 готовили среду, содержащую на 10 л: 100 г триптон, 50 г дрожжевой экстракт (Becton Dickinson, США), доводили водой до 8800 мл и автоклавировали при 121 0С 20 мин, затем добавляли 1200 мл 50% (вес/объем) сахарозы. Далее засевали в колбу затравочную культуру штамма Escherichia coli SCS110-AF/VTvaf17-NOS2 в объеме 100 мл. Инкубировали в шейкере-инкубаторе 16 ч при 30°С. Переносили затравочную культуру в ферментер Techfors S (Infors HT, Швейцария), растили до достижения стационарной фазы. Контроль осуществляли измерением оптической плотности культуры при длине волны 600 нм. Клетки осаждали центрифугированием 30 мин при 5000-10000 g. Супернатант удаляли, клеточную массу ресуспендировали в 10% по объему фосфатно-солевого буфера. Повторно центрифугировали 30 мин при 5000-10000g. Супернатант удаляли, к клеточной массе добавляли раствор 20 мМ TrisCl, 1 мМ ЭДТА, 200 г/л сахароза, рН 8,0 в объеме 1000 мл, тщательно перемешивали до образования гомогенной суспензии. Добавляли раствор яичного лизоцима до конечной концентрации 100 мкг/мл. Инкубировали 20 мин на льду при бережном перемешивании. Далее, добавляли 2500 мл раствора 0,2 М NaOH, 10 г/л додецилсульфат натрия, инкубировали 10 мин на льду при бережном перемешивании, затем добавляли 3500 мл раствора 3M ацетат натрия, 2М уксусная кислота, рН 5-5,5, инкубировали 10 мин на льду при бережном перемешивании. Полученный образец центрифугировали 20-30 мин при 15000 g или более. Раствор аккуратно декантировали, от остатков осадка избавлялись фильтрацией через грубый фильтр (фильтровальную бумагу). Добавляли РНКазу А (Sigma, США) до конечной концентрации 20 нг/мл, инкубировали ночь 16 ч при комнатной температуре. Раствор центрифугировали 20-30 мин при 15000g, затем фильтровали через мембранный фильтр с порами 0,45 мкм (Millipore, США). Далее проводили ультрафильтрацию через мембрану размером отсечения 100кДа (Millipore, США) и разбавляли до начального объема буфером 25 мМ TrisCl, pH 7.0. Операцию повторяли три - четыре раза. Наносили раствор, на колонку с 250 мл сорбента DEAE sepharose HP (GE, США), уравновешенную раствором 25 мМ TrisCl, pH 7.0. После нанесения образца колонку промывали тремя объемами этого же раствора, а затем проводили элюцию генотерапевтического ДНК-вектора VTvaf17-NOS2 линейным градиентом от раствора 25 мМ TrisCl, pH 7.0 до раствора 25 мМ TrisCl, pH 7.0, 1М NaCl в объеме пяти объемов колонки. Контроль элюции осуществляли по оптической плотности сходящего раствора при 260 нм. Хроматографические фракции, содержащие генотерапевтический ДНК-вектор VTvaf17-NOS2, объединяли и проводили гель-фильтрацию на сорбенте Superdex 200 (GE, США). Колонку уравновешивали фосфатно-солевым буфером. Контроль элюции осуществляли по оптической плотности сходящего раствора при 260 нм, фракции анализировали электрофорезом в агарозном геле. Фракции, содержащие генотерапевтический ДНК-вектор VTvaf17-NOS2 объединяли и хранили при -20°С. Для оценки воспроизводимости техпроцесса обозначенные технологические операции повторяли пятикратно. Все технологические операции для штаммов Escherichia coli SCS110-AF/VTvaf17-NOS3, или Escherichia coli SCS110-AF/VTvaf17-VIP, или Escherichia coli SCS110-AF/VTvaf17-KCNMA1, или Escherichia coli SCS110-AF/VTvaf17-CGRP проводили аналогичным образом.
Воспроизводимость техпроцесса и количественные характеристики выхода конечного продукта подтверждают технологичность получения и возможность производства в промышленных масштабах генотерапевтического ДНК-вектора VTvaf17-NOS2, или VTvaf17-NOS3, или VTvaf17-VIP, или VTvaf17-KCNMA1 или VTvaf17-CGRP.
Таким образом, созданный генотерапевтический ДНК-вектор с целевым геном может быть использован для введения в клетки организма животных и человека, характеризующихся сниженной или недостаточной экспрессией белка, кодируемого данным геном, обеспечивая таким образом достижение терапевтического эффекта.
Задача, поставленная в данном изобретении, а именно: конструирование генотерапевтических ДНК-векторов для повышения уровня экспрессии генов NOS2, NOS3, VIP, KCNMA1, CGRP, сочетающих в себе следующие свойства:
I) Эффективность повышения экспрессии целевых генов в эукариотических клетках;
II) Возможность безопасного применения для генетической терапии человека и животных за счет отсутствия в составе генотерапевтического ДНК-вектора регуляторных элементов, представляющих собой нуклеотидные последовательности вирусных геномов;
Возможность безопасного применения для генетической терапии человека и животных за счет отсутствия в составе генотерапевтического ДНК-вектора генов антибиотикорезистентности;
III) Технологичность получения и возможность наработки в штаммах в промышленных масштабах;
IV) а также задача по конструированию штаммов, несущих эти генотерапевтические ДНК-вектора для производства этих генотерапевтических ДНК-векторов решена, что подтверждается примерами:
для п. I - пример 1, 2, 3, 4, 5; 6; 7; 8; 9; 10; 11; 12; 13; 14; 15; 16; 17; 18; 19; 20;
для п. II - пример 1, 2, 3, 4, 5;
для п. III - пример 1, 2, 3, 4, 5;
для п. IV - пример 21, 22.
Промышленная применимость:
Все представленные выше примеры подтверждают промышленную применимость предлагаемого генотерапевтического ДНК-вектора на основе генотерапевтического ДНК-вектора VTvaf17, несущего целевой ген, выбранный из группы генов: ген NOS2, ген NOS3, ген VIP, ген KCNMA1, ген CGRP для повышения уровня экспрессии этих целевых генов, штамма Escherichia coli SCS110-AF/VTvaf17-NOS2 или Escherichia coli SCS110-AF/VTvaf17-NOS3 или Escherichia coli SCS110-AF/VTvaf17-VIP или Escherichia coli SCS110-AF/VTvaf17-KCNMA1 или Escherichia coli SCS110-AF/VTvaf17-CGRP несущего генотерапевтический ДНК-вектор, способа получения предлагаемого генотерапевтического ДНК-вектора, способа производства в промышленных масштабах генотерапевтического ДНК-вектора.
ПЕРЕЧЕНЬ СОКРАЩЕНИЙ
VTvaf17 - вектор генотерапевтический, не содержащий последовательностей вирусных геномов и маркеров антибиотико-резистентности (vector therapeutic virus-antibiotic-free)
ДНК - дезоксирибонуклеиновая кислота
кДНК - комплементарная дезоксирибонуклеиновая кислота
РНК - рибонуклеиновая кислота
мРНК - матричная рибонуклеиновая кислота
п.н. - пар нуклеотидов
ПЦР - полимеразная цепная реакция
мл - миллилитр, мкл - микролитр
куб. мм - кубический миллиметр
л - литр
мкг - микрограмм
мг - миллиграмм
г - грамм
мкМ - микромоль
мМ - миллимоль
мин - минута
сек - секунда
об/мин - обороты в минуту
нм - нанометр
см - сантиметр
мВт - милливатт
о.е. ф-относительная единица флуоресценции
РВС - фосфатно-солевой буфер.
Список литературы
1. Молекулярная биология, 2011, том 45, №1, с. 44-55.
2. Заявка WO1994016718A1.
3. Заявка US20040120930A1.
4. Патент US5594032A.
5. Патент US8536146B2.
6. Патент US9550998 В2.
7. Barbato JE, Tzeng E. iNOS gene transfer for graft disease. Trends Cardiovasc Med. 2004 Oct;14(7):267-72.
8. Bivalacqua TJ, Champion HC, Abdel-Mageedgfntyn AB, Kadowitz PJ, Hellstrom WJ. Gene.
9. Bivalacqua TJ, Champion HC, Mehta YS, Abdel-Mageed AB, Sikka SC, Ignarro LJ, Kadowitz PJ, Hellstrom WJ. Adenoviral gene transfer of endothelial nitric oxide synthase (eNOS) to the penis improves age-related erectile dysfunction in the rat. Int J Impot Res. 2000 Sep;12 Suppl 3: S8-17.
10. Chen H, Yang H, Yue H, Strappe PM, Xia P, Pan L, Zhang Y, Chai S, Chen S, Ma L, Wang L. Mesenchymal Stem Cells Expressing eNOS and a Cav1 Mutant Inhibit Vascular Smooth Muscle Cell Proliferation in a Rat Model of Pulmonary Hypertension. Heart Lung Circ. 2017 May;26(5):509-518.
11. Chevalier RL. Promise for gene therapy in obstructive nephropathy. Kidney Int. 2004 Oct;66(4):1709-10.
12. Cobb J.P., R.S. Hotchkiss, P.E. Swanson, K. Chang, Y. Qiu, V.E. Laubach, I.E. Karl, T.G. Buchman, Inducible nitric oxide synthase (iNOS) gene deficiency increases themortality of sepsis in mice, Surgery 126 (1999) 438-442.
13. Delgado M, Abad C, Martinez C, Leceta J, Gomariz RP. Vasoactive intestinal peptide prevents experimental arthritis by downregulating both autoimmune and inflammatory components of the disease. Nat Med. 2001 May;7(5):563-8.
14. Draft Guideline on the quality, non-clinical and clinical aspects of gene therapy medicinal products, http://www.ema.europa.eu/docs/en_GB/document_library/Scientific_guideline/2015/05/WC500187020.pdf.
15. Dran GI, Fernández GC, Rubel CJ, Bermejo E, Gomez S, Meiss R, Isturiz MA,Palermo MS. Protective role of nitric oxide in mice with Shiga toxin-induced hemolytic uremic syndrome. Kidney Int. 2002 Oct;62(4):1338-48.
16. El Karim IA, Linden GJ, Orr DF, Lundy FT. Antimicrobial activity of neuropeptides against a range of micro-organisms from skin, oral, respiratory and gastrointestinal tract sites. J Neuroimmunol. 2008 Aug 30;200(1-2):11-6.
17. Fang Z, Yang Q, Xiong W, Li GH, Liao H, Xiao J, Li F. Effect of CGRP-adenoviral vector transduction on the osteoblastic differentiation of rat adipose-derived stem cells. PLoS One. 2013 Aug 30;8(8):e72738.
18. Granath A, Norrby-Teglund A, Uddman R, Cardell LO. Reduced iNOS expression in adenoids from children with otitis media with effusion. Pediatr Allergy Immunol. 2010 Dec;21(8):1151-6. doi: 10.1111/j.1399-3038.2010.01020.x.
19. Guan CX, Zhang M, Qin XQ, Cui YR, Luo ZQ, Bai HB, Fang X. Vasoactive intestinal peptide enhances wound healing and proliferation of human bronchial epithelial cells. Peptides. 2006 Dec;27(12):3107-14. Epub 2006 Sep 11.
20. Guideline on the quality, non-clinical and clinical aspects of gene therapy medicinal Products EMA/CAT/80183/2014.
21. Hamidi SA, Lin RZ, Szema AM, Lyubsky S, Jiang YP, Said SI. VIP and endothelin receptor antagonist: an effective combination against experimental pulmonary arterial hypertension. Respir Res. 2011 Oct 26;12:141.
22. He Y, He W, Qin G, Luo J, Xiao M. Transplantation KCNMA1 modified bone marrow-mesenchymal stem cell therapy for diabetes mellitus-induced erectile dysfunction. Andrologia. 2014 Jun;46(5):479-86.
23. Hornstein BD, Roman D, Arévalo-Soliz LM, Engevik MA, Zechiedrich L. Effects of Circular DNA Length on Transfection Efficiency by Electroporation into HeLa Cells. Ceña V, ed. PLoS ONE. 2016;11(12):e0167537. doi:10.1371/journal.pone.0167537.
24. Igamonti E, Touvier T, Clementi E, Manfredi AA, Brunelli S, Rovere-Querini P. Requirement of inducible nitric oxide synthase for skeletal muscle regeneration after acute damage. J Immunol. 2013 Feb 15;190(4):1767-77.
25. Jiang B, Du L, Flynn R, Dronadula N, Zhang J, Kim F, Dichek D. Overexpression of endothelial nitric oxide synthase improves endothelium-dependent vasodilation in arteries infused with helper-dependent adenovirus. Hum Gene Ther. 2012 Nov;23(11):1166-75.
26. Kato I, Suzuki Y, Akabane A, Yonekura H, Tanaka O, Kondo H, Takasawa S, Yoshimoto T, Okamoto H. Enhancement of glucose-induced insulin secretion in transgenic mice overexpressing human VIP gene in pancreatic beta cells. Ann N Y Acad Sci. 1996 Dec 26;805:232-42.
27. Li L, Petrovsky N. Molecular mechanisms for enhanced DNA vaccine immunogenicity. Expert Rev Vaccines. 2016;15(3):313-29.
28. Ma G, Liu H, Hua Q, Wang M, Du M, Lin Y, Ge Y, Gong W, Zhao Q, Qiang F, Tao G,Zhang Z, Chu H. KCNMA1 cooperating with PTK2 is a novel tumor suppressor in gastric cancer and is associated with disease outcome. Mol Cancer. 2017 Feb 23;16(1):46.
29. Mairhofer J, Grabherr R. Rational vector design for efficient non-viral gene delivery: challenges facing the use of plasmid DNA. Mol Biotechnol. 2008.39(2):97-104.
30. Manzanares D, Srinivasan M, Salathe ST, Ivonnet P, Baumlin N, Dennis JS, Conner GE, Salathe M. IFN-γ-mediated reduction of large-conductance, Ca2+-activated, voltage-dependent K+(BK) channel activity in airway epithelial cells leads to mucociliary dysfunction. Am J Physiol Lung Cell Mol Physiol. 2014 Mar 1;306(5):L453-62.
31. Márquez-Rodas I, Longo F, Rothlin RP, Balfagón G. Pathophysiology and therapeutic possibilities of calcitonin gene-related peptide in hypertension. J Physiol Biochem. 2006 Mar;62(1):45-56.
32. Melman A, Bar-Chama N, McCullough A, Davies K, Christ G. hMaxi-K gene transfer in males with erectile dysfunction: results of the first human trial. Hum Gene Ther. 2006 Dec;17(12):1165-76. PubMed PMID: 17134370.
33. Reflection paper on design modifications of gene therapy medicinal products during development / 14 December 2011 EMA/CAT/GTWP/44236/2009 Committee for advanced therapies.
34. Schwentker A, Billiar TR. // World J Surg. 2002 Jul;26(7):772-8. Chevalier RL. // Kidney Int. 2004 Oct;66(4):1709-10. Igamonti E et al. // J Immunol. 2013 Feb 15;190(4):1767-77.
35. Schwentker A, Billiar TR. Inducible nitric oxide synthase: from cloning to therapeutic applications. World J Surg. 2002 Jul;26(7):772-8.
36. Shah G, Zhang G, Chen F, Cao Y, Kalyanaraman B, See WA. iNOS expression and NO production contribute to the direct effects of BCG on urothelial carcinoma cell biology. Urol Oncol. 2014 Jan;32(1):45.e1-9.
37. She F, Sun W, Mao JM, Wang X. Calcitonin gene-related peptide gene therapy suppresses reactive oxygen species in the pancreas and prevents mice from autoimmune diabetes. Sheng Li Xue Bao. 2003 Dec 25;55(6):625-32.
38. Tabarki B, AlMajhad N, AlHashem A, Shaheen R, Alkuraya FS. Homozygous KCNMA1 mutation as a cause of cerebellar atrophy, developmental delay and seizures. Hum Genet. 2016 Nov;135(11):1295-1298.
39. Tao J, Zhou ZL, Wu B, Shi J, Chen XM, Ji YH. Recombinant expression and functional characterization of martentoxin: a selective inhibitor for BK channel(α+β4). Toxins (Basel). 2014 Apr 22;6(4):1419-33.
40. Tasyurek HM, Eksi YE, Sanlioglu AD, Altunbas HA, Balci MK, Griffith TS, Sanlioglu S. HIV-based lentivirus-mediated vasoactive intestinal peptide gene delivery protects against DIO animal model of Type 2 diabetes. Gene Ther. 2018 Jul;25(4):269-283.
41. transfer of prepro-calcitonin gene-related peptide restores erectile function in the aged rat. Biol Reprod. 2001 Nov;65(5):1371-7.
42. Tsuji S, Iharada A, Kimata T, Shimo T, Hirabayashi M, Kaneko K. Production of nitric oxide is lower in Shiga toxin-stimulated neutrophils of infants compared to those of children or adults. Tohoku J Exp Med. 2012 Nov;228(3):247-52.
43. Vacas E, Fernández-Martínez AB, Bajo AM, Sánchez-Chapado M, Schally AV, Prieto JC, Carmena MJ. Vasoactive intestinal peptide (VIP) inhibits human renal cell carcinoma proliferation. Biochim Biophys Acta. 2012 Oct;1823(10):1676-85.
44. Wang T, Li M, Yuan H, Zhan Y, Xu H, Wang S, Yang W, Liu J, Ye Z, Li LC. saRNA guided iNOS up-regulation improves erectile function of diabetic rats. J Urol. 2013 Aug;190(2):790-8.
45. Wang W, Sun W, Wang X. Intramuscular gene transfer of CGRP inhibits neointimal hyperplasia after balloon injury in the rat abdominal aorta. Am J Physiol HeartCirc Physiol. 2004 Oct;287(4):H1582-9.
46. Wei L, Zhu W, Xia L, Yang Y, Liu H, Shen J, Zhu J, Xu Y, Yang Z, Wang C. Therapeutic effect of eNOS-transfected endothelial progenitor cells on hemodynamic pulmonary arterial hypertension. Hypertens Res. 2013 May;36(5):414-21.
47. Wyllie MG. The anatomy of drug development: Invicorp, a product before its time. BJU Int. 2010 Sep;106(5):723-4.
48. Xiang L, Ma L, Wei N, Wang T, Yao Q, Yang B, Xiong Y, Wu Y, Gong P. Effect of lentiviral vector overexpression α-calcitonin gene-related peptide on titanium implant osseointegration in α-CGRP-deficient mice. Bone. 2017 Jan;94:135-140.
49. Zhao CX, Xu X, Cui Y, Wang P, Wei X, Yang S, Edin ML, Zeldin DC, Wang DW. Increased endothelial nitric-oxide synthase expression reduces hypertension and hyperinsulinemia in fructose-treated rats. J Pharmacol Exp Ther. 2009 Feb;328(2):610-20.
--->
ПЕРЕЧЕНЬ ПОСЛЕДОВАТЕЛЬНОСТЕЙ
<110> Селл энд Джин Терапи Лтд (CELL and GENE THERAPY Ltd), Общество с ограниченной ответственностью «Прорывные Инновационные Технологии»,
<120> Генотерапевтический ДНК-вектор на основе генотерапевтического ДНК-вектора VTvaf17, несущий целевой ген, выбранный из группы генов NOS2, NOS3, VIP, KCNMA1, CGRP, для повышения уровня экспрессии этих целевых генов, способ его получения и применения, штамм Escherichia coli SCS110-AF/VTvaf17-NOS2 или Escherichia coli SCS110-AF/VTvaf17-NOS3 или Escherichia coli SCS110-AF/VTvaf17-VIP или Escherichia coli SCS110-AF/VTvaf17-KCNMA1 или Escherichia coli SCS110-AF/VTvaf17-CGRP, несущий генотерапевтический ДНК-вектор, способ его получения, способ производства в промышленных масштабах генотерапевтического ДНК-вектора.
<160> 8
<170> BiSSAP 1.3.6
<210> 1
<211> 6625
<212> DNA
<213> Homo Sapiens
<400> 1
cgtgaggctc cggtgcccgt cagtgggcag agcgcacatc gcccacagtc cccgagaagt 60
tggggggagg ggtcggcaat tgaaccggtg cctagagaaa gtggcgcggg gtaaactggg 120
aaagtgatgt cgtgtactgg ctccgccttt ttcccgaggg tgggggagaa ccgtatataa 180
gtgcagtagt cgccgtgaac gttctttttc gcaacgggtt tgccgccaga acacaggtaa 240
gtgccgtgtg tggttcccgc gggcctggcc tctttacggg ttatggccct tgcgtgcctt 300
gaattacttc cacgcccctg gctgcagtac gtgattcttg atcccgagct tcgggttgga 360
agtgggtggg agagttcgag gccttgcgct taaggagccc cttcgcctcg tgcttgagtt 420
gaggcctggc ttgggcgctg gggccgccgc gtgcgaatct ggtggcacct tcgcgcctgt 480
ctcgctgctt tcgataagtc tctagccatt taaaattttt gatgacctgc tgcgacgctt 540
tttttctggc aagatagtct tgtaaatgcg ggccaagatc tgcacactgg tatttcggtt 600
tttggggccg cgggcggcga cggggcccgt gcgtcccagc gcacatgttc ggcgaggcgg 660
ggcctgcgag cgcggccacc gagaatcgga cgggggtagt ctcaagctgg ccggcctgct 720
ctggtgcctg gcctcgcgcc gccgtgtatc gccccgccct gggcggcaag gctggcccgg 780
tcggcaccag ttgcgtgagc ggaaagatgg ccgcttcccg gccctgctgc agggagctca 840
aaatggagga cgcggcgctc gggagagcgg gcgggtgagt cacccacaca aaggaaaagg 900
gcctttccgt cctcagccgt cgcttcatgt gactccacgg agtaccgggc gccgtccagg 960
cacctcgatt agttctcgag cttttggagt acgtcgtctt taggttgggg ggaggggttt 1020
tatgcgatgg agtttcccca cactgagtgg gtggagactg aagttaggcc agcttggcac 1080
ttgatgtaat tctccttgga atttgccctt tttgagtttg gatcttggtt cattctcaag 1140
cctcagacag tggttcaaag tttttttctt ccatttcagg tgtcgtgaaa actaccccta 1200
aaagccagga tccgatatcg tcgaccacca tggcctgtcc ttggaaattt ctgttcaaga 1260
ccaaattcca ccagtatgca atgaatgggg aaaaagacat caacaacaat gtggagaaag 1320
ccccctgtgc cacctccagt ccagtgacac aggatgacct tcagtatcac aacctcagca 1380
agcagcagaa tgagtccccg cagcccctcg tggagacggg aaagaagtct ccagaatctc 1440
tggtcaagct ggatgcaacc ccattgtcct ccccacggca tgtgaggatc aaaaactggg 1500
gcagcgggat gactttccaa gacacacttc accataaggc caaagggatt ttaacttgca 1560
ggtccaaatc ttgcctgggg tccattatga ctcccaaaag tttgaccaga ggacccaggg 1620
acaagcctac ccctccagat gagcttctac ctcaagctat cgaatttgtc aaccaatatt 1680
acggctcctt caaagaggca aaaatagagg aacatctggc cagggtggaa gcggtaacaa 1740
aggagataga aacaacagga acctaccaac tgacgggaga tgagctcatc ttcgccacca 1800
agcaggcctg gcgcaatgcc ccacgctgca ttgggaggat ccagtggtcc aacctgcagg 1860
tcttcgatgc ccgcagctgt tccactgccc gggaaatgtt tgaacacatc tgcagacacg 1920
tgcgttactc caccaacaat ggcaacatca ggtcggccat caccgtgttc ccccagcgga 1980
gtgatggcaa gcacgacttc cgggtgtgga atgctcagct catccgctat gctggctacc 2040
agatgccaga tggcagcatc agaggggacc ctgccaacgt ggaattcact cagctgtgca 2100
tcgacctggg ctggaagccc aagtacggcc gcttcgatgt ggtccccctg gtcctgcagg 2160
ccaatggccg tgaccctgag ctcttcgaaa tcccacctga ccttgtgctt gaggtggcca 2220
tggaacatcc caaatacgag tggtttcggg aactggagct aaagtggtac gccctgcctg 2280
cagtggccaa catgctgctt gaggtgggcg gcctggagtt cccagggtgc cccttcaatg 2340
gctggtacat gggcacagag atcggagtcc gggacttctg tgacgtccag cgctacaaca 2400
tcctggagga agtgggcagg agaatgggcc tggaaacgca caagctggcc tcgctctgga 2460
aagaccaggc tgtcgttgag atcaacattg ctgtgctcca tagtttccag aagcagaatg 2520
tgaccatcat ggaccaccac tcggctgcag aatccttcat gaagtacatg cagaatgaat 2580
accggtcccg tgggggctgc ccggcagact ggatttggct ggtccctccc atgtctggga 2640
gcatcacccc cgtgtttcac caggagatgc tgaactacgt cctgtcccct ttctactact 2700
atcaggtaga ggcctggaaa acccatgtct ggcaggacga gaagcggaga cccaagagaa 2760
gagagattcc attgaaagtc ttggtcaaag ctgtgctctt tgcctgtatg ctgatgcgca 2820
agacaatggc gtcccgagtc agagtcacca tcctctttgc gacagagaca ggaaaatcag 2880
aggcgctggc ctgggacctg ggggccttat tcagctgtgc cttcaacccc aaggttgtct 2940
gcatggataa gtacaggctg agctgcctgg aggaggaacg gctgctgttg gtggtgacca 3000
gtacgtttgg caatggagac tgccctggca atggagagaa actgaagaaa tcgctcttca 3060
tgctgaaaga gctcaacaac aaattcaggt acgctgtgtt tggcctcggc tccagcatgt 3120
accctcggtt ctgcgccttt gctcatgaca ttgatcagaa gctgtcccac ctgggggcct 3180
ctcagctcac cccgatggga gaaggggatg agctcagtgg gcaggaggac gccttccgca 3240
gctgggccgt gcaaaccttc aaggcagcct gtgagacgtt tgatgtccga ggcaaacagc 3300
acattcagat ccccaagctc tacacctcca atgtgacctg ggacccgcac cactacaggc 3360
tcgtgcagga ctcacagcct ttggacctca gcaaagccct cagcagcatg catgccaaga 3420
acgtgttcac catgaggctc aaatctcggc agaatctaca aagtccgaca tccagccgtg 3480
ccaccatcct ggtggaactc tcctgtgagg atggccaagg cctgaactac ctgccggggg 3540
agcaccttgg ggtttgccca ggcaaccagc cggccctggt ccaaggtatc ctggagcgag 3600
tggtggatgg ccccacaccc caccagacag tgcgcctgga ggccctggat gagagtggca 3660
gctactgggt cagtgacaag aggctgcccc cctgctcact cagccaggcc ctcacctact 3720
tcctggacat caccacaccc ccaacccagc tgctgctcca aaagctggcc caggtggcca 3780
cagaagagcc tgagagacag aggctggagg ccctgtgcca gccctcagag tacagcaagt 3840
ggaagttcac caacagcccc acattcctgg aggtgctaga ggagttcccg tccctgcggg 3900
tgtctgctgg cttcctgctt tcccagctcc ccattctgaa gcccaggttc tactccatca 3960
gctcctcccg ggatcacacg cccacagaga tccacctgac tgtggccgtg gtcacctacc 4020
acacccgaga tggccagggt cccctgcacc acggcgtctg cagcacatgg ctcaacagcc 4080
tgaagcccca agacccagtg ccctgctttg tgcggaatgc cagcggcttc cacctccccg 4140
aggatccctc ccatccttgc atcctcatcg ggcctggcac aggcatcgcg cccttccgca 4200
gtttctggca gcaacggctc catgactccc agcacaaggg agtgcgggga ggccgcatga 4260
ccttggtgtt tgggtgccgc cgcccagatg aggaccacat ctaccaggag gagatgctgg 4320
agatggccca gaagggggtg ctgcatgcgg tgcacacagc ctattcccgc ctgcctggca 4380
agcccaaggt ctatgttcag gacatcctgc ggcagcagct ggccagcgag gtgctccgtg 4440
tgctccacaa ggagccaggc cacctctatg tttgcgggga tgtgcgcatg gcccgggacg 4500
tggcccacac cctgaagcag ctggtggctg ccaagctgaa attgaatgag gagcaggtcg 4560
aggactattt ctttcagctc aagagccaga agcgctatca cgaagatatc tttggtgctg 4620
tatttcctta cgaggcgaag aaggacaggg tggcggtgca gcccagcagc ctggagatgt 4680
cagcgctctg aggtaccgaa ttccctgtga cccctcccca gtgcctctcc tggccctgga 4740
agttgccact ccagtgccca ccagccttgt cctaataaaa ttaagttgca tcattttgtc 4800
tgactaggtg tccttctata atattatggg gtggaggggg gtggtatgga gcaaggggca 4860
agttgggaag acaacctgta gggcctgcgg ggtctattgg gaaccaagct ggagtgcagt 4920
ggcacaatct tggctcactg caatctccgc ctcctgggtt caagcgattc tcctgcctca 4980
gcctcccgag ttgttgggat tccaggcatg catgaccagg ctcagctaat ttttgttttt 5040
ttggtagaga cggggtttca ccatattggc caggctggtc tccaactcct aatctcaggt 5100
gatctaccca ccttggcctc ccaaattgct gggattacag gcgtgaacca ctgctccctt 5160
ccctgtcctt acgcgtagaa ttggtaaaga gagtcgtgta aaatatcgag ttcgcacatc 5220
ttgttgtctg attattgatt tttggcgaaa ccatttgatc atatgacaag atgtgtatct 5280
accttaactt aatgattttg ataaaaatca ttaactagtc catggctgcc tcgcgcgttt 5340
cggtgatgac ggtgaaaacc tctgacacat gcagctcccg gagacggtca cagcttgtct 5400
gtaagcggat gccgggagca gacaagcccg tcagggcgcg tcagcgggtg ttggcgggtg 5460
tcggggcgca gccatgaccc agtcacgtag cgatagcgga gtgtatactg gcttaactat 5520
gcggcatcag agcagattgt actgagagtg caccatatgc ggtgtgaaat accgcacaga 5580
tgcgtaagga gaaaataccg catcaggcgc tcttccgctt cctcgctcac tgactcgctg 5640
cgctcggtcg ttcggctgcg gcgagcggta tcagctcact caaaggcggt aatacggtta 5700
tccacagaat caggggataa cgcaggaaag aacatgtgag caaaaggcca gcaaaaggcc 5760
aggaaccgta aaaaggccgc gttgctggcg tttttccata ggctccgccc ccctgacgag 5820
catcacaaaa atcgacgctc aagtcagagg tggcgaaacc cgacaggact ataaagatac 5880
caggcgtttc cccctggaag ctccctcgtg cgctctcctg ttccgaccct gccgcttacc 5940
ggatacctgt ccgcctttct cccttcggga agcgtggcgc tttctcatag ctcacgctgt 6000
aggtatctca gttcggtgta ggtcgttcgc tccaagctgg gctgtgtgca cgaacccccc 6060
gttcagcccg accgctgcgc cttatccggt aactatcgtc ttgagtccaa cccggtaaga 6120
cacgacttat cgccactggc agcagccact ggtaacagga ttagcagagc gaggtatgta 6180
ggcggtgcta cagagttctt gaagtggtgg cctaactacg gctacactag aagaacagta 6240
tttggtatct gcgctctgct gaagccagtt accttcggaa aaagagttgg tagctcttga 6300
tccggcaaac aaaccaccgc tggtagcggt ggtttttttg tttgcaagca gcagattacg 6360
cgcagaaaaa aaggatctca agaagatcct ttgatctttt ctacggggtc tgacgctcag 6420
tggaacgaaa actcacgtta agggattttg gtcatgagat tatcaaaaag gatcttcacc 6480
tagatccttt taaattaaaa atgaagtttt aaatcaatct aaagtatata tgagtaaact 6540
tggtctgaca gttaccaatg cttaatcagt gaggcaccta tctcagcgat ctgtctattt 6600
cgttcatcca tagttgcctg actcc 6625
<210> 2
<211> 6774
<212> DNA
<213> Homo Sapiens
<400> 2
cgtgaggctc cggtgcccgt cagtgggcag agcgcacatc gcccacagtc cccgagaagt 60
tggggggagg ggtcggcaat tgaaccggtg cctagagaaa gtggcgcggg gtaaactggg 120
aaagtgatgt cgtgtactgg ctccgccttt ttcccgaggg tgggggagaa ccgtatataa 180
gtgcagtagt cgccgtgaac gttctttttc gcaacgggtt tgccgccaga acacaggtaa 240
gtgccgtgtg tggttcccgc gggcctggcc tctttacggg ttatggccct tgcgtgcctt 300
gaattacttc cacgcccctg gctgcagtac gtgattcttg atcccgagct tcgggttgga 360
agtgggtggg agagttcgag gccttgcgct taaggagccc cttcgcctcg tgcttgagtt 420
gaggcctggc ttgggcgctg gggccgccgc gtgcgaatct ggtggcacct tcgcgcctgt 480
ctcgctgctt tcgataagtc tctagccatt taaaattttt gatgacctgc tgcgacgctt 540
tttttctggc aagatagtct tgtaaatgcg ggccaagatc tgcacactgg tatttcggtt 600
tttggggccg cgggcggcga cggggcccgt gcgtcccagc gcacatgttc ggcgaggcgg 660
ggcctgcgag cgcggccacc gagaatcgga cgggggtagt ctcaagctgg ccggcctgct 720
ctggtgcctg gcctcgcgcc gccgtgtatc gccccgccct gggcggcaag gctggcccgg 780
tcggcaccag ttgcgtgagc ggaaagatgg ccgcttcccg gccctgctgc agggagctca 840
aaatggagga cgcggcgctc gggagagcgg gcgggtgagt cacccacaca aaggaaaagg 900
gcctttccgt cctcagccgt cgcttcatgt gactccacgg agtaccgggc gccgtccagg 960
cacctcgatt agttctcgag cttttggagt acgtcgtctt taggttgggg ggaggggttt 1020
tatgcgatgg agtttcccca cactgagtgg gtggagactg aagttaggcc agcttggcac 1080
ttgatgtaat tctccttgga atttgccctt tttgagtttg gatcttggtt cattctcaag 1140
cctcagacag tggttcaaag tttttttctt ccatttcagg tgtcgtgaaa actaccccta 1200
aaagccagga tccgatatcg tcgacaagct tccaccatgg gcaacttgaa gagcgtggcc 1260
caggagcctg ggccaccctg cggcctgggg ctggggctgg gccttgggct gtgcggcaag 1320
cagggcccag ccaccccggc ccctgagccc agccgggccc cagcatccct actcccacca 1380
gcgccagaac acagcccccc gagctccccg ctaacccagc ccccagaggg gcccaagttc 1440
cctcgtgtga agaactggga ggtggggagc atcacctatg acaccctcag cgcccaggcg 1500
cagcaggatg ggccctgcac cccaagacgc tgcctgggct ccctggtatt tccacggaaa 1560
ctacagggcc ggccctcccc cggccccccg gcccctgagc agctgctgag tcaggcccgg 1620
gacttcatca accagtacta cagctccatt aagaggagcg gctcccaggc ccacgaacag 1680
cggcttcaag aggtggaagc cgaggtggca gccacaggca cctaccagct tagggagagc 1740
gagctggtgt tcggggctaa gcaggcctgg cgcaacgctc cccgctgcgt gggccggatc 1800
cagtggggga agctgcaggt gttcgatgcc cgggactgca ggtctgcaca ggaaatgttc 1860
acctacatct gcaaccacat caagtatgcc accaaccggg gcaaccttcg ctcggccatc 1920
acagtgttcc cgcagcgctg ccctggccga ggagacttcc gaatctggaa cagccagctg 1980
gtgcgctacg cgggctaccg gcagcaggac ggctctgtgc ggggggaccc agccaacgtg 2040
gagatcaccg agctctgcat tcagcacggc tggaccccag gaaacggtcg cttcgacgtg 2100
ctgcccctgc tgctgcaggc cccagatgat cccccagaac tcttccttct gccccccgag 2160
ctggtccttg aggtgcccct ggagcacccc acgctggagt ggtttgcagc cctgggcctg 2220
cgctggtacg ccctcccggc agtgtccaac atgctgctgg aaattggggg cctggagttc 2280
cccgcagccc ccttcagtgg ctggtacatg agcactgaga tcggcacgag gaacctgtgt 2340
gaccctcacc gctacaacat cctggaggat gtggctgtct gcatggacct ggatacccgg 2400
accacctcgt ccctgtggaa agacaaggca gcagtggaaa tcaacgtggc cgtgctgcac 2460
agttaccagc tagccaaagt caccatcgtg gaccaccacg ccgccacggc ctctttcatg 2520
aagcacctgg agaatgagca gaaggccagg gggggctgcc ctgcagactg ggcctggatc 2580
gtgcccccca tctcgggcag cctcactcct gttttccatc aggagatggt caactatttc 2640
ctgtccccgg ccttccgcta ccagccagac ccctggaagg ggagtgccgc caagggcacc 2700
ggcatcacca ggaagaagac ctttaaagaa gtggccaacg ccgtgaagat ctccgcctcg 2760
ctcatgggca cggtgatggc gaagcgagtg aaggcgacaa tcctgtatgg ctccgagacc 2820
ggccgggccc agagctacgc acagcagctg gggagactct tccggaaggc ttttgatccc 2880
cgggtcctgt gtatggatga gtatgacgtg gtgtccctcg aacacgagac gctggtgctg 2940
gtggtaacca gcacatttgg gaatggggat cccccggaga atggagagag ctttgcagct 3000
gccctgatgg agatgtccgg cccctacaac agctcccctc ggccggaaca gcacaagagt 3060
tataagatcc gcttcaacag catctcctgc tcagacccac tggtgtcctc ttggcggcgg 3120
aagaggaagg agtccagtaa cacagacagt gcaggggccc tgggcaccct caggttctgt 3180
gtgttcgggc tcggctcccg ggcatacccc cacttctgcg cctttgctcg tgcggtggac 3240
acacggctgg aggaactggg cggggagcgg ctgctgcagc tgggccaggg cgacgagctg 3300
tgcggccagg aggaggcctt ccgaggctgg gcccaggctg ccttccaggc cgcctgtgag 3360
accttctgtg tgggagagga tgccaaggcc gccgcccgag acatcttcag ccccaaacgg 3420
agctggaagc gccagaggta ccggctgagc gcccaggccg agggcctgca gttgctgcca 3480
ggtctgatcc acgtgcacag gcggaagatg ttccaggcta caatccgctc agtggaaaac 3540
ctgcaaagca gcaagtccac gagggccacc atcctggtgc gcctggacac cggaggccag 3600
gaggggctgc agtaccagcc gggggaccac ataggtgtct gcccgcccaa ccggcccggc 3660
cttgtggagg cgctgctgag ccgcgtggag gacccgccgg cgcccactga gcccgtggca 3720
gtagagcagc tggagaaggg cagccctggt ggccctcccc ccggctgggt gcgggacccc 3780
cggctgcccc cgtgcacgct gcgccaggct ctcaccttct tcctggacat cacctcccca 3840
cccagccctc agctcttgcg gctgctcagc accttggcag aagagcccag ggaacagcag 3900
gagctggagg ccctcagcca ggatccccga cgctacgagg agtggaagtg gttccgctgc 3960
cccacgctgc tggaggtgct ggagcagttc ccgtcggtgg cgctgcctgc cccactgctc 4020
ctcacccagc tgcctctgct ccagccccgg tactactcag tcagctcggc acccagcacc 4080
cacccaggag agatccacct cactgtagct gtgctggcat acaggactca ggatgggctg 4140
ggccccctgc actatggagt ctgctccacg tggctaagcc agctcaagcc cggagaccct 4200
gtgccctgct tcatccgggg ggctccctcc ttccggctgc cacccgatcc cagcttgccc 4260
tgcatcctgg tgggtccagg cactggcatt gcccccttcc ggggattctg gcaggagcgg 4320
ctgcatgaca ttgagagcaa agggctgcag cccactccca tgactttggt gttcggctgc 4380
cgatgctccc aacttgacca tctctaccgc gacgaggtgc agaacgccca gcagcgcggg 4440
gtgtttggcc gagtcctcac cgccttctcc cgggaacctg acaaccccaa gacctacgtg 4500
caggacatcc tgaggacgga gctggctgcg gaggtgcacc gcgtgctgtg cctcgagcgg 4560
ggccacatgt ttgtctgcgg cgatgttacc atggcaacca acgtcctgca gaccgtgcag 4620
cgcatcctgg cgacggaggg cgacatggag ctggacgagg ccggcgacgt catcggcgtg 4680
ctgcgggatc agcaacgcta ccacgaagac attttcgggc tcacgctgcg cacccaggag 4740
gtgacaagcc gcatacgcac ccagagcttt tccttgcagg agcgtcagtt gcggggcgca 4800
gtgccctggg cgttcgaccc tcccggctca gacaccaaca gcccctgaat tccctgtgac 4860
ccctccccag tgcctctcct ggccctggaa gttgccactc cagtgcccac cagccttgtc 4920
ctaataaaat taagttgcat cattttgtct gactaggtgt ccttctataa tattatgggg 4980
tggagggggg tggtatggag caaggggcaa gttgggaaga caacctgtag ggcctgcggg 5040
gtctattggg aaccaagctg gagtgcagtg gcacaatctt ggctcactgc aatctccgcc 5100
tcctgggttc aagcgattct cctgcctcag cctcccgagt tgttgggatt ccaggcatgc 5160
atgaccaggc tcagctaatt tttgtttttt tggtagagac ggggtttcac catattggcc 5220
aggctggtct ccaactccta atctcaggtg atctacccac cttggcctcc caaattgctg 5280
ggattacagg cgtgaaccac tgctcccttc cctgtcctta cgcgtagaat tggtaaagag 5340
agtcgtgtaa aatatcgagt tcgcacatct tgttgtctga ttattgattt ttggcgaaac 5400
catttgatca tatgacaaga tgtgtatcta ccttaactta atgattttga taaaaatcat 5460
taactagtcc atggctgcct cgcgcgtttc ggtgatgacg gtgaaaacct ctgacacatg 5520
cagctcccgg agacggtcac agcttgtctg taagcggatg ccgggagcag acaagcccgt 5580
cagggcgcgt cagcgggtgt tggcgggtgt cggggcgcag ccatgaccca gtcacgtagc 5640
gatagcggag tgtatactgg cttaactatg cggcatcaga gcagattgta ctgagagtgc 5700
accatatgcg gtgtgaaata ccgcacagat gcgtaaggag aaaataccgc atcaggcgct 5760
cttccgcttc ctcgctcact gactcgctgc gctcggtcgt tcggctgcgg cgagcggtat 5820
cagctcactc aaaggcggta atacggttat ccacagaatc aggggataac gcaggaaaga 5880
acatgtgagc aaaaggccag caaaaggcca ggaaccgtaa aaaggccgcg ttgctggcgt 5940
ttttccatag gctccgcccc cctgacgagc atcacaaaaa tcgacgctca agtcagaggt 6000
ggcgaaaccc gacaggacta taaagatacc aggcgtttcc ccctggaagc tccctcgtgc 6060
gctctcctgt tccgaccctg ccgcttaccg gatacctgtc cgcctttctc ccttcgggaa 6120
gcgtggcgct ttctcatagc tcacgctgta ggtatctcag ttcggtgtag gtcgttcgct 6180
ccaagctggg ctgtgtgcac gaaccccccg ttcagcccga ccgctgcgcc ttatccggta 6240
actatcgtct tgagtccaac ccggtaagac acgacttatc gccactggca gcagccactg 6300
gtaacaggat tagcagagcg aggtatgtag gcggtgctac agagttcttg aagtggtggc 6360
ctaactacgg ctacactaga agaacagtat ttggtatctg cgctctgctg aagccagtta 6420
ccttcggaaa aagagttggt agctcttgat ccggcaaaca aaccaccgct ggtagcggtg 6480
gtttttttgt ttgcaagcag cagattacgc gcagaaaaaa aggatctcaa gaagatcctt 6540
tgatcttttc tacggggtct gacgctcagt ggaacgaaaa ctcacgttaa gggattttgg 6600
tcatgagatt atcaaaaagg atcttcacct agatcctttt aaattaaaaa tgaagtttta 6660
aatcaatcta aagtatatat gagtaaactt ggtctgacag ttaccaatgc ttaatcagtg 6720
aggcacctat ctcagcgatc tgtctatttc gttcatccat agttgcctga ctcc 6774
<210> 3
<211> 3652
<212> DNA
<213> Homo Sapiens
<400> 3
cgtgaggctc cggtgcccgt cagtgggcag agcgcacatc gcccacagtc cccgagaagt 60
tggggggagg ggtcggcaat tgaaccggtg cctagagaaa gtggcgcggg gtaaactggg 120
aaagtgatgt cgtgtactgg ctccgccttt ttcccgaggg tgggggagaa ccgtatataa 180
gtgcagtagt cgccgtgaac gttctttttc gcaacgggtt tgccgccaga acacaggtaa 240
gtgccgtgtg tggttcccgc gggcctggcc tctttacggg ttatggccct tgcgtgcctt 300
gaattacttc cacgcccctg gctgcagtac gtgattcttg atcccgagct tcgggttgga 360
agtgggtggg agagttcgag gccttgcgct taaggagccc cttcgcctcg tgcttgagtt 420
gaggcctggc ttgggcgctg gggccgccgc gtgcgaatct ggtggcacct tcgcgcctgt 480
ctcgctgctt tcgataagtc tctagccatt taaaattttt gatgacctgc tgcgacgctt 540
tttttctggc aagatagtct tgtaaatgcg ggccaagatc tgcacactgg tatttcggtt 600
tttggggccg cgggcggcga cggggcccgt gcgtcccagc gcacatgttc ggcgaggcgg 660
ggcctgcgag cgcggccacc gagaatcgga cgggggtagt ctcaagctgg ccggcctgct 720
ctggtgcctg gcctcgcgcc gccgtgtatc gccccgccct gggcggcaag gctggcccgg 780
tcggcaccag ttgcgtgagc ggaaagatgg ccgcttcccg gccctgctgc agggagctca 840
aaatggagga cgcggcgctc gggagagcgg gcgggtgagt cacccacaca aaggaaaagg 900
gcctttccgt cctcagccgt cgcttcatgt gactccacgg agtaccgggc gccgtccagg 960
cacctcgatt agttctcgag cttttggagt acgtcgtctt taggttgggg ggaggggttt 1020
tatgcgatgg agtttcccca cactgagtgg gtggagactg aagttaggcc agcttggcac 1080
ttgatgtaat tctccttgga atttgccctt tttgagtttg gatcttggtt cattctcaag 1140
cctcagacag tggttcaaag tttttttctt ccatttcagg tgtcgtgaaa actaccccta 1200
aaagccagga tccaccatgg acaccagaaa taaggcccag ctccttgtgc tcctgactct 1260
tctcagtgtg ctcttctcac agacttcggc atggcctctt tacagggcac cttctgctct 1320
caggttgggt gacagaatac cctttgaggg agcaaatgaa cctgatcaag tttcattaaa 1380
agaagacatt gacatgttgc aaaatgcatt agctgaaaat gacacaccct attatgatgt 1440
atccagaaat gccaggcatg ctgatggagt tttcaccagt gacttcagta aactcttggg 1500
tcaactttct gccaaaaagt accttgagtc tcttatggga aaacgtgtta gtaacatctc 1560
agaagaccct gtaccagtca aacgtcactc agatgcagtc ttcactgaca actatacccg 1620
ccttagaaaa caaatggctg taaagaaata tttgaactca attctgaatg gaaagaggag 1680
cagtgaggga gaatctcccg actttccaga agagttagaa aaatgaattc cctgtgaccc 1740
ctccccagtg cctctcctgg ccctggaagt tgccactcca gtgcccacca gccttgtcct 1800
aataaaatta agttgcatca ttttgtctga ctaggtgtcc ttctataata ttatggggtg 1860
gaggggggtg gtatggagca aggggcaagt tgggaagaca acctgtaggg cctgcggggt 1920
ctattgggaa ccaagctgga gtgcagtggc acaatcttgg ctcactgcaa tctccgcctc 1980
ctgggttcaa gcgattctcc tgcctcagcc tcccgagttg ttgggattcc aggcatgcat 2040
gaccaggctc agctaatttt tgtttttttg gtagagacgg ggtttcacca tattggccag 2100
gctggtctcc aactcctaat ctcaggtgat ctacccacct tggcctccca aattgctggg 2160
attacaggcg tgaaccactg ctcccttccc tgtccttacg cgtagaattg gtaaagagag 2220
tcgtgtaaaa tatcgagttc gcacatcttg ttgtctgatt attgattttt ggcgaaacca 2280
tttgatcata tgacaagatg tgtatctacc ttaacttaat gattttgata aaaatcatta 2340
actagtccat ggctgcctcg cgcgtttcgg tgatgacggt gaaaacctct gacacatgca 2400
gctcccggag acggtcacag cttgtctgta agcggatgcc gggagcagac aagcccgtca 2460
gggcgcgtca gcgggtgttg gcgggtgtcg gggcgcagcc atgacccagt cacgtagcga 2520
tagcggagtg tatactggct taactatgcg gcatcagagc agattgtact gagagtgcac 2580
catatgcggt gtgaaatacc gcacagatgc gtaaggagaa aataccgcat caggcgctct 2640
tccgcttcct cgctcactga ctcgctgcgc tcggtcgttc ggctgcggcg agcggtatca 2700
gctcactcaa aggcggtaat acggttatcc acagaatcag gggataacgc aggaaagaac 2760
atgtgagcaa aaggccagca aaaggccagg aaccgtaaaa aggccgcgtt gctggcgttt 2820
ttccataggc tccgcccccc tgacgagcat cacaaaaatc gacgctcaag tcagaggtgg 2880
cgaaacccga caggactata aagataccag gcgtttcccc ctggaagctc cctcgtgcgc 2940
tctcctgttc cgaccctgcc gcttaccgga tacctgtccg cctttctccc ttcgggaagc 3000
gtggcgcttt ctcatagctc acgctgtagg tatctcagtt cggtgtaggt cgttcgctcc 3060
aagctgggct gtgtgcacga accccccgtt cagcccgacc gctgcgcctt atccggtaac 3120
tatcgtcttg agtccaaccc ggtaagacac gacttatcgc cactggcagc agccactggt 3180
aacaggatta gcagagcgag gtatgtaggc ggtgctacag agttcttgaa gtggtggcct 3240
aactacggct acactagaag aacagtattt ggtatctgcg ctctgctgaa gccagttacc 3300
ttcggaaaaa gagttggtag ctcttgatcc ggcaaacaaa ccaccgctgg tagcggtggt 3360
ttttttgttt gcaagcagca gattacgcgc agaaaaaaag gatctcaaga agatcctttg 3420
atcttttcta cggggtctga cgctcagtgg aacgaaaact cacgttaagg gattttggtc 3480
atgagattat caaaaaggat cttcacctag atccttttaa attaaaaatg aagttttaaa 3540
tcaatctaaa gtatatatga gtaaacttgg tctgacagtt accaatgctt aatcagtgag 3600
gcacctatct cagcgatctg tctatttcgt tcatccatag ttgcctgact cc 3652
<210> 4
<211> 10327
<212> DNA
<213> Homo Sapiens
<400> 4
cgtgaggctc cggtgcccgt cagtgggcag agcgcacatc gcccacagtc cccgagaagt 60
tggggggagg ggtcggcaat tgaaccggtg cctagagaaa gtggcgcggg gtaaactggg 120
aaagtgatgt cgtgtactgg ctccgccttt ttcccgaggg tgggggagaa ccgtatataa 180
gtgcagtagt cgccgtgaac gttctttttc gcaacgggtt tgccgccaga acacaggtaa 240
gtgccgtgtg tggttcccgc gggcctggcc tctttacggg ttatggccct tgcgtgcctt 300
gaattacttc cacgcccctg gctgcagtac gtgattcttg atcccgagct tcgggttgga 360
agtgggtggg agagttcgag gccttgcgct taaggagccc cttcgcctcg tgcttgagtt 420
gaggcctggc ttgggcgctg gggccgccgc gtgcgaatct ggtggcacct tcgcgcctgt 480
ctcgctgctt tcgataagtc tctagccatt taaaattttt gatgacctgc tgcgacgctt 540
tttttctggc aagatagtct tgtaaatgcg ggccaagatc tgcacactgg tatttcggtt 600
tttggggccg cgggcggcga cggggcccgt gcgtcccagc gcacatgttc ggcgaggcgg 660
ggcctgcgag cgcggccacc gagaatcgga cgggggtagt ctcaagctgg ccggcctgct 720
ctggtgcctg gcctcgcgcc gccgtgtatc gccccgccct gggcggcaag gctggcccgg 780
tcggcaccag ttgcgtgagc ggaaagatgg ccgcttcccg gccctgctgc agggagctca 840
aaatggagga cgcggcgctc gggagagcgg gcgggtgagt cacccacaca aaggaaaagg 900
gcctttccgt cctcagccgt cgcttcatgt gactccacgg agtaccgggc gccgtccagg 960
cacctcgatt agttctcgag cttttggagt acgtcgtctt taggttgggg ggaggggttt 1020
tatgcgatgg agtttcccca cactgagtgg gtggagactg aagttaggcc agcttggcac 1080
ttgatgtaat tctccttgga atttgccctt tttgagtttg gatcttggtt cattctcaag 1140
cctcagacag tggttcaaag tttttttctt ccatttcagg tgtcgtgaaa actaccccta 1200
aaagccagga tccggtaccg aggagatctg ccgccgcgat cgccatggca aatggtggcg 1260
gcggcggcgg cggcagcagc ggcggcggcg gcggcggcgg aggcagcagt cttagaatga 1320
gtagcaatat ccacgcgaac catctcagcc tagacgcgtc ctcctcctcc tcctcctcct 1380
cttcctcttc ttcttcttcc tcctcctctt cctcctcgtc ctcggtccac gagcccaaga 1440
tggatgcgct catcatcccg gtgaccatgg aggtgccgtg cgacagccgg ggccaacgca 1500
tgtggtgggc tttcctggcc tcctccatgg tgactttctt cgggggcctc ttcatcatct 1560
tgctctggcg gacgctcaag tacctgtgga ccgtgtgctg ccactgcggg ggcaagacga 1620
aggaggccca gaagattaac aatggctcaa gccaggcgga tggcactctc aaaccagtgg 1680
atgaaaaaga ggaggcagtg gccgccgagg tcggctggat gacctccgtg aaggactggg 1740
cgggggtgat gatatccgcc cagacactga ctggcagagt cctggttgtc ttagtctttg 1800
ctctcagcat cggtgcactt gtaatatact tcatagattc atcaaaccca atagaatcct 1860
gccagaattt ctacaaagat ttcacattac agatcgacat ggctttcaac gtgttcttcc 1920
ttctctactt tggcttgcgg tttattgcag ccaacgataa attgtggttc tggctggaag 1980
tgaactctgt agtggatttc ttcacggtgc cccccgtgtt tgtgtctgtg tacttaaaca 2040
gaagttggct tggtttgaga tttttaagag ctctgagact gatacagttt tcagaaattt 2100
tgcagtttct gaatattctt aaaacaagta attccatcaa gctggtgaat ctgctctcca 2160
tatttatcag cacgtggctg actgcagccg ggttcatcca tttggtggag aattcagggg 2220
acccatggga aaatttccaa aacaaccagg ctctcaccta ctgggaatgt gtctatttac 2280
tcatggtcac aatgtccacc gttggttatg gggatgttta tgcaaaaacc acacttgggc 2340
gcctcttcat ggtcttcttc atcctcgggg gactggccat gtttgccagc tacgtccctg 2400
aaatcataga gttaatagga aaccgcaaga aatacggggg ctcctatagt gcggttagtg 2460
gaagaaagca cattgtggtc tgcggacaca tcactctgga gagtgtttcc aacttcctga 2520
aggactttct gcacaaggac cgggatgacg tcaatgtgga gatcgttttt cttcacaaca 2580
tctcccccaa cctggagctt gaagctctgt tcaaacgaca ttttactcag gtggaatttt 2640
atcagggttc cgtcctcaat ccacatgatc ttgcaagagt caagatagag tcagcagatg 2700
catgcctgat ccttgccaac aagtactgcg ctgacccgga tgcggaggat gcctcgaata 2760
tcatgagagt aatctccata aagaactacc atccgaagat aagaatcatc actcaaatgc 2820
tgcagtatca caacaaggcc catctgctaa acatcccgag ctggaattgg aaagaaggtg 2880
atgacgcaat ctgcctcgca gagttgaagt tgggcttcat agcccagagc tgcctggctc 2940
aaggcctctc caccatgctt gccaacctct tctccatgag gtcattcata aagattgagg 3000
aagacacatg gcagaaatac tacttggaag gagtctcaaa tgaaatgtac acagaatatc 3060
tctccagtgc cttcgtgggt ctgtccttcc ctactgtttg tgagctgtgt tttgtgaagc 3120
tcaagctcct aatgatagcc attgagtaca agtctgccaa ccgagagagc cgaagccgaa 3180
agcgtatatt aattaatcct ggaaaccatc ttaagatcca agaaggtact ttaggatttt 3240
tcatcgcaag tgatgccaaa gaagttaaaa gggcattttt ttactgcaag gcctgtcatg 3300
atgacatcac agatcccaaa agaataaaaa aatgtggctg caaacggctt gaagatgagc 3360
agccgtcaac actatcacca aaaaaaaagc aacggaatgg aggcatgcgg aactcaccca 3420
acacctcgcc taagctgatg aggcatgacc ccttgttaat tcctggcaat gatcagattg 3480
acaacatgga ctccaatgtg aagaagtacg actctactgg gatgtttcac tggtgtgcac 3540
ccaaggagat agagaaagtc atcctgactc gaagtgaagc tgccatgacc gtcctgagtg 3600
gccatgtcgt ggtctgcatc tttggcgacg tcagctcagc cctgatcggc ctccggaacc 3660
tggtgatgcc gctccgtgcc agcaactttc attaccatga gctcaagcac attgtgtttg 3720
tgggctctat tgagtacctc aagcgggaat gggagacgct tcataacttc cccaaagtgt 3780
ccatattgcc tggtacgcca ttaagtcggg ctgatttaag ggctgtcaac atcaacctct 3840
gtgacatgtg cgttatcctg tcagccaatc agaataatat tgatgatact tcgctgcagg 3900
acaaggaatg catcttggcg tcactcaaca tcaaatctat gcagtttgat gacagcatcg 3960
gagtcttgca ggctaattcc caagggttca cacctccagg aatggataga tcctctccag 4020
ataacagccc agtgcacggg atgttacgtc aaccatccat cacaactggg gtcaacatcc 4080
ccatcatcac tgaactggtg aacgatacta atgttcagtt tttggaccaa gacgatgatg 4140
atgaccctga tacagaactg tacctcacgc agccctttgc ctgtgggaca gcatttgccg 4200
tcagtgtcct ggactcactc atgagcgcga cgtacttcaa tgacaatatc ctcaccctga 4260
tacggaccct ggtgaccgga ggagccacgc cggagctgga ggctctgatt gctgaggaaa 4320
acgcccttag aggtggctac agcaccccgc agacactggc caatagggac cgctgccgcg 4380
tggcccagtt agctctgctc gatgggccat ttgcggactt aggggatggt ggttgttatg 4440
gtgatctgtt ctgcaaagct ctgaaaacat ataatatgct ttgttttgga atttaccggc 4500
tgagagatgc tcacctcagc acccccagtc agtgcacaaa gaggtatgtc atcaccaacc 4560
cgccctatga gtttgagctc gtgccgacgg acctgatctt ctgcttaatg cagtttgacc 4620
acaatgccgg ccagtcccgg gccagcctgt cccattcctc ccactcgtcg cagtcctcca 4680
gcaagaagag ctcctctgtt cactccatcc catccacagc aaaccgacag aaccggccca 4740
agtccaggga gtcccgggac aaacagaaca gaaaagaaat ggtttacaga taagcttggt 4800
accgaattcc ctgtgacccc tccccagtgc ctctcctggc cctggaagtt gccactccag 4860
tgcccaccag ccttgtccta ataaaattaa gttgcatcat tttgtctgac taggtgtcct 4920
tctataatat tatggggtgg aggggggtgg tatggagcaa ggggcaagtt gggaagacaa 4980
cctgtagggc ctgcggggtc tattgggaac caagctggag tgcagtggca caatcttggc 5040
tcactgcaat ctccgcctcc tgggttcaag cgattctcct gcctcagcct cccgagttgt 5100
tgggattcca ggcatgcatg accaggctca gctaattttt gtttttttgg tagagacggg 5160
gtttcaccat attggccagg ctggtctcca actcctaatc tcaggtgatc tacccacctt 5220
ggcctcccaa attgctggga ttacaggcgt gaaccactgc tcccttccct gtccttacgc 5280
gtagaattgg taaagagagt cgtgtaaaat atcgagttcg cacatcttgt tgtctgatta 5340
ttgatttttg gcgaaaccat ttgatcatat gacaagatgt gtatctacct taacttaatg 5400
attttgataa aaatcattaa ctagtccatg gctgcctcgc gcgtttcggt gatgacggtg 5460
aaaacctctg acacatgcag ctcccggaga cggtcacagc ttgtctgtaa gcggatgccg 5520
ggagcagaca agcccgtcag ggcgcgtcag cgggtgttgg cgggtgtcgg ggcgcagcca 5580
tgacccagtc acgtagcgat agcggagtgt atactggctt aactatgcgg catcagagca 5640
gattgtactg agagtgcacc atatgcggtg tgaaataccg cacagatgcg taaggagaaa 5700
ataccgcatc aggcgctctt ccgcttcctc gctcactgac tcgctgcgct cggtcgttcg 5760
gctgcggcga gcggtatcag ctcactcaaa ggcggtaata cggttatcca cagaatcagg 5820
ggataacgca ggaaagaaca tgtgagcaaa aggccagcaa aaggccagga accgtaaaaa 5880
ggccgcgttg ctggcgtttt tccataggct ccgcccccct gacgagcatc acaaaaatcg 5940
acgctcaagt cagaggtggc gaaacccgac aggactataa agataccagg cgtttccccc 6000
tggaagctcc ctcgtgcgct ctcctgttcc gaccctgccg cttaccggat acctgtccgc 6060
ctttctccct tcgggaagcg tggcgctttc tcatagctca cgctgtaggt atctcagttc 6120
ggtgtaggtc gttcgctcca agctgggctg tgtgcacgaa ccccccgttc agcccgaccg 6180
ctgcgcctta tccggtaact atcgtcttga gtccaacccg gtaagacacg acttatcgcc 6240
actggcagca gccactggta acaggattag cagagcgagg tatgtaggcg gtgctacaga 6300
gttcttgaag tggtggccta actacggcta cactagaaga acagtatttg gtatctgcgc 6360
tctgctgaag ccagttacct tcggaaaaag agttggtagc tcttgatccg gcaaacaaac 6420
caccgctggt agcggtggtt tttttgtttg caagcagcag attacgcgca gaaaaaaagg 6480
atctcaagaa gatcctttga tcttttctac ggggtctgac gctcagtgga acgaaaactc 6540
acgttaaggg attttggtca tgagattatc aaaaaggatc ttcacctaga tccttttaaa 6600
ttaaaaatga agttttaaat caatctaaag tatatatgag taaacttggt ctgacagtta 6660
ccaatgctta atcagtgagg cacctatctc agcgatctgt ctatttcgtt catccatagt 6720
tgcctgactc csdnvtvacg rcgtgaggct ccggtgcccg tcagtgggca gagcgcacat 6780
cgcccacagt ccccgagaag ttggggggag gggtcggcaa ttgaaccggt gcctagagaa 6840
agtggcgcgg ggtaaactgg gaaagtgatg tcgtgtactg gctccgcctt tttcccgagg 6900
gtgggggaga accgtatata agtgcagtag tcgccgtgaa cgttcttttt cgcaacgggt 6960
ttgccgccag aacacaggta agtgccgtgt gtggttcccg cgggcctggc ctctttacgg 7020
gttatggccc ttgcgtgcct tgaattactt ccacgcccct ggctgcagta cgtgattctt 7080
gatcccgagc ttcgggttgg aagtgggtgg gagagttcga ggccttgcgc ttaaggagcc 7140
ccttcgcctc gtgcttgagt tgaggcctgg cttgggcgct ggggccgccg cgtgcgaatc 7200
tggtggcacc ttcgcgcctg tctcgctgct ttcgataagt ctctagccat ttaaaatttt 7260
tgatgacctg ctgcgacgct ttttttctgg caagatagtc ttgtaaatgc gggccaagat 7320
ctgcacactg gtatttcggt ttttggggcc gcgggcggcg acggggcccg tgcgtcccag 7380
cgcacatgtt cggcgaggcg gggcctgcga gcgcggccac cgagaatcgg acgggggtag 7440
tctcaagctg gccggcctgc tctggtgcct ggcctcgcgc cgccgtgtat cgccccgccc 7500
tgggcggcaa ggctggcccg gtcggcacca gttgcgtgag cggaaagatg gccgcttccc 7560
ggccctgctg cagggagctc aaaatggagg acgcggcgct cgggagagcg ggcgggtgag 7620
tcacccacac aaaggaaaag ggcctttccg tcctcagccg tcgcttcatg tgactccacg 7680
gagtaccggg cgccgtccag gcacctcgat tagttctcga gcttttggag tacgtcgtct 7740
ttaggttggg gggaggggtt ttatgcgatg gagtttcccc acactgagtg ggtggagact 7800
gaagttaggc cagcttggca cttgatgtaa ttctccttgg aatttgccct ttttgagttt 7860
ggatcttggt tcattctcaa gcctcagaca gtggttcaaa gtttttttct tccatttcag 7920
gtgtcgtgaa aactacccct aaaagccagg atccggacgt catggaagtg aaggatgcca 7980
attctgcgct tctcagtaac tacgaggtat ttcagttact aactgatctg aaagagcagc 8040
gtaaagaaag tggaaagaat aaacacagct ctgggcaaca gaacttgaac actatcacct 8100
atgaaacgtt aaaatacata tcaaaaacac catgcaggca ccagagtcct gaaattgtca 8160
gagaatttct cacagcattg aaaagccaca agttgaccaa agctgagaag ctccagctgc 8220
tgaaccaccg gcctgtgact gctgtggaga tccagctgat ggtggaagag agtgaagagc 8280
ggctcacgga ggagcagatt gaagctcttc tccacaccgt caccagcatt ctgcctgcag 8340
agccagaggc tgagcagaag aagaatacaa acagcaatgt ggcaatggac gaagaggacc 8400
cagcatagga attccctgtg acccctcccc agtgcctctc ctggccctgg aagttgccac 8460
tccagtgccc accagccttg tcctaataaa attaagttgc atcattttgt ctgactaggt 8520
gtccttctat aatattatgg ggtggagggg ggtggtatgg agcaaggggc aagttgggaa 8580
gacaacctgt agggcctgcg gggtctattg ggaaccaagc tggagtgcag tggcacaatc 8640
ttggctcact gcaatctccg cctcctgggt tcaagcgatt ctcctgcctc agcctcccga 8700
gttgttggga ttccaggcat gcatgaccag gctcagctaa tttttgtttt tttggtagag 8760
acggggtttc accatattgg ccaggctggt ctccaactcc taatctcagg tgatctaccc 8820
accttggcct cccaaattgc tgggattaca ggcgtgaacc actgctccct tccctgtcct 8880
tacgcgtaga attggtaaag agagtcgtgt aaaatatcga gttcgcacat cttgttgtct 8940
gattattgat ttttggcgaa accatttgat catatgacaa gatgtgtatc taccttaact 9000
taatgatttt gataaaaatc attaactagt ccatggctgc ctcgcgcgtt tcggtgatga 9060
cggtgaaaac ctctgacaca tgcagctccc ggagacggtc acagcttgtc tgtaagcgga 9120
tgccgggagc agacaagccc gtcagggcgc gtcagcgggt gttggcgggt gtcggggcgc 9180
agccatgacc cagtcacgta gcgatagcgg agtgtatact ggcttaacta tgcggcatca 9240
gagcagattg tactgagagt gcaccatatg cggtgtgaaa taccgcacag atgcgtaagg 9300
agaaaatacc gcatcaggcg ctcttccgct tcctcgctca ctgactcgct gcgctcggtc 9360
gttcggctgc ggcgagcggt atcagctcac tcaaaggcgg taatacggtt atccacagaa 9420
tcaggggata acgcaggaaa gaacatgtga gcaaaaggcc agcaaaaggc caggaaccgt 9480
aaaaaggccg cgttgctggc gtttttccat aggctccgcc cccctgacga gcatcacaaa 9540
aatcgacgct caagtcagag gtggcgaaac ccgacaggac tataaagata ccaggcgttt 9600
ccccctggaa gctccctcgt gcgctctcct gttccgaccc tgccgcttac cggatacctg 9660
tccgcctttc tcccttcggg aagcgtggcg ctttctcata gctcacgctg taggtatctc 9720
agttcggtgt aggtcgttcg ctccaagctg ggctgtgtgc acgaaccccc cgttcagccc 9780
gaccgctgcg ccttatccgg taactatcgt cttgagtcca acccggtaag acacgactta 9840
tcgccactgg cagcagccac tggtaacagg attagcagag cgaggtatgt aggcggtgct 9900
acagagttct tgaagtggtg gcctaactac ggctacacta gaagaacagt atttggtatc 9960
tgcgctctgc tgaagccagt taccttcgga aaaagagttg gtagctcttg atccggcaaa 10020
caaaccaccg ctggtagcgg tggttttttt gtttgcaagc agcagattac gcgcagaaaa 10080
aaaggatctc aagaagatcc tttgatcttt tctacggggt ctgacgctca gtggaacgaa 10140
aactcacgtt aagggatttt ggtcatgaga ttatcaaaaa ggatcttcac ctagatcctt 10200
ttaaattaaa aatgaagttt taaatcaatc taaagtatat atgagtaaac ttggtctgac 10260
agttaccaat gcttaatcag tgaggcacct atctcagcga tctgtctatt tcgttcatcc 10320
atagttg 10327
<---
--->
ПЕРЕЧЕНЬ ПОСЛЕДОВАТЕЛЬНОСТЕЙ ОЛИГОНУКЛЕОТИДОВ
SEQ ID NO:6 NOS2_FATCGTCGACCACCATGGCCTGTCCTTGGAAATTTC
SEQ ID NO:7 NOS2_RCGGTACCTCAGAGCGCTGACATCTCCAGG
SEQ ID NO:8 NOS2_SFAACGTGTTCACCATGAGGCT
SEQ ID NO:9 NOS2_SRCTCTCAGGCTCTTCTGTGGC
SEQ ID NO:10 NOS3_FGACAAGCTTCCACCATGGGCAACTTGAAGAG
SEQ ID NO:11 NOS3_RGGAATTCAGGGGCTGTTGGTGTCTGAGCCG
SEQ ID NO:12 NOS3_SFGACCCACTGGTGTCCTCTTG
SEQ ID NO:13 NOS3_SRCTCCGTTTGGGGCTGAAGAT
SEQ ID NO:14 VIP_FAGGATCCACCATGGACACCAGAAATAAGGCCCAG
SEQ ID NO:15 VIP_RGGAATTCATTTTTCTAACTCTTCTGGAAAG
SEQ ID NO:16 VIP_SFCCTTCTGCTCTCAGGTTGGG
SEQ ID NO:17 VIP_SRCCCTCACTGCTCCTCTTTCC
SEQ ID NO:18 KCNMA1_F AGGATCCGGTACCGAGGAGATCTGCCGCCGCGATCGCCATG
SEQ ID NO:19 KCNMA1_R ACCAAGCTTATCTGTAAACCATTTCTTTTCTG
SEQ ID NO:20 KCNMA1_SFGAGAGAGCCGAAGCCGAAAG
SEQ ID NO:21 KCNMA1_SRACCCTTGGGAATTAGCCTGC
SEQ ID NO:22 CGRP_FAGGATCCGGACGTCATGGAAGTGAAGGATGCCAATT
SEQ ID NO:23 CGRP_R GGAATTCCTATGCTGGGTCCTCTTCGTCCATTG
SEQ ID NO:24 CGRP_SFACTGATCTGAAAGAGCAGCGT
SEQ ID NO:25 CGRP_SRAGAATGCTGGTGACGGTGTG
<---
Реферат
Изобретение относится к генной инженерии и может быть использовано в биотехнологии, медицине и сельском хозяйстве для создания препаратов генной терапии. Предложен генотерапевтический ДНК-вектор на основе генотерапевтического ДНК-вектора VTvaf17, несущий целевой ген, выбранный из группы генов NOS2, NOS3, VIP, KCNMA1, CGRP, для повышения уровня экспрессии этого целевого гена в организме человека и животных. При этом генотерапевтический ДНК-вектор VTvaf17-NOS2, или VTvaf17-NOS3, или VTvaf17-VIP, или VTvaf17-KCNMA1, или VTvaf17-CGRP имеет нуклеотидную последовательность SEQ ID №1 или SEQ ID №2 или SEQ ID №3 или SEQ ID №4 или SEQ ID №5 соответственно. Предложены также способ получения указанного вектора, применение вектора, штамм Escherichia coli, несущий указанный вектор, а также способ производства в промышленных масштабах указанного вектора. Изобретение может быть использовано для безопасного применения для генетической терапии человека и животных. 14 н. и 2 з.п. ф-лы, 22 пр., 16 ил.

Комментарии