Способ изготовления хирургического имплантата (варианты) и хирургический имплантат - RU2305514C2
Код документа: RU2305514C2
Чертежи





Описание
Настоящее изобретение относится к хирургическому имплантату и к способам его изготовления.
Существует множество различных типов хирургических имплантатов и устройств, включая ортопедические имплантаты (тазобедренного, плечевого, коленного, голеностопного, локтевого сустава), черепно-лицевые имплантаты и позвоночные имплантаты (такие как позвоночный каркас или позвоночный диск). Такие имплантаты обычно изготавливают из биологически совместимых металлов, таких как титан, сплавы на основе титана, нержавеющая сталь или кобальт-хромовые сплавы, в зависимости от соображений прочности и массы. Другим соображением, в частности, для имплантатов, которые замещают кость, является модуль упругости имплантата. Чем ближе модуль упругости имплантата к естественной кости, тем лучше перераспределение напряжения в прилегающую кость. Лучшее распределение напряжения приводит к более длительному сроку использования имплантата.
Известно, что для увеличения связывания окружающих тканей с имплантатом на поверхность имплантата наносят покрытие, например, путем плазменного напыления, которое придает поверхности имплантата шероховатость. Такое покрытие может иметь другой состав по сравнению с самим имплантатом для улучшения устойчивости к износу и/или для обеспечения улучшенной биологической совместимости (например, нитрид титана TiN является крайне инертным и может наноситься в качестве покрытия на имплантаты, содержащие алюминий или ванадий, для предотвращения выделения (выщелачивания) указанных металлов из имплантата.
Целью настоящего изобретения является предоставление усовершенствованного хирургического имплантата, который предпочтительно имеет улучшенную совместимость с костью и/или устойчивость к износу (сопротивление износу), и/или более длительный срок использования и/или является более прочным, чем известные имплантаты.
В соответствии с настоящим изобретением предложен хирургический имплантат, содержащий:
(i) область сердцевины и
(ii) пористую поверхностную область, простирающуюся поверх по меньшей мере части указанной области сердцевины,
причем пористая поверхностная область имеет заданную долю объема пор.
Следует понимать, что используемый здесь термин «доля объема пор» пористой области представляет собой отношение объема пор в данной области к общему объему данной области, выраженное в виде процентной доли.
Имплантат может иметь любую форму, что определяется его предполагаемым применением. Например, имплантат может быть удлиненным (например, цилиндрическим) или иметь форму диска. Имплантат может иметь неправильную форму, и пористая поверхностная область может варьироваться по толщине поверх области сердцевины.
Предпочтительно доля объема пор в пределах пористой поверхностной области составляет от 20 до 50%. Заданную долю объема пор выбирают в соответствии с природой имплантата. Более высокая доля объема пор приводит к получению более легкого имплантата с более низким модулем (упругости).
Предпочтительно поры взаимно соединены и, по существу, равномерно распределены в пределах пористой поверхностной области. Предпочтительно по меньшей мере некоторые (а предпочтительно - большинство) поры имеют размер в диапазоне от 100 мкм до около 750 мкм, а предпочтительнее - от около 200 мкм до 500 мкм.
Предпочтительно пористая поверхностная область имеет толщину по меньшей мере около 1 мм, а предпочтительнее она имеет толщину от около 2 мм до около 5 мм, наиболее предпочтительно толщину от 2 мм до 3 мм.
Различные области в пределах пористой поверхностной области могут иметь различное распределение размеров пор и/или различную долю объема пор, так что существует градиент размеров пор и/или доли объема пор в пределах пористой поверхностной области. Например, может существовать градиент доли объема пор вдоль оси имплантата и/или перпендикулярно оси имплантата.
Область сердцевины может быть полностью плотной или пористой. Степень пористости области сердцевины может быть больше, меньше или такой же, как и у поверхностной области.
Предпочтительно область сердцевины является относительно менее пористой, чем поверхностная область.
Предпочтительно область сердцевины имеет плотность от 0,7 до 1,0 от теоретической плотности (т.е. пористость от 0 до 30%).
Область сердцевины и пористую поверхностную область можно изготовить из одного и того же или из различных материалов. Особенно подходящие материалы включают титан (например, титан коммерческой чистоты [ASTM В 338 GR 2]), нержавеющую сталь, сплавы на основе титана (например, титан-алюминий-ванадиевые [Ti-Al-V] сплавы и титан-алюминий-ниобиевые [Ti-Al-Nb] сплавы) и сплавы на основе кобальта-хрома.
Особенно предпочтительными материалами являются титан коммерческой чистоты, сплавы Ti-6Al-4V, Ti-6Al-7Nb, Stellite 211 и нержавеющая сталь 316L.
Предпочтительно пористая поверхностная область диффузионно связана с областью сердцевины. Таким образом, следует понимать, что поверхность раздела между областью сердцевины и пористой поверхностной областью не привносит непрочность в имплантат, т.е. не является его слабым местом.
В соответствии со вторым аспектом настоящего изобретения предложен способ изготовления хирургического имплантата в соответствии с указанным первым аспектом, включающий в себя этапы:
(i) загрузки металлического порошка, имеющего заданное распределение размеров частиц, в герметизируемую капсулу вокруг предварительно сформированной (сформованной) сердцевины,
(ii) снижения давления внутри указанной капсулы до заданного давления ниже атмосферного давления,
(iii) создания повышенного давления в указанной капсуле технологическим газом до заданного давления, которое выше, чем заданное давление этапа (ii),
(iv) герметизации указанной капсулы,
(v) нагревания указанной герметизированной капсулы с созданным в ней повышенным давлением при повышенной температуре и повышенном давлении в течение заданного времени для изготовления заготовки (предшественника) имплантата,
(vi) охлаждения указанной герметизированной капсулы, и
(vii) нагревания указанной заготовки имплантата в течение заданного времени при повышенной температуре и заданном давлении ниже атмосферного давления для создания тем самым пористости в указанной заготовке имплантата.
Предпочтительно порошок, используемый на этапе (i), содержит частицы размером в диапазоне от около 50 мкм до около 750 мкм (т.е., по существу, все частицы находятся в пределах определенного здесь диапазона размеров). Порошок можно изготовить, например, распылением с помощью газа или механическим истиранием.
Подходящим является тот вариант, когда сердцевина может представлять собой единое целое с капсулой, хотя сердцевина может быть «свободно стоящей». В любом случае сердцевина может быть изготовлена из того же или из другого материала по отношению к порошку и из того же или из другого материала по отношению к остальной капсуле.
Предпочтительно заданное давление этапа (ii) составляет 10-3 мбар (0,1 Па) или менее. Предпочтительно заданное давление этапа (vii) составляет 10-3 мбар (0,1 Па) или менее.
Технологический газ этапа (iii) может представлять собой нереакционноспособный газ (например, аргон) или реакционноспособный газ (например, азот) или смесь реакционноспособного и нереакционноспособного газов, причем нереакционноспособный газ служит в качестве носителя или разбавителя реактивного газа. Когда в технологическом газе присутствует азот, поверхности сформированных в конечном счете пор становятся нитридированными (азотированными), увеличивая тем самым устойчивость к износу и химическую инертность. Использование азота особенно предпочтительно в том случае, когда металлический порошок содержит титан. В качестве альтернативы отдельный этап нитридирования можно провести после этапа (vii), предпочтительно при температуре от около 800°С до около 1000°С и при давлении от около 10 до около 100 МПа в течение от 1 до 8 часов.
Предпочтительно давление этапа (iii) составляет от около 1 бара (1·105 Па) до около 5 бар (5·105 Па) избыточного давления.
Предпочтительно повышенная температура этапа (v) составляет от около 850 до около 1100°С. Предпочтительно этап (v) проводят в течение периода времени от около 1 часа до около 4 часов.
На этапе (vi) герметизированную капсулу (и содержащуюся в ней заготовку имплантата) предпочтительно охлаждают до комнатной температуры. Этап (vii) можно выполнять на заготовке имплантата в капсуле. Альтернативно заготовку имплантата можно отделить от капсулы после этапа (vi) перед этапом (vii). Капсулу удобно удалить, например, путем механической обработки на токарном станке. Предпочтительно повышенная температура этапа (vii) составляет от около 900 до около 1300°С. Предпочтительно этап (vii) проводят в течение не более около 80 часов, предпочтительно не более около 60 часов, а еще предпочтительнее не более около 48 часов. Предпочтительно этап (vii) проводят в течение по меньшей мере 6 часов, а предпочтительнее в течение по меньшей мере 12 часов.
Если этап (vii) выполняют на заготовке имплантата, находящейся в капсуле, то капсулу отделяют от имплантата после этапа (vii), например, путем механической обработки.
Следует понимать, что имплантат, сформированный указанным выше способом, будет иметь форму внутренних поверхностей капсулы, так что могут потребоваться дополнительные этапы механической обработки для получения конечной желательной формы имплантата. Однако имплантат, имеющий, по существу, требуемую форму, можно изготовить с использованием капсулы, имеющей соответствующую форму внутренней поверхности. Примеры способов, которыми можно изготовить капсулу соответствующей формы, включают электроформовку и прямое лазерное изготовление.
В несколько модифицированном варианте указанного выше способа металлический порошок частично агломерируют перед помещением его в капсулу. Этого можно достичь, например, с помощью избирательного лазерного спекания смеси металлического порошка и полимерного связующего. Различные фракции порошка можно использовать для формирования различных областей имплантата, так что данный модифицированный вариант является особенно пригодным для изготовления имплантатов, имеющих градиент пористости в пределах пористой области.
В соответствии с третьим аспектом настоящего изобретения предложен еще один способ изготовления хирургического имплантата указанного первого аспекта, включающий в себя этапы:
(i) избирательного спекания последовательных слоев металлических частиц для формирования тем самым заготовки имплантата требуемой формы, и
(ii) нагревания указанной заготовки имплантата для формирования тем самым указанного имплантата.
Предпочтительно этап (ii) осуществляют при пониженном давлении, например, в вакуумной печи.
Этап (i) можно осуществить путем спекания частиц вокруг сердцевины. Предпочтительно указанная сердцевина имеет теоретическую плотность от 0,7 до 1,0 (т.е. имеет пористость от 0 до 30%). Однако сердцевина может иметь такую же, более высокую или более низкую плотность, чем полученная в итоге плотность пористой поверхностной области.
Предпочтительно, по существу, все указанные металлические частицы имеют размер 750 мкм или менее, предпочтительнее 500 мкм или менее, а наиболее предпочтительно 150 мкм или менее. Предпочтительно указанные частицы имеют размер по меньшей мере 50 мкм. Предпочтительно указанные металлические частицы находятся в смеси со связующим, таким как чувствительное к свету и/или теплу полимерное связующее. Предпочтительнее этап (i) осуществляют путем сканирования лазером (обычно мощностью от 20 до 40 Вт) по указанной смеси металлического порошка и связующего агента.
Предпочтительно этап (ii) осуществляют при температуре от около 1000°С до около 1300°С. Следует понимать, что на этапе (ii) любое присутствующее связующее выжигают.
Следует понимать, что этап (i) можно осуществить для получения областей макропористости. Например, спеченную лазером область можно снабдить углублениями, простирающимися внутрь от поверхности имплантата, и/или камерами внутри имплантата. Кроме того, указанные камеры и/или углубления могут взаимно соединяться для обеспечения каналов или проходов в имплантате. Следует также понимать, что такую макропористость можно ввести в имплантат, изготовленный модифицированным способом второго аспекта, в котором используют избирательное лазерное спекание.
Теперь варианты реализации изобретения будут описаны только в качестве примера со ссылкой на сопровождающие чертежи, на которых:
фиг.1 представляет собой фотографию, показывающую, как способом в соответствии с третьим аспектом изобретения можно ввести макропористость;
фиг.2а представляет собой схематическое изображение в разрезе замещающего поясничного позвоночного диска в соответствии с настоящим изобретением;
фиг.2b представляет собой вид в плане диска, показанного на фиг.2а;
фиг.2с представляет собой детальный вид по фиг.2а;
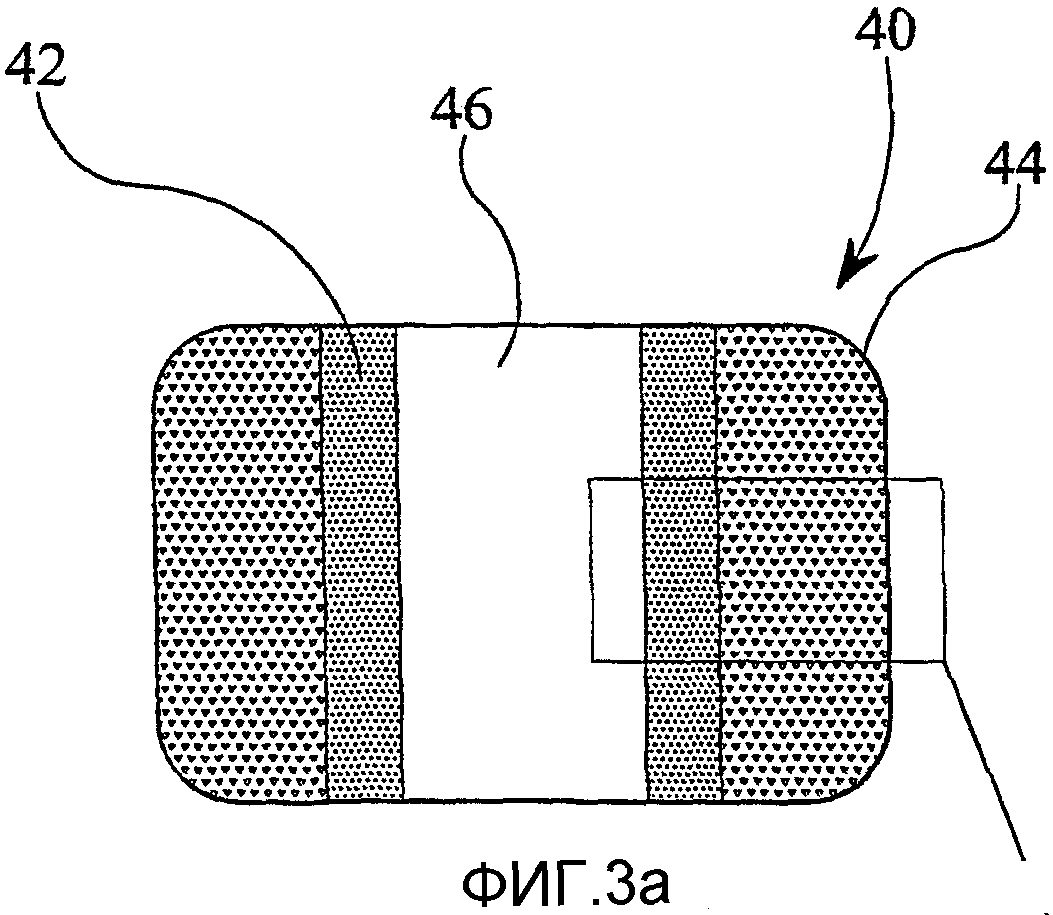
фиг.3а представляет собой схематическое изображение в разрезе позвоночного каркаса в соответствии с настоящим изобретением;
фиг.3b представляет собой вид в плане каркаса по фиг.3а;
фиг.3с представляет собой детальный вид каркаса по фиг.3а.
Пример 1
Цилиндрический контейнер длиной 100 мм из титана коммерческой чистоты (ASTM В 338 GR 2), имеющий внутренний диаметр около 22 мм и наружный диаметр 25,4 мм, заполняли распыленным с помощью газа порошком, состоящим из частиц сплава Ti-6Al-4V (Crucible Research, USA) и имеющим заданное распределение размеров частиц. При необходимости порошок пропускали через сита с соответствующим числом и размером отверстий на единицу площади для получения фракции частиц определенного размера. Контейнер заполняли без вибрации, т.е. только до «насыпной плотности». Воздух из контейнера вакуумировали (давление < 0,1 Па) и проводили обратное заполнение аргоном (избыточное давление 105 Па) в течение 2 мин. После герметизации контейнер подвергали горячему изостатическому прессованию (ГИП) в течение 4 часов при 950°С при внешнем давлении 100 МПа. Затем контейнеру давали возможность охладиться при комнатной температуре и атмосферном давлении, причем аргон оставался под давлением в матрице сплава. Заготовку имплантата механически вырезали из контейнера и подвергали тепловой обработке при 1050°С в течение 48 часов в вакууме (<0,1 Па).
Степень пористости в полученном в итоге имплантате дана ниже и табл.1 для различных фракций порошка.
Пример 2
Пример 1 повторяли с использованием порошков, имеющих. распределение размеров 180-250 мкм и 150-500 мкм. Горячее изостатическое прессование проводили при 1000°С, а последующую тепловую обработку (после удаления из контейнера) проводили при 1050°С в течение 48 часов. Результаты показаны в табл.2.
Пример 3
Пример 1 повторяли с использованием порошка, имеющего распределение размеров 250-500 мкм. Горячее изостатическое прессование проводили при 1000°С, а последующую тепловую обработку (после удаления из контейнера) проводили при 1050°С в течение от 12 до 48 часов. Результаты показаны в табл.3.
Пример 4
Пример 1 повторяли с использованием порошка, имеющего распределение размеров < 150 мкм. Последующую тепловую обработку после удаления из контейнера проводили при 1050°С. Результаты показаны в табл.4.
Пример 5
Пример 1 повторяли с использованием порошка, имеющего распределение размеров 250-425 мкм. Последующую тепловую обработку после удаления из контейнера проводили в течение 48 часов при различных температурах. Результаты показаны в табл.5.
Пример 6
Пример 1 повторяли с различными порошками. После тепловой обработки (1100°С в течение 48 часов) имплантаты нитридировали под давлением в чистом азоте при 950°С и 50 МПа в течение 6 часов для покрытия внутренней поверхности пор тонким слоем нитрида титана. Результаты показаны в табл.6.
Пример 7
Твердую цилиндрическую сердцевину размером 12,7 мм из сплава Ti-6Al-4V помещали в центр титанового контейнера, описанного выше в примере 1. Пространство между сердцевиной и внутренней стенкой цилиндра заполняли порошком сплава Ti-6Al-4V (размер частиц 500-710 мкм). Контейнер вакуумировали и проводили обратное заполнение аргоном до избыточного давления 105 Па, герметизировали и подвергали горячему изостатическому прессованию при 950°С в течение 4 часов при 100 МПа. Последующую тепловую обработку после удаления из контейнера проводили при 1050°С в течение 48 часов. Это привело к получению образца, имеющего пористое покрытие с пористостью 29±5%, причем при 43% пор были с размером > 50 мкм, 16% >100 мкм и 6% >150 мкм.
Пример 8
Пример 1 повторяли с использованием порошка, имеющего размер частиц < 125 мкм. После горячего изостатического прессования деталь механически обрабатывали для удаления контейнера и для уменьшения диаметра детали до ˜17 мм. В отличие от примера 1 тепловую обработку не проводили на данной стадии. Полученный в результате цилиндр использовали затем в качестве сердцевины таким же образом, как в примере 7, причем контейнер имел наружный диаметр 38,1 мм и внутренний диаметр приблизительно 35 мм. Затем пример 7 повторяли, причем сердцевина была окружена в данном случае порошком с размером частиц 250-425 мкм. Полученный в результате имплантат имел пористую сердцевину со средним размером пор 26 мкм (пористость 28,9±2,1%) и пористый наружный слой со средним размером пор 113 мкм (пористость 24,9±1,9).
Пример 8 демонстрирует способность предложенного способа регулируемым образом изготавливать имплантаты, имеющие заданные области с отличающейся пористостью. Кроме того, следует понимать, что процедуру можно расширить для изготовления имплантата, имеющего более двух различных слоев с отличающейся пористостью, т.е. можно изготовить структуры с градиентом пористости.
Пример 9
Пример 1 повторяли с использованием порошка, имеющего заданное распределение размеров. После тепловой обработки (1100°С в течение 48 часов) образцы механически обрабатывали до пригодных для испытания на растяжение деталей с тем, чтобы можно было оценить свойства пористого материала. Результаты показаны в табл.7.
Пример 10
Для демонстрации того, что в примерах, где предварительно сформованная сердцевина связана с пористой поверхностной областью, существует прочная связь на границе раздела между сердцевиной и поверхностными областями, проводили испытания прочности на растяжение. В указанных испытаниях порошок (Ti-6Аl-4V) одновременно агломерировали и подвергали диффузионному связыванию со сплошным бруском из сплава Ti-6Al-4V так, что поверхность раздела находилась в средней точке по длине измерительного прибора для образца. Оценивали две фракции порошка: 125-150 мкм (испытуемый образец а) и 150-250 мкм (испытуемый образец b). В каждом случае проводили обратное заполнение контейнера для образца аргоном до избыточного давления 105 Па. Начальную стадию горячего изостатического прессования проводили при 950°С в течение 4 часов при 100 МПа. Стадию последующей тепловой обработки проводили при 1100°С в течение 48 часов. Итоговая пористость составляла около 40% (испытуемый образец а) и 35% (испытуемый образец b).
В обоих случаях предел прочности на растяжение составил около 400 МПа, и разрыв происходил в отдалении от поверхности раздела в объеме пористого материала. Обычные металлографические исследования подтвердили, что поверхность раздела оставалась неповрежденной, а также то, что поверхность раздела не содержала примесей (т.е. оксидов) и была неотличимой от прилегающей матрицы.
Пример 11
Детали, показанные на фиг.1, были изготовлены избирательным лазерным спеканием. Лазером управляли с помощью компьютера, в который загружали файл компьютерной диагностики, содержащий конфигурацию детали. Деталь изготавливали из слоя порошка, нагретого до 160°С (обычная температура 100-200°С). Порошок с размером частиц < 150 мкм и 15 об.% связующего (обычно от 5 до 25 об.%) нагревали до 60°С (обычно 50-100°С) и подавали в виде слоя порошка при высоте наращивания 200 мкм за один слой (обычно от 100 до 500 мкм). Избирательное спекание осуществляли с использованием лазера мощностью 25 Вт. После того как деталь была изготовлена в виде многослойной структуры, осуществляли удаление связующего при 400°С в течение 30 мин (обычно при 200-500°С в течение от 30 до 120 мин), после чего осуществляли спекание при 1100°С (обычно 1000-1350°С).
Как видно из фиг.1, деталь 2 имеет в целом пористую цилиндрическую область (пористость около 20-25%) с упорядоченным набором круглых углублений 6 вокруг ее внешней периферии («макропористость»). Углубления 6 имеют окружность 0,75 мм и простираются внутрь на 3 мм. Деталь 12 аналогична детали 2, за исключением того, что углубления 6 имеют диаметр 2 мм.
Деталь 22 также аналогична детали 2, за исключением того, что углубления 6 имеют диаметр 1 мм и глубину 5 мм. Кроме того, имеется круговой набор каналов 8. Каждый канал имеет диаметр 1,5 мм и простирается от верхней поверхности детали к ее основанию.
На фиг.2а-2с схематически показан замещающий позвоночный диск. Диск содержит известный сам по себе биомедицинский полукристаллический полимерный диск 30 (например, из полиуретана или полиэтилена), проложенный между парой имеющих форму диска металлических концевых пластин 32 в соответствии с настоящим изобретением. Полимерный диск 30 прикреплен к концевым пластинам 32 клеем, хотя следует понимать, что элементы можно сплавить вместе, или же концевые пластины 32 можно пропитать полимерным диском 30.
Сами диски 32 в целом имеют форму почки (фиг.2b) и содержат, по существу, непористую область 32а сердцевины, прилегающую к полимерному диску 30, и пористую наружную область 32b, удаленную от полимерного диска 30 (фиг.2с). Пористая наружная область способствует врастанию ткани.
Показанный на фиг.3а-3с позвоночный каркас 40 имеет в целом форму полой трубки с прямоугольным поперечным сечением. Сердцевина 42 из, по существу, полностью плотного металла окружена пористой наружной металлической областью 44 (способствующей врастанию ткани). Канал 46 простирается через центр каркаса 40.
Из предшествующего описания вполне очевидно, что тщательный отбор порошковой фракции и параметров осуществления способа, желательной пористости и распределения размеров пор в пористой поверхностной области можно выполнить в соответствии с конкретным конечным применением, предполагаемым для имплантата. Хотя приведенные выше примеры описывают цилиндрические стержни, следует понимать, что их можно легко механически обработать для придания им соответствующей формы в зависимости от предполагаемого использования. Также следует понимать, что контейнер, используемый для изготовления заготовки имплантата, не обязательно должен быть цилиндрическим и может иметь любую желательную форму.
Реферат
Группа изобретений относится к области медицины, а именно к травматологии и ортопедии. Изобретения обеспечивают улучшение совместимости с костью и/или устойчивости к износу. По первому варианту способ изготовления хирургического имплантата, содержащего область сердцевины и пористую поверхностную область, простирающуюся поверх по меньшей мере части указанной области сердцевины, причем пористая поверхностная область имеет заданную долю объема пор, включает в себя этапы: (i) загрузки металлического порошка, имеющего заданное распределение размеров частиц, в герметизируемую капсулу вокруг предварительно сформированной сердцевины; (ii) снижения давления внутри указанной капсулы до заданного давления ниже атмосферного давления; (iii) создания давления в указанной капсуле технологическим газом до заданного давления, более высокого, чем заданное давление на этапе (ii); (iv) герметизации указанной капсулы; (v) нагревания указанной герметизированной капсулы с созданным в ней давлением при повышенной температуре и повышенном давлении в течение заданного времени с получением заготовки имплантата; (vi) охлаждения указанной герметизированной капсулы; и (vii) нагревания указанной заготовки имплантата в течение заданного времени при повышенной температуре и заданном давлении ниже атмосферного давления для создания тем самым пористости в указанной заготовке имплантата. По второму варианту особенность способа заключается в том, что способ включает в себя этапы: (i) избирательного спекания последовательных слоев металлических частиц для формирования тем самым заготовки имплантата требуемой формы; и (и) нагревания указанной заготовки имплантата для формирования тем самым указанного имплантата. Хирургический имплантат изготовлен способом по первому варианту. 3 н. и 27 з.п. ф-лы, 3 ил., 7 табл.


Комментарии