Костный материал и коллагеновая композиция для восстановления поврежденных суставов - RU2292858C2
Код документа: RU2292858C2
Чертежи
Описание
Перекрестная ссылка на родственную заявку
Настоящая заявка притязает на эффект предварительной заявки сер. №60/219009, поданной 19 июля 2000 г.
Предпосылки к созданию изобретения
Область техники изобретения
Настоящее изобретение относится к области восстановления поврежденных или имеющих дефекты суставов.
Описание известного уровня техники
Сочлененные суставы у млекопитающих покрыты суставным хрящом, который препятствует непосредственному контакту противоположных поверхностей кости и обеспечивает мягкое движение сочлененных костей относительно друг друга.
Известно несколько путей восстановления повреждений и дефектов в суставном хряще. Они включают имплантацию выращенных в культуре хондроцитов в место повреждения хряща и нанесение на повреждения покрытия из коллагеновой бляшки.
В некоторых случаях повреждение или дефект сочлененного сустава простирается глубже суставного хряща в низлежащий слой кости. Таким образом, в данной области существует необходимость в разработке материалов и методов восстановления сочлененных суставов, в которых повреждение или дефект простирается через хрящ в кость.
Краткое изложение сущности изобретения
Объектом настоящего изобретения является костный минеральный продукт, предназначенный для применения при лечении комбинированных повреждений или дефектов хряща и кости в сочлененных суставах, который включает частицы пористого костного минерала, полученные из натуральной кости, имеющие кристаллическую структуру, практически соответствующую структуре натуральной кости и практически не содержащие какого-либо эндогенного органического материала, где частицы имеют по крайней мере на их поверхности волокна способного к рассасыванию физиологически совместимого коллагена типа II, причем массовое соотношение волокон коллагена типа II и частиц пористого костного минерала составляет по меньшей мере примерно 1:40.
Краткое описание чертежей
На фиг.1 изображена, частично схематично, вертикальная проекция конца здоровой кости сочлененного сустава.
На фиг.2 изображена, частично схематично, вертикальная проекция конца кости сочлененного сустава, в которой присутствует повреждение (дефект), простирающийся через хрящ в кость.
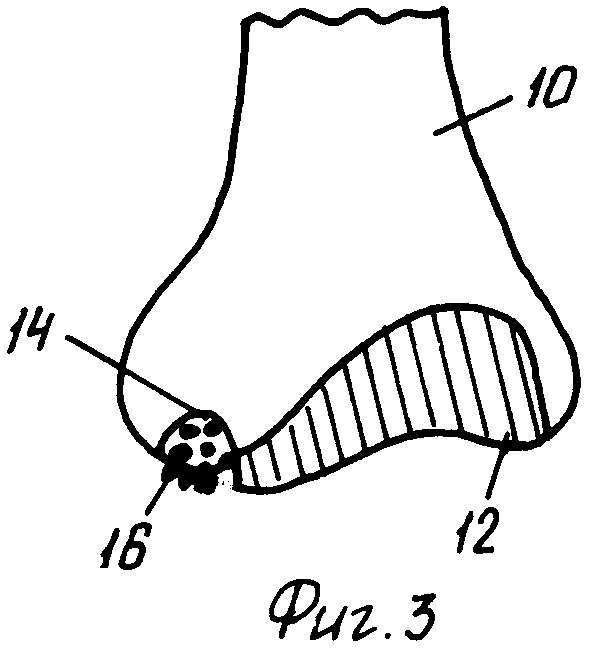
На фиг.3 изображена, частично схематично, вертикальная проекция, на которой представлен костно-минеральный/коллагеновый матрикс по настоящему изобретению, введенный в повреждение на конце кости сочлененного сустава.
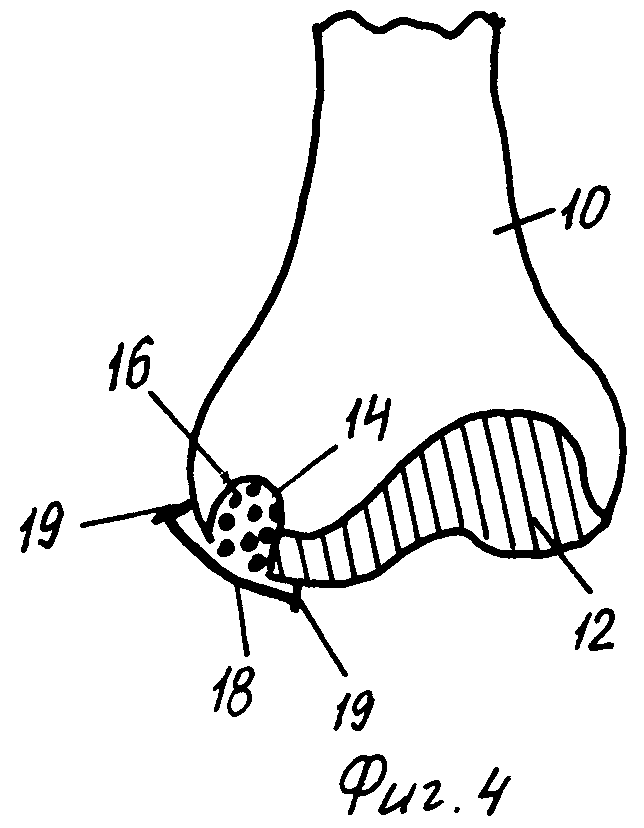
На фиг.4 изображена, частично схематично, вертикальная проекция, на которой представлена коллагеновая или синтетическая мембрана, покрывающая повреждение сустава, которое заполнено костно-минеральным/коллагеновым матриксом по настоящему изобретению.
На фиг.5 схематично изображена боковая проекция мембраны, предназначенной для применения согласно одному из вариантов осуществления настоящего изобретения.
На фиг.6 схематично изображена боковая проекция другой мембраны, предназначенной для применения согласно второму варианту осуществления настоящего изобретения.
Подробное описание изобретения
Настоящее изобретение может применяться для коррекции дефектов ткани, включая как дефекты хряща, так и дефекты кости, прежде всего, сочлененных суставов, таких как коленные суставы и суставы позвоночного столба.
Костный минеральный продукт по настоящему изобретению, включающий частицы пористого костного минерала и волокна коллагена типа II, представляет собой субстрат для прорастания как нативных хондроцитов, так и нативных остеоцитов внутрь матрикса для воздействия на регенерацию хряща и кости.
Матрикс из коллагена типа II продукта по настоящему изобретению также укрепляет хрупкий костный минерал.
Объектом настоящего изобретения является очищенный состоящий из частиц костный минеральный продукт, предназначенный для применения в медицине, частицы этого минерала практически не содержат какого-либо эндогенного органического материала и имеют по крайней мере на их поверхности способный к рассасыванию физиологически совместимый коллаген типа II.
Кости убитых животных представляют собой недорогой исходный продукт, который доступен в больших количествах. Они содержат 50-60% очень мелких кристаллов гидроксиапатита, соединенных коллагеновой тканью и содержащих достаточные количества белкового и другого материала, а также связанные с ними жировую и мышечную ткани. С учетом их созданной биологическим путем кристаллической структуры они также могут рассматриваться в качестве обладающих высокой биологической совместимостью протезов, предназначенных для замены кости. Принимая во внимание их большую удельную поверхность, они также могут использоваться, например, в качестве адсорбента или подложки для лекарственных средств с медленным высвобождением.
Натуральный костный минерал включает гидроксиапатитподобные кристаллиты, у которых степень кристалличности, форма и размер кристаллов (неправильная напоминающая ленточный кристалл морфология, толщина 5-10 мм, длина 10-50 мм) и химическое строение поверхности зависят от соотношения кальция и фосфата (37,5-38,0% кальция и 15,5-51,9% фосфора). Кроме того, в натуральном костном минерале присутствуют небольшие количества некристаллических включений и другая состоящая из фосфата кальция кристаллическая фаза, которая включает минералы брушит и нихитлокит и октакальцийфосфат. Неорганическая фаза кости содержит поры, включающие ультраструктурные пустоты (10-100 мм) между встречающимися в естественных условиях кристаллитами и образованные в результате удаления органической фазы, и микроскопические пространства (1-20 микрон, которые включают остеоцитные лакуны, канальца, сосудистые каналы, каналы Волкмана и каналы гаверсовых систем (100-500 мм)). Площадь удельной поверхности, которая является критерием пористости, составляет от 50 до 100 м2/г при определении с помощью ртутного порозиметра. Степень кристалличности костного минерала может быть определена с помощью дифракции в рентгеновских лучах, а пористость и морфология, а также размер кристаллов - с помощью электронной микроскопии. Небольшие количества неапатитных кристаллов могут быть обнаружены с помощью термогравиметрического анализа.
Однако состав и строение натурального костного минерала не могут быть точно воспроизведены в продуктах, полученных in vitro, или с использованием ранее полученных встречающихся в естественных условиях гидроксиапатитов. Было предложено два метода для очистки натурального костного минерала, таких как кальцинирование (прокаливание) и экстракция растворителем.
Температура, которая требуется в процессе кальцинирования для прокаливания органических составляющих костей, является достаточно высокой. Это приводит к обширной рекристаллизации минеральной составляющей с образованием многочисленных более крупнозернистых кристаллов. Полученный в результате такого процесса материал имеет относительно небольшую удельную поверхность. Вследствие этого такой материал не может быть легко реконструирован с получением новой кости при имплантации и имплантаты могут сохранять неясные с точки зрения реконструирования свойства, хотя в некоторых случаях они могут найти применение.
В процессе экстракции протеины удаляют из обезжиренной кости с помощью приемлемого растворителя. Полученный в результате костный минерал затем промывают для удаления растворителя.
В обоих случаях, когда из натуральной кости удаляют органические примеси для того, чтобы получить только костный минерал, прочность материала в значительной степени снижается и отдельные кусочки очищенного костного минерала в результате становятся очень хрупкими. Это затрудняет обработку материала и может привести к нежелательным воздействиям при имплантации.
В находящемся в совместном владении патенте US 5573771 (включенном в настоящее описание в качестве ссылки) описан медицинский продукт в виде костного минерала, в котором костный минерал усилен матриксом из коллагена типа I (коллаген I) или смесью коллагена типа I и коллагена типа III (коллаген I и коллаген III).
В организме животного коллаген присутствует в нескольких формах, и различные ткани содержат различные пропорции коллагена соответствующего типа. Коллагеновый губчатый материал, который применяется в медицине и косметике, как правило получают из кожи и сухожилий, и он состоит главным образом из коллагена I и/или коллагена III. Костный коллаген в основном представлен коллагеном I и коллагеном II.
Материал коллагена II по настоящему изобретению может включать помимо практически чистого коллагена II различные пропорции коллагена I, коллагена III и их смесей с коллагеном II. Например, материал коллагена II может быть смешан примерно с 0,1-10 мас.% (предпочтительно примерно с 0,1-5 мас.%) коллагена III и/или примерно с 1-50 мас.% коллагена I.
Материал коллагена II по настоящему изобретению может быть импрегнирован каждым из отдельных типов частиц с целью улучшения свойств при обработке продукта при производстве и применении. В этом случае массовое соотношение материала коллагена II и очищенного костного минерала предпочтительно превышает 1:40, предпочтительно находится в диапазоне от более чем 1:8 до менее чем 4:1, предпочтительно менее чем 1:2. Предпочтительно на долю коллагена II приходится примерно 1-30 мас.% в пересчете на костный минеральный продукт по настоящему изобретению, предпочтительно примерно 5-15%. Материал коллагена II проникает в пористую структуру костного минерала и эффективно замещает часть природного белкового материала, ранее присутствующего в натуральной кости, что хотя и придает прочность, но также приводит к иммунологическим реакциям ткани на имплантацию костного минерала.
Материал коллагена II может применяться для получения матрикса, состоящего из частиц костного минерала, из которого могут быть получены суставы определенной формы. В этом случае возможно применение коллагена II в сочетании с гелеобразующим макромолекулярным веществом, таким как желатин. Массовое соотношение волокнистого материала и костного минерала может находиться в диапазоне от 1:40 до 3:20, например примерно 1:10. На гелеобразную фазу предпочтительно приходится от 2 до 20 мас.% в пересчете на костный минерал, например примерно 5%. Когда в качестве гелеобразной фазы используют желатин, то он может иметь небольшое количество поперечных связей, например, образованных с использованием 0,28 частей формальдегида.
Костный минерал предпочтительно получают из губчатой кости и связывают с волокнами коллагена II для того, чтобы усилить физическую прочность матрикса. Согласно предпочтительным вариантам осуществления костно-минеральный/коллаганеновый продукт по настоящему изобретению применяют в качестве матрикса для регенерации дефектов хряща в сочлененных суставах, в которых кроме того имеется дополнительная потеря костной ткани.
Костно-минеральный продукт по настоящему изобретению может использоваться для регенерации хряща в коленных суставах, суставах стопы, позвоночного столба и т.д, и в качестве применяемого для коррекции имплантата или протеза для замены кости, например, при ортопедической хирургии, включая реверсию бедра, замену потерянной кости, например в травматологии, коррекцию при челюстно-лицевой хирургии или заполнение дефекта периодонта и лунок после удаления зуба, включая наращивание бугорков. Таким образом, импрегнированный состоящий из частиц материал по изобретению может применяться для заполнения различных полостей в кости, и его повышенная прочность (пониженная хрупкость) является важной для обработки и процедуры заполнения.
Согласно одному из вариантов способа по изобретению костно-минеральный продукт/материал коллагена II вводят в место повреждения кости и затем костно-минеральный/коллагеновый продукт и место повреждения кости закрывают коллагеновой мембраной для восстановления ткани. Пригодные коллагеновые мембраны известны в данной области и могут представлять собой однослойную коллагеновую мембрану, описанную в WO 96/25961 (заявка на патент US №08/894517), двухслойную мембрану из коллагена I/III, описанную в патенте US №5837278, имеющую компактную гладкую непористую внешнюю барьерную поверхность и противоположную волокнистую, поверхность, или многослойную мембрану, которая включает открытый губкоподобный слой матрикса из коллагена II и по меньший мере один барьерный слой из коллагена I, коллагена III или их смеси, описанный в заявке на патент US №09/545465, поданной 7 апреля 2000 г., которая соответствует PCT/GB98/02976 и т.п. Вышеперечисленные документы включены в настоящее описание в качестве ссылки.
Согласно одному из предпочтительных вариантов осуществления мембрана имеет внешнюю гладкую барьерную поверхность, которая ингибирует адгезию клеток и действует в качестве барьера, препятствующего прохождению через него клеток, а противоположная сторона мембраны имеет волокнистую и мягкую поверхность, через которую клетки могут прорастать. Одним из таких продуктов является Bio-Gide®, поставляемый фирмой Ed. Geistlich Söhne AG für Chemishe Industrie, Щвейцария. На фиг.5 показан продукт Bio-Gide®, имеющий гладкую внешнюю барьерную поверхность 20 и мягкую волокнистую поверхность 22. При применении согласно настоящему изобретению мягкую волокнистую поверхность накладывают на место повреждения, а гладкую внешнюю барьерную поверхность располагают снаружи. Продукт Bio-Gide® описан в патенте US №5837278 (выше), и он включает примерно 95-99% коллагена I и примерно 1-5% коллагена III.
Согласно другому предпочтительному варианту осуществления настоящего изобретения применяют многослойную мембрану, описанную в указанной выше заявке на патент США №09/545465. Такая многослойная мембрана может быть приготовлена путем нанесения суспензии коллагена II на мягкую волокнистую поверхность описанного выше продукта Bio-Gide®. Такой продукт показан на фиг.6 и включает внешнюю барьерную поверхность 20 и матриксный слой, состоящий в основном из коллагена II, имеющего открытую губкоподобную текстуру 24, который наносят в виде суспензии на мягкую волокнистую поверхность 22 и сушат. Когда продукт, показанный на фиг.6, применяют согласно настоящему изобретению, то открытый губкоподобный, состоящий из коллагена II слой 24 наносят непосредственно на место повреждения, а гладкую внешнюю барьерную поверхность 20 располагают снаружи.
Как отмечалось выше, изобретение, прежде всего, относится к регенерации дефектов сочлененного сустава, которые отличаются наличием повреждения как хряща, так и низлежащей кости. Костно-минеральный/коллагеновый продукт по изобретению может применяться для заполнения области повреждения кости, и заполненная область повреждения кости затем может быть покрыта коллагеновой мембраной.
Для усиления регенерации в костно-минеральный/коллагеновый матрикс по изобретению до имплантации могут быть добавлены внеклеточные выращенные в культуре хондроциты, и обогащенный хондроцитами матрикс может быть имплантирован в процессе хирургического вмешательства в открытый орган или при артроэндоскопии. В альтернативном варианте или в дополнение к предыдущему имплантированный матрикс может быть покрыт коллагеновой мембраной, состоящей из коллагена I, II и/или III, или покрыт синтетической мембраной. В альтернативном варианте или в дополнение к предыдущему в такую коллагеновую мембрану или синтетическую мембрану могут быть добавлены выращенные в культуре хондроциты, и мембрана может быть нанесена на заполняющий повреждение костный имплантат в процессе хирургического вмешательства в открытый орган или при артроэндоскопии.
Очищенный костный материал может, например, представлять собой продукт, описанный в международной заявке на патент WO 86/07265 (PCT/GB86/00310). Такие продукты могут быть получены путем практически полного обезжиривания определенной кости, например бедренных костей быков, и обработаны аммиаком или органическим амином для расщепления оставшегося протеина с последующей интенсивной промывкой водой. Такой материал сохраняет способность к рассасыванию при применении, что способствует процессу коррекции.
Очищенный костный минерал также может быть получен с помощью кальцинирования определенного губчатого вещества или кортикального слоя кости, например, при 900°С в течение 24 ч. Такой кальцинированный костный минерал находит применение, когда требуются постоянные нерассасываемые имплантаты, например, при наращивании бугорков. В любом случае после удаления органического материала кость становится чрезвычайно хрупкой, и ее прочность может быть существенно повышена обработкой согласно изобретению.
Если кость предназначена для применения в качестве носителя лекарственного средства, как описано выше в международной заявке на патент, то целесообразно, чтобы костный минерал нес одно или несколько абсорбированных лекарственных средств или других физиологически активных веществ. Согласно одному из вариантов осуществления продукт по изобретению включает по меньшей мере одну абсорбированную фармацевтически или биологически активную субстанцию или мезенхимные стволовые клетки, обладающие способностью к дифференцировке в клетки, предназначенные для регенерации хряща или кости.
Физиологические активные субстанции, которые могут быть адсорбированы на костный минерал, предпочтительно представляют собой по меньшей мере частично растворимые в воде вещества и включают антибактериальные субстанции, такие как антибиотики, например пенициллины, цефалоспорин, аминогликозиды и т.д., сульфонамиды и, прежде всего, продукты конденсации формальдегида и тауринамида или N-замещенного тауринамида. Последние соединения могут быть представлены формулой
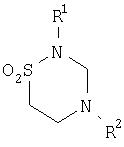
где R1 обозначает водород или С1-С4 алкильную группу и R2 обозначает водород или группу формулы

где R1 имеет указанные выше значения.
Соединение формулы (I), в котором и R1 и R2 обозначают водород, представляет собой таурултам, а соединение, в котором R1 обозначает водород и R2имеет структуру формулы (II), представляет собой тауролидин. Эти соединения действуют в качестве агентов переноса метилола, и они обладают эффективностью не только в отношении грамотрицательных и грамположительных бактерий, но также в отношении инактивации эндотоксинов и экзотоксинов, продуцируемых бактериями.
Другие приемлемые физиологически активные субстанции включают протеины и полипептиды, которые могут способствовать регенерации кости, прежде всего неколлагеновые протеины, происходящие из костного матрикса и костных клеток. Они включают митогенные факторы, такие как фактор роста скелета, и морфогенетические факторы и факторы ангиогенеза, а также трансформирующий фактор роста кости. Особенно ценными являются факторы роста из натурального костного матрикса, такие как оссеин или более предпочтительно остеопоетин.
Согласно одному из вариантов осуществления фармацевтически активную субстанцию выбирают из группы, включающей костные морфогенетические протеины (BMP), такие как ВМР-2-8, или другие молекулы скелетного матрикса, а также сигнальные пептиды, такие как трансформирующий фактор-β роста TGF-β, TGF-β1, сосудистый эндотелиальный фактор роста (VEGF), инсулинподобный фактор роста (IGF), протеин, родственный паратиреоидному гормону (PTHrP) и тромбоцитарный фактор роста (PGGF).
Продукт по изобретению также может применяться в качестве носителя для стволовых клеток, предназначенных для конкретных линий дифференцировки, таких как клетки суставного хряща или кости. Такие стволовые клетки могут выращиваться in vitro для увеличения их количества и вноситься в места, предназначенные для восстановления, в матриксах носителя вместе с факторами роста или без них.
Должно быть очевидно, что согласно другому варианту или в дополнение к предыдущему физиологически активные субстанции могут быть включены в макромолекулярное вещество, например, в импрегнированный желатин. Это особенно важно для протеинов, таких как указанные выше факторы роста кости.
Костный минерал, как правило, имеет форму частиц, средний диаметр которых составляет от 0,1 до 10 мм. Частицы для включения в волокно коллагена II предпочтительно получают из губчатой кости, и они, как правило, должны иметь размер 0,1-5 мм, предпочтительно 0,5-2 мм. Может оказаться целесообразной плотная упаковка частиц костного минерала для применения смеси из частиц двух или большого количества размеров, например от 0,25 до 1 мм и от 1 до 2 мм, или в более широком диапазоне, например от 0,25 до 2 мм.
Очищенный костный минерал может быть получен, например, с помощью метода, описанного в указанной выше международной заявке на патент. Так, например, жиры могут быть удалены с помощью одного или нескольких общепринятых растворителей жира, таких как простые эфиры, например диметиловый эфир; кетоны, например ацетон; или углеводороды или галогенированные углеводороды, например гептан или метилциклогексан или толул.
Может оказаться целесообразным перед последующей обработкой удалять экстрагирующий агент, такой как толуол, путем промежуточной экстракции смешивающимся с водой растворителем, таким как этанол. Коллагеновый материал может быть растворен с помощью протеолитических агентов, таких как основания, например гидроксид калия в глицерине, или органические основания, такие как амины, например этилендиамин, или амиды, такие как формамид, предпочтительно при повышенных температурах. Такие агенты предпочтительно представляются собой смешивающиеся с водой вещества для облегчения их удаления путем промывки водой. Особенно хорошие результаты были получены с использованием экстракции кости этилендиамином при температуре дефлегмации.
Экстракцию целесообразно проводить на каждой стадии, при необходимости с заменами растворителя до тех пор, пока больше не будет экстрагироваться дополнительный материал, например, в течение 1 или 2 двух недель. Может оказаться целесообразным осуществлять дополнительное измельчение после начальной стадии удаления протеина, поскольку кость легче разломить на этой стадии, чем перед экстракцией. После обработки основанием избыток растворителей тщательно удаляют, например, выпариванием и/или при необходимости промывкой водой.
Материал, как правило, подвергают стадии сушки. Может оказаться целесообразным на этой стадии стерилизовать материал, например, горячей обработкой, что может приводить к дополнительной очистке. Абсорбцию и/или адсорбцию физиологически активной субстанции предпочтительно осуществляют путем погружения обработанного костного минерала в водный раствор субстанции, предпочтительно в стерильных условиях. Концентрация активной субстанции предпочтительно является относительно высокой для облегчения абсорбции и/или адсорбции и зависит в том числе от растворимости активного продукта.
Изобретение ниже будет описано более подробно со ссылкой на чертежи.
На фиг.1 показан конец суставной кости 10 с хрящом 12, который является здоровым и не имеет повреждения.
На фиг.2 показана суставная кость 10 с хрящом 12, в котором имеется повреждение 14, простирающееся от хряща 12 в кость 10.
На фиг.3 показан костно-минеральный/хрящевой матрикс 16 по изобретению, в который могут быть введены или не введены хондроциты, заполняющий повреждение 14 в хряще 12 и кости 10.
На фиг.4 показана коллагеновая или синтетическая бляшка 18, в которую могут быть введены или не введены хондроциты, покрывающая повреждение 14, заполненное новым костно-минеральным/коллагеновым матриксом 16 по изобретению, для регенерации повреждения как хряща 12, так и кости 10. Бляшка 18 может быть прикреплена с помощью любых пригодных средств 19, таких как хирургические швы, хирургические штифты или клей.
Изобретение пояснено с помощью следующих примеров, которые даны только с целью иллюстрации.
Пример 1
Бедренные кости быка кипятили в горячей воде до очистки, измельчали на частицы размером 5-10 мм и экстрагировали толуолом при температуре дефлегмации в течение 24 ч в аппарате Сокслета. Материал дополнительно экстрагировали этанолом для удаления толуола и затем экстрагировали при повышенной температуре с азеотропной смесью этилендиамина и воды (85:15) в течение 8 дней с несколькими заменами растворителя до тех пор, пока больше не экстрагировался никакой дополнительный органический материал. Затем продукт сушили на воздухе при 100°С.
Высушенный продукт дополнительно измельчали до получения частиц со средним размером 0,2-2 мм и стерилизовали в автоклаве. Кусочки губчатой кости из бедра быков, как правило, диаметром 10 мм, очищали с помощью аналогичного процесса без окончательного гранулирования.
Пример 2
Замороженный хрящ из только что забитых свиней замачивали в холодной воде, тщательно промывали и механически очищали от остатков мяса, костей и твердых кусков. Затем материал промывали в течение 30 мин в проточной воде.
После чего материал измельчали трижды в гомогенизаторе. Видимый простым глазом размер частиц в конце стадии измельчения составлял примерно 8 мм.
Куски хряща обезвоживали путем четырехкратной промывки ацетоном, каждый раз по 8 ч. Затем хрящ обезжиривали путем четырехкратной экстракции н-гексаном. Каждая обработка продолжалась в течение по меньшей мере 8 ч. Соотношение гексана и хряща составляло 1:10.
После обезжиривания хрящу давали набухнуть в воде для питья. Соотношение воды и материала составляло 10:1. Время обработки составляло 24 ч.
Затем материал обрабатывали NaOH (5 мас.%), соотношение хряща и жидкости составляло 1:4, и обработка продолжалась в течение 32 ч. В процессе обработки кусочки хряща хорошо перемешивали. Затем хрящ отмывали от щелочи. Тем самым исходное значение рН, равное 14, снижалось до 9-11. Растворенные примеси отмывали и отделяли от хряща. Полученную после обработки щелочью жидкость собирали для восстановления гликозаминогликана.
Затем коллагеновый материал обрабатывали концентрированной HCl (примерно 3 мас.%) сначала при значении рН ниже 1,0. Время обработки составляло 4-6 ч.
После чего материал промывали холодной водой до тех пор, пока значение рН не повышалось до 3-3,5. Все примеси удаляли и образовавшийся продукт представлял собой несодержащую соли коллагеновую массу, пригодную для получения губки или другого коллагенового материала. Для этой цели хрящевая масса согласно изобретению может быть подвергнута обезжириванию, замораживанию и сушке вымораживанием.
Пример 3
Экстракт, полученный после щелочной обработки, описанной в примере 2, содержал гликозаминогликан, щелочь, денатурированные протеины и соли. Экстракт сначала нейтрализовали HCl, значение рН после нейтрализации составляло 6. Затем экстракт обрабатывали вспомогательным средством для фильтрации, а именно кизельгуром, который применяется для удаления денатурированных протеинов. В экстракт вводили 0,5 мас.% кизельгура и удаляли фильтрацией вместе с денатурированным протеином.
Затем надосадочную жидкость подвергали ультрафильтрации, используя мембрану, не пропускающую частицы с молекулярной массой выше примерно 10000 Да. Таким образом, удаляли соли, оставляя очищенный гликозаминогликан.
Пример 4
2,0 г материала коллагена II, полученного в примере 3, измельчали в смесители с 500 г дистиллированной воды. Эту дисперсию центрифугировали и надосадочную воду удаляли. К полученной суспензии коллагенового волокна добавляли 17,5 г гранулированной кортикальной кости быка, очищенной с помощью процесса, описанного в примере 1, с последующим тщательным смешением и удалением воды под вакуумом (70 мм рт. столба). Гранулированная кость имела размер от 0,5 до 1,0 мм. После удаления воды добавляли 5 мл 9 мас.% водного раствора желатина (поперечно связанного с 0,6% 35%-ного водного формальдегида) и смесь вновь сушили под вакуумом.
Губчатую массу нарезали на куски и сушили под вакуумом при 60°С. Куски губки упаковывали в полиэтиленовые контейнеры и стерилизовали облучением гамма-лучами.
Реферат
Изобретение относится к области медицины. Костно-минеральный продукт для восстановления комбинированных повреждений хряща и повреждений кости включает частицы пористого костного минерала, полученные из натуральной кости, имеющие кристаллическую структуру, практически соответствующую структуре натуральной кости, и практически не содержащие какого-либо эндогенного органического материала. Частицы имеют по крайней мере на их поверхности волокна способного к рассасыванию физиологически совместимого коллагена типа II. Массовое соотношение волокон коллагена типа II и частиц пористого костного минерала составляет, по меньшей мере, примерно 1:40. Использование продукта позволяет восстановить поврежденные или имеющие дефекты суставы. 7 з.п. ф-лы, 6 ил.

Комментарии