Комплекс, содержащий ингибирующий остеокластогенез фактор (ocif) и полисахарид - RU2232594C2
Код документа: RU2232594C2
Чертежи



Описание
Область техники
Данное изобретение относится к комплексу, содержащему по меньшей мере один ингибирующий остеокластогенез фактор (далее называемый OCIF) или его аналог или его вариант и по меньшей мере один полисахарид или его производное, к способу получения указанного комплекса, к лекарственному средству для лечения или предупреждения костных метаболических заболеваний, содержащему этот комплекс в качестве активного ингредиента, и к применению указанного комплекса при лечении или для предупреждения костных метаболических заболеваний.
Предпосылки изобретения
Кости содержат около 99% общего кальция, присутствующего в живом организме, и, следовательно, играют важную роль не только в поддержании тела, но также в функционировании в качестве самого крупного запасающего кальций органа в теле. Кости играют важную роль в поддержании гомеостаза кальция. Известно, что активация остеокластов, которые играют важную роль в резорбции костей, вызывает избыточный приток кальция в кровь из костей с нарушением гомеостаза кальция в крови, индуцируя гиперкальциемию. Эта индукция гиперкальциемии посредством активации остеокластов и стимуляции резорбции костей может быть вызвана цитокинами, которые секретируются ненормально вследствие распространения рака в кость [например, см. Jean-Jacques Body, Current and Future Directions in Medical Therapy: Hypercalcemia, CANCER Supplement, 88(12), 3054-3058 (2000)]. Прогноз для пациентов, страдающих от раковой гиперкальциемии, обычно является плохим, и, следовательно, крайне желательным является нахождение эффективного лечения для этого состояния.
Известно, что в ревматизме, таком как ревматоидный артрит и т.п. или остеоартрит, ненормальное образование или ненормальная активация остеокластов является одной из основных причин различных симптомов, которые присутствуют в костях и суставах пациентов, страдающих от этих состояний [см., например, Е. Romas, M.T. Gillespie and T.J. Martin, Involvement of Receptor Activator NF-кВ Ligand and Tumor Necrosis Factor-α in Bone Destruction in Rheumatoid Arthritis, Bone, 30(2), 340-346 (2002)]. Боль в суставах и костях, вызываемая ревматизмом, таким как ревматоидный артрит и остеоартрит, является чрезвычайно интенсивной и является крайне вредной для качества жизни пациентов, страдающих от этих состояний. Опять, следовательно, является крайне желательным нахождение эффективного лечения для таких состояний.
Известно также, что остеокласты играют роль в остеопорозе. Баланс резорбции костей, стимулируемой остеокластами, и костеобразования, стимулируемого остеобластами, постепенно склоняется в сторону резорбции костей вследствие пониженной секреции женских гормонов после менопаузы или вследствие старения, в результате чего плотность костей понижается и возникает остеопороз, если это уменьшение плотности костей является достаточно тяжелым. Когда стареющие пациенты с высоким риском остеопороза получают перелом, возможность, что они станут прикованными к постели, является очень высокой, и это стало социальной проблемой в результате все увеличивающейся стареющей популяции во всех частях света [например, см. Bruno Fautrel and Francis Guillemin, Cost of illness studies in rheumatic diseases, Current Opinion in Rheumatology, 14, 121-126 (2002)]. Таким образом ведется энергичный поиск эффективного способа лечения и предупреждения остеопороза.
Общепринятые способы лечения для этих состояний включают в себя восполнение гормонов, таких как эстроген, и применение агентов, которые подавляют активность остеокластов, таких как бифосфонаты или кальцитонины [см., например, Mohammed М. Iqbal and Tanveer Sobhan, Osteoporosis: A Review, Missouri Medicine, 99(1), 19-23 (2002).]. Однако гормоны могут иметь нежелательные побочные действия, такие как повышенный риск онкогенеза, индукция эндометриоза и ненормальное кровотечение из половых органов [например, см. Joyce Penrose White and Judith S. Schilling, Postmenopausal Hormone Replacement: Historical Perspectives and Current Concerns, Clinical Excellence for Nurse Practitioners, 4(5), 277-285 (2000)]. Хотя известно, что бифосфонаты легко связывают избыточный кальций в крови и накапливаются в кости, некоторые исследователи сомневаются в том, до какой степени может быть улучшена прочность костей с их использованием. Кроме того, сообщалось также, что существует опасность ухудшения функционирования почек, связанная с их применением [например, см, Jonathan R. Green, Yves Seltenmeyer, Knut A. Jaeggi and Leo Wildler, Renal Tolerability Profile of Novel, Potent Bisphosphonates in Two Short-Term Rat Model, Pharmacology and Toxicology, 80, 225-230 (1997)]. Что касается кальцитонина, то увеличение плотности костей, получаемое с его использованием, является, к сожалению, временным. Сообщалось также, что прерывание введения кальцитонина может вызвать регресс состояния, подлежащего лечению, в то время как эффективность кальцитонинов, происходящих из животных, иных, чем человек, может снижаться после продолжительного лечения вследствие появления циркулирующих антител к этому кальцитонину в теле человека [S.L. Porcel, J.A. Cumplido, В. dela Hoz, M. Cuevas and E. Losada, Anaphylaxis to calcitonin, Allergologia et Immunopathologia, 28(4), 243-245 (2000)].
Как объяснялось выше, остеокласты играют главную роль в стимуляции резорбции костей, которая является важным фактором, обусловливающим увеличение концентрации кальция в крови. Однако считается, что ни одно из вышеупомянутых лекарственных средств не является активным в супрессии образования остеокластов. Таким образом, ни одно из этих общепринятых лекарственных средств не является пригодным для фундаментального лечения костных метаболических заболеваний, так как эти лекарственные средства способны справляться только с симптомами, а не с причинами заболевания.
Не так давно было показано, что OCIF является эндогенным белком, который ингибирует дифференцировку клеток-предшественников остеокластов в остеокласты и/или костно-резорбционную активность зрелого остеокласта (см. WO-A-96/26217 и ЕР-А-0816380). Ввиду того факта, что вышеупомянутые костные метаболические заболевания, такие как гиперкальциемия, остеопороз и ревматоидный артрит, являются результатом по меньшей мере некоторой степени резорбции костей, была надежда, что эти заболевания могли бы успешно лечиться с использованием OCIF вследствие его способности подавлять образование самого остеокласта и/или подавлять костно-резорбционную активность зрелого остеокласта. Однако OCIF является основным белком, который имеет изоэлектрическую точку около 9, и он исчезает очень быстро из кровотока после введения. Попытка решить эту проблему описана в WO-A-2000/24416 и ЕР-А-1127578, где продолжительность времени, в течение которого OCIF остается в крови после введения (и, следовательно, действия OCIF), была продлена до некоторой степени совместным введением OCIF с полисахаридом, таким как гепарин или декстрансульфат. Однако пролонгирование времени удерживания, достигаемое в результате, может быть недостаточным для получения настолько пролонгированного удерживания OCIF в крови, чтобы сделать его истинным кандидатом для использования в лечении костных метаболических заболеваний, таких как гиперкальциемия, остеопороз и ревматизм. Таким образом, существует потребность в улучшенном способе прологирования продолжительности времени, в течение которого OCIF остается в кровотоке после введения.
Сущность изобретения
Таким образом, целью данного изобретения является обеспечение препарата, содержащего OCIF, который позволяет пролонгировать время, в течение которого OCIF удерживается в кровотоке после введения, с обеспечением таким образом агента (средства), в котором действие OCIF в лечении и профилактике костных метаболических заболеваний, которые опосредованы остеокластами, таких как гиперкальциемия, остеопороз и ревматизм, является усиленным и пролонгированным.
Другие цели и преимущества данного изобретения станут очевидными по мере продолжения описания.
Таким образом, данное изобретение обеспечивает комплекс, содержащий по меньшей мере одно вещество, выбранное из группы, состоящей из OCIF, его аналогов и его вариантов, которое связано с по меньшей мере одним веществом, выбранным из группы, состоящей из полисахаридов и их производных.
Данное изобретение обеспечивает также способ пролонгирования времени, в течение которого OCIF или его аналог или вариант удерживается в кровотоке после введения пациенту, посредством образования комплекса по меньшей мере одного указанного OCIF, указанного аналога или указанного варианта с по меньшей мере одним полисахаридом или его вариантом.
Данное изобретение обеспечивает также фармацевтическую композицию, содержащую эффективное количество фармакологически активного агента (средства) вместе с его носителем или разбавителем, где указанное фармакологически активное средство представляет собой комплекс, содержащий по меньшей мере одно вещество, выбранное из группы, состоящей из OCIF, его аналогов и его вариантов, которое связано с по меньшей мере одним веществом, выбранным из группы, состоящей из полисахаридов и их производных. В частности, оно обеспечивает такую фармацевтическую композицию для лечения или профилактики костных метаболических заболеваний.
Данное изобретение обеспечивает также способ лечения или профилактики костных метаболических заболеваний, предусматривающий введение пациенту эффективного количества комплекса, содержащего по меньшей мере одно вещество, выбранное из группы, состоящей из OCIF, его аналогов и его вариантов, которое связано с по меньшей мере одним веществом, выбранным из группы, состоящей из полисахаридов и их производных.
Данное изобретение обеспечивает также применение комплекса, содержащего по меньшей мере одно вещество, выбранное из группы, состоящей из OCIF, его аналогов и его вариантов, которое связано с по меньшей мере одним веществом, выбранным из группы, состоящей из полисахаридов и их производных, в приготовлении лекарственного средства для профилактики или лечения костных метаболических заболеваний.
Подробное описание изобретения
Авторы обнаружили, что посредством инкубирования по меньшей мере одного вещества, выбранного из OCIF, его аналогов и вариантов, с по меньшей мере одним веществом, выбранным из полисахаридов и их производных, в условиях, которые приводят к образованию комплекса, в котором указанное одно или несколько веществ, выбранных из OCIF, его аналогов и вариантов, связаны с указанным по меньшей мере одним веществом, выбранным из полисахаридов или их производных, образуется посредством этого агента, в котором действие указанного OCIF или его аналога или варианта в лечении и профилактике костных метаболических заболеваний, опосредованных остеокластами, таких как гиперкальциемия, остеопороз и ревматизм, является усиленным или пролонгированным. Это обусловлено тем фактом, что продолжительность времени, в течение которого указанный OCIF или его аналог или вариант удерживается в кровотоке после введения, пролонгируется в сравнении с комбинациями OCIF и полисахаридов предыдущего уровня техники, описанными в WO-A-2000/24416 и ЕР-А-112578.
Как отмечалось выше, комплексы данного изобретения содержат по меньшей мере одно вещество, выбранное из OCIF, его аналогов и вариантов, которые связаны с по меньшей мере одним веществом, выбранным из полисахаридов и их производных. В указанном комплексе OCIF и полисахарид связаны друг с другом химической связью, такой как ковалентная связь (например, с образованием оснований Шиффа), ионная связь или координатная связь, или нехимической связью, например гидрофобным взаимодействием, водородной связью, электростатическим взаимодействием или аффинным связыванием.
OCIF, его аналог или вариант, используемый в данном изобретении, может быть природного типа или он может быть рекомбинантного типа, и его происхождение не является особо ограничиваемым. OCIF природного типа обозначает OCIF, который получают в виде природно продуцируемого белка экстракцией, очисткой и/или выделением из органа, жидкости тела, клеточной культуры, полученных из человека или животного, не являющегося человеком. OCIF рекомбинантного типа, его аналог или его вариант является рекомбинантным белком, полученным экстракцией, очисткой и/или выделением указанного белка из хозяина, обычно используемого в таких способах, такого как прокариотическая клетка-хозяин (например, Escherichia coli) или эукариотическая клетка, такая как линия клеток человека или не человека, которая была трансформирована вектором, содержащим полинуклеотид, который кодирует OCIF, его аналог или его вариант [например, см. рекомбинантные способы, описанные в ЕР-А-0816380 (WO-A-96/26217) и WO-A-97/23614].
Происхождение OCIF, его аналогов и его вариантов, используемых в данном изобретении, не является особо ограничиваемым, и они, могут быть получены от человека или животного (не человека). Предпочтительно, они могут быть получены из млекопитающего, такого как человек, крыса, мышь, кролик, собака, кошка, корова, свинья, овца или коза; или из птиц, таких как домашняя птица, гусь, курица или индейка. Более предпочтительно, их получают из млекопитающих и наиболее предпочтительно их получают из человека.
OCIF или его аналог, используемый в данном изобретении, может быть OCIF мономерного типа (например, в людях мономером, имеющим молекулярную массу, измеренную при помощи электрофореза в ДСН-ПААГ при невосстанавливающих условиях, около 60000) или димерного типа (например, в людях димером, имеющим молекулярную массу около 120000, измеренную при помощи электрофореза в ДСН-ПААГ при невосстанавливающих условиях) [см. ЕР-А-0816380 (WO-A-96/26217)].
Известно, что OCIF транслируется в клетках в виде полипептида, содержащего сигнальный пептид на его аминоконце, и что затем он созревает с использованием процессинга, включающего в себя удаление указанного сигнального пептида [например, см. рекомбинантные способы, описанные в ЕР-А-0816380 (WO-A-96/26217)]. OCIF, его аналог или его вариант, используемый в данном изобретении, включает в себя как полипептид, содержащий сигнальный пептид, так и его созревшую форму. Предпочтительные примеры включают в себя OCIF с сигнальным пептидом, имеющий аминокислоты -21 - +380 SEQ ID NO:1 списка последовательностей, и зрелый OCIF без сигнального пептида, имеющий аминокислоты +1 - +380 SEQ ID NO: списка последовательностей. Из них особенно предпочтительным является зрелый OCIF.
Известно также, что метионин может быть добавлен к такой зрелой форме OCIF, его аналога или его варианта, когда он экспрессируется в виде рекомбинантного белка в клетке-хозяине, в частности в прокариотической клетке-хозяине, такой как Escherichia coli. Это достигается добавлением триплета нуклеотидов, имеющего последовательность ATG (AUG) к 5’-концу полинуклеотида, кодирующего зрелую форму OCIF, его аналога или его варианта, и встраиванием полученного полинуклеотида в подходящий экспрессирующий вектор. Затем этот желаемый зрелый белок, имеющий метионин на его аминоконце, может экспрессироваться подходящей клеткой-хозяином, которая была трансформирована указанным рекомбинантным экспрессирующим вектором. Кроме того, одна или несколько аминокислот могут быть добавлены к указанному белку в положении, смежном с триплетом нуклеотидов ATG, добавленным на 5’-конце полинуклеотида, кодирующего зрелую форму OCIF, его аналога или его варианта.
В данном изобретении аналог OCIF обозначает белок, кодируемый полинуклеотидом, который существует природно в клетках, жидкости тела и/или органах человека или животных (не человека), таких как приведенные в виде примеров выше. Конкретные предпочтительные примеры таких аналогов включают в себя OCIF2, OCIF3, OCIF4 и OCIF5 [см. ЕР-А-0816380 (WO-A-96/26217)]. Такие аналоги OCIF или их активные фрагменты могут быть получены с использованием следующего способа: РНК экстрагируют из клетки, органа, ткани или жидкости тела человека или животного (не человека); первую цепь кДНК, которая комплементарна указанной РНК, синтезируют с использованием обратной транскриптазы, а затем вторую цепь указанной кДНК синтезируют с использованием первой цепи в качестве матрицы с использованием ДНК-полимеразы; полученную таким образом двухцепочечную кДНК встраивают в подходящий, обычно используемый экспрессирующий вектор; затем подходящую, обычно используемую клетку-хозяина трансформируют полученным таким образом вектором; затем клетки-хозяева, продуцирующие желаемый пептид, подвергают скринингу с использованием способа гибридизации, такого как гибридизация бляшек или фаговая гибридизация, с использованием кДНК OCIF или ее фрагмента в качестве зонда при строгих условиях гибридизации [см. ЕР-А-0816380 (WO-A-96/26217)]; и затем, наконец, желаемый аналог OCIF экспрессируется общепринятым способом полученной таким образом клеткой-хозяином.
В данном изобретении вариант OCIF обозначает белок, который имеет аминокислотную последовательность, в которой один или несколько аминокислотных остатков были заменены, делегированы, добавлены или инсертированы в аминокислотную последовательность OCIF или его аналога, и все еще имеет по меньшей мере часть активности OCIF. Такие варианты OCIF могут быть получены, например, при помощи следующего способа: заменой, делецией, добавлением и/или инсертированием одного или нескольких нуклеотидов в нуклеотидную последовательность, кодирующую OCIF или его аналог, с использованием способа полимеразной цепной реакции (называемого далее ПЦР), способа генетической рекомбинации или способа расщепления нуклеазами с использованием экзонуклеазы или эндонуклеазы, такой как рестрикционный фермент; трансформации эукариотической клетки-хозяина, такой как клетка животного, или прокариотической клетки-хозяина, такой как Escherichia coli, экспрессирующим вектором, в который был встроен полученный нуклеотид, кодирующий желаемый вариант OCIF; и затем экстракции, очистки и/или выделения желаемого пептида из содержащей белок фракции, продуцируемой культурой клеток указанного трансформированного хозяина, в соответствии со способом, хорошо известным специалисту в данной области.
Известно, что укороченные формы OCIF, в которых значительная часть аминокислотной последовательности была делегирована из карбоксиконца полипептида OCIF, также сохраняют по меньшей мере часть активности OCIF [например, см. ЕР-А-0816380 (WO-A-96/26217) и WO-A-97/23614]. Такие укороченные типы OCIF, сохраняющие по меньшей мере часть активности полного полипептида OCIF, также включены в варианты OCIF данного изобретения.
Кроме того, известны OCIF или его укороченная форма, которые слиты с доменом иммуноглобулина, таким как Fc-домен (например, слитый полипептид, в котором Fc-домен IgG человека присоединен к карбоксиконцу OCIF), и которые сохраняют по меньшей мере некоторую часть активности полного полипептида OCIF (см. WO-A-97/23614), и такие слитые белки также включены в варианты OCIF данного изобретения.
Было также показано, что OCIF или его аналог или его вариант могут быть химически модифицированы и все еще сохраняют применимую активность и, в некоторых случаях, могут проявлять преимущества, например увеличенную стабильность или уменьшенную иммуногенность. Такая химическая модификация может включать в себя дериватизацию всего лишь в единственном сайте в молекуле OCIF или его аналога или его варианта или в более чем одном сайте. Например, было показано, что OCIF и его варианты (производные), такие как укороченная форма, могут быть химически модифицированы одним или несколькими водорастворимыми полимерами, такими как полиэтиленгликоль, сополимеры этиленгликоля и пропиленгликоля, карбоксиметилцеллюлоза и поливиниловый спирт, и могут обнаруживать в результате улучшенную биологическую активность (например, см. WO-A-97/23614). Такие химически модифицированные типы OCIF или его аналога или его варианта также включены в варианты OCIF данного изобретения.
Примеры известных вариантов OCIF, которые пригодны для применения в приготовлении комплексов данного изобретения, включают в себя: OCIF-C19S, OCIF-C20S, OCIF-C21S, OCIF-C22S, OCIF-C23S, OCIF-DCR1, OCIF-DCR2, OCIF-DCR3, OCIF-DCR4, OCIF-DDD1, OCIF-DDD2, OCIF-CL, OCIF-CC, OCIF-CDD2, OCIF-CDD1, OCIF-CCR4, OCIF-CCR3, OCIF-CBst, OCIF-CSph, OCIF-CBsp, OCIF-CPst [см. EP-A-0816380 (WO-A-96/26217)], muOPG[22-401]-Fc, muOPG[22-194]-Fc, muOPG[22-185]-Fc, muOPG[22-180]-Fc, muOPG[22-401], muOPG[22-401]C195, muOPG[22-401]C202, muOPG[22-401]C277, muOPG[22-401]C319, muOPG[22-401]C400, muOPG[22-185], muOPG[22-194], muOPG[22-200], muOPG[22-212], muOPG[22-293], muOPG[22-355], huOPG[22-401]-Fc, huOPG[22-201]-Fc, huOPG[22-401]-Fc P26A, huOPG[22-401]-Fc Y28F, huOPG[22-401], huOPG[27-401]-Fc, huOPG[29-401]-Fc, huOPG[32-401]-Fc, muOPG met[22-194], muOPG met[22-194] 5k PEG, muOPG met[22-194] 20k PEG, huOPG met[22-194]P25A, huOPG met[22-194]P25A 5k PEG, huOPG met[22-194]P25A 20k PEG, huOPG met[22-194]P25A 31k PEG, huOPG met[22-194]P25A 57k PEG, huOPG met[22-194]Р25А 12k PEG, huOPG met[22-194]P25A 20k разветвленный PEG, huOPG met[22-194]P25A 8k димер PEG, huOPG met[22-194]P25A с дисульфидной поперечной связью (WO-A-97/23614), OPG[22-194]-Fc, OPG[22-201]-Fc, OPG[22-194]-Fc Δ C, OPG [22-201]-Fc Δ C, OPG [22-194]-FcG10, metFc Δ C-OPG[22-194] (WO-A-2001/17543), OPG[22-194]-Fc Δ C, OPG[22-194]-FcG10, Fc Δ C-OPG[22-194], metFc Δ C-OPG[22-194], metFc Δ C-22-194, OPG[22-194]-Fc, OPG[22-194]-Fc Δ C, metOPG[22-194], metOPG[22-201], OPG[22-293], OPG[22-401] и metFc Δ C-22-194 (WO-A-2001/18203).
Из них предпочтительные примеры включают в себя: OCIF-C19S, OCIF-C20S, OCIF-C21S, OCIF-C22S, OCIF-C23S, OCIF-DCR1, OCIF-DCR2, OCIF-DCR3, OCIF-DCR4, OCIF-DDD1, OCIF-DDD2, OCIF-CL, OCIF-CC, OCIF-CDD2, OCIF-CDD1, OCIF-CCR4, OCIF-CCR3, OCIF-CBst, OCIF-CSph, OCIF-CBsp, OCIF-CPst, muOPG[22-401]-Fc, muOPG[22-194]-Fc, muOPG[22-185]-Fc, muOPG[22-401]C195, muOPG[22-401]C202, muOPG[22-401]C319, muOPG[22-401]C400, muOPG[22-194], muOPG[22-200], muOPG[22-293], muOPG[22-355], huOPG[22-401]-Fc, huOPG[22-201]-Fc, huOPG[22-401]-Fc P26A, huOPG[22-401]-Fc Y28F, huOPG[22-401], huOPG[27-401]-Fc, huOPG[29-401]-Fc, huOPG[32-401]-Fc, muOPG met[22-194]5k PEG, muOPG met[22-194]20k PEG, huOPG met[22-194]P25A 5k PEG, huOPG met[22-194]P25A 20k PEG, huOPG met[22-194]P25A 31k PEG, huOPG met[22-194]P25A 57k PEG, huOPG met[22-194]P25A 12k PEG, huOPG met[22-194]P25A 20k разветвленный PEG, huOPG met[22-194]P25A 8k PEG димер, huOPG met[22-194]P25A с дисульфидной поперечной связью, OPG[22-194]-Fc, OPG[22-201]-Fc, OPG [22-194 ]-Fc Δ С, OPG[22-201]-Fc Δ C, OPG [22-194]-FcG10, metFc Δ C-OPG[22-194], OPG[22-194]-Fc Δ C, OPG [22-194]-FcG10, Fc Δ C-OPG[22-194], metFc Δ C-OPG[22-194], metFc Δ C-22-194, OPG[22-194]-Fc, OPG[22-194]-Fc Δ C, metOPG[22-194], metOPG[22-201], OPG[22-293], OPG[22-401] и metFc Δ C-22-194.
OCIF или его аналог или вариант данного изобретения может содержать сахарную цепь в качестве части молекулы. Любой природно продуцируемый OCIF или его аналог или рекомбинантный OCIF или его аналог или вариант может содержать сахарную цепь, которая присоединена к OCIF или его аналогу или варианту посттрансляционно. Природно продуцируемый OCIF или его аналог, содержащий сахарную цепь, может быть получен из культур клеток, тканей, органов, жидкостей тела или клеточных линий, полученных от человека или животных (не человека) при помощи общепринятых способов. Рекомбинантный OCIF или его аналог или вариант, содержащий сахарную цепь, может быть получен из культуры эукариотической клетки-хозяина, трансформированной вектором, содержащим нуклеотидную последовательность, кодирующую OCIF или его аналог или вариант, такой как аналоги и варианты, описанные и приведенные в качестве примеров выше. Примеры подходящих клеток-хозяев, которые могут быть использованы, которые способны к посттрансляционной модификации OCIF или его аналога или варианта таким образом, чтобы присоединить сахарную цепь, включают в себя клетки яичника китайского хомячка и клетки COS [Yasuda, H. et al., Endocrinology, 139, 1329-1337 (1998)]. OCIF или его аналог или вариант, содержащий такую сахарную цепь, пригоден для применения в образовании комплексов данного изобретения.
Если, с другой стороны, желательно получить рекомбинантный OCIF или его аналог или вариант, который не имеет сахарной цепи, которая была присоединена в качестве посттрансляционной модификации, то предпочтительными клетками-хозяевами являются прокариотические клетки, такие как Escherichia coli.
Полисахарид, используемый в образовании комплексов данного изобретения, является полимером (гликаном), получаемым при помощи гликозидной связи двух или нескольких моносахаридов, и предпочтительно является гетерополисахаридом (гетерогликаном), состоящим из по меньшей мере двух различных типов моносахарида. Любой полисахарид, природно встречающийся или синтетический, потенциально может быть использован в комплексе данного изобретения.
В данном изобретении производным полисахарида является полисахарид, в котором по меньшей мере часть молекулы указанного полисахарида заменена одной или несколькими молекулами и/или остатками, иными, чем сахарид или сахар. Предпочтительные производные включают в себя кислые эфиры полисахаридов и особенно предпочтительными являются сульфатные эфиры полисахаридов.
Примеры природных полисахаридов, пригодных для применения в образовании комплексов данного изобретения, включают в себя гиалуроновую кислоту, хондроитинсерную кислоту, дерматан-кислоту, гепаран-кислоту, кератан-кислоту, каррагенан, пектин и гепарин. Примеры синтетических полисахаридов, пригодных для применения в образовании комплексов данного изобретения, включают в себя декстран, тогда как примеры подходящих производных синтетических полисахаридов включают в себя декстрансульфат. Из полисахаридов и их производных наиболее предпочтительным для применения в образовании комплексов данного изобретения является декстрансульфат.
В данном изобретении полисахариды и их производные, такие как декстрансульфат, включают в себя и их соли. Наиболее предпочтительной солью декстрансульфата является его натриевая соль. Примеры натриевых солей декстрансульфата включают в себя натриевую соль декстрансульфата сера 5 (далее называемую DS5: производимую Meito Sangyo Co., Ltd.) и натриевую соль декстрансульфата 5000 и натриевую соль декстрансульфата 10000 (обе производятся Waco Pure Chemical Industries, Ltd.).
Молекулярную массу декстрансульфата рассчитывают следующим образом.
1) Измерение молекулярной массы декстрана
Молекулярная масса декстрана может быть рассчитана согласно рецептуре Sato, приведенной ниже [например, см. Manual for Pharmacopoeia of Japan, the thirteenth revision, published by Hirokawashoten (1998), статья, касающаяся декстрана 40], основанной на измерении предельной вязкости указанного декстрана.
Предельная вязкость = 9,00×10-4 × молекулярная масса0’50
2) Измерение содержания серы
Содержание серы в представляющем интерес декстрансульфате может быть измерено в виде мас.% при помощи любого общепринятого способа, известного в данной области, например способа, описанного в статье, касающейся натриевой соли декстрансульфата сера 5 в Pharmacopoeia of Japan [14th revision, published by Jihou (2001)].
Хотя молекулярная масса глюкозы, которая является элементарным звеном декстрана, равна 180, фактическая молекулярная масса глюкозного звена в молекуле декстрана равна 162, причем эта величина получена вычитанием молекулярной массы воды из 180, так как соседние глюкозные звенья связаны друг с другом α-1,6-гликозидной связью в молекуле декстрана. Атом водорода заменен натрий-сульфатной группой (SO3Na: один грамм-эквивалент = 103) в каждом глюкозном звене декстрансульфата, который замещен таким образом. С использованием этой информации степень замещения молекулы декстрансульфата (называемая далее “степень замещения”) может быть определена из следующей формулы:
Содержание серы (мас.%)=[32 × степень замещения/(162+102 × степень замещения)]×100
3) Расчет молекулярной массы декстрансульфата
Поскольку, как отмечалось выше, действительная молекулярная масса глюкозного звена в декстрансульфате равна 162, молекулярная масса декстрансульфата может быть рассчитана на основании этой информации и степени замещения, определенной, как описано в (2) выше, с использованием следующей формулы:
Молекулярная масса декстрансульфата = молекулярная масса декстрана × (162+102 × степень замещения)/162
Известно, что полисахариды проявляют молекулярно-массовое распределение, например каждый отличающийся тип декстрансульфата проявляет определенное молекулярно-массовое распределение. Молекулярная масса любого полисахарида, используемого в образовании комплексов данного изобретения, дается в виде средней молекулярной массы. Средняя молекулярная масса полисахаридов, используемых в данном изобретении, никаким образом не ограничивается. Диапазон средней молекулярной массы наиболее предпочтительного полисахаридного производного данного изобретения, декстрансульфата, равен обычно 1500-12000 и более предпочтительно равен 1800-6000. Молекулярная масса (среднее±стандартное отклонение) DS5 равна приблизительно 1950±70 (n=7). Степень замещения серы (среднее±стандартное отклонение) DS5, рассчитанная, как описано выше, равно приблизительно 0,32±0,01 (n=7). Средние молекулярные массы натриевой соли декстрансульфата 5000 и натриевой соли декстрансульфата 10000 равны приблизительно 5000 и приблизительно 10000 соответственно. Полисахариды, используемые для получения комплексов данного изобретения, могут быть использованы без какой-либо дополнительной очистки и/или фракционирования или с дополнительной очисткой и/или фракционированием их перед применением. В данном изобретении полисахариды или их производные не включают в себя какую-либо сахарную цепь, которая присоединена к рекомбинантному OCIF или его аналогам или вариантам или к природно продуцируемому OCIF или его аналогам или вариантам посттрансляционно и/или эндогенно в клетках или тканях или теле человека или животных, иных, чем человек.
Молярное отношение вещества, выбранного из группы, состоящей из OCIF, его аналогов и вариантов, к веществу, выбранному из группы, состоящей из полисахаридов и их производных, в комплексах данного изобретения будет варьироваться в зависимости от различных факторов, в том числе идентичности компонентов указанного комплекса и условий, при которых получают этот комплекс. Нет особого ограничения в отношении молярного отношения вещества, выбранного из группы, состоящей из OCIF, его аналогов и вариантов, к веществу, выбранному из группы, состоящей из полисахаридов и их производных, в комплексах данного изобретения. В предпочтительных комплексах данного изобретения, содержащих вещество, выбранное из группы, состоящей из OCIF, его аналогов и его вариантов, и декстрансульфат, молярное отношение указанного вещества, выбранного из группы, состоящей из OCIF, его аналогов и его вариантов, к декстрансульфату равно от 1:1 до 1:10; более предпочтительно это молярное отношение равно от 1:1 до 1:8; еще более предпочтительно это молярное отношение равно от 1:1 до 1:5 и наиболее предпочтительно это молярное отношение равно от 1:1 до 1:4,5.
Как уже упоминалось выше, OCIF или его аналог или вариант могут существовать в виде мономера или могут образовывать димеры, так что OCIF или его аналог или вариант, присутствующие в комплексах данного изобретения, могут быть гомодимером или гетеродимером или они могут быть гомоолигомером, гетероолигомером, гомополимером или гетерополимером, содержащим более чем две мономерные единицы OCIF, его аналога или его варианта (например, см. патент США US 6369027). Молярное отношение вещества, выбранного из группы, состоящей из OCIF, его аналогов и вариантов, к веществу, выбранному из группы, состоящей из полисахаридов и их производных, в комплексе, содержащем OCIF или его аналог или вариант и полисахариды или их производное, рассчитывают в виде числа молекул полисахарида или его производного на мономерное звено OCIF, его варианта или его аналога.
Число молекул полисахарида или его производного в комплексе данного изобретения предпочтительно может быть определено следующим образом. Содержание нейтрального сахара испытуемого комплекса [обозначенного как (х)] и это же содержание ссылочной пробы, которая содержит не находящийся в комплексе, свободный OCIF или его аналог или вариант [обозначенной как (y)], количественно определяют с использованием способа с применением фенола и серной кислоты (который описан подробно в другом месте данной заявки). Затем количество полисахарида или его производного, которое связано с OCIF или его аналогом или вариантом в испытуемом комплексе, определяют вычитанием (y) из (х). С использованием полученного таким образом числа число молекул полисахарида или его производного, которые связаны с OCIF или его аналогом или вариантом, рассчитывают согласно (I) или (II), как указано ниже:
(I) Полученное число для количества полисахарида или его производного, которое связано с OCIF или его аналогом или вариантом, делят на среднюю молекулярную массу указанного полисахарида или его производного. Полученное число представляет общее число молекул полисахарида или его производного в испытуемом комплексе.
(II) Полученное число для количества полисахарида или его производного, которое связано с OCIF или его аналогом или вариантом, делят на количество (мг) указанного OCIF, его аналога или варианта в указанном комплексе. Затем полученное число, которое является количеством полисахарида или его производного на 1 мг OCIF, его аналога или варианта в этом комплексе, используют для расчета числа молекул полисахарида или его производного на одну молекулу OCIF, его аналога или варианта на основе молекулярной массы указанного OCIF, его аналога или варианта [например, в соответствии с примером 4(d), ниже].
Число молекул OCIF или его аналога или варианта в комплексе данного изобретения предпочтительно может быть определено с использованием способа иммунологического анализа, такого как способы, описанные в другом месте данной заявки.
Предпочтительным признаком комплексов данного изобретения, который может быть использован для их характеристики, является их аффинность в отношении гепарина. Гепарин является полисахаридом, содержащим D-глюкозамин, D-глюкуроновую кислоту и D-идуроновую кислоту, который частично или полностью модифицирован сульфатными и ацетильными группами. Предпочтительным признаком комплексов данного изобретения является то, что прочность адсорбции указанного комплекса OCIF или его аналога или варианта с гепарином является более низкой, чем прочность адсорбции свободного, не находящегося в комплексе OCIF или его аналога или варианта. Степень адсорбции может быть определена с использованием колонки, упакованной гранулами сшитой в высокой степени агарозы, на которых был иммобилизован гепарин (например, гепарин, полученный из слизистой оболочки бычьего кишечника). Подходящие колонки этого типа включают в себя колонку HiTrap heparin HP, HiPrep 16/10 Heparin и Heparin Sepharose (все могут быть получены из Amersham Pharmacia). Прочность адсорбции (аффинность) комплекса может быть определена согласно любому подходящему способу, который хорошо известен квалифицированному специалисту в данной области, для определения аффинности белков в отношении полисахаридов. Предпочтительно степень адсорбции может быть определена сравнением количества комплекса, который связывается с колонкой гепарина в условиях низкой ионной силы, но который элюируется из указанной колонки в условиях высокой ионной силы, с количеством комплекса, который не связывается с колонкой гепарина в условиях низкой ионной силы (ионная сила может устанавливаться с использованием соли сильной кислоты, такой как хлорид натрия). Таким образом, степень адсорбции комплекса на гепарине может быть определена следующим образом:
(a) Колонку, упакованную носителем, таким как гранулы сшитой агарозы, на которых был иммобилизован гепарин, уравновешивают буфером, имеющим относительно низкую ионную силу (например, натрий-фосфатным буфером, содержащим 0,1-0, 8 М хлорида натрия).
(b) Комплекс данного изобретения, который тестируется, растворяют в том же самом буфере низкой ионной силы, который используют в (а), и наносят на колонку и затем собирают первый элюат (фракцию А).
(c) Затем колонку промывают дополнительно тем же самым буфером низкой ионной силы, который используют в стадии (а), и собирают второй элюат (фракцию В).
(d) Затем колонку промывают буфером, имеющим относительно высокую ионную силу (например, натрий-фосфатным буфером, содержащим 1,0-2,0 М хлорида натрия) и затем собирают третий элюат (фракцию С).
(e) Затем определяют количество комплекса, присутствующего в каждой из фракций А, В и С [обозначенных (а), (b) и (с) соответственно] (например, при помощи иммуноанализа).
(f) Затем определяют степень адсорбции комплекса на гепарине согласно следующей формуле:

Чем больше прочность связывания этого комплекса с колонкой, тем больше величина (с) (так как он может быть удален из колонки с использованием элюентов, имеющих относительно высокую ионную силу) и, следовательно, тем выше степень адсорбции. Степень адсорбции комплексов данного изобретения, измеренная по приведенной выше формуле, будет варьироваться в некоторой степени в зависимости от типа гепариновой колонки и условий, в которых проводят определение. Однако степень адсорбции свободного, не находящегося в комплексе OCIF всегда будет равна приблизительно 1,0, тогда как степень адсорбции комплексов OCIF данного изобретения равна менее чем 1,0, что демонстрирует то, что прочность связывания комплексов, содержащих OCIF или его аналог или вариант по данному изобретению, с гепарином является более слабой, чем прочность связывания свободного, не находящегося в комплексе OCIF или его аналога или варианта (например, с использованием свиного гепарина, иммобилизованного на агарозных гранулах, таких как колонка HiTrap heparin HP, первой и второй элюций 10 мМ натрий-фосфатным буфером, содержащим 0,7 М хлорида натрия, и третьей элюций 10 мМ натрий-фосфатным буфером, содержащим 2,0 М хлорида натрия, степень адсорбции комплексов данного изобретения, содержащих OCIF или его аналог или вариант, составляет не более 0,7, предпочтительно не более 0,6 и особенно предпочтительно не более 0,5).
Другим предпочтительным признаком комплексов данного изобретения, который может быть использован для их характеристики, является отношение числа молекул OCIF или его аналога или варианта, присутствующих в указанном комплексе, измеренного способом иммунологического анализа (например, ELISA), к числу молекул OCIF или его аналога или варианта, присутствующих в указанном комплексе, измеренного по способу измерения общего числа белка, присутствующего в указанном комплексе [например, по способу Лоури: Lowry, O.H. et al., J. Biol. Chem., 193, 263-275 (1951), по поглощению (λ 280) при окрашивании серебром или по БСА-способу].
Число молекул OCIF или его аналога или варианта, присутствующих в указанном комплексе, может быть измерено способом иммунологического анализа при помощи, например, ELISA. Антителами для применения в связывании с иммобилизованной фазой или для мечения репортерным ферментом, таким как пероксидаза, в ELISA являются любые антитела к представляющему интерес OCIF или его аналогу или варианту, которые являются пригодными для этой цели. Например, подходящие антитела для связывания с твердой фазой включают в себя OI-26, выделенные из культуры гибридомы, продуцирующей антитело OI-26 (FERM BP-6421), и OI-19, выделенные из культуры гибридомы, продуцирующей антитело OI-19 (FERM ВР-6420), тогда как подходящие антитела для применения в качестве антитела, меченного репортерным ферментом, в подвижной фазе, включают в себя моноклональное антитело OI-4, выделенное из культуры гибридомы, продуцирующей антитело OI-4 (FERM ВР-6419), меченное пероксидазой. Типичной процедурой для измерения числа молекул OCIF или его аналога или варианта в комплексе является следующая процедура:
(a) Известные концентрации свободного, не находящегося в комплексе OCIF используют для получения калибровочной кривой.
(b) Проводят ELISA на представляющем интерес комплексе и затем калибровочную кривую используют для определения концентрации OCIF.
(c) С использованием информации, полученной в (b), и молекулярной массы мономера OCIF рассчитывают число молекул OCIF в испытуемом комплексе.
Число молекул OCIF или его аналога или варианта, присутствующих в указанном комплексе, измеренное по способу измерения общего количества белка, присутствующего в указанном комплексе, может быть определено с использованием, например, способа Лоури. Типичной является следующая процедура:
(a) Известные концентрации бычьего сывороточного альбумина используют для получения калибровочной кривой.
(b) Затем используют способ Лоури для определения общей концентрации белка в испытуемом комплексе, причем калибровочную кривую используют для определения концентрации OCIF.
(c) С использованием информации, полученной в (b), и молекулярной массы мономера OCIF рассчитывают число молекул OCIF в испытуемом комплексе.
Фактическое отношение варьируется в зависимости от типа используемого способа иммуноанализа и/или способа, используемого для измерения общего белка. Предпочтительный вариант данного изобретения включает в себя комплекс происходящего от человека OCIF или его аналога или варианта с декстрансульфатом, в котором отношение числа молекул указанного OCIF или его аналога или варианта, присутствующих в указанном комплексе, определенных твердофазным иммуноферментным анализом (ELISA) с использованием моноклонального антитела против OCIF человека (FERM BP-6420) в качестве антитела, связанного с твердой фазой, и моноклонального антитела OI-4 против OCIF человека, очищенного из культуры гибридомы, продуцирующей антитело OI-4 (FERM BP-6419), меченное пероксидазой, в подвижной фазе, к числу молекул OCIF или его аналога или варианта, присутствующих в указанном комплексе, определенному измерением содержания общего белка при помощи способа Лоури, равно по меньшей мере 0,5, но не более 1,2. Более предпочтительно, это отношение равно по меньшей мере 0,6, но не более 1,1, и наиболее предпочтительно это отношение равно по меньшей мере 0,7, но не более 1,1.
Предпочтительные комплексы данного изобретения включают в себя:
(а) комплекс, в котором указанное вещество, выбранное из группы, состоящей из OCIF, его аналогов и его вариантов, представляет собой мономерный OCIF человека, имеющий молекулярную массу, измеренную при помощи электрофореза в ДСН-ПААГ в невосстанавливающих условиях, приблизительно 60000, или димерный OCIF человека, имеющий молекулярную массу приблизительно 120000, измеренную при помощи электрофореза в ДСН-ПААГ в невосстанавливающих условиях, и указанные полисахариды и их производные выбраны из группы, состоящей из гиалуроновой кислоты, хондроитинсерной кислоты, дерматан-кислоты, гепаран-кислоты, кератан-кислоты, каррагенана, пектина и гепарина, декстрана и их производных, причем молярное отношение указанного вещества, выбранного из группы, состоящей из OCIF, его аналогов и его вариантов, к указанному веществу, выбранному из группы, состоящей из полисахаридов и их производных, равно от 1:1 до 1:10;
(b) комплекс, в котором указанное вещество, выбранное из группы, состоящей из OCIF, его аналогов и его вариантов, представляет собой мономерный OCIF человека, имеющий молекулярную массу, измеренную при помощи электрофореза в ДСН-ПААГ в невосстанавливающих условиях, приблизительно 60000, или димерный OCIF человека, имеющий молекулярную массу приблизительно 120000, измеренную при помощи электрофореза в ДСН-ПААГ в невосстанавливающих условиях, и указанные полисахариды и их производные выбраны из группы, состоящей из декстрансульфата и его солей, причем молярное отношение указанного вещества, выбранного из группы, состоящей из OCIF, его аналогов и его вариантов, к указанному веществу, выбранному из группы, состоящей из полисахаридов и их производных, равно от 1:1 до 1:10;
(c) комплекс, в котором указанное вещество, выбранное из группы, состоящей из OCIF, его аналогов и его вариантов, представляет собой мономерный или димерный OCIF человека, в котором указанный мономер или одно из звеньев указанного димера OCIF содержит аминокислоты +1 - +380 SEQ ID NO:1 списка последовательностей, а указанное производное полисахарида представляет собой натриевую соль декстрансульфата, имеющую среднюю молекулярную массу от 1500 до 12000, причем молярное отношение указанного вещества, выбранного из группы, состоящей из OCIF, его аналогов и его вариантов, к указанной натриевой соли декстрансульфата равно от 1:1 до 1:10;
(d) комплекс по (с), где молярное отношение указанного вещества, выбранного из группы, состоящей из OCIF, его аналогов и его вариантов, к указанной натриевой соли декстрансульфата равно от 1:1 до 1:8;
(e) комплекс по (с), где молярное отношение указанного вещества, выбранного из группы, состоящей из OCIF, его аналогов и его вариантов, к указанной натриевой соли декстрансульфата равно от 1:1 до 1:5; и
(f) комплекс по любому из (с)-(е), где указанное производное полисахарида представляет собой натриевую соль декстрансульфата, имеющую среднюю молекулярную массу от 1800 до 6000.
Комплексы данного изобретения могут быть получены с использованием любого подходящего способа, который способствует связыванию полисахарида или его варианта с OCIF или его аналогом или вариантом. В следующем варианте данного изобретения обеспечен способ получения комплекса, содержащего по меньшей мере одно вещество, выбранное из группы, состоящей из OCIF, его аналогов и его вариантов, которое связано по меньшей мере с одним веществом, выбранным из группы, состоящей из полисахаридов и их производных, причем указанный способ предусматривает стадии инкубирования указанного по меньшей мере одного вещества, выбранного из группы, состоящей из OCIF, его аналогов и его вариантов, с указанным по меньшей мере одним веществом, выбранным из группы, состоящей из полисахаридов и их производных, в условиях, благоприятствующих образованию комплекса между указанным OCIF, его аналогами или его вариантами и указанными полисахаридами или их вариантами, и затем удаление любых свободных полисахаридов или их вариантов, которые не связаны с указанными OCIF, его аналогами или вариантами.
Инкубирование указанного по меньшей мере одного вещества, выбранного из группы, состоящей из OCIF, его аналогов и его вариантов, с указанным по меньшей мере одним веществом, выбранным из группы, состоящей из полисахаридов и их производных, выполняют в любых подходящих условиях, но обычно инкубирование имеет место в водных условиях. Предпочтительно инкубирование выполняют в щелочных условиях. Более предпочтительно инкубирование выполняют при рН от 9,5 до 12. Наиболее предпочтительно инкубирование выполняют при рН от 10 до 11.
Во время инкубирования диапазон концентрации указанного OCIF, его аналога или варианта в водном растворе не ограничивается особо, пока он является подходящим для образования желаемого комплекса. Обычно максимальная концентрация указанного OCIF, его аналога или варианта в водном растворе равна от 0,1 до 0,5 мМ, а минимальная концентрация равна от 0,001 до 0,05 мМ. Предпочтительно концентрация указанного OCIF, его аналога или варианта в водном растворе равна от 0,01 до 0,2 мМ и наиболее предпочтительно она равна от 0,05 до 0,1 мМ. В случае OCIF максимальная концентрация в водном растворе равна от 10 до 50 мг/мл, а минимальная концентрация равна от 0,1 до 5 мг/мл. Предпочтительно концентрация OCIF в водном растворе равна от 1 до 20 мг/мл и более предпочтительно она равна от 5 до 10 мг/мл.
Во время инкубирования диапазон концентрации указанного полисахарида или его варианта в водном растворе не ограничивается особо, пока он является подходящим для образования желаемого комплекса. Обычно максимальная концентрация указанного полисахарида или его производного в водном растворе равна от 0,1 до 0,5 М, а минимальная концентрация равна от 0,00005 до 0,05 М. Предпочтительно концентрация указанного полисахарида или его производного в водном растворе равна от 0,005 до 0,25 М и наиболее предпочтительно она равна от 0, 05 до 0,1 М. В случае натриевой соли декстрансульфата сера 5 максимальная концентрация указанного полисахарида или его варианта в водном растворе равна от 200 до 1000 мг/мл, а минимальная концентрация равна от 0,1 до 100 мг/мл. Предпочтительно концентрация указанного полисахарида или его варианта в водном растворе равна от 10 до 500 мг/мл и наиболее предпочтительно она равна от 100 до 200 мг/мл.
Во время инкубирования температура конкретно не ограничивается, пока она является подходящей для образования желаемого комплекса. Обычно верхний предел температуры для инкубирования равен от 10 до 50°С, а нижний предел ее равен от 0 до 4°С. Предпочтительно диапазон температур составляет от 4 до 37°С и наиболее предпочтительно диапазон температур составляет от 4 до 10°С.
Как отмечалось выше, комплекс данного изобретения не содержит свободных полисахаридов или их вариантов, которые не связаны с OCIF или его аналогом или вариантом. Способ, используемый для удаления свободных полисахаридов и их вариантов, не ограничивается, пока он является способом, который удобно используется в таких процедурах, как очистка, выделение и/или фракционирование. Примеры подходящих способов включают в себя ионообменную хроматографию, адсорбционную хроматографию, распределительную хроматографию, гель-фильтрационную хроматографию, гидрофобную хроматографию, аффинную хроматографию, кристаллизацию, высаливание и ультрафильтрацию. Из них предпочтительными являются гель-фильтрационная хроматография (далее называемая “гель-фильтрацией”) и ультрафильтрация, а гель-фильтрация является наиболее предпочтительной.
Нет особого ограничения в отношении геля, используемого для гель-фильтрации при удалении свободных полисахаридов или их вариантов из желаемого комплекса после инкубирования, так как он может быть использован для отделения фракции, содержащей желаемый комплекс, от свободного полисахарида или его вариантов, которые не связаны с OCIF. Подходящие примеры включают в себя агарозный гель, декстрановый гель и полиакриламидный гель.
Комплексы данного изобретения, содержащие по меньшей мере одно вещество, выбранное из группы, состоящей из OCIF, его аналогов и вариантов, которое связано по меньшей мере с одним веществом, выбранным из группы, состоящей из полисахаридов и их производных, могут быть отличены от свободного, не находящегося в комплексе OCIF или его аналога или варианта per se с использованием различных приемов, в том числе по изоэлектрической точке, по содержанию сахара и путем иммунологического детектирования.
Изоэлектрическая точка может быть измерена любым общепринятым способом изоэлектрического электрофореза, хорошо известным специалистам в данной области. OCIF является основным белком, и его изоэлектрическая точка равна приблизительно рI 9. Это значительно выше, чем изоэлектрическая точка комплексов данного изобретения, содержащих OCIF и полисахариды и их варианты, такие как декстрансульфат, типичные величины рI которых находятся в области 5-7. Таким образом, с использованием этого способа можно легко отличить находящийся в комплексе и не находящийся в комплексе OCIF.
Содержание сахара комплексов данного изобретения и свободного, не находящегося в комплексе OCIF или его аналога или варианта может быть измерено с использованием любого способа, обычно используемого для количественного определения содержания нейтральных сахаров, причем типичные примеры включают в себя способ с фенолом и серной кислотой [М. Dibois et al., Anal. Chem., 28, 350 (1956)]. Поскольку содержание общего сахара комплекса данного изобретения, содержащего OCIF или его аналог или вариант, и полисахарид или его вариант, является более высоким, чем содержание самого OCIF, они могут быть отличены друг от друга.
Другим альтернативным способом для отличения не находящегося в комплексе OCIF или его аналога или варианта от комплексов данного изобретения, содержащих указанный OCIF или его аналог или вариант, связанный с полисахаридом или его вариантом, является определение количества полисахарида или его варианта в каждом из них с использованием антитела, которое специфически связывается с указанным полисахаридом или вариантом.
Для измерения количества белка в OCIF или его аналоге или варианте или в комплексе данного изобретения, содержащем OCIF или его аналог или вариант и полисахарид или его вариант, может быть использован любой способ, обычно применяемый для измерения содержания общего белка. Подходящие примеры включают в себя метод Лоури [Lowry, O.H. et al., J. Biol. Chem., 193, 263-275 (1951)], поглощение (λ 280 нм) при окрашивании серебром и БСА-способ.
Свободный, не находящийся в комплексе OCIF или его аналог или вариант, или OCIF или его аналог или вариант, присутствующий в комплексе данного изобретения, может быть измерен иммунологически с использованием способа, который применяет по меньшей мере одно моноклональное антитело против OCIF. Примеры подходящих моноклональных антител против OCIF, предпочтительно используемых для иммунологического измерения OCIF человека, включают в себя антитело, продуцируемое гибридомой OI-19 (FERM ВР-6420), антитело, продуцируемое гибридомой OI-4 (FERM BP-6419), и антитело, продуцируемое гибридомой OI-26 (FERM BP-6421) (например, см. WO-A-99/15691). Эти антитела называют “антитело OI-19”, “антитело OI-4” и “антитело OI-26” соответственно в данном изобретении. Антитело OI-19 и антитело OI-4 связывают как мономер OCIF, так и димер OCIF с эквивалентной аффинностью, тогда как OI-26 специфически связывает димер OCIF. Иммунологическое измерение может быть выполнено с использованием антител этого типа в соответствии с любым способом, хорошо известным специалисту в данной области (например, см. WO-A-99/15691). Примеры подходящих способов включают в себя иммуноферментный анализ (указанный как “EIA”), радиоиммунный анализ, иммуноферментный твердофазный анализ (ELISA) и сэндвич-иммуноферментный анализ (сэндвич-EIA). Из них предпочтительным является ELISA. Если OCIF имеет человеческое происхождение, ELISA может быть предпочтительно использован с использованием антитела OI-19 или антитела OI-26 в качестве иммобилизованного антитела и антитела OI-4 в качестве меченного ферментом антитела. Предпочтительным ферментом, используемым для мечения антитела, является пероксидаза (называемая “POD”).
Гибридома, продуцирующая антитело OI-4, была депонирована как “OI-4” в National Institute of Bioscience and Human-Technology Agency of Industrial Science and Technology at 1-3, Higashi 1 chome, Tsukuba-shi Ibaraki-ken 305-8566 Japan (который стал с тех пор Международным Депозитарием патентуемых организмов, National Institute of Advanced Industrial Science and Technology at AIST Tsukuba Central 6, 1-1, Higashi 1 chome, Tsukuba-shi Ibaraki-ken 305-8566 Japan) 16 октября 1997 (Heisei-9), и ей был присвоен номер FERM Р-16473. Она была перенесена в международный депозитарий с номером депозита FERM BP-6419 13 июля 1998 (Heisei-10).
Гибридома, продуцирующая антитело OI-19, была депонирована как “OI-19” в National Institute of Bioscience and Human-Technology Agency of Industrial Science and Technology at 1-3, Higashi 1 chome, Tsukuba-shi Ibaraki-ken 305-8566 Japan (который стал с тех пор Международным Депозитарием патентуемых организмов, National Institute of Advanced Industrial Science and Technology at AIST Tsukuba Central 6, 1-1, Higashi 1 chome, Tsukuba-shi Ibaraki-ken 305-8566 Japan) 16 октября 1997 (Heisei-9), и ей был присвоен номер FERM P-16474. Она была перенесена в международный депозитарий с номером депозита FERM BP-6420 13 июля 1998 (Heisei-10).
Гибридома, продуцирующая антитело OI-26, была депонирована как “OI-26” в National Institute of Bioscience and Human-Technology Agency of Industrial Science and Technology at 1-3, Higashi 1 chome, Tsukuba-shi Ibaraki-ken 305-8566 Japan (который стал с тех пор Международным Депозитарием патентуемых организмов, National Institute of Advanced Industrial Science and Technology at AIST Tsukuba Central 6, 1-1, Higashi 1 chome, Tsukuba-shi Ibaraki-ken 305-8566 Japan) 16 октября 1997 (Heisei-9), и ей был присвоен номер FERM Р-16475. Она была перенесена в международный депозитарий с номером депозита FERM BP-6421 13 июля 1998 (Heisei-10) (см. WO-A-99/15691).
Концентрация в крови или сыворотке комплекса данного изобретения, содержащего OCIF или его аналог или вариант и полисахарид или его вариант, может быть измерена следующим образом. Сначала указанный комплекс вводят человеку или животному (не человеку). Затем после определенной продолжительности времени из него берут кровь или сыворотку. Затем концентрацию указанного комплекса в крови или сыворотке измеряют с использованием ELISA при помощи по меньшей мере одного моноклонального антитела против OCIF, как описано в другом месте в данной заявке (см. WO-A-99/15691).
Комплекс данного изобретения, содержащий по меньшей мере одно вещество, выбранное из группы, состоящей из OCIF, его аналогов и вариантов, которое связано по меньшей мере с одним веществом, выбранным из группы, состоящей из полисахаридов и их производных, применимо в лечении или предупреждении костных метаболических заболеваний. В данном изобретении костными метаболическими заболеваниями являются любые заболевания, которые характеризуются пониженным нетто-количеством кости у пациента, страдающего от такого заболевания, и у которого необходимо ингибировать резорбцию костей и/или скорость резорбции костей для лечения или предупреждения указанного заболевания. Костные метаболические заболевания, которые могут лечиться или предупреждаться комплексом данного изобретения, включают в себя: первичный остеопороз (сенильный остеопороз, постменопаузальный остеопороз и идиопатический ювенильный остеопороз); эндокринный остеопороз (гипертиреоз, гиперпаратиреоз, синдром Кушинга и акромегалия); остеопороз, сопровождающий гипогонадизм (гипопитуитаризм, синдром Кляйнфельтера и синдром Тернера); наследственный и врожденный остеопороз (несовершенный остеогенез, гомоцистинурия, синдром Менкеса и синдром Райли-Дея); остеопению, вызываемую ослаблением гравитационной нагрузки или фиксацией и иммобилизацией конечностей; болезнь Педжета; остеомиелит; инфекционный очаг, обусловленный разрежением кости; гиперкальциемию, возникающую из-за солидной карциномы (например, рака молочной железы, рака легкого, рака почки и рака предстательной железы); гематологическое злокачественное заболевание (множественная миелома, лимфома и лейкемия); идиопатическую гиперкальциемию; гиперкальциемию, сопровождающую гипертиреоз или дисфункцию почки; остеопению, возникающую вследствие введения других лекарственных средств (например, иммуносупресоров, таких как метотрексат и циклоспорин А, гепарина и антиэпилептических средств); остеопению, возникающую вследствие дисфункции почек; остеопению, возникающую вследствие хирургической операции или заболевания органа пищеварения (например, нарушения тонкой кишки, нарушения толстой кишки, хронического гепатита, гастрэктомии, билиарного цирроза печени и цирроза печени); остеопению, обусловленную различными типами ревматизма, такими как ревматоидный артрит, остеоклазия; деструкцию суставов, вызываемую различными типами ревматизма, такими как ревматоидный артрит; фиброзит; остеоартрит; разрежение периодонтальной костной ткани; раковое метастазирование кости (размягчение и разрушение костной ткани); остеонекроз или гибель остеоцитов, сопровождающие травматическое повреждение, болезнь Гоше, серповидно-клеточную анемию, системную красную волчанку или нетравматическое повреждение; остеодистрофию, например почечную остеодистрофию; остеопению, сопровождающую гипощелочную фосфатазаемию или диабеты; остеопению, сопровождающую нарушения питания или нарушения приема пищи; и другие остеопении. Костные метаболические заболевания включают в себя также кахексию, вызываемую солидной карциномой или раковым метастазированием костей или гематологическим злокачественным заболеванием (см. публикацию заявки на патент Японии 2000-178200).
Таким образом, композиция, которая содержит комплекс данного изобретения, содержащий по меньшей мере одно вещество, выбранное из группы, состоящей из OCIF, его аналогов и вариантов, которое связано по меньшей мере с одним веществом, выбранным из группы, состоящей из полисахаридов и их производных, вместе с фармацевтически приемлемым носителем или разбавителем, может быть безопасно введена перорально или неперорально человеку или животному (не человеку). Дозированная форма может быть подходящим образом выбрана и она будет варьироваться в зависимости от различных факторов, таких как тип подлежащего лечению заболевания, степень указанного заболевания, и от возраста, пола и веса пациента. Например, этот комплекс может вводиться перорально в форме таблеток, капсул, порошков, гранул или сиропов, инъецироваться внутривенно отдельно или в комбинации с общепринятыми вспомогательными агентами, такими как глюкоза, аминокислоты или т.п., инъецироваться внутримышечно, подкожно, внутрикожно или внутрибрюшинно отдельно, вводиться чрескожно в форме припарки, вводиться трансназально в форме капель для носа, вводиться через слизистую оболочку или в полость рта в форме агента для нанесения на слизистую оболочку или вводиться интраректально в форме суппозитория. Эти препараты могут быть приготовлены общепринятым образом с использованием хорошо известных добавок, обычно применяемых в области медицины, таких как эксципиенты, связывающие агенты, дезинтегранты, смазывающие агенты, ароматизирующие агенты, солюбилизаторы, суспендируюшие агенты, красители, регуляторы рН, антисептические агенты, гелеобразующие агенты, поверхностно-активные вещества и средства для покрытия.
При приготовлении комплексов данного изобретения в виде таблеток могут быть использованы любые носители, известные в данной области. Эти носители включают в себя, например, наполнители, такие как лактоза, белый сахар, хлорид натрия, глюкоза, мочевина, крахмал, карбонат кальция, каолин, кристаллическая целлюлоза, силикат или т.п.; связывающие агенты, такие как вода, этанол, пропанол, простой сироп, раствор глюкозы, раствор крахмала, раствор желатина, карбоксиметилцеллюлоза, шеллак, метилцеллюлоза, фосфат калия, поливинилпирролидон или т.п.; дезинтеграторы, такие как сухой крахмал, альгинат натрия, порошок агара, порошок ламинарана, гидрокарбонат натрия, кислый карбонат кальция, эфиры жирных кислот и полиоксиэтиленсорбитана, лаурилсульфат натрия, моноглицерид стеариновой кислоты, крахмал, лактоза или т.п.; ингибиторы разрушения, такие как белый сахар, стеарин, масло какао, гидрогенизированное масло или т.п.; ускорители абсорбции, такие как основания четвертичного аммония, лаурилсульфат натрия или т.п.; увлажняющие агенты, такие как глицерин, крахмал или т.п.; абсорбенты, такие как крахмал, лактоза, каолин, бентонит, коллоидный силикат или т.п.; и смазывающие вещества, такие как очищенный тальк, стеариновая кислота, соли металлов стеариновой кислоты, такие как стеарат кальция и стеарат магния, тальк, порошок борной кислоты, полиэтиленгликоль и т.п. Кроме того, если желательно, таблетки могут иметь покрытия, например, для образования покрытой сахаром таблетки, покрытой желатином таблетки, таблетки с энтеросолюбильным покрытием, покрытой пленкой таблетки, таблетки с двойным покрытием или таблетки с многослойным покрытием.
При приготовлении комплексов данного изобретения в виде пилюль, препарат может содержать носители, известные в данной области, например наполнители, такие как глюкоза, лактоза, масло какао, порошок крахмала, отвержденное растительное масло, каолин, тальк или т.п.; связывающие агенты, такие как порошок аравийской камеди, порошок трагаканта, желатин, этанол или т.п.; и дезинтеграторы, такие как ламинаран, агар или т.п.
При приготовлении комплексов данного изобретения в виде суппозитория препарат может содержать общепринятые носители, такие как полиэтиленгликоль, масло какао, высшие спирты, сложные эфиры высших спиртов, желатин, полусинтетический глицерид или т.п.
При приготовлении комплексов данного изобретения в виде инъекционных растворов предпочтительно этот препарат в форме раствора или суспензии стерилизуют и делают изотоничным по отношению к крови. Если препараты находятся в форме раствора, эмульсии или суспензии, может быть использован любой разбавитель, известный и обычно используемый в данной области, примеры которого включают в себя воду, этанол, пропиленгликоль, этоксилированный изостеариловый спирт, полиоксилированный изостеариловый спирт и эфиры жирных кислот и полиоксиэтиленсорбитана. Кроме того, в таких инъекционных композициях эти препараты могут также содержать соли, глюкозу, глицерин или т.п. в количестве, достаточном для поддержания изотоничности по отношению к крови. Они могут также содержать дополнительные агенты, в том числе солюбилизаторы, буферные агенты, обезболивающие агенты, регуляторы рН, стабилизаторы и солюбилизирующие агенты. Инъекционные растворы могут быть лиофилизированы после приготовления.
Препараты данного изобретения могут также содержать дополнительные добавки, такие как красящие агенты, консерванты, отдушки, улучшающие вкус и запах агенты, подсластители или другие ингредиенты.
Нет особых ограничений в отношении количества комплекса данного изобретения, содержащего по меньшей мере одно вещество, выбранное из группы, состоящей из OCIF, его аналогов и вариантов, и по меньшей мере одно вещество, выбранное из группы, состоящей из полисахаридов и их вариантов, которое присутствует в композиции для введения для того, чтобы предотвратить или лечить костное метаболическое заболевание, но оно находится обычно в количестве 0,1-70% по массе и предпочтительно 1-30% по массе всей композиции.
Доза комплекса в соответствии с данным изобретением будет варьироваться в зависимости от различных факторов, в том числе подлежащего лечению состояния, возраста, пола и веса тела пациента и способа введения. Однако количество, вводимое взрослому человеку, обычно находится в диапазоне, имеющем верхний предел от -30 до 1000 мг и нижний предел от 0,001 до 0,03 мг в день. Предпочтительный диапазон составляет от 0,03 до 30 мг в день. Вводимое количество обычно находится в диапазоне, имеющем верхний предел от 1 до 20 мг/кг в день и нижний предел от 0,01 до 0,5 мкг/кг в день. Предпочтительный диапазон составляет от 0,5 мкг/кг до 1 мг/кг в день. Комплекс данного изобретения может быть введен один раз в день или больше, чем один раз в день, в зависимости от таких факторов, как форма введения и состояние пациента.
Следующие примеры, ссылочные примеры и тест-примеры предназначены для дополнительной иллюстрации данного изобретения и не предназначены для ограничения каким-либо образом данного изобретения.
Пример 1
Получение комплексов, содержащих OCIF и декстрансульфат (I)
1(а) Получение рекомбинантного димерного OCIF человека
Рекомбинантный димерный OCIF человека, имеющий молекулярную массу около 120000, получали в соответствии с процедурой, описанной в ЕР-А-0816380 (WO-A-96/26217) в примерах. А именно, pBKOCIF, плазмидный вектор, содержащий нуклеотидную последовательность, которая кодирует OCIF человека, содержащий сигнальный пептид, полученный из pBK/01F10 штамма-трансформанта Е. coli [депонированный в виде FERM ВР-5267 согласно Budapest Treaty в National Institute of Bioscience and Human-Technology Agency of Industrial Science and Technology at 1-3, Higashi 1 chome, Tsukuba-shi Ibaraki-ken 305-8566 Japan (который стал с тех пор Международным Депозитарием патентуемых организмов, National Institute of Advanced Industrial Science and Technology), полученный согласно примеру 11 ЕР-А-0816380, расщепляли рестриктазами SalI и EcoRI. Нуклеотид, который кодирует OCIF человека, содержащий сигнальный пептид, который является эквивалентом кДНК OCIF человека, извлекали в соответствии с процедурой, описанной в примере 14 ЕР-А-0816380. После выделения и очистки указанного нуклеотида его встраивали в экспрессирующий вектор pcDL-SR α296 (Molecular and Cellular Biology, vol.8, p.466, 1988) и затем штамм Е. coli DH5 α (Gibco BRL) трансформировали им (см. процедуру, описанную в примере 14 ЕР-А-0816380). Полученный таким образом рекомбинантный вектор, названный pSRαOCIF, экстрагировали из указанной культуры трансформанта и очищали.
Затем применяли процедуру примера 14 ЕР-А-0816380 для получения желаемого рекомбинантного зрелого OCIF человека. А именно, клетки СНО dhFr (ATCC CRL 9096) трансфицировали рекомбинантной плазмидой pSRαOCIF, полученной, как описано выше, и отбирали плазмиду, экспрессирующую дигидрофолатредуктазу (DHFR) (плазмиду pBAdDSV, описанную в WO-A-92/01053), а затем экспрессирующий DHFR трансфектант. Трансформанты, которые экстрагировали большие количества OCIF, клонировали. Клоны, кондиционированная среда которых содержала OCIF в высокой концентрации, отбирали и получали клон, экспрессирующий наибольшее количество OCIF, а именно - 5561. Культуру полученного таким образом клона 5561 кондиционировали и фильтровали и затем наносили на колонку Heparin Sepharose-FF (2,6×10 см, Pharmacia Co.) и подвергали колоночной хроматографии с использованием линейного градиента хлорида натрия в качестве элюента. Затем фракцию, имеющую активность OCIF, элюируемую приблизительно от 0,6 до 1,2 М хлорида натрия, наносили на аффинную колонку (blue-5PW, 0,5×5,0 см, Tosoh Co) и подвергали аффинной хроматографии с использованием линейного градиента хлорида натрия в качестве элюента. Элюированные фракции подвергали электрофорезу в ДСН-полиакриламидном геле в восстанавливающих и невосстанавливающих условиях и фракции, содержащие желаемый очищенный рекомбинантный зрелый OCIF человека, определяли как фракции, которые давали те же самые полосы белка rOCIF со средними молекулярными массами 60000 и 120000, какие получали в примере 14 ЕР-А-0816380. Аминокислотная последовательность мономерного пептида показана в SEQ ID NO:1 списка последовательностей, которая идентична полной последовательности SEQ ID NO:4 или аминокислотам №1-№380 SEQ ID NO:5 WO-A-96/26217 и ЕР-А-0816380.
Затем к объединенным фракциям, содержащим полученный OCIF человека, добавляли 1/100 объема 25% трифторуксусной кислоты и полученную смесь наносили на обращенно-фазовую колонку (PROTEIN-RP, 2,0 мм × 250 мм, поставляемую YMC Co.), которая была предварительно уравновешена 30% ацетонитрилом, содержащим 0,1% трифторуксусной кислоты. Затем колонку элюировали линейным градиентом от 30 до 55% ацетонитрила при скорости тока 0,2 мл/мин в течение 50 мин. Фракции двух пиков собирали раздельно и затем лиофилизировали. Затем фракцию, которая обнаруживала полосу, имеющую среднюю молекулярную массу 120000 при электрофорезе на ДСН-ПААГ в восстанавливающих условиях, использовали в следующих примерах в качестве димерного OCIF человека (см. примеры 17 и 18 WO-A-96/26217 и ЕР-А-0816380).
1(b) Получение комплексов, содержащих OCIF и декстрансульфат
Очищенный димерный OCIF человека, полученный, как описано в примере 1 (а) выше, растворяли в 10 мМ буферном растворе фосфата натрия (рН 6,0), содержащем 0,15 М хлорида натрия, с получением концентраций OCIF 1,5, 2, 5, 6,5, 10, 12,5, 20 или 50 мг/мл. Натриевую соль декстрансульфата сера 5 (производимую Meito Sangyo Co., Ltd., далее называемую “DS5”) растворяли в полученных таким образом водных растворах до конечной концентрации 40, 100, 130, 150, 200, 400, 500, 510 или 1000 мг/мл и затем к ним добавляли 1 н. гидроксид натрия до конечного рН 10, 10,5 или 11. Полученные водные растворы инкубировали при 4, 7, 25 или 37°С в течение 1, 3, 6, 18, 24, 48, 72, 96, 144, 168 или 288 часов.
В конце этого периода 4 мл каждого полученного раствора наносили на гель-фильтрационную колонку Superdex 200 prep grade (внутренний диаметр колонки: 16 мм; длина: 60 см; ограничивающая вытеснение молекулярная масса: 1300000; производимая Amersham Pharmacia Biotech), предварительно уравновешенную 10 мМ натрий-фосфатным буфером (рН 6), содержащим 0, 3 М хлорида натрия, и затем элюировали тем же самым буфером при скорости тока 2 мл/мин. Абсорбцию при длине волны 280 нм контролировали с использованием измеряющего поглощение в ультрафиолете спектрофотометра, и элюат при времени удерживания около 28-36 мин собирали. Свободный DS5, который не связывался с OCIF, элюировали при времени удерживания около 50-70 мин. Все стадии этой процедуры гель-фильтрации выполняли при комнатной температуре. Полученные препараты, которые содержали желаемые комплексы димерного OCIF человека и DS5, замораживали и хранили при -60°С. Условия получения для каждого комплекса суммированы в таблице 1.
1(с) Получение природного OCIF человека
Природно продуцируемый OCIF человека получали в соответствии с процедурой, описанной в примерах WO-A-96/26217 и ЕР-А-0816380, из клеток культуры фибробластов легкого эмбриона человека IMR-90 (ATCC-CCL186).
Пример 2
Получение комплексов, содержащих OCIF и декстрансульфат (II)
Очищенный димерный OCIF человека, полученный, как описано в примере 1 (а) выше, растворяли в 10 мМ буферном растворе фосфата натрия (рН 6,0), содержащем 0,15 М хлорида натрия, с получением раствора, имеющего концентрацию OCIF 5 мг/мл. Натриевую соль декстрансульфата, имеющую молекулярную массу 5000 (изготовляемую Waco Pure Chemical Industries, Ltd., далее называемую “DS 5000”), растворяли в полученном таким образом водном растворе с получением конечной концентрации DS 5000 150 мг/мл и затем добавляли к нему 1 н. гидроксид натрия до конечного рН 10,5. Полученный таким образом водный раствор инкубировали при 4°С в течение 24 часов.
В конце этого периода времени 4 мл полученного раствора наносили на гель-фильтрационную колонку Superdex 200 prep grade для хроматографии, как описано в примере 1(b) выше. Абсорбцию при длине волны 280 нм контролировали с использованием измеряющего поглощение в ультрафиолете спектрофотометра, и элюат при времени удерживания около 28-36 мин собирали. Свободный DS5000, который не связывался с OCIF, элюировали при времени удерживания около 40-65 мин.
Полученные препараты, которые содержали желаемые комплексы димерного OCIF человека и DS5000, замораживали и хранили при -60°С. Условия получения для этого комплекса суммированы в таблице 2.
Пример 3
Измерения изоэлектрической точки
Очищенный рекомбинантный димерный OCIF человека, полученный, как описано в примере 1(а) выше, и комплекс OCIF и декстрансульфата, полученный, как описано в примере 1(b) выше, и который был обозначен как Препарат №22 в таблице 1, наносили раздельно на гель для электрофореза с изоэлектрическим фокусированием IEF PAGE (диапазон рН 3-10, производимый Iwaki Glass) с использованием набора буферов рН 3-7 для IEF (изоэлектрического фокусирования) (Technical Frontier Co.) и прилагали напряжение к этому гелю в соответствии со следующим режимом: 100 В в течение 1 ч, затем 200 В в течение 1 ч и наконец 500 В в течение 30 мин. После завершения электрофореза гель, полученный в каждом случае, окрашивали Кумасси синим.
Из полученных, как описано выше, гелей для электрофореза определили, что изоэлектрическая точка димерного OCIF человека была около рI 9, а изоэлектрическая точка комплекса OCIF и декстрансульфата, обозначенного как Препарат №22, была около pI 6,5, посредством сравнения положения полосы OCIF и полосы комплекса OCIF с маркерами рI.
Пример 4
Измерение молярного отношения OCIF и декстрансульфата в комплексе, содержащем OCIF и декстрансульфат
4(а) Получение исходного раствора моноклонального антитела против OCIF человека OI-4, меченного пероксидазой
В этой стадии моноклональное антитело против OCIF человека метили пероксидазой с использованием набора для активированной малеимидом пероксидазы хрена (EZ-Link Maleimide Activated Horseradish Peroxidase Kit, производимого Pierce) согласно протоколу II, описанному в буклете-инструкции, прилагаемой к набору. Детали этой процедуры являются следующими.
Моноклональное антитело против OCIF человека OI-4 выделяли из культуры гибридомы, продуцирующей антитело OI-4 (FERM ВР-6419), согласно способу, описанному в примере 4 ЕР-А-0974671 (WO-A-99/156991), и затем разбавляли до конечной концентрации белка 1 мг/мл 10 мМ фосфатным буфером (рН 7,6).
N-сукцинимидил-3-ацетилтиоацетат (представленный в указанном наборе EZ-Link Maleimide Activated Horseradish Peroxidase Kit) растворяли в диметилформамиде с получением раствора, имеющего концентрацию 10 мг/мл, непосредственно перед использованием. Аликвоту 4 мкл добавляли к 1 мл разбавленного OI-4-содержащего раствора, полученного, как описано выше, и затем полученный раствор инкубировали при комнатной температуре в течение 30 минут. В конце этого периода времени, 20 мкл раствора, полученного непосредственно перед применением растворением 5 мг гидрохлорида гидроксиламина в 100 мкл буфера для конъюгации малеимида (представленного в указанном наборе EZ-Link Maleimide Activated Horseradish Peroxidase Kit), добавляли к нему и полученный раствор инкубировали при комнатной температуре в течение 2 часов. В конце этого периода времени эту реакционную смесь наносили на полиакриламидную обессоливающую колонку (10 мл, содержащуюся в указанном наборе EZ-Link Maleimide Activated Horseradish Peroxidase Kit), предварительно уравновешенную 30 мл буфера для конъюгации малеимида (также представленного в указанном наборе), и затем буфер для конъюгации малеимида наносили на указанную колонку. Элюат собирали в виде фракций по 0,5 мл. Фракции 7-10, содержащие антитело, объединяли. Затем 100 мкл раствора, полученного растворением 5 мг активированной малеимидом пероксидазы хрена (EZ-Link Maleimide Activated Horseradish Peroxidase) (содержащейся в указанном наборе EZ-Link Maleimide Activated Horseradish Peroxidase Kit) в 500 мкл дистиллированной воды непосредственно перед применением, добавляли к объединенным фракциям элюата и полученную смесь инкубировали при комнатной температуре в течение одного часа. После инкубирования добавляли к смеси равный объем глицерина и полученный таким образом раствор хранили при -20°С.
Раствор, полученный по описанному выше способу, использовали в качестве исходного раствора моноклонального антитела против OCIF человека OI-4, меченного пероксидазой (далее называемого “POD-OI-4”), называемого далее “исходным раствором POD-OI-4”.
4(b) Определение количества OCIF
Количество OCIF, присутствующего в любом из комплексов, полученных в примерах 1 и 2 выше, и в комбинации, приготовленной в ссылочном примере 1 ниже, измеряли твердофазным иммуноферментным анализом (ELISA) с использованием двух моноклональных антител против OCIF, причем подробности этой процедуры были следующими.
Моноклональное антитело против OCIF человека OI-26 выделяли из культуры гибридомы, продуцирующей антитело OI-26 (FERM ВР-6421), согласно способу, описанному в примере 4 ЕР-А-0974671 (WO-A-99/15691), и затем разбавляли 0,1 М гидрокарбонатом натрия с получением раствора, имеющего конечную концентрацию белка 5 мкг/мл. Аликвоту его, объемом 100 мкл, переносили в каждую лунку 96-луночного микротитрационного планшета (Maxisorp, производимого NUNC) и затем планшет герметизовали и инкубировали при 4°С в течение ночи. В конце этого периода времени каждую лунку промывали три раза 250 мкл забуференным фосфатом солевым раствором (ЗФР) (рН 7,4), содержащего 0, 1% полисорбата 20. 20 мкл раствора буфера для разведения [содержащего 0,2 М Трис-HCl, 40% Block Асе (поставляемый Dainippon Pharmaceutical Co., Ltd.), и 0,1% полисорбат 20; рН 7,4] добавляли в каждую лунку и затем планшет выдерживали при комнатной температуре в течение 20 минут для блокирования зон лунок, не связанных OI-26.
Пробы для добавления к связанным OI-26 лункам, полученные, как описано выше, предпочтительно разводили раствором буфера для разведения, используемым выше для блокирования лунок. Для построения калибровочной кривой раствор буфера для разведения, содержащий OCIF человека в известных концентрациях, использовали в качестве стандартов. Раствор буфера для разведения использовали в качестве контроля. 50 мкл каждой пробы переносили в каждую лунку.
После добавления проб в лунки, 50 мкл раствора, полученного разбавлением исходного раствора POD-OI-4 [приготовленного, как описано в примере 4(а) выше] 1500-кратным объемом раствора буфера для разведения [0,2 М Трис-HCl, 40% Block Асе (поставляемый Dainippon Pharmaceutical Co., Ltd.), 0,1% полисорбата 20; рН 7,4], добавляли в каждую лунку и затем планшет инкубировали при комнатной температуре в течение 2 часов. В конце этого периода времени каждую лунку промывали четыре раза 250 мкл фосфатного буфера, содержащего 0,1% полисорбата 20 (далее называемого “РВ”, рН 7,4).
0,1 М лимонную кислоту и 0,2 М динатрийгидрофосфат смешивали и использовали в качестве раствора субстрата (рН 4,5). Его аликвоту 32,5 мл переносили в тест-пробирку и к ней добавляли 6,5 мкл пероксида водорода. Затем 13 мг таблетки о-дигидрохлорида фенилендиамина (OPD) (изготовляемой Waco Pure Chemical Industries, Ltd.) растворяли в полученном растворе. Аликвоту 100 мкл добавляли в каждую лунку, планшет накрывали алюминиевой фольгой и затем инкубировали при комнатной температуре в течение 15 минут. В конце этого периода времени 50 мкл раствора для остановки реакции, содержащего очищенную воду и концентрированную серную кислоту в соотношении 250:50 по объему, добавляли к каждой лунке. После осторожного перемешивания растворов в лунках при помощи шейкера (Titer mixer MB-1; изготовляемый Japan Trika) поглощение каждой лунки измеряли при длине волны 490 нм при помощи микропланшет-ридера (SPECTRAFLUOR: изготовляемый TECAN).
На основе калибровочной кривой, полученной, как объяснялось выше, из поглощения стандартных растворов OCIF человека при известных концентрациях, рассчитывали количество OCIF человека в каждой пробе.
4(с) Определение количества декстрансульфата
Количество декстрансульфата в каждом комплексе, полученном, как описано в примерах 1 и 2, измеряли в виде нейтрального сахара по способу с фенолом и серной кислотой, подробности которого являются следующими.
Раствор, имеющий концентрацию в диапазоне 10-60 мкг/мл DS5 (производимого Meito Sangyo Co., Ltd.) или DS5000 (производимого Waco Pure Chemical Industries, Ltd.), готовили с использованием раствора для разведения (0,01 М лимонной кислоты, 0,3 М хлорида натрия, 0,01% водный раствор полисорбата 80: рН 6,0) и использовали в качестве стандартного раствора. 0,2 мл каждого из стандарта, пробы или раствора для разведения переносили в каждую тест-пробирку. 0,2 мл водного фенола (50 мг/мл) добавляли и быстро перемешивали. После инкубирования полученной смеси при 60°С в течение 20 секунд на водяной бане к ней добавляли 1,0 мл концентрированной серной кислоты. После осторожного, но быстрого перемешивания пробирку инкубировали в течение 10 минут при комнатной температуре, опять быстро перемешивали и затем инкубировали в течение 20 минут при комнатной температуре. В конце этого периода времени поглощение раствора в пробирке измеряли при длине волны 490 нм с использованием спектрофотометра (УФ-240: производимого Shimadzu Seisakusho, К.К.).
Из этого поглощения и калибровочной кривой определяли содержание нейтрального сахара. OCIF человека содержит сахарную цепь. Таким образом, количество декстрансульфата, связанного с OCIF человека в анализируемом препарате, рассчитывают вычитанием величины содержания нейтрального сахара самого OCIF человека из величины, которую измерили для любого анализируемого препарата.
4 (d) Расчет молярного отношения OCIF и декстрансульфата в комплексе, содержащем OCIF и декстрансульфат
Количество декстрансульфата, присутствующего в анализируемом препарате, определенное, как описано в примере 4 (с) выше, делили на количество OCIF человека, присутствующего в анализируемом препарате, определенное, как описано в примере 4(b) выше, с получением количества декстрансульфата, присутствующего на 1 мг OCIF человека в анализируемом препарате.
Полученное таким образом значение использовали затем для расчета молярного отношения OCIF в виде мономера и декстрансульфата в анализируемом препарате посредством расчета числа молекул декстрансульфата на одну молекулу мономера OCIF, на основе предположения, что молекулярная масса мономера OCIF человека равна 60000, молекулярная масса DS5 равна 1950, молекулярная масса DS5000 равна 5000.
Полученные результаты показаны в таблице 3.
Пример 5
Стабильность связывания между OCIF и декстрансульфатом в комплексах OCIF/декстрансульфат
Гель-фильтрацию комплекса, содержащего OCIF и декстрансульфат, повторяли дважды, как описано в примере 4(с) выше, и количество декстрансульфата, присутствующего в комплексе, измеряли после каждой из указанных гель-фильтраций. Подробности были следующие.
5(а) Инкубирование OCIF и декстрансульфата
Использовали процедуру, описанную выше в примере 1(b). Рекомбинантный димерный OCIF человека, полученный, как описано в примере 1(а), растворяли в 10 мМ натрий-фосфатном буфере (рН 6,0), содержащем 0,15 М хлорида натрия, с получением раствора, имеющего концентрацию OCIF 5 мг/мл. DS5 растворяли в полученном таким образом растворе с получением конечной концентрации DS5 150 мг/мл и затем добавляли к этому раствору 1 н. раствор гидроксида натрия для доведения рН до 10,5. Затем полученный раствор инкубировали при 4°С в течение 7 дней с получением раствора, содержащего комплекс димерного OCIF человека и DS5.
5(b) Первая гель-фильтрация
Раствор, содержащий комплекс димерного OCIF человека и DS5, полученный в конце инкубирования в примере 5(а) выше, подвергали гель-фильтрации в соответствии со способом, описанным в примере 1(b) выше. Фракции при времени удерживания около 28-36 минут собирали, тогда как свободный декстрансульфат, который не был связан с OCIF, элюировался при времени удерживания около 50-70 минут.
5(с) Измерение содержания белка
Количество белка, присутствующего в комплексе, измеряли по методу Лоури [Lowry, O.H. et al., J. Biol. Chem., 193, 263-275 (1951)] следующим образом.
0,2 г пентагидрата сульфата меди (II) (Waco Pure Chemical) растворяли в воде до конечного объема 50 мл. 0,4 г дигидрата тартрата натрия (Waco Pure Chemical) растворяли в воде до конечного объема 50 мл. 20 г карбоната натрия растворяли в воде до конечного объема 100 мл. Три водных раствора, полученных таким образом, смешивали в соотношении 1:1:2 по объему непосредственно перед использованием (полученный раствор был назван “раствором А”). 10 г додецилсульфата натрия (Nacalai Tesque Inc.) растворяли в воде до конечного объема 200 мл (полученный раствор был назван “раствором В”). 3,2 г гидроксида натрия (Waco Pure Chemical) растворяли в воде до конечного объема 100 мл (полученный раствор был назван “раствором С”). Раствор А, раствор В и раствор С смешивали в соотношении 1:2:1 по объему непосредственно перед использованием.
Отдельно реагент Фолина-Чокальтеу (Waco Pure Chemical) и воду смешивали в соотношении 1:5 по объему непосредственно перед использованием. 2,76 г дигидрата тринатриевой соли лимонной кислоты (Wacp Pure Chemical), 0,13 г моногидрата лимонной кислоты (Waco Pure Chemical), 17,5 г хлорида натрия и 0,1 г полисорбата 80 растворяли в воде до конечного объема 1 л (рН 6,9) с получением раствора, называемого “раствором для разведения”.
9,5 мл раствора для разведения добавляли к 500 мкл стандартного бычьего сывороточного альбумина (Pierce Co. Ltd.), содержащего 2 мг/мл бычьего сывороточного альбумина (называемого “БСА”) в 0,9% водном хлориде натрия, содержащем азид натрия в концентрации менее 0,1%, с получением раствора, названного “раствором БСА 100 мкг/мл”. 3,5 мл, 3 мл, 2,5 мл или 2 мл раствора для разведения добавляли к 1,5 мл, 2 мл, 2,5 мл или 3 мл раствора БСА 100 мкг/мл с получением, соответственно растворов, называемых “раствором БСА 30 мкг/мл”, “раствором БСА 40 мкг/мл”, “раствором БСА 50 мкг/мл” и “раствором БСА 60 мкг/мл” соответственно. 3 мл раствора для разведения добавляли к 1,5 мл БСА 60 мкг/мл с получением раствора, называемого “раствором БСА 20 мкг/мл”.
Пробу, содержание белка которой требовалось определить, разводили раствором для разведения с получением раствора с конечной концентрацией около 40 мкг белка на 1 мл. 1 мл раствора БСА 20 мкг/мл, раствора БСА 30 мкг/мл, раствора БСА 40 мкг/мл, раствора БСА 50 мкг/мл, раствора БСА 60 мкг/мл, разведенную пробу раствора для разведения (n=3) переносили в тест-пробирку, добавляли к ней 1 мл щелочного медного реагента и полученный раствор смешивали и инкубировали при комнатной температуре в течение 10 минут. Затем к нему добавляли 0,5 мл разведенного реагента Фолина-Чокальтеу и полученный раствор смешивали и инкубировали при комнатной температуре в течение 30 минут. В конце этого периода поглощение каждой смеси при длине волны 750 нм измеряли с использованием ячейки, изготовленной из кварца, ширина которой была 10 мм, с применением УФ-спектрофотометра (Lambda 20: Perkin Elmer Co. Ltd.). Затем количество белка, содержащееся в пробе, рассчитывали на основе калибровочной кривой, полученной с использованием поглощений стандартных растворов БСА (в виде величины, приведенной к количеству БСА).
5(d) Определение количества декстрансульфата
Количество декстрансульфата, связанного с OCIF человека в комплексе, который был получен после первой гель-фильтрации в примере 5 (b) выше, измеряли с использованием процедуры, описанной в примере 4(с) выше.
5(е) Вторая гель-фильтрация
Объединенные собранные, фракции, полученные в примере 5(b) выше, переносили в два фильтрующих элемента Centriprep (УМ-30, отсечка MW 30000, Millipore Amicon Co Ltd.) и их центрифугировали при 2000 об/мин в течение 20 минут с использованием центрифуги (himacCT60, Hitachi Seisakusho Co Ltd.). Неотфильтрованные концентрированные растворы, полученные из двух фильтрующих элементов Centriprep, собирали и объединяли. Полученный раствор подвергали гель-фильтрации, как описано в примере 1(b) выше, и фракции при времени удерживания около 28-36 минут собирали и объединяли. Затем содержание белка и сахара в комплексе, присутствующем в объединенных фракциях, измеряли, как описано в примерах 5(с) и 5(d) выше.
5(f) Третья гель-фильтрация
Объединенные собранные фракции, полученные в примере 5(е) выше, переносили в два фильтрующих элемента Centriprep (УМ-30, отсечка MW 30000, Millipore Amicon Co Ltd.) и их центрифугировали при 2000 об/мин в течение 20 минут с использованием центрифуги (himacCT60, Hitachi Seisakusho Co Ltd.). Неотфильтрованные концентрированные растворы, полученные из двух фильтрующих элементов Centriprep, собирали и объединяли. Полученный раствор подвергали гель-фильтрации, как описано в примере 1(b) выше, и фракции при времени удерживания около 28-36 минут собирали и объединяли. Затем содержание белка и сахара в комплексе, присутствующем в объединенных фракциях, измеряли, как описано в примерах 5(с) и 5(d) выше.
5(g) Расчет молярного отношения OCIF к декстрансульфату
Молярное отношение OCIF в виде мономера к декстрансульфату, присутствующих в комплексе, полученном во фракциях после первой гель-фильтрации в примере 5(b) выше, второй гель-фильтрации в примере 5(е) выше и третьей гель-фильтрации в примере 5(f) выше, рассчитывали в соответствии с примером 4(d), описанным выше. Полученные результаты суммированы в таблице 4.
Из вышеописанного сразу будет очевидно, что молярное отношение OCIF к декстрансульфату в комплексе данного изобретения является постоянным на протяжении трех гель-фильтраций, что указывает на высокую степень стабильности связывания между OCIF и декстрансульфатом в комплексах данного изобретения.
Пример 6
Степень адсорбции комплекса OCIF и дектрансульфата на гепариновой сшитой колонке
6(а) Хроматография на гепариновой колонке
Все процедуры колоночной хроматографии в этом примере выполняли при скорости тока 4 мл в минуту.
Гепариновую сшитую колонку (HiTrap Heparin HP column, Lot. 289212, Amersham Pharmacia Biotech) предварительно уравновешивали 5 мл 10 мМ натрий-фосфатного буфера, содержащего 0, 7 М хлорида натрия. Препарат из таблицы 1 примера 1 брали и разбавляли до конечной концентрации белка 0,1 мг/мл 10 мМ натрий-фосфатным буфером, содержащим 0,7 М хлорида натрия. 1 мл полученного таким образом разбавленного раствора наносили на указанную колонку и собирали 1 мл первого элюата (фракцию А). Затем 5 мл 10 мМ натрий-фосфатного буфера, содержащего 0,7 М хлорида натрия, наносили на указанную колонку и собирали 5 мл второго элюата (фракцию В). Наконец, 4 мл 10 мМ натрий-фосфатного буфера, содержащего 2 М хлорида натрия, наносили на указанную колонку и собирали 4 мл элюата (фракцию С).
6(b) Измерение количества OCIF в элюате
100 мкл 0,1 М гидрокарбоната натрия (рН 9,6), в котором растворяли моноклональное антитело против OCIF человека 01-19 (FERM ВР-6420) в концентрации 10 мкг на мл, переносили в каждую лунку 96-луночного микротитрационного планшета (Maxisorp: NUNC Co Ltd.). Планшет герметизовали и затем инкубировали при 4°С в течение ночи. В конце этого периода времени раствор в каждой лунке удаляли декантированием, в каждую лунку добавляли 300 мкл 50% Block Асе (производимого Dainippon Pharmaceutical Co., Ltd.), и затем планшет инкубировали при комнатной температуре в течение 2 часов. После удаления раствора из каждой лунки, каждую лунку промывали три раза 300 мкл ЗФР (рН 7,4), содержащим 0,1% полисорбата 20, с использованием SERA WASHER MW-96R (Bio Tec Co Ltd.).
После приготовления лунок, как описано выше, 20 мкл каждого из трех элюатов (фракции А, В и С), полученных в примере 6 (а) выше, разбавляли до конечного объема 120 мкл 0,2 М Трис-НСl (рН 7,4), содержащим 40% Block Асе, 10 мкг/мл мышиного иммуноглобулина G и 0,1% полисорбата 20 и затем разбавляли тем же самым объемом чистой воды. В то же самое время, известное количество OCIF человека растворяли в 120 мкл 0,2 М Трис-НСl (рН 7,4), содержащего 40% Block Асе, 10 мкг/мл мышиного иммуноглобулина G и 0,1% полисорбата 20 и затем разбавляли тем же самым объемом чистой воды. Полученный таким образом раствор использовали в качестве стандарта.
100 мкл каждого из разведенных элюатов и стандарта добавляли в одну лунку (каждый) предварительно приготовленного микротитрационного планшета, как описано выше, и затем этот планшет инкубировали при комнатной температуре в течение 2 часов с осторожным перемешиванием при помощи микропланшетного шейкера (NS-P: Ichi Seiei-Do, Co Ltd.). В конце этого периода времени раствор удаляли из каждой лунки и затем каждую лунку промывали шесть раз 300 мкл ЗФР (рН 7,4), содержащим 0,1% полисорбата 20, при помощи SERA WASHER MW-96R (Bio Tec Co Ltd.). Затем 100 мкл 0,1 М Трис-HCl (рН 7,4), содержащего 25% Block Асе, 10 мкг/мл мышиного иммуноглобулина G и 0,1% полисорбата 20, к которому был добавлен исходный раствор POD-OI-4, приготовленный, как описано в примере 4(а) выше, с получением 0,01% раствора (об./об.), добавляли в каждую лунку, и планшет инкубировали при комнатной температуре в течение 2 часов с осторожным перемешиванием с использованием того же самого, микропланшетного шейкера. После удаления раствора в каждой лунке лунку промывали шесть раз 300 мкл ЗФР (рН 7,4), содержащим 0,1% полисорбата 20, с использованием SERA WASHER MW-96R (Bio Tec Co Ltd.).
После промывания лунок 100 мкл 3,3’,5,5’-тетраметилбензидин (ТМВ) - растворимого реагента (Scytec Co Ltd.) добавляли в каждую лунку и затем планшет инкубировали при комнатной температуре в течение 10-15 минут с осторожным перемешиванием с использованием того же самого микропланшетного шейкера, который описан выше. В конце этого периода времени в каждую лунку добавляли 100 мкл ТМВ-стоп-буфера (Scytec Co Ltd.). После осторожного перемешивания планшета с использованием микропланшетного шейкера в течение около 1 минуты поглощение каждой лунки при длине волны 450 нм измеряли с использованием микропланшет-ридера (SPECTRA THERMO: TECAN Co. Ltd.). Затем количество OCIF, содержащееся в каждой из фракций А, В и С [обозначенное как (а), (b) и (с)], рассчитывали на основе калибровочной кривой, полученной построением графика поглощения каждого стандарта, описанного выше, в зависимости от концентрации. Затем степень адсорбции тестируемого комплекса OCIF и декстрансульфата на гепариновой сшитой колонке рассчитывали в соответствии со следующей формулой:

Результаты суммированы ниже в таблице 5 для 7 из комплексов, полученных в примере 1 выше. Дается также соответствующий результат для не находящегося в комплексе OCIF. Как можно видеть из этой таблицы, не находящийся в комплексе OCIF связывался более сильно с гепариновой колонкой, чем комплексы данного изобретения. Было также обнаружено, что комплексы данного изобретения могут быть дополнительно охарактеризованы по степени их адсорбции на гепариновой сшитой колонке.
Пример 7
Иммунологическое обнаружение комплекса OCIF-декстрансульфат
7(а) Измерение количества белка
Количество белка, содержащегося в препарате комплекса примера 1, описанного выше, определяли согласно способу, описанному в примере 5(с) выше.
7(b) Иммунологическое измерение количества OCIF
Количество OCIF, содержащегося в препарате комплекса примера 1, описанного выше, определяли иммунологически с использованием способа ELISA, описанного в примере 6 выше.
7(с) Расчет коэффициента иммунологического детектирования
Величину, полученную в примере 7(b) выше, делили на соответствующую величину, полученную в примере 7(а) выше, и полученную таким образом величину называли “коэффициентом иммунологического детектирования”.
Эти результаты суммированы в таблице 6. Дается также результат для не находящегося в комплексе OCIF. Было также обнаружено, что комплексы данного изобретения могут быть дополнительно охарактеризованы их коэффициентом иммунологического детектирования.
Ссылочный пример 1
Получение комбинации OCIF и декстрансульфата
Комбинацию OCIF и натриевой соли декстрансульфата (молекулярная масса 5000 или 10000) готовили следующим образом с использованием процедуры, описанной в примере 1 ЕР-А-1127578 (WO-A-2000/24416).
Очищенный димерный OCIF человека, имеющий молекулярную массу около 120000, полученный, как описано в примере 1(а) выше, растворяли в 10 мМ растворе натрий-фосфатного буфера (рН 6,0), содержащего 0,15 М хлорида натрия и 0,01% полисорбата 80, с получением раствора, имеющего концентрацию OCIF 0,25 мг/мл. DS 5000 (изготовляемого Waco Pure Chemical Industries, Ltd.), описанный выше в примере 2, или натриевую соль декстрансульфата, имеющую молекулярную массу 10000 (изготовляемую Waco Pure Chemical Industries, Ltd., далее называемую “DS10000”) растворяли в полученном водном растворе с получением раствора, имеющего конечную концентрацию натриевой соли дестрансульфата 1 или 4 мг/мл, и затем к нему добавляли гидроксид натрия до конечного рН 7. Полученные таким образом водные растворы инкубировали при 4°С в течение 24 часов с получением желаемых препаратов, содержащих OCIF и DS5000 или DS10000, которые затем использовали для сравнительных целей в тест-примере 1.
Условия приготовления для каждой комбинации суммированы в таблице 7.
Тест-пример 1
Измерение концентрации комплексов, содержащих OCIF и декстрансульфат, в сыворотке крови
1(а) Инъецирование и сбор крови
Пятинедельных самок крыс Wistar (имеющих вес тела около 100 г) заставляли голодать в течение ночи. Препарат OCIF и декстрансульфата, полученный, как описано в любом из примеров 1, 2 или ссылочном примере 1, который подлежал испытанию, разбавляли до концентрации 0,25 мг/мл с использованием ЗФР (рН 7,4), содержащего 0,01% полисорбата 80, для получения инъекционного раствора, который затем вводили в хвост одной из тестируемых крыс через хвостовую вену в одноразовой дозе из расчета 2 мл/кг веса тела. Спустя 6 часов после введения кровь брали из сердца крысы.
1(b) Фракционирование сыворотки
После выдерживания крови, собранной, как описано в 1(а) выше, для коагуляции при комнатной температуре в течение 30 минут из нее получали сыворотку в виде супернатанта при центрифугировании этой крови при 14000 об/мин в течение 3 минут с использованием ротора диаметром 10 см.
1(с) Количественное определение OCIF в сыворотке
100 мкл раствора, в котором моноклональное антитело OI-19 против OCIF человека (см. ЕР-А-0974671 (WO-A-99/15691)] растворяли в 0,1 растворе гидрокарбоната натрия до конечной концентрации OCIF 10 кг/мл, добавляли в каждую лунку 96-луночного микротитрационного планшета (Maxisorp: изготовляемого NUNC), и затем планшет герметизовали и давали ему стоять в течение ночи при 4°С. Затем раствор антител удаляли декантированием и к каждой лунке добавляли 300 мкл блокирующего буферного раствора (50% Block Асе: производимый Dainippon Pharmaceutical Co., Ltd.) и затем планшету давали стоять при комнатной температуре в течение 2 часов. В конце этого периода времени каждую лунку промывали три раза 300 мкл ЗФР (рН 7,4), содержащим 0,1% полисорбата 20.
100 мкл очищенной воды и 120 мкл буферного раствора для разведения [состав: 0,2 М Трис-хлористо-водородная кислота, 40% Block Асе (производимый Dainippon Pharmaceutical Co., Ltd.), 10 мкг/мл мышиного иммуноглобулина G и 0,1% полисорбата 20; рН 7,4] добавляли к 20 мкл тестируемой сыворотки, которую собирали, как описано в 1 (b) выше, и перемешивали. В качестве контроля, 100 мкл очищенной воды и 120 мкл буфера для разведения, содержащего димер OCIF человека в известной концентрации, добавляли к 20 мкл дистиллированной воды и перемешивали.
100 мкл каждого из препаратов сыворотки, полученного таким образом, добавляли в каждую лунку и затем планшету давали стоять при комнатной температуре в течение 2 часов. Каждую лунку промывали шесть раз после завершения реакции 300 мкл раствора, содержащего 0,1% полисорбата 20 (рН 7,4). Затем 100 мкл раствора, полученного 1000-кратным разведением исходного раствора POD-OI-4, полученного в примере 4(а), как указано выше, раствором для разведения [состав: 0,1 М Трис-хлористо-водородная кислота, 20% Block Асе (приобретенный Dainippon Pharmaceutical Co., Ltd.), 10 мкг/мл мышиного иммуноглобулина G и 0,1% полисорбата 20: рН 7,4], добавляли в каждую лунку и планшету давали стоять при комнатной температуре в течение 2 часов.
В конце этого периода времени каждую лунку промывали шесть раз 300 мкл ЗФР (рН 7,4), содержащего 0,1% полисорбата 20. Затем 100 мкл раствора субстрата (ТМВ-растворимый реагент: производимый Scytec) добавляли к каждой лунке и планшету давали стоять при комнатной температуре в течение 10-15 минут. Затем 100 мкл раствора для остановки реакции (ТМВ-стоп-буфер, производимый Scytec) добавляли к каждой лунке.
После перемешивания при помощи аппарата для встряхивания (микропланшетного шейкера NS-P; производимого Iuchi Seiei-Do, Со Ltd.) поглощение каждой лунки при длине волны 450 нм измеряли с использованием микропланшет-ридера (SPECTRA THERMO, производимого TECAN). Затем концентрацию OCIF в тестируемой сыворотке рассчитывали из калибровочной кривой с использованием стандартного раствора OCIF. Дозу рассчитывали в виде дозы OCIF на кг веса тела (мг/кг) измерением концентрации OCIF для каждого инъекционного раствора, приготовленного, как описано в 1(а), аналогично тому, как это делали в случае сыворотки.
1(d) Концентрация в сыворотке
OCIF в сыворотке, полученной, как описано в 1(b) выше, определяли количественно для каждой пробы по способу, описанному выше в 1(с). Результаты показаны в таблице 8.
Как показано в таблице 8, концентрации в сыворотке препаратов данного изобретения, вводимых в дозе 0,5 мг/кг веса тела, спустя шесть часов после введения были в 2,2-11,7 раз более высокими, чем концентрации, полученные после введения ссылочного препарата 1 при такой же дозе.
Преимущества, обеспечиваемые данным изобретением
Как продемонстрировано выше, комплексы данного изобретения, содержащие по меньшей мере один OCIF, его аналог или вариант и по меньшей мере один полисахарид или его вариант, удерживаются в крови после введения в значительно более высокой концентрации в сравнении с известными комбинациями, содержащими OCIF и полисахариды, такие как описанные в WO-A-2000/24416. Комплексы данного изобретения применимы для предупреждения или лечения различных костных метаболических заболеваний, таких как остеопороз, гиперкальциемия, литическое метастазирование костей, разрежение кости вследствие ревматоидного артрита, остеопения, обусловленная стероидными лекарственными средствами, множественная миелома, остеопения или гиперкальциемия, обусловленные дисфункцией почек, почечная остеодистрофия, остеоартрит и т.д.


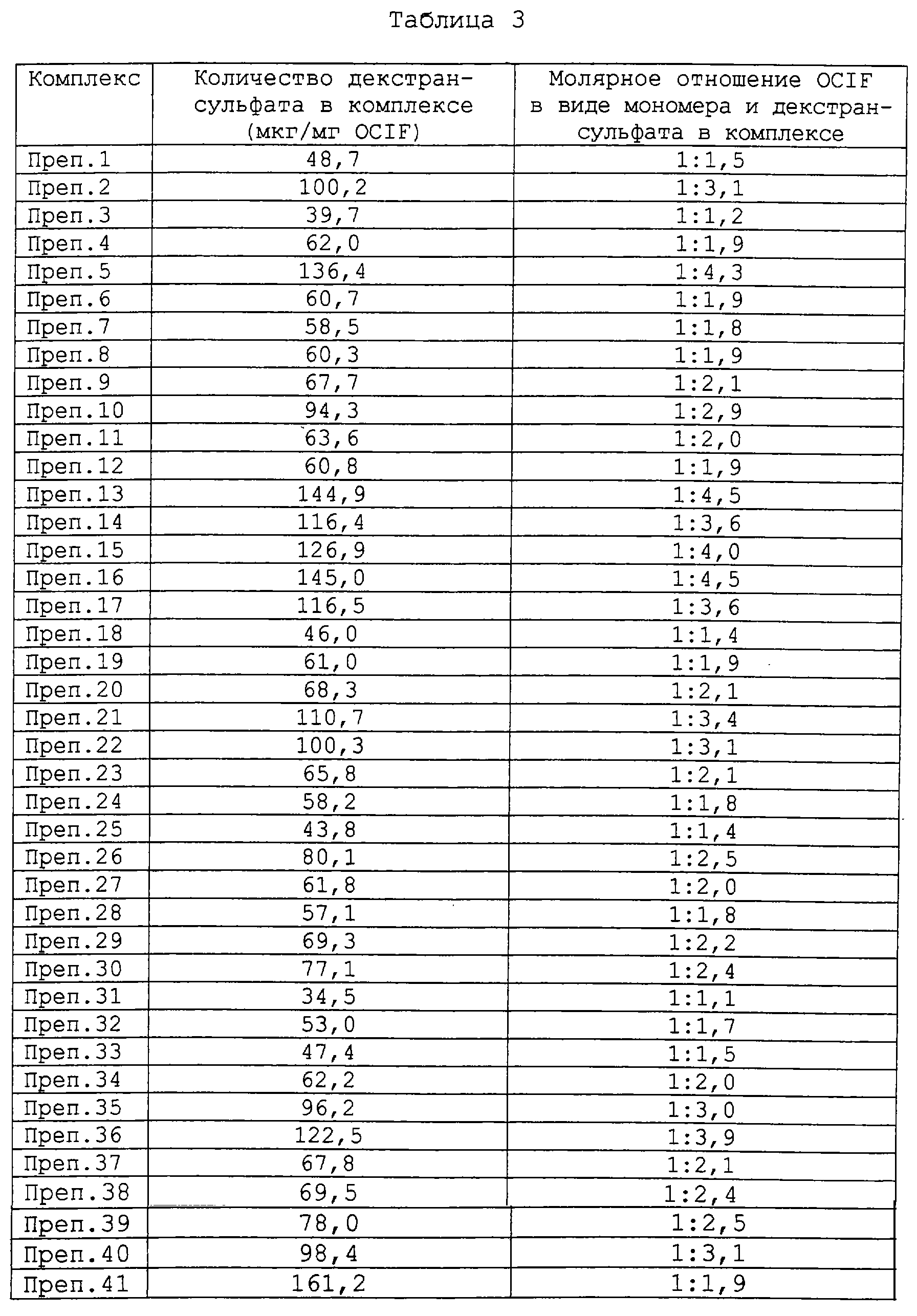





Реферат
Изобретение относится к области медицинских препаратов. Сущностью изобретения является новый комплекс, содержащий по меньшей мере одно вещество, выбранное из группы: ингибирующего остеокластогенез фактора (OCIF), его аналогов и его вариантов, которое связано с веществом, выбранным из группы, состоящей из полисахаридов и их производных. Комплекс обнаруживает свойство пролонгированного удерживания в кровотоке после введения, что делает его применимым при лечении и профилактики костных метаболических заболеваний. Технический результат - расширение арсенала средств для нормализации костного метаболизма. 7 н. и 27 з.п.ф-лы, 8 табл.
Формула


Комментарии