Способ получения растворимых в жировых системах химических комплексов на основе органических соединений, новые химические комплексы таких соединений, а также различные применения этих комплексов - RU2145320C1
Код документа: RU2145320C1
Чертежи



Описание
Область техники
Настоящее изобретение относится к способу
придания
растворимости в жировых системах органическим веществам, имеющим гидрофильные группы. Изобретение далее относится к группе новых химических комплексов, образующихся по указанному способу, а
также к
применению этих комплексов для различных целей, указанных ниже.
Изобретение в особенности относится к способам придания большей липофильности, т. е. жирорастворимости, веществам, имеющим гидрофильную группу. Это объясняется тем, что согласно изобретению гидрофильные соединения образуют стабильные жирорастворимые комплексы с липофильным носителем.
Уровень
техники
Обычно жирорастворимость придается веществам путем химической модификации, т. е. получением их производных. Это включает, например, введение в молекулу алифатической боковой
цепи,
которая делает молекулу более липофильной. В книге "Составление лекарственных препаратов" (I.Racz, Глава 4, John Wiley and Sons, 1989) этерификация подходящей жирной кислотой упоминается как
способ
придания большей липофильности веществу. Вместе с тем получение производных ведет за собой появление нескольких проблем. После химической модификации соединения зачастую проявляют совсем
другую
степень биологической активности, а иногда эта желаемая активность может быть утрачена. Далее, получение производных известного безвредного вещества приводит к появлению нового вещества,
токсичность
которого должна быть тщательно исследована, а это - большая и дорогостоящая работа.
Открытие в 1960-х годах липосом привлекло всеобщее внимание. Липосомы состоят из одного или более концентрических сферических липидных двойных слоев, окруженных водными оболочками. Обычно липосомы используют для капсулирования гидрофильных веществ в водных растворах с целью придания указанным веществам большей стабильности или биологического эффекта, например, в косметике. Если липосомы вводятся в жировую фазу, гидрофильные вещества остаются изолированными от жировой фазы, потому что на самом деле они существуют в виде гетерогенной дисперсии. В технологическом плане, а также при создании фармацевтических препаратов, достижения использования липосом были довольно ограниченными (см. "Ориентирование и транспорт лекарственных препаратов", гл.6, изд-во Н.Е. Junginger, Ellis Horwood, 1992).
Липосомы не являются альтернативой данному изобретению, поскольку они не придают липофильности гидрофильным веществам. Включение веществ в липосомы также создает трудности и вследствие этого требуется получение их производных.
Образование комплексов также упоминается в фармацевтической литературе, но только в связи с улучшением водорастворимости соединений, а также в связи с образованием осадков при определенных сочетаниях фармацевтических препаратов.
Ряд природных производных фенола, таких как флавоны, глюкозиды флавонов, фенольные ди- и тритерпены, гингеролы и другие вещества, обладают ограниченной растворимостью как в водных, так и в жировых системах. Несмотря на очень интересные химические и фармакологические свойства, многие соединения поэтому находят только ограниченное применение как активные агенты, например, в фармацевтических, пищевых и косметических продуктах. Так, имбирь (Zingiber officinale) содержит ряд 4-гидрокси-3-метоксифенильных (ГМФ) соединений, обладающих интересным химическим и фармакологическим действием, таким как потенциально антиокислительный эффект и эффект, модулирующий функции отдельных иммунных клеток. Вместе с тем, они применяются мало вследствие своей невысокой растворимости. Пряные растения семейства Labiatae, такие как шалфей, розмарин и тимьян, содержат фенольные дитерпены (Schwarz and Ternes, Z. Lebensmitteluntersuchung und Forschung. 195, 99 (1992)), из которых экстракцией можно выделить антиоксидант, сравнимый по силе с обычно используемым антиоксидантом БГА (бутилированным гидроксианизолом). Указанные производные фенола могут быть выделены из смолы экстракцией растительных терпентинов (смесей эфирных масел и смол). Обычно терпентины экстрагируют такими органическими растворителями, как этанол или метанол с последующей их отгонкой. Более мягкий способ экстракции терпентинов - суперкритическая экстракция жидким CO2 (патент США N US 5017397).
В качестве примера ГМФ-соединений, экстрагируемых из имбиря, можно привести 6-гингерол (5-гидрокси-1-(4-гидрокси-3- метоксифенил)-3-деканон) и 6- шогаол(1-(4-гидрокси-3-метоксифенил) -4-децен-3-он).
Не только эти природные производные фенола, но и многие другие органические соединения, в общем случае содержащие гидрофильные группы, не растворяются или очень плохо растворяются в жировых системах, вследствие чего ценные свойства этих соединений зачастую не используются.
Сущность изобретения
Задачей настоящего изобретения является придание органическим соединениям, содержащим гидрофильные группы,
включая и упомянутые выше
природные соединения, большей растворимости, что соответственно расширяет область их применения. В более конкретной формулировке задачей настоящего изобретения является
трансформация органических
соединений в новую комплексную форму с использованием носителя (агента-комплексообразователя), который:
(1) - придает органическим соединениям растворимость в
растительных и животных жирах
различной полярности;
(2) - придает органическим соединениям лучшую биологическую совместимость, облегчая таким образом их поглощение живыми организмами, и
(3) - упрощает введение
органических соединений в фармацевтические и косметические продукты, а также продукты питания.
Отличительной чертой способа, составляющего предмет
настоящего изобретения, с помощью
которого органическим соединениям, имеющим по меньшей мере одну гидрофильную группу, придается повышенная растворимость в жировых системах, является образование
химического комплекса между
органическим соединением и носителем, когда это соединение непосредственно или в виде спитового раствора смешивают с соответствующим носителем с последующим удалением по
необходимости спирта.
Неожиданно было обнаружено, что некоторые сложные эфиры жирных кислот с многоатомными спиртами и, в частности, с гидроксиалканами хорошо подходят в качестве носителей согласно
данному изобретению.
Указанные сложные эфиры имеют общую формулу

где R1 - это H или -CH2 OR5, R2 - это H или CH2OR6, а каждый из R3, R4, R5, R6 - остаток насыщенной или ненасыщенной жирной кислоты, имеющей от 4 до 30 углеродных атомов, или остаток насыщенной жирной кислоты, имеющей от 1 до 3 углеродных атомов, при условии, что по меньшей мере один из R3, R4, R5, R6 - остаток насыщенной или ненасыщенной жирной кислоты, имеющей от 4 до 30 углеродных атомов, и по меньшей мере один или в случае, когда любой из R1 и R2 не H, по меньшей мере, два из R3, R4, R5, R6, - остатки насыщенной жирной кислоты, имеющей от 1 до 3 углеродных атомов.
Предпочтительной группой
таких сложных эфиров являются глицериновые сложные эфиры жирных кислот, имеющие общую формулу

где один из R1, R2 или R3 представляет собой остаток насыщенной или ненасыщенной жирной кислоты, имеющей от 4 до 30, преимущественно от 10 до 22 атомов углерода, а два из R1, R2 или R3 представляют собой остатки насыщенной жирной кислоты, имеющей от 1 до 3 углеродных атомов. Подходящим остатком жирной кислоты, имеющей от 1 до 3 углеродных атомов, является ацетат.
Органические соединения, связываемые в комплекс указанными носителями, выбираются из ароматических соединений, содержащих одну или более функциональных групп, предпочтительно гидрокси- (-OH), амино- (-NH2), моно- и дизамещенную амино- (-NHR и -NR2), карбокси- (-COOH), нитро- (-NO2) и оксо-группы. Кроме того, указанные носители могут образовывать комплексы с более липофильными соединениями, имеющими одну или несколько гидрофильных групп, такими как витамин E (токоферолы), витамин A (ретинолы) и коэнзим Q10.
Как указывалось выше, соединения, способные связываться с носителями, могут быть выбраны из
широкого круга органических веществ. Некоторые из производных фенола
представляют особенный интерес, среди них надо упомянуть следующие вещества:
(а) 4-гидрокси-3-метоксифенильные соединения,
например, гингеролы и шогаолы из имбиря, а также куркуминоиды из
Curcuma longa;
(b) фенолокислоты и их производные, получаемые из растений или других природных источников;
(с)
флавоноидные и другие фракции, экстрагируемые из прополиса, растений,
таких, например, как гинкго двулопастный, стручковый перец, жень-шень, шалфей, розмарин, или других природных источников.
Исследования показали, что комплексы, являющиеся предметом изобретения, в особенности комплексы сложных эфиров уксусной кислоты (I) с указанными веществами (а-с), стабильны даже при предельных значениях pH. Далее, эти комплексы хорошо растворимы в различных жировых субстанциях, в то время как в свободном виде указанные производные фенола в тех же жировых субстанциях не растворяются.
Автор выдвигает гипотезу, что высокая эффективность комплексообразования и стабильность комплексов, являющихся предметом изобретения, является результатом нековалентного (диполь-дипольного) взаимодействия между соседствующими гидрокси- и метоксигруппами соединения ГМФ и нуклеофильными атомами кислорода радикалов уксусной кислоты носителя. Указанные нуклеофильные участки доступны для комплексообразования вследствие малой длины радикалов уксусной кислоты. Поэтому аналогичное комплексообразование не имеет места в случае триглицеридов жирных кислот со средней или большой длиной цепи. Вследствие этого предполагается, что ацетилированные моноглицериды в общем случае способны образовывать жирорастворимые комплексы с любым соединением, содержащим гидрофильные группы, способные взаимодействовать с доступным нуклеофильным областью носителя.
Указанные сложные эфиры (I) способны образовывать комплексы с большим числом органических соединений. Эти комплексы растворимы и стабильны в различных жирах, даже в сравнительно высоких концентрациях, которые будут указаны ниже в соответствующем разделе описания. Эти особенности в свойствах комплексов, являющихся предметом изобретения, позволяют предполагать возможность их использования в следующих областях.
Антиоксиданты и красители для пищевых продуктов
Антиоксиданты используются для защиты пищевых продуктов от прогоркания. Ряд
фенолов, экстрагируемых из растений, таких как карнозол, розманол и некоторые флавоиды и фенолокислоты, являются
эффективными антиоксидантами. Вместе с тем, их использованию в пищевых продуктах
препятствует низкая растворимость в жирах.
Когда эти антиоксиданты образуют комплексы со сложными эфирами (I), их растворимость в жировых субстанциях значительно повысится, и, соответственно, они становятся высокоэффективными антиоксидантами для пищевых продуктов. Хорошо известный пищевой антиоксидант dl-α-токоферол, который широко используется для консервации пищевых продуктов, был испытан в сравнении с комплексом, являющимся предметом изобретения и содержащим ГМФ соединения из имбиря, в качестве антиоксиданта при окислении линолевой кислоты при 37oC в течение 30 часов. Антиокислительная активность комплекса согласно изобретению была значительно выше, чем у соответствующего количества dl-α-токоферол. Эти результаты показывают, что комплексообразование согласно изобретению может быть приложено и к фенольным пищевым красителям, получаемым из растений, таким как флавоноиды и куркуминоиды. В настоящее время они, несмотря на свою эффективность, имеют ограниченное применение вследствие малой растворимости и низкой способности к диспергированию.
Активные компоненты для диетических добавок и пероральных
лекарственных препаратов
Большое число упомянутых выше малорастворимых веществ растительного
происхождения обладает ценными фармакологическими свойствами, например, противовоспалительным
действием, включающим антиокислительную активность. Главная проблема состоит, однако, в том, что при
прохождении по пищеварительному тракту эти вещества не усваиваются организмом, поскольку исходным
условием усвоения является растворимость соединения. Теперь оказывается, что комплексообразование со
сложным эфиром (I) согласно изобретению позволяет решить эту проблему. Было показано, что данные
комплексы удовлетворяют основным условиям хорошей усвояемости:
(1) комплексы образуют мицеллы
в присутствии солей желчных кислот;
(2) комплексы совместимы с жировыми субстанциями,
присутствующими в пищеварительном тракте;
(3) испытаниями in vitro было показано, что комплексы
стабильны в окружении, типичном для важной первой части пищеварительного тракта.
Поэтому вероятно, что комплексы будут включены в мицеллы с минимальным выделением активных компонентов. Активные компоненты перейдут из мицелл на стенки кишечника путем диффузии.
В
отношении пероральных лекарственных препаратов очевидны следующие применения
комплексообразования:
(1) Комплексообразование с чистыми веществами, такими как фармпрепараты. Это было успешно
осуществлено с рядом различных соединений, таких как чистые флавоны, флавонолы,
куркуминоиды, коэнзим Q10, α-токоферол.
(2) Комплексообразование со всеми растительными экстрактами для диетических добавок или с природными медицинскими препаратами. Это было успешно осуществлено для экстрактов прополиса и экстрактов различных растительных материалов, таких как имбирь, турмерик, Gingko biloba (гинкго двулопастный), жень-шень, капсикум (стручковый перец), розмарин, шалфей и Oregano.
Активные компоненты для использования в косметике.
В последние десять лет антиоксиданты нашли широкое применение в косметических продуктах для предотвращения процессов окислительной деградации, индуцируемой солнечным светом.
Комплексы природных антиоксидантов (например, гингеролов) и носителей в форме сложных эфиров формулы (I) обладают очевидными преимуществами при использовании в качестве активных компонентов для средств ухода за кожей. Условием усвоения препарата кожей является его способность преодолевать ее жировой барьер. Показано, что комплексы, составляющие предмет изобретения, хорошо сочетаются с жирами, сходными с жировым слоем кожи.
Специальные лекарственные формы
Комплексы согласно изобретению могут быть использованы как лекарственные препараты
независимо от особенностей лекарственной формы и способа введения. Это
связано с тем, что комплексы согласно изобретению лучше усваиваются организмом, чем те вещества, на основе которых они получены.
Примером этого является развитие перкутантных препаратов, т.е.
лекарств, поглощаемых организмом через кожу. Комплексообразование согласно изобретению должно увеличить применение лекарств, вводимых
путем транспорта через кожу.
Технохимические
применения
В дополнение к упомянутым выше областям применения комплексы согласно изобретению могут иметь различные технохимические
применения, например, как красители, антиоксиданты и другие
добавки для красок, пластмасс, нефтепродуктов и т. д. Основным преимуществом комплексов, как и во всех остальных случаях, является
отсутствие необходимости получения производных, а хорошая
совмещаемость с жирами является необходимым условием применения различных соединений для многих технических целей.
Подобным образом были созданы стабильные растворимые комплексы с желтым красителем куркумином. Куркумин в свободном состоянии очень слабо растворяется в жировых системах. Комплекс же, наоборот, полностью растворим в нескольких типах жиров.
Изобретение иллюстрируется следующей экспериментальной частью.
Сведения, подтверждающие возможность осуществления изобретения
Пример 1
А. КОМПЛЕКСООБРАЗОВАНИЕ И ЕГО
ОПРЕДЕЛЕНИЕ
Целью настоящего исследования являлось изучение образования, стабильности и совместимости с жирами комплексов согласно
изобретению.
Приготовление комплексов
5 г испытуемого соединения в чистом виде или в виде раствора в этаноле смешивали с 20 г каждого из указанных ниже носителей. После
интенсивного перемешивания этанол удаляли путем испарения.
В качестве носителя были использованы два диацетильных моноглицерида:
1. Диацетильный моноглицерид (далее C-12) со
следующим жирнокислотным составом моноглицерида: около 50%
лауриновой кислоты (12:0), 20% миристиновой кислоты (14:0), 15% каприловой и каприновой кислот (8:0 и 10:0) и 10% пальмитиновой кислоты
(16:0).
2. Диацетильный моноглицерид (далее C-18) со следующим жирнокислотным составом моноглицерида: 80% олеиновой кислоты (18: 1) и 10% стеариновой кислоты (18:0).
Комплексообразование проводилось для следующих контрольных
продуктов:
концентрат ГМФ-соединений из имбиря, полученного из китайского имбиря;
концентрат фенольной фракции прополиса
(ФФП) с высоким содержанием флавоноидов;
экстракт
гинкго двулопастного с высоким содержанием флавоновых гликозидов и терпеновых лактонов;
экстракт турмерика с высоким содержанием
куркумина;
экстракт капсикума с высоким содержанием
капсаицина;
чистый коэнзим Q10.
Образование комплексов было эффективным, что подтверждается следующими
данными:
1. После образования комплекса образцы
центрифугировали при 800 g в течение 15 мин. Наблюдение под микроскопом при увеличении 400-900-крат с фазовым контрастом показало только
незначительную степень седиментации.
2. После этого содержание комплекса определялось хроматографически с помощью тонкослойной хроматографии и обращенно-фазовой высокоэффективной жидкостной хроматографии. Образование комплекса подтверждалось количественной солюбилизацией контрольных соединений.
Стабильность при различных pH
Стабильность комплексов в
нейтральной, кислой и щелочной среде определялась следующим
образом:
1. К 50 мл 0.2 М раствора HCl при перемешивании магнитной мешалкой добавляли 0.5 г комплекса. После 15 и 120 мин
определяли стабильность и степень дисперсности комплекса.
2. К 50 мл 0.2 М раствора NaOH при перемешивании магнитной мешалкой добавляли 0.5 г комплекса. После 15 и 120 мин определяли стабильность и степень дисперсности комплекса.
3. К 50 мл воды при перемешивании магнитной мешалкой добавляли 0.5 г комплекса. После 15 и 120 мин определяли стабильность и степень дисперсности комплекса.
Все испытанные комплексы были стабильны в кислых, нейтральных и щелочных средах.
Растворимость в различных жировых системах
Совместимость комплексов с жирами определялась следующим образом.
0,100 г комплекса смешивали с 0,900 г следующих жировых субстанций:
1. Арахисовое масло ("Aextreff CT",
Aarhus Oliefabrik A/S);
2. Каприловый и каприновый сложные эфиры
пропиленгликоля;
3. Цетарилоктаноат;
4. Жидкий парафин.
После интенсивного встряхивания растворимость комплексов оценивали визуально, а также под микроскопом при 900-кратном увеличении с фазовым контрастом после центрифугирования при 1500 g в течение 15 мин.
Все контрольные вещества до комплексообразования очень слабо растворимы в исследуемых жировых системах. Комплексообразование значительно увеличило растворимость во всех контрольных жировых системах. В случае длинноцепного триглицерида и смеси каприлового и капринового сложных эфиров пропиленгликоля растворимость стала полной, а в цетарилоктаноате и жидком парафине - хорошей, с маргинальной тенденцией к образованию частиц.
Б. ИСПЫТАНИЯ БИОУСВОЯЕМОСТИ
Многие вещества плохо усваиваются организмом вследствие слабой растворимости или способности к диспергированию.
Целью настоящих исследований было определить, способствует ли комплексообразование
согласно изобретению увеличению поглощения тестируемых соединений в системе органов пищеварения.
Приготовление комплексов
5 г исследуемого соединения в чистом виде или в
этанольном растворе смешивали с 5-20 г носителя, указанного ниже. После интенсивного перемешивания этанол удаляли
испарением.
Был использован носитель следующего состава: диацетильный моноглицерид со следующим составом жирных кислот в расчете на моноглицерид: около 50% лауриновой кислоты (12:0), 20% миристиновой кислоты (14:0), 15% каприловой и каприновой кислоты (8:0 и 10:0) и 10% пальмитиновой кислоты.
В тестах были использованы следующие вещества:
концентрат
ГМФ-соединений из имбиря (далее ГМФ), полученный из китайского имбиря;
концентрат фенольных фракций прополиса (далее ФФП) с высоким содержанием флавоноидов;
чистый коэнзим Q10 (далее Q10).
Моделирование кишечного
усваивания
Стандартизированный желудочный сок приготовляли смешением следующих веществ: 2,00 г желчного экстракта
(В-8631, Sigma Chemical Company, St. Louis МО, 5 USA), 0,14 г панкреатина
(Р-1750, Sigma Chemical Company, St. Louis MO, USA), 3,00 г бикарбоната натрия (Е. Merck, Darmstadt, Germany) и 200 мл воды.
pH смеси был доведен до 8,3.
0,500 г комплекса и 50 мл стандартизированного желудочного сока смешивали в емкости объемом 100 мл и помещали в качающуюся водяную баню с температурой 37oC при умеренном встряхивании. В контрольных опытах вместо 500 г комплекса использовалось свободное испытуемое вещество в количестве, соответствующем содержащемуся в 0.500 г комплекса.
Пробы объемом 1,000 мл отбирались спустя 60, 120, 180 и 240 мин и экстрагировались с 1,5 мл 1-бутанола. Концентрация испытуемого вещества в желудочном соке определялась соответствующим способом (спектрофотометрически или с помощью высокоэффективной жидкостной хроматографии).
Результаты
Результаты представлены на фиг. 1-3, где показана зависимость
концентрации тестового соединения в желудочном соке от времени (среднее
значение по двум экспериментам).
Данные о веществах ГМФ приведены на фиг. 1. Усвояемость ГМФ была в 1,6 раза больше в случае комплексной формы по сравнению со свободным веществом (среднее значение по всему эксперименту).
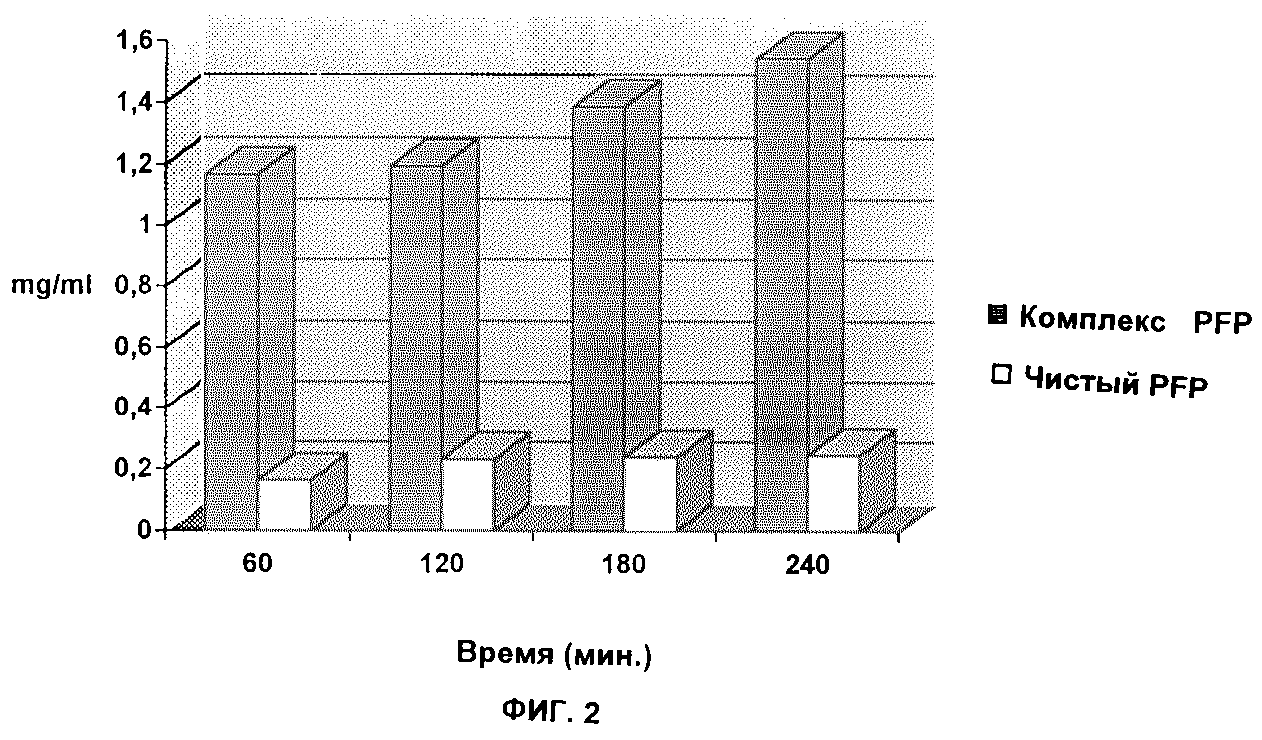
Результаты испытаний ФФП приведены на фиг. 2. Усвояемость ФФП была в 5,6 раза больше в случае комплексной формы по сравнению со свободным веществом (среднее значение по всему эксперименту).
Результаты испытаний Q10 приведены на фиг. 3. Усвояемость Q10 была в 2,2 раза больше в случае комплексной формы по сравнению со свободным веществом (среднее значение по всему эксперименту).
Таким образом, комплексообразование приводит к значительному повышению усвояемости активных компонентов в рамках полного периода эксперимента, что указывает на существенное повышение биоусвояемости.
В аналогичном эксперименте было проведено сравнение нескольких обычно применяемых носителей фармацевтических препаратов с носителем согласно изобретению. Было установлено, что, например, длинно- и среднецепные триглицериды и полиоксиэтилированный моноолеат сорбита ("Полисорбит 80") в незначительной степени повышают усвояемость испытуемых соединений, и, соответственно, не являются альтернативой данному изобретению.
Пример 2
В настоящем
исследовании изучалась способность носителя согласно изобретению образовывать комплексы с органическими соединениями, содержащими
различные функциональные группы. Точнее, было изучено
комплексообразование носителя с ароматическими гидрокси-, амино- и нитропроизводными, а также производными карбоновых кислот
Приготовление комплексов.
50,0 мг исследуемого соединения смешивали с 450,0 мг носителя и помещали на кипящую водяную баню на 30 мин. Каждые 10 мин смесь энергично встряхивали.
В качестве носителей использовались два типа
ацетилированных моноглицеридов:
1. Диацетильный моноглицерид (далее C-18) со следующим составом жирных кислот относительно
моноглицерида: около 80% олеиновой кислоты (18:1) и 10% стеариновой
кислоты (18:0).
2. Диацетильный моноглицерид (далее C-12) со следующим составом жирных кислот относительно моноглицерида: около 50% лауриновой кислоты (12:0), 20% миристиновой кислоты (14:0), 15% каприновой и каприловой кислот (8:0 и 10:0) и 10% пальмитиновой кислоты (16:0).
Комплексообразование изучалось на примере следующих испытуемых соединений: 1,2, 3-тригидроксибензол; 1,2-дигидроксибензол; 1,3-дигидроксибензол; 1,4-дигидроксибензол; 1,2-диаминобензол; 1, 4-диаминобензол; 3-нитрофенол; 4-нитрофенол; 4-метоксифенол; 4-аминофенол; 2-амино-4-нитрофенол; 4-амино-2- нитрофенол; 2-нитроанилин; 3-нитроанилин; 4-нитроанилин; 2,4-диаминотолуол; 2, 6-диаминотолуол; 2-аминобензойная кислота; 2-нитробензойная кислота; 3-нитробензойная кислота; 4-нитробензойная кислота; 2-гидроксибензойная кислота; 3-гидроксибензойная кислота; 3, 4-дигидроксибензойная кислота; куркумин.
Оценка величины комплексообразования
1) После образования комплекса образцы охлаждали и центрифугировали при 800 g в течение 15
мин.
2) Микроскопическое исследование при 400-900-кратном увеличении с фазовым контрастом имело целью установить, не образуются ли какие-либо видимые частицы.
3) 100 мг комплекса растворяли в 400 мг арахисового масла ("Aextreff CT", Aarhus Oliefabrik A/S), в котором испытуемые вещества за некоторыми исключениями были нерастворимы. С помощью микроскопических наблюдений при 400-900-кратном увеличении с фазовым контрастом было установлено, что никакого осаждения испытуемого соединения не имело места.
4) Закомплексованные испытуемые вещества выделялись обратно с помощью тонкослойной хроматографии и высокоэффективной жидкостной хроматографии.
Результаты
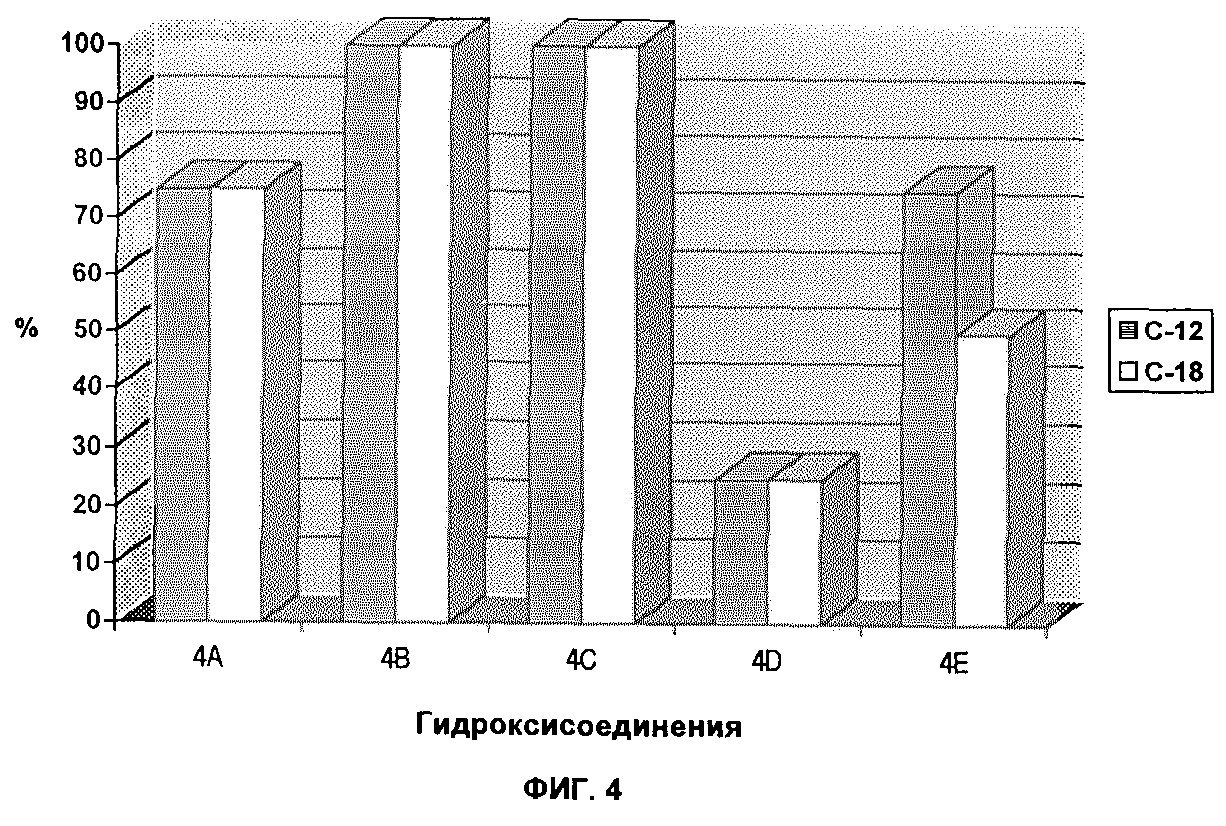
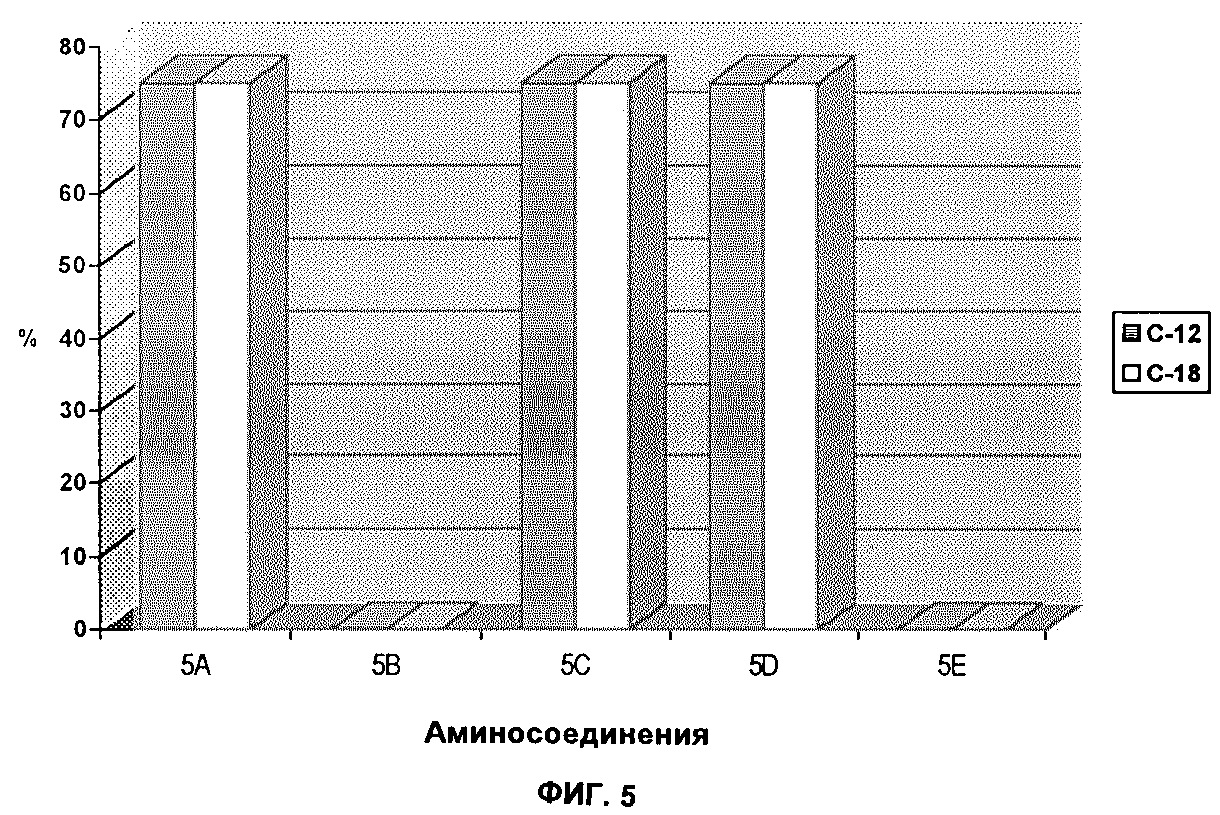
Результаты комплексообразования с испытуемыми соединениями
представлены на фиг. 4-7, где показано, сколько процентов испытуемого соединения было
закомплексовано двумя носителями (C-12 и C-18).
а) Результаты комплексообразования с различными
гидроксисоединениями показаны на фиг. 4. Были испытаны следующие гидроксисоединения:
4A: 1, 2, 3 - тригидроксибензол,
4B: 1, 2 - дигидроксибензол,
4C: 1, 3
- дигидроксибензол,
4D: 1, 4 - дигидроксибензол,
4E: куркумин,
б) Результаты
комплексообразования с аминосоединениями показаны на фиг. 5. Были испытаны следующие
аминосоединения:
5A: 1, 2 - диаминобензол,
5B: 1, 4 - диаминобензол,
5C: 2, 6
- диаминотолуол,
5D: 2, 4 - диаминотолуол,
5E: 4 - аминофенол.
в) Результаты комплексообразования с нитросоединениями показаны на фиг. 6. Были испытаны следующие
нитросоединения:
6A: 3 - нитрофенол,
6B: 4 - нитрофенол,
6C: 4
- нитроанилин,
6D: 3 - нитроанилин,
6E: 2 - нитроанилин.
г) Результаты
комплексообразования с различными карбоновыми кислотами показаны на фиг.7. Были испытаны
следующие карбоновые кислоты:
7A: 2 - аминобензойная кислота,
7B: 2 - нитробензойная кислота,
7C: 3 - нитробензойная кислота,
7D: 4 - нитробензойная кислота,
7Е: 2 - гидроксибензойная кислота,
7F: 3 - гидроксибензойная кислота,
7G: 3, 4
- дигидроксибензойная кислота.
Таким образом, было успешно испытано комплексообразование согласно изобретению на широком круге ароматических соединений. Оказалось возможным получить стабильные комплексы между двумя носителями, имеющими общую формулу (1) и рядом гидрокси-, амино- и нитросоединений, а также карбоновых кислот.
В большинстве случаев комплексообразование проходило с выходом от 25 до 100%. Комплексообразование оказалось возможным с соединениями, имеющими одну или более гидрофильных групп в разных положениях.
В некоторых случаях носитель C-12 превосходил носитель C-18. Таким образом, возможно, что для конкретных соединений можно создать оптимальный носитель, например, для соединений, которые плохо образовывают комплексы в условиях настоящего эксперимента.
Таким образом, результаты демонстрируют широкую область применения настоящего изобретения.
Реферат
Органические соединения, содержащие по меньшей мере одну гидрофильную
группу, становятся растворимыми в жировых системах вследствие образования химических комплексов с носителями, представляющими собой эфиры жирных кислот и многоатомных спиртов общей формулы I

где R1 - это Н или -СH2ОR5, R2 - это Н или -СH2 ОR6, а каждый из R3, R4, R5, R6 - остаток насыщенной или ненасыщенной жирной кислоты, имеющей 4-30 углеродных атомов, или остаток насыщенной жирной кислоты, имеющей 1-3 углеродных атомов, при условии, что по меньшей мере один из R3, R4, R5 и R6 - остаток насыщенной или ненасыщенной жирной кислоты, имеющей 4-30 углеродных атомов, и по меньшей мере один или, в случае когда любой из R1 и R2 не Н, по меньшей мере два из R3, R4, R5, R6 - остатки насыщенной жирной кислоты, имеющей 1-3 углеродных атомов. Диацетаты обычных моноглицеридов особенно предпочтительны как носители при образовании комплексов. Эти комплексы применимы для введения веществ, содержащих гидрофильные группы, в лекарственные и косметические препараты, продукты питания, кормовые продукты, диетические добавки и природные медицинские препараты, а также техно- химические композиции. 2 с. и 7 з.п.ф-лы, 7 ил.

Формула

где R1 - H или -CH2OR5, R2 - H или -CH2OR6, а каждый из R3, R4, R5 и R6 - остаток насыщенной или ненасыщенной жирной кислоты, имеющей от 4 до 30 углеродных атомов, или остаток насыщенной жирной кислоты, имеющей от 1 до 3 углеродных атомов, при условии, что по меньшей мере один из R3, R4, R5 и R6 - остаток насыщенной или ненасыщенной жирной кислоты, имеющей от 4 до 30 углеродных атомов, и по меньшей мере один или, в случае когда любой из R1 и R2 не H, по меньшей мере два из R3, R4, R5 и R6 - остаток насыщенной жирной кислоты, имеющей 1 - 3 углеродных атомов, с последующим удалением, при необходимости, спирта.

где один из R1, R2 и R3 представляет собой остаток насыщенной или ненасыщенной жирной кислоты, имеющей от 4 до 30, преимущественно 10 - 22 атомов углерода, а два из R1, R2 или R3 представляют собой остаток ненасыщенной жирной кислоты, имеющей 1 - 3 углеродных атомов.

где R1 - H или - CH2OR5, R2 - H или CH2OR6, а каждый из R3, R4, R5 и R6 - остаток насыщенной или ненасыщенной жирной кислоты, имеющей от 4 до 30 углеродных атомов, или остаток насыщенной жирной кислоты, имеющей от 1 до 3 углеродных атомов, что по меньшей мере один из R3, R4, R5 и R6 - остаток насыщенной или ненасыщенной жирной кислоты, имеющей от 4 до 30 углеродных атомов, и по меньшей мере один или, в случае когда любой из R1 и R2 не H, по меньшей мере два из R3, R4, R5 и R6 - остатки насыщенной жирной кислоты, имеющей 1 - 3 углеродных атомов.

где один из R1, R2 или R3 представляет собой остаток насыщенной или ненасыщенной жирной кислоты, имеющей 4 - 30, преимущественно 10 - 22 углеродных атомов, а два из R1, R2 или R3 представляет собой остатки насыщенной жирной кислоты, имеющей 1 - 3 углеродных атома.

Комментарии