Протез для субэпителиальной имплантации - RU2114579C1
Код документа: RU2114579C1
Чертежи


Описание
Изобретение относится к способам имплантации протезирующих устройств людям или животным. Точнее, оно относится к способу имплантации протезирующих устройств в тех случаях, когда желательно на постоянный срок ввести протез под поверхность эпителия. Способ по данному изобретению можно применять при субэпителиальной имплантации таких протезов, как контактные линзы, дермальные устройства, дентальные устройства, отоларингологические устройства, сосудистые протезы и остомические устройства. Изобретение относится также к способам обработки протезов и получаемых из них устройств, что позволяет на постоянный срок вводить устройства под эпителиальный слой.
Существует большое число протезирующих устройств, которые необходимо или желательно вводить полностью или частично под эпителиальную ткань. Необходимо отметить, что под эпителиальными тканями здесь понимается эпидермальная ткань и другие эпителиальные ткани. Имплантация под эпителий может производиться для фиксации устройства относительно других тканей и/или с косметическими целями. Примерами имплантируемых протезов являются дентальные протезы, такие как искусственные зубы и мосты; протезы слухового аппарата; дермальные имплантаты; васкулярные дополняющие устройства, например обусловленные гипералиментацией; колостомические устройства; протезы роговицы, изготавливаемые из синтетических и природных материалов. Хотя способы по данному изобретению будут описаны конкретно для применения при субэпителиальной имплантации протезов роговицы, однако легко понять, что их можно применять в любых случаях, где желательно имплантировать протезирующее устройство частично или полностью под поверхность эпителия.
Способы по данному изобретению успешно можно применять в офтальмологии. Офтальмологи длительное время связаны с лечениями дефектов зрения, обусловленных дефектами роговицы. Наиболее распространенными из этих дефектов являются близорукость, которая может вызываться излишним изгибом роговицы, дальнозоркость, которая может вызываться недостаточным изгибом роговицы, и астигматизм, вызываемый асимметрией роговицы. Травма роговицы, приводящая к царапанию и/или разрушению роговичной ткани, также вызывает дефекты зрения. Часто корректирующие линзы, например очки или контактные линзы, можно использовать для коррекции дефектов зрения. Однако, в некоторых тяжелых случаях или в случае травмы роговицы, а также для пациентов, нетолерантных к контактным линзам, необходимо использовать хирургическое вмешательство для исправления геометрии роговицы. Хотя разработано большое число таких методик, обычно называемых рефрактивной кератопластикой, однако постоянные хорошие результаты не достигаются. Поэтому эти подходы широко не используются.
Большое число рефрактивных кератопластических методик используется при имплантации геометрически измененных роговичных тканей, полученных от донора или самого пациента с достижением рефрактивной коррекции. В одной из таких методик переднюю часть собственной роговицы пациента удаляют. Форму удаленной секции роговицы затем изменяют в замороженном состоянии для уменьшения или повышения кривизны. Затем роговицу размораживают и помещают обратно на ее место на роговичной поверхности. По другой методике донорскую роговицу, форма которой изменена в замороженном состоянии, используют для замены передней части роговицы пациента, удаленной хирургически.
По другой методике рефрактивной кератопластики удаляют лишь эпителиальный слой роговицы пациента. Затем донорскую линзовую "пуговицу", предварительно обточненную в замороженном состоянии до нужной степени рефракции, пересаживают на это место.
В патенте США N 4 346 482, поданном от имени Теннента и др., описан способ коррекции зрения, где циркулярную часть донорской роговицы с передней стороны изменяют для коррекции зрения. Обратную часть роговичной секции обтачивают до соответствия кривизне роговицы пациента. Линзы включают обращенное внутрь интегральное кольцо, вставляемое в роговицу пациента. Донорскую роговицу обрабатывают замораживанием, убивающим кератоциты, в результате чего лишь коллаген остается для фиксации. Методика основана на миграции кератоцитов из тканей пациента в донорскую роговицу для заживления и включения донорской роговицы в глаз.
Все вышеописанные методики с использованием донорской или собственной роговичной ткани основаны на предельно точном и осторожном разрезе. Даже с использованием изощренного оборудования, доступного для этой цели, трудно достичь требуемой степени коррекции. Если используют донорскую роговицу, то доступность ее крайне ограничена, что обусловлено социальными и религиозными причинами, затрудняющими взятие роговицы у трупов. В случае неудачи, например при отсечении ткани, инфекции, плохого приживления или неправильной коррекции, трудно получить дополнительный биосовместимый материал для исправляющего хирургического вмешательства. Еще одной трудностью этих методик является трудность работы с биоматериалами, имеющими ограниченное время жизни и требующими специальных предосторожностей для поддержания их жизнеспособности.
Разработано большое число рефрактивных кератопластических методик с использованием роговичных протезов, изготовленных из синтетических материалов или из неживых материалов из природного сырья, например из коллагена. В патенте США N 4 581 030 (Брюне и др.) описано замещение роговицы протезом, в частности прозрачным коллагеновым материалом, пригодным для изготовления таких протезов, и способы получения прозрачного коллагенового материала. Протез содержит коллаген, полигидроксиэтилметакрилат или витрозин.
В патенте США N 3 545 966 (Розен) описана роговичная трансплантантная структура из синтетического материала, совместимого с тканями для замещения удаленной секции роговицы. Внешняя краевая часть структуры находится в плотном контакте с краевой частью роговицы, окружающей структуру. Для успешного закрепления контролируемая температура накладывается на структуру по площади контакта ее с частями роговицы.
В большом числе статей описывается использование тканевых адгезивов, таких как цианоакрилатные адгезивы, для приклеивания синтетических контактных линз на поверхность роговицы (см., например, Richards Y.S. Can.Y.Ophthalmol, 6/2/: 98-103 (1971); Ruben M., Trans. Ophthalmol Soc. U.K., 90: 551-564 (1970); Dohlman C.H., Arch. Ophthalmol., 83/1/: 10-20 (1970); Dohlman C. H., Trans. Am Acad. Ophthalmol Otolaryngol., 73/3/: 482-493 (1969)). Синтетические линзы изготавливают, как правило, из акрилатных полимеров, таких как полигидроксиэтилметакрилат.
Вышеописанные методики, в которых синтетические или коллагеновые контактные линзы фиксируют на поверхности роговицы, преодолевают некоторые из вышеуказанных недостатков, присущих кератопластике, где используют донорскую или собственную роговичную ткань.
Недостатком синтетических линз является то, что их трудно надолго ввести в глаз без инфекции или отторжения. Была предложена методика для преодоления этого недостатка, в которой делают разрез в стромальных тканях роговицы и формируют карман, в который помещают синтетическую линзу. По этой методике с успехом исправляли зрения кроликов (McCarey B.E., Andrews D.M., Invest. Ophthalmol Vis. Sci., 21:107-115 (1981)). Однако у приматов мембрана Боумена, являющаяся относительно жесткой, приводит к повышению сопротивления роговицы любому возрастанию кривизны, вызываемому имплантированными линзами. Коениг с соавторами предложили решать эту проблему серией релаксационных разрезов в мембране Боумена (Ophthalmic herg., 15: 225 - 229 (1984)).
Таким образом в офтальмологии существует потребность в методике, позволяющей вводить на постоянный срок и имплантировать синтетические линзы для рефрактивной коррекции в ткани глаза. Кроме того, имеется общая потребность в постоянной имплантации и введении протезирующих устройств под эпителиальные ткани людей и животных.
В данном изобретении предлагается способ имплантации протезирующих устройств под эпителиальный слой. В способе по данному изобретению часть эпителия удаляют в зоне имплантации, оставляя остальную часть эпителия интактной. Поверхность имплантируемого протезирующего устройства покрывают композицией, содержащей сшитый или несшитый фибронектин, либо биологически активный фрагмент или аналог фибронектина. Поверхность протеза способна связывать фибронектин. Поверхность устройства может состоять из таких материалов, как коллаген, который способен без химической модификации связывать фибронектин. Она может состоять из синтетического материала, который сам по себе не связывает фибронектин, но химически модифицирован таким образом, что начинает его связывать. Связывающие свойства фибронектина способствуют фиксации покрытого устройства в субэпителиальных тканях, хотя можно использовать и механическую фиксацию, например шовную или другую, для закрепления линзы с субэпителиальных тканях. Эпителиальная ткань из окружающих зон затем нарастает сверху и сама фиксируется к поверхности протезирующего устройства.
Способ по данному изобретению можно использовать для любого применения, где желательно имплантировать протезирующее устройство на постоянный срок под эпителиальную ткань.
На фиг. 1 показана часть интактной человеческой роговицы, поперечное сечение; на фиг. 2 - часть человеческой роговицы, подготовленной для имплантации поверхностно-модифицированной мягкой контактной линзы, поперечное сечение; на фиг. 3 - часть человеческой роговицы, содержащей имплантированную линзу, поперечное сечение.
В способе по данному изобретению поверхность имплантируемого протезирующего устройства покрывают композицией, содержащей сшитый или несшитый фибронектин, его биологически активный фрагмент или аналог. Фибронектин представляет собой гликопротеин (4-5% углеводов) с молекулярной массой около 220000 Да, существующий в форме димера массой 440000 Да. Фибронектин существует в формах, ассоциированных с плазмой и клетками. Его удобно выделять из плазмы способом, описанным в Nishida и др. , Jap.J. Ophth., 26:4416-24 (1985). Фибронектин известен также под другими различными названиями, включая нерастворимый на холоде глобулин, поверхностный фибробластный антиген, клеточный поверхностный белок, полоса I, полоса LI, зета-белок, основной фибробластный гликопротеин, галактопротеин A, больше чувствительный к внешней трансформации белок (LETS), микрофибриллярный белок, белок прикрепления клеток (Mol. & Cell Biochem., 29: 103-125 (1980)). В данном изобретении можно использовать биологические активные фрагменты или аналоги фибронектина. Например, вместо фибронектина можно использовать белок, имеющий аминокислотную последовательность, в высокой степени гомологичную фибронектину, например витронектин (Suzuki S., J. Biol. Chem., 259: 15307-15314 (1984)). Можно использовать другие аналоги, включая полученные методами генной инженерии, при условии, что они обладают закрепляющей клетки активностью, аналогичной активности нативного фибронектина. Подходящие фрагменты и способы их получения описаны в патенте США N 4589881 (Пиерсбахер и Руослати) и в патенте США N 4578079 (Руослати и Пиерсбахер), приводимых здесь для справки. В патенте США N 4589881 описан фрагмент фибронектина длиной 108 аминокислотных остатков (масса 11500 Да), обладающий закрепляющей клетки активностью, а также фрагмент из 30 аминокислотных остатков, также обладающий такой активностью. В патенте США N 4 578 079 описан фрагмент и его аналог, имеющие формулы X-Arg-Gly-Aip-Thr-Y, X-Arg-Gly-Asp-Cys-Y и X-Arg-Gly-Asp-Ser-Y, где X представляет собой H или по крайней мере один аминокислотный остаток, а Y является COOH или по крайней мере одним аминокислотным остатком. Используемый ниже термин фибронектин включает биологически активные фрагменты и его аналоги. Фибронектин включает также природные материалы и материалы, полученные техникой рекомбинантных ДНК.
Обычно фибронектин доступен в виде стабилизированных композиций,
содержащих альбумин и сахар в качестве стабилизаторов, а также буферные и контролирующие осмос соли. Ниже
представлен пример состава фибронектиновой композиции, которую можно использовать в данном
изобретении, мг:
Фибронектин - 60
Альбумин - 30
Сахароза - 150,4
NaCl
- 25,4
NaH2PO4 • 2H2O - 3,3
Na2HPO4 • 12H2O - 3,5
В данном изобретении фибронектин можно
использовать в форме раствора, получаемого смешением вышеописанной рецептуры с раствором соли с
получением нужной концентрации фибронектина.
Используемый фибронектин должен быть свободен от вирусов, таких как вирус гепатита. Удаление вирусов гепатита из фибронектина можно проводить по методике, описанной в патенте США N 4 242 206, приводимом здесь для справки.
Фибронектин обладает рядом свойств, делающих его пригодным для использования в данном изобретении. Как известно, он играет ключевую роль при организации клеток и экстрацеллюлярных матриц в растущей ткани. Он хемотактичен для фибробластов и кератоцитов, играющих важную роль при заживлении ран. Таким образом, фибронектин промотирует рост и клеточную организацию эпителиальной ткани на поверхности протезирующего устройства и вызывает миграцию фибробластов или кератоцитов по площади с ускорением заживления раны.
Фибронектин можно наносить на поверхности протеза в сшитой или в несшитой форме. В первом случае наносимая на поверхность композиция содержит также сшивающий агент. Сшивающий агент может представлять собой любой сшивающий агент, способный сшивать молекулы белка по боковым аминокислотным цепям.
Сшивающий агент может быть любым соединением, способным сшивать ковалентно белковые молекулы, фармацевтически приемлемым для данного применения. Примерами таких соединений являются альдегиды, например формальдегид и глутаральдегид; диимидаты, например диметиладипимидат и диметилпимелимидат; водорастворимые ди-N-оксисукцинимидные сложные эфиры, например бис/сульфосукцинимидил/суберат и дисукцинимидилтартрат; фотореактивные сшивающие агенты, например п-азидофенилглиоксаль, N-оксисукцинимидил-4-азидобензоат и метил-4-азидобензоат; и гетеробифункциональные сшивающие агенты, такие как N-сукцинимидил/4-иодацетил/аминобензоат и сукцинимидил-4-/N-малеимидометил/циклогексан-1-карбоацилат. Можно использовать другие классы соединений, известных как сшиватели белков и фармацевтически приемлемых для данного применения.
Проверенные сшивающие агенты относятся к классу диимидатных эфиров. Эти соединения можно
представить следующей формулой:
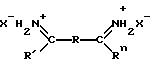
где
R - такой остаток, как - (CH2)n-, S-S-,
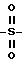
R' и R'', которые могут быть одинаковы или различны, представляют собой алкоксигруппы, имеющие от 1 до приблизительно 20 атомов углерода; X- является противоанионом, таким как Cl- или B-. Если R представляет собой -(CH2)n-S-S-(CH2)n-, то n предпочтительно равно 2.
В качестве примера диимидатных соединений можно указать диметилпимелимидатдигидрохлорид, диметиладипидатдигидрохлорид и диметил-3, 3'-дитиобиспропионимидатдигидрохлорид.
Соединения формулы I предпочтительно использовать в форме раствора при таком pH, при котором соединение формулы I способно эффективно сшивать белковые молекулы. Предпочтительно раствор является слабо-щелочным. Для того, чтобы быть офтальмологически приемлемым, раствор должен иметь pH не выше чем приблизительно 8,5. Предпочтительно применять соединение формулы I в растворе с pH около 7,5 - 8,5, наиболее предпочтительно около 7,8. Можно использовать любой пригодный, офтальмологически приемлемый носитель. Например, можно использовать соединение формулы I в 0,3 М растворе NaOH в стерильной воде с pH 13, 0 - 14,0, смешанном с 50 мг/мл соединения формулы II с получением раствора с pH 7,5 - 7,8, пригодного для данного изобретения.
Пригодным сшивающим агентом является
диметилпимелимидатдигидрохлорид, имеющий следующую формулу:
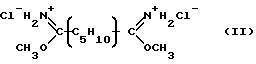
Диметилпимелимидатдигидрохлорид широко используется как фиксирующий агент в гистологии.
При необходимости в композицию можно вводить соединения, обладающие положительным эффектом на заживление ран, например создающие матрицу для миграции и роста клеток. Они предпочтительно являются экстрацеллюларными матричными белками (ECM). ECM это белки, найденные в экстрацеллюларных матричных структурах культивированных клеток (Asieh P., Baum J., Invest. Ophth. & Vis. Sci. , 26: 457-463 (1985)). Обычно это высокомолекулярные (более 150000 Да) нитчатые гликопротеины, включающие коллагены, витронектин, эластин, ламинин, актин и фибриноген. Понятно, что под ECM понимаются не только соединения природного происхождения, но и соединения, полученные синтетически, экспрессией микроорганизмов, полученных генной инженерией или комбинированные. В случае белков или гликопротеинов эти соединения должны включать биологически активные фрагменты и аналоги таких белков или гликопротеинов. ECM, отличающиеся от фибронектина, можно наносить на протезы обработкой их раствором, содержащим соединение в количестве около 0,1 - 10 мг/дл.
При желании покрывающая композиция может также содержать лекарства и/или другие соединения, промотирующие заживление ран. Например, в покрывающей композиции можно диспергировать антибиотики. Подходящими антибиотиками являются, например, гентамицин, неомицин, бацитрацин и т.п. Кроме того, в покрывающую композицию можно вводить другие соединения, например антимикробные агенты, противовирусные агенты, противовоспалительные агенты, антипротеазные гормоны, витамины, анальгетики, хелатные агенты, митогенные агенты и т.п.
В покрывающей композиции можно диспергировать любые известные факторы роста ткани. Факторы роста - это митогенные белки или полипептиды; промотирующие пролиферацию клеток. Известно большое число факторов роста. Они включают эпидермальный фактор роста (EGF), трансформационный фактор роста (TGF), фактор роста нервов (ПGF). Инсулин, полипептидный гормон, обладает митогенной активностью и может использоваться с простагландином F2, непептидом, который, как было показано, значительно повышает митогенную активность инсулина (см. Jimenez de Asua L. и др. Cold. Spring Harbor Conf. Cell Proliferation, vol. 6, Sato, ed., Cold Spring Harbor Labs., New York (1979), p. 403 - 424). Аналогичная активация инсулина была обнаружена для фибробластного фактора роста (Rudland P.S. и др., Proc. Natl. Acad. Sci., USA, 76: 1279-1293 (1974)). Положительное действие на рост клеток было установлено для фактора роста из тромбоцитов или фактора роста или фибробластов в сочетании с соединением инсулинового класса, таким как соматомедины A и C (Stiles C. D. и др., Proc. Natl. Acad. Sci., USA., 76: 1279-1283 (1979)). Кроме того, недавно было выделено и охарактеризовано большое число новых пептидных факторов роста, как указано в Fissul Growth Factors, R. Baserga, ed. , Springer-Verlag pub., New York (1981)). Другие лекарства или факторы роста диспергируют в композиции в известных эффективных количествах.
Как отмечалось выше, фибронектинсодержащие покрывающие композиции можно наносить на поверхность протеза, поверхность которого способна, после или без химической модификации, связывать фибронектин. Фибронектин имеет связывающие участки, способные связывать большое число белков, включая коллаген. Так например, в случае протеза роговицы, содержащего коллаген, описанного в патенте США N 4581030 (Брюнс и др.) или в патенте США N 4 223 984 (Мията и др.), нет необходимости химически модифицировать поверхность перед обработкой фибронектинсодержащей покрывающей композицией.
Большинство протезирующих устройств, однако, не сделаны из материалов, в нормальном состоянии связывающих фибронектин, а из синтетических полимерных материалов, которые можно химически модифицировать, придавая им свойство связывать фибронектин. Например, мягкие контактные линзы обычно получают из гидрогелей.
Как правило, эти типы полимеров получают из гидрофильных мономеров, способных сополимеризоваться с другими соединениями, придающими нужные физические свойства. Кроме того, для придания нужных свойств результирующему изделию можно добавлять полимеризуемые добавки, такие как УФ-поглощающие агенты. Контактные линзы, которые можно имплантировать способом по данному изобретению, широко доступны и изготавливаются из различных материалов. Примерами гидрогелей этого типа являются полимеры 2-оксиэтилакрилата (например, полимакон), различные сополимеры 2-оксиэтилметакрилата (например, гафилкон A и B, вифилкон A, тетрафилкон, дизефилкон, буфилкон, перфилкон и пр.), сополимеры N-винилпирролидона (например, лидофилкон A и B, скафилкон A, сурфилкон, сурфилкон, вифилкон, филкон Y A, и пр.), гидрофильные сополимеры акрилонитрила, например HYPAN, гидрогели, содержащие коллаген, например, описанные в патентах США NN 4452925 и 4388428 и в P.N.A.S., USA, 77, N 4, 2064-2068 (1980). Используемый здесь термин мягкая контактная линза включает линзы, изготовленные из вышеуказанных соединений, и линзы, обладающие высокой проницаемостью по кислороду, питательным веществам (особенно по глюкозе) и метаболитам. Проницаемость по кислороду должна быть по крайней мере настолько высокой, как у гидрогелевых линз с содержанием воды около 70%. Проницаемость по питательным веществам и метаболитам должна быть по крайней мере настолько высокой, как у гидрогелевых линз с содержанием воды около 60% или с эффективным диаметром пор большим, чем приблизительно 12

В случае протезирующих устройств, которые в нормальном состоянии не связывают фибронектин, поверхность модифицируют для придания ей способности его связывать. Один из подходящих методов модификации полимерной поверхности - покрытие ее поли (L-лизином). Можно также использовать другие полиамины, такие как полиэтиленимин, полиаллиламин и пр. Хотя точный механизм присоединения непонятен, однако гомополимеры аминокислоты L-лизина способны связываться с широким набором полимеров. Молекулярная масса поли(L-лизина) не является особенно важным фактором. Поли(L-лизины) с молекулярными массами от 30000 до более чем 300000 Да успешно применяются для обработки поверхности протезирующих устройств и придания им способности связывать фибронектин. Предпочтительной предобработкой поверхности является инкубирование ее в водном растворе поли(L-лизина) в течение приблизительно 1-24 ч при температуре около 15 - 30oC. Затем поверхность промывают стерильной водой.
Для предобработки протезирующего устройства можно также использовать другие известные способы придания реакционной способности исходно инертным поверхностям. Например, способ придания синтетическому материалу способности связывать фибронектин включает в себя обработку поверхности цианогенбромидом.
После предобработки поверхности и придания ей способности связывать фибронектин, на нее наносят фибронектиновую покрывающую композицию. Если на поверхность наносят несшитый фибронектин, то предобработанную поверхность затем инкубируют в растворе фибронектина и, возможно, других соединений, таких как ECM и/или факторы роста и/или лекарства. Раствор может быть водным, например в стерильной воде, или раствором в диметилформамиде или другом фармацевтически приемлемом нетоксичном растворе. Фибронектин, как правило, присутствует в растворе в концентрации около 1-100 мг/мл, предпочтительно около 1-10 мг/мл. Так как фибронектин высаживается из раствора при низкой температуре, то предпочтительно инкубировать в фибронектиновом растворе при температуре не ниже чем приблизительно 15oC, предпочтительно при комнатной. Время инкубирования равно приблизительно 0,25 - 24 ч.
Предпочтительно фибронектинсодержащую покрывающую композицию наносить в форме сшитого покрытия. В предпочтительном варианте на предобработанную поверхность протеза сначала наносят вышеописанный сшивающий агент, например диметилпимелимидатдигидрохлорид. Это можно проводить инкубированием поверхности в водном растворе сшивающего агента. Сшивающий агент связывается с предобработанной поверхностью. В случае поверхности, предобработанной поли(L-лизином), поли(L-лизин) связывается с полимерной поверхностью протеза и сшивающий агент затем связывается с поли(L-лизином). Так как сшивающий агент полифункционален, то его можно связать с поли(L-лизином), и оставшиеся функциональные группы по-прежнему будут доступны для реакции с фибронектином. Предпочтительно инкубировать протезирующее устройство в растворе сшивающего агента с концентрацией около 1 -20 мг/мл, в течение приблизительно 0,5 - 1,5 ч. Инкубирование предпочтительно проводить при температуре около 1 - 25oC.
После инкубирования предобработанного протеза в сшивающем агенте поверхность затем отмывают стерильной водой и обрабатывают фибронектином инкубированием в растворе фибронектина, который может содержать другие соединения, например ECM, факторы роста и лекарства. Растворители, концентрации фибронектина, время инкубирования и температура могут быть такими, как описано выше для покрытия из несшитого фибронектина. Фибронектин и, возможно, другие ECM, факторы роста или лекарства взаимодействуют со сшивающим агентом с образованием сшитого покрытия, связанного с поверхностью протезирующего устройства.
В другом варианте композицию, содержащую фибронектин, сшивающий агент и, возможно, другие ингредиенты, такие как ECM или факторы роста либо лекарства, сначала формуют в сшитый гель. Это можно проводить растворением ингредиентов в подходящей среде, например в фосфатном солевом буфере, отливанием смеси в виде тонкой пленки и проведением сшивки фибронектина с образованием геля в форме тонкой пленки. Затем пленку режут на куски нужной для нанесения формы. При получении пленки отношение фибронектина к сшивающему агенту может варьироваться в широком интервале и не является критическим фактором. Например, гели можно получать при весовых отношениях фибронектина к сшивающему агенту приблизительно от 5:1 до 1:4. Однако при отношениях больше 1: 1 гель может стать несколько более жестким, чем это нужно. И в этом случае, если протез изготовлен из синтетического материала, исходно не связывающего фибронектин, то поверхность протеза следует предобработать для придания ей способности связывать фибронектин.
Предпочтительный вариант по данному изобретению, в котором производится имплантация на постоянный срок мягкой контактной линзы в роговицу, можно понять из фиг. 1, 2 и 3.
На фиг. 1 показан поперечный разрез части интактной человеческой роговицы. Роговица 10 состоит из нескольких слоев. Внешний слой, известный как эпителий 12, служит для поддержания целостности роговицы. Эпителиальные клетки богаты гликогеном, ферментами и ацетилхолином, и их активность регулирует роговичные корпускулы и контролирует транспорт воды и электролитов через строму 16. Под эпителием 12 располагается мембрана Боумена 14, отделяющая эпителий 12 от стромы 16, которая составляет толстую часть роговицы. Мембрана Десцемета 18 отделяет строму 16 от эндотелия 20, который является монослоем клеток и образует внутреннюю поверхность роговицы 10.
На фиг. 2 представлено поперечное сечение человеческой роговицы, подготовленной для имплантации мягкой контактной линзы в соответствии со способом по данному изобретению. Для подготовки роговицы к имплантации круглую часть эпителия 12 сначала удаляют из центра роговицы. Кроме того, весь эпителий или его часть можно удалить интектным и вернуть на место после имплантации (Martel Y. R. , Aguayo-Martel Y., Ophthalmology Fimes, August 1, 1987). Подходящий метод удаления эпителиальной ткани состоит в нанесении стерильного раствора кокаина на обрабатываемый участок. Обработка кокаином разрушает эпителиальную ткань, но не повреждает мембрану Боумена 14. На фиг. 2 показано поперечное сечение роговицы 10 с удаленной частью эпителия 12, где окружающий эпителий оставлен интактным. После удаления разрушенной эпителиальной ткани губкой делается разрез трефайном, показанный прерывистой линией 22. Разрез делается через мембрану Боумена 14, приблизительно на 0,1 мм в стромальную ткань 16. Кольцевой периферийный разрез делается вокруг зоны, в которую предполагается вставлять контактную линзу. С использованием раздвигателя тканей хирург формирует затем непрерывный карман, показанный прерывистой линией 24, отходящий радиально в стромальную ткань 16, для образования навеса ткани по периферии места имплантации.
На фиг. 3 показано поперечное сечение человеческой роговицы, содержащей имплантированную контактную линзу 26. Линза 26 - это мягкая контактная линза, обработанная снаружи и внутри предобработкой поли(L-лизином) с последующим нанесением покрытия 30, содержащего фибронектин, сшитый диметилпимелимидатдигидрохлоридом с использованием описанной выше методики нанесения. Внешняя поверхность контактной линзы 26 имеет нужную форму и получена известным способом, для рефрактивной коррекции зрения пациента. Внутренняя поверхность контактной линзы 26 имеет форму, соответствующую поверхности роговицы 10 пациента.
Покрытую линзу 26 вставляют в роговицу 10 введением кромки линзы 26 в карман под периферийным навесом, образованным разрезами 22 и 24, причем убеждаются, что внутренняя поверхность линзы 26 плотно прилегает к мембране Боумена 14. Полезно сначала нанести раствор тканевого адгезива или сшивающего агента между стромой 16 и внутренней поверхностью линзы 26 для фиксации на месте.
После введения линзы 26 хирург поднимает кромку навеса и вводит небольшое количество водной смеси фибронектина и тканевого адгезива или сшивающего агента в карман между кромкой линзы 26 и навесом. Фибронектин затем сшивается и связывает стромальную ткань с кромкой линзы 26, формируя уплотнение.
Фибронектинсодержащее покрытие 30 на внутренней поверхности линзы 26 связывает поверхность мембраны Боумена 14 с поверхностью линзы, фиксируя положение контактной линзы 26 на роговице 10. Основное преимущество способа по данному изобретению при имплантации контактных линз заключается в том, что не требуется пришивка линзы или использование других методов механической фиксации. Покрытие 30 промотирует заживление раны и закрепляет линзу на поверхности роговицы. Ключевой функцией фибронектинсодержащего покрытия 30 на внешней поверхности имплантированной контактной линзы 26 это промотирование миграции эпителиальных клеток с окружающего эпителия 12 по поверхности линзы 26 с образованием новой эпителиальной поверхности, указанной прерывистой линией 28, на поверхности линзы. При исследовании мы установили, что новый образовавшийся эпителий 28 полностью покрывает имплантированную линзу 26 за несколько дней после ее введения. Новый образовавшийся эпителий 28 регулирует транспорт жидкостей и газов внутрь и изнутри имплантированной линзы 26.
В некоторых случаях из-за повреждения или болезни необходимо удалять не только часть эпителия 12, но и часть мембраны Боумена и часть стромы 16 перед имплантацией офтальмологических протезов. При такой "глубокой стромальной" имплантации существует опасность реэпителизации роговицы под имплантированным протезом, что неприемлемо. В этих случаях можно подготовить раневое ложе получением тонкого листка сшитого фибронектина и тканевого адгезива или сшивающего агента и вставкой соответствующим образом вырезанного листка из сшитого материала в раневое ложе перед имплантацией протеза. Листок с фибронектином не только приближает протез к поверхности роговицы и обеспечивает адгезию протеза к строме, но и промотирует регенерацию стромальной ткани под протезом и ингибирует эпителизацию под протезом.
Пример. Гидрофильную линзу, полученную из сополимера, содержащего N-винилпирролидон, вымачивают ночь при комнатной температуре в 1,5 мл водного раствора, содержащего 2 мг/мл поли(N-лизина). Затем линзы промывают в воде и вымачивают 30 мин при 4oC в 0,9 N солевом растворе, содержащем 10 мг/мл дигидрохлорида диметилпимелимидата. Линзы затем промывают водой и вымачивают 2 ч при комнатной температуре в водном растворе, содержащем около 50 мг/мл фибронектина. После этого линзы промывают в воде и вымачивают в 0,9%-ном солевом растворе, содержащем 10 мг/мл дигидрохлорида диметилпимелимидата при комнатной температуре 1 ч. Линзы затем промывают водой и имплантируют по стандартной хирургической методике, описанной выше для эпикератофакии, где в отличие от стандартной методики линзы приклеивают на место с помощью фибронектина и дигидрохлорида диметилпимелимидата. Реэпителизация обычно протекает в течение недели.
Реферат
Изобретение относится к медицине и касается имплантации протезирующих устройств. Цель - введение протеза под эпителиальную ткань. Протез для субэпителиальной имплантации содержит покрытие из сшитого или несшитого фибронектина его биологически активного компонента или аналога, при этом поверхность протеза состоит из коллагена или сополимера коллагена, способных связывать фибронектин, или из синтетического полимерного материала, обработанного поли-L-лизином и сшивающим агентом. 3 ил.

Формула
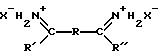
где R - (CH2)n-, -S-S-,
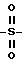
или (CH2)n -S-S-(CH2 )n-;
R' и R'' - алкоксигруппы с 1 - 20 атомами углерода;
X - Cl или B-,
в частности дигидрохлориддиметилпимемемидат, в частности дигидрохлориддиметиладипимидат или дигидрохлориддиметил-3,3-дитиобиспропионимидат, а покрытие на поверхность протеза наносят раствором, содержащим 0,1 - 1000 мг/мл фибронектина, его биологически активного фрагмента или аналога раствора 1 - 20 мг/мл экстрацеллюлярного матричного соединения, отличающегося от фибронектина.

Комментарии