Способ модификации (со) полимеров пероксидами циклических кетонов - RU2142473C1
Код документа: RU2142473C1
Чертежи




Описание
Область изобретения
Настоящее изобретение относится к способу модификации (со)полимеров, в котором применяют
пероксиды циклических кетонов, и к применению таких пероксидов циклических кетонов для модификации (со)полимеров.
Предшествующий уровень техники
Из предшествующего уровня
техники в данной области известно несколько способов модификации (со)полимеров пероксидами. Во многих из этих способов используют ненасыщенные пероксиды. Некоторые примеры таких способов можно найти в
EP-A-0322945 и WO 94/05707.
Кроме того, в патенте Канады 999698 указывается, что пероксиды метилэтилкетона могут быть использованы для уменьшения вязкости α-олефиновых полимеров. Далее, EP-A-0497590 и EP-A-0264156 являются примерами патентов, в которых для увеличения показателя текучести расплава полипропилена предлагается применение пероксида метилэтилкетона.
Известно, что пероксид метилэтилкетона и пероксид метилизобутилкетона представляют смеси нескольких различных пероксидных соединений кетона, среди которых преобладают пероксиды нециклического кетона. Однако такие пероксиды кетона содержат небольшие количества пероксидов циклического кетона, которые получаются в результате побочных реакций, происходящих во время получения пероксидов метилэтилкетона и метилизобутилкетона. Например, в коммерчески пригодных пероксидах метилэтилкетона около 1-4% от общего содержания активного кислорода свойственно пероксидам циклического кетона.
Хотя известно, что эти пероксиды применяют при модификации полимеров, однако их способность к деструкции полипропилена является неудовлетворительной, и, кроме того, они вызывают пожелтение полимера. Таким образом, хотя эти пероксиды увеличивают показатель текучести расплава полипропилена, они не являются даже приблизительно такими же эффективными, как коммерческие продукты, например 2, 5-бис(трет-арилбутилперокси)-2,5-диметилгексан, применяемый для вышеуказанной цели. Пероксиды настоящего изобретения обладают свойствами, которые сравнимы со свойствами коммерчески пригодных пероксидов, и, кроме того, они имеют дополнительное преимущество, состоящее в том, что нежелательные побочные продукты получаются за счет побочных реакций пероксидов во время их разложения.
Поэтому в данной области остается необходимость в пероксидах, которые обеспечивают при модификации полимера приемлемое соотношение между ценой и свойствами. Эти и другие цели настоящего изобретения станут очевидными из последующих сущности и подробного описания изобретения.
Сущность изобретения.
По первому аспекту настоящее изобретение относится к
способу модификации (со)полимеров, в котором применяют органический пероксид. Способ включает стадию контактирования (со)полимера с органическим пероксидом при условиях, посредством которых, по
крайней мере, какой-нибудь из органических пероксидов разлагается. Способ, кроме того, отличается тем, что, по крайней мере, 20% от общего содержания кислорода органического пероксида свойственно, по
крайней мере, одному пероксиду циклического кетона, выбранному из пероксидов, представленных формулами I-III:

где R1-R10 независимо выбирают из группы, состоящей из водорода, C1-C20-алкила, C3-C20-циклоалкила, C6 -C20-арила, C7-C20-аралкила и C7-C20-алкарила, эти группы могут включать линейные или разветвленные алкильные составляющие; и каждый из R1-R10 может быть необязательно замещен одной или несколькими группами, выбранными из гидрокси, C1-C20-алкокси, линейного или разветвленного C1-C20-алкила, C6-C20-арилокси, галогена, сложного эфира, карбокси, нитрила и амидо.
По второму аспекту настоящее изобретение также относится к композиции органического пероксида для модификации (со)полимеров, в котором, по крайней мере, 20% от общего содержания активного кислорода свойственно, по крайней мере, одному пероксиду циклического кетона, выбранному из пероксидов, представленных формулами I-III.
В Международной заявке на патент WO 87/06944 для модификации полипропилена и увеличения показателя текучести его расплава раскрыто применение 3,6,6,9,9-пентаметил-3н-пропил-1,2,4,5-тетраоксициклононана. Аналогичное раскрытие представлено также в патенте США 4451589. Однако в этих публикациях не описано и не предлагается применение настоящих органических пероксидов формул I-III для модификации (со)полимеров.
Было неожиданно обнаружено, что пероксиды формул I-III обеспечивают свойства в процессах модификации полимера, которые сравнимы со свойствами коммерчески пригодных пероксидов для такого применения, и что они также обеспечивают свойства, которые являются превосходными по сравнению с пероксидами нециклического диалкилкетона.
Подробное описание изобретения.
Пероксиды формул I-III могут быть получены путем взаимодействия кетона с пероксидом водорода, как описано в патенте США 3003000; Uhlmann, 3-rd Edition, vol. 13, p.p. 256-57 (1962); статье "Studies in Organic Peroxides. XXV. Preparation, Separation and Idenification of Peroxides Derived from Metyl Etyl Ketone and Hydrogen Peroxide", Milas N.A. и Golubovic A., J. Am. Chem. Soc. , vol. 81. p.p. 5824-26 (1959), Organic Peroxides, Swern, D. editor, Wiley-Interscience, New York (1970) и Houben Weyl Methoden der Organische Chemie, E13, Volume 1, page 736, на раскрытие которых здесь приводится ссылка.
Кетоны, подходящие для применения в синтезе настоящих пероксидов, включают, например, ацетон, ацетофенон, метил-н-амилкетон, этилбутилкетон, этилпропилкетон, метилизоамилкетон, метилгептилкетон, метилгексилкетон, этиламилкетон, диэтилкетон, дипропилкетон, метилэтилкетон, метилизобутилкетон, метилизопропилкетон, метилпропилкетон, метил-н-бутилкетон, метил-трет-бутилкетон, изобутилгептилкетон, диизобутилкетон, 2,4-пентандион, 2,4-гександион, 2,4-гептандион, 3, 5-гептандион, 3,5-октандион, 5-метило-2,4-гександион, 2,6-диметил-3,5-гептандион, 2,4-октандион, 5,5-диметил-2,4-гександион, 6-метил-2,4-гептандион, 1-фенил-1,3-бутандион, 1-фенил-1,3-пентандион, 1, 3-дифенил-1,3-пропандион, 1-фенил-2,4-пентандион, метилбензилкетон, фенилметилкетон, фенилэтилкетон, метилхлорметилкетон, метилбромметилкетон и продукты их взаимодействия. Предпочтительными пероксидами формул I-III являются такие, в которых R1-R10 независимо выбирают из C1-C12-алкильных групп. Конечно, могут быть использованы другие кетоны, имеющие подходящие R группы, а также смеси двух или нескольких различных кетонов.
Примерами предпочтительных пероксидов формул I-III, используемых в соответствии с настоящим изобретением, являются пероксиды циклических кетонов, полученные из ацетона, метиламилкетона, метилгептилкетона, метилгексилкетона, метилпропилкетона, метилбутилкетона, диэтилкетона, метилэтилкетона, метилоктилкетона, метилнонилкетона, метилдециклокетона, метилундецилкетона, и их смеси.
Пероксиды циклического кетона состоят из, по крайней мере, двух структурных единиц кетона, которые могут быть одинаковыми или разными. Таким образом, пероксиды циклического кетона могут существовать в форме димеров, тримеров и т.д. Когда получают пероксид циклического кетона, обычно образуется смесь, которая преимущественно состоит из димерных и тримерных форм. Соотношение между различными формами зависит, главным образом, от реакционных условий во время получения. По желанию смесь можно разделить на отдельные пероксиды соединения циклического кетона. Обычно тримеры пероксида циклического кетона являются менее летучими и более реакционноспособными, чем соответствующие димеры. Предпочтение определенным композициям или отдельным соединениям может зависеть от разницы в физических свойствах или от требований, предъявляемых при применении пероксидов, например от устойчивости при хранении, зависимости периода полупревращения от температуры, летучести, температуры кипения, растворимости и т.д. Следует понимать, что в настоящее изобретение включена любая форма пероксидов циклического кетона, например олигомерные соединения или смеси.
Пероксиды можно получать, транспортировать, хранить и применять как таковые или в форме порошков, гранул, таблеток, лепешек, хлопьев, пластин, паст и растворов. Такие составы, когда необходимо, можно необязательно, в зависимости от конкретного пероксида и его концентрации в составе, флегматизировать. Предпочтительность той или иной формы отчасти зависит от легкости подачи пероксида в замкнутую систему. Принимая во внимание соображения безопасности, в определенные композиции до некоторой степени могут быть включены флегматизаторы. В качестве примеров подходящих флегматизаторов могут быть упомянуты материалы твердых носителей, такие как полимеры, диоксид кремния, мел, глина, инертные пластификаторы, растворители и инертные разбавители, такие как силиконовые масла, белые масла и вода.
Пероксиды циклического кетона настоящего изобретения исключительно хорошо подходят для применения при модификации полимеров. Более конкретно, эти пероксиды можно использовать в таких процессах, как деструкция полиолефинов, например полипропилена и его сополимеров, сшивание полиолефинов, например этилена/пропилена/полидиенов, полиэтилена и его сополимеров, динамическое сшивание смесей эластомеров и термопластичных полимеров, прививка мономеров на полимеры, например полиэфиры, полиолефины и эластомеры, и функционализация полиолефинов в случае функциональной группы, содержащей пероксиды циклического кетона.
В общем пероксид циклического кетона можно привести в контакт с (со)полимером различными способами в зависимости от конкретной цели процесса модификации. Например, если является желательной модификация поверхности трехмерного полимерного объекта, пероксид циклического кетона можно нанести на поверхность модифицируемого материала. Альтернативно, если является желательным однородно модифицировать (со)полимер по всей (со)полимерной матрице, тогда пероксид можно смешать с модифицируемым материалом, который может быть в расплавленном состоянии, в форме раствора или, в случае эластомера, пластичном состоянии. Можно также смешать (со)полимер в форме порошка с пероксидом циклического кетона.
Для завершения гомогенного смешивания немодифицированного (со)полимера с пероксидом может быть использовано большинство из общепринятых смесителей. Типичные смесители включают месильные машины, закрытые смесители и смесительное оборудование, применяемое при экструдировании. Смешивание будет представлять проблему для конкретного материала из-за его высокой температуры плавления, например, пока (со)полимер находится в твердом состоянии, его можно сначала модифицировать на поверхности и затем расплавить и смешать. Альтернативно, (со)полимер можно сначала растворить в растворителе и затем осуществить реакцию с пероксидом циклического кетона в растворе.
Важным практическим аспектом настоящего изобретения является то, что момент, когда пероксид циклического кетона и (со)полимер приводят в контакт друг с другом, а также момент, когда пероксид циклического кетона начнет взаимодействовать с (со)полимером, можно выбрать независимо от других обычных стадий обработки полимера, включающих введение добавок, формование и т.д. Модификацию можно осуществить до введения в полимер других добавок или после их введения. Является более важным то, что модификацию полимера в соответствии с настоящим изобретением можно завершить во время стадии формования полимера, например экструзии, прямого прессования, дутьевого формования или литьевого формования. Настоящий способ модификации полимера наиболее предпочтительно осуществляют в оборудовании для экструзии.
Слово (со)полимер, которое использовано в этой заявке, следует интерпретировать как означающее "полимеры и сополимеры". Термин "пероксид кетона", который использован в этой заявке, следует интерпретировать как включающий пероксиды, полученные как из кетона, так и из альдегидов.
В общем посредством настоящего способа может быть модифицирован любой (со)полимер, включающий удаленные атомы водорода. Материал (со)полимера, обработанный способом настоящего изобретения, может быть в любой физической форме, включая тонкоизмельченные частицы (хлопья), таблетки, пленку, лист, в расплаве, в растворе и т.п. В предпочтительных вариантах настоящего изобретения (со)полимерный материал находится в тонкоизмельченной форме, подходящей для модификации порошка в атмосфере, по существу не содержащей кислорода, в форме расплава, подходящей для модификации в атмосфере, содержащей воздух, или атмосфере азота, или в растворе в подходящем растворителе.
Количество пероксида, используемого в способе модификации настоящего изобретения, будет представлять количество, эффективное для достижения значительной модификации (со)полимера при его обработке. Более конкретно, следует применять 0,001-0,15 вес.% пероксида относительно веса (со)полимера. Более предпочтительно применяют 0,005-10 вес.%. Наиболее предпочтительно применяют 0,01-0,5 вес.%.
Для того, чтобы ясно отличить настоящие пероксиды циклического кетона от пероксида кетона предшествующего уровня техники в данной области, которые содержат пероксиды циклического кетона в качестве примеси, необходимо, чтобы, по крайней мере, 20% от общего содержания активного кислорода в пероксиде(ах), применяемом(ых) в способе модификации настоящего изобретения, было свойственно одному или нескольким пероксиду(ам) циклического кетона. Более предпочтительно, пероксиды циклического кетона обеспечивают, по крайней мере, 50% от общего содержания активного кислорода относительно кислорода композиции, которую применяют в способе модификации, и наиболее предпочтительно пероксиду(ам) циклического кетона свойственно, по крайней мере, 70% от общего содержания активного кислорода пероксидной композиции, используемой в способе модификации. Сравнительные примеры, включенные здесь, иллюстрируют преимущества этих пероксидов циклических кетонов над пероксидами нециклических кетонов.
Во время модификации (со)полимер может также содержать обычные полимерные добавки. В качестве примеров таких добавок могут быть названы: стабилизаторы, например ингибиторы окислительной, термической или ультрафиолетовой деструкции, смазки, масла для наполнения, регуляторы pH, такие как карбонат кальция, смазки для форм, красители, упрочняющие или неупрочняющие наполнители, например диоксид кремния, глина, мел, углеродная сажа и волокнистые материалы, например стекловолокна, зародышеобразователи, пластификаторы, катализаторы и сшивающие агенты, например другие типы пероксидов, и сера. Эти добавки можно использовать в обычных количествах.
Было найдено, что, когда определенные (со)полимеры контактируют с настоящими пероксидами циклического кетона, происходит деструкция полимерных цепей. Например, полимеры, которые обладают склонностью к деструкции, включают изотактический полипропилен, атактический полипропилен, синдиотактический полипропилен, сополимеры алкилена и пропилена, например статистические и блок-сополимеры этилена и пропилена, и терполимеры, такие как тройные сополимеры алкилена-пропилена-бутена, например тройные сополимеры этилена-пропилена-бутилена; сополимеры пропилена и диенового мономера, сополимеры пропилена и стирола, поли(бутен-1), поли(бутен-2), полиизобутен, сополимеры изопрена и изобутилена, сополимеры хлорированного изопрена и изобутилена, поли(метилпентен), поливиниловый спирт, полистирол, поли(α-метил)стирол, 2,6-диметилполифениленоксид и смеси или комбинации таких полимеров с одним, другим и/или с другими, не способными к деструкции полимерами.
Обработка (со)полимеров, склонных к деструкции, посредством способа настоящего изобретения обычно приводит к получению полимерного материала, имеющего чистое увеличение показателя текучести расплава и уменьшение средней молекулярной массы, а также более узкое молекулярно-массовое распределение (дисперсность) по сравнению с исходным немодифицированным полимером. В случае полипропилена и его сополимеров большая часть механических свойств модифицированных (со)полимеров остается неизменной. Кроме того, улучшаются некоторые свойства конкретных (со)полимерных продуктов, такие как прочность волокон, уменьшается деформация изделий, полученных литьевым формованием, и увеличивается прозрачность полимерных пленок. Способ модификации настоящего изобретения является в особенности выгодным для различных процессов, связанных с полипропиленом, таких как формование волокон, высокоскоростное литьевое формование и раздувание нетканых волокон из расплава.
Деструкцию можно осуществлять обычным способом. В присутствии одного или нескольких пероксидов формул I-III (со)полимер нагревают до температуры плавления (со)полимера и выше температуры разложения пероксида. Обычно используют температуру 50-350oC, более предпочтительно 100-300oC. Время нагревания составляет обычно между 0,1 и 30 минутами и более, предпочтительно 0,5-5 минут. Деструкцию наиболее предпочтительно осуществляют в оборудовании для экструзии.
Пероксиды, содержащие трет-бутилпероксидные группы, обычно используемые при деструкции полиолефинов, выделяют при реакции в качестве основных продуктов разложения трет-бутанол и ацетон. Преимущество пероксидов циклического кетона, например таких, которые получают из метилэтилкетона, метилпропилкетона, бутилметилкетона и диэтилкетона, состоит в том, что они в качестве продуктов разложения не дают ацетон или трет-бутанол.
Настоящие пероксиды циклического кетона могут быть также использованы при сшивании полимеров, таких как полиэтилен пониженной плотности, линейный полиэтилен пониженной плотности, полиэтилен средней плотности и полиэтилен повышенной плотности, сополимеры этилена и алкена, тройные сополимеры этилена-пропилена-диенового мономера, хлорсульфированный полиэтилен, хлорированный полиэтилен, сополимеры этилена и винилацетата, сополимеры этилена и пропилена, сополимеры пропилена и диенового мономера, сополимеры бромированного изопрена и изобутилена, сополимеры частично гидрированного бутадиена и акрилонитрила, полиизопрен, полихлоропрен, поли(циклопентадиен), поли(метилциклопентадиен), полинорборнен, сополимеры изопрена и стирола, сополимеры бутадиена и стирола, сополимеры бутадиена и акрилонитрила, тройные сополимеры акрилонитрила-бутадиена-стирола, полиакриламиды, полиметакриламиды, полиуретаны, полисульфиды, полиэтилентерефталат, полибутилентерефталат, сложные эфиры сополимера простого эфира, полиамиды, силоксановые каучуки, фторкаучуки, такие как полифторалкоксифосфазены; сополимеры аллилглицидилового эфира и эпихлоргидрина и их смеси или комбинации.
Для осуществления способа сшивания настоящего изобретения могут быть использованы общепринятые методики сшивания и общепринятое оборудование. Способ настоящего изобретения является, в частности, подходящим для сшивания полиэтилена повышенной плотности в процессах центробежного формования, которые обычно осуществляют при высоких температурах.
Настоящее изобретение является также подходящим для динамического сшивания комбинации из эластомера и термопластичного (со)полимера. Подходящие эластомеры, предназначенные для применения в комбинациях, используемых для динамического сшивания посредством способа настоящего изобретения, включают сополимеры этилена и винилацетата, хлорированные полиэтилены, хлорсульфированные полиэтилены, сополимеры этилена и пропилена, тройные сополимеры этилена-пропилена-диенового мономера, сополимеры бутадиена и акрилонитрила, сополимеры гидрированного бутадиена и акрилонитрила, натуральный каучук, полихлоропрен, силоксановые каучуки, фторкаучуки и их смеси или комбинации.
Подходящие термопластичные (со)полимеры, предназначенные для применения в комбинациях, используемых для сшивания посредством способа настоящего изобретения, включают термопластичные, кристаллические или аморфные (со)полимеры. Более конкретно, упомянутый (со)полимер выбирают из полиэтилена пониженной плотности, полиэтилена средней плотности и полиэтилена повышенной плотности, изотактического полипропилена, атактического полипропилена, синдиотактического полипропилена, полиэтилентерефталата, полибутилентерефталата, полиамидов, полифениленоксидов, смесей полифениленоксидов с полистиролом и их смесей.
Способ модификации (со)полимера настоящего изобретения является также пригодным для прививки мономеров на полимеры или для получения графт-сополимеров. Примерами подходящих (со)полимеров, которые в соответствии с настоящим изобретением могут быть привиты посредством пероксидов циклического кетона, являются сополимеры и блок-сополимеры сопряженных 1,3-диенов и один или несколько сополимеризуемых моноэтиленоненасыщенных мономеров, таких как ароматические моновинилиденовые углеводороды, галогенированные ароматические моновинилиденовые углеводороды, (мет)акрилонитрил, алкил(мет)акрилаты, акриламиды, ненасыщенные кетоны, сложные виниловые эфиры, винилидены и винилгалогениды; сополимеры этилена и пропилена и сополимеры этилена и пропилена с другими (поли)ненасыщенными соединениями, такими как гексадиен-1,4, дициклопентадиен и 5-этилиденнорборнен; полиолефины, например полиэтилен, полипропилен и их сополимеры; и полиолы, включая полиолы, которые по существу не имеют этиленового ненасыщения. Такие полиолы включают полиалкиленовые простые полиэфиры с концевыми гидроксильными группами, имеющие 2-6 углеродных атомов на мономерное звено и Mn 400-2000, содержащие полигидроксильные сложные полиэфиры, сложные полиэфиры с концевыми гидроксильными группами и алифатические полиолы.
Мономерами, подходящими для прививки на вышеупомянутые полимеры с использованием пероксидов циклических кетонов настоящего изобретения, являются олефиновые или этиленоненасыщенные мономеры, например замещенные или незамещенные виниловые ароматические мономеры, включая стирол и α-метилстирол; этиленоненасыщенные карбоновые кислоты и их производные, такие как (мет)акриловые кислоты, (мет)акриловые сложные эфиры и глицидилметакрилат; этиленоненасыщенные нитрилы и амиды, например акрилонитрил, метакрилонитрил и акриламид; замещенные или незамещенные этиленоненасыщенные мономеры, например бутадиен; виниловые сложные эфиры, например винилацетат и винилпропионат; этиленоненасыщенные дикарбоновые кислоты и их производные; включая моно- и сложные диэфиры, ангидриды и имиды, например малеиновый ангидрид, цитраконовый ангидрид, цитраконовую кислоту, итаконовую кислоту, надиковый ангидрид, малеиновую кислоту, арил-, алкил- и аралкилцитраконимиды и малеимиды; винилгалогениды, например винилхлорид и винилденхлорид; олефины, например изобутен и 4-метилпентен; и эпоксиды.
В процессе прививки соотношение полимера к прививаемому мономеру составляет от 99:1 до 1:50. Для обеспечения прививки пероксидами формул I-III настоящего изобретения могут быть использованы общепринятые способы прививки, условия и оборудование.
В конечном счете способ модификации настоящего изобретения можно использовать для введения в (со)полимеры функциональных групп. Это можно выполнить путем использования пероксида формул I-III, который содержит одну или несколько присоединенных к нему функциональных групп "R". Эти функциональные группы останутся нетронутыми в свободных радикалах, образованных пероксидами циклических кетонов, и таким образом вводятся в модифицированный (со)полимер. Для достижения этой цели настоящего изобретения могут быть использованы общепринятые условия модификации полимера и оборудования.
В соответствии с предпочтительным вариантом настоящего изобретения способ модификации осуществляют в присутствии соагента для того, чтобы регулировать степень полимерной деструкции, или для усиления степени модификации (т. е. сшивания или введения функциональной группы) в (со)полимере.
Под "соагентом" обычно понимают полифункциональную реакционноспособную добавку, такую как полиненасыщенное соединение, которое будет быстро взаимодействовать с полимерными радикалами, будет преодолевать эффекты пространственного затруднения и будет сводить к минимуму нежелательные реакции. Дополнительная информация о соагентах (которые иногда называют соактиваторы) представлена в источниках "Rubber Chemistry and Technology, vol. 61. p.p. 238-354 и W.Hofmann, Progress in Rubber and Plastics Tehnology, vol. 1. N 2, March 1985, pp. 18-50, на описания которых здесь приводится ссылка. В отношении настоящего изобретения термин "соагент" имеет то же самое значение, которое дано в этих публикациях.
Коммерчески пригодным является широкое множество пригодных соагентов, включающее ди- и триаллильные соединения, ди- и три(мет)акрилатные соединения, бисмалеимидные соединения, дивинильные соединения, например дивинилбензол, винилтолуол, винилпиридин, полиалкенилбензолы и их полимеры, полибутадиен, парахинондиоксим, 1,2-цис-полибутадиен и производные этих соединений. Кроме того, другие пригодные соагенты включают олигомеры 1,3-диизопропенилбензола, 1,4-диизопропенилбензола и 1,3,5-триизопропенилбензола.
Включение в (со)полимер эффективного количества одного или нескольких из этих соагентов перед или во время реакции с настоящими пероксидами циклического кетона будет приводить к уменьшению степени деструкции модифицируемых материалов. По желанию степень деструкции может быть отрегулирована таким способом. К удивлению, в некоторых случаях соагент может обеспечить усовершенствованные механические свойства, например повышенную прочность связи у модифицированных (со)полимеров полярного типа. Такое повышение может быть отнесено за счет большей степени введения в (со)полимер функциональной группы в результате присутствия соагента.
В конечном счете настоящее изобретение относится к применению органического пероксида, в котором 20% от общего содержания активного кислорода свойственно, по крайней мере, одному пероксиду циклического кетона, выбранного из пероксида, представленных формулами I-III, для модификации (со)полимеров.
Условия модификации и оборудование являются такими же, как те, которые представлены выше в отношении способов модификации (со)полимера.
Изобретение будет проиллюстрировано последующими примерами.
Примеры.
Используемые материалы
Полимеры:
Тройной сополимер этилена-пропилена-диенового мономера ( Keltan® 520, например от DSM)
- Гомополимер
полипропилена ( Moplen® FLS 20, например от Химонт)
- Гомополимер полипропилена ( Hostalen® PPH1050, например от Хоуст)
- Гомополимер
полипропилена ( Hostalen® PPR1060P, например от Хоуст)
- Сополимер полипропилена ( Stamylan® , 56 MN10, например от DSM)
- Смесь полипропиленового
эластомера ( Hostalen® PPN8009, например от Хоуст)
- Линейный полиэтилен низкой плотности (LLDPE) (Escorene LL 1001 XV, например от Эксон)
- Полибутадиеновый каучук
(Cariflex BR12028, например от Шелл)
Углеродная сажа: Углеродная сажа N-772
Масла для наполнения: Парафиновое масло Sunpar® 150 (например от Суноко)
Пероксиды -
- 2,5-бис(трет-бутилперокси)-2,5-диметилгексан (как показал анализ 95,35%) ( Trigonox® 101, например от Акзо Кэмикалз) [Теоретическое содержание активного
кислорода 11,0%]
- Пероксид метилэтилкетона ( Butanox® LPT, например от Акзо Кэмикалз) (Общее содержание активного кислорода 8,5%)
- Пероксид метилэтилкетона
(MEKP-T3)
- Пероксид циклического метилэтилкетона (MEKP-циклический) [Общее содержание активного кислорода 10,63%]
- Пероксид метилизопропилкетона (MIPKP-T3) [Общее содержание
активного кислорода 8,24%]
- Пероксид метилизобутилкетона Trigonox® 233, например от Акзо Кэмикалз) [Общее содержание активного кислорода 8,04%]
- Пероксид
циклического метилизобутилкетона (MIBKP-циклический) [Общее содержание активного кислорода 8,03%]
- Пероксид циклического метилизопропилкетона (MIBKP-циклический) [Общее содержание активного
кислорода 7,86%]
- Бис(Трет-бутилпероксиизопропил)бензол (Perkadox® 14-40MB-GR, например от Акзо Нобель Кэмикалз) [Теоретическое содержание активного кислорода 9,46%]
- 2,5-Бис(трет-бутилперокси)-2,5-диметил-3-гексин (Trigonox® 145-45B-PO, например от Акзо Кэмикалз) [Теоретическое содержание активного кислорода 11,17%]
- Пероксид
циклического метилэтилкетона (MEKP-циклический) [Общее содержание активного кислорода 10,6%]
- Пероксид циклического метилэтилкетона (MEKP-циклический) [Общее содержание активного кислорода *
6,7%]
- Димер пероксида циклического метилэтилкетона
(MEKP-циклический-D) [Общее содержание активного кислорода 6,58%]
- Тример пероксида циклического метилэтилкетона
(MEKP-циклический-T) [Общее содержание активного кислорода 2,0%]1
- Тример пероксида циклического метилэтилкетона (MEKP-циклический-I) [Общее содержание активного кислорода 7,
06%]2
- Пероксид циклического диэтилкетона (DEKP-циклический) [Общее содержание активного кислорода 2,09%]
- Пероксид диэтилкетона (DEKP-T3+T4) [Общее содержание активного
кислорода 9,0%]
- Пероксид диэтилкетона (DEKP-T3) [Общее содержание активного кислорода 9,0%]1
- Пероксид циклического метилпропилкетона (MPKP-циклический) [Общее
содержание активного кислорода 2,15%]1
- Димер пероксида циклического метилпропилкетона (MPKP-циклический-D) [Общее содержание активного кислорода 6,18%]1
- Тример пероксида циклического метилпропилкетона (MPKP-циклический-T) [Общее содержание активного кислорода 7,12%]1
- Пероксид метилпропилкетона (MPKP-T3+T4) [Общее содержание
активного кислорода 9%]1
- Пероксид метилпропилкетона (MPKP-T3) [Общее содержание активного кислорода 9,0%]1
- Пероксид циклического метилбутилкетона
(BMKP-циклический) [Общее содержание активного кислорода 2,4%]1
- Пероксид метилбутилкетона (MBKP-T3-T4) [Общее содержание активного кислорода 9,0%]1)
- Пероксид метилбутилкетона (MBKP-T3) [Общее содержание активного кислорода 9,0%]1
- Димер/тример пероксида циклического метилизопропилкетона (D/T MIPKP-циклического)
1 Изододекан
2Primol® 352
* при разбавлении
Смешанные:
Irganox® 1010 (пространственно затрудненный фенольный
антиоксидант - например от Циба-Гейджи)
Irganox® 8225 (Irganox® 1010/Irgafos® 168 1:1, например от Циба-Гейджи)
Tinuvin® 770 (Пространственно затрудненный аминовый светостабилизатор, например от Циба-Гейджи)
Растворитель изододекан
Растворитель пентадекан
Белое масло Primol® 352 (например от Эксон)
Solvesso® (например от Эксон)
Стеарат кальция
Мономер стирола (перегнанный)
Соагент: Триаллилцианурат
(Perkalink® 300, например от Акзо Нобель Кэмикалз).
Методы, используемые в примерах.
Реологические свойства резиновых смесей измерили на вибрационном реометре Монсанто MDR 100 E (движущаяся головка (20 мин), диапазон 20 N.m, дуга 0,5o) или с помощью эластографа Gottfert® . Реологические свойства дают показания продолжительности подвулканизации, времени вулканизации и густоты поперечных связей в каучуке (Международный стандарт ISO 6502).
Показатель текучести расплава (MFI) измерили с помощью прибора для определения индекса расплава Gottfert модели MP-D в соответствии с DIN 53735/ASTM 1238 (230oC, нагрузка 21,6 N (Ньютона).
Прочность расплава измерили с помощью Rheotens Gottfert®, присоединенного к капиллярному вискозиметру (180oC) Rheograph Gottfert® 2002.
Общее содержание активного кислорода измерили путем помещения 50 мл ледяной уксусной кислоты в 250 мл круглодонную колбу, снабженную притертым стеклянным соединением, впускной трубкой для газа азота, нагревательным кожухом и 70 см конденсатором с воздушным охлаждением. Над жидкостью при нагревании до тех пор, пока она закипела, затем пропустили газ азот. Через две минуты кипения добавили 5 мл 770 г/л раствора иодида калия и затем к реакционной смеси при перемешивании добавили пробу, содержащую приблизительно 2 миллиэквивалента активного кислорода. После этого присоединили конденсатор с воздушным охлаждением, и содержимое колбы быстро нагрели до кипения и поддерживали при умеренном кипении в течение 30 минут. Затем через конденсатор добавили 50 мл воды и конденсатор убрали из колбы. После этого реакционную смесь сразу же титровали 0,1 N раствора тиосульфата натрия до тех пор, пока исчез желтый цвет. Вместе с титрованием осуществляли движение заготовки.
Общее содержание активного кислорода можно было затем вычислить путем вычитания объема раствора тиосульфата натрия в заготовке от количества, используемого при титровании, умножения этой цифры на нормальность раствора тиосульфата натрия и затем на 800 и в конечном счете деления на массу пробы пероксида в миллиграммах.
Содержание активного кислорода у использованных нециклических пероксидов измерили путем помещения 20 мл ледяной уксусной кислоты в 200 мл круглодонную колбу, снабженную притертым стеклянным соединением и впускной трубкой для газа азота. Затем над поверхностью жидкости пропустили газ азота. Через две минуты добавили 4 мл 770 г/л раствора иодида калия и затем к реакционной смеси при перемешивании добавили пробу, содержащую приблизительно 1,5 миллиэквивалента активного кислорода. После этого реакционную смесь выдержали в течение, по крайней мере, 1 минуты при температуре 25oC ± 5oC. Затем реакционную смесь титровали 0,1 N раствором тиосульфата натрия до конечной точки исчезновения цвета и в конце титрования добавили 3 мл раствора крахмала с концентрацией 5 г/л. Вместе с титрованием осуществляли движение заготовки.
Показатель пожелтения (VI) определили на 0,1 мм прессованном листе, который изготовили с использованием пресса Fontijn® . Цвет определили по отношению к калиброванному фону (Dr. Lange®) (X = 79,6, Y = 84,1, Z = 90,7) с использованием колориметра LMC Dr. Lande® в соответствии с ASTM 1925.
Привитой полибутадиен:
Содержание свободного полибутадиена
определяли посредством турбидиметрического титрования. Приготовили три раствора высокоударопрочного полистирола (HIPS):
1) 60 мл приблизительно 0,1% HIPS в стабилизованном толуоле. Конечная
концентрация составила Cb 1 (% мас.)
2) 30 мл приблизительно 0,3% HIPS в стабилизованном толуоле. Конечная концентрация составила Cs (% мас.)
3) приблизительно к 30 мл раствора 1
добавили примерно 0,01% полибутадиена. Дополнительное количество полибутадиена составило Cpb (% мас.)
Перед анализом испытуемых растворов их осторожно встряхивали в течение, по крайней мере,
24-х часов для обеспечения полного растворения полимеров.
В термостатированном сосуде (25oC), снабженном магнитной мешалкой и колориметрическим индикатором (калиброванная волоконно-оптическая измерительная иммерсионная ячейка Бринкмана PC 600, 420 нм), титровали 20 мл испытуемого раствора смесью ацетона и метанола при их массовом соотношении 9:1. Во время титрования регистрировали изменение трансмиссии при 420 нм. Определили изменение трансмиссии в течение периода от начала добавления нерастворителя до момента, когда наблюдали устойчивое показание. Такое изменение трансмиссии, наблюдаемое для раствора 1, 2 и 3, обозначили соответственно Tb1, Ts и Tpb.
Содержание свободного полибутадиена (% мас.) вычислили затем следующим образом:
Cpb/(Cs - Cb1) • (Ts - Tb1)/(Tpb - Tb1) • 100
Привитой сополимер (% мас.) = 100 - свободный полибутадиен.
Превращение стирола:
Содержание
остаточного стирола определили посредством газовой хроматографии (GC) раствора полимера в дихлорметане с использованием в качестве внутреннего стандарта н-бутилбензола или трет-бутилбензола.
Определение отношения димера к тримеру (D/T) посредством анализа методом газовой хроматографии:
Оборудование: Hewlett Packard (Хьюлетт-Пакард) 5890
Колонка: CP Sil 19CB
Диаметр: 0,32 μм
Толщина: 0,20 μм
Длина: 25 м
Индикатор: FID
Температура инжекции: 100oC
Температура определения: 300oC, диапазон 4, разбавление 1
Температурная программа: 40oC (2 минуты), 8oC/мин до 280oC 10 мин.
Для 100% чистого пероксида количество активного кислорода определяют по формуле: (n • 16/М) • 100%, где n - число пероксидных связей в одной молекуле, M - молекулярный вес пероксидной молекулы.
В последующих примерах, если не указано иным образом, все количества приведены в частях на 100 относительно количества применяемого (со)полимера.
Примеры синтеза
Получение MEKP-T3 в
изододекане.
К перемешанной смеси, состоящей из 21,6 г метилэтилкетона, 22,5 г изододекана и 5,9 г 50% водного раствора серной кислоты, в течение 60 минут при 20oC добавили 23,3 г 70% водного раствора пероксида водорода. После протекания последующей реакции в течение 60 минут при 20oC отделили органический слой, нейтрализовали 3,0 г 6% водного раствора бикарбоната натрия, сушили 1,3 г дигидрата сульфата магния и фильтровали. Для обеспечения 55,2 г MEKP-T3 высушенный органический слой затем разбавили 7,2 г изододекана. MEKP-T3 имел общее содержание активного кислорода 11,49%, при этом 3,6% от общего содержания активного кислорода было свойственно пероксидам циклического кетона формул I-III.
Получение MEKP-цыиклического в изододекане.
К перемешанной смеси, состоящей из 28,8 г метилэтилкетона, 13,5 г изододекана и 14,0 г 70% водного раствора серной кислоты, при 40oC в течение 15 минут добавили 19,4 г 70% водного раствора пероксида водорода. После протекания последующей реакции в течение 270 минут при 40oC отделили органический слой, нейтрализовали 12,5 г 6% водного раствора бикарбоната натрия, сушили 1,0 г дигидрата сульфата магния и фильтровали. Высушенный органический слой представлял 42,1 MEKP-циклического, MEKP-циклический имел общее содержание активного кислорода 10, 63%, при этом 96,9% от общего содержания активного кислорода было свойственно пероксидам циклического кетона формул I-III.
Получение MIPKP-циклического в изододекане.
К перемешанной смеси, состоящей из 17,2 г метилизопропилкетона, 4,0 г изододекана и 19,6 г 50% водного раствора серной кислоты, при 40oC в течение 10 минут добавили 9,7 г 70% водного раствора пероксида водорода. После протекания последующей реакции в течение 355 минут при 40oC органический слой отделили и добавили 10,0 г воды. Затем эту смесь нейтрализовали 5,5 г водного раствора 4 N гидроксида натрия и нейтрализованный органический слой выпарили в вакууме при температуре 20oC и давлении 20 миллибар. Остаток высушили 0,5 г дигидрата сульфата магния и фильтровали. Высушенный органический слой представлял 12,0 г MIPKP-циклического. MIPKP-циклический имел общее содержание активного кислорода 7,86%, при этом 94,5% от общего содержания активного кислорода было свойственно пероксидам циклического кетона формул I-III.
Получение MIBKP-циклического в изододекане.
К перемешанной смеси, состоящей из 20,0 г метилизобутилкетона, 3,0 г изододекана и 19,6 г 50% водного раствора серной кислоты, при 20oC в течение 15 минут добавили 9,7 г 70% водного раствора пероксида водорода. После протекания последующей реакции в течение 300 минут при 20oC температуру увеличили до 25oC для дополнительного последующего протекания реакции в течение 1080 минут, после чего температуру подняли до 30oC для последующего протекания реакции в течение 120 минут и затем температуру повысили до 40oC для последующего протекания реакции в течение 240 минут.
После этого органический слой отделили, нейтрализовали 15,0 г водного раствора 4 N гидроксида натрия и перемешали в течение 120 минут при 40oC. Нейтрализованный органический слой отделили и дважды промыли водой. Смесь выпарили в вакууме при давлении 20 миллибар и температуре 20oC. Остаток все еще содержал два слоя. Прозрачный органический слой декантировали, сушили 0,3 г дигидрата сульфата магния и фильтровали. Высушенный органический слой представлял 11,6 г MIBKP-циклического. MIBKP-циклический имел общее содержание активного кислорода 8,03%, при этом 93,9% от общего содержания активного кислорода было свойственно пероксидам циклических кетонов формул I-III.
Анализировали Trigonox® 233 и обнаружили, что он содержит 8,04% от общего содержания активного кислорода, при этом 1,2% было свойственно пероксидам циклического кетона.
Получение MEKP-циклического в Primol® 352.
К перемешанной смеси, состоящей из 28,8 г метилэтилкетона, 13,5 г Primol 352 и 14,0 г серной кислоты (70%), в течение 20 минут при температуре 40oC добавили 19,4 г пероксида водорода (70%). После протекания последующей реакции в течение 120 минут при этой температуре отделили органический слой. Органический слой при перемешивании, температуре 20oC в течение 10 минут обработали 10,0 г раствора бикарбоната натрия (6%). Нейтрализованный органический слой сушили 1,0 г дигидрата сульфата магния и фильтровали. Высушенный органический слой разбавили 26,4 г Primol 352, что привело к получению композиции, имеющей вес 68,3 г.
Получение димера MEKP-циклического в Primol® 352.
К перемешанной смеси, состоящей из 720 г 99% уксусной кислоты, 97,1 г 70% H2O2, 35,2 г воды и 7,7 г 50% серной кислоты, при температуре 35 - 39oC в течение 25 минут добавили 144,2 г метилэтилкетона. После протекания последующей реакции в течение 23-х часов при 40oC реакционную смесь влили в перемешанную смесь, состоящую из 3 л воды и 40 г Primol 352. Через 12 часов органический слой отделили и 3 раза обработали 50 мл 4 N гидроксида натрия при температуре 30 - 40oC в течение 30 минут. Отделили органический слой и 2 раза промыли 50 мл насыщенного раствора хлорида натрия при температуре 20oC. Органический слой сушили дигидратом сульфата магния и фильтровали. Высушенный органический слой имел вес 70,0 г.
Получение тримера MEKP-циклического в Primol 352.
К перемешанной смеси, состоящей из 86,5 г метилэтилкетона и 66,6 г 36% соляной кислоты, при 0oC - 2oC в течение 20 минут добавили 72,6 г 30% пероксида водорода, после указанного добавления при этой температуре в течение 180 минут происходила последующая реакция. Затем добавили 200 мл воды и 60,0 г Primol 352. Органический слой отделили и три раза при температуре 30 - 40oC в течение 30 минут обработали 50 мл 4 N гидроксида натрия. Затем органический слой отделили и два раза промыли 50 мл насыщенного раствора хлорида натрия при температуре 20oC. Органический слой сушили дигидратом сульфата магния и фильтровали. Высушенный органический слой разбавили 21,9 г Primol 352 и выпарили при давлении 2 миллибара и температуре 40oC, вес составил 114,4 г.
Получение димера MEKP-циклического в пентадекане.
К перемешанной смеси, состоящей из 720 г 99% уксусной кислоты, 97,1 г 70% H2O2, 35,2 г воды и 7,7 г 50% серной кислоты, в течение 30 минут при температуре 25 - 37oC добавили 144,2 г метилэтилкетона. После протекания последующей реакции в течение 4 часов при 40oC, 12 часов при 20oC и 7 часов при 40oC реакционную смесь влили в перемешанную смесь, состоящую из 3 л воды и 40 г пентадекана. Органический слой отделили и два раза обработали в течение 30 минут при температуре 30oC 50 мл 4 N раствора гидроксида натрия. Органический слой отделили и два раза промыли 50 мл насыщенного раствора хлорида натрия при температуре 20oC. Органический слой сушили дигидратом сульфата магния и фильтровали. Высушенный органический слой имел вес 79,0 г.
Получение тримера MEKP-циклического в пентадекане.
К перемешанной смеси, состоящей из 144,2 г метилэтилкетона и 92,0 г 36% соляной кислоты, при температуре 0 - 2oC в течение 30 минут добавили 120,1 г 30% пероксида водорода, после чего при этой температуре в течение 180 минут происходила реакция. Затем добавили 200 мл воды и 80,0 г пентадекана. Органический слой отделили и три раза обрабатывали в течение 30 минут при температуре 30 - 40oC 50 мл 4 N гидроксида натрия. Органический слой отделили и два раза промыли 50 мл насыщенного раствора хлорида натрия при температуре 20oC. Органический слой сушили дигидратом сульфата магния и фильтровали. Высушенный органический слой имел вес 168,0 г.
Получение MPKP-циклического в изододекане.
К перемешанной смеси, состоящей из 44,4 г метилпропилкетона, 20,0 г изододекана и 24,5 г 50% серной кислоты, при температуре 40oC в течение 15 минут добавили 24, 3 г 70% пероксида водорода, после чего при этой температуре в течение 360 минут происходила реакция. Затем органический слой отделили и три раза обработали в течение 30 минут при температуре 40oC 50 мл 4 N гидроксида натрия. Органический слой отделили и два раза промыли 20 мл насыщенного раствора хлорида натрия при температуре 20oC. Органический слой сушили дигидратом сульфата магния, фильтровали и фильтр промыли 20,0 г изододекана и добавили к органическому слою. Высушенный органический слой разбавили 85,4 г изододекана, что привело к получению композиции, имеющей вес 132,7 г.
Получение тримера MPKP-циклического в Primol® 352.
К перемешанной смеси, состоящей из 106,5 г метилпропилкетона и 72,6 г 36% соляной кислоты, при температуре 0 - 2oC в течение 20 минут добавили 72,6 г 30% пероксида водорода, после чего при этой температуре в течение 180 минут произошла реакция. Затем добавили 200 мл воды и 50,0 г Primol 352. Органический слой отделили и три раза при температуре 30 - 40oC в течение 30 минут обработали 50 мл 4 N гидроксида натрия. Органический слой отделили и два раза промыли 50 мл насыщенного раствора хлорида натрия при температуре 20oC. Органический слой сушили дигидратом сульфата магния и фильтровали. Высушенный органический слой выпарили в вакууме при температуре 50oC и давлении 2 миллибара, при этом получили композицию, имеющую вес 85,7 г.
Получение димера MPKP-циклического в Primol® 352.
К перемешанной смеси, состоящей из 720 г 99% уксусной кислоты, 97,1 г 70% H2O2, 35,2 г воды и 7,7 г 50% серной кислоты, при температуре 35 - 39oC в течение 25 минут добавили 177,5 г метилпропилкетона. После протекания последующей реакции в течение 23 часов при 40oC реакционную смесь влили в перемешанную смесь, состоящую из 3 л воды и 30 г Primol® 352. Через 12 часов органический слой отделили и три раза при температуре 30 - 40oC в течение 30 минут обработали 50 мл 4 N гидроксида натрия. Органический слой отделили и два раза промыли 50 мл насыщенного раствора хлорида натрия при 20oC. Органический слой сушили дигидратом сульфата магния и фильтровали. Высушенный органический слой выпарили в вакууме при температуре 50oC и давлении 2 миллибара, при этом получили композицию, имеющую вес 130,0 г.
Получение MPKP-T4/T3 в изододекане.
К перемешанной смеси, состоящей из 105,0 г метилпропилкетона, 85 г изододекана и 24,0 г 50% серной кислоты, при температуре 20oC в течение 30 минут добавили 118,5 г 70% пероксида водорода. После протекания последующей реакции в течение 120 минут при этой температуре органический слой отделили. К органическому слою добавили 25,0 г 6% раствора бикарбоната натрия. Реакционную смесь перемешали при этой температуре в течение еще 15 минут. Полученный органический слой сушили 25 г дигидрата сульфата магния и фильтровали. Высушенный органический слой имел вес 199 г. К 112 г полученного раствора добавили 36,8 г изододекана, при этом получили композицию, имеющую вес 148,8 г.
Получение MPKP-T3 в изододекане.
К перемешанной смеси, состоящей из 105,0 г метилпропилкетона, 85 г изододекана и 24,0 г 50% серной кислоты, при 20oC в течение 30 минут добавили 118,5 г пероксида водорода. После протекания последующей реакции при этой температуре в течение 120 минут органический слой отделили. К органическому слою добавили 25,0 г 6% раствора бикарбоната натрия. Органический слой отделили. К 97,0 г органического слоя при 20oC в течение 30 минут добавили 100 г 20% раствора сульфата натрия. Реакционную смесь перемешали при этой температуре в течение еще 30 минут. Полученный органический слой промыли 100 мл воды, сушили 10 г дигидрата сульфата магния и фильтровали. К 75,0 г полученного раствора добавили 10,7 г изододекана, при этом получили композицию, имеющую вес 85,7 г.
Получение MIPKP-T3 в Solvesso 100.
К перемешанной смеси, состоящей из 126,6 г метилизопропилкетона, 150 г гексана и 28,2 г 50% серной кислоты, при температуре 20oC в течение 30 минут добавили 112,2 г 70% пероксида водорода. После протекания последующей реакции при этой температуре в течение 90 минут органический слой отделили. К органическому слою добавили 30,0 г 6% раствора бикарбоната натрия, после чего в течение 30 минут при 20oC осуществили дозирование 100 г 20% раствора сульфита натрия. Реакционную смесь при этой температуре перемешали в течение еще 30 минут. Полученный органический слой промыли 100 мл воды, сушили 15 г дигидрата сульфата магния и фильтровали. Высушенный органический слой имел вес 281 г. К 150 г полученного раствора добавили 70 г Solvesso 100. Смесь выпаривали в роторном испарителе при 20oC и давлении 10 миллибар. Остаток имел вес 136 г.
Получение MBKP-циклического в изододекане.
К перемешанной смеси, состоящей из 40,0 г метилбутилкетона, 160 г 99% уксусной кислоты и 1,7 г 50% серной кислоты, при температуре ниже 30oC в течение 15 минут добавили 21,8 г 70% пероксида водорода. После протекания последующей реакции при 40oC в течение 480 минут реакционную смесь влили в 600 мл воды. К полученной смеси при перемешивании добавили 25,0 г изододекана. Затем органический слой отделили. Полученный органический слой два раза в течение 30 минут обработали 50 мл 4 N гидроксида натрия и затем два раза 50 мл воды. Органический слой отделили и разбавили 37,5 г изододекана, при этом получили композицию, имеющую вес 80,0 г.
Получение MBKP-T4/T3 в изододекане.
К перемешанной смеси, состоящей из 122,0 г метилбутилкетона, 85 г изододекана и 48,0 г 50% серной кислоты, при температуре 30oC в течение 30 минут добавили 118,5 г 70% пероксида водорода, после этого реакционную смесь в течение 15 минут охладили до 20oC. После протекания последующей реакции при этой температуре в течение 120 минут органический слой отделили. К органическому слою добавили 25,0 г 6% раствора бикарбоната натрия. Реакционную смесь при этой температуре перемешали еще в течение 15 минут. После отделения полученный органический слой сушили 25 г дигидрата сульфата магния и фильтровали. Высушенный органический слой имел вес 218 г. К 110 г полученного раствора добавили 37,9 изододекана, при этом получили композицию, имеющую вес 147,9 г.
Получение MBKP-T3 в изододекане.
К перемешанной смеси, состоящей из 122,0 г метилбутилкетона, 85 г изододекана и 48,0 г 50% серной кислоты, при 20oC в течение 30 минут добавили 118,5 г 70% пероксида водорода. После протекания последующей реакции при этой температуре в течение 120 минут органический слой отделили. К органическому слою добавили 25,0 г 6% раствора бикарбоната натрия. Органический слой отделили. К 100 г органического слоя при 20oC в течение 30 минут добавили 100 г 20% раствора сульфата натрия. Реакционную смесь при этой температуре перемешали еще в течение 30 минут. Полученный органический слой промыли 100 мл воды, сушили 10 г дигидрата сульфата магния и фильтровали. Высушенный органический слой имел вес 90,5 г. К 90,0 г полученного раствора добавили 11,3 г изододекана, при этом получили композицию, имеющую вес 101,3 г.
Получение DEKP-циклического в изододекане.
К перемешанной смеси, состоящей из 43,9 г диэтилкетона, 20,0 г изододекана и 24,5 г 50% серной кислоты, при температуре 40oC в течение 15 минут добавили 24,3 г 70% пероксида водорода, после чего при этой температуре в течение 360 минут происходила последующая реакция. Затем отделили органический слой. Органический слой при температуре 40oC в течение 30 минут три раза обработали 50 мл 4 N гидроксида натрия. Затем органический слой отделили и два раза промыли 20 мл насыщенного раствора хлорида натрия при 20oC. Органический слой сушили дигидратом сульфата магния, фильтровали и фильтрат промыли 50 г изододекана и добавили к органическому слою. Высушенный органический слой разбавили 57,0 г изододекана, в результате чего получили композицию, имеющую вес 119,1 г.
Получение DEKP-T4/T3 в изододекане.
К перемешанной смеси, состоящей из 122,0 г диэтилкетона, 85 г изододекана и 48 г 50% серной кислоты, при температуре 30oC в течение 60 минут добавили 118,5 г 70% пероксида водорода. После протекания последующей реакции при этой температуре в течение 120 минут органический слой отделили. К органическому слою добавили 25,0 г 6% бикарбоната натрия. Реакционную смесь при этой температуре перемешивали в течение еще 15 минут. После отделения полученный органический слой сушили 25 г дигидрата сульфата магния и фильтровали. Высушенный органический слой имел вес 191 г. К 102 г полученного раствора добавили 28,8 г изододекана, при этом получили композицию, имеющую вес 130,8 г.
Получение DEKP-T3 в изододекане.
К перемешанной смеси, состоящей из 122,0 г диэтилкетона, 85 г изододекана и 48,0 г 50% серной кислоты, при температуре 20oC в течение 30 минут добавили 118,5 г 70% пероксида водорода. После протекания последующей реакции при этой температуре в течение 120 минут органический слой отделили. К органическому слою добавили 25,0 г 6% раствора бикарбоната натрия. Затем органический слой отделили. К 100,0 г органического слоя при температуре 20o C в течение 30 минут добавили 100 г 20% раствора сульфата натрия. Реакционную смесь при этой температуре перемешали в течение еще 30 минут. Полученный органический слой промыли 100 мл воды, сушили 10 г дигидрата сульфата магния и фильтровали. Высушенный органический слой имел вес 87,0 г. К 86,0 г полученного раствора добавили 14,1 г изододекана, при этом получили композицию, имеющую вес 101,1 г.
Анализ полученных пероксидов кетона представлен в табл. 1.
Примеры 1-7 и сравнительные примеры A-I
В этих примерах для получения концентрации активного
кислорода, равной 0,011%, предварительно смешали Moplen® FLS20 с 0,1 вес.% антиоксиданта Irganox® 1010 и пероксидами в количествах, упомянутых в табл. 2. Пероксиды
полностью разбавили в изододекане, используемом в качестве флегматизатора. В кубическом смесителе в течение 15 минут осуществили перемешивание.
Затем в системе Haake-Pheocord® 40, снабженной двухшнековым экструдером ( Rheomex® TW-100, содержащий шнеки для интенсивного перемешивания), при температуре 250oC и 60 оборотах в минуту под быстрым притоком азота осуществили реакцию деструкции полипропилена. Пример 1 повторили под воздушной атмосферой без притока азота, и в табл. 2 в круглых скобках привели MFI для модифицированной воздушной атмосферы. Перед оценкой степени пожелтения подвергнутый деструкции полипропилен гранулировали и сушили при 60oC.
Результаты представлены в табл. 2
Из
табл. 2 можно видеть, что пероксиды циклического кетона настоящего изобретения дают гораздо более высокую степень деструкции полипропилена, чем пероксиды нециклического кетона.
В действительности, показано, что настоящие пероксиды циклического кетона являются сравнимыми с коммерческим продуктом Trigonox® 101, который общепринято используют при деструкции полипропилена. В конечном счете деструкция с помощью пероксида циклического кетона приводит к меньшему пожелтению по сравнению с пожелтением в способах, в которых применяют пероксиды нециклического кетона.
Примеры 8-35 и сравнительные примеры J-V
Повторили методику примера 1, за исключением того, что MEKP-циклический, DEKP-циклический, MPKP-циклический и
MBKP-циклический использовали при различных концентрациях, которые приведены в табл. 3. В сравнительных примерах соответственно не применяли пероксид циклического кетона, а использовали пероксиды
линейного кетона LPT Butanox®, MPKP, DEKP и MBKP.
Результаты представлены в таблице 3.
Из табл. 3 можно видеть, что увеличение концентрации пероксидов циклического кетона приводит к увеличению степени деструкции полипропилена. Соответственно, желательную степень полимерной деструкции можно контролировать посредством регулирования концентрации используемого пероксида циклического кетона. Как показано в сравнительных примерах, пероксиды линейного кетона дают очень низкую степень деструкции полипропилена.
Примеры
36-54 и сравнительные примеры W-CC
В этих примерах для демонстрации того, что изобретение можно применять при различных температурах модификации, модификацию полимера осуществляют при
различных температурах. Повторили методику примера 1, за исключением того, что изменяли температуру модификации полимера, а также, как показано в табл. 4, количество используемого пероксида. В табл. 4
также представлены результаты модификации полипропилена.
Из табл. 4 можно видеть, что чем выше температура модификации, тем выше степень деструкции полипропилена. Это указывает на то, что способ настоящего изобретения является эффективным в широком диапазоне температур и что степень деструкции полимера можно регулировать до определенной степени путем изменения температуры модификации. Кроме того, показано, что пероксиды нециклического кетона (MEKP-T3, LPT Butanox® и Trigonox® 233) являются гораздо менее эффективными при деструкции полипропилена, чем пероксиды циклического кетона настоящего изобретения.
Примеры 55-58 и сравнительные примеры DD-FF
100 частей эластомера Keltan® 520, 50
частей углеродной сажи и 10 частей парафинового масла в течение 5 минут при температуре 50oC смешали в 1,6 л смесителе Бенбери при 70% факторе загрузки и скорости вращения ротора 77
оборотов в минуту. Затем с эластомерной смесью в двухвалковой мельнице в соответствии со стандартными методиками, хорошо известными специалистам в данной области, смешали пероксид и соагент, указанные
в табл. 5.
Сделали реограммы эластомерной смеси, полученные результаты представлены в табл. 6.
Эти примеры показывают, что при эквивалентных концентрациях активного кислорода пероксида циклического кетона настоящего изобретения увеличивают время подвулканизации (ts2) по сравнению с контрольными и другими коммерчески пригодными пероксидами, используемыми при сшивании EPDM (тройного этилен-пропиленового каучука с диеновым сомономером), что приводит к большей степени надежности процесса. Кроме того, пероксид нециклического метилэтилкетона (MEKP-T3) не обеспечивает какого-либо сшивания.
Примеры 63-64 и сравнительный пример GG
Повторили методику примеров 55-58, за исключением того, что
температуру вулканизации и тип и
количество пероксида изменяли так, как это показано в табл. 7. Количество каждого пероксида выбирали таким образом, чтобы во всех примерах концентрации активного кислорода были одинаковыми. Результаты
также представлены в табл. 7.
Эти примеры показывают, что пероксид нециклического кетона MEKP-T3 и пероксид Trigonox® 233 не обеспечивают сшивание. Пероксиды циклического кетона настоящего изобретения обеспечивают поперечное сшивание и большую степень безопасности процесса, которая показана посредством времени подвулканизации (ts2).
Примеры 65-66 и сравнительный пример HH
В этих примерах количества MEKP-циклического и Perkadox® 14-40MB-GR выбирали таким образом, чтобы обеспечить количество активного
кислорода, эквивалентное количеству кислорода в способе примера 12. Затем с использованием эластографа Gottfert® измерили крутящий момент дельта, полученный посредством каждого из
соединений:
Состав DD при 250oC дает крутящий момент дельта 0,98 нм
Состав 59 при 250oC дает крутящий момент дельта 0,34 нм
Состав 59 при 250oC дает крутящий момент дельта 0,44 нм
Эти примеры показывают, что пероксиды циклического кетона настоящего изобретения являются более активными при сшивании EPDM при повышенных
температурах.
Примеры 67-69 и сравнительный пример II
Путем медленного добавления к стиролу при перемешивании точного количества полибутадиеновой крошки получили раствор 6
вес.% полибутадиена в стироле. Для обеспечения полного растворения полибутадиена содержимое сосуда перемешивали в темноте в течение 24 часов.
1 л реактор Buchi (Бучи), изготовленный
из нержавеющей стали, снабженный глушителем, трехлопастной мешалкой, датчиком давления и продувкой для азота, загрузили раствором, состоящим из 0,375 миллиэквивалента инициатора в 250 г 6 вес.%
полибутадиена в растворе стирола. Из реактора откачали воздух и создали повышенное давление. Реакцию осуществили при 130oC и давлении азота 5 бар. Через 2 часа полимеризации со дна взяли
пробы и затем их анализировали на привитой полибутадиен и степень превращения. Результаты представлены в табл. 8
Примеры 70-71 и сравнительные примеры JJ-NN
В этих примерах применили
такую же методику, как и в примере 1, за исключением того, что в качестве полипропилена использовали Hostalen® PPH 1050. К смесям также добавили стабилизаторы, которые обычно
используют в практике регулирования деструкции полипропилена: Irganox® B225 (смесь антиоксидантов фенольного и фосфитного типа) и Tinuvin® 770 (стабилизатор
ультрафиолетового излучения). В сравнительных примерах также использовали Trigonox® 101 (см. табл. 9).
Из табл. 9 видно, что использование MEKP-циклического в присутствии стабилизатора приводит к существенной деструкции полипропилена. Отрицательного воздействия на изменение UV не наблюдали. Значения MFI и YI, полученные при использовании MEKP-циклического, сравнимы с таковыми, полученными при использовании Trigonox® 101.
Примеры 72-73 и сравнительные примеры OO-RR
В этих примерах смешали гомополимер
(Hostalen® PPR 1060F), сополимер (Stamylan® 56 MN10) и эластомерную смесь (Hostalen® PPN8009) и осуществили их взаимодействие с 0,11% активного
кислорода MEKP-циклического и 0,1 вес.% антиоксиданта Irganox 1010. Реакцию деструкции полипропилена осуществили в системе Haake-Pheocord® 90, снабженной камерой смешения (Rheomix RM
600, содержащая цилиндрические роторы), при 200oC или при 225oC в течение 10 минут. Перед оценкой MFI подвергнутый деструкции полипропилен гранулировали (см. табл. 10).
Из табл. 10 можно видеть, что применение MEKP-циклического позволяет получить более высокую степень деструкции сополимеров, чем применение пероксида нециклического кетона.
Примеры 74-77 и сравнительные примеры SS-VV
В этих примерах перемешали LL DPE (линейный полиэтилен низкой плотности) ( Escorene® LL 1001XV) и осуществили его взаимодействие
с пероксидом различных концентраций в соответствии с методикой примеров 70-71. Реакцию модификации LL DPE осуществили в течение 10 минут при температуре 225oC. Перед оценкой прочности
расплава модифицированный LL DPE гранулировали.
Результаты показаны в табл. 11.
Табл. 11 показывает, что после взаимодействия LL DPE с MEKP-циклическим прочность расплава увеличивается в большей степени по сравнению с прочностью расплава в том случае, когда применяют пероксид линейного кетона.
Вышеприведенные примеры представлены только с целью иллюстрации и описания, и их ни в коей мере не следует истолковывать как ограничивающие изобретение. Объем изобретения определен из приложенной формулы изобретения.
Реферат
Представлен способ модификации (со)полимеров с применением органического пероксида, включающий стадию контактирования (со)полимера с органическим пероксидом при условиях, посредством которых, по крайней мере, какой-нибудь из органических пероксидов разлагается. Способ отличается тем, что, по крайней мере, 20% от общего содержания активного кислорода органического пероксида свойственно одному или нескольким пероксидам циклического кетона. По второму аспекту изобретение относится к применению композиции органического пероксида, в которой, по крайней мере, 20% от общего содержания активного кислорода способствует один или несколько пероксид(ов) циклического кетона для модификации (со)полимеров. Было найдено, что эти пероксиды циклического кетона являются чрезвычайно эффективными в способах модификации (со)полимера. 2 с. и 8 з.п. ф-лы. 11 табл.
Формула
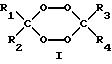
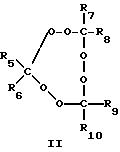
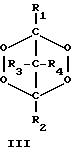
в которых R1-R10 независимо выбирают из группы, состоящей из водорода, С1-С20-алкила, C3-С20 -циклоалкила, C6-C20-арила, C7-C20-аралкила и C7-C20-алкарила, при этом эти группы могут включать линейные или разветвленные алкильные составляющие, и каждый из R1-R10 может быть необязательно замещен одной или несколькими группами, выбранными из гидрокси-, С1-С20-алкокси, линейного или разветвленного С1-С20-алкила, С6-C20-арилокси, галогена, сложного эфира, карбокси-, нитрила и амидо.

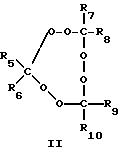

где R1-R10 независимо выбирают из группы, состоящей из водорода, С1-C20-алкила, C3 -C20-циклоалкила, C6-C20-арила, С7-C20-аралкила и С7-C20-алкарила, при этом группа может включать линейные или разветвленные алкильные составляющие; и каждый из R1-R10 может быть необязательно замещен одной или несколькими группами, выбранными из гидрокси-, C1-C20 -алкокси, линейного или разветвленного С1-C20-алкила, С6-C20-арилокси, галогена, сложного эфира, карбокси, нитрила и амидо.

Комментарии