Гидрированные полимеры с радиальной структурой, имеющие ядро на основе каликсаренов, и их применение в смазочных композициях - RU2672421C2
Код документа: RU2672421C2
Описание
Настоящее изобретение касается гидрированных полимеров с радиальной структурой, имеющих ядро на основе каликсаренов, способов их получения. Полимеры по настоящему изобретению можно применять в смазочных композициях в качестве присадок, улучшающих индекс вязкости.
В настоящей патентной заявке все упоминаемые в тексте рабочие условия должны быть предпочтительными условиями, даже если это прямо не указано.
Для целей настоящих пояснений выражение "содержать" или "включать" также охватывают выражение "заключаться" или "главным образом состоять из".
Для целей настоящих пояснений, если не указано иное, определения диапазонов всегда включают пределы.
В настоящей патентной заявке радиальные полимеры также известны и обозначены как звездообразные полимеры.
Известно, что вязкость смазочных масел меняется в зависимости от температуры. Многие смазочные масла должны использоваться в широком температурном диапазоне, и, таким образом, важно, чтобы масло не было слишком вязким при низкой температуре и не было слишком текучим при повышенной температуре. Изменение вязкости масла с температурой выражают величиной индекса вязкости. Чем выше индекс вязкости, тем меньше изменение вязкости масла при изменении температуры.
Известно применение добавок на полимерной основе с целью увеличения индекса вязкости смазочных масел, таким способом увеличивают их вязкость при повышенной температуре и по возможности максимально ограничивают повышение вязкости при низкой температуре. Полимеры, которые обычно используют для улучшения индекса вязкости, представляют собой: этилен-пропиленовые сополимеры, гидрированные сопряженные полидиены (например, гидрированный полиизопрен), гидрированные стирол-бутадиеновые сополимеры, гидрированные стирол-изопреновые сополимеры и поли(алкилметакрилаты). Синтез линейных гидрированных полимеров сопряженных диенов и линейных стирол-сопряженных диеновых сополимеров и их применение в смазках описаны, например, в патентах США 3554911; 3668125; 3772196; 3775329; 3835053; EP 585269 и EP 578725. Для каждого полимера из указанных выше классов, с увеличением молекулярной массы также повышается загущающая способность и, следовательно, уменьшается количество полимера, необходимое для определенного увеличения вязкости масла при повышенной температуре (загустевания). Если полимер должен представлять собой хорошую добавку, которая улучшает индекс вязкости, он должен не только оказывать благоприятное действие на индекс вязкости чистого масла, но также должен быть стабильным и сохранять свои функции, если масло используется в двигателе. По этой причине хорошая добавка должна также обладать устойчивостью к механическому сдвигу. Известно, что устойчивость полимера к механическому сдвигу падает с повышением молекулярной массы и, таким образом, выбор добавки, которая улучшает индекс вязкости, обычно является компромиссом между использованием больших количеств низкомолекулярных полимеров, которые устойчивы к механическому сдвигу, и использованием малых количеств высокомолекулярных полимеров, которые имеют плохую устойчивость к механическому сдвигу.
Кроме того, известно, что используемые в смазочных маслах добавки, улучшающие индекс вязкости, могут способствовать образованию лакообразного нагара и сажистого отложения в тех частях двигателя, которые подвергаются воздействию повышенных температур. Поэтому предпочтительными будут те добавки, которые обеспечивают хорошую загущающую способность и хорошую прочность на сдвиг при минимальном количестве полимера.
В патенте США 4116917 раскрывается класс гидрированных радиальных (звездообразных) полимеров, составленных из полидивинилбензольного (PDVB) ядра, к которому радиально присоединены, по меньшей мере, 4, предпочтительно от 7 до 15 линейных сегментов гидрированных сопряженных полидиенов или гидрированных стирол-сопряженных диеновых сополимеров.
Указанные радиальные полимеры дают возможность повышать загущающую способность указанных добавок в горячем виде, снижать влияние на вязкость смазки в холодном виде и повышать устойчивость к механическому сдвигу. Способ, применяемый для синтеза таких звездообразных полимеров, известен как «рука-первая, ядро-последнее» и включает: (a) анионную полимеризацию сопряженного диена или сополимеризацию сопряженного диена и стирола с образованием живого анионного полимера; (b) добавление дивинилбензола к живому анионному полимеру, образующему сначала PDVB-ядро, винильные группы которого способны взаимодействовать с живым анионом, образуя, таким образом, звездообразный полимер; (c) гидрирование звездообразного полимера. Применение таких звездообразных полимеров делает возможным снижение (относительно известных полимеров прототипов) количества смазочных масел, необходимого для достижения определенного загустевания и определенной устойчивости к механическому сдвигу. Добавки, улучшающие индекс вязкости и содержащие звездообразные полимеры, раскрытые в патенте США 4116917, продаются фирмой Infineum International Ltd.
Однако указанный класс радиальных полимеров имеет ряд отрицательных свойств, связанных, главным образом, с PDVB-ядром, которое:
имеет структуру сшитого геля, которая строго не определена;
затрудняет контроль количества линейных полимерных сегментов, связанных с ядром, приводя, таким образом, к некоторой степени непостоянства в структуре и характеристиках радиального полимера, таких как, например, устойчивость к механическому сдвигу и загустевание.
Кроме того, промышленное применение дивинилбензола проблематично вследствие его повышенной реакционной способности и тенденции вызывать нежелательные реакции полимеризации. Следовательно, желательно получить полимеры, составленные из ядра с хорошо определяемой структурой, таким образом, чтобы иметь строго определенное количество полимерных сегментов, связанных с указанным ядром.
Известны два разных способа получения звездообразных полимеров, имеющих ядро с хорошо определяемой структурой:
(1) способ с использованием многофункциональных инициаторов, известный как «ядро-первое, рука-последняя»;
(2) способ с использованием молекул многофункциональных реагентов, способных связываться с функциональными группами образованных ранее полимеров, способ, известный как «рука и ядро-первые».
Использование многофункциональных инициаторов для синтеза звездообразных полимеров анионной и катионной полимеризацией является хорошо известным способом, но не очень широко применяемым из-за проблем с растворимостью многофункционального инициатора, особенно в реакциях анионной полимеризации.
В противоположность этому, существуют различные примеры прототипов по использованию многофункциональных реагентов для синтеза звездообразных полимеров способом "рука и ядро-сначала". Примерами таких типов многофункциональных реагентов, которые используются в качестве ядра для получения звездообразных полимеров, являются силоксаны, к которым присоединяют сегменты катионно-полученного полиизобутилена посредством реакций гидросилилирования, и алкоксисиланы и галогенсиланы, к которым присоединяют живые цепи анионных полимеров посредством анионной полимеризации. Однако силоксаны имеют недостаток, обладая низкой термической и окислительной стабильностью, тогда как основным недостатком алкоксисиланов и галогенсиланов является образование звездообразных полимеров, составленных максимум из четырех полимерных сегментов, связанных с силиконовым ядром.
Еще один тип многофункциональных реагентов, которые обычно характеризуются большим числом реактивных функциональных групп и превосходной термической и окислительной стабильностью, составляют каликсарены, представляющие собой циклические продукты, получаемые конденсацией пара-замещенных фенолов и формальдегида. Различные каликсареновые соединения и соответствующие способы их получения разработаны Gutsche и упоминаются, например, в Houben-Weyl 6, 1036 и книге "Monographs in Supramolecular Chemistry", редактор серии J. Fraser Stoddart, опубликовано Royal Society of Chemistry в 1989 и 1998.
В патенте США 5840814 описаны радиальные полимеры, имеющие множество строго определенных ветвей, связанных со строго определенным ядром, и их синтез (в прототипе радиальные полимеры, также известные как звездообразные полимеры).
Ядро состоит из каликс[n]арена, в котором n равно от 4 до 16, и его производных, к которому присоединено, по меньшей мере, три полимерных ветви. Указанные полимерные ветви предпочтительно выбраны из полиизобутилена, полисилоксанов, в частности, полидиметилсилоксана, или обоих.
В патенте США 5840814 к тому же описаны способы синтеза таких радиальных полимеров.
Первый способ касается присоединения полиизобутиленовых цепей с терминальными гидроксильными группами (-OH) к каликсареновому ядру, которое составлено из 4-16 элементов и включает, по меньшей мере, одну сложноэфирную функциональную группу на каждый элемент, с которой полиизобутилен связывают трансэтерификацией в присутствии катализатора.
Второй способ касается присоединения полисилоксановых цепей, предпочтительно полидиметил силоксанов, с терминальными Si-H группами к каликсареновому ядру, которое составлено из 4-16 элементов и включает, по меньшей мере, одну аллильную функциональную группу на каждый элемент, с которой полисилоксан связывают гидросилилированием в присутствии катализатора.
Третий способ касается присоединения полиизобутиленовых цепей с терминальными гидроксильными группами (-OH) и полисилоксановых цепей с терминальными Si-H группами к каликсареновому ядру, которое составлено из 4-16 элементов и включает, по меньшей мере, одну сложноэфирную функциональную группу на каждый элемент, с которой полиизобутилен связывают трансэтерификацией в присутствии первого катализатора, и аллил-функциональную группу на каждый элемент, с которой полисилоксан связывают посредством гидросилилирования в присутствии второго катализатора.
В патенте США 5840814 не представлены примеры использования указанных выше полимеров в моторных маслах, и, кроме того, такие продукты имеют недостаток, из-за которого они не очень подходят для применения в качестве присадок, улучшающих индекс вязкости смазочных масел. Это связано с тем, что полимеры на основе полисилоксанов, как известно, не используются для такого приложения, и что продукты на основе полиизобутилена (PIB) не очень эффективны в улучшении индекса вязкости масел, при этом они обладают хорошей загущающей способностью в горячем виде, вызывая при повышенной температуре увеличение вязкости смазочного масла, к которому их добавляют, но они не проявляют себя с хорошей стороны в холодном виде, при этом они также вызывают увеличение низкотемпературной вязкости масла. Такое поведение затрудняет использование таких полимеров для получения смазочных масел со степенями вязкости SAE 0W, 5W и 10W, для которых установлены строгие пределы значений низкотемпературной вязкости (CCS-вязкость (Cold Cranking Simulator)). Поэтому при составлении всесезонных смазочных масел другие добавки, принадлежащие к другим классам химических соединений, предпочтительны над добавками на основе полиизобутилена.
Заявитель неожиданно обнаружил, что радиальные полимеры, содержащие ядро, полученное из каликсарена общей формулы (I), к которому присоединено некоторое количество P сегментов специфических гидрированных линейных полимерных, обладают превосходными характеристиками в отношении загущающей способности, устойчивости к механическому сдвигу, термоокислительной стабильности и низкотемпературного поведения и, следовательно, способны преодолеть недостатки полимеров известных прототипов, применяемых в качестве добавок в смазочных маслах.
Таким образом, настоящее изобретение касается гидрированных полимеров с радиальной структурой, имеющих ядро, полученное из каликсаренов общей формулы (I), к которому присоединено некоторое количество P сегментов гидрированных линейных полимеров, выбранных из:
гидрированных гомополимеров или сополимеров сопряженных диенов или
гидрированных сополимеров указанных сопряженных диенов и моноалкениларенов и
их смесей.
Термин "гидрированные" касается селективного гидрирования олефиновой ненасыщенности, оставляющего ароматическую ненасыщенность в основном неизменной.
Настоящее изобретение также касается способа синтеза гидрированных полимеров с радиальной структурой, описанных и заявленных в настоящем описании.
Радиальные полимеры по настоящему изобретению имеют определенные характеристики, например, загущающую способность, устойчивость к механическому сдвигу, термоокислительную стабильность, уменьшенную тенденцию к образованию отложений и низкотемпературное поведение, которые делают их в высокой степени пригодными для применения в качестве добавок, способных модифицировать индекс вязкости смазочных масел. В частности, указанные полимеры, полученные из каликсаренового ядра, к которому присоединены сегменты гидрированных полидиенов и/или гидрированных сополимеров сопряженных диенов и моноалкениларенов, способны придавать реологические свойства, устойчивость к механическому сдвигу, устойчивость к окислению и устойчивость к образованию отложений, которые превосходят характеристики, известные из прототипов.
Подробное описание
Таким образом, настоящее изобретение касается гидрированных полимеров с радиальной структурой, имеющих ядро, полученное из каликсаренов общей формулы (I), к которому присоединено некоторое количество P сегментов гидрированных линейных полимеров, выбранных из:
гидрированных гомополимеров или сополимеров сопряженных диенов или
гидрированных сополимеров указанных сопряженных диенов и моноалкениларенов и
их смесей.
Указанные сегменты линейных полимеров предпочтительно представляют собой гидрированные гомополимеры или сополимеры сопряженных диенов, выбранных из бутадиена, изопрена, 1,3-пентадиена, 2,3-диметил-1,3-бутадиена, 3-бутил-1,3-октадиена, 1-фенил-1,3-бутадиена и 1,3-гексадиена. Наиболее предпочтительными сопряженными диенами являются бутадиен и изопрен.
Указанные сегменты линейных полимеров предпочтительно представляют собой гидрированные сополимеры сопряженных диенов, выбранных из бутадиена, изопрена, 1,3-пентадиена, 2,3-диметил-1,3-бутадиена, 3-бутил-1,3-октадиена, 1-фенил-1,3-бутадиена и 1,3-гекса диена, и моноалкениларенов, последние выбраны из стирола, орто-метилстирола, пара-метилстирола, мета-метилстирола, трет-бутилстирола и моновинилнафталина. Стирол является предпочтительным моноалкенилареном. Предпочтительными гидрированными сополимерами сопряженных диенов и моноалкениларенов являются гидрированные бутадиен-стирольные и изопрен-стирольные сополимеры.
Предпочтительными сегментами полимеров являются гидрированные сополимеры бутадиена и стирола или гидрированные сополимеры изопрена и стирола, причем еще более предпочтительным является гидрированный сополимер бутадиена и стирола.
Каликсарены представляют собой хорошо известные циклические соединения, получаемые конденсацией пара-замещенных фенолов и формальдегида. Расширение цикла в каликсаренах обычно указывают в номенклатуре, обозначая такие продукты как каликс[n]арены, в которых n обозначает количество единиц, присутствующих в циклическом продукте.
Каликсарены по изобретению представлены формулой (I)

где:
R1, R2, R3 и R4независимо выбраны из атома водорода; группы, содержащей атомы углерода и водорода; группы, также содержащей гетероатомы в дополнение к атомам углерода и водорода; группы, также содержащей атомы кремния в дополнение к атомам углерода, водорода и гетероатомам;
один или два заместителя R5 и R6 представляют собой атом водорода, тогда как другие заместители могут представлять собой атомы водорода или алкилы с количеством атомов углерода от 1 до 6, предпочтительно метил и этил;
n равно целому числу в диапазоне от 4 до 16, предпочтительно от 6 до 12 и более предпочтительно 8.
В тексте термин «гетероатомы» обозначает атомы кислорода, азота, фосфора, серы и галогенов.
Количество P линейных гидрированных сегментов составляет от 4 до 72, предпочтительно от 16 до 48.
Более предпочтительно, если P=j×n, где j соответствует количеству полимерных сегментов, которое может присоединить каждая фенольная единица, и равно целому числу от 1 до 6.
Предпочтительно R1 и R2 могут быть выбраны из:
алкила, имеющего число атомов углерода от 1 до 24, предпочтительно от 2 до 12; или
группы, также содержащей гетероатомы в дополнение к атомам углерода и водорода и, имеющей число атомов углерода от 1 до 16; в этом случае предпочтительными гетероатомами являются атомы кислорода и галогенов; или
группы, также содержащей атомы кремния в дополнение к атомам углерода, водорода и гетероатомам, в которой количество атомов углерода варьируется от 5 до 21; предпочтительными среди этих групп являются алкоксиалкилсилановые и галогеналкилсилановые группы с количеством атомов углерода от 5 до 21; или
ненасыщенной углеводородной группы с гетероатомами или без оных, имеющей число атомов углерода от 2 до 16, предпочтительно группы винильного, аллильного или акролеильного типа, более предпочтительно винильного типа.
R3, R4, R5 и R6 предпочтительно одновременно представляют собой атомы водорода.
Более предпочтительный R1 может быть выбран из:
группы формулы (II), содержащей атом галогена:

где X обозначает атом галогена, предпочтительно выбранный из Cl, Br и I; R7 представляет собой алкиленовую или алкенильную группу с количеством атомов углерода от 1 до 12, предпочтительно от 1 до 6, или арилалкилен с количеством атомов углерода от 7 и 18; R8 и R9 представляют собой атомы водорода или алкильные или алкенильные группы с количеством атомов углерода от 1 до 12, предпочтительно атомы водорода;
группы формулы (III), содержащей функциональность сложноэфирного типа:

где R10 представляет собой алкиленовую или алкенильную группу с количеством атомов углерода от 1 до 12, предпочтительно от 1 до 6, или арилалкилен с количеством атомов углерода от 7 и 18; R11 представляет собой алкильную группу с количеством атомов углерода от 1 до 6, предпочтительно метил и этил;
группы формулы (IV), содержащей функциональность кетонного или альдегидного типа:

где R12 представляет собой алкиленовую или алкенильную группу с количеством атомов углерода от 1 до 12, предпочтительно от 1 до 6, или арилалкилен с количеством атомов углерода от 7 и 18; R13 представляет собой атом водорода или алкильную или алкенильную группу с количеством атомов углерода от 1 до 12, предпочтительно от 1 до 6, или арилалкил с количеством атомов углерода от 7 и 18;
группы формулы (V):

где R14 представляет собой алкиленовую или алкенильную группу с количеством атомов углерода от 1 до 12, предпочтительно от 1 до 6, или арилалкилен с количеством атомов углерода от 7 и 18, R15, R16, R17 независимо представляют собой алкильную группу с количеством атомов углерода от 1 до 8, предпочтительно метил и этил.
Еще более предпочтительный R1 может быть выбран из:

, or
-CH2CH2CH2Si(OCH2CH3)3, или
еще предпочтительнее, если R1 выбран из:
-CH2CH2CH2Si(OCH2CH3)3 или

Более предпочтительно, если R2 выбран из:
алкила, имеющего число атомов углерода от 1 до 12, предпочтительно -C(CH3)3, -C(CH3)2CH2C(CH3)3;
галогеналкила, имеющего число атомов углерода от 1 до 8, предпочтительна группа -CH2Cl;
алкоксикарбонила, имеющего число атомов углерода от 2 до 6, предпочтительны группы -COOCH3 и -COOC2H5;
группы формулы (V), где R14, R15, R16 и R17 имеют упоминаемые выше значения;
алкоксибензоатной группы формулы (VI):

где R18 представляет собой алкиленовую группу с количеством атомов углерода от 1 до 6, предпочтительно метилен, и R19представляет собой алкильную группу с количеством атомов углерода от 1 до 6, предпочтительно метил и этил.
Еще предпочтительнее, если R2 выбран из:
-C(CH3)3; -CH2Cl; -COOCH3; -CH2CH2CH2Si(OCH2CH3)3.
Предпочтительные гидрированные радиальные полимеры имеют ядро, полученное из каликсаренов формулы (I), в которой:
R1, R2, R3 и R4независимо выбраны из атома водорода; группы, содержащей атомы углерода и водорода; группы, также содержащей гетероатомы в дополнение к атомам углерода и водорода; группы, также содержащей атомы кремния в дополнение к атомам углерода, водорода и гетероатомам;
один или два заместителя R5 и R6 представляют собой атом водорода, тогда как другие заместители могут представлять собой атомы водорода или алкилы с количеством атомов углерода от 1 до 6, предпочтительно метил и этил;
n равно целому числу в диапазоне от 4 до 16, предпочтительно от 6 до 12 и более предпочтительно 8,
и сегменты гидрированных линейных полимеров представляют собой гидрированные сополимеры бутадиена и стирола, или изопрена и стирола, или гидрированные гомополимеры, или гидрированные сополимеры бутадиена и изопрена.
Предпочтительные гидрированные радиальные полимеры имеют ядро, полученное из каликсаренов формулы (I), в которой:
R1, R2 независимо выбраны из атома водорода; группы, содержащей атомы углерода и водорода; группы, также содержащей гетероатомы в дополнение к атомам углерода и водорода; группы, также содержащей атомы кремния в дополнение к атомам углерода, водорода и гетероатомам;
R3, R4, R5 и R6 одновременно представляют собой атомы водорода;
n равно целому числу в диапазоне от 4 до 16, предпочтительно от 6 до 12 и более предпочтительно 8,
и сегменты гидрированных линейных полимеров представляют собой гидрированные сополимеры бутадиена и стирола или изопрена и стирола.
Более предпочтительные гидрированные радиальные полимеры имеют ядро, полученное из каликсаренов формулы (I), в которой:
R1выбран из заместителей формулы (II), (III), (IV) и (V),
R2 выбран из:
алкила, имеющего число атомов углерода от 1 до 12, предпочтительно -C(CH3)3, -C(CH3)2CH2C(CH3)3;
галогеналкила, имеющего число атомов углерода от 1 до 8, предпочтительна группа -CH2Cl;
алкоксикарбонила, имеющего число атомов углерода от 2 до 6, предпочтительны группы -COOCH3 и -COOC2H5;
алкилентриалкоксисилановой группы формулы (V), в которой R14, R15, R16 и R17 имеют упоминаемые выше значения;
алкоксибензоатной группы формулы (VI);
R3, R4, R5 и R6 одновременно представляют собой атомы водорода;
n равно целому числу в диапазоне от 4 до 16, предпочтительно от 6 до 12 и более предпочтительно 8,
и сегменты гидрированных линейных полимеров представляют собой гидрированные сополимеры бутадиена и стирола или изопрена и стирола.
Еще предпочтительнее, если радиальные полимеры имеют ядро, полученное из каликсаренов формулы (I), в которой:
R1 выбран из:


или R2 выбран из: -C(CH3)3; -CH2Cl; -COOCH3; -CH2CH2CH2Si(OCH2CH3)3;
R3, R4, R5 и R6 одновременно представляют собой атомы водорода;
n равно целому числу в диапазоне от 4 до 16, предпочтительно от 6 до 12 и более предпочтительно 8;
и сегменты гидрированных линейных полимеров представляют собой гидрированные сополимеры бутадиена и стирола или изопрена и стирола.
Более предпочтительно, если радиальные полимеры имеют ядро, полученное из каликсаренов формулы (I), выбранных из следующих: 5,11,17,23,29,35,41,47-октахлорметил-49,50,51,52,53,54,55,56-октагексилоксикаликс[8]арен; 5,11,17,23,29,35,41,47-окта-трет-бутил-49,50,51,52,53,54,55,56-окта[4-(метоксикарбонил)бензилокси]каликс[8]арен; 5,11,17,23,29,35,41,47-окта-трет-бутил-49,50,51,52,53,54,55,56-окта(3-триэтоксисилилпропокси) каликс[8]арен; 5,11,17,23,29,35,41,47-октаметоксикарбонил-49,50,51,52,53,54,55,56-окта[4-(метоксикарбонил)бензилокси]каликс[8]арен; 5,11,17,23,29,35,41,47-окта(3-триэтокси силилпропил)-49,50,51,52,53,54,55,56-окта(3-триэтоксисилилпропокси)каликс[8]арен, и имеют сегменты гидрированных полимеров, выбранных из гидрированных сополимеров бутадиена и стирола или изопрена и стирола.
Более предпочтительно, если радиальные полимеры имеют ядро, полученное из каликсаренов формулы (I), выбранных из следующих: 5,11,17,23,29,35,41,47-октахлорметил-49,50,51,52,53,54,55,56-октагексилоксикаликс[8]арен; 5,11,17,23,29,35,41,47-окта-трет-бутил-49,50,51,52,53,54,55,56-окта[4-(метоксикарбонил)бензилокси]каликс[8]арен; 5,11,17,23,29,35,41,47-окта-трет-бутил-49,50,51,52,53,54,55,56-окта(3-триэтоксисилил пропокси) каликс[8]арен; 5,11,17,23,29,35,41,47-октаметоксикарбонил-49,50,51,52,53,54,55,56-окта[4-(метоксикарбонил)бензилокси]каликс[8]арен; 5,11,17,23,29,35,41,47-окта(3-триэтокси силилпропил)-49,50,51,52,53,54,55,56-окта(3-триэтоксисилилпропокси)каликс[8]арен; и имеют сегменты гидрированных полимеров, выбранных из гидрированных гомополимеров бутадиена.
СПОСОБ СИНТЕЗА РАДИАЛЬНЫХ ПОЛИМЕРОВ, ОПИСАННЫХ И ЗАЯВЛЕННЫХ В НАСТОЯЩЕЙ ПАТЕНТНОЙ ЗАЯВКЕ
Кроме того, настоящее изобретение касается способа синтеза радиальных полимеров, описанных и заявленных в настоящем описании, который включает следующие стадии:
i. синтез каликсарена общей формулы (I);
ii. получение сегментов линейных полимеров анионной полимеризацией в растворе одного или более сопряженных диенов или сополимеризацией одного или более сопряженных диенов и моноалкениларена в присутствии инициатора ионной полимеризации с образованием живого анионного полимера;
iii. взаимодействие живого анионного полимера, полученного в (ii), с каликсареном, синтезированным в (i), с образованием полимера с радиальной структурой; и
iv. взаимодействие при селективном гидрировании олефиновой ненасыщенности, присутствующей в радиальном полимере, полученном в (iii), с получением гидрированного радиального полимера.
Живые анионные полимеры, полученные на стадии (ii), являются предшественниками цепей гидрированных линейных полимеров, которые вытянуты радиально от каликсаренового ядра. В предпочтительном варианте настоящего изобретения заместители каликсарена R1 и R2 выбраны таким образом, что для каждой из n единиц каликс[n]арена, по меньшей мере, один или оба заместителя имеют функциональность, способную взаимодействовать с живым анионным полимером, образуя, таким образом, радиальный полимер.
Следовательно, количество сегментов гидрированных линейных полимеров P в конечном радиальном полимере зависит от количества n единиц каликс[n]арена, количества групп R1 и R2 реактивных относительно живого анионного полимера, количества звеньев живого анионного полимера, которое каждая из групп R1 и R2 способна связывать и от выхода реакции связывания живых анионных полимеров и каликсаренов.
Группы R1 и R2 не должны содержать кислотных атомов водорода, способных взаимодействовать с живым анионным полимером, выводя последние из реакций связывания с каликсареном, которые ведут к образованию радиальных полимеров.
Группы R1 и R2, содержащие функциональность сложноэфирного типа, способны связывать две единицы живого анионного полимера; это происходит потому, что взаимодействие с первой единицей живого анионного полимера протекает с удалением алкоксида и образованием кетона, который, в свою очередь, способен связывать единицу второго живого анионного полимера посредством реакции присоединения, образуя, таким образом, радиальный полимер.
Группы R1 и R2, содержащие функциональность альдегидного или кетонного типа, способны связывать только одну единицу живого анионного полимера посредством реакции присоединения.
Группы R1 и R2, содержащие функциональность типа галогенированного алкила, способны связывать одну единицу живого анионного полимера посредством реакции замещения.
С другой стороны, алкилтриалкоксисилановые группы способны связывать три единицы живого анионного полимера с удалением соответствующих алкоксидов.
Группы R1илиR2, которые содержат олефиновую ненасыщенность, предпочтительно винильного, аллильного или акрилоильного типа, могут присоединять одну единицу живого анионного полимера посредством реакции присоединения.
СТАДИЯ (i): СИНТЕЗ КАЛИКСАРЕНОВЫХ ЯДЕР
Синтез каликсаренов формулы (I), где R1=R3=R4=H хорошо известен из прототипов и обычно его осуществляют конденсацией n фенолов, которые являются пара-замещенными, предпочтительно алкильными группами, и формальдегида при повышенной температуре, как показано ниже на схеме 1:

Схема 1
Используемые катализаторы обычно представляют собой гидроксиды металлов, предпочтительно щелочных или щелочноземельных металлов, которые представлены, например, в работе Gutsche, C. D. и др.Org. Synth. 1990, 68, 234-246. В последнее время также используют с хорошим выходом кислоты Льюиса при содействии СВЧ-облучения, как показано в работе Bew, S. P. и др. Chem. Commun. 2007, 975-977; Bew, S. P. и др. J. Org. Chem. 2011, 76, 7076-7083. Обычно размер макроцикла можно легко регулировать, изменяя основный катион, растворитель и температуру нагревания. В случае некоторых фенолов, обычно пара-трет-бутилфенола, объединенные экспериментальные процедуры (например, в Gutsche, C. D. и др.Org. Synth. 1990, 68, 234-246 и Gutsche, C. D. Org. Prep. Proced. Int. 1992, 25, 137-139) позволяют провести синтез с превосходными выходами (60-90%), получая продукты формулы (I), где R1=R3=R4=H, R2=трет-C4H9 и имеющие n=4, 5, 6 или 8. Обычно для синтеза пара-трет-бутилкаликс[8]аренового производного формулы (I), где R1=R3=R4=H, R2=трет-C4H9 и n=8, пара-трет-бутилфенол (1), показанный на схеме 1, и параформальдегид взаимодействуют с NaOH в ксилоле при температуре кипения с обратным холодильником. Количества используемого параформальдегида и NaOH составляет, соответственно, 1,7 экв. и 0,03 экв. на экв. пара-трет-бутилфенола. После удаления воды из дефлегматора можно выделить требуемый продукт фильтрованием после 4-часового взаимодействия в виде циклического октамерного производного (1n) с n=8, показанного на схеме 1.
Для целей настоящего изобретения каликсарены со свободными гидроксильными группами, такие, как например (1n), функционализируют по нижнему контуру (R1 формулы (I)) и/или по верхнему контуру (R2 формулы (I)) группами, содержащими функциональности, способные связывать единицы живого анионного полимера. Функциональности кетонного, альдегидного и галогеналкильного типа способны связывать максимум одну единицу живого анионного полимера; функциональности сложноэфирного типа способны связывать максимум две единицы живого анионного полимера; алкилтриалкоксисилановые группы способны связывать максимум три единицы живого анионного полимера.
Общие способы получения предпочтительных каликсаренов по изобретению показаны ниже при помощи примеров.
СТАДИЯ (i) (СИНТЕЗ КАЛИКСАРЕНОВЫХ ЯДЕР): синтез каликсареновых производных, к которым можно добавить один полимерный сегмент на каждое фенольное ядро.
Каликсареновые производные, содержащие хлорметильные группы на верхнем контуре каждой фенольной единицы, получают по следующей методике, включающей взаимодействия, показанные ниже на схеме 2.

Схема 2
трет-Бутильные группы можно легко удалить из пара-трет-бутилкаликс[n]аренов, используя AlCl3 в толуоле, что хорошо известно из литературы (Gutsche, C. D. и др. J. Org. Chem., 1985, 50, 5802-5806).
Обработка пара-трет-бутилкаликс[8]арена (2) солью AlCl3 (0,25 экв. на каждое фенольное ядро) в течение 2 ч при 60°C в инертной атмосфере дает производное (3), что делает возможным функционализацию верхнего контура (пара-положение относительно фенольного кислорода) каликсаренов.
Алкилирование (3) 1-бромгексаном (5 экв. на каждое фенольное ядро) и NaH (10 экв. на каждое фенольное ядро) в безводном ДМФА (Perret и др. New J. Chem., 2007, 31, 893-900) делает возможным выделение производного (4), которое, согласно литературным данным (Casnati A.Tetrahedron 1989, 45, 2177-2182), взаимодействует в CHCl3 с хлорметилоктиловым эфиром (10 экв. на каждое фенольное ядро) и тетрахлоридом олова (4 экв. на каждое фенольное ядро), приводя к образованию соединения (5) (90% выход).
СТАДИЯ (i) (СИНТЕЗ КАЛИКСАРЕНОВЫХ ЯДЕР): синтез каликсареновых производных, к которым можно добавить два полимерных сегмента на каждое фенольное ядро.
Каликсареновые производные с функциональностью сложноэфирного типа получают алкилированием каликсарена (2) по фенольным кислородам при взаимодействии с галогенсодержащими сложными эфирами, предпочтительно с 4-(бромметил)метилбензоатом, и карбонатом калия в ацетоне при температуре кипения с обратным холодильником по приведенной ниже схеме 3. Количество используемого 4-(бромметил)метилбензоата составляет от 1 до 1,5 экв. на экв. пара-трет-бутилфенола, и количество карбоната калия составляет от 1,1 до 2 экв. на экв. пара-трет-бутилфенола. Октафункционализированный продукт (6), полученный согласно схеме 3, выделяют и после соответствующей дегидратации используют для взаимодействия с живыми анионными полимерами.

Схема 3
СТАДИЯ (i) (СИНТЕЗ КАЛИКСАРЕНОВЫХ ЯДЕР): синтез каликсареновых производных, к которым можно добавить три полимерных сегмента на каждое фенольное ядро.
Альтернативный продукт, который следует использовать в качестве ядра в реакциях с живым анионным полимером, представляет собой производное (8), полученное по схеме 4, показанной ниже. Для получения указанного продукта проводят взаимодействие в условиях фазового переноса пара-трет-бутилкаликс[8]арена (2) формулы (I), где R1=R3=R4=H, R2=трет-C4H9 и n=8, с KOH (1,5 экв. на каждое фенольное ядро), аллилбромидом (3 экв. на каждое фенольное ядро) в смеси 1:1 вода:дихлорметан и в присутствии полиэтиленгликоля со среднемолекулярной массой 600 (PEG 600), согласно литературным данным (Wang и др. Synthetic Communications 1999, 29, 3711-3718). После выделения проводят взаимодействие результирующего октааллилового эфира пара-трет-бутилкаликс[8]арена (7) с триэтоксисиланом (1,5 экв. на каждое фенольное ядро) и гексагидратом гексахлорплатиновой кислоты (каталитическое количество) в толуоле при температуре кипения с обратным холодильником в течение 16 ч. После фильтрования и удаления толуола и избытка триэтоксисилана выделяют производное (8).

Схема 4
СТАДИЯ (i) (СИНТЕЗ КАЛИКСАРЕНОВЫХ ЯДЕР): синтез производных, к которым можно добавить 4 полимерных сегмента (2 к верхнему контуру и 2 к нижнему контуру) на каждое фенольное ядро.
Каликсареновые производные, содержащие сложноэфирные группы по обоим контурам, нижнему и верхнему, каждой фенольной единицы, получают по следующей методике, включающей взаимодействия, показанные ниже на схеме 5.

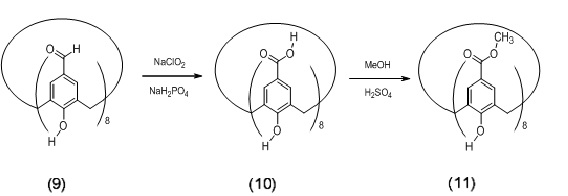

Схема 5
Обработка пара-трет-бутилкаликс[8]арена солью AlCl3 (0,25 экв. на каждое фенольное ядро) в течение 2 ч при 60°C в инертной атмосфере дает производное (3), в результате последующей обработки которого гексаметилентетрамином (ГМТА, 11 экв. на каждое фенольное ядро) в трифторуксусной кислоте (8 экв. на каждое фенольное ядро) при 140°C в течение 5 ч происходит введение формильной группы и образование соединения (9), как указано в литературе (Pasquale, S. и др. Nat. Commun., 2012, 3, 785). В результате последующего окисления соединения 9 при помощи NaClO2 (4 экв. на каждое фенольное ядро) и NaH2PO4 (0,15 экв. на каждое фенольное ядро) получают октакислоту (10), которая, будучи метилирована в обычных условиях этерификации по Фишеру, дает сложный октаэфир (11). Алкилирование последнего 4-бромметилметилбензоатом и K2CO3 в ацетоне при температуре кипения с обратным холодильником позволяет выделить производное (12), которое имеет сложноэфирные группы на обоих контурах, верхнем и нижнем, и позволяет ввести 4 полимерные цепи на фенольное ядро макроцикла.
СТАДИЯ (i) (СИНТЕЗ КАЛИКСАРЕНОВЫХ ЯДЕР): синтез производных, к которым можно добавить 6 полимерных сегментов (3 к верхнему контуру и 3 к нижнему контуру) на каждое фенольное ядро.
Как показано ниже на схеме 6, получают соединение (13), исходя из производного (3) и вводя аллильные группы по нижнему контуру с последующим алкилированием в условиях фазового переноса (PEG 600) аллилбромидом (3 экв. на каждое фенольное ядро) в присутствии KOH (1,5 экв. на каждое фенольное ядро) и в смеси дихлорметан/вода в качестве растворителя.
После обработки N,N-диэтиланилином (12 экв. на каждое фенольное ядро) производное (13) дает производное (14) посредством перегруппировки Фриса, которая также хорошо известна для каликсаренов (Gutsche, C. D. и др.J. Org. Chem., 1985, 50, 5802-5806). Соединение (14) после проведения взаимодействия в описанных выше условиях фазового переноса с KOH и аллилбромидом позволяет выделить гексадекааллильное производное (15). Дальнейшая обработка гексахлорплатиновой кислотой (каталитические количества) и триэтоксисиланом (1,5 экв. для каждого аллильного остатка) в толуоле при температуре кипения с обратным холодильником в течение 16 ч дает производное (16).

Схема 6
СТАДИЯ (ii): ПОЛУЧЕНИЕ СЕГМЕНТОВ ЖИВЫХ АНИОННЫХ ПОЛИМЕРОВ
Живые полимеры по настоящему изобретению можно получить хорошо известными способами анионной полимеризации в растворе одного или более сопряженных диенов или сополимеризации одного или более сопряженных диенов и одного или более моноалкениларенов в присутствии инициатора анионной полимеризации, такого как, например, щелочной металл-углеводородное соединение. Примеры инициаторов включают литийорганические соединения, такие как алкиллитиевые соединения, в частности, метиллитий, н-бутиллитий, втор-бутиллитий, циклоалкиллитиевые соединения, в частности, циклогексиллитий и ариллитиевые соединения, в частности, фениллитий, 1-метилстириллитий, пара-толиллитий, нафтил литий и 1,1-дифенил-3-метилпентиллитий. Другие примеры инициаторов включают натрий-нафталин, 1,4-динатрий-1,1,4,4-тетрафенилбутан, дифенилметилкалий и дифенилметилнатрий.
Примеры сопряженных диенов, которые пригодны для использования при получении живого полимера, включают бутадиен; изопрен; 1,3-пентадиен; 2,3-диметил-1,3-бутадиен; 3-бутил-1,3-октадиен; 1-фенил-1,3-бутадиен; 1,3-гексадиен. Предпочтительными диенами являются бутадиен и изопрен.
Концентрация используемого инициатора определяется желательной молекулярной массой живого полимера.
Кроме того, что живой полимер является производным сопряженных диенов, он также может представлять собой производное одного или нескольких моноалкениларенов. Примеры моноалкениларенов включают стирол, орто-метилстирол, пара-метилстирол, мета-метилстирол, трет-бутилстирол и моновинилнафталин. Предпочтительным моноалкенилареном является стирол.
Если при получении живого полимера используют моноалкениларены, то их количество составляет от 2% масс. до 50% масс. относительно общей массы всех диенов и моноалкениларенов.
Живые полимеры могут представлять собой живые гомополимеры, живые сополимеры, живые терполимеры или живые кватерполимеры.
Живые гомополимеры можно представить формулой A-M, в которой M обозначает, например, литий, и A обозначает, например, полибутадиен или полиизопрен.
Живые сополимеры можно представить формулой A-B-M, в которой M обозначает, например, литий, и A-B может представлять собой "статистический" сополимер или блок-сополимер, или альтернативно "конический" сополимер. В случае статистических сополимеров два мономера беспорядочно следуют друг за другом вдоль цепи. Указанный тип полимеров можно получить, применяя способы полимеризации, известные из прототипов. В случае блок-сополимеров за последовательностью большей или меньшей длины, образованной мономером A, следует другая последовательность, образованная мономером B.
Полимеры такого типа получают при последовательных добавлениях двух мономеров к реакционной смеси. Например, в случае стирол-бутадиеновых сополимеров полимеризация бутадиена дает живой полимер, который при последующем добавлении стирола образует полибутадиен-полистирол-M блок-сополимер. И наоборот, если сначала полимеризуют стирол и затем добавляют бутадиен, то образуется полистирол-полибутадиен-M блок-сополимер. Применяя такой подход, возможно получить живой полимер с требуемым числом блоков и требуемой последовательностью мономерных блоков. Комбинируя указанные выше подходы, можно получить живой сополимер с частично "статистической" и частично блочной структурой.
"Конические" живые сополимеры, которые образуются, когда полимеризуют смесь двух мономеров различной реакционной способности, характеризуются полимерной цепью, которая содержит два относительно чистых мономера с двух концов. При движении от одного конца полимерной цепи к другому происходит снижение содержания первого мономера и повышение содержания второго мономера.
Предпочтительными живыми полимерами являются полимеры, получаемые сополимеризацией сопряженного диена, предпочтительно бутадиена или изопрена, с моноалкенилареном, предпочтительно стиролом, характеризующиеся содержанием моноалкениларена от 3% масс. до 30% масс. относительно общей массы сополимера и содержанием диена от 97% масс. до 70% масс. относительно общей массы сополимера. Еще более предпочтительными являются живые полимеры, получаемые сополимеризацией бутадиена и стирола и характеризующиеся содержанием стирола от 5% масс. до 25% масс. относительно общей массы сополимера и содержанием бутадиена от 95% масс. до 75% масс. относительно общей массы сополимера. Предпочтение для живых сополимеров, получаемых сополимеризацией бутадиена и стирола, продиктовано ценой, коммерческой доступностью и простотой использования сырых материалов.
Еще в одном предпочтительном варианте настоящего изобретения выполняют сополимеризацию в присутствии модификаторов, в частности, простых эфиров и/или аминов, основной целью которых является промотирование полимеризации, рандомизация сополимеризации и модификация микроструктуры полидиенового сегмента. В частности, как показано в международной патентной заявке WO 2012/055802, если используют бутадиен, целью модификаторов является повышение содержания 1,2-связи сопряженного диена относительно содержания 1,4-связи. Так как предпочтительно, чтобы полимер, получаемый полимеризацией по 1,2-связи бутадиена составлял более 50% от всего полибутадиена. При содержании 1,2-связи бутадиена менее 50% после гидрирования олефиновой ненасыщенности происходит образование кристаллического полимера, что нежелательно, так как ухудшает низкотемпературное поведение звездообразного полимера, если он используется в качестве добавки для модификации индекса вязкости смазочных масел. Это происходит потому, что кристалличность конечного полимера оказывает отрицательное воздействие на температуру застывания и MRV-вязкость (ротационный минивискозиметр) смазочного масла. Примеры модификаторов включают диметиловый эфир диэтиленгликоля, диэтиловый эфир диэтиленгликоля, дибутиловый эфир диэтиленгликоля, диметиловый эфир триэтиленгликоля, диэтиловый эфир триэтиленгликоля, тетрагидрофуран, 2-метоксиэтилтетрагидрофуран, 2-метоксиметилтетрагидрофуран и диоксан.
Процесс сополимеризации проводят в присутствии, по меньшей мере, одного инертного растворителя. Примеры растворителей, которые можно применять, включают алифатические углеводороды, такие как, например, изобутанол, пентан, циклопентан, гексан, циклогексан, гептан, метил циклогексан, октан и 2-этилгексан; ароматические углеводороды, такие как, например, бензол, толуол, этилбензол и ксилол; простые эфиры, такие как, например, тетрагидрофуран, диглим и тетраглим.
Температура, при которой можно проводить сополимеризацию, составляет от 0°C до 150°C, предпочтительно от 20°C до 100°C.
Процесс сополимеризации проводят в отсутствие кислорода и влаги, предпочтительно в инертной атмосфере, при абсолютном давлении от 50 до 1013 кПа, предпочтительно при давлении от 101 до 507 кПа.
Определяемая методом ГПХ средневесовая молекулярная масса (MW) живых полимеров, полученных на стадии (ii) способа получения звездообразных полимеров, составляет от 10000 до 200000, предпочтительно от 14000 до 100000.
СТАДИЯ (iii): РЕАКЦИИ СВЯЗЫВАНИЯ ЖИВЫХ АНИОННЫХ ПОЛИМЕРОВ С КАЛИКСАРЕНАМИ
После получения живых полимеров проводят их взаимодействие на стадии взаимодействия (iii) способа получения радиальных полимеров, описанных и заявленных в настоящем описании, с каликсаренами, полученными на стадии взаимодействия (i). Каликсарен добавляют к живому полимеру по завершении полимеризации мономеров на стадии (ii).
Количество каликсарена в молях, которое добавляют, зависит от количества линейных полимерных сегментов, которые каликсарен может присоединить. Количество каликсарена составляет от 0,8/P моль до 1,2/P моль на моль живого полимера, более предпочтительно от 0,9/P моль и 1,1/P моль.
Стадию взаимодействия (iii) выполняют в присутствии, по меньшей мере, одного инертного растворителя. Примеры растворителей, которые можно применять, включают алифатические углеводороды, такие как, например, изобутанол, пентан, циклопентан, гексан, циклогексан, гептан, метилциклогексан, октан и 2-этилгексан; ароматические углеводороды, такие как, например, бензол, толуол, этилбензол и ксилол; простые эфиры, такие как, например, тетрагидрофуран, диглим и тетраглим.
Стадию взаимодействия (iii) предпочтительно проводят в том же растворителе, который используют на стадии взаимодействия (ii), при температуре от 0°C и 150°C, предпочтительно от 20°C до 100°C. Взаимодействие проводят в отсутствие кислорода и влаги, предпочтительно в инертной атмосфере, при атмосферном давлении или альтернативно при абсолютном давлении от 50 до 1013 кПа, предпочтительно от 101 до 507 кПа.
Выход реакции связывания живых анионных полимеров с каликсаренами составляет более 50%, предпочтительно более 80%.
Если полимер с радиальной структурой со стадии взаимодействия (iii) находится в анионном виде, его можно дезактивировать, применяя известные методики, добавляя соединение, способное взаимодействовать с анионом. Примеры дезактиваторов включают соединения, содержащие активный атом водорода, такие как вода и спирты.
Радиальный полимер, получаемый на стадии взаимодействия (iii), характеризуется наличием центрального ядра, состоящего из каликсарена, с которым радиально связано некоторое количество P полимерных сегментов, которые простираются от ядра. Чем больше количество полимерных сегментов связано с каликсареном, тем лучше загущающая способность. При одинаковой загущающей способности, чем больше количество полимерных сегментов, тем лучше устойчивость к механическому сдвигу, так как можно получить таким способом радиальный полимер с высокой молекулярной массой без необходимости иметь чрезмерно длинные полимерные сегменты.
СТАДИЯ (iv): ГИДРИРОВАНИЕ ЗВЕЗДООБРАЗНОГО ПОЛИМЕРА
Звездообразный полимер, полученный на стадии взаимодействия (iii), гидрируют таким образом, что степень гидрирования изначально присутствующей олефиновой ненасыщенности составляет более 85%, предпочтительно более 94%.
Применяемый катализатор гидрирования и условия гидрирования дают возможность получения количества гидрированной ароматической ненасыщенности в каликсарене и в моноалкениларене, если таковой используется, меньше 5%, более предпочтительно меньше 2%. Гидрирование можно выполнять, применяя известные катализаторы, содержащие либо благородные металлы, либо неблагородные металлы. Предпочтение отдают катализаторам на основе неблагородных металлов и, в частности, предпочтительными являются катализаторы, содержащие титан, упоминаемые в Европейском патенте EP 1721910.
Затем гидрированный звездообразный полимер выделяют из раствора, проводя серию операций, включающих удаление растворителя и сушку.
Средневесовая молекулярная масса (MW) каждого из сегментов гидрированных линейных полимеров, которые составляют гидрированный звездообразный полимер, равна от 10000 до 200000, предпочтительно от 14000 до 100000.
Средневесовая молекулярная масса (MW) гидрированных звездообразных полимеров по настоящему изобретению составляет от 100000 до 2000000, предпочтительно от 200000 до 1000000.
Средние молекулярные массы определяют методом гель-проникающей хроматографии (ГПХ) с УФ-детектором, используя полистирол в качестве калибровочного стандарта.
ПРИМЕНЕНИЕ ГИДРИРОВАННЫХ ЗВЕЗДООБРАЗНЫХ ПОЛИМЕРОВ В СМАЗОЧНЫХ СОСТАВАХ
Гидрированные звездообразные полимеры по настоящему изобретению можно применять в смазочных композициях в качестве присадок, улучшающих индекс вязкости.
Для получения смазок можно добавлять указанные гидрированные звездообразные полимеры как таковые в виде твердых веществ, или они могут быть в растворе, предпочтительно в растворе с основой смазочного масла.
Базовые масла, используемые в качестве растворителей для растворения гидрированных звездообразных полимеров, выбраны из базовых масел минерального, синтетического, растительного или животного происхождения и их смесей.
Масла минерального происхождения получают известными способами нефтепереработки, такими как, например, перегонка, депарафинизация, деасфальтинизация, деароматизация и гидрирование. Масла синтетического происхождения включают углеводородные масла, такие как, например, полимеризованные и гидрированные терминальные или внутренние олефины; алкилбензолы; полифенилы; алкилированные дифениловые эфиры; полиалкиленгликоли и производные, в которых терминальные гидроксильные группы модифицированы, например, с образованием сложного эфира или простого эфира.
Другой класс синтетических смазочных масел включает сложные эфиры карбоновых кислот синтетического, животного или растительного происхождения с различными спиртами или полиолами.
Еще один класс синтетических смазочных масел включает сложные эфиры карбоновых кислот с разными спиртами и полиолами.
Типичными примерами растительных масел являются соевое, пальмовое или касторовое масло, тогда как примерами масел животного происхождения являются талловое масло, лярдовое масло или китовый жир.
Другим способом классификации базовых масел является способ, представленный в публикации American Petroleum Institute (API) "Engine Oil Licensing and Certification System" (API EOLCS, 1507-Industry Services Department, Fourteenth Edition, December 1996, Addendum 1, December 1998). Базовые масла подразделяются на пять групп по функции их физико-химических и композиционных характеристик.
Согласно этой классификации, базовые масла, применяемые для растворения звездообразных полимеров, могут принадлежать любой из указанных выше API-групп, предпочтительно к API-группам I, II, III и IV и еще предпочтительнее к API-группам I, II и III.
Добавки, улучшающие индекс вязкости и получаемые растворением гидрированных звездообразных полимеров в базовых маслах, имеют концентрацию полимера, выраженную как процент массы полимера в растворе, приготовленном из полимера и базового масла, от 1 до 30, предпочтительно от 5 до 25.
Кроме того, настоящее изобретение касается смазочных композиций, обозначенных также как смазочные составы, содержащих одну или более из основ смазочного масла, описанных ранее, и один или более из гидрированных звездообразных полимеров, описанных и заявленных в настоящей патентной заявке, применяемых при общей концентрации, выраженной как процент массы полимера в конечном смазочном масле, от 0,1 до 5, предпочтительно от 0,3 и 2.
Если для получения смазок используют растворы звездообразных полимеров в базовых маслах, то смазочные композиции по изобретению содержат один или более указанных растворов при общей концентрации, выраженной как процент массы раствора в конечном смазочном масле, от 0,5 до 50, предпочтительно от 3,5 до 30, более предпочтительно от 5 до 18.
Такие смазочные композиции, применяемые, например, в качестве автомобильных масел, могут содержать в дополнение к указанным выше добавкам одну или более добавок, выбранных из моющих присадок, диспергирующих присадок, противоокислительных присадок, фрикционных преобразователей, противоизносных и противозадирных (EP) присадок, ингибиторов коррозии, присадок для понижения температуры застывания, противопенных присадок, эмульгаторов и других.
Для разъяснения настоящего изобретения ниже приведено несколько иллюстративных неограничительных примеров изобретения.
ПРИМЕР 1: СИНТЕЗ КАЛИКСАРЕНА ФОРМУЛЫ (5)
Каликс[8]ареновое производное, которое можно применять, согласно предпочтительному варианту настоящего изобретения, для синтеза звездообразных полимеров, представляет собой 5,11,17,23,29,35,41,47-октахлорметил-49,50,51,52,53,54,55,56-октагексилоксикаликс[8]арен, который можно представить структурой (5):

В инертной атмосфере вводят 111,2 г (0,72 моль) трет-бутилфенола (1), 27 г (1,2 моль) пара-формальдегида, 1,6 мл (0,016 моль) 10N NaOH и 600 мл ксилола в 3-горлую стеклянную колбу на 1 л, снабженную механической лопастной мешалкой и приемником Дина-Старка, оснащенным холодильником. Смесь доводят до кипения с обратным холодильником при перемешивании и поддерживают такие условия в течение 4 ч, в течение которых воду из реакции собирают в приемник Дина-Старка.
После охлаждения до комнатной температуры смесь фильтруют и твердый продукт промывают последовательно толуолом, эфиром, ацетоном и водой. Высушенный продукт перекристаллизовывают из хлороформа. Выделяют 65,8 г (выход 70,4%) белого твердого продукта. Чистоту продукта пара-трет-бутилкаликс[8]арена (2) проверяют методом масс-спектрометрии с ионизацией электрораспылением (ESI), который показывает единственный монодисперсный сигнал.
В инертной атмосфере вводят 8,25 г (6,36 ммоль) пара-трет-бутилкаликс[8]арена (2), 1,70 г (12,7 ммоль) безводного трихлорида алюминия, 10 мл фенола и 100 мл толуола в 3-горлую стеклянную колбу на 250 мл, оснащенную механической мешалкой и холодильником. При перемешивании доводят температуру смеси до 60°C и хранят в таких условиях в течение 2 ч. Добавляют 100 мл (100 ммоль) 1N HCl, смесь перемешивают и затем переносят в делительную воронку, где из отделенной органической фазы удаляют растворитель при пониженном давлении, получая в результате белое твердое вещество. Высушенный продукт перекристаллизовывают из смеси хлороформ/метанол. Получают 4,10 г (выход 76%) продукта каликс[8]арена (3).
В инертной атмосфере вводят 4,10 г (4,83 ммоль) каликс[8]арена (3), 15,46 г (386,4 ммоль) 60% NaH в минеральном масле и 50 мл безводного ДМФА в 3-горлую стеклянную колбу на 100 мл, оснащенную мешалкой, термометром и холодильником. Смесь оставляют взаимодействовать в инертной атмосфере при комнатной температуре в течение 30 мин. Затем добавляют 27,12 мл (193,2 ммоль) 1-бромгексана. Доводят температуру смеси до 70°C за 24 ч в инертной атмосфере. После охлаждения до комнатной температуры добавляют 10 мл (100 ммоль) 1N HCl, смесь перемешивают и переносят в делительную воронку, где экстрагируют органическую фазу толуолом, отделяя ее от водной фазы. Растворитель удаляют при пониженном давлении, получая в результате белое твердое вещество. Высушенный продукт перекристаллизовывают из метанола. Получают 7,41 г (выход 80%) продукта 49,50,51,52,53,54,55,56-октагексилоксикаликс[8]арена (4).
В инертной атмосфере вводят 7,41 г (3,87 ммоль) 49,50,51,52,53,54,55,56-октагексилоксикаликс[8]арена (4), 54,7 г (306 ммоль) хлорметилоктилового эфира и 500 мл хлороформа в 3-горлую стеклянную колбу на 1 л, оснащенную механической лопастной мешалкой, термометром и холодильником. При перемешивании доводят температуру смеси до -15°C и добавляют по капле 14 мл (120 ммоль) тетрахлорида олова при перемешивании в инертной атмосфере.
Проводят взаимодействие смеси в течение 1 ч при перемешивании в инертной атмосфере и комнатной температуре. Добавляют по капле 50 мл дистиллированной воды, смесь перемешивают и водную фазу отделяют в делительной воронке. Органическую фазу промывают дистиллированной водой и затем удаляют растворитель при пониженном давлении. Высушенный продукт перекристаллизовывают из гептана. Получают 8,02 г (выход 90%) продукта 5,11,17,23,29,35,41,47-октахлорметил-49,50,51,52,53,54,55,56-октагексилоксикаликс[8]арена (5).
ПРИМЕР 2: ПОЛУЧЕНИЕ ГИДРИРОВАННОГО ИЗОПРЕН-СТИРОЛЬНОГО ЗВЕЗДООБРАЗНОГО ПОЛИМЕРА ИЗ КАЛИКСАРЕНА ФОРМУЛЫ (5)
В атмосфере инертного газа вводят 8 кг безводного циклогексана (50 кПа, N2) в 15-литровый реактор, снабженный нагревательной рубашкой и мешалкой. Затем добавляют 47 г стирола и 1,2 г тетрагидрофурана. Далее раствор термостатируют при 40°C. По достижении указанной температуры добавляют 0,49 г н-бутиллития в циклогексановом растворе (7,65 ммоль). Через 20 мин. по завершении конверсии стирола добавляют 423 г изопрена. Через 30 мин по завершении конверсии изопрена добавляют 1,83 г (0,956 ммоль) каликсарена формулы (5) в тетрагидрофурановом растворе. Затем реакционную смесь выдерживают при температуре 40°C в течение 1 ч.
Далее раствор еще в атмосфере инертного газа переносят в другой 15-литровый реактор, снабженный нагревательной рубашкой и мешалкой, который подготовлен для гидрирования. Добавляют 1,61 г бутилэтилмагния в виде гептанового раствора и 1,22 г дихлорида бис-циклопентадиенилтитана в виде циклогексановой суспензии. Далее в реакторе с раствором создают давление водорода (1,5 МПа) и выдерживают раствор при температуре 120°C и перемешивании в течение 1,5 ч. Далее раствор переносят в бак, добавляют антиоксиданты (2,6 г Irganox 565 и 17 г Irgafos 168) и затем переносят в зачистную систему, где удаляют растворитель при помощи пара; далее результирующий гранулированный продукт сушат в вакуумной печи.
Характеристики результирующего гидрированного звездообразного полимера показаны в таблице 1.
ПРИМЕР 3: СИНТЕЗ КАЛИКСАРЕНА ФОРМУЛЫ (6)
Каликс[8]ареновое производное, которое, согласно еще одному предпочтительному варианту настоящего изобретения, можно применять для синтеза звездообразных полимеров, представляет собой 5,11,17,23,29,35,41,47-окта-трет-бутил-49,50,51,52,53,54,55,56-окта[4-(метоксикарбонил)бензилокси]каликс[8]арен, который можно представить структурой (6):

В инертной атмосфере вводят 8,25 г (6,36 ммоль) пара-трет-бутилкаликс[8]арена (2), синтез которого описан в примере 1, 16,45 г (71,8 ммоль) 4-(бромметил)метилбензоата, 5,14 г (30,9 ммоль) KI, 13,26 г (30,9 ммоль) K2CO3 и 100 мл ацетона в 3-горлую стеклянную колбу на 250 мл, снабженную механической лопастной мешалкой, термометром и холодильником. Смесь доводят до кипения с обратным холодильником при перемешивании и поддерживают такие условия в течение 48 ч.
После охлаждения до комнатной температуры добавляют 100 мл (100 ммоль) 1N HCl, смесь перемешивают и экстрагируют толуолом в делительной воронке, отделяя органическую фазу от водной фазы. Растворитель удаляют из органической фазы при пониженном давлении, получая в результате белое твердое вещество.
Высушенный продукт перекристаллизовывают из метанола. Получают 8,10 г (выход 51,3%) продукта 5,11,17,23,29,35,41,47-окта-трет-бутил-49,50,51,52,53,54,55,56-окта[4-(метоксикарбонил)бензилокси]каликс[8]арена (6).
ПРИМЕР 4: ПОЛУЧЕНИЕ ГИДРИРОВАННОГО ИЗОПРЕН-СТИРОЛЬНОГО ЗВЕЗДООБРАЗНОГО ПОЛИМЕРА ИЗ КАЛИКСАРЕНА ФОРМУЛЫ (6)
В атмосфере инертного газа (50 кПа, N2) вводят 8 кг безводного циклогексана в 15-литровый реактор, снабженный нагревательной рубашкой и мешалкой. Затем добавляют 47 г стирола и 1,2 г тетрагидрофурана. Далее раствор термостатируют при 40°C. По достижении указанной температуры добавляют 0,82 г н-бутиллития в циклогексановом растворе (12,80 ммоль). Через 20 мин. по завершении конверсии стирола добавляют 423 г изопрена. Через 30 мин по завершении конверсии изопрена добавляют 1,99 г (0,800 ммоль) каликсарена формулы (6) в тетрагидрофурановом растворе. Затем реакционную смесь выдерживают при температуре 40°C в течение 45 мин. Затем смесь переносят, еще в атмосфере инертного газа, в другой 15-литровый реактор, снабженный нагревательной рубашкой и мешалкой, который подготовлен для гидрирования. Добавляют 1,61 г бутилэтилмагния в виде гептанового раствора и 1,22 г дихлорида бис-циклопентадиенилтитана в виде циклогексановой суспензии. Далее в реакторе с раствором создают давление водорода (1,5 МПа) и выдерживают раствор при температуре 120°C и перемешивании в течение 1,5 ч. Далее раствор переносят в бак, добавляют антиоксиданты (2,6 г Irganox 565 и 17,0 г Irgafos 168) и затем переносят в зачистную систему, где удаляют растворитель при помощи пара; затем результирующий гранулированный продукт сушат в вакуумной печи.
Характеристики результирующего гидрированного звездообразного полимера показаны в таблице 1.
ПРИМЕР 5: ПОЛУЧЕНИЕ ГИДРИРОВАННОГО БУТАДИЕН-СТИРОЛЬНОГО ЗВЕЗДООБРАЗНОГО ПОИМЕРА ИЗ КАЛИКСАРЕНА ФОРМУЛЫ (6)
В атмосфере инертного газа (50 кПа, N2) вводят 8 кг безводного циклогексана в 15-литровый реактор, снабженный нагревательной рубашкой и мешалкой. Затем добавляют 47 г стирола и 95 г тетрагидрофурана. Далее раствор термостатируют при 40°C. По достижении указанной температуры добавляют 0,82 г н-бутиллития в циклогексановом растворе (12,80 ммоль). Через 20 мин. по завершении конверсии стирола, добавляют 423 г 1,3-бутадиена. Через 30 мин по завершении конверсии бутадиена добавляют 1,99 г (0,800 ммоль) каликсарена формулы (6) в тетрагидрофурановом растворе. Затем реакционную смесь выдерживают при температуре 40°C в течение 45 мин.
Далее раствор, еще в атмосфере инертного газа, переносят в другой 15-литровый реактор, снабженный нагревательной рубашкой и мешалкой, который подготовлен для гидрирования. Добавляют 1,61 г бутилэтилмагния в гептановом растворе и 1,22 г дихлорида бис-циклопентадиенилтитана в виде циклогексановой суспензии. Затем в реакторе со смесью создают давление водорода (1,5 МПа) и выдерживают смесь при температуре 120°C и перемешивании в течение 1 ч. Далее раствор переносят в бак, добавляют антиоксиданты (2,6 г Irganox 565 и 17,0 г Irgafos 168) и затем переносят в зачистную систему, где удаляют растворитель при помощи пара; затем результирующий гранулированный продукт сушат в вакуумной печи.
Характеристики результирующего гидрированного звездообразного полимера показаны в таблице 2.
ПРИМЕР 6: ПОЛУЧЕНИЕ ГИДРИРОВАННОГО ЗВЕЗДООБРАЗНОГО ПОЛИБУТАДИЕНА ИЗ КАЛИКСАРЕНА ФОРМУЛЫ (6)
В атмосфере инертного газа (50 кПа, N2) вводят 8 кг безводного циклогексана в 15-литровый реактор, снабженный нагревательной рубашкой и мешалкой. Затем добавляют 500 г 1,3-бутадиена и 95 г тетрагидрофурана. Далее раствор термостатируют при 40°C. По достижении указанной температуры добавляют 0,82 г н-бутиллития в циклогексановом растворе (12,80 ммоль). Через 20 мин. по завершении конверсии бутадиена добавляют 1,99 г (0,800 ммоль) каликсарена формулы (6) в тетрагидрофурановом растворе. Затем реакционную смесь выдерживают при температуре 40°C в течение 45 мин.
Далее раствор, еще в атмосфере инертного газа, переносят в другой 15-литровый реактор, снабженный нагревательной рубашкой и мешалкой, который подготовлен для гидрирования. Добавляют 1,61 г бутилэтилмагния в гептановом растворе и 1,22 г дихлорида бис-циклопентадиенилтитана в виде циклогексановой суспензии. Затем в реакторе со смесью создают давление водорода (1,5 МПа) и выдерживают смесь при температуре 120°C и перемешивании в течение 1 ч. Далее раствор переносят в бак, добавляют антиоксиданты (2,6 г Irganox 565 и 17,0 г Irgafos 168) и затем переносят в зачистную систему, где удаляют растворитель при помощи пара; затем результирующий гранулированный продукт сушат в вакуумной печи.
Характеристики результирующего гидрированного звездообразного полимера показаны в таблице 2.
ПРИМЕР 7: СИНТЕЗ КАЛИКСАРЕНА ФОРМУЛЫ (8)
Каликс[8]ареновое производное, которое, согласно еще одному предпочтительному варианту настоящего изобретения, можно применять для синтеза звездообразных полимеров, представляет собой 5,11,17,23,29,35,41,47-окта-трет-бутил-49,50,51,52,53,54,55,56-окта(3-триэтоксисилилпропокси)каликс[8]арен, который можно представить структурой (8):

Вводят 8,25 г (6,36 ммоль) пара-трет-бутилкаликс[8]арена (2), синтез которого описан в примере 1, 13,3 мл (153 ммоль) бромаллила, 4,3 г (76 ммоль) KOH, 2 мл PEG 600, 20 мл дистиллированной воды и 20 мл дихлорметана в 3-горлую стеклянную колбу на 100 мл, оснащенную мешалкой, термометром и холодильником. Смесь хранят в инертной атмосфере и при комнатной температуре в течение 24 ч. Добавляют 100 мл (100 ммоль) 1N HCl, смесь перемешивают и переносят в делительную воронку, где органическую фазу экстрагируют хлороформом, отделяя ее от водной фазы. Растворитель удаляют при пониженном давлении, получая в результате белое твердое вещество. Высушенный продукт перекристаллизовывают из метанола.
Получают 5,96 г (выход 58%) продукта 5,11,17,23,29,35,41,47-окта-трет-бутил-49,50,51,52,53,54,55,56-октааллилоксикаликс[8]арена (7). В инертной атмосфере вводят 5,96 г (3,69 ммоль) 5,11,17,23,29,35,41,47-окта-трет-бутил-49,50,51,52,53,54,55,56-октааллилокси-каликс[8]арена (7), 8,16 мл (44,28 ммоль) триэтоксисилана, 100 мг (0,19 ммоль) гексагидрата дигидрогексахлорплатината(VI) и 50 мл толуола в 3-горлую стеклянную колбу на 100 мл, оснащенную мешалкой, термометром и холодильником. Смесь доводят до кипения с обратным холодильником при перемешивании и поддерживают такие условия в течение 16 час.
Смесь фильтруют в горячем состоянии и присутствующий в фильтрате растворитель удаляют при пониженном давлении. Высушенный продукт перекристаллизовывают из гептана. Получают 7,55 г (выход 70%) продукта 5,11,17,23,29,35,41,47-окта-трет-бутил-49,50,51,52,53,54,55,56-окта(3-триэтоксисилилпропокси)каликс[8]арена (8).
ПРИМЕР 8: ПОЛУЧЕНИЕ ГИДРИРОВАННОГО ИЗОПРЕН-СТИРОЛЬНОГО ЗВЕЗДООБРАЗНОГО ПОИМЕРА ИЗ КАЛИКСАРЕНА ФОРМУЛЫ (8)
В атмосфере инертного газа (50 кПа, N2) вводят 8 кг безводного циклогексана в 15-литровый реактор, снабженный нагревательной рубашкой и мешалкой. Затем добавляют 47 г стирола и 1,2 г тетрагидрофурана. Далее раствор термостатируют при 40°C. По достижении указанной температуры добавляют 0,82 г н-бутиллития в циклогексановом растворе (12,80 ммоль). Через 20 мин по завершении конверсии стирола добавляют 423 г изопрена. Через 30 мин по завершении конверсии изопрена добавляют 1,56 г (0,533 ммоль) каликсарена формулы (8) в тетрагидрофурановом растворе. Затем реакционную смесь выдерживают при температуре 40°C в течение 1 ч.
Далее раствор, еще в атмосфере инертного газа, переносят в другой 15-литровый реактор, снабженный нагревательной рубашкой и мешалкой, который подготовлен для гидрирования. Добавляют 1,61 г бутилэтилмагния в гептановом растворе и 1,22 г дихлорида бис-циклопентадиенилтитана в виде циклогексановой суспензии. Затем в реакторе со смесью создают давление водорода (1,5 МПа) и выдерживают смесь при температуре 120°C и перемешивании в течение 1,5 ч. Далее раствор переносят в бак, добавляют антиоксиданты (2,6 г Irganox 565 и 17,0 г Irgafos 168) и затем переносят в зачистную систему, где удаляют растворитель при помощи пара; затем результирующий гранулированный продукт сушат в вакуумной печи.
Характеристики результирующего гидрированного звездообразного полимера показаны в таблице 1.
ПРИМЕР 9: СИНТЕЗ КАЛИКСАРЕНА ФОРМУЛЫ (12)
Каликс[8]ареновое производное, которое, согласно еще одному предпочтительному варианту настоящего изобретения, можно применять для синтеза звездообразных полимеров, представляет собой 5,11,17,23,29,35,41,47-октаметоксикарбонил-49,50,51,52,53,54,55,56-окта[4-(метоксикарбонил)бензилокси]каликс[8]арен, который можно представить структурой (12):

В инертной атмосфере вводят 4,10 г (4,83 ммоль) каликс[8]арена (3), синтез которого описан в примере 1, 60,8 г (443 ммоль) гексаметилентетрамина (ГМТА) и 450 мл трифторуксусной кислоты 3-горлую колбу на 2 л, оснащенную механической лопастной мешалкой, термометром и холодильником. При перемешивании доводят температуру смеси до 140°C и поддерживают такие условия в течение 5 ч.
Добавляют 500 мл (100 ммоль) 1N HCl и 500 мл CHCl3, смесь перемешивают и органическую фазу отделяют от водной фазы в делительной воронке. Растворитель удаляют при пониженном давлении и результирующее твердое вещество перекристаллизовывают из дихлорметана.
Получают 3,63 г (выход 70%) продукта 5,11,17,23,29,35,41,47-октаформилкаликс[8]арена (9) в виде темно-желтого твердого вещества.
В инертной атмосфере вводят 3,63 г (3,38 ммоль) 5,11,17,23,29,35,41,47-октаформилкаликс[8]арена (9) в 60 мл ДМСО и 50 мл дистиллированной воды в 3-горлую стеклянную колбу на 500 мл, оснащенную механической лопастной мешалкой, термометром и холодильником. Затем добавляют к смеси 0,48 г (4,04 ммоль) NaH2PO4 и по капле за 3 час. раствор 10 г (111 ммоль) NaClO2 в 50 мл дистиллированной воды. Реакционную смесь оставляют на 12 ч при комнатной температуре и перемешивании. Добавляют 50 мл (примерно 500 ммоль) конц. HCl. Доводят температуру реакционной смеси до 5°C и оставляют в таких условиях на 12 ч, образующееся твердое вещество отфильтровывают, промывают дистиллированной водой и метанолом и затем сушат.
Получают 2,44 г (выход 60%) продукта 5,11,17,23,29,35,41,47-октагидроксикарбонилкаликс[8]арена (10) в виде коричневого твердого вещества.
В инертной атмосфере вводят 2,44 г (2,03 ммоль) 5,11,17,23,29,35,41,47-окта(гидроксикарбонил)каликс[8]арена (10), 1 мл (10 ммоль) концентрированной H2SO4 и 200 мл (5 моль) метанола в 3-горлую стеклянную колбу на 500 мл, оснащенную механической мешалкой, термометром и холодильником. Смесь доводят до кипения с обратным холодильником при перемешивании и оставляют на 24 ч в таких условиях. Растворитель удаляют при пониженном давлении и результирующее твердое вещество перекристаллизовывают из метанола и затем сушат.
Получают 2,58 г (выход 97%) продукта 5,11,17,23,29,35,41,47-октаметоксикарбонилкаликс[8]арена (11) в виде коричневого твердого вещества.
В инертной атмосфере вводят 2,58 г (1,97 ммоль) 5,11,17,23,29,35,41,47-октаметоксикарбонилкаликс[8]арена (11), 5,10 г (22,3 ммоль) 4-(бромметил)метилбензоата, 1,59 г (9,58 ммоль) KI, 4,11 г (9,58 ммоль) K2CO3 и 50 мл ацетона в 3-горлую колбу на 100 мл, оснащенную мешалкой, термометром и холодильником. Смесь доводят до кипения с обратным холодильником при перемешивании и выдерживают в течение 48 ч в таких рабочих условиях.
После охлаждения до комнатной температуры добавляют 50 мл (50 ммоль) 1N HCl, смесь перемешивают и экстрагируют толуолом в делительной воронке, отделяя органическую фазу от водной фазы. Растворитель удаляют при пониженном давлении, получая в результате коричневое твердое вещество. Высушенный продукт перекристаллизовывают из метанола.
Получают 2,72 г (выход 55,3%) продукта 5,11,17,23,29,35,41,47-октаметоксикарбонил-49,50,51,52,53,54,55,56-окта[4-(метоксикарбонил)бензилокси]каликс[8]арена (12).
ПРИМЕР 10: ПОЛУЧЕНИЕ ГИДРИРОВАННОГО ИЗОПРЕН-СТИРОЛЬНОГО ЗВЕЗДООБРАЗНОГО ПОЛИМЕРА ИЗ КАЛИКСАРЕНА ФОРМУЛЫ (12)
В атмосфере инертного газа (50 кПа, N2) вводят 8 кг безводного циклогексана в 15-литровый реактор, снабженный нагревательной рубашкой и мешалкой. Затем добавляют 47 г стирола и 1,2 г тетрагидрофурана. Далее раствор термостатируют при 40°C. По достижении указанной температуры добавляют 0,82 г н-бутиллития в циклогексановом растворе (12,80 ммоль). Через 20 мин по завершении конверсии стирола, добавляют 423 г изопрена. Через 30 мин по завершении конверсии изопрена добавляют 1,00 г (0,400 ммоль) каликсарена формулы (12) в тетрагидрофурановом растворе. Затем реакционную смесь выдерживают при температуре 40°C в течение 1 ч.
Далее раствор, еще в атмосфере инертного газа, переносят в другой 15-литровый реактор, снабженный нагревательной рубашкой и мешалкой, который подготовлен для гидрирования. Добавляют 1,61 г бутилэтилмагния в гептановом растворе и 1,22 г дихлорида бис-циклопентадиенилтитана в виде циклогексановой суспензии. Далее в реакторе с раствором создают давление водорода (1,5 МПа) и выдерживают раствор при температуре 120°C в течение 1,5 ч. Затем раствор переносят в бак, добавляют антиоксиданты (2,6 г Irganox 565 и 17,0 г Irgafos 168) и переносят в зачистную систему, где удаляют растворитель при помощи пара; затем результирующий гранулированный продукт сушат в вакуумной печи.
Характеристики результирующего гидрированного звездообразного полимера показаны в таблице 1.
ПРИМЕР 11: ПОЛУЧЕНИЕ ГИДРИРОВАННОГО БУТАДИЕН-СТИРОЛЬНОГО ЗВЕЗДООБРАЗНОГО ПОИМЕРА ИЗ КАЛИКСАРЕНА ФОРМУЛЫ (12)
В атмосфере инертного газа (50 кПа, N2) вводят 8 кг безводного циклогексана в 15-литровый реактор, снабженный нагревательной рубашкой и мешалкой. Затем добавляют 47 г стирола и 95 г тетрагидрофурана. Далее раствор термостатируют при 40°C. По достижении указанной температуры добавляют 0,82 г н-бутиллития в циклогексановом растворе (12,80 ммоль). Через 20 мин. по завершении конверсии стирола добавляют 423 г 1,3-бутадиена. Через 30 мин. по завершении конверсии бутадиена добавляют 1,00 г (0,400 ммоль) каликсарена формулы (12) в тетрагидрофурановом растворе. Затем реакционную смесь выдерживают при температуре 40°C в течение 1 ч.
Далее раствор, еще в атмосфере инертного газа, переносят в другой 15-литровый реактор, снабженный нагревательной рубашкой и мешалкой, который подготовлен для гидрирования. Добавляют 1,61 г бутилэтилмагния в гептановом растворе и 1,22 г дихлорида бис-циклопентадиенилтитана в виде циклогексановой суспензии. Затем в реакторе со смесью создают давление водорода (1,5 МПа) и выдерживают смесь при температуре 120°C и перемешивании в течение 1 ч. Далее раствор переносят в бак, добавляют антиоксиданты (2,6 г Irganox 565 и 17,0 г Irgafos 168) и затем переносят в зачистную систему, где удаляют растворитель при помощи пара; затем результирующий гранулированный продукт сушат в вакуумной печи.
Характеристики результирующего гидрированного звездообразного полимера показаны в таблице 2.
ПРИМЕР 12: СИНТЕЗ КАЛИКСАРЕНА ФОРМУЛЫ (16)
Каликс[8]ареновое производное, которое, согласно еще одному предпочтительному варианту настоящего изобретения, можно применять для синтеза звездообразных полимеров, представляет собой 5,11,17,23,29,35,41,47-окта(3-триэтоксисилилпропил)-49,50,51,52,53,54,55,56-окта(3-триэтоксисилилпропокси)каликс[8]арен, который можно представить структурой (16):

В инертной атмосфере вводят 4,10 г (4,84 ммоль) каликс[8]арена (3), синтез которого описан в примере 1, 10,1 мл (116 ммоль) бромаллила, 3,3 г (59 ммоль) KOH, 1,5 мл PEG 600, 15 мл дистиллированной воды и 15 мл хлороформа в 3-горлую колбу на 100 мл, оснащенную мешалкой, термометром и холодильником. Смесь хранят при комнатной температуре в течение 24 ч в инертной атмосфере. Добавляют 75 мл (75 ммоль) 1N HCl, смесь перемешивают и выполняют экстракцию хлороформом, отделяя органическую фазу от водной фазы, в делительной воронке. Растворитель удаляют при пониженном давлении, получая в результате белое твердое вещество.
Высушенный продукт перекристаллизовывают из метанола. Получают 4,07 г (выход 72%) продукта 49,50,51,52,53,54,55,56-октааллилоксикаликс[8]арена (13). В инертной атмосфере вводят 4,07 г (3,49 ммоль) 49,50,51,52,53,54,55,56-октааллилоксикаликс[8]арена (13) и 50 мл N,N-диэтиланилина в 3-горлую колбу на 100 мл, оснащенную мешалкой, термометром и холодильником. Смесь доводят до кипения с обратным холодильником при перемешивании и поддерживают такие условия в течение 2 ч. После охлаждения до комнатной температуры добавляют 250 мл льда и 250 мл (250 ммоль) 1N HCl.
Смесь фильтруют и твердый продукт перекристаллизовывают из 2-пропанола, получая в результате 3,01 г (выход 74%) 5,11,17,23,29,35,41,47-октааллил-каликс[8]арена (14).
В инертной атмосфере вводят 3,01 г (2,58 ммоль) 5,11,17,23,29,35,41,47-октааллилкаликс[8]арена (14), 7,5 мл (86 ммоль) бромаллила, 2,44 г (44 ммоль) KOH, 1 мл PEG 600, 10 мл дистиллированной воды и 10 мл хлороформа в 3-горлую колбу на 50 мл, оснащенную магнитной мешалкой, термометром и холодильником. Смесь хранят при комнатной температуре в течение 24 ч в инертной атмосфере. Добавляют 50 мл (50 ммоль) 1N HCl, смесь перемешивают и выполняют экстракцию хлороформом, отделяя водную фазу от органической фазы, в делительной воронке.
Растворитель удаляют при пониженном давлении, получая в результате белое твердое вещество. Высушенный продукт перекристаллизовывают из метанола.
Получают 2,61 г (выход 68%) продукта 5,11,17,23,29,35,41,47-октааллил-49,50,51,52,53,54,55,56-октааллилоксикаликс[8]арена (15). В инертной атмосфере вводят 2,61 г (1,75 ммоль) 5,11,17,23,29,35,41,47-октааллил-49,50,51,52,53,54,55,56-октааллилокси каликс[8]арена (15), 7,74 мл (42 ммоль) триэтоксисилана, 100 мг (0,19 ммоль) гексагидрата гидрогексахлорплатината(VI) и 50 мл толуола в 3-горлую стеклянную колбу на 100 мл, оснащенную мешалкой, термометром и холодильником. Смесь доводят до кипения с обратным холодильником при перемешивании и поддерживают такие условия в течение 16 ч. Смесь фильтруют в горячем состоянии и удаляют присутствующий в фильтрате растворитель при пониженном давлении.
Высушенный продукт перекристаллизовывают из гептана. Получают 5,05 г (выход 70%) продукта 5,11,17,23,29,35,41,47-окта(3-триэтоксисилилпропил)-49,50,51,52,53,54,55,56-окта(3-триэтоксисилилпропокси)каликс[8]арена (16).
ПРИМЕР 13: ПОЛУЧЕНИЕ ГИДРИРОВАННОГО БУТАДИЕН-СТИРОЛЬНОГО ЗВЕЗДООБРАЗНОГО ПОИМЕРА ИЗ КАЛИКСАРЕНА ФОРМУЛЫ (16)
В атмосфере инертного газа (50 кПа, N2) вводят 8 кг безводного циклогексана в 15-литровый реактор, снабженный нагревательной рубашкой и мешалкой. Затем добавляют 47 г стирола и 95 г тетрагидрофурана. Далее раствор термостатируют при 40°C. По достижении указанной температуры добавляют 0,82 г н-бутиллития в циклогексановом растворе (12,80 ммоль). Через 20 мин. по завершении конверсии стирола добавляют 423 г 1,3-бутадиена. Через 30 мин по завершении конверсии бутадиена добавляют 1,10 г (0,267 ммоль) каликсарена формулы (16) в тетрагидрофурановом растворе. Затем реакционную смесь выдерживают при температуре 40°C в течение 1 ч 15 мин.
Далее раствор, еще в атмосфере инертного газа, переносят в другой 15-литровый реактор, снабженный нагревательной рубашкой и мешалкой, который подготовлен для гидрирования. Добавляют 1,61 г бутилэтилмагния в гептановом растворе и 1,22 г дихлорида бис-циклопентадиенилтитана в виде циклогексановой суспензии. Затем в реакторе с раствором создают давление водорода (1,5 МПа) и выдерживают раствор при температуре 120°C и перемешивании в течение 1 ч. Далее раствор переносят в бак, добавляют антиоксиданты (2,6 г Irganox 565 и 17,0 г Irgafos 168) и затем переносят в зачистную систему, где удаляют растворитель при помощи пара; затем результирующий гранулированный продукт сушат в вакуумной печи.
Характеристики результирующего гидрированного звездообразного полимера показаны в таблице 2.
ПРИМЕР 14: ПОЛУЧЕНИЕ ВТОРОГО ГИДРИРОВАННОГО БУТАДИЕН-СТИРОЛЬНОГО ЗВЕЗДООБРАЗНОГО ПОИМЕРА ИЗ КАЛИКСАРЕНА ФОРМУЛЫ (16)
В атмосфере инертного газа (50 кПа, N2) вводят 8 кг безводного циклогексана в 15-литровый реактор, снабженный нагревательной рубашкой и мешалкой. Затем добавляют 47 г стирола и 95 г тетрагидрофурана. Далее раствор термостатируют при 40°C. По достижении указанной температуры добавляют 2,47 г н-бутиллития в циклогексановом растворе (38,56 ммоль). Через 20 мин по завершении конверсии стирола добавляют 423 г 1,3-бутадиена. Через 30 мин по завершении конверсии бутадиена добавляют 3,31 г (0,803 ммоль) каликсарена формулы (16) в тетрагидрофурановом растворе. Затем реакционную смесь выдерживают при температуре 40°C в течение 1 ч 15 мин.
Далее раствор, еще в атмосфере инертного газа, переносят в другой 15-литровый реактор, снабженный нагревательной рубашкой и мешалкой, который подготовлен для гидрирования. Добавляют 1,61 г бутилэтилмагния в гептановом растворе и 1,22 г дихлорида бис-циклопентадиенилтитана в виде циклогексановой суспензии. Далее в реакторе с раствором создают давление водорода (1,5 МПа) и выдерживают раствор при температуре 120°C и перемешивании в течение 1 ч. Далее раствор переносят в бак, добавляют антиоксиданты (2,6 г Irganox 565 и 17,0 г Irgafos 168) и затем переносят в зачистную систему, где удаляют растворитель при помощи пара; затем результирующий гранулированный продукт сушат в вакуумной печи.
Характеристики результирующего гидрированного звездообразного полимера показаны в таблице 2.
ТАБЛИЦА 1: ГИДРИРОВАННЫЕ ИЗОПРЕН-СТИРОЛЬНЫЕ ЗВЕЗДООБРАЗНЫЕ ПОЛИМЕРЫ И ИХ ХАРАКТЕРИСТИКИ
(a) значения, полученные методом ГПХ/УФ
ТАБЛИЦА 2: ГИДРИРОВАННЫЕ БУТАДИЕН-СТИРОЛЬНЫЕ И БУТАДИЕНОВЫЕ ЗВЕЗДООБРАЗНЫЕ ПОЛИМЕРЫ И ИХ ХАРАКТЕРИСТИКИ
(a) значения, полученные методом ГПХ/УФ
ПРИМЕРЫ 15-25: СМАЗОЧНЫЕ СОСТАВЫ
Готовят растворы звездообразных полимеров в базовом масле из группы I Solvent Neutral 150 (eni SN 150). Растворение проводят при нагревании базового масла до температуры 130°C, добавляя полимер и производя перемешивание при этой температуре до завершения растворения. В таблицах 3 и 4 показаны концентрации звездообразных полимеров в базовом масле. Применяя такие же рабочие условия, затем готовят растворы в базовом масле SN 150 коммерческого продукта Infineum Shellvis 260 (SV 260), который представляет собой гидрированный стирол-изопреновый звездообразный полимер с PDVB-ядром, и коммерческого продукта eni MX 4006, который представляет собой линейный этилен-пропиленовый сополимер. В таблице 5 показаны концентрации коммерческих полимеров в базовом масле.
Следующие параметры, показанные в таблицах 3, 4 и 5, определяют на растворах полимеров в базовом масле:
индекс стабильности к сдвигу (способ CEC-L-14-93);
загущающую способность.
Индекс стабильности к сдвигу определяют на растворе, состоящем из 10% масс. раствора полимера в базовом масле и 90% масс. базового масла SN 150.
Загущающую способность вычисляют как разницу между значением кинематической вязкости 1% масс. раствора полимера при 100°C в SN 150 и значением кинематической вязкости SN 150 масла при 100°C.
Используя концентрированные растворы полимеров в качестве присадок, улучшающих индекс вязкости, получают соответствующие смазочные моторные масла класса вязкости SAE 10W-40 указанного далее состава, выраженного в массовых процентах относительно смазочного масла:
базовые масла: 79,1% масс.;
комплект присадок (DI комплект): 13,8% масс.;
присадка, улучшающая индекс вязкости (VI): 7% масс.;
присадка, понижающая температуру застывания (PPD): 0,1% масс.
Также добавляют к смазке 50 миллионных долей (м.д.) ингибитора пенообразования.
Используемый комплект присадок представляет собой смесь следующих добавок: диспергаторы, детергенты, антиоксиданты и противоизносные присадки.
Определяют следующие параметры на смазочных маслах:
кинематическую вязкость при 100°C (способ ASTM D 445)
кинематическую вязкость при 40°C (способ ASTM D 445)
индекс вязкости (способ ASTM D 2270)
CCS вязкость при -25°C (способ ASTM D 5293)
MRV вязкость при -30°C (способ ASTM D 4684)
MRV предел текучести (способ ASTM D 4684)
процент потери вязкости при деполимеризации (способ CEC L-14-93)
индекс гелеобразования (способ ASTM D 5133)
температуру гелеобразования (способ ASTM D 5133)
HTHS вязкость (способ CEC L-36-90)
температуру застывания (способ ASTM D 6892)
высокотемпературные отложения (способ ASTM D 7097).
Результаты показаны в таблицах 3, 4 и 5.
ТАБЛИЦА 3: СМАЗОЧНЫЕ СОСТАВЫ С ГИДРИРОВАННЫМИ ИЗОПРЕН-СТИРОЛЬНЫМИ ЗВЕЗДООБРАЗНЫМИ ПОЛИМЕРАМИ
ТАБЛИЦА 4: СМАЗОЧНЫЕ СОСТАВЫ С ГИДРИРОВАННЫМИ БУТАДИЕН-СТИРОЛЬНЫМИ И БУТАДИЕНОВЫМИ ЗВЕЗДООБРАЗНЫМИ ПОЛИМЕРАМИ
ТАБЛИЦА 5: СМАЗОЧНЫЕ СОСТАВЫ С КОММЕРЧЕСКИМИ ПОЛИМЕРАМИ MX 4006 и SV 260
На основании результатов, представленных в таблицах 3, 4 и 5, ясно, что радиальные полимеры по настоящему изобретению с центральных ядром, состоящим из каликсаренов, обладают такими характеристиками, например, загущающей способностью, устойчивостью к механическому сдвигу, устойчивостью к окислению, устойчивостью к образованию отложений и низкотемпературным поведением, которые делают их в высокой степени пригодными для применения в смазочных маслах в качестве присадок, улучшающих индекс вязкости.
В частности, полимер (пример 4), применяемый в составе примера 16, полученный из каликсаренового ядра, с которым связаны 16 гидрированных изопрен-стирольных полимерных сегментов, демонстрирует устойчивость к механическому сдвигу (индекс стабильности к сдвигу, потерю вязкости при деполимеризации), которая лучше устойчивости коммерческого звездообразного продукта SV 260 (сравнительный пример 26), который получен из полимерных сегментов такого же типа, но с PDVB-ядром. Использование того же каликсарена из примера 4, но при введении 16 бутадиен-стирольных или полибутадиеновых полимерных сегментов, дает звездообразные полимеры (примеры 5 и 6), которые, будучи использованными в составах примеров 19 и 20, демонстрируют загущающую способность и значения устойчивости к механическому сдвигу, которые являются хорошими, но немного хуже значений, полученных в примере 16. Тем не менее предпочтительно использовать бутадиен, а не изопрен по причинам стоимости и коммерческой доступности. Кроме того, введение сополимеров, содержащих стирол (например, стирол-бутадиеновых), по каликсарену обеспечивает большую устойчивость к образованию отложений по сравнению с полидиеновыми сегментами (например, полибутадиеном).
Увеличение количества гидрированных полимерных сегментов одинаковой молекулярной массы, связанных с каликсареновым ядром, будь то полимеры из ряда бутадиен-стирольных сополимеров (примеры 19, 21 и 22) или из ряда изопрен-стирольных сополимеров (примеры 16, 17 и 18), дает значительное повышение загущающей способности за счет небольшого понижения устойчивости к механическому сдвигу. В частности, звездообразные полимеры (примеры 10 и 13), используемые в составах примеров 18 и 22 и, соответственно, содержащие 32 и 48 полимерных сегментов, имеют значения загущающей способности, более чем в два раза превышающие значения для коммерческого продукта eni MX 4006, линейного этилен-пропиленового сополимера, при сравнимых значениях устойчивости к механическому сдвигу.
Кроме того, при идентичной загущающей способности, чем больше количество полимерных сегментов, связанных с каликсареновым ядром, тем лучше устойчивость к механическому сдвигу. Это происходит потому, что полимер (пример 14), используемый в составе примера 23, содержащий 48 низкомолекулярных гидрированных бутадиен-стирольных полимерных сегментов, демонстрирует такую же загущающую способность, но существенно лучшую прочность на сдвиг, чем полимер (пример 5), используемый в составе примера 19, который составлен из 16 высокомолекулярных гидрированных бутадиен-стирольных полимерных сегментов.
Реферат
Изобретение относится к гидрированным полимерам с радиальной структурой, имеющим ядро, полученное из каликсаренов, и может быть применено в смазочных маслах в качестве присадок, улучшающих индекс вязкости. Получают гидрированные полимеры радиальной структуры, имеющие ядро из каликсаренов общей формулы (I), к которому присоединено некоторое количество P сегментов гидрированных линейных полимеров, выбранных из гидрированных гомополимеров или сополимеров сопряженных диенов, или гидрированных сополимеров указанных сопряженных диенов и моноалкениларенов и их смесей. Изобретение позволяет придавать загущающую способность, устойчивость к механическому сдвигу, термоокислительную стабильность, устойчивость к образованию отложений и проявлять низкотемпературное поведение. 4 н. и 19 з.п. ф-лы, 5 табл., 25 пр.
Формула
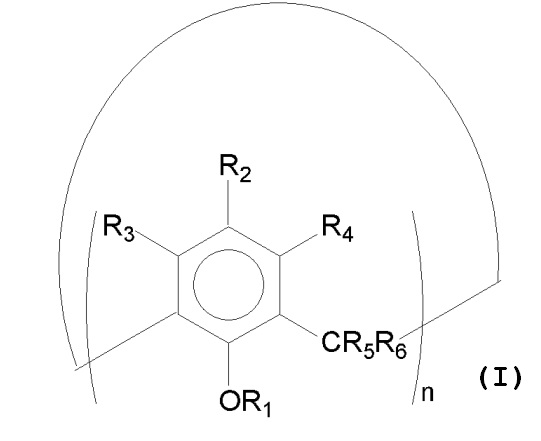

Комментарии