Композиционный эквивалент живой кожи, способ его получения, тест-набор - RU2135191C1
Код документа: RU2135191C1
Чертежи



Описание
Изобретение относится к композиционным эквивалентам живой кожи, в частности к композиционным эквивалентам живой кожи, включающим эпидермальный слой культивированных кератиноцитных клеток, слой беспористого коллагена высокой чистоты и дермальный слой культивированных фибробластовых клеток в пористой сшитой коллагеновой губке. Предметом изобретения является также способ получения такого композиционного эквивалента живой кожи.
Эквиваленты кожи широко используются не только в качестве заменителей человеческой кожи и кожи животных при трансплантации кожи, но и для определения влияния на кожу фармацевтических препаратов и косметических средств.
Главная проблема в испытании фармакологических, химических и косметических средств заключается в трудности определения эффективности их действия на кожу и их безопасности. Одним из преимуществ эквивалентов кожи в соответствии с настоящим изобретением является возможность их использования в качестве индикатора эффектов, вызываемых при воздействии этих веществ на испытуемую кожу в опытах in vitro.
И трансплантация кожи на обнаженных поверхностях, грануляционных ранах и при ожогах, несмотря на прогресс в этой области, и сейчас остается основной проблемой при лечении такого рода поражений. Аутотрансплантаты с расщеплением по толщине и эпидермальные аутотрансплантаты (культивированные аутогенные кератиноциты) использовались для этой цели с переменным успехом. Однако оба эти способа лечения имеют ряд недостатков. Так, например, аутотрансплантаты с расщеплением по толщине, как правило, нельзя использовать в случае ожоговых ранений с большой поверхностью (В А). Кроме того, они наносят вред пациенту, находят лишь ограниченно использование при лечении пациентов с Dystrophit Epidermolysis bullosa (DEB), обладают ограниченным расширением ткани, требуют повторных хирургических вмешательств и длительной госпитализации и вызывают нежелательные косметические эффекты.
Получение эпидермальных аутотрансплантатов требует длительного времени, они имеют низкую эффективность приживления порядка 30-50%, при их использовании часто образуются спонтанные пузыри, они хрупки, при работе с ними возникают трудности, сужаются до 60-70% от первоначального размера, уязвимы в течение примерно первых 15 дней после трансплантации и фактически неприменимы при лечении глубоких ран при одновременном поражении и дермиса, и эпидермиса.
Другим способом лечения является использование эпидермальных аллотрансплантатов (культивированных аллогенных кератиноцитов). Американские ученые добились определенных успехов при лечении пациентов с ожогами второй степени путем трансплантации на раны эпидермальных аллотрансплантатов. К преимуществам таких аллотрансплантатов относятся: возможность создания запасов таких трансплантатов, благодаря чему пациентам за один раз может быть пересажен материал в количестве, обеспечивающим перманентное лечение; исключение необходимости аутотрансплантации, применение которой увеличивает поверхность ран и приводит к появлению болезненных и легко подверженных инфекциям донорских мест; ожоговые раны, при лечении которых используются культивированные аллотрансплантаты, заживают так же быстро, как и ожоговые раны с пересаженными аутотрансплантами, и возможность лечения пациентов с ЕВ.
Тем не менее эпидермальным аллотрансплантатам присущи многие из недостатков эпидермальных аутотрансплантатов.
При ожоговых ранах на всю толщину кожи происходит разрушение и эпидермиса, и дермиса, и лечение с помощью культивированной кожи требует замены обоих этих компонентов. T.F. Наnsborough и S.Т. Boyce сообщили в TAMA 1989, 2125-2130, о нанесении аутоэпидермальных клеток на эквивалент кожи, который затем трансплантировали на рану. Главная трудность этого метода состоит в получении эквивалента кожи.
Кроме того, этот метод предполагает использование хондроитин-6-сульфата (GAG), который образует непрочную связь с коллагеном при нейтральных pH и поэтому может выделяться в свободном виде в среду раны, являясь причиной непредвиденно длительного заживания ран у человека. Согласно литературным данным, GAG увеличивает вероятность образования рубцов в ранах, что недопустимо при использовании трансплантатов. Другой эффект, вызываемый содержащими GAG коллагеновыми губками и заключающийся в снижении способности образования коллагеновых сгустков крови, можно считать нежелательным при лечении кровоточащих ран. Фибриновые сгустки способствуют адгезии трансплантата к ране.
И в случае этого метода стабилизация коллагеновой губки осуществляется путем сшивания ее 0,25% глутаровым альдегидом (GTA). Сшитый таким образом коллаген рессорбируется с меньшей скоростью и является стойким к бактериальным и грибковым инфекциям. Кроме того, уменьшается прорастание внутрь клеток, инфильтрация сшитой GTA коллагеновой матрицы. Коллаген, сшитый GTA, может удерживать его в виде высокомелккулярного полимера, который непрерывно гидролизуется с выделением мономерного, который может обнаруживаться в течение до 6 недель. Цитотоксическое действие GTA на фибробласты в тканевой культуре говорит о том, что он не является идеальным сшивающим агентом для эквивалентов кожи, поскольку в такие эквиваленты происходит инфильтрация клеток хозяина, а их бычья коллагеновая матрица быстро разрушается, и в результате выделяющийся в свободном виде попадает в жидкости организма.
Недавно Bell'om и др. (Tournae Investigative Dermatology, 1983, 81:2-10) была успешно осуществлена трансплантация крысам Sprague Dawleg, использующихся в качестве аллотрансплантатов трансплантатов эквивалента живой кожи, включающих дермальный слой фибробластовых клеток крысы в растворимом коллагене и эпидермальный слой культивированных кератиноцитов крысы. Гистологические исследования трансплантата показали, что произошла полная дефференциация эпидермального слоя с образованием десмосом, тонофиламентов, кератогиалина и пластины-основы. Однако попытки воспроизвести такой эквивалент живой кожи с использованием человеческих фибробастов и кератиноцитов имели лишь ограниченный успех. В этом случае не происходило полной дифференциации кератиноцитов с образованием пластины-основы, а дермоэпидермальная функция представляла собой прямую линию.
Проблемы, связанные с эпидермализацией поверхности вышеуказанного эквивалента кожи, привели к тому, что Bell модифицировал свой метод, использовав в качестве источника кератиноцитов биопсии кожи, как это описано в международной заявке PCT WO 86/02273. Недостаток этого модифицированного метода состоит в том, что полученный описанным образом эквивалент кожи неоднороден по поверхности, поскольку биопсия, включая дермальную часть, остается включенной в эквивалент. Кроме того, величина поверхности полученного таким образом заменителя кожи ограничивается количеством биопсий, которые могут быть взяты у одного человека. Взятие биопсии предполагает медицинскую процедуру, связанную с потенциальной опасностью инфекции и образования рубцов. Иссечение биопсий эквивалента кожи как способ увеличения производства дополнительных эквивалентов кожи требует больших затрат времени, и поэтому такие эквиваленты кожи не нашли применения в клинической практике. В 1988 г. в статье в журнале "Burns" Calounb и др. сообщили о полном отказе использования метода Bell'a.
Bernard и др., авторы австралийской заявки AU-A-13743/88, попытались избежать вышеуказанных недостатков путем использования культивирующей способности кератиноцитов, содержащихся в оболочке фолликул волос. Вместо биопсии кожи они использовали фолликулу волоса, заключенную в собственную оболочку, которую имплантировали в перпендикулярном направлении в свободную поверхность формируемого заменителя кожи. Основными недостатками указанного изобретения являются природа дермиса и тот факт, что период эпидермального роста может продолжаться несколько месяцев.
Наиболее близкий композиционный эквивалент живой кожи описан в публикации Boyсe et al, Surgery, vol. 10 N 4, 1988. В статье описано образование in vitro биологических соединений между кератиноцитами и коллагеновым и хондроитин-6-сульфатным дермальным заменителем кожи. Дермальные мембраны получают в виде родовых бесклеточных слоев и хранят в сухом состоянии в течение продолжительных периодов. Композитный материал имеет дискретные дермальные и эпидермальные отделения, имеет общую толщину, сравнимую с толщиной в разрезе полнослойного кожного лоскута, его можно использовать для лечения глубоких кожных повреждений.
Таким образом, существует необходимость в разработке трансплантатов эквивалентов живой кожи, включающих эпидермальный и дермальный слои, которые можно было бы легко получать и сохранять в количествах, достаточных для единоразового лечения кожных ран.
При создании эквивалента живой кожи желательно, чтобы он отвечал, по меньшей мере, некоторым или всем следующим требованиям: он должен быстро и в течение длительного времени сцепляться с поверхностью раны; должен быть совместимым с тканью; должен иметь внутреннюю, контактирующую с раной поверхность, способствующую прорастанию внутрь фиброваскулярной ткани, и/или должен обеспечивать защиту от инфекций и предупреждать потерю жидкости.
Задачей настоящего изобретения поэтому является создание культивированных эквивалентов живой кожи, которые отвечали бы, по меньшей мере, некоторым из перечисленных требований и которые не обладали бы или обладали в меньшей степени одним или несколькими из вышеперечисленных недостатков.
Одним из аспектов настоящего изобретения являются композиционные эквиваленты живой кожи, включающие эпидермальный слой культивированных кератиноцитных слеток, слой беспористого коллагена высокой чистоты и дермальный слой культивированных фибробластовых клеток в пористой сшитой коллагеновой губке.
Другим аспектом настоящего изобретения является способ получения композиционных эквивалентов живой кожи, включающий получение образца кожи; ферментативную обработку его для отделения эпидермиса от дермиса; ферментативную обработку эпидермиса для выделения в свободном виде кератиноцитных клеток; культивирование эпидермальных кератиноцитов до слияния; проводимую параллельно или отдельно фермантивную обработку дермиса для выделения в свободном виде фибробластовых клеток; культивирование фибробластовых клеток до субслияния; инокуляцию пористой сшитой коллагеновой губчатой мембраны культивированным фибробластовыми клетками; инкубацию инокулированной коллагеновой губки на ее поверхности для обеспечения роста фибробластовых клеток по всему объему коллагеновой губки; переворачивание коллагеновой губки и нанесение на другую ее сторону тонкого слоя беспористого, предпочтительно обработанного пепсином, колагена высокой чистоты с образованием слоистого губчатого комплекса; инкубацию полученного комплекса для обеспечения полимеризации беспористого коллагена; инокуляцию комплекса культивироваными кератиноцитными клетками и инкубацию композиционного комплекса - эквивалента коки для обеспечения роста клеток.
Первичную культуру фибробластов предпочтительно готовят следующим образом: получают дермальный образец, суспендируют его в растворе коллагеназы для выделения фибробластовых клеток, инкубируют полученную культуру, центрифугируют ее для отделения осадка клеток фибробласта, удаляют культуральную среду, промывают осадок клеток для удаления внешней культуральной среды, определяют количество клеток и их жизнеспособность, инокулируют колбы с культурой полученными клетками и проводят культивирование до субслияния.
Предпочтительным беспористым коллагеном высокой чистоты является коллаген типа 1, типа 3 или их смеси. Подходящим, например, является коллаген из бычьей шкуры, поставляемый Sigma.
Такой коллаген идеально очищается от антигенных веществ путем обработки его пепсином.
В качестве коллагеновой трубки можно использовать любую подходящую губку, например поставляемую фирмой Mitaplast.
Кератиноциты, предназначенные для осуществления настоящего изобретения, предпочтительно получать "Капельным" методом. По этому методу кератиноциты выделяют в свободном виде из эпидермиса для получения суспензии однородных клеток. Отдельные капли этой суспензии наносят равномерно пятнами на культуральную среду и проводят инкубацию, таким образом, чтобы происходило разрастание и в конечном счете отрастание клеток.
Ниже изобретение описывается с помощью неограничивающих его примеров и содержащихся в приложении рисунков, на которых
изображены:
фиг. 1 - схематическое представление способа получения композиционных эквивалентов живой кожи в соответствии с настоящим изобретением;
фиг. 2:
a) гистологический
вид эквивалента живой кожи, представленный в ежегодном отчете за 1987 г. Organogenesis Company, 150 Dan Road, Canton, Massachussetg 02021 USA, и для сравнения,
в) гистологический вид живой
кожи, как показано в вышеуказанном отчете;
фиг. 3 - гистология биопсии кожи из трансплантата с использованием эквивалента кожи в соответствии с настоящим изобретением;
фиг. 4
- композиционный эквивалент кожи в соответствии с настоящим изобретением;
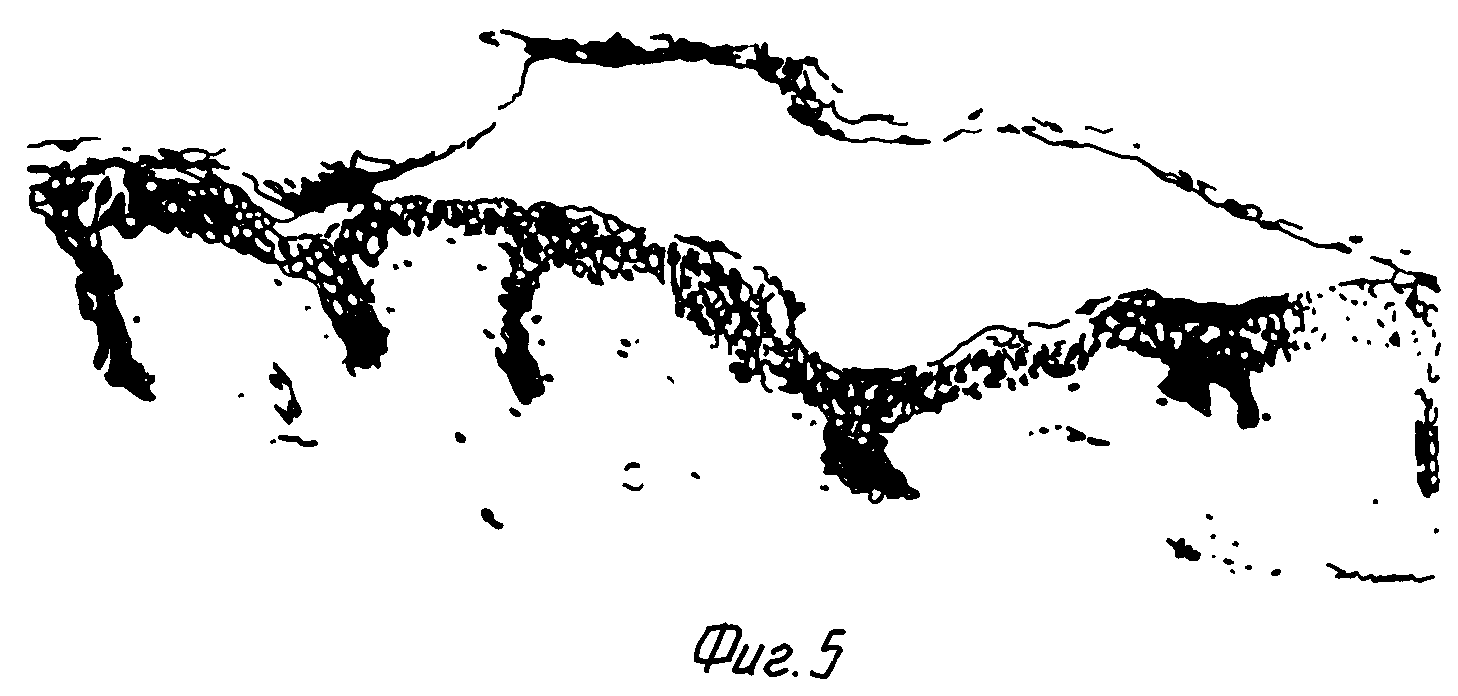
фиг. 5 - биопсия эквивалента кожи в трансплантате кожи, взятом у человека.
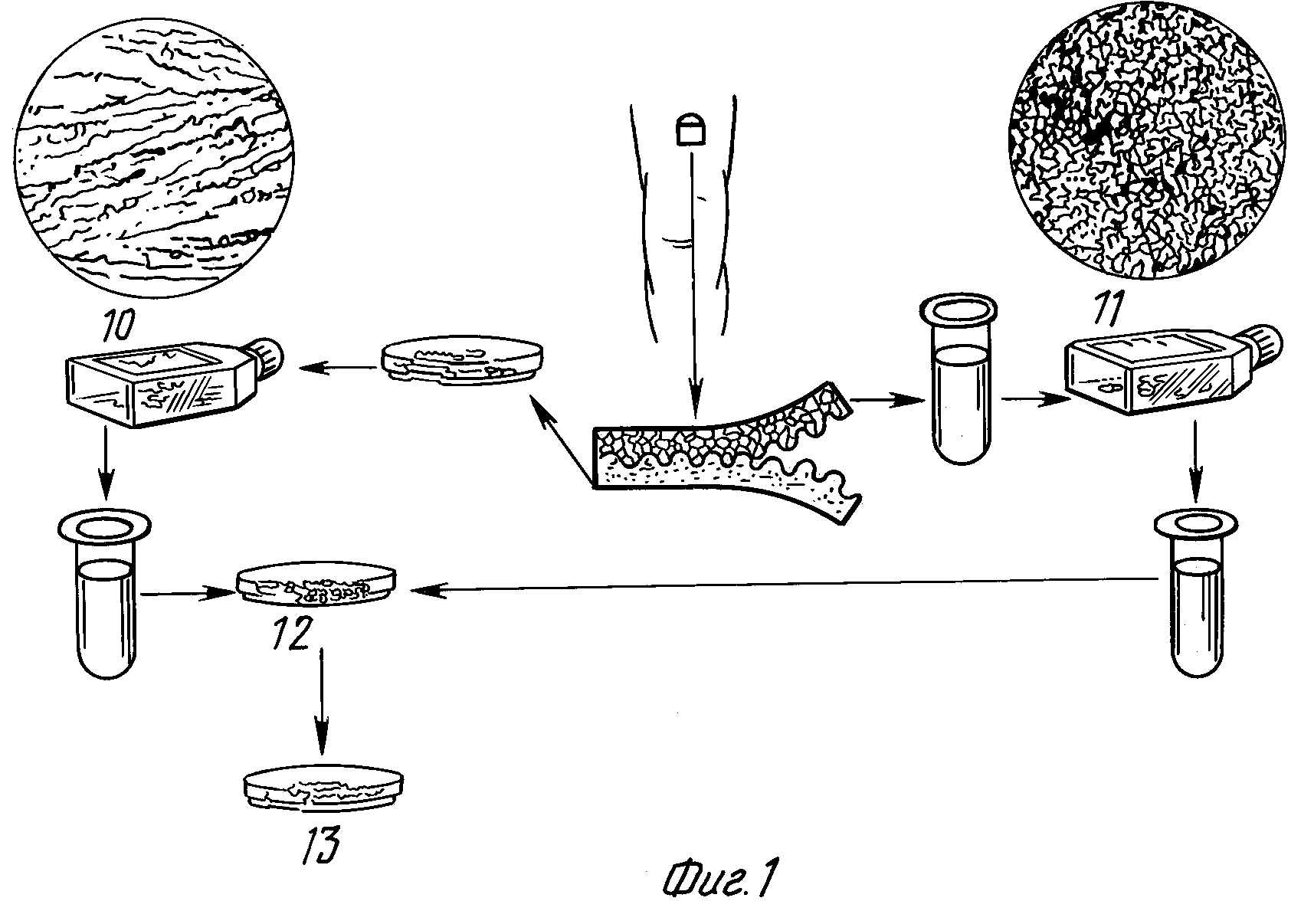
На фиг. 1 схематически изображен процесс получения композиционного эквивалента живой кожи.
В соответствии с изображенным на этом рисунке процессом образец кожи разделяют на дермис, предназначенный для использования в качестве источника фибробластов (10), и эпидермис, предназначенный для использования в качестве источника кератиноцитов (11). Культивированными фибробластами (10) инокулируют коллагеновую губку (12) и после образования на губке колоний фибробластов другую ее сторону инокулируют обработанным пепсином беспористым коллагеном. После повторной инкубации беспористый коллаген инокулируют кератиноцитной культурой, предпочтительно "Капельным" методом, и проводят культивирование, получая в результате эквивалент кожи (13).
Для осуществления настоящего изобретения можно использовать любые образцы кожи, на которых возможно выращивание известными способами культур клеток. Такие образцы кожи могут быть как аутогенными, так и аллогенными.
Образцы кожи обрабатывают трипсином для отделения эпидермиса от дермиса (1985) стр. 193). Отделенный эпидермис измельчают и обрабатывают трипсином для выделения кератиноцитных клеток. Полученные кератиноцитные клетки культивируют обычными методами до слияния. По предпочтительному варианту кератиноцитные клетки культивируют в виде моноклеточной суспензии до слияния.
Первичные культуры фибробластовых клеток для осуществления настоящего изобретения могут быть получены стандартными методами, например методом, описанным в статье "Aspecifiс collaqenase from Rabbit fibroblasts in monolayer cultyre" (Tornal of Biochemistry (1974) 137, 373-385). По предпочтительному варианту первичные культуры фибробластовых клеток получают следующим образом.
Дермальный образец нарезают кубиками со стороной 1 мм и суспендируют в растворе коллагеназы, буферированном буфером трис-HCl с pH 7,4. Образцы кожи могут быть как аллогенными, так и аутогенными. Подходящий коллагеназой является коллагеназа Clostridium histolyticum. Предпочтительно, чтобы концентрация суспензии образца кожи в растворе составляла 1 мкг/л. Приготовленную суспензию инкубируют и затем центрифугируют при 1500 об/мин для выделения клеток из раствора. Предпочтительно инкубацию суспензии проводят в течение 30 минут. Осадок клеток промывают DMEM и определяют количество фибробластовых клеток с помощью гемоцитометра. Жизнеспособность фибробластовых клеток определяют методом исключения красителя с использованием трипана голубого. Полученные фибробластовые клетки могут непосредственно вводиться в коллагеновые губки или ими засевают колбы с культурой и выращивают стандартными методами до субслияния. Поразительно, но этот метод приготовления первичных культур фибробластов занимает меньше времени (до 2 недель), чем другие известные методы, требующие до трех недель.
Совершенно удивительно, но вышеописанный метод позволяет культивировать и другие дермальные эпителиальные клетки, обладающие способностью развиваться в потовых железах, или другие типы клеток кожи.
Сшитые бычьи коллагеновые губчатые мембраны выпускаются промышленностью и хранятся в замороженном состоянии. Перед использованием губки промывают стерильной водой и обезвоживают при 37oC для уплотнения мембран.
Приготовленную таким образом коллагеновую губку инокулируют культивированными фибробластовыми клетками. По одному из вариантов осуществления губку инокулируют субконфлуентной клеточной культурой. Предпочтительно, чтобы концентрация фибробластового инокулята составляла примерно 4•105 клеток/мл.
Инокулированную губку культивируют стандартными методами для обеспечения роста фибробластовых клеток в объеме коллагеновой матрицы. По одному из вариантов инкубацию проводят при 37oC в атмосфере с концентрацией CO2 5% со 100%-ной влажностью в течение 10 дней в DMEM и кондиционированной среде.
DMEM и кондиционированную среду предпочтительно меняют через день. В качестве кондиционированной среды используют модифицированную по методу Дульбекко среду Игла (DMEM), использовавшуюся при культивировании человеческих кератиноцитов в течение 2 дней. Она содержит различные микромолекулы, выделяемые кератиноцитами, которые, как известно, стимулируют рост фибробластов. До использования такую кондиционированную среду можно хранить замороженной. Ее используют в комбинации со свежей DMEM в соотношении 1:2.
После этого губку переворачивают и на верхнюю сторону наносят слой обработанного пепсином беспористого коллагена. По одному из вариантов осуществления настоящего изобретения в качестве такого слоя используют обработанный пепсином (очищенный) беспористый стерильный бычий коллаген типа 1 или смесь бычьих коллагенов типов 1 и 3. Такой бычий коллаген выпускается промышленно в достаточно чистом виде. Для удаления телиопептидов его обрабатывают пепсином методом M. P. Drake, P.F. Davision и S. Bump (Biochemistry, 1966, 5: 301-312). pH раствора коллагена устанавливают нейтральным и стерилизуют с помощью гамма-излучения. Подходящей является концентрация коллагена в растворе 2 мг/мл. Коллаген наносят на губку в виде тонкой пленки и затем проводят инкубацию при 37oC в течение 60 минут до полной полимеризации коллагена.
Культивированные кератиноциты высевают затем на нанесенный слой. Предпочтительно осуществлять инокуляцию клеток путем нанесения капель среды с концентрацией 1•105 клеток в капле. Губку затем инкубируют в DMEM с добавкой 2% плодной бычьей сыворотки, человеческого эпидермального фактора роста 10 мг/мл, 0,4 мг/мл гидрокортизона и 10-9 М холерного токсина при pH 7,2 и 35oC в течение 10 дней.
В течение всего времени инкубации эквивалент кожи остается погруженным в вышеуказанную культуральную среду.
Перед клиническим применением или испытаниях in vitro полученного композиционного эквивалента живой кожи и культуральной среде добавляют среду без экстракта бычьего гипофиза.
Совершенно неожиданно оказалось, что при клиническом применении композиционный эквивалент кожи в соответствии с настоящим изобретением обеспечивает быструю нормализацию поверхности раздела между эпидермисом и дермисом пересаженных трансплантатов.
Гистологические исследования эквивалента кожи в соответствии с настоящим изобретением после 2 недель культивирования in vitro показали наличие многослойного эпидермиса, растущего на гомогенной мембране. Гистологические исследования бипосим эквивалента кожи в соответствии с настоящим изобретением, взятой через 2 недели после трансплантации, подтвердили образование stratum corneum с полностью кератинизированным эпидермисом, заселенным клетками невоспаленной соединительной ткани.
Существенным здесь является образование волнообразного и морфологически зрелого соединения между эпидермисом и дермисом видимого в электронном и оптическом микроскопах. При этом наблюдалось разобщение выступов и дермальных бугорков, что является характерным для нормальной кожи и имеет существенное значение для нормализации поверхности раздела между эпидермисом и дермисом.
Если культивировать эквивалент кожи вначале погруженным в течение 4 дней в модифицированную по способу Дульбекко культуральную среду Игла с концентрацией Ca++ 0,05• 10-3 М, а затем в течение 10 дней с эпидермисом, находящимся в этой же среде (межфазная граница воздух-жидкость), содержащей более высокую концентрацию Ca++ 0,05•10-3 M становится возможным выявить многослойный характерный эпидермис, состоящий из основного слоя клеток на хорошо развитом основном тонком слое и нескольких слоев надосновных клеток, свидетельствующих о начале кератинизации.
Описанная система in vitro близко напоминает по структуре и биосинтетической способности функционировать кожу человека и может использоваться для испытаний безопасности для кожи пестицидов и раздражающего действия на нее косметических композиций. Испытуемые вещества, будучи нанесены на поверхность этой системы, могут вызывать раздражение клеток и являются причиной выделения медиаторов воспалительной реакции, концентрация которых может быть измерена в культуральной жидкости. Эта система может оказаться подходящей для испытаний на цитотоксичность in vitro: определения общего содержания белка в клетках и поглощения нейтрального красного. Определенная концентрация белка в клетках дает возможность количественной оценки присутствия живых и мертвых клеток.
Культивирование эквивалента кожи может осуществляться в стеклянных колбах или чашках, в которые вводятся различные химикаты, испытуемые на их воздействие на культивированную кожу. Осуществляя непрерывную подачу соответствующей культуральной среды, можно обеспечить условия для непрерывного роста кожи в течение всего периода испытаний.
Коллагеновая губка играет роль временной матрицы, которая обеспечивает быстрое и длительное связывание композиционного эквивалента живой кожи с поверхностью раны человека или животного и их тесное контактирование, создавая благоприятные условия для фиброваскулярного прорастания со стороны поверхности раны и образования неодермальных структур. Коллагеновая матрица стареет и постепенно разрушается, заменяясь эндогенным каллогеном, образующимся в результате физического взаимодействия ее с фибробластами и частично биосинтеза. Однако, поскольку коллагеновые губки представляют собой сшитый коллаген, то они не сокращаются в размерах и поэтому могут храниться в течение некоторого времени. Они не сокращаются также при трансплантации их на раны.
Обработанный пепсином беспористый коллаген, будучи размещенным на верхней стороне коллагеновой губки, предохраняет последнюю от инвазии культивированными кератиноцитными клетками и тем самым обеспечивает внедрение эквивалента кожи в эпидермальный и дермальный слои. Этот ламинированный слой также постепенно разрушается, создавая тем самым возможность формирования нормальной поверхности раздела между дермисом и эпидермисом.
Композиционные эквиваленты живой кожи в соответствии с настоящим изобретением имеют толщину примерно 0,8 мм. Поэтому они прочнее эпидермальных трансплантатов, и с ними легче работать при их трансплантации. Степень эффективности эквивалентов кожи в соответствии с настоящим изобретением составляет примерно 90%, что можно приписать наличию в них дермального слоя, который способствует процессу васкуляризации трансплантата. И, наконец, композиционные эквиваленты живой кожи в соответствии с настоящим изобретением позволяют осуществлять пересадку трансплантата в один прием. Для облегчения транспортировки и нанесения композиционных эквивалентов живой кожи поверх культивированного трансплантата может быть размещена вазелиновая сетка.
Фибробласты и кератиноциты, используемые при осуществлении настоящего изобретения, могут быть аутогенными или аллогенными. Использование аллогенных клеток дает возможность получать и хранить эквиваленты живой кожи в соответствии с настоящим изобретением, благодаря чему исключаются задержки, связанные с доставлением трансплантатов для лечения ран. Оба типа клеток, кератиноциты и фибробласты, могут месяцами храниться в замороженном состоянии в виде моноклеточных суспензий с использованием известных способов. После оттаивания эти клетки сохраняют свою жизнеспособность и быстро растут в культуральной среде, и поэтому вполне могут использоваться для получения эквивалента кожи. Предлагаемый в соответствии с настоящим изобретением эквивалент кожи был успешно транспортирован добровольному пациенту. Поскольку при охлаждении подавляется иммуногенность трансплантатов кожи (Baldwin W.M. и др. Transplantation 1973; 15: 419-422), хранение при низких температурах аллогенных клеток способствует ослаблению некоторых нежелательных антигенов. Создание композиционных эквивалентов живой кожи для лечения поверхностных ран позволяет получать фактически неограниченные количества кожи для трансплантации в качестве материала для длительного покрытия ран.
Ниже изобретение описывается на приведенных примерах, в которых использовались аллогенные клетки кожи человека.
Пример 1.
Композиционные трансплантаты получали из отдельных культур аллогенных человеческих кератиноцитов (ЧК) и человеческих фибробластов (ЧФ), а также пористой бычьей коллагеновой мембраны. Для получения плоской поверхности для культивированных ЧК дермальную мембрану модифицировали, используя бычий коллаген типа 1.
Человеческую кожу получали из хирургических образцов, а именно путем натального иссечения крайней плоти. После иссечения кожу помещали в стерильный контейнер с модифицированной по методу Дульбекко средой Игла (DMEM). Образцы отправляли на короткое время в лабораторию тканевых культур, в которой эпидермис отделяли от дермиса ферментивным способом по методу M. Eisinger (Method in Skin Research, Editor D. Skerrow 1985, стр. 193).
Кератиноциты культивировали в виде моноклеточной суспензии по методу Eisinger, модифицированного следующим образом. ЧК культивировали в DMEM с добавкой 2% плодной бычьей сыворотки, эпидермального фактора роста, инсулина и гидрокортизона при pH 7,2. Слившиеся культуры были готовы для сбора через 12-14 дней и могли использоваться как субкультуры или для инокуляции на коллагеновой мембране.
Фибробласты выделяли из дермальных фрагментов путем ферментации последних Clostridium hislolyticum коллагеназой. Культивировали затем в DМЕМ стандартными методами.
Коллагеновые губчатые мембраны (диаметром 6 см), хранившиеся замороженными в чашках Петри, промывали стерильной водой и обезвоживали в целях уплотнения в инкубаторе при 37oC. После этого губки инкубировали в течение ночи в DMEM с добавкой кондиционированной среды. Субслившиеся культуры ЧФ высевали при концентрации 4•105 клеток/мл на ЧФ поверхность губки. Губку затем помещали в DMEM и выдерживали в инкубаторе в течение 10 дней при 37oC, концентрации диоксида углерода 5% и 100%-ной влажности.
Через день среду сменяли. В конце этого периода губки переворачивали и готовили беспористую поверхность для создания плоской поверхности для культивированных ЧК.
Ламинирование осуществляли путем нанесения тонкой пленки обработанного пепсином беспористого стерильного бычьего коллаген типа 1. Пленки получали из выпускаемого очищенного коллагена типа 1, обработанного пепсином для удаления телиопептидов и стерилизованного путем обработки гамма-излучением. pH раствора коллагена доводили до нейтрального значения и наносили в виде тонкой пленки на поверхность коллагеновой губки, после чего проводили инкубацию в течение 60 минут при 37oC.
Культивированные ЧК наносили затем каплями при концентрации 1•105 клеток в капле на беспористую поверхность губки и выдерживали в течение 10 дней в DMEM с вышеуказанными добавками. Перед клиническим использованием к культуре в чашках добавляли культуральную среду без экстракта бычьего гипофиза. Для облегчения транспортирования и закрепления трансплантата на ране поверх культивированного трансплантата наносили вазелиновую сетку.
В 8 операциях на 5 детях с использованием эквивалентов живой кожи в соответствии с настоящим изобретением степень эффективности составляла 90%.
Клинические и гистологические исследования этих трансплантатов, пересаженных в ходе восьми операций детям с RDEB, позволяли сделать вывод об отсутствии отторжения.
Тем не менее, в целях получения прямого доказательства длительного выживания культивированных аллотрансплантатов или их содействия перманентному эпителию были проведены клинические испытания на здоровых взрослых добровольцах, описанные в нижеследующем примере.
Пример 2.
Композиционные трансплантаты и аллотрансплантаты получали таким же образом, как это описано в примере 1. На плоскую поверхность субстрата из сшитого бычьего коллагена для культивированных кератиноцитов наносили человеческие кератиноциты. Приготовленный таким образом "сэндвич культивированной кожи" трансплантировали затем в раненое ложе пациентов. При этом коллагеновая матрица играла роль каркаса, обеспечивающего фиброваскулярное прорастание внутрь из глубины раны, благодаря чему создаются условия для выживания человеческих кератиноцитов и формирования неодермальной структуры.
Клинические исследования проводились на четырех добровольцах, которым удаляли декоративную татуировку. У каждого добровольца иссекали на руке четыре куска кожи. В двух местах кожу иссекали до жирового слоя, а в двух других местах иссечения оставляли дермальные элементы. В месте с иссечением на всю и неполную глубину трансплантировали культивированную кожу и аутотрансплантат кожи с расщеплением по толщине (для сравнения).
Раз в неделю, до полного заживления ран, делали перевязки. Раны фотографировали, брали биопсии для гистологических исследований и получения фингерпринта ДНК.
У добровольца 1 в двух местах была трансплантирована культивированная кожа, а в двух других - аутотрансплантаты. Через 2 недели трансплантаты фотографировали. При этом не было обнаружено их сокращения. В биопсиях центрального участка трансплантата наблюдался хорошо дифференцированный многослойный эпидермис, а в дермисе содержались многочисленные фибробласты и невоспаленные клетки, находящиеся в коллагеновой матрице с рыхлой упаковкой. На фиг. 3 и 5 показана гистология биопсии кожи из культивированного трансплантата через 2 недели после операции. На фиг. 4 показан эквивалент кожи перед трансплантацией. Из фингерпринта ДНК следует, что в данном случае имела место смешанная популяция клеток донора и реципиента. Это свидетельствует о том, что часть дермальных клеток происходит от пациентов, поскольку имело место явная дермальная клеточная насыщенность.
Доброволец 2. Трансплантат не принялся ни в одном из мест, через три недели были все гистологические признаки грануляционной раны.
Доброволец 3. Через 4 недели все трансплантаты зажили. При этом не происходило их сокращения. Данные гистологических исследований свидетельствуют о наличии полностью дифференцированного эпидермиса и насыщенного клетками дермиса. Из фингерпринта ДНК следует, что имела место смешанная популяция клеток донора и реципиента.
Доброволец 4. Через 8 недель трансплантат несколько сократился в размерах (примерно на 15-20%). Центральный участок трансплантата этого пациента имел полностью дифференцированный эпидермис и зрелый дермис без придатков.
Для специалиста в данной области ясно, что в рамках настоящего изобретения, помимо описанных, возможны самые различные модификации и варианты его осуществления.
Реферат
Композиционный эквивалент живой кожи включает эпидермальный слой культивированных кератиноцитовых клеток, слой беспористого коллагена и дермальный слой культивированных фибробластовых клеток в сшитой пористой коллагеновой губчатой матрице. Предпочтительно беспористым коллагеном является бычий коллаген типа 1, типа 3 или их смеси, обработанные пепсином. Описаны способ получения эквивалента кожи, а также тест-набор для испытаний in vitro эквивалента кожи. Технический результат: расширение функциональных возможностей за счет того, что указанный эквивалент кожи может использоваться для трансплантации кожи, а также для определения in vitro действия, оказываемого на кожу различными веществами. 3 с. и 5 з. п. ф-лы, 5 ил.
Формула
24.04.98 - по пп.1 - 4 и 6 - 8;
22.01.91 - по п.5.

Комментарии