Полимерный тканевый герметик - RU2453340C2
Код документа: RU2453340C2
Чертежи




Описание
Область техники
Настоящее изобретение относится к биоматериалам, в особенности к полимерным тканевым герметикам и молекулам предшественников, способным образовывать биоматериалы, в особенности к полимерным тканевым герметикам и способам их получения и использования. В частности, настоящее изобретение относится к биоматериалам, предназначенным для герметизации или блокирования разрывов, порезов или потертостей ткани.
Уровень техники
При проведении медицинских процедур в виде части хирургического вмешательства или лечения повреждения врач зачастую должен иметь дело с экстравазацией жидкостей организма, таких как спинномозговые жидкости во время хирургических операций на головном или спинном мозге или кровь, появляющаяся в результате повреждения, заболевания или расстройства или проведения оперативного вмешательства. Восстановление целостности ткани и кровообращения важно для достижения положительного результата лечения вне зависимости от того, было ли поражение результатом наличия повреждения или проведения оперативного вмешательства.
Самый старый способ соединения пораженных тканей заключается в использовании механических крепежных средств, таких как зажимы, скобки или лигатура. Исправление механических средств скрепления тканей ограничено. Механические крепежные средства требуют значительных профессиональных навыков, много времени для наложения и могут привести к протечке по линии соединения, что само по себе может привести к дополнительному травмированию окружающей ткани. Кроме того, механические крепежные средства могут оказаться неэффективными в ряде высоковаскуляризированных органов. Данные недостатки дополнительно увеличивают время оперативного вмешательства и реабилитации.
Попытки устранения данных недостатков в результате привели к разработке адгезивов, клеев или герметиков, способных быстро склеивать поверхности тканей друг с другом либо индивидуально, либо в комбинации с механическими крепежными средствами при одновременном промотировании или, по меньшей мере, без осложнения обычного лечения и уменьшении или предотвращении потери жидкостей организма.
Обычным классом тканевых адгезивов являются материалы на основе фибрина, которые содержат концентрат фибриногена и тромбина. Фибриновые адгезивы обычно представляют собой двухкомпонентные адгезивы, которые при перемешивании с источником кальция вступают в реакцию, моделируя последние стадии встречающегося в естественных условиях каскада тромбообразования. Получающийся в результате тромб пристает к ткани и образует перемычки между тканями, перекрывает зазоры и герметизирует ткань вплоть до появления возможности излечения. Однако успехи в использовании адгезивов на основе фибрина невелики вследствие низкой прочности герметизирующих материалов и риска трансфекции, связанной с использованием продуктов из человеческой крови.
Скромные успехи достигнуты также и в использовании клеев на желатиновой основе, сшитых альдегидом. Представителями данного класса клеев являются желатин-резорцин, сшитый формальдегидом (GRF) или глутаровым альдегидом (GRFG). Несмотря на обширные исследования клеев на желатиновой основе и демонстрацию ими в общем случае эффективности, успехи в использовании данных композиций невелики вследствие применения горячих желатиновых растворов, раздражения ткани, связанного с альдегидом, и критичности проводимых операций, необходимых для получения надлежащего сшивания на месте соединения.
Вследствие наличия вышеописанных ограничений значительные усилия по разработке были направлены на поиск подходящей для использования синтетической композиции, которая может быть использована в качестве тканевых клеев или герметиков. С ограниченным успехом с этой целью в качестве тканевых клеев или герметиков, помимо других синтетических полимеров, исследовались цианакрилаты, полиуретаны, полиметилметакрилаты и полиэтиленгликоли. Существует немного доступных тканевых клеев или композиций герметиков, которые соответствуют требованиям достаточной механической прочности и биосовместимости в дополнение к характеристикам проводимых операций, согласующихся с широким ассортиментом условий проведения оперативного вмешательства.
Однако данным композициям свойственны недостатки, касающиеся характеристик проводимых операций и механических свойств, таких как набухание биоматериала. Таким образом существует потребность в биоматериале, который может быть нанесен в виде тканевых клея или герметика, которые не только являются биосовместимыми, но также представляют собой хорошее средство лечения и демонстрируют наличие комбинации требуемых механических свойств.
Поэтому цель настоящего изобретения заключается в предложении композиций, способов и комплектов, подходящих для использования при получении синтетических биоматериалов, предназначенных для использования в качестве тканевого герметика. Дополнительная цель изобретения заключается в предложении синтетического биоматериала, предназначенного для использования в качестве тканевого герметика, который демонстрирует малое увеличение объема вследствие поглощения воды. Дополнительная цель изобретения заключается в предложении синтетического биоматериала, предназначенного для использования в качестве тканевого герметика, который с течением времени может полностью рассасываться. Дополнительная цель изобретения заключается в предложении синтетического биоматериала, характеризующегося хорошей механической прочностью для использования в качестве тканевого герметика. Дополнительная цель изобретения заключается в предложении синтетического биоматериала, который потенциально может быть использован в качестве вспомогательного средства при шовной пластике твердой мозговой оболочки в ходе проведения хирургической операции на черепе и уменьшает или предотвращает протечки спинномозговой жидкости во внешнюю среду.
Краткое изложение изобретения
В настоящем документе описываются композиции и способы получения биоматериалов, предназначенных для использования в качестве тканевых герметиков, комплекты, содержащие молекулы предшественников, образующие биоматериалы, и использование биоматериалов в условиях проведения оперативного вмешательства. Композиции, которые используются для получения биоматериалов, содержат, по меньшей мере, молекулы первого и второго предшественников. Молекула первого предшественника имеет, по меньшей мере, две нуклеофильные группы, а молекула второго предшественника имеет, по меньшей мере, две электрофильные группы. Нуклеофильные и электрофильные группы молекул первого и второго предшественников в физиологических условиях способны образовывать друг с другом ковалентные связи. Сшивание предпочтительно протекает в воде в основных условиях. Молекулы предшественников выбирают исходя из желательных свойств биоматериала. В одном варианте реализации молекула первого предшественника представляет собой полимер на основе поли(этиленгликоля), имеющий х нуклеофильных групп, выбираемых из группы, состоящей из тиольных или аминовых групп, где х является большим или равным 2. Предпочтительно х нуклеофильных групп являются тиольными группами. Предпочтительно молекула второго предшественника представляет собой многолучевой блок-сополимер сополи(этиленоксид-пропиленоксид) (ПЭО-ППО), функционализованный по каждому из своих лучей сопряженными ненасыщенными группами, и молекула второго предшественника описывается общей формулой I:
A-[(C3H6O)n-(C2H4O)m-B]i, (Формула I)
где m и n представляют собой целые числа в диапазоне от 1 до 200,
i является большим, чем 2, предпочтительно 3, 4, 5, 6, 7 или 8,
А представляет собой точку разветвления,
В представляет собой сопряженную ненасыщенную группу, например акрилат.
Такие полимеры продают в компании BASF под торговым обозначением Tetronic®.
В одном предпочтительном варианте реализации молекула первого предшественника представляет собой четырехлучевой поли(этиленгликоль) (ПЭГ), функционализованный по каждому из своих лучей тиольной группой (тетрасульфгидрил поли(этиленгликолевого) эфира пентаэритрита «ПЭГ-тетратиол»). В одном наиболее предпочтительном варианте реализации тетрасульфгидрил поли(этиленгликолевого) эфира пентаэритрита имеет молекулярную массу в диапазоне приблизительно от 2 до 20 кД, более предпочтительно в диапазоне приблизительно от 3 до 11 кД, а еще более предпочтительно в диапазоне приблизительно от 5 до 10 кД. В еще одном воплощении сопряженными ненасыщенными группами В молекулы второго предшественника являются акрилатные группы. Предпочтительно точку разветвления А молекулы второго предшественника выбирают из группы, состоящей из углерода, глицерина, пентаэритрита, дипентаэритрита и этилендиамина. Более предпочтительно точкой разветвления А молекулы второго предшественника является этилендиамин. Молекула второго предшественника, описывающаяся формулой I, имеет молекулярную массу в диапазоне приблизительно от 10 до 25 кД, более предпочтительно приблизительно от 12 до 20 кД, а еще более предпочтительно приблизительно от 14 до 18 кД. Предпочтительно каждый из лучей молекул первого или второго предшественников характеризуется одной и той же степенью полимеризации. Это значит то, что каждый луч молекул первого или второго предшественников имеет идентичную молекулярную массу.
Выбор молекул предшественников, где сумма количеств нуклеофильных и электрофильных групп является большей или равной пяти, в результате приводит к получению трехмерной сетки. Композиция необязательно содержит одну или несколько добавок, таких как красители, тиксотропные добавки, рентгеноконтрастные средства, наполнители, стабилизаторы или биологически активные компоненты. В одном предпочтительном варианте реализации композиция содержит краситель, выбираемый из группы, состоящей из метиленового синего, лиссаминового зеленого или прочного зеленого. Кроме того, композиция необязательно содержит основание. В одном варианте реализации основанием является карбонат натрия. В предпочтительном варианте реализации биоматериалы, полученные из композиций, используются для уменьшения, ингибирования или сдерживания потери жидкостей организма, такой как потеря спинномозговой жидкости после проведения хирургической операции на головном мозге и/или спинном мозге. В одном предпочтительном варианте реализации композиции используются в качестве медицинского герметика. В еще одном предпочтительном варианте реализации композиции используются для нанесения покрытия на поверхность ткани. В еще одном варианте реализации композиции используются при получении лекарственного препарата, предназначенного для реализации нехирургического прикрепления первой поверхности ко второй поверхности.
При получении биоматериалов настоящего изобретения способ получения биоматериала включает стадии:
i) получения молекулы первого предшественника,
ii) получения молекулы второго предшественника,
iii) проведения реакции между двумя молекулами предшественников в присутствии основного раствора для получения сшитой трехмерной сетки.
Предпочтительно основный раствор характеризуется значением рН в диапазоне от 9 до 14, более предпочтительно - от 10 до 13, а еще более предпочтительно - от 10 до 12. Для обеспечения быстрого прохождения гелеобразования значение рН раствора, получающегося в результате проведения каждой из стадий i), ii) или iii), предпочтительно находится в диапазоне от 9 до 13, более предпочтительно - от 9,5 до 11,5, а еще более предпочтительно - от 9,8 до 11. Предпочтительно основным раствором является раствор карбоната натрия. После введения двух молекул предшественников в контакт с основным раствором быстро образуется биоматериал, предпочтительно биоматериал образуется в течение менее, чем двух минут, более предпочтительно в течение менее, чем 10 секунд, а еще более предпочтительно в течение менее, чем 5 секунд.
Молекулы предшественников могут храниться раздельно в виде сухих порошков и/или в буферированных растворах, обычно характеризующихся кислотными значениями рН. В одном предпочтительном варианте реализации молекулу первого предшественника хранят в виде сухого порошка в первом контейнере, а молекулу второго предшественника хранят в водном буферированном растворе, характеризующемся кислотным значением рН, во втором контейнере. Необязательно основание может храниться в растворе в третьем контейнере. Молекулы предшественников перед использованием могут находиться в контакте в течение минут или часов. В одном варианте реализации молекулу первого предшественника и молекулу второго предшественника хранят раздельно и перемешивают только перед передачей получающейся в результате смеси в двухсекционный шприц. Одна секция шприца содержит смесь молекул предшественников, а другая секция содержит основный раствор. При получении биоматериала, демонстрирующего требуемые характеристики, важным параметром является контроль концентрации молекул предшественников перед сшиванием. Для сохранения данного контроля двухсекционный шприц может иметь две секции с предварительно определенным объемным соотношением. Предпочтительно соотношение между объемами секций составляет 1:5, а более предпочтительно 1:10. Большая секция содержит смесь молекул предшественников, а меньшая секция содержит основный раствор. Двухсекционный шприц снабжен съемной разбрызгивающей насадкой, и содержимое двух секций разбрызгивают совместно для получения «по месту» биоматериала, содержащего трехмерную сетку, на требуемом месте в организме.
Краткое описание чертежей
Фиг. 1 представляет собой линейный график сопоставления процентного набухания в зависимости от времени для представительных рецептур описанных биоматериалов и коммерчески доступного биоматериала при хранении в фосфатно-солевом буфере при 37°С.
Фиг. 2 представляет собой линейный график сопоставления процентного набухания в зависимости от времени для представительных рецептур описанных биоматериалов и коммерчески доступного биоматериала при хранении в фосфатно-солевом буфере при 50°С.
Фиг. 3 представляет собой влияние буфера на время гелеобразования для композиции 10, полученной с использованием буфера, содержащего ТЭА, при рН 7,4, 8 и 8,5.
Фиг. 4 представляет собой влияние буфера на время гелеобразования для композиции 13, полученной с использованием боратного буфера при рН 9,13, 9,32 и 9,47.
Подробное описание изобретения
Определения
Термины «биосовместимость» или «биосовместимый» в соответствии с общим использованием в настоящем документе относятся к способности материала реализовывать свою функцию при надлежащей реакции организма-хозяина в конкретной области применения. В наиболее широком смысле это соответствует отсутствию неблагоприятного влияния на организм таким образом, который бы для пациента перевешивал преимущества материала и/или лечения.
Термины «биоматериал» или «композиция» в соответствии с общим использованием в настоящем документе относятся к материалу, предназначенному для размещения в промежутке между биологическими системами предпочтительно для обследования, лечения или герметизации любых ткани, органа или функции организма. Биоматериалом называют полностью составленный материал (молекулы предшественников плюс все добавки, основание или растворители и биологически активные компоненты в случае присутствия таковых) во время и после достижения и прохождения его точки гелеобразования. Композицией называют полностью составленный материал до достижения его точки гелеобразования.
Термин «концентрация компонентов предшественников» в соответствии с использованием в настоящем документе относится к массовому проценту, который определяют как массу растворенного вещества в граммах, помноженную на 100 и поделенную на массу всего раствора в граммах (то есть сумму раствора и растворенного вещества): % (масс.) = масса растворенного вещества (100)/масса совокупного раствора.
Термин «сопряженная ненасыщенная связь» может относиться к чередованию как углерод-углеродных, так и углерод-гетероатомных или гетероатом-гетероатомных кратных связей с одинарными связями. Двойные связи, разделенные звеном СН или СН2, называются «гомосопряженными двойными связями».
Термин «сшивание» в соответствии с общим использованием в настоящем документе обозначает образование ковалентных связей.
Термин «плотность сшивания» в соответствии с использованием в настоящем документе обозначает среднюю молекулярную массу между двумя сшивками (Мс) соответствующих молекул.
Термин «электрофильная группа» в соответствии с использованием в настоящем документе относится к функциональным группам, которые способны акцептировать электронную пару у нуклеофила в реакции образования полярной связи. Термины электрофил и электрофильные группы используются синонимичным образом.
Термин «функциональность» в соответствии с общим использованием в настоящем документе обозначает количество реакционных центров в молекуле предшественника.
Термин «реакционные центры» относится к нуклеофильным и электрофильным группам, которые, по меньшей мере, способны вступать в реакцию друг с другом в условиях организма человека или животного.
Термин «гель» относится к состоянию вещества, промежуточному между жидким и твердым. Как таковой «гель» обладает некоторыми свойствами жидкости (то есть форма является эластичной и деформируемой) и некоторыми свойствами твердого вещества (то есть форма является достаточно дискретной для сохранения трехмерности на двумерной поверхности).
Термин «точка гелеобразования» в соответствии с использованием в настоящем документе относится к точке, в которой модуль вязкости и модуль упругости пересекаются, а вязкость увеличивается. Таким образом, точка гелеобразования представляет собой стадию, на которой жидкость начинает приобретать характеристики полутвердого вещества геля.
Термин «образование «по месту»» в соответствии с общим использованием в настоящем документе относится к способности смесей молекул предшественников, которые являются по существу несшитыми до и во время инъецирования, образовывать ковалентную связь друг с другом при физиологической температуре на месте инъецирования в организм.
Термин «молекулярная масса» в соответствии с использованием в настоящем документе относится к средневзвешенной молекулярной массе для ряда молекул в любом заданном образце, как это широко используется на современном уровне техники. Таким образом, образец ПЭГ 5000 может содержать статистическую смесь полимерных молекул в диапазоне масс, например, от 4000 до 6000 дальтонов (Д), при этом в пределах диапазона одна молекула несколько отличается от следующей. Приведение диапазона молекулярных масс свидетельствует о том, что средняя молекулярная масса может иметь любое значение в промежутке между указанными пределами и возможно включение отдельных молекул вне данных пределов. Таким образом, диапазон молекулярных масс от приблизительно 2000 Д до приблизительно 20000 Д указывает на среднюю молекулярную массу, равную, по меньшей мере, приблизительно 2000 Д и доходящую вплоть до приблизительно 20 кД.
Термин «полифункциональный» в соответствии с общим использованием в настоящем документе обозначает наличие в молекуле предшественника более, чем одной функциональной группы.
Термин «нуклеофильная группа» в соответствии с общим использованием в настоящем документе относится к функциональным группам, которые способны переносить электронную пару на электрофил при образовании полярной связи. Предпочтительно нуклеофил является в большей степени нуклеофилом, чем Н2О, при физиологическом значении рН. Примером сильного нуклеофила является тиол, и он же относится к молекулам, которые имеют данные функциональные группы. Термины нуклеофил и нуклеофильная группа используются синонимичным образом.
Термины «олигомер и полимер» используются в обычных значениях данных терминов. Олигомер представляет собой низкомолекулярный полимер. Олигомеры обычно содержат от двух до десяти мономерных звеньев. В соответствии с использованием в настоящем документе полимеры обычно содержат более, чем 10 мономерных звеньев.
Термин «полимер на основе поли(этиленгликоля)» относится к полимеру, у которого полимерная цепь или цепи полимера преимущественно, предпочтительно полностью, образованы из поли(этиленгликоля).
Термин «физиологический» в соответствии с использованием в настоящем документе обозначает условия, которые могут быть обнаружены в живых позвоночных животных. В частности, физиологические условия относятся к условиям, существующим в организме человека, таким как температура, рН и тому подобное. Физиологическая температура обозначает, в частности, температурный диапазон от 35°С до 42°С, предпочтительно приблизительно 37°С при атмосферном давлении.
Термин «полимерная сетка» в соответствии с использованием в настоящем документе относится к продукту способа, по которому по существу все мономеры, олигомеры или полимеры, использующиеся в качестве молекул предшественников, связываются межмолекулярными связями, предпочтительными ковалентными связями, по своим доступным функциональным группам с образованием макромолекулы.
Термин «молекулы предшественников» в соответствии с использованием в настоящем документе относится к молекулам, образующим полимерную сетку биоматериала. В отличие от полимерной сетки биоматериал может содержать добавки и биологически-активные компоненты. Молекулы предшественников могут быть выбраны из функционализованных мономеров, олигомеров и полимеров.
Термин «соответствующий партнер» в соответствии с использованием в настоящем документе обозначает партнера по реакции для заданной молекулы предшественника. Соответствующим партнером для электрофильной группы является нуклеофильная группа и наоборот.
Термин «самоселективная реакция» в соответствии с общим использованием в настоящем документе обозначает намного более быструю реакцию молекулы первого предшественника композиции с молекулой второго предшественника композиции и наоборот, чем с другими соединениями, присутствующими в композиции и/или на месте реакции. В соответствии с использованием в настоящем документе нуклеофильная группа молекулы первого предшественника предпочтительно связывается с электрофильной группой молекулы второго предшественника, а не с другими биологическими соединениями, а электрофильная группа молекулы второго предшественника предпочтительно связывается с нуклеофильной группой молекулы первого предшественника, а не с другими биологическими соединениями.
Термин «набухание» в соответствии с использованием в настоящем документе относится к поглощению воды биоматериалами настоящего изобретения. Это функция увеличения массы биоматериала при равновесном набухании, обычно после размещения биоматериала в избытке буфера ФСБ (10 ммоль/л фосфатно-солевого буфера, например, порошок Р3813 от компании Sigma приводит к получению буфера, содержащего 0,01 моль/л фосфата, 0,0027 моль/л хлорида калия и 0,138 моль/л хлорида натрия, рН 7,4). Обычно равновесное набухание достигается в течение 2 дней и определяется как время достижения биоматериалом своей максимальной массы до разложения биоматериала. Набухание измеряют в результате деления массы биоматериала при равновесном набухании на первоначальную массу биоматериала по истечении 10 минут после прохождения реакции сшивания. Термины «поглощение воды» и «набухание» по ходу изложения данной заявки используются синонимичным образом.
Термин «когезионная прочность» относится к способности биоматериалов настоящего изобретения оставаться неповрежденными, то есть не имеющими прорыва, разрыва или растрескивания, при воздействии физических напряжений или условий окружающей среды. Термины «когезионная прочность» и «сопротивление продавливанию» по ходу изложения данной заявки используются синонимичным образом.
Термин «адгезионная прочность» относится к способности биоматериалов настоящего изобретения иметь возможность оставаться прикрепленными к тканям на месте введения пациенту при воздействии физических напряжений или условий окружающей среды.
Композиции
Предлагается композиция, предназначенная для получения сшиваемого «по месту» биоматериала, который может быть предпочтительно использован для уменьшения, предотвращения или сдерживания потери жидкости в организме человека. Композиция содержит, по меньшей мере, молекулы первого и второго полифункциональных предшественников. Для получения композиции к молекулам предшественников необязательно могут быть добавлены добавки, красители и/или биологически активные компоненты. Композиция содержит молекулы предшественников плюс любые добавку и/или биологически активный компонент, и молекулы предшественников могут полимеризоваться «по месту» на требуемом месте в организме с образованием полимерной сетки биоматериала. Структуру молекул предшественников выбирают исходя из типа биоматериала, который будет желателен.
А. Предшественники
Молекула первого предшественника имеет, по меньшей мере, две нуклеофильные группы, а молекула второго предшественника имеет, по меньшей мере, две электрофильные группы. Молекулы первого и второго предшественников выбирают таким образом, чтобы нуклеофильные и электрофильные группы были бы способны образовывать друг с другом ковалентные связи в физиологических условиях или в основных условиях. Этого можно добиться по различным механизмам реакций. Одним механизмом реакций является реакция нуклеофильного замещения. В еще одном варианте реализации молекулы предшественников образуют ковалентные связи по реакции присоединения Михаэля между нуклеофильными группами или фрагментами молекулы первого предшественника и сопряженными ненасыщенными группами или фрагментами молекулы второго предшественника. Реакция присоединения Михаэля включает реакцию между нуклеофилом, таким как тиольная, аминовая или гидроксильная группы, и сопряженным ненасыщенным фрагментом, таким как α,β-ненасыщенный карбонилсодержащий фрагмент.
Примеры молекул предшественников включают нижеследующие, но не ограничиваются только этими: производные простых полиэфиров, такие как полиоксиалкилены или их производные, пептиды и полипептиды, поли(винилпирролидинон) («ПВП») и поли(аминокислоты). Предпочтительными производными полиоксиалкиленов являются полиэтиленгликоль («ПЭГ»), полипропиленоксид («ППО»), полиэтиленоксид («ПЭО»), сополи(этиленоксид-пропиленоксид) («ПЭО-ППО»), полиэтиленоксидные блочные или статистические сополимеры, полоксамеры, мероксаполы, полоксамины и поливиниловый спирт («ПВС»). Блок-сополимеры или гомополимеры (в случае А = В) могут быть линейными (типа АВ, АВА, АВАВА или АВСВА), звездообразными (AnB или BAnC, где В является, по меньшей мере, n-валентным, а n находится в диапазоне от 3 до 6) или разветвленными (несколько А, обуславливающихся одним В). Предпочтительные молекулы предшественников выбирают из ПЭГ и блок-сополимеров ПЭО-ППО. Наиболее предпочтительно ПЭГ и блок-сополимеры ПЭО-ППО используют в комбинации друг с другом. Предпочтительно молекулой первого предшественника является полимер на основе поли(этиленгликоля), имеющий х нуклеофильных групп, выбираемых из группы, состоящей из тиольных или аминовых групп, где х является большим или равным 2. Предпочтительно молекулой второго предшественника является многолучевой блок-сополимер сополи(этиленоксид-пропиленоксид) (ПЭО-ППО), описывающийся общей формулой (I):
A-[(C3H6O)n-(C2H4O)m-B]i, (Формула I)
где m и n представляют собой целые числа в диапазоне от 1 до 200,
i является большим, чем 2, предпочтительно 3, 4, 5, 6, 7 или 8,
А представляет собой точку разветвления,
В представляет собой сопряженную ненасыщенную группу.
Молекулами предшественников являются полифункциональные мономеры, олигомеры и/или полимеры. Предпочтительно молекулярная масса молекулы первого предшественника находится в диапазоне от 2 до 20 кД, более предпочтительно от 3 до 11 кД, наиболее предпочтительно от 5 до 10 кД. Предпочтительная молекулярная масса молекулы второго предшественника предпочтительно находится в диапазоне от 10 до 25 кД, более предпочтительно от 12 до 20 кД, наиболее предпочтительно от 14 до 18 кД.
Предпочтительно точку разветвления А молекулы второго предшественника выбирают из группы, состоящей из углерода, глицерина, пентаэритрита, дипентаэритрита и этилендиамина. В одном варианте реализации биоматериал получают из многолучевого блок-сополимера сополи(этиленоксид-пропиленоксида) (ПЭО-ППО), описывающегося формулой I, где А представляет собой молекулу этилендиамина (то есть i равен 4), а В представляет собой акрилатную группу (Tetronic®-тетраакрилат). Четырехлучевой блок-сополимер сополи(этиленоксид-пропиленоксид) (ПЭО-ППО), включающий в качестве ядра молекулу этилендиамина, продают в компании BASF под торговым обозначением Tetronic®. В одном дополнительном варианте реализации композиции содержат Tetronic®-тетраакрилат, имеющий молекулярную массу, равную приблизительно 15 кД, (Tetronic® 1107) и ПЭГ-тетратиол, имеющий молекулярную массу, равную приблизительно 10 кД. В еще одном варианте реализации биоматериал получают из Tetronic®-тетраакрилата, имеющего молекулярную массу, равную приблизительно 15 кД, и ПЭГ-тетратиола, имеющего молекулярную массу, равную приблизительно 5 кД. В еще одном предпочтительном варианте реализации биоматериал получают из Tetronic®-тетраакрилата, имеющего молекулярную массу, равную приблизительно 15 кД, и линейного функционализованного в концевых положениях ПЭГ-дитиола, имеющего молекулярную массу, равную приблизительно 3,4 кД. В еще одном другом варианте реализации Tetronic®-тетраакрилат сшивают дитиотреитолом (ДТТ). На механические характеристики биоматериала (то есть когезионную прочность и адгезионную прочность, набухание и время гелеобразования) влияние оказывают количество лучей из молекул предшественников и длина данных лучей. Большое количество лучей на каждой молекуле предшественника в результате будет приводить к получению более плотной сшитой сетки, характеризующейся повышенной когезионной прочностью. Однако рассасывание получающегося в результате биоматериала будет более длительным. Длина цепи молекулы первого предшественника оказывает влияние на набухание получающегося в результате биоматериала. Более длинные цепи поли(этиленгликоля) будут приводить к получению более набухаемого биоматериала.
Предпочтительно молекулы предшественников являются симметричными, что соответствует наличию у разветвлений одних и тех же молекулярной массы и структуры.
Сумма функциональности молекул первого и второго предшественников является большей или равной пяти. В одном варианте реализации молекула первого предшественника характеризуется функциональностью четыре, а молекула второго предшественника характеризуется функциональностью три. В еще одном варианте реализации молекула первого предшественника характеризуется функциональностью два, а молекула второго предшественника характеризуется функциональностью четыре. В еще одном другом варианте реализации одна из молекул предшественников характеризуется функциональностью, равной восьми и отличной от четырех. В еще одном другом варианте реализации обе молекулы предшественников характеризуются функциональностью, равной четырем и более. Небольшая и компактная молекула предшественника будет приводить к получению полимерной сетки, характеризующейся большей прочностью, чем в случае удлиненной молекулы предшественника, несмотря на возможную идентичность для обеих молекул функциональности и партнера по реакции.
В качестве общего руководства можно сказать то, что соотношение между компонентами первого и второго предшественников выбирают таким образом, чтобы большинство функциональных групп обоих компонентов вступало бы в реакцию с соответствующими партнерами. Соотношение между функциональными группами молекул первого и второго предшественников (то есть соотношение между электрофильными группами и нуклеофильными группами) находится в диапазоне от 0,7 до 1,2, более предпочтительно от 0,8 до 1,1, а наиболее предпочтительно равно 1 (то есть стехиометрическому соотношению).
а. Нуклеофильные группы
Нуклеофильные группы компонента первого предшественника способны вступать в реакцию с электрофильными группами, такими как сопряженные ненасыщенные группы, по различным механизмам реакций, предпочтительно самоселективно в организме человека, в результате прохождения реакции нуклеофильного замещения или присоединения типа Михаэля. Нуклеофилами, которые являются подходящими для использования, являются те, которые предпочтительно проявляют реакционную способность по отношению к сопряженным ненасыщенным группам по реакциям присоединения, в частности по самоселективной реакции присоединения типа Михаэля, в условиях, существующих в организме человека или животного. Реакционная способность нуклеофила зависит от типа ненасыщенной группы. Тип ненасыщенной группы, в первую очередь, определяется ее реакцией с водой при физиологическом значении рН. Таким образом, подходящие для использования нуклеофилы в общем случае являются в большей степени нуклеофилами, чем вода, при физиологическом значении рН. Подходящие для использования нуклеофилы включают нижеследующие, но не ограничиваются только этими: -SH, -NH2, -OH, -PH2 и -CO-NH-NH2.
Пригодность конкретных нуклеофилов для использования зависит от рассматриваемой ситуации и от желательной степени самоселективности. В предпочтительном варианте реализации нуклеофилом является тиол. Однако эффективными нуклеофилами также могут являться и амины и/или гидроксильные группы.
Особенное внимание обращают на значение рН в том смысле, что депротонированные амин или тиол являются намного более сильными нуклеофилами, чем протонированные амин или тиол. В силу этого при обращении особенного внимания на значение рК амина или тиола, использующихся в качестве сильного нуклеофила, может быть получена существенная самоселективность. Условия проведения реакции, при которых значение рН раствора близко к значению рК аминов или тиолов молекул предшественников, благоприятствуют прохождению реакции сопряженной ненасыщенной группой с введенными амином или тиолом, а не с другими нуклеофилами, присутствующими в системе.
Нуклеофильные группы могут иметься в молекулах, характеризующихся большой гибкостью совокупной структуры. Например, дифункциональный нуклеофил мог бы иметь форму Nuc-P-Nuc, где Р обозначает мономер, олигомер или полимер, а Nuc обозначает нуклеофил. Подобным же образом разветвленный полимер Р мог бы быть дериватизирован несколькими нуклеофилами для получения P-(Nuc)i, где I является большим, чем 1. Нуклеофил мог бы являться частью повторяющейся структуры, например (Р-Nuc)i. Очевидно то, что не все в Р или нуклеофилах в такой структуре должно быть идентичным.
Полиэтиленгликоли и их производные могут быть химически модифицированы для введения нескольких первичных аминовых или тиольных групп в соответствии со способами, приведенными, например, в главе 22 работы POLY(ETHYLENE GLYCOL) CHEMISTRY: BIOTECHNICAL AND BIOMEDICAL APPLICATIONS, J.Milton Harris, ed., Plenum Press, NY (1992). В наиболее предпочтительном варианте реализации тиол, имеющийся в концевых положениях молекулы первого предшественника, в полимеры на основе ПЭГ вводят в результате замещения концевых гидроксильных групп тиольной группой (SH). Таким образом, полученная молекула предшественника быстрее вступает в реакцию с молекулой второго предшественника, чем молекула предшественника, у которой тиольную группу вводят через меркаптопропионатную группу.
Различные формы полиаминового ПЭГ коммерчески доступны в компании Nektar Therapeutics, Inc. из Сан-Карлоса, Калифорнии (благодаря поглощения ею компании Shearwater Polymers из Хантсвилла, Алабама) и в компании Texaco Chemical Company из Хьюстона, Техас под обозначением «Jeffamine». Полиаминовые ПЭГ, подходящие для использования в настоящем изобретении, включают диамины (серия «D») и триамины (серия «Т») Jeffamine от компании Texaco, которые на одну молекулу имеют две и три первичные аминовые группы соответственно. В качестве синтетического полимера, имеющего несколько нуклеофильных групп, также могут быть использованы и полиамины, такие как этилендиамин (H2N-CH2CH2-NH2), тетраметилендиамин (H2N-(CH2)4-NH2), пентаметилендиамин (кадаверин) (H2N-(CH2)5-NH2), гексаметилендиамин (H2N-(CH2)6-NH2), бис(2-гидроксиэтил)амин (HN-(CH2CH2OH)2), бис(2-аминоэтил)амин (HN-(CH2CH2NH2)2) и трис(2-аминоэтил)амин (N-(CH2CH2NH2)3).
В качестве синтетического полимера, имеющего несколько нуклеофильных групп, также может быть использован и дитиотреитол (HS-CH2-CHOH-CHOH-CH2-SH).
Молекулы предпочтительных первых предшественников
В одном предпочтительном варианте реализации молекулой первого предшественника является ПЭГ-тетратиол, описывающийся формулой II:

где n находится в диапазоне от 25 до 60.
b. Электрофильные группы
Электрофильными группами молекулы второго предшественника предпочтительно являются сопряженные ненасыщенные группы. Структуры Р и сопряженные ненасыщенные группы могут быть подобны тем, которые были описаны ранее для нуклеофилов. Необходимо только, чтобы один электрофильный предшественник имел бы такие электрофильные группы в количестве, большем или равном двум. В одном варианте реализации электрофильными группами являются сопряженные ненасыщенные группы.
Реакции нуклеофильного присоединения, в частности реакции присоединения Михаэля, могут быть проведены для широкого ассортимента сопряженных ненасыщенных соединений. В структурах, продемонстрированных далее, мономерная, олигомерная или полимерная структура обозначены как Р. Далее в настоящем документе обсуждаются различные предпочтительные возможности для конкретного типа Р. Р может быть сочлененным с реакционно-способными сопряженными ненасыщенными группами, включающими нижеследующие, но не ограничивающимися только этими: те структуры, которые обозначены номерами от 1 до 20 в таблице 1.
Реакционно-способные двойные связи могут быть сопряженными с одной или несколькими карбонильными группами в линейной структуре кетона, сложного эфира или амида (1а, 1b, 2) или с двумя в кольцевой системе, как в случае малеиновых или парахиноидных производных (3, 4, 5, 6, 7, 8, 9, 10). В последнем случае кольцо может быть сконденсированным с образованием нафтохинона (6, 7, 10) или 4,7-бензимидазолдиона (8), и карбонильные группы могут быть превращены в оксим (9, 10). Двойная связь может быть сопряженной с гетероатом-гетероатомной двойной связью, так как в случае сульфона (11), сульфоксида (12), сульфоната или сульфонамида (13) или фосфоната или фосфонамида (14). В заключение, двойная связь может быть сопряженной с электронодефицитной ароматической системой, так как в случае иона 4-винилпиридиния (15). В сопряжении с карбонилом или кратными связями на гетероатомной основе могут быть использованы и тройные связи (16, 17, 18, 19, 20).
Структуры, такие как 1а, 1b и 2, в своей основе имеют сопряжение углерод-углеродной двойной связи с одной или двумя электроноакцепторными группами. Одной из них всегда является карбонил при увеличении реакционной способности при переходе от амидной к сложноэфирной, а затем к феноновой структуре. Нуклеофильное присоединение протекает легче при уменьшении стерических затруднений или увеличении электроноакцепторной способности в альфа-положении. Например, существует следующее соотношение: СН3
Более высокая реакционная способность, полученная при использовании последних двух структур, может быть промодулирована в результате варьирования объемности заместителей в бета-положении, где протекает нуклеофильная атака; реакционная способность уменьшается в порядке P
Структуры 3-10 проявляют очень высокую реакционную способность по отношению к нуклеофилам вследствие как наличия цис-конфигурации двойной связи, так и присутствия двух электроноакцепторных групп. Ненасыщенные кетоны вступают в реакцию быстрее, чем амиды или имиды, вследствие более сильной электроотрицательности данных карбонильных групп. Таким образом, циклопентендионовые производные вступают в реакцию быстрее, чем малеимидные (3), а парахиноны вступают в реакцию быстрее, чем малеиновые гидразиды (4) и циклогексаноны, вследствие более протяженного сопряжения. Наивысшую реакционную способность проявляют нафтохиноны (7). Р может быть размещен в тех положениях, в которых он не будет уменьшать реакционную способность ненасыщенной группы, то есть в противоположной части кольца (3, 5), на другом кольце (7, 8) или при наличии О-связи через пара-хинонмонооксим (9, 10). Для уменьшения скорости реакции нуклеофильного присоединения Р также может быть связан с реакционно-способной двойной связью (6, 8).
Активация двойных связей для нуклеофильного присоединения может быть получена благодаря использованию электроноакцепторных групп на гетероатомной основе. Собственно говоря, подобное электроноакцепторное поведение демонстрируют гетероатомсодержащие аналоги кетонов (11, 12), сложных эфиров и амидов (13, 14). Реакционная способность по отношению к нуклеофильному присоединению увеличивается при возрастании электроотрицательности группы. Таким образом, структуры описываются следующим соотношением 11>12>13>14, где 11 является наиболее электроотрицательным, а 14 является наименее электроотрицательным. Реакционная способность по отношению к нуклеофильному присоединению также увеличивается и благодаря наличию связи с ароматическим кольцом. Сильная активация двойных связей также может быть получена и при использовании электроноакцепторных групп на основе ароматических колец. Любая ароматическая структура, содержащая катион, подобный пиридинию (например, производные хинолина, имидазола, пиразина, пиримидина, пиридазина и подобные соединения, содержащие sp2-азот), сильно поляризует двойную связь и делает возможными быстрые присоединения типа Михаэля.
Углерод-углеродные тройные связи, сопряженные с электроноакцепторными группами на углеродной или гетероатомной основе, могут легко вступать в реакцию с серосодержащими нуклеофилами с образованием продуктов одинарного и двойного присоединения. На реакционную способность заместители оказывают влияние, подобное тому, которое имеет место и для обсуждавшихся ранее аналогичных соединений, содержащих двойные связи. В одном предпочтительном варианте реализации электрофильными группами являются акрилатные группы.
Молекулы предпочтительных вторых предшественников
В предпочтительном варианте реализации молекулой второго предшественника являются мономер, олигомер или полимер, которые содержат акрилат. В частности, вторым предшественником является соединение, соответствующее формуле Ia в качестве конкретного варианта реализации формулы I:

где n и m представляют собой целые числа в диапазоне от 1 до 200.
Предпочтительно n находится в диапазоне от 18 до 22, а m находится в диапазоне от 58 до 62.
Tetronic® представляет собой четырехфункциональный блок-сополимер на основе полиэтиленоксида и полипропиленоксида, доступный в компании BASF. Блок-сополимеры Tetronic® могут быть функционализованы сопряженными ненасыщенными группами, такими как акрилатные группы, в результате проведения реакции между свободными гидроксильными группами полимера и избытком акрилоилхлорида в присутствии основания. Подобным же образом может быть присоединена и другая электрофильная группа.
с. Добавки
Композиция может дополнительно содержать органические и/или неорганические добавки, такие как тиксотропные добавки, рентгеноконтрастное средство и/или флуоресцентные вещества, для того чтобы отслеживать эксплуатационные характеристики при применении или моментально обнаруживать потенциальную протечку в случае отсутствия простой видимости, стабилизаторы для стабилизации молекул предшественников во избежание прохождения преждевременной полимеризации и/или наполнители, которые могут привести в результате к улучшению механических свойств (например, предела прочности при сжатии и модуля Юнга Е) биоматериала в сопоставлении с механическими свойствами полимерной сетки. Примеры стабилизирующих добавок включают акцепторы радикалов, такие как бутилированный гидрокситолуол или дитиотреитол. В зависимости от области применения композиция (и, таким образом, биоматериал) может содержать краситель, предпочтительно органический краситель, такой как краска. В одном варианте реализации в качестве красителя добавляют метиленовый синий. Метиленовый синий не только выступает в роли красителя, но также может и играть роль стабилизатора для молекул акрилатсодержащего предшественника, исполняя функцию восстановителя. Он также может действовать в качестве индикатора образования дисульфида (поскольку он становится бесцветным при восстановлении). В еще одном варианте реализации в качестве красителя добавляют прочный зеленый. Еще одним предпочтительным красителем является лиссаминовый зеленый. Лиссаминовый зеленый и прочный зеленый представляют собой красители, которые обладают способностью изменять окраску в зависимости от значения рН раствора. Они имеют зеленую окраску в кислых условиях и синюю окраску в основных условиях. Поэтому данные два красителя демонстрируют наличие дополнительного преимущества, заключающегося в указании на хорошее перемешивание растворов молекул предшественников с основным раствором.
d. Основания
Сшивание «по месту» для молекул первого и второго предшественников протекает в основных условиях. Требования катализа реакции в физиологических условиях и без вреда для организма пациента удовлетворяет широкий ассортимент оснований, которые таким образом выступают в роли активаторов получения биоматериала. Подходящие для использования основания включают нижеследующие, но не ограничиваются только этими: третичные алкиламины, такие как трибутиламин, триэтиламин, этилдиизопропиламин или N,N-диметилбутиламин. Для заданной композиции (и в основном в зависимости от типа молекул предшественников) время гелеобразования зависит от типа основания и значения рН раствора. Таким образом, для желательной области применения время гелеобразования композиции можно контролировать и регулировать в результате варьирования значения рН основного раствора. Увеличение значения рН основного раствора будет уменьшать время гелеобразования, но также будет и увеличивать время разложения биоматериала. Поэтому должен быть получен компромисс между временем гелеобразования и разложением. В одном предпочтительном варианте реализации в качестве активатора реакции ковалентного сшивания основание выбирают из водных буферных растворов, которые характеризуются попаданием их значений рН и рК в один и тот же диапазон. Диапазон значений рК предпочтительно заключен в пределах от 9 до 13. В случае наличия у основания в основном диапазоне двух значений рК первое из них предпочтительно будет попадать в пределы от 8,5 до 10, а второе - в пределы от 10 до 13. Подходящие для использования буферы включают нижеследующие, но не ограничиваются только этими: карбонат натрия, борат натрия и глицин. В одном варианте реализации предпочтительным основанием является карбонат натрия. Предпочтительно основный раствор характеризуется значением рН в диапазоне от 9 до 14, более предпочтительно в диапазоне от 10 до 13, а еще более предпочтительно в диапазоне от 10 до 12.
с. Биологически активные компоненты
Биоматериал также может содержать биологически активные факторы, подобные небольшим молекулам или пептидным белкам, которые могут медленно диффундировать из материала и таким образом способствуют регенерации и исцелению ткани. В таких случаях биоматериал исполняет функцию как тканевого герметика, обладающего дополнительными свойствами регенерации ткани, так и матрицы для доставки лекарственного средства. Биологически активные факторы и/или небольшие молекулы могут быть просто перемешаны с биоматериалом или могут быть ковалентно связаны с биоматериалом благодаря введению в молекулу свободной тиольной группы и высвобождены в результате гидролитического или ферментативного разложения. Биологически активными факторами могут являться факторы роста, предпочтительно из суперсемейства бета-ТФР и ФРТ.
II. Биоматериалы
Как упоминалось ранее, требования к биоматериалам и, таким образом, выбор молекул предшественников зависят от назначения и места применения в организме. В одном предпочтительном варианте реализации биоматериал образует покрытие, непроницаемый слой или герметик, которые предотвращают, уменьшают или сдерживают потерю жидкости. Потеря жидкости включает нижеследующее, но не ограничивается только этим: потеря любых биологических жидкости или газа, такая как потеря крови, потеря спинномозговой жидкости или потеря газа из легких. Биоматериал может быть использован внутри организма или снаружи. При данном назначении биоматериал должен характеризоваться хорошими адгезионной и когезионной прочностями, регулируемым коротким временем гелеобразования, малым увеличением объема вследствие поглощения воды, а также полным рассасыванием в организме с течением времени. В то время как механическая прочность биоматериала в существенной степени зависит от плотности сшивания полимерной сетки, на поглощение воды биоматериалом влияние оказывает взаимодействие плотности сшивания и гидрофобности полимерной сетки. Плотность сшивания и гидрофобная природа биоматериала главным образом определяются структурой и соотношением компонентов предшественников. Поэтому поглощение воды и механические характеристики биоматериала можно регулировать и определять надлежащим выбором компонентов предшественников.
Характеристики биоматериалов
В одном варианте реализации биоматериал используют для герметизации твердой оболочки головного мозга или спинного мозга после ее разрезания или повреждения в целях предотвращения или уменьшения протечки спинномозговой жидкости во внешнюю среду после проведения хирургического вмешательства. Герметизация может быть произведена в качестве вспомогательного средства при наложении швов или в случае не слишком большого поражения твердой мозговой оболочки. Биоматериал может быть использован в качестве единственного средства закрытия раны, обеспечивая нехирургическое прикрепление первой поверхности ко второй поверхности. В наиболее предпочтительной области применения композицию используют в качестве вспомогательного средства при наложении швов для шовной пластики твердой мозговой оболочки после проведения хирургической операции на черепе. Одним фактором, который оказывает влияние на время реакции получения биоматериала, предназначенного для использования в качестве герметика для твердой мозговой оболочки (называемого «герметиком»), является значение рН композиции на момент сшивания. Молекулы предшественников растворяют в водном буферном растворе при значении рН в диапазоне от 2 до 7,5, более предпочтительно от 4 до 5. В одном предпочтительном варианте реализации для получения буферированных растворов или регулирования значения рН растворов молекул предшественников используют ацетат натрия при рК 4,76, фосфат натрия при рК1 2,15 и рК2 7,2 или соляную кислоту (HCl). После или во время перемешивания молекул предшественников (и любых добавок и/или биологически активных компонентов) реакцию в качестве активатора должно катализировать основание. Предпочтительно в качестве активатора используют основный раствор, характеризующийся попаданием, по меньшей мере, одного из своих значений рК в диапазон от 9 до 13. Наиболее предпочтительными являются карбонат натрия при рК2 10,33 или борат натрия при рК1 9,23 и рК2 12,74. В дополнение к этому борат натрия обладает антисептическими свойствами и по этой причине также выгоден для использования при нанесении на раны. В еще одном варианте реализации в качестве активатора может быть использован глицин при рК2 9,78. Предпочтительно во время сшивания композиция характеризуется значением рН в диапазоне от 9 до 13, более предпочтительно в диапазоне от 9,5 до 11,5, еще более предпочтительно в диапазоне от 9,8 до 11 и еще более предпочтительно в диапазоне от 10,3 до 10,6.
Композиция, использующаяся в качестве герметика для твердой мозговой оболочки, должна характеризоваться очень коротким временем сшивания для того, чтобы остаться на месте и немедленно предотвратить протечку. Предпочтительно композиция сшивается в течение менее, чем двух минут, еще более предпочтительно менее, чем одной минуты, а наиболее предпочтительно в течение периода времени продолжительностью от 5 до 20 секунд и еще более предпочтительно от 1 до 5 секунд.
Набухание биоматериала должно быть ограничено, поскольку набухание может привести в результате к сдавливанию тканей, результатом чего являются сдавление нерва или ишемия. Как это определялось в настоящем документе ранее, набухание герметика не должно превышать 1,5, а предпочтительно является меньшим, чем 1, более предпочтительно меньшим, чем 0,5. Наиболее предпочтительным является набухание, результатом которого будет значение в диапазоне от 0,1 до 1,5, более предпочтительно в диапазоне от 0,1 до 1, а еще более предпочтительно от 0,1 до 0,8. В одном предпочтительном варианте реализации, по меньшей мере, одна из молекул предшественников в качестве основной цепи имеет молекулу, более гидрофобную, чем полиэтиленгликоль. Например, в одном варианте реализации молекула первого предшественника имеет основную цепь ПЭГ в комбинации с блок-сополимером ПЭО/ППО в качестве основной цепи молекулы второго предшественника. Предпочтительно обе молекулы предшественников имеют функционализованные в концевых положениях лучи в количестве, равном трем и более. Наиболее предпочтительно обе молекулы предшественников имеют четыре луча, функционализованных в концевых положениях. Предпочтительно молекулой первого предшественника является ПЭГ-тетратиол (формула II), имеющий молекулярную массу в диапазоне от 4 кД до 11 кД, более предпочтительно от 5 кД до 10 кД. Компонентом второго предшественника предпочтительно является Tetronic®-тетраакрилат (формула I), имеющий молекулярную массу, находящуюся в диапазоне от 10 кД до 20 кД, более предпочтительно равную приблизительно 15 кД. В частности, хорошие свойства материала герметика могли бы быть получены в результате объединения ПЭГ-тетратиола при 5 кД или 10 кД с Tetronic®-тетраакрилатом. Концентрация молекулы второго предшественника (электрофильного предшественника), образующего биоматериал, находится в диапазоне от 8% до 18% (масс./масс.), более предпочтительно от 10% до 16% (масс./масс.), а наиболее предпочтительно от 12% до 14% (масс./масс.). Концентрацию молекулы первого предшественника (молекулы нуклеофильного предшественника) рассчитывают и регулируют в соответствии с желательным соотношением функциональных групп между молекулами первого и второго предшественников. Концентрационные диапазоны молекул предшественников также оказывают значительное влияние на набухание, гелеобразование и время рассасывания биоматериала, и по этой причине для конечных свойств в качестве герметика важным является оптимальный диапазон. Работа при низкой концентрации молекул предшественников будет увеличивать время гелеобразования, но в результате будет приводить к получению биоматериала, который в меньшей степени будет набухать. В одном дополнительном варианте реализации биоматериал разлагается in vivo в течение менее, чем 12 недель.
III. Способы получения биоматериалов
А. Хранение
Во избежание разложения функциональных групп до использования молекулы первого и второго предшественников предпочтительно хранят в растворе при исключении присутствия кислорода и при низких температурах, равных, например, приблизительно +4°С. Молекулы предшественников могут храниться в виде сухого порошка или в виде раствора в буфере. В одном варианте реализации молекулы двух предшественников хранят в виде растворов в кислотном натрийацетатном буфере. В еще одном варианте реализации молекулу первого предшественника хранят в виде сухого порошка, а молекулу второго предшественника хранят в растворе, характеризующемся кислотным значением рН.
В. Получение композиции тканевого герметика
Композиция, образующая биоматериал, в частности тканевый герметик, может быть получена по следующему далее общему способу:
а) получение, по меньшей мере, одной молекулы первого полифункционального предшественника, имеющей, по меньшей мере, две нуклеофильные группы, предпочтительно четыре нуклеофильные группы, которая необязательно содержит добавки и/или биологически активные компоненты;
b) получение, по меньшей мере, одной молекулы второго полифункционального предшественника, имеющей, по меньшей мере, две электрофильные группы, предпочтительно четыре электрофильные группы, способные образовывать ковалентную связь с нуклеофильными группами стадии а) в физиологических условиях, которая необязательно содержит добавки и/или биологически активные компоненты;
с) растворение молекул предшественников стадий а) и b) в буферном растворе, предпочтительно характеризующемся кислотным значением рН;
d) перемешивание растворов молекул предшественников, полученных на стадии с); и
е) добавление во время стадии d) или после нее основного раствора, предпочтительно водного буферного раствора, характеризующегося значением рН в диапазоне от 9 до 13, для инициализации реакции сшивания между растворами молекул первого и второго предшественников.
В одном предпочтительном варианте реализации способ получения биоматериала включает стадии:
i) получение молекулы первого предшественника, которая представляет собой полимер на основе поли(этиленгликоля), имеющий х концевых тиольных групп, где х является равным 2 или большим, чем 2, предпочтительно 3, 4, 5, 6, 7 или 8;
ii) получение молекулы второго предшественника, описывающейся общей формулой:
A-[(C3H6O)n-(C2H4O)m-B]i,
где m и n представляют собой целые числа в диапазоне от 1 до 200;
i является большим, чем 2, предпочтительно 3, 4, 5, 6, 7 или 8;
А выбирают из группы, состоящей из углерода, глицерина, пентаэритрита, дипентаэритрита и этилендиамина;
В представляет собой сопряженную ненасыщенную группу;
iii) проведение реакции между молекулами предшественников стадий i) и ii) в присутствии основания для получения сшитой трехмерной сетки.
Во время перемешивания молекул первого и второго предшественников сшивание протекает с низкой скоростью (от 10 минут до часов) в случае кислотного значения рН раствора. Поэтому во избежание достижения смесью точки гелеобразования до введения пациенту и для получения биоматериала за короткое предварительно определенное время молекулы предшественников требуется хранить в растворе, характеризующемся кислотным значением рН. Предпочтительно значение рН раствора находится в диапазоне от 2 до 6, а более предпочтительно в диапазоне от 2,5 до 5,5. Предпочтительный кислый раствор получают при использовании ацетатного буфера или раствора соляной кислоты.
В одном предпочтительном варианте реализации молекулы первого и второго предшественников растворяют в буферном растворе, характеризующемся кислотным значением рН. В еще одном предпочтительном варианте реализации молекула первого предшественника представляет собой сухой порошок, молекулу второго предшественника растворяют в буферном растворе, характеризующемся кислотным значением рН, и молекулы двух предшественников перемешивают перед введением в контакт с основанием. Перед перемешиванием молекулы первого и второго предшественников и любые добавки и/или биологически-активные компоненты в случае присутствия таковых необязательно могут быть стерилизованы. Предпочтительно этого добиваются в результате стерилизующего фильтрования компонентов предшественников и любого растворимого другого компонента и в результате гамма-облучения нерастворимых в воде компонентов. Молекулы предшественников, полученные на стадиях а), b), и/или смесь, полученная на стадии d), могут храниться в течение продолжительного периода времени, предпочтительно при низких температурах. Перед использованием молекулы предшественников (и другие компоненты в случае присутствия таковых) перемешивают друг с другом, а после этого с основным раствором в качестве активатора. При введении основного раствора композиция быстро претерпевает гелеобразование. Для обеспечения протекания гелеобразования в течение менее, чем 2 минут, предпочтительно в течение менее, чем 10 секунд, а более предпочтительно в течение менее, чем 5 секунд, композиция, включающая основный раствор, предпочтительно характеризуется значением рН в диапазоне от 9 до 13, более предпочтительно в диапазоне от 9,5 до 11,5, еще более предпочтительно в диапазоне от 9,8 до 11 и еще более предпочтительно в диапазоне от 10,3 до 10,6. Существуют различные способы перемешивания. В одном варианте реализации при использовании трехходового соединительного устройства могут быть соединены друг с другом три шприца, один из которых содержит нуклеофильного предшественника, другой содержит электрофильного предшественника, а третий содержит основный раствор. Содержимое шприцов перемешивают в результате продавливания через статический смеситель на выходе из трехходового соединительного устройства. Композицию инъецируют непосредственно на требуемом месте лечения в организме в результате соединения статического смесителя с инъекционной иглой. Во втором варианте реализации один из растворов молекул предшественников перемешивают с основным раствором. Этого предпочтительно добиваются в результате соединения шприца, содержащего основный раствор, со шприцом, предпочтительно содержащим электрофильного предшественника (необязательно также содержащего добавки и/или биологически активные компоненты), через соединительное устройство, которое делает возможным перемешивание между шприцами их соответствующего содержимого. Частью соединительного устройства может являться статический смеситель. Перемешивание будет завершено при достижении гомогенного перемешивания. После перемешивания один шприц содержит смесь основание/молекула предшественника, а другой шприц является пустым. После этого пустой шприц из соединительного устройства удаляют и замещают шприцом, содержащим молекулу другого предшественника, необязательно также содержащим добавки и/или биологически активные компоненты. Опять-таки, перемешивание между шприцами представляет собой один путь достижения гомогенного перемешивания содержимого обоих шприцов. После этого шприц, содержащий смесь, соединяют с инъекционной иглой и композицию инъецируют на требуемом месте в организме.
В альтернативном варианте шприц, содержащий смесь основание/предшественник, и шприц, содержащий другого предшественника, соединяют друг с другом при помощи двухходового соединительного устройства, включающего на своем выходе статический смеситель. Двухходовое соединительное устройство может представлять собой двухсекционный шприц. Содержимое перемешивают в результате продавливания содержимого шприцов через статический смеситель. Либо статический смеситель непосредственно соединяют с инъекционной иглой, либо смесь продавливают в дополнительный шприц, который после этого соединяют с инъекционной иглой.
В одном предпочтительном варианте реализации растворы молекул первого и второго предшественников, предпочтительно молекулы первого и второго предшественников, растворенные в натрийацетатном буфере, перемешивают (совместно с любыми добавками или биологически активными компонентами в случае необходимости), а после этого разбрызгивают на ткани совместно с активатором - основным раствором.
IV. Комплекты для получения композиций, сшиваемых «по месту»
Комплекты настоящего изобретения представляют собой наборы деталей, использующиеся для получения биоматериалов настоящего изобретения. Комплект содержит, по меньшей мере, компоненты первого и второго предшественников. Комплект также может включать одно или несколько устройств, таких как шприцы или двухсекционные шприцы, предназначенных для введения пациенту молекул первого и второго предшественников плюс любые добавки и/или биологически активные компоненты. Комплект также может включать контейнеры для хранения молекул предшественников и основного раствора. Комплект также включает безыгольные устройства для передачи содержимого контейнеров друг в друга или для передачи содержимого контейнеров в двухсекционный шприц. Необязательно комплект также содержит основный раствор. Предпочтительно основание хранят в третьем контейнере. Необязательно молекулы первого и/или второго предшественников содержат одного или нескольких представителей, выбираемых из добавок и/или биологически активных компонентов. До введения пациенту молекулы предшественников могут быть размещены в одном или нескольких устройствах. Комплект также может включать краску, например метиленовый синий, лиссаминовый зеленый или прочный зеленый, которая может быть добавлена к биоматериалу для облегчения визуализации биоматериала. В одном предпочтительном варианте реализации, в особенности подходящем для использования при применении биоматериалов, растворы молекул предшественников хранят в одной из секций двухсекционного устройства, а основный раствор хранят во второй секции того же самого устройства. Выходное отверстие устройства включает разбрызгивающую насадку, которая необязательно может быть объединена со статическим смесителем для оптимизации перемешивания основного раствора с растворами молекул предшественников. Растворы молекул предшественников (плюс любые добавки или биологически активные компоненты в случае необходимости) могут содержаться в секции предварительно перемешанными, или молекулы предшественников в секции могут быть разделены при помощи мембраны, которая делает возможным перемешивание молекул после своего удаления или разрушения.
В еще одном варианте реализации комплект включает первый контейнер (под вакуумом), который может представлять собой стеклянный флакон, содержащий молекулу первого предшественника в виде сухого порошка, и второй контейнер, который может представлять собой стеклянный флакон, содержащий молекулу второго предшественника, растворенную в водном буферированном растворе, характеризующемся кислотным значением рН. Необязательно первый или второй контейнеры могут содержать одну или несколько добавок, выбираемых из группы, состоящей из тиксотропных добавок и рентгеноконтрастных средств или красителя. Содержимое второго контейнера передают в первый контейнер при помощи безыгольного передаточного устройства (Mix2Vial® 20/20, West). После этого молекулы первого и второго предшественников перемешивают и растворяют в водном буферированном растворе, характеризующемся кислотным значением рН. Третий контейнер, который может представлять собой стеклянный флакон, содержит основный раствор. Предпочтительно двухсекционный шприц снабжают переходником для двухсекционного заполнения. Две секции двойного шприца могут иметь различный объем. Предпочтительно объем секции, принимающей смесь молекул предшественников, в десять раз превышает объем секции, принимающей основный раствор. Контейнер, содержащий молекулы предшественников, и контейнер, содержащий основание, соединяют с соединительным устройством, а их содержимое одновременно передают в две секции шприца в результате вытягивания поршней шприца. Соединительное устройство и два контейнера из шприца удаляют и шприц снабжают съемной разбрызгивающей насадкой. Перемешивание раствора молекул предшественников и основного раствора протекает в разбрызгивающей насадке, а получающуюся в результате гомогенную смесь разбрызгивают на желательном месте.
V. Варианты использования композиций
Компоненты полифункциональных предшественников выбирают и приспосабливают для получения биоматериалов, обладающих желательными свойствами. Молекулы предшественников способны сшиваться «по месту» при физиологической температуре в соответствии с конкретными требованиями к герметику. В предпочтительном варианте реализации композиции и биоматериалы настоящего изобретения используют для предотвращения, уменьшения, ингибирования или сдерживания потери биологических жидкостей. В еще одном варианте реализации композиции и биоматериалы настоящего изобретения используют для нанесения покрытия на поверхность ткани.
А. Тканевый герметик
В одном варианте реализации композиции и биоматериалы настоящего изобретения используют в качестве тканевых герметиков. В предпочтительном варианте реализации сшиваемая «по месту» композиция образует биоматериал, формирующий покрытие, непроницаемый слой или герметик, уменьшающие, ингибирующие или сдерживающие потерю жидкости. В частности, биоматериал может быть использован для ингибирования, уменьшения или сдерживания потери жидкости после проведения медицинской процедуры. Предпочтительная медицинская процедура включает нижеследующее, но не ограничивается только этим: хирургия головного мозга или нейрохирургия.
В. Медицинские показания, отличные от тканевого герметика
Описанные биоматериалы не ограничиваются использованием при оперативном вмешательстве. Биоматериал может быть использован в качестве раневой повязки для раны на любой части тела. В одном варианте реализации биоматериал может быть использован в качестве первичной повязки для предотвращения или уменьшения потери крови, возникающей в результате травмы. В еще одном варианте реализации биоматериал может быть использован для уменьшения или предотвращения образования послеоперационных спаек.
Примеры
Материалы
Этилендиаминтетракис(блок-сополимер поли(этиленоксид-пропиленоксид)) (tetronic® 1107, молекулярная масса 15 кД, BASF) функционализовали в концевых положениях акрилатными группами для получения этилендиаминтетракис((блок-сополимер поли(этиленоксид-пропиленоксид))-акрилата) (tetronic-тетраакрилат, молекулярная масса 15 кД) в соответствии со способом, описанным в работе Biomaterials 25 (2004) 5115-5124.
Получение буфера
Триэтаноламин (ТЭА) с концентрацией 0,3 моль/л получали в результате растворения 1,11 г в 25 мл воды, очищенной в системе Milli-Q, и регулирования значения рН в результате добавления соляной кислоты с концентрацией 5 моль/л.
ТСБ получали в результате растворения 8 г NaCl, 0,2 г KCl и 3 г основания трис в воде, очищенной в системе Milli-Q. Значение рН регулировали при использовании NaOH с концентрацией 5 моль/л.
Глициновый буфер: 7,5 г глицина и 5,85 г NaCl растворяли в 1 л воды, очищенной в системе Milli-Q. Значение рН регулировали при использовании NaOH с концентрацией 5 моль/л.
Ацетатный буфер: при использовании воды, очищенной в системе Milli-Q, получали уксусную кислоту с концентрацией 10 ммоль/л и натрийацетатный буфер с концентрацией 10 ммоль/л. Два буфера перемешивали при соотношении, обеспечивающем получение желательного значения рН.
Боратный буфер: получали борнокислотный буфер с концентрацией 100 ммоль/л и буфер на основе декагидрата тетрабората натрия с концентрацией 50 ммоль/л. Два буфера перемешивали при соотношении, обеспечивающем получение желательного значения рН.
Карбонатный буфер: в воде, очищенной в системе Milli-Q, получали натрийкарбонатный буфер с концентрацией 100 ммоль/л и натрийбикарбонатный буфер с концентрацией 100 ммоль/л. Два раствора перемешивали при соотношении, обеспечивающем получение желательного значения рН.
Испытание на гелеобразование
Для оценки времени гелеобразования 50-100 мкл указанных количеств раствора молекулы первого предшественника и раствора молекулы второго предшественника из таблицы 2 пипетировали в пробирки Эппендорфа. Для материалов, быстро претерпевающих гелеобразование, капли (равного объема) соответствующего раствора молекулы первого предшественника помещали на внутреннюю стенку для предотвращения прохождения преждевременной полимеризации еще без вхождения в контакт с раствором второго предшественника. Таймер запускали одновременно с размещением пробирок Эппендорфа в прибор для встряхивания и перемешивания, где растворы после этого перемешивали в точности в течение 5 секунд. Сразу же после перемешивания объединенные растворы зондировали иглой и в качестве «точки гелеобразования» регистрировали фиксируемый момент времени «точки гелеобразования» (когда тонкие нити оставались прикрепленными к игле после вынимания), при котором тонкие нити начинали оставаться прикрепленными к игле при ее вынимании из раствора. Для рецептур, претерпевающих быстрое гелеобразование, после зондирования в момент времени 5 секунд регистрировали статус (например, тонкие нити, толстые нити и/или плотный гель). В альтернативном варианте перемешивание проводили в виде перемешивания между шприцами. Для этого раствор молекулы первого предшественника и раствор молекулы второго предшественника отбирали в шприцы, шприцы соединяли с соединительным звеном и раствор десять раз прогоняли туда и обратно. Смесь передавали на весовую чашку и определяли точку гелеобразования так, как это описывалось ранее по методу «зондирования иглой». После первоначального гелеобразования гидрогель обычно остается клейким вплоть до достижения существенной степени сшивания. Время, которое требовалось для достаточного сшивания материала (утраты клейкого характера), регистрировали как «время схватывания», которое отражает время, по истечении которого до материала можно было дотрагиваться без его повреждения.
Пример 1: Композиции тканевых герметиков
1а: Композиция 1: Tetronic-тетраакрилат и ПЭГ-SH-10
Раствор молекулы первого предшественника
В 1 мл ацетатного буфера с концентрацией 10 ммоль/л при рН 5 растворяют 235 мг поли(этиленгликоль)тетрасульфгидрила («ПЭГ-SH-10») (молекулярная масса 10 кД) и 0,1 мг лиссаминового зеленого.
Раствор молекулы второго предшественника
В 1 мл ацетатного буфера с концентрацией 10 ммоль/л при рН 5 растворяют 315 мг tetronic-тетраакрилата (молекулярная масса 15 кД).
Основный раствор
0,22 мл боратного буфера с концентрацией 50 ммоль/л при рН 9,8.
1b: Композиция 2: Tetronic-тетраакрилат и ПЭГ-SH-5
Раствор молекулы первого предшественника
В 1 мл ацетатного буфера с концентрацией 10 ммоль/л при рН 5 растворяют 112 мг поли(этиленгликоль)тетрасульфгидрила («ПЭГ-SH-5») (молекулярная масса 5 кД) и 0,1 мг лиссаминового зеленого.
Раствор молекулы второго предшественника
В 1 мл ацетатного буфера с концентрацией 10 ммоль/л при рН 5 растворяют 315 мг tetronic-тетраакрилата (молекулярная масса 15 кД).
Основный раствор
0,22 мл боратного буфера с концентрацией 50 ммоль/л при рН 10,4.
1c: Композиция 3: Tetronic-тетраакрилат и ПЭГ-SH-5
Раствор молекулы первого предшественника
В 1 мл ацетатного буфера с концентрацией 10 ммоль/л при рН 4,9 растворяют 168 мг поли(этиленгликоль)тетрасульфгидрила («ПЭГ-SH-5») (молекулярная масса 5 кД).
Раствор молекулы второго предшественника
В 2 мл ацетатного буфера с концентрацией 20 ммоль/л при рН 4,9 растворяют 472 мг tetronic-тетраакрилата (молекулярная масса 15 кД).
Основный раствор
0,3 мл карбонатного буфера с концентрацией 250 ммоль/л при рН 11,0.
1d: Композиция 4: Tetronic-тетраакрилат и ПЭГ-SH-5
Раствор молекулы первого предшественника
В 1 мл ацетатного буфера с концентрацией 5 ммоль/л при рН 4,9 растворяют 192 мг поли(этиленгликоль)тетрасульфгидрила («ПЭГ-SH-5») (молекулярная масса 5 кД).
Раствор молекулы второго предшественника
В 1 мл ацетатного буфера с концентрацией 15 ммоль/л при рН 4,9 растворяют 472 мг tetronic-тетраакрилата (молекулярная масса 15 кД).
Основный раствор
0,3 мл карбонатного буфера с концентрацией 250 ммоль/л при рН 11,0.
1е: Композиция 5: Tetronic-тетраакрилат и ДТТ
Раствор молекулы первого предшественника
В 500 мкл триэтаноламинового буфера с концентрацией 0,3 моль/л при рН 8,5 растворяют 2,5 мг дитиотреитола (ДТТ, молекулярная масса 154 г/моль).
Раствор молекулы второго предшественника
В 500 мкл триэтаноламинового буфера с концентрацией 0,3 моль/л при рН 8,5 растворяют 120 мг tetronic-тетраакрилата (молекулярная масса 15 кД).
или
Раствор молекулы первого предшественника
В 500 мкл триэтаноламинового буфера с концентрацией 0,3 моль/л при рН 8,5 растворяют 3,15 мг дитиотреитола.
Раствор молекулы второго предшественника
В 500 мкл триэтаноламинового буфера с концентрацией 0,3 моль/л при рН 8,5 растворяют 150 мг tetronic-тетраакрилата (молекулярная масса 15 кД).
1f: Композиция 6: Tetronic-тетраакрилат и 2-лучевой ПЭГ-SH-3,4
Раствор молекулы первого предшественника
В 1 мл ацетатного буфера с концентрацией 10 ммоль/л при рН 5,5 растворяют 156 мг поли(этиленгликоль)дисульфгидрила («ПЭГ-SH-3,4») (молекулярная масса 3,4 кД).
Раствор молекулы второго предшественника
В 1 мл ацетатного буфера с концентрацией 10 ммоль/л при рН 5,5 растворяют 315 мг tetronic-тетраакрилата (молекулярная масса 15 кД).
Основный раствор
0,3 мл карбонатного буфера с концентрацией 250 ммоль/л при рН 10,0.
1g: Композиция 7: Tetronic-тетраакрилат и 8-лучевой ПЭГ-SH-10
Раствор молекулы первого предшественника
В 1 мл ацетата с концентрацией 10 ммоль/л при рН 4,9 растворяют 161 мг 8-лучевого поли(этиленгликоль)октасульфгидрила («8-лучевой ПЭГ-SH-10») (молекулярная масса 5 кД).
Молекула второго предшественника
В 2 мл ацетата с концентрацией 20 ммоль/л при рН 4,9 растворяют 472 мг tetronic-тетраакрилата (молекулярная масса 15 кД).
Основный раствор
0,3 мл натрийкарбонатного буфера с концентрацией 0,25 моль/л при рН 11,0.
1h: Композиция 8: Tetronic-тетраакрилат и 4-лучевой ПЭГ-SH-5
472 мг Tetronic-тетраакрилата, 15 кД.
192 мг ПЭГ-тетратиола, 5 кД.
0,55 мг соляной кислоты.
9,5 мг карбоната натрия.
0,15 мг гидрата метиленового синего.
3,3 г воды для инъекций.
Получение комплекта
Маточный раствор HCl с концентрацией 5 ммоль/л получали в результате разбавления 5 мл раствора HCl с концентрацией 100 ммоль/л в 95 мл воды, очищенной в системе Milli-Q. Маточный раствор метиленового синего с концентрацией 1 мг/мл в HCl с концентрацией 5 ммоль/л получали в результате растворения 20 мг метиленового синего в 20 мл маточного раствора HCl. Буфер для растворения tetronic-тетраакрилата получали из HCl с концентрацией 5 ммоль/л при содержании метиленового синего 0,05 мг/мл. Его разбавляли маточным раствором HCl при соотношении 1:20, значение рН доводили до величины в диапазоне 2,3-2,6. Значение рН основного раствора (карбонатного буфера) доводили до величины в диапазоне 11,35-11,45. 472 мг tetronic-тетраакрилата растворяли в 3 мл холодного буфера для tetronic-тетраакрилата и выдерживали на льду в течение 5 минут для облегчения солюбилизации. Раствор центрифугировали в течение 1 минуты при 3000 об/мин для удаления воздушных пузырьков и пипетировали во флакон, содержащий 192 мг ПЭГ-тетратиола, который растворяли в результате осторожного встряхивания. После растворения полимера 3 мл смеси передавали в большую секцию двойного шприца с соотношением объемов секций 1:10. Меньшую секцию заполняли раствором карбоната натрия с концентрацией 300 ммоль/л в количестве 0,4 мл. Вставляли плунжер, из шприца осторожно удаляли воздух и прикрепляли разбрызгивающую насадку.
1i. Получение DuraSeal®
DuraSeal® (Confluent Surgical Inc.) получали в соответствии с инструкциями по применению.
1j: Композиция 10: Tetronic-тетраакрилат и 2-лучевой ПЭГ-SH-3,4
В 500 мкл триэтаноламинового буфера с концентрацией 0,3 моль/л при рН 8,5 растворяют 133 мг поли(этиленгликоль)дисульфгидрила («ПЭГ-SH-3,4») (молекулярная масса 3,4 кД).
Раствор молекулы второго предшественника
В 500 мкл триэтаноламинового буфера с концентрацией 0,3 моль/л при рН 8,5 растворяют 220 мг tetronic-тетраакрилата (молекулярная масса 15 кД).
1k: Композиция 11: Tetronic-тетраакрилат и 2-лучевой ПЭГ-SH-3,4
В 1,5 мл триэтаноламинового буфера с концентрацией 0,3 моль/л при рН 8,5 растворяют 107 мг поли(этиленгликоль)дисульфгидрила («ПЭГ-SH-3,4») (молекулярная масса 3,4 кД).
Раствор молекулы второго предшественника
В 500 мкл триэтаноламинового буфера с концентрацией 0,3 моль/л при рН 8,5 растворяют 220 мг tetronic-тетраакрилата (молекулярная масса 15 кД).
1l: Композиция 12: Tetronic-тетраакрилат и 2-лучевой ПЭГ-SH-3,4
В 1,5 мл триэтаноламинового буфера с концентрацией 0,3 моль/л при рН 8,5 растворяют 354 мг поли(этиленгликоль)дисульфгидрила («ПЭГ-SH-3,4») (молекулярная масса 3,4 кД).
Раствор молекулы второго предшественника
В 500 мкл триэтаноламинового буфера с концентрацией 0,3 моль/л при рН 8,5 растворяют 240 мг tetronic-тетраакрилата (молекулярная масса 15 кД).
1m: Композиция 13: Tetronic-тетраакрилат и 2-лучевой ПЭГ-SH-3,4
В 50 мкл боратного буфера с концентрацией 100 ммоль/л при рН 10,1, 9,8 и 9,6 растворяют 140,7 мг поли(этиленгликоль)дисульфгидрила («ПЭГ-SH-3,4») (молекулярная масса 3,4 кД).
Раствор молекулы второго предшественника
В 50 мкл боратного буфера с концентрацией 100 ммоль/л при рН 8,5 растворяют 286 мг tetronic-тетраакрилата (молекулярная масса 15 кД).
Пример 2а: Стабильность смеси молекул первого и второго предшественников
Раствор молекулы первого предшественника
В 1 мл ацетатного буфера с концентрацией 10 ммоль/л при рН 4,9 растворяют 194 мг поли(этиленгликоль)тетрасульфгидрила («ПЭГ-SH-5») (молекулярная масса 5 кД). Буфер получают в результате перемешивания уксуснокислотного буфера с концентрацией 100 ммоль/л и натрийацетатного буфера с концентрацией 100 ммоль/л до достижения значения рН 4,90 и разбавления буфера водой при соотношении 1:10 (об./об.).
Раствор молекулы второго предшественника
В 2 мл ацетатного буфера с концентрацией 20 ммоль/л при рН 4,9 растворяют 545 мг tetronic-тетраакрилата (молекулярная масса 15 кД). Буфер получают в результате перемешивания уксусной кислоты с концентрацией 100 ммоль/л и натрийацетатного буфера с концентрацией 100 ммоль/л до достижения значения рН 4,90 и разбавления буфера водой при соотношении 1:5 (об./об.).
Основный раствор
0,3 мл карбонатного буфера с концентрацией 250 ммоль/л при рН 11,0.
В случае перемешивания в течение 30 сек в приборе для встряхивания и перемешивания только молекул первого и второго предшественников гелеобразование протекает в течение 30 мин. Время гелеобразования измеряли в результате погружения иглы в раствор и вынимания иглы из раствора, измеряя время вплоть до образования нитей, указывающих на существенную степень сшивания материала. При пониженной концентрации молекул предшественников, то есть для растворов молекул предшественников, полученных так, как это описывалось в примерах 1с и 1d (композиция 3 и композиция 4), гелеобразование протекает только по истечении 1 часа. При воздействии на смесь молекул предшественников основного раствора обе композиции претерпевают гелеобразование в течение секунд (в течение менее, чем 10 секунд).
Пример 2b: Влияние соотношения между количествами акрилатов и тиолфункциональных групп, имеющихся в соответствующих полимерах
Раствор молекулы первого предшественника и раствор молекулы второго предшественника, определенные в примере 1с, перемешивают при различных объемных соотношениях (0,25:1, 0,375:1, 0,5:1, 0,675:1 и 0,75:1). Данные соотношения соответствуют соотношениям молей тиола и молей акрилата 1:0,5, 1:0,75, 1:1, 1:1,25 и 1:1,5. Раствор молекулы первого предшественника и раствор молекулы второго предшественника перемешивали в течение 30 секунд в приборе для встряхивания и перемешивания. После этого в объем, соответствующий одной десятой от совокупного объема растворов молекул предшественников, добавляли 0,2 мл боратного буфера с концентрацией 50 ммоль/л при рН 9,3. Смесь перемешивали в приборе для встряхивания и перемешивания в точности в течение 5 секунд. В результате погружения иглы в раствор и вынимания иглы из раствора измеряли время вплоть до образования нитей, указывающих на существенную степень сшивания материала. Минимальное время гелеобразования в 10-11 секунд получали для образцов при молярном соотношении между акрилатом и тиолом 1:1 и 1:0,75. При других соотношениях время гелеобразования увеличивалось до 13-15 секунд.
Пример 3: Получение биоматериала
3а: Получение биоматериала из композиции 1, 2, 3, 4 и 6
До нанесения фармацевтической композиции на желательное место растворами молекул первого и второго предшественников заполняют два отдельных шприца, которые соединяют соединительным звеном. Растворы молекул первого и второго предшественников перемешивают в результате передачи материала, содержащегося в одном шприце, в другой шприц. (Обычно растворы прогоняют туда и обратно 10 раз). Хотя смесь после своего получения и остается стабильной в течение 10-20 минут, в идеальном случае фармацевтическую композицию необходимо использовать в течение 5 минут после ее получения. Биоматериал на желательном месте получают «по месту» в результате подачи на место поражения смеси, содержащей молекулы первого и второго предшественников и активатор, при использовании двухкомпонентного устройства, снабженного либо размазывающим наконечником, либо разбрызгивающим наконечником. Биоматериал образовывается в течение менее, чем 1 минуты после подачи содержимого двухкомпонентного устройства.
3b: Получение биоматериала из композиции 5, 10, 11, 12 и 13
Растворами молекул первого и второго предшественников заполняют два отдельных шприца, которые соединяют соединительным звеном. Растворы молекул первого и второго предшественников перемешивают в результате передачи материала, содержащегося в одном шприце, в другой шприц. Время гелеобразования достигается в шприце, и биоматериал вытесняют из шприца и подают в форму.
3с: Получение биоматериала из композиции 7
Молекулы двух предшественников перемешивают в результате перемешивания между шприцами. Без добавления основного раствора молекулы предшественников претерпевают гелеобразование в течение 30 мин. Это значит то, что смесь молекул предшественников перед использованием может храниться в течение 30 минут. В случае добавления 300 мкл натрийкарбонатного буфера с концентрацией 0,25 моль/л при рН 11,0 гелеобразование протекало в течение нескольких секунд (менее, чем 5 секунд).
Пример 4: Набухание/разложение биоматериала
Для оценки набухания и разложения биоматериала биоматериалы получали из композиций, описанных в примерах 1а и 1b.
До нанесения композиций на желательное место растворами молекул первого и второго предшественников заполняют два отдельных шприца, которые соединяют соединительным звеном. Растворы молекул первого и второго предшественников перемешивают в результате передачи материала, содержащегося в одном шприце, в другой шприц. (Обычно растворы прогоняют туда и обратно 10 раз). Хотя смесь после своего получения и остается стабильной в течение 10-20 минут (в том смысле, что смесь не достигала точки гелеобразования раньше, чем по истечении от 10 до 20 минут), в идеальном случае композиции необходимо использовать в течение 5 минут после их получения. Биоматериал на желательном месте получают «по месту» в результате подачи на желательное место смесей, содержащих молекулы первого и второго предшественников и основный раствор, при использовании двухсекционного устройства, снабженного либо размазывающим наконечником, либо разбрызгивающим наконечником. Биоматериалы образовываются в течение менее, чем 5 секунд после подачи содержимого двухсекционного устройства. Композиции размазывают по весовой чашке так, чтобы получить слой биоматериалов в 1 мм. После этого весовую чашку, содержащую реагирующие растворы, при 37°С помещают в увлажненную атмосферу и в течение 10 мин проводят отверждение. Из каждой пленки вырезают 3 диска с диаметром в 1,2 см. Образцы помещают в пробирки, содержащие фосфатно-солевой буфер (ФСБ), и их размещают в инкубаторе при 37°С. Биоматериалы из пробирок вынимают при помощи шпателя в различные моменты времени. Биоматериалы осторожно высушивают при использовании папиросной бумаги для удаления любого избытка воды, а после этого взвешивают. Затем биоматериалы возвращают обратно в свои соответствующие пробирки и помещают обратно в инкубатор. По истечении 2 дней в ФСБ при 37°С набухание достигает величины 0,87±0,11 для биоматериала, полученного из композиции примера 1а, и 0,32±0,06% для биоматериала, полученного из композиции примера 1b. Оба биоматериала полностью растворялись в течение от 28 до 35 дней (фиг. 1 и 2).
Пример 6: Испытание на сжатие
8 образцов биоматериалов, полученных из композиции 1, описанной в примере 1а, и 8 образцов биоматериалов, полученных из композиции 2, описанной в примере 1b, получали в результате заполнения шприца с ячейкой на 1 мл композициями 1 и 2 в количестве 100 мкл. Биоматериалы отверждали в течение 5-10 мин, а после этого вынимали из их формы. Получали цилиндры, имеющие диаметр 5 мм и высоту 11,5 мм. Четыре биоматериала помещали в ФСБ с концентрацией 10 ммоль/л при рН 7,4, а четыре биоматериала размещали в сухой пробирке. Пробирки инкубировали при 37°С в течение 24 часов. Вследствие чрезмерной краткости времени гелеобразования для получения гомогенных образцов в случае основного раствора, характеризующегося значениями рН 9,8 и 10,4 соответственно, значение рН основного раствора уменьшали до рН 9,6. Измерения для образцов проводили при использовании прибора «Zwick Materialprüfung 1456». Модуль Юнга (модуль упругости) определяли при помощи динамометрического датчика на 50 Н, а предел прочности - при помощи динамометрического датчика на 20 кН. Скорость предварительного нагружения увеличивали от 0,05 до 0,1 мм/сек, а время ожидания уменьшали до 3 сек. Модуль Юнга измеряли при 3%-ном сжатии, но при скорости 0,08 мм/сек. Ту же самую скорость использовали для динамометрического датчика на 20 кН при регистрации давления вплоть до растрескивания материала. Образцы таких биоматериалов подвергали сжатию в сухом состоянии и по истечении 24 часов инкубирования в ФСБ. Ни один из биоматериалов в своем сухом состоянии (хранение на воздухе при 37°С в течение 24 часов) не разрушался при сжатии вплоть до 99%. Во влажном состоянии давление разрушения составляло 3,8±2,5 н/мм2 для биоматериала, полученного из композиции 1, и 1,51±0,17 н/мм2 для биоматериала, полученного из композиции 2. % сжатия при разрушении составил 91±3% для биоматериала, полученного из композиции 1, и 88±2% для биоматериала, полученного из композиции 2. Во влажном состоянии модуль Юнга составлял 0,125±0,005 для биоматериала, полученного из композиции 1, и 0,10±0,00 н/мм2 для биоматериала, полученного из композиции 2. В сухом состоянии модуль Юнга для биоматериала, полученного из композиции 2, при величине 0,561±0,152 н/мм2 был большим, чем в случае биоматериала, полученного из композиции 1, который характеризовался модулем Юнга 0,152±0,024 н/мм2.
Пример 6: Адгезионная и когезионная прочности биоматериалов
Адгезионную и когезионную прочности биоматериалов исследуют в испытании на продавливание. Измерения в испытании на продавливание проводили в соответствии с документом ASTM F-2329-04 (Standard test for burst strength of surgical sealants). Для диапазона измерений 0-2 бар (максимальное избыточное давление 4 бар) и разрешения 0,1 мбар использовали датчик относительного давления (DeltaOhm TP704-2BGI). В качестве жидкостного насоса использовали шприцевой насос с постоянной производительностью (Alaris, Asena GH). В испытании на давление продавливания композицию 8 и Duraseal®, полученные так, как это описывалось в примерах 1h и 1i, наносят на влажную коллагеновую мембрану. Для обеспечения одинаковости формы образца коллагеновую мембрану помещают под трафарет, через который наносят герметик. После этого образцам дают возможность отверждаться перед их осторожным выниманием из трафарета. После измерения толщины и массы образцов образцы зажимают в устройстве для испытаний и по отдельности подвергают испытаниям. Проводят постоянное измерение возрастающего давления, которое непосредственно воздействует на герметик через предварительно сделанное отверстие в коллагене. После продавливания герметика насос может быть выключен и может быть произведена оценка полученных данных. Для обеспечения сопоставления конкретных сопротивлений продавливанию у различных образцов их толщины перед проведением испытаний измеряли и пересчитывали на 1 мм. Испытание на давление продавливания для двух синтетических хирургических герметиков продемонстрировало четкие различия их сопротивлений разрушению. В то время как для биоматериала, полученного из композиции 8, продавливание происходит при среднем давлении 240 мм ртутного столба, для DuraSeal® продавливание имеет место при среднем давлении 74 мм ртутного столба. Степень когезионного разрушения для обоих герметиков составляла 90%, что демонстрирует хорошее приставание к коллагеновой мембране, использующейся в испытании.
Пример 7: Хирургическая герметизация для твердой мозговой оболочки овцы
Препарировали твердую мозговую оболочку овцы, которую умертвили за 3 часа до этого. Кожу удаляли, используя скальпель, и при помощи трепанационной фрезы в черепе вырезали отверстие прямоугольной формы. Череп поднимали, и, поскольку твердая мозговая оболочка все еще частично к черепу прикреплялась, твердую мозговую оболочку осторожно из черепа извлекали и снова размещали на мозге. Композиции 1 и 2 (описанные в примерах 1а и 1b) размазывали в виде тонкой пленки на твердой мозговой оболочке и оставляли отверждаться в течение 1 мин. Никакой протечки жидкостей не наблюдали. Для тестирования и удаления/отслаивания отвержденного материала от твердой мозговой оболочки использовали закругленный плоский шпатель. Внешний вид геля, время гелеобразования и клейкость количественно оценивали по шкале 1-5. Что касается внешнего вида геля, то категория 1 соответствует неоднородному гелю. Категория 2 соответствует гелю, который в основном обладает грубой структурой, категория 3 соответствует гелю, у которого грубой структурой обладают некоторые части, а категория 5 соответствует однородному гомогенному гелю. Что касается времени гелеобразования, то категория 1 соответствует приблизительно 50-100%-ному стеканию композиции. Категория 2 соответствует приблизительно 25-50%-ному стеканию композиции, категория 3 соответствует приблизительно 5-10%-ному стеканию композиции, а категория 5 соответствует приблизительно 0-5%-ному стеканию композиции. Что касается клейкости, то категория 1 соответствует отслаиванию геля без приложения усилий, категория 2 соответствует отслаиванию геля при приложении незначительного усилия, категория 3 соответствует необходимости приложения среднего усилия для удаления геля, категория 4 соответствует очень незначительному отслаиванию геля, а категория 5 соответствует неудаляемости геля. Для уменьшения времени гелеобразования в случае композиции 2 значение рН увеличивали до 10,4. Для сопоставления композиции также наносили на влажные коллагеновые мембраны, а также непосредственно на мозг. Как было установлено, оба биоматериала, образованные из композиций, очень хорошо приставали к твердой мозговой оболочке (биоматериал, полученный из композиции 1, - категория 4, биоматериал, полученный из композиции 2, - категория 3). Как было установлено, клейкость биоматериала по отношению к твердой мозговой оболочке была намного лучшей, чем клейкость по отношению к коллагеновым мембранам. В противоположность этому при нанесении биоматериала на мозг овцы (покрытый мягкой мозговой оболочкой и слоем паутинной оболочки) биоматериал легко мог отслоиться. Композиция 1 быстро претерпевала гелеобразование (категория 4) и поэтому по окончании нанесения появлялись некоторые части, обладающие грубой структурой, вследствие нахождения полугелеобразного материала в контакте с размазывающим шпателем (категория 4 для внешнего вида геля). С другой стороны, композиция 2 претерпевала гелеобразование относительно медленно (категория 2) даже в случае увеличения значения рН основного раствора до 10,4, и весь продукт не оставался на месте нанесения и стекал в сторону, в особенности в случае негоризонтальности твердой мозговой оболочки. Тем не менее, при нанесении материала тонкий слой материала оставался. В течение 30 сек материал образовывал прочный и неклейкий гидрогель (категория 5 для внешнего вида геля).
Пример 8: Модель дуротомии овцы
Обнажали твердую мозговую оболочку анестезированной овцы и в твердой мозговой оболочке и паутинной оболочке производили рассечение в 2 см, так чтобы возникла протечка спинномозговой жидкости. Повреждение в общих чертах устраняли с использованием полипропиленовой лигатуры 4/0, но при сохранении зазора в 1 мм. Композицию 8, описанную в примере 1h, использовали по следующему способу.
Стерилизация компонентов
Все компоненты аппликатора, пакеты, стеклянные флаконы и крышки стерилизовали в результате гамма-облучения до дозы 21,8 кГр. После этого любые операции со стерильным материалом проводили в стерильном боксе. Буферы и раствор tetronic-тетраакрилата подвергали стерилизующему фильтрованию через шприцевые фильтры PES на 0,22 мкм. ПЭГ-SH-5 в комплекте был нестерильным, и его отфильтровывали через шприцевой фильтр PES на 0,22 мкм после растворения tetronic-тетраакрилата во время получения комплекта.
Получение буферов
Основный раствор получали в результате растворения 1,59 г карбоната натрия в 50 мл воды для инъекций. Зарегистрированное значение рН составляло 11,38.
Раствор Tetronic-тетраакрилата получали в результате растворения 471 мг tetronic-тетраакрилата в 3 мл HCl с концентрацией 5 ммоль/л при содержании метиленового синего 0,05 мг/мл. Растворения добивались в результате использования в течение 10-20 сек прибора для встряхивания и перемешивания, хранения раствора при 4°С в течение 10 мин и центрифугирования в течение 5 мин при 2500 об/мин. Раствор HCl с концентрацией 5 ммоль/л получали из раствора HCl c концентрацией 100 ммоль/л в результате разбавления водой для инъекций. Метиленовый синий получали в виде раствора метиленового синего с концентрацией 10 мг/мл в HCl с концентрацией 5 ммоль/л, а после этого разбавляли при помощи HCl с концентрацией 5 ммоль/л.
Асептическое заполнение и упаковывание комплекта
Перед стерилизацией проводили сборку двойного шприца с поршнями. Меньшую секцию шприца заполняли карбонатом натрия в количестве 400 мкл и упаковывали в пакет 1 совместно с 4 разбрызгивающими насадками и плунжером. Компонент ПЭГ-SH-5 получали в результате отвешивания 192 мг полимера в стеклянные флаконы. Стеклянный флакон протирали этанолом и в стерильный стеклянный флакон высыпали порошок, не прикасаясь к наружной поверхности. Флакон закрывали винтовой крышкой. Раствор tetronic-тетраакрилата отбирали в шприц на 20 мл и 3,3 мл передавали в шприц на 5 мл через соединительное звено между шприцами. Шприц закрывали комбинированной пробкой. Флакон, шприц на 5 мл, синюю и розовую иглы и шприцевой фильтр упаковывали в пакет 2 и запечатывали термосваркой. Пакеты 1 и 2 собирали в больший пакет и запечатывали термосваркой. Комплекты хранили при температуре, меньшей, чем температура в диапазоне от -15°С до -25°С, и транспортировали на сухом льду. В день эксперимента комплект забирали из хранения и помещали в среду при комнатной температуре вплоть до полного оттаивания. Во время использования комплект открывали в стерильном поле. Раствор tetronic-тетраакрилата передавали во флакон, содержащий порошок ПЭГ-SH-5. Порошок растворяли в результате осторожного взбалтывания флакона в течение 1-2 мин. Смесь еще раз отбирали в шприц и шприц соединяли со стерильным фильтром и синей иглой и производили передачу в большую секцию двойного шприца. К двойному шприцу прикрепляли дозатор и из двойного шприца вытесняли оставшийся воздух. На двойной шприц надевали разбрызгивающую насадку, и теперь аппликатор был готов к использованию. Композицию разбрызгивали поверх повреждения твердой мозговой оболочки, и биоматериал отверждался в течение менее, чем 5 секунд. Повреждение твердой мозговой оболочки тщательно обследовали на предмет выявления повторного возникновения протечки спинномозговой жидкости. Герметик был способен прекратить протечку жидкости во время операции. Материал все еще присутствовал по истечении 1 недели и полностью рассасывался по истечении 12 недель.
Пример 9: Испытание на характеристики термогелеобразования tetronic-акрилата при высоких концентрациях
Характеристики гелеобразования композиции 11 (описанной в примере 1k) и композиции 12 (описанной в примере 1l) сопоставляли в обоих случаях в сочетании с линейным ПЭГ-SH, 3,4 кД. Гелеобразование предположительно протекало в результате химического сшивания в композиции 11 и по физическим механизмам (термогелеобразование) с последующим химическим сшиванием в композиции 12. Композиция 11 претерпевала гелеобразование в течение 1,5 минут по завершении 30-секундного перемешивания между шприцами и характеризовалась временем схватывания 2-3,5 минуты после нанесения раствора на весовую чашку через иглу. В случае композиции 12 гель образовывался при нанесении композиции на весовую чашку, обогреваемую окружающей водяной баней при 37°С, и стекание материала предотвращалось. Однако время схватывания увеличивалось до 4-55 минут и поэтому гелеобразование было более продолжительным, чем в случае композиции 11.
Пример 10: Влияние значения рН на кинетику реакции
Время гелеобразования композиции 10 (полученной в примере 1j) в зависимости от значения рН буферного раствора графически представлено на фиг. 3. Как видно, время гелеобразования уменьшается при увеличении значения рН. Подобное поведение наблюдается и для композиции 13 (полученной так, как это описывалось в примере 1m).
Реферат
Изобретение относится к медицине. Описаны способы получения биоматериалов для использования в качестве тканевого герметика, комплекты, содержащие предшественников для получения биоматериалов, и получающиеся в результате биоматериалы. Биоматериалы получают из композиции, содержащей, по меньшей мере, молекулы первого и второго предшественников, где: i) молекулой первого предшественника является полимер на основе поли(этиленгликоля), имеющий х нуклеофильных групп, выбираемых из группы, состоящей из тиольных или аминовых групп, где х является равным 2 или большим, чем 2, предпочтительно 3, 4, 5, 6, 7 или 8; ii) молекула второго предшественника описывается общей формулой: А-[(С3Н6О)n-(С2Н4О)m-В]i, где m и n представляют собой целые числа в диапазоне от 1 до 200, i является большим, чем 2, предпочтительно 3, 4, 5, 6, 7 или 8, А представляет собой точку разветвления, В представляет собой сопряженную ненасыщенную группу. Биоматериалы способны быстро склеивать поверхности тканей друг с другом без осложнения обычного лечения. 4 н. и 44 з.п. ф-лы, 4 ил., 1 табл., 10 пр.
Формула
i) молекулой первого предшественника является полимер на основе поли(этиленгликоля), имеющий х нуклеофильных групп, выбираемых из группы, состоящей из тиольных или аминовых групп, где х является равным 2 или большим, чем 2, предпочтительно 3, 4, 5, 6, 7 или 8;
ii) молекула второго предшественника описывается общей формулой:
A-[(C3H6O)n-(C2H4O)m-B]i,
где m и n представляют собой целые числа в диапазоне от 1 до 200;
i является большим, чем 2, предпочтительно 3, 4, 5, 6, 7 или 8;
А представляет собой точку или фрагмент разветвления;
В представляет собой сопряженную ненасыщенную группу.
i) получение молекулы первого предшественника, которая представляет собой полимер на основе поли(этиленгликоля), имеющий х нуклеофильных групп, выбираемых из группы, состоящей из тиольных или аминовых групп, где х является равным 2 или большим, чем 2, предпочтительно 3, 4, 5 или 6;
ii) получение молекулы второго предшественника, который описывается общей формулой:
А-[(С3Н6О)n-(С2Н4О)m-В]i,
где m и n представляют собой целые числа в диапазоне от 1 до 200;
i является большим, чем 2, предпочтительно 3, 4, 5 или 6;
А представляет собой точку или фрагмент разветвления;
В представляет собой сопряженную ненасыщенную группу;
iii) проведение реакции между молекулами предшественников стадий i) и ii) в присутствии основного раствора для получения сшитой трехмерной сетки.
i) первый контейнер, содержащий молекулу первого предшественника, которой является полимер на основе поли(этиленгликоля), имеющий х нуклеофильных групп, выбираемых из группы, состоящей из тиольных или аминовых групп, где х является равным 2 или большим, чем 2, предпочтительно 3, 4, 5, 6, 7 или 8;
ii) второй контейнер, содержащий молекулу второго предшественника, описывающуюся общей формулой:
A-[(C3H6O)n-(C2H4O)m-B]i,
где m и n представляют собой целые числа в диапазоне от 1 до 200;
i является большим, чем 2, предпочтительно 3, 4, 5, 6, 7 или 8;
А представляет собой точку или фрагмент разветвления;
В представляет собой сопряженную ненасыщенную группу.
Документы, цитированные в отчёте о поиске
Композиция для склеивания, уплотнения и выполнения покрытий








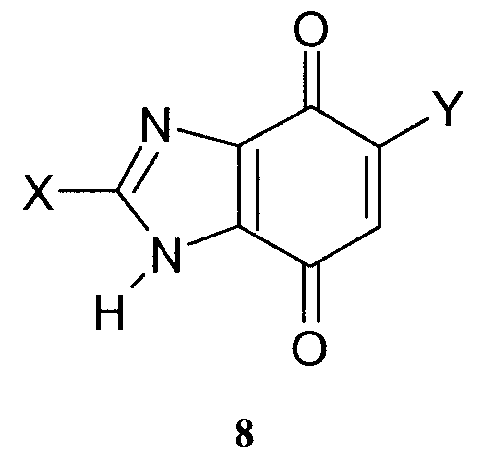





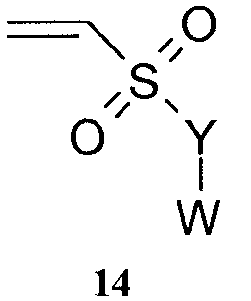







Комментарии