Имплантаты для моделирования, увеличения или коррекции частей лица, например подбородка - RU2715234C2
Код документа: RU2715234C2
Чертежи

Описание
Настоящее изобретение в целом относится к инъекционным композициям, и более конкретно относится к инъекционным имплантатам для придания структуры и контура нижней части лица.
Дермальные филлеры представляют собой инъекционные, биосовместимые композиции, которые, как хорошо известно, корректируют морщины и складки и добавляют объем лицу. Гиалуроновая кислота (ГК) по-прежнему считается многими одним из наиболее востребованных дермальных филлеров, поскольку она не создает опасность возникновения аллергической реакции и является временной и обратимой. Подавляющее большинство дермальных филлеров на основе гиалуроновой кислоты специально разработаны для лечения морщин и складок кожи. Чтобы быть пригодными для контурирования или существенного увеличения объема лица, было бы полезно увеличить объемный эффект композиций, также называемый "лифтингом". Также. было бы полезно максимизировать устойчивости композиций к сдвигу и нормальной деформации, происходящей в мягких тканях лица. Одним из недостатков максимизации этих устойчивостей, например эластичности и когезивности, является то, что ожидается, что при этом, вязкость композиций будет увеличиваться до такой степени, что их инъецирование с помощью тонкой иглы будет затруднительным.
Следовательно, существует большая потребность в имплантате на основе инъецируемой ГК, который специально разработан для эффективного добавления существенного объема лицу, например, для контурирования нижней части лица, например, для увеличения или коррекции подбородка, например, для коррекции ретрузии подбородка или, например, для увеличения или коррекции носа. Было бы очень желательно, если бы такой имплантат, несмотря на его высокую вязкость, мог бы быть легко инъецирован тонкой иглой.
Форма подбородка давно признана важной частью лица, которая вызывает сильное эстетическое восприятие, и которую, как правило, связывают с личностными особенностями человека. Недоразвитый подбородок, не имеющий проекции, обычно называют "слабым подбородком", а выступающие подбородки называют "сильными подбородками", в обоих случаях подразумевая силу личности.
В нескольких исследованиях было показано, что лица со средними пропорциями считаются наиболее привлекательными, и что некрупные черты лица, включая небольшой подбородок, считаются привлекательными у женщин, в то время как расширенные в результате созревания подбородок и челюсть, считаются привлекательными у мужчин. Внешний вид подбородка является определяющим фактором воспринимаемой привлекательности и может даже влиять на психосоциальное благополучие человека.
Увеличение подбородка обычно осуществляется хирургически, путем размещения постоянного имплантата над челюстью. Согласно данным Американского общества эстетической пластической хирургии (ASAPS), в настоящее время эта операция входит в число самых распространенных эстетических хирургических операций, и их число с 2010 года увеличилось на 71%.
Ретрузия подбородка может быть результатом изменений роста нижней трети лица во время созревания, результатом травмы или старения лица, последнее из которых может усугубить деформации или асимметрии, вызванные двумя первыми. Форма нижней челюсти влияет на рот, подбородок и шею. С возрастом, уменьшение скелетной поддержки этой области делает атрофию мягких тканей заметной, зрительно увеличивая челюсти, уменьшая выступание подбородка и заставляя линию подбородка выглядеть слабой. Деформации подбородка являются одними из самых часто встречающихся костных аномалий лица, наиболее распространенными из которых являются горизонтальная микрогения, характеризующаяся наличием нормальной вертикальной высоты с задвинутым костным подбородком.
Поскольку нижняя челюсть и подбородок составляют основу нижней части лица, наращивающие способы лечения возрастной ретрузии подбородка и изменения контура области подбородка, или лечения микрогении изучались на протяжении десятилетий. В тех случаях, когда подход к коррекции ретрузии подбородка заключается в добавлении объема, способы лечения включают в себя имплантаты подбородка, гениопластику и инъекцию силиконовых и полупостоянных филлеров, таких как полиметилметакрилатные микросферы и гидроксиапатит кальция. Однако все эти методы лечения имеют свои недостатки. Например, имплантаты подбородка и гениопластика связаны с болезненной хирургией, которая может не привести к коррекции ретрузии подбородка и эстетической гармонизации этой области. Этот подход может усугубить резорбцию и инфекцию кости, приводя к необходимости удаления имплантата. Инъекция полупостоянных наполнителей является компромиссом между способностью создавать объем и побочными эффектами, связанными с полупостоянными наполнителями.
Краткое описание изобретения
Соответственно, предложен инъекционный имплантат для моделирования лица, например, для увеличения, коррекции, восстановления или создания объема в подбородке и других частях лица у человека.
Настоящее изобретение предлагает временные, обратимые структурирующие гели на основе ГК, изготовленные специально для обеспечения безопасного, минимально инвазивного способа создания объема лица или контуров лица. Имплантаты по изобретению обеспечивают улучшение признаков увеличения объема и лифтинга по сравнению с другими инъекционными материалами на основе ГК, благодаря комбинации механических свойств, в том числе высокой эластичности и высокой когезивной способности, при сохранении легкости введения тонкой иглой. Имплантаты по изобретению могут быть использованы для инъекций в подкожное пространство и/или супрапериостально. Во многих вариантах осуществления, имплантаты после инъекции являются пластичными и, следовательно, позволяют выполнять моделирование, контурирование и формование всех инъецированных областей, например, подбородочной области и области челюсти.
Имплантаты обычно содержат композицию, содержащую гиалуроновую кислоту (ГК), поперечно-сшитую сшивающим агентом, выбранным из группы, состоящей из диглицидилового эфира 1,4-бутандиола (BDDE), 1,4-бис(2,3-эпоксипропокси)бутана, 1,4-бисглицидилоксибутана, 1,2-бис(2,3-эпоксипропокси)этилена и 1-(2,3-эпоксипропил)-2,3-эпоксициклогексана. В некоторых воплощениях, имплантаты обычно содержат композицию, содержащую гиалуроновую кислоту (ГК), поперечно-сшитую с BDDE. Композиции являются пригодными для инъекций, например, с помощью иглы высокого калибра, и способны увеличивать, корректировать или создавать объем или лифтинг лица, например, нижней части лица, например, подбородка или челюсти, или средней зоны лица, например, носа.
В некоторых вариантах осуществления концентрация ГК больше 20 мг/г. В других вариантах осуществления, концентрация ГК составляет приблизительно 21 мг/г или приблизительно 22 мг/г, или приблизительно 23 мг/г, или приблизительно 24 мг/г, или приблизительно 25 мг/г, или приблизительно 26 мг/г, или приблизительно 27 мг/г, или приблизительно 28 мг/г, или приблизительно 29 мг/г, или приблизительно 30 мг/г или больше. В других вариантах осуществления, композиция имеет концентрацию ГК 22,5-27,5 мг/г, например, 25,0 мг/г.
В некоторых вариантах осуществления способ добавляет объем и лифтинг подбородку или нижней части овала лица или носу пациента в течение периода времени от приблизительно 9 месяцев до приблизительно 24 месяцев после введения или инъекции в подбородок или нижнюю часть овала лица пациента. Композицию можно формовать, например, путем физического манипулирования тканью вблизи имплантата в течение периода времени после инъекции. Композиции могут иметь время схватывания, когда композиция больше не формуется и по существу сохраняет свою форму на протяжении времени существования имплантата, в течение от приблизительно 24 до приблизительно 48 часов после имплантации или инъекции.
В некоторых вариантах осуществления композиции дополнительно включают анестезирующее средство, например лидокаин HCl. Например, композиции могут включать приблизительно 0,3 масс./масс. % лидокаина HCl.
В предпочтительных вариантах осуществления композиции содержат гель гиалуроновой кислоты, предпочтительно в количестве приблизительно 25 мг; и лидокаина гидрохлорид, предпочтительно, в количестве приблизительно 3 мг, в фосфатном буфере (рН 7,2), предпочтительно в объеме q.s. (в достаточном количестве) 1 мл.
В некоторых вариантах осуществления композиция получена из смеси низкомолекулярной гиалуроновой кислоты и высокомолекулярной гиалуроновой кислоты. Например, поперечно-сшитая гиалуроновая кислота может быть получена из приблизительно 50% и приблизительно 100% низкомолекулярной гиалуроновой кислоты до сшивания поперечно-сшивающим агентом. В некоторых вариантах осуществления поперечно-сшитая гиалуроновая кислота получена из от приблизительно 70% до приблизительно 90% низкомолекулярной гиалуроновой кислоты до поперечного сшивания поперечно-сшивающим агентом. В некоторых вариантах осуществления поперечно-сшитая гиалуроновая кислота получена из приблизительно 90% низкомолекулярной гиалуроновой кислоты до поперечного сшивания с поперечно-сшивающим агентом.
Использование преимущественно низкомолекулярной ГК перед поперечным сшиванием, например приблизительно 50% или больше, например приблизительно 70%, или приблизительно 90% низкомолекулярной ГК, вместо использования преимущественно высокомолекулярной ГК, дает более прочный, более долговечный, формуемый гидрогель, имеющий более высокую когезивность и эластичность и более подходящий для моделирования и увеличения лица способами подкожной или супрапериостальной инъекции.
В некоторых вариантах осуществления ГК имеет степень поперечного сшивания от приблизительно 4% до приблизительно 12%. Например, ГК имеет степень поперечного сшивания приблизительно 4% или приблизительно 6%, или приблизительно 8%, или приблизительно 10%. В некоторых вариантах осуществления ГК имеет степень поперечного сшивания приблизительно 6,5%. В других вариантах осуществления ГК имеет степень поперечного сшивания приблизительно 7,5% или приблизительно 8,5%, или приблизительно 9,5%, или приблизительно 10,5%.
В другом аспекте изобретения предложены способы коррекции ретрузии подбородка у пациента. Способы, как правило, включают супрапериостальное введение в подбородок пациента эффективного количества композиции, содержащей BDDE-поперечно-сшитую гиалуроновую кислоту (ГК), где ГК имеет степень поперечного сшивания приблизительно 10% и концентрация ГК составляет больше 20 мг/г. Например, в предпочтительном варианте осуществления, концентрация ГК составляет приблизительно 25 мг/г.
В конкретном варианте осуществления композиции содержат низкомолекулярную гиалуроновую кислоту (NaГК), поперечно-сшитую с приблизительно 10 масс. % BDDE, с концентрацией приблизительно 25 мг/г с 0,3 масс. % гидрохлорида лидокаина в фосфатном буфере рН 7,2, и поставляемую в шприце из СОС (циклический олефиновый сополимер) объемом 1 мл.
Композиции экструдируют через иглу большим числом калибра, например иглу, имеющую калибр 25 G, 26 G, 27 G, 28 G, 29 G или 30 G. В конкретном варианте осуществления игла представляет собой иглу 27 калибра X 13 мм/27 G 1/2 X 26 мм.
Сила экструзии представляет собой силу (в Ньютонах Н), необходимую для выдавливания композиции из шприца с определенной скоростью. Например, у поставляемого 1 мл шприца из СОС и иглы TSK X 13 мм, сила экструзии некоторых композиций по настоящему изобретению может составлять от приблизительно 4 Н до приблизительно 15 Н при 13 мм/мин, что считается очень низким значением. Например, сила экструзии может составлять от приблизительно 7 Н до приблизительно 12 Н и предпочтительно от приблизительно 8 Н до приблизительно 10 Н.
В другом аспекте изобретения способы обеспечивают контурирование или коррекцию части лица, например задвинутого подбородка индивидуума. Способы включают, например, стадию субдермального введения пациенту в область обработки эффективного количества композиции по изобретению, например приблизительно 1,0 мл или больше, например приблизительно 2,0 мл или больше, например приблизительно 3,0 мл или больше, например 4,0 мл. Частью лица, которая должна быть улучшена или контурирована, может быть подбородок, например, задвинутый подбородок пациента. Область обработки может включать область, выбранную из группы, состоящей из погониона, ментума, левой предчелюстной борозды, правой предчелюстной борозды и сублабиальной складки. Лечение может включать введение композиции в две или более областей обработки.
Любой признак, описанный в настоящем документе и любая комбинация из двух или более таких признаков, включена в объем настоящего изобретения при условии, что признаки, включенные в такую комбинацию, не являются взаимно противоречивыми.
Краткое описание графических материалов
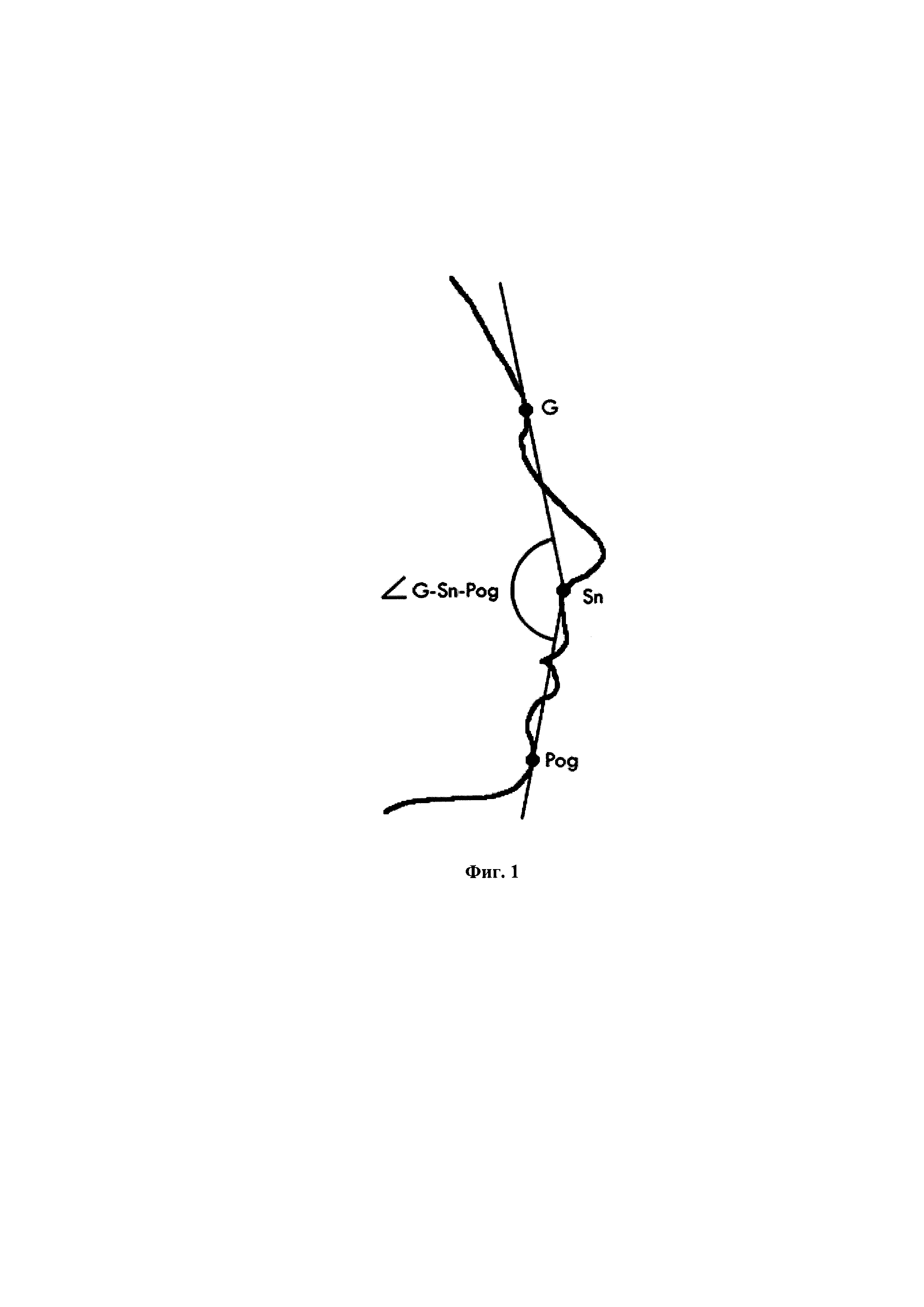
На Фиг. 1 показан профиль лица и ориентиры для расчета угла G-Sn-Pog у пациента.
На Фиг. 2 показан угол Burstone усредненного подбородка.
Подробное описание изобретения
Некоторые термины, используемые в описании, предназначены для обозначения следующих определений, подробно описанных ниже. В тех случаях, когда определение терминов отступает от общеупотребительного значения термина, заявитель намеревается использовать определения, приведенные ниже, если не указано иное.
Термин "приблизительно" в контексте числовых значений будет легко понят специалистом в данной области и, предпочтительно, означает, что конкретные значения могут быть изменены на +/- 10%. Что касается пограничных значений диапазонов, определение "приблизительно" предпочтительно означает, что значение нижней границы интервала может быть уменьшено на 10%, а значение верхней границы интервала может быть увеличено на 10%. Также предполагается, что каждое числовое значение или диапазон, раскрытые в этом приложении, могут быть абсолютными, то есть определение "приблизительно" может быть удалено.
Все числа, обозначающие в настоящем документе "молекулярную массу" ГК, следует понимать как обозначающие среднюю молекулярную массу (Mw) в Дальтонах.
Молекулярную массу ГК рассчитывают по измерению характеристической вязкости с использованием следующего отношения Марка Хоувинка:
Характеристическая вязкость (л/г)=9,78×10-5 × Mw0,690
Характеристическую вязкость измеряют в соответствии с процедурой, определенной Европейской Фармакопеей (монография ГК №1472, 01/2009).
Если не указано иное, термин молекулярная масса относится к средней молекулярной массе (Mw). ГК, используемая для изготовления композиций по изобретению, может содержать смесь высокомолекулярной ГК, низкомолекулярной ГК и/или среднемолекулярной ГК, где высокомолекулярная ГК имеет молекулярную массу больше чем приблизительно 2000000 Да (или характеристическую вязкость более 2,2 л/г), и где низкомолекулярная ГК имеет молекулярную массу меньше чем приблизительно 1000000 Да (или характеристическую вязкость меньше 1,4 л/г). Например, высокомолекулярная ГК в композициях по изобретению может иметь среднюю молекулярную массу в диапазоне от приблизительно 2 МДа до приблизительно 4,0 МДа, например, приблизительно 3,0 МДа (2,9 л/г). В другом примере, высокомолекулярная ГК может иметь среднюю молекулярную массу от приблизительно 2,4 МДа до приблизительно 3,6 МДа, например приблизительно 3,0 МДа. Высокомолекулярная ГК может иметь характеристическую вязкость больше 2,2 л/г, например, от приблизительно 2,5 л/г до приблизительно 3,3 л/г.
Низкомолекулярная ГК может иметь молекулярную массу от приблизительно 200000 Да (0,2 МДа) до меньше чем 1,0 МДа, например, от приблизительно 300000 Да (0,3 МДа) до приблизительно 750000 Да (1,1 л/г), и до, но не больше чем 0,99 МДа (1,4 л/г). Низкомолекулярная ГК может иметь характеристическую вязкость меньше приблизительно 1,40 л/г, например, от приблизительно 0,6 л/г до приблизительно 1,2 л/г.
Предпочтительно, не существует перекрытия между молекулярно-массовым распределением материалов с низкой и высокой молекулярной массой.
Предпочтительно, смесь низкомолекулярной ГК и высокомолекулярной ГК имеет бимодальное молекулярно-массовое распределение. Смесь также может иметь мультимодальное распределение.
В одном аспекте изобретения, композиции включают ГК с высокомолекулярным компонентом и низкомолекулярным компонентом, и высокомолекулярный компонент имеет среднюю молекулярную массу по меньшей мере в два раза превышающую среднюю молекулярную массу низкомолекулярного компонента.
Термин "степень сшивания", используемый в настоящем документе, относится к межмолекулярным соединениям, соединяющим отдельные молекулы полимера ГК или мономерные цепи в постоянную структуру или, как описано в настоящем документе, композицию филлера мягкой ткани. Кроме того, степень поперечного сшивания для целей настоящего изобретения дополнительно определяется как процентное массовое отношение поперечно-сшивающего агента к ГК-мономерным единицам в поперечно-сшитой части композиции на основе ГК. Она измеряется массовым отношением сшивающего агента к мономерам ГК.
Термин "не поперечно-сшитая ГК", используемый в настоящем документе, относится к отдельным молекулам полимера ГК, которые не являются поперечно-сшитыми. Не поперечно-сшитая ГК обычно остается водорастворимой. Фракция не поперечно-сшитой ГК необязательно может также быть включена в композиции, например, в качестве смазки и облегчать инъекцию в ткани лица. Такая композиция может содержать не поперечно-сшитую фракцию ГК, где добавленная не поперечно-сшитая ГК присутствует в концентрации от приблизительно 0,1 мг/г до приблизительно 3 мг/г. Предпочтительно, не поперечно-сшитая ГК может присутствовать в концентрации от приблизительно 0,2 мг/г до приблизительно 1,5 мг/г.
В других вариантах осуществления в гелях нет не поперечно-сшитой ГК, или по меньшей мере не поперечно-сшитую ГК добавляют к гелям в качестве смазки.
Композиции, описанные в настоящем документе, демонстрируют высокий уровень эластичности, выраженный в виде значения модуля упругости (G'), измеренного посредством осцилляционной реологии с деформацией 0,8%, с использованием системы конических пластин, и измеренной в диапазоне частот. В некоторых вариантах осуществления модуль упругости композиций, измеренный при частоте 5 Гц, составляет от приблизительно 500 Па до приблизительно 900 Па. Это считается высокой эластичностью в контексте дермальных наполнителей на основе ГК и способствует повышению эффекта лифтинга путем повышения устойчивости имплантата к деформации сдвига.
Когезивность относится к способности геля оставаться сцепленным с собой, что, например, означает устойчивость к разрыву и способность удлинять или сжимать гель без его распадения на части. Когезивность гелей по настоящему изобретению может быть количественно определена следующим образом (см. Derek Jones "Injectable Filers: Principles and Practice", Wiley, 2011, Chapter 3). Небольшой образец геля (например, 1 мл) помещают на плоскую поверхность реометра. Образец помещают так, что он образует небольшую горку. Подвижную верхнюю пластину помещают на образец, так чтобы образец был полностью закрыт, например, при осмотре пластины в направлении, перпендикулярном поверхности реометра, образец не виден. Чтобы обеспечить это, нужно выбрать размер пластины, который больше размера образца. В идеале, центр пластины помещают над образцом. Как правило, для 1 мл гелевого материала используют верхнюю пластину диаметром 25 мм.
На следующем этапе измерения, регулируют зазор между подвижной пластиной и поверхностью до 2,5 мм. Медленно и постоянно перемещая пластину из ее начального положения до ширины зазора 0,9 мм в течение 2 минут, регистрируют силу (Fn), развиваемую образцом в нормальном направлении на пластине.
По достижении ширины зазора 0,9 мм, системе дают вернуться в состояние равновесия в течение 12 минут. В течение этого времени продолжают измерения. Проведены пять измерений. Для нормализации измеренных сил, все 5 начальных значений Fn, измеренных при старте теста, усредняют (среднее арифметическое), и это среднее значение вычитают из всех других точек данных. Максимальная сила в конце сжимающей части этого теста (при достижении минимальной ширины зазора 0,9 мм между верхней пластиной и плоскостью) называется силой сжатия и является показателем для определения когезивности геля.
В частности, сила 20 гс (0,1962 Н) или больше указывает на когезивный материал в контексте настоящего изобретения. Гели с более низкими значениями силы сжатия, обычно не считаются когезивными в контексте настоящего изобретения. Точность этого измерения составляет порядка ±5 гс. В контексте настоящего изобретения, инъецируемая композиция обладает высокой когезивностью, по меньшей мере приблизительно 60 гс, например, от приблизительно 60 до приблизительно 200 гс. Например, в предпочтительном варианте осуществления, когезивность составляет от приблизительно 60 гс до приблизительно 100 гс, что придаст имплантату высокую устойчивость к давлению и нормальным силам в мягких тканях лица.
В контексте дермального филлера, когезивность, определенная выше, будет способствовать увеличению способности к лифтингу (клинически называемой волюмизацией/эффектом увеличения объема), обеспечиваемому гелем, вместе с его модулем упругости G'. В то время как когезивные гели могут демонстрировать хороший эффект волюмизации, некогезивные или слабокогезивные материалы с аналогичным модулем упругости проявляют более низкую способность к лифтингу из-за того, что материал некогезивного геля растекается больше, чем более когезивный материал, когда он подвергается вертикальному сжатию. В контексте настоящего изобретения композиции по изобретению демонстрируют как высокие уровни модуля упругости, так и высокие уровни когезивности, чтобы максимизировать эффект лифтинга при имплантации.
В некоторых предпочтительных вариантах осуществления, раскрытых в примерах, имплантаты или филлеры обычно содержат когезивную стерильную композицию, которую имплантируют субдермально или супрапериостально в область подбородка, нос или нижнюю часть овала лица пациента, нуждающегося в этом, например пациента, желающего улучшить профиль лица или "усилить" подбородок. Композиция обычно содержит поперечно-сшитую гиалуроновую кислоту (ГК), поперечно сшитую с диглицидиловым эфиром 1,4-бутандиола (BDDE); и концентрация ГК в композиции составляет больше 20 мг/г. Например, в некоторых вариантах осуществления концентрация ГК составляет приблизительно 22,5 мг/г или приблизительно 25 мг/г, или приблизительно 27,5 мг/г. ГК, используемая для поперечного сшивания, может быть изготовлена из смеси низкомолекулярной гиалуроновой кислоты и высокомолекулярной гиалуроновой кислоты. В некоторых вариантах осуществления композиции имеют модуль упругости от приблизительно 500 Па до приблизительно 900 Па при 5 Гц, и когезивность выше приблизительно 60 гс. Преимущественно, в некоторых вариантах осуществления композиции проявляют силу экструзии от приблизительно 4Н до приблизительно 15Н, например, от приблизительно 8Н до приблизительно 10 Н при 13 мм/мин, при использовании шприца из СОС объемом 1 мл и иглы 27 G × 13 мм.
В одном аспекте изобретения предложены инъекционные имплантаты на основе ГК, имеющие улучшенную способность к лифтингу, по сравнению с коммерческими дермальными филлерами на основе ГК. Имплантаты по изобретению упоминаются в некоторых случаях в настоящем описании альтернативно как дермальные филлеры и субдермальные филлеры. Имплантаты и филлеры по настоящему изобретению основаны на гиалуроновых кислотах (ГК) и фармацевтически приемлемых солях ГК, например гиалуронате натрия (NaГК). Также предложены способы изготовления этих композиций и способы использования этих композиций.
Используемый в настоящем документе термин гиалуроновая кислота (ГК), может относиться к любой из ее гиалуронатных солей и включает без ограничений гиалуронат натрия (NaГК), гиалуронат калия, гиалуронат магния, гиалуронат кальция и их комбинации. В настоящем изобретении, могут быть использованы как ГК, так и их фармацевтически приемлемые соли.
Кроме того, в вариантах осуществления с анестетиками концентрация одного или нескольких анестетиков находится в количестве, эффективном для уменьшения боли, возникающей при инъекции композиции. По меньшей мере, один местный анестетик может быть выбран из группы, включающей амбукаин, амоланон, амилокаин, беноксинат, бензокаин, бетоксикаин, бифенамин, бупивакаин, бутакаин, бутамбен, бутаниликаин, бутетамин, бутоксикаин, карцикаин, хлорпрокаин, кокаэтилен, кокаин, циклометикаин, дибукаин, диметизокин, диметокаин, диперодон, дицикломин, экгонидин, экгонин, этилхлорид, этидокаин, бета-эвкаин, эупроцин, феналкомин, формокаин, гексилкаин, гидрокситетракаин, изобутил п-аминобензоат, лейцинокаин-мезилат, левоксадрол, лидокаин, мепивакаин, меприлкаин, метабутоксикаин, метилхлорид, миртекаин, напаин, октокаин, ортокаин, оксетазаин, паретоксикаин, фенакаин, фенол, пиперокаин, пиридокаин, полидоканол, прамоксин, прилокаин, прокаин, пропанокаин, пропаракаин, пропипокаин, пропоксикаин, псевдококаин, пиррокаин, ропивакаин, салициловый спирт, тетракаин, толикаин, тримекаин, золамин и их соли. В одном варианте осуществления по меньшей мере один анестетик представляет собой лидокаин, например, в форме HCl лидокаина. Композиции, описанные в настоящем документе, могут иметь концентрацию лидокаина от приблизительно 0,1 масс. % до приблизительно 5 масс. % относительно массы композиции, например, от приблизительно 0,2 масс. % до приблизительно 1,0 масс. % относительно массы композиции. В одном варианте осуществления, композиция имеет концентрацию лидокаина приблизительно 0,3 масс. % относительно массы композиции (масс./масс. %). Концентрация лидокаина в композициях, описанных в настоящем документе, может быть терапевтически эффективной, что означает, что концентрация достаточна для обеспечения терапевтического эффекта без причинения вреда пациенту.
Композиции по изобретению могут быть получены посредством стадий предоставления очищенного материала ГК, например в виде волокон NaГК; материала ГК, имеющего требуемую молекулярную массу, например смеси низкомолекулярной и высокомолекулярной ГК в необходимой пропорции, гидратирования материала ГК; и поперечного сшивания гидратированного материала ГК с подходящим поперечно-сшивающим агентом в необходимом соотношении с образованием поперечно-сшитого геля на основе ГК. Затем гель может быть нейтрализован и подвергнут набуханию. При желании, может быть добавлен раствор, содержащий лидокаин, предпочтительно, кислотную соль гидрохлорида лидокаина с образованием геля ГК/лидокаин. Гель может быть гомогенизирован, например, путем измельчения или смешивания с усилием сдвига. Затем гомогенизированная композиция может быть упакована в шприцы. Шприцы затем стерилизуют путем автоклавирования при эффективной температуре и давлении. Например, композиции стерилизуют путем автоклавирования, например, подвергают воздействию температуры, составляющей по меньшей мере от приблизительно 120°С до приблизительно 130°С и/или давления, составляющего по меньшей мере от приблизительно 12 фунтов на квадратный дюйм (PSI), до приблизительно 20 PSI в течение периода времени по меньшей мере от 1 минуты до 15 минут. Стерилизованные шприцы упаковывают вместе с иглой высокого калибра для использования врачом.
Более конкретно, исходный неочищенный материал ГК может содержать волокна или порошок NaГК, например, волокна NaГК бактериального происхождения. Альтернативно, материал ГК может иметь животное происхождение, например, может быть получен из петушиных гребней. Предполагается, что материал ГК может представлять собой комбинацию неочищенных материалов, включающих ГК и по меньшей мере один другой полисахарид, например гликозаминогликан (GAG).
В одном из способов получения композиций чистые сухие волокна NaГК гидратируют в щелочном растворе для получения не поперечно-сшитого геля NaГК. Любой подходящий щелочной раствор можно использовать для гидратации NaГК на этой стадии, например водные растворы, содержащие гидроксид натрия (NaOH), гидроксид калия (КОН), бикарбонат натрия (NaHCO3), гидроксид лития (LiOH), и подобные, но не ограничиваясь ими. Полученный щелочной гель будет иметь рН больше 7,5. Полученный щелочной гель может иметь рН больше 9, или рН больше 10, или рН больше 12, или рН больше 13.
Следующая стадия в процессе получения может включать стадию поперечного сшивания гидратированного щелочного геля NaГК подходящим поперечно-сшивающим агентом. Поперечно-сшивающим агентом может быть любой агент, про который известно, что он подходит для поперечного сшивания полисахаридов и их производных через их гидроксильные группы. Одним из подходящих поперечно-сшивающих агентов является диглицидиловый эфир 1,4-бутандиола (BDDE).
В другом варианте осуществления поперечное сшивание ГК производят в ходе гидратации волокон ГК путем гидратации комбинированных высокомолекулярных и низкомолекулярных волокон в щелочном растворе, содержащем сшивающий агент, например, BDDE.
Степень поперечного сшивания в ГК компоненте композиций по изобретению составляет по меньшей мере приблизительно 4%, и составляет до приблизительно 12% BDDE/ГК масс. %, например, приблизительно 10%, например, приблизительно 8%, например, приблизительно 6%, например, приблизительно 4%. В конкретном варианте осуществления степень поперечного сшивания составляет приблизительно 6,5%. В некоторых вариантах осуществления ГК имеет степень поперечного сшивания приблизительно 6,5%. В других вариантах осуществления ГК имеет степень поперечного сшивания приблизительно 7,5% или приблизительно 8,5%, или приблизительно 9,5%, или приблизительно 10,5%.
Гидратированные поперечно-сшитые гели ГК могут быть подвержены набуханию, для получения требуемой концентрации ГК. Эта стадия может быть осуществлена путем нейтрализации поперечно-сшитого гидратированного геля ГК, например, путем добавления водного раствора, содержащего кислоту, например HCl. Затем гели оставляют набухать в фосфатно-солевом буферном растворе (PBS) в течение достаточного времени и при низкой температуре.
Теперь гели могут быть очищены традиционными способами, такими как диализ против фосфатного буфера или осаждением с помощью спирта, для извлечения поперечно-сшитого материала, для стабилизации рН материала и для удаления любого непрореагировавшего поперечно-сшивающего агента. Дополнительная вода или слабощелочный водный раствор могут быть добавлены, чтобы довести концентрацию ГК в композиции до требуемой концентрации. В некоторых вариантах осуществления концентрацию ГК композиций доводят до уровня выше 20 мг/г, например до приблизительно 25 мг/г. В других вариантах осуществления концентрацию ГК доводят до получения концентрации ГК приблизительно 21 мг/г, приблизительно 22 мг/г, приблизительно 23 мг/г, приблизительно 24 мг/г, приблизительно 26 мг/г, приблизительно 27 мг/г, приблизительно 28 мг/г, приблизительно 29 мг/г или приблизительно 30 мг/г.
В вариантах осуществления, в которых в конечную композицию должен быть включен анестезирующий агент, например лидокаин, рН очищенных поперечно-сшитых гелей ГК может быть подведена так, чтобы гель становился слегка щелочным, так чтобы гели имели рН больше чем приблизительно 7,2, например от приблизительно 7,5 до приблизительно 8,0. Эта стадия может быть выполнена любым подходящим способом, например путем добавления к гелям подходящего количества разбавленного NaOH, KOH, NaHCO3 или LiOH или любой другой щелочной молекулы, раствора и/или буферной композиции.
Эффективное количество анестетика, например лидокаина, такого как лидокаин HCl, затем добавляют к очищенным поперечно-сшитым гелям NaГК. Например, в некоторых вариантах осуществления лидокаин HCl предоставлен в виде порошка, который солюбилизируют с использованием воды для инъекций (WFI). Гели сохраняют нейтральным с помощью буфера или путем регулирования разбавленным NaOH, чтобы конечная композиция ГК/лидокаина имела требуемый, по существу нейтральный рН. Окончательные композиции, включающие лидокаин, могут иметь концентрацию лидокаина, составляющую по меньшей мере от приблизительно 0,1% до приблизительно 5 масс. %, например, приблизительно 2% относительно массы композиции, или в другом примере, приблизительно 0,3%.
После добавления лидокаина HCl или, альтернативно, во время добавления лидокаина HCl, гели ГК/лидокаин или композиции гомогенизируют для создания высокогомогенных гелей ГК/лидокаина, имеющих требуемую консистенцию и стабильность. Предпочтительно, стадия гомогенизации включает смешивание, перемешивание или измельчение гелей с контролируемой силой сдвига с получением по существу гомогенных смесей.
После гомогенизации композиции ГК, некоторое количество не поперечно-сшитого раствора ГК или геля может быть добавлено в композицию для повышения смазывающей способности.
В некоторых вариантах осуществления к композиции после гомогенизации не добавляют раствор не поперечно-сшитой ГК..
Затем композиции могут быть введены в шприцы и стерилизованы. Подходящие, согласно настоящему описанию, шприцы включают любой шприц, известный в данной области техники, способный доставлять вязкие композиции дермального филлера. Шприцы обычно имеют внутренний объем от приблизительно 0,4 мл до приблизительно 3 мл, от приблизительно 0,5 до приблизительно 1,5 мл, или от приблизительно 0,8 мл до приблизительно 2,5 мл. Указанный внутренний объем связан с внутренним диаметром шприца, который играет ключевую роль в силе экструзии, необходимой для введения высоковязких композиций дермального филлера. Внутренние диаметры обычно составляют от приблизительно 4 мм до приблизительно 9 мм, более предпочтительно, от приблизительно 4,5 мм до приблизительно 6,5 мм или от приблизительно 4,5 мм до приблизительно 8,8 мм. Кроме того, сила экструзии, необходимая для доставки композиций ГК из шприца, зависит от калибра иглы. Калибры используемых игл обычно включают в себя калибры от приблизительно 18 G до приблизительно 40 G, более предпочтительно от приблизительно 25 G до приблизительно 33 G или от приблизительно 25 G до приблизительно 30 G. Например, в некоторых вариантах осуществления композиции упаковывают в 1 мл шприц и вводят с использованием иглы 27 G.
Одним из предпочтительных способов стерилизации наполненных шприцев является автоклавирование. Автоклавирование может быть выполнено путем применения комбинации тепла, давления и влаги к образцу, который необходимо стерилизовать. На этом этапе можно использовать различные температуры стерилизации, давления и времена цикла. Например, наполненные шприцы можно стерилизовать при температуре по меньшей мере от приблизительно 120°С до приблизительно 130°С или выше. Влага может использоваться или не использоваться. Приложенное давление в некоторых вариантах осуществления зависит от температуры, используемой в процессе стерилизации. Цикл стерилизации может составлять по меньшей мере от приблизительно 1 минуты до приблизительно 20 минут или больше.
Другой способ стерилизации включает использование газообразного вещества, которое уничтожает или устраняет инфекционные агенты. Предпочтительно, в качестве стерилизующего газа используют этиленоксид, и в данной области техники известно, что он пригоден для использования при стерилизации медицинских устройств и препаратов.
Еще один способ стерилизации включает использование источника излучения, который, как известно в данной области, уничтожает или устраняет инфекционные агенты. Пучок излучения нацелен на шприц, содержащий композицию ГК, и волны излучения уничтожают или устраняют нежелательные инфекционные агенты. Предпочтительная полезная энергия включает в себя, но не ограничивается ими, ультрафиолетовый (УФ) свет, гамма-излучение, видимый свет, микроволны или волны любой другой длины или полосу длин волн, которая убивает или устраняет нежелательные инфекционные агенты, предпочтительно без существенного изменения разрушения композиции ГК.
Предпочтительно, композиции по изобретению также остаются стабильными при хранении в течение длительных периодов времени. Например, многие из композиций по изобретению имеют срок годности приблизительно 6 месяцев, приблизительно 12 месяцев, приблизительно 18 месяцев или приблизительно 24 месяца или больше, при хранении при температуре от приблизительно 2°С до 25°С. В конкретном варианте осуществления композиции стабильны при температуре от 2°С до 25°С в течение по меньшей мере 18 месяцев. В другом конкретном варианте осуществления, композиции стабильны при температуре от 2°С до 25°С в течение по меньшей мере 24 месяцев.
Способ инъекции композиций по изобретению может варьироваться в зависимости от угла и ориентации среза иглы и вводимого количества. Как правило, композиции по изобретению вводят подкожно и/или супрапериостально для увеличения проекции подбородка, ограничиваясь обработкой погониона, ментума (нижняя часть подбородка), предчелюстной борозды (левой и правой) и сублабиальной (ментальной) складки для достижения оптимальной коррекции и эстетического контура подбородка. Надлежащий объем инъекции определяется исследователем, но, как правило, не превышает максимальный общий объем приблизительно 4,0 мл для первоначальной и дополнительной инъекций вместе взятых. Для повторного лечения допускается введение общего объема инъекции до приблизительно 4,0 мл. Разрешается вводить не более чем 2,0 мл в одну зону обработки в любом сеансе лечения, где зоны обработки определены как погонион, ментум, предчелюстные борозды (левая и правая) и сублабиальная (ментальная) складка.
Перед инъекцией композиций по изобретению, область обработки необходимо тщательно продезинфицировать, чтобы гарантировать, что нет загрязнения инъекционного филлера бактериями или инородным телом (например, макияжем, тальком из перчаток).
Затем поставляемая игла 27 G 1/2 ''/ 27 G × 13 мм должна быть прикреплена к шприцу (в соответствии с указаниями по применению). Перед введением композиций по изобретению, шток поршня шприца должен быть нажат до тех пор, пока продукт заметно вытекает из иглы, и вытереть излишки стерильной марлей.
Композиции по изобретению вводят следующим образом: медленно инъецируют композиции по изобретению и наблюдают за кожей на предмет изменения цвета или обесцвечивания. Наблюдают за пациентом на предмет боли или дискомфорта. Композиции по изобретению инъецируют плавно и размеренно. Вставляют иглу с учетом местной сосудистой анатомии в месте инъекции. Осуществляют аспирацию, чтобы убедиться, что нет обратного тока крови, свидетельствующего о попадании наконечника иглы внутрь кровеносного сосуда.
Инъецировать в погонион можно супрапериостально, используя несколько небольших болюсов. Инъецировать в ментум можно супрапериостально, используя несколько небольших болюсов. Инъецировать в предчелюстные борозды (левую и правую) можно с использованием глубокой подкожной веерной техники. Инъецировать в сублабиальную (ментальную) складку можно применяя линейную, ретроградную или антероградную поверхностную подкожную технику прошивки.
Когда обработка завершена, обработанную область можно осторожно массировать, чтобы обеспечить равномерное распределение продукта и соответствие контуру окружающих тканей. Если происходит чрезмерная коррекция, аккуратно массируйте область пальцами или костяшками пальцев, чтобы получить оптимальные результаты.
Композиции по изобретению не должны быть введены в кровеносные сосуды (интраваскулярно). Введение гиалуроновой кислоты в сосудистое русло может закупорить сосуды и вызвать инфаркт или развитие эмболии. Симптомы окклюзии сосудов и эмболии сосудов включают боль, непропорциональную процедуре или удаленную от места инъекции, мгновенное побледнение, выходящее за пределы области инъекции и отражающее распространение композиции по изобретению по второстепенным сосудам, и изменения цвета, характеризующие ишемическую ткань, например потемнение или появление сосудистой сеточки.
Инъецирование продукта слишком поверхностно или в больших объемах на небольшой площади может привести к появлению видимых и постоянных вздутий и/или обесцвечиванию.
При использовании ретроградной техники композиции по изобретению инъецируют, прикладывая равномерное давление на шток поршня шприца, медленно потянув иглу назад. Важно, чтобы инъекция была остановлена непосредственно перед прохождением иглой дермоэпидермальной границы, чтобы предотвратить утечку материала или слишком поверхностное проникновение в кожу. При использовании антероградной техники необходимо убедиться, что игла находится в подкожной клетчатке до начала инъекции.
Если игла заблокирована, давление на шток поршня не увеличивают, а останавливают инъекцию и заменяют иглу.
Если обработанная область набухает сразу после инъекции, на нее можно положить пакет льда на короткое время. Если пациенты сообщают о воспалительных реакциях, которые сохраняются более 1 недели, или о каком-либо другом побочном эффекте, который развивается, врач должен использовать соответствующее лечение.
В предпочтительных вариантах осуществления композиции по изобретению включают гель гиалуроновой кислоты, предпочтительно в количестве приблизительно 25 мг; и лидокаина гидрохлорид, предпочтительно в количестве приблизительно 3 мг, в фосфатном буфере (рН 7,2), предпочтительно в объеме q.s. 1 мл, предварительно наполнены, например в одноразовый шприц объемом 1 мл, при этом гель гиалуроновой кислоты поперечно сшит с BDDE. Этот предварительно наполненный, например, 1 мл одноразовый шприц может содержаться в наборе (блистерная упаковка) вместе с двумя одноразовыми иглами (например, иглы 27 G 1/2''/27 G × 13 мм). Содержимое шприца можно стерилизовать влажным жаром. Одноразовые иглы можно стерилизовать ионизирующим излучением.
Композиции по изобретению представляют собой инъекционные имплантаты, предназначенные для восстановления и создания объема лица, например, в области подбородка и челюсти. Присутствие лидокаина предназначено для уменьшения боли у пациента во время лечения.
Пример 1. Получение инъекционного имплантата в соответствии с осуществлением изобретения
Предварительно высушенные волокна гиалуроната натрия (NaГК) (0,9 г), имеющего молекулярную массу приблизительно 0,9 МДа, взвешивали в первую емкость.
Предварительно высушенные волокна NaГК (0,1 г), имеющего молекулярную массу приблизительно 3,0 МДа, взвешивали во вторую емкость.
Два разных сорта NaГК объединяли и разбавляли в 1% растворе гидроксида натрия и перемешивали в течение одного-двух часов при температуре от 20°С до 50°С для получения по существу гомогенного щелочного геля ГК.
В отдельной емкости выбранный поперечно-сшивающий агент диглицидиловый эфир 1,4-бутандиола (BDDE) разбавляли в 1% растворе гидроксида натрия до конечной концентрации 10 масс. % BDDE.
К щелочному гелю ГК добавляли 10 масс. % BDDE (1 г предварительно приготовленного раствора BDDE). Полученную смесь механически гомогенизировали.
Затем смесь выдерживали при 50°С в течение периода времени от 3 до 4,5 часов.
Затем, полученный поперечно-сшитый полимер ГК погружали в фосфатный буфер (РВ), содержащий соляную кислоту, для стабилизации рН.
Полученный таким образом поперечно-сшитый полимер ГК затем погружали в ванны с фосфатным буфером для удаления непрореагировавшего сшивающего агента и ГК с получением очищенного гидрогеля со степенью поперечного сшивания приблизительно 6,5%.
Необязательно, сухой материал ГК с высокой молекулярной массой гидратировали в 1 литре фосфатного буфера для получения не поперечно-сшитого геля ГК. Этот не поперечно-сшитый гель ГК может быть добавлен к поперечно-сшитой композиции ГК до 5 масс. % относительно общей концентрации ГК.
Полученный гидрогель затем механически гомогенизировали для обеспечения окончательной гомогенности и упаковывали в шприцы, которые стерилизовали в автоклаве.
Полученный гель представляет собой инъекционную композицию, которую можно вводить субдермально или супрапериостально с помощью иглы высокого калибра (например, 27 калибра). Композиция пригодна для восстановления, контурирования или создания объема лица, например, в области подбородка, челюсти или носа человека, как описано в данном документе.
В одном аспекте изобретения предложены способы улучшения профиля лица пациента. Например, в некоторых вариантах осуществления предложены способы изменения лицевого угла G-Sn-Pog, например, увеличения лицевого угла G-Sn-Pog. Например, в некоторых вариантах осуществления предложены способы лечения для исправления ретрузии подбородка у пациента. В некоторых вариантах осуществления изобретения пациент перед началом лечения имел лицевой угол G-Sn-Pog меньше чем приблизительно 165°. После лечения, пациент имеет увеличенный лицевой угол G-Sn-Pog, то есть лицевой угол больше, чем первоначальный лицевой угол до лечения. В одном варианте осуществления пациент имеет угол G-Sn-Pog равный приблизительно 169° или больше после стадии введения. Угол G-Sn-Pog может быть измерен с использованием обычного оборудования и вычисления, например, могут быть основаны на вычислениях лицевого угла, полученных из цифровых изображений пациента, например с использованием научного оборудования для визуализации изображений Canfield. На Фиг. 1 показан профиль лица и ориентиры для расчета угла G-Sn-Pog у пациента, который может быть использован для диагностики или определения наличия и/или степени ретрузии подбородка с использованием известных методов.
Способы, как правило, включают введение по меньшей мере в одну область обработки лица пациента эффективного количества композиции, содержащей BDDE-поперечно-сшитую гиалуроновую кислоту (ГК), где ГК имеет степень поперечного сшивания приблизительно 6,5%, или приблизительно 10%, и имеет концентрацию ГК больше 20 мг/г.
В некоторых вариантах осуществления предложены способы лечения, включающие супрапериостальное введение композиции, описанной в настоящем документе, в по меньшей мере одну область обработки лица пациента, при этом у пациента лицевой угол G-Sn-Pog составляет от 145° до 165°. Значение лицевого угла может быть основано на вычислениях лицевого угла, полученных из цифровых изображений лица пациента, или с использованием других методов. В соответствии с некоторыми вариантами осуществления, стадия введения приводит к увеличению лицевого угла G-Sn-Pog у пациента по отношению к лицевому углу G-Sn-Pog у пациента перед лечением, например, непосредственно перед стадией введения. В некоторых вариантах осуществления пациент имеет увеличенный угол G-Sn-Pog в течение периода времени по меньшей мере приблизительно 3 месяца или более предпочтительно в течение по меньшей мере приблизительно 6 месяцев, например, приблизительно от 9 месяцев до приблизительно 24 месяцев после введения. Например, пациент имеет увеличенный угол G-Sn-Pog в течение по меньшей мере приблизительно 6 месяцев, или в течение по меньшей мере приблизительно 9 месяцев или по меньшей мере приблизительно 12 месяцев или по меньшей мере приблизительно 18 месяцев или по меньшей мере приблизительно 24 месяца после стадии введения.
В некоторых вариантах осуществления область обработки представляет собой область, выбранную из группы, состоящей из погониона, ментума, левой предчелюстной борозды, правой предчелюстной борозды и сублабиальной складки. Лечение может включать введение композиции в две или более областей обработки. Введение включает инъекцию композиций супрапериостально или субдермально в количестве от приблизительно 0,5 мл до приблизительно 3,0 мл на область обработки. В некоторых вариантах осуществления количество, вводимое в данную область обработки, не превышает 2,0 мл. В некоторых вариантах осуществления общее количество, вводимое в ходе однократного сеанса лечения, во все области лечения, составляет от 2,0 мл до приблизительно 6,0 мл, например, приблизительно 2,5 мл, приблизительно 3,0 мл, приблизительно 3,5 мл, приблизительно 4,0 мл, приблизительно 4,5 мл, приблизительно 5,0 мл, приблизительно 5,5 мл или приблизительно 6,0 мл. В некоторых вариантах осуществления количество, вводимое в ходе однократного сеанса лечения, составляет приблизительно 4,0 мл или меньше.
Восстановление и создание объема в подбородке и челюсти
В одном из аспектов настоящего изобретения предложены способы восстановления и создания объема в подбородке и челюсти, например, при моделировании, формировании и контурировании определенных областей лечения лица. Области лечения могут включать в себя одну или несколько из погониона (наиболее выступающая точка на передней поверхности подбородка), ментума (самая низкая точка на подбородке), левой и правой предчелюстной борозды (левая вырезка антигониона и правая вырезка антигониона) и сублабиальной (ментальной) складки (складки между нижней губой и ментумом).
Форма и проекция подбородка способствуют балансу пропорций лица, который лежит в основе привлекательности. Недостаточно выступающий подбородок обычно называют "слабым подбородком", тогда как выступающие подбородки называют "сильными подбородками" и подразумевают силу личности. В нескольких исследованиях было показано, что лица со средними пропорциями считаются наиболее привлекательными, и что ювенильные черты лица, включающие небольшой подбородок, считаются привлекательными у женщин, тогда как сильный подбородок и челюсть считаются привлекательными у мужчин. Внешний вид подбородка является определяющим фактором воспринимаемой привлекательности и может влиять на психосоциальное благополучие человека
Средние пропорции определены на основе анализа представленных профилей лиц в популяции и включают расстояния и углы между носом, губой и ментумом. В цефалометрическом анализе использовали несколько точек мягких тканей для измерения и диагностики протрузии и ретрузии подбородка как отклонений от средних параметров лица. Пересечение верхних лицевых и передних нижних лицевых компонентов и угол, образованный точкой на глабелле, субназале и погонионе (G-Sn-Pog), были тщательно проанализированы для понимания средней проекции подбородка, общей среди популяций. Угол Бурстоуна (фиг. 2) был определен равным приблизительно 169° для среднего подбородка и приблизительный угол (168°-169°) был подтвержден в нескольких исследованиях.
Отклонения от среднего подбородка, по мере нарастания, приводят восприятию лица как непривлекательного. Анализ взаимосвязи между профилем лица и воспринимаемой привлекательностью показывает, что подбородочный выступ играет важную роль в этом восприятии. Чтобы понять взаимосвязь между степенью выступания подбородка и привлекательностью, группа изображений профилей, измененных с шагом в 2 мм от изображения идеализированного профиля, была представлена группе пациентов с ортогнатией готовящихся к лечению, врачей и обычных людей (непрофессионалов). Участникам было предложено оценивать каждое изображение по 7-балльной шкале Лайкерта, от крайне непривлекательного до очень привлекательного. Оценки воспринимаемой привлекательности снижались в среднем на 0,15 по шкале Лайкерта на каждые 2 мм ретрузии подбородка и были очевидны после изменения на 4 мм. Степень ретрузии подбородка, при которой была желательна операция, составила 11 мм для пациентов и врачей и 10 мм для обычных людей. Самым привлекательным изображением было то, которое показывало идеальный ортогнатический профиль с погонионом мягких тканей, опирающимся на истинную вертикальную линию.
Пример 2. Способ увеличения лицевого угла G-Sn-Pog у субъекта, имеющего ретрузию подбородка или слабый подбородок
Композицию по изобретению вводили в виде инъекционного имплантата путем субдермальной или супрапериостальной инъекции в подбородочную область и/или область челюсти 32-летнего пациента-мужчины. Пациент жалуется, что у него "слабый подбородок". Врач измеряет угол лица субъекта и определяет, что угол G-Sn-Pog составляет приблизительно 150°, что существенно меньше, чем классический угол Burstone среднего подбородка (приблизительно 169°). Измерение основано на расчетах лицевого угла, полученных из цифровых изображений, полученных с использованием оборудования и программного обеспечения для обработки изображений Canfield.
Врач считает, что ретрузия лица/челюсти субъекта может быть исправлена путем лечения, направленного на увеличение горизонтальной проекции подбородка (вид в профиль), а не удлинения или расширения подбородка.
Врач полагает, что он может обеспечить субъекту более привлекательный профиль лица и более сильную линию подбородка путем применения имплантируемых композиций, описанных в настоящем документе.
Пациент проходит три сеанса лечения, включая начальную обработку, дополнительную обработку и повторную обработку, как описано ниже.
Для каждой обработки области обработки включают по меньшей мере одну или несколько из следующих областей обработки: погонион (наиболее выступающая точка на передней поверхности подбородка), ментум (самая низкая точка на подбородке), левая предчелюстная борозда (левая вырезка антигониона), правая предчелюстная борозда (правая вырезка антигониона) и/или сублабиальная складка (складка между нижней губой и ментумом).
Врач имплантирует не более 2,0 мл в одну зону обработки в ходе любого сеанса лечения.
Первоначальную обработку проводили следующим образом. Врач проводит асептическую подготовку кожи и проводит анестезию в соответствии со своей стандартной практикой. Применение льда и местной анестезии может уменьшить дискомфорт при введении. Инъекционная анестезия ограничена только участками обработки и вводится так, чтобы не деформировать планируемые области лечения.
Используя иглы (27 G × 13 мм/27 G 1/2''), поставляемые с набором, врач вводит композиции, описанные в настоящем документе, подкожно и/или супрапериостально, чтобы увеличить проекцию подбородка (горизонтально, вид в профиль), а также эстетически смоделировать, контурировать, и придать форму, ограничивая лечение областью погониона, ментума, предчелюстной борозды и сублабиальной (ментальной) складки. Соответствующие техники инъекции были описаны выше. Целью лечения является увеличение проекции подбородка (горизонтально, вид в профиль) и достижение эстетического контура подбородка. Врач определяет соответствующий объем инъекции до приблизительно 4,0 мл для первоначальной и возможной дополнительной обработки вместе взятых.
Врач осторожно формирует обработанную область с помощью ручного манипулирования лежащей сверху тканью для достижения требуемого контура лица.
Дополнительное лечение осуществляют примерно через 30 дней после первоначального лечения, если это требуется пациенту, или, если, по мнению врача, оптимальное (полное) увеличение проекции подбородка и/или эстетическое контурирование не было достигнуто в результате первоначальной обработки. Если проводится дополнительная обработка, общий объем вводимой композиции (после первоначальной и дополнительной обработки) составляет от приблизительно 2,0 мл до приблизительно 4,0 мл. Во время этого визита врач оценивает области обработки на предмет любой локальной реакции и обсуждает любые отмеченные симптомы. Трехмерные цифровые изображения лица (фронтальные и профильные изображения) записывают для объективного вычисления угла ретрузии подбородка. Если врач определит в ходе последующего дополнительного осмотра, что оптимальное (полное) увеличение проекции подбородка или эстетическое контурирование не было достигнуто в результате первоначального лечения, то пациенту рекомендуют получить дополнительное лечение.
Одно повторное лечение назначают в ходе запланированного осмотра между месяцами 18 и 24, если повторное лечение оправданно по мнению врача, и/или по желанию пациента. Объем инъекции для подбородка не превышает общий объем 4,0 мл для повторного лечения.
Хотя изобретение было описано и проиллюстрировано с определенной степенью детализации, понятно, что настоящее раскрытие было сделано только в качестве примера и что специалисты в данной области техники могут прибегать к многочисленным изменениям в комбинации и компоновке деталей, не отступая от объема изобретения, как заявлено в дальнейшем.
Если не указано иное, все числа, выражающие количества ингредиентов, свойства, такие как молекулярная масса, условия реакции и т.д., используемые в описании и формуле изобретения, следует понимать как модифицированные во всех случаях термином "приблизительно". Соответственно, если не указано обратное, числовые параметры, указанные в описании и прилагаемой формуле изобретения, являются приближенными и могут варьироваться в зависимости от требуемых свойств, которые должны быть получены в соответствии с настоящим изобретением. Каждый численный параметр должен по меньшей мере истолковываться в свете количества заявленных значащих цифр и применения обычных методов округления, что по меньшей мере не является попыткой ограничить применение доктрины эквивалентов рамками формулы изобретения.
Несмотря на то, что числовые диапазоны и параметры, определяющие широкий объем изобретения, являются приближенными, численные значения, указанные в конкретных примерах, заявлены как можно точнее. Любое числовое значение, однако, по своей сути содержит определенные ошибки, неизбежно возникающие в результате стандартного отклонения, обнаруженного в их соответствующих тестовых измерениях.
Конкретные раскрытые здесь варианты осуществления могут быть дополнительно ограничены в формуле изобретения с использованием выражений "состоящий из", или "состоящий по существу из". При использовании в формуле изобретения, как поданной, так и добавленной после каждого изменения, переходный термин "состоящий из" исключает любой элемент, стадию или ингредиент, не указанные в формуле изобретения. Переходный термин "состоящий по существу из" ограничивает объем заявки указанными материалами или стадиями и теми, которые не оказывают существенного влияния на основную и новую характеристику (характеристики). Варианты осуществления изобретения, заявленные таким образом, по своей сути или прямо описаны и включены в настоящее описание.
В заключение, следует понимать, что варианты осуществления изобретения, раскрытые в настоящем документе, являются иллюстрацией принципов настоящего изобретения. Другие модификации, которые могут быть использованы, входят в объем изобретения. Таким образом, в качестве не ограничивающего примера, альтернативные конфигурации настоящего изобретения могут быть использованы в соответствии с приведенными здесь инструкциями. Соответственно, настоящее изобретение не ограничивается этим, как показано и описано.
Реферат
Группа изобретений относится к области косметологии, а именно: к стерильному гелю для моделирования лица, имплантируемому субдермально или супрапериостально в область подбородка, нижнюю часть овала лица или нос нуждающегося в этом пациента; к способу коррекции ретрузии подбородка у пациента; к способу создания или восстановления объема подбородка или челюсти пациента; к набору для моделирования лица; и к способу моделирования лица или увеличения, коррекции, восстановления или создания объема в области подбородка и челюсти у пациента. Предложенный стерильный гель содержит поперечно-сшитую гиалуроновую кислоту (ГК) в концентрации более 20 мг/г, полученную путем поперечного сшивания диглицидиловым эфиром 1,4-бутандиола (BDDE) смеси низкомолекулярной ГК (при ее содержании по меньшей мере 50 мас.%) и высокомолекулярной ГК, причем гель имеет модуль упругости 500-900 Па при 5 Гц, когезивность выше 60 гс и проявляет силу экструзии 4-15 Н при 13 мм/мин с использованием шприца из COC (циклический олефиновый сополимер) объемом 1 мл и иглы 27 G х 13 мм. Группа изобретений обеспечивает наполнитель, легко инъецируемый через тонкую иглу, который является эффективным для создания объемов и контура лица. 5 н. и 41 з.п. ф-лы, 2 ил., 2 пр.

Комментарии