Способ получения стабильных в кислой среде производных бензимидазола - RU2105773C1
Код документа: RU2105773C1
Чертежи
Описание
Изобретение относится к способу получения оральных лекарств с энтеросолюбильным покрытием, содержащих нестабильные в кислой среде соединения, в частности, к оральному лекарству с энтеросолюбильным покрытием, полученному в форме стабильной в кислой среде стандартной дозы, представляющей собой комплекс включения, полученный при взаимодействии производного бензимидазола нестабильного в кислых условиях соединения с циклодекстрином в щелочной среде.
Нестабильные в кислой среде соединения, и особенно соединения на основе бензимидазола, легко обесцвечиваются и разлагаются в кислой и нейтральной среде. Например, омепразол, производное бензимидазола, имеет время полураспада 10 мин в среде с pH ниже 4, но 18 ч. при pH 6,8 и около 300 дней при pH 11. Омепразол, как описывали, отличается стабильностью в щелочных условиях (Pilbrant A. Cederberg C. Scand. J. Castrenterology. Suppl. 108, 113-120. 1985). Нестабильные в кислой среде соединения под действием влаги воздуха или растворителя также обесцвечиваются и разлагаются.
Терапевтическое использование нестабильных в кислых средах соединений, которые ингибируют выделение желудочной кислоты и используются при лечении язвы желудка и/или язвы двенадцатиперстной кишки, требуют подходящего механизма защиты этих соединений от разложения в желудочном соке после орального введения.
Способы стабилизации кислотно-нестабильных соединений, в частности, омепразола, как известно, заключаются в следующем. Омепразол смешивают с солью щелочного металла, такой как соль Na+, K+, Mg2+, Ca2+, что сохраняет стабильность самого соединения.
В публикации международной заявки PCT N 86-00913 (PCT/EP 85/0037) раскрывается образование стабильного комплекса при смешивании и взаимодействии омепразола с β -циклодекстрином в 96%-ном этаноле и охлаждении реагентов.
Последний процесс, как оказывается, сопровождается обесцвечиванием и разложением самого омепразола, когда реакцию проводят при температурах 25-38oC в течение 15 ч в этаноле.
Кроме того, трудно ожидать образования соединения включения, так как и омепразол, и циклодекстрин диспергированы в реакционной среде в виде твердых частиц, а не находятся в растворенном состоянии. Для образования соединений включения на основе циклодекстрина реакцию необходимо проводить в присутствии молекул воды (К. Hara, H. Hashimoto. J. Jpn,Soc. Sarch. Sci 32(2), 152-161. 1986). Следовательно, нельзя ожидать, что последний способ приведет к образованию соединений включения, так как описанные выше реакционные условия не рассматривались.
С другой стороны, в выкладке корейской заявки N 87-9718 и Корейской патентной публикации N 91-4579 раскрывается получение препаратов омепразола, которое включает смешение омепразола с щелочным соединением с образованием материала ядра, формирование водорастворимого внешнего слоя на ядре и формирование энтеросолюбильного покрытия для стабилизации омепразола.
Однако установлено, что способы, описанные в Корейских патентных публикациях, имеют ряд следующих недостатков.
Способ получения материала ядра и формирования энтеросолюбильного покрытия очень сложен. Стабилизированный омепразол во время пребывания в желудке после орального применения подвергается обесцвечиванию и разложению, так как желудочный сок проходит через энтеросолюбильное покрытие, частично растворяет водорастворимое внутреннее покрытие и затем проникает в ядро, растворяя щелочное вещество и частично разрушая энтеросолюбильное покрытие.
Таким образом, полная стабильность омепразола при таком процессе не обеспечивается. При приготовлении препаратов на основе омепразола необходимо уделить большое внимание самому омепразолу. Например, он должен находиться при температуре ниже -20oC и сразу же использоваться после удаления влаги или сразу после синтеза, чтобы обеспечить начальную стабильность.
Кроме того, для кислотно-нестабильного соединения первичный фактор заключается не только в сохранении стабильности препарата, но также в стабильности самого соединения. Следовательно, при попытке стабилизировать кислотно-нестабильное соединение необходимо принимать во внимание стабильность соединения при проведении процесса стабилизации, его стабильность относительно желудочного сока и необходимость быстрого и полного растворения, что делает большую часть лекарства доступной для поглощения и кишечнике.
Как обсуждалось выше, большинство ранее описанных способов обеспечивают либо частичную стабилизацию лекарства, либо все попытки получить стабильные соединения включения при добавлении щелочных солей к омепразолу были безуспешными.
Цель настоящего изобретения заключается в получении орального лекарства на основе нестабильного в кислой среде соединения, имеющего хорошую стабильность при хранении, способного растворяться и абсорбироваться после орального применения, в разработке способа получения, который включает образование комплекса включения при взаимодействии кислотно-нестабильного соединения с циклодекстрином, с получением стабилизированного соединения.
В настоящем изобретении описан способ получения орального лекарства с энтеросолюбильным покрытием при использовании циклодекстрина для стабилизации кислотно-нестабильного соединения, который отличается тем, что кислотно-нестабильное соединение взаимодействует с циклодекстрином из расчета 1≈10 молей на 1 моль кислотно-нестабильного соединения в щелочном растворе с получением комплекса включения без присутствия щелочного соединения.
В настоящем изобретении предложена новая система растворителей вместо органического растворителя, такого, как этанол, который использовался в работах предшествующего уровня, в которой кислотно-нестабильное соединение реагирует с циклодекстрином с целью стабилизации. Щелочной раствор, используемый в настоящем изобретении, выполняет функцию, отличную от функции щелочного растворителя, используемого ранее. В результате получаемый в соответствии с настоящим изобретением комплекс включения не содержит щелочных компонентов.
В соответствии с настоящим изобретением, при взаимодействии кислотно-нестабильного соединения с циклодекстрином в щелочном растворе, реакцию проводят в гомогенной системе растворителей в течение 1≈30 мин при 40≈70oC, а после охлаждения до комнатной температуры реакционный раствор выдерживают при 4oC для формирования осадка комплекса включения. Реагент отфильтровывают для удаления остатка щелочного компонента и для получения чистого стабильного желаемого комплекса включения.
В описанной выше реакции, если температура ниже 40oC, растворимость циклодекстрина уменьшается и появляется необходимость в избытке щелочного раствора и если температура выше 70oC, кислотно-нестабильное соединение может обесцвечиваться или разлагаться.
Кроме того, при реакционном времени менее 1 мин кислотно-нестабильное соединение и циклодекстрин не растворяются полностью в щелочном растворе, а при реакционном времени более 30 мин кислотно-нестабильное соединение также подвергается обесцвечиванию и разлагается.
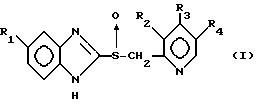
В настоящем изобретении в качестве кислотно-нестабильного соединения предпочтительно используется производное бензимидазола, имеющее
следующую формулу (I) и его фармацевтически приемлемая соль:
где
заместитель R1 выбирают из группы, включающей атом водорода, метокси-группу, трифторметильную группу и тетрафторэтокси-группу;
заместитель R2 выбирают из группы, включающей атом водорода, метиламинную или диметиламинную группу;
заместитель R3 выбирают из группы, включающей атом водорода, метокси-группу, арилокси-группу и пропаргилокси-группу; и
заместитель R4 представляет собой атом водорода или метильную группу.
Фармацевтические препараты, содержащие вышеуказанные кислотно-нестабильные соединения в фармацевтически эффективном количестве могут быть приготовлены, в соответствии с настоящим изобретением, в форме стандартных доз для орального применения, например, в форме таблеток, гранул, капсул, сферических пилюль, микрогранул или микрокапсул.
В соответствии с настоящим изобретением, кислотно-нестабильные соединения реагируют с циклодекстрином, в структуре которого присутствует гидрофобная полость необходимого размера, при этом образуется комплекс включения, так что циклодекстрин защищает гидрофобные соединения от внешней среды, захватывая их в эту полость.
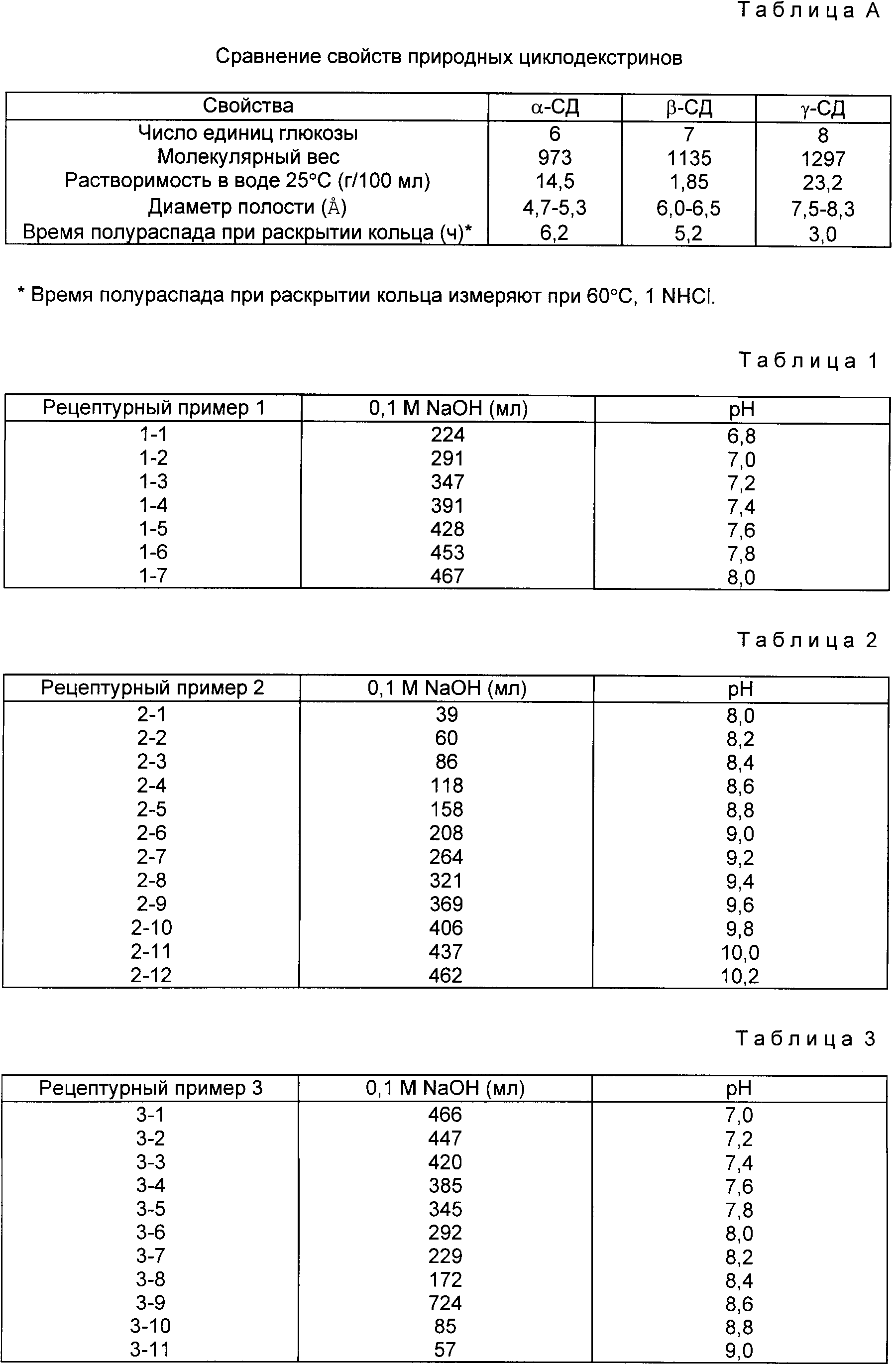
Циклодекстрин может быть приготовлен при расщеплении крахмала циклодекстрингликозилтрансферазой и его классифицируют по свойствам и размерам, так как это показано в таблице A.
В настоящем изобретении может быть использован циклодекстрин (ЦД), выбираемый из группы, включающей α-, β- и γ- циклодекстрин, а также производные циклодекстрина, такие как метил- β -циклодекстрин, гидраксиэтил b -циклодекстрин, гидроксипропил- a -циклодекстрин, гидроксипропил- b -циклодекстрин, гидроксипропил- g -циклодекстрини и др.
В настоящем изобретении для получения порошка стабильного комплекса включения в качестве щелочного раствора используется водный раствор, выбираемый из группы раствора, включающей растворы гидроксидов щелочного металла, щелочных солей органических или неорганических кислот, аминов, буферов и их солей.
Щелочные соединения настоящего изобретения, присутствующие в виде щелочного водного раствора, могут быть представлены следующими примерами: гидроксиды щелочного металла могут выбраться из группы, включающей гидроксид натрия, гидроксид калия, гидроксид кальция, гидроксид бария и их смеси.
Щелочные соли могут выбираться из группы, включающей борат натрия, карбонат натрия, фосфат натрия, борат натрия, карбонат калия, фосфат калия, ацетат натрия, цитрат натрия и их смеси. Амины могут выбираться из группы, включающей диэтиламин, триэтиламин, бутиламин, этилендиамин, триэтаноламин, пропиламин, дипропиламин, диэтаноламин, моноэтано ламин, изобутиламин, диизопропиламин, трет. -бутиламин, дибутиламин, диизобутиламин, трибутиламин, пентиламин, дипентиламин и их смеси.
Буферные растворы могут выбираться из группы, включающей карбонатный буфер, фосфатный буфер, боратный буфер, солевой аминный буфер и их смеси.
Если в качество щелочного водного раствора используется раствор гидроксида щелочного металла, соли щелочного металла органической или неорганической кислоты, то более низкое значение pH щелочного раствора влияет на кислотно-нестабильное соединение, которое может в процессе реакции стабилизации подвергаться обесцвечиванию или разложению.
Кроме того, более высокое значение pH требует более продолжительной водной промывки для получения нейтрального комплекса включения кислотно-нестабильного соединения в циклодекстрине и выход уменьшается, так как при водной промывке часть комплекса включения вымывается водой. Следовательно, величина pH щелочного раствора должна предпочтительно составлять 8,0 12.0.
При использовании в щелочном растворе амина для образования комплекса включения в стабильных условиях и для уменьшения времени обработки предпочтительно может использоваться 0,01≈0, 5 M водный раствор амина.
С другой стороны, вышеуказанный циклодекстрин в настоящем изобретении предпочтительно используется при соотношении 1≈10 молей на 1 моль кислотно-нестабильного соединения. Если циклодекстрин используется в количестве менее 1,0 моля, а кислотно-нестабильное соединение находится в избытке, и если циклодекстрин используется в количестве более 10 молей, количество кислотно-нестабильного соединения в получаемом комплексе включения понижается из-за непрореагировавшего циклодекстрина.
В соответствии с настоящим изобретением, прозрачный раствор, получаемый в результате описанной выше реакции, охлаждается до низкой температуры (4oC) и выдерживается при этой температуре в течение 3≈15 ч для образования микрокристаллического порошка комплекса включения.
Для получения комплекса включения охлаждение реакционной смеси следует проводить очень внимательно, чтобы следить за образованием кристаллического осадка. Если время обработки меньше 3 ч, образование осадка комплекса включения недостаточно, и если время обработки выше 15 ч, выход необходимого продукта уменьшается, а комплекс включения может быть обесцвечен реакционным раствором.
Полученный комплекс включения промывают небольшим количеством холодной воды несколько раз до полного удаления оставшейся щелочной компоненты на комплексе включения и получают нейтральный очищенный комплекс.
С другой стороны, реакционный раствор может быть очищен при распылительной сушке, при сушке вымораживанием, вакуумным упариванием или путем перекристаллизации, при этом получают порошок очищенного комплекса включения в виде стабильного продукта, и в то же время процесс очистки может быть проведен как и в работах предшествующего уровня с учетом свойств системы, а именно, типа раствора.
Полученный в соответствии с настоящим изобретением комплекс включения очевидно сам должен иметь повышенную стабильность при хранении и одновременно должен полностью сохранять стабильность при получении препарата и в желудочном соке при наличии прекрасной способности к растворению и поглощению.
В стабилизированном комплексе включения щелочная компонента отсутствует, так как щелочной раствор, в соответствии с настоящим изобретением, используется только в качестве реакционного раствора в процессе стабилизации. Этот процесс отличается от использовавшихся ранее процессов, так как получаемый материал ядра не содержит щелочной компоненты, присутствие которой является обычным для предшествующего уровня.
При получении фармацевтического препарата, содержащего комплекс включения настоящего изобретения в форме стандартной дозы для орального введения, вышеуказанный комплекс может быть смешан с такими наполнителями, как микрокристаллическая целлюлоза, крахмал, манитол и др. диспергирующими добавками такими, как глюколат натрия крахмала и др. а также со смазывающими веществами, например, со стеаратом магния.
Смесь затем прессуют в таблетки, содержащие активный ингридиент, например, из расчета 20 мг омепразола на одну таблетку. Приготовленные таблетки могут быть покрыты водорастворимым веществом, выбираемым из группы, включающей гидроксипропилметилцеллюлозу, гидроксипропилцеллюлозу, поливинилидон и поливиниловый спирт, с последующим нанесением энтеросолюбильного агента, выбираемого из группы, включающей фталат гидроксипропилметилцеллюлозы, фталат ацетата целлюлозы и сополимер метакриловой кислоты и метакрилата, который смешивается с пластификатором в органическом растворителе.
Полученные в соответствии с настоящим изобретением препараты с энтеросолюбильным покрытием, являясь стабилизированными препаратами, содержащими в качестве активной компоненты кислотно-нестабильное соединение, терапевтически могут применяться для лечения желудочно-кишечных заболеваний.
Способ, описанный в данном изобретении, обеспечивает повышенную стабильность кислотно-нестабильных соединений относительно кислоты, повышает растворимость и улучшает общую стабильность. В случае омепразола данный способ позволяет полностью решить проблему его стабильности.
Следующие примеры иллюстрируют предпочтительное воплощение настоящего изобретения, но не ограничивают его.
Подготовительный пример 1. Буферный раствор (фосфатный).
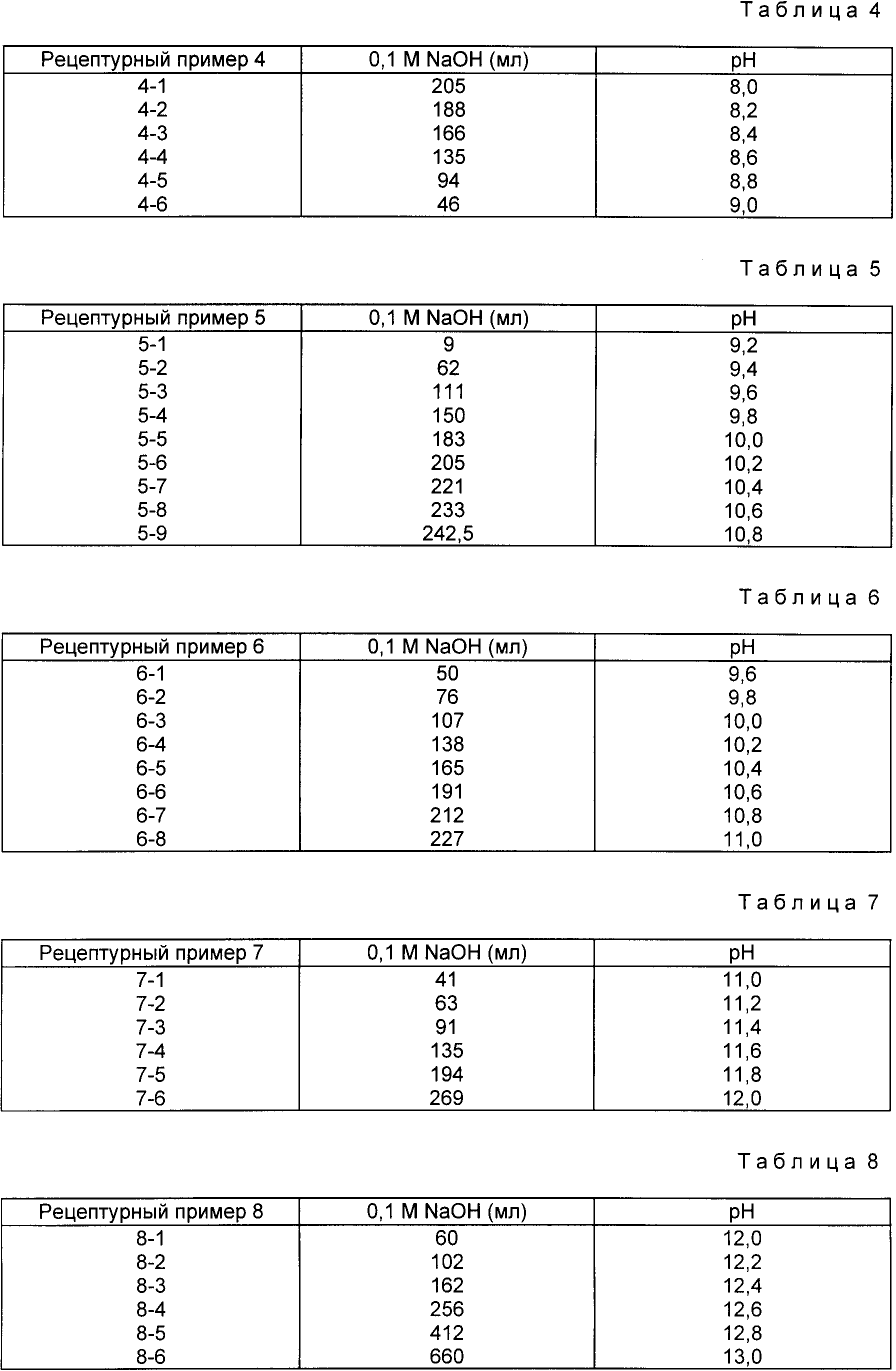
Для получения щелочного раствора для стабилизации кислотно-нестабильного соединения в 500 мл 0,1 M раствора KH2PO4 добавляют 0.1 M раствор NaOH по схеме, приведенной в табл. 1.
Эти растворы затем разбавляют водой до 1000 мл для получения раствора фосфатного буфера. Для селективного использования в щелочном растворе измеряют значение pH каждого полученного буферного раствора.
Подготовительный пример 2. Буферный раствор (боратный).
Для получения боратных буферных растворов, в соответствии с подготовительным примером 1 в 500 мл 0,1 M раствора H3BO3-KCl добавляют 0,1 M раствор NaOH по схеме, приведенной в табл. 2. Для селективного использования в щелочном растворе измеряют значение pH каждого полученного буферного раствора.
Подготовительный пример 3. Тройной буферный раствор.
Для получения буферных растворов аминной соли, в соответствии с подготовительным примером 1, в 500 мл 0,1 M раствора трис(гидроксиметил)аминометана добавляют 0,1 M раствор HCl по схеме, приведенной в табл. 3.
Для селективного использования в щелочном растворе измеряют значение pH каждого полученного буферного раствора.
Подготовительный пример 4. Буферный раствор (боратный).
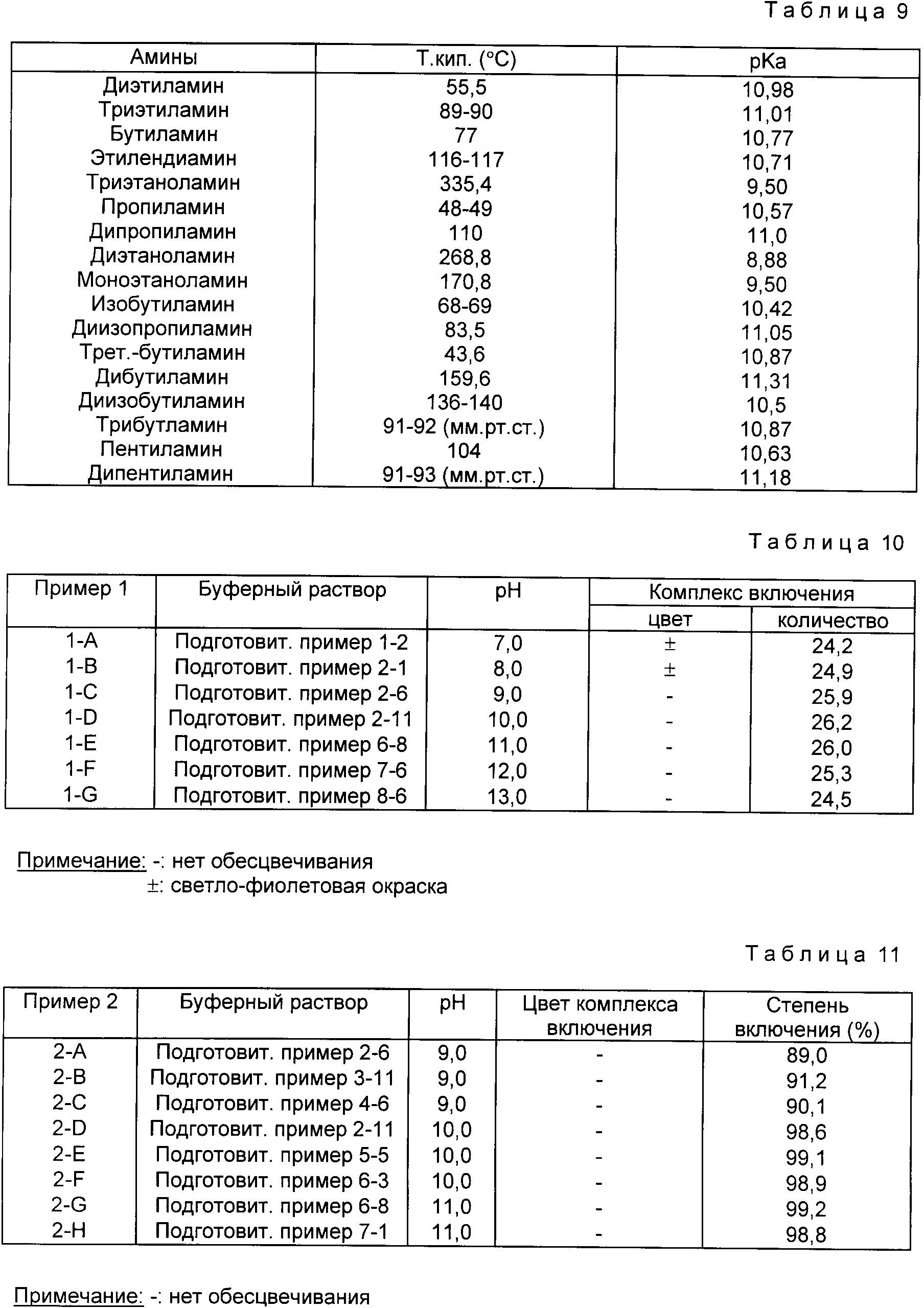
Для получения боратных буферных растворов, в соответствии с подготовительным примером 1 в 500 мл 0,025 M раствора Na2B4O7 добавляют 0.1 M раствор HCl по схеме, приведенной в табл. 4.
Для селективного использования в щелочном растворе измеряют значение pH каждого полученного буферного раствора.
Подготовительный пример 5. Буферный раствор (боратный).
Для получения боратных буферных растворов, в соответствии с подготовительным примером 1, в 500 мл 0,025 M раствора Na2B4O7 добавляют 0,1 M раствор NaOH по схеме, приведенной в табл. 5.
Для селективного использования в щелочном растворе измеряют значение pH каждого полученного буферного раствора.
Подготовительный пример 6. Буферный раствор (карбонатный)
Для получения карбоновых буферных растворов, в соответствии с подготовительным
примером 1, в 500 мл 0.05 M раствора NaHCO3 добавляют 0,1 M раствор NaOH по схеме, приведенной в табл. 6.
Для селективного использования в щелочном растворе измеряют значение pH каждого полученного буферного раствора.
Подготовительный пример 7. Буферный раствор (фосфатный).
Для получения фосфатных буферных растворов, в соответствии с подготовительным примером 1, в 500 мл 0,05 M раствора Na2HPO4 добавляют 0.1 M раствор NaOH по схеме, приведенной в табл. 7.
Для селективного использования в щелочном растворе измеряют значение pH каждого полученного буферного раствора.
Подготовительный пример 8. Буферный раствор (хлоратный).
Для получения хлоратных буферных растворов, в соответствии с подготовительным примером 1 в 250 мл 0.2 M раствора KCl добавляют 0.2 M раствора NaOH по схеме, приведенной в табл. 8.
Для селективного использования в щелочном растворе измеряют значение pH каждого полученного буферного раствора.
Полученные буферные растворы предпочтительно могут быть использованы для щелочного раствора в интервале значений pH 8,0≈12,0. После установки pH 8,0≈12,0 также могут быть использованы гидроксиды щелочного металла или соли щелочного металла и органической или неорганической кислоты.
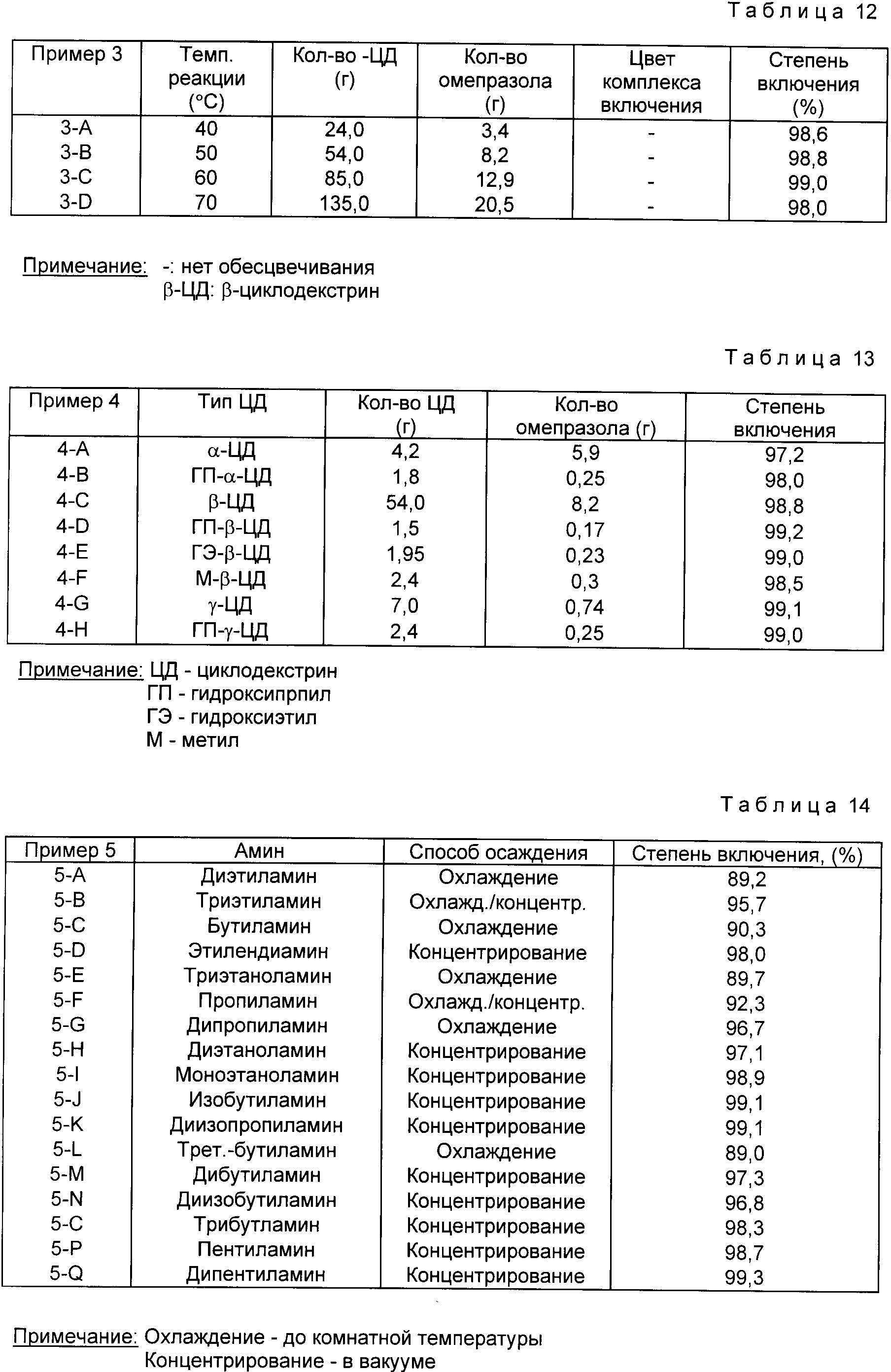
Однако для аминов необходимо определить предпочтительный интервал молярности щелочного раствора. В соответствии с настоящим изобретением, могут быть использованы водорастворимые или смешивающиеся с водой амины, представленные в табл. 9, предпочтительно 0,01≈0,5 M амины, но метиламин, диметиламин, триметиламин, этиламин, изопропиламин и др. исключены из рассмотрения, так как они имеют низкую температуру кипения.
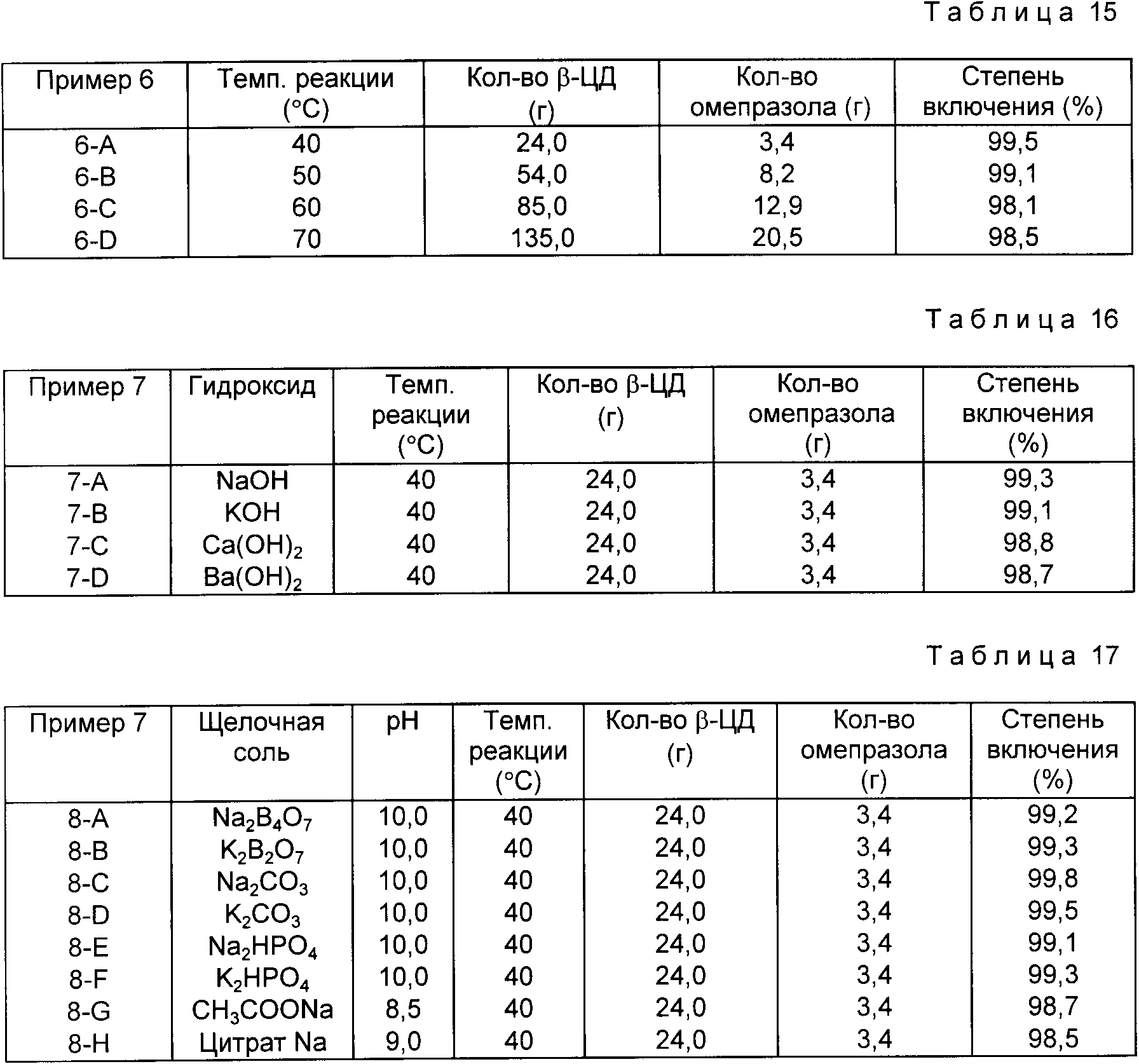
Пример 1. В 900 мл каждого буферного раствора, в соответствии с табл. 10, при 40oC растворяют 24 г b -циклодекстрина, и к полученному раствору при перемешивании добавляют 3.4 г омепразола, выдерживают для проведения реакции в течение 15 мин.
Реагенты концентрируют в вакууме до 100 до и после охлаждения до комнатной температуры оставляют в холодильнике на 6 ч для выпадения осадка комплекса включения. Отфильтрованный комплекс включения промывают несколько раз водой, сушат в вакууме и получают комплекс- включения омепразол-циклодекстрин.
Результаты реакции и получаемые количества комплекса включения представлены в табл. 10.
Результаты, представленные в табл.10, показывают, что при низком значении pH комплекс включения обеспечивается до светло-фиолетовой окраски, а при низком значении pH количество получаемого комплекса включения понижается из-за промывки избытком воды.
Следовательно, величина pH буферного раствора для щелочного раствора предпочтительно выбирается между 8.0 и 12.0.
Пример 2. В 900 мл каждого буферного раствора (pH 9.0, pH 10.0, pH 11.0), в соответствии с табл. 11, при 40oC растворяют 24 г b- -циклодекстрина, и к полученному раствору при перемешивании добавляют 3,4 г омепразола, выдерживают для проведения реакции в течение 15 мин.
Реагенты концентрируют в вакууме до 100 мл и после охлаждения до комнатной температуры оставляют в холодильнике на 6 ч для выпадения осадка комплекса включения. Отфильтрованный комплекс включения промывают несколько раз водой, сушат в вакууме и получают комплекс-включения омепразол-циклодекстрин.
Результаты реакции представлены в табл. 11.
Результаты, представленные в табл. 11, показывают, что при одинаковых значениях pH буферного раствора эффективность не зависит от типа
буферного раствора и что при значениях pH более 10, степень включения составляет более 98,6%
Пример 3. β -Циклодекстрин, в соответствии с табл. 12, растворенный в 900 мл буферных
растворов (pH 10.0), полученного в соответствии с приведенным выше подготовленным Примером 2-11, добавляют омепразол и далее при температурах реакции 40, 50, 60 и 70oC проводят реакцию в
течение 15 мин.
Реагенты концентрируют в вакууме до 100 мл и после охлаждения до комнатной температуры оставляют в холодильнике на 6 ч для выпадения осадка комплекса включения. Отфильтрованный комплекс включения промывают несколько раз водой, сушат в вакууме и получают комплекс-включения омепразол-циклодекстрин.
Результаты представлены в табл. 12.
Пример 4. b -Циклодекстрин, в соответствии с табл. 13, растворяют при 50oC в 900 мл буферного раствора (pH 10.0), полученного в соответствии с приведенным выше подготовительным примером 2-11, добавляют при перемешивании омепразол и проводят реакцию в течение 15 мин.
Реагенты концентрируют в вакууме до 100 мл и после охлаждения до комнатной температуры оставляют в холодильнике на 6 ч для выпадения осадка комплекса включения. Отфильтрованный комплекс включения промывают несколько раз водой, сушат в вакууме и получают комплекс-включения омепразол-циклодекстрин.
Результаты реакции представлены в табл. 13.
Пример 5. В 900 мл каждого 0.1 М водного раствора амина, в соответствии с табл. 9, при 50oC растворяют 54 г b -циклодекстрина, при перемешивании к раствору добавляют 8.2 г омепразола и проводят реакцию в течение 15 мин.
Реагенты охлаждают до комнатной температуры и/или концентрируют в вакууме до 100 мл и оставляют в холодильнике на 6 ч для выпадения осадка комплекса включения. Отфильтрованный комплекс включения промывают несколько раз водой, сушат в вакууме и получают комплекс-включения омепразол-циклодекстрин.
Результаты реакции приведены в табл. 14.
Пример 6. В соответствии с табл. 15, b -циклодекстрин растворяют в 900 мл воды, а омепразол растворяют в 40% (об./об.) водном растворе триэтиламина с получением 27%-ного раствора. К полученному раствору омепразола по каплям добавляют водный раствор циклодекстрина.
Реагенты охлаждают до комнатной температуры и/или концентрируют в вакууме до 100 мл и оставляют в холодильнике на 6 ч для выпадения осадка комплекса включения. Отфильтрованный комплекс включения промывают несколько раз водой, сушат в вакууме и получают комплекс-включения омепразол-циклодекстрин.
Результаты реакции представлены в табл.15.
Пример 7. В 900 мл водного раствора гидроксида щелочного металла (pH 12.0), в соответствии с табл. 16 растворяют 24 г b -циклодекстрина и к полученному раствору при перемешивании добавляют 3.4 г, омепразола, выдерживают для проведения реакции в течение 15 мин.
Реагенты концентрируют в вакууме до 100 мл и после охлаждения до комнатной температуры оставляют в холодильнике на 6 ч для выпадения осадка комплекса включения. Отфильтрованный комплекс включения промывают несколько раз водой, сушат в вакууме и получают комплекс включения омепразол-циклодекстрин.
Результаты реакции представлены в табл. 16.
Пример 8. Опыт проводят по методике, описанной в примере 7, за исключением того, что для получения комплекса включения омепразол-декстрин используют растворы щелочных солей, в соответствии с табл. 17.
Отфильтрованный комплекс включения промывают несколько раз водой, сушат в вакууме и получают комплекс включения омепразол-циклодекстрин.
Полученные результаты представлены в табл. 17.
Способ измерения степени включения.

Количество омепрозола в полученном компоненте включения измеряют с помощью ВЭЖХ при следующих условиях:
Растворитель Карбонатный буферный раствор pH 9.8: этанол 80:20
Колонка μ Bondapak C18 3.9 мм (внутр. диаметр) • 300 мм (длина)
Подвижная фаза фосфатный буферный раствор pH 7.6: ацетонитрил
Длина волны детектора 302 нм
Вводимый объем 20 мкл
Скорость потока 1,0 мл/мин.
Сравнительный пример 1. К 20 мл 96%-ного спирта добавляют 5,67 г b -циклодекстрина и 1,73 г омепразола и перемешивают при 30-32oC в течение 15 ч.
После выдерживания при 10oC в течение 3 ч реакционный раствор отфильтровывают и получают желаемый продукт красновато-коричневого цвета. Реакционный раствор имеет пурпурную окраску.
Сравнительный пример 2. Тщательно смешивают 2,0 г омепразола с 2,0 г Na2 HPO4 и перемешанные соединения сушат в вакууме, получают стабилизированное ядро препарата омепразола в качестве сравнительного образца.
Сравнительный пример 3. Этот опыт проводят по методике описанного выше сравнительного примера 2, используя 2,0 г омепразола и 2,0 г Mg(OH)2. Полученное ядро используют в качестве сравнительного образца.
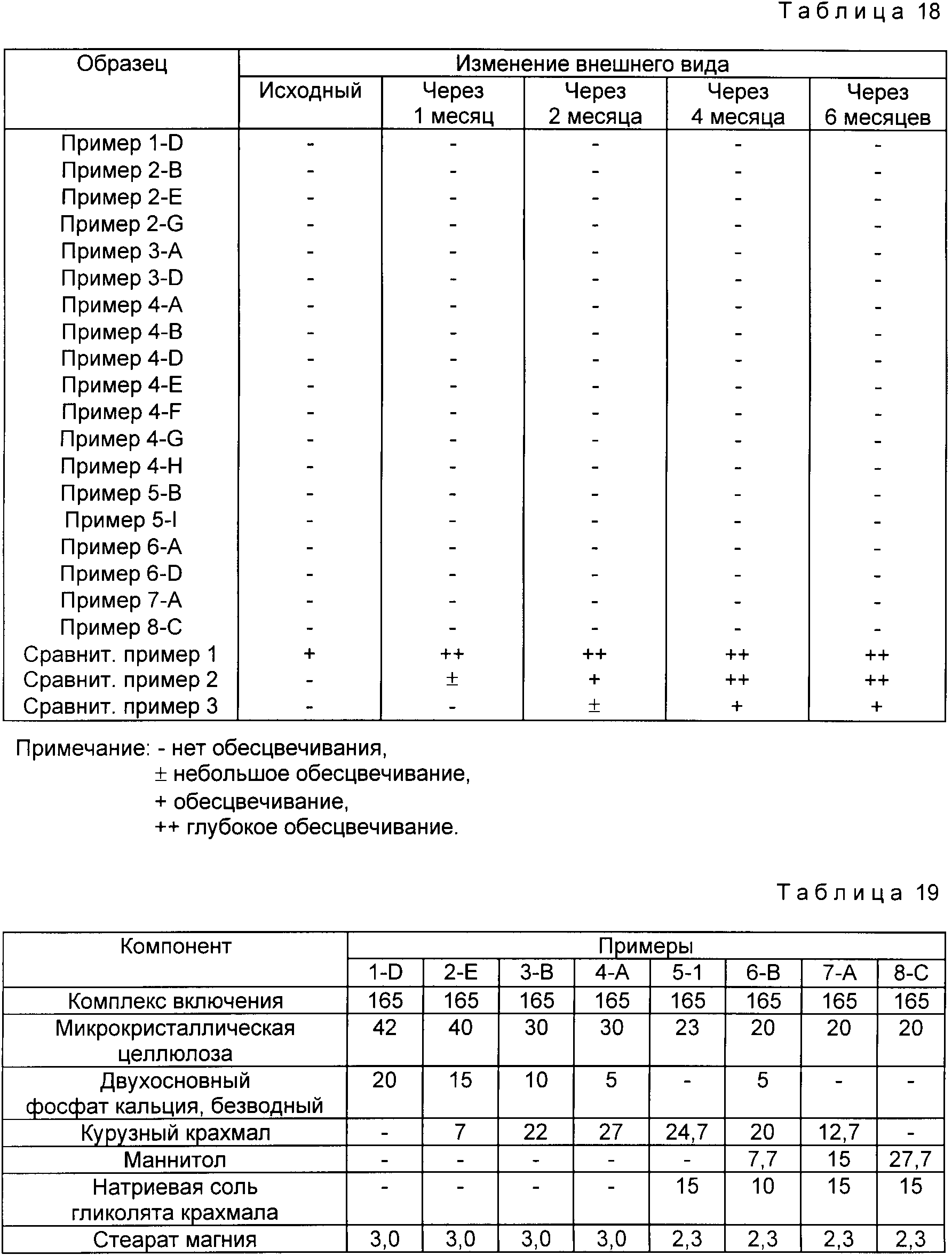
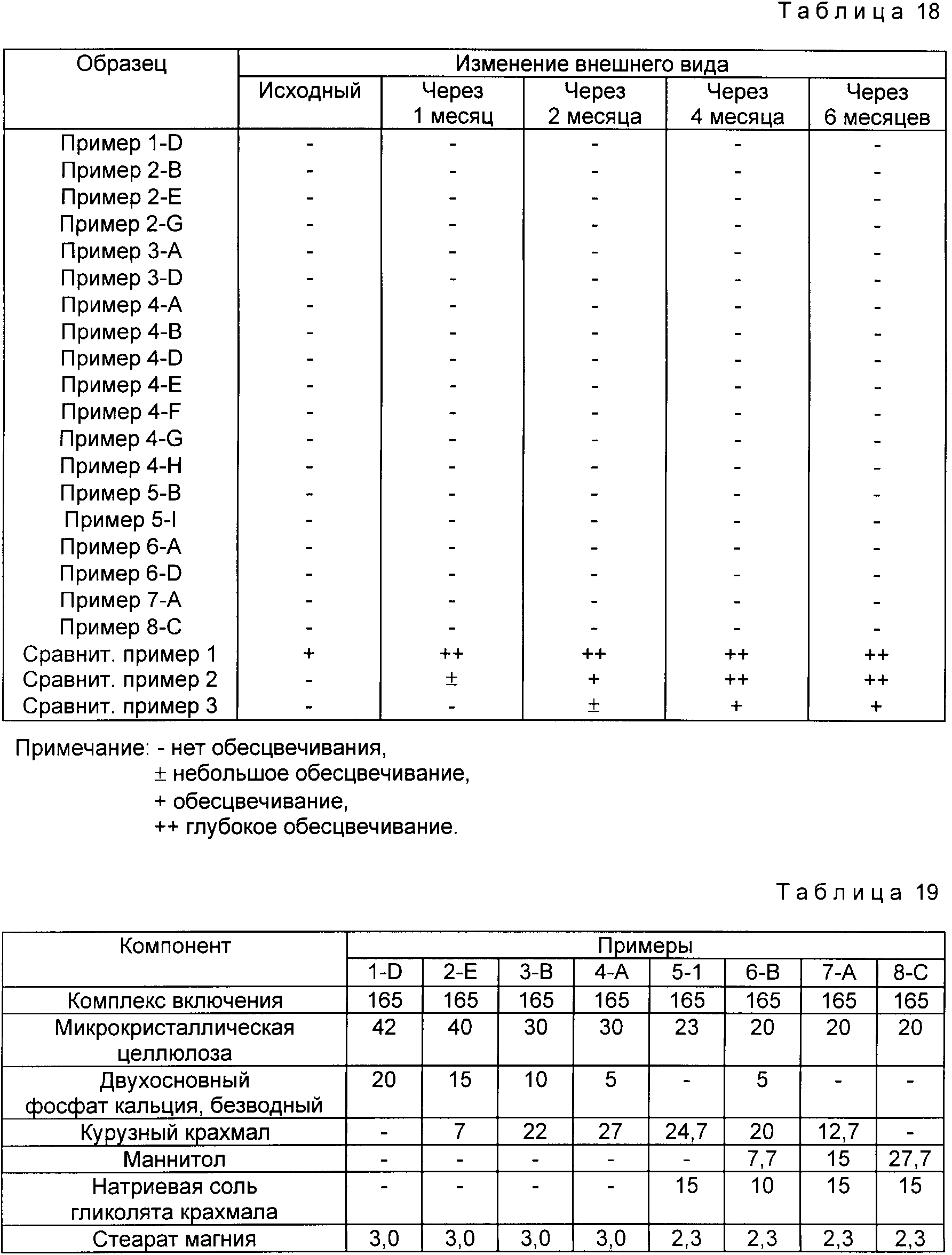
Экспериментальный пример 1. (Стабильность комплекса включения при хранении).
Для оценки результатов стабилизации в рассмотренных выше примерах 1-8 и сравнительных примерах 1-3 используют изменение внешнего вида через определенные промежутки времени при 40oC и относительной влажности 75% (ускоряющие условия).
Результаты представлены в табл. 18.
При указанных выше условиях стабильность при хранении в течение 6 мес означает стабильность в течение 3 лет при нормальных условиях. Результаты, представленные в табл. 18, подтверждают, что в случае примеров 1-8 настоящего изобретения наблюдается более высокая стабильность, чем в случае сравнительных примеров 1-3.
Получение комплекса включения.
Для получения оральных лекарств с энтеросолюбильным покрытием получение в примерах 1-8 комплексы включения омепразол-циклодекстрин используют следующим образом.
Получение таблеток без покрытия.
20 мг омепразола гомогенно смешивают с наполнителями, диспергирующими добавкам и смазывающими веществами, в соответствии с табл. 19, и смесь таблетируют по 230 мг с помощью
роторной таблетирующей машины (компоненты взять в мг.)
В рассмотренном выше примере при использовании избыточных количеств микрокристаллической целлюлозы и двухосновного фосфата кальция
(безводного) получают таблетки с прекрасной твердостью, но скорость диспергирования понижается. Поэтому предпочтительно используют небольшие количества микрокристаллической целлюлозы и, одновременно,
уменьшают используемые количества кукурузного крахмала и/или маннитола и добавляют минимальное количество безводного двухосновного фосфата кальция.
Покрытие из водорастворимого вещества.
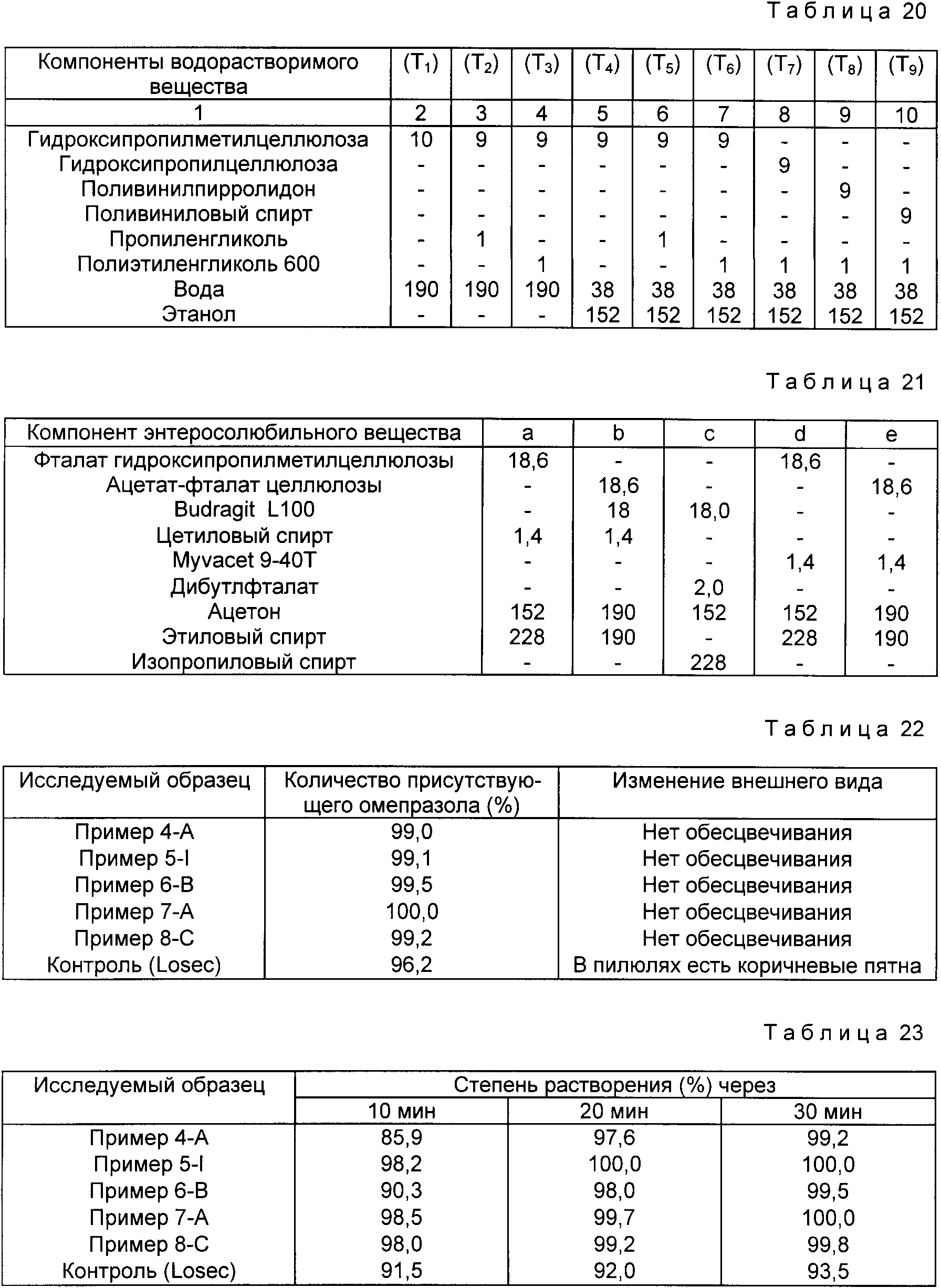
На таблетки без покрытия наносят водорастворимое вещество в соответствии с табл. 20 (в мг).
В рассмотренном выше опыте, когда в качестве растворителя используется только вода или когда используется избыточное количество воды, время сушки покрытия увеличивают.
Поскольку таблетки, как установлено, прилипают друг к другу, что приводит к нарушению однородности поверхности покрытия, то в этом процессе в качестве основного растворителя предпочтительно используют 80%-ный водный этанол.
Покрытие из энтеросолюбильного вещества.
На таблетки, покрытые водорастворимым веществом, наносят энтеросолюбильное вещество в соответствии с табл. 21 и получают желаемое оральное лекарство с энтеросолюбильным покрытием.
Экспериментальный пример 2.
Полученный в примерах комплексы включения используют для приготовления оральных лекарств с энтеросолюбильным покрытием, для оценки свойств оральных лекарств водорастворимое вещество, в соответствии с табл. 20, (T5) наносят соответственно на таблетки, приготовление в Примерах 4-A, 5-1, 6-B, 7-A и 8-C, и затем на эти таблетки наносят энтеросолюбильное вещество, в соответствии с табл. 21 "d".
Для изучения кислотой устойчивости, растворимости и о стабильности при хранении приготовленные оральные лекарства сравнивают с контрольным продуктом Astra's LOSEC.
Оценка кислотой устойчивости.
Приготовленные оральные лекарства помещают в искусственную желудочную жидкость [USP, 1-ый раствор] без ферментов и перемешивают при 37oC мешалкой при 100 об/мин.
Исследуемый раствор оставляют на 2 ч для оценки изменения внешнего вида и с помощью ВЭЖХ измеряют количество омепразола, присутствующего в препарате. Полученные результаты представлены в табл. 22.
В рассмотренном выше опыте установлено наличие коричневых пятен на 40-75% контрольных пилюль (Losec) и уменьшение содержания омепразола.
Однако, в оральных лекарствах, приготовленных в примерах, не обнаружено изменения внешнего вида, а содержание омепразола уменьшается незначительно. Таким образом, получены лекарства с прекрасными свойствами.
Оценка растворимости.
Для оценки скорости растворения в
тонком кишечнике приготовленные оральные лекарства добавляют к искусственной желудочной жидкости [USP, 37oC, 100 об/мин]
Через 2 ч лекарства переносят в искусственную кишечную
жидкость [USP, устройство для растворения N 2, метод с перемешиванием] а затем с помощью ВЭЖХ определяют количество растворившегося омепразола. Полученные результаты представлены в табл. 23.
Как показывают результаты приведенного выше эксперимента, из всех образцов степень растворения является хорошей только в случае примеров 4-A и 5-1, полученных с использованием в качестве наполнителя безводного двухосновного фосфата кальция и показывающих несколько уменьшенную скорость растворения в первые 10 мин.
Степень растворения через 20 и 30 мин. для исследуемых образцов, приготовленных в примерах, очевидно выше, таковой для контроля.
Оценка стабильности при хранении.
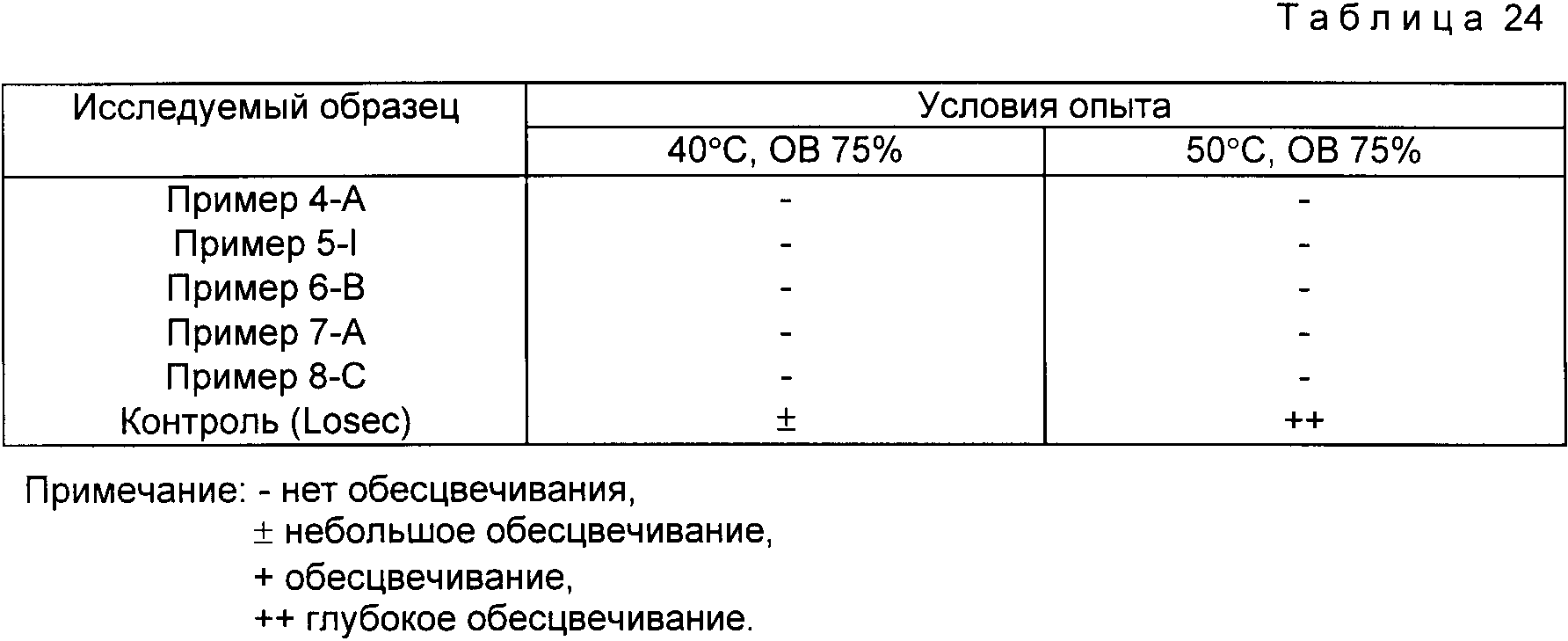
В соответствии с методикой Экспериментального примера 1, лекарства хранят в стеклянном сосуде в течение 6 мес при 40oC и относительной влажности 75% (условия ускорения) и при 50oC и относительной влажности 75% (жесткие условия).
Полученные образцы оценивают по изменению внешнего вида. Результаты представлены в табл. 24.
Приведенные выше результаты подтверждают, что стабильность при хранении образцов, полученных в примерах, однозначно выше, чем в случае контроля.
Результаты, полученные в экспериментальном примере 2 показывают, что оральные лекарства с энтеросолюбильным покрытием настоящего изобретения, приготовленные с комплексом включения омепразол-циклодекстрин, обладают прекрасными стабильностью и растворимостью по сравнению с известными препаратами.
Реферат
Изобретение относится к способу получения оральных лекарств с энтеросолюбильным покрытием, которые содержат нестабильное в кислой среде соединение, в частности, к оральному лекарству с энтеросолюбильным покрытием, полученному в форме стабильных в кислой среде стандартных доз в виде комплекса включения, полученного реакцией производного бензимидазола - нестабильного в кислой среде соединения - с циклодекстрином в щелочном растворе. 1 с. и 7 з.п. ф-лы, 25 табл.
Формула
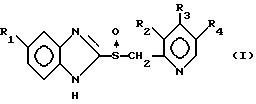
где R1 выбирают из группы, включающей атом водорода, метоксигруппу, трифторметильную группу и тетрафторэтокси-группу;
R2 выбирают из группы, включающей атом водорода, метиламино- и диметиламиногруппу;
R3 выбирают из группы, включающей атом водорода, метоксигруппу, арилоксигруппу и пропаргилоксигруппу;
R4 выбирают из группы, включающей атом водорода или метильную группу,
или его фармацевтически приемлемой соли, путем взаимодействия вышеуказанного производного бензимидазола с циклодекстрином в щелочном растворе при мольном соотношении производного бензимидазола к циклодекстрину, равном от 1 1 до 1 10.

Комментарии