Средство для улучшения репродуктивной функции - RU2487705C1
Код документа: RU2487705C1
Описание
Изобретение относится к медицине, а именно к андрологии, а также может быть использовано в ветеринарии для лечения млекопитающих с нарушенной фертильностью.
Бесплодие представляет серьезную медицинскую и социально-экономическую проблему, как в нашей стране, так и за рубежом. В настоящее время бесплодием страдает по разным оценкам от 15 до 25% семейных пар, и эта цифра имеет тенденцию к увеличению. Примерно 40% случаев отсутствие беременности в браке связывают с мужским бесплодием, столько же с женским и примерно 20% случаев является следствием бесплодия двух сторон. Причины мужского бесплодия, приводящие к нарушению нормального хода сперматогенеза и нарушению секреции половых гормонов, могут быть самые разнообразные. В зависимости от патологического процесса, приводящего к развитию патоспермии, для лечения мужского бесплодия используют хирургические и медикаментозные методы.
Реабилитация репродуктивного здоровья мужчин с нарушенной фертильностью с помощью имеющихся медикаментозных средств представляет серьезные трудности в связи с отсутствием лекарственных препаратов стабильно и качественно стимулирующих и/или восстанавливающих сперматогенез. Как правило, приходится применять комплекс препаратов - антибактериальных, противовоспалительных и гормональных, приостанавливающих патологический процесс, приводящий к дистрофическим изменениям в семенных канальцах и межуточной ткани яичек. При этом приходится полагаться на то, что после ликвидации патологического процесса с восстановлением сперматогенеза справиться сам организм мужчины. Однако это происходит далеко не всегда. Помимо инфекционных агентов и эндогенных факторов в последние десятилетия особое значение приобрела проблема экзогенных интоксикаций в связи с накоплением в окружающей среде большого количества химических веществ, отрицательно влияющих на половые органы мужчины. Отрицательное влияние оказывает на сперматогенный (зародышевый) эпителий яичек также бесконтрольное применение лекарственных препаратов: сульфаниламидов, антибиотиков, цитостатиков и других.
Перечисленные экзогенные факторы, а также ряд профессиональных интоксикаций приводит к выраженному оксидативному стрессу. Установлено, что примерно у 40% бесплодных мужчин в половых органах происходит накопление свободных радикалов, которые могут привести к поражению весьма чувствительного герминативного эпителия яичек.
Связь селена с возникновением нарушений воспроизводительной функции животных отмечена достаточно давно, и этой проблематике посвящено значительное количество исследований. При недостатке селена в рационе у животных возникают множественные метаболические изменения, напоминающие авитаминоз Е: задержка роста, дегенеративные и дистрофические изменения в скелетной мускулатуре и миокарде, нервных клетках, печени, почках, легких и других органах. Происходят нарушения воспроизводительной функции у животных и птицы различных видов обоего пола: нарушение овариального цикла, повышенная эмбриональная смертность, высокий процент бесплодия, снижение либидо, уменьшение количества и ухудшение качества спермы. Дефицит селена вызывает разрыв сперматозоида по середине хвоста, где обнаружен селенопептид, который играет важную роль в формировании хвоста, а также является структурным протеином митохондрий и энзимов тела сперматозоидов и компонентом плазмы семени.
Известно средство для лечения расстройств половой функции у мужчин /RU 2163806, A61K 31/475, 2001/, которое содержит йохимбина гидрохлорид, корень женьшеня, натрия селенит, цинка окись и кислоту аскорбиновую.
Известно применение аминокислотного хелата цинка, селена и пурегона совместно с физиотерапевтическими процедурами для улучшения качества спермы при патоспермии /RU 2205047, A61N 5/067, 2001/.
Известно также применение пролонгированной формы селенопирана в масле (пролонгированная форма) одновременно с витаминоми Е, Д и А для улучшения репродуктивной функции быков /RU 2249450, A61K 31/00, 2005/.
Во всех приведенных средствах используется либо селен, либо его химические соединения. Известна токсичность селена и его химических соединений, что препятствует использованию его в достаточных для достижения результата дозах.
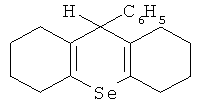
Наиболее близким по технической сути к заявляемому средству является средство для улучшения репродуктивной функции /RU 2414215, A61K 31/095, 2011/, представляющее собой α-кристаллическую форму 9-фенил-симм-октагидроселеноксантена, соответствующее структурной формуле
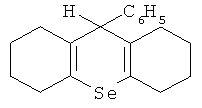
с порошковой рентгенограммой, полученной на Cu-K источнике излучения с показателями характеристического отражения, выраженных в градусах угла дифракции 2θ: 6,0 12,0 15,0 17,0 19,0 20,0 21,5 21,720,9 25,0 27,0 28, 0 29,0 37,0 и температурой плавления 96,8°C.
Однако прототип не обеспечивает желаемых показателей беременности и плодовитости.
Задачей предлагаемого изобретения является создание средства, лишенного указанных недостатков.
Таким образом, технический результат изобретения направлен на повышение показателей беременности и плодовитости.
Для решения поставленной задачи и для достижения заявляемого технического результата предлагается средство для улучшения репродуктивной функции, представляющее собой клатратный комплекс β-циклодекстрина с 9-фенил-симм-октагидроселен-оксантеном, соответствующим структурной формуле

Указанное соединение 9-фенил-симм-октагидроселеноксантен может находиться в α-кристаллической форме, с порошковой рентгенограммой, полученной на Cu-K источнике излучения с показателями характеристического отражения, выраженных в градусах угла дифракции 2θ: 6,0 12,0 15,0 17,0 19,0 20,0 21,5 21,7 20,9 25,0 27,0 28,0 29,0 37,0 и температурой плавления 96,8°C.
Нахождение 9-фенил-симм-октагидроселеноксантена в клатратном комплексе дает возможность препарату активизировать действие репродуктивных органов, таким образом достигается технический результат.
Улучшение репродуктивных функций крыс под влиянием препарата продемонстрировано в двух независимых экспериментах. Сущность изобретения поясняется примерами конкретного выполнения.
Пример 1. Исследования выполнены на 180 самцах и самках крыс линии Wistar (исходная масса тела 180-200 г).
Группа самцов, состоящая из 60 животных, была разделена на 6 подгрупп по 10 животных, каждая из которых получала соответственно: 1 группа - растительное масло, 2 группа - β-циклодекстрин, 3 группа - препарат 0,35 мг/кг (прототип), 4 группа - препарат 0,70 мг/кг (прототип), 5 группа - препарат в составе клатратного комплекса 0,35 мг/кг, 6 группа - препарат в составе клатратного комплекса 0,70 мг/кг.
Самцам опытных подгрупп ежедневно в течение 10 недель (2-3 цикла созревания сперматозоидов) внутрижелудочно вводили прототип и препарат в составе клатратного комплекса в указанных дозах. Животные контрольных групп в те же сроки получали плацебо - соответствующее количество растительного масла и β-циклодекстрина. Выбор плацебо обусловлен тем, что прототип представляет собой препарат, растворенный в растительном масле, а препарат в составе клатратного комплекса является водорастворимым веществом. Препарат вводили 1 раз в сутки (в 10 часов).
После окончания введения препарата сформировали шесть групп животных:
- первая (растительное масло) - к 10 контрольным самцам подсаживали 20 контрольных самок;
- вторая - (β-циклодекстрин) к 10 контрольным самцам подсаживали 20 контрольных самок;
- третья (прототип 0,35 мг/кг) - к 10 контрольным самцам подсаживали 20 опытных самок;
- четвертая (прототип 0,70 мг/кг) - к 10 опытным самцам подсаживали 20 контрольных самок;
- пятая (препарат в составе клатратного комплекса 0,35 мг/кг) - к 10 контрольным самцам подсаживали 20 опытных самок;
- шестая (препарат в составе клатратного комплекса 0,70 мг/кг) - к 10 опытным самцам подсаживали 20 контрольных самок.
В течение двух эстральных циклов просматривали вагинальные мазки. Отмечали стадии проэструс, эструс, метаэструс и диэструс. Обнаружение в вагинальных мазках сперматозоидов считали первым днем беременности. По истечении 10 дней из беременных самок в каждой из пяти групп создавали две подгруппы. Первые подгруппы самок забивали на 20 день беременности. Подсчитывали количество плодов, резорбций, мест имплантации в полости матки, желтых тел в яичниках. На основании полученных данных вычисляли показатели предимплантационной и постимплантационной гибели по формуле:
Предимплантационная гибель, ,
где N1 - количество желтых тел,
N2 - количество мест имплантации.
Постимплантационная гибель, 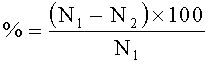
где N1 - количество мест имплантации,
N2 - количество живых плодов,
а также индекс плодовитости (соотношение количества подсаженных к самцам самок и количества самок, у которых определялись сперматозоиды в вагинальных мазках) и индекс беременности (соотношение количества самок, у которых определялись сперматозоиды в вагинальном мазке и количества животных, доносивших беременность):
Индекс плодовитости, 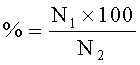
где
N1 - количество оплодотворенных самок,
N2 - количество ссаженных самок.
Индекс беременности, 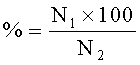
где
N1 - количество беременных самок,
N2 - количество оплодотворенных самок.
При осмотре плодов регистрировали патологические изменения (подкожные кровоизлияния и отек подкожной клетчатки, нарушения развития скелета, глазных яблок).
Вторые подгруппы беременных самок оставляли на роды, наблюдая за животными, 1 раз в неделю их взвешивали и отмечали прибавку массы тела. Фиксировали дату родов, количество крысят в помете и массу тела новорожденных крысят. На 21 день со дня родов вычисляли процент выживаемости, отмечали общий и средний вес крысят.
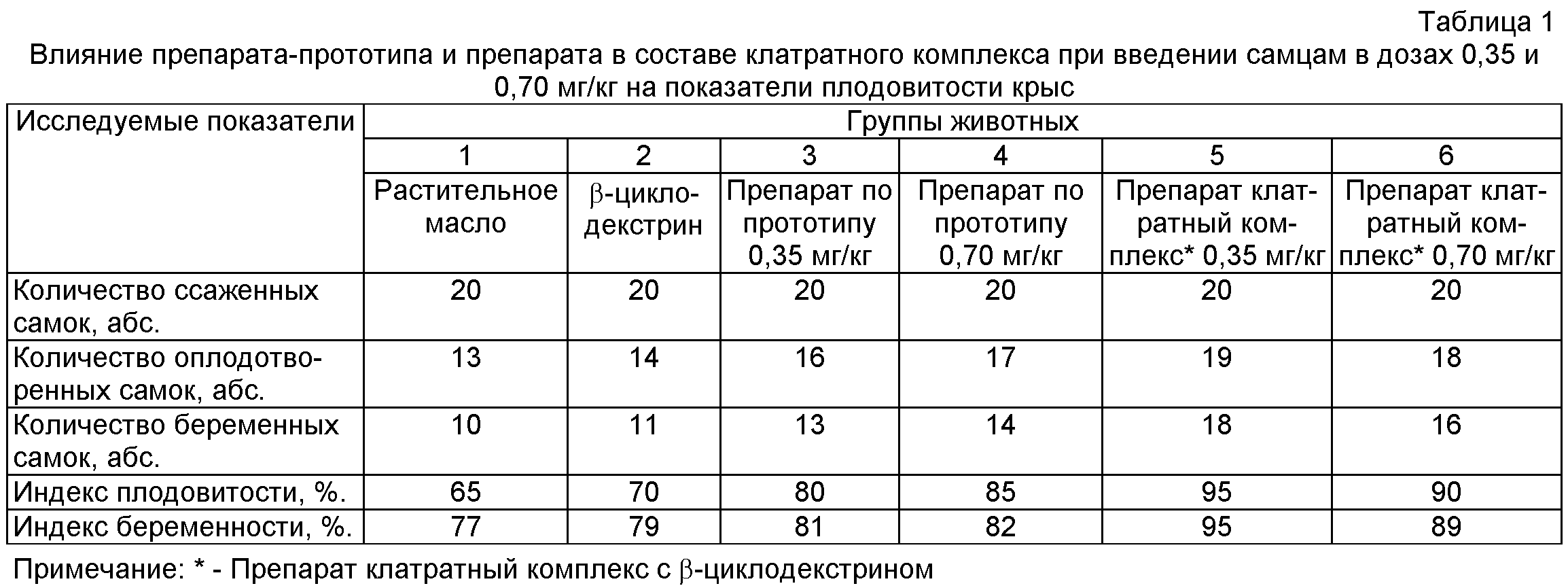
При исследовании показателей плодовитости крыс (табл.1) выявлено повышение данных показателей 3, 4, 5 и 6 (опытных) групп по сравнению с животными 1 и 2 групп. Особенно заметное повышение показателей плодовитости отмечено при введении препарата в составе клатратного комплекса.
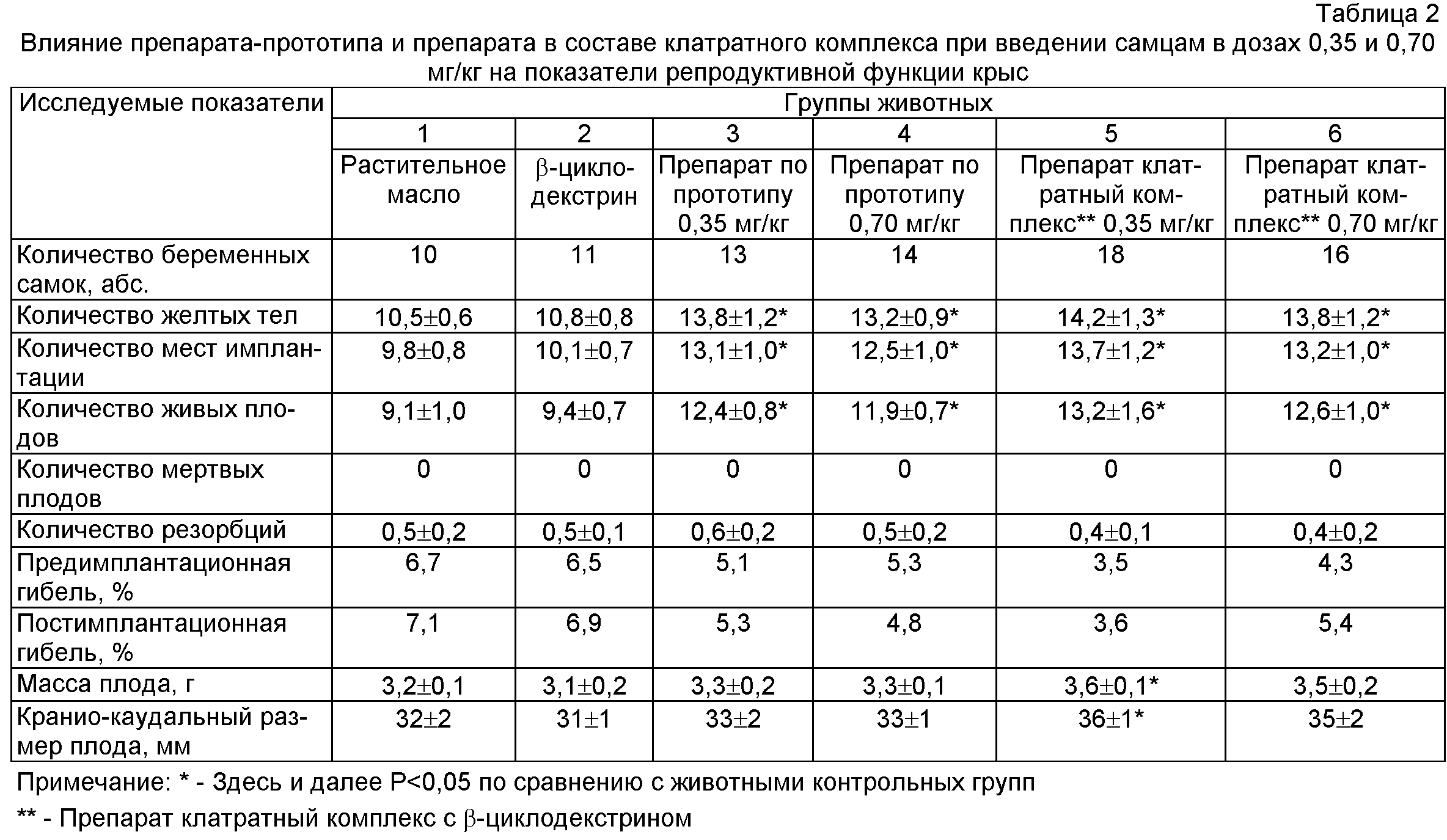
Внутрижелудочное введение препарата в составе клатратного комплекса самцам в дозах 0,35 и 0,70 мг/кг вызывало достоверное повышение таких показателей репродуктивной функции у крыс самок, как количество желтых тел, мест имплантации, живых плодов и не влияло на количество резорбций. Величины пред- и постимплантационной гибели в 1 и 2 группах превышали показателей опытных групп. Масса тела эмбрионов и кранио-каудальный размер достоверно отличались в сторону увеличения при введении самцам препарата в составе клатратного комплекса в дозе 0,35 мг/кг по сравнению с животными 1 и 2 групп (табл.2).
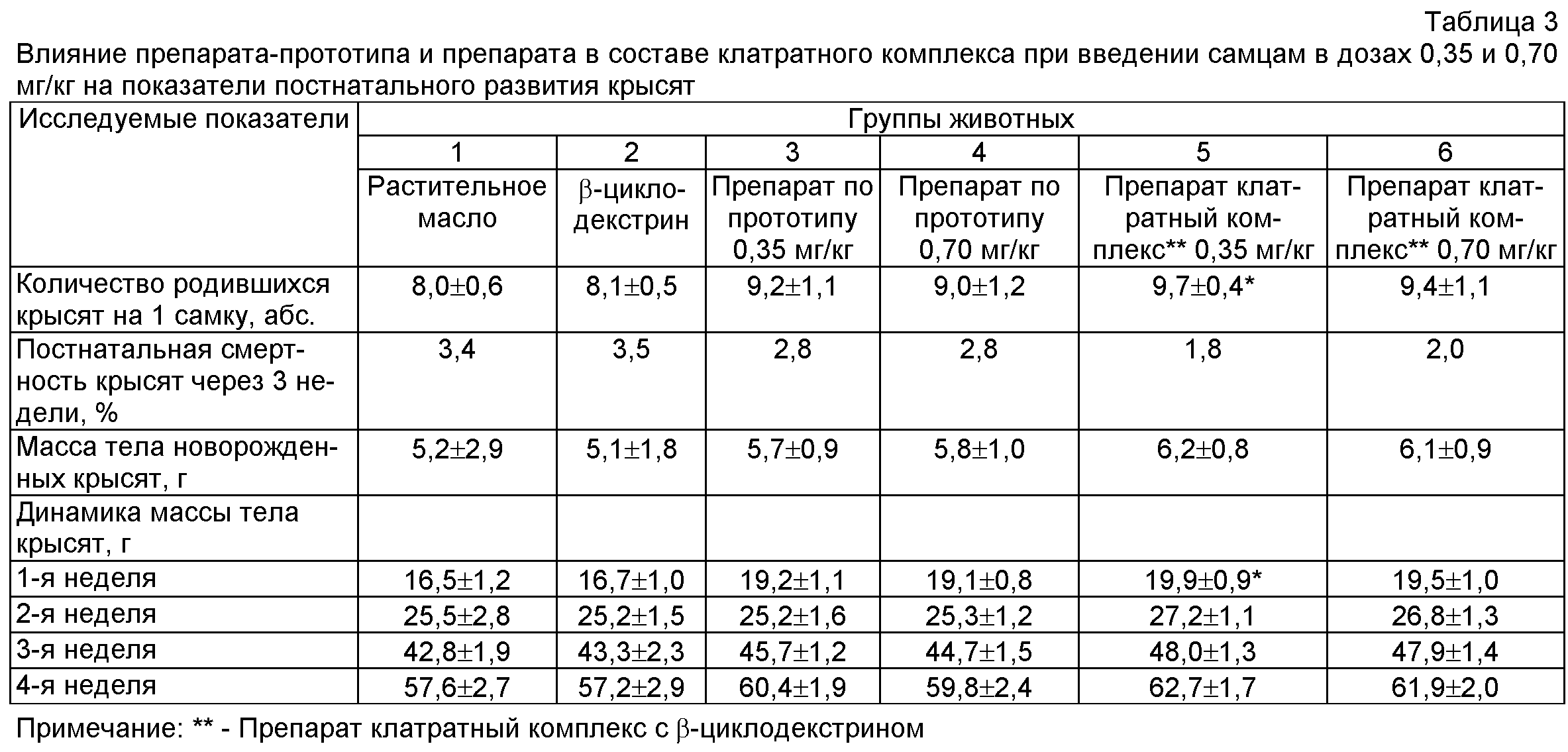
Прибавка массы тела беременных крыс опытных групп была выше по сравнению с показателями контрольных групп. Количество крысят на 1 крысу, масса плодов при рождении и дальнейшая прибавка массы тела новорожденных крысят в первый месяц неонатального развития также отличались в сторону увеличения во всех 4-х опытных группах от животных контрольных групп. При этом достоверное повышение вышеуказанных показателей отмечено при введении препарата в составе клатратного комплекса в дозе 0,35 мг/кг (табл.3).
Физическое развитие крысят в течение 1-го месяца постнатального развития (покрытие шерстью, появление резцов, открытие глаз, отлипание ушных раковин, открытие вагины, опускание яичек и т.д.) не отличалось от сроков, характерных для нормального физиологического развития животных этого вида.
В заключение следует отметить, что в результате проведенных исследований установлено, что внутрижелудочное введение препарата самцам крыс в дозах 0,35 и 0,70 мг/кг оказывает положительное влияние на репродуктивную функцию животных. При этом повышаются такие репродуктивные показатели как количество живых плодов, количество желтых тел, мест имплантации, масса тела и кранио-каудальный размер плодов, снижается пред- и постимплантационной гибель и не изменяются количество резорбций. Наилучшие результаты были получены при введении препарата самцам в составе клатратного комплекса в дозе 0,35 мг/кг.
Пример 2. Исследования выполнены на 180 самках и самцах крыс Wistar (исходная масса тела 180-200 г). Прототип и препарат в составе клатратного комплекса вводили внутрижелудочно в дозе 0,35 мг/кг. Группа самок, состоящая из 120 животных, была разделена на 2 подгруппы: контрольную (80 животных) и опытную (40 животных). Самкам опытной подгруппы ежедневно в течение 2 недель (3-4 - эстральных цикла) внутрижелудочно вводили прототип и препарат в составе клатратного комплекса. Группа самцов, состоящая из 60 животных, была разделена на 2 подгруппы: контрольную (40 животных) и опытную (20 животных). Самцам опытной подгруппы ежедневно в течение 10 недель (2-3 - цикла созревания сперматозоидов) так же внутрижелудочно вводили прототип и препарат в составе клатратного комплекса. Животные контрольной подгруппы в те же сроки получали плацебо - соответствующее количество растительного масла и β-циклодекстрина. Выбор плацебо обусловлен тем, что прототип представляет собой препарат, растворенный в растительном масле, а препарат в составе клатратного комплекса является водорастворимьм веществом. Препарат вводили 1 раз в сутки (в 10 часов).
После окончания введения препарата сформировали шесть групп животных:
- первая (растительное масло) - к 10 контрольным самцам подсаживали 20 контрольных самок;
- вторая (β-циклодекстрин) - к 10 контрольным самцам подсаживали 20 контрольных самок;
- третья (прототип 0,35 мг/кг) - к 10 контрольным самцам подсаживали 20 опытных самок;
- четвертая (прототип 0,35 мг/кг) - к 10 опытным самцам подсаживали 20 контрольных самок;
- пятая (препарат в составе клатратного комплекса 0,35 мг/кг) - к 10 контрольным самцам подсаживали 20 опытных самок;
- шестая (препарат в составе клатратного комплекса 0,35 мг/кг) - к 10 опытным самцам подсаживали 20 контрольных самок.
Показатели предимплантационной и постимплантационной гибели, индексы плодовитости и беременности рассчитывали по формулам, приведенным в примере 1.

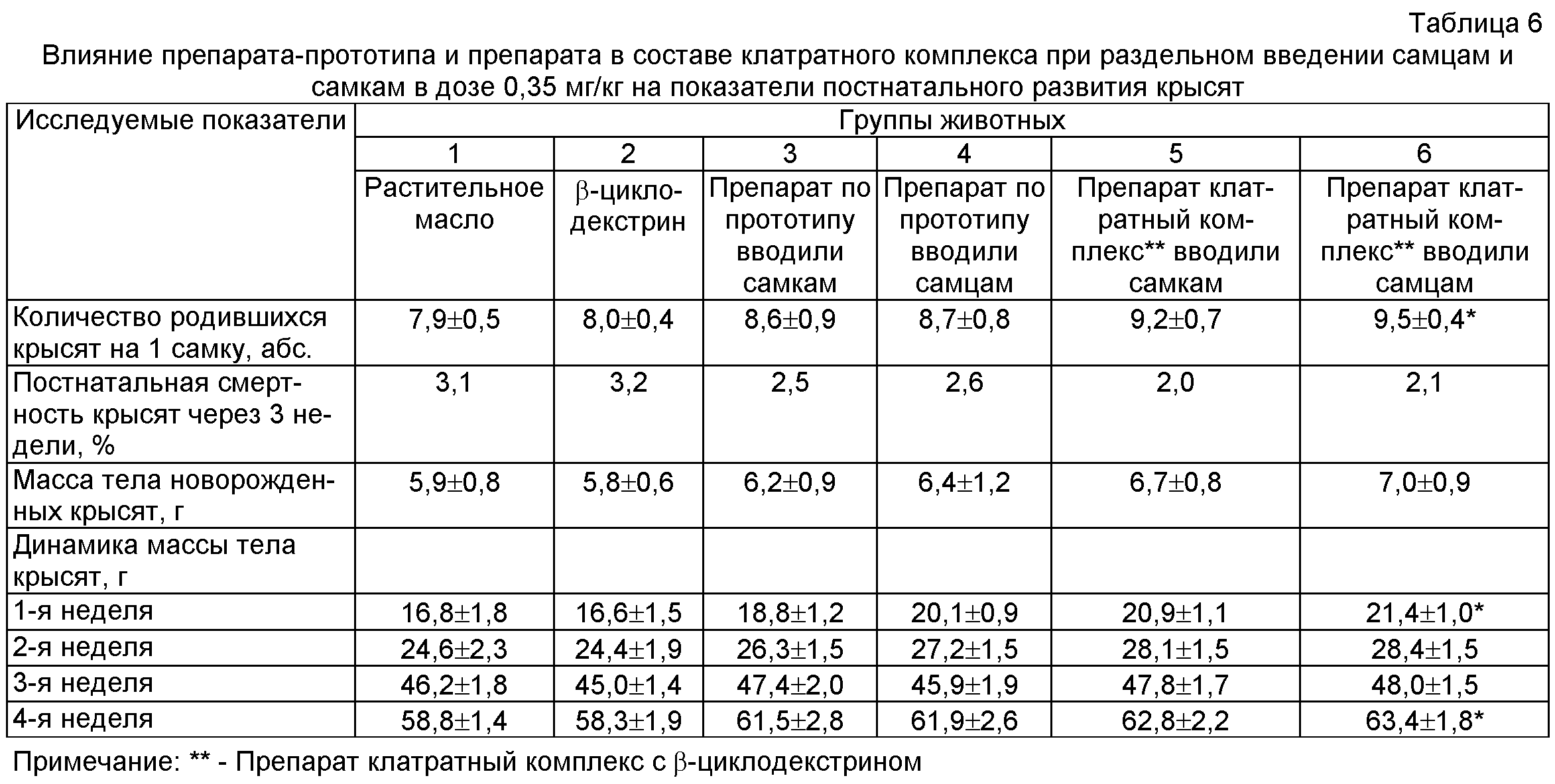
В результате проведенных исследований было выявлено повышение показателей плодовитости крыс (табл.4) опытных групп (3, 4, 5 и 6) по сравнению с животными контрольных групп (1 и 2). При этом существенное (достоверное) повышение показателей плодовитости отмечено при введении самцам препарата в составе клатратного комплекса в дозе 0,35 мг/кг.
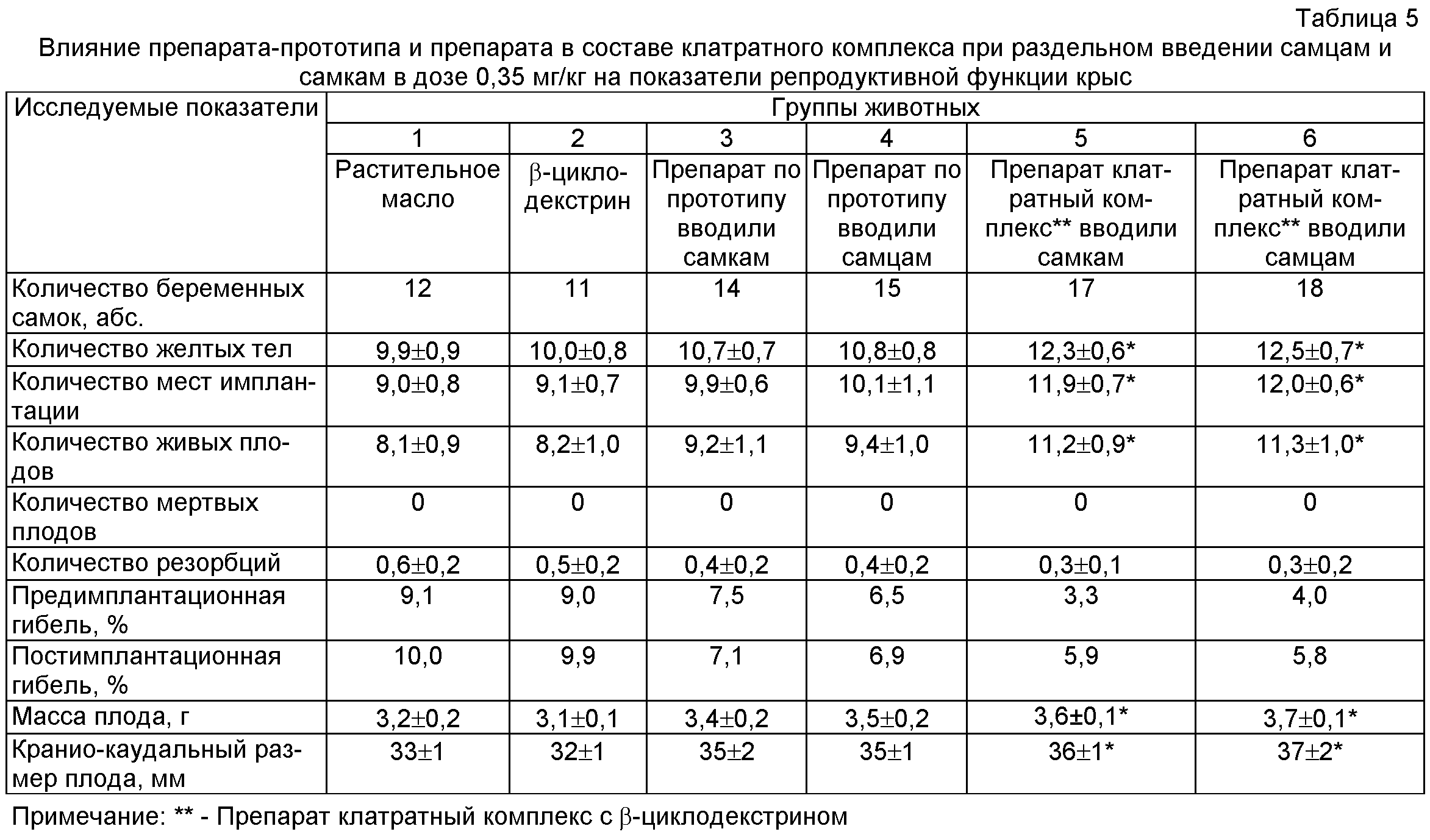
Внутрижелудочное введение препарата в составе клатратного комплекса при раздельном введении самцам и самкам в дозе 0,35 мг/кг приводило к достоверному повышению таких показателей репродуктивной функции у крыс самок, как количество желтых тел, мест имплантации, живых плодов и не влияло на количество резорбций. Величины пред- и постимплантационной гибели в контрольных группах превышали показатели опытных групп. Масса тела эмбрионов и кранио-каудальный размер достоверно отличались в сторону увеличения при раздельном введении самцам и самкам препарата в составе клатратного комплекса при раздельном введении самцам и самкам в дозе 0,35 мг/кг по сравнению с животными контрольных групп (табл.5).
Прибавка массы тела беременных крыс опытных групп была выше по сравнению с показателями контрольных групп. Количество крысят на 1 крысу, масса плодов при рождении и дальнейшая прибавка массы тела новорожденных крысят в первый месяц неонатального развития также отличались в сторону увеличения во всех 4-х опытных группах от контрольных групп. При этом достоверное повышение вышеуказанных показателей отмечено при введении препарата самцам в составе клатратного комплекса в дозе 0,35 мг/кг (табл.6).
Таким образом, введение препарата в составе клатратного комплекса самцам в дозе 0,35 мг/кг оказывает наиболее существенное влияние на репродуктивную функцию половозрелых крыс.
Реферат
Изобретение относится к медицине, а именно к андрологии, а также может быть использовано в ветеринарии для лечения млекопитающих с нарушенной фертильностью. Средство для улучшения репродуктивной функции представляет собой клатратный комплекс β-циклодекстрина с 9-фенил-симм-октагидроселеноксантеном в α-кристаллической форме, и соответствующее структурной формулес порошковой рентгенограммой полученной на Cu-K источнике излучения с показателями характеристического отражения, выраженных в градусах угла дифракции 2θ: 6,0 12,0 15,0 17,0 19,0 20,0 21,5, 21,7, 20,9 25,0 27,0 28,0 29,0 37,0 и температурой плавления 96,8°C. Изобретение обеспечивает повышение показателей беременности и плодовитости. 6 табл., 2 пр., 1 з.п. ф-лы.
Формула

Комментарии