Способы ферментации богатых углеводами сельскохозяйственных культур - RU2642296C1
Код документа: RU2642296C1
Чертежи

Описание
[0001] Настоящая международная заявка испрашивает приоритет на основании заявки на патент США №14/966650, поданной 11 декабря 2015 г.; заявки на патент США №14/940390, поданной 13 ноября 2015 г.; предварительной заявки на патент США №62/139881, поданной 30 марта 2015 г.; и предварительной заявки на патент США №62/127637, поданной 3 марта 2015 г., каждая из которых включена в данный документ посредством ссылки.
ОБЛАСТЬ, К КОТОРОЙ ОТНОСИТСЯ ИЗОБРЕТЕНИЕ
[0002] Настоящее изобретение относится главным образом к способам ферментации богатых углеводами сельскохозяйственных культур.
ПРЕДПОСЫЛКИ ИЗОБРЕТЕНИЯ
[0003] Многие ферментирующие организмы преобразуют углеводы в этанол. Наиболее широко используемые ферментирующие организмы, пивные дрожжи и пекарские дрожжи, являются штаммами Saccharomyces cerevisiae. Этанол имеет важнейшее экономическое значение при использовании в качестве напитков, транспортного топлива и предшественника для других органических соединений.
[0004] Ферментирующие организмы могут напрямую преобразовывать глюкозу, фруктозу, мальтозу (димер глюкозы) и сахарозу (димер из глюкозы и фруктозы) в этанол. В данном документе мономеры и димеры глюкозы и фруктозы будут называться простыми сахарами, а ферментирующие организмы, которые преобразуют простые сахара в этанол, будут называться дрожжами.
[0005] Дрожжи ферментируют простые сахара в этанол в анаэробных условиях окружающей среды (при отсутствии кислорода). При ферментации одного моля глюкозы или фруктозы (или 0,5 моль сахарозы) образуется 2 моля этанола и 2 моля углекислого газа и выделяется 118 кДж тепла. Это означает, что ферментация 18%-ного раствора сахара приведет к повышению температуры на 34°C, а это означает, что требуется охлаждение среды ферментации. Ферментация 1 литра 18%-ного раствора сахара (1 моль глюкозы) также будет приводить к образованию 2 моль углекислого газа, который имеет объем приблизительно 48 литров при 20°C и атмосферном давлении. Типичные дрожжи наиболее эффективно ферментируют при 20-40°C, но характеризуются значительной ферментирующей активностью до 5°C (белое вино ферментируется при 7-15°C). Клетки дрожжей постепенно погибают при температурах выше 42°C. Saccharomyces cerevisiae относительно нечувствительны к pH и будут осуществлять ферментацию в диапазоне pH от 2,9 до 7,2. Это описано более подробно в
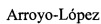
[0006] Диаметр клеток у большинства штаммов Saccharomyces cerevisiae составляет 10 микрон. Штаммом Saccharomyces cerevisiae с размером клеток приблизительно 5 микрон является Thermosacc® Dry, доступный от Lallemand Biofuels & Distilled Spirits, Дулут, Джорджия, США. Он вырабатывает этанол в концентрациях до 20% по объему (16% по весу), таким образом, богатые углеводами сельскохозяйственные культуры с содержанием углеводов до 32% по весу могут быть ферментированы этими дрожжами. Это означает, что сельскохозяйственную культуру можно обезводить перед ферментацией, чтобы концентрация получаемого этанола была выше.
[0007] В присутствии простых сахаров клетки дрожжей прилипают к поверхностям (таким как клетки паренхимы). Это описано у Verstrepen and Klis, "Flocculation, adhesion and biofilm formation in yeasts," Molecular microbiology 60.1 (2006): 5-15, которая включена в данный документ посредством ссылки.
[0008] Saccharomyces cerevisiae продаются в лиофилизированной форме и просты в обращении. Они классифицируются как GRAS (Generally Recognized as Safe - признаваемый в целом безопасным) и часто потребляются в обычном рационе, например, с использованием дрожжей Saccharomyces cerevisiae производят хлеб.
[0009] Крахмал представляет собой полимер глюкозы, а инулин является полимером, который состоит преимущественно из фруктозы с глюкозой на одном конце. Перед тем как крахмал и инулин смогут быть преобразованы дрожжами в этанол, они сначала должны быть преобразованы в простые сахара амилазами и инулиназами, соответственно, или кислотами. Крахмал не растворяется в воде в диапазоне температур, при которых активны дрожжи, и только приблизительно 5% инулина растворяется при этом же температурном диапазоне.
[0010] Доступны амилазы, которые эффективно преобразуют крахмал в глюкозу в температурном диапазоне, в котором эффективно работают дрожжи. Одним примером является ферментный состав STARGEN® 002 от DuPont Industrial Biosciences, США. Он содержит альфа-амилазу из Aspergillus kawachi, экспрессированную в Trichoderma reesei, и глюкоамилазу из Trichoderma reesei, которые работают синергически для гидролиза гранулированного крахмального субстрата до глюкозы. Эндогенная активность, альфа-амилаза, и экзогенная активность, глюкоамилаза, катализируют полный гидролиз гранулированного крахмала при различных условиях ферментации в этанол.
[0011] Доступны инулиназы, которые эффективно преобразуют инулин во фруктозу в температурном диапазоне, в котором эффективно работают дрожжи. Одним примером является ферментный состав Fructozyme L, доступный от Novozymes A/S, Дания.
[0012] Многие сельскохозяйственные культуры содержат углеводы в пределах клеток запасающей паренхимы. Эти богатые углеводами клетки паренхимы обычно содержат от 10% до 20% углеводов в одной большой вакуоли с 80%-90% воды. Эти углеводы обычно включают простые сахара и полисахариды. В данном документе части этих богатых углеводами сельскохозяйственных культур, которые содержат значительную массу богатых углеводами клеток паренхимы, будут называться богатой углеводами паренхимной тканью. Все сельскохозяйственные культуры с богатой углеводами паренхимной тканью содержат в клетках паренхимы некоторое количество простых сахаров, а некоторые содержат значительное количество полисахаридов.
[0013] Существует два типа сельскохозяйственных культур с богатой углеводами паренхимной тканью: однодольные растения (однодольные) в семействах злаков (Роасеае и Dioscorea) и двудольные растения (двудольные). Они отличаются тем, как клетки паренхимы прикрепляются друг к другу. Клетки однодольных прикрепляются посредством как пектина, так и гемицеллюлозы в срединной пластинке, а клетки двудольных прикрепляются посредством пектина в срединной пластинке.
[0014] Наиболее широко культивируемыми сельскохозяйственными культурами с богатой углеводами паренхимной тканью в стеблях являются сахарный тростник (Saccharum officinarum), сахарное сорго (Sorghum bicolor) и гибриды сахарной кукурузы (Zea mays). Все они представляют собой однодольные из семейства злаков (Роасеае). Сахарный тростник и гибриды сахарной кукурузы в клетках запасающей паренхимы содержат простые сахара, а сахарное сорго в клетках запасающей паренхимы содержит 90% простых сахаров и 10% крахмала.
[0015] Наиболее широко культивируемыми сельскохозяйственными культурами с богатой углеводами паренхимной тканью в клубнях являются картофель (Solanum tuberosum), сладкий картофель (Ipomoea batatas), маниок (Manihot esculenta), ямс (род Dioscorea) и топинамбур (Helianthus tuberosus). Картофель, сладкий картофель, маниок и топинамбур являются двудольными, в то время как ямс является однодольным. Картофель, сладкий картофель, маниок и ямс в клетках запасающей паренхимы содержат крахмал, а топинамбур в клетках запасающей паренхимы содержит инулин.
[0016] Наиболее широко культивируемыми сельскохозяйственными культурами с богатой углеводами паренхимной тканью в плодах являются яблоки, виноград и апельсины. Все они являются двудольными и содержат глюкозу и фруктозу в клетках запасающей паренхимы.
[0017] Существуют хорошо известные методики ферментации сельскохозяйственных культур с богатой углеводами паренхимной тканью. Стебли, как правило, раздавливают с помощью серии вальцов для экстракции сока путем разрушения клеток паренхимы, а затем сок отделяют от оставшихся твердых частиц и ферментируют. Сахарную свеклу, как правило, нарезают на мелкие кусочки толщиной приблизительно 4 мм (стружка), и сахар экстрагируют с помощью текучей горячей воды и потом ферментируют. Фрукты, как правило, выжимают для экстракции богатого сахаром сока, который затем ферментируют. Крахмалистые сельскохозяйственные культуры, как правило, преобразуют в этанол путем нагревания клубня выше температуры клейстеризации и применения амилаз для клейстеризованного крахмала, после чего следует ферментация глюкозы. Богатые инулином сельскохозяйственные культуры, как правило, ферментируют путем нагревания до растворения инулина, экстракции сока, применения кислотного гидролиза для преобразования во фруктозу, и затем фруктозу ферментируют. Все эти способы являются весьма капиталоемкими.
[0018] Клетки запасающей паренхимы в богатой углеводами паренхимной ткани представляют собой тонкостенные полиэдрические клетки. Диаметр клеток паренхимы сахарной свеклы составляет приблизительно 100 микрон, при этом толщина стенок составляет приблизительно 2 микрона. Длина клеток паренхимы в стеблях составляет приблизительно 360 микрон, диаметр равен 60 микрон, а толщина стенок составляет приблизительно 2 микрона. Характеристики запасающей паренхимной ткани более подробно описаны в Gibson, "The hierarchical structure and mechanics of plant materials," Journal of The Royal Society Interface 9.76 (2012): 2749-2766, которая включена в данный документ посредством ссылки.
[0019] Клетки паренхимы плотно упакованы вместе, но между ними есть небольшие промежутки, поскольку упаковка не является совершенной. Эти промежутки известны как апопласт, или межклеточное пространство. Эти промежутки связаны между собой, и вода может проходить сквозь паренхимную ткань через эти промежутки. Прохождение воды через апопласт более подробно описано в Steudle, "Water transport in plants: role of the apoplast," Plant and Soil 187.1 (1996): 67-79, которая включена в данный документ посредством ссылки.
[0020] Вода течет через апопласт в паренхимной ткани сахарной свеклы в осевом направление (вверх/вниз), но ограничена в радиальном направлении (вход/выход) поясками Каспари в корнях. Это описано более подробно в Amodeo, "Radial and axial water transport in the sugar beet storage root," Journal of Experimental Botany 50.333 (1999): 509-516, которая включена в данный документ посредством ссылки.
[0021] Аналогичным образом, вода течет через апопласт паренхимной ткани богатых углеводами стеблей в осевом направлении, но ограничена длиной междоузлия (непрерывные части стебля). Вода не течет в радиальном направлении, поскольку внешняя часть стебля непроницаема для воды. Междоузлие большинства богатых углеводами стеблей имеет длину от 100 мм до 300 мм.
[0022] Апопласт (межклеточное пространство) сахарного тростника является достаточно большим для заселения разнообразными бактериями. Это описано более подробно в Dong, "A nitrogen-fixing endophyte of sugarcane stems (a new role for the apoplast)," Plant Physiology 105.4 (1994): 1139-1147 и в Tejera, "Nitrogen compounds in the apoplastic sap of sugarcane stem: Some implications in the association with endophytes," Journal of plant physiology 163.1 (2006): 80-85, которые включены в данный документ посредством ссылки. Аналогичным образом, апопласт других видов богатой углеводами паренхимной ткани является достаточно большим для заселения бактериями.
[0023] Существует возможность заполнения апопласта богатой углеводами паренхимной ткани с применением вакуумной инфузии (которая также называется вакуумной пропиткой). Она предусматривает окружение паренхимной ткани жидкостью, применение вакуумного воздействия, ожидание пока жидкость и газ покинут паренхимную ткань, прекращение вакуумного воздействия и ожидание пока жидкость не заполнит апопласт. Это описано более подробно в Gras, "The response of some vegetables to vacuum impregnation," Innovative Food Science & Emerging Technologies 3.3 (2002): 263-269, которая включена в данный документ посредством ссылки.
[0024] Богатая углеводами паренхимная ткань часто содержит до 20% (по массе) углеводов. Стенки клеток паренхимы обеспечивают прочность клетки паренхимы, а клеточная мембрана предотвращает вытекание содержимого клетки из нее. Клеточная стенка проницаема для сахарозы и других простых сахаров. Клеточную мембрану можно денатурировать под действием нагревания, как правило, выше 70°C, что увеличивает коэффициент диффузии простых сахаров через клеточную мембрану. Эту методику обычно используют для экстракции сахарозы из сахарной свеклы: клеточную мембрану денатурируют под действием нагревания, и затем сахароза диффундирует из сахарной свеклы в горячую воду. Коэффициент диффузии сахарозы через денатурированную ткань сахарной свеклы примерно в пять раз выше, чем через неденатурированную ткань сахарной свеклы, что описано более подробно в Bessadok-Jemai et al., "Modeling the kinetic of solute diffusion from sugarbeet particles based on electric conductivity measurements," International Journal of Physical Sciences 6.28 (2011): 6464-6468, которая включена в данный документ посредством ссылки.
[0025] Клетки паренхимы можно подвергать мацерации (отделять друг от друга) с помощью либо нагревания, либо ферментов. Когда клетки паренхимы подвергают мацерации, целостность клеточной мембраны также нарушается, как под влиянием механического воздействия, так и под влиянием ферментов, которые высвобождаются из клеточной стенки. Это приводит к тому, что содержимое вакуолей просачивается из клеток паренхимы, и приводит к тому, что ферменты легче диффундируют в вакуоли. Это также обеспечивает эффект размачивания, при котором воду в клетках паренхимы можно проще удалять с помощью выжимания или выпаривания. Любая комбинация пектинлиазы, пектатлиазы и полигалактуроназы мацерирует клетки паренхимы у двудольных, в то время как пектинлиаза и ксиланаза мацерируют клетки паренхимы у однодольных. Это описано в Ishii, "Enzymes for the isolation of protoplasts," Plant Protoplasts and Genetic Engineering I. Springer Berlin Heidelberg, 1989, 23-33, которая включена в данный документ посредством ссылки.
[0026] Пектатлиаза и полигалактуроназа при расщеплении пектина также вырабатывают метанол, который зачастую является нежелательным продуктом при производстве этанола. Пектинлиаза расщепляет пектин без выработки метанола в качестве побочного продукта, а ксиланаза не вырабатывает каких-либо спиртов. Доступны пектинлиазы, которые работают в том же диапазоне pH и температурном диапазоне, что и дрожжи, в частности пектинлиазы из Aspergillus niger, с оптимальным pH 5,5 и оптимальной температурой 35°C. Это описано в Yadav et al., "Pectin lyase: a review," Process Biochemistry 44.1 (2009): 1-10, которая включена в данный документ посредством ссылки. Одним примером пектинлиазы, которая работает в том же диапазоне pH и температурном диапазоне, что и дрожжи, является ферментный состав "Pectinex® Ultra Color", доступный от Novozymes A/S, Дания.
[0027] Во время осуществления ферментации дрожжи производят большое количество углекислого газа (CO2). Угольная кислота образуется за счет растворения СО2 в воде. Во время ферментации парциальное давление CO2 составляет 100 кПа (1 атм), а pH этого раствора составляет приблизительно 3,92. Дрожжи осуществляют эффективную ферментацию при этом значении pH, ферменты пектинлиазы из Aspergillus niger (такие как Pectinex Ultra Color) обладают значительной активностью при этом значении pH, ферменты гидролиза гранулированного крахмала (такие как STARGEN) обладают значительной активностью при этом значении pH, и ферменты инулиназы (такие как Fructozyme L) обладают значительной активностью при этом значении pH. Аналогично, все эти ферменты обладают значительной активностью в температурном диапазоне активности дрожжей (от 25°C до 40°C).
[0028] Температура при уборке сахарной свеклы может быть достаточно холодной, часто ниже 10°C, а температура при уборке сахарного тростника, сахарного сорго и гибридов сахарной кукурузы может быть ниже 20°C. Однако тепло, выделяющееся при ферментации простых сахаров в апопласте богатой углеводами паренхимной ткани, будет быстро повышать температуру этой ткани до температурного диапазона, в котором ферменты обладают значительной активностью.
[0029] На скорость ферментации в значительной степени влияет концентрация клеток дрожжей. Ферментация сахарного тростника на обычных заводах в Бразилии может занять от 6 до 10 часов, но для этого требуется высокая концентрация (10% вес./вес.) дрожжей и рециркуляция клеток дрожжей. Это описано более детально в Basso, "Ethanol production in Brazil: the industrial process and its impact on yeast fermentation," INTECH Open Access Publisher, 2011, которая включена в данный документ посредством ссылки. Ферментация вина или пива при более низкой концентрации дрожжей может занимать до недели.
[0030] Одной важной проблемой современных методик ферментации сахаров в этанол является контаминация бактериями, в частности контаминация Lactobacillus. Не желая быть связанными какой-либо конкретной теорией, полагают, что вихревое перемешивание распространяет бактерии по всей среде ферментации, и поэтому контаминирующие бактерии могут вытеснять дрожжи, при этом возникает значительная контаминация. В отсутствие перемешивания и без градиента концентрации сахара (обусловленных равномерным распределением дрожжей в богатой углеводами паренхимной ткани) любая возможная контаминация бактериями остается локализованной и не в состоянии вытеснить дрожжи по всему объему биомассы. Это описано в Kundiyana et al., "Influence of temperature, pH and yeast on in-field production of ethanol from unsterilized sweet sorghum juice," Biomass and bioenergy 34.10 (2010): 1481-1486, которая включена в данный документ посредством ссылки.
[0031] Поскольку клетки паренхимы являются настолько маленькими, то на их раздавливание или экстракцию из них сахара с помощью горячей водой требуется много энергии. Почти 35% капитальных и производственных затрат на производство сахара из стеблей обусловлены стоимостью отжима. Аналогичным образом, большая часть стоимости производства сахара из сахарной свеклы, обусловлена стоимостью экстракции горячей водой. Экономические аспекты отжима сахарного тростника описаны более подробно в Gbaboa, "Comparative study on cane cutter/juice expeller and roller model Sugarcane juice extraction systems," INT J CURR 50/2013, 7: E 55-60, которая включена в данный документ посредством ссылки. Если бы можно было устранить необходимость в отжиме или экстракции горячей водой, это позволило бы снизить затраты на экстракцию сахаров.
[0032] Объемная плотность сахарной свеклы составляет приблизительно 769 кг/м3, а объемная плотность фрагментов (нарезанных частей) сахарного тростника, сахарного сорго и гибридов сахарной кукурузы (т.е. стеблей) составляет приблизительно 350 кг/м3. Если содержание сахара составляет приблизительно 18%, это приводит к плотности сахара, составляющей 138 кг сахара на кубический метр сахарной свеклы и 63 кг сахара на кубический метр сахарного тростника, сахарного сорго и гибридов сахарной кукурузы. Так как транспортные расходы в первую очередь зависят от объема (а не от веса), и поскольку сельскохозяйственные культуры часто собирают на значительных расстояниях от места, где их обрабатывают, достаточно дорого транспортировать сахара при таких низких плотностях, поскольку сахар занимает всего лишь от 5% до 10% объема грузовика. Чтобы уменьшить стоимость производства этанола из богатых углеводами сельскохозяйственных культур, желательно производить этанол в месте сбора урожая (или вблизи него) этих сельскохозяйственных культур, снижая транспортные расходы.
[0033] Клетки паренхимы в богатых углеводами паренхимных тканях являются живыми тканями и, следовательно, осуществляют респирацию (дыхание) после сбора. Дыхание включает преобразование кислорода и сахара в клетках паренхимы в углекислый газ и энергию для поддержания клетки. После сбора сахарной свеклы за счет дыхания расходуется приблизительно 200 г сахара на метрическую тонну сахарной свеклы в день, а в первые 5 дней после сбора за счет дыхания расходуется от приблизительно 600 до 1500 г сахара в день на метрическую тонну сахарной свеклы. Если сахарная свекла содержит приблизительно 18% сахара по весу, то в метрической тонне сахарной свеклы содержится приблизительно 180 кг сахара, что приводит к потере от 0,3% до 0,8% сахара в день в первые 5 дней и 0,1% сахара в день в последующие дни. С учетом того, что сахарную свеклу можно хранить в течение 100 дней перед переработкой, из-за дыхания она может потерять до 10% своего содержания сахара. Сахарный тростник, сахарное сорго и сахарная кукуруза теряют аналогичные количества сахара во время хранения. В данной области техники существует потребность в снижении обусловленных дыханием потерь сахара за счет более быстрого, чем существующие способы, преобразования углеводов в этанол. После того, как углеводы в сельскохозяйственных культурах преобразованы в этанол, их можно хранить в течение длительных периодов времени, что позволяет непрерывно извлекать этанол круглый год. Желательно более эффективно использовать капитал, инвестированный в экстракцию с помощью вальцов, отгонку этанола и дистилляцию за счет применения этого оборудования круглый год, а не только в период сбора урожая.
[0034] Если сахарную свеклу хранить в анаэробных (без кислорода) условиях, микроорганизмы заселят свеклу и через 21 дней полностью ферментируют все сахара в свекле, в основном, в молочную кислоту и уксусную кислоту. Поскольку внешний слой сахарной свеклы часто стирается и повреждается во время сбора, микроорганизмы могут легче проникнуть в наружные слои сахарной свеклы, что приводит к потерям сахара вследствие ферментации в молочную кислоту и уксусную кислоту. Аналогичным образом, сахарный тростник, сахарное сорго и гибриды сахарной кукурузы более восприимчивы к микроорганизмам, проникающим в сердцевину, поскольку во время сбора тростник разрезали на фрагменты.
[0035] Значительную часть капитальных и производственных затрат при производстве этанола из богатых углеводами сельскохозяйственных культур составляет стоимость нагревания сырья. Эти затраты можно было бы снизить (или исключить) при применении саморазогрева от энергии, выделяющейся при ферментации.
[0036] Некоторые методики получения этанола из богатых углеводами сельскохозяйственных культур требуют предварительной обработки или ферментации внутри резервуара высокого давления. Поскольку резервуары высокого давления подвергаются опасности взрыва и требуют большей прочности, чем резервуар без давления, было бы полезно, чтобы резервуар высокого давления не требовался.
[0037] Другими значительными капитальными и производственными затратами при производстве этанола из богатых углеводами сельскохозяйственных культур являются затраты на охлаждение реактора ферментации. Было бы желательным применение недорогого пассивного охлаждения, такое как обдувание воздухом металлических стенок резервуаров или циркуляция холодного углекислого газа через сельскохозяйственную культуру.
КРАТКОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
[0038] В настоящем изобретении предусмотрен способ получения продуктов ферментации из богатой углеводами паренхимной ткани растения, причем способ включает стадии:
[0039] (а) обеспечения богатой углеводами паренхимной ткани растения при температуре сельскохозяйственной культуры;
[0040] (b) объединения богатой углеводами паренхимной ткани растения с водным раствором реагента, который содержит ферментирующий организм, при температуре реагента;
[0041] (с) воздействия на богатую углеводами паренхимную ткань растения давлением газообразной фазы при подготовке в течение времени подготовки либо перед стадией (b), либо после стадии (b), где давление газообразной фазы при подготовке меньше атмосферного давления;
[0042] (d) воздействия на богатую углеводами паренхимную ткань растения давлением газообразной фазы при инфузии в течение времени инфузии, где давление газообразной фазы при инфузии больше давления газообразной фазы при подготовке; и
[0043] (е) поддержания давления газообразной фазы при ферментации в течение времени ферментации для получения продуктов ферментации в пределах богатой углеводами паренхимной ткани растения, где давление газообразной фазы при ферментации больше давления газообразной фазы для подготовки, и где по меньшей мере 25% массы продуктов ферментации составляет этанол.
[0044] В предпочтительных вариантах осуществления богатую углеводами паренхимную ткань растения выбирают из группы, состоящей из стеблей сахарного тростника, стеблей сахарного сорго, стеблей гибридов сахарной кукурузы, корнеплодов сахарной свеклы, яблок, винограда и апельсинов. В некоторых вариантах осуществления богатую углеводами паренхимную ткань растения выбирают из группы, состоящей из клубней картофеля, клубней сладкого картофеля, клубней маниока, клубней ямса и клубней топинамбура.
[0045] В некоторых вариантах осуществления водный раствор реагента содержит ферменты пектиназы. В некоторых вариантах осуществления водный раствор реагента содержит ферменты ксиланазы. В некоторых вариантах осуществления водный раствор реагента содержит ферменты амилазы. В некоторых вариантах осуществления водный раствор реагента содержит ферменты инулиназы.
[0046] В предпочтительных вариантах осуществления температура сельскохозяйственной культуры составляет от приблизительно 5°C до приблизительно 40°C.
[0047] В предпочтительных вариантах осуществления давление газообразной фазы при подготовке составляет от приблизительно 105% до приблизительно 200% равновесного давления воды при большем из следующего, температуры сельскохозяйственной культуры и температуры реагента.
[0048] В предпочтительных вариантах осуществления время подготовки составляет от приблизительно 1 минуты до приблизительно 1 часа.
[0049] В предпочтительных вариантах осуществления ферментирующим организмом является Saccharomyces cerevisiae.
[0050] В предпочтительных вариантах осуществления температура реагента составляет от приблизительно 20°C до приблизительно 40°C.
[0051] В предпочтительных вариантах осуществления водный раствор реагента является гомогенизированным. В некоторых вариантах осуществления способ дополнительно включает перемешивание водного раствора реагента с применением турбулентной энергии в диапазоне от приблизительно 0,15 Вт/кг до приблизительно 50 Вт/кг.
[0052] В предпочтительных вариантах осуществления время инфузии составляет от приблизительно 1 минуты до приблизительно 1 часа.
[0053] В предпочтительных вариантах осуществления время ферментации составляет от приблизительно 6 часов до приблизительно 7 дней.
[0054] В предпочтительных вариантах осуществления давление при ферментации является атмосферным давлением.
[0055] В некоторых вариантах осуществления способ дополнительно включает поддержание богатой углеводами паренхимной ткани растения в анаэробных условиях в течение времени сохранения сельскохозяйственной культуры после завершения времени ферментации.
[0056] В предпочтительных вариантах осуществления способ дополнительно включает выделение продуктов ферментации с помощью вакуумной отгонки. В некоторых вариантах осуществления способ дополнительно включает выделение продуктов ферментации с помощью отжима. В некоторых вариантах осуществления способ дополнительно включает отведение водного раствора реагента либо перед стадией (е), либо после стадии (е).
КРАТКОЕ ОПИСАНИЕ ГРАФИЧЕСКИХ МАТЕРИАЛОВ
[0057] ФИГ. 1 представляет собой схематический чертеж экспериментального устройства, применяемого в вариантах осуществления и примерах по настоящему изобретению.
ПОДРОБНОЕ ОПИСАНИЕ ВАРИАНТОВ ОСУЩЕСТВЛЕНИЯ ИЗОБРЕТЕНИЯ
[0058] Способы, процессы и системы по настоящему изобретению будут описаны подробно со ссылкой на различные неограничивающие варианты осуществления и фигуру(ы).
[0059] Данное описание позволит специалисту в данной области изготовить и применять настоящее изобретение, и в нем описаны несколько вариантов осуществления, адаптации, вариантов, альтернатив и способов применения настоящего изобретения. Эти и другие варианты осуществления, признаки и преимущества настоящего изобретения станут более очевидны для специалистов в данной области при рассмотрении со ссылкой на следующее подробное описание настоящего изобретения в сочетании с прилагаемыми графическими материалами.
[0060] Используемые в данном описании и прилагаемой формуле изобретения формы единственного числа включают формы множественного числа, если контекст явно не указывает на иное. Если не определено иное, все технические и научные термины, используемые в данном документе, имеют то же значение, которое обычно понятно специалисту в области техники, к которой относится настоящее изобретение.
[0061] Если не указано иное, все числа, выражающие параметры, условия, результаты и т.д., используемые в данном описании и формуле изобретения, следует понимать как модифицированные во всех случаях термином "приблизительно". Соответственно, если не указано обратное, числа, приведенные в следующем описании и прилагаемой формуле изобретения, представляют собой приближенные значения, которые могут меняться в зависимости от конкретных алгоритмов и расчетов.
[0062] Термин "содержащий", который является синонимом слова "включающий", "заключающий в себе" или "характеризующийся", является включающим или неограничивающим и не исключает дополнительных не перечисленных элементов или стадий способа. "Содержащий" является термином области техники, используемый в языке пункта формулы изобретения, который означает, что названные элементы пункта формулы являются необходимыми, но другие элементы пункта формулы могут быть добавлены и все еще образуют конструктивный элемент в пределах пункта формулы изобретения.
[0063] Используемая в данном описании фраза "состоящий из" исключает любой элемент, стадию или ингредиент, не обозначенный в пункте формулы изобретения. Если фраза "состоящий из" (или ее вариации) появляется в отличительной части пункта формулы изобретения, а не сразу после ограничительной части, она ограничивает только элемент, изложенный в этой отличительной части; при этом другие элементы в целом не исключаются из пункта формулы изобретения. Используемая в данном документе фаза "состоящий фактически из" ограничивает объем пункта формулы изобретения указанными элементами или стадиями способа, плюс теми, которые не оказывают существенного влияния на основную и новую характеристику(и) заявленного объекта изобретения.
[0064] Что касается терминов "содержащий", "состоящий из" и "состоящий фактически из", когда один из этих трех терминов используется в данном документе, раскрываемый и заявляемый объект настоящего изобретения может включать применение любого из остальных двух терминов. Таким образом в некоторых вариантах осуществления, если иное не указано в явном виде, любое использование "содержащий" может быть заменено на "состоящий из" или, в качестве альтернативы, "состоящий фактически из"
[0065] Ни один из описанных в данном документе вариантов осуществления не должен ограничиваться какой-либо теорией или предположением относительно механизмов реакций, механизмов массообмена, или описанием сырья или продуктов.
[0066] Настоящее изобретение основывается на техническом решении проблемы дороговизны производства продуктов ферментации из богатой углеводами паренхимной ткани растения из-за большого количества энергии и капитала, требуемых для эффективного отжима или экстракции с диффузией в горячую воду. В настоящем изобретении применяется альтернативный подход, заключающийся в инфузии реагентов для ферментации в условиях вакуума в апопласт богатой углеводами паренхимной ткани растения, обеспечении возможности ферментации и затем отделении полученного раствора этанола с применением недорогих методик, таких как вакуумная отгонка. Принципы настоящего изобретения продемонстрированы в примерах, приведенных в данном документе.
[0067] Настоящее изобретение также основывается на техническом решении проблемы разрушения богатых крахмалом и богатых инулином сельскохозяйственных культур после сбора и перед переработкой или потреблением. В настоящем изобретении применяется подход инфузии ферментирующих организмов в условиях вакуума в апопласт паренхимной ткани с ферментацией простых сахаров в этанол, тем самым лишая другие организмы простых сахаров, необходимых для заселения и потребления крахмала или инулина. Это приводит к средней потере, составляющей 0,1% массы богатой углеводами ткани, и имеет преимущество, заключающееся в защите крахмала или инулина от разрушения. После того как простые сахара ферментированы, единственными организмами, которые могут разрушать эти паренхимные ткани, будут грибы, растущие на пектине, организмы, растущие на этаноле, и организмы, растущие на крахмале или инулине.
[0068] Большинство грибов, которые растут на пектине, являются аэробными,
поэтому поддержание анаэробных условий предотвращает колонизацию паренхимной ткани этими грибами. Анаэробным грибам, которые растут на пектине, особенно Rhizopus oryzae, для роста на пектине также необходима глюкоза, таким образом, поддержание условий с отсутствием глюкозы, а также поддержание анаэробных условий предотвращает колонизацию паренхимной ткани этими грибами.
[0069] Организмы, которые растут на этаноле, особенно Acetobacter, также являются аэробными, так что поддержание анаэробных условий предотвращает преобразование этанола в уксусную кислоту этими организмами.
[0070] Организмам, которые растут на крахмале, особенно Bacillus subtilis, необходимо получить доступ к крахмальным гранулам внутри паренхимной ткани. Не желая быть связанными какой-либо конкретной теорией, полагают, что удаление глюкозы в апопласте и внутри клетки паренхимы приводит к тому, что организмы, такие как Bacillus subtilis, не будут иметь достаточно энергии для перемещения в пределах паренхимной ткани.
[0071] При осуществлении ферментации дрожжи производят большие количества углекислого газа, и инфузия дрожжей в богатую углеводами паренхимную ткань растения приводит к образованию пены на внешней стороне этой ткани в процессе ферментации и выталкивает жидкость из этой ткани под действием образования пузырьков внутри ткани. Удивительно, но дрожжи не выталкиваются этими пузырьками, и дрожжи могут продолжать ферментацию до тех пор, пока все простые сахара не будут ферментированы.
[0072] Не желая быть связанными какой-либо конкретной теорией, полагают, что адгезия клеток дрожжей к клеткам паренхимы в присутствии глюкозы сильнее, чем силы, с которыми действуют пузырьки углекислого газа для выталкивания дрожжей из паренхимной ткани.
[0073] Настоящее изобретение также основывается на том факте, что скорость диффузии простых сахаров через клеточную мембрану клеток паренхимы у богатых углеводами сельскохозяйственных культур является достаточной, чтобы обеспечить ферментацию простых сахаров в пределах клеток паренхимы ферментирующими организмами в апопласте на высокой скорости. Затем этанол диффундирует в клетки паренхимы. В некоторых вариантах стенки клеток паренхимы не разрушают, при этом сохраняется структурную прочность сельскохозяйственной культуры, что обеспечивает возможность применения недорогой вакуумной отгонки. В других вариантах пектиназы разрушают стенки клеток паренхимы, при этом увеличивается скорость ферментации и уменьшается энергия, необходимая для удаления воды из ткани после извлечения этанола.
[0074] В некоторых вариантах в настоящем изобретении предусмотрен способ получения продуктов ферментации из богатой углеводами паренхимной ткани растения, при этом способ включает стадии:
[0075] (а) обеспечения богатой углеводами паренхимной ткани растения при температуре сельскохозяйственной культуры;
[0076] (b) объединения богатой углеводами паренхимной ткани растения с водным раствором реагента, который содержит ферментирующий организм, при температуре реагента;
[0077] (с) воздействия на богатую углеводами паренхимную ткань растения давлением газообразной фазы при подготовке в течение времени подготовки либо перед стадией (b), либо после стадии (b), где давление газообразной фазы при подготовке меньше атмосферного давления;
[0078] (d) воздействия на богатую углеводами паренхимную ткань растения давлением газообразной фазы при инфузии в течение времени инфузии, где давление газообразной фазы при инфузии больше давления газообразной фазы при подготовке; и
[0079] (е) под держания давления газообразной фазы при ферментации в течение времени ферментации для получения продуктов ферментации в пределах богатой углеводами паренхимной ткани растения, где давление газообразной фазы при ферментации больше давления газообразной фазы для подготовки, и где по меньшей мере 25% массы продуктов ферментации составляет этанол.
[0080] Специалистам в данной области будет понятно, что давление газообразной фазы при подготовке может быть применено либо перед, либо после объединения богатой углеводами паренхимной ткани растения с водным раствором реагента. Gras описывает объединение перед применением вакуума, а в примерах, приведенные ниже, описано объединение после применения вакуума. Объединение перед применением вакуума, описанное в Gras, имеет преимущество в меньшем времени получения нужно степени разрежения, так как необходимо откачать меньший объем. Однако имеется недостаток, заключающийся в более высоком гидростатическом давлении в нижней части большого резервуара. Для резервуара глубиной всего 1 м этот недостаток не является существенным, но для более глубоких резервуаров этот недостаток может быть существенным.
[0081] Специалистам в данной области будет понятно, что существует широкий спектр ферментирующих организмов, которые производят этанол, и эти ферментирующие организмы прилипают к поверхностям в присутствии глюкозы.
[0082] Вакуумную инфузию можно проводить с помощью резервуара ограниченной прочности, доверху заполненного клубнями или стеблями и имеющего резиновый баллон на верхней части во время применения вакуума, сила самой сельскохозяйственной культуры является тем, что удерживает атмосферное давление 100 кПа снаружи сосуда. В результате этого стоимость резервуара для вакуумной инфузии очень низка, а затраты энергии на выкачивание воздуха из такого резервуара для вакуумной инфузии также весьма низки. В некоторых вариантах осуществления таким резервуаром для вакуумной инфузии может служить, например, грузовик, который привозит сельскохозяйственную культуру с поля, с резиновым баллоном, помещенным сверху.
[0083] Сразу после инфузии водного раствора реагента сельскохозяйственную культуру можно перенести в еще более дешевый резервуар для ферментации. Этот более дешевый резервуар для ферментации не обязательно должен быть герметичным, просто должен закрываться достаточно плотно для того, чтобы удерживать углекислый газ, который производится во время ферментации для поддержания анаэробных условий во время ферментации, тем самым предотвращая разрушение этанола бактериями Acetobacter.
[0084] В предпочтительных вариантах осуществления богатую углеводами паренхимную ткань растения выбирают из группы, состоящей из стеблей сахарного тростника, стеблей сахарного сорго, стеблей гибридов сахарной кукурузы, корнеплодов сахарной свеклы, яблок, винограда и апельсинов. Все они содержат преимущественно простые сахара в паренхимной ткани и могут быть ферментированы дрожжами без необходимости инфузии пектиназы. Необязательно, пектиназа ускоряет ферментацию, хоть и за счет усложнения и дополнительных затрат на ферменты.
[0085] В некоторых вариантах осуществления богатую углеводами паренхимную ткань растения выбирают из группы, состоящей из клубней картофеля, клубней сладкого картофеля, клубней маниока, клубней ямса и клубней топинамбура. Эти сельскохозяйственные культуры содержат небольшое количество простых сахаров, от 0,01% до 2% по весу, а остальную часть углеводов составляют полисахариды. В случае сохранения этих сельскохозяйственных культур инфузия дрожжей будет преобразовывать небольшие количества простых сахаров в этанол. Для преобразования полисахаридов в этих сельскохозяйственных культурах в этанол требуется дополнительная инфузия пектиназы и амилазы или инулиназы.
[0086] В некоторых вариантах осуществления водный раствор реагента содержит ферменты пектиназы. В некоторых вариантах осуществления водный раствор реагента содержит ферменты ксиланазы. В некоторых вариантах осуществления водный раствор реагента содержит ферменты амилазы. В некоторых вариантах осуществления водный раствор реагента содержит ферменты инулиназы. В вариантах осуществления, для которых требуется минимальная выработка метанола в качестве побочного продукта, предпочтительным ферментом пектиназой является пектинлиаза. Для разрушения стенки клеток паренхимы у двудольных необходима комбинация пектиназы и ксиланазы.
[0087] В предпочтительных вариантах осуществления температура сельскохозяйственной культуры составляет от приблизительно 5°C до приблизительно 40°C. Этот температурный диапазон необходим, потому что ферментирующие организмы активны в этом диапазоне.
[0088] В предпочтительных вариантах осуществления давление газообразной фазы для подготовки составляет от приблизительно 105% до приблизительно 200% равновесного давления воды при большем из следующего, температуры сельскохозяйственной культуры и температуры реагента. Давление должно быть насколько возможно низким, при этом все же не допускающим закипание сельскохозяйственной культуры или реагента.
[0089] В предпочтительных вариантах осуществления время подготовки составляет от приблизительно 1 минуты до приблизительно 1 часа. У некоторых сельскохозяйственных культур откачка газа из апопласта занимает больше времени, чем у других, в частности, у сахарного тростника и сахарного сорго.
[0090] В предпочтительных вариантах осуществления ферментирующим организмом является Saccharomyces cerevisiae. Этот организм имеет самую высокую переносимость этанола, чем любой другой ферментирующий организм, и многие гибриды являются доступными.
[0091] В предпочтительных вариантах осуществления температура реагента составляет от приблизительно 20°C до приблизительно 40°C. Ферментирующие организмы хорошо развиваются в этом температурном диапазоне.
[0092] Температура реагента должна быть достаточно низкой, чтобы вода в водном растворе реагента не закипала в условиях давления при подготовке, при этом кипение вызывает быстрое высвобождение пара в виде больших пузырьков. Так как вода обычно является основным компонентом водного раствора реагента, равновесные данные воды можно использовать для определения температуры реагента при заданном давлении при подготовке, и наоборот. Например, если температура реагента составляет приблизительно 38°C, давление при подготовке должно быть больше приблизительно 7кПа.
[0093] В предпочтительных вариантах осуществления водный раствор реагента является гомогенизированным. В некоторых вариантах осуществления способ дополнительно включает перемешивание водного раствора реагента с применением турбулентной энергии в диапазоне от приблизительно 0,15 Вт/кг до приблизительно 50 Вт/кг.
[0094] Применяется достаточное количество турбулентной энергии, так что колмогоровский масштаб длин на порядок меньше, чем свободная длина апопласта (например, приблизительно 10 микрон). Используя колмогоровский масштаб длин и зная, что кинематическая вязкость воды при 20°C составляет приблизительно 10-6 м2/с, энергия, необходимая для смешивания реагентов и продвижения воды в масштабе 10 микрон, составляет приблизительно 50 Вт/кг. Точно так же, смешивание в масштабе 20 микрон требует приблизительно 5 Вт/кг, а смешивание в масштабе 50 микрон требует приблизительно 0,15 Вт/кг.
[0095] Специалисту со средней квалификацией в данной области будет понятно, что существует множество простых смешивающих устройств, которые способны смешивать с таким типом энергии. Одним из таких простых смешивающих устройств является пластиковая труба 25 мм в диаметре и 8 метров в длину с шероховатостью трубы 0,0014, которая производит инфузию от атмосферного давления (100 кПа) до вакуума, составляющего 20 кПа, со скоростью 2,8 литра/с (6 CFM), при этом во время инфузии вакуум поддерживается вакуумным насосом. Мощность, рассеиваемая в трубе из-за падения давления, составляет 226,4 Вт. Общий объем жидкости в трубе составляет 4,05 кг, таким образом, мощность, рассеиваемая на кг, составляет приблизительно 56 Вт/кг, этого достаточно для смешивания в масштабе 10 микрон (приводимой в качестве примера скорости потока достаточно для вливания 18 м3 за 1,8 часа).
[0096] В предпочтительных вариантах осуществления время инфузии составляет от приблизительно 1 минуты до приблизительно 1 часа. Эксперименты показали, что эффективность преобразования сахаров относительно нечувствительна к времени инфузии.
[0097] В предпочтительных вариантах осуществления время ферментации составляет от приблизительно 6 часов до приблизительно 7 дней. Эксперименты показали, что время ферментации при концентрации дрожжей, составляющей около 2 клеток на клетку паренхимы, будет составлять от приблизительно 6 часов до 20 часов, в зависимости от типа богатой углеводами паренхимы растения.
[0098] В предпочтительных вариантах осуществления давление при ферментации является атмосферным давлением. Поскольку CO2 вырабатывается постоянно, и так как резервуары высокого давления являются дорогостоящими и опасными, отвод CO2 при атмосферном давлении будет менее затратным.
[0099] В некоторых вариантах осуществления способ дополнительно включает поддержание богатой углеводами паренхимной ткани растения в анаэробных условиях в течение времени сохранения сельскохозяйственной культуры после завершения времени ферментации. Когда условия являются анаэробными и в апопласте или клетках паренхимы отсутствуют простые сахара, грибы и бактерии не могут расти на пектине или этаноле.
[00100] В предпочтительных вариантах осуществления способ дополнительно включает выделение продуктов ферментации с помощью вакуумной отгонки. В некоторых вариантах осуществления способ дополнительно включает выделение продуктов ферментации с помощью отжима. В некоторых вариантах осуществления способ дополнительно включает отведение водного раствора реагента либо перед стадией (е), либо после стадии (е).
[00101] Вакуумная отгонка является предпочтительной, поскольку это эффективная и самая экономичная методика выделения продуктов ферментации. Вакуумную отгонку этанола можно проводить с помощью аналогичного резервуара, что и при вакуумной инфузии, но с дополнительной возможностью нагревания сельскохозяйственной культуры. Отведение водного раствора реагента приводит к более высокой процентной доле этанола в отгоняемом паре.
[00102] Специалисту со средней квалификацией в данной области будет понятно, что повышение температуры во время ферментации можно ограничивать до приблизительно 38°C с помощью различных недорогих методик, особенно если ферментация занимает более приблизительно 20 часов.
[00103] Специалисту со средней квалификацией в данной области будет понятно, что известное устройство можно применять для процессов, систем и способов, раскрытых в настоящем описании. Процессы, описанные в данном документе, могут быть периодическими, непрерывными, полунепрерывными или псевдонепрерывными. Любое упоминание терминов "резервуар" или "реактор" в данном документе, должно быть истолковано в понимании одного или множества таких устройств (например, соединенных последовательно или параллельно). Могут требоваться или наблюдаться различные схемы потока. С химическими реакциями и одновременными массообменными процессами с участием нескольких фаз, динамика жидкостей может быть довольно сложной. В зависимости от конкретной конструкции схемы потока могут быть выполнены как поршневой поток или хорошо перемешанный поток.
[00104] Выработка, или производительность процесса, может меняться в широких пределах от небольших лабораторных установок до полноценных промышленных предприятий по переработке биомассы, включая любые экспериментальные, демонстрационные или полупромышленные установки. В различных вариантах осуществления производительность процесса составляет по меньшей мере приблизительно 1 кг/день, 10 кг/день, 100 кг/день, 1 тонна/день (все тонны являются метрическими тоннами), 10 тонн/день, 100 тонн/день, 500 тонн/день, 1000 тонн/день, 2000 тонн/день, или более.
[00105] Вся система может быть неподвижно закреплена, или может быть выполнена как передвижная. Система может быть сконструирована с применением модулей, которые можно просто дублировать для практического расширения масштабов.
[00106] Различные зонды могут обеспечивать возможность тщательного мониторинга процесса и контроля на различных стадиях процесса, вплоть до и потенциально включая все стадии процесса. Ожидается, что тщательный мониторинг процесса приведет к увеличению количества произведенного продукта и улучшению эффективности, как в динамическом режиме, так и за определенный период времени, при этом история эксплуатации может быть использована для коррекции условий процесса (включая программы циклического изменения давления). В некоторых вариантах осуществления реакционный зонд расположен в функциональном взаимодействии с зоной, в которой происходит процесс. Такой реакционный зонд может быть полезен для экстракции жидких образцов и их анализа, чтобы определить степень гидролиза или состав сахаров и т.д. Коррекция процесса может основываться на результатах измерений, если это будет необходимо или потребуется, путем применения хорошо известных принципов контроля процесса (обратную связь, прямую связь, пропорционально-интегрально-дифференциальную логическую схему и т.д.).
[00107] Потоки твердых веществ, жидкостей и газов, вырабатываемые или существующие в рамках процесса, могут быть независимо друг от друга рециркулированы, переданы на последующие стадии или извлечены/выведены из процесса в любой момент.
ПРИМЕРЫ
[00108] Следующие примеры показывают принципы настоящего изобретения. С помощью экспериментальных данных было показано, что вакуумная инфузия дрожжей и ферментов, описанных выше, применима для ферментации богатых углеводами сельскохозяйственных культур.
[00109] Экспериментальное устройство на фиг. 1 разработано для воспроизведения функциональных возможностей промышленного процесса, таких как температура, давление и контроль потока в промышленном установке. Оно отличается от промышленной установки загрузкой и выгрузкой сельскохозяйственной культуры (образца). Экспериментальное устройство используется во всех приведенных ниже примерах.
[00110] Со ссылкой на фиг. 1 экспериментальное устройство 100 состоит из основного резервуара 102 для инфузии, который во время эксплуатации почти полностью погружен в термостатическую баню 101, которая может работать в широком диапазоне температур и точное управление температурой которой обеспечивается с помощью регулятора 114 температуры. Резервуар 102 для инфузии закрывается съемной и герметичной крышкой 118. Резервуар 102 для инфузии и герметичная крышка 118 разработаны таким образом, чтобы удерживать и поддерживать вакуумные условия, как того требуют условия процесса. Требуемое количество материала 117 образца можно поместить внутрь резервуара 102 для инфузии. Резервуар 102 для инфузии может снабжаться CO2 посредством баллона 106 с CO2 и трубопровода 107 для CO2. На трубопроводе 107 для CO2 используется регулятор 108 потока/давления, чтобы задавать давление, при котором CO2 доставляется в резервуар 102 для инфузии. Вакуумный насос 103 используется для откачивания и поддержания вакуума внутри резервуара 102 для инфузии. Индикатор 116 давления и индикатор 119 температуры установлены на резервуар 102 для инфузии. Резервуар 102 для инфузии соединен посредством запорного клапана 109 с контейнером 105 с подготовленным водным раствором реагента. Вакуумный насос 103 соединен с резервуаром 102 для инфузии посредством трубопровода, на котором установлен регулятор 110 давления. Регулятор 110 давления обеспечивает возможность регуляции давления в резервуаре 102 для инфузии в широком диапазоне уровней вакуума, в то время как вакуумный насос 103 работает при постоянной скорости. Отводное отверстие 112 на регуляторе 110 давления соединено с газовым счетчиком. Четырехходовой клапан 104 на линии выхода газа из резервуара 102 для инфузии обеспечивает возможность изъятия образцов через пробоотборный канал 111, изоляции резервуара 102 для инфузии, циклического изменения давления 116 и рециркуляции части образца обратно в резервуар 102 для инфузии без изменения давления и состава газовой шапки внутри него.
[00111] Экспериментальная процедура для примеров, приведенных ниже, является следующей. Предварительно смешанный водный раствор реагента готовят отдельно в соответствии с конкретными требованиями эксперимента; необязательно водный раствор реагента может быть предварительно нагрет до требуемой температуры. Образец сельскохозяйственной культуры помещают внутрь резервуара 102 для инфузии. В резервуаре 102 для инфузии отсутствует любая жидкость. Резервуар 102 для инфузии помещают в термостатическую баню 101, которая работает при температуре, заданной для эксперимента. После того как крышку 118 помещают сверху резервуара 102 для инфузии, с применением вакуумного насоса 103 и CO2 из трубопровода 107 весь воздух выпускают, и на поверхности образца образуется атмосфера CO2. После подтверждения выпуска всего остаточного воздуха, поток свежего CO2 из трубопровода 107 прерывается путем воздействия на регулятор 115 потока. Давлению в резервуаре 102 для инфузии дают опуститься до уровня, заданного в эксперименте, посредством регулирования его с помощью регулятора 110 давления.
[00112] Как только давление и температура стабилизируются на требуемом уровне, свободную жидкость, которая была вытеснена из сельскохозяйственной культуры при падении давления, необязательно можно отвести из резервуара через пробоотборный канал 111 и сохранить для дальнейшего анализа. Затем запорный клапан 109 открывается и обеспечивается возможность попадания предварительно смешанного водного раствора реагента в резервуар 102 для инфузии, при этом происходит инфузия. Количество материала образца задается так, чтобы, в зависимости от объемной плотности материала, образец был полностью погруженным, как только прерывается подача жидкости. При точно выбранных температуре и давлении кипения жидкости можно избежать (кипение вызывает значительное высвобождение пузырьков газа). После того как инфузия завершается и запорный клапан 109 закрывается, устанавливается парциальное давление CO2, составляющее 1,0 атм, путем открытия и регуляции с помощью регулятора 108 потока и давления.
[00113] После того, как жидкость была инфузирована в сельскохозяйственную культуру при давлении 1,0 атм в течение требуемого времени, свободную жидкость можно необязательно отвести из резервуара через пробоотборный канал 111.
[00114] Затем эксперимент может продолжаться в течение всего требуемого срока. Если жидкий образец необходим во время эксперимента, то шприц можно подсоединить к пробоотборному каналу 111 четырехходового клапана 104, который установлен таким образом, чтобы обеспечить возможность заполнения шприца жидкостью. Любая остаточная жидкость стекает обратно в резервуар через трубку четырехходового клапана, как только шприц удален и пробоотборный канал 111 закрыт.
[00115] Ход ферментации измеряют с помощью вырабатываемого газа в отводном отверстии 112 с помощью MilliGascounter типа MGC-1 от Dr.-Ing. Ritter Apparatebau GmbH & Co. KG Бохум, Германия. Количество вырабатываемого газа измеряют при обнаружении в миллилитровом количестве в течение периода ферментации. При ферментации 3,35 г (обычно сахарозы) вырабатывается 1 л газа (CO2), так что о количестве ферментированного сахара, скорости ферментации и общем количестве ферментированного сахара можно судить по графику образуемого газа в зависимости от времени.
[00116] В следующих примерах использована сахарная свекла из северной Миннесоты, сахарный тростник из Флориды и сахарное сорго из Теннесси. Из каждого растения выжимали сок и измеряли содержание сахара по шкале Брикса с помощью цифрового рефрактометра. Образцы каждого растения высушили до постоянного веса для определения процента сухих твердых веществ. Их объединяли для расчета процента (вес/вес) сахаров в этих культурах.
[00117] Следует отметить, что измерения сока сахарного сорго по шкале Брикса корректировали путем умножения на приблизительно 0,8, чтобы получить процентное содержание по весу общих сахаров. Это обусловлено тем, что в соке сахарного сорго присутствует больше глюкозы и фруктозы, чем в соке сахарной свеклы или сахарного тростника, а показатель преломления глюкозы и фруктозы отличается от показателя сахарозы. Это описано Liu et al., "Refining bioethanol from stalk juice of sweet sorghum by immobilized yeast fermentation," Renewable Energy 33.5 (2008): 1130-1135, которая включена в данный документ посредством ссылки.
[00118] Было рассчитано, что в сахарной свекле содержится 18% сахара по весу, в сахарном тростнике содержится 14% сахара по весу, а в сахарном сорго содержится 10% сахара по весу.
[00119] Пример 1. Инфузия воды в паренхимную ткань сахарной свеклы
[00120] Сахарную свеклу нарезали радиально на кусочки трех различных толщин, 6 мм, 12 мм и 18 мм. Затем эти кусочки нарезали на квадратные кусочки по 25 мм и все квадратные кусочки по 25 мм для каждой из трех толщин взвешивали и помещали в три устройства, описанные выше (фиг. 1). В этом примере газовой шапкой служил воздух.
[00121] Во время фазы 1 в течение 30 минут применяли вакуум, равный 13 кПа, свободную воду удаляли, давление восстанавливали до 100 кПа и каждый кубик взвешивали.
[00122] Во время фазы 2 в течение 30 минут применяли вакуум, равный 13 кПа, воду вливали в условиях вакуума, пока она не покрывала кубик, давление восстанавливали до 100 кПа, воду инфузировали в паренхимную ткань в течение 30 минут, свободную воду удаляли и затем каждый кубик взвешивали.
[00123] Во время фазы 3 в течение 30 минут применяли вакуум, равный 13 кПа, свободную воду удаляли, давление восстанавливали до 100 кПа и каждый кубик взвешивали.
[00124] Результат данного теста показан в таблице 1 ниже, и этот результат показывает, что приблизительно 10% от массы паренхимной ткани уходило из ткани при применении вакуума в течение 30 минут. Он также показывает, что приблизительно 6% от массы паренхимной ткани можно инфузировать водой в условиях вакуума и что приблизительно ее половина уходит из ткани во время повторного применения вакуума. Что более важно, этот пример показывает, что инфузия была практически идентичной в ткани толщиной 6 мм и ткани толщиной 18 мм.

[00125] Пример 2. Ферментация сахарного тростника
[00126] В нарезанный сахарный тростник инфузировали слабокислый раствор дрожжей, дополненный питательными веществами, обогащенными азотом (Fermax от BSG Corporation). Два разных раствора тестировали в двух повторностях, один с использованием дрожжей Thermosacc, а другой с использованием дрожжей Distillamax. Оба вида дрожжей коммерчески доступны от Lallemand Biofuels & Distilled Spirits и отличаются средним размером протопластов. У дрожжей Thermosacc средний диаметр клеток составляет 5 микрон, а у Distillamax средний диаметр клеток составляет 10 микрон. После завершения инфузии посредством газовых счетчиков отслеживали выработку углекислого газа для оценки хода ферментации. Применяли следующую процедуру.
[00127] 1. Начинали нагревание термостатической бани до 38°C.
[00128] 2. Взвешивали приблизительно 50 г сахарного тростника, затем измельчали на куски длиной один дюйм, снова взвешивали общее количество тростника после измельчения.
[00129] 3. Готовили два раствора дрожжей, один из расчета 5 г/л дрожжей Distillamax, 1 г/л питательных веществ Fermax, а другой из расчета 5 г/л дрожжей Thermosacc (С6), 1 г/л питательных веществ Fermax, оба забуферивали при pH 3,5 с помощью фосфорной кислоты.
[00130] 4. Помещали сахарный тростник в герметичных стаканах в термостатическую баню, и в течение 30 мин применяли вакуум, чтобы обеспечить полный отвод газа из биомассы.
[00131] 5. В каждый стакан вливали приблизительно 200 г раствора.
[00132] 6. Медленно восстанавливали атмосферное давление, создавая шапку из инертного газа над содержимым стакана.
[00133] 7. Открывали отводное отверстие для газа, чтобы газ мог пройти через измерители потока газа.
[00134] 8. Оставляли ферментацию проходить до завершения, в то же самое время проводили регистрацию результатов измерения потока газа.
[00135] Опыты с применением образцов с дрожжами Thermosacc и Distillamax проводили в двух повторностях, и результаты с наибольшим выходом газа представлены в таблице 2. Обе ферментации полностью завершились чуть меньше чем за 8 часов.
[00136] В обоих случаях инфузия обеспечила возможность ферментации проходить внутри стебля сахарного тростника с минимальной предварительной обработкой субстрата кроме уменьшения крупных фрагментов. Неожиданным образом, более мелкие клетки дрожжей оказались более эффективными, обеспечивая преобразование большего количества сахара, о чем свидетельствует большая выработка газа. Этот результат согласуется с тем, что более мелкие дрожжи способны диффундировать глубже в середину апопласта сахарного тростника. В обоих случаях, вакуумная инфузия обеспечила возможность активной ферментацию in-situ, как показано в таблице 2.

[00137] Пример 3. Ферментация сахарной свеклы
[00138] В крупно нарезанные куски сахарной свеклы инфузировали слабокислый раствор дрожжей, приготовленный из дрожжей Distillamax от Lallemand Biofuels & Distilled Spirits. Для каждого образца применяли различное время инфузии. После завершения инфузии посредством газовых счетчиков отслеживали выработку углекислого газа для оценки хода ферментации. Применяли следующую процедуру.
[00139] 1. Обеспечивали, чтобы температура термостатической бани составляла 38°C.
[00140] 2. Взвешивали приблизительно 100 г сахарной свеклы, затем измельчали на куски в виде кубиков размером приблизительно один дюйм, снова взвешивали общее количество свеклы после измельчения.
[00141] 3. Готовили раствор дрожжей при 5 г/л дрожжей Distillamax, забуферивали pH при 3,5 с помощью фосфорной кислоты.
[00142] 4. В раствор для образцов 2 и 4 добавляли фермент с пектиназной активностью при загрузке, составляющей приблизительно 5 г на кг сухой биомассы.
[00143] 5. Помещали образец сахарной свеклы в герметичный стакан в термостатическую баню и в течение 30 мин применяли вакуум.
[00144] 6. Вливали достаточное количество раствора, чтобы покрыть все куски свеклы.
[00145] 7. Мгновенно сбрасывали давление в случае образцов 1 и 2 и медленно (приблизительно за 5 минут) в случае образцов 3 и 4.
[00146] 8. Подсоединяли газовые счетчики.
[00147] 9. Оставляли ферментацию проходить до завершения.
[00148] Размер образца и количество газа, вырабатываемого при ферментации каждого из этих 4-х образцов сахарной свеклы, представлены в таблице 3. Обе ферментации полностью завершились за 13-15 часов. Время инфузии не оказывало существенного влияния на общий выход преобразования сахаров, так как этот выход составлял более приблизительно 90% для случаев быстрой инфузии (образцы 1 и 2). Медленная инфузия, по-видимому, является немного разрушительной. Добавление фермента пектиназы, который разрушает клеточную стенку, по-видимому, улучшает ферментацию и дополнительно иллюстрирует возможность с помощью вакуумной инфузии in situ доставки ферментной и микробиологической активности без механического перемешивания и минимальной предварительной обработки биомассы.
[00149] Пример 4. Ферментация сахарного сорго
[00150] Для ферментации сахарного сорго применяли такую же процедуру, как описана выше в примере 2. Вместо варьирования типа дрожжей в случае обоих образцов применяли дрожжи Thermosacc. После инфузии из стеблей в одном образце отводили жидкость, а в другом образце жидкость не отводили.
[00151] Результаты этих ферментаций представлены в таблице 4. Обе ферментации полностью завершились чуть меньше чем за 20 часов.
[00152] Неожиданным образом, эффективность ферментации при отведении жидкости из стеблей была выше, чем эффективность при сохранении жидкости возле стеблей. В обоих случаях, однако, вакуумная инфузия обеспечивала возможность активной ферментации in-situ.

[00153] Пример 5. Ферментация картофеля
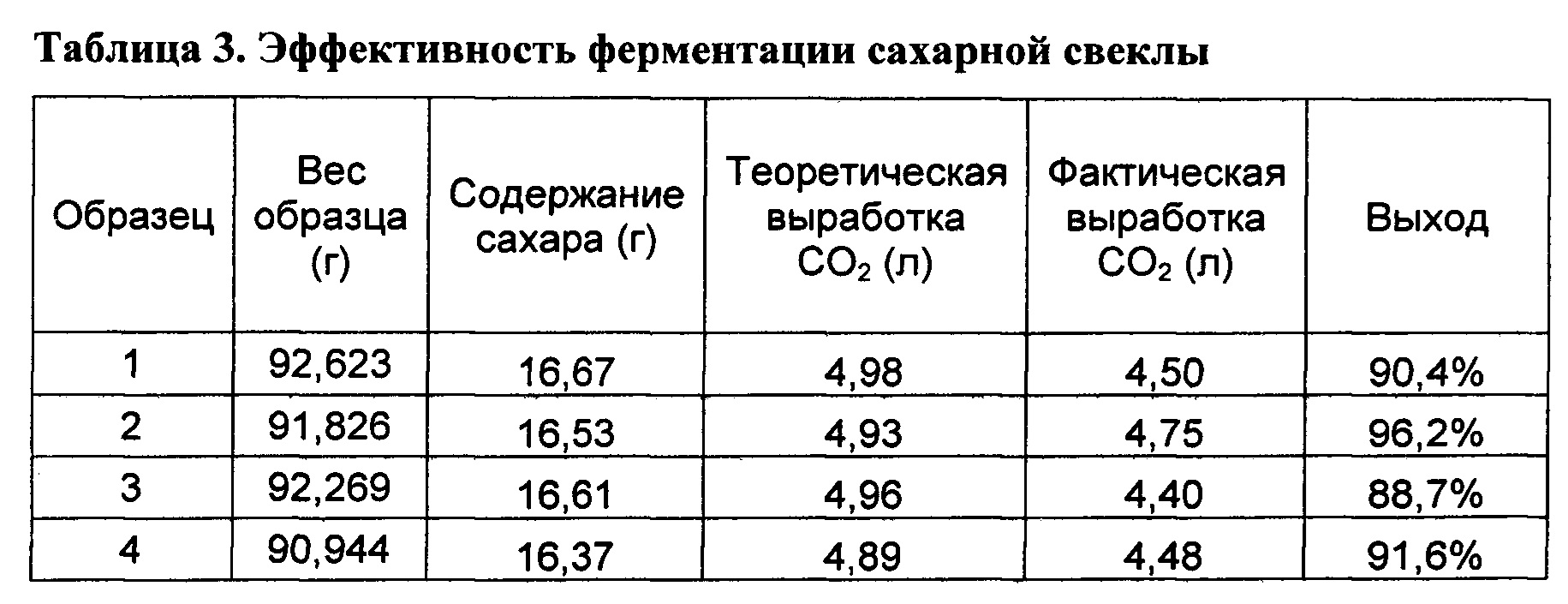
[00154] В крупно нарезанные куски картофеля инфузировали слабокислый раствор дрожжей, приготовленный из дрожжей Thermosacc от Lallemand Biofuels & Distilled Spirits. В один образец дополнительно инфузировали ферменты α-амилазы от BSG Handcraft из Шакопи, Миннесота, США. Данная α-амилаза обладает максимальной активностью при 66°C и приблизительно 20% активностью при 38°C.После завершения инфузии посредством газовых счетчиков отслеживали выработку углекислого газа для оценки хода ферментации. Применяли следующую процедуру.
[00155] 1. Обеспечивали, чтобы температура термостатической бани составляла 38°C.
[00156] 2. Взвешивали приблизительно 70 г картофеля, затем измельчали на куски в виде кубиков размером приблизительно один дюйм, взвешивали общее количество картофеля после измельчения.
[00157] 3. Готовили раствор дрожжей при 5 г/л дрожжей Thermosacc, забуферивали pH при 3,5 с помощью фосфорной кислоты.
[00158] 4. В раствор для образца 2 добавляли фермент с α-амилазной активностью при загрузке, составляющей приблизительно 5 г на кг сухой биомассы.
[00159] 5. Помещали образец картофеля в герметичный стакан в термостатическую баню и в течение 30 мин применяли вакуум.
[00160] 6. Вливали достаточное количество раствора, чтобы покрыть все куски картофеля.
[00161] 7. Мгновенно сбрасывали давление.
[00162] 8. Подсоединяли газовые счетчики.
[00163] 9. Оставляли ферментацию проходить в течение приблизительно 120 часов.
[00164] Размер образца и количество газа, вырабатываемого при ферментации каждого из этих 2-х образцов картофеля, представлены в таблице 5. Специалистам в данной области техники будет понятно, что в клетках паренхимы картофеля содержится приблизительно 0,5%-2% простых сахаров (сахароза + глюкоза) и приблизительно 18% крахмала, приблизительно 80% которого может расщепляться до глюкозы, мальтозы и мальтотриозы с помощью α-амилазы. Ферментация обоих образцов заняла 14,5 часа, пока не начало производиться измеряемое количество газа.
[00165] Не желая быть связанными какой-либо конкретной теорией, полагают, что такое продолжительное время индукции было частично вызвано тем, что исходный выработанный CO2 поглотился водой в картофеле, и выработка газа началась, когда вода в картофеле насытилась CO2.Специалистам в данной области техники будет понятно, что растворимость CO2 в воде при 38°C составляет приблизительно 1,6 г/л, что 0,076 л ткани картофеля содержит приблизительно 0,608 л воды, и что приблизительно 0,042 л CO2 растворится в 0,076 л картофеля до появления первого пузырька.
[00166] После 120 часов ферментации в образце 1 выработалось 0,155 л газа, а в образце 2 выработалось 1,27 л газа. В образце 1 не вырабатывалось измеримое количество газа в период от 72 часов до 120 часов, что указывает на то, что все простые сахара в апопласте и клетках паренхимы были ферментированы и что дополнительные простые сахара не высвобождались из крахмальных гранул. Это указывает на то, что инфузия дрожжей будет сохранять богатую крахмалом паренхимную ткань.
[00167] Значительно более высокая выработка газа в образце 2 указывает на то, что α-амилаза диффундирует в клетки паренхимы и гидролизирует приблизительно 40% крахмальных гранул в сахара, которые могли ферментировать дрожжи. Выработка газа была непрерывной на протяжении 120 часов ферментации с медленным уменьшением. Этот пример показывает, что с помощью данной методики можно ферментировать крахмальные гранулы внутри клеток паренхимы путем простой инфузии дрожжей и амилазы, без инфузии пектиназы. Он также указывает на то, что мембрана клеток паренхимы проницаема для ферментов амилаз.
[00168] В этом подробном описании была сделана ссылка на несколько вариантов осуществления и на прилагаемые графические материалы, на которых в иллюстративных целях показаны конкретные, приведенные в качестве примера варианты осуществления настоящего изобретения. Эти варианты осуществления описаны для того, чтобы специалисты в данной области смогли осуществить настоящее изобретение на практике, и следует понимать, что модификации различных раскрытых вариантов осуществления могут быть сделаны специалистом в данной области.
[00169] Там, где способы и стадии, описанные выше, указывают на определенные события, происходящие в определенном порядке, специалистам в данной области будет понятно, что порядок определенных стадий может быть изменен и что такие модификации находятся в полном соответствии с вариациями настоящего изобретения. Кроме того, некоторые стадии могут выполняться одновременно в параллельном процессе, когда это возможно, а также выполняться последовательно.
[00170] Все публикации, патенты и заявки на патенты, упоминаемые в настоящем описании, включены в данный документ с помощью ссылки во всей своей полноте как если бы каждая публикация, патент или заявка на патент была конкретно и индивидуально изложена в данном документе.
[00171] Варианты осуществления, вариации и фигуры, описанные выше, должны давать представление о полезности и универсальности настоящего изобретения. Другие варианты осуществления, которые не предусматривают всех признаков и преимуществ, изложенных в данном документе, также могут быть использованы без отступления от существа и объема настоящего изобретения. Такие модификации и вариации считаются входящими в объем настоящего изобретения, определяемого формулой изобретения. В случае конфликта в определениях между настоящим раскрытием и словарем или другим справочным источником настоящее описание будет иметь преимущественную силу.
Реферат
Предложен способ получения продуктов ферментации из богатой углеводами паренхимной ткани растения. Способ включает обеспечение богатой углеводами паренхимной ткани растения, содержащей апопласт, при температуре сельскохозяйственной культуры от 5 до 40°С. Объединяют указанную паренхимную ткань растения с водным раствором, содержащим дрожжи, при температуре раствора от 20 до 40°С. Осуществляют воздействие на указанную паренхимную ткань растения давлением газообразной фазы при подготовке в течение времени подготовки либо перед объединением ткани растения с водным раствором, содержащим дрожжи, либо после указанного объединения. При этом указанное время подготовки составляет от 1 минуты до 1 часа, а указанное давление газообразной фазы при подготовке меньше атмосферного давления и составляет от 105 до 200% от равновесного давления водяного пара при большей температуре из указанной температуры сельскохозяйственной культуры и указанной температуры раствора. Осуществляют воздействие на указанную паренхимную ткань растения давлением газообразной фазы при инфузии в течение времени инфузии, составляющего от 1 минуты до 1 часа, где происходит инфузия указанных дрожжей в указанный апопласт и где указанное давление газообразной фазы при инфузии больше указанного давления газообразной фазы при подготовке. Отводят свободную жидкость, которая не была втянута в апопласт, после чего поддерживают давление газообразной фазы при ферментации в течение времени ферментации для получения продуктов ферментации в пределах указанного апопласта без повторного введения указанного водного раствора, содержащего дрожжи, в указанную паренхимную ткань растения. При этом указанное давление газообразной фазы при ферментации больше указанного давления газообразной фазы при подготовке, указанное время ферментации составляет от 6 часов до 7 суток, а указанные продукты ферментации получены ферментацией углеводов, выбранных из группы, состоящей из простых сахаров, простых сахаров, полученных гидролизом крахмала, и их сочетаний, и где углекислый газ не вытесняет указанные дрожжи из указанного апопласта в ходе указанной ферментации. Изобретение обеспечивает эффективную ферментацию богатых углеводами сельскохозяйственных культур. 12 з.п. ф-лы, 1 ил., 5 табл., 5 пр.

Комментарии