Композиционная коллагеновая губка и способ ее изготовления - RU2584348C2
Код документа: RU2584348C2
Чертежи

Описание
Область изобретения
Настоящее изобретение лежит в области биомедицинских материалов и относится к композиционной коллагеновой губке и способу ее изготовления. Композиционную коллагеновую губку применяют для остановки кровотечения из раневых поверхностей организма человека и животного и для стимулирования роста и пролиферации клеток, а также для восстановления тканей сосудов и органов.
Уровень техники
В области медицины заживление ран и послеоперационные рост и регенерация организма представляют собой взаимосвязанные патологические и физиологические процессы, которые включают серии биохимических, физиологических и морфологических изменений в организме. Таким образом, когда организм поврежден, на коже и поверхностях органов часто появляются дефекты. В случае когда клетки невозможно восстановить, на поверхности тела могут возникать такие состояния как инфекция, нагноение или некроз пересаженных лоскутов и пересаженных кожных трансплантатов. Обычно, для того чтобы уменьшить вероятность таких явлений, в клинической практике часто применяют противоинфекционные способы лечения, например введение антибиотиков или наружное применение традиционной китайской и западной медицины, но коэффициент выживаемости клеток ткани на раневой поверхности организма очень низок, что приводит к неблагоприятным состояниям, таким как дефекты мышц, образование рубцов и продолжительный период заживления ран, и даже вызывает необходимость повторной операции.
Чтобы решить техническую проблему предотвращения неблагоприятных состояний ран и уменьшить частоту повторных операций с 1980-х годов были проведены обширные исследования и клинические испытания в отношении применения восстанавливающего эффекта факторов роста на раны организма и послеоперационные ткани организма. Концепция восстановления тканей организма, таким образом, развилась от простого заживления поверхностей тела до процесса восстановления клеток и тканей, который улучшает или восстанавливает эффект выживания клеток тканей за счет применения факторов роста при искусственном вмешательстве в естественный процесс заживления раневых поверхностей.
Коллаген, структурный белок, составляющий внеклеточный матрикс, представлен в виде белых прозрачных неразветвленных фибрилл, состоящих из нескольких типов гликопротеиновых молекул, и обладает четвертичной структурой. Единицей коллагена является тропоколлаген, молекула которого представляет собой тонкую трехнитевую спиральную цепь диаметром 1,5 нм и длиной 300 нм, как измерено посредством электронной микроскопии, и имеет относительную молекулярную массу 2,85×105. Она имеет стабильную трехспиральную пространственную структуру благодаря ее особому аминокислотному составу. Коллаген является кровоостанавливающим, слабоантигенным, разлагаемым и биосовместимым, применяется для изготовления биомедицинских материалов, а также в клиническом аспекте для остановки кровотечения и стимуляции роста клеток.
Факторы роста фибробластов (FGF) представляют собой митогенные, хемотаксические и регуляторые белки, представленные во всех клетках, связанных с заживлением ран, и стимулируют восстановление и регенерацию клеток мезодермального и эктодермального происхождения (например, эпителиальных клеток, гиподермальных клеток, фибробластов и сосудистых эндотелиальных клеток).
В US 2006/0236891, US 1978/4066083, US 20080268052 и US 2010/7754258 раскрыты способы изготовления коллагеновых мембран путем применения коллагенов, выделенных из ахилловых сухожилий или кожи животных, в то же время ни в одном из них не упоминаются средства для вирусной инактивации. Однако в клинической практике всегда существуют возможности перекрестного инфицирования патогенными микроорганизмами, инфекционными как для человека, так и для животных, например вирусом энцефалита В (EBV), вирусом гепатита Е (HEV), вирусом ложного бешенства (PRV), вирусом везикулярного стоматита (VSV) и стрептококком, которые все когда-то вызывали широко распространенные перекрестно-инфекционные заболевания человека и животных и бедственные последствия. Следовательно, продукты, изготовленные этими способами изготовления, имеют определенную угрозу безопасности при клинических применениях.
В CN 1228339 и CN 1511592 раскрыты композиционные коллагеновые губки, содержащие биологические факторы, но там применяли облучение для проведения дезинфекции во время изготовления этих губок. Что касается биоактивных материалов, облучение увеличивает температуру продуктов, приводя к денатурации этих биоактивных материалов, что не только снижает активность биоактивных материалов, но также приводит к образованию новых иммунологически активных материалов и, следовательно, вызывает ненужные проблемы при клиническом применении.
Более того, активность продукта уменьшается во время длительного хранения, что может повлиять на его клиническую эффективность и срок годности. Однако в вышеупомянутых патентных документах никаких защитных мер не предпринимали и не проводили никаких исследований, касающихся стабильности включенных биоактивных материалов, и эффективность вирусной инактивации также не была подтверждена.
Сущность изобретения
С целью решить вышеизложенные технические проблемы в настоящем изобретении предложена композиционная коллагеновая губка и способ ее изготовления. В частности, настоящее изобретение включает следующие аспекты.
1. В настоящем изобретении предложена композиционная коллагеновая губка, содержащая коллаген и факторы роста клеток и имеющая водопоглощающую способность более чем 52 раза.
2. Композиционная коллагеновая губка по п. 1, имеющая модуль упругости более чем 70,0 Н/см.
3. Композиционная коллагеновая губка по п.2, дополнительно содержащая защитный агент в количестве 10%-50% по массе относительно массы композиционной коллагеновой губки, где указанный защитный агент содержит аминокислоты, сахариды и альбумин в массовом отношении от 1 до 11 : от 1,25 до 17,5 : от 1 до 7,5, где аминокислоты представляют собой по меньшей мере одну аминокислоту, выбранную из лейцина, изолейцина, глицина, аланина и серина; и сахариды представляют собой по меньшей мере один сахарид, выбранный из глюкозы, лактозы, сахарозы, трегалозы и маннита.
4. Композиционная коллагеновая губка по п. 3, где защитный агент добавлен таким образом, что конечная концентрация аминокислот, добавленных в раствор коллагена, составляет 2,0-22 мг/мл, предпочтительно 2,5-15 мг/мл; конечная концентрация сахаридов, добавленных в раствор коллагена, составляет 2,5-35 мг/мл, предпочтительно 3,0-15 мг/мл; и конечная концентрация сывороточного альбумина человека, добавленного в раствор коллагена, составляет 2-15 мг/мл.
5. Композиционная коллагеновая губка по п. 4, где защитный агент дополнительно содержит глицерин, который добавлен в раствор коллагена до конечной концентрации 1,0-15 мг/мл. Таким образом, когда композиционная коллагеновая губка содержит глицерин, массовое отношение глицерина к сахариду в защитном агенте составляет от 0,5 до 7,5 : от 1,25 до 17,5.
6. Композиционная коллагеновая губка, содержащая коллаген, факторы роста клеток и защитный агент, как он определен в любом из пп. 3-5.
7. В настоящем изобретении дополнительно предложен способ изготовления композиционной коллагеновой губки по любому из пп. 1-6, где этап очистки коллагена включает процесс очистки с использованием ионообменной хроматографии, которая представляет собой препаративную хроматографию на катионообменной смоле СМ52, и элюенты представляют собой растворы с рН 4,5, содержащие хлорид натрия в концентрациях от 0,2 моль/л до 0,8 моль/л и ацетат натрия в концентрации 0,1 моль/л.
8. Способ изготовления композиционной коллагеновой губки по п. 7, где этап вирусной инактивации включает двухстадийную процедуру вирусной инактивации:
первая стадия вирусной инактивации представляет собой вирусную инактивацию органическим растворителем/детергентом;
вторая стадия вирусной инактивации представляет собой 30-120-минутную обработку композиционной коллагеновой губки на водяной бане при 90-100°С.
9. Способ изготовления композиционной коллагеновой губки по п. 8, где органический растворитель/детергент представляет собой смесь полисорбата 80 и трибутил фосфата, и полисорбат 80 и трибутилфосфат добавляют в раствор коллагена в таких количествах, что конечная концентрация полисорбата 80 составляет 1% и конечная концентрация трибутилфосфата составляет 0,3%; предпочтительно в условиях, при которых концентрацию коллагена поддерживают при 30-70 мг/мл и рН поддерживают при 6,0-8,0, смешанный стерильный водный раствор, содержащий полисорбат 80 и трибутилфосфат, медленно добавляют в раствор коллагена до тех пор, пока конечная концентрация полисорбата 80 не составит 1% и конечная концентрация трибутилфосфата не составит 0,3%, и вирусную инактивацию проводят при 24-26°С в течение 6-8 часов.
10. Способ изготовления композиционной коллагеновой губки по любому из пп. 6-9, где вторую стадию вирусной инактивации проводят в присутствии защитного агента, который добавляют в раствор коллагена в таком количестве, что конечная концентрация аминокислот, составляющих защитный агент, составляет 2,0-22 мг/мл, конечная концентрация сахаридов составляет 2,5-35 мг/мл и конечная концентрация раствора альбумина составляет 2-15 мг/мл; предпочтительно защитный агент дополнительно содержит глицерин, так что конечная концентрация глицерина, добавленного к раствору коллагена, составляет 1,0-15 мг/мл.
Композиционная коллагеновая губка по настоящему изобретению может стимулировать регенерацию капилляров, местно улучшать кровообращение, ускорять заживление раневых поверхностей и является полезной для ожоговых раневых поверхностей (включая поверхностные второй степени, глубокие второй степени и грануляционные раневые поверхности), хронических раневых поверхностей (включая хроническую язву поверхности тела и т.д.) и свежих раневых поверхностей (включая травму, раневые поверхности на донорских участках кожи при трансплантации, операционную рану и т.д.). Продукт по настоящему изобретению, композиционная коллагеновая губка, может поддерживать стабильность биоактивных материалов в течение длительного хранения, имеет высокую водопоглощающую способность, большой модуль упругости и отличную гибкость и может обладать превосходными эффектами при клиническом применении.
Краткое описание графических материалов
На Фиг. 1 представлена фотография результатов электрофореза коллагена по настоящему изобретению. На Фиг. 1, а обозначает стандартный маркер относительных молекулярных масс; 6 обозначает стандартный образец коллагена; и в обозначает образец коллагена по настоящему изобретению.
На Фиг. 2 показано сравнение водопоглощающей способности образца по настоящему изобретению и таковой контрольного образца.
На Фиг. 3 показано сравнение модулей упругости образца по настоящему изобретению и контрольного образца.
Исходным материалом для коллагена по настоящему изобретению может быть свежая соединительная ткань млекопитающих или кожа свиней. В конкретном воплощении настоящего изобретения коллаген представляет собой коллаген I типа, выделенный из кожи свиней, и во время экстракции которого очистку проводят высаливанием в комбинации с хроматографией для получения высокоочищенного неиммуногенного коллагена, имеющего значительно улучшенные водопоглощающую способность и модуль упругости; коллаген, полученный в результате экстракции, подвергают двухстадийной вирусной инактивации для снижения риска контаминации получающейся в результате коллагеновой губки патогенными микроорганизмами и для уменьшения влияния на биоактивные материалы. Более того, при добавлении эффективного защитного агента полученный продукт, композиционная коллагеновая губка, будет очень стабильным.
В композиционной коллагеновой губке, предложенной по настоящему изобретению, коллаген применяется как матрикс, в котором равномерно распределены факторы роста, например основной фактор роста фибробластов (FGF), и содержание FGF на квадратный сантиметр композиционной коллагеновой губки может составлять от 200 ед. до 1500 ед.
Композиционная коллагеновая губка, изготовленная в соответствии с настоящим изобретением, может быть изготовлена в виде продукта, имеющего длину 2,5-10 см, ширину 2,5-5,0 см и толщину 0,3-2,0 см.
Композиционная коллагеновая губка, предложенная в настоящем изобретении, также характеризуется чистотой коллагена более чем 99,0%, водопоглощающей способностью более чем 52 раза и содержанием золы менее чем 1,0%.
Композиционная коллагеновая губка, предложенная в настоящем изобретении, имеет модуль упругости более чем 70,0 Н/см и поры, сформированные в ней, обычно имеют диаметр от 50 до 100 мкм. Губка может непрерывно высвобождать FGF на протяжении периода от 0 до 100 ч, с тем чтобы улучшить терапевтический эффект на раны.
С целью снижения риска наличия вирусов в продукте коллагеновой губки и для обеспечения безопасности продукта в способе изготовления коллагеновой губки по настоящему изобретению применяют следующую двухстадийную процедуру вирусной инактивации в дополнение к процедурам для более строгой проверки и контроля исходного материала.
Первая стадия S/D процедуры вирусной инактивации: вирусный инактиватор (например, растворитель/детергент (S/D)) добавляют в раствор коллагена, полученный после экстракции, для того чтобы инактивировать вирусы, покрытые липидной оболочкой. Конкретнее, в условиях непрерывного перемешивания при 50-200 об/мин водный раствор, содержащий полисорбат 80 и трибутилфосфат, медленно добавляют в раствор коллагена и гомогенизируют перемешиванием до тех пор, пока конечная концентрация полисорбата 80 не составит 1% и конечная концентрация трибутилфосфата не составит 0,3%, и затем вирусную инактивацию проводят при 24°С-26°С в течение 6-8 часов.
В отношении эпидемических вируса энцефалита В и вируса ложного бешенства, взятых в качестве индикаторных вирусов, вышеописанная процедура привела к инактивации этих индикаторных вирусов более чем на 4 логарифма, что соответствует требованиям безопасности.
В вышеописанной процедуре вирусной инактивации чрезмерно высокие концентрации коллагена будут влиять на результат вирусной инактивации, и, следовательно, концентрацию коллагена обычно поддерживают от 30 до 70 мг/мл, вышеописанную S/D процедуру вирусной инактивации проводят при рН 6,0-8,0.
Вторая стадия вирусной инактивации: продукт инактивируют при 90°С-100°С в течение 30-120 минут. Например, продукт упаковывают в материал из алюмопластика, помещают в камеру для инактивации на водяной бане и подвергают обработке на водяной бане при 90°С-100°С в течение 30-120 минут. Обработки вирусной инактивации, в которых применяют такой процесс инактивации на водяной бане вместо облучения, могут приводить к эффективной инактивации ДНК- и РНК-вирусов, не покрытых липидной оболочкой.
Во время второй стадии вирусной инактивации условия инактивации, 90°С-100°С и 30-120 минут, могут влиять на биоактивности коллагена и факторов роста. Чтобы решить эту проблему, на второй стадии вирусной инактивации по настоящему изобретению в раствор коллагена добавляют защитный агент, содержащий аминокислоты, сахариды и альбумин. Для того чтобы сделать получающуюся в результате композиционную коллагеновую губку мягче и эластичнее, в состав защитного агента может быть включено подходящее количество глицерина.
Аминокислоты или их соли, применяемые в защитном агенте, представляют собой одну или две аминокислоты или их соли, выбранные из лейцина, изолейцина, глицина, аланина и серина. Конечная концентрация аминокислот или их солей, добавленных в раствор коллагена, обычно составляет 2,0-22 мг/мл, предпочтительно 2,5-15 мг/мл.
Сахариды, применяемые в защитном агенте, представляют собой по меньшей мере один сахарид, выбранный из глюкозы, лактозы, сахарозы, трегалозы и маннита. Конечная концентрация сахаридов, добавленных в раствор коллагена, обычно составляет 2,5-35 мг/мл, предпочтительно 3,0-15 мг/мл.
Если защитный агент содержит глицерин, конечная концентрация глицерина, добавленного в раствор коллагена, обычно составляет 1,0-15 мг/мл.
Когда продукт применяют в клинической практике, альбумин, применяемый в защитном агенте, предпочтительно представляет собой сывороточный альбумин человека. Конечная концентрация сывороточного альбумина человека, добавленного в раствор коллагена, обычно составляет 2 мг/мл или более, но не более чем 15 мг/мл.
Коллаген по настоящему изобретению выделяют из кожи животных. Когда продукт применяют в клинической практике, предпочтительно применяют коллаген I типа, выделенный из кожи свиней. В приготовленном растворе композиционной коллагеновой губки содержание коллагена обычно составляет 30 мг/мл или более, и концентрация факторов роста фибробластов обычно составляет 400-3000 ед./мл.
S/D-способ вирусной инактивации обычно является подходящим для препаратов крови. Добавление органических растворителей/детергентов в препараты крови для инактивации вирусов, покрытых липидной оболочкой, является общепринятым способом, и применяемые органические растворители/детергенты представляют собой полисорбат 80 и трибутилфосфат. Однако полисорбат 80 и трибутилфосфат обладают определенными неблагоприятными эффектами, и поэтому необходимо контролировать их остаточные количества во время последующей очистки коллагена, так чтобы остаточная концентрация полисорбата 80 была меньше чем 100 мкг/мл, и остаточная концентрация трибутилфосфата была меньше чем 10 мкг/мл.
В настоящем изобретении полисорбат 80 и трибутилфосфат могут быть эффективно удалены путем проведения двухкратного высаливания и проведения хроматографической очистки, так чтобы остаточная концентрация полисорбата 80 была меньше чем 10 мкг/мл и остаточная концентрация трибутилфосфата была меньше чем 2 мкг/мл.
Антигенность коллагена, главным образом, характеризуется неспиральными областями на концах молекулы коллагена, то есть С-концевым пептидом и N-концевым пептидом. В настоящем изобретении неспиральные области на концах молекулы отщепляют пепсином и эти концевые пептиды удаляют экстракцией и очисткой для получения высокоочищенного коллагена для применения в изготовлении коллагеновых губок. Во время очистки высаливанием применяют водный раствор NaCl с концентрацей 2,0-3,5 моль/л, предпочтительно 2,0-2,5 моль/л, и поддерживают температуру от 0°C до 4°C в течение 4-12 ч. Во время очистки СМ52-катионообменной хроматографией водный раствор NaCl с концентрацией от 0,2 до 0,8 моль/л и рН 3,5-4,5 применяют для градиентной элюции; и предпочтительно водные растворы с рН 4,5, каждый из которых содержит 0,1 моль/л ацетата натрия и 0,2 моль/л, 0,4 моль/л или 0,6 моль/л NaCl применяют для градиентной элюции. При исследовании электрофорезом в полиакриламидном геле в присутствии додецилсульфата натрия (SDS-PAGE) обнаружили, что коллаген по настоящему изобретению имеет полную трехспиральную структуру и полностью сохраняет биоактивность, а чистота коллагена достигает 96% (масс/масс.) или более, даже 99,0% или более, как проверено и рассчитано, что предупреждает иммунногенные реакции, вызываемые коллагенами низкой чистоты, выделенными традиционными способами очистки.
Для лиофилизации продукта, продукт, во-первых, подвергают замораживанию при температуре от -40 до -45°C в течение 3-5 ч и затем вакуумной сушке при степени вакуума, поддерживаемой на уровне не выше чем 20 Па; температуру продукта поднимают до 20°C за 10-15 ч при контролируемой скорости подъема температуры и продукт оставляют при 20-25°C на 2-5 ч; и поддерживают содержание воды в лиофилизированном продукте 5% или меньше для обеспечения активности биологических факторов.
Конкретнее, этапы получения композиционной коллагеновой губки по настоящему изобретению представляют собой следующие.
Этап 1. Выбор исходного материала и обезжиривающая обработка
Свежую соединительную ткань млекопитающих или кожу свиней, прошедших карантин и обследование, брали в качестве исходных материалов и обрабатывали в ходе следующего процесса: щетину и внутренний жир кожи свиньи удаляли при помощи лезвия; обработанную кожу свиньи взвешивали и помещали в контейнер из нержавеющей стали, в который добавляли водный раствор карбоната натрия в массовом отношении исходного материала кожи свиньи к водному раствору 10%-35% (масс/масс.) (предпочтительно 25%) карбоната натрия 1 : от 1 до 10 (предпочтительно 1:5) для вымачивания кожи свиньи в течение 20-60 мин (предпочтительно 20 мин), в то же время выполняя перемешивания один раз каждые 5 минут; после вымачивания кожу свиньи вынимали из контейнера и промывали 10 раз чистой водой; воду сливали и загрязнения в исходном материале, такие как жир или волосяные фолликулы, соскабливали режущим инструментом из нержавеющей стали.
Этап 2. Процедура измельчения
Кожу свиньи, обработанную на этапе 1, взвешивали, нарезали полосами в резальной машине, затем разрезали на куски 0,2-0,5 см2 с помощью криогенной мельницы и помещали в контейнер из нержавеющей стали, в который добавляли раствор 75% этанола для вымачивания кусков в течение 20 минут; и после этого куски вынимали, 10 раз повторно промывали чистой водой, затем 5 раз повторно промывали охлажденной водой для инъекций и высушивали.
Этап 3. Процедура энзимолиза
Воду для инъекций при 0-4°C добавляли к исходному материалу кожи свиньи, обработанной на этапе 2 в массовом отношении 1 : от 5 до 30 (например, отношение кожи свиньи к воде 1 кг : 10 кг) и тщательно перемешивали; смесь накачивали в коллоидную мельницу с помощью перистальтического насоса, в котором предварительно была запущена циркуляционная система охлаждения для поддержания температуры от 0°С до 4°C, и затем гомогенизировали; жидкость-гомогенат переносили в резервуар для энзимолиза, в который медленно по каплям добавляли водный раствор 1,0 М уксусной кислоты для доведения рН до 2,5-3,5, предпочтительно 2,5; добавляли пепсин (5-10 г пепсина на 1 кг исходного материала, полученного на этапе 2); температуру энзимолиза поддерживали между 10°C и 20°C и проводили энзимолиз в течение 20-24 ч; и на этом этапе ферментативный лизат представлял собой вязкую и однородную коллоидную жидкость.
Этап 4. Процедура инактивации пепсина
Водный раствор гидроксида натрия, 20% по массе, медленно добавляли к ферментативному лизату, полученному на этапе 3, для доведения рН до 9,0; лизат выдерживали при 0-4°C в течение 10 ч; затем доводили рН до 6,5 водным раствором 1,0 М уксусной кислоты.
Этап 5. Процедура фильтрования
Воду для инъекций добавляли к ферментативному лизату, полученному на этапе 4, (ферментативный лизат разводили в массовом отношении лизата к воде 1 : от 1 до 10 и тщательно перемешивали, так что концентрация коллагена составляла 30-70 мг/мл, предпочтительно 30 мг/мл; смесь подвергали грубому фильтрованию через фильтрующий элемент с размером пор 40 мкм и затем подвергали тонкому фильтрованию через фильтрующий элемент с размером пор 1,0 мкм в специальный резервуар для вирусной инактивации.
Этап 6. S/D процедура вирусной инактивации
При непрерывном перемешивании при 50-200 об/мин водный раствор, содержащий полисорбат 80 и трибутилфосфат, медленно добавляли к раствору, полученному на этапе 5, смесь перемешивали до однородного состояния, так что конечная концентрация полисорбата 80 составляла 1% (по массе) и конечная концентрация трибутилфосфата составляла 0,3% (по массе), и вирусную инактивацию проводили при 24-26°C в течение 6-8 ч, предпочтительно 6 ч.
Этап 7. Процедура высаливания
NaCl добавляли к раствору, полученному на этапе 6, при перемешивании на мешалке со скоростью вращения 100-500 об/мин, так что конечная концентрация NaCl составляла 2,0-2,5 моль/л, предпочтительно 2,5 моль/л, и смесь выдерживали при 0-4°C в течение 4 ч. Смесь центрифугировали при 0-4°C в центрифуге с постоянным охлаждением при 14000-16000 об/мин в течение 60-30 мин и супернатант отбрасывали; осадок собирали, добавляли к водному раствору 0,3 М уксусной кислоты при массовом отношении осадка к 0,3 М раствору уксусной кислоты 1 : от 10 до 15 и затем перемешивали до полного растворения осадка; добавляли NaCl до конечной концентрации NaCl 2,05-2,5 моль/л, предпочтительно 2,5 моль/л; затем смесь центрифугировали для получения осадка коллагена.
Этап 8. Процедура обессоливания
Охлажденный раствор 95% этанола добавляли к осадку коллагена, полученному на этапе 7, в массовом отношении осадка коллагена к охлажденному 95% этанолу 1 : от 3 до 8, и перемешивали до однородного состояния; смесь центрифугировали при 0-4°C, 8000 об/мин в течение 30 мин, супернатант отбрасывали и осадок собирали; и вышеописанный процесс повторяли один раз. 0,1 моль/л раствор ацетата натрия с рН 4,5 добавляли к осадку коллагена в массовом отношении осадок коллагена : раствор ацетата натрия 1 : от 8 до 20 и перемешивали до однородного состояния; смесь фильтровали через фильтр, имеющий фильтрующий элемент с размером пор 0,45 мкм, и передавали на процедуру очистки СМ-катионообменной хроматографией.
Этап 9: Процедура очистки СМ52-катионообменной хроматографией Препаративную хроматографическую колонку, набитую СМ52-катионообменной смолой (10×100 см), уравновешивали 10 объемами слоя 0,1 моль/л буфера ацетата натрия при рН 4,5, затем вносили образец со скоростью внесения 20,0-30,0 мл/мин, предпочтительно 23,0 мл/мин; колонку элюировали 5 объемами слоя 0,1 моль/л водного раствора ацетата натрия с рН 4,5, содержащего 0,2 моль/л NaCl, затем 0,1 моль/л водного раствора ацетата натрия с рН 4,5, содержащего 0,4 моль/л NaCl, белковый элюат собирали, когда его пик начинал появляться, и затем колонку элюировали 5 объемами слоя 0,1 моль/л водного раствора ацетата натрия с рН 4,5, содержащего 0,6 моль/л NaCl, при этом длина волны детектирования составляла 215 нм.
Этап 10. Процедура ультрафильтрации
Для концентрирования и обессоливания собранный элюат коллагена подвергали ультрафильтрации через ультрафильтр с тангенциальным потоком (Millipore), с порогом отсечения 10 кДа и площадью мембраны 4 м2, в котором элюат сначала концентрировали до 1/3 первоначального объема и дополняли 2/3 водой для инъекций до первоначального объема, затем снова концентрировали до 1/3 первоначального объема и дополняли 2/3 водой для инъекций до первоначального объема, затем концентрировали до 1/3 первоначального объема; во время концентрирования давление на входе ультрафильтра составляло менее чем 0,15 МПа на всем протяжении концентрирования; и уловленный раствор коллагена собирали.
Этап 11. Процедура приготовления
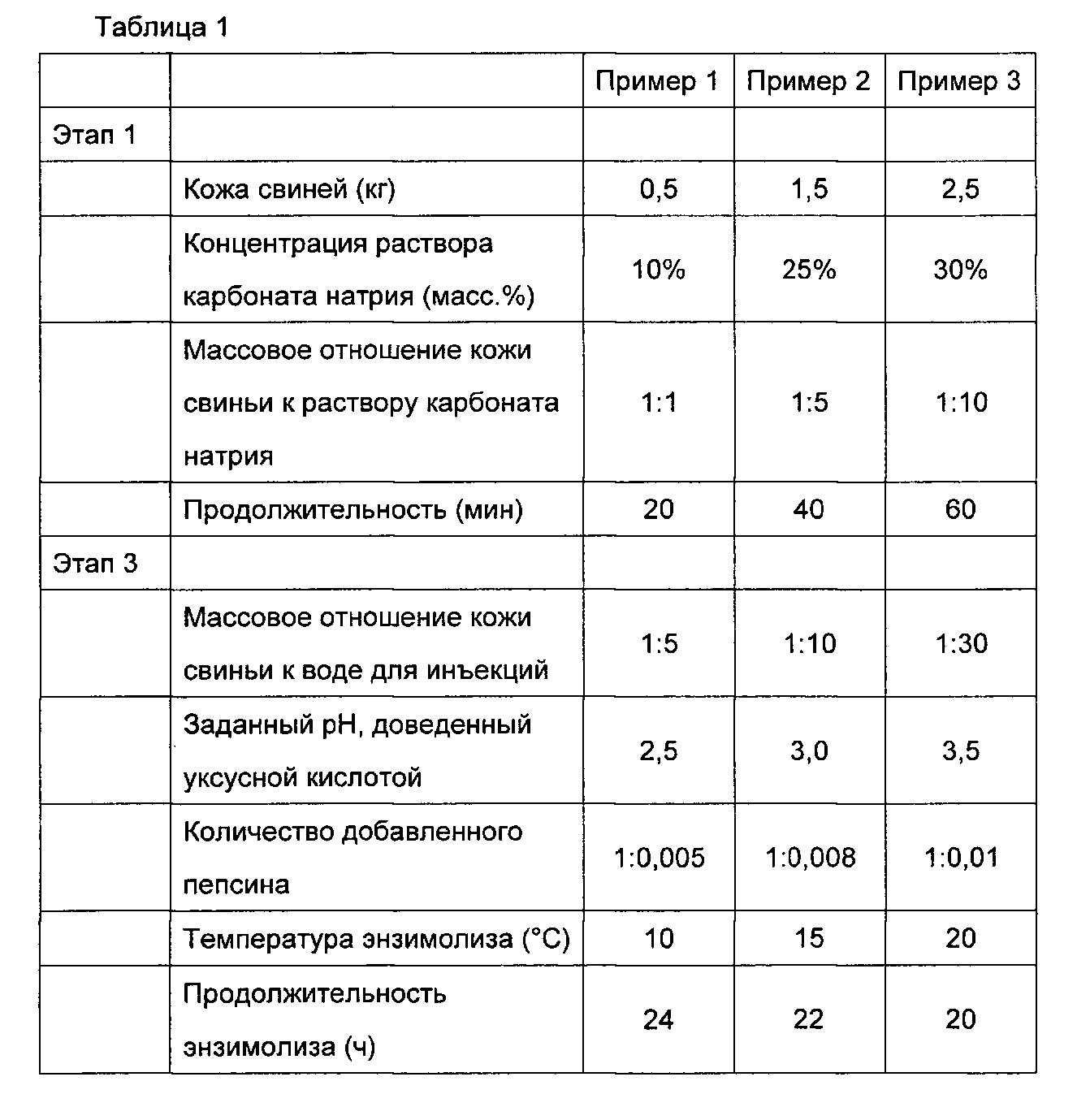
Концентрацию раствора коллагена, полученного на этапе 10, доводили до 40-70 мг/мл и 1000 мл раствора композиционной коллагеновой губки готовили в соответствии с составом, показанным в Таблице 1.
Этап 12. Процедура стерилизации фильтрованием
Приготовленный раствор фильтровали последовательно через фильтры, оснащенные полиэфирсульфоновыми фильтровальными элементами с размером пор 0,45 мкм и размером пор 0,22 мкм (PALL).
Этап 13. Процедура лиофилизации
Раствор, обработанный на этапе 12, добавляли в форму из нержавеющей стали 15 см×5 см; объем налитой жидкости составлял 37 мл; затем форму помещали в лиофилизатор для лиофилизации и воду из раствора удаляли способом криогенной лиофилизации, при котором раствор сначала замораживали при -40°C в течение 4 ч и затем высушивали под вакуумом со степенью вакуума, поддерживаемой на уровне не выше 20 Па, температуру продукта повышали до 20°C за 15 ч при контролируемой скорости повышения температуры и поддерживали при 25°C в течение 4 ч.
Этап 14. Двухстадийная процедура вирусной инактивации
Лиофилизированный продукт упаковывали в материал из алюмопластика в упаковочной машине для материала из алюмопластика и затем помещали в стерильную камеру на водяной бане для проведения вирусной инактивации на водяной бане. После завершения вирусной инактивации продукт хранили при 2-8°C в защищенном от света месте до применения.
Примеры 1-3
Вышеописанные этапы изготовления композиционной коллагеновой губки проводили в условиях, перечисленных ниже в Таблице 1, и были получены образцы 1-3.


В защитном агенте примера 1 в качестве аминокислоты применяли глицин и в качестве сахарида применяли сахарозу; в защитном агенте примера 2 в качестве аминокислот применяли лейцин и изолейцин в массовом отношении 1:1 и в качестве сахаридов применяли глюкозу и трегалозу в массовом отношении 1:2; в защитном агенте примера 3 в качестве аминокислот применяли аланин и серии в массовом отношении 1:1 и в качестве сахаридов применяли лактозу и маннит в массовом отношении 1:2.
5. Результаты исследования
(1) Проверка эффективности S/D вирусной инактивации
Проверяли эффективность S/D вирусной инактивации. Вирус эпидемического энцефалита В и вирус ложного бешенства применяли в качестве индикаторных вирусов; культивируемые клетки представляли собой клетки ВНК21 (фибробласты почек сирийского хомячка); вычисления проводили на 96-луночных микропланшетах с помощью метода цитопатического эффекта и в соответствии с методом Карбера. Результаты показаны в таблицах 2 и 3.

Результаты:
Уменьшение вируса в примере 1 более чем на 5,563 LgTCID50/0,1 мл.
Уменьшение вируса в примере 2 более чем на 5,813 LgTCID50/0,1 мл.
Уменьшение вируса в примере 3 более чем на 5,563 LgTCID50/0,1 мл.

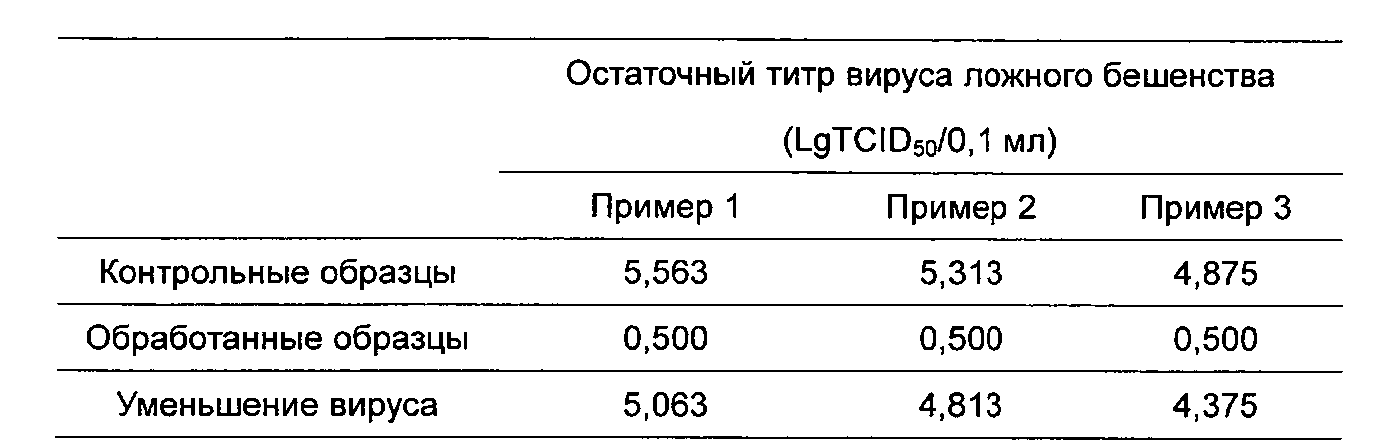
Результаты:
Пример 1 более чем на 5,063 LgTCID50/0,1 мл.
Пример 2 более чем на 4,813 LgTCID50/0,1 мл.
Пример 3 более чем на 4,375 LgTCID50/0,1 мл.
Результаты проверки демонстрируют инактивацию индикаторных вирусов более чем на 4 логарифма после S/D-обработки раствора коллагена, что соответствует требованиям безопасности. То есть она эффективна для выполнения вирусной инактивации при 24-26°C в течение 6-8 ч с полисорбатом 80 в конечной концентрации 1% и трибутилфосфатом в конечной концентрации 0,3%, в условиях, при которых концентрацию коллагена поддерживают при 30-70 мг/мл и рН 6,5-7,5.
(2) После вирусной инактивации на водяной бане образцы брали для проверки эффективности инактивации. Вирус эпидемического энцефалита В, вирус ложного бешенства и свиной парвовирус использовали в качестве индикаторных вирусов; культивируемые клетки представляли собой клетки ВНК21; вычисления проводили на 96-луночных микропланшетах с помощью метода цитопатического эффекта и в соответствии с методом Карбера. Результаты показаны в таблицах 4, 5 и 6.


Результаты:
Пример 1 более чем на 4,938 LgTCID50/0,1 мл.
Пример 2 более чем на 5,188 LgTCID50/0,1 мл.
Пример 3 более чем на 5,063 LgTCID50/0,1 мл.

Результаты:
Пример 1 более чем на 4,563 LgTCID50/0,1 мл.
Пример 2 более чем на 5,063 LgTCID50/0,1 мл.
Пример 3 более чем на 5,188 LgTCID50/0,1 мл.

Результаты:
Пример 1 более чем на 4,813 LgTCID50/0,1 мл.
Пример 2 более чем на 4,750 LgTCID50/0,1 мл.
Пример 3 более чем на 5,125 LgTCID50/0,1 мл.
Результаты проверки демонстрируют инактивацию индикаторных вирусов более чем на 4 логарифма после инактивации образцов на водяной бане, что соответствует требованиям безопасности.
(3) Исследование чистоты коллагена
После хроматографической очистки образцы коллагена брали для исследования чистоты коллагена. Были приготовлены контрольные образцы коллагена с одинаковой массовой концентрацией. Хроматографически очищенные образцы и образцы, не прошедшие хроматографическую очистку, перемешивали с раствором для обработки образцов и нагревали в течение 5 мин на кипящей водяной бане, затем подвергали электрофорезу в геле из 5% концентрирующего геля и 10% разделяющего геля, окрашивали Кумасси Бриллиантовым Голубым R250 и отмывали в 7,5% уксусной кислоте и 5% метаноле. Объем загрузки составлял 10 мкл. Контрольный образец коллагена I типа приобретали у Sigma. Электрофоретический анализ показал, что коллаген, обработанный путем хроматографической очистки, демонстрировал такие же зоны, как и контрольный образец, и представлял собой типичный коллаген I типа; никаких других примесных зон не наблюдали, что указывает на то, что выделенный образец был высокоочищенным. Электрофоретические изображения показаны на Фиг. 1. На Фиг. 1, а обозначает стандартный маркер относительных молекулярных масс; б обозначает стандартный образец коллагена; в обозначает образец коллагена, полученный в примере 2 настоящего изобретения.
(4) Измерение содержания коллагена
Суммарные белки определяли методом Кьельдаля и содержание гидроксильных групп пролина в гидролизате измеряли методом Woessener. Содержание коллагена рассчитывали по формуле M1=M0/14% и затем сравнивали с суммарным содержанием белка для расчета чистоты коллагена.
Содержание коллагена в примере 2 настоящего изобретения составляло не меньше чем таковое в контроле, что предполагает очень высокую чистоту. Результаты показаны в таблице 7.

(5) Остаточные количества полисорбата 80 и трибутилфосфата После хроматографической очистки образцы брали для измерения остаточных количеств полисорбата 80 и трибутилфосфата с целью подтвердить эффективность их удаления.
На основании того факта, что синий комплекс, образованный в результате реакции полиоксиэтилена в полисорбате 80 с кобальто-тиоцианатом аммония, растворим в дихлорметане, полисорбат 80 измеряли колориметрией при 620 нм. Контрольный образец полисорбата 80 имеет регистрационный номер CAS: 9005-65-6 (Стандарт Фармакопеи США (USP)). Остаточное количество трибутилфосфата в образце, который тестируют, измеряли газовой хроматографией. Контрольный образец трибутилфосфата имеет регистрационный номер CAS: 126-73-8 (Стандарт Европейской Фармакопеи (ЕР)). Оборудование для хроматографии: Shimadzu GC-14C с капиллярной колонкой кислотно-модифицированного полиэтиленгликоля и пламенно-ионизационным детектором; объем загрузки: 0,1 мкл. Результаты показали, что количества остаточных полисорбата 80 и трибутилфосфата в продукте после хроматографической очистки были очень низкими, что соответствует требованиям безопасности. Результаты детекции показаны в таблице 8.

(6) Различие между активностями FGF до и после инактивации на водяной бане
Образцы 4, 5 и 6 готовили таким же способом, как в примере 1, за исключением того, что применяли состав композиционной коллагеновой губки, показанный в Таблице 9.
Фактор роста фибробластов (FGF) измеряли на клетках NIH3T3 (клетки фибробластов мыши линии NIH3T3) способом клеточной пролиферации/МТТ колориметрии (МТТ: 3-(4,5-диметил-2-тиазолил)-2,5-дифенил-2Н-бромид тетразолия). FGF является стимулятором роста клеток NIH3T3, и скорость роста клеток NIH3T3 изменяется в зависимости от биоактивности FGF, что применяют для измерения активности FGF. Стандартный образец FGF приобретали в Институте Медицины и Идентификации биологических продуктов Китая (Institute of Medicines and Biological Products Identification of China); и клетки NIH3T3 приобретали в Клеточной Библиотеке Комитета Типичных Культур Академии Наук Китая (Cell Library of Typical Culture Committee of the Chinese Academy of Sciences). Результаты измерений показаны в таблицах 10 и 11.
Результаты измерений показывают, что излучение 10 кг СобО в значительной степени губительно для активности FGF. Когда излучение 10 кг Со60 сравнивают с условиями 100°C/30 мин, данные показывают Р менее 0,01 после обработки программным обеспечением SPSS (статистический пакет для социальных наук, от англ. Statistical package for social sciences), что означает, что их можно сравнивать.
Образцы 7 и 8 были получены посредством изготовления коллагеновых губок тем же способом, как и в примере 1, за исключением того, что количества добавленного FGF отличались, и образцы 7 и 8 подвергали исследованию на долговременную стабильность вместе с образцом 4. Результаты показывают, что добавление аминокислот, альбумина, сахаридов и глицерина к композиции в качестве защитных агентов может эффективно обеспечивать биоактивность продукта на протяжении его срока годности.



(7) Сравнение водопоглощающих способностей
Водопоглощающие способности образцов 1, 2 и 3, полученных в примерах 1, 2 и 3, изучали и сравнивали с таковой контрольного образца. Брали кусок губки и точно взвешивали (с точностью до 0,1 мг), погружали в чистую воду при 20°C и осторожно перемешивали, не вызывая каких-либо разрывов; когда он полностью пропитывался водой, губку доставали из воды путем осторожного захватывания угла маленькими щипцами и подвешивали над водной поверхностью на 2 минуты перед взвешиванием. Массу сравнивали с массой коллагеновой губки. Результаты исследования и сравнения показаны на Фиг. 2.
На Фиг. 2 ось Y обозначает абсорбцию воды (масс/масс); контроль 1 представляет собой стандарт абсорбции воды для абсорбирующей желатиновой губки в «Фармакопее США» (USP32-NF27); контроль 2 представляет собой коллагеновую губку, полученную в соответствии с примером 1 патента Китая CN 101279104; контроль 3 представляет собой коллагеновую губку, полученную в соответствии с примерами патента Китая CN 1915437. Как показано на Фиг.2, все композиционные коллагеновые губки по настоящему изобретению имеют водопоглощающую способность 52 раза или более, в то время как все коллагеновые губки, полученные в соответствии с уровнем техники или существующие коллагеновые губки имеют водопоглощающую способность ниже, чем таковая по настоящему изобретению.
(8) Сравнение модулей упругости
Образец фиксировали за оба конца на зажимах динамометра; прибор начинал разделять и натягивать образец с определенной скоростью; изменение в напряжении образца измеряли до тех пор, пока образец не рвался. Результаты исследования и сравнения показаны на Фиг. 3. На Фиг. 3 ось Y представляет собой модуль упругости (Н/см); контроль 4 представляет собой коллагеновую губку, полученную способами, раскрытыми в CN 1487967А. На Фиг. 3 показано, что образцы по настоящему изобретению имеют модуль упругости больше чем 70,0 Н/см, в то время как модуль упругости коллагеновой губки, полученной в соответствии с уровнем техники, составляет менее чем 50,0 Н/см.
Реферат
Изобретение относится к медицине. Композиционная коллагеновая губка предназначена для остановки кровотечения, а также для стимулирования роста и пролиферации клеток. Губка содержит коллаген, факторы роста клеток и защитный агент в количестве 10%-50% масс., где защитный агент содержит аминокислоты, сахариды и альбумин в массовом отношении 1-11:1,25-17,5:1-7,5. Способ изготовления губки включает этап вирусной инактивации, который включает две стадии: первая стадия представляет собой вирусную инактивацию органическим растворителем/детергентом; вторая стадия представляет собой 30-120-минутную обработку раствора губки на водяной бане при 90-100°C, и ее проводят в присутствии защитного агента. Технический результат заключается в том, что губка имеет водопоглощающую способность более чем 52 раза на основании массы губки и имеет модуль упругости более 70,0 Н/см. Губку можно подвергать вирусной инактивации в течение продолжительного времени при высокой температуре, в то время как биоактивность коллагена и факторов роста поддерживается. 2 н. и 5 з.п. ф-лы, 3 пр., 11 табл., 3 ил.
Формула
где способ изготовления композиционной коллагеновой губки включает этап вирусной инактивации, который включает двухстадийную процедуру вирусной инактивации:
первая стадия вирусной инактивации представляет собой вирусную инактивацию органическим растворителем/детергентом;
вторая стадия вирусной инактивации представляет собой 30-120-минутную обработку раствора композиционной коллагеновой губки на водяной бане при 90-100°C, и ее проводят в присутствии защитного агента.
где этап (9) представляет собой этап очистки коллагена, который включает процесс очистки с использованием ионообменной хроматографии, которая представляет собой препаративную хроматографию на катионообменной смоле СМ52, и элюенты, используемые в ионообменной хроматографии, представляют собой растворы с pH 4,5, содержащие хлорид натрия в концентрациях от 0,2 моль/л до 0,8 моль/л и ацетат натрия в концентрации 0,1 моль/л,
этап (6) представляет собой вирусную инактивацию органическим растворителем/детергентом;
этап (14) представляет собой 30-120-минутную обработку раствора композиционной коллагеновой губки на водяной бане при 90-100°C, и его проводят в присутствии защитного агента.
Документы, цитированные в отчёте о поиске
Гемостатическая губка, основанная на коллагене, способ ее получения, повязка для ран, включающая такую губку, и набор для приготовления повязки для ран

Комментарии