Композиции, способы стимуляции заживлений - RU2115410C1
Код документа: RU2115410C1
Чертежи









Описание
Изобретение является частичным продолжением заявки США на патент N 186031, поданной 25 апреля 1988 г., которая в свою очередь является заявкой в частичное продолжение заявки США N 115923, поданной 28 октября 1987 г.
Изобретение касается в основном использования новых составов 2'-деоксирибонуклеозидов и 2'-деоксирибонуклеотидов, а также использования этих соединений в фармацевтических носителях для стимуляции заживления ран. Более точно, это изобретение относится к новым комбинациям из двух или более соединений 2'-деоксиаденозина, 2'-деоксигуанозина, 2'- деоксицитидина и 2'-деокситимидина и/или соответствующих им нуклеотидов и их использованию локально или местно в смеси с носителями для повышения доставки активных компонентов к тканям животных и таким образом для поддерживания клеточных метаболических функций. Еще более точно это изобретение касается использования смесей этих соединений и ускорения заживления ран, хирургических разрезов, поражений или язв желудочно-кишечного тракта, ожогов, вызванных теплом, ультрафиолетовым облучением или химическими агентами, а также неглубоких ран в тканях, вызванных инфекциями.
Заживление ран или поврежденных тканей зависит в основном от клеточной пролиферации /разрастания/ и образования новых соединений, эндотелиальных и эпителиальных тканей. Агент, который стимулирует или ускоряет клеточные процессы, вовлеченные в заживление раны, имеют большое значение в медицинской практике и могли бы быть использованы для улучшения или ускорения заживления многих типов ран или поражений включая хирургические разрезы, ожоги, тепловые, химические или радиоционные, ссадины, рваные раны, ампутации - ишемические /малокровные/, пролежни, поражения или язвы во рту, желудке или кишечнике, а также участки кожи у донора, и роговичные повреждения. Такие агенты могут быть также важны для улучшения восприятия кожных или роговичных трансплантантов и для обеспечения восстановления поврежденных хрящей или костей.
Агенты, которые ускоряют или улучшают заживление ран, были бы очень важны в физиологических условиях, при которых ухудшается заживление раны, например, у пациентов, страдающих сахарным диабетом, или у людей, подвергающихся раковой химиотерапии /т.е. которым вводят адриамицин или циклофосфамид/, или лечению кортикостероидами, или у пациентов после терапевтического или случайного воздействия ионизационным облучением.
Было раскрыто несколько агентов, которые успешно влияют на клеточные процессы, включенные в заживление раны, например, факторы роста полипептида, аллантоин, витамин A /и производные/, цинк, экзогенный DNA и препараты аллое. Механизм действия этих соединений плохо изучен, они проявляют различную степень эффективности в конкретных случаях.
Деоксирибонуклеиновая кислота /DNA/ использовалась ранее для ускорения рубцевания или заживления. В публикации Думонта "Хирургия" 150 - 709, 1959 г. , указано, что экзогенные DNA, нанесенные на экспериментальные раны ушей кроликов, ускоряли рост гранулированных тканей ран. Смесь DNA и деоксирибонуклеазы /энзим, отвечающий за разрушенные DNA/ была более эффективна для ускорения фиброплазии, чем DNA или деоксирибонуклеаза в отдельности. Общее количество гранулированных тканей, образованных после обработки DNA, было не больше, чем в необработанных контрольных ранах, но наличие и скорость их роста были значительно ускорены. Авторы публикации предлагают, чтобы фрагменты низшего полимера DNA использовались в качестве активных агентов.
В публикации 1966 года указано, что Николау и Баданой лечили экспериментальные раны кожи на спинках крыс ежедневно внутривенной инъекцией 1% раствора DNA в физиологическом растворе. Раны, образованные локальными инъекциями DNA, рубцевались в течение четырех - восьми дней, в то время как пролеченные только физиологическим раствором рубцевались через десять - пятнадцать дней. 2% раствор DNA, вводимый аналогично в раны, вызвал некроз тканей.
В публикации Маршака и Уолкера в журнале Общества Экспериментальной и биологической медицины, с. 58 - 62, 1945 г., описано нанесение DNA на экспериментальные раны на коже крыс. Было обнаружено значительное ускорение роста гранулированных тканей в ране по сравнению с необработанными контрольными ранами. Хотя гранулированные ткани появляются раньше в обработанных ранах, конечное количество гранулированных тканей не больше, чем в необработанных ранах.
В патенте США N 4560678 Рансона раскрыта технология приготовления локального препарата, содержащего DNA и алантоин, который использовался для лечения язвы ноги венозного происхождения. В патенте США N 2556727 Флекси раскрыта композиция, содержащая DNA и бактерицидные четвертичные количества соединений для лечения ран. В патенте США N 4657896 раскрыто использование DNA для лечения симптомов язв пищеварительной системы, в частности, при приеме парентерально. При локальном введении DNA может быть эффективна для стимуляции заживления раны, но имеется несколько существенных недостатков для использования DNA как таковой в фармацевтических препаратах, которые могут ограничивать его клиническую полезность или приемлемость. DNA будучи экстрагирована из тканей животных, содержит другие биологические материалы, например, гистоны или другие белки, которые могут оказаться антигенами. Удалить эти биологические материалы очень трудно, и, соответственно, чистота DNA, полученной промышленным способом, составляет обычно около 0,5% белка. Кроме того, DNA из натуральных источников сырья не может быть однородной от партии к партии. DNA может также иметь нежелательную биологическую активность, выходящую за пределы агента по заживлению раны. Например, двойные нуклеиновые кислоты вызывают образование интерферона, возможно из-за взаимодействия с неопределенными областями на поверхности фибропластов или лимфоцитов. Такой эффект не может быть положительным и даже может быть пагубным при заживлении ран и в других биологических процессах.
DNA содержит также фосфат /эквимолярно к содержанию нуклеозидов/, и местное наложение на раны может привести к высокой локальной концентрации фосфата, поскольку DNA метаболизирована. Это может оказать разрушающее действие на процесс заживления раны и может привести к некрозу, что наблюдалось после введения 2% DNA в исследованиях Николау и др. И последнее, экзогенный DNA может внедриться в клеточную DNA и таким образом ввести экзогенные функциональные гены в клетки. Это совершенно понятно, если, например, введенная DNA является вирусом или онкогеном.
В патентной заявке Великобритании N 2152814 A Огощи раскрыты композиции для питательного пополнения, которые содержат, по меньшей мере два
соединения нуклеиновых кислот, выбранных из:
а/ исходных нуклеиновых кислот,
b/ нуклеозидов, и
с/ нуклеотидов или их солей.
В патенте указано, что композиции могут вводиться перентерально или энтерально, способны усиливать эффективность использования аминокислот в теле человека и удовлетворительного надежного контроля питания и поддержания азотного балланса.
В патенте Японии N 600228929 раскрыто использование орального введения деоксигуанозина для предотвращения образования стрессовых язв у крыс. Но в нем не представлено данных, касающихся эффекта /если таковой существует/ деоксигуанозина на заживление язвы желудка.
В патенте США N 4208406 Лапинета раскрыто использование циклического 3', 5'-аденозин монофосфата /циклический АМР/ в качестве местного противовоспалительного и заживляющего агента.
В настоящее время признано, что заживляющие агенты, которые включают в себя DNA, попадая в рану, ускоряют заживление раны, но, по - прежнему, остается необходимость в поиске более эффективных композиций для заживления ран, ожогов и других поражений, которые не вызывают нежелательных побочных эффектов.
Первой целью изобретения является создание новых соединений и фармацевтических композиций, которые способствуют эффективному и ускоренному заживлению ран, язв, ожогов и других типов поражений.
Другой целью настоящего изобретения является создание группы эффективных заживляющих агентов, которые не являются антигенами и не несут генетической информации.
Еще одной целью настоящего изобретения является создание группы эффективных заживляющих агентов, которые были бы недорогими, однородными и стойкими.
Еще одной целью изобретения является создание заживляющих агентов, которые могут эффективно вводится локально, которые не имеют нежелательного токсичного эффекта и которые могут вводится животным и человеку для эффективного заживления ран, язв, ожогов и других типов поражений.
И еще одной целью изобретения является создание эффективных заживляющих агентов, которые могут наносится локально или местно в различных наполнителях.
Эти и другие изобретения достигаются путем введения новых смесей 2'-деоксирибонуклеозидов, предпочтительно включенных в композиции носителя, для улучшения заживления ран или восстановления поврежденных тканей и при лечении других физиологических и патологических состояний, которые могут быть соответственно использованы для лечения путем нанесения или введения местных или локальных препаратов для ускорения заживления.
В общем случае, изобретение заключается в создании смесей 2'-деоксирибонуклеозидов в определенных соотношениях, растворенных или суспендированных в подходящих фармацевтических носителях. Было обнаружено, что нанесение 2'-деоксирибонуклеозидов на экспериментальные раны либо слабо ускоряет, либо не ускоряет заживление раны. Но специальные смеси из двух или более различных 2'-деоксирибонуклеозидов ускоряют заживление экспериментальных ран. Каждая специфическая смесь демонстрирует характерное заживление.
Более конкретно, было обнаружено, что комбинация из двух 2'-деоксирибонуклеозидов; 2'-деоксицитидина и 2'-деоксигуанозина, дает существенное повышение скорости заживления ран по сравнению с контрольными и другими способами. Композиции могут содержать: а/ основное количество 2'-деоксицитидина и эффективное количество 2'-деоксигуанозина или b/ основное количество 2'-деоксигуанозина и эффективное количество 2'-деоксицитидина. Желательно, чтобы бинарная композиция содержала от 10 до 90 мол.% 2'-деоксицитидина и 90 - 10 мол. % 2'-деоксигуанозина. Предпочтительные композиции содержат от 25 до 75% двух компонентов.
Трехкомпонентная комбинация 2'-деоксицитидина, 2'-деоксигуанозина и 2'-деоксиаденозина, также как и трехкомпонентная комбинация 2'-деоксицитидина, 2'-деоксигуаонзина и 2'-деокситимидина также показывает существенное повышение скорости заживления экспериментальных ран по сравнению с контрольными, такой же эффект дают и другие трехкомпонентные комбинации. Четырехкомпонентные комбинации из 2'-деоксицитидина, 2'-деоксигуанозина, 2'-деоксиаденозина и 2'-деокситимидина являются наиболее эффективными для повышения скорости заживления экспериментальных ран.
Трех и четырехкомпонентные композиции содержат эффективные количества 2'-деоксицитидина и 2'-деоксигуанозина, обычно 50% или более бинарных смесей, описанных выше.
Композиции для заживления ран содержит 2'-деоксирибонуклеозиды и/или их производные 3'- и/или 5'-фосфата эфира. Эти соединения могут быть замещенными и могут быть в свободной форме или в виде их фармацевтически приемлемых солей.
Смеси 2'-деоксирибонуклеозидов, предпочтительно в фармацевтических носителях, ускоряют скорость заживления ран путем поставки 2'-деоксирибонуклеозидов в области поврежденных тканей. Препараты настоящего изобретения могут вводиться в комбинации с множеством традиционных фармацевтических носителей, мазей, гелей, паст, суппозиторий, спреев, или промывающих растворов, или могут быть объединены с носителями, включающими липосомы, полимеры или биоразлагающиеся полимеры, для постепенного освобождения, или освобождения из пропитанных ими повязок, хирургических швов и аналогичных материалов.
Композиции, согласно изобретению, могут быть использованы для стимуляции заживления любого типа ран, включая порезы, разрезы, ссадины, ожоги и т.п., которые могут быть обработаны путем локального, преимущественно, местного введения препарата, или путем наложения любого другого материала, который может удерживать и постепенно освобождать и поставлять соответствующую смесь 2'-деоксирибонуклеозидов.
Изобретение, его цели и преимущества будут более понятны из дальнейшего подробного описания со ссылкой на сопровождающие чертежи.
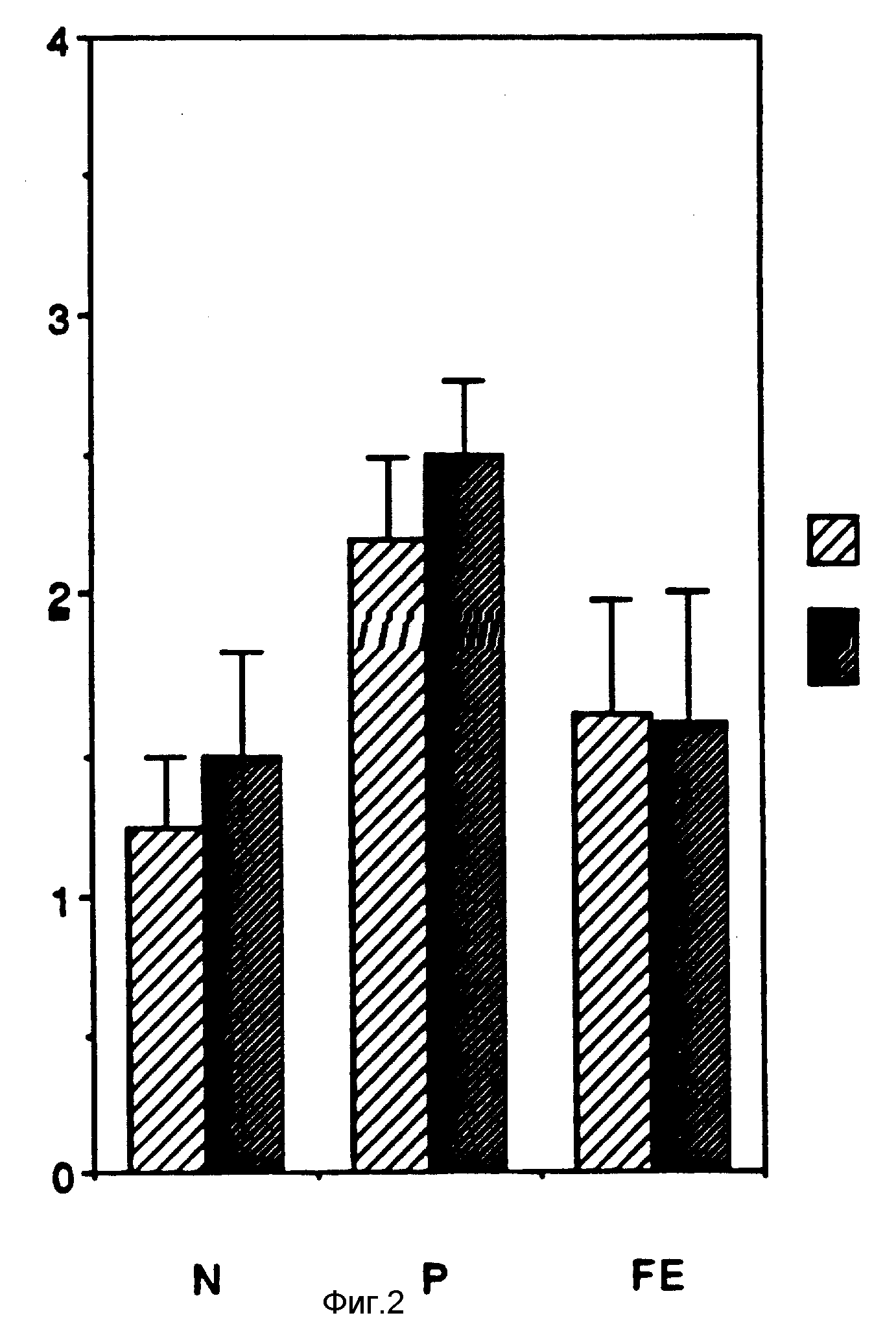
На фиг. 1 изображена шкала значений для четырех параметров, характеризующих заживление раны; степень развития кровеносных сосудов /A/, плотность микрофагов /M/, плотность фибропласта /волокнистой соединительной ткани/ /F/, эпителиальную зону действия /B/ для контрольных крыс и крыс, которых лечили комбинацией деоксиаденозина, деоксицитидина, деоксигуанозина и деокситимидина в течение одной недели. Все крысы перед этим были пролечены дексаметазоном для замедления заживления раны. Значения шкалы: 0 - отсутствие эффекта, 1 - минимальный, 2 - слабый, 3 - умеренный и 4 - зарубцевание. Знак * на первой и всех последующих фигурах означает статистически существенные отличия по сравнению с контрольными значениями; на фиг. 2 - шкала значений для трех индексов воспаления некроза /N/, полиморфонуклеолейкоцитной плотности /P/ и фибринозного экструдата /F E/ для контрольных крыс и крыс, которых лечили комбинацией деоксиаденозина, деоксицитидина, деоксигуанозина и деокситимидина в течение одной недели. Все крысы перед этим были пролечены дексаметазоном для замедления заживления раны. Значения на шкале: 0 - отсутствие эффекта, 1 - минимальный, 2 - слабый, 3 - умеренный, 4 - зарубцевание; на фиг. 3 - процентное соотношение начального участка, покрытого новым эпителием у крыс через 5 и 7 дней после начала лечения только одним наполнителем /контроль/ и с комбинацией деоксиаденозина, деоксицитидина, деоксигуанозина и деокситимидина; на фиг. 4 - длина отросшего нового эпителия по краю раны /в гистологическом сечении/ у крыс через 5 и 7 дней после начала лечения только с одним наполнителем /контроль/ и с комбинацией деоксиаденозина, деоксицитидина, деоксигуанозина и деокситимидина; на фиг. 5 - глубина гранулированной ткани /в гистологическом сечении/ в ранах крыс через 5 и 7 дней после начала лечения только одним наполнителем /контроль - и комбинацией деоксиаденозина, деоксицитидина, деоксигуанозина и деокситимидина; на фиг. 6 - область язвы желудка /область язвы, оставшуюся не эпителизованной/ у контрольных крыс и у крыс, обработанных комбинацией деоксиаденозина, деоксицитидина, деоксигуанозина и деокситимидина через 10, 20, 30 дней после начала лечения; на фиг. 7 - область язвы желудка у контрольных крыс и крыс, обработанных комбинацией деоксиаденозина, деоксицитидина, деоксигуанозина и деокситимидина через 10 и 16 дней после обработки; на фиг. 8 - область язвы желудка у контрольных крыс, крыс, обработанных цимитидином /Cim/, у крыс, обработанных комбинацией деоксиаденозина, деоксицитидина, деоксигуанозина и деокситимидина на /N/, и крыс, обработанных одновременно цимитидином и деоксирибонуклеозидами /N - Cim/ через 14 дней после начала обработки. Знак показывает статистически значительные отличия по сравнению с контрольными значениями. Знак ** показывает статистически значительные отличия по сравнению со значениями Cim - и N - обработкой; на фиг. 9 - область язвы желудка у контрольных крыс, крыс, обработанных комбинацией деоксиаденозина, декосицитидина, деоксигуанозина и деокситимидина /N/, и крыс обработанных только деоксигуанозином /dG/.
В самом широком аспекте обнаружено, что существом изобретения является композиция, содержащая от 10 до 90 мол.% 2'-деоксицитидина и от 90 до 10 мол. % 2'-деоксигуанозина, или их фармацевтически приемлемые соли, которая имеет очень высокую активность для заживления ран. Было обнаружено, что бинарные смеси 2'-деоксицитидина и 2'-деоксигуанозина, предпочтительно те смеси, в которых каждый из двух компонентов находится в количестве от 25 до 75% от массы композиции, при наложении локально или местно на раны, включая порезы, поражения, ссадины, ожоги и т.п., существенно увеличивают скорость заживления. Другие заживляющие рану материалы могут быть включены в композиции настоящего изобретения, при этом активные заживляющие рану агенты состоят в основном из бинарных смесей 2'-деоксицитидина и 2'-деоксигуанозина.
2'-деоксирибонуклеозиды могут находится в свободном виде или в виде соответствующих нуклеотидов, т.е. 3' или 5' или 3', 5' производных эфира фосфорной кислоты. Альтернативно деоксирибонуклеозиды могут присутствовать в виде замещенных производных эфира в свободном виде и в виде нуклеотидов. Замещенные производные 2'-деоксицитидина и 2'-деоксигуанозинов включают соединения, замещенные на одном или обеих концах гидроксильных групп деоксирибозы и/или замещенные в экзоциклическом амине пуринового кольца 2'-деоксигуанозина, или в экзоциклическом амине пиримидинового кольца 2'-деоксицитидина радикалом, выбранным из группы, состоящей из биосовместимых ацильных радикалов, содержащих от 2 до 20 атомов углерода. Когда имеется более, чем один заместитель, заместители могут быть одинаковыми или различными. Активные компоненты могут присутствовать в виде фармацевтически приемлемых солей 2'-деоксирибонуклеозидов или их производных. В этом контексте, замещенные производные предпочтительно после наложения на ткани преобразуются энзиматически в нуклеозиды. Таким образом, производные могут служить также и наполнителем для доставки нуклеозидов к тканям или могут иметь другие преимущества в фармацевтических препаратах.
Эффективные бинарные смеси, описанные выше, могут быть включены в композиции, предназначенные для заживления ран, которые содержат фармацевтически приемлемые носители, и, если потребуется, другие заживляющие рану агенты. Обычно носитель адаптирован для локального или местного введения.
Описанные бинарные смеси могут быть объединены с 2'-деоксиаденозином, 2'-деокситимидином или со смесями 2'-деоксиаденозина и 2'-деокситимидина. Хорошие результаты были получены для трех заживляющих композиций, которые содержат эффективное количество бинарной смеси из 2 -деоксицитидина и 2'-деоксигуанозина, как описано выше, и, дополнительно, либо (или оба вместе) 2'-деоксиаденозина или 2'-деокситимидина. Желательно, чтобы указанная бинарная смесь 2'-деоксицитидина. и 2'-деоксианозина находилась в количестве, по меньшей мере, 50 мол. % от общей композиции, и смесь 2'-деоксицитидина и 2'-деоксигуанозина находилась в этой бинарной смеси в количестве от 25 до 75% от ее количества. Указанные 2'-деоксицитидин, 2'-деоксигуанозин, 2'-деоксиаденозин и 2'-деокситимидин могут находится в свободной форме в виде нуклеотидов, или в виде замещенных производных от свободных форм, или в виде нуклеотидных форм.
Замещенные производные 2'-деоксицитидина и 2'-деоксигуанозина включают соединения, замещенные у одной или обеих гидроксильных групп деоксирибозы и/или замещенные в экзоциклическом амине пуринового кольца 2'-деоксигуанозина или в экзоциклическом амине пиримидинового кольца 2'-деоксицитидина, радикалом, выбранным из группы, состоящей из биосовместимых ацильных радикалов, содержащих от 2 до 20 атомов углерода. Там, где заместителей более одного, они могут быть одинаковыми или различными.
Замещенные производные 2'-деоксиаденозина включают соединения, замещенные в одной или обеих гидроксильных группах деоксирибозы и/или замещенные в экзоциклическом амине пуринового кольца радикалом, выбранным из группы, состоящей из биосовместимых апильных радикалов, содержащих от 2 до 20 атомов углерода. Так, где заместителей более одного, они могут быть одинаковыми или различными.
Замещенные производные 2'-деокситимидина включают соединения, замещенные в одной или обеих гидроксильных группах деоксирибозы одним или более биосовместимым ацильным радикалом, содержащим от 2 до 20 атомов углерода, которые могут быть одинаковыми или различными.
Активные компоненты могут также находится в виде фармацевтически приемлемых солей.
Композиция для заживления ран, содержащие бинарные смеси и 2'-деоксиаденозин или соответственно 2'-деокситимидин, могут быть приготовлены с использованием фармацевтически приемлемых носителей, адаптированных для локального или местного введения.
Наилучшие результаты были получены при применении четырехкомпонентных смесей, содержащих эффективное количество, предпочтительно, по меньшей мере, 50 мол.% от всей компании, смеси, состоящей из от 10 до 90 мол.% 2'-деоксицитидина и от 90 до 10 мол.% 2'-деоксигуанозина и 2'-деоксиаденозина и 2'-деокситимидина. Указанные 2'-деоксирибонуклеозиды, как бинарные смеси, так и трехкомпонентные смеси, описанные выше, могут присутствовать в виде их фармацевтически приемлемых солей. Желательно, чтобы бинарная смесь 2'-деоксицитидина и 2'-деоксигуанозина содержала, по меньшей мере, 25 мол.% каждого из 1 этих двух компонентов. Четыре 2'-деоксирибонуклеозида могут 1 находится в свободной форме, например, производных либо 3', либо 5', либо 3', 5' сложного эфира фосфорной кислоты, или в виде замещенных производных, описанных выше, либо в свободной форме, либо в форме нуклеотида. Композиции могут быть получены с использованием носителей, адаптированных для локального или местного введения.
Смеси активных компонентов могут быть получены путем смешения их свободных форм, нуклеотидов или производных компонентов, или они могут быть получены гидролизом DNА без сепарации нуклеозидов или нуклеотидов.
Было обнаружено, что деоксирибонуклеозиды эффективны для стимуляции заживления ран, и это открывает ряд важных возможностей для введения этих агентов. Для облегчения описания и дальнейшего обсуждения предполагается принять, что деоксирибонуклеозиды включают: свободные формы, нуклеотидные формы, замещенные производные и их смеси.
Наиболее предпочтительно вводить эти соединения локально или местно в гелях, мазях, растворах, пропитанных повязках, липосомах, биоразлагающихся микрокапсулах или искусственных оболочках, содержащих натуральные нуклеозиды. В отличие от DNA деоксирибонуклеозиды содержат генетической информации и не являются антигенами. Они также обладают химической стабильностью и могут быть легко очищены и включены в ряд композиций. DNA, наоборот, неустойчивы и легко распадаются на олигонуклеотиды - фрагменты с различными молекулярными весами и поэтому непригодными для включения в фармацевтические препараты, к которым предъявляются требования по постоянному свойств стойкости.
Композиция или лекарственные формы для местного наложения могут включать растворы, примочки, мази, кремы, гели, суппозитории, спрей-аэрозоли, взвеси, присыпки, пропитанные повязки и перевязочный материал, липосомы, биоразлагающиеся полимеры и искусственные оболочки типичными фармацевтическими носителями, при помощи которых созданы вышеуказанные композиции, являются альгинаты, карбоксиметилцеллюлометилцеллюлоза, агароза, пектины, желатины, коллаген, растительные масла, стеариновая кислота, стеариновый спирт, вазелин (петролатум) полиэтиленгликоль, полисорбат, полиактат, полигликолят, полиангидриды, фосфолипиды, поливинилпирролидон и т. п.
Концентрации деоксирибонуклеозидов в фармацевтически приемлемых носителей находятся в пределах от 0,1 до 20%. Доза, используемая в конкретной форме или для наложения, определяется в соответствии с требованиями конкретного типа повреждения ткани и также определяется характеристиками и возможностями материалами носителя. Для лосьона для загара может быть добавлено от 0,1 до 5 вес. вышеуказанных композиций.
Композиции, описанные выше, могут быть объединены или использоваться вместе, или вместе с антибиотиком, с противогрибковым препаратом, или с противовирусным веществом для ускорения заживления ран или других инфекционных поражений кожи одновременно или согласовано с лечением от инфекции. Кроме того, 2'-деоксирибонуклеозиды настоящего изобретения могут быть объединены или использоваться совместно или согласовано с другими стимуляторами заживления тканей, как например, фактором роста эпидермия, фактором роста фибробласта, фактором роста производного тромбоцитов, превращающий фактор роста альфа, превращающий фактор роста бета, инсулиноподобный фактор роста 1 (Брайт, Дж. В. и Тиланснер, А. Биотехнология 6:25-30, 1988) для стимуляции ускоренного заживления поврежденных тканей.
Полезно также вводить совместно 2'-деоксирибонуклеозиды настоящего изобретения с местными кортикостероидными и противовоспалительными агентами для ускорения заживления поражений у пациентов, страдающих аллергическими заболеваниями или воспалительными процессами, поскольку известно, что стероиды замедляют заживление ран.
Заявленные композиции полезны при условиях, когда нормальное заживление ран протекает недостаточно хорошо. Например, раны, которые заживают плохо или медленно, к ним относятся язвы венозного происхождения, язвы от лежачего положения (пролежни), раны на коже и раны пищеварительного тракта или язвы у пациентов с диабетом, и у пациентов, подвергавшихся облучению, раковой химиотерапии (с адриамицином или циклофосфамидом) и местной или системной противоспалительной глюкокортикостероидной терапии.
Следующие соединения могут быть также полезны для комбинации или согласования с 2'-деоксирибонуклеозидами при лечении ран. Эти соединения могут быть использованы параллельно 1 или последовательно с 2'-деоксирибонуклеозидами. Они включают, но не ограничены только этим, аллантоин, ретиновую кислоту, алое, глицин, витамин A, витамины группы B, особенно никотинамид, витамины C и E, антибактерицидные агенты (например, четырех компонентные соединения аммония, бацитрацин, неомицин, полимиксин), препараты из корня окопника, тромбоциты и/или экстракты тромбоцитов, рибонуклеозиды, коллаген, пролины, лизины, эластин, фибронектин, глюкозаминогликаны, спермидин) и другие полиамины), ангиогенные факторы, цинк, сахар и различные пептидные факторы роста, такие как соматомедины, 1 амин, EGF, IGF, PDGF, FGF, EDGF, TGF, CDGF, MDGF и NGF. Композиции настоящего изобретения могут быть использованы совместно с искусственной кожей (оболочкой) при лечении ожогов и других ран и для заживления кожи или роговичной ткани.
Для лечения язвы желудка и двенадцатиперстной кишки 2'-деоксирибонуклеозиды могут вводится вместе с другими противоязвенными агентами. Такие агенты включают, но не ограничены только ими, циметидин, ранитидин, смепразол, сукралфат, (комплекс, приклеивающийся к язве), мизопростил (цитозащитный простагландин) или антитациды.
Композиция из 2'-деоксирибонуклеозида и носителя может быть приготовлена в качестве составной части лосьона для солнечного загара, который может наносится на кожу до или после принятия солнечных ванн. Лосьон для загара может также включать один или более блокаторов солнечных лучей, например, PABA, эфиры PABA и другие химические солнечные экраны. Композиция для лечения или улучшения эффекта старения может наносится локально в виде лосьонов.
Деоксирибонуклеозиды, включенные в соответствующую глазную мазь, раствор или включение, могут использоваться для лечения повреждений роговичной ткани или язв, полученных в результате действия химических веществ, операций, травм, ожогов и инфекций. Такие композиции могут быть использованы для улучшения заживления пересаженных роговичных тканей и реципиента.
Деокcирибонуклеозидные композиции могут быть включены в заполняющие хирургические имплантаты или имплантаты костных матриц для матриц для ускорения или улучшения роста гранулированных или соединительных тканей.
Медицинские или ветеринарные индикации на использование изобретения включают, но не ограничивают, следующие ситуации. Композиции могут быть использованы для ускоренного заживления механических ран или ссадин на коже или других тканях, которые подвергались механическому повреждению, например, на коже или слизистой желудочно-кишечного тракта. Изобретение может быть использовано для ускоренного заживления ожогов на коже или любых подкожных тканях, которые могут быть подвержены такому повреждению. Ожоги могут быть вызваны теплом, ионизационным облучением, ультрафиолетовыми лучами, включая солнечные электроэнергию или химические вещества.
Кроме того, композиции могут быть использованы для ускоренного заживления хирургических разрезов любой части тела, внутренних и внешних органов, в которые могут быть введены растворы или другие носители, содержащие деоксирибонуклеозиды настоящего изобретения. Композиции могут быть использованы для ускоренного заживления ишемических язв, пролежней, или язв, вызванных диабетом или другими заболеваниями. Они могут быть использованы для лечения поражений слизистой оболочки или язв, например, во рту, желудке или кишечнике. Это может включать введение деоксирибонуклеозидов в соответствующие клейкие или коллоидные суспензии или средства, уменьшающие раздражение, они могут вводится орально для локальной доставки нуклеозидов в нужное место кишечного тракта.
Для стимуляции заживления кожных ран, включающих хирургические разрезы, лучше наносить заявленные соединения локально, либо в виде мази, либо в виде повязки на рану. Местный антибиотик или противовирусный агент могут вводится совместно. Молярный эквивалент 0,1-20 мл смеси деоксирибонуклеозидов согласно композиции, заявленным в изобретении, должен наносится на участок раны в 1 см2 или 0,1-10 мг на 1 см длины поражения.
Ниже приводятся примеры, иллюстрирующие, но не ограничивающие, заявленные способы и композиции. Все другие возможные варианты и приложения разнообразных условий и параметров, обычно используемых в клинической терапии, которые очевидны для специалистов в данной области техники, включены в объем настоящего изобретения.
Пример 1. 48 самцов крыс F 344 весом около 150 г анестезировали комбинацией кетамина (100 мг/кг и ксилазина (13 мг/кг) путем внутрибрюшинной инъекции. Выбривали спинку каждой крысы и в спинно-поясничном отделе делали иссечение круглой формы во всю толщину кожи диаметром 8 мм для образования раны, так, чтобы оголилась подкожная повеностная скелетная мышца. На каждую рану помещали диск диаметром 8 мм из агарозы (1%), содержащий один или комбинацию из четырех основных 2'-деоксирибогуклеозидов или чистый диск (контроль). Концентрация каждого нуклеозида 30 мг/мл физиологического раствора. Затем на рану накладывалась жидкая пластическая повязка.
Через два дня рану открывали, удаляли диск из агарозы, рану фотографировали и обмеряли для определения степени заживления. Затем на каждую рану наносили алгинатный гель (2%), содержащий также нукозиды или комбинацию нуклеозидов, после чего на рану снова накладывали повязку из жидкого пластика. На четвертый день после операции раны вновь открывали, алгинатный гель удаляли и раны обмеряли для определения степени заживления. В каждой из 16 групп использовали трех крыс. Каждая группа получала либо один, либо два, три, либо все четыре 2-деоксирибонуклеозида: деокситимидин, деоксицитидин, диоксигуанозия и деоксиаденозин во всех возможных комбинациях (см. таблицу).
Из шести различных комбинаций из двух 2'-деоксирибонуклеозидов только комбинация dC и dG наиболее эффективна для стимуляции развития соединительной ткани через 48 и 96 ч по сравнению с контролем. На четырех различных комбинаций из трех 2'-деоксиобонуклеозидов только те комбинации, которые включали dC и dG (dC, dG, dA и dC, dG, dT) были более эффективны для стимуляции заживления ран по сравнению с контролем через 48 и 96 ч. Ни один из индивидуальных 2'-деоксирибонуклеозидов или комбинации из двух или трех 2'-диоксирибонуклеозидов не был так эффективен для стимуляции развития соединительной или гранулированной ткани, как это показала комбинация из четырех основных 2'-деоксирибонуклеозидов через 48 и 96 ч.
Пример 2. Проводилось сравнение заживляющего эффекта четырех основных деоксирибонуклеозидов (dA, dC, dG, dT) с соответствующими монофосфат деоксирибонуклеотидами.
Восемь самцов крыс F 344 весом около 200 г каждый анестезировали комбинацией кетамина (100 мг/кг) и ксилазина (13 мг/кг) и их спинки выбривались. На спинке каждой крысы вырезалась кожа на всю толщину для образования раны стандартным диаметром 8 мм. На каждую рану помещали диск из агарозы, содержащий либо все четыре деоксирибонуклеозида (dA, dC, dG, dT) (h=3), или все четыре соответствующих деоксирибонуклеотида (dAMP, dCMP, dGMP, dTMP), в физиологическом растворе концентрацией 30 мг/мл (n=4), или чистый диск из агарозы (n= 2). Затем все раны покрывались метакрилатом. Через 2 дня каждая рана обрабатывалась алгинатным гелем, содержащим либо нуклеозиды, либо нуклеотиды, или только одним гелем. Затем раны открывали, осматривали и определяли степень заживления на 2 и 4 день. Кроме того, на 4 день кожу, окружающую рану и область раны, удаляли и помещали в 10% раствор формалина для гистологического исследования.
Результаты через 2 дня.
В обеих контрольных ранах результат нулевой. В обеих ранах, обработанных нуклеозидом, результат 3* (рана полностью закрыта соединительной тканью и в некоторых областях непрозрачна). Все четыре раны, обработанные нуклеотидами, также дали результат 3*. Все обработанные раны были неопределимы через 48 ч.
Результаты через 4 дня.
Все контральные раны дали результат 2-3 (полностью закрыты, ткань очень тонкая и прозрачная). Раны, обработанные нуклеозидами были оценены как 3+ и 4. Все четыре раны, обработанные нуклеотидами дали результат 2-3. Они были неотличимы от контрольных. Они заработали не так быстро, как на 2 день. Соединительная ткань, покрывающая эти раны, была заметно тоньше и менее прочная, чем ткань, покрывающая раны, обработанные нуклеозидами.
Пример 3. Острое токсичное испытание смесью деоксирибонуклеозидов.
Смесь эквимолярных количеств деоксиэденозина, деоксигуанозина, деоксицитидина и тимидина суспендировалась в воде и вводилась в группе крыс самцов F 344 весом 200 г орально интубацией. При наблюдении в течение недели после введения признаков токсичности или смерти не наблюдалось при любых дозах, включая 10 г/кг - это самая высокая доза при испытаниях. Соответственно показано, что 50% летальная доза (ЛД 50) больше, чем 10 г/кг.
Пример 4. Известно, что глюкокортикостериоды, которые широко используются в клинической терапии, замедляют процессы заживления ран у человека и животных. Лечение кортикостероидами представляет стандартную модель ухудшения заживления ран. Цель этого эксперимента была - проверить действие и безопасность комбинации четырех основных деоксирибонуклеозидов для залечивания кожных язв, вызванных стероидами.
Четырнадцать самцов крыс F 344 средний вес 200 г каждый (возраст 3 недель) были пролечены дексаметазоном (5 мг/кг веса). Через 24 ч в спинной шейной области были сделаны стандартные круглые вырезы диаметром 8 мм на всю толщину кожи, В день операции и через каждые 48 ч на рану наносилось 50 микролитров комбинации деоксиаденозина, деоксицитидина, деоксигуанозина и деокситимидина в наполнителе из гидрогеля или одного гидрогеля 0,025 мл (в каждую). Раны закрывались повязкой из жидкого пластика, также как это выполнено у Маршака "Экспериментальная биологическая медицина", 58: 63-65, 1945. Затем проводили макроскопическое исследование и фотографирование, раны и окружающую их ткань исследовали через 7 дней после операции для микроскопической и гистологической оценки. Такое исследование тканей путем ее иссечения и оценки было описано и реализовано Ассоциацией патологии, Фредерик МД.
Результаты представлены на фиг. 1 и 2. Для оценки был использован полуколичественный метод: величина ангиогенезиса и повторной эпителизации; число макрофагов и фибробластов в каждой ране; степень (отношение) ткани и клеточного некроза; инфильтрация полиморфоядерных лейкопитов (ПМЯ); количество волокнистого эксудата. Индексы заживления для тех ран, которые были обработаны деоксирибонуклеозидами, были значительно выше (P. 001) чем у ран, обработанных только одним наполнителем (фиг. 1). Величина некроза ткани, аккумулирование фибринового эксудата инфильтрация раны ПМЯ не отличались для контрольных и обработанных групп (фиг. 2), это показывает, что деоксирибонуклеозиды не приводят к воспалению в этих ранах. Гистоморфологический анализ выявил нормальные клетки и морфологию ткани во всех образцах ран.
Отличия в степени заживления ран, обработанных деоксирибонуклеозидами, по сравнению с ранами, обработанными только наполнителем, были поразительными в отношении роста на макроскопическом уровне, седьмой день вид ран, которые оставались контрольными, не отличался от того дня, когда проводилась операция, самое лучшее, что можно было заменить - это небольшие участки гранулированной ткани и минимальное количество нового эпителия. И наоборот, раны, обработанные нуклеозидами, все были полностью закрыты толстым слоем гранулированной ткани. Новый эпителий покрывал более 50% первоначальной площади ран.
Поэтому наложение комбинации четырех основных деоксирибонуклеозидов на полную толщину ран преодолевает задержку в заживлении ран, вызванную дексаметазоном, без побочного вредного эффекта и значительно ускоряет заживление ран.
Пример 5. Цель этого эксперимента - оценить эффективность и безопасность комбинации четырех основных деоксирибонуклеозидов для ускорения процесса заживления ран у молодых нормальных крыс, которые, как известно, быстро заживают и без вмешательства.
Тридцать шесть крыс самцов F 344 весом около 200 г (в возрасте 8 недель) были преоперированы, всем удалили кожу на полную толщину диаметров 8 мм в спинной шейной области. В день операции и через каждые 48 ч после на раны наносили 50 микролитров комбинации деоксиаденозина, деоксицитидина, деоксианозина и деокситимидина (0,025 мл в каждую) в гидрогеле, служащим наполнителем, или только один наполнитель. Раны закрывали повязкой из жидкого пластика, как описано у Маршака "Экспериментальная биологическая медицина", 58: 63- 65, 1945. Затем осуществляли макроскопический осмотр и фотографирование, раны и окружающие ткани исследовали через 5 (n=8 на группу) и восемь дней после операции (n=10 на группу) для микроскопической и гистологической оценки. Иссечение и оценка тканей проводились по методике, предложенной Ассоциацией патологии, Фредерик МД.
Макроскопическое образование на 5 и 7 день в ранах, обработанных нуклеозидами, показали очень высокую степень образования гранулированной ткани и нового эпителия по сравнению с контрольными ранами, обработанными только наполнителем. Результаты микроскопической и гистологической оценки представлены на фиг. 3, 4 и 5 подтверждаются макроскопическими наблюдениями. Процент ран на 5 и 7 день с новым эпителием был значительно выше (P. 001 и P. 01 соответственно) в группе, обработанной нуклеозидами, по сравнению с контрольной группой. Аналогично, абсолютная длина нового эпителия по периметру раны была значительно выше в группе, обработанной нуклеозидами и на 5 (P. 001) и на 7 день (P. 005), чем в контрольной группе. Также значительно больше была толщина гранулированной ткани (фиг. 3) (Р. 001) в группе, обработанной нуклеозидами, чем в контрольной группе на 5 день. На 7 день гранулированная ткань в контрольных ранах достигла толщины, которую имела гранулированная ткань в экспериментальной группе на 5 день. Толщина гранулированной ткани в группе, обработанной нуклеозидами, не отличалась от той, которую наблюдали на 5 день в этой же группе. Гистологическая оценка показала нормальные клетки и ткани с морфологией, а также нормальный уровень воспаления как в контрольных, так и в ранах, обработанных нуклеозидами, а также в окружающих тканях.
Приведенные данные показывают, что лечение глубоких язв на коже у молодых нормальных крыс комбинацией деоксиденозина, деоксицитидина, деоксигуанозина и деоксимитидина значительно ускоряет скорость нормального заживления. Обработанные раны заживали на 5 день, а контрольные на 7. Это составляет 28,6% возрастания скорости заживления в течение курса, состоящего из одной недели у молодых нормальных крыс.
Пример 6. 1. Получение липосом, содержащих деоксирибонуклеозиды. Липосомы или другие биоразрушающиеся наполнители, содержащие деоксирибонуклеозиды могут с успехом быть использованы для получения пролонгированного действия деоксирибонуклеозидов на ткани раны.
Подробно приготовление липосом раскрыто Зокой и Парахадопулосом (PNA S75: 4194-4198, 1978 г. ). Другие способы получения липосом (и различных других липидных компонентов) могут быть использованы для получения наполнителей, содержащих деоксирибонуклеозиды.
Холестерин (50 микромолей), фосфатидилхолин (40 микромолей), фосфатидилглицерин (10 микромолей) растворялось в хлороформе (5 мл) и эдиэтиловом эфире (5 мл) в 50 мл колбе с круглым дном. Колба закрывалась и наполнялась азотом. К органической фазе добавлялось 1,5 мл водного раствора, содержащего деоксирибонуклеозиды (т. е. 10 мг/мл деоксиаденозина, деоксицитидина, деоксигуанозина и тимидина в 15 мм NaCl). Смесь обрабатывалась ультразвуком в течение 5 мин при температуре 0-5oC в ультразвуковой ванне до тех пор, пока двухфазная система не стала однородной гомогенной дисперсией. Может быть использован и зондирующий ультразвуковой смеситель. Затем органические растворители удалялись во вращающемся испарителе при пониженном давлении (например, водном вытяжном вентиляторе) при 35-40oC при скорости вращения 200 об/минуту. Смесь вначале вспенилась, а затем становилась вязким гелем, в итоге превращалась в водную суспензию. В это время к суспензии добавлялось 2 мл физиологического раствора и суспензия выпаривалась в течение дополнительно 15 мин для удаления оставшихся следов эфира или хлороформа. Затем препарат центрифугировался для сепарации липосом от незакапсулированного материала. От 35 до 40% органического раствора деоксирибонуклеида капсулировалось в липосомах. Затем проводилась очистка, липосомы концентрировались путем центрифугирования и суспендирования в 3 мл физиологического раствора для местного наложения на раны.
Липосомы, содержащие деоксирибонуклеозиды, могут также суспендироваться в мазях, кремах или других наполнителях для местного наложения на рану, повреждения кожи или язвы.
2. Эффект от использования липосом, содержащих деоксирибонуклеозиды, для заживления ран.
Липосомы могут служить эффективными средами для доставки различных фармацевтических объединений. Цель этого эксперимента - оценка липосом в качестве потенциальных сред для доставки лекарственных препаратов для местного наложения деоксирибонуклеозидов на кожные раны.
Четырнадцать самцов крыс F 344 весом около 200 г каждый (в возрасте 8 недель) были прооперированы, им удалили кожу в области шеи и на спинке диаметром 8 мм. В липосомах были заключены деоксиаденозин, деоксицитидин, деоксигуанозин и деокситимидин (0,010 мл/каждому), как указано выше. Чистые липосомы (изготовленные только с физиологическим раствором) или липосомы, содержащие деоксирибонуклеозиды, наносились на раны в день операции и через 48 ч. Раны закрывались повязкой из жидкого пластика, как предлагалось в публикации Маршака (1945 г.). Через 7 дней после операции проводили макроскопическое исследование ран для определения степени грануляции тканей образований и степени эпителизации.
Было установлено, что количество образовавшейся гранулированной ткани и нового эпителия, который начал покрывать раны, обработанные липосомами, содержащими нуклеозид, значительно выше, чем в ранах, обработанных только чистыми липосомами. Эти результаты показали, что липосомы, содержащие деоксирибонуклеозиды, являются полезными вариантами воплощения изобретения.
Пример 7. Для установления эффективности комбинации четырех основных деоксирибонуклеозидов при заживлении ран на слизистой использовалась модель хронической язвы у крыс по Окабе и др. (Заболевания пищеварительных органов", 16: 227-284, 1971 г.).
48 крыс самцов F 344 весом около 190 г анестизировали комбинацией кетамина (100 мг/кг) и ксилазина (13 мг/кг), которые вводили внутрь брюшной полости. Брюшная поверхность крысы выбривалась и обрабатывалась антибактерицидным раствором. Затем выделяли желудок и через вентральный разрез на серозную поверхность у границы корпуса и полости желудка помещали пластический цилиндр с внутренним диаметром 7 мм, после чего в течение 1 минуты наносилась уксусная кислота в количестве 0,07 мл. Область, обработанная кислотой, затем тщательно промывалась стерильным физиологическим раствором и разрез закрывали. Лечение начинали через 5 дней.
Препарат приготовляли путем смешивания 1,25 г (каждой крысе) деоксиаденозина, деоксицитидина, деоксигуанозина и деокситимидина с препаратом, уменьшающим раздражение, состоящим из 0,27 г (каждой крысе) карбоксиметилцеллюлозы и клейкого ксантана и 50 мл стерильной воды. Контрольный препарат состоял только из карбоксиметилцеллюлозы и клейкого ксантового наполнителя. Крысы получали 1 мл либо лечебного, либо контрольного препарата дважды в день (утром и к вечеру) оральным введением через трубочку. Животные получали стандартную лабораторную пищу для крыс. Пища и вода были не нормированы. На 10, 20 и 30 день восемь животных из каждой группы забивались и желудки извлекались. Затем желудки выдерживали в слабом растворе формалина 1% для фиксации; область язвы/область, оставшуюся без нового эпителиального покрытия измерялась и данные по каждой язве фиксировались.
Результаты этого эксперимента показаны на фиг. 6. В каждой точке область язвы в обрабатываемой препаратом группе значительно больше, чем в контрольной группе. Эти данные показывают эффективность деоксирибонуклеозидных препаратов, использованных для ускорения заживления язв слизистой желудка.
Пример 8. Стандартная лабораторная пища для крыс, которая использовалась в экспериментах по примеру 7, содержала много волокнистой пищи и грубых кормов, которые, как известно, анулируют заживление желудочных язв у крыс, т. е. осложняют процесс заживления. Поэтому эффект деоксирибонуклеозидов на заживление язв желудка проверялась на крысах, получавших мягкую агар-содержащую пищу, которая устраняла потенциальное осложнение, создаваемое стандартной лабораторной пищей.
60 самцов крыс F 344 получили язву желудка в соответствии с протоколом, указанным в примере 7. Животные получали пищу согласно Bioserv Basal Gel Diet (Bioserv, Inc, Freuchtuwn, N 5). Пища и вода были не нормированы. Животные получая ли только наполнитель (карбоксиметилцеллюлозу и клейкий ксантан) или комбинацию деоксиаденозина, деоксицитидина, деоксигуанозина, деокситимидина в клейком ксантане и карбоксиметилцеллюлозе, как указано в примере 7, 15. животных в каждой группе забивали на 10 и 16 день лечения. Область язвы, остающуюся неэпителизованной, измеряли для каждого желудка и данные регистрировали.
Результаты эксперимента, представленные на фиг. 7, показывают, что скорость заживления и контрольных и обрабатываемых язв была выше, чем при использовании стандартной лабораторной пищи для крыс (фиг. 6). Лечение язв слизистой деоксикарбонуклеозидными препаратами значительно ускоряет процесс заживления по сравнению с контрольными язвами, которые пролечивали только наполнителем, на 10 и 16 день (P. 002; P. 001 соответственно). Микроскопическое исследование и гистология подтвердили макроскопическое исследование, т. е. значительно более высокую эпителизацию пролеченных язв, оно выявило, что морфология клеток и тканей была нормальной в обоих случаях для контрольных и пролеченных язв.
Пример 9. Циметидин известен как эффективный противоязвенный агент, Механизм действия циметидина - это, во-первых, ингибирование секреции желудочной кислоты через его действие на желудочные гистаминные (H2) рецепторы. Это обеспечивает менее агрессивную среду в желудке при заживлении язвы, но не обязательно стимулирует сам процесс заживления. Агенты, которые непосредственно ускоряют процесс заживления, должны оказывать эффективное воздействие на заживление язвы желудка, больше, чем эффект, полученный только от использования циметидина. Поэтому исследовалось влияние цимитидина и препарата, содержащего деоксирибонуклеозид в отдельности и в комбинации, на заживление язвы желудка.
51 самец крыс F 344 получили язву желудка в соответствии с методике описанной в примере 7. Через 5 дней началось лечение. Животные получили 1 мл либо только наполнителя (карбоксиметилцеллюлоза) клейкий ксантан, см. пример 7), либо комбинацию деоксиаденозина, деоксицитидина, деоксигуанозина, деокситимидина (0,025 г/мл каждый) в наполнителе, либо циметидин (15 мг/мл) в наполнителе, либо циметидин плюс деоксирибонуклеозиды в наполнителе. Лекарства вводились дважды в день утром и к вечеру, орально через трубку. Крыс пролечили в течение 14 дней и потом забивали. Желудки извлекали и слегка фиксировали в 1% формалине. Затем исследовали оставшуюся язву и окружающие ткани и выявляли неэпителизированные области язв. Образцы хранили в 10% формалине.
Результаты этого эксперимента показаны на фиг. 8. Область язв, обработанных циметидином и деоксирибонуклеозидом, была значительно меньше по сравнению с контрольными язвами, обработанными только наполнителем (P. 001 и P. 002 соответственно). Язвы, обработанные циметидином плюс деоксирибонуклеозидами, были не только значительно меньше контрольных (P. 001), но значительно меньше язв, обработанных циметидином (P. 05) или препаратом, содержащим деоксирибонуклеозид (Р. 05). Таким образом, следует, что деоксирибонуклеозиды имеют отличающийся от циметидина механизм действия, а их объединение дает дополнительный эффект для стимуляции заживления хронических язв желудка.
Пример 10. В японском патенте N 60028929 А Хокурики Фарм заявлено лекарственное средство для язв желудка, хотя представлены данные только частичного предупреждения острых стрессовых 1 язв. Лекарственное средство содержит 2'-деоксигуанозин. Цель настоящего эксперимента - сравнить эффективность одного деоксигуанозина с эффективностью комбинации 2'-деоксирибонуклеозидов: аденина, цитидина, гуанина и тимина при лечении хронических язв желудка.
48 крыс самцов F 344 весом около 210 грамм каждый получали язву желудка уксусной кислотой по методике, описанной в примере 7. Лечение начинали через 5 дней после инициирования язвы и проводили по методике и схеме, описанной выше. Животные получали 1 мл либо только наполнителя (контроль), либо четырех деоксирибонуклеозидов в наполнителе (0,025 г/мл на каждого), либо деоксигуанозина (0,025 г/мл) утром и ближе к вечеру ежедневно в течение 14 дней. В последний день лечения все 16 животных в каждой группе забивали, извлекали желудки и слегка фиксировали в формалине, после чего неэпителизированные области измеряли и регистрировали.
Результаты этого эксперимента представлены на фиг. 9. Область контрольных язв, обработанных только наполнителем, составила 12,6, 1,5, в то время как область язв, обработанных всеми четырьмя деоксирибонуклеозидами была 7,7±0,87 (P. 01) и обработанных только деоксигуанозином 16,3± 1,5 (P. 02). Таким образом следует, что деоксигуанозин сам по себе неэффективен при лечении хронических язв желудка, в то время как комбинация деоксиаденозина, деоксицитидина, деоксигуанозина и деокситимидина эффективно ускоряет заживление слизистой.
Реферат
Изобретение относится к химико-фармацевтической промышленности и касается композиций, содержащих 2'-деоксирибонуклеоиды. Изобретение касается также способов ускорения заживления ран, ссадин, порезов, разрезов, поверхностных /неглубоких/ ожогов, вызванных нагревом, солнечными лучами, химическими агентами или от инфекций, а также способов усиления эффекта старения эпидермиса, включающих способ заживления раны, способ стимуляции заживления ран. 16 с. и 25 з.п. ф-лы, 1 табл., 9 ил.

Формула
2'-деоксицитидин - 10 - 90,0
2'-деоксигуанозин - 10 - 90,0
2. Композиция по п.1, отличающаяся тем, что каждое из указанных соединений содержится в количестве 25 - 75 мол.% от массы указанной композиции.
2'-деоксицитидин, или его 3', или 5', или 3',5'-эфир фосфорной кислоты, или его замещенное производное, или его фармацевтически приемлемая соль - 10 - 90,0
2'-деоксигуанозин, или его 3', или 5', или 3',5'-эфир фосфорной кислоты, или его замещенное производное, или его фармацевтически приемлемая соль - 10 - 90,0
5. Композиция по п.4, отличающаяся тем, что одно или оба указанных соединений, 2'-деоксицитидин и 2'-деоксигуанозин, замещены одной или несколькими группами, одинаковыми или различными, по одной или обеим гидроксильным группам деоксирибозы и/или замещены по экзоциклическому амину пуринового кольца 2'-деоксигуанозина или по экзоциклическому амину пиримидинового кольца 2'-деоксицитидина радикалом, выбранным из группы, содержащей биосовместимые ацильные радикалы, содержащие 2 - 20 атомов углерода.
2'-деоксицитидин - 10 - 90,0
2'-деоксигуанозин - 10 - 90,0
и эффективное количество 2'-деоксиаденозина, причем указанные соединения могут быть в свободном виде или в виде фармацевтически приемлемых солей.
2'-деоксицитидин - 25 - 75,0
2'-деоксигуанозин - 25 - 75,0
10. Композиция по п.8, отличающаяся тем, что она содержит фармацевтически приемлемый носитель.
2'-деоксицитидин, или его 3', или 5', или 3',5'-эфир фосфорной кислоты, или его замещенное производное, или его фармацевтически приемлемая соль - 10 - 90,0
2'-деоксигуанозин, или его 3', или 5', или 3',5'-эфир фосфорной кислоты, или его замещенное производное, или его фармацевтически приемлемая соль - 10 - 90,0
взятую в количестве по меньшей мере 50 мол.%, и эффективное количество 2'-деоксиаденозин, или его 3', или 5', или 3',5'-эфира фосфорной кислоты, или его замещенного производного, или его фармацевтически приемлемой соли.
2'-деоксицитидин - 10 - 90,0
2'-деоксигуанозин - 10 - 90,0
и эффективное количество 2'-деокситимидина, причем указанные соединения могут быть в свободном виде или в виде фармацевтически приемлемых солей.
2'-деоксицитидин - 25 - 75,0
2'-деоксигуанозин - 25 - 75,0
18. Композиция для заживления ран, включающая активный ингредиент и, необязательно, фармацевтически приемлемый носитель, отличающаяся тем, что в качестве активного ингредиента она содержит смесь следующего состава, мол.%:
2'-деоксицитидин, или его 3', или 5', или 3',5'-эфир фосфорной кислоты, или его замещенное производное, или его фармацевтически приемлемая соль - 10 - 90,0
2'-деоксигуанозин, или его 3', или 5', или 3',5'-эфир фосфорной кислоты, или его замещенное производное, или его фармацевтически приемлемой соли - 10 - 90,0
взятую в количестве по меньшей мере 50 мол.%, и эффективное количество 2'-деокситимидина, или его 3', или 5', или 3',5'-эфира фосфорной кислоты, или его замещенного производного, или его фармацевтически приемлемой соли.
2'-деоксицитидин - 10 - 90,0
2'-деоксигуанозин - 10 - 90, 0
эффективное количество 2'-деоксиаденозина и эффективное количество 2'-деокситимидина, причем указанные соединения могут быть в свободном виде или в виде фармацевтически приемлемых солей.
2'-деоксицитидин - 25 - 75,0
2'-деоксигуанозин - 25 - 75,0
24. Композиция для заживления ран, включающая активный ингредиент и, необязательно, фармацевтически приемлемый носитель, отличающаяся тем, что в качестве активного ингредиента она содержит смесь следующего состава, мол.%:
2'-деоксицитидин, или его 3', или 5', или 3',5'-эфир фосфорной кислоты, или его замещенное производное, или его фармацевтически приемлемая соль - 10 - 90,0
2'-деоксигуанозин, или его 3', или 5', или 3',5'-эфир фосфорной кислоты, или его замещенное производное, или его фармацевтически приемлемая соль - 10 - 90,0
взятую в количестве по меньшей мере 50 мол.%, и эффективное количество 2'-деоксиаденозина, или его 3', или 5', или 7',5'-эфира фосфорной кислоты, или его замещенного производного, или его фармацевтически приемлемой соли и эффективное количество 2'-деокситимидина, или его 3', или 5', или 3',5'-эфира фосфорной кислоты, или его замещенного производного, или его фармацевтически приемлемой соли.
2'-деоксицитидин - 10 - 90,0
2'-деоксигуанозин - 10 - 90,0
эффективное количество 2'-деоксиаденозина и эффективное количество 2'-деокситимидина, где указанные соединения могут быть в свободном виде или в виде фармацевтически приемлемых солей, а также эффективное количество противоязвенного агента, выбранного из группы, содержащей антагонисты секреции желудочной кислоты, цитозащитные простагландины, антацидные средства или сращивающие комплексы для желудка.
2'-деоксицитидин - 25 - 75,0
2'-деоксигуанозин - 25 - 75,0
30. Композиция для заживления язвы желудка или двенадцатиперстной кишки или раны, включающая активный ингредиент и, необязательно, фармацевтически приемлемый носитель, отличающаяся тем, что в качестве активного ингредиента она содержит смесь следующего состава, мол.%:
2'-деоксицитидин, или его 3', или 5', или 3',5'-эфир фосфорной кислоты, или его замещенное производное, или его фармацевтически приемлемая соль - 10 - 90,0
2'-деоксигуанозин, или его 3', или 5', или 3',5'-эфир фосфорной кислоты, или его замещенное производное, или его фармацевтически приемлемая соль - 10 - 90,0
взятую в количестве по меньшей мере 50 мол.%, эффективное количество 2'-деоксиаденозина, или его 3', или 5', или 3',5'-эфира фосфорной кислоты, или его замещенного производного, или его фармацевтически приемлемой соли и эффективное количество 2'-деокситимидина, или его 3', или 5', или 3',5'-эфира фосфорной кислоты, или его замещенного производного, или его фармацевтически приемлемой соли.

Комментарии