Ингибиторы mir-155 для лечения кожной t-клеточной лимфомы (ctcl) - RU2718534C2
Код документа: RU2718534C2
Чертежи































Описание
ПЕРЕКРЕСТНАЯ ССЫЛКА НА РОДСТВЕННЫЕ ЗАЯВКИ
[0001] По настоящей заявке испрашивают приоритет предварительной заявки США № 62/171,758, поданной 5 июня 2015 года, содержание которой включено, таким образом, посредством ссылки в полном объеме.
ОБЛАСТЬ ИЗОБРЕТЕНИЯ
[0002] Настоящее изобретение относится к олигонуклеотидным ингибиторам miR-155 и их композициям. Изобретение также относится к способам лечения или предотвращения злокачественной опухоли у нуждающегося в этом субъекта посредством введения олигонуклеотидного ингибитора miR-155. Активность или функцию miR-155 снижают в клетках злокачественной опухоли субъекта после введения олигонуклеотидного ингибитора.
УРОВЕНЬ ТЕХНИКИ
[0003] МикроРНК (мкРНК) представляют собой небольшие эндогенные некодирующие РНК, которые действуют в качестве посттранскрипционных репрессоров экспрессии гена. мкРНК действуют в качестве репрессоров мРНК-мишеней посредством содействия их разрушению, когда их последовательности превосходно комплементарны, или посредством ингибирования трансляции, когда их последовательности содержат несовпадения.
[0004] Транскрипция мкРНК происходит с помощью РНК полимеразы II (pol II) или РНК полимеразы III (pol III; см. Qi et al. (2006) Cellular & Molecular Immunology, том 3:411-419) и возникает из начальных транскриптов, называемых первичными транскриптами мкРНК (первичной мкРНК), которые в целом имеют длину в несколько тысяч оснований. Первичная мкРНК проходит процессинг в ядре под действием РНКазы Дроша до предшественников в форме шпильки приблизительно от 70 приблизительно до 100 нуклеотидов (пред-мкРНК). После транспортировки в цитоплазму, шпилечная пред-мкРНК проходит дополнительный процессинг под действием дайсера с образованием двухцепочечный мкРНК. Затем цепь зрелой мкРНК встраивается в индуцированный РНК комплекс сайленсинга (RISC), где она связывается со своими мРНК-мишенями за счет комплементарности пар оснований. В относительно редких случаях, когда основание мкРНК превосходно образует пару с мРНК-мишенью, она содействует разрушению мРНК. Более часто мкРНК образует неидеальные гетеродуплексы с мРНК-мишенями, или воздействуя на стабильность мРНК или ингибируя трансляцию мРНК.
[0005] МикроРНК вовлечены в некоторые заболевания, включая злокачественную опухоль. Например, гены мкРНК человека miR15a и miR16-1 удалены или находятся под понижающей регуляцией приблизительно в 60% случаев B-клеточного хронического лимфоцитарного лейкоза (CLL) (Calin et al., Proc Natl Acad Sci, 2002; 99:15524-15529). Аналогичным образом, дисрегуляция miR-155-5p связана с событиями передачи сигналов, которые вовлечены в патогенез кожной T-клеточной лимфомы (CTCL). Показано, что озлокачествленные T-клетки конститутивно экспрессируют рецепторный комплекс IL-2 и ассоциированные янус-киназы (JAK), которые активируют транскрипцию через белки сигнальных трансдукторов и активаторов транскрипции (STAT). Эксперименты по иммунопреципитации хроматина показали, что STAT-5 связан с промотором MIR155HG, геном-хозяином для miR-155-5p. Это подсказывает, что miR-155-5p может регулировать путь передачи сигнала STAT-5 в CTCL озлокачествленных T-клетках. Ингибирование пути JAK/STAT вело к понижающей регуляции экспрессии miR-155-5p, тогда как обработка клеток цитокинами, которые активируют STAT-5, вела к увеличенным уровням miR-155-5p (Kopp et al. 2013). Эти результаты подсказывают, что miR-155-5p может играть роль в патогенезе CTCL.
[0006] В настоящее время не существует терапии, которая излечивает пациентов с CTCL на поздней стадии или продлевает их выживаемость (Prince et al., 2009). Лечение пациентов с CTCL на начальной стадии заболевания является паллиативным и не агрессивным, под тщательным мониторингом со стороны врача. Пациентов с CTCL на более запущенных стадиях обычно лечат системными лекарственными средствами, такими как ретиноиды (бексаротен) или ингибиторы гистондеацетилазы (вориностат). Лучевая терапия обычно является последней линией защиты и может вести к частичной регрессии заболевания, но не полной эрадикации. Лечение часто имеет серьезные побочные эффекты или ведет к резистентности с течением времени. Таким образом, сохраняется неудовлетворенная медицинская потребность в новой терапии для лечения T-клеточной лимфомы кожи.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
[0007] Настоящее изобретение предусматривает олигонуклеотидные ингибиторы для модулирования активности или функции miR-155 в клетках субъекта. В одном из вариантов осуществления введение олигонуклеотидного ингибитора miR-155 осуществляет понижающую регуляцию активности или функции miR-155 в клетках злокачественной опухоли субъекта после введения. В определенных вариантах осуществления клетки злокачественной опухоли представляют собой озлокачествленные T-клетки, включая клетки кожной T-клеточной лимфомы (CTCL), CD4+ T-клетки, CD8+ T-клетки, αβ T-клетки, γδ T-клетки и T-клетки памяти.
[0008] В одном из вариантов осуществления олигонуклеотидный ингибитор miR-155 содержит последовательность от 11 до 16 нуклеотидов, где олигонуклеотидный ингибитор полностью комплементарен зрелой последовательности miR-155 и имеет полный фосфоротиоатный остов; и где по меньшей мере первые три нуклеотида с 3'-конца олигонуклеотидного ингибитора представляют собой замкнутые нуклеотиды и по меньшей мере второй нуклеотид с 5'-конца олигонуклеотидного ингибитора представляет собой нуклеотид дезоксирибонуклеиновой кислоты (ДНК). В некоторых из этих вариантов осуществления четвертый нуклеотид с 3'-конца олигонуклеотидного ингибитора также представляет собой замкнутый нуклеотид. В некоторых из этих вариантов осуществления первый нуклеотид с 5'-конца олигонуклеотидного ингибитора представляет собой замкнутый нуклеотид.
[0009] В другом варианте осуществления олигонуклеотидный ингибитор miR-155 содержит последовательность от 11 до 14 нуклеотидов, в которой олигонуклеотидный ингибитор полностью комплементарен зрелой последовательности miR-155 и имеет полный фосфоротиоатный остов; и где по меньшей мере первые три нуклеотида с 3'-конца указанного олигонуклеотидного ингибитора представляют собой модифицированные нуклеотиды и по меньшей мере второй нуклеотид с 5'-конца олигонуклеотидного ингибитора представляет собой нуклеотид дезоксирибонуклеиновой кислоты (ДНК). В этих вариантах осуществления олигонуклеотидный ингибитор может содержать по меньшей мере 5, 6, 7, 8, 9 или 10 модифицированных нуклеотидов. В некоторых из этих вариантов осуществления, олигонуклеотидный ингибитор содержит 7, 8, 9 или 10 модифицированных нуклеотидов. В некоторых из этих вариантов осуществления все 7, 8, 9 или 10 модифицированных нуклеотидов, присутствующих в олигонуклеотидном ингибиторе, представляют собой замкнутые нуклеотиды. В некоторых других вариантах осуществления, 7, 8, 9 или 10 модифицированных нуклеотидов, присутствующих в олигонуклеотидном ингибиторе, представляют собой комбинацию замкнутых нуклеотидов и других модификаций, таких как нуклеотиды с этиленовым мостиком, бициклические нуклеотиды с 2'-C-мостиком и модификации сахаров, такие как 2'-замещенные нуклеотиды. В некоторых из этих вариантов осуществления второй ДНК нуклеотид с 5'-конца олигонуклеотидного ингибитора может представлять собой не модифицированный ДНК нуклеотид. В некоторых из этих вариантов осуществления первые три модифицированных нуклеотида с 3'-конца олигонуклеотидного ингибитора представляют собой замкнутые нуклеотиды.
[0010] В еще одном другом варианте осуществления олигонуклеотидный ингибитор miR-155 содержит последовательность от 11 до 14 нуклеотидов, где олигонуклеотидный ингибитор полностью комплементарен зрелой последовательности miR-155 и имеет полный фосфоротиоатный остов; и где по меньшей мере 7 нуклеотидов указанного олигонуклеотидного ингибитора представляют собой модифицированные нуклеотиды и по меньшей мере второй нуклеотид с 5'-конца олигонуклеотидного ингибитора представляет собой нуклеотид дезоксирибонуклеиновой кислоты (ДНК). В этих вариантах осуществления олигонуклеотидный ингибитор может содержать по меньшей мере 7, 8, 9 или 10 модифицированных нуклеотидов. В некоторых из этих вариантов осуществления все 7, 8, 9 или 10 модифицированных нуклеотидов, присутствующих в олигонуклеотидном ингибиторе, представляют собой замкнутые нуклеотиды. В некоторых других вариантах осуществления 7, 8, 9 или 10 модифицированных нуклеотидов, присутствующих в олигонуклеотидном ингибиторе, представляют собой комбинацию замкнутых нуклеотидов и других модификаций, таких как нуклеотиды с этиленовым мостиком, бициклические нуклеотиды с 2'-C-мостиком и модификации сахаров, такие как 2'-замещенные нуклеотиды. В некоторых из этих вариантов осуществления первые три нуклеотида с 3'-конца олигонуклеотидного ингибитора представляют собой модифицированные нуклеотиды. В некоторых из этих вариантов осуществления, первые три модифицированных нуклеотида с 3'-конца олигонуклеотидного ингибитора представляют собой замкнутые нуклеотиды. В некоторых из этих вариантов осуществления второй или третий нуклеотид с 3'-конца олигонуклеотидного ингибитора представляет собой ДНК нуклеотид. В некоторых из этих вариантов осуществления второй ДНК нуклеотид с 5'-конца олигонуклеотидного ингибитора может представлять собой не модифицированный ДНК нуклеотид.
[0011] В еще одном другом варианте осуществления олигонуклеотидный ингибитор miR-155 содержит последовательность от 11 до 14 нуклеотидов, где олигонуклеотидный ингибитор полностью комплементарен зрелой последовательности miR-155 и имеет полный фосфоротиоатный остов; и где по меньшей мере первые три нуклеотида с 3'-конца указанного олигонуклеотидного ингибитора представляют собой модифицированные нуклеотиды и по меньшей мере четвертый и пятый нуклеотиды с 5'-конца олигонуклеотидного ингибитора представляют собой нуклеотиды дезоксирибонуклеиновой кислоты (ДНК). В этих вариантах осуществления олигонуклеотидный ингибитор может содержать по меньшей мере 7, 8, 9 или 10 модифицированных нуклеотидов. В некоторых из этих вариантов осуществления все 7, 8, 9 или 10 модифицированных нуклеотидов, присутствующих в олигонуклеотидном ингибиторе, представляют собой замкнутые нуклеотиды. В некоторых из этих вариантов осуществления первые три модифицированные нуклеотида с 3'-конца олигонуклеотидного ингибитора представляют собой замкнутые нуклеотиды. В некоторых из этих вариантов осуществления четвертый и/или пятый ДНК нуклеотид с 5'-конца олигонуклеотидного ингибитора может представлять собой не модифицированный ДНК нуклеотид.
[0012] Модифицированные нуклеотиды, которые могут присутствовать в олигонуклеотидных ингибиторах по настоящему изобретению, включают, но не ограничиваясь этим, замкнутые нуклеотиды, нуклеотиды с этиленовым мостиком, бициклические нуклеотиды с 2'-C-мостиком, 2'-замещенные нуклеотиды и другие модификации сахаров и/или оснований, описанные в настоящем описании. В некоторых вариантах осуществления все модифицированные нуклеотиды, присутствующие в олигонуклеотидных ингибиторах по настоящему изобретению, представляют собой замкнутые нуклеотиды. В некоторых других вариантах осуществления модифицированные нуклеотиды, присутствующие в олигонуклеотидных ингибиторах, представляют собой комбинацию замкнутых нуклеотидов и других модификаций, таких как нуклеотиды с этиленовым мостиком, бициклические нуклеотиды с 2'-C-мостиком и 2'-замещенные нуклеотиды, и другие модификации сахаров и/или оснований, описанные в настоящем описании.
[0013] В одном из вариантов осуществления олигонуклеотидный ингибитор miR-155 имеет длину от 12 до 14 нуклеотидов. В некоторых вариантах осуществления олигонуклеотидный ингибитор содержит по меньшей мере 5, 6, 7, 8, 9 или 10 замкнутых нуклеотидов. В некоторых других вариантах осуществления олигонуклеотидный ингибитор содержит по меньшей мере 1, 2, 3, 4, 5 или больше ДНК нуклеотидов. В определенных вариантах осуществления по меньшей мере второй нуклеотид с 5'-конца олигонуклеотидного ингибитора представляет собой ДНК нуклеотид. В определенных дополнительных вариантах осуществления по меньшей мере второй и четвертый нуклеотиды с 5'-конца олигонуклеотидного ингибитора представляют собой ДНК нуклеотиды. В дополнительных вариантах осуществления по меньшей мере шестой и/или восьмой нуклеотид с 5'-конца олигонуклеотидного ингибитора представляет собой ДНК нуклеотид. В других вариантах осуществления олигонуклеотидный ингибитор содержит ДНК нуклеотиды во втором, шестом и восьмом положении с 5'-конца.
[0014] В некоторых вариантах осуществления олигонуклеотидный ингибитор miR-155 имеет последовательность, выбранную из SEQ ID NO: 3-27 и 29-120. В образцовом варианте осуществления олигонуклеотидный ингибитор miR-155 имеет последовательность SEQ ID NO: 25. В другом образцовом варианте осуществления олигонуклеотидный ингибитор miR-155 имеет последовательность SEQ ID NO: 22 или 23. В еще одном другом образцовом варианте осуществления олигонуклеотидный ингибитор miR-155 имеет последовательность, выбранную из SEQ ID NO: 33, 39, 43, 44, 47, 58, 84, 99, 111, 115 и 120.
[0015] В одном из вариантов осуществления олигонуклеотидные ингибиторы miR-155 в соответствии с настоящим изобретением снижают или ингибируют пролиферацию клеток злокачественной опухоли и/или индуцируют апоптоз клеток злокачественной опухоли. В другом варианте осуществления олигонуклеотидные ингибиторы осуществляют повышающую регуляцию одного или нескольких генов-мишеней miR-155 в клетках злокачественной опухоли.
[0016] Настоящее изобретение также относится к композициям, содержащим олигонуклеотидные ингибиторы miR-155, и их использованию. В одном из вариантов осуществления изобретение относится к способам лечения злокачественной опухоли у нуждающегося в этом субъекта, включающим введение субъекту терапевтически эффективного количества олигонуклеотидного ингибитора miR-155 по настоящему изобретению. Активность или функцию miR-155 снижают в клетках злокачественной опухоли после введения олигонуклеотидного ингибитора. В одном из вариантов осуществления злокачественная опухоль представляет собой кожную T-клеточную лимфому (CTCL). В некоторых вариантах осуществления способы лечения злокачественной опухоли включают введение субъекту терапевтически эффективного количества олигонуклеотидного ингибитора miR-155 по изобретению и терапевтически эффективного количества второго терапевтического средства, такого как ретиноид или ингибитор гистондеацетилазы (HDAC).
[0017] В одном из вариантов осуществления изобретение относится к способам снижения или ингибирования пролиферации озлокачествленных T-клеток, которые включают введение олигонуклеотидного ингибитора miR-155 в соответствии с изобретением. Активность или функцию miR-155 снижают в озлокачествленных T-клетках после введения олигонуклеотидного ингибитора.
КРАТКОЕ ОПИСАНИЕ ФИГУР
[0018] На фиг. 1 представлена абсолютная экспрессия miR-155-5p в различных клеточных линиях CTCL по сравнению с нормальными периферическими CD4+ T-хелперными клетками, как измеряют посредством количественной ПЦР в реальном времени.
[0019] На фиг. 2 приведено представление изменений экспрессии генов на «тепловой карте» для 9 генов-мишеней для miR-155 в различных CTCL клетках в ответ на обработку с использованием 10 мкМ одного из четырех соединений против miR-155 в течение 72 часов.
[0020] На фиг. 3A представлена кратность изменения экспрессии четырех генов-мишеней miR-155 в ответ на обработку с использованием 2 мкМ соединений против miR-155 в течение 72 часов в клетках HuT102. На фиг. 3B представлена кратность изменения экспрессии четырех генов-мишеней miR-155 в ответ на обработку с использованием 10 мкМ соединений против miR-155 в течение 72 часов в клетках HuT102. На фиг. 3C представлена кратность изменения экспрессии четырех генов-мишеней miR-155 в ответ на обработку с использованием 50 мкМ соединений против miR-155 в течение 72 часов в клетках HuT102. На фиг. 3D представлена кратность изменения экспрессии четырех генов-мишеней miR-155 в ответ на обработку с использованием 2 мкМ соединений против miR-155 в течение 96 часов в клетках HuT102. На фиг. 3E представлена кратность изменения экспрессии четырех генов-мишеней miR-155 в ответ на обработку с использованием 10 мкМ соединений против miR-155 в течение 96 часов в клетках HuT102. На фиг. 3F представлена кратность изменения экспрессии четырех генов-мишеней miR-155 в ответ на обработку с использованием 50 мкМ соединений против miR-155 в течение 96 часов в клетках HuT102. * p-значение < 0,0001 по сравнению с необработанными по непараметрическому критерию Манна-Уитни.
[0021] На фиг. 4A представлена кратность изменения экспрессии четырех генов-мишеней miR-155 в ответ на обработку с использованием 2 мкМ соединений против miR-155 в течение 72 часов в клетках MJ. На фиг. 4B представлена кратность изменения экспрессии четырех генов-мишеней miR-155 в ответ на обработку с использованием 10 мкМ соединений против miR-155 в течение 72 часов в клетках MJ. На фиг. 4C представлена кратность изменения экспрессии четырех генов-мишеней miR-155 в ответ на обработку с использованием 50 мкМ соединений против miR-155 в течение 72 часов в клетках MJ. На фиг. 4D представлена кратность изменения экспрессии четырех генов-мишеней miR-155 в ответ на обработку с использованием 2 мкМ соединений против miR-155 в течение 96 часов в клетках MJ. На фиг. 4E представлена кратность изменения экспрессии четырех генов-мишеней miR-155 в ответ на обработку с использованием 10 мкМ соединений против miR-155 в течение 96 часов в клетках MJ. На фиг. 4F представлена кратность изменения экспрессии четырех генов-мишеней miR-155 в ответ на обработку с использованием 50 мкМ соединений против miR-155 в течение 96 часов в клетках MJ. * p-значение < 0,0001 по сравнению с необработанными по непараметрическому критерию Манна-Уитни.
[0022] На фиг. 5A представлена кратность изменения экспрессии четырех генов-мишеней miR-155 в ответ на обработку с использованием 2 мкМ соединений против miR-155 в течение 72 часов в клетках HH. На фиг. 5B представлена кратность изменения экспрессии четырех генов-мишеней miR-155 в ответ на обработку с использованием 10 мкМ соединений против miR-155 в течение 72 часов в клетках HH. На фиг. 5C представлена кратность изменения экспрессии четырех генов-мишеней miR-155 в ответ на обработку с использованием 50 мкМ соединений против miR-155 в течение 72 часов в клетках HH. На фиг. 5D представлена кратность изменения экспрессии четырех генов-мишеней miR-155 в ответ на обработку с использованием 2 мкМ соединений против miR-155 в течение 96 часов в клетках HH. На фиг. 5E представлена кратность изменения экспрессии четырех генов-мишеней miR-155 в ответ на обработку с использованием 10 мкМ соединений против miR-155 в течение 96 часов в клетках HH. На фиг. 5F представлена кратность изменения экспрессии четырех генов-мишеней miR-155 в ответ на обработку с использованием 50 мкМ соединений против miR-155 в течение 96 часов в клетках HH. * p-значение < 0,0001 по сравнению с необработанными по непараметрическому критерию Манна-Уитни.
[0023] На фиг. 6A представлена кратность изменения экспрессии четырех генов-мишеней miR-155 в ответ на обработку с использованием 2, 10, и 50 мкМ соединений против miR-155 в течение 72 часов в клетках My-LA. На фиг. 6B представлена кратность изменения экспрессии четырех генов-мишеней miR-155 в ответ на обработку с использованием 2, 10, и 50 мкМ соединений против miR-155 в течение 96 часов в клетках My-La. * p-значение < 0,0001 по сравнению с необработанными по непараметрическому критерию Манна-Уитни.
[0024] На фиг. 7A представлена кратность изменения экспрессии четырех генов-мишеней miR-155 в ответ на обработку с использованием 2 мкМ соединений против miR-155 в течение 72 часов в клетках HuT78. На фиг. 7B представлена кратность изменения экспрессии четырех генов-мишеней miR-155 в ответ на обработку с использованием 10 мкМ соединений против miR-155 в течение 72 часов в клетках HuT78. На фиг. 7C представлена кратность изменения экспрессии четырех генов-мишеней miR-155 в ответ на обработку с использованием 50 мкМ соединений против miR-155 в течение 72 часов в клетках HuT78. На фиг. 7D представлена кратность изменения экспрессии четырех генов-мишеней miR-155 в ответ на обработку с использованием 2 мкМ соединений против miR-155 в течение 96 часов в клетках HuT78. На фиг. 7E представлена кратность изменения экспрессии четырех генов-мишеней miR-155 в ответ на обработку с использованием 10 мкМ соединений против miR-155 в течение 96 часов в клетках HuT78. На фиг. 7F представлена кратность изменения экспрессии четырех генов-мишеней miR-155 в ответ на обработку с использованием 50 мкМ соединений против miR-155 в течение 96 часов в клетках HuT78.
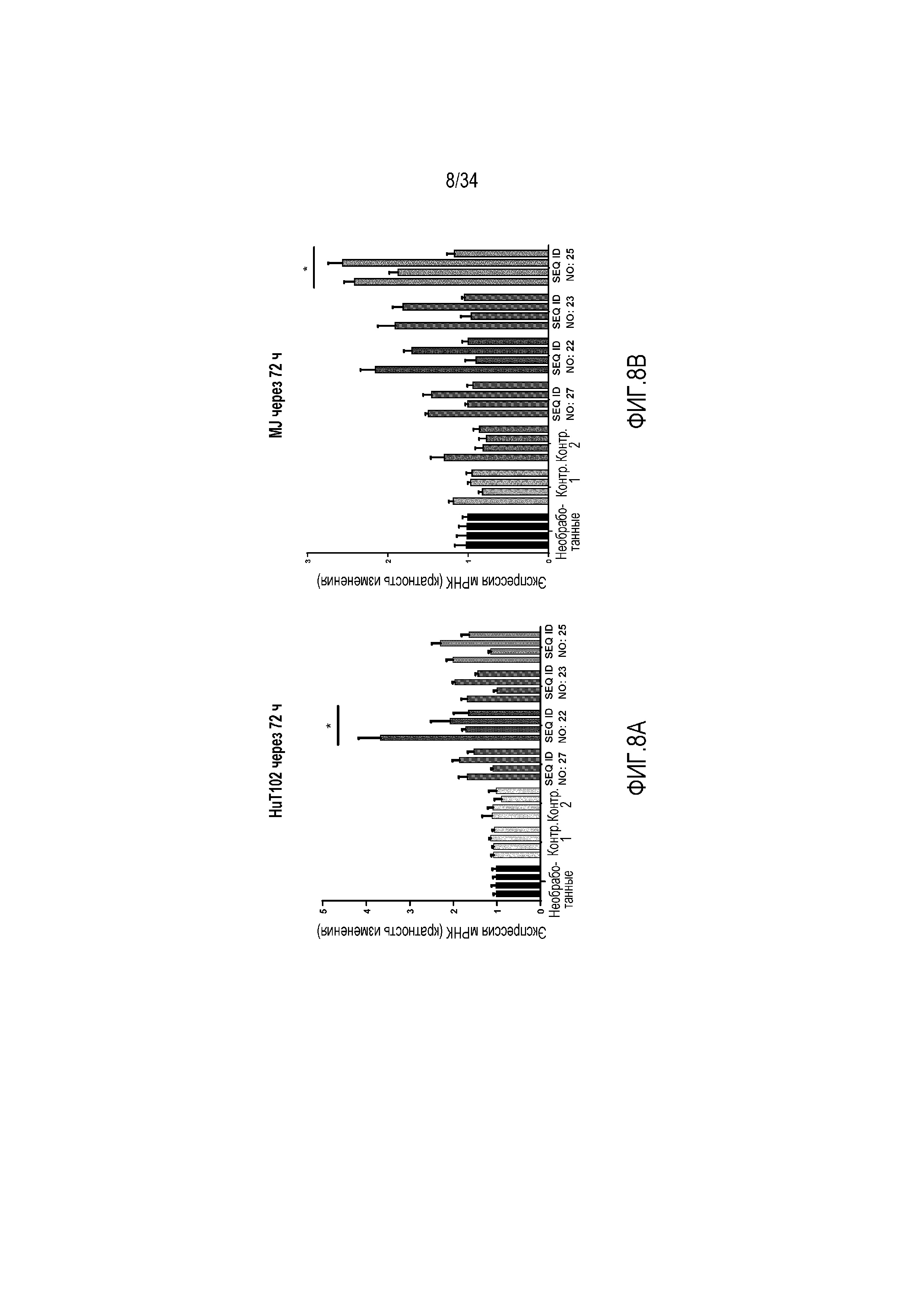
[0025] На фиг. 8A представлена кратность изменения экспрессии четырех генов-мишеней miR-155 в ответ на обработку с использованием 10 мкМ соединений против miR-155 или контрольных олигонуклеотидов в клетках HuT102. На фиг. 8B представлена кратность изменения экспрессии четырех генов-мишеней miR-155 в ответ на обработку с использованием 10 мкМ соединений против miR-155 или контрольных олигонуклеотидов в клетках MJ. * p-значение < 0,0001 по сравнению с необработанными по непараметрическому критерию Манна-Уитни.
[0026] На фиг. 9 представлена тепловая карта дифференциальной сигнатуры генной экспрессии в клетках MJ, которые обрабатывали соединениями против miR-155 в течение 4 или 8 суток. Клетки MJ, которые обрабатывали с использованием соединений против miR-155, подвергали определению профиля экспрессии полного генома. Дифференциальную сигнатуру экспрессии фильтровали по генам, которые значительно менялись, при p-значении ≤ 0,05, скорректированном по уровню ложноположительных результатов.
[0027] На фиг. 10 представлена тепловая карта дифференциальной сигнатуры генной экспрессии в клетках HuT102, которые обрабатывали соединениями против miR-155 в течение 4 или 8 суток. Клетки HuT102, которые обрабатывали соединениями против miR-155, подвергали определению профиля экспрессии полного генома. Дифференциальную сигнатуру экспрессии фильтровали по генам, которые значительно менялись, при p-значении ≤ 0,05, скорректированном по уровню ложноположительных результатов.
[0028] На фиг. 11A представлена аннотация профиля генной экспрессии для генов, находящихся под повышающей регуляцией в ответ на соединения против miR-155 как в клетках MJ, так и в клетках HuT102. Генная сигнатура обогащена непосредственными мишенями, совпадающими с последовательностью-затравкой miR-155, с гипергеометрическим p-значением для обогащения 1,6e-25. Гены, идентифицированные здесь, значительно менялись при обработке соединениями против miR-155 по сравнению с необработанной группой при p-значении ≤ 0,05, скорректированном по уровню ложноположительных результатов. На фиг. 11B представлен график функции кумулятивного распределения дифференциальной экспрессии непосредственных генов-мишеней miR-155, содержащих 8-, 7- или 6-нуклеотидные последовательности-затравки, по сравнению с транскриптами, не содержащими последовательность-затравку. Приведенные p-значения являются результатом критерия Колмогорова-Смирнова для определения значимого различия между двумя массивами данных.
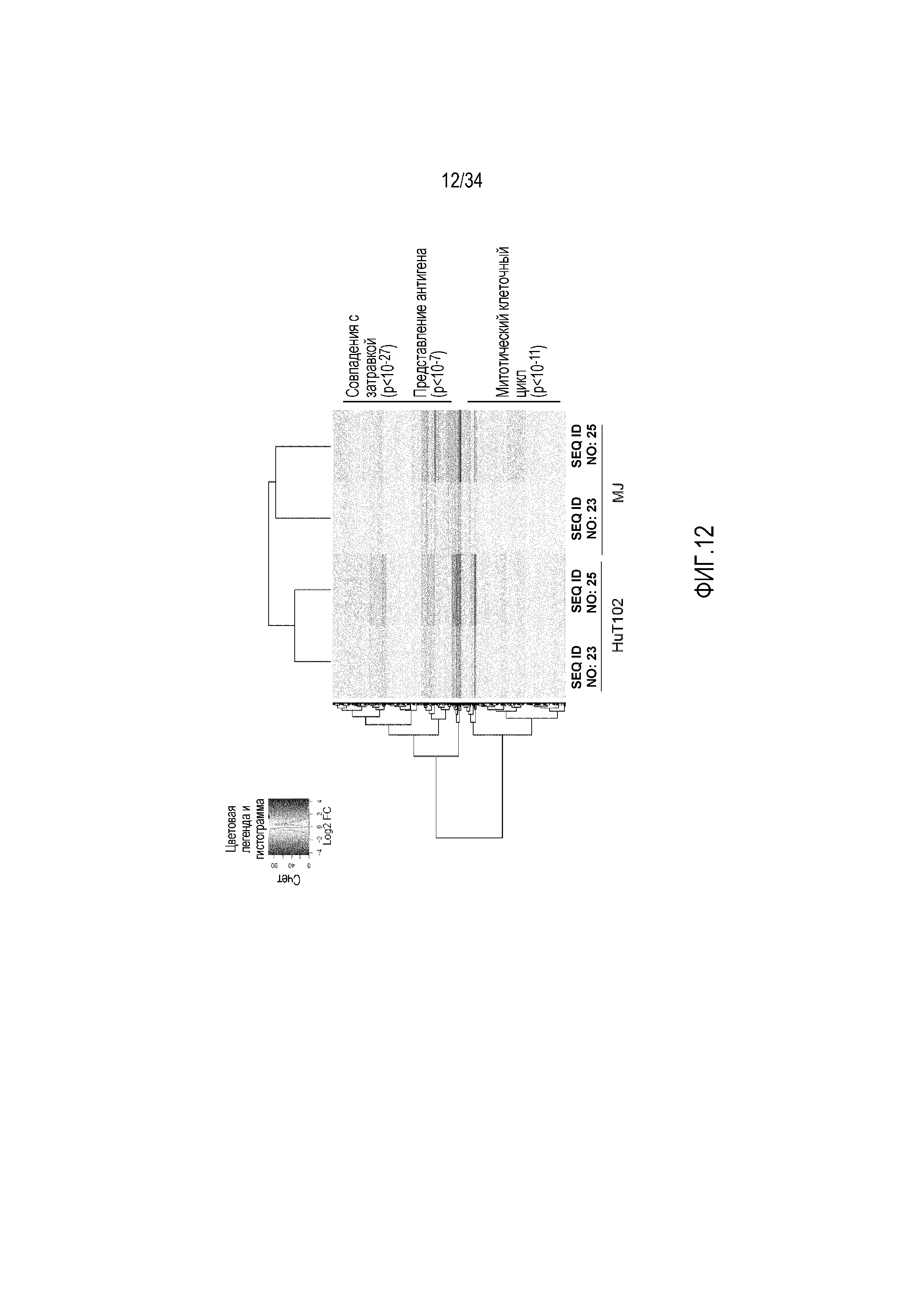
[0029] На фиг. 12 представлен аннотированный профиль генной экспрессии генов, находящихся под повышающей или понижающей регуляцией в ответ на обработку соединениями против miR-155 в течение 8 суток как в клетках MJ, так и в клетках HuT102.
[0030] На фиг. 13 представлен профиль экспрессии генов, находящихся под повышающей или понижающей регуляцией в ответ на 8 суток обработки соединением против miR-155, имеющим последовательность SEQ ID NO: 25, в CTCL клетках.
[0031] На фиг. 14A представлен эффект соединений против miR-155, оказываемый на пролиферацию клеток HuT102. На фиг. 14B представлен эффект соединений против miR-155, оказываемый на активность каспазы 3/7 в клетках HuT102.
[0032] На фиг. 15A представлена пролиферация клеток HuT102 в ответ на различные концентрации соединений против miR-155 в сутки 8 обработки. На фиг. 15B представлена активность каспазы 3/7 в клетках HuT102 в ответ на различные концентрации соединений против miR-155 в сутки 8 обработки.
[0033] На фиг. 16A представлен эффект соединений против miR-155, оказываемый на пролиферацию клеток HuT102. На фиг. 16B представлен эффект соединений против miR-155, оказываемый на активность каспазы 3/7 в клетках HuT102.
[0034] На фиг. 17A представлен эффект соединений против miR-155, оказываемый на пролиферацию клеток My-La. На фиг. 17B представлен эффект соединений против miR-155, оказываемый на активность каспазы 3/7 в клетках My-La.
[0035] На фиг. 18A представлена пролиферация клеток My-La в ответ на различные концентрации соединений против miR-155 в сутки 8 обработки. На фиг. 18B представлена активность каспазы 3/7 в клетках My-La в ответ на различные концентрации соединений против miR-155 в сутки 8 обработки.
[0036] На фиг. 19A представлен эффект 10 мкМ соединений против miR-155 и 0,25 мкМ ингибитора HDAC, оказываемый на пролиферацию клеток HuT102. На фиг. 19B представлен эффект 10 мкМ соединений против miR-155 и 0,50 мкМ ингибитора HDAC, оказываемый на пролиферацию клеток HuT102.
[0037] На фиг. 20A представлен эффект 10 мкМ соединений против miR-155 и 0,25 мкМ ингибитора HDAC, оказываемый на активность каспазы 3/7 в клетках HuT102. На фиг. 20B представлен эффект 10 мкМ соединений против miR-155 и 0,50 мкМ ингибитора HDAC, оказываемый на активность каспазы 3/7 в клетках HuT102.
[0038] На фиг. 21 представлена тепловая карта изменений экспрессии 587 генов, находящихся под повышающей или понижающей регуляцией, во всех трех клеточных линиях грибовидного микоза человека в сутки 4 или сутки 8 в ответ на соединение 4 (SEQ ID NO: 25).
[0039] На фиг. 22 представлена активность олигонуклеотидных ингибиторов против miR-155 различной длины, измеряемая с использованием двойной люциферазной репортерной плазмиды, содержащей сайт связывания miR-155.
[0040] На фиг. 23A, 23B, 23C и 23D представлена активность олигонуклеотидных ингибиторов против miR-155, содержащих различное число модификаций замкнутых нуклеотидов, измеряемая с использованием двойной люциферазной репортерной плазмиды, содержащей сайт связывания miR-155.
[0041] На фиг. 24A, 24B, 24C, и 24D представлена активность олигонуклеотидных ингибиторов против miR-155, содержащих модификации замкнутых нуклеотидов в различных положениях, измеряемая с использованием двойной люциферазной репортерной плазмиды, содержащей сайт связывания miR-155.
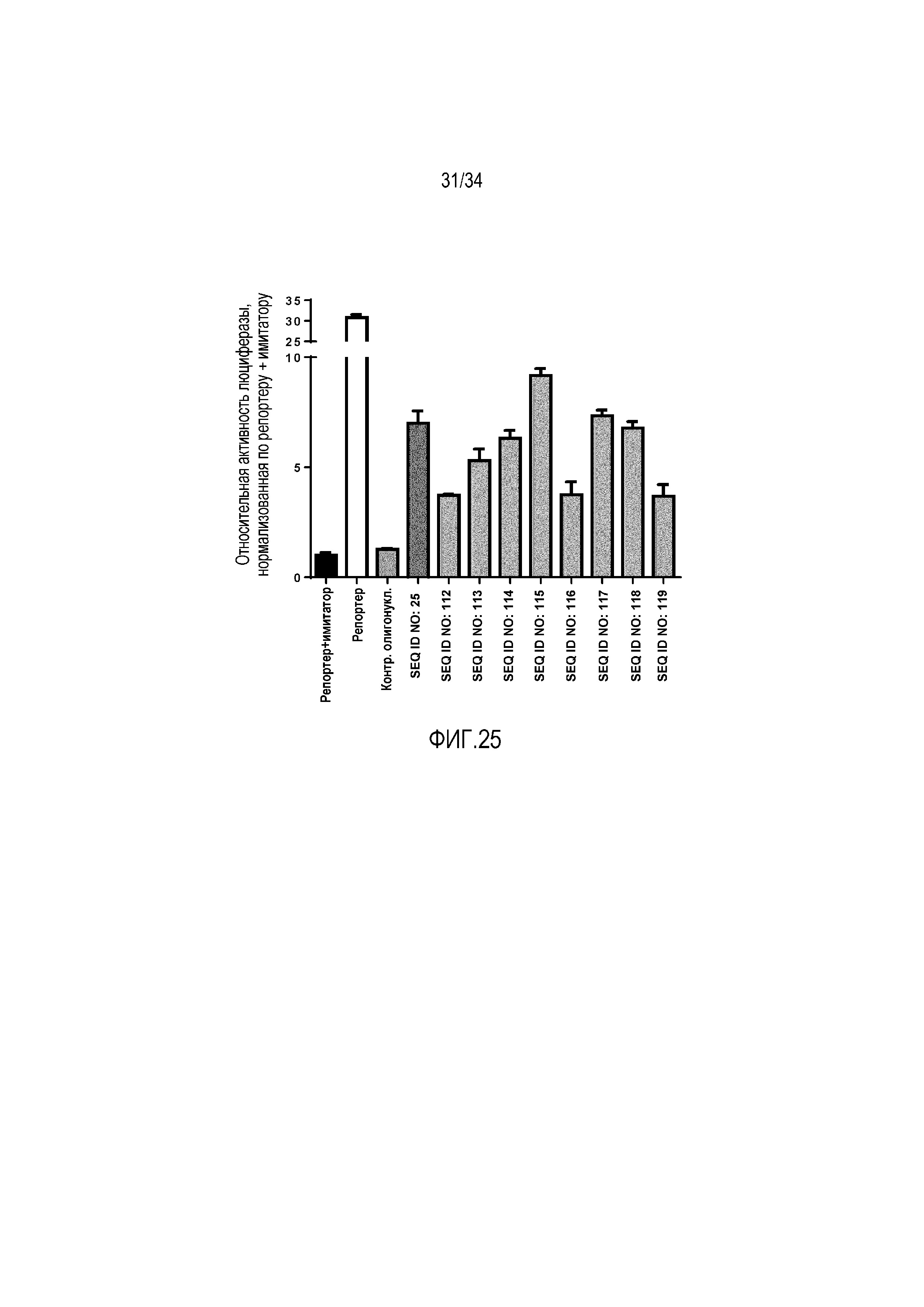
[0042] На фиг. 25 представлена активность олигонуклеотидных ингибиторов против miR-155, содержащих различные модификации нуклеотидов, измеряемая с использованием двойной люциферазной репортерной плазмиды, содержащей сайт связывания miR-155.
[0043] На фиг. 26 представлена активность различных олигонуклеотидных ингибиторов длиной 14 нуклеотидов против miR-155, измеряемая с использованием двойной люциферазной репортерной плазмиды, содержащей сайт связывания miR-155.
[0044] На фиг. 27 представлена активность олигонуклеотидных ингибиторов SEQ ID NO: 25 и 23 против miR-155, измеряемая с использованием двойной люциферазной репортерной плазмиды, содержащей сайт связывания miR-155.
[0045] На фиг. 28 представлена кратность изменения экспрессии генов-мишеней miR-155 в ответ на обработку олигонуклеотидными ингибиторами SEQ ID NO: 25 и 120.
ПОДРОБНОЕ ОПИСАНИЕ
[0046] Все патентные и непатентные документы, упомянутые на всем протяжении этого раскрытия, включены по ссылке в настоящее описание в полном объеме.
[0047] Настоящее изобретение предусматривает олигонуклеотидные ингибиторы, которые ингибируют активность или функцию miR-155 в клетках злокачественной опухоли. У человека в хромосоме 21 человека расположен ген-хозяин MIR155, или MIR155HG, который кодирует miR-155. Поскольку оба плеча предшественника miR-155 могут давать начало зрелой мкРНК, продукты процессинга предшественника miR-155 обозначают как miR-155-5p (из 5'-плеча) и miR-155-3p (из 3'-плеча). Зрелые последовательности для miR-155-5p и miR-155-3p человек приведены далее:
Зрелая miR-155-5p человека (SEQ ID NO: 1)
5'-UUAAUGCUAAUCGUGAUAGGGGU-3'
Зрелая miR-155-3p человека (SEQ ID NO: 2)
5'-CUCCUACAUAUUAGCAUUAACA-3'
[0048] miR-155-5p экспрессируется в гематопоэтических клетках, включая B-клетки, T-клетки, моноциты и гранулоциты (Landgraf et al. 2007). miR-155-5p является важной молекулой для контроля как миелопоэза, так и эритропоэза. Эта мкРНК высоко экспрессирована в гематопоэтических стволовых клетках-предшественниках на стадии ранних стволовых предшественников и блокирует их дифференцировку в более зрелые гематопоэтические клетки (например, лимфоциты, эритроциты). Экспрессия miR-155-5p постепенно снижается по мере созревания клеток в этих линиях дифференцировки и приблизительно в 200 раз ниже в зрелых гематопоэтических клетках (Masaki et al. 2007; Gerloff et al. 2015).
[0049] miR-155-5p играет важную роль в опосредовании воспалительных и иммунных ответов. Мыши, не имеющие miR-155-5p, демонстрируют нормальное число и распределение субпопуляций T- и B-лимфоцитов, но дефектный иммунный ответ, в частности, в отношении регуляции дифференцировки T-хелперных клеток и реакции зародышевого центра, чтобы вызывать оптимальное T-клеточно-зависимое образование антител (Rodriguez et al. 2007; Thai et al. 2007). miR-155-5p управляет дифференцировкой CD4+ T-клеток в субпопуляции T-хелперных клеток 1 типа (Th1), Th2 и Th17 и влияет на развитие регуляторных T-клеток (Treg) (Baumjohann and Ansel 2013). miR-155-5p также регулирует ответы эффекторных и CD8+ T-клеток памяти на вирусную инфекцию (Dudda et al. 2013; Gracias et al. 2013), а также дифференцировку нормальных B-клеток и образование антител. У человека экспрессия miR-155-5p на низком уровне в нелимфоидных органах, а также в покоящихся наивных CD4+ T-клетках. Экспрессию miR-155-5p значительно повышает антигенная стимуляция рецепторов B- и T-клеток (Tam 2001; Haasch et al. 2002; van den Berg et al. 2003; Rodriguez et al. 2007; Thai et al. 2007; Vigorito et al. 2007; Banerjee et al. 2010) и стимуляция агонистами Toll-подобных рецепторов макрофагов и дендритных клеток (Taganov et al. 2006; O'Connell et al. 2007; Ceppi et al. 2009; Mao et al. 2011). Активация MIR155HG включает как AP1-, так и NF-κB-опосредованные механизмы.
[0050] Кожные бляшки или опухоли у пациентов с диагнозом фунгоидного микоза (MF), который является подтипом CTCL, имеют повышенные уровни miR-155-5p. О повышенной miR-155-5p в биоптатах кожи MF пациентов по сравнению с контрольными биоптатами кожи сообщали несколько групп (van Kester et al. 2011; Maj et al. 2012; Kopp et al. 2013b; Moyal et al. 2013). В одном исследовании уровни miR-155-5p были повышены в 4,16 раза биоптатах на стадии опухоли по сравнению с биоптатами раннего MF (Moyal et al. 2013), что подсказывает, что уровни miR-155-5p могут коррелировать с прогрессированием заболевания. Во втором исследовании, направленном на идентификацию конкретных типов клеток, которые экспрессируют miR-155-5p, обнаруживали экспрессию мкРНК как в озлокачествленных, так и в не озлокачествленных T-клетках в CTCL повреждениях (Kopp et al. 2013b).
[0051] Фунгоидный микоз (MF) представляет собой самый распространенный подтип CTCL, который насчитывает 50-70% всех первичных кожных лимфом. Вторым наиболее распространенным подтипом является синдром Сезари (SS), который составляет 15% случаев CTCL. MF отличается пролиферацией атипичных T-лимфоцитов размером от небольшого до среднего с церебриформными ядрами, которые образуют очаги, бляшки или узелковые опухоли в эпидермисе. MF обычно поражает пожилых взрослых (медианный возраст диагноза: 55-60) и индолентное клиническое течение, при котором очаги и бляшки предшествуют формированию опухолей или сопутствуют ему. В некоторых случаях опухолей на поздних стадиях наблюдают вовлечение лимфатических узлов и висцеральных органов. Во время MF на стадии опухоли кожные инфильтраты становятся более диффузными, и эпидермотропизм атипичных T-клеток может быть утрачен. В отличие от этого, SS является более агрессивной лейкозной формой CTCL, которая отличается обширным покраснением и шелушением кожи (эритродермия), увеличенными лимфатическими узлами и злокачественными клетками в периферической циркуляции (Yamashita et al., 2012; Jawed et al. 2014).
[0052] Молекулярный анализ MF на стадии опухоли выявил значительные изменения в экспрессии генов по сравнению с нормальной кожей, воспаленной кожей и нормальными T-клетками (van Kester et al. 2012), несмотря на то, что генетическое или эпигенетическое происхождение этих различий в экспрессии генов не известно. Ранние повреждения кожи содержат множество воспалительных клеток, в том числе T-клеток, с нормальным фенотипом, а также небольшую популяцию T-клеток с аномальной морфологие и озлокачествленным фенотипом. Инфильтрат в первую очередь состоит из неозлокачествленных Th1 клеток, регуляторных T-клеток и цитотоксических CD8+ T-клеток. Озлокачествленные T-клетки обычно представляют собой CD4+ T-клетки памяти клонального происхождения. Во время развития заболевания, эпидермотропизм постепенно исчезает, чему сопутствует увеличение озлокачествленных CD4+ T-клеток и уменьшение неозлокачествленных CD8+ T-клеток.
[0053] CTCL отличается аберрантной экспрессией и функцией факторов транскрипции и регуляторов сигнальной трансдукции. Существует гипотеза о том, что нарушенная функциональная регуляция сигнальных молекул и цитокинов играет ключевую роль в злокачественной трансформации и патогенезе CTCL (Girardi et al., 2004; Zhang et al., 2006; van Doorn et al., 2009; Kadin and Vonderheid, 2010). Наблюдали значимые различия в профилях генной экспрессии клеток при MF и SS, что соответствует четко выраженному патогенезу для этих вариантов CTCL (van Doorn et al., 2009; Campbell et al., 2010). В последнее время сообщалось о различной экспрессии микроРНК (мкРНК) и ее потенциальном вовлечении в патогенез CTCL. miR-155-5p входит в мкРНК, которые находятся под наиболее выраженной повышающей регуляцией при фунгоидном микозе (Kopp et al, 2013a; Kopp et al., 2013b), тогда как синдром Сезари отличает четкая подгруппа мкРНК с нарушенной регуляцией, а miR-155-5p не находится под повышающей регуляцией при этом подтипе CTCL (Ballabio et al., 2010).
[0054] Настоящее изобретение предусматривает олигонуклеотидные ингибиторы, которые снижают или ингибируют активность или функцию miR-155 человека. В контексте настоящего изобретения термин «олигонуклеотидный ингибитор», «против miR» (например, против miR-155), «антагонист», «антисмысловой олигонуклеотид или ASO», «олигомер», «олигонуклеотид против микроРНК или AMO» или «миксмер» используют широко, и он охватывает олигомер, содержащий рибонуклеотиды, дезоксирибонуклеотиды, модифицированные рибонуклеотиды, модифицированные дезоксирибонуклеотиды или их сочетание, который ингибирует активность или функцию микроРНК-мишень (мкРНК) посредством полной или частичной гибридизации с мкРНК, тем самым подавляя функцию или активность мкРНК-мишени.
[0055] Термин «miR-155», как используют в настоящем описании, включает первичную miR-155, предшественник miR-155, miR-155-5p и hsa-miR-155-5p.
[0056] В одном из вариантов осуществления настоящее изобретение предусматривает олигонуклеотидный ингибитор miR-155, который имеет длину от 11 до 16 нуклеотидов. В некоторых других вариантах осуществления настоящее изобретение предусматривает олигонуклеотидный ингибитор miR-155, который имеет длину от 11 до 14 нуклеотидов. В различных вариантах осуществления, олигонуклеотидный ингибитор, направленный на miR-155, составляет 11, 12, 13, 14, 15 или 16 нуклеотидов в длину. В одном из вариантов осуществления олигонуклеотидный ингибитор miR-155 имеет длину 12 нуклеотидов. В другом варианте осуществления олигонуклеотидный ингибитор miR-155 имеет длину 14 нуклеотидов.
[0057] Последовательность олигонуклеотидного ингибитора miR-155 в соответствии с изобретением достаточно комплементарна зрелой последовательности miR-155-5p, чтобы образовывать гибрид с miR-155-5p при физиологических условиях и ингибировать активность или функцию miR-155-5p в клетках субъекта. Например, в некоторых вариантах осуществления олигонуклеотидные ингибиторы содержат последовательность, которая по меньшей мере частично комплементарна зрелой последовательности miR-155-5p, например, по меньшей мере приблизительно на 75%, 80%, 85%, 90%, 95%, 96%, 97%, 98% или 99% комплементарна зрелой последовательности miR-155-5p. В некоторых вариантах осуществления олигонуклеотидный ингибитор может быть по существу комплементарен зрелой последовательности miR-155-5p, то есть по меньшей мере приблизительно на 90%, 95%, 96%, 97%, 98% или 99% комплементарен зрелой последовательности miR-155-5p. В одном из вариантов осуществления олигонуклеотидный ингибитор содержит последовательность, которая на 100% или полностью комплементарна зрелой последовательности miR-155-5p. Понятно, что последовательность олигонуклеотидного ингибитора считают комплементарной miR-155, даже если олигонуклеотидная последовательность содержит модифицированный нуклеотид вместо нуклеотида, встречающегося в природе. Например, если зрелая последовательность miR-155 содержит нуклеотид гуанозин в конкретном положении, олигонуклеотидный ингибитор может содержать модифицированный нуклеотид цитидин, такой как замкнутый нуклеотид цитидин или 2'-фтор-цитидин, в соответствующем положении.
[0058] Термин «приблизительно», как используют в настоящем описании, охватывает вариации +/- 10% и более предпочтительно +/- 5%, насколько такие вариации подходят для практической реализации настоящего изобретения.
[0059] В некоторых вариантах осуществления вся последовательность олигонуклеотидного ингибитора miR-155 полностью комплементарна зрелой последовательности miR-155-5p человека. В различных вариантах осуществления зрелая последовательность miR-155-5p человека, которой последовательность олигонуклеотидного ингибитора по настоящему изобретению частично, по существу или полностью комплементарна, содержит нуклеотиды 1-17, или нуклеотиды 2-17, или нуклеотиды 2-16, или нуклеотиды 2-15, или нуклеотиды 2-14, или нуклеотиды 2-13, или нуклеотиды 2-12 с 5'-конца SEQ ID NO: 1. В одном из вариантов осуществления зрелая последовательность miR-155-5p человека, которой последовательность олигонуклеотидного ингибитора по настоящему изобретению частично, по существу или полностью комплементарна, содержит нуклеотиды 2-15 с 5'-конца SEQ ID NO: 1. В другом варианте осуществления зрелая последовательность miR-155-5p человека, которой последовательность олигонуклеотидного ингибитора по настоящему изобретению частично, по существу или полностью комплементарна, содержит нуклеотиды 2-13 с 5'-конца SEQ ID NO: 1.
[0060] В одном из вариантов осуществления олигонуклеотидный ингибитор miR-155 содержит по меньшей мере одну модификацию остова, такую как по меньшей мере одну фосфоротиоатную, морфолино или фосфонокарбоксилатную межнуклеотидную связь (см., например, патенты США №№ 6693187 и 7067641, которые включены в настоящее описание посредством ссылки во всей их полноте). В определенных вариантах осуществления олигонуклеотидный ингибитор miR-155 содержит только фосфоротиоатные связи.
[0061] В одном из вариантов осуществления олигонуклеотидный ингибитор miR-155 содержит по меньшей мере один модифицированный нуклеотид. В некоторых вариантах осуществления олигонуклеотидный ингибитор содержит по меньшей мере 5, 6, 7, 8, 9, 10 или больше модифицированных нуклеотидов. Термин «модифицированный нуклеотид», как используют в настоящем описании, охватывает нуклеотиды с модификациями сахара, основания и/или остова. Примеры модифицированных нуклеотидов включают, но не ограничиваясь этим, замкнутые нуклеотиды (LNA), нуклеотиды с этиленовым мостиком (ENA), бициклический нуклеотид с 2′-C-мостиком (CBBN), 2′,4′-ограниченную этилнуклеиновую кислоту, называемую S-cEt или cEt, 2′-4′-карбоциклическую LNA и 2'-замещенные нуклеотиды.
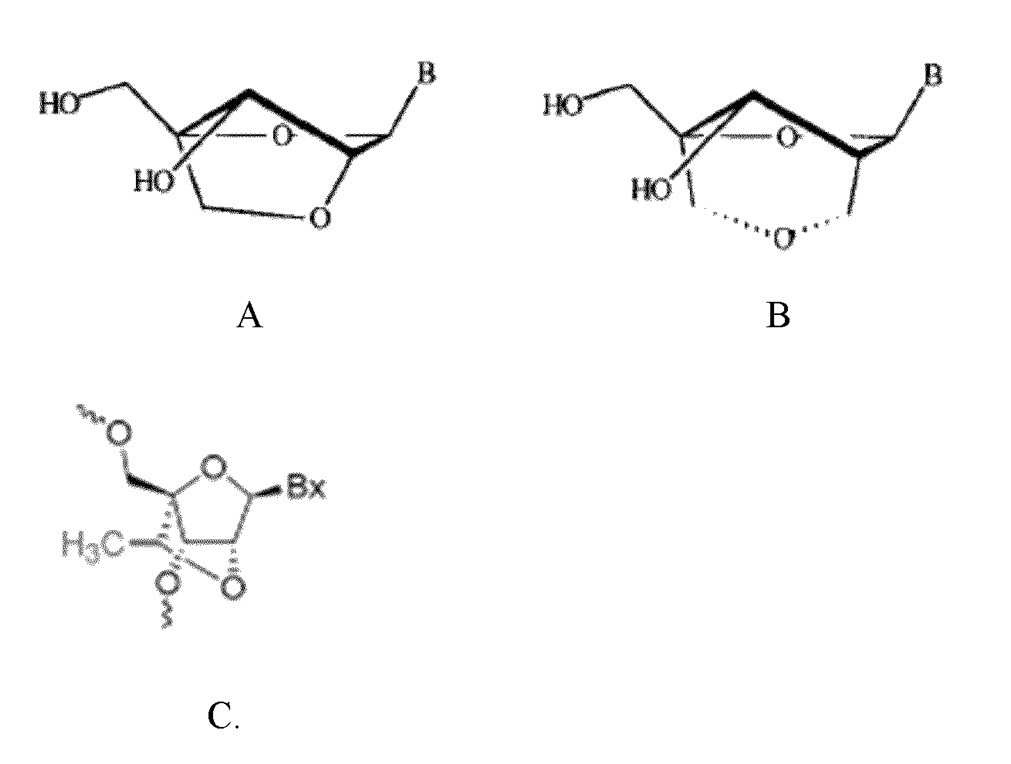
[0062] Термины «замкнутый нуклеотид», «замкнутое звено нуклеиновой кислоты» «замкнутый остаток нуклеиновой кислоты» или «звено LNA» можно использовать взаимозаменяемо на всем протяжении раскрытия, и они относятся к бициклическому аналогу нуклеозида. Например, подходящие олигонуклеотидные ингибиторы могут содержать одну или несколько «конформационно ограниченных» модификаций или модификаций нуклеозидов бициклическими сахарами (BSN), которые придают повышенную тепловую стабильность комплексам, образуемым между олигонуклеотидом, содержащим BSN, и комплементарной ему цепью-мишенью. В одном из вариантов осуществления олигонуклеотидные ингибиторы содержат замкнутые нуклеотиды или LNA, содержащие 2'-O, 4'-C-метиленрибонуклеозид (структура A), в котором фрагмент сахара рибозы находится в «замкнутой» конформации. В другом варианте осуществления олигонуклеотидные ингибиторы содержат по меньшей мере один 2'-дезоксирибонуклеозид с 2'-C, 4'-C-мостиком (структура B). См., например, патент США № 6403566 и Wang et al. (1999) Bioorganic and Medicinal Chemistry Letters, том 9: 1147-1150, которые включены в настоящее описание посредством ссылки в полном объеме. В еще одном другом варианте осуществления олигонуклеотидные ингибиторы содержат по меньшей мере один модифицированный нуклеозид, имеющий структуру, представленную структурой C. Олигонуклеотидные ингибиторы, нацеленные на miR-155, могут содержать комбинации BSN (LNA, 2'-дезоксирибонуклеозида с 2'-C, 4'-C-мостиком и т. п.) или другие модифицированные нуклеотиды и рибонуклеотиды или дезоксирибонуклеотиды.
[0063] Термины «не LNA нуклеотид», и «не LNA модификация», как используют в настоящем описании, относятся к нуклеотиду, отличному от LNA нуклеотида, т.е. термины включают ДНК нуклеотид, РНК нуклеотид, а также модифицированный нуклеотид, где основание и/или сахар модифицированы, за исключением того, что модификация не представляет собой LNA модификацию.

[0064] В некоторых вариантах осуществления олигонуклеотидный ингибитор miR-155 содержит по меньшей мере один нуклеотид, содержащий не LNA модификацию. Например, в одном из вариантов осуществления олигонуклеотидный ингибитор miR-155 содержит по меньшей мере один бициклический нуклеотид с 2′-C-мостиком (CBBN), как описано в публикации патентной заявки США № 2016/0010090A1 через 18 месяцев с даты приоритета («публикация '090»), которая настоящим в полном объеме включена в настоящее описание посредством ссылки. В публикации '090 описаны различные модификации CBBN, такие как 2'-CBBN, оксо CBBN, амино CBBN, тио CBBN и т. д. Все модификации CBBN, описанные в публикации '090, можно использовать в олигонуклеотидных ингибиторах по настоящему изобретению. В другом варианте осуществления не LNA модификация, присутствующая в олигонуклеотидном ингибиторе miR-155, может представлять собой модификацию нуклеиновой кислоты с этиленовым мостиком (ENA). Например, в одном из вариантов осуществления олигонуклеотидный ингибитор miR-155 содержит по меньшей мере одну нуклеиновую кислоту с этиленовым мостиком (ENA), также обозначаемую в настоящем описании как нуклеотид с этиленовым мостиком. Другие модификации с мостиками включают 2′,4′-ограниченную этилнуклеиновую кислоту, называемую S-cEt или cEt, и 2′-4′-карбоциклическую LNA (carba-LNA).
[0065] При упоминании замещения ДНК или РНК нуклеотида соответствующим замкнутым нуклеотидом в контексте настоящего изобретения, термин «соответствующий замкнутый нуклеотид» предназначен для того, чтобы обозначать, что ДНК/РНК нуклеотид заменен замкнутым нуклеотидом, содержащим то же встречающееся в природе азотистое основание, что и ДНК/РНК нуклеотид, который заменен, или то же азотистое основание, которое химически модифицировано. Например, соответствующий замкнутый нуклеотид ДНК нуклеотида, содержащего азотистое основание C, может содержать то же азотистое основание C или то же азотистое основание C, которое химически модифицировано, такое как 5-метилцитозин.
[0066] В определенных вариантах осуществления олигонуклеотидный ингибитор miR-155 содержит по меньшей мере 5, 6, 7, 8, 9, 10 или 11 замкнутых нуклеотидов. В одном из вариантов осуществления олигонуклеотидный ингибитор miR-155 содержит по меньшей мере 7, 8, 9 или 10 замкнутых нуклеотидов. В одном из вариантов осуществления по меньшей мере первые три нуклеотида с 3'-конца олигонуклеотидного ингибитора представляют собой замкнутые нуклеотиды. В другом варианте осуществления по меньшей мере первые четыре нуклеотида с 3'-конца олигонуклеотидного ингибитора представляют собой замкнутые нуклеотиды. В еще одном другом варианте осуществления первый нуклеотид с 5'-конца олигонуклеотидного ингибитора представляет собой замкнутый нуклеотид.
[0067] В определенных вариантах осуществления олигонуклеотидный ингибитор содержит по меньшей мере 1, по меньшей мере 2, по меньшей мере 3, по меньшей мере 4 или по меньшей мере 5 ДНК нуклеотидов. В одном из вариантов осуществления по меньшей мере второй нуклеотид с 5'-конца олигонуклеотидного ингибитора представляет собой ДНК нуклеотид. В другом варианте осуществления по меньшей мере второй и четвертый нуклеотиды с 5'-конца олигонуклеотидного ингибитора представляют собой ДНК нуклеотиды.
[0068] Олигонуклеотидные ингибиторы по настоящему изобретению могут содержать модифицированные нуклеотиды, которые имеют модификацию или замену основания. Природные или не модифицированные основания в РНК представляют собой пуриновые основания аденин (A) и гуанин (G) и пиримидиновые основания цитозин (C) и урацил (U) (ДНК содержит тимин (T)). Модифицированные основания, также обозначаемые как фрагменты гетероциклических оснований, включают другие синтетические и природные нуклеиновые основания, такие как 5-метилцитозин (5-me-C), 5-гидроксиметилцитозин, ксантин, гипоксантин, 2-аминоаденин, 6-метил и другие алкильные производные аденина и гуанина, 2-пропил и другие алкильные производные аденина и гуанина, 2-тиоурацил, 2-тиотимин и 2-тиоцитозин, 5-галогеноурацил и цитозин, 5-пропинилурацил и цитозин и другие алкинильные производные пиримидиновых оснований, 6-азоурацил, цитозин и тимин, 5-урацил (псевдоурацил), 4-тиоурацил, 8-галогено, 8-амино, 8-тиол, 8-тиоалкил, 8-гидроксил и другие 8-замещенные аденины и гуанины, 5-галогено (включая 5-бром, 5-трифторметил и другие 5-замещенные урацилы и цитозины), 7-метилгуанин и 7-метиладенин, 2-F-аденин, 2-аминоаденин, 8-азагуанин и 8-азааденин, 7-деазагуанин и 7-деазааденин и 3-деазагуанин и 3-деазааденин. В определенных вариантах осуществления олигонуклеотидные ингибиторы, нацеленные на miR-155, содержат одну или несколько BSN модификаций в комбинации с модификацией основания (например, 5-метилцитозин).
[0069] Олигонуклеотидные ингибиторы по настоящему изобретению могут включать нуклеотиды с фрагментами модифицированных сахаров. Репрезентативные модифицированные сахара включают карбоциклические или ациклические сахара, сахара, имеющие группы заместителей в одном или нескольких из их положений 2', 3' или 4', и сахара, имеющие заместители вместо одного или нескольких атомов водорода в сахаре. В определенных вариантах осуществления сахар модифицируют посредством наличия группы заместителя в положении 2'. В дополнительных вариантах осуществления сахар модифицируют посредством наличия группы заместителя в положении 3'. В других вариантах осуществления сахар модифицируют посредством наличия группы заместителя в положении 4'. Также предусмотрено, что сахар может иметь модификацию в больше чем одном из этих положений или что олигонуклеотидный ингибитор может иметь один или несколько нуклеотидов с модификациями сахара в одном положении и также один или несколько нуклеотидов с модификацией сахара в другом положении.
[0070] Модификации сахаров, предполагаемые в олигонуклеотидных ингибиторах по настоящему изобретению, включают, но не ограничиваясь этим, группу заместителя, выбранную из: OH; F; O-, S- или N-алкила; O-, S- или N-алкенила; O-, S- или N-алкинила; или O-алкил-O-алкила, где алкил, алкенил и алкинил могут быть замещенными или незамещенными с использованием C1-10 алкила или C2-10 алкенила и алкинила. В одном из вариантов осуществления модификация включает 2'-метоксиэтокси (2'-O-CH2CH2OCH3, который также известен как 2'-O-(2-метоксиэтил) или 2'-MOE), то есть алкоксиалкоксильную группу. Другая модификация включает 2'-диметиламинооксиэтокси, то есть группы O(CH2)2ON(CH3)2, также известную как 2'-DMAOE, и 2'-диметиламиноэтоксиэтокси (также известную в данной области как 2'-O-диметиламиноэтоксиэтил или 2'-DMAEOE), то есть 2'-O-CH2-O-CH2-N(CH3)2.
[0071] Дополнительные группы заместителей сахаров включают аллил (-CH2-CH=CH2), -O-аллил, метокси (-O-CH3), аминопропокси (-OCH2CH2CH2NH2) и фтор (F). Группы заместителей сахаров в положении 2' (2'-) могут быть в положении арабино- (вверх) или положении рибо- (вниз). Одна 2'-арабиномодификация представляет собой 2'-F. Другие схожие модификации также можно выполнять в других положениях на фрагменте сахара, в частности, в положении 3' сахара на 3'-концевом нуклеозиде или в 2'-5'-связанных олигонуклеотидах и положении 5' в 5'-концевом нуклеотиде. В определенных вариантах осуществления модификация сахара представляет собой модификации 2'-O-алкил (например 2'-O-метил, 2'-O-метоксиэтил), 2'-галогено (например, 2'-фтор, 2'-хлор, 2'-бром) и 4'-тио.
[0072] Другие модификации олигонуклеотидных ингибиторов для увеличения стабильности и усовершенствования эффекта, такие как те, что описаны в патенте США № 6838283, который включен в настоящее описание посредством ссылки в полном объеме, известны в данной области и пригодны для использования в способах по изобретению. Например, чтобы содействовать доставке и стабильности in vivo, олигонуклеотидный ингибитор может быть связан со стероидом, таким как фрагмент холестерина, витамином, жирной кислотой, углеводом или гликозидом, пептидом или другим низкомолекулярным лигандом на его 3'-конце.
[0073] В некоторых вариантах осуществления олигонуклеотидные ингибиторы по настоящему изобретению можно конъюгировать с молекулой-носителем, такой как стероид (холестерин). Молекулу-носитель прикрепляют к 3'- или 5'-концу олигонуклеотидного ингибитора или непосредственно или через группу линкера или спейсера. В различных вариантах осуществления, молекула-носитель представляет собой холестерин, производное холестерина, холевую кислоту или производное холевой кислоты. Использование молекулы-носителя, раскрытой в патенте США № 7202227, который в полном объеме включен в настоящее описание посредством ссылки, также предусмотрено. В определенных вариантах осуществления молекула-носитель представляет собой холестерин, и ее прикрепляют к 3'- или 5'-концу олигонуклеотидного ингибитора через линкер по меньшей мере из 6 углеродов. В некоторых вариантах осуществления молекулу-носитель прикрепляют к 3'- или 5'-концу олигонуклеотидного ингибитора через линкер из 6 или 9 углеродов. В некоторых вариантах осуществления линкер представляет собой расщепляемый линкер. В различных вариантах осуществления линкер содержит по существу линейный углеводородный фрагмент. Углеводородный фрагмент может содержать приблизительно от 3 приблизительно до 15 атомов углерода, и его можно конъюгировать с холестерином через относительно неполярную группу, такую как простая эфирная или простая тиоэфирная связь. В определенных вариантах осуществления углеводородный линкер/спейсер содержит необязательно замещенную C2-15 насыщенную или ненасыщенную углеводородную цепь (например, алкилен или алкенилен). Различные группы линкеров/спейсеров, описанные в публикации патентной заявки США № 2012/0128761, опубликованной через 18 месяцев с даты приоритета, которая в полном объеме включена в настоящее описание посредством ссылки, можно использовать в настоящем изобретении.
[0074] В одном из вариантов осуществления олигонуклеотидный ингибитор miR-155 содержит последовательность от 11 до 16 нуклеотидов, где олигонуклеотидный ингибитор полностью комплементарен зрелой последовательности miR-155 и имеет полный фосфоротиоатный остов; и где по меньшей мере первые три нуклеотида с 3'-конца олигонуклеотидного ингибитора представляют собой замкнутые нуклеотиды и по меньшей мере второй нуклеотид с 5'-конца олигонуклеотидного ингибитора представляет собой нуклеотид дезоксирибонуклеиновой кислоты (ДНК). В некоторых из этих вариантов осуществления, четвертый нуклеотид с 3'-конца олигонуклеотидного ингибитора также представляет собой замкнутый нуклеотид. В некоторых из этих вариантов осуществления, по меньшей мере второй и четвертый нуклеотиды с 5'-конца олигонуклеотидного ингибитора представляют собой ДНК нуклеотиды. В определенных вариантах осуществления олигонуклеотидный ингибитор miR-155 имеет длину 12 или 14 нуклеотидов. В некоторых вариантах осуществления олигонуклеотидный ингибитор содержит по меньшей мере 5, 6, 7, 8, 9 или 10 замкнутых нуклеотидов. В дополнительных вариантах осуществления по меньшей мере шестой и/или восьмой нуклеотид с 5'-конца олигонуклеотидного ингибитора представляет собой ДНК нуклеотид. В других вариантах осуществления олигонуклеотидный ингибитор содержит ДНК нуклеотиды во втором, шестом и восьмом положении с 5'-конца.
[0075] В другом варианте осуществления олигонуклеотидный ингибитор miR-155 содержит последовательность от 11 до 14 нуклеотидов, где олигонуклеотидный ингибитор полностью комплементарен зрелой последовательности miR-155 и имеет полный фосфоротиоатный остов; и где по меньшей мере первые три нуклеотида с 3'-конца указанного олигонуклеотидного ингибитора представляют собой модифицированные нуклеотиды и по меньшей мере второй нуклеотид с 5'-конца олигонуклеотидного ингибитора представляет собой модифицированный или не модифицированный нуклеотид дезоксирибонуклеиновой кислоты (ДНК).
[0076] В еще одном другом варианте осуществления, олигонуклеотидный ингибитор miR-155 содержит последовательность от 11 до 14 нуклеотидов, где олигонуклеотидный ингибитор полностью комплементарен зрелой последовательности miR-155 и имеет полный фосфоротиоатный остов; где по меньшей мере 7 нуклеотидов указанного олигонуклеотидного ингибитора представляют собой модифицированные нуклеотиды и по меньшей мере второй нуклеотид с 5'-конца олигонуклеотидного ингибитора представляет собой модифицированный или не модифицированный нуклеотид дезоксирибонуклеиновой кислоты (ДНК).
[0077] В еще одном другом варианте осуществления, олигонуклеотидный ингибитор miR-155 содержит последовательность от 11 до 14 нуклеотидов, где олигонуклеотидный ингибитор полностью комплементарен зрелой последовательности miR-155 и имеет полный фосфоротиоатный остов; и где по меньшей мере первые три нуклеотида с 3'-конца указанного олигонуклеотидного ингибитора представляют собой модифицированные нуклеотиды и по меньшей мере четвертый и пятый нуклеотиды с 5'-конца олигонуклеотидного ингибитора представляют собой модифицированные или не модифицированные нуклеотиды дезоксирибонуклеиновой кислоты (ДНК). В некоторых из этих вариантов осуществления четвертый и/или пятый ДНК нуклеотид с 5'-конца олигонуклеотидного ингибитора представляют собой не модифицированные ДНК нуклеотиды.
[0078] В некоторых вариантах осуществления, где олигонуклеотидный ингибитор составляет от 11 до 14 нуклеотидов в длину, указанный ингибитор содержит по меньшей мере 5, 6, 7, 8, 9 или 10 модифицированных нуклеотидов. В некоторых из этих вариантов осуществления олигонуклеотидный ингибитор содержит 7, 8, 9 или 10 модифицированных нуклеотидов. В некоторых вариантах осуществления, где олигонуклеотидный ингибитор составляет от 11 до 14 нуклеотидов в длину, по меньшей мере первые три нуклеотида с 3'-конца указанного олигонуклеотидного ингибитора представляют собой модифицированные нуклеотиды. В некоторых вариантах осуществления все модифицированные нуклеотиды представляют собой замкнутые нуклеотиды. В некоторых вариантах осуществления 5, 6, 7, 8, 9 или 10 модифицированных нуклеотидов, присутствующих в олигонуклеотидных ингибиторах, представляют собой комбинацию замкнутых нуклеотидов и нуклеотидов, содержащих не LNA модификации, таких как нуклеотиды с этиленовым мостиком, бициклические нуклеотиды с 2'-C-мостиком, 2'-замещенные нуклеотиды и другие модификации сахаров и/или оснований, описанные в настоящем описании.
[0079] В некоторых вариантах осуществления второй нуклеотид с 5'-конца олигонуклеотидного ингибитора представляет собой не модифицированный нуклеотид дезоксирибонуклеиновой кислоты (ДНК).
[0080] В одном из вариантов осуществления олигонуклеотидный ингибитор miR-155 содержит последовательность SEQ ID NO: 25. В другом варианте осуществления олигонуклеотидный ингибитор miR-155 содержит последовательность SEQ ID NO: 22. В еще одном другом варианте осуществления олигонуклеотидный ингибитор miR-155 содержит последовательность SEQ ID NO: 23.
[0081] В некоторых других вариантах осуществления олигонуклеотидный ингибитор miR-155 содержит последовательность, выбранную из группы, состоящей из SEQ ID NO: 33, 39, 43, 44, 47, 58, 84, 99, 111, 115 и 120.
[0082] В различных вариантах осуществления олигонуклеотидный ингибитор miR-155-5p имеет последовательность, выбранную из таблицы 1.
Таблица 1
1l=замкнутая модификация нуклеиновой кислоты; d=дезоксирибонуклеотид; s=фосфортиоатная связь; md=5-метилцитозин; e=нуклеотид с этиленовым мостиком (ENA); ab=бициклический нуклеотид с амино-2'-C-мостиком (CBBN).
[0083] Введение олигонуклеотидного ингибитора по настоящему изобретению субъекту снижает или ингибирует активность или функцию miR-155 в клетках субъекта. В одном из вариантов осуществления олигонуклеотидный ингибитор ингибирует активность или функцию miR-155 в клетках злокачественной опухоли, клетках иммунной системы, включая B- и T-лимфоциты, моноциты, макрофаги, микроглию, естественные киллерные клетки и воспалительные клетки. В одном из вариантов осуществления клетки злокачественной опухоли представляют собой озлокачествленные T-клетки. Озлокачествленные T-клетки, которые можно лечить олигонуклеотидными ингибиторами по изобретению, включают клетки кожной T-клеточной лимфомы (CTCL), CD4+ T-клетки, CD8+ T-клетки, αβ T-клетки, γδ T-клетки и T-клетки памяти. В одном из вариантов осуществления озлокачествленные T-клетки представляют собой клетки кожной T-клеточной лимфомы (CTCL).
[0084] В некоторых вариантах осуществления определенные олигонуклеотидные ингибиторы по настоящему изобретению могут демонстрировать более высокое ингибирование активности или функции miR-155 в клетках злокачественной опухоли, таких как озлокачествленные T-клетки, по сравнению с другими ингибиторами miR-155. Термин «другие ингибиторы miR-155» включает ингибиторы нуклеиновой кислоты, такие как антисмысловые олигонуклеотиды, соединения против miR, антагонисты miR, миксмеры, гэпмеры, аптамеры, рибозимы, малые интерферирующие РНК или малые шпилечные РНК; антитела или их антигенсвязывающие фрагменты; и/или лекарственные средства, которые ингибируют активность или функцию miR-155. Возможно, что конкретный олигонуклеотидный ингибитор по настоящему изобретению может демонстрировать более сильное ингибирование miR-155 в клетках злокачественной опухоли, таких как озлокачествленные T-клетки, по сравнению с другими олигонуклеотидными ингибиторами по настоящему изобретению. Термин «более сильный», как используют в настоящем описании, относится к количественно большему или статистически более значимому.
[0085] Введение олигонуклеотидного ингибитора по настоящему изобретению осуществляет повышающую регуляцию экспрессии или активности генов-мишеней miR-155 в клетках субъекта. Гены-мишени для miR-155 включают, но не ограничиваясь этим, INPP50/SHIP1, Jarid2, Picalm, Bach1, Wee1, CUX1, Cebpb, SPIB/PU.1 и IL7R. В одном из вариантов осуществления олигонуклеотидные ингибиторы по настоящему изобретению осуществляют повышающую регуляцию экспрессии или активности по меньшей мере четырех генов-мишеней miR-155 в клетках злокачественной опухоли, клетках иммунной системы, включая B- и T-лимфоциты, моноциты, макрофаги, микроглию, естественные киллерные клетки и воспалительные клетки. В некоторых вариантах осуществления четыре гена-мишени, находящиеся под повышающей регуляцией олигонуклеотидными ингибиторами по настоящему изобретению, включают Bach1, Jarid2, Picalm и SHIP1. Данное изобретение относится к использованию изменений в экспрессии этих четырех генов (сигнатуры генной экспрессии) в качестве средства определения активности ингибиторов miR-155. В некоторых вариантах осуществления имеет место приблизительно 1,25-кратное, 1,5-кратное, 2-кратное, 3-кратное, 4-кратное, 5-кратное, 6-кратное, 7-кратное или 8-кратное, включая промежуточные значения, изменение экспрессии или активности генов-мишеней miR-155 после введения олигонуклеотидных ингибиторов по настоящему изобретению. В одном из вариантов осуществления имеет место по меньшей мере приблизительно 2-кратное, 3-кратное, 4-кратное или 5-кратное, включая промежуточные значения, изменение экспрессии или активности генов-мишеней miR-155 после введения олигонуклеотидных ингибиторов по настоящему изобретению.
[0086] В одном из вариантов осуществления олигонуклеотидный ингибитор по настоящему изобретению демонстрирует более сильную повышающую регуляцию генов-мишеней miR-155 в клетках злокачественной опухоли, таких как озлокачествленные T-клетки, по сравнению с другими ингибиторами miR-155. В определенных вариантах осуществления олигонуклеотидные ингибиторы по настоящему изобретению демонстрируют более сильную повышающую регуляцию по меньшей мере четырех генов-мишеней miR-155 в клетках злокачественной опухоли по сравнению с другими ингибиторами miR-155. В одном из вариантов осуществления олигонуклеотидные ингибиторы по настоящему изобретению демонстрируют более сильную повышающую регуляцию экспрессии или активности четырех генов, а именно Bach1, Jarid2, Picalm и SHIP1, в клетках злокачественной опухоли по сравнению с другими ингибиторами miR-155. В различных вариантах осуществления, «более сильная повышающая регуляция» включает приблизительно 2-кратное, 3-кратное, 4-кратное или 5-кратное, включая промежуточные значения, увеличение экспрессии или активности генов-мишеней miR-155 по сравнению с другими ингибиторами miR-155.
[0087] В некоторых вариантах осуществления олигонуклеотидные ингибиторы по настоящему изобретению снижают или ингибируют пролиферацию клеток злокачественной опухоли и/или индуцируют апоптоз клеток злокачественной опухоли, таких как озлокачествленные T-клетки, включая клетки кожной T-клеточной лимфомы (CTCL). Введение олигонуклеотидных ингибиторов по настоящему изобретению может обеспечивать приблизительно вплоть до 5%, 10%, 15%, 20%, 25%, 30%, 35%, 40%, 45%, 50%, 55%, 60%, 65%, 70%, 80%, 90% или 100%, включая промежуточные значения, снижения числа клеток злокачественной опухоли. В некоторых вариантах осуществления олигонуклеотидные ингибиторы по настоящему изобретению могут обеспечивать по меньшей мере приблизительно 5%, 10%, 15%, 20%, 25%, 30%, 35%, 40%, 45% или 50%, включая промежуточные значения, снижения числа клеток злокачественной опухоли.
[0088] В некоторых вариантах осуществления олигонуклеотидные ингибиторы по настоящему изобретению могут демонстрировать более сильное ингибирование пролиферации клеток злокачественной опухоли и/или более сильную индукцию апоптоза клеток злокачественной опухоли по сравнению с другими ингибиторами miR-155. Например, олигонуклеотидный ингибитор по настоящему изобретению может демонстрировать приблизительно вплоть до 10%, 15%, 20%, 25%, 30%, 35% или 40%, включая промежуточные значения, большее снижение числа клеток злокачественной опухоли по сравнению с другими ингибиторами miR-155.
[0089] Настоящее изобретение предусматривает способы лечения злокачественной опухоли у нуждающегося в этом субъекта, включающие введение субъекту олигонуклеотидного ингибитора miR-155 в соответствии с изобретением. Снижение активности или функции miR-155 в клетках злокачественной опухоли субъекта происходит после введения олигонуклеотидного ингибитора.
[0090] В одном из вариантов осуществления способ лечения злокачественной опухоли включает введение олигонуклеотидного ингибитора miR-155, который имеет последовательность от 11 до 16 нуклеотидов, где олигонуклеотидный ингибитор полностью комплементарен зрелой последовательности miR-155 и имеет полный фосфоротиоатный остов; и где по меньшей мере первые три нуклеотида с 3'-конца указанного олигонуклеотидного ингибитора представляют собой замкнутые нуклеотиды и по меньшей мере второй нуклеотид с 5'-конца олигонуклеотидного ингибитора представляет собой нуклеотид дезоксирибонуклеиновой кислоты (ДНК).
[0091] В другом варианте осуществления способ лечения злокачественной опухоли включает введение олигонуклеотидного ингибитора miR-155, который имеет последовательность от 11 до 14 нуклеотидов, где олигонуклеотидный ингибитор полностью комплементарен зрелой последовательности miR-155 и имеет полный фосфоротиоатный остов; и где по меньшей мере первые три нуклеотида с 3'-конца указанного олигонуклеотидного ингибитора представляют собой модифицированные нуклеотиды и по меньшей мере второй нуклеотид с 5'-конца олигонуклеотидного ингибитора представляет собой нуклеотид дезоксирибонуклеиновой кислоты (ДНК).
[0092] В другом варианте осуществления способ лечения злокачественной опухоли включает введение олигонуклеотидного ингибитора miR-155, который имеет последовательность от 11 до 14 нуклеотидов, где олигонуклеотидный ингибитор полностью комплементарен зрелой последовательности miR-155 и имеет полный фосфоротиоатный остов; и где по меньшей мере 7 нуклеотидов указанного олигонуклеотидного ингибитора представляют собой модифицированные нуклеотиды и по меньшей мере второй нуклеотид с 5'-конца олигонуклеотидного ингибитора представляет собой нуклеотид дезоксирибонуклеиновой кислоты (ДНК).
[0093] В еще одном другом варианте осуществления способ лечения злокачественной опухоли включает введение олигонуклеотидного ингибитора miR-155, который имеет последовательность от 11 до 14 нуклеотидов, где олигонуклеотидный ингибитор полностью комплементарен зрелой последовательности miR-155 и имеет полный фосфоротиоатный остов; и где по меньшей мере первые три нуклеотида с 3'-конца указанного олигонуклеотидного ингибитора представляют собой модифицированные нуклеотиды и по меньшей мере четвертый и пятый нуклеотиды с 5'-конца олигонуклеотидного ингибитора представляют собой нуклеотиды дезоксирибонуклеиновой кислоты (ДНК).
[0094] Злокачественные опухоли, которые можно лечить в соответствии с изобретением, включают лимфомы, в том числе T-клеточную лимфому, такую как кожная T-клеточная лимфома (CTCL), и B-клеточную лимфому и злокачественную опухоль кожи. В определенных вариантах осуществления способ лечения злокачественной опухоли включает введение олигонуклеотидного ингибитора miR-155, выбранного из группы, состоящей из SEQ ID NO: 22, SEQ ID NO: 23 и SEQ ID NO: 25. В некоторых других вариантах осуществления способ лечения злокачественной опухоли включает введение олигонуклеотидного ингибитора miR-155, выбранного из группы, состоящей из SEQ ID NO: 33, 39, 43, 44, 47, 58, 84, 99, 111, 115 и 120.
[0095] В одном из вариантов осуществления изобретение относится к способам лечения CTCL в форме фунгоидного микоза (MF) посредством введения субъекту олигонуклеотидного ингибитора miR-155 в соответствии с изобретением. В одном из вариантов осуществления способ лечения CTCL в форме MF включает введение олигонуклеотидного ингибитора miR-155, который имеет последовательность от 11 до 16 нуклеотидов, где олигонуклеотидный ингибитор полностью комплементарен зрелой последовательности miR-155 и имеет полный фосфоротиоатный остов; и где по меньшей мере первые три нуклеотида с 3'-конца указанного олигонуклеотидного ингибитора представляют собой замкнутые нуклеотиды и по меньшей мере второй нуклеотид с 5'-конца олигонуклеотидного ингибитора представляет собой нуклеотид дезоксирибонуклеиновой кислоты (ДНК).
[0096] В другом варианте осуществления изобретение относится к способам лечения CTCL в форме фунгоидного микоза (MF), включающим введение олигонуклеотидного ингибитора miR-155, который имеет последовательность от 11 до 14 нуклеотидов, где олигонуклеотидный ингибитор полностью комплементарен зрелой последовательности miR-155 и имеет полный фосфоротиоатный остов; и где по меньшей мере первые три нуклеотида с 3'-конца указанного олигонуклеотидного ингибитора представляют собой модифицированные нуклеотиды и по меньшей мере второй нуклеотид с 5'-конца олигонуклеотидного ингибитора представляет собой нуклеотид дезоксирибонуклеиновой кислоты (ДНК).
[0097] В другом варианте осуществления изобретение относится к способам лечения CTCL в форме фунгоидного микоза (MF), включающим введение олигонуклеотидного ингибитора miR-155, который имеет последовательность от 11 до 14 нуклеотидов, где олигонуклеотидный ингибитор полностью комплементарен зрелой последовательности miR-155 и имеет полный фосфоротиоатный остов; и где по меньшей мере 7 нуклеотидов указанного олигонуклеотидного ингибитора представляют собой модифицированные нуклеотиды и по меньшей мере второй нуклеотид с 5'-конца олигонуклеотидного ингибитора представляет собой нуклеотид дезоксирибонуклеиновой кислоты (ДНК).
[0098] В еще одном другом варианте осуществления, изобретение относится к способам лечения CTCL в форме фунгоидного микоза (MF), включающим введение олигонуклеотидного ингибитора miR-155, который имеет последовательность от 11 до 14 нуклеотидов, где олигонуклеотидный ингибитор полностью комплементарен зрелой последовательности miR-155 и имеет полный фосфоротиоатный остов; и где по меньшей мере первые три нуклеотида с 3'-конца указанного олигонуклеотидного ингибитора представляют собой модифицированные нуклеотиды и по меньшей мере четвертый и пятый нуклеотиды с 5'-конца олигонуклеотидного ингибитора представляют собой нуклеотиды дезоксирибонуклеиновой кислоты (ДНК).
[0099] В определенных вариантах осуществления способ лечения CTCL в форме MF включает введение олигонуклеотидного ингибитора miR-155, выбранного из группы, состоящей из SEQ ID NO: 22, SEQ ID NO: 23 и SEQ ID NO: 25. В некоторых других вариантах осуществления способ лечения CTCL в форме MF включает введение олигонуклеотидного ингибитора miR-155, выбранного из группы, состоящей из SEQ ID NO: 33, 39, 43, 44, 47, 58, 84, 99, 111, 115 и 120.
[00100] Изобретение также относится к способам лечения CTCL, включающим введение олигонуклеотидного ингибитора miR-155 в соответствии с изобретением в комбинации со вторым терапевтическим средством. Существующие лечения CTCL включают терапию, направленную на кожу, такую как топические стероиды, топический азотистый иприт (мехлорэтамин HCL), топические ретиноиды, фототерапия, лечение ультрафиолетовым светом, лечение псораленом и ультрафиолетовым светом, лучевую терапию, терапию электронным пучком и т. д., и системную терапию, такую как введение ингибиторов гистондеацетилазы (HDAC), ретиноидов (бексаротена), интерферона и антифолатов в низких дозах (например, метотрексата и пралатрексата). Дополнительные варианты лечения, такие как антитело против CD30 (например, брентуксимаб), антитело против CCR4 (например, могамулизумаб) и антитело против PD-1 или против PD-L1 в настоящее время проходят тестирование. Второе терапевтическое средство в целом содержит средство или терапию, выбранные из одного из этих лечений. Например, данное изобретение относится к способам лечения CTCL посредством введения олигонуклеотидного ингибитора miR-155 в комбинации со второй терапией, такой как лечение ингибиторами HDAC, ретиноидами, интерфероном, антифолатами, топическими стероидами, топическими ретиноидами, топическим азотистым ипритом, фототерапия, ультрафиолетовый свет, псорален и ультрафиолетовый свет, лучевая терапия, терапия электронным пучком, антитело против CD30 (например, брентуксимаб), антитело против CCR4 (например, могамулизумаб) и антитело против PD-1 или против PD-L1.
[00101] Известны различные ингибиторы HDAC, некоторые из которых одобрены FDA для клинического использования и некоторые проходят тестирование в клинических исследованиях. Способы лечения злокачественной опухоли в соответствии с изобретением охватывают использование ингибиторов HDAC, включая в качестве неограничивающих примеров вориностат, ромидепсин, панобиностат (LBH589), моцетиностат, белиностат (PXD101), абексиностат, CI-994 (тацединалин) и MS-275 (энтиностат). В вариантах осуществления, где включена вторая терапия/средство, вторую терапию/средство можно вводить в различные моменты времени до или после введения олигонуклеотидного ингибитора miR-155. До введения включает, например, введение первого средства в диапазоне приблизительно от одной недели вплоть до 30 минут перед введением второго средства. Перед введением также может включать, например, введение первого средства в диапазоне приблизительно от 2 недель вплоть до 30 минут перед введением второго средства. После или более позднее введение включает, например, введение второго средства в диапазоне приблизительно от одной недели вплоть до 30 минут после введения первого средства. После или более позднее введение также может включать, например, введение второго средства в диапазоне приблизительно от 2 недель вплоть до 30 минут после введения первого средства.
[00102] Изобретение также относится к способам снижения или ингибирования пролиферации клеток злокачественной опухоли, в частности, озлокачествленных T-клеток, посредством введения олигонуклеотидного ингибитора miR-155, который имеет последовательность от 11 до 16 нуклеотидов, где олигонуклеотидный ингибитор полностью комплементарен зрелой последовательности miR-155 и имеет полный фосфоротиоатный остов; и где по меньшей мере первые три нуклеотида с 3'-конца указанного олигонуклеотидного ингибитора представляют собой замкнутые нуклеотиды и по меньшей мере второй нуклеотид с 5'-конца олигонуклеотидного ингибитора представляет собой нуклеотид дезоксирибонуклеиновой кислоты (ДНК).
[00103] В другом варианте осуществления изобретение относится к способам снижения или ингибирования пролиферации клеток злокачественной опухоли, в частности, озлокачествленных T-клеток, которые включают введение олигонуклеотидного ингибитора miR-155, который имеет последовательность от 11 до 14 нуклеотидов, где олигонуклеотидный ингибитор полностью комплементарен зрелой последовательности miR-155 и имеет полный фосфоротиоатный остов; и где по меньшей мере первые три нуклеотида с 3'-конца указанного олигонуклеотидного ингибитора представляют собой модифицированные нуклеотиды и по меньшей мере второй нуклеотид с 5'-конца олигонуклеотидного ингибитора представляет собой нуклеотид дезоксирибонуклеиновой кислоты (ДНК).
[00104] В другом варианте осуществления изобретение относится к способам снижения или ингибирования пролиферации клеток злокачественной опухоли, в частности, озлокачествленных T-клеток, которые включают введение олигонуклеотидного ингибитора miR-155, который имеет последовательность от 11 до 14 нуклеотидов, где олигонуклеотидный ингибитор полностью комплементарен зрелой последовательности miR-155 и имеет полный фосфоротиоатный остов; и где по меньшей мере 7 нуклеотидов указанного олигонуклеотидного ингибитора представляют собой модифицированные нуклеотиды и по меньшей мере второй нуклеотид с 5'-конца олигонуклеотидного ингибитора представляет собой нуклеотид дезоксирибонуклеиновой кислоты (ДНК).
[00105] В еще одном другом варианте осуществления изобретение относится к способам снижения или ингибирования пролиферации клеток злокачественной опухоли, в частности, озлокачествленных T-клеток, которые включают введение олигонуклеотидного ингибитора miR-155, который имеет последовательность от 11 до 14 нуклеотидов, где олигонуклеотидный ингибитор полностью комплементарен зрелой последовательности miR-155 и имеет полный фосфоротиоатный остов; и где по меньшей мере первые три нуклеотида с 3'-конца указанного олигонуклеотидного ингибитора представляют собой модифицированные нуклеотиды и по меньшей мере четвертый и пятый нуклеотиды с 5'-конца олигонуклеотидного ингибитора представляют собой нуклеотиды дезоксирибонуклеиновой кислоты (ДНК).
[00106] В определенных вариантах осуществления способы снижения или ингибирования пролиферации клеток злокачественной опухоли, в частности, озлокачествленных T-клеток, включают введение олигонуклеотидного ингибитора miR-155, выбранного из группы, состоящей из SEQ ID NO: 22, SEQ ID NO: 23 и SEQ ID NO: 25. В некоторых других вариантах осуществления способы снижения или ингибирования пролиферации клеток злокачественной опухоли, в частности, озлокачествленных T-клеток, включают введение олигонуклеотидного ингибитора miR-155, выбранного из группы, состоящей из SEQ ID NO: 33, 39, 43, 44, 47, 58, 84, 99, 111, 115 и 120.
[00107] Озлокачествленные T-клетки включают клетки кожной T-клеточной лимфомы (CTCL), CD4+ T-клетки и T-клетки памяти. Введение олигонуклеотидного ингибитора по настоящему изобретению снижает активность или функцию miR-155 и/или осуществляет повышающую регуляцию одного или нескольких генов-мишеней miR-155 в озлокачествленных T-клетках после введения. Способы снижения или ингибирования пролиферации клеток злокачественной опухоли также включают использование второй терапии/средства, описанных выше, наряду с введением данных олигонуклеотидных ингибиторов.
[00108] В определенных вариантах осуществления способы, охватываемые изобретением, включают введение 18,75, 37,5 или 75 мг олигонуклеотидного ингибитора по изобретению на повреждение кожи пациента. В других вариантах осуществления способы по изобретению включают системное введение пациенту всего приблизительно 37,5, 75, 150, 300, 600, 900 или 1200 мг, включая промежуточные значения, олигонуклеотидного ингибитора по изобретению. В некоторых других вариантах осуществления, способы по изобретению включают системное введение пациенту всего приблизительно 350, 700, 1050, 1400, 1750, 2100, 2450, 2800, 3150 или 3500 мг, включая промежуточные значения, олигонуклеотидного ингибитора по изобретению.
[00109] Предпочтительно введение олигонуклеотидного ингибитора по настоящему изобретению субъекту ведет к улучшению одного или нескольких симптомов или патологий, связанных с злокачественной опухолью. Например, в одном из вариантов осуществления введение олигонуклеотидного ингибитора по настоящему изобретению отдельно или в комбинации со вторым терапевтическим средством, таким как ингибитор HDAC, снижает число повреждений кожи; число красных зудящих очагов или бляшек на коже; и/или формирование новых повреждений/очагов/бляшек на коже, связанных с CTCL. В одном из вариантов осуществления введение олигонуклеотидного ингибитора по настоящему изобретению отдельно или в комбинации со вторым терапевтическим средством, таким как ингибитор HDAC, снижает или ингибирует миграцию озлокачествленных T-лимфоцитов в кожу. В другом варианте осуществления введение олигонуклеотидного ингибитора по настоящему изобретению отдельно или в комбинации со вторым терапевтическим средством снижает общие озлокачествленные T-лимфоциты в коже. В еще одном другом варианте осуществления введение олигонуклеотидного ингибитора по настоящему изобретению отдельно или в комбинации со вторым терапевтическим средством снижает число озлокачествленных T-клеток, которые могут уклоняться или мигрировать из кожи на периферию.
[00110] Как используют в настоящем описании, термин «субъект» или «пациент» относится к какому-либо позвоночному, включая, без ограничения, человека и других приматов (например, шимпанзе и другие виды обезьян), сельскохозяйственных животных (например, крупный рогатый скот, овец, свиней, коз и лошадей), домашних млекопитающих (например, собак и кошек), лабораторных животных (например, грызунов, таких как мыши, крысы и морские свинки) и птиц (например, домашних, диких птиц и пернатой дичи, например, кур, индеек и других куриных, уток, гусей и т. п.). В некоторых вариантах осуществления субъектом является млекопитающее. В других вариантах осуществления субъектом является человек.
[00111] Какие-либо из олигонуклеотидных ингибиторов miR-155, описанных в настоящем описании, можно доставлять в клетку-мишень (например, озлокачествленные T-клетки) посредством доставки в клетку экспрессирующего вектора, кодирующего олигонуклеотидный ингибитор miR-155. «Вектор» представляет собой композицию вещества, которую можно использовать для того, чтобы доставлять нуклеиновую кислоту, представляющую интерес, во внутреннюю часть клетки. Многие векторы известны в данной области, включая в качестве неограничивающих примеров линейные полинуклеотиды, полинуклеотиды, связанные с ионными или амфифильными соединениями, плазмиды и вирусы. Таким образом, термин «вектор» включает автономно реплицирующуюся плазмиду или вирус. Примеры вирусных векторов включают, но не ограничиваясь этим, аденовирусные векторы, аденоассоциированные вирусные векторы, ретровирусные векторы и т. п. В одном конкретном варианте осуществления вирусный вектор представляет собой лентивирусный вектор или аденовирусный вектор. Экспрессионную конструкцию можно реплицировать в живой клетке или ее можно получать синтетически. Для целей этой заявки термины «экспрессионная конструкция», «экспрессирующий вектор» и «вектор» используют взаимозаменяемо для того, чтобы демонстрировать применение изобретения в общем иллюстративном смысле, без намерения ограничить изобретение.
[00112] В одном из вариантов осуществления экспрессирующий вектор для экспрессии олигонуклеотидного ингибитора miR-155 содержит промотор, функционально связанный с полинуклеотидной последовательностью, кодирующей олигонуклеотидный ингибитор. Фраза «функционально связан» или «под транскрипционным контролем», как используют в настоящем описании, обозначает, что промотор находится в правильном местоположении и ориентации по отношению к полинуклеотиду, чтобы управлять инициацией транскрипции РНК полимеразой и экспрессии полинуклеотида.
[00113] Как используют в настоящем описании, «промотор» относится к ДНК последовательности, распознаваемой синтезирующими механизмами клетки или введенными синтезирующими механизмами, которая необходима для того, чтобы инициировать специфичную транскрипцию гена. Подходящие промоторы включают, но не ограничиваясь этим, промоторы РНК pol I, pol II, pol III и вирусные промоторы (например, промотор предраннего гена цитомегаловируса человека (CMV), ранний промотор SV40 и длинный концевой повтор вируса саркомы Рауса). В одном из вариантов осуществления промотор представляет собой специфический T-клеточный промотор, такой как проксимальные и дистальные промоторы гена lck или промоторные и энхансерные последовательности гена CD4, и т. д.
[00114] В определенных вариантах осуществления промотор, функционально связанный с полинуклеотидом, кодирующим олигонуклеотидный ингибитор miR-155, может представлять собой индуцибельный промотор. Индуцибельные промоторы известны в данной области и включают, но не ограничиваясь этим, тетрациклиновый промотор, промотор металлотионеина IIA, промотор теплового шока, элементы ответа на стероид/тиреоидный гормон/ретиноевую кислоту, поздний промотор аденовирусов и индуцибельный LTR вируса опухоль молочной железы мышей.
[00115] Способы доставки экспрессионных конструкций и нуклеиновых кислот в клетки известны в данной области и могут включать, например, копреципитацию с фосфатом кальция, электропорацию, микроинъекцию, DEAE-декстран, липофекцию, трансфекцию с использованием полиаминных реактивов для трансфекции, обработку клеток ультразвуком, бомбардировку генами с использованием высокоскоростных микроснарядов и трансфекцию, опосредованную рецепторами.
[00116] Настоящее изобретение также относится к способам диагностирования CTCL и способам мониторинга клинического статуса пациента, проходящего лечение CTCL. Изобретение показывает, что введение соединений против miR-155 по изобретению осуществляет повышающую регуляцию и/или осуществляет понижающую регуляцию уникального набора генов во всех трех клеточных линиях MF (HuT102, MJ и MyLa) по сравнению с клетками, которые обрабатывали контролем, или клетками синдрома Сезари. Изобретение относится к использованию сигнатуры генной экспрессии на основании этого уникального набора генов для того, чтобы диагностировать CTCL подтипа MF, а также для того, чтобы осуществлять мониторинг прогресса лечения CTCL ингибиторами miR-155. Например, изобретение показывает, что набор генов, перечисленных в таблице 2, подвержен повышающей или понижающей регуляции во всех трех клеточных линиях MF в ответ на соединения против miR-155 по изобретению. В одном из вариантов осуществления изобретение относится к способам диагностирования CTCL посредством измерения уровней экспрессии одного или нескольких генов, перечисленных в таблице 2, у субъекта, предположительно страдающего CTCL, сравнения уровней экспрессии с эталонными уровнями (например, уровнями экспрессии у здорового субъекта или уровнями экспрессии в клетках не злокачественной опухоли субъекта с CTCL) и диагностирования субъекта в качестве имеющего CTCL, если уровни экспрессии у субъекта находятся под понижающей или повышающей регуляцией по сравнению с эталонными уровнями.
Таблица 2
[00117] В дополнительных вариантах осуществления изобретение относится к способу выбора субъекта для лечения CTCL, который включает определение уровня экспрессии одного или нескольких генов в CTCL клетках субъекта, где один или несколько генов выбирают из набора генов, модулируемых во всех MF клетках, например, таблица 2; сравнение уровня одного или нескольких генов в CTCL клетках субъекта с эталонным уровнем одного или нескольких генов; и выбор субъекта, имеющего увеличение или уменьшение уровня одного или нескольких генов в CTCL клетках по сравнению с эталонным уровнем для лечения CTCL. В другом варианте осуществления способ выбора субъекта для лечения CTCL включает определение уровня экспрессии 4 или больше генов, выбранных из группы, состоящей из INPP50/SHIP1, Jarid2, Picalm, Bach1, Wee1, CUX1, Cebpb, SPIB/PU.1 и IL7R, в CTCL клетках субъекта; сравнение уровня 4 или больше генов в CTCL клетках субъекта с эталонным уровнем 4 или больше генов; и выбор субъекта, имеющего снижение уровня 4 или больше генов в CTCL клетках по сравнению с эталонным уровнем для лечения CTCL. В одном из вариантов осуществления способ выбора субъекта для лечения CTCL включает определение уровня 4 генов, Bach1, Jarid2, Picalm и SHIP1, в CTCL клетках субъекта в сравнении с эталонным уровнем 4 генов. В определенных вариантах осуществления способ выбора субъекта для лечения CTCL включает определение уровня 4 генов, Bach1, Jarid2, Picalm и SHIP1, в CTCL клетках субъекта в сравнении с эталонным уровнем 4 генов; и выбор субъекта, имеющего по меньшей мере 2-кратное снижение уровня 4 генов в CTCL клетках по сравнению с эталонным уровнем для лечения CTCL. В одном из вариантов осуществления эталонный уровень представляет собой уровень экспрессии тех же генов в клетках, обработанных контрольными олигонуклеотидами. В другом варианте осуществления эталонный уровень представляет собой уровень экспрессии тех же генов в клетках синдрома Сезари. В еще одном другом варианте осуществления эталонный уровень представляет собой уровень экспрессии тех же генов у здорового субъекта (например, субъекта, который не демонстрирует два или больше симптомов злокачественной опухоли кожи, субъекта, у которого не диагностирована злокачественная опухоль кожи, и/или субъекта, который не имеет злокачественной опухоли кожи в семейном анамнезе).
[00118] Изобретение также относится к способам оценки эффекта лечения соединениями против miR-155, которые включают определение уровня экспрессии одного или нескольких генов в клетках субъекта перед лечением соединениями против miR-155, где один или несколько генов выбирают из набора генов, модулируемых во всех MF клетках, например, таблица 2; определение уровня экспрессии того же одного или нескольких генов в клетках субъекта после лечения соединениями против miR-155; и определение лечения как эффективного, менее эффективного или не эффективного на основании уровней экспрессии до и после лечения. То есть в одном из вариантов осуществления гены, перечисленные в таблице 2, служат в качестве биологического маркера для клинического эффекта лечения против miR-155.
[00119] В некоторых вариантах осуществления изобретение относится к способам диагностирования CTCL посредством измерения уровня miR-155 у субъекта, предположительно страдающего CTCL, в сравнении с эталонным уровнем, где более высокая экспрессия miR-155 у субъекта указывает на то, что субъект страдает CTCL. Уровень экспрессии miR-155 у субъекта, предположительно страдающего CTCL, можно определять с использованием клеток, выделенных из повреждений кожи субъекта, плазмы, сыворотки, белых клеток крови или PBMC. В определенных вариантах осуществления изобретение относится к способам диагностирования CTCL в форме фунгоидного микоза посредством измерения уровня miR-155 у субъекта в сравнении с эталонным уровнем, где более высокая экспрессия miR-155 у субъекта указывает на то, что субъект страдает CTCL в форме MF. В некоторых других вариантах осуществления изобретение относится к способам оценки ответа на лечение против miR-155 посредством определения уровня экспрессии miR-155 у субъекта, проходящего лечение, в сравнении с эталонным уровнем miR-155. Эталонный уровень может представлять собой уровень miR-155 у здорового субъекта или средний или медианный уровень miR-155 в группе здоровых субъектов или уровень miR-155 у субъекта, имеющего синдром Сезари.
[00120] Настоящее изобретение также относится к фармацевтическим композициям, содержащим олигонуклеотидный ингибитор miR-155, как раскрыто в настоящем описании, и фармацевтически приемлемый носитель или эксципиент. В одном из вариантов осуществления фармацевтическая композиция содержит эффективную дозу олигонуклеотидного ингибитора miR-155, имеющего последовательность от 11 до 16 нуклеотидов, где олигонуклеотидный ингибитор полностью комплементарен зрелой последовательности miR-155 и имеет полный фосфоротиоатный остов; и где по меньшей мере первые три нуклеотида с 3'-конца олигонуклеотидного ингибитора представляют собой замкнутые нуклеотиды и по меньшей мере второй нуклеотид с 5'-конца олигонуклеотидного ингибитора представляет собой нуклеотид дезоксирибонуклеиновой кислоты (ДНК).
[00121] В другом варианте осуществления фармацевтическая композиция содержит эффективную дозу олигонуклеотидного ингибитора miR-155, который имеет последовательность от 11 до 14 нуклеотидов, где олигонуклеотидный ингибитор полностью комплементарен зрелой последовательности miR-155 и имеет полный фосфоротиоатный остов; и где по меньшей мере первые три нуклеотида с 3'-конца указанного олигонуклеотидного ингибитора представляют собой модифицированные нуклеотиды и по меньшей мере второй нуклеотид с 5'-конца олигонуклеотидного ингибитора представляет собой нуклеотид дезоксирибонуклеиновой кислоты (ДНК).
[00122] В другом варианте осуществления фармацевтическая композиция содержит эффективную дозу олигонуклеотидного ингибитора miR-155, который имеет последовательность от 11 до 14 нуклеотидов, где олигонуклеотидный ингибитор полностью комплементарен зрелой последовательности miR-155 и имеет полный фосфоротиоатный остов; и где по меньшей мере 7 нуклеотидов указанного олигонуклеотидного ингибитора представляют собой модифицированные нуклеотиды и по меньшей мере второй нуклеотид с 5'-конца олигонуклеотидного ингибитора представляет собой нуклеотид дезоксирибонуклеиновой кислоты (ДНК).
[00123] В еще одном другом варианте осуществления, фармацевтическая композиция содержит эффективную дозу олигонуклеотидного ингибитора miR-155, который имеет последовательность от 11 до 14 нуклеотидов, где олигонуклеотидный ингибитор полностью комплементарен зрелой последовательности miR-155 и имеет полный фосфоротиоатный остов; и где по меньшей мере первые три нуклеотида с 3'-конца указанного олигонуклеотидного ингибитора представляют собой модифицированные нуклеотиды и по меньшей мере четвертый и пятый нуклеотиды с 5'-конца олигонуклеотидного ингибитора представляют собой нуклеотиды дезоксирибонуклеиновой кислоты (ДНК).
[00124] В определенных вариантах осуществления фармацевтические композиции содержат эффективную дозу олигонуклеотидного ингибитора, имеющего последовательность, выбранную из группы, состоящей из SEQ ID NO: 22, SEQ ID NO: 23 и SEQ ID NO: 25. В некоторых других вариантах осуществления фармацевтические композиции содержат эффективную дозу олигонуклеотидного ингибитора, имеющего последовательность, выбранную из группы, состоящей из SEQ ID NO: 33, 39, 43, 44, 47, 58, 84, 99, 111, 115 и 120. В других вариантах осуществления фармацевтическая композиция содержит олигонуклеотидный ингибитор, имеющий последовательность, выбранную из последовательностей, перечисленных в таблице 1.
[00125] «Эффективная доза» представляет собой количество, достаточное для того, чтобы вызывать полезный или желаемый клинический результат. Эффективная доза олигонуклеотидного ингибитора miR-155 по изобретению может составлять приблизительно от 1 мг/кг приблизительно до 100 мг/кг, приблизительно от 2,5 мг/кг приблизительно до 50 мг/кг или приблизительно от 5 мг/кг приблизительно до 25 мг/кг. В некоторых вариантах осуществления эффективная доза может составлять приблизительно 18,75, 37,5 или 75 мг олигонуклеотидного ингибитора на повреждение кожи пациента. Точное определение того, что следует считать эффективной дозой, может происходить на основании факторов, индивидуальных для каждого пациента, включая их размер, возраст, тип нарушения и форму ингибитора (например, голый олигонуклеотид или экспрессионная конструкция и т.д.). Следовательно, дозировки могут легко определять средние специалисты в данной области с помощью этого раскрытия и знаний в данной области.
[00126] В определенных вариантах осуществления изобретение относится к использованию ингибитора HDAC в комбинации с олигонуклеотидными ингибиторами по изобретению. В вариантах осуществления, в которые включен ингибитор HDAC, ингибитор HDAC можно вводить параллельно, но в раздельных составах или последовательно. В других вариантах осуществления ингибитор HDAC можно вводить в различные моменты времени до или после введения ингибитора miR-155. Когда предусмотрены клинические применения, фармацевтические композиции получают в форме, подходящей для предполагаемого применения. В целом, это влечет получение композиций, которые по существу не содержат пирогены, а также другие примеси, которые могут быть вредны для человека или животных.
[00127] В одном из вариантов осуществления изобретение относится к топическим композициям, содержащим олигонуклеотидные ингибиторы miR-155 и один или несколько косметически или фармацевтически приемлемых носителей или эксципиентов. Термин «косметически приемлемый», как используют в настоящем описании, обозначает, что носители или эксципиенты пригодны для использования в контакте с тканями (например, кожей), без чрезмерной токсичности, несовместимости, нестабильности, раздражения, аллергического ответа и т.п.
[00128] Косметические или фармацевтические носители или эксципиенты могут представлять собой жидкости, такие как вода и масла, включая таковые нефтяного, животного, растительного или синтетического происхождения, такие как арахисовое масло, соевое масло, минеральное масло, сезамовое масло и т.п. Топические композиции часто содержат эмульсию «масло-в-воде» или «вода-в-масле». Данное изобретение относится к использованию таких эмульсий для получения топической композиции соединений против miR-155. Подходящие фармацевтические носители описаны в «Remington's Pharmaceutical Sciences» E. W. Martin. Подходящие косметические носители описаны далее.
[00129] В одном из вариантов осуществления косметически приемлемый топический носитель составляет приблизительно от 50% приблизительно до 99,99% по массе композиции (например, приблизительно от 80% приблизительно до 99% по массе композиции). Топические композиции включают, но не ограничиваясь этим, растворы, лосьоны, кремы, гели, помады, спреи, мази, очищающие жидкости, твердые плитки, шампуни, пасты, пены, порошки, муссы, кремы для бритья, салфетки, пластыри, лаки для ногтей, раневые повязки, клейкие пластыри, гидрогели и пленки. Продукты этих типов могут содержать косметически приемлемые топические носители нескольких типов, включая в качестве неограничивающих примеров растворы, эмульсии (например, микроэмульсии и наноэмульсии), гели, твердые вещества и липосомы. Определенные неограничивающие примеры таких носителей изложены ниже в настоящем описании. Другие подходящие носители могут формулировать средние специалисты в данной области.
[00130] Топические композиции, которые можно использовать в настоящем изобретении, можно формулировать в виде раствора, содержащего смягчитель. Такие композиции предпочтительно содержат приблизительно от 1% приблизительно до 50% смягчителя(ей). Как используют в настоящем описании, термин «смягчитель» относится к материалам, используемым для предотвращения или облегчения сухости, а также для защиты кожи. Известно множество подходящих смягчителей, и их можно использовать в настоящем изобретении. Например, Sagarin, Cosmetics, Science and Technology, 2-е изд., том 1, стр. 32-43 (1972) и International Cosmetic Ingredient Dictionary and Handbook, ред. Wenninger и McEwen, стр. 1656-61, 1626 и 1654-55 (The Cosmetic, Toiletry, and Fragrance Assoc., Washington, D.C., 7-е изд., 1997) (далее в настоящем описании «ICI Handbook») содержат многие примеры подходящих материалов.
[00131] Лосьон можно получать из такого раствора. Лосьоны обычно содержат приблизительно от 1% приблизительно до 20% (например, приблизительно от 5% приблизительно до 10%) смягчителя(ей) и приблизительно от 50% приблизительно до 90% (например, приблизительно от 60% приблизительно до 80%) воды.
[00132] Продуктом другого типа, который можно формулировать из раствора, является крем. Крем обычно содержит приблизительно от 5% приблизительно до 50% (например, приблизительно от 10% приблизительно до 20%) смягчителя(ей) и приблизительно от 45% приблизительно до 85% (например, приблизительно от 50% приблизительно до 75%) воды.
[00133] Продуктом еще одного другого типа, который можно формулировать из раствора, является мазь. Мазь может содержать простую основу из животных или растительных масел или полутвердые углеводороды. Мазь может содержать приблизительно от 2% приблизительно до 10% смягчителя(ей) плюс приблизительно от 0,1% приблизительно до 2% загустителя(ей). Более полное раскрытие загустителей или средств, повышающих вязкость, которые можно использовать в настоящем описании, можно найти in Sagarin, Cosmetics, Science and Technology, 2-е изд., том 1, стр. 72-73 (1972) и ICI Handbook, стр. 1693-1697.
[00134] Топические композиции, которые можно использовать в настоящем изобретении можно, формулировать в виде эмульсий. Если носитель представляет собой эмульсию, приблизительно от 1% приблизительно до 10% (например, приблизительно от 2% приблизительно до 5%) носителя содержит эмульсификатор(ы). Эмульсификаторы могут быть неионными, анионными или катионными. Подходящие эмульсификаторы раскрыты, например, в Detergents and Emulsifiers, северо-американское издание, стр. 317-324 (1986) и ICI Handbook, стр. 1673-1686.
[00135] Лосьоны и кремы можно формулировать в качестве эмульсий. Обычно такие лосьоны содержат от 0,5% приблизительно до 5% эмульсификатора(ов). Такие кремы обычно содержат приблизительно от 1% приблизительно до 20% (например, приблизительно от 5% приблизительно до 10%) смягчителя(ей); приблизительно от 20% приблизительно до 80% (например, от 30% приблизительно до 70%) воды; и приблизительно от 1% приблизительно до 10% (например, приблизительно от 2% приблизительно до 5%) эмульсификатора(ов).
[00136] Препараты для ухода за кожей в виде единой эмульсии, такие как лосьоны и кремы, типа «масло-в-воде» и типа «вода-в-масле» хорошо известны косметической области, и их можно использовать в настоящем изобретении. Многофазные эмульсионные композиции, например, типа «вода-в-масле-в-воде», как раскрыто в патентах США №№ 4254105 и 4960764, также можно использовать в настоящем изобретении. В целом, такие единые или многофазные эмульсии содержат воду, смягчители и эмульсификаторы в качестве необходимых ингредиентов.
[00137] Топические композиции по данному изобретению также можно формулировать в виде геля (например, водного, спиртового, спиртового/водного или масляного геля с использованием подходящего гелеобразующего средства(в)). Подходящие гелеобразующие средства для водных гелей включают, но не ограничиваясь этим, натуральные камеди, акриловую кислоту и полимеры и сополимеры акрилатов, а также производные целлюлозы (например, гидроксиметилцеллюлозу и гидроксипропилцеллюлозу). Подходящие гелеобразующие средства для масел (таких как минеральное масло) включают, но не ограничиваясь этим, гидрогенизированный бутилен/этилен/стироловый сополимер и гидрогенизированный этилен/пропилен/стироловый сополимер. Такие гели обычно содержат между приблизительно 0,1% и 5% по массе гелеобразующих средств.
[00138] Липосомные составы также представляют собой эффективные композиции по рассматриваемому изобретению. В одном из вариантов осуществления олигонуклеотиды содержатся в липосоме. Примерами липосом являются однослойные, многослойные и олиголамеллярные липосомы, которые могут содержать или могут не содержать фосфолипиды. Такие композиции можно получать посредством объединения олигонуклеотидного ингибитора с фосфолипидом, таким как дипальмитоилфосфатидилхолин, холестерин и вода. Коммерчески доступные жировые эмульсии, которые могут подходить для доставки нуклеиновых кислот по изобретению в клетки злокачественной опухоли или кожную ткань, включают Intralipid®, Liposyn®, Liposyn® II, Liposyn® III, Nutrilipid и другие схожие липидные эмульсии. Предпочтительной коллоидной системой для применения в качестве наполнителя для доставки in vivo является липосома (т.е. искусственная мембранная везикула). Получение и использование таких систем хорошо известно в данной области. Образцовые составы также раскрыты в US 5981505; US 6217900; US 6383512; US 5783565; US 7202227; US 6379965; US 6127170; US 5837533; US 6747014; и WO03/093449, которые включены в настоящее описание посредством ссылки во всей полноте.
[00139] Затем препарат липосом можно встраивать в один из вышеуказанных носителей (например, гель или эмульсию «масло-в-воде») для того, чтобы получать липосомный состав. Другие композиции и использования топически применяемых липосом описаны в Mezei, M., «Liposomes as a Skin Drug Delivery System», Topics in Pharmaceutical Sciences (ред. D. Breimer и P. Speiser), Elsevier Science Publishers B. V., New York, N.Y., 1985, стр. 345-358, патентной заявке PCT № WO96/31194, Niemiec, et al., 12 Pharm. Res. 1184-88 (1995) и патенте США № 5260065.
[00140] В одном из вариантов осуществления липосомы присутствуют в топической композиции в количестве, основываясь на общем объеме композиции, приблизительно от 5 мг/мл приблизительно до 100 мг/мл, таком как приблизительно от 10 мг/мл приблизительно до 50 мг/мл.
[00141] В дополнение к приведенным выше носителям и эксципиентам, другие смягчители и поверхностно-активные средства можно встраивать в эмульсии, включая глицерина триолеат, ацетилированный сахарозы дистеарат, сорбитана триолеат, полиоксиэтилена (1) моностеарат, глицерина моноолеат, сахарозы дистеарат, полиэтиленгликоля (50) моностеарат, октилфеноксиполи (этиленокси) этанол, декаглицерина пентаизостеарат, сорбитана сесквиолеат, гидроксилированный ланолин, ланолин, триглицерила диизостеарат, простой полиоксиэтилен (2) олеиловый эфир, стеароил-2-лактилат кальция, метилглюкозида сесквистеарат, сорбитана монопальмитат, сополимер метоксиполиэтиленгликоля-22/додецилгликоля (Elfacos E200), сополимер полиэтиленгликоля-45/додецилгликоля (Elfacos ST9), полиэтиленгликоля 400 дистеарат и экстракты стеринов, полученные из ланолина, гликольстеарат и глицеринстеарат; спирты, такие как цетиловый спирт и ланолиновый спирт; миристаты, такие как изопропилмиристат; цетилпальмитат; холестерин; стеариновую кислоту; пропиленгликоль; глицерин, сорбит и т.п.
[00142] В определенных вариантах осуществления липосомы, используемые для доставки представляют собой амфотерные липосомы, такие как SMARTICLES® (Marina Biotech, Inc.), которые подробно описаны в патентной заявке США № 20110076322, опубликованной через 18 месяцев с даты приоритета. Заряд поверхности на SMARTICLES® является полностью обратимым, что делает их особенно подходящими для доставки нуклеиновых кислот. SMARTICLES® можно доставлять через инъекции, они остаются стабильными, не образуют агрегаты и пересекают клеточные мембраны для того, чтобы доставлять нуклеиновые кислоты.
[00143] В целом, можно пожелать использовать подходящие соли и буферы, чтобы делать наполнители для доставки стабильными и допускать захват клетками-мишенями. Фармацевтические композиции по настоящему изобретению содержат эффективное количество наполнителя для доставки, содержащего ингибиторные полинуклеотиды (например липосомы или другие комплексы или экспрессирующие векторы), растворенные или диспергированные в фармацевтически приемлемом носителе или водной среде. Фразы «фармацевтически приемлемый» или «фармакологически приемлемый» относятся к молекулярным объектам и композициям, которые не вызывают нежелательных, аллергических или других неблагоприятных реакций при введении животному или человеку. Как используют в настоящем описании, «фармацевтически приемлемый носитель» включает растворители, буферы, растворы, дисперсионные среды, покрытия, антибактериальные и противогрибковые средства, изотонические и задерживающие абсорбцию средства и т.п., приемлемые для использования при формулировании фармацевтических средств, таких как фармацевтические средства, подходящие для введения человеку. Использование таких сред и средств для фармацевтически активных веществ хорошо известно в данной области. За исключением случаев, когда какие-либо стандартные среды или средства несовместимы с активными ингредиентами по настоящему изобретению, предусмотрено их использование в терапевтических композициях. В композиции также можно встраивать дополнительные активные ингредиенты, при условии, что они не инактивируют векторы или полинуклеотиды в композициях.
[00144] Активные композиции по настоящему изобретению могут включать классические фармацевтические препараты. Введение этих композиций в соответствии с настоящим изобретением может происходить через какой-либо обыкновенный путь при условии, что ткань-мишень доступна через этот путь. Это включает оральную, топическую, парентеральную, внутрикожную, подкожную или внутривенную инъекцию. В другом варианте осуществления композиции, содержащие олигонуклеотидные ингибиторы miR-155, как раскрыто в настоящем описании, можно формулировать в форме, подходящей для топического нанесения, такой как крем, мазь, паста, лосьон или гель.
[00145] Активные соединения также можно вводить парентерально. В качестве иллюстрации, растворы активных соединений в виде свободного основания или фармакологически приемлемых солей можно получать в воде, подходящим образом смешанной с поверхностно-активным средством, таким как гидроксипропилцеллюлоза. Дисперсии также можно получать в глицерине, жидких полиэтиленгликолях и их смесях, а также в маслах. При обычных условиях хранения и использования, эти препараты обычно содержат консервант для того, чтобы предотвращать рост микроорганизмов.
[00146] Фармацевтические формы, подходящие для инъекционного использования, включают, например, стерильные водные растворы или дисперсии и стерильные порошки для экстемпорального приготовления стерильных инъецируемых растворов или дисперсий. В целом, эти препараты являются стерильными и текучими в такой степени, чтобы была возможна инъекция без труда. Препараты должны быть стабильными в условиях изготовления и хранения и должны быть защищены от загрязняющего действия микроорганизмов, таких как бактерии и грибы. Подходящие растворители или дисперсионные среды могут включать, например, воду, этанол, полиол (например, глицерин, пропиленгликоль и жидкий полиэтиленгликоль и т. п.), их подходящие смеси и растительные масла. Надлежащую текучесть можно поддерживать, например, с помощью покрытия, такого как лецитин, с помощью поддержания необходимого размера частиц в случае дисперсии и с помощью поверхностно-активных средств. Действия по предохранению от микроорганизмов можно осуществлять с помощью различных антибактериальных и противогрибковых средств, например, парабенов, хлорбутанола, фенола, сорбиновой кислоты, тимеросала и т. п. Во многих случаях будет предпочтительно включать изотонические средства, например, сахара или хлорид натрия. Пролонгированную абсорбцию инъецируемых композиций можно обеспечивать посредством использования в композициях средств, задерживающих абсорбцию, например, моностеарата алюминия и желатина.
[00147] Стерильные инъецируемые растворы можно получать посредством встраивания активных соединений в подходящем количестве в растворитель наряду с какими-либо другими ингредиентами (например, как перечислено выше) по желанию, после чего следует стерилизация фильтрованием. В целом, дисперсии получают посредством встраивания различных стерилизованных активных ингредиентов в стерильный наполнитель, который содержит основную дисперсионную среду и другие желаемые ингредиенты, например, как перечислено выше. В случае стерильных порошков для получения стерильных инъецируемых растворов, предпочтительные способы получения включают способы вакуумной сушки и лиофилизации, которые дают порошок активного ингредиента(ов) плюс какой-либо желаемый дополнительный ингредиент из их раствора, предварительно стерилизованного фильтрованием.
[00148] Композиции по настоящему изобретению в целом можно формулировать в нейтральной или солевой форме. Фармацевтически приемлемые соли включают, например, кислотно-аддитивные соли (образованные со свободными аминогруппами белка), полученные из неорганических кислот (например, соляной или фосфорной кислот) или из органических кислот (например, уксусной, щавелевой, винной, миндальной и т.п.). Соли, образуемые со свободными карбоксильными группами белка, также можно получать из неорганических оснований (например, гидроксидов натрия, калия, аммония, кальция или железа) или из органических оснований (например, изопропиламина, триметиламина, гистидина, прокаина и т.п.).
[00149] После формулирования, композиции предпочтительно вводят таким образом, который совместим с дозированным составом, и в таком количестве, которое является терапевтически эффективным. Составы можно легко вводить в различных дозированных формах, таких как инъецируемые растворы, крем, мазь, паста, лосьон или гель и т.п. Для парентерального введения в водном растворе, например, раствор обычно подходящим образом забуферивают и жидкий разбавитель сначала делают изотоническим, например, с использованием достаточного физиологического раствора или глюкозы. Такие водные растворы можно использовать, например, для внутривенного, подкожного и внутрикожного введения. Предпочтительно, стерильные водные среды используют, как известно специалистам в данной области, в частности, в свете настоящего раскрытия. Некоторые вариации дозы неизбежно возникнут, в зависимости от состояния субъекта, подлежащего лечению. Человек, отвечающий за введение, в любом случае определяет подходящую дозу для индивидуального субъекта. Кроме того, для введения человеку препараты должны отвечать стандартам стерильности, пирогенности, общей безопасности и чистоты, как того требуют регулирующие органы.
[00150] В определенных вариантах осуществления фармацевтические композиции по изобретению упаковывают вместе с устройством для введения или хранят внутри него. Устройства для инъецируемых составов включают, но не ограничиваясь этим, предварительно заполненные шприцы, инъекционные порты, автоинъекторы, инъекционные насосы и шприцы-ручки. Устройства для аэрозольных или порошкообразных составов включают, но не ограничиваясь этим, ингаляторы, инсуффляторы, аспираторы и т.п. Устройства для дермальной доставки композиций по настоящему изобретению также включают дермальные инъекции с микроиглами или пластыри. Таким образом, настоящее изобретение включает устройства для введения, содержащие фармацевтическую композицию по изобретению для лечения или предотвращения одного или нескольких из нарушений, описанных в настоящем описании.
[00151] Это изобретение дополнительно проиллюстрировано следующими дополнительными примерами, которые не следует толковать в качестве ограничения. Специалисты в данной области, в свете настоящего раскрытия, примут во внимание, что многие изменения можно выполнять в конкретных вариантах осуществления, которые раскрыты, и все же получать подобный или схожий результат, не отступая от сущности и объема изобретения.
ПРИМЕРЫ
Пример 1: олигонуклеотидные ингибиторы miR-155 («против miR-155») активны в клеточных линиях грибовидного микоза человека, которые демонстрируют сниженную экспрессию miR-155
[00152] Для того чтобы определять характеристики экспрессии miR-155-5p в клеточных линиях, полученных от пациентов с CTCL, измеряли абсолютные уровни miR-155-5p при фунгоидном микозе (MF), синдроме Сезари (SS), и в CTCL клеточной линии, классифицируемой не как MF и не как SS. Исследованные клеточные, патологические и молекулярные характеристики клеточных линий представлены в таблице 3.
Таблица 3. Характеристики CTCL клеточных линий
[00153] Абсолютную экспрессию miR-155-5p в клеточных линиях CTCL по сравнению с нормальными периферическими CD4+ хелперными T-клетками измеряли посредством ПЦР в реальном времени, используя общую РНК, выделенную из каждого типа клеток, в качестве матрицы. Калибровочные кривые с корреляцией значения Ct с числом копий miR-155-5p строили, используя синтетическую матрицу РНК miR-155-5p. Число копий miR-155-5p на клетку экстраполировали по значениям Ct, определяемым для образцов РНК CTCL или образца нормальной РНК CD4+ T-клеток с использованием калибровочной кривой, созданной по синтетической матрице, исходя из 10 пг общей РНК на клетку (фиг. 1). Клеточные линии грибовидного микоза человека (HuT102, MJ и My-La), а также идеопситическая клеточная линия (HH) демонстрировали высокую экспрессию miR-155-5p по сравнению с нормальными CD4+ T-клетками, тогда как клеточная линия, полученная у пациента с синдромом Сезари (HuT78), не экспрессировала miR-155-5p чрезмерно.
[00154] Клеточные линии CTCL культивировали в полной среде для выращивания с добавлением соединения 1 (SEQ ID NO: 27), соединения 2 (SEQ ID NO: 22), соединения 3 (SEQ ID NO: 23) и соединения 4 (SEQ ID NO: 25) против miR-155 в концентрациях в диапазоне от 2 мкМ до 50 мкМ. Соединения против miR добавляли в среду без каких-либо дополнительных компонентов для усиления клеточного захвата. Клетки собирали после 72 часов обработки и очищали общую РНК. ПЦР в реальном времени осуществляли для 13 непосредственных генных мишеней miR-155 (Worm et al. 2009; O'Connell et al. 2010; Zhang et al. 2012; и неопубликованные данные miRagen). Вычисляли относительную кратность изменения экспрессии 13 генов в клетках, обработанных соединениями против miR, по сравнению с необработанными клетками. На фиг. 2 приведено представление на «тепловой карте» изменений экспрессии генов в ответ на 72 часа обработки с использованием 10 мкМ указанного соединения против miR. Четыре предсказанные непосредственные мишени, у которых отсутствовала экспрессия по меньшей мере в одной клеточной линии, опущены. Кратность изменения экспрессии генов преобразовывали в log10, наносили на колориметрическую шкалу от синего до красного, где наиболее интенсивный красный представляет наивысшее относительное увеличение экспрессии гена и, наоборот, наиболее интенсивный синий представляет наибольшее снижение экспрессии гена. Тепловая карта показывает, что экспрессию нескольких из генов-мишеней miR-155-5p модулировали под воздействием антагонистов miR-155-5p в трех клеточных линиях грибовидного микоза человека (MJ, HuT102 и My-La). Схожие, но более умеренные изменения экспрессии генов наблюдали в идеопситической клеточной линии (HH), которая экспрессирует высокие уровни miR-155-5p. В отличие от этого, экспрессия этих генов не была значительно изменена в клеточной линии синдрома Сезари (HuT78), которая экспрессирует низкие уровни miR-155-5p, что показывает, что изменения уровней экспрессии генов в клеточных линиях грибовидного микоза человека и клеточной линии HH опосредованы антагонизмом к miR-155-5p.
Пример 2: соединения 2 (SEQ ID NO: 22) и 4 (SEQ ID NO: 25) против miR-155 демонстрируют более высокую активность в клеточных линиях фунгоидного микоза по сравнению с другими соединениями против miR
[00155] Четыре непосредственные генные мишени miR-155-5p (Bach1, Jarid2, Picalm и SHIP1) выбирали для дополнительного анализа, поскольку соединения против miR-155 модулировали эти четыре гена во всех трех клеточных линиях грибовидного микоза человека (MJ, HuT102 и My-La). Эти гены выбирали для того, чтобы представлять сигнатуру генной экспрессии для активности против miR in vitro. Дополнительно сигнатуру четырех генов использовали для того, чтобы сравнивать активность соединений против miR. Эти генные изменения воспроизводили в трех независимых экспериментах с использованием клеток с различным числом пассирований. На фиг. 3, 4, 5, 6 и 7 представлены результаты кратности изменения этой сигнатуры четырех генов в клеточных линиях HuT102, MJ, HH, My-La и Hut78, соответственно. * p-значение < 0,0001 по сравнению с необработанными по непараметрическому критерию Манна-Уитни. Критерий Манна-Уитни выбирали, поскольку дисперсии не равны между обработками по сравнению с необработанными клетками.
[00156] Кумулятивные данные для трех доз (2 мкМ, 10 мкМ и 50 мкМ) и трех клеточных линий грибовидного микоза человека показывали, что соединения 2 (SEQ ID NO: 22) и 4 (SEQ ID NO: 25) более активны, чем соединения 1 (SEQ ID NO: 27) и 3 (SEQ ID NO: 23). Как показано на фиг. 7, все четыре соединения против miR-155-5p не демонстрировали статистически значимую активность в линии синдрома Сезари (HuT78), что находится в соответствии с более низкими уровнями экспрессии miR-155 в этой клеточной линии, как показано на фиг. 1.
Пример 3: Изменения экспрессии генов, индуцированные лечением против miR-155, являются специфичными для ингибирования miR-155
[00157] Для того чтобы тестировать специфичность изменений экспрессии генов, индуцируемых соединениями против miR-155 по изобретению, клеточные линии грибовидного микоза человека обрабатывали олигонуклеотидами, которые не нацелены на miR-155 (контрольные олигонуклеотиды). Контрольный олигонуклеотид представлял собой 14-нуклеотидный олигонуклеотид против miR, направленный на мкРНК C. elegans, не экспрессируемую у млекопитающих (контроль 1). Второй олигонуклеотид представляет собой случайную 14-нуклеотидную последовательность соединения 4 против miR-155 (контроль 2). Клеточные линии MJ и HuT102 инкубировали с 10 мкМ соединений 3 (SEQ ID NO: 23) или 4 (SEQ ID NO: 25) против miR-155 или двумя контрольными олигонуклеотидами в течение 72 часов. На фиг. 8 представлена кратность изменения экспрессии гена для четырех непосредственных мишеней miR-155-5p, как измеряют посредством ПЦР. Сигнатуры генной экспрессии в клетках, которые обрабатывали соединениями 3 (SEQ ID NO: 23) или 4 (SEQ ID NO: 25) против miR-155, статистически значимо отличались от таковых у необработанных клеток. В отличие от этого, экспрессия генов в клетках, которые обрабатывали контрольными соединениями, не отличалась от таковых у необработанных клеток. Эти результаты показывают, что происходило снятие репрессии с непосредственных мишеней miR-155 в ответ на ингибирование miR-155, а не из-за неспецифических эффектов обработки олигонуклеотидами. * p-значение < 0,0001 по сравнению с необработанными по непараметрическому критерию Манна-Уитни.
Пример 4: определение профиля экспрессии полного генома клеточных линий CTCL, которые обрабатывали соединениями против miR-155, подтверждает взаимодействие с мишенью и дает механистическую идею
[00158] Для получения более полного понимания молекулярных последствий ингибирования miR-155 в клеточных линиях грибовидного микоза человека, осуществляли профилирование транскриптома полного генома для клеточных линий MJ и HuT102, которые обрабатывали соединениями 3 (SEQ ID NO: 23) или 4 (SEQ ID NO: 25) против miR-155 в течение 4 суток (96 часов) или 8 суток. Статистически значимую сигнатуру генной экспрессии определяли посредством однофакторного дисперсионного анализа для клеток, обработанных соединениями против miR, по сравнению с необработанными клетками в один и тот же момент времени. Данные фильтровали по генам, которые значительно менялись, при p-значении ≤ 0,05, скорректированном по уровню ложноположительных результатов. Результаты кратности изменения представлены на фиг. 9 и 10 в виде тепловых карт, как описано для фиг. 2.
[00159] Исследование глобальных сигнатур генной экспрессии в сутки 4 и сутки 8 свидетельствовало о динамике изменений экспрессии генов в ответ на лечение против miR-155: идентифицировали уникальные наборы генов, которые регулировали в ранний момент времени (4 сутки) или в поздний момент времени (8 сутки), а также некоторые гены, которые менялись в оба момента времени (фиг. 9 для профиля MJ, фиг. 10 для профиля HuT102). Кроме того, определение профиля экспрессии идентифицировало уникальные наборы генов, регулируемых в каждой клеточной линии, а также некоторые гены, регулируемые в обеих клеточных линиях. Соединение 4 (SEQ ID NO: 25) демонстрировало более значительную величину регуляции генов в обеих клеточных линиях и в оба момента времени, как продемонстрировано более высокой интенсивностью синих и красных цветов на тепловой карте соединения 4 (SEQ ID NO: 25).
[00160] Профиль генной экспрессии, общий для обеих клеточных линий и обоих соединений в сутки 4, анализировали на обогащение генными мишенями, совпадающими с последовательностью-затравкой miR-155-5p, (8-, 7- и 6-нуклеотидные сайты связывания). Кратность изменения этих генов представлена на тепловой карте на фиг. 11. Эта сигнатура из 150 генов под повышающей регуляцией значительно обогащена мишенями, совпадающими с последовательностью-затравкой miR-155-5p, (8-, 7- и 6-нуклеотидные сайты связывания) с гипергеометрическим p-значением 1,6×10-25 (фиг. 11A). Анализ с помощью функции кумулятивного распределения подтверждал обогащение мишенями, совпадающими с последовательностью-затравкой, и демонстрировал обогащение 8- > 7- > 6-нуклеотидными сайтами связывания (фиг. 11B). Генную сигнатуру также анализировали с использованием биоинформационного ресурса DAVID для обогащения функциональными аннотациями генов (Huang da et al., 2009). Значимое обогащение терминов базы данных Gene Ontology не происходило, как определено с помощью скорректированного по Бенжамини p-значения ≤ 0,01.
[00161] Сигнатуру генной экспрессии, общую для обеих клеточных линий и обоих соединений в сутки 8 (всего 677 генов) подвергали анализу на обогащение генными мишенями, совпадающими с последовательностью-затравкой, и на функциональные аннотации генов. Генная сигнатура под повышающей регуляцией значительно обогащена мишенями, совпадающими с последовательностью-затравкой, при гипергеометрическом p-значении < 10-27. В отличие от сигнатуры в сутки 4, сигнатура в сутки 8 также показывала выраженное обогащение двух терминов функциональной аннотации: представление антигена в сигнатуре под повышающей регуляцией и митотический клеточный цикл в сигнатуре под понижающей регуляцией (фиг. 12). Вместе эти результаты подтверждают, что эффект соединений против miR опосредован через ингибирование miR-155-5p и его непосредственные генные мишени, а также что фенотипы, обусловленные ингибированием функции miR-155-5p, могут включать усиленное представление антигена и снижение пролиферации.
[00162] Активность соединения 4 (SEQ ID NO: 25) против miR-155 дополнительно изучали посредством обработки третьей клеточной линии грибовидного микоза человека, MyLa, соединением 4 (SEQ ID NO: 25) в течение 4 суток и 8 суток и создания профиля изменений экспрессии генов. Для того чтобы тестировать специфичность соединения 4 (SEQ ID NO: 25), клетки клеточной линии синдрома Сезари (HuT78) обрабатывали соединением 4 (SEQ ID NO: 25) в течение 8 суток и создавали профиль изменения экспрессии генов. Эти результаты представлены на фиг. 13. Гены, которые статистически менялись, при p-значении <0,05, скорректированном по уровню ложноположительных результатов (FDR), в ответ на соединение 4 (SEQ ID NO: 25) в трех клеточных линиях грибовидного микоза человека, HuT102, MJ и My-La, изображены на тепловой карте, как описано выше. Общее число генов на тепловой карте составляет 324. На фиг. 13 показано, что обработка клеточной линии синдрома Сезари HuT78 соединением 4 (SEQ ID NO: 25) не дает значительного изменения экспрессии генов, что показывает, что изменения экспрессии генов в клеточных линиях грибовидного микоза человека в действительности обусловлены ингибированием miR-155-5p с помощью соединения 4 (SEQ ID NO: 25).
[00163] Дополнительно, гены, регулируемые соединением 4 (SEQ ID NO: 25) во всех трех клеточных линиях грибовидного микоза человека, идентифицировали как сигнатуру биологических маркеров, которую можно использовать для клинической оценки лечения соединениями против miR-155, такими как соединение 4 (SEQ ID NO: 25), по изобретению. Идентифицированный набор генов находился под повышающей регуляцией во всех трех клеточных линиях или под понижающей регуляцией во всех трех клеточных линиях. Общие сигнатуры для каждого момента времени (сутки 4 и сутки 8) идентифицировали и затем объединяли в один список генов (таблица 2). Не накладывали фильтр на величину экспрессии гена. Следовательно, таблица 2 содержит гены, которые регулируются только в сутки 4 или только в сутки 8, или регулируются в оба момента времени. Таблица 2 содержит 587 генов, включая ранние (непосредственные) мишени и нижележащие (опосредованные) мишени, регулируемые соединением 4 (SEQ ID NO: 25) (фиг. 21). Список генов в таблице 2 включает непосредственные мишени Bach1, Picalm и Jarid2, что демонстрирует, что эти гены являются надежными маркерами активности соединения 4 (SEQ ID NO: 25) для нескольких клеточных линий и моментов времени.
Пример 5: соединения против miR-155 по изобретению ингибируют клеточную пролиферацию и увеличивают апоптоз в CTCL клетках
[00164] Пассивный захват соединений против miR-155 CTCL клетками давал значительное снижение клеточной пролиферации и индуцировал запрограммированную гибель клеток. Эти эффекты наблюдали в двух клеточных линиях CTCL, HuT102 и MyLa. Соединения 2 (SEQ ID NO: 22) и 4 (SEQ ID NO: 25) против miR-155, которые демонстрировали более выраженное снятие репрессии с мишени, чем соединение 3 (SEQ ID NO: 23) против miR-155 в обеих клеточных линиях HuT102 и MyLa, демонстрировали более сильное ингибирование пролиферации и более сильную апоптозную активность.
[00165] На фиг. 14A представлен эффект соединения 4 (SEQ ID NO: 25) против miR-155, оказываемый на пролиферацию клеток HuT-102 с течением времени. Поскольку уровень АТФ коррелирует непосредственно с числом клеток, АТФ измеряли для того, чтобы определять число клеток. Эффект соединения 4 (SEQ ID NO: 25), оказываемый на число клеток, сравним с таковым, наблюдаемым с использованием бексаротена, терапевтического стандарта для CTCL (фиг. 14A). Снижение числа клеток сопровождалось увеличением апоптоза, как измеряют по активности каспазы 3/7 (фиг. 14B). Белки каспаз 3 и 7 являются членами семейства цистеиновых протеаз со специфичностью к аспарагиновой кислоте (каспаз). Семейство каспаз играет роль ключевого эффектора в апоптозе в клетках млекопитающих. Активность каспаз нормализовали по уровням АТФ, поскольку все клетки имеют низкий уровень базовой активности каспаз, который может искажать результаты, если не нормализовать надлежащим образом. Соединение 4 (SEQ ID NO: 25) демонстрировало более выраженную индукцию апоптоза, чем бексаротен (фиг. 14B).
[00166] В дополнение к динамике, титрование дозы соединений против miR-155 в клетках HuT102 осуществляли с измерениями АТФ и каспазы 3/7, которые выполняли после 8 суток обработки (фиг. 15A и 15B, соответственно). Эти результаты подтверждают ингибиторный потенциал соединения 4 (SEQ ID NO: 25).
[00167] Схожие эффекты, оказываемые на пролиферацию и активацию каспазы 3/7, наблюдали с использованием соединения 2 (SEQ ID NO: 22) против miR-155 в сутки 8 в клетках HuT-102 (фиг. 16A и 16B, соответственно).
[00168] Соединение 4 (SEQ ID NO: 25) демонстрировало схожую активность во второй клеточной линии грибовидного микоза человека, клетках My-La. На фиг. 17A и 17B представлены пролиферация и активация каспазы 3/7 с течением времени с использованием соединений 3 (SEQ ID NO: 23) и 4 (SEQ ID NO: 25). Подобно клеткам HuT102, соединение 4 (SEQ ID NO: 25) демонстрировало более выраженную активность по сравнению с соединением 3 (SEQ ID NO: 23).
[00169] В дополнение к динамике, титрование дозы соединений против miR-155 в клетках My-La осуществляли с использованием измерений АТФ и каспазы 3/7 после 8 суток обработки (фиг. 18A и 18B, соответственно). Эти результаты дополнительно подтверждают ингибиторный потенциал соединения 4 (SEQ ID NO: 25).
Пример 6: Лечение против miR-155 в комбинации с ингибитором HDAC усиливает эффект, оказываемый на клеточную пролиферацию и апоптозную активность.
[00170] Вориностат (химическое название: SAHA) представляет собой стандартную эпигенетическую терапию для пациентов с запущенным фунгоидным микозом. Однако побочные эффекты общих ингибиторов HDAC достаточно описаны. Для того чтобы определять, может ли комбинированное лечение демонстрировать увеличенную активность по сравнению с лечением отдельными соединениями, клетки HuT102 обрабатывали субэффективной дозой SAHA в комбинации с соединениями против miR-155.
[00171] Клетки HuT102 обрабатывали с использованием 0,25 мкМ SAHA и 10 мкМ соединения 3 (SEQ ID NO: 23) или 4 (SEQ ID NO: 25), индивидуально или в комбинации. Клетки собирали каждые сутки для того, чтобы измерять уровни АТФ и активность каспазы 3/7. Уровни АТФ представлены на фиг. 19A. Схожий эксперимент осуществляли с использованием 0,50 мкМ SAHA. На фиг. 19B представлены уровни АТФ, полученные, когда клетки HuT102 обрабатывали с использованием 0,50 мкМ SAHA и 10 мкМ соединения 3 (SEQ ID NO: 23) или 4 (SEQ ID NO: 25), индивидуально или в комбинации.
[00172] На фиг. 20A и 20B представлен эффект, оказываемый на активность каспазы 3/7. Соединение 4 (SEQ ID NO: 25) в комбинации с 0,25 или 0,5 мкМ SAHA вело к увеличенному апоптозу по сравнению с каждым лечением в отдельности. Эти данные подсказывают, что олигонуклеотиды против miR-155 можно использовать в комбинации с низкими дозами общего ингибитора HDAC.
Пример 7: активность олигонуклеотидов против miR-155 различной длины
[00173] Для того чтобы оценивать активность ингибитора miR-155, использовали двойную люциферазную репортерную аналитическую систему. Вкратце, сайт связывания для miR-155 клонировали в 3' UTR гена люциферазы Renilla, который расположен в коммерчески доступной векторной системе psiCHECK-2 (Promega). В отсутствие ингибитора miR-155, экспрессию белка люциферазы Renilla репрессировал имитатор miR-155. В присутствии ингибитора miR-155 происходило снятие репрессии с экспрессии белка люциферазы Renilla. Для того чтобы контролировать трансфекцию плазмиды, вектор содержит ген люциферазы светлячка, который не содержит сайт связывания miR-155. Экспрессию люциферазы Renilla или светлячка измеряют через обнаружение света, испускаемого белком люциферазы.
[00174] 50 нг двойной люциферазной репортерной плазмиды, содержащей сайт связывания miR-155, трансфицировали в клетки HeLa без имитатора miR-155 (только «репортер»), с использованием 10 нМ имитатора miR-155 («репортер+имитатор»), с использованием 10 нМ имитатора miR-155 и 2 нМ контрольного олигонуклеотида или 10 нМ имитатора miR-155 и 2 тестового олигонуклеотидного ингибитора miR-155 длиной 11-14 нуклеотидов (таблица 4). В Dharmacon приобретали имитатор miR-155 (имитатор miRIDIAN microRNA Human hsa-miR-155-5p; номер доступа MIMAT0000646; № по каталогу C-300647-05-0005), который содержит последовательность зрелой мкРНК: -UUAAUGCUAAUCGUGAUAGGGGU- (SEQ ID NO: 121). Контрольный олигонуклеотид, который использовали в эксперименте, имел следующую последовательность: 5'-lCs.dTs.dAs.lGs.dAs.lAs.dAs.lGs.lAs.dGs.lTs.dAs.lGs.lA-3' (SEQ ID NO: 122).
Таблица 4
[00175] На фиг. 22 показано, что трансфекция репортерной плазмиды и имитатора вела к максимальной репрессии люциферазы; трансфекция только репортерной плазмиды вела к максимальной экспрессии люциферазы; трансфекция контрольного олигонуклеотида с репортером и имитатором не снимала репрессии с экспрессии люциферазы; и трансфекция тестовых олигонуклеотидных ингибиторов miR-155 с репортером и имитатором снимала репрессию с экспрессии люциферазы в различной степени.
Пример 8: активность олигонуклеотидов против miR-155, содержащих различное число замкнутых нуклеотидов (LNA)
[00176] Эксперимент осуществляли, как описано в примере 7. Тестовые олигонуклеотидные ингибиторы miR-155, которые использовали в этом эксперименте, различались числом содержащихся LNA (таблицы 5-8). Результаты представлены на фиг. 23A (таблица 5), 23B (таблица 6), 23C (таблица 7) и 23D (таблица 8).
Таблица 5
Таблица 6
Таблица 7
Таблица 8
Пример 9: активность олигонуклеотидов против miR-155, содержащих LNA модификации в различных положениях
[00177] Эксперимент осуществляли, как описано в примере 7. Тестовые олигонуклеотидные ингибиторы miR-155, которые использовали в этом эксперименте, различались положением LNA модификаций (таблицы 9-12). Результаты представлены на фиг. 24A (таблица 9), 24B (таблица 10), 24C (таблица 11) и 24D (таблица 12).
Таблица 9
Таблица 10
Таблица 11
Таблица 12
Пример 10: Активность олигонуклеотидов против miR-155, содержащих различные модификации нуклеотидов
[00178] Эксперимент осуществляли, как описано в примере 7. Тестовые олигонуклеотидные ингибиторы miR-155, которые использовали в этом эксперименте, составляли 14 нуклеотидов в длину, и каждый содержал 9 модификаций нуклеотидов (таблица 13). Модификации нуклеотидов включали замкнутые нуклеотиды (LNA), нуклеиновые кислоты с этиленовым мостиком/ нуклеотиды с этиленовым мостиком (ENA) и бициклический нуклеотид с 2'-C-мостиком (CBBN). Результаты представлены на фиг. 25.
Таблица 13
l=замкнутый нуклеотид; d=дезоксирибонуклеотид; s=фосфортиоатная связь; e=нуклеотид с этиленовым мостиком; ab=бициклический нуклеотид с амино-2'-C-мостиком (CBBN).
Пример 11: активность олигонуклеотидов против miR-155 длиной 14 нуклеотидов
[00179] Эксперимент осуществляли, как описано в примере 7. Тестовые олигонуклеотидные ингибиторы miR-155, которые использовали в этом эксперименте, составляли 14 нуклеотидов в длину и содержали 9 или 10 LNA модификаций (таблица 14). Результаты представлены на фиг. 26.
Таблица 14
Пример 12: Активность олигонуклеотидных ингибиторов против miR-155, содержащих SEQ ID NO: 25 и 23
[00180] Эксперимент осуществляли, как описано в примере 7. Тестовые олигонуклеотидные ингибиторы miR-155, которые использовали в этом эксперименте, представляли собой олигонуклеотидные ингибиторы SEQ ID NO: 25 и 23. Результаты представлены на фиг. 27.
Пример 13: Активность олигонуклеотидных ингибиторов против miR-155, содержащих SEQ ID NO: 25 и 120.
[00181] Олигонуклеотидные ингибиторы miR-155 SEQ ID NO: 25 и 120 пассивно трансфицировали в клеточную линию Oci-Ly3. мРНК выделяли в сутки 4 и анализировали посредством qPCR на экспрессию генов-мишеней miR-155 (Bach1, CEBPB, CUX1, INPP5D/SHIP1, Jarid2, Picalm и Wee1). На фиг. 28 представлена кратность изменения экспрессии этих генов после трансфекции олигонуклеотидных ингибиторов SEQ ID NO: 25 и 120. Порядок генов слева направо в каждой точке данных на фиг. 28: Bach1, CEBPB, CUX1, INPP5D/SHIP1, Jarid2, Picalm и Wee1. SEQ ID NO: 120 содержит CBBN нуклеотиды в тех же положениях, что LNA в SEQ ID NO: 25.
Реферат
Изобретение относится к биотехнологии. Описан олигонуклеотидный ингибитор miR-155, содержащий/состоящий из последовательность/и 5’-lCs.dAs.lCs.dGs.dAs.lTs.lTs.dAs.lGs.dCs.lAs.lTs.lTs.lA-3’ (SEQ ID NO: 25), где l представляет собой замкнутый нуклеотид; d представляет собой дезоксирибонуклеотид; s представляет собой фосфортиоатную связь или олигонуклеотидный ингибитор miR-155, содержащий/состоящий из последовательность/и 5’-lCs.dAs.lCs.dGs.dAs.lTs.lTs.dAs.lGs.lCs.dAs.lTs.lTs.lA-3’ (SEQ ID NO: 53), где l представляет собой замкнутый нуклеотид; d представляет собой дезоксирибонуклеотид; s представляет собой фосфортиоатную связь. Изобретение может быть использовано для лечения злокачественной опухоли, такой как T-клеточная лимфома. Изобретение также может быть использовано для снижения или ингибирования пролиферации озлокачествленных T-клеток. 7 н. и 27 з.п. ф-лы, 28 ил., 14 табл., 13 пр.
Формула
Документы, цитированные в отчёте о поиске
Двойное нацеливание нп mir-208 и mir 499 в лечении заболеваний сердца

Комментарии