Имплантат и способ обработки поверхности имплантата - RU2313307C2
Код документа: RU2313307C2
Чертежи

















Описание
Изобретение относится к имплантату для имплантации в костную ткань и к способу обработки поверхности имплантата, предназначенного для имплантации в костную ткань, для улучшения биологической совместимости имплантата, включающего указанную поверхность.
Предпосылки изобретения
В настоящее время в большинстве случаев для имплантации ортопедических или стоматологических имплантатов, как правило, металлических имплантатов, в костную ткань используется одноэтапная процедура.
При одноэтапной процедуре первую часть имплантата, такую как стоматологическую неподвижно закрепляемую деталь, хирургически помещают в костную ткань, а защитный колпачок или часть вторичного имплантата, такую как опору, прикрепляют затем к первой части имплантата непосредственно после хирургической операции. Затем мягкой ткани дают возможность зажить вокруг защитного колпачка или части вторичного имплантата. При использовании защитного колпачка колпачок удаляют через несколько недель или месяцев без какой-либо хирургической процедуры, а части вторичного имплантата, такие как опорный зуб и временная коронка, прикрепляют к первой части имплантата. Одноэтапная процедура, например, описана в публикации L Cooper et al.: "A multicenter 12-month evaluation of single-tooth implants restored 3 weeks after 1-stage surgery", The International Journal of Oral & Maxillofacial Implants, Vol 16, No 2 (2001).
Двухэтапная процедура, которую еще может быть необходимо использовать в некоторых стоматологических случаях, включает на первом этапе хирургическое размещение первой части имплантата, такой как стоматологическая неподвижно закрепленная деталь, в костную ткань, где ей затем дают возможность находиться без нагрузки и в неподвижном состоянии в течение периода заживления 3 мес или более для обеспечения возможности нарастания костной ткани для обеспечения возможности хорошего прикрепления имплантата к костной ткани, причем разрез в мягкой ткани покрывает участок имплантата, имея возможность зажить над имплантатом, и на втором этапе открытие мягкой ткани, покрывающей имплантат, и прикрепление частей вторичного имплантата, такого как опорный зуб и/или протез зуба, к первой части имплантата, такой как указанная стоматологическая неподвижно закрепленная деталь, формируя конечную структуру имплантата. Указанная процедура, например, описана Brenemark et al.: "Osseointegrated Implants in the Treatment of the Edentulous Jaw, Experience from a 10-year period", Almquist & Wiksell International, Stockholm, Sweden.
Однако тот факт, что имплантат не должен испытывать нагрузку во время периода заживления, означает, что части вторичного имплантата нельзя прикрепить к части первого имплантата и/или использовать во время периода заживления длительностью 3 мес или более. Учитывая связанный с этим дискомфорт, желательно минимизировать период времени, необходимый для указанной выше первой стадии, или даже выполнять всю процедуру имплантации в одной операции, т.е. использовать одноэтапную процедуру.
Для некоторых пациентов может считаться лучшим ожидание, по меньшей мере, в течение трех месяцев перед функциональной нагрузкой имплантата и для одно-, и для двухэтапных процедур. Однако альтернативой использования одноэтапной процедуры является введение имплантата в функцию непосредственно после имплантации (ранняя нагрузка). Указанные процедуры, например, описаны D M Esposito, pp. 836-837, in Titanium in Medicine, Material Science, Surface Science, Engineering, Biological Responses and Medical Application, Springer-Verlag (2001).
Существенно, чтобы имплантат приобретал достаточную устойчивость и связь между имплантатом и костной тканью для обеспечения возможности описанной выше немедленной или ранней нагрузки имплантата.
Следует также отметить, что немедленная или ранняя нагрузка имплантата может оказывать благоприятное воздействие на формирование кости.
Некоторые из металлов или сплавов, таких как титан, цирконий, гафний, тантал, ниобий или их сплавы, которые используются для костных имплантатов, способны формировать относительно прочную связь с костной тканью, связь, которая может быть такой же прочной как сама костная ткань, иногда даже прочнее. Наиболее примечательным примером данного вида материала металлического имплантата является титан и сплавы титана, свойства которых в этом отношении были известны приблизительно с 1950 г. Данная связь между металлом и костной тканью была названа «оссеоинтеграцией» Branemark et al.
Хотя связь между металлом, например титаном, и костной тканью может быть сравнительно прочной, желательно усилить данную связь.
В настоящее время существует несколько способов обработки металлических имплантатов для получения лучшего прикрепления имплантата и, таким образом, улучшенной оссеоинтеграции. Некоторые из них включают изменение морфологии имплантата, например, созданием относительно больших неровностей на поверхности имплантата для увеличения шероховатости, по сравнению с необработанной поверхностью. Увеличенная шероховатость поверхности обеспечивает больший контакт и площадь прикрепления между имплантатом и костной тканью, посредством чего можно получить лучшее механическое удерживание и прочность. Шероховатость поверхности может быть обеспечена, например, плазменным напылением, струйной очисткой или травлением.
Обеспечивающее шероховатость травление поверхностей имплантата можно выполнить восстанавливающими кислотами, такими как фтористоводородная кислота (HF) или смеси хлористоводородной кислоты (HCl) и серной кислоты (H2SO4). Целью такого способа шерохования травлением является получение поверхностей имплантата с достаточно большими неровностями, такими как диаметры пор в пределах диапазона 2-10 мкм и глубины пор в пределах диапазона 1-5 мкм.
Другие способы получения лучшего прикрепления имплантата к костной ткани включают изменение химических свойств поверхности имплантата. Например, один способ включает нанесение слоя керамического материала, такого как гидроксиапатит, на поверхность имплантата, наряду с другим, для стимуляции регенерации костной ткани. Однако керамические покрытия могут быть хрупкими и могут опадать или отламываться от поверхности имплантата, что, в свою очередь, ведет, в конечном счете, к повреждению имплантата.
Кроме раскрытых выше способов модификации поверхности имплантата следует отметить, что при контакте с кислородом титан, цирконий, гафний, тантал, ниобий и их сплавы немедленно покрываются тонким слоем оксида. Слои оксида титановых имплантатов, главным образом, состоят из двуокиси титана (IV) (TiO2) с небольшими количествами Ti2О3 и TiO. Оксид титана в целом имеет толщину приблизительно 4-8 нм. Однако титановые имплантаты, имеющие толщину слоя оксида приблизительно до 20 мкм, можно создать с использованием анодирования (анодного окисления). По мере того как толщина слоя оксида титана увеличивается, увеличиваются пористость и шероховатость поверхности слоя оксида. Кроме того, кристалличность оксида титана увеличивается по мере увеличения толщины слоя оксида. Таким образом, шероховатость поверхности имплантата можно также получить созданием более толстого слоя оксида.
В предыдущей заявке авторов изобретения WO 95/17217 описывается способ, в котором металлический имплантат (после струйной очистки или без струйной очистки) обрабатывают 0,2% раствором фтористоводородной кислоты в течение периода обработки предпочтительно 30 с при комнатной температуре. В соответствии с WO 95/17217 морфология поверхности имплантата не тронута данной обработкой, т.е. значительного травления поверхности не происходит.
В предыдущей заявке авторов изобретения WO 94/13334 описывается способ, в котором металлический имплантат обрабатывают водным раствором, содержащим фторид натрия, имеющим концентрацию приблизительно 0,1-4%, рН 2, 5-6, в течение периода, по меньшей мере, от 10 с до около 5 мин при комнатной температуре.
В обеих предыдущих заявках описаны металлические имплантаты, имеющие улучшенную биологическую совместимость, и способы их изготовления. Конкретно скорость прикрепления костной ткани увеличивается и получается более прочное связывание между имплантатом и костной тканью. Считают, что улучшенная биологическая совместимость данных имплантатов связана с удержанием фтора и/или фторида на поверхностях имплантата.
Предполагают, что фтор и/или фторид, в соответствии с данными J E Ellingsen, "Pre-treatment of titanium implants with fluoride improves their retention in bone", Journal of Material Science: Materials in Medicine, 6 (1995), pp.749-753, взаимодействует с поверхностным слоем оксида титана и замещает связанный с титаном кислород для образования соединения фторида титана. In vivo кислород фосфата в тканевой жидкости может замещать фторид в слое оксида, и фосфат станет затем ковалентно связанным с титановой поверхностью. Это может вызвать образование кости, где фосфат в кости связан с титановым имплантатом. Кроме того, высвобожденный фторид может катализировать данную реакцию и вызвать образование соединенного с фторидом гидроксиапатита и фторапатита в окружающей кости.
Описание изобретения
Целью настоящего изобретения является создание имплантата для имплантации в костную ткань, имеющего улучшенную скорость соединения между имплантатом и костной тканью, так что описанный выше послеоперационный период заживления (при использовании одно- или двухэтапной процедуры) уменьшается и/или обеспечивается возможность немедленной или ранней нагрузки имплантата.
Другой целью изобретения является создание имплантата, формирующего механически более прочную связь с костной тканью. Таким образом, должен быть создан имплантат, предназначенный для имплантации в костную ткань, имеющий улучшенную биологическую совместимость.
Еще одной целью изобретения является создание способа обработки поверхности имплантата, предназначенного для имплантации в костную ткань, такой как поверхность ортопедического или стоматологического имплантата, посредством которого получают имплантат в соответствии с изобретением.
В соответствии с первым аспектом изобретения указанные и другие цели достигаются способом обработки поверхности имплантата, предназначенного для имплантации в костную ткань, которая содержит фтор и/или фторид, по меньшей мере, на части поверхности имплантата, такой как 1-99% площади, предпочтительно >10% площади, предпочтительнее >40% площади, с атомной средней концентрацией предпочтительно, по меньшей мере, 0,2 ат.%, и обеспечение на поверхности имплантата микрошероховатости, имеющей среднеквадратическую шероховатость (Rq и/или Sq) ≤250 нм, такую как от 1 до 250 нм.
Микрошероховатость включает неровности поверхности в форме пор и, необязательно, пиков, и их можно, следовательно, также выразить с точки зрения размеров пор.
Таким образом, в соответствии со вторым аспектом изобретения указанная цель и другие цели достигаются способом обработки поверхности имплантата, предназначенного для имплантации в костную ткань, который включает предоставление фтора и/или фторида, по меньшей мере, на части поверхности имплантата, такой как 1-99% площади, предпочтительно >10% площади, предпочтительнее >40% площади, с атомной средней концентрацией предпочтительно, по меньшей мере, 0,2 ат.%, и обеспечение на поверхности имплантата микрошероховатости, включающей поры, имеющие диаметр пор ≤1 мкм, такой как от 1 до 1 мкм, предпочтительно, в пределах диапазона от 50 нм до 1 мкм, и глубину пор ≤500 нм, такую как от 1 до 500 нм, предпочтительно в пределах диапазона от 50 до 500 нм.
Указанные процедуры способа в соответствии с изобретением можно выполнять в любом порядке или одновременно.
Один вариант реализации способа в соответствии с изобретением включает обработку поверхности металлического имплантата водным раствором фтористоводородной кислоты, имеющим концентрацию предпочтительно менее чем 0,5 М, предпочтительнее 0,1 М, приводящую к травлению, в течение периода травления предпочтительно до 180 с, предпочтительнее до 60 с, при комнатной температуре (24±1°С). В данном варианте реализации фтор и/или фторид и микрошероховатость предоставляются одновременно.
Было показано, что удивительно хорошие результаты биологической совместимости получаются для имплантата, имплантированного в костную ткань, имеющего поверхность имплантата, включающую фтор и/или фторид и мелкую микрошероховатость, как определено выше. Получается и улучшенная скорость соединения, и более прочная связь между поверхностью имплантата и костной тканью. Таким образом, мелкая микрошероховатость в комбинации с фтором и/или фторидом улучшают процесс оссеоинтеграции.
В соответствии с третьим аспектом изобретения указанные цели и другие цели достигаются имплантатом для имплантации в костную ткань, имеющим поверхность имплантата, по меньшей мере, часть которой, такая как 1-99% площади, предпочтительно >10% площади, предпочтительнее >40% площади, была обработана способом в соответствии с изобретением, как описано выше в данном описании.
В соответствии с четвертым аспектом изобретения указанные цели и другие цели достигаются имплантатом для имплантации в костную ткань, имеющим поверхность имплантата, причем, по меньшей мере, часть поверхности имплантата, такая как 1-99% площади, предпочтительно >10% площади, предпочтительнее >40% площади, содержит фтор и/или фторид и микрошероховатость, имеющую среднеквадратическую шероховатость (Rq и/или Sq ) ≤250 нм, такую как от 1 до 250 нм.
В соответствии с пятым аспектом изобретения указанные цели и другие цели достигаются имплантатом для имплантации в костную ткань, имеющим поверхность имплантата, причем, по меньшей мере, часть поверхности имплантата, такая как 1-99% площади, предпочтительно >10% площади, предпочтительнее >40% площади, включает фтор и/или фторид, и микрошероховатость, которая включает поры, имеющие диаметр пор ≤1 мкмм, такой как от 1 нм до 1 мкм, предпочтительно, в пределах диапазона от 50 нм до 1 мкм, и глубину пор ≤500 нм, такую как от 1 до 500 нм, предпочтительно, в пределах диапазона от 50 до 500 нм.
Другие признаки и преимущества настоящего изобретения станут очевидными из вариантов реализации, описанных ниже, и прилагаемой формулы изобретения.
Краткое описание чертежей
Фиг.1 определяет термины «диаметр пор» (D), «глубина пор» (h) и «ширина пика на половине глубины пор» (х).
На фиг.2 показаны полученные сканирующей электронной микроскопией (SEM) картины подвергнутой грубой струйной очистке эталонной поверхности имплантата.
На фиг.3 показаны полученные SEM картины описанной в настоящем описании и проанализированной поверхности имплантата предшествующего уровня техники в соответствии с WO 95/17217. Поверхность имплантата не подвергнута струйной очистке.
На фиг.4 показаны полученные SEM картины варианта реализации поверхности имплантата в соответствии с настоящим изобретением. Поверхность имплантата не подвергнута струйной очистке и была обработана в соответствии со способом I (Пример 1, без струйной очистки).
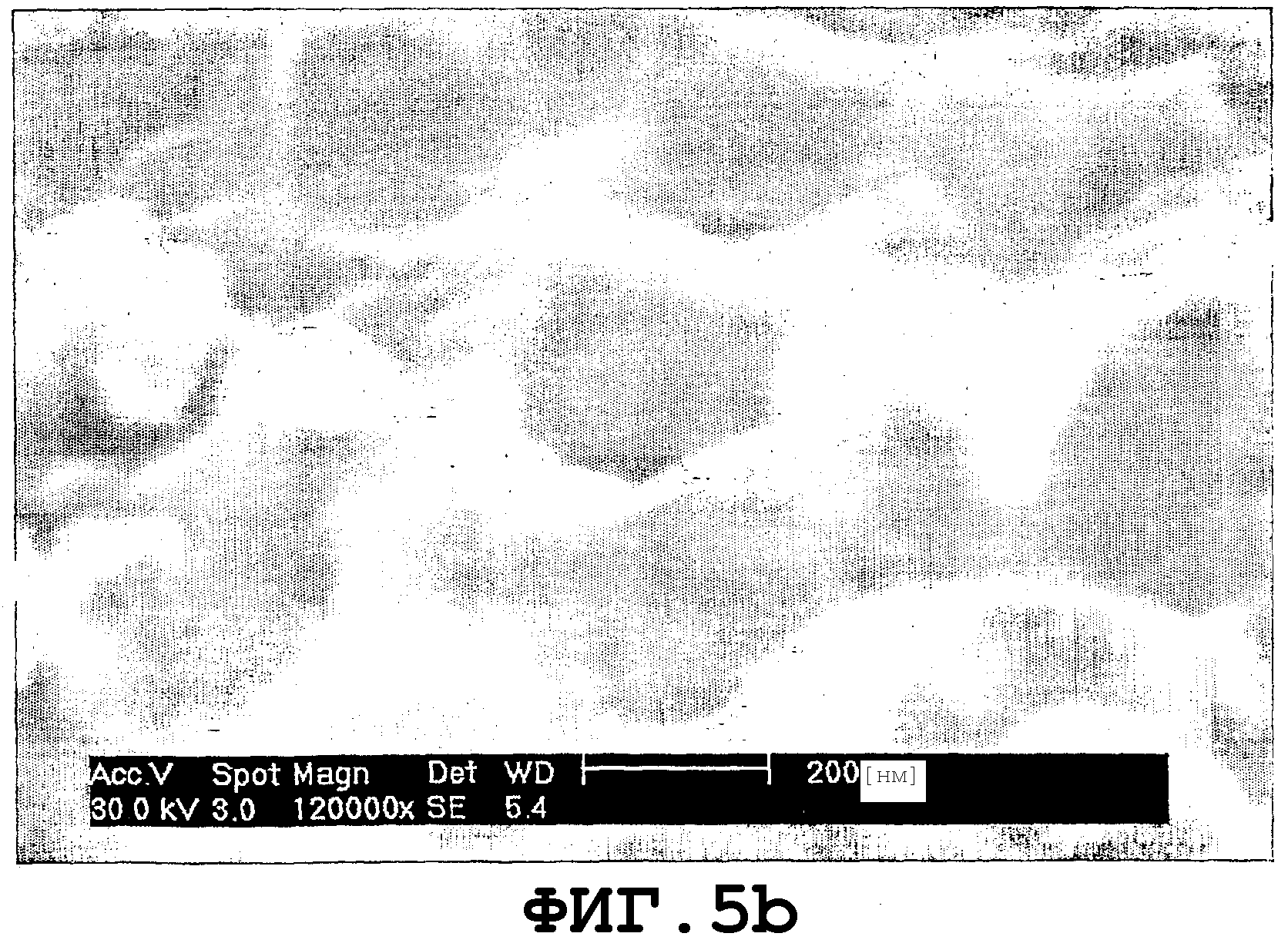
На фиг.5 показаны полученные SEM картины варианта реализации поверхности имплантата в соответствии с настоящим изобретением. Поверхность имплантата была подвергнута грубой струйной очистке и была обработана в соответствии со способом I (Пример 1, с грубой струйной очисткой).
На фиг.6 показаны полученные SEM картины варианта реализации поверхности имплантата в соответствии с настоящим изобретением. Поверхность имплантата не подвергнута струйной очистке и была обработана в соответствии со способом II (Пример 2, без струйной очистки).
На фиг.7 показаны полученные SEM картины варианта реализации поверхности имплантата в соответствии с настоящим изобретением. Поверхность имплантата была подвергнута грубой струйной очистке и была обработана в соответствии со способом II (Пример 2, с грубой струйной очисткой).
Фиг.8 иллюстрирует профиль AFM поверхности, показанной на фиг.3 (имплантат предшествующего уровня техники).
Фиг.9 иллюстрирует профиль AFM поверхности, показанной на фиг.4 (Пример 1, без струйной очистки).
Фиг.10 иллюстрирует профиль AFM поверхности, показанной на фиг.6 (Пример 2, без струйной очистки).
Фиг.11 иллюстрирует распределение фтора и/или фторида (измеренное с использованием TOF-SIMS) на поверхности имплантата поверхности, показанной на фиг.5 (пример 1, подвергнутый грубой струйной очистке).
Фиг.12 иллюстрирует распределение фтора и/или фторида (измеренное с использованием TOF-SIMS) на поверхности имплантата поверхности, показанной на фиг.7 (пример 2, подвергнутый грубой струйной очистке).
Подробное описание изобретения
Используемый в настоящем описании в связи с изобретением термин «травление» относится к процессу, происходящему во время периода обработки, в течение которого Н2 (g) генерируется на поверхности имплантата. Период травления измеряется от образования первого пузырька Н2 (g) на поверхности имплантата. Травление в контексте настоящего изобретения относится к очень мягкому травлению поверхности имплантата, обеспечивающему описанную в настоящем описании желательную микрошероховатость.
Используемый в настоящем описании термин «микрошероховатость» относится к шероховатости, включающей поры, имеющие диаметр пор, равный 1 мкм, или меньше его, и глубину пор, равную 1 мкм, или меньше ее.
Используемый в настоящем описании термин «макрошероховатость» относится к шероховатости поверхности, включающей неровности поверхности, имеющие размеры более чем 1 мкм.
Используемый в настоящем описании термин «имплантат» включает любое устройство, предназначенное для имплантации в организм позвоночного животного. В частности, млекопитающего, такого как человек. Имплантаты можно использовать для замещения элементов анатомической структуры и/или восстановления любой функции организма.
Обычно имплантат состоит из одной или нескольких частей имплантата. Например, стоматологический имплантат обычно включает стоматологическую неподвижно закрепленную деталь, соединенную с частями вторичного имплантата, такими как опорный зуб и/или протез зуба. Однако любое устройство, такое как стоматологическая неподвижно закрепленная деталь, предназначенная для имплантации, может отдельно именоваться имплантатом, даже если другие части должны соединяться с ней.
Используемый в настоящем описании термин «имплантат (предназначенный) для имплантации в костную ткань» относится к имплантатам, предназначенным, по меньшей мере, для частичной имплантации в костную ткань, таким как стоматологические имплантаты, ортопедические имплантаты и подобные им. Имплантат для имплантации в костную ткань можно также именовать имплантатом костной ткани.
Используемый в настоящем описании термин «поверхность имплантата» относится, по меньшей мере, к одной области поверхности имплантата. Таким образом, определенная область поверхности может включать всю площадь поверхности имплантата или ее части.
Примером поверхности имплантата, предназначенного для имплантации в костную ткань, является поверхность стоматологической неподвижно закрепленной детали, которая предназначена для имплантации в челюстную кость пациента, и должна контактировать с костной тканью.
Другим примером поверхности имплантата, предназначенного для имплантации в костную ткань, является поверхность имплантата тазобедренного сустава, который предназначен для имплантации в шейку бедренной кости пациента.
Термины «диаметр пор» (D), «глубина пор» (h) и «ширина пика на половине глубины пор» (х) определены на фиг.1. Данные термины используются в контексте микрошероховатости. На фиг.1 микрошероховатость наложена на макрошероховатость. Однако те же термины используются для микрошероховатости, предоставляемой на поверхности, лишенной указанной макрошероховатости.
Диаметр пор (D) представляет собой расстояние между самыми высокими точками двух соседних пиков, как определено на фиг.1. Если имеется несколько точек на одном и том же уровне, которые можно именовать самыми высокими, то следует выбрать точку, самую близкую к поре. Если «пики» слишком широкие (т.е., поверхность может казаться лишенной четко определенных пиков), поверхность можно описать как имеющую по существу плоский профиль поверхности между порами (образующими указанную микрошероховатость), которые распространены по поверхности. В таком случае диаметр пор представляет собой расстояние между теми точками, где профиль поверхности начинает отклоняться от по существу плоского профиля поверхности, таким образом, образуя указанные поры. Это согласуется с указанным определением, показанным на фиг.1.
Глубина пор (h) определяется как расстояние между воображаемой линий, проведенной между самыми высокими точками двух соседних пиков, и дном поры (в самой низкой точке (см. фиг.1). Расстояние измеряется в направлении, перпендикулярном к касательной указанной самой низкой точки поры. Если имеется несколько точек на самом низком уровне, в качестве глубины пор рассчитывается средняя величина расстояний от указанных точек до воображаемой линии. Если нет четко очерченных пиков, воображаемая линия проводится между теми точками, где профиль поверхности начинает отклоняться от по существу плоского профиля поверхности, таким образом, формируя указанную пору.
Ширина пика (х) на половине глубины поры (h) определяется как показано на фиг.1.
Настоящее изобретение относится к способу обработки поверхности имплантата, предназначенного для имплантации в костную ткань, который включает предоставление фтора и/или фторида, по меньшей мере, на части поверхности имплантата, и обеспечение на поверхности имплантата микрошероховатости, имеющей среднеквадратическую шероховатость (Rq и/или Sq) ≤250 нм. Среднеквадратическая шероховатость соответствует среднеквадратическому отклонению профиля от средней линии по длине одного образца. Rq представляет собой среднеквадратическую шероховатость, измеренную в двух измерениях, а Sq представляет собой среднеквадратическую шероховатость, измеренную в трех измерениях.
Среднеквадратическую шероховатость (Rq и/или Sq) можно измерить атомной силовой микроскопией (AFM) для площади поверхности 5×5 мкм. AFM представляет собой очень чувствительный метод характеристики поверхности. Однако анализ следует осуществлять осторожно с тем, чтобы анализировалась микрошероховатость, а не структура лежащей в основании поверхности, такой как поверхность, подвергнутая струйной очистке или обработке на станке.
Среднеквадратическую шероховатость можно также рассчитать на основании морфологии поверхности, показанной на фотографиях SEM поверхности имплантата или оценить по результатам, полученным любым другим способом характеристики поверхности.
Таким образом, расчеты с использованием диаметра пор ≤1 мкм и глубины пор ≤500 нм, дает среднеквадратическую шероховатость (Rq) ≤250 нм на основании определения среднеквадратической шероховатости (Rq), как известно специалисту в данной области.
Микрошероховатость, которая включает неровности поверхности в форме пор и, необязательно, пиков, можно также выразить с точки зрения размеров пор.
Таким образом, способ обработки поверхности имплантата, предназначенного для имплантации в костную ткань в соответствии с изобретением, включает предоставление фтора и/или фторида, по меньшей мере, на части поверхности имплантата, и обеспечение микрошероховатости, включающей поры, имеющие диаметр пор ≤1 мкм, предпочтительно в пределах диапазона от 50 нм до 1 мкм, и глубину пор ≤500 нм, предпочтительно в пределах диапазона от 50 до 500 нм, на поверхности имплантата.
Кроме того, микрошероховатость может также предпочтительно включать пики, имеющие ширину пика на половине глубины пор от 15 до 150% диаметра пор (см. фиг.1). Таким образом, ширина пика находится предпочтительно в пределах диапазона от 7,5 нм до 1,5 мкм. Даже еще более предпочтительными являются пики, имеющие ширину пика на половине глубины пор от 30 до 150% диаметра пор. Наиболее предпочтительными являются пики, имеющие ширину пика на половине глубины пор от 60 до 150% диаметра пор.
Данная специфическая морфология поверхности дает очень устойчивое врастание кости. При данной специфической морфологии вновь сформированная кость, которая врастает в неровности поверхности имплантата, нелегко отламывается от старой кости. Кроме того, пики поверхности имплантата нелегко отламываются от имплантата.
Кроме того, следует отметить, что только часть или части поверхности имплантата могут включать определенные в настоящем описании неровности поверхности, что означает, что поры и, необязательно, также пики, могут группироваться в нескольких областях по всей поверхности. Таким образом, расстояния между порами и/или пиками могут варьироваться по всей поверхности. Предпочтительно >10% площади поверхности имплантата включают указанные неровности поверхности, предпочтительнее >40% площади, а еще предпочтительнее >70% площади. Наиболее предпочтительно вся поверхность имплантата включает указанные неровности поверхности, однородно распределенные по всей поверхности.
Нет необходимости в том, чтобы указанная, по меньшей мере, часть поверхности имплантата, включающая фтор и/или фторид, перекрывалась указанной частью или частями поверхности имплантата, включающие неровности поверхности. Могут быть площади поверхности, включая пятна, имеющие только неровности поверхности и области, имеющие только фтор и/или фторид. Однако, предпочтительно, по меньшей мере, частичное перекрытие неровностей поверхности и фтора и/или фторида.
Оцененная, как описано выше, среднеквадратическая шероховатость (Rq и/или Sq) микрошероховатости, имеющей приведенные выше размеры, составляет предпочтительно ≤250 нм.
Следовательно, способ обработки поверхности имплантата, предназначенного для имплантации в костную ткань в соответствии с указанным первым и вторым аспектом изобретения можно также выразить как включающий:
предоставление фтора и/или фторида, по меньшей мере, на части поверхности имплантата, и
обеспечение на поверхности имплантата микрошероховатости, имеющей среднеквадратическую шероховатость (Rq и/или Sq), ≤250 нм, и/или включающей поры, имеющие диаметр пор 1≤1 мкм и глубину пор ≤500 нм.
Предпочтительно, поверхность имплантата имеет среднюю атомную концентрацию, по меньшей мере, 0,2 ат.% фтора и/или фторида, измеренную рентгеновской фотоэлектронной спектроскопией (XPS) для площади поверхности 100×100 мкм.
Средняя атомная концентрация фтора и/или фторида составляет преимущественно ≤20 ат.%, измеренную XPS.
Наиболее предпочтительно, средняя атомная концентрация фтора и/или фторида находится в пределах диапазона 0,4-7 ат.%, измеренная в соответствии с указанным выше способом. Однако исходно предоставленное количество фтора и/или фторида может потребоваться увеличить ввиду потенциального уменьшения во время хранения имплантата.
Поверхность имплантата представляет собой предпочтительно поверхность металлического имплантата, такого как поверхность титанового имплантата.
Поверхность металлического имплантата может представлять собой часть металлического имплантата или может представлять собой наложенный металлический поверхностный слой неметаллического имплантата, такого как керамический, пластиковый или композитный материал. Кроме того, поверхность металлического имплантата может также представлять собой часть частично металлического имплантата, посредством чего предоставляется поверхность частично металлического имплантата.
Фтор и/или фторид предпочтительно включается/включаются внутрь слоя оксида на поверхности металлического имплантата, предоставляя слой оксида, который более реактивен, чем слой оксида без фтора и/или фторида (см. примеры). Оксид титана с включенным фтором и/или фторидом имеет нарушенную структуру оксида, по сравнению со структурой обычного чистого оксида титана. Без связи с какой-либо теорией, нарушенная структура оксида дает более реактивный слой оксида, что означает то, что оксид in vivo, вероятно, в более высокой степени, по сравнении со структурой чистого оксида титана, взаимодействует с молекулами, такими как ионы фосфата, и, вероятно, также растет с более высокой скоростью, что означает достижение улучшенной биологической совместимости.
Фтор и/или фторид может быть предоставлен на поверхности имплантата с использованием любого подходящего способа, такого как:
- плазменное напыление с использованием плазмы, включающей фтор и/или фторид, например, CHF3-плазмы,
- любая электрохимическая обработка, включающая фтор и/или фторид, например, анодирование в электролите, включающем фтор и/или фторид,
- обработка водным и/или неводным раствором, включающим фтор и/или фторид, например, растворами, включающими растворенные фтористые соли, такие как NaF, или HF (водный раствор),
- ионная имплантация или
- любая комбинация указанных способов или им подобных.
Перед, после или одновременно с предоставлением фтора и/или фторида может быть обеспечена микрошероховатость с использованием мягкого травления, микрохолодной обработки давлением, анодирования, пламенного распыления, электрохимической обработки, лазерной, искровой эрозии или любого другого подходящего способа модификации поверхности.
Предпочтительно, фтор и/или фторид и микрошероховатость предоставляются одновременно обработкой поверхности металлического имплантата водным раствором фтористоводородной кислоты (HF), приводя к процессу травления.
Концентрация фтористоводородной кислоты составляет предпочтительно менее чем 0,5 М, предпочтительнее 0,1 М.
Поверхность металлического имплантата предпочтительно обрабатывается в течение периода травления до 180 с, предпочтительнее до 60 с, при комнатной температуре (24±1°С). Перед тем как начинается травление, естественный слой оксида удаляется кислотой, и когда кислота вступает в контакт с поверхностью имплантата, начинается процесс травления. Затем формируется новый слой оксида с фтором и/или фторидом, включенным в него и распределенным по всему слою оксида. Кроме того, описанная выше микрошероховатость обеспечивается процессом травления поверхности имплантата.
Следует отметить, что даже если обработка фтористоводородной кислотой используется и для предоставления фтора и/или фторида, и микрошероховатости на поверхности имплантата, указанные процедуры можно выполнять отдельно и в обратном порядке.
Обработка HF (водным раствором) предпочтительно выполняется при комнатной температуре. Т.е., приблизительно при 20-30°С (нормальное воздушное давление), предпочтительно, 24± 1°С. Если используется более высокая температура, чем 24±1°С, процесс травления, как известно специалисту в данной области, начнется раньше, и процесс травления будет более быстрым, т.е. для получения желательного результата потребуется более короткий период травления, чем период, приведенный в настоящем описании, для травления при 24±1°С. Следовательно, при использовании температуры ниже чем 24±1°С, для получения желательного результата потребуется более длительный период травления, чем период, приведенный в настоящем описании, для травления при 24±1°С.
Период травления, температура и концентрация HF (водного раствора) определяют соотношение между протравленными площадями, т.е. площадями, имеющими микрошероховатость, и непротравленными площадями.
Споласкивание удаляет любой рыхло сцепленный фтор и/или фторид и примеси с поверхности имплантата. Таким образом, затем получается имплантат, имеющий лучшую долговечность при хранении. Таким образом, поверхность имплантата предпочтительно споласкивается после предоставления на ней фтора и/или фторида.
Предпочтительно, способ, кроме того, включает обеспечение макрошероховатости на поверхности имплантата перед предоставлением фтора и/или фторида и перед обеспечением микрошероховатости. Таким образом, получается имплантат, имеющий микрошероховатость, наложенную поверх макрошероховатости. Макрошероховатость предпочтительно обеспечивается струйной очисткой, предпочтительнее, струйной очисткой поверхности титанового имплантата частицами двуокиси титана.
Макрошероховатость можно также обеспечить любой другой подходящей методикой, такой как травление, холодная микрообработка давлением, анодирование, пламенное распыление, любая электрохимическая обработка, лазерная, искровая эрозия, механическая обработка, накатка или любой другой подходящий способ модификации поверхности.
Кроме того, следует также отметить, что на поверхность имплантата с макрошероховатостью или без нее можно или не наносить резьбу, или нанести резьбу.
Указанная поверхность металлического имплантата предпочтительно изготовлена из промышленно чистого титана или сплава титана, но она может также быть изготовлена из любого другого биологически совместимого металлического материала, такого как цирконий или его сплавы, гафний или его сплавы, ниобий или его сплавы, тантал или его сплавы, хромованадиевый сплав или любая комбинация указанных материалов.
Имплантат для имплантации в костную ткань в соответствии с изобретением представляет собой предпочтительно стоматологический имплантат или ортопедический имплантат.
Настоящее изобретение также относится к имплантату для имплантации в костную ткань, имеющему поверхность имплантата, по меньшей мере, часть которой была обработана способом в соответствии с изобретением, как описано выше в настоящем описании.
Таким образом, имплантат для имплантации в костную ткань, имеющий поверхность имплантата с описанными выше характеристиками, также составляет часть настоящего изобретения.
Теперь изобретение будет проиллюстрировано посредством следующих неограничивающих примеров.
ПРИМЕРЫ
Приготовление образца
Использовали хирургические имплантаты из промышленно чистого (п.ч.) титана.
Каждый имплантат повергали обезжириванию в Ecosolv® (70-100% этил-2-гидроксипропионате) в условиях воздействия ультразвука в течение 5 мин, а после этого в этаноле (70%) в течение 5 мин.
Некоторые из имплантатов затем подвергали струйной очистке частицами двуокиси титана. Использовали два различных диапазона размера частиц двуокиси титана; 6,8-90 мкм (мелкие=F) и 106-180 мкм (крупные=С). Однако можно также использовать более крупные частицы, такие как 180-300 мкм.
Подвергнутые струйной очистке имплантаты затем подвергали в условиях обработки ультразвуком споласкиванию в деионизированной воде в течение 2×5 мин и в этаноле в течение 2×5 мин для удаления любых остаточных частиц струйной очистки.
Имплантаты затем обрабатывали в соответствии со следующими способами:
а) Эталонные имплантаты
Не подвергнутые и подвергнутые струйной очистке (F и С) имплантаты, очищенные в соответствии с описанной выше процедурой, предоставляли в качестве эталонов для исследований, как описано ниже в настоящем описании.
b) Способ предшествующего уровня техники (в соответствии с WO 95/17217)
Не подвергнутые и подвергнутые струйной очистке имплантаты (F и С), очищенные в соответствии с описанной выше процедурой, погружали в 0,1 М HF (водный раствор) при комнатной температуре (около 24±1°С) на 90 с. В течение данного периода обработки Н2 (g) не образовывался, таким образом, травление не происходило.
Затем имплантаты погружали в деионизированную воду на 20 с и после этого сушили.
с) Способ I
Не подвергнутые и подвергнутые струйной очистке имплантаты (F и С), очищенные в соответствии с описанной выше процедурой, погружали в этанол (99,5%) на 2 с и в деионизированную воду на 5 с.
Затем имплантаты, в соответствии с настоящим изобретением, погружали в перемешанный раствор 0,1 М HF (водный раствор) при комнатной температуре (около 24±1°С) в течение периода травления 40±5 с. Приблизительно 80-90% поверхности было протравлено, таким образом, обеспечивая микрошероховатость. Однако, поскольку было показано, что процесс травления был медленнее для не подвергнутых струйной очистке имплантатов, данные имплантаты следует предпочтительно протравливать в течение более длительного периода времени, такого как 60±5 с, чем подвергнутые струйной очистке имплантаты, для получения аналогичной степени травления. Период травления измеряли от момента образования первого пузырька Н2 (g) на поверхности имплантата. Травление поверхности имплантата начинается, когда кислота вступает в непосредственный контакт с чистым титаном, т.е. когда удаляется оксид титана, покрывающий поверхность титана.
Затем имплантаты погружали в перемешанную деионизированную воду на 20 с.
Имплантаты в условиях обработки ультразвуком споласкивали в этаноле (20%) в течение 3 мин и в деионизированной воде в течение 4 мин.
Затем имплантаты споласкивали в этаноле (99,5%) в течение 5 с, вытирали и сушили.
Имплантат, обработанный в соответствии с данным способом, именуют примером 1.
d) Способ II
Не подвергнутые и подвергнутые струйной очистке имплантаты (F и С), очищенные в соответствии с описанной выше процедурой, погружали в этанол (99,5%) на 2 с и в деионизированную воду на 5 с.
Затем имплантаты, в соответствии с настоящим изобретением, погружали в 0,1 М HF (водный раствор) при комнатной температуре (около 24±1°С) при перемешивании в течение периода травления 40±5 с. Вследствие объясненных выше причин некоторые из не подвергнутых струйной очистке имплантатов протравливали в течение 60±5 с (данные образцы использовали только для измерения AFM, описанного ниже в настоящем описании). Период травления измеряли от момента образования первого пузырька Н2 (g) на поверхности имплантата.
Затем имплантаты вытирали и сушили.
Имплантат, обработанный в соответствии с данным способом, именуют примером 2.
Оценка in vivo
Поверхности имплантатов, обработанные в соответствии с описанными выше способами, оценивали in vivo с использованием испытания на растяжение, описанного H.J. Ronald и J.E. Ellingsen, Biomaterials 23 (2002), pp. 2201-2209.
Имплантаты имели форму монет, имеющих диаметр 6,25 мм и высоту 1,95 мм. Одну сторону монет имплантатов обрабатывали указанными способами. В центре другой стороны монеты было выполнено резьбовое отверстие для прикрепления к динамометрическому элементу.
В качестве испытуемых животных использовали новозеландских белых кроликов. 2 направляющих отверстия сверлили в одной из большеберцовых костей каждого кролика с использованием спирального сверла диаметром 1,0 мм (Medicon®, Germany) с использованием направляющего устройства дрели для обеспечения стандартизированного и правильного расположения. Затем получали полости для каждого монетного имплантата с использованием изготовленного по заказу шипа из нержавеющей стали диаметром 7,05 мм, установленного на низкоскоростную бормашину при обильном орошении физиологическим солевым раствором.
Обработанные и необработанные поверхности имплантата, в соответствии с таблицей 1, помещали в полости и стабилизировали предварительно спрофилированной титановой верхнечелюстно-лицевой пластиной толщиной 0,2 мм (Medicon® CMS, Germany), удерживаемой в кортикальной кости двумя титановыми винтами размером 1,2×3 мм2 (Medicon® CMS, Germany). Это обеспечивает устойчивую пассивную фиксацию имплантатов во время периода заживления. Политетрафторэтиленовые (PTFE) колпачки вводили для противодействия росту кости в направлении вертикальных поверхностей имплантата, а также избыточному росту кости. Подкожную мягкую ткань и поверхностные слои возвращали в исходное положение и зашивали.
Обрабатываемая поверхность находилась в непосредственном контакте с костной тканью, но вертикальные стороны и обратная сторона монеты не находились в контакте с костной тканью.
Затем модели имплантатов оставляли на 7 недель в испытании 1 и на 8 недель в испытании 2.
18 кроликов использовали в испытании 1 и 20 кроликов использовали в испытании 2.
В конце указанного периода кроликов умерщвляли и удаляли средства фиксации имплантатов и колпачок из PTFE. Затем большеберцовую кость фиксировали в специально спроектированной установке для стабилизации кости во время процедуры испытания. Резьбовой штифт с шариковой головкой прикрепляли к монетному имплантату с использованием предварительно изготовленного резьбового отверстия и установку приспосабливали перпендикулярно к динамометрическому элементу с использованием трубки уровня. Затем проводили испытания на растяжение с использованием установки для испытаний Lloyds LRX Materials, оборудованной калиброванным динамометрическим элементом 100 N. Диапазон скорости крестовины устанавливали на 1,0 мм/мин. Нагрузку прилагали до тех пор, пока имплантат не отделялся от кости, и регистрировали прилагаемую силу на графике зависимости смещения от нагрузки. На отделение монетного имплантата на данном графике указывала четко определенная точка прерывания с вертикальным падением нагрузки. Средние величины сил, необходимых для отрыва подвергнутых различной обработке монет, представлены в таблице 1. Регистрируемая сила дает прямую оценку силы соединения между монетным имплантатом и костью. Чем выше зарегистрированная сила, тем сильнее соединение.
Первое испытание включало эталонную монету, подвергнутую струйной очистке мелкими (F) частицами двуокиси титана, и подвергнутые струйной очистке (F) монеты, обработанные в соответствии со способом предшествующего уровня техники, способом I, и способом II, как описано выше.
Второе испытание включало эталонную монету, подвергнутую струйной очистке мелкими (F) частицами двуокиси титана, эталонную монету, подвергнутую струйной очистке (С) крупными частицами оксида титана, и подвергнутые струйной очистке (С) монеты, обработанные в соответствии со способом I, и способом II, как описано выше.
Как видно из таблицы 1, монетные имплантаты, обработанные в соответствии со способом I и II, давали улучшенное прикрепление к кости, по сравнению с эталонными монетами и монетами, обработанными в соответствии со способом предшествующего уровня техники.
Кроме того, следует отметить, что монетные имплантаты, подвергнутые струйной очистке крупными (С) частицами оксида титана, дали лучшее прикрепление к кости, чем монетные имплантаты, подвергнутые струйной очистке мелкими (F) частицами оксида титана.
Характеристика поверхности
Характеристики поверхности имплантатов, обработанных в соответствии со способами, раскрытыми выше, оценивали с использованием рентгеновской фотоэлектронной спектроскопии (XPS), атомной силовой микроскопии (AFM), сканирующей электронной микроскопии (SEM) и вторичной ионной масс-спектрометрией времени полета (TOF-SIMS). Оценивали шероховатость поверхности, среднюю атомную концентрацию фтора и/или фторида и распределение фтора и/или фторида на поверхности имплантата и по всему слою оксида.
XPS (сканирующий микроскоп Quantum 2000, Physical Electronics, USA) использовали для измерения средней атомной концентрации фтора и/или фторида по площади 100× 100 мкм. Монохромированный AlKα использовали в качестве источника рентгеновского излучения и применяли энергию перехода 187,8 эВ.
TOF-SIMS (TRIFT II Time-of-Flight SIMS, Physical Electronics, USA) использовали для оценки распределения по поверхности (направление х- и у-) фтора и/или фторида по площади 250×250 мкм (см. фиг.11 и 12). Энергия первичного пучка ионов составила 25 кВ, и69Ga+ использовали в качестве первичного пучка ионов.
Угловую XPS (сканирующий микроскоп Quantum 2000, Physical Electronics, USA) и аргоновое распыление использовали для оценки глубины распределения (направление z-) фтора и/или фторида внутри слоя оксида.
AFM (AFM DualScope, DME AS, Denmark) использовали для измерения морфологии поверхностей имплантата. Измеряли два размера площадей образца, соответственно 5×5 мкм (256 точек взятия проб в направлении х- и у-), и 10×10 мкм (256 точек взятия проб в направлении х- и у-) (см. фиг.8-10). Z-масштабирование трехмерных картин (5×5 мкм), показанное на фиг.8-10, было увеличено в 4 раза.
SEM (Philips XL-30 ESEM, Philips, the Netherlands) использовали для визуального исследования морфологии поверхности (см. фиг.2-7).
Средние атомные концентрации и распределение по поверхности фтора и/или фторида для монет имплантатов, использованных в исследовании in vivo, представлены в таблице 2.
Имплантат, обработанный в соответствии с WO 95/17217, имел атомную среднюю концентрацию около 1,1 ат.% фтора и/или фторида.
Имплантат, обработанный соответственно способом I и способом II в соответствии с настоящим изобретением, имел атомную среднюю концентрацию соответственно около 0,8 и 5-6 ат.% фтора и/или фторида. Атомы галогена обеспечиваются наиболее вероятно и предпочтительно главным образом фторидами.
Споласкивание в условиях обработки ультразвуком удаляет рыхло сцепленный фтор и/или фторид с поверхности имплантата, и концентрация фтора и/или фторида уменьшается. Кроме того, получается однородное распределение фтора и/или фторида. Полученные TOF-SIMS картины поверхностей, подвергнутых струйной очистке крупными (С) частицами, примера 1 и примера 2, показаны соответственно на фиг.11 и 12. На данных чертежах красный цвет указывает F-, синий цвет указывает О-, и в случае, когда F- и О- перекрываются при равных количествах, в результате возникает пурпурный красный цвет. Отметка на шкале соответствует 100 мкм. Показано, что распределение по поверхности F- скорее неоднородное для примера 1. На фиг.12 показано скорее однородное распределение F- для примера 2.
Не подвергнутые струйной очистке имплантаты, обработанные в соответствии со способом I и II (период травления 40±5 с), оценивали в отношении распределения фтора и/или фторида на всем протяжении слоя оксида титана.
Средние атомные концентрации фтора и/или фторида для примера 1 и примера 2, использованные в данном анализе, составили соответственно 0,5 и 5 ат.%.
Не подвергнутый струйной очистке имплантат, обработанный в соответствии со способом II (пример 2), исследовали с использованием распыления аргоном. Данные результаты представлены в таблице 3, где видно, что слой оксида имеет уменьшающуюся концентрацию фтора и/или фторида от поверхности в глубину.
Однако аргоновое распыление не подходило для анализа примера 1, поскольку атомная концентрация была слишком низкой для такого анализа. Таким образом, поверхность данного имплантата анализировали с использованием XPS с различными углами распространения (10-90°). Данные результаты представлены в таблице 4, где видно, что фтор и/или фторид равномерно распределен в слое оксида до глубины, по меньшей мере, около 7 нм.
Кроме того, оценивали характеристики поверхности для имплантатов, обработанных в соответствии со способами, раскрытыми выше. Изучали не подвергнутые струйной очистке имплантаты и имплантаты, подвергнутые струйной очистке крупными (С) частицами двуокиси титана.
Поверхности имплантатов изучали с использованием SEM и AFM.
Картины SEM необработанной, подвергнутой струйной очистке крупными (С) частицами поверхности эталонного имплантата показаны на фиг.2 (увеличение ×500 и ×10000).
Картины SEM не подвергнутой струйной очистке поверхности имплантата в соответствии с описанным выше способом предшествующего уровня техники показаны на фиг.3 (увеличение ×500 и ×10000). График AFM данной поверхности показан на фиг.8.
Картины SEM не подвергнутой струйной очистке и подвергнутой струйной очистке крупными (С) частицами поверхностей имплантата, обработанных в соответствии со способом I, показаны соответственно на фиг.4 (увеличение ×500 и ×10000) и фиг.5 (увеличение ×60000 и ×120000). График AFM не подвергнутой струйной очистке поверхности, показанной на фиг.4, показан на фиг.9.
Картины SEM не подвергнутой струйной очистке и подвергнутой струйной очистке крупными (С) частицами поверхностей имплантата, обработанных в соответствии со способом II, показаны соответственно на фиг.6 (увеличение ×2500 и ×10000) и фиг.7 (увеличение ×500 и ×10000). График AFM не подвергнутой струйной очистке поверхности, показанной на фиг.6, показан на фиг.10.
Результаты указали на то, что и подвергнутые струйной очистке и не подвергнутые струйной очистке имплантаты, обработанные в соответствии со способом I и II, имели поры с диаметром пор 100-600 нм, конкретнее, преимущественно около 250-300 нм, глубиной пор 50-300 нм, конкретнее, преимущественно около 60-150 нм, и шириной пика на уровне половины глубины пор 150-670 нм.
Параметры микрошероховатости, полученные для не подвергнутых струйной очистке поверхностей с использованием AFM, представлены в таблице 5. Регистрировали величины параметров для двух областей поверхности имплантата, и данные величины представлены в таблице 5.
Как видно из таблицы 5, Sa и Sq составляют соответственно приблизительно 0,07-0,13 и 0,08-0,16 мкм, для имплантатов примера 1 и примера 2, которые представляют собой варианты реализации настоящего изобретения.
Кроме того, развившееся отношение поверхности (Sdr), т.е. увеличение площади поверхности, по сравнению с гладкой площадью, увеличено для имплантатов примера 1 и примера 2, в сравнении с эталонным имплантатом предшествующего уровня техники.
Более того, из таблицы 5 видно, что поверхностная морфология поверхности имплантата, обработанной в соответствии со способом предшествующего уровня техники, аналогична поверхности эталонного имплантата, т.е. поверхность не подвергнута воздействиям, что также подтверждается картинами SEM (фиг.3). Полученные величины (показанные в таблице 5), наиболее вероятно, связаны со следами механической обработки.
Для улучшения точности и получения более высокого разрешения измерения AFM для подвергнутых струйной очистке поверхностей сканер AFM размещали на стадии демпфирования вибрации образца. Подвергнутую струйной очистке (С) поверхность, обработанную в соответствии со способом I, анализировали данной модифицированной установкой. Данные величины представлены в таблице 6.
Как видно из таблицы 6, Sa и Sq составляют соответственно приблизительно 0,11-0,19 и 0,13-0,22 мкм для подвергнутого струйной очистке крупными частицами имплантата примера 1.
Картины SEM (см. фиг.4-7) и результаты AFM (см. фиг.9 и 10) показывают, что микрошероховатость подвергнутых струйной очистке и не подвергнутых струйной очистке поверхностей, обработанных в соответствии со способом настоящего изобретения, т.е. в данном примере способом I и способом II, почти идентичны. Кроме того, видно, что имплантат, обработанный способом предшествующего уровня техники, не подвергнут воздействиям, т.е. поверхность почти идентична необработанному эталонному имплантату.
Реактивность слоя оксида титана
Для демонстрации того, что реактивность оксида титана, имеющей включенный фтор и/или фторид, увеличивается, выполняли следующий эксперимент.
Реактивность оксида различных слоев оксида можно оценить по измерению периода времени от погружения имплантата в разведенный HF (водный) и до образования первого пузырька Н2 (g) на поверхности имплантата. В данном эксперименте использовали концентрацию 0,1 М HF (водного).
Подвергнутые струйной очистке (С) имплантаты, обработанные в соответствии со способом II, как раскрыто выше, сравнивали с эталонным имплантатом, подвергнутым струйной очистке (С).
Таблица 7 показывает, что процесс травления поверхности имплантата, обработанной способом II (пример 2), начинается раньше, чем необработанной поверхности эталонного имплантата.
Период времени до образования первого пузырька Н2 (g) увеличивается со временем хранения. Это, вероятно, вызвано увеличением толщины слоя оксида после хранения.
Однако даже после периода хранения около 6,5 мес процесс травления поверхности имплантата, обработанной способом II, начинается раньше, чем необработанной поверхности эталонного имплантата.
Данные результаты могут интерпретироваться или как указывающие на более тонкий исходный слой оксида на поверхности имплантата, обработанной способом II, по сравнению с необработанной поверхностью эталонного имплантата, или их можно интрепретировать как нарушенный, а следовательно, более реактивный слой оксида на поверхности имплантата, обработанной способом II.
Поскольку измеренная с использованием распыления ионов аргона толщина слоя оксида на поверхности имплантата, обработанной способом II, была в пределах нормального диапазона толщины, более вероятно, что слой оксида поверхности имплантата, обработанной способом II, более реактивен вследствие нарушенной структуры оксида.
Хотя изобретение было подробно описано и со ссылкой на конкретные варианты его реализации, для специалиста в данной области будет очевидно, что в нем могут быть сделаны различные изменения и модификации без отхода его от сущности и диапазона.
Реферат
Изобретение относится к способу обработки поверхности имплантата, предназначенного для имплантации в костную ткань, включающему предоставление фтора и/или фторида, по меньшей мере, на части поверхности имплантата и обеспечение на поверхности имплантата микрошероховатости, имеющей среднеквадратическую шероховатость (Rq и/или Sq) = 250 нм, и/или включающей поры, имеющие диаметр пор ≤1 мкм и глубину пор ≤500 нм. Изобретение также относится к имплантату, включающему поверхность, имеющую указанные выше характеристики. 5 н. и 36 з.п. ф-лы, 12 ил., 7 табл.

Комментарии