Клетки-предшественники печени человека - RU2247565C2
Код документа: RU2247565C2
Чертежи















Описание
Область техники, к которой относится изобретение
Настоящее изобретение относится к печеночным стволовым клеткам человека, плюрипотенциальным клеткам, дающим начало гепатоцитам и билиарным клеткам, а также к другим субпопуляциям клеток-предшественников печени, обладающих способностью размножаться и дифференцироваться в одну или более линий дифференцировки клеток печени, включая линии гемопоэтических (кроветворных), мезенхимных и печеночных клеток. В частности, изобретение относится к маркерам и к свойствам, используемым для идентификации клеток-предшественников печени человека, к способам их очистки и криоконсервации, к новым подходам, позволяющим отличить субпопуляции печеночных клеток от субпопуляций кроветворных клеток, а также к доказательствам того, что печеночные клетки-предшественники существуют в печени, начиная от печени плода и до печени взрослого человека. Изобретение закладывает основу для клеточной и генной терапии и для получения био-искусственных органов.
Уровень техники
Первичной структурной и функциональной единицей зрелой печени является ацинус, который в поперечном сечении имеет форму колеса, расположенного вокруг двух отдельных сосудистых лож: 3-7 наборов воротных триад (каждая с воротной венулой, печеночной артериолой и желчным протоком) на периферии и центральная вена в центре. Клетки печени устроены в виде клеточных пластинок, обе стороны которых покрыты ячеистым эндотелием, и образуют серию синусоид, прилегающих к воротной и центральной сосудистой сети. Последние данные показывают, что геринговы каналы, небольшие протоки, расположенные вокруг каждой из воротных триад, образуют мельчайшие канальцы, которые проходят в печеночные пластинки через зону 1 и образуют структуры, по форме напоминающие ерши для чистки бутылок (Theise, N. 1999, Hepatology, 30:1425-1433).
Узкое пространство, пространство Дисса, отделяет эндотелий от гепатоцитов вдоль всей синусоиды. В результате такой организации гепатоциты имеют две базальных области, каждая из которых обращена к синусоиде, и апикальную область, которая определяется зоной контакта между соседними гепатоцитами. Базальные области контактируют с кровью и участвуют в абсорбции и секреции компонентов плазмы, а апикальные области образуют желчные канальцы, специализирующиеся на секреции желчных солей и связанные с помощью соединительной сети с желчными протоками. Кровь протекает от воротных венул и печеночных артериол через синусоиды к концевым печеночным венулам и к центральной вене.
С точки зрения вида микроциркуляции ацинус делится на три зоны: зона 1 - околопортальная зона; зона 2 - среднеацинарная зона; и зона 3 - околоцентральная зона. Пролиферативный потенциал, морфологические признаки, плоидность и большинство печень-специфичных генов связаны с зональным расположением (Gebhardt, R., et al. 1988. FEBS Lett. 244:89-93; Gumucio, J.J., 1989, Vol.19. Springer International, Madrid; Traber, P. et al., 1988. Gastroenterology, 95:1130-43). Градиенты концентрации компонентов крови, включая кислород, через ацинус и в направлении тока крови от воротных триад к центральной вене, ответственны за некоторые моменты этого зонирования, например за взаимное расположение зон гликолиза и глюконеогенеза. Однако околоворотное зонирование белка щелевого контакта коннексина 26 и околоцентральное зонирование глютаминсинтетазы (представляющие собой лишь два примера) является более интенсивным в направлении этих градиентов, и оно более характерно для наиболее специфичных для тканей генов, и по-видимому, определяется факторами, внутренне присущими клеткам или переменным, иным, чем кровоток в микросреде.
Кроме гепатоцитов, эпителиальных клеток желчного протока (холангиоцитов) и эндотелиальных клеток, область между воротным и центральным путями содержит другие типы клеток, такие как клетки Ито и клетки Купфера. Они играют важную роль в патогенных состояниях печени, особенно в воспалении и фиброзе, но их непосредственный вклад в основные гомеостатические функции нормального органа явно невелик.
Печень развивается в результате конвергенции дивертикула, образовавшегося из каудальной передней кишки и поперечной перегородки, части внутренностной мезенхимы. Образование печеночных клеток начинается после взаимодействия эндодермального эпителия с кардиогенным мезодермом, по-видимому, с помощью факторов роста фибропластов. Затем указанные печеночные клетки пролиферируют и проникают в мезенхиму поперечной перегородки, в виде шнура, образуя зачаток печени. Непосредственное взаимодействие между эпителием и мезенхимой на этих ранних стадиях развития печени имеет решающее значение, определяя, какие из клеток станут гепатоцитами или холангиоцитами, или ячеистым эпителием, соответственно. Мутации в мезенхима-специфичных генах hlx и jumonji блокируют развитие печени, что иллюстрирует важность вклада этих тканей в указанный процесс. В ранней фазе своего развития печень состоит из кластеров примитивных гепатоцитов, связанных непрерывным эпителием, не имеющих базальной мембраны, и из многочисленных кроветворных клеток. По мере того как эндотелий приобретает прерывистую ячеистую структуру, сосудистая система, особенно воротная сосудистая система, становится более развитой, с образованием базальных мембран. Воротной интерстиций может дать толчок к развитию желчных протоков, и когда он окружает воротные венулы, образуются печеночные артериолы, желчные протоки и воротные триады. Незрелые гепатоциты быстро пролиферируют и образуются паренхимные пластинки, по-видимому, в ответ на изменения в количестве и распределении таких тканеорганизующих молекул, как С-САМ 105, Agp110, Е-кадгерин и коннексины, одновременно с перемещением большинства, но не всех, кроветворных клеток в костный мозг. Недавние исследования подтверждают, что некоторые кроветворные клетки-предшественники сохраняются в печени взрослых грызунов, находящихся в состоянии покоя, а стволовые кроветворные клетки выделены из печени как взрослого человека, так и из печени мышей (Crosbie, O.M. et al. 1999. Hepatology, 29:1193-8). Зрелая физическая организация наступает у грызунов в первые недели после рождения, а у людей - в первые несколько лет. Метаболическое зонирование устанавливается в соответствии с несколько различающимися схемами для разных ферментов, но становится очевидным в период после рождения.
Стволовые клетки и коммитированные клетки-предшественники
Стволовые клетки определяют как примитивные клетки, которые обладают свойством саморепликации и являются плюрипотентными, т.е. образуют дочерние клетки, имеющие более одного потенциального пути развития, которые интенсивно размножаются и могут восстановить ткань или ткани. Большинство литературы по стволовым клеткам относится либо к литературе по зародышам, либо к литературе по кроветворным, эпидермальным или кишечным тканям.
В последнее время обозначения были изменены, с тем, чтобы можно было различать различные классы стволовых клеток. Клетки, способные принимать участие в развитии клеток всех типов, включая зародышевые клетки, называют тотипотентными стволовыми клетками, и они включают зиготы и обычные эмбриональные клетки, вплоть до стадии 8 клеток (стадии морулы). Эмбриональные стволовые клетки, называемые также “ЕS”-клетками, состоят из постоянных клеточных популяций, происходящих из тотипотентных нормальных клеток в бластоцистах, о которых впервые сообщили в литературе в начале 1980-х годов. Линии ES-клеток можно культивировать in vitro, поддерживая их тотипотентность. ES-клетки являются онкогенными, если их вводят хозяину с нарушенным иммунитетом в любой сайт, кроме in utero ("в матке"), вызывая образование тератокарцином. Однако когда их вновь вводят в нормальные бластоциты, они способны к возобновлению эмбрионального развития и к участию в образовании нормальной, но химерной мыши. Хотя линии ES-клеток получены от многих биологических видов (мышь, крыса, свинья и др.), но для получения животных с новыми генотипами (нокауты (knockouts), трансгенные животные) обычно применяют только систему с использованием мышей, путем погружения модифицированных ES-клеток из культуры в бластоциты с последующим имплантированием этих бластоцитов псевдобеременным хозяевам. Линии эмбриональных зародышевых (EG) клеток, которые проявляют многие характеристики ES-клеток, можно выделить непосредственно in vitro из популяции примордиальных зародышевых клеток. Как и в случае ES-клеток, EG-клетки из тератокарцином, будучи введенными мышам с нарушенным иммунитетом, принимают участие в образовании химер, включая зародышевую линию, при введении их в бластоциты.
Детерминированные стволовые клетки представляют собой плюрипотентные клетки, генетический потенциал которых ограничен до определенного числа клеточных типов, и которые обладают высоким ростовым потенциалом. Увеличивается количество данных, например, в области изучения теломеразы, которые подтверждают, что детерминированные стволовые клетки не обладают свойством саморепликации, т.е. что их потомство может иметь меньший ростовой потенциал, чем родительские клетки. Детерминированные стволовые клетки дают начало дочерним клеткам, которые теряют свойство плюрипотенции в результате ограничения их генетического потенциала до одного пути развития, например, с образованием гепатоцитов и которые называются коммитированными клетками-предшественниками. В печеночных линиях имеются коммитированные гепатоцитные клетки-предшественники и коммитированные билиарные клетки-предшественники.
В последнее время в печати появилось много экспериментальных данных о том, что культуры ES-клеток человека можно получить из зародышей человека. Предполагают, что эти культуры ES-клеток человека можно инъецировать в ткани, в надежде, что они будут способны восстановить поврежденные органы и ткани. На основании данных о том, что ES- и EG-клетки образуют опухоли при введении их в сайты, иные, чем in utero (см. выше), полагают, что план введения ЕS-клеток пациентам является нереальным, поскольку при этом существует большая опасность создания опухолей у пациентов. Чтобы преодолеть этот тупик, некоторые группы исследователей изучают возможность дифференцировки ES-клеток в определенных условиях микросреды с получением детерминированных стволовых клеток, которые затем можно безопасно инокулировать пациентам. Например, имеется некоторый успех в получении кроветворных клеток-предшественников. Однако остается опасение, что остаточные ES-клетки в культуре могут вызвать онкогенез, если эти культуры инокулировать пациентам. Подытоживая, можно сказать, что до тех пор, пока исследования в области биологии развития не выявят мириады управляющих событий, определяющих пути развития клеток во время эмбриогенеза, ES-клетки будут оставаться лишь экспериментальным инструментом, с малой надеждой на возможность осуществления клинических программ по клеточной или генной терапии. Единственным реалистичным вариантом клинических программ по клеточной и генной терапии является использование детерминированных стволовых клеток, в которых генетический потенциал ограничен до определенного количества клеточных типов. B противоположность этому, ES-клетки могут быть многообещающими для создания биоискусственных органов для тех типов тканей (например, для кроветворных клеток), которые продуцируются ES-клетками в известных условиях.
Полемика вокруг стволовых клеток печени
Присутствие стволовых клеток во взрослой нормальной печени является предметом большой полемики в области биологии клеток печени. Ниже кратко излагаются некоторые преобладающие модели, существующие в данной области техники и полемизирующие между собой. Текст, выделенный жирным шрифтом, указывает на ключевую идею различных моделей.
Некоторые специалисты в данной области техники полагают, что печеночные стволовые клетки существуют только в эмбриональной ткани, что во взрослой печени нет стволовых клеток и что все зрелые клетки печени в равной степени участвуют в процессах регенерации (Фарбер (Farber, E. 1992), в сборнике "The Role of Cell Types in Hepatocarcinogenesis" S.A.E., editor. Academic Рress, New York.). Модель Фарбера рассматривает все зрелые паренхимные клетки как являющиеся фенотипически равными между собой и считает, что известная гетерогенность ростового потенциала и экспрессии генов в печени обусловлена только условиями микросреды. Фарбер предполагает, что в онкогенных условиях взрослые паренхимные клетки проходят обратную дифференциацию и становятся опухолевыми клетками. Эта модель доминировала в области канцерогенеза печени в течение десятилетий и все еще оказывает влияние на исследования в области регенерации печени.
Другие специалисты полагают, что все клетки печени являются стволовыми клетками (Kennedy, S. et al. 1995. Hepatology, 22:160-8; Michalopoulos, G.K, et al., 1997. Science, 276:60-6.). Эти исследователи полагают, что все паренхимные клетки являются равными между собой и высокопластичными, а экспрессия генов обуславливается только условиями микросреды. Предполагают, что в соответствующих онкогенных условиях зрелые паренхимные клетки становятся стволовыми клетками, которые затем могут превратиться в опухолевые клетки.
Модель молчащих стволовых клеток основана на исследованиях Уилсона и Лидука (Wilson J.W. et al., 1958. J. Pathol. Bacteriol. 76:411-449). Как и в области кроветворных клеток, эта концепция вызывает наибольшее доверие благодаря интенсивным исследованиям канцерогенеза печени (Marceau, N. 1994. Gut. 35:294-6.). Эти исследователи полагают, что клетки-предшественники, включая бипотенциальные клетки-предшественники, могут сохраняться во взрослой ткани, но полагают, что они представляют собой редкие остатки клеточных популяций, полученных в результате эмбрионального развития. Они полагают, что клетки-предшественники не играют никакой роли в обычном или регенеративном функционировании печени, а играют роль только в состояниях болезни (Overturf; К. et al. 1999. American Journal of Pathology, 155:2135-2143.). Таким образом, их считают “молчащими”, подобно сателлитным клеткам в мышцах. Эти клетки описывают как “овальные клетки”, на основании характерной формы клеточного ядра. Эти клетки имеют маленький размер (~9 мкм) и экспрессируют характерный антигенный профиль на клеточной поверхности. Все зрелые клетки печени считают равными между собой в отношении роста и экспрессии генов, и полагают, что все аспекты гетерогенности экспрессии генов обусловлены только клеточной микросредой. Сторонники модели молчащих стволовых клеток категорически отрицают любую возможность движения паренхимных клеток из околоворотной в околоцентральную области. Полагают, что стволовые клетки и другие печеночные клетки-предшественники имеют важное значение только для состояний болезни, особенно канцерогенеза. Поэтому эти исследователи сфокусировали свои усилия на изучении клеток-предшественников у животных, подвергавшихся различным онкогенным воздействиям. Эти исследования показывают, что “овальные клетки” не образуют распознаваемого тела из быстро пролиферирующих клеток в регенеративных условиях или в условиях от слабых до умеренных повреждений. Значительные количества популяций пролиферирующих овальных клеток наблюдали только после очень серьезных повреждений печени (Grisham, J.W. et al. 1997. В сборнике "Stem Cells", C.S. Potter, editor. Academic Press, London. 233-282).
Модель, основанная на перетекании клеток печени (Arber, N. et al. 1988. Liver, 8:80-7; Zajicek, G. et al. 1991. Liver, L 11:347-51.) подвергалась резкой критике и большинством исследователей не признается (Jirtle, R.L. 1995. Liver Regeneration and Carcinogenesis: Molecular and Cellular Mechanisms, Academic Press, New York.). Эта модель постулирует, что компартмент стволовых клеток в каждой воротной триаде продуцирует взрослые паренхимные клетки, которые “перетекают” по направлению к центральной вене. Процесс перетекания приводит дочерние клетки в соприкосновение с определенными условиями микросреды, что приводит к изменениям в фенотипе этих клеток. Опять-таки, высказывается гипотеза, что условия микросреды имеют решающее значение для определения фенотипа. Большинство исследователей выступают против этой модели, полагая, что она не согласуется с исследованиями, в которых не найдено никакого передвижения помеченных маркером донорных клеток, вновь введенных в печень (Kennedy, S. et al. 1995. Hepatology, 22:160-8.). Однако даже в исследованиях, которые дают наиболее веские свидетельства в пользу модели перетекания, все же неизвестно, что именно влияет на экспрессию маркеров, использованных в донорных клетках - микросреда или положение линии дифференцировки клеток. Кроме того, гипотеза о перетекании клеток печени, вероятно, будет пересмотрена после недавно полученных Тайзом и его помощниками (Tiese, N. Hepatology, 30:1425-1433) данных, говорящих о том, что геринговы каналы, которые в течение долгого времени считали связанными с печеночными клетками-предшественниками, простирают свои канальцы через печеночную пластинку по меньшей мере в зоне 1.
Райд (Reid) и его помощники защищают гипотезу о том, что печень представляет собой систему стволовых клеток и линий дифференцировки клеток по созреванию (Sigal, S.H. et al. 1992. Am. J. Physiol. 263:G139-48.). Они предполагают, что ткани организованы в виде линий дифференцировки клеток по созреванию, подпитываемых популяциями стволовых клеток или ранних клеток-предшественников (Brill, S. Et al. 1993. Proceedings of the Society for Experimental Biology Medicine. 204:261-9.). Эту ткань определяют как развивающуюся от “молодых клеток к клеткам среднего возраста и к старым клеткам”. Процесс созревания сопровождается зависимыми от линии дифференцировки и положения изменениями в размере клеток, их морфологии, антигенных профилях, ростовом потенциале и экспрессии генов. Высказывается гипотеза, что эти изменения происходят благодаря комбинации автономных клеточных изменений, независимых от условий микросреды, и изменений, индуцированных микросредой; микросреда включает питательные вещества, газообмен (кислород, СО2), рН, гормоны, межклеточные взаимодействия и химический состав внеклеточной матрицы.
Авторы этой гипотезы предполагают, что максимальный рост наблюдается в стволовых клетках и в ранних клетках-предшественниках и постепенно понижается в линии дифференцировки клеток. Эта модель принимает в расчет, что большинство клеток в ткани взрослой печени являются полиплоидными, главным образом тетраплоидными или октаплоидными, и менее трети клеток являются диплоидными. Последние данные поддерживают концепцию, говорящую о том, что регенеративный потенциал ткани в основном определяется популяцией диплоидных клеток и что более старые клетки вносят свой вклад в регенерацию путем увеличения клеточной массы в результате, гипертрофических реакций, связанных с полиплоидией (Sigal, S.H. et al. 1999. American Journal of Physiology. 276:G1260-72.). Поэтому эти исследователи отстаивают гипотезу о том, что наибольшие надежды на клеточный рост, при использовании метода как в клеточной или генной терапии, так и для биоискусственных органов, связаны с популяцией диплоидных клеток ткани.
Модель системы стволовых клеток и линий дифференцировки клеток по созреванию противоречит другим моделям развития клеток печени в том, что она предполагает, что злокачественное перерождение печени наиболее часто является результатом косвенного, а не прямого онкогенного воздействия. Предполагают, что онкогенные поражения убивают большинство клеток печени, особенно зрелых клеток в линии развития, приводя к резкому индуцированию регенеративной реакции. Происходящее в результате этого увеличение количества клеток-предшественников увеличивает риск вторичных мутационных событий в быстро растущих клетках, клетках-предшественниках, что может привести к злокачественному развитию. Таким образом, более старые гипотезы о том, что рак представляет собой блокированую дифференциацию или что рак возникает в результате онкогенных повреждений, поражающих стволовые клетки, принимаются как верные, но с представленной выше модификацией.
Возрастающее признание модели линий дифференцировки клеток по созреванию сейчас основывается на данных о том, что печень полна признаков, указывающих на процесс апоптоза (утраты клеток) или процесс окончательной дифференциации (Sigal, S.H. 1995. Differentiation. 59:35-42.) и на полученных данных о том, что только определенные субпопуляции клеток печени, присутствующие во взрослой печени, способны к интенсивном клеточным делениям (Overturf К. et al. 1999. American Journal of Pathology. 155:2135-2143; Tateno, С. et al. 2000. Hepatology. 31:65-74.). В этой модели клетки-предшественники и субпопуляция взрослых клеток (которую рассматривают как диплоидную субпопуляцию) способны к восстановлению ткани печени после того, как их возвращают в условия in vivo, и способны к интенсивному росту, включая клональный рост.
В патенте США №5559022, выданном Ноутону (Naughton), описывается выделение клеток из печени и последующая их очистка с помощью градиентного центрифугирования. Однако выделенная клеточная популяция представляет собой “популяцию ацидофильных паренхимных клеток”, которые не являются клетками-предшественниками печени, заявленными в настоящем изобретении.
Доклиническая и клиническая применимость клеток-предшественников печени
Существует большой клинический и коммерческий интерес к выделению и идентификации незрелых клеток-предшественников из печени из-за того влияния, которое такая клеточная популяция может оказать на лечение болезней печени. Каждый год в США около 250000 человек госпитализируют по поводу недостаточности печени. Печеночные трансплантаты оказывают лечебное воздействие на некоторые формы недостаточности печени, и в США в год делают около 4100 пересадок. Одним из лимитирующих факторов при пересадках печени является доступность донорской печени, особенно учитывая то обстоятельство, что донорская печень для пересадки органов должна происходить от пациентов, у которых произошла смерть мозга, но не остановка сердца. Использование печени от трупных доноров не приводила к успешным результатам, хотя последние попытки использования таких доноров говорят о возможности их использования в случае, если печень получают не позже, чем через час после смерти донора.
Трансплантация клеток в печень представляет собой привлекательную альтернативную терапию для большинства болезней печени. Хирургические процедуры, требующиеся при пересадке клеток, очень невелики по сравнению требующимися при пересадке целого органа и поэтому их можно использовать для пациентов с различными хирургическими рисками, такими как возраст или слабое состояние здоровья пациента. Использование клеток печени человека предпочтительней, чем использование клеток печени других млекопитающих, поскольку потенциальные патогены, если таковые имеются, будут человеческого происхождения и лучше переносятся пациентами, и, кроме того, их легче отсеять перед использованием.
При попытках осуществить пересадку клеток печени использовали нефракционированные зрелые клетки печени, и при этом достигли некоторую степень эффективности (Fox, I.J. et al. 1998. New England Journal of Medicine. 338:1422-1426.). Однако для успеха необходимо вводить большие количества клеток (10-20 миллиардов), поскольку эти клетки не растут in vivo. Кроме того, введение существенных количеств крупных зрелых клеток печени (средний диаметр клетки 30-50 мкм) осложняется их тенденцией к образованию больших агрегатов после введения, что может привести к летальной эмболии. И кроме того, эти клетки вызывают заметную реакцию иммунологического отторжения, вынуждая к тому, что пациентов приходится держать на иммунодепрессантах ради сохранения их жизни. И наконец, не достигнут успех в криоконсервации зрелых клеток печени, и поэтому очень сложно скоординировать возможность получения подходящей ткани печени, получение клеточных суспензий и немедленную доставку клеток для клинической терапии.
Достижения в выделении клеток-предшественников печени
Известно, что выделение клеток-предшественников из печени является чрезвычайно сложной задачей из-за недостатка маркеров для позитивного отбора клеток печени. Единственными доступными антителами для кандидатов в печеночные клетки-предшественники являются такие моноклональные антитела, которые получают против субпопуляций печеночных клеток-предшественников (овальных клеток), побуждаемых к пролиферации после того, как их подвергли онкогенным повреждениям. Однако эти антитела перекрестно реагируют с антигенами, присутствующими в кроветворных клетках.
В прошлом предпринимали попытки получения популяции печеночных клеток-предшественников, считая их наиболее подходящей популяцией для клеточной и генной терапии печени. В патентах США №№5576207 и 5789246 (Reid et. al.) использовали маркеры клеточной поверхности и проточную цитометрию с боковым рассеянием для получения определенной субпопуляции клеток печени. Субпопуляции печеночных клеток крысы выделяли путем удаления линейно-коммитированных клеток с последующим отбором незрелых печеночных клеток-предшественников, которые определяли как клетки, имеющие форму, отличную от гранулярной, несущие ОС.3-положительный (антигенный маркер овальных клеток), AFP-положительный, альбумин-положительный и СК-19-отрицательный (цитокератин 19) клеточные маркеры. Вышеупомянутые субпопуляции клеток печени крысы демонстрируют особые характеристики, важные для выделения и идентификации обогащенных популяций печеночных клеток-предшественников из печени грызунов.
Выделение клеток-предшественников печени из печени взрослого человека, описываемое здесь, является новым и неожиданным, в частности, из-за полемики, касающейся самого лишь факта присутствия клеток-предшественников печени у взрослого человека, поскольку считается, что печеночные клетки-предшественники в печени взрослого человека либо вовсе не присутствуют, либо являются физиологически молчащими клетками, оставшимися от эмбриогенеза. Поэтому не было попыток их выделения или изучения, за исключением изучения их в состоянии болезни.
В противоположность этому, присутствие цитоплазматических белков альфа-фетопротеина (AFP) и альбумина в развивающейся печени признают сильным положительным индикатором клеток-предшественников. На самых ранних стадиях развития печени эти клетки способны производить потомков, которые поступают как в билиарные, так и в печеночные линии дифференцировки клеток. Если эти дочерние клетки коммитируют к линиям дифференцировки билиарных клеток, то экспрессия альфа-фетопротеина прекращается. Однако в гепатоцитных линиях диференцировки клеток экспрессия альфа-фетопротеина сохраняется вплоть до перинатального периода, когда она подавляется, и в качестве одной из основных характеристик взрослых гепатоцитов остается экспрессия альбумина.
Однако поскольку альфа-фетопротеин является внутриклеточным белком и становится видимым только после фиксации и пермеабилизации клетки (придания клетке свойства проницаемости), то он не подходит для использования в качестве маркера для идентификации жизнеспособных печеночных клеток-предшественников.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Изобретение относится к способу получения композиции, включающей смесь клеток, происходящих из ткани печени человека, причем эта смесь включает обогащенную популяцию человеческих печеночных клеток-предшественников, при этом способ включает: получение по существу одноклеточной суспензии клеток печени человека, включающей смесь клеток различных размеров, включая незрелые клетки и зрелые клетки; и разделение суспензии в условиях, позволяющих удалить зрелые клетки и клетки сравнительно большого размера, оставляя незрелые клетки и клетки сравнительно малого размера, чтобы получить смесь клеток, включающую обогащенную популяцию человеческих печеночных клеток-предшественников, причем сами эти клетки, их потомство или их более зрелые формы несут один или более маркеров, указывающих на экспрессию альфа-фетопротеина, альбумина или их обоих. Альфа-фетопротеин и альбумин могут быть полноразмерными или вариантными. Процесс разделения суспензии может включать разделение по размерам клеток, по плавучей плотности или по обоим этим параметрам. Разделение суспензии также может основываться на скорости отстаивания, на гидродинамическом радиусе и на отстаивании до равновесной плотности. В качестве альтернативы, разделение можно осуществлять на основе разной степени прилипания поверхностных маркеров к связующим компонентам, например к антителам или лектинам. Выделенные клетки-предшественники могут быть диплоидными и могут иметь размер менее 15 микрон в диаметре. Кроме того, клетки-предшественники или их потомство могут синтезировать макромолекулы, характерные для клеток предшественников, включая, но не ограничиваясь этим, альфа-фетопротеин и альбумин. Предпочтительно, альфа-фетопротеин включает пептидную последовательность, кодированную экзоном 1 (aFP). Таким образом, альфа-фетопротеин транскрибируется с мРНК размером более 2 т.п.н., т.е. полноразмерной мРНК aFP. Сходным образом, альбумин предпочтительно включает кодированную экзоном 1 (ALB) пептидную последовательность. Таким образом, альбумин транскрибируется с полноразмерной мРНК.
В другом варианте осуществления настоящее изобретение касается способа выделения, криоконсервации и использования клеток-предшественников печени человека, включающего обработку ткани печени человека для Получения по существу одноклеточной суспензии, включающей клетки-предшественники и клетки, не являющиеся предшественниками, одной или более линий дифференцировки клеток, имеющихся в печени человека; осуществление стадии разделения этой суспензии, которая существенно уменьшает в суспензии количество клеток, не являющихся клетками-предшественниками, чтобы получить разделенную суспензию, обогащенную клетками-предшественниками, экспрессирующими один или более маркеров, связанных, по меньшей мере, с одной из этих линий дифференцировки клеток; необязательно отбор из разделенной суспензии тех клеток, которые сами по себе, либо их потомки, либо их более зрелые формы экспрессируют, по меньшей мере, один маркер, связанный, по меньшей мере, с одной линией дифференцировки клеток; необязательно суспендирование клеток в условиях, оптимальных для криоконсервации; и необязательно использование для получения ростовых факторов и для лечения пациентов. Предпочтительно отбирают клетки-предшественники печени, экспрессирующие цитоплазматические белки, такие как альфа-фетопротеин. Обработка или стадия разделения суспензии по настоящему изобретению предпочтительно включают центрифугирование в градиенте плотности или центрифужную элютриацию (отмывку) суспензии клеток печени для разделения клеток в соответствии с их плавучей плотностью и/или размером, которые связаны с одной или более градиентных фракций, имеющих более низкую плавучую плотность и/или более мелкий размер. Способ градиента плотности может включать зональное центрифугирование и центрифугирование в непрерывном потоке.
Один из вариантов настоящего изобретения представляет собой негативный отбор клеток, не являющихся клетками-предшественниками, включая зрелые печеночные, гемопоэтические (кроветворные) и мезенхимные клетки, с помощью маркеров, связанных со зрелыми печеночными клетками, таких как коннексин, маркеров, связанных со зрелыми гемопоэтическими клетками, таких как гликофорин А и CD45, и/или маркеров, связанных со зрелыми мезенхимными клетками, таких как ретиноиды, а также фактор фон Виллебранда.
Авторы настоящего изобретения установили, что посредством использования печеночных клеток-предшественников можно преодолеть многие из недостатков, связанных с использованием зрелых клеток печени, и сделать их идеальными клетками для использования в генной и клеточной терапии и для получения биоискусственных органов. Эти клетки мелкие (7-15 мкм), поэтому сводится к минимуму возможность образования большой эмболии. Кроме того, эти клетки обладают высоким ростовым потенциалом, что означает, что меньшее количество клеток требуется для восстановления ткани печени у пациента. И наконец, клетки-предшественники имеют минимальные антигенные маркеры, которые могли бы вызвать иммунологическое отторжение, что дает основания надеяться на то, что потребуется лишь небольшое количество иммунодепрессантов, либо они вообще не потребуются. Терапия с помощью клеток печени включает либо экстракорпоральное лечение, либо трансплантацию клеток печени. Клетки, предпочтительно включающие клетки-предшественники, вводят любыми возможными путями, включая парентеральный и внутрибрюшинный пути. Необходимо использовать эффективное количество клеток, предпочтительно составляющее между 103 и 1010 клеток. Более предпочтительно пересаживать между 105 и 108 клеток, а оптимально - около 106 клеток.
В другом варианте осуществления изобретения клетки-предшественники печени очень полезны для получения ростовых факторов и других белков. Эти факторы связаны с их собственным ростом или ростом других клеток-предшественников в печени (например, гемопоэтических или мезенхимных клеток-предшественников) и с факторами, связанными с ранними стадиями, определяющими предназначение печеночных клеток-предшественников для определенных линий дифференцировки клеток. Эти новые ростовые факторы можно использовать для лечения болезней печени или против тех видов рака, которые представляют собой трансформанты печеночных клеток-предшественников. Кроме того, печеночные клетки-предшественники являются важной целью для генной терапии, при которой введенные генетически трансформированные или нормальные печеночные клетки-предшественники улучшают здоровье индивидуума, которому пересажены такие печеночные клетки-предшественники.
Другим аспектом настоящего изобретения является определение уникальных антигенных профилей на поверхности клеток, которые коррелируют с экспрессией альфа-фетопротеина в клетке. Определение таким путем характеристик содержащих альфа-фетопротеин клеток позволяет произвести обогащение с помощью методов проточной цитометрии жизнеспособными печеночными клетками-предшественниками из одноклеточных суспензий живых клеток, полученных из целой печени или из доли печени. Кроме того, выделение и идентификация печеночных клеток-предшественников человека, описываемые здесь, осуществлялись с помощью комбинации уникальных способов, маркеров и параметров, которые авторы настоящего изобретения использовали впервые, для получения уникальной клеточной популяции по настоящему изобретению.
Следующий аспект настоящего изобретения касается клеток-предшественников печени печеночного, гемопоэтического или мезенхимного происхождения. Эти линии дифференцировки клеток, их потомки или их более зрелые формы отбирают с помощью антигенных маркеров, выбранных из группы, состоящей из CD14, CD34, CD38, CD45, CD117, ICAM, гликофорина А, и/или цитоплазматических маркеров, таких как альфа-фетопротеиноподобная иммунореактивность, альбуминоподобная иммунореактивность или с помощью обоих этих маркеров. Альфа-фетопротеин может происходить от полноразмерной мРНК (более чем 2 т.п.н. - форма, обычно экспрессируемая в печеночных клетках-предшественниках) или из вариантной формы (менее чем 2 т.п.н., т.е. примерно 0,5, 0,8, 1, 1,5 или 2 т.п.н. - форма, обычно экспрессируемая в гемопоэтических клетках-предшественниках). Клетки-предшественники печени по настоящему изобретению можно выделять из печени плода, новорожденного, младенца, ребенка, подростка или взрослого человека.
В соответствии с еще одним аспектом этого изобретения изолированные клетки-предшественники печени человека выделяют в высокообогащенной форме до по существу чистой формы. Такие клетки-предшественники печени содержат печеночные, гемопоэтические и мезенхимные клетки-предшественники. Печеночные клетки-предшественники обладают способностью развиваться в гепатоциты, билиарные клетки или в комбинацию этих клеток; гемопоэтические клетки-предшественники обладают способностью развиваться в макрофаги, нейтрофилы, гранулоциты, лимфоциты, тромбоциты, нейтрофильные эозинофилы, базофилы или в комбинацию этих элементов. Мезенхимные клетки-предшественники обладают способностью развиваться в эндотелиальные клетки, стромальные клетки, печеночные звездообразные клетки (клетки Ито), хрящевые клетки, костные клетки или в комбинацию этих клеток. Способ по настоящему изобретению можно использовать для отбора мезенхимных клеток-предшественников, экспрессируюших альфа-фетопротеиноподобную иммунореактивность, CD-45, альбуминоподобную иммунореактивность, CD34, остеопонтин, костный сиалопротенин, коллаген (типы I, II, III и IV) или их комбинацию.
Еще один аспект настоящего изобретения касается клеток-предшественников печени, которые содержат экзогенную нуклеиновую кислоту. Такая экзогенная нуклеиновая кислота может кодировать, по меньшей мере, один полипептид по настоящему изобретению, или может способствовать экспрессии, по меньшей мере, одного полипептида по настоящему изобретению.
В соответствии с еще одним аспектом данного изобретения предлагается способ смягчения отрицательных воздействий одного или более нарушений или дисфункций у человека путем введения индивидууму, страдающему от таких отрицательных воздействий, эффективного количества изолированных клеток-предшественников печени человека. Клетки-предшественники можно вводить либо внутрибрюшинно, либо парентерально, через васкулярный сосуд, или же вводить напрямую в печень. Прямое введение можно осуществить хирургическим путем, через воротную вену, брыжеечную вену, печеночную артерию, печеночный желчный проток или с помощью комбинации этих способов. В ткачестве альтернативы печеночные клетки-предшественники можно вводить в эктопический участок тела пациента, такой как селезенка или брюшина.
Нарушения или дисфункции у человека, которые можно смягчить с помощью способа по настоящему изобретению, включают: гепатохолангит, размягчение печени, гепатомегалию, цирроз, фиброз, гепатит, острую печеночную недостаточность, хроническую печеночную недостаточность или врожденные нарушения метаболизма, а также рак печени, такой как гепатокарцинома или гепатобластома. Рак печени может представлять собой первичную локализацию рака или рак, метастазировавший в печень. Метастатическая опухоль может происходить из любого количества мест первичной локализации, включая кишечник, простату, молочную железу, почку, поджелудочную железу, кожу, мозг, легкое или комбинацию этих мест первичной локализации рака.
В соответствии со следующим аспектом настоящего изобретения предлагается биореактор, который содержит биологический материал, включающий изолированные клетки-предшественники из печени человека, их потомство, их созревающие или дифференцированные потомки, или их комбинации; и культуральные среды, такие как базальная (минимальная) среда; одно или более отделений, содержащих биологический материал или компоненты, включающие биологический материал; и необязательно - одно или более соединительных отверстий. Кроме того, биореактор может необязательно также включать: внеклеточную матрицу; гормоны; ростовые факторы, питательные вещества или комбинацию перечисленного; а также биологическую текучую среду, такую как сыворотка, плазма или лимфа.
Биореактор приспособлен для поддержания указанных клеток-предшественников в жизнеспособном функциональном состоянии и может поддерживать клетки-предшественники печени в течение периода, длящегося от около одной недели до около 55 недель. Конкретно, биореактор приспособлен для использования в качестве искусственной печени, для изготовления продуктов, для токсикологических исследований или для метаболических исследований, включая исследования активности цитохрома Р450 или других типов метаболизма лекарственных веществ.
В соответствии с еще одним аспектом данного изобретения предлагается композиция изолированных клеток-предшественников печени человека или суспензия, обогащенная клетками-предшественниками, полученными из печени человека. Клеточная суспензия предлагается в фармацевтически приемлемом носителе или разбавителе, и ее вводят субъекту, нуждающемуся в лечении. Композиция по настоящему изобретению включает клетки-предшественники печени, экспрессирующие один или более маркеров, связанных, по меньшей мере, с одной или более линиями дифференцировки клеток, имеющихся в печени человека, и по существу не содержит зрелых клеток. Более конкретно, изолированные клетки-предшественники печени происходят из одной или более линий клеточной дифференцировки, включая линии печеночных, гемопоэтических или мезенхимных клеток, и сами клетки-предшественники, их потомки или их более зрелые формы экспрессируют, по меньшей мере, один или более антигенных маркеров CD14, CD34, CD38, CD90 или CD117, CD45, гликофорин А, а также цитоплазменные маркеры альфа-фетопротеиноподобной иммунореактивности, альбуминоподобной иммунореактивности, или оба этих маркера. В другом варианте осуществления изобретения незрелые клетки, их потомство или их более зрелые формы экспрессируют остеопонтин, костный сиалопротеин, коллаген I, коллаген III, коллаген IV или их комбинацию.
В соответствии с еще одним вариантом осуществления данного изобретения предлагается система культуры клеток-предшественников печени, включающая изолированные клетки-предшественники из печени человека, их потомство, их более зрелых или дифференцированных потомков либо их комбинации. Система культуры клеток дополнительно включает внеклеточную матрицу, включающую один или более коллагенов, один или более адгезивных белков (ламинины фибронектины) и другие компоненты, такие как протеогликаны (такие, как гепарансульфат-протеогликаны); или индивидуальный матричный компонент. Матричный компонент включает фрагменты матричных компонентов, имитаторы матрицы, которые могут быть синтетическими или способными к биологическому разложению материалами (т.е. микросферами), покрытыми одним или более факторами из одного или более классов внеклеточных матриц. Система культуры клеток дополнительно может включать базальную или обогащенную среду и другие питательные вещества; гормоны, ростовые факторы и необязательно - биологическую текучую среду, такую как сыворотка, плазма или лимфа. Кроме того, система культуры клеток может иметь одно или более отделений, содержащих биологические материалы, такие как культуральная чашка, планшет, колба, роллерный флакон, transwell или другой подобный контейнер.
Культуры или биореакторы по настоящему изобретению можно использовать в одном или более исследованиях метаболизма, включая изучение активности систем биотрансформации ферментов фазы I или фазы II, в одном или более исследованиях транспорта, включая изучение экспрессии, регуляции и активности печеночных синусоидальных и канальцевых транспортных систем, аспектов метаболизма лекарственных веществ, а также в исследованиях активности цитохрома Р450, среди прочего.
В следующем варианте осуществления настоящего изобретения предлагается способ криоконсервации прикрепленных к субстрату клеток. Способ криоконсервации прикрепленных к субстрату клеток включает (а) обеспечение прикрепленных к субстрату клеток и матрицы или усилителя вязкости; (b) суспендирование клеток в смеси для криоконсервации, включающей культуральную среду, ингибитор образования кристаллов льда, фактор регуляции углеводов, источник железа, липопротеин и липид; и (с) охлаждение суспензии до температуры, которая ниже температуры замерзания клеток. Температура замерзания здесь обозначает температуру, при которой клетки превращаются в твердую массу, которая может представлять собой переохлажденную жидкость или стекловидную микрокристаллическую или макрокристаллическую массу. Кроме того, описывается смесь для криоконсервации, включающая культуральную среду, ингибитор образования кристаллов льда, фактор регуляции углеводов, источник железа, липопротеин и липид. Смесь для криоконсервации может также включать антиоксидант, такой как аскорбиновая кислота, глицерин (10% об.) или диметилсульфоксид (DMSO, 10% об.), причем два последних агента могут действовать как ингибиторы образования кристаллов льда. Фактор регуляции углеводов может представлять собой инсулин или инсулиноподобный ростовой фактор. Источник железа, липопротеин и липид могут представлять собой трансферрин, липопротеин высокой плотности и свободные жирные кислоты, соответственно. Свободные жирные кислоты необязательно находятся в комплексе с альбумином. Смесь для криоконсервации может включать коллаген, коллагеноподобное вещество, агарозу, метилцеллюлозу или желатин, причем коллаген может представлять собой коллаген I, коллаген III или коллаген IV. Компоненты среды для криоконсервации можно приготовить в растворе Viaspan, т.е. в растворе для криоконсервации Висконсинского университета.
Следующий вариант осуществления изобретения представляет собой коллекцию, клеточный банк, каталог или биологический репозиторий, имеющий множество криоконсервированных печеночных клеток-предшественников и/или их потомство. Клетки-предшественники могут быть выделены вышеописанным способом, а также могут представлять собой печеночные клетки-предшественники, выделенные, любым подходящим способом, который обеспечивает получение печеночных клеток-предшественников, экспрессирующих полноразмерный альфа-фетопротеин, альбумин или их оба. Сходным образом, клетки-предшественники могут экспрессировать маркеры, указывающие на присутствие полноразмерного альфа-фетопротеина, альбумина или обоих. Репозиторий может включать систему индексации клеточных маркеров. После оттаивания клетки из репозитория можно использовать для инокуляции биореакторов, для инициации клеточных культур или для лечения пациентов.
Еще один вариант осуществления изобретения включает вариантный альфа-фетопротеин, представляющий собой генный продукт гена или мРНК без экзона 1, что описывается ниже. Как описывается в данном изобретении, вариантный альфа- фетопротеин часто связан с гемопоэтическими клетками-предшественниками и их потомством и не связан с печеночными клетками-предшественниками. И еще один вариант осуществления изобретения включает пептид, включающий от трех до десяти аминокислот, взятый из последовательности, кодируемой экзоном 1 альфа-фетопротеина.
Другой вариант осуществления изобретения включает конъюгат макромолекулы и пептида, включающего от трех до десяти аминокислот, из последовательности, кодируемой экзоном 1 альфа-фетопротеина, и подходящий для использования в качестве антигена. Макромолекула может представлять собой альбумин, гемоцианин, казеин, овальбумин, полилизин, например поли-L-лизин или поли-D-лизин, или любую другую подходящую макромолекулу, известную данной области техники. Можно использовать антиген, генерирующий антитела, специфичные для альфа-фетопротеина, экспрессия которого указывает на наличие печеночных клеток-предшественников, и не указывает на наличие гемопоэтических клеток-предшественников или их потомства. Антитела можно вырабатывать путем иммунизации животного антигеном, в отсутствие или в присутствии адъюванта, или путем обработки клеток селезенки антигеном, с последующим слиянием клеток селезенки для получения гибридом, как это известно в данной области техники.
В следующем варианте осуществления изобретения описывается способ выделения клеток-предшественников из печени человека, включающий обработку ткани печени человека, обеспечивающую получение по существу одноклеточной суспензии, включающей клетки-предшественники клетки, не являющиеся предшественниками, из одной или более линий дифференцировки клеток, имеющихся в печени человека; разделение суспензии, которое существенно уменьшает в суспензии количество клеток, не являющихся клетками-предшественниками, с получением отсортированной суспензии, обогащенной клетками-предшественниками, экспрессирующими один или более маркеров, связанных по меньшей мере с одной или более линиями клеточной дифференцировки, и отбор из отсортированной суспензии тех клеток-предшественников, их потомков или их более зрелых форм, которые экспрессируют один или более маркеров, связанных по меньшей мере с одной или более линиями дифференцировки клеток.
Краткое описание фигур
Фигура 1. ПЦР-анализ мРНК альфа-фетопротеина.
Фигура 2. ПЦР-анализ мРНК альбумина.
Фигура 3. Влияние криоконсервации на жизнеспособность клеток фетальной печени.
Фигура 4. Левая панель: Гистограмма иммунофлуоресценции альфафетопротеина, полученная с помощью клеточного сортера с возбуждением флуоресценции (FACS). Правая панель: Гистограмма иммунофлуоресценции альбумина, полученная с помощью FACS.
Фигура 5. Процент клеток, экспрессирующих поверхностные маркеры CD14, CD34, CD38, CD45 и гликофорин A (GA) в нефракционированных суспензиях клеток печени.
Фигура 6. Коэкспрессия маркеров поверхности клетки и альфа-фетопротеина клетками фетальной печени.
Фигура 7. Вверху слева: Процент альфа-фетопротеин-положительных клеток.
Вверху справа: Процент альбумин-положительных клеток.
Внизу: Влияние фракционирования в перколле на коэкспрессию альфа-фетопротеина и альбумина.
Фигура 8. FACS-анализ суспензии клеток фетальной печени на коэкспрессию CD14, CD38 и альфа-фетопротеина.
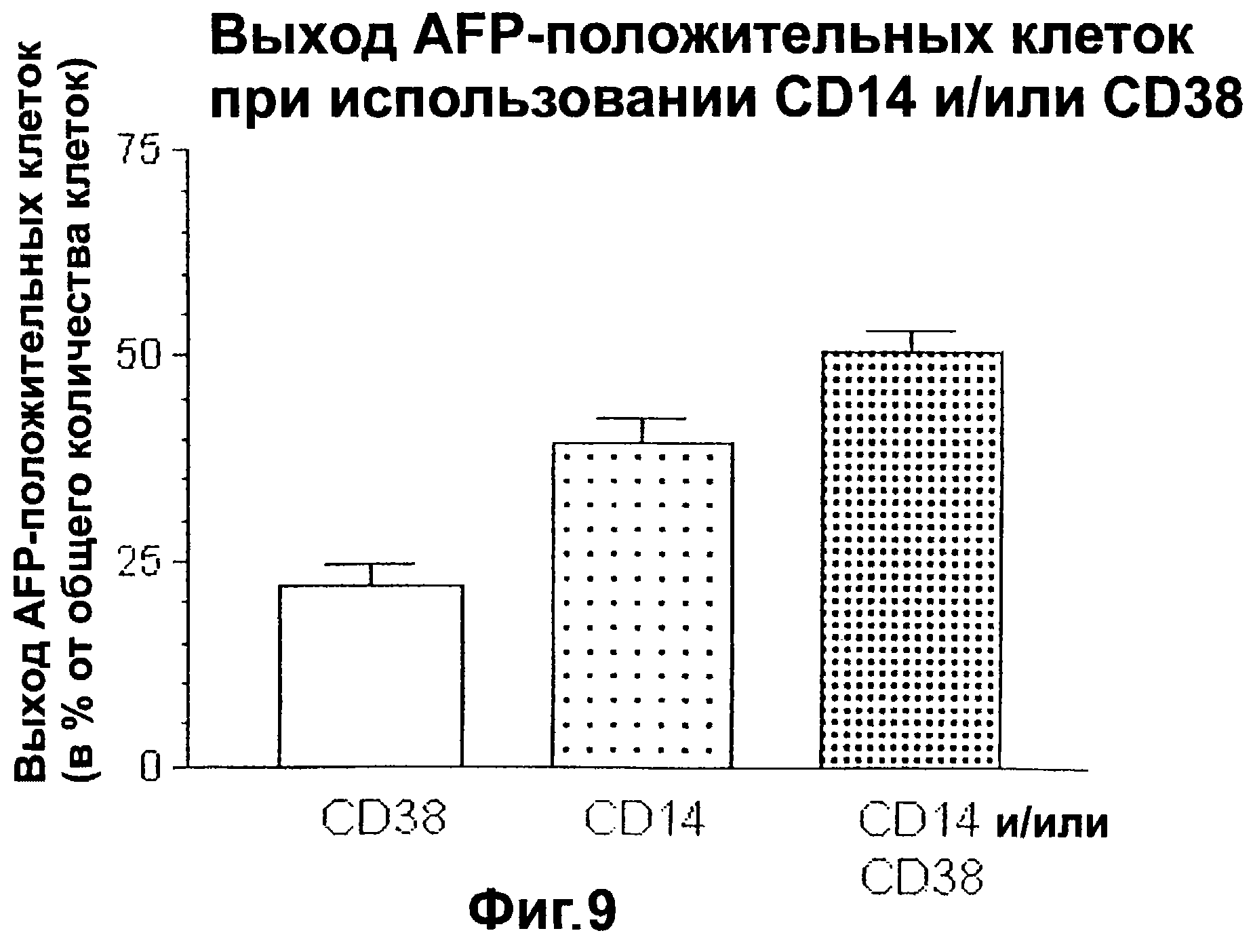
Фигура 9. Выход альфа-фетопротеин-положительных клеток при отборе с помощью CD14 и/или CD38.
Фигура 10. Четыре репрезентативных полученных с помощью иммунофлуоресценции изображения фетальных печеночных клеток-предшественников, окрашенных на альфа-фетопротеин.
Фигура 11. Влияние отбора на CD14 (справа): Изображения, полученные с помощью интерференционного микроскопа (вверху) и иммунофлуоресценции (внизу).
Фигура 12А. Изображение группы клеток печени, полученное с помощью фазово-контрастной микроскопии.
Фигура 12В. Изображение той же самой группы клеток печени, полученное с помощью иммунофлуоресценции с антителом к альфа-фетопротеину.
Фигура 12С. Наложение А и B.
Фигура 13А. Клетки печени, окрашенные с кальцеином.
Фигура 13В. Клетки печени, окрашенные с альфа-фетопротеином, тот же самый вид, что и на панели А.
ПОДРОБНОЕ ОПИСАНИЕ ПРЕДПОЧТИТЕЛЬНЫХ ВАРИАНТОВ ОСУЩЕСТВЛЕНИЯ ИЗОБРЕТЕНИЯ
I. Определения
В нижеследующем описаний ряд терминов часто используют для описания изобретения. Для того чтобы обеспечить ясное и правильное понимание описания и формулы изобретения, включая объем, вкладываемый в такие термины, приводятся нижеследующие определения.
Альфа-фетопротеиноподобная иммунореактивность: Любые иммунные реакции, вызываемые альфа-фетопротеином. Альфа-фетопротеин может быть полноразмерным или усеченным, включая изомеры и сплайс-варианты альфа-фетопротеина.
Коммитированные клетки-предшественники: Незрелые клетки, имеющие один возможный путь развития, такие как гепатоцитные коммитированные клетки-предшественники (дающие начало гепатоцитам) или билиарные клетки-предшественники (дающие начало желчным протокам). Процесс коммитирования на молекулярном уровне не выяснен. Его наблюдают только эмпирически, когда количество путей развития клеток сокращается по сравнению с предшествующими поколениями.
Печеночные клетки: Субпопуляция клеток печени, включающая гепатоциты и билиарные клетки.
Клетки печени: Как он используется в настоящем описании, термин “клетки печени” относится ко всем типам клеток, присутствующих в нормальной печени, независимо от их происхождения или пути развития.
Стволовые клетки: Как он используется в настоящем описании, термин “стволовые клетки” относится к незрелым клеткам, которые могут дать начало дочерним клеткам, имеющим более чем один возможный путь развития, т.е. являющимся плюрипотентными. Тотипотентные стволовые клетки, такие как эмбриональные стволовые клетки (ЕS-клетки) или эмбриональные клетки вплоть до 8-клеточной стадии зародыша млекопитающего, обладают способностью самовозобновления (самоподдержания), заключающейся в том, что стволовая клетка продуцирует идентичную себе дочернюю клетку. В противоположность этому, детерминированные стволовые клетки, такие как кроветворные, нервные, кожные или печеночные стволовые клетки, являются плюрипотентными и обладают способностью к интенсивному росту, но их способность к самовозобновлению находится под вопросом. В случае тотипотентных стволовых клеток, некоторые дочерние клетки идентичны родительским клеткам, а некоторые “изменяют” им (“коммитируют”), переходя на специфический путь (пути) развития, что ограничивает их генетический потенциал до величины, меньшей, чем генетический потенциал родителей. В случае детерминированных стволовых клеток некоторые дочерние клетки сохраняют плюрипотентность, а некоторые теряют ее, коммитируя до единственного конкретного пути развития.
Печеночные клетки-предшественники: Эти клетки дают начало гепатоцитам и билиарным клеткам. Печеночные клетки-предшественники включают три субпопуляции: “печеночные стволовые клетки”, “коммитированные гепатоцитные клетки-предшественники” и “коммитированные билиарные клетки-предшественники”, причем последние две субпопуляции представляют собой незрелые клетки, которые являются потомками печеночных стволовых клеток и имеют один возможный путь развития, т.е. они могут стать либо гепатоцитами, либо билиарными клетками, но не любыми из них.
Печеночные стволовые клетки: Субпопуляция печеночных клеток-предшественников.
Клетки-предшественники печени: Популяция клеток из печени, включающая печеночные клетки-предшественники, гемопоэтические клетки-предшественники и мезенхимные клетки-предшественники.
Гемопоэз (кроветворение): Образование клеток крови с путями развития лимфоцитов (В и Т), тромбоцитов, макрофагов, нейтрофилов и гранулоцитов.
Мезенгенез: Образование мезенхимных производных с путями развития клеток эндотелия, жировых клеток, стромальных клеток, хрящей и даже кости (два последних пути развития встречаются в печени только в состоянии болезни).
Клеточная терапия: Как он используется здесь, термин “клеточная терапия” относится к переносу in vivo или ex vivo определенных клеточных популяций, используемых в качестве аутогенного или аллогенного материала и трансплантируемых в конкретные клетки-мишени пациента или вблизи от этих клеток. Клетки можно трансплантировать в любой подходящей среде, носителе или разбавителе, или с помощью любого типа системы доставки лекарств, включая микроносители, гранулы, микросомы, микросферы, пузырьки и т.д.
Генная терапия: Как он используется здесь, термин “генная терапия” относится к переносу in vivo или ex vivo определенного генетического материала к конкретным клеткам-мишеням пациента, тем самым изменяя генотип в большинстве случаев, изменяя фенотип этих клеток-мишеней, конечной целью чего является предотвращение или изменение определенного болезненного состояния. Генная терапия может включать модификацию клетки-мишени ех vivo и введение этих клеток пациенту. В качестве альтернативы к клеткам-предшественникам печени может быть in vivo направлен вектор, чтобы доставить к ним экзогенный генетический материал и трансфецировать эти клетки-предшественники. Кроме того, в биореакторе могут использоваться полученные с помощью методов генной инженерии клетки-предшественники для лечения пациентов или в качестве источника биологических продуктов. В соответствии с этим определением основная предпосылка состоит в том, что эти терапевтические генетические процедуры направлены на то, чтобы в максимальной степени предотвратить, вылечить или изменить явное или скрытое патологическое состояние. В большинстве случаев конечной целью генной терапии является изменение фенотипа популяции конкретных клеток-мишеней.
CD: “Кластер дифференциации” или “общая детерминанта” в данном описании относится к молекулам поверхности клеток, распознаваемым моноклональными антителами. Экспрессия некоторых CD специфична для клеток определенной линии дифференцировки или пути созревания, а экспрессия других CD варьирует в зависимости от состояния активации, положения или дифференцировки одних и тех же клеток.
Когда в данном описании используются термины “один” он обозначает “по меньшей мере один” или “один или более”, если не оговорено иное.
II. Альфа-фетопротеин и альбумин в качестве диагностических маркеров для линий печеночных клеток.
Альфа-фетопротеин (AFP) и альбумин, оба из которых являются цитоплазменными белками, представляют собой особо надежные маркеры для линий печеночных клеток. Экспрессия этих белков лежит в основе идентификации субпопуляций печеночных клеток, позволяя отличить их от других типов клеток печени.
Клеточные линии лейкоза человека и нормальные Т-лимфоциты после стимуляции in vitro также могут экспрессировать AFP. Однако в литературе не сообщается, находятся ли мРНК AFP в клеточных линиях лейкоза и в активированных Т-лимфоцитах в форме, идентичной аутентичной мРНК AFP в печеночных клетках. Необходимо было определить, можно ли измерять экспрессию мНРК AFP или альбумина с помощью обычных методов анализа белков, таких как иммунофлуоресценция, вестерн-блоттинг и т.п., поскольку метод RT-PCR (ПЦР с обратной рестриктазой) является наиболее чувствительным из известных методов идентификации конкретных матриц РНК.
До описываемых здесь исследований никто подробно не изучал формы мРНК AFP или альбумина в гемопоэтических клетках человека. Настоящее изобретение демонстрирует экспрессию вариантных форм AFP и альбумина в гемопоэтических клетках.
Фигура 1 иллюстрирует анализ клеток печени и клеток, не являющихся клетками печени, с помощью полимеразной цепной реакции (ПЦР), с праймерами к нескольким экзонам мРНК альфа-фетопротеина.
ПЦР-анализ выявляет усеченный AFP в гемопоэтических клетках. Осуществляли анализ RT-PCR с помощью комбинации праймеров hAFPl, hAFP2, hAFP3 и hAFP4. М обозначает молекулярную массу маркеров, дорожки 1-3 обозначают Нер3В; дорожки 10-12 - фибробласты STO; дорожки 13-15 - без РНК. Обратите внимание, что на дорожках 2, 4 и 8 имеется общая полоса - усеченная форма AFP. На дорожках 1 и 4 отмечена вариантная форма AFP, уникальная для клеток печени. Полный вид AFP наблюдается на дорожках 3 и 6. Авторы изобретения сконструировали девять праймеров для ПЦР, чтобы охарактеризовать вариантные формы мРНК hAFP, как описано в примере 1. Последовательность кодирования AFP идет от экзона 1 до экзона 14. Все комбинации праймеров, кроме комбинации для экзона 1 мРНК AFP, амплифицируют часть мРНК AFP в клеточной линии эритролейкоза человека, К562, и в то же время все комбинации обнаруживают мРНК AFP в линиях печеночных клеток человека HepG2 и Нер3В. Это показывает, что вариантные формы мРНК AFP содержат экзоны от экзона 2 до экзона 14, как это экспрессируется в К562, но не охватывают всю последовательность кодирования AFP. Этот результат подтверждает, что единственными пригодными праймерами для идентификации печеночных клеток являются те, которые обнаруживают часть экзона 1 AFP, экспрессия которого скорее всего ограничена ткань-специфичным образом. Тот факт, что экзон 1 является уникальным для субпопуляций печеночных клеток-предшественников, позволяет использовать его в качестве зонда для идентификации печеночных клеток-предшественников и отличать их от гемопоэтических клеток-предшественников.
Поскольку усеченные формы AFP найдены в некоторых субпопуляциях гемопоэтических клеток, альбумин также анализируют как в печеночных, так и в гемопоэтических клетках. Праймеры для альбумина сконструировали таким же образом, как и для AFP (см. выше) и использовали их для анализа экспрессии альбумина в линиях печеночных клеток no сравнению с линиями гемопоэтических клеток. Что касается AFP, то его усеченная форма была найдена в К562, линии гемопоэтических клеток, а транскрипт был обнаружен с помощью праймера для экзона 12-14.
Данное изобретение описывает конструкцию и получение специфических праймеров RT-PCR для определения вида экспрессии вариантных форм мРНК AFP и альбумина в популяциях печеночных клеток по сравнению с популяциями гемопоэтических клеток. Как описывается здесь, изобретение демонстрирует, что вариантные формы мРНК как AFP, так и альбумина, можно найти в гемопоэтических клетках-предшественниках. Это означает, что в случае применения таких чувствительных методов анализа необходимо использовать дополнительные критерии, такие как зонд экзон 1 для AFP, чтобы отличить популяции печеночных клеток от популяций гемопоэтических клеток.
Фигура 2 иллюстрирует ПЦР-анализ клеток печени и клеток, не являющихся клетками печени, для нескольких экзонов альбумина. Поскольку усеченная форма мРНК AFP найдена в некоторых субпопуляциях гемопоэтических клеток, то альбумин также анализируют как в печеночных, так и в гемопоэтических клетках. Праймеры для альбумина сконструировали аналогичным образом, как и для AFP (см. выше) и использовали их для анализа экспрессии альбумина в линиях печеночных клеток по сравнению с линиями гемопоэтических клеток. Что касается AFP, то его усеченная форма была найдена в К562, линии гемопоэтических клеток, и транскрипт был обнаружен с помощью праймера для экзона 12-14.
Исследования развития печени показывают, что печень плода во время внутриутробного развития представляет собой как гепатопоэтический, так и гемопоэтический орган. Во время различных стадий развития печени, печень плода содержит большие количества гемопоэтических клеток, особенно эритроидных линий дифференцировки клеток. Кроме того, появляется все больше подтверждений того, что гепатопоэтическая и гемопоэтическая системы близко связаны между собой, и, возможно, эта взаимосвязь включает совместную экспрессию AFP и альбумина или, может быть, изотипов этого белка. Тот факт, что экзон 1 AFP является уникальным для субпопуляций печеночных клеток-предшественников, позволяет идентифицировать определенные субпопуляции клеток-предшественников печени по настоящему изобретению.
Хотя ПЦР-анализ показывает, что гемопоэтические клетки-предшественники могут экспрессировать мРНК как AFP, так и альбумина, но уровни экспрессии этой мРНК очень малы. Действительно, в случае, если AFP и альбумин измеряют методом проточной цитометрии, то в К562 нельзя найти обнаруживаемых количеств ни AFP, ни альбумина. Хотя как AFP, так и альбумин имеют решающее значение для идентификации печеночных клеток-предшественников, но AFP является особенно ценным для диагностики печеночных клеток-предшественников после их очистки методом проточной цитометрии, благодаря его интенсивной экспрессии в печеночных клетках-предшественниках. AFP также пригоден для оценки чистоты печеночных клеток-предшественников после любых процедур по фракционированию.
III. Обработка клеток-предшественников печени человека
Авторы настоящего изобретения разработали способы, обеспечивающие оптимальный выход диссоциированных клеток-предшественников печени плода и взрослого человека. Изолирование зрелых клеток печени обычно включает ферментативную и механическую диссоциацию ткани с получением одноклеточной суспензии, с последующим фракционированием с помощью методов центрифугирования в градиенте плотности, центрифужной элютриации (отмучивания), дифференциального ферментативного расщепления (а именно печеночных звездчатых клеток), и/или с отбором с помощью культуры клеток (обзор в публикации Freshney, "Culture of Animal Cells, A Manual of Basic Technique", 1983, Alan R Liss. Inc. NY). Центрифугирование в градиенте плотности большинство исследователей обычно используют для удаления тех элементов, которые они считают обломками клеток и мертвыми клетками, отбракровывая все фракции и оставляя только последний осадок в пробирке после центрифугирования.
В то время как все остальные исследователи используют последний осадок в пробирке после фракционирования в градиенте плотности, описываемая здесь методика является уникальной в том отношении, что она предполагает использование верхних фракций градиента плотности и исключает использование осадка после центрифугирования. Описываемый здесь новый вариант способа центрифугирования в градиенте плотности заключается в том, что осадок в пробирке после центрифугирования удаляют, а клетки, имеющие более низкую плавучую плотность (т.е. клетки, собирающиеся в верхней или около верхней части градиента), оставляют. Авторы изобретения установили, что более молодые (т.е. диплоидные) клетки и лучше переносящие криоконсервацию клетки собираются в верхней части перколла, используемого в качестве градиента плотности, а не в осадке в пробирке.
IV. Разделение популяции
Разделение популяции - это процесс обогащения ее клетками-предшественниками печени. Клетки-предшественники могут относиться к любой из нескольких линий дифференцировки клеток, включая печеночные, гемопоэтические и мезенхимные линии клеток. Поскольку в печени имеются различные зрелые клетки, которые могут быть тетраплоидными или полиплоидными, то полезно удалить некоторые или все зрелые клетки, чтобы получить обогащенную популяцию клеток-предшественников. Предпочтительно, но не обязательно, осуществлять стадию разделения при 4°С.
После получения одноклеточной суспензии клеток печени, клетки разделяют на множество фракций по размеру клеток, плавучей плотности или по комбинации обоих этих параметров. В соответствии с настоящим изобретением клетки-предшественники печени имеют размер менее 315 микрон в диаметре. Подходящим является любой способ разделения, позволяющий отделить такие мелкие клетки от более крупных клеток и от обломков клеток, включая способы разделения по скорости отстаивания в культуральной среде (которая может быть базальной или обогащенной средой), градиентное отстаивание, хроматографию с использованием гранул с крупными порами для фракционирования клеток, среди прочего. Градиентный материал может представлять собой покрытый поливинилпирролидоном кремнезем (перколл), сшитую целлюлозу (фиколл), декстран или любой другой материал, известный в данной области техники и приготовленный в виде изотонического раствора, чтобы предотвратить лизис клеток, например, в фосфатно-буферном солевом растворе или в базальной среде Игла (Eagle) (ВМЕ). Суспензию диссоциированных клеток обычно наносят на поверхность слоя градиентного материала и подвергают воздействию центробежного поля, поддерживая ее при температуре 4°С. В качестве альтернативы, клеточную суспензию можно наносить на устройство для афереза, такое как используемое для выделения компонентов крови, т.е. для плазмафереза. Крупные клетки, включая зрелые паренхимные клетки и тетраплоидные клетки, оседают быстрее, чем мелкие клетки-предшественники и диплоидные клетки, после чего осевшие клетки удаляют. Методика центрифугирования учитывает чувствительность клеток к низкому давлению; кислорода и минимизирует время, необходимое для обогащения клеточной суспензии. С помощью этих способов клеточную суспензию можно обогатить печеночными клетками-предшественниками. Кроме того, стадия разделения может включать отмучивание центрифугированием (элютриацию), пэннинг, основанный на белках, прилипающих к поверхности клеток, аффинную хроматографию или обработку в периодическом режиме, мечение флуоресцентными метками, зональное центрифугирование, центрифугирование в непрерывном потоке, магнитное разделение после инкубации с магнитными гранулами, например с магнитными гранулами в комплексе с антителами, или комбинацию этих способов. При центрифугировании в градиенте плотности может использоваться прерывистый или непрерывный градиент. Перколловая фракция пригодна для немедленного использования, для криоконсервации, для введения в культуру или для дальнейшего обогащения. Дальнейшее обогащение можно осуществлять путем пэннинга, аффинного отбора, с помощью клеточного сортера с возбуждением флуоресценции (FACS) или любым другим способом, известным в данной области техники и описанным выше. Негативный отбор осуществляют путем удаления клеток, экспрессирующих маркеры для CD45, гликофорина А или другие маркеры, которые упоминаются ниже. Позитивный отбор осуществляют путем отбора клеток, экспрессирующих CD14, CD34, CD38, ICAM и другие маркеры, указывающие на экспрессию полноразмерного альфа-фетопротеина, альбумина или обоих.
В другом варианте разделения популяции клетки, не являющиеся клетками-предшественниками, селективно удаляют с помощью селективного лизиса. Эритроциты лизируют путем кратковременного помещения суспензии клеток в изотонический раствор хлорида аммония, с последующим разбавлением культуральной средой и центрифугированием для удаления “теней” эритроцитов и свободного гемоглобина. Аналогично, клетки, не являющиеся клетками-предшественниками, селективно и гидролитически лизируют путем замораживания с помощью смеси для криоконсервации, описываемой ниже. Различные способы разделения суспензии позволяют удалить полиплоидные клетки; клетки, экспрессирующие маркеры, связанные со зрелыми гемопоэтическими клетками; клетки, экспрессирующие маркеры, связанные со зрелыми печеночными клетками; клетки, экспрессирующие маркеры, связанные со зрелыми мезенхимными клетками, а также комбинацию этих клеток.
IV. Криоконсервация клеток-предшественников печени человека и потомства этих клеток
Методология криоконсервации в соответствии с настоящим изобретением уникальна и отличается от способов, используемых на известном уровне техники. Главные отличия заключаются в использовании других буферов и в криоконсервации популяции клеток-предшественников печени, которая имеет низкую плотность и, таким образом, является плавучей при градиентном центрифугировании. Печеночные клетки-предшественники имеют малый размер и являются диплоидными.
Успешная криоконсервация зрелых клеток печени человека очень желательна, но ее никогда не достигали в данной области техники. Как правило, успешную криоконсервацию определяют как возможность замораживания клеток при температурах жидкого азота (-160...-180°С) с последующим их оттаиванием и с сохранением после этого жизнеспособности в размере >75% и способности прикрепляться к культуральным сосудам. При использовании более старых способов зрелые гепатоциты грызунов и человека имеют жизнеспособность 30-40%, и не способны прикрепляться к культуральным сосудам после замораживания при вышеуказанных условиях (см. Toledo-Pereya et al., патент США №4242883; Fahy et al., патент США №5217860; Mullon et al., патент США №5795711; и Fahy et al., патент США №5472876). В этих патентах сообщается об очень низких показателях жизнеспособности (<50%) клеток, и они касаются в основном клеточных культур (а не индивидуальных клеток в клеточной суспензии) и требуют продолжительного пребывания клеток в буфере перед замораживанием.
Фигура 3 демонстрирует отличную жизнеспособность клеток печени после криогенного хранения в соответствии со способом по настоящему изобретению. Данные выражены в виде изменения процента жизнеспособности, измеренной во время обработки и во время оттаивания. Эти данные показывают, что криоконсервация не оказывала существенного отрицательного влияния на жизнеспособность клеток. Не отмечалось существенных изменений в жизнеспособности в течение периода до 550 суток хранения. Особая методология криоконсервации по настоящему изобретению включает использование нового буфера, новой клеточной популяции, и необязательно погружение клеток в формы внеклеточных матриц. С помощью этой методологии впервые достигли жизнеспособности после оттаивания, которая не отличалась от жизнеспособности, измеренной до замораживания, сразу же после диспергирования клеток. Фактические значения жизнеспособности варьируют в зависимости от состояния ткани после ее доставки и от воздействий, оказываемых подготовкой клеточной суспензии с применением ферментативной и механической диссоциации, и в среднем составляют 77% для клеток фетальной печени. Применявшиеся методики криоконсервации не привели к существенным потерям жизнеспособности в результате замораживания и к потере способности клеток прикрепляться к культуральным сосудам и размножаться ex vivo после оттаивания.
V. Имиуноселекция клеток-предшественников печени человека
Изобретение предлагает способ изолирования клеток-предшественников из печени человека, включающий обеспечение по существу одноклеточной суспензии клеток ткани печени человека, с последующей позитивной или негативной иммуноселекцией. Способ иммуноселекции может включать отбор из суспензии тех клеток, которые сами по себе, их потомство или их более зрелые формы экспрессируют по меньшей мере один маркер, связанный по меньшей мере с одной линией дифференцировки клеток. Эти линии дифференцировки клеток могут представлять собой линии гемопоэтических, мезенхимных, печеночных клеток или какие-либо комбинации этих линий дифференцировки клеток. Этап селекции (отбора) клеток может включать удаление клеток, экспрессирующих гликофорин A, CD45, маркер, специфичный для клеток взрослой печени, коннексин 32 или комбинацию вышеупомянутого. Кроме того, способ селекции может включать удаление полиплоидных клеток; клеток, экспрессирующих маркеры, связанные со зрелыми гемопоэтическими клетками; клеток, экспрессирующих маркеры, связанные со зрелыми печеночными клетками; клеток, экспрессирующих маркеры, связанные со зрелыми мезенхимными клетками, или комбинацию вышеупомянутого. Отбор клеток может включать отбор клеток, экспрессирующих CD14, CD34, CD38, ICAM или их комбинацию. Кроме того, с помощью этого способа можно идентифицировать и отбирать зрелые гемопоэтические клетки, которые эксперссируют гликофорин А, CD45 или их комбинацию. И кроме того, с помощью этого способа селекции можно отбирать зрелые мезенхимные клетки, экспрессирующие ретиноиды, фактор фон Виллебранда, фактор VIII или их комбинации.
Способ иммуноселекции можно осуществлять в сочетании с разделением популяции клеток, основанным на размере клеток, на их плавучей плотности или на комбинации этих параметров. С помощью этого способа можно отобрать клетки, экспрессирующие, по меньшей мере, один маркер, связанный, по меньшей мере, с одной линией дифференцировки клеток, которая может представлять собой линию гемопоэтических, печеночных или мезенхимных клеток. Отбор клеток, их потомства или их более зрелых форм может основываться, по меньшей мере, на одном маркере, связанном, по меньшей мере, с одной линией дифференцировки печеночных клеток. Эта линия дифференцировки может представлять собой паренхимные клетки или гепатоциты, или же билиарные клетки. Таким образом, маркеры, экспрессируемые клетками, могут представлять собой CD14, CD34, CD38, CD117, ICAM или их комбинации.
VI. Клеточные маркеры и проточная цитометрия
Используя свое определение клеток-предшественников печени как популяций незрелых клеток, экспрессирующих альфа-фетопротеин, наряду с экспрессией альбумина или без нее, авторы настоящего изобретения проанализировали маркеры, с помощью которых можно проводить селекцию конкретно на эти типы клеток, используя технологии иммуноселекции. Поразительным открытием явилось то, что многие из маркеров (например, CD34), являющихся классическими маркерами для гемопоэтических клеток-предшественников, могут также идентифицировать субпопуляции печеночных клеток-предшественников. Так, одноцветный сортинг для выделения CD34 привел к значительному (по меньшей мере в 9 раз) обогащению популяции клетками, экспрессирующими AFP. Однако не для всех из этих АFР-положительных клеток может быть подтверждено, что они являются печеночными клетками-предшественниками. Основываясь на проценте альбумин-положительных клеток, авторы изобретения установили, что 80-90% этих клеток являются печеночными клетками-предшественниками, а остальные являются либо печеночными клетками-предшественниками, слишком незрелыми для того, чтобы экспрессировать альбумин, либо, возможно, субпопуляциями гемопоэтических клеток, экспрессирующих альфа-фетопротеин.
В этом изобретении используется уникальная стратегия сортинга с помощью проточной цитометриии. Используя комбинацию экспрессии AFP и альбумина, как две уникальных определяющих характеристики печеночных клеток-предшественников, авторы настоящего изобретения идентифицировали антигенные маркеры и другие проточно-цитометрические параметры, определяющие печеночные клетки-предшественники. Известные к настоящему времени стратегии сортинга включают отбор мелких клеток (<15 мкм, при измерении с прямым рассеиванием), которые являются диплоидными (что определяют с помощью флуоресценции при окрашивании красителем Hoechst 33342), выглядят гранулярными при боковом рассеивании и являются отрицательными по отношению к определенным гемопоэтическим; антигенам (т.е. к гликофорину А, антигену эритроцитов и CD45), с последующим разделением с помощью положительных маркеров на субпопуляции печеночных и гемопоэтических клеток (т.е. CD14 и/или CD38).
В описываемых здесь экспериментах авторы настоящего изобретения идентифицируют печеночные клетки-предшественники с помощью отбора тех клеток, которые в сильной степени экспрессируют альфа-фетопротеин, слабо экспрессируют альбумин, а также экспрессируют CD14, CD34, CD38, CD117 или их комбинацию. Кроме того, здесь описывается доказательство того, что гемопоэтические клетки экспрессируют также и AFP, хотя и в усеченной форме. Авторы данного изобретения описывают новую клеточную популяцию, способы изолирования, идентификации, культивирования, а также способ применения такой клеточной популяции. Успех в изолировании, идентификации и культивировании конкретных клеточных популяций по настоящему изобретению обеспечивается, в частности, с помощью улучшенных способов изолирования, аффинного разделения популяции, высокоскоростного сортинга клеток с возбуждением флуоресценции, повышенной скоростью и точностью способа, а также с помощью модифицированных способов криоконсервации и культивирования.
Авторы изобретения демонстрируют стратегии проточно-цитометрического сортинга и способы выделения клеток-предшественников из свежеизолированных клеточных суспензий и/или из оттаявших криоконсервироеанных клеток печени. Эти способы включают: 1) окрашивание клеток несколькими помеченными фторным зондом антителами к конкретным маркерам клеточной поверхности и 2) использование комбинации стратегий негативного и позитивного сортинга в многопараметровых технологиях проточной цитометрии. Способы выделения конкретных стадий линий дифференцировки клеток из популяций печеночных кдеток человека можно применять для печени, полученной от донора любого возраста, поскольку эти маркеры являются специфичными для линии дифференцировки клеток и ее положения.
Улучшенные способы мечения клеток и резко улучшенный проточный цитометр (проточный цитометр "MoFlo" фирмы Cytomation, сортирующий клетки со скоростью 40000 клеток в секунду и выполняющий 8-цветный сортинг), по сравнению с проточным цитометром, применявшимся в прошлом (FACSTAR PLUS, фирмы Becton Dickenson, который сортирует клетки со скоростью 2000-6000 клеток в секунду и выполняет 2-4-цветный сортинг) позволяют осуществлять успешное изолирование и идентификацию этой новой клеточной популяции.
Фигура 4 демонстрирует унивариантный сортинг с возбуждением флуоресценции (FACS-сортинг). Клеточную суспензию готовят для иммунофлуоресцентного анализа альфа-фетопротеина (AFP) с помощью антител, конъюгированных с красным красителем Сy5, а для альбумина - с помощью антител, конъюгированных с синим красителем (АМСА). Осуществили скрининг тридцати тысяч клеток на наличие красной (AFP) и синей (альбумин) флюоресценции. Результаты показывают наличие четких групп клеток, положительных по отношению к каждому из этих белков. Дальнейший анализ показывает, что около 80% популяций, положительных по отношению к каждому из белков, представлено одними и теми же клетками (т.е. показана коэкспрессия этих двух белков). Экспрессия AFP-подобной и альбуминоподобной иммунореактивности хорошо определяется в клеточных суспензиях, с наличием явно выраженной группы клеток, демонстрирующей четкое отличие от фонового сигнала. Альфа-фетопротеин экспрессируется у 6,9±0,86% клеток в нефракционированных клеточных суспензиях, а альбумин присутствует у 7,7±1,1% клеток. Среди AFP-положительных клеток 75,6±4,9% клеток коэкспрессйруют альбумин, а 80±5,5% альбумин-положительных клеток экспрессируют также и AFP. Таким образом, примерно 25% клеток, экспрессирующих альфа-фетопротеин, не экспрессируют альбумин, и 20% клеток, экспрессирующих альбумин, не экспрессируют альфа-фетопротеин.
Пропорциональное содержание клеток, несущих основные поверхностные маркеры, использованные в этой работе, показано для полных клеточных суспензий (т.е. включающих эритроциты) в таблице 2 (GA = гликофорин А, поверхностный маркер на эритроцитах).
Фигура 5 иллюстрирует процент клеток, экспрессирующих поверхностные маркеры CD14, CD34, CD38, CD45 и гликофорин А (GA) в нефракционированных суспензиях клеток печени. Обратите внимание, что данные по GA размещены на правой оси, чтобы сохранить масштаб. Фигура 6 иллюстрирует процент клеток в исходной клеточной суспензии, экспрессирующих альфа-фетопротеин и другие антигенные маркеры. Показаны средние величины ± стандартная ошибка среднего для процента клеток, положительных по отношению к альфа-фетопротеину (AFP) и к определенным поверхностным маркерам (CD14, 34, 38, 45 и гликофорину А). Ясно, что гликофорин А (GA)-положительные клетки (т.е. эритроидные клетки) представляют собой основной компонент в клеточной массе, за исключением незначительной фракции AFP-положительных клеток.
Фигура 7 (вверху) иллюстрирует коэкспрессию альфа-фетопротеина и альбумина. Показана экспрессия альфа-фетопротеина (левая панель) и альбумина (правая панель) в суспензиях клеток фетальной печени с селективным уменьшением или без селективного уменьшения количества эритроцитов с помощью фракционирования в перколле. Процент AFP-положительных клеток, коэкспрессирующих альбумин, также увеличен до 80,5±8,2%, а пропорциональное содержание альбумин-положительных клеток, коэкспрессирующих AFP, увеличилось до 89±3,1%, хотя ни одно из этих изменений не является статистически значимым.
Фигура 7 (внизу) иллюстрирует влияние разделения клеточной популяции с помощью фракционирования в перколле на коэкспрессию альфа-фетопротеина и альбумина. Пропорциональное содержание клеток, экспрессирующих как альфа-фетопротеин, так и альбумин, выражено в виде процентов AFP- или альбумин-положительных клеток. Данные для клеток с уменьшением или без уменьшения количества эритроцитов получены с применением фракционирования в перколле. Видно, что когда в клеточных суспензиях путем фракционировния в перколле уменьшали количество эритроцитов, то пропорциональное содержание клеток, экспрессирующих AFP, значительно возрастало - до 12,9±1,9%, а клеток, экспрессирующих альбумин - до 12,1±2,3%.
Результаты воздействия этой процедуры на пропорциональное содержание клеток, несущих поверхностные маркеры, показаны в таблице 3, вместе с пропорциональным содержанием каждой подгруппы, проявляющей положительное окрашивание на AFP.
Фигура 8 иллюстрирует FACS-анализ суспензии клеток фетальной печени на коэкспрессию CD14, CD38 и AFP. Бивариантная диаграмма рассеяния показывает распределение окрашивания триколором на CD14 (ордината) по сравнению с окрашиванием флуоресцинизотиоцианатом (ФИТЦ) на CD38 (абсцисса). Создали окна возбуждения флуоресценции для отбора определенных группировок клеток в соответствии с сигналами CD14 и CD38. Их использовали для демонстрации интенсивности AFP-окрашивания для каждой из этих подгрупп.Результаты по AFP показывают, что высокий уровень обогащения AFP получали путем отбора клеток, положительных в отношении как CD38, так и CD14. AFP-сигнал, генерируемый всей клеточной суспензией (30000 клеток), показан внизу слева. В большинстве случаев присутствие AFP в подгруппах, отобранных с помощью маркера клеточной поверхности, имеет непрерывное распределение с явным преобладанием клеток, демонстрирующих интенсивность окрашивания в позитивном диапазоне. Однако распределение CD38-положительных клеток по коэкспрессии AFP было уникальным. У CD38-положительных клеток было очевидным бимодальное распределение по коэкспрессии AFP, при котором явно видны две различающиеся группы клеток, одна из которых является AFP-положительной, а другая отрицательной.
Результаты показывают, что альфа-фетопротеин (AFP) присутствует у 7% клеток в одноклеточных суспензиях ткани фетальной печени (т.е. в исходной клеточной суспензии). Установлено, что антитело к гликофорину А (антиген на красных кровяных тельцах, эритроцитах) идентифицирует субпопуляцию клеток, не экспрессирующих AFP. Таким образом, клетки, экспрессирующие этот антиген (т.е. эритроидные клетки) исключают из клеток, характеризуемых как печеночные клетки-предшественники. Антиген CD38 идентифицирует популяцию клеток, демонстрирующую значительное увеличение пропорционального содержания AFP-положительных клеток (а именно, их пропорциональное содержание; более чем в 7 раз выше, чем в нефракционированных образцах). Оба антигена демонстрируют наличие ряда изоформ, в зависимости от того, присутствуют или не присутствуют части молекулы, кодируемые сплайсинговыми вариантами. Имеются антитела, которые идентифицируют различные изоформы.
Установлено, что классический маркер для гемопоэтических клеток-предшественников, CD34, присутствует на многих клетках, которые экспрессируют также и AFP. Отбор СD34-положительных клеток приводит также и к обогащению AFP-положительными клетками, по меньшей мере, в 9 раз по сравнению с исходной клеточной суспензией (67% в CD-положительных клетках по сравнению с 7% в исходной клеточной суспензии). Однако наиболее эффективным одинарным антителом для обогащения по содержанию AFP-положительных клеток является CD14, которое приводит к более чем 11-кратному увеличению пропорционального содержания этих клеток по сравнению с исходной популяцией (81% против 7%).
Предположили, что выход AFP-положительных клеток можно увеличить с помощью комбинации поверхностных маркеров. Поэтому определяли величину коэкспрессии AFP с выбранными комбинациями поверхностных маркеров, чтобы установить, до какой степени можно увеличить отбор внутриклеточных маркеров. Данные выражены в виде пропорционального содержания AFP-положительных клеток, экспрессирующих поверхностные маркеры (обозначенного как “выход” AFP-положительных клеток) и в виде пропорционального содержания всех АFР-положительных клеток в популяции, определенного с помощью поверхностного маркера (обозначенного как фактор “обогащения” для AFP-положительных клеток). Результаты для комбинаций CD14, CD34 и CD38 показаны в таблице 4 вместе с результатами, полученными по отдельным маркерам, для сравнения.
Обогащение. Процент клеток, экспрессирующих любой (или оба) из поверхностных маркеров, которые также являются AFP-положительными.
Выход. Процент всех AFP-положительных клеток, которые также экспрессируют одну (или обе) комбинации поверхностных маркеров.
Фигура 9 показывает, как отбор на CD14 и CD38 обогащает по содержанию AFP-положительных клеток. Пропорциональное содержание AFP-положительных клеток в клеточных суспензиях, полученных из фетальной печени, резко увеличивается в результате отбора клеток, имеющих на своей поверхности положительные метки, указывающие на маркеры CD38 и CD14. Комбинация этих двух маркеров обеспечивает значительно лучшее обогащение AFP-содержащими клетками, чем использование любого из этих маркеров по отдельности.
Фигура 10 иллюстрирует результаты флуоресцентной микроскопии печеночных клеток-предшественников человека. Репрезентативные печеночные клетки-предшественники из фетальной печени окрашивали для определения содержания AFP. Размеры клеток указывают на то, что присутствуют как более ранние клетки-предшественники, так и более продвинутые печеночные клетки-предшественники. Морфология клеток, дающих положительное окрашивание на AFP, различна и охватывает весь диапазон размеров и форм клеток в суспензии, полученной из печени плода, но не из печени взрослого человека. Самые крупные из AFP-положительных клеток, размером примерно в 12-15 мкм, намного меньше, чем зрелые гепатоциты, имеющие размер в интервале от 20 до 50 мкм.
Фигура 11 иллюстрирует репрезентативные клетки, отобранные на основании экспрессии AFP. Клетки с положительным окрашиванием на CD14 (справа) характерны для гепатобластов. Клетки с отрицательным окрашиванием на поверхностные маркеры более мелкие и по размеру и морфологии сходны с ранними печеночными клетками-предшественниками. Во всех случаях определенная часть AFP-положительных клеток не экспрессирует никаких поверхностных антител, использованных в этом исследовании. Внешний вид таких AFP-положительных “нулевых” клеток показан на фигуре 11, где их можно сравнить с внешним видом СD14-положительных/АFР-положительных клеток, отобранных из той же самой суспензии. Ясно, что хотя оба этих типа клеток являются AFP-положительными, но клетки, дающие отрицательное окрашивание на наличие поверхностных антигенов, значительно более мелкие и менее сложные, чем CD14-положительные клетки.
Таким образом, возможными маркерами для отбора печеночных клеток-предшественников являются: гликофорин A-, CD45-, ICAM+, один или более из CD14+, CD34, CD38+, CD117, диплоидные, негранулярные (при боковом рассеивании), размером менее 15 мкм (при прямом рассеивании). По фенотипу эти отобранные клетки представляют собой мелкие (<15 мкм) клетки, с малым количеством цитоплазмы (с высоким соотношением ядра к цитоплазме), альбумин+и/или AFP+++ .
VII. Конфокальное описание экспрессирующих альфа-фетопротеин клеток в печени плода и в печени взрослого человека
Конфокальное микроскопирование использовали для получения изображений клеток печени плода и взрослого человека, экспрессирующих альфа-фетопротеин. Эта методология позволяет наблюдать морфологию и размеры этих клеток, а также непосредственно показывает расположение внутриклеточных белков, таких как AFP и ALB, и белков мембранных поверхностных маркеров, таких как CD34 и CD38.
Фигура 12 иллюстрирует конфокальное микроскопирование экспрессирующих альфа-фетопротеин клеток, то есть печеночных клеток-предшественников в печени взрослого человека. На фигуре показаны три вида одного и того же поля, и видно, что в этом поле имеются две AFP-положительных клетки. На панели (С) показано наложение панели (A) и панели (В) и видна морфология AFP-положительных клеток (розового цвета, в оригинале) в группе клеток печени.
Фигура 13 иллюстрирует клетки, меченные кальцеином (А), чтобы показать все типы клеток. Фигура 13 (В) состоит из тех же самых клеток, коэкспрессирующих AFP, и показывает, что только две клетки являются АFР-положительными. Размер клеток не является фактором, связанным AFP-положительным состоянием.
Экспрессирующие AFP клетки обнаружены как в печени плода, так и в печени взрослого человека. Печень плода, как и ожидалось, имеет самый высокий процент (6-7%) этих клеток, в то время как печень взрослого человека имеет низкий процент (<1%), причем количество этих клеток уменьшается с возрастом донора. Имеющееся в печени взрослого человека небольшое количество печеночных клеток-предшественников можно значительно обогатить с помощью способа фракционирования в перколле, получив выход клеток до 2% в перколльных фракциях 1 и 2, полученных из печени взрослого человека (таблица 5). Ни одной экспрессирующей AFP клетки не найдено в печени доноров в возрасте старше 71 года.
Таблица 5 показывает размер и жизнеспособность клеток из выделенных с помощью перколла фракций клеток печени взрослого человека. Более мелкие клетки (фракции 1-3) имеют более высокую жизнеспособность, чем более крупные клетки (фракция 4), после криосохранения, осуществлявшегося в одинаковых условиях.
Эти результаты подтверждают, что органы доноров, пригодные для использования в клеточной терапии печени, а также для пересадки органов, включают печень от молодых доноров (в возрасте примерно до 45 лет). Кроме того, печень от престарелых доноров (в возрасте более 65 лет) не подходит в качестве донорного материала для клеточной терапии, а возможно и для пересадки целых органов, особенно для детей, поскольку в такой печени очень мало или совсем нет обладающих высокой регенеративной способностью печеночных клеток-предшественников, а известно, что зрелые клетки обладают регенеративной способностью, которая характеризуется только как умеренная до минимальной.
VIII. Линии дифференцировки клеток по созреванию
Таким образом, зрелая печень содержит популяцию печеночных клеток-предшественников, способную к росту и дифференциации в гепатоциты и билиарные клетки, как в нормальном состоянии, так и в состоянии болезни. Настоящее изобретение отстаивает предположение о том, что каждая позиция в линии дифференцировки клеток печени представляет собой отдельную стадию созревания, и о том, что в печени имеются многочисленные популяции стволовых клеток.
Выяснилось, что зародышевая печень в соответствии с настоящим изобретением обеспечивает выход клеток-предшественников для трех отдельных линий дифференцировки клеток по созреванию: линия гепатопоэза, при котором клетки могут развиваться в гепатоциты и билиарные клетки (клетки желчных протоков); линия гемопоэза, при котором клетки могут развиваться в лимфоциты (В и Т), тромбоциты, макрофаги, нейтрофилы и гранулоциты; и линия мезенгенеза, при котором клетки могут развиваться в эндотелий, жировые клетки, стромальные клетки, хрящевые клетки и даже в костные клетки (два последних типа клеток встречаются в печени только в состоянии болезни).
Как правило, стволовые клетки представляют собой незрелые клетки, которые могут дать начало дочерним клеткам, имеющим более одного возможного пути развития. Стволовые клетки продуцируют дочерние клетки, некоторые из которых идентичны родительским клеткам, а некоторые “коммитируют” (уходят) на особый путь развития. Процесс коммитирования на молекулярном уровне неясен. Его существование признают только на эмпирическом уровне, когда наблюдают, что возможности развития клеток сужаются по сравнению с возможными путями развития предшествующих клеток. “Коммитированные клетки-предшественники” определяют как незрелые клетки, имеющие только один возможный путь развития, такие как гепатоцитные коммитированные клетки-предшественники (дающие начало гепатоцитам) или билиарные коммитированные клетки-предшественники (дающие начало желчным протокам).
Переходы от стволовых клеток к взрослым клеткам происходят в виде ступенчатого процесса, который приводит к образованию линий дифференцировки клеток по созреванию, в которых размер клеток, их морфология, потенциал роста и экспрессия генов связаны с определенной линией. Для определения этого процесса годится метафора “старение”. “Молодые” клетки обладают ранней экспрессией генов и самым высоким ростовым потенциалом; более поздние клетки в данной линии дифференцировки обладают “поздней” экспрессией генов и обычно ограничены в росте или не растут совсем. Поздние клетки можно рассматривать как “старые”, или, пользуясь биологическим термином, апоптотические, и в конечном счете исчезающие из популяции. Процесс развития линии дифференцировки клеток по созреванию приводит к естественному кругообороту клеток в ткани и позволяет осуществлять регенерацию после повреждений. Ткани отличаются происходящими в них кинетическими процессами и процессами созревания. Линия дифференцировки по созреванию клеток кишечника развивается очень быстро, проходя полный цикл развития менее чем за неделю, а линия дифференцировки по созреванию клеток печени развивается медленно, и для клеток печени крысы полный цикл развития требует около года.
Формы клеток печени крысы, развивающиеся примерно на 10-й день эмбриональной жизни, называемые “эмбриональными клетками 10-го дня” или Е-10, отличаются впячиванием кардиальной мезенхимы эндодермом, расположенным в области средней кишки эмбриона (Zaret, К. 1998. Current Opinion in Genetics & Development. 8:526-31). Наиболее раннее распознавание клеток печени в эмбрионах было получено в исследованиях мРНК, кодирующей альфа-фетопротеин (AFP), в которых использовали гибридизацию in situ ((Zaret, К. 1998. Current Opinion in Genetics & Development. 8:526-31); Zaret, K. 1999. Developmental Biology (Orlando). 209:1-10). Экспрессирующие AFP клетки наблюдали в области средней кишки эмбриона около мезенхимы, которая дает начало сердцу на 9-10-й день, у всех изученных образцов печени крысы и мыши. Печень становится макроскопически видимой на 12-й день развития эмбриона (Е-12) и достигает величины около 1 мм на 13-й день (Е-13).
Параллельно этому происходит гемопоэз, с появлением первых идентифицируемых гемопоэтических клеток на 15-16 дни (Е-15 - Е-16 (у грызунов) и на 3-4-й месяц эмбрионального развития у людей, с пиком эритропоэза (образования эритроидных клеток или красных кровяных телец), отмечаемым в день Е-18 (у грызунов) и на 5-6-й месяц у людей. Во время пика эритропоэза красные кровяные тельца преобладают в печени, и их количество составляет более 70% от общего количества клеток в печени. Конец периода беременности у грызунов приходится на 21-й день, а у людей на 9 месяцев. Во время первых часов после рождения количество гемопоэтических клеток резко уменьшается, так что на второй день постнатальной жизни (у грызунов) и в первые одну или две недели (у людей) большинство гемопоэтических клеток исчезают, мигрируя в костный мозг. Никто не знает причины этой миграции гемопоэтических клеток. Однако имеются два основных предположения.
Первое заключается в том, что гемопоэтические клетки предпочитают относительно анаэробные условия и уходят в костный мозг (который является относительно анаэробным), поскольку в печени уровень кислорода повышенный при активации легких; а второе предположение состоит в том, что причиной миграции является потеря гормонов беременности. После рождения потеря гемопоэтических клеток-предшественников в печени связана с резким уменьшением количеств печеночных клеток-предшественников и параллельным увеличением количеств и степени зрелости гепатоцитов и билиарных клеток. Полное созревание печени завершается ко 2-3-й неделе постнатальной жизни (у грызунов) и в течение нескольких месяцев (у людей). К этому времени оставшиеся печеночные клетки-предшественники локализуются в областях воротных триад на периферии каждого из ацинусов печени.
После этого устанавливается классическое строение ацинуса печени, причем каждый ацинус на своей периферии определяется шестью наборами воротных триад, каждая из которых имеет желчный проток, печеночную артерию и печеночную вену, а в центре имеется центральная вена, которая соединяется с полой веной. Пластинки клеток печени, как спицы в колесе, располагаются от периферии к центру. Условно, эти пластинки можно разделить на три зоны: зона 1 расположена около портальных триад; зона 2 является среднеацинозной, и зона 3 расположена около центральной вены. Диплоидные клетки печени имеются только в зоне 1; тетраплоидные клетки находятся в зоне 2; а тетраплоидные, октаплоидные и многоядерные клетки расположены в зоне 3. Такая структура весьма вероятна для линии дифференцировки клеток по созреванию, которое завершается процессом апоптоза (Sigal, S.H. et al. 1995, Differentiation, 59:35-42);
IX. Использование концепции линий дифференцировки клеток в доклинических и клинических исследованиях биологии печени
Характеристики роста и; дифференциации in vitro и in vivo клеточной популяции по настоящему изобретению согласуются с концепцией и применениями модели линии дифференцировки клеток печени, основанной на положении линии дифференцировки. Например, в культуре паренхимы in vitro способность паренхимных клеток к делению и количество делений клеток строго предопределены зависимостью от положения линии дифференцировки клеток. Поэтому околоворотные клетки паренхимы будут иметь более высокий потенциал делений, чем околоцентральные клетки. Это позволяет ответить на вопрос, долго не имевший ответа, заключающийся в том, почему первичные культуры клеток печени - органа, известного как наиболее регенеративный во всем теле, демонстрируют такую низкую способность к делению в культуре.
Для стволовых клеток и их трансформированных копий, гепатом, предсказывается экспрессия рано проявляющихся генов, таких как гены альфа-фетопротеина и инсулиноподобного фактора II, но не генов, более поздно экспрессируемых в линии дифференцировки клеток. В модели линий дифференцировки клеток по созреванию ни одна гепатома не экспрессирует поздние гены, поскольку полное прохождение по всей линии дифференцировки клеток требует ненарушенной регулировки дифференциации, роста и клеточных циклов. И это действительно наблюдается в клеточной популяции по настоящему изобретению. В исследованиях по молекулярной биологии, сравнивающих специфичную для печени экспрессию генов в эмбриональных и во взрослых тканях, определяют несколько классов генов: гены, с помощью которых можно диагностировать компартменты (стволовые клетки, амплификация, дифференциация); гены, экспрессируемые зонально, способные пересекать границы компартментов; и гены, экспрессируемые на ранней, средней или поздней стадии в линии дифференцировки клеток, но дискретно в небольшом количестве клеток.
Различные морфологические типы и виды экспрессии генов в первичных опухолях печени можно выявить путем изучения клеточной популяции по настоящему изобретению. Если опухоли представляют собой пролиферацию трансформированных стволовых клеток с различными способностями к дифференцировке, то общая экспресия альфа-фетопротеина в гепатомах не является маркером, индуцированным опухолью, является индикатором наличия увеличенной популяции незрелых клеток, нормально экспрессирующих альфа-фетопротеин.
Популяция изолированных клеток по настоящему изобретению имеет большое значение для успеха клеточной и/или генной терапии печени. Настоящее изобретение, как описывается в примерах, определяет ключевые условия, при которых можно успешно криоконсервировать печеночные клетки человека и не относящихся к человеку приматов.
Благодаря способности значительно увеличиваться in vitro, клеточную популяцию по настоящему изобретению, подобно клеткам в гемопоэтической линии дифференцировки, можно использовать в качестве “материала для трепанобиопсии”, для получения исходных клеток для размножения их ex vivo. Это устраняет необходимость больших инвазивных хирургических вмешательств на печени пациента.
После того как получена культура печеночных клеток-предшественников, осуществляют перенос генов. Это можно осуществить с помощью ряда различных систем векторов для доставки генов. При этом важно иметь в виду, что успешный перенос генов требует наличия быстро растущей культуры, а поскольку печеночные клетки-предшественники человека по настоящему изобретению успешно делятся в нормальных физиологических условиях, то эти клетки идеально подходят для переноса генов в печень. Кроме того, ростовые характеристики клеточной популяции по настоящему изобретению позволяют использовать их для переноса генов ex vivo с помощью определенных векторов для доставки генов (т.е. ретровирусных векторов), при этом для эффективной вставки и экспрессии генов требуется наличие пролиферации клеток.
Альтернативный подход для генной терапии представляет собой конструирование векторов, мишенью которых являются конкретные клетки-предшественники, с последующим введением этого вектора, сопряженного с нужным геном, непосредственно пациенту. Векторы направляются к эндогенной популяции клеток-предшественников и модифицируют их.
Популяцию клеток-предшественников по настоящему изобретению можно использовать в аутогенной и аллогенной клеточной или генной терапии. Ясно, что использование аутогенных печеночных клеток-предшественников устраняет серьезные опасения, связанные с отторжением пересаженных клеток. Клеточная популяция по настоящему изобретению особенно привлекательна для аллогенной пересадки клеток, поскольку их антигенный профиль предполагает минимальную иммунологическую реакцию отторжения. Кроме того, другие клеточные элементы, такие как клетки крови, эндотелиальные клетки, клетки Купффера, известные как высокоиммуногенные, по существу устраняются в процессе очистки.
После того как аутогенные или аллогенные печеночные клетки-предшественнники выделены, очищены и введены в культуру, их можно генетически модифицировать или оставить неповрежденные, размножающиеся in vitro клерки, а затем вновь трансплантировать их хозяину. Если желательная генетическая модификация, то после нее и перед трансплантацией генетически измененные клетки можно размножить и/или отобрать на основе введения и экспрессирования доминантного селектируемого маркера. Трансплантат можно возвратить в печеночный компартмент или в эктопический либо гетеротопический сайт. Для трансплантации в печеночный компартмент можно использовать вливание в воротную вену или внутриселезеночную инъекцию. Внутриселезеночная инъекция может применяться по выбору в ткачестве пути ведения, поскольку печеночные клетки-предшественники, пересаженные путем внутриселезеночной инъекции, перемещаются в печеночный компартмент.
Дополнительные медицинские процедуры могут способствовать повышению эффективности приживления в печени трансплантированных печеночных клеток-предшественников. Модели на животных продемонстрировали, что при частичной гепатэктомии введение факторов ангиогенеза и других ростовых факторов способствует приживлению трансплантата и повышению жизнеспособности пересаженных гепатоцитов. Альтернативный подход состоит в пересадке генетически модифицированных гепатоцитов в эктопический сайт.
К настоящему времени попытки использования клеточной терапии в отношении печени оказались малоэффективными. Это может быть обусловлено тем, что использовавшиеся донорные клетки в основном были представлены взрослыми клетками печени, срок жизни которых после выделения и повторного введения невелик. Кроме того, использование взрослых клеток приводит к сильному иммунологическому отторжению. Печеночные клетки-предшественники по настоящему изобретению обеспечивают более высокую эффективность, за счет их уменьшенной тенденции вызывать иммунологическую реакцию отторжения, а также благодаря их высокому регенеративному потенциалу.
Что касается генной терапии, то продолжаются попытки использовать “направленные инъецируемые векторы”, которые представляют собой наиболее популярный разрабатываемый подход для клинической терапии. Однако эти попытки имели ограниченный успех, как из-за иммунологических проблем, так и из-за неустойчивой экспрессии векторов. Единственным подходом в генной терапии, доказавшим свою перспективность, была генная терапия ех vivo, и эти исследования были проведены почти исключительно на гемопоэтических клетках-предшественниках. Авторы изобретения уверены, что генная терапия ех vivo с использованием клеток-предшественников (или с использованием инъецируемых векторов, каким-либо образом направленных на популяции этих клеток-предшественников) окажется более эффективной, поскольку эти векторы можно ввести ех vivo в очищенные субпопуляции клеток-предшественников; модифицированные клетки отбирают и вновь вводят in vivo. Преимущество клеток-предшественников состоит в их огромном потенциале размножения, а также в том, что они вызывают лишь минимальную реакцию отторжения или вообще не вызывают такой реакции, и в их способности к дифференциации с образованием целой линии дифференцировки зрелых клеток.
X. Общие или взаимозависимые линии дифференцировки клеток.
Улучшенные методологии позволили авторам настоящего изобретения более подробно изучить и охарактеризовать печеночные клетки-предшественники. Эти исследования выявили особо тесную взаимосвязь между печеночными и гемопоэтическими клетками-предшественниками, что подтверждает наличие тесной связи между этими двумя линиями дифференцировки клеток. И действительно, эти исследования показывают, что клетки-предшественники печеночных и гемопоэтических линий дифференцировки обладают многочисленными одинаковыми антигенными маркерами (CD14, CCD334, CCD38, CD117 или ckit, антигенами овальных клеток), обладают общими биохимическими свойствами (а именно имеют одинаковые трансферрины, глутатион-S-трансферазы и усеченную изоформу альфа-фетопротеина), а также имеют большое сходство в требованиях к условиям культивирования (формы внеклеточной матрицы и специфические требования к гормонам) для размножения ех vivo. Клетки-предшественники обеих линий дифференцировки расположены в одних и тех же сайтах ацинуса печени. И наконец, в клетках этих двух линий дифференцировки клеток по созреванию существует паракринная передача сигналов, а именно сигналы, продуцируемые каждой из этих линий дифференцировки, управляют клетками другой из этих двух линий. Таким образом, можно сделать вывод, что, по-видимому, существует общая линия или по самой меньшей мере взаимозависимые линии дифференцировки печеночных и гемопоэтических клеток.
Описываемые здесь клеточные популяции очищают и используют для получения производных либо миелогемопоэтических, либо печеночных клеток, в зависимости от условий, в которых эти клетки выделяют и культивируют. Поэтому системы биореакторов, инокулированных клеточными популяциями, отобранными на набор антигенов, определяющий как печеночные, так и гемопоэтические клетки-предшественники (например, CD38+, ckit+, CD45+) могут обеспечить получение клеточных популяций, обладающих многими потенциальными путями развития. Путь развития зависит от того, как клетки вновь вводят in vivo, или от того, в какие условия культивирования помещают клетки.
Другой важный аспект клеточной популяции по настоящему изобретению заключается в том, что эти клетки экспрессируют специфичный для гемопоэтических стволовых клеток поверхностный антиген CD34. CD34-положительные клетки костного мозга использовали в качестве удобного маркера для позитивного отбора гемопоэтических стволовых клеток. Однако увеличивается число сообщений, в которых высказываются сомнения в отношении специфичности антигенного маркера CD34 для гемопоэтических стволовых клеток (Nakauchi H., Nature Medicine, 4:1009-1010 (1998)). Экспериментальные данные свидетельствуют о том, что в CD34-отрицательной популяции клеток костного мозга человека и в пуповинной крови существуют клетки, которые могут вновь заселять костный мозг иммунонедостаточных мышей.
Настоящее изобретение, как описывается здесь, предлагает способы очистки популяций как гемопоэтических, так и печеночных клеток-предшественников, которые затем используют в клинических и доклинических программах, на основании установленных тесных взаимосвязей между печеночными и гемопоэтическими клетками.
Использование печеночных клеток-предшественников широко и многообразно. Оно включает: 1) исследования, проводимые на клетках человека; 2) получение вакцин и антивирусных препаратов; 3) токсикологические исследования; 4) разработку лекарственных средств; 5) получение белков (с использованием клеток в качестве хозяев для выработки различных специфичных для человека факторов); 6) клеточную терапию печени; 7) генную терапию печени; 8) получение биоискусственной печени, которую можно использовать в научных исследованиях, в токсикологических и антимикробных исследованиях, для получения белков, или использовать в лечебных целях в качестве системы помощи печени. Учитывая возможность существования общих для печеночных и гемопоэтических клеток-предшественников линий дифференцировки, показанную авторами настоящего изобретения, одни и те же клетки можно использовать как для печеночного, так и для гемопоэтического пути развития, в зависимости от условий, в которые их помещают.
Доступность печеночных клеток-предшественников человека с высокой степенью очистки позволит проводить гораздо более интенсивные исследования на клетках человека, что ускорит разработку успешных форм клеточной и генной терапии печени, а также позволит получить биоискусственную печень человека для использования ее как в исследованиях, так и в клинических устройствах. В настоящее время ограниченная доступность здоровых донорных тканей человека мешает осуществлению клинических программ по клеточной терапии печени и получению биоискусственной печени. Популяции клеток-предшественников имеют значительный потенциал размножения, что поможет преодолеть или, по меньшей мере, значительно уменьшить указанную ограниченную доступность донорного материала.
ПРИМЕРЫ
Нижеследующие примеры вносят иллюстративный характер и не ограничивают объем настоящего изобретения.
Пример 1
Анализ вариантных форм и альбумина, экспрессируемых в печеночных клетках, по сравнению с другими типами клеток.
Клеточные линии: Две линии гепатомы человека, Нер3В и HepG2, поддерживают в среде Игла MEM с добавкой 1 мМ пирувата натрия, 2мМ L-глютамина, 50 Е/мл пенициллина, 50 мкг/мл стрептомицина, 0,1 мМ раствора не являющихся незаменимыми аминокислот среды MEM, 5 мкг/мл инсулина и 10% фетальной бычьей сыворотки (FBS). Клеточную линию эритролейкоза человека К 562 и клеточную линию эмбриональных фибропластов мышей STO поддерживают в среде DMEM/F12 с добавкой 2 мМ L-глютамина, 50 Е/мл пенициллина, 50 мкг/мл стрептомицина, 5×10-5 М 2-МЕ и 10% фетальной бычьей сыворотки.
Анализ RT-PCR: Тотальные РНК экстрагируют из Нер3В, HepG2 и STO методом Chomcznski and Sacchi N., Anal. Biochem. 162:156-159 (1987). кДНК синтезируют с помощью олиго-DТ-примирования и подвергают PCR-амплификации с помощью наборов праймеров, сконструированных авторами настоящего изобретения для человеческого AFP или альбумина. Последовательности праймеров следующие:


Реакцию ПЦР проводят в общем объеме 50 мкл, состоящем из 1 мкМ каждого праймера, 200 мкМ каждого из dNTP, 50 мМ КСl, 1,5 мМ MgCl2, 10 мМ Tris HCl, pH 8,3, и 1,25 Е Amplitaq-полимеразы (Cetus Corp.). Образцы нагревают до 94°С в течение 3 минут, с последующей амплификацией в течение 30 циклов по 2 минуты при 94°С, 2 минуты при 62°С и 3 минуты при 72°С. После последнего цикла осуществляют конечную стадию удлинения при 72°С в течение 7 минут. Затем по 5 мкл реакционного раствора каждой реакции ПЦР выливают на 2%-ный агарозный гель, содержащий 5 мкг/мл этидийбромида в трис-ацетатном-ЭДТА-буфере.
RT-PCR для AFP: Ген AFP человека состоит из 15 экзонов (Gibbs et al., Biochemistry, 26:1323-1343). Чтобы отличить усеченные транскрипты от мРНК функционального полного AFP, две разных части последовательности кДНК AFP отбирают в качестве молекул-мишеней реакции RT-РCR. Комбинацию праймеров hAFP1 и hAFP2 используют для амплификации экзона 1, содержащего инициаторный MET (метионин), до экзона 3, в то время как hAFP3 и hAFP4 амплифицируют экзон 12 до экзона 14, содержащего терминирующий кодон. Результаты ПЦР показаны на фигуре 1. Обе комбинации праймеров приводят к получению хорошо заметных полос амплификации в РНК из Нер3В и HepG2 (дорожки 1, 2, 4 и 5). В противоположность этому, только одна специфическая полоса С-терминальной части обнаруживается с помощью набора праймеров hAFP3 и hAFP4 в мРНК из К562 (дорожки 7 и 8). Этот результат подтверждает, что клеточная линия эритролейкоза, К562, экспрессирует только усеченную форму AFP без N-конца. Для подтверждения этой гипотезы провели реакцию ПЦР для всей области кодирования AFP с помощью праймеров hAFP1 и hAFP4. Как и ожидалось, ПЦР кДНК Нер3В и HepG2 демонстрирует только одну заметную полосу величиной в 1,8 т.п.н. (дорожки 3 и 6), при отсутствии полосы в К562 (дорожка 9). Контролями служили образцы без РНК и образец, происходящий из клеточной линии эмбриональных фибропластов мышей (STO). Ни один из них не имел ни одной заметной полосы.
Далее, сконструировали серию праймеров 5’ от экзона 2 до экзона 6, чтобы увидеть различия между аутентичной и вариантной формами мРНК hAFP. Представленный на фигуре 1 результат показывает, что вся область кодирования, кроме экзона 1, у вариантной формы hAFP в К562 одинакова с аутентичной формой (дорожки 1, 3, 5, 7, 9 и 11).
RT-PCR для альбумина: Ген альбумина человека состоит из 15 кзонов (Minghetti et al., J. Biol. Chem., 261:6747-7657). Как и для AFP, комбинацию праймеров hALB1 и hALB2 используют для амплификации экзона 1, содержащего инициаторный MET (метионин), до экзона 4, в то время как комбинация hАLВ3 и hALB4 амплифицирует экзон 12 до экзона 14, содержащего терминирующий кодон. Результаты ПЦР показаны на фигуре 1. Обе комбинации праймеров приводят к хорошо:заметным полосам амплификации в РНК из Нер3В и HepG2 (дорожки 1, 2, 4 и 5). В противоположность этому, только одна специфическая полоса С-терминальной части обнаруживается с помощью набора праймеров hALB3 и hALB4 в РНК из К562 (дорожки 7 и 8). ПЦР для всей кодирующей области альбумина, проведенная с помощью праймеров hALBl и hALB4, не показала ни одной полосы в К562 (дорожка 9). Контролями служили образцы без РНК и образец, происходящий из клеточной линии эмбриональных фибропластов мышей (STO). Ни один из них не имел ни одной заметной полосы.
Поставщики реагентов включают:
Sigma Chemical Companyi (St. Louis, Mo)
Gibco BRL Products (Gaxthersburgh, MD)
Worthinghton Biochemical Corporation (Frehold, New Jersey)
Dupont Pharmaceuticals (Wilmington, Delaware)
Falcon-a-subsidiary из Becton Dickinson Labware (Franklin Lakes, New Jersey)
Поставщики тканей включают:
Anatomical Gift Foundation (Atlanta, Georgia)
Advanced Biosciencies Research, ABR (San Francisco, Cal)
Местные отделения трансплантационной хирургии в больнице UNC
Пример 2
Обработка печени человека
Фетальная печень: Фетальная печень поступает из многих клиник, связанных с Advanced Biosciencies Research (ABR), все из которых расположены в Калифорнии, или из Anatomical Gift Foundation (AGF), с клиниками на Юге США (а именно в штатах Калифорния, Вирджиния), на Северо-востоке (Пенсильвания) или на Среднем Западе (Канзас, Колорадо). Плоды получали из клиник; ткани вычленяли из плодов и помещали в среду RPMI 1640 (Gibco) с добавкой инсулина (Sigma, 5 мкг/мл), трансферрина (Sigma, 5 мкг/мл), селена (10-9M) и 5% фетальной бычьей сыворотки (Gibco). Затем образцы помещали на лед и отправляли в лабораторию авторов изобретения, причем этот процесс мог занимать 10-16 часов. Таким образом, авторы получали образцы примерно через 24 часа после операции. Затем образцам присваивали номер с приставкой REN, в хронологическом порядке поступления образцов (REN 1, 2, 3 и т.д.), где REN представляет собой аббревиатуру от слова Renaissance ("Возрождение").
Печень взрослого человека: Образцы печени взрослого человека поступали из Anatomical Gift Foundation или из местных хирургических клиник (UNC) и представляли собой отторгнутую ткань печени, эксплантаты из реципиентов трансплантатов или печень, предназначавшуюся для пересадки органов, но не использованную для этих целей по причинам иным, чем патогены. Пациентов, являвшихся донорами ткани эксплантата или отторгнутой донорской ткани, подвергали исследованию на ряд заболеваний, и только те образцы, которые на основании этих исследований были признаны безопасными, использовали для дальнейшей технологической обработки клеток. После извлечения из тела пациентов образцы печени помещали в раствор Висконсинского университета (называемый также Viaspan) и на льду отправляли в лабораторию авторов изобретения. Промежутки времени между извлечением органа из тела пациента с мертвым мозгом (“время фиксации”) и его прибытием в лабораторию были очень разными. Образцы прибывали менее чем через 24 часа от “времени фиксации”, т.е. от времени, когда печень удаляли из тела донора.
Трупная печень: Печень, взятую после смерти человека, по меньшей мере через 30 часов после смерти, получали из местных ассоциаций по поставке органов (например, из Каролинской Ассоциации по поставке органов, или СОРА). Печень обрабатывали так же, как печень взрослого человека.
Перечень элементов, проанализированных на безопасность для исследователя: ВИЧ I и II, вирус человеческого Т-клеточного лейкоза I и II, гепатит B и С; туберкулез. Перечень для клинического использования включает: ВИЧ I и II, вирус человеческого Т-клеточного лейкоза I и II, гепатит А, В, С и G; EBV, CMV; туберкулез, сифилис и микоплазму.
Печень плода и взрослого человека обрабатывали с помощью комбинации ферментативного расщепления и механической диссоциации, причем печень плода готовили преимущественно с помощью механической диссоциации, а печень взрослого человека - преимущественно с помощью ферментативного расщепления. Описание каждого из этих способов дано ниже. Печень как плода, так и взрослого человека расщепляли в течение различных промежутков времени в ферментном буфере, который служит для растворения внеклеточных матриц, связывающих между собой клетки в ткани. Смесь коллагеназных ферментов, использованная для выделения клеток печени, представляет собой ферментный препарат высокой чистоты "Liberase", выпускаемый фирмой Boehringer-Mannheim, состоящий из смеси очищенных коллагеназы и эластазы. Эту ферментную смесь можно использовать при значительно более низких концентрациях и с уменьшенным количеством побочных действий.
Ферментный раствор: раствор коллагеназы - 60-70 мг/100 мл буфера (коллагеназа фирмы Sigma, типа IV, № по каталогу С5138, или фирмы Worthington, типа В, № по каталогу LS005273; оба являются бактериальными препаратами, обогащенными коллагеназой, но с наличием большого количества ферментных примесей) или либеразы (Liberase) (очищенный препарат коллагеназы/эластазы, производства фирмы Boehringer-Mannheim, № по каталогу 1814184), приготовленной в буфере Р2 (см. ниже) и используемый в концентрации 0,23 мг/мл.
Раствор для промывки клеток: раствор RPMI 1640 (Gibco) с добавкой инсулина (5 мкг/мл), трансферрина (5 мкг/мл), смеси свободных жирных кислот (см. ниже), связанный в молярном отношении 1:1 очищенным альбумином бычьей или человеческой сыворотки.
Cмесь свободных жирных кислот: Популяции незрелых клеток, а также поврежденным более старым клеткам печени для их поддержания и синтеза их мембран требуются липиды. Хотя полностью зрелые гепатоциты могут синтезировать свои мембраны из одной жирной кислоты (линолевой кислоты), но более молодые паренхиные клетки к этому у не способны, и для удовлетворения потребностей в липидах им требуется смесь многих разных жирных кислот. Авторы предлагают комплексную смесь, которую затем связывают в молярном отношении 1:1 альбумином высокой степени очистки. Подробное описание способа получения этой смеси жирных кислот приводится ниже.
Маточные растворы готовят, как указано ниже, для получения смеси свободных жирных кислот (в сумме 100 мМ):
Чтобы получить окончательную концентрацию в 7,6 мкМ/л, добавляют 76 мкл смеси на питр культуральной среды. [Ссылка: Chessebauf and Padieu, In vitro 20 (10):780; 1984. В соответствии с этой ссылкой смесь свободных жирных кислот используют в окончательной концентрации в 7,6 мкэкв/л (=7,6 мкМ) в культуральной среде для клеток].
Получение отдельных компонентов смеси жирных кислот:
Каждый отдельный компонент растворяют в 100% EtOH, как указано ниже:
Пальмитиновая кислота - 1 М маточный раствор, растворимый в горячем EtOH.
Пальмитолеиновая кислота - 1 М маточный раствор, легкорастворимый в EtOH.
Стеариновая кислота - 151 мМ маточный раствор, растворимый в нагретом ЕtOH в концентрации 1 г/ 21 мл.
Олеиновая кислота - 1 М маточный раствор, легкорастворимый в ЕtOH.
Линолевая кислота - 1 М маточный раствор, легкорастворимый в EtОH.
Линоленовая кислота - 1 М маточный раствор, легкорастворимый в EtOH.
Эти отдельные маточные растворы затем смешивают для получения 100 мМ смеси свободных жирных кислот. Аликвоты этих отдельных растворов свободных жирных кислот и смеси свободных жирных кислот готовят, пропуская через них пузырьки азота, чтобы уменьшить окисление и повысить стабильность. Маточные растворы замораживают при -20°С.
Перфузионный буфер (буфер для заливки) P1 - не содержащий альция и магния перфузионный буфер (рН 7,2) с окончательной нцентрацией, указанной ниже для каждого из следующих компонентов: 118 мМ NaCl, 4,7 мМ KCl, 1,2 мМ КН2РО4, рН 7,4, 2,5 мМ NaHCO3, 0,5 мМ ЭДТА, 5,5 мМ глюкозы, 0,5% альбумина бычьей или человеческой сыворотки (BSA), аскорбиновая кислота (50 мкг/мл), инсулин (4 мкг/мл), дексаметазон (1 мкМ).
Перфузионный буфер (буфер для заливки) Р2 - модифицированная Dulbecco среда Eagle или среда RPMI 1640, с добавкой 0,5% BSA, аскорбиновой кислоты (50 мкг/мл), инсулина (4 мкг/мл), дексаметазона (1 мкМ).
DMEM - модифицированная Dulbecco среда Eagle (Gibco), с глюкозой, пируватом натрия и L-глютамином, в которую затем добавляют 5% фетальной бычьей сыворотки, инсулин (4 мкг/мл) и дексаметазон (1 мкМ).
Среда Chee, с добавлением культуральной добавки ITS (5 мл/500 мл) и дексаметазона (0,1 мкМ).
Перколл (Pharmacia, № по каталогу 17089102), разбавленный в соотношении 9:1 10-кратным забуференным солевым фосфатным буфером раствором Dulbecco.
Пример 3
Изучение тканей фетальной печени
Фетальная печень доставляется в транспортировочном буфере (описанном выше) и на льду. Полученный материал ополаскивают "буфером для ополаскивания клеток”, состоящим из среды RPMI 1640 (Gibco) с добавкой инсулина (Sigma, 5 мкг/мл), трансферрина (Sigma, 5 мкг/мл), селена (элементы для масс-спектроскопии, Johnson Mattey; 10-9 M) и смеси свободных жирных кислот, связанных альбумином бычьей сыворотки в молярном соотношении 1:1. Затем фетальную печень помещают в коллагеназный буфер на 15-20 минут, после чего осторожно продавливают через “collector” (Sigma) с размером ячеек 800, в результате чего получают небольшие клеточные агрегаты; для облегчения процесса диссоциации используют “буфер для промывки клеток”. После этого полученные клеточные агрегаты полностью диссоциируют, продавливая их через фильтр с ячейками 70 микрон (клеточный фильтр Falcon, нейлон с ячейками 70 мкм, № по каталогу 2350), используя буфер для промывки клеток, чтобы ускорить этот процесс. Клетки, прошедшие через фильтр с отверстиями 70 микрон, держат отдельно от клеток, не прошедших через этот фильтр. Оба образца подвергают криоконсервации и проверяют на процент жизнеспособности с помощью окрашивания трипановым синим.
Пример 4
Изучение тканей печени взрослого человека
Печень катетеризируют с использованием воротной вены, полой вены или обеих этих вен, заливают буферами, чтобы удалить кровь, а затем заливают буферами, содержащими коллагеназы/протеазы для ферментативной диссоциации клеток. После расщепления, для чего требуется обычно 15-30 минут, в зависимости от размера печени, ткань продавливают через марлю или нейлоновый фильтр, либо соскребают скребком для механической диссоциации клеток. Диссоциированные клетки дополаскивают буфером, содержащим сыворотку для инактивации; коллагеназы и других ферментов, использованных при заливке.
Перфузионные буферы P1 и Р2 помещают в водяную баню с температурой 37°С. Перфузию осуществляют в сосуде Миллера для заливки образцов, в котором в течение всего процесса поддерживают температуру 37°С. Во время перфузии в буферы подают кислород. Все трубки в сосуде ополаскивают 70%-ным этанолом, затем дистиллированной водой и после этого - буфером Р1, чтобы убедиться, что из системы удален весь воздух. Печень канюлируют тефлоновой канюлей, с помощью иглы 16-го калибра, прикрепленной к шприцу на 60 мл, чтобы пропустить через печень буфер Р1 с температурой льда, используя при этом различные кровеносные сосуды, имеющиеся на поверхности среза больших кусков печени (100-300 граммов). В редких случаях, когда получают целые доли печени, можно канюлировать остатки полой вены. Изучали, какие из различных кровеносных сосудов, имеющихся в кусках печени, лучше всего позволяют осуществить перфузию ткани. С помощью этой процедуры также удаляют из печени всю излишнюю кровь. Выбранный кровеносный сосуд канюлируют и запечатывают на месте с помощью медицинского “суперклея”. Все другие крупные кровеносные сосуды и отверстия на поверхности печени запечатывают с помощью медицинского клея или, если это требуется, с помощью Q-наконечников с медицинским клеем, чтобы лучше запечатать отверстия. После того как клей высохнет, образец печени помещают на нейлоновое сито внутри стеклянной чашки подходящего размера. В чашку добавляют буфер Р1, погружая в него печень. Чашку с печенью помещают внутрь сосуда для перфузии и прикрепляют трубку, отходящую от канюли. Буфер Р1 рециркулируют в течение 15 минут, начиная с низкой скорости, около 24 мл/мин, а затем медленно увеличивают скорость до 58 и 90 мл/мин, чтобы оптимизировать расход жидкости с подходящим противодавлением. Необходимо проверять, чтобы не было излишнего вытекания перфузионного раствора из печени. Через 15 минут буфер Р1 удаляют из чашки и заменяют его на буфер Р2, содержащий коллагеназу. Буфер Р2 рециркулируют до тех пор, пока печень не будет в достаточной степени расщеплена (что определяется по изменению цвета печени от темного красновато-коричневого до бледно-коричневого, а также по приобретению печенью кашеобразной консистенции). Буфер Р2 рециркулируют в течение не более 20-25 минут. По окончании перфузии буфер Р2 сливают из чашки, а печень переносят в чашке в биологический бокс.
В чашку добавляют среду для культивирования клеток (DMEM), а канюлю и клей удаляют, вместе с нерасщепленными участками печени. Фиброзную капсулу печени (глиссонову капсулу) измельчают с помощью пинцета и ножниц. Это позволяет высвободить расщепленную ткань в среду удалив соединительную ткань и нерасщепленный материал. Расщепленный материал помещают в среду DMEM, а затем фильтруют через серию фильтров разных размеров. Чтобы облегчить фильтрацию, фильтры размещают внутри большой воронки. Расщепленный материал фильтруют сначала через один слой марли, а затем через нейлоновый фильтр с порами 400 мкм, и наконец, через тефлоновый фильтр с порами 70 мкм. Фильтрат поровну распределяют между центрифужными пробирками и центрифугируют при 70g в течение 4 минут.
Надосадочную жидкость, полученную после центрифугирования, перед добавлением перколла, называют фракцией 1 (ф1). К полученному после центрифугирования осадку клеток в пробирках добавляют DMEM и изотонический раствор перколла, так, чтобы получить конечное соотношение 3:1, соответственно. Например, небольшое количество клеточной массы объемом в 5 мл из осадка в пробирках суспендируют в 30 мл DMEM и 10 мл изотонического раствора перколла. Образец центрифугируют при 100g в течение 5 минут. Получают надосадочную жидкость; верхний слой называют фракцией 2 (Ф2). Средний слой перколла называют фракцией 3 (Ф3). Остающийся в пробирках осадок клеток называют фракцией 4 (Ф4). Клетки разных фракций суспендируют и анализируют на жизнеспособность путем окрашивания трипановым синим. Показатели жизнеспособности этих различных фракций представлены в таблице 3, наряду с их жизнеспособностью после криоконсервации.
Клетки, которые оставались связанными с сосудистой или желчепроводящей системой ткани печени после перфузии, сохраняют. Эти клетки находятся в исходной суспензии клеток, полученной после ферментативной перфузии, и обычно остаются на ситах (например, на марле) после фильтрования клеток суспензии. Эти остатки сосудистой и желчепроводящей систем снова обрабатывают ферментами, и полученные клетки объединяют с другими клетками.
Фракционирование в перколле обычно используется большинством исследователей, чтобы удалить элементы, которые они считают обломками клеток и мертвыми клетками; сохраняют только окончательный осадок. Новый вариант обычной перфузии, описываемый здесь, заключается в том, что осадок отбраковывают, а сохраняют и используют для дальнейших исследований только клетки с самой низкой плавучей плотностью (т.е. клетки, собравшиеся наверху градиента). Эти клетки представляют собой более молодые паренхимные клетки и гораздо легче поддаются криоконсервации (см. раздел По криоконсервации).
Пример 5
Эксперименты по криоконсервации. Образцы печени, используемые для разработки методик криоконсервации, получали от доноров в возрасте начиная от возраста плода (срок беременности от 12 до 25 недель) и до возраста 77 лет.
“Новый буфер для криоконсервации”
- Viaspan (каталог Dupont №1000-46-06) с добавкой 2% сыворотки человека (Gibco) или фетальной бычьей сыворотки (Biowhittaker);
- 10%-ный криоконсервант [диметилсульфоксид (каталог Sigma №D5879 или D8779), используемый исключительно для зрелых паренхимных клеток, или диметилсульфоксид или глицерин (каталог Sigma №66279), используемый для клеток-предшественников];
- затем к буферу добавляют антибиотики (пенициллин, 200 Е/мл); стрептомицин, 100 мкг/мл);
- затем к буферу добавляют гормоны и ростовые факторы: инсулин (5 мкг/л), трансферрин (5 мкг/мл), эпидермальный ростовой фактор (50 мкг/мл), FGF (10 нг/мл), IGF II (10 нг/мл);
- затем к буферу добавляют липиды: свободные жирные кислоты (7,6 мкМ/л), связанные с альбумином бычьей сыворотки (BSA) или сыворотки человека (HSA), а также липопротеин высокой плотности (10 мкг/мл);
- кроме того, к буферу добавляют микроэлементы (селен (10-9), медь (10-9М), цинк (5×10-11М)), а также антиоксидант (например, порфорин, представляющий собой имитатор супероксиддисмутазы, используемый в концентрации 10 мкг/мл; аскорбиновую кислоту, используемую в концентрации около 0,1 мг/мл, или любые другие антиоксиданты, известные в данной области техники).
Описываемый здесь вариант композиции состоит в объединении основных питательных веществ, липидов, гормонов и ростовых факторов, идентифицированных как часть не содержащей сыворотки среды определенного гормонального состава, приспособленной для клеток печени. Использование нового буфера приводит к получению показателя жизнеспособности клеток печени фракций Ф4 от низкой, порядка 50% (для очень плохих образцов), до высокой, составляющей 80% (для хороших образцов). Показатели жизнеспособности фракций Ф1-Ф3 постоянно выше 80%, что, по мнению авторов, объясняется тем, что эти фракции содержат более молодые клетки, с уровнем плоидности и метаболической активностью, более подходящими для синтеза компонентов внеклеточной матрицы и/или других клеточных факторов, необходимых для поддержания жизнеспособности и роста; поэтому следует ожидать, что эти клетки будут легче переносить замораживание. Использование в буфере имитатора супероксиддисмутазы привело к повышению жизнеспособности клеток на 5-10%.
Альтернатива вышеизложенному:
- использование модифицированного буфера, в котором отсутствует Viaspan, а к базальной среде (такой, как RPMI 1640) добавлены инсулин, (5 мкг/мл), трансферрин (5 мкг/мл), свободные жирные кислоты (7,6 мкМ/л), связанные с BSA (альбумином бычьей сыворотки), липопротеин высокой плотности (10 мкг/мл), микроэлементы (10-9М), медь (10-7М),цинк (5×10-11М) и антиоксидант;
- покрытие клеток одной из форм внеклеточной матрицы, такой как коллаген типа IV, смешанный с ламинином, или коллаген типа I или III, смешанный с фибронектином.
Клетки фетальной печени, обработанные, как описано выше, суспендируют в буфере для криоконсервации (описанном выше), переносят отдельными аликвотами в пробирки для замораживания на 3 мл, по 5-10×106 клеток/мл, и содержат в этих условиях в течение 1-2 часов. Затем клетки замораживают до температуры жидкого азота от -100°С до -180°С, предпочтительно -160°С, используя компьютерный контроль за скоростью замораживания (Forma Cryomed), а затем хранят в большой паровой фазе в резервуаре для хранения, содержащем жидкий азот (-160°С). Клетки хорошо переносят эту процедуру, при этом не наблюдается сколько-нибудь значительной потери жизнеспособности в течение периодов хранения от 50 до 270 дней (см. фиг.3).
Установлено, что фракции клеток взрослой печени (Ф1-Ф4) содержат отличающиеся друг от друга популяции клеток: Ф1 содержит обломки, красные кровяные тельца, печеночные звездчатые клетки и мелкие печеночные клетки (меньше 10 мкм), которые, по-видимому, являются популяциями клеток-предшественников (либо печеночных, либо гемопоэтических линий дифференцировки клеток); фракция Ф2, верхняя часть раствора перколла, содержит более крупные печеночные клетки (10-15 мкм), являющиеся небольшими диплоидными паренхимными клетками; фракция Ф3, нижняя часть раствора перколла, содержит еще более крупные паренхимные клетки (15-25 мкм), состоящие из смеси диплоидных и тетраплоидных клеток; и фракция Ф4 (используемая всеми остальными исследователями), состоит из самых крупных паренхимных клеток (25-50 микрон), все из которых являются полиплоидными (тетраплоидными или октаплоидными). Как правило, паренхимные клетки фракций Ф1-Ф3 имеют жизнеспособность после замораживания, составляющую 85-95%, а паренхимные клетки фракции Ф4 имеют жизнеспособность после замораживания, составляющую 50-80% (в зависимости от состояния печени после ее получения). Установленные переменные, влияющие на жизнеспособность паренхимных клеток фракции Ф4, следующие: 1) возраст донора (чем старше донор, тем хуже прогноз для клеток); 2) промежуток времени между “временем фиксации” и доставкой в лабораторию (чем короче, тем лучше); 3) состояние здоровья ткани печени перед ее удалением из тела донора (например, состояние сильной ишемии предполагает плохой прогноз). Эти факторы взаимодействуют между собой, так что быстрая доставка ткани от пожилого пациента может дать лучшие результаты, чем ткань, взятая у молодого пациента, но слишком долго находившаяся в пути.
Очень большой диапазон жизнеспособности фракций Ф4 как после обработки, так и после оттаивания объясняется различной продолжительностью промежутка времени между “временем фиксации” и получением образцов в лаборатории, а также различным состоянием печени (фиброзное, ишемическое и др.) Как правило, фракция Ф4 наиболее чувствительна к отрицательным воздействиям, связанным с обработкой печени и с общим состоянием здоровьяь ткани. Примечательно, что фракции Ф2 и Ф3 были, как правило, жизнеспособны и хорошо сохранялись после криоконсервации, даже если их получали от плохих образцов печени. Фракции Ф1 были более изменчивыми, содержали большое количество обломков клеток, капелек жира, а также многочисленных мелких клеток, которые включали как мелкие паренхимные клетки (содержащие, как полагают, печеночные клетки-предшественники), так и различные субпопуляции гемопоэтических клеток (т.е. эритроцитов).


Пример 6
Проточная цитометрия
Клетки пропускают в один ряд через проточную кювету, где их подвергают лазерному облучению. Примерный объем одной клетки определяют с помощью “прямого рассеивания”, или количества света, отраженного во время пересечения луча. Рассеянный свет, или “боковое рассеяние” от внутренних структур клетки, таких как ядро, тельца Гольджи в эндоплазменном ретикулюме, пузырьки и т.п., используют для определения величины внутренней комплексности (т.е. активных клеток и более взрослых клеток, которые содержат больше внутренних компонентов, чем покоящиеся или более молодые клетки). Более селективную информацию о характеристиках клеток получают посредством связывания высокоспецифичных характерных антигенов с белковыми комплексами на поверхности клеток. Эти антитела могут быть ковалентно связанными с флуоресцентными молекулами, такими как флуоресцеинизотиоцианат (ФИТЦ), фикоэритрин (РЕ) и тандемные конъюгаты РЕ и цитохрома, которые возбуждаются лазерными лучами, генерируя испускаемый свет со специфической длиной волны для каждого флуорофора. Путем отбора панели с характерными хромофорами, конъюгированными со специфическими антителами, отбирают представляющие интерес клеточные популяции.
Клетки анализируют ни основании входных сигналов их параметров. Для сбора желаемых клеток используют ряд устройств для сбора клеток, включая пробирки Эппендорфа и конические пробирки, а также многоячеистые планшеты любого размера, при скорости до 40000 операций в секунду и выше.

Основные растворы, использованные для подготовки клеток к проточной цитометрии
BSA: альбумин бычьей сыворотки (Pentex V);
PBS: физиологический раствор с фосфатным буфером;
FBS: фетальная бычья сыворотка;
AFP: альфа-фетопротеин.
Модифицированная Dulbecco среда Eagle с гормонами: НС_DMEM
500 мл DMEM, высокое содержание глюкозы без фенолового красного
25 мл фетальной бычьей сыворотки (FBS)
20 мл 5 мМ EGTA (этиленгликольтетрауксусной кислоты)
Инсулин (5 мкг/мл), трансферрин (5 мкг/мл)
Микроэлементы [(селен (10-9 М), медь (10-7 М), цинк (5×10-11М)]
Антибиотики (пенициллин - 100 мкг/мл, стрептомицин - 100 мкг/мл)
500 мг альбумина бычьей сыворотки (BSA) 30 мг ДНК-азы
38 мкл смеси свободных жирных кислот, связанных с BSA
Стерильный раствор, профильтрованный через фильтровальное устройство Nalgene с размером пор 0,2 мкм.
Забуференный физиологический раствор Хенкса, модифицированная версия: HBSS-mod
50 мл 10Х HBSS (сбалансированного солевого раствора Хенкса)
10 мл 1 М Hepes
Пенициллин - 100 мкг/мл/ стрептомицин - 100 мкг/мл
500 мг/л BSA
30 мг/л ДНК-азы
Довести до 400 мл
рН до 7,3
Довести до 500 мл
Фильтрация через стерильный фильтр с размером пор 0,2 мкм.
Блокирующий буфер для иммунохимии
100 мл HBSS_mod
2,2 мл 45%-го рыбного Геля (teleostean) и
0,8 г BSA
0,5 мл 1% сапонина в HBSS
Заливочная среда для иммунофлуоресцентной микроскопии
0,5 мл 2Х PBS
0,25 г n-пропилгаллата
5,7 г глицерина
Пример 7
Методики получения ткани замороженной печени для проточной цитометрии
Ткань замороженной печени подвергают быстрому оттаиванию при 37°С. Каждый сосуд для криоконсервации (содержащий около 3 мл буфера с 5-10×106 клеток/мл) доливают средой HC-DMEM до 10 мл, со скоростью 1 мл/мин, на льду. Затем образец центрифугируют при 1200 об/мин в течение 5 минут при 4°С. Надосадочную жидкость удаляют, а осадок клеток ресуспендируют в 5 мл НС-DMEM. Промывку клеток повторяют до тех пор, пока надосадочная жидкость не станет прозрачной. Затем клетки подсчитывают и определяют их жизнеспособность с помощью гемоцитометра, используя метод окрашивания трипановым синим. Клетки разделяют на фракции в соответствии с методикой эксперимента. Для получения контрольных данных готовят стандартные пробирки, содержащие от 1 до 2×106 клеток/мл, что обычно делают путем внесения в каждую пробирку по 200 мкл клеточной суспензии, содержащей 5-10×106 клеток/мл. Необходимы следующие стандартные пробирки:
1) OSC. Исходная клеточная суспензия, состоящая из неокрашенных контрольных клеток.
2) ФИТЦ для корректировки компенсации. К 200 мкл клеточной суспензии добавляют 5 мкл меченного по ФИТЦ антигликофорина А. Альтернатива - смесь меченных по ФИТЦ CD34, CD38 и СD45, добавляемая в количестве по 7 мкл каждого компонента к 200 мкл клеток.
3) РЕ для корректировки компенсации. Используют гликофорин-РE (2 мкл на 1 мл HC_DMEM, добавляя 30 мл полученного раствора к 200 мкл клеток.
4) 7AAD для компенсации. Хороший сигнал получают путем фиксирования 200 мкл клеточной суспензии 2%-ным параформальдегидом, с последующим добавлением 5 мкл 100 мкМ 7AAD и 5 мкл детергента (1% сапонин) к 1 мл суспензии этих клеток в HBSS-mod. Пермеабилизированные (получившие свойство проницаемости) клетки интенсивно окрашиваются 7AAD.
5) Сy5 для компенсации. 200 мкл зафиксированных 2%-ным параформальдегидом клеток инкубируют в течение 40 минут в 2%-ной козьей сыворотке, чтобы пометить клеточные поверхности иммуноглобулином G (IgG) овцы. Затем клетки инкубируют с Су5, конъюгированным с антителом осла к IgG козы (1:800) в течение 40 минут.
6) АМСА для компенсации. Как и для 7AAD, генерируется искусственный интенсивный сигнал для регулировки компенсации. 200 мкм зафиксированных 2%-ным параформальдегидом клеток инкубируют в течение 40 минут в 2%-ной овечьей сыворотке, чтобы пометить клеточные поверхности иммуноглобулином G (IgG) овцы. Затем клетки инкубируют с АМСА, конъюгированным с антителом осла к IgG овцы (1:800) в течение 90 минут.
7) Контроли АМСА/Су5. Инкубируют зафиксированные (2%-ным параформальдегидом) и пермеабилизированные (0,05%-ным сапонином) клетки с антителом осла к IgG овцы, конъюгированным с АМСА, и с антителом осла к IgG козы, конъюгированным с Сy5, в течение 90 минут.
8) Контроли для моноклональных изотипов. Клетки инкубируют с конъюгатом РЕ с IgG1 мыши и с конъюгатом ФИТЦ с IgG2 мыши. Концентрации должны соответствовать концентрациям, использованным для мечения пробирок для анализа и сортинга.
9) Контроли для внутриклеточных изотипов. Инкубируют зафиксированные (2%-ным параформальдегидом) и пермеабилизированные (0,05%-ным сапонином) клетки с неиммунным IgG овцы и IgG козы, в течение 90 минут, в качестве контролей для антител, используемых для идентификации альбумина и альфа-фетопротеина. Продолжают инкубацию с антителом осла к IgG козы, конъюгированным с Су5, и с антителом осла к IgG овцы, конъюгированным с AMCA, в течение 90 минут.
Готовят сортерные пробирки для получения популяций отобранных клеток, экспресирующих конкретные комбинации маркеров CD. Как правило, эти пробирки содержат по 50-70×106 клеток. Клетки ресуспендируют в 1 мл красящего буфера, содержащего HC_DMEM+1% BSA+500 пМ 7AAD (5 мкл маточного раствора с концентрацией 100 мкМ). К красящему буферу добавляют по 15-25 мкл CD34 ФИТЦ и CD38 РЕ, или CD45 РЕ, в соответствии с количеством клеток (обычно используют по 3 мкл антител фирмы Pharmingen на 10×106 клеток). Антитело к c-Kit добавляют при разбавлении 1:60, гликофорин А используют при разбавлении 1:500. Окрашивают в течение 40 минут на льду, в темноте. После окрашивания клетки дважды промывают средой HBSS-mod и фиксируют 2%-ным формальдегидом в РВS в течение 30 минут на льду.
Пример 8
Внутриклеточное окрашивание для сортинга клеток
Для внутриклеточного окрашивания клеток с целью проведения анализа на альфа-фетопротеин (AFP) с помощью проточной цитометрии клеточную суспензию пермеабилизируют смесью сапонина (Sigma S4521) 0,05% в HBSS_mod в течение 10 минут на льду. Затем клетки блокируют в смеси среды HBSS_mod, содержащей 1%-ный рыбный (teleostean) гель, 0,8% BS и 0,005% сапонина, в течение 20 минут, с последующей инкубацией с антителом козы к AFP человека и с антителом овцы к альбумину человека (оба антитела применяют в разбавлении 1:800 в блокирующем буфере) в течение 90 минут при комнатной температуре, в темноте. Клетки дважды промывают средой HBSS-mod, содержащей 0,01% сапонина, а затем инкубируют с антителом осла к IgG козы, конъюгированным с Су5, и с антителом осла к IgG овцы, конъюгированным с АМСА, в течение 90 минут.
В качестве альтернативы, вслед за первичным антителом клетки инкубируют с биотинилированным антителом кролика к IgG козы (1:500, в блокирующем буфере, содержащем 2% сыворотки человека и 0,01% сапонина, в течение 90 минут, при комнатной температуре, в темноте). После этого клетки дважды промывают средой HBSS-mod, содержащей 0,01% сапонина, а затем инкубируют с 9 мкг/мл конъюгата стрептавидин/Су5 в среде HBSS-mod с 0,01% сапонина в течение 90 минут, при комнатной температуре, в темноте. И наконец, клетки дважды промывают средой HBSS-mod и ресуспендируют в HBSS-mod, затем фильтруют через сито с размером пор 50 мкм, чтобы удалить скопления клеток, для последующего анализа и сортинга на проточном цитометре.
Если планируют проводить отбор (селекцию) печеночных клеток-предшественников, то иммуноселекция включает удаление полиплоидных клеток и/или клеток, экспрессирующих маркеры, связанные со зрелыми гемопоэтическими клетками из печени, такие как гликофорин А на красных кровяных тельцах. Кроме того, удаляют клетки, экспрессирующие CD45, который экспрессируется на всех зрелых гемопоэтических клетках; клетки, экспрессирующие маркеры, связанные со зрелыми печеночными клетками, такие как коннексин 32, который обнаруживается на всех гепатоцитах и билиарных клетках; и клетки, экспрессирующие маркеры, связанные со зрелыми мезенхимными клетками, такие как ретиноиды в печеночных звездчатых клетках или фактор фон Виллебранда, или фактор 8 в эндотелии.
Пример 9
Иммуногистохимическое окрашивание отсортированных клеточных популяций.
Клетки окрашивают на альфа-фетопротеин после анализа и сортинга на проточном цитометре. Отсортированные клеточные фракции собирают в 0,3% среде HBSS-mod, содержащей 1% BSA. После возвращения в лабораторию объемы собранных образцов корректируют так, чтобы они содержали 0,5×106 клеток/мл, и аликвоты по 200 мкл наносят кругами на предметные стекла с помощью устройства Shandon Cytospin. Полученные препараты сушат на воздухе и сохраняют для дальнейшего окрашивания на альфа-фетопротеин и/или альбумин. Прикрепленный к предметному стеклу клеточный “диск” окружают резиновым валиком, чтобы получить “лунку” для нанесения иммуногистохимических реагентов. Стекла замачивают в трис-буфере (“низкосолевом” 10 мМ трис с 0,09% NaCl с рН 7,4), содержащем 0,3% тритона X, в течение 10 минут, а затем 10 минут в одном только низкосолевом трис-буфере.
Затем клетки блокируют в 10%-ной сыворотке кролика, содержащейся в блокирующем растворе с описанном выше рыбным гелем (teleostaen), в течение более 90 минут при комнатной температуре. После двукратной промывки в низкосолевом трис-буфере клетки инкубируют до следующего утра при 4°С с антителом козы к AFP человека, разбавленным в соотношении 1:100 в блокирующем буфере, содержащем 2% сыворотки кролика. После двукратной промывки в трис-буфере клетки инкубируют в течение 90 минут с биотинилированным антителом кролика к IgG козы (1:200) в блокирующем буфере при комнатной температуре. Окончательную инкубацию с комплексом стрептавидин/АМСА (9 мкг/мл в низкосолевом трис-буфере) используют для локализации AFP-подобной иммунореактивности путем связывания флуорохрома АМСА с биотинилированным антителом кролика. После двух промывок трис-буфером клеточные препараты подсушивают до состояния, близкого к сухости, прежде, чем накрыть их покровными стеклами по слоем антифэдинговой (antifade) заливочной среды (0,25 г n-пропилгаллата в 5,7 г глицерина с 1 мл PBS). Когда это необходимо, клетки двукратно окрашивают на альбумин путем включения конъюгированного с техасским красным антитела кролика к антителу человека против альбумина, с первичным антителом против фетопротеина.
Контрольные препараты готовят без первичного и вторичного антител, чтобы продемонстрировать отсутствие мечения клеток по АМСА в отсутствие либо антитела против альфа-протеина, либо биотинилированного вторичного антитела. Препараты исследуют с помощью эпифлуоресцентной микроскопии, использующей возбуждение ультрафиолетовым светом красителя АМСА, который испускает свет в голубой части спектра (450 нм).
Пример 10
Клеточная и/или генная терапия
Поскольку активатор плазминогена человеческой урокиназы (uPA) может активировать плазминоген у вида рекомбинатного аденовирусного вектора, который экспрессирует человеческую урокиназу под контролем промотора RSV-LTR, сконструировали Ad-RSV-uPA, с целью индуцировать регенерацию печени. Для конструирования и получения рекомбинантных аденовирусных векторов получают кДНК для uPA человека следующим образом. Фрагмент Hindill/Asp718 величиной в 1,326 т.п.н., который содержит кодирующую белок последовательность, вставляют в сайты Hindill/Asp718 pXCJL.1 под транскрипционным контролем промотора вируса саркомы Роуса LTR (RSV), выше участка, генерирующего сигнал полиаденилирования бычьего гормона роста. Вирус получают после совместной трансфекции pJMI7 и вектор обозначали как Ad-RSV-uPA. Отбор на Ad-RSV-uPA осуществляют путем амплификации индивидуальных зон гемолиза в 293 клетках. Через три дня после инфецирования надосадочную жидкость исследуют на иммунологически реактивный uРА с помощью анализа ИФА и определения фибринолитической активности с помощью чашечного теста для определения гемолиза, демонстрирующего каталитическую активность uРА, продуцируемого после инфецирования Ad-RSV-uPA. Очищенный вирус хранят в аликвотах при -80°С, а непосредственно перед инъецированием разбавляют средой HGDMEM. Вирусные титры определяют путем измерения оптической плотности и с помощью стандартного метода определения гемолиза. Конструирование векторов по существу осуществляют так, как описано в патенте США №5980886. Вирусы титруют на клетках 208F.
Самок мышей линии C57BL/6 в возрасте от 5 до 6 недель (Jackson Laboratories, Bar Harbor, ME) содержат в среде, свободной от конкретного патогена. Образцы ишемической печени в различные периоды времени берут у умерщвленных мышей, и из них изолируют клетки-предшественники печени, как описано выше. Для канюлирования воротной вены мышь-реципиент анестезируют путем внутрибрюшинного введения 0,5 мл раствора, содержащего 20 мг/мл 2,2,2-трибромэтанола. Осуществляют лапаротомию по средней линии и отделяют кожу от брюшины, чтобы создать подкожный карман. Вскрывают брюшину и обнажают воротную вену. В портальную вену вставляют силиконовую трубку (с внутренним диаметром 0,02 дюйма, внешним диаметром 0,037 дюйма, S/P Medical Grade, Baxter, 111) и заливают гепаринизированным физиологическим раствором. После этого через брюшину проводят канюлю и закрепляют ее швом, выполненным шелковой нитью 4,0. Канюлю длиной 3 см отвязывают на дистальном конце и помещают подкожно в заранее образованный карман. Мышам вводят инфецированные вирусом клетки-предшественники не ранее чем 24 часа спустя. У некоторых мышей канюлирование воротной вены осуществляют вместе с удалением 2/3 печени. Затем осуществляют частичное удаление печени. Чтобы залить воротную вену, мышей анестезируют, вскрывают кожу на проксимальной стороне уже существующего разреза брюшины. Обнажают канюлю и соединяют ее с насосом шприца. Для инфузии вируса препараты аденовируса в DMEM вводят в течение от 5 до 10 минут в воротную вену через канюлю.
Все биохимические и гистологические анализы выполняют после введения инфецированных аденовирусом печеночных клеток-предшественников в воротную вену через канюлю. ИФА-анализ на uРА основан на двух разных моноклональных антителах, направленных против каталитической и связывающейся с рецептором области uРА. Одно из моноклональных антител метят пероксидазой. Тотальный протеин сыворотки и альбумин анализируют с помощью обычных автоматизированных методов в лабораториях клинической патологии. Известно, что инфузия аденовируса в портальную вену мышей линии C57BL/6 приводит к трансдукции 100% гепатоцитов более чем одной копией аденовирусной ДНК на клетку. Та же самая доза Ad-RSV-uPA приводит к 90% смертности которая по меньшей мере частично связана с кровоизлияниями. Если используют более низкую дозу Ad-RSV-uPA, то смертность составляет менее 5%, и эту дозу выбирают для экспериментов по регенерации печени. Инфузия Ad-RSV-uPA приводит к кратковременным повышениям уровня урокиназы в сыворотке, пиковые значения которых достигают около 350 нг/мл (что в 70-100 раз выше, чем эндогенные уровни) четыре дня спустя, а затем падают до фоновых концентраций к 12-му дню. Подъем уровней uРА связан также с увеличением концентраций SGPT в сыворотке. В различные периоды времени после инфузии аденовируса животным вливают 3Н-тимидин и определяют величину радиоактивности, включенной в ДНК печени, в качестве способа количественного определения пролиферации клеток. Животные, получавшие Ad-RSV-uPA, имели увеличенный период поглощения тимидина, который начинался на 3-й день и продолжался в течение 8 дней.
Таким образом, период поглощения печеночного 3Н-тимидина при введении Ad-RSV-uPA/овальных клеток намного больше, чем полученный при частичном удалении печени. Реципиенты, получавшие негативный контрольный аденовирус, демонстрировали пик поглощения печеночного 3Н-тимидина на 4-й день, а через 24 часа эти показатели возвращались к базисным уровням, и минимальный подъем поглощения 3Н-тимидина отмечался на 11-й день. Резюмируя, можно сказать, что повреждение печени, измеряемое уровнями SPGT и высокими показателями поглощения 3Н-тимидина, объясняется выработкой в печени урокинаэы, что указывает на то, что в печени происходит значительная биосинтетическая регенерация. Использование печеночных клеток-предшественников, вливаемых без uРА, лучше, чем использование аденовируса без вставки uРА.
Результаты микроскопических гистологических исследований животных, получавших рекомбинантный аденовирус/клетки-предшественники, происходящие от трупных доноров с остановившимся сердцем, указывают на то, что к 3-му дню получавшие указанное лечение мыши имели умеренный воспалительный инфильтрат, который содержал макрофаги и нейтрофилы. Дегенеративные изменения в гепатоцитах включали вакуолизацию, пикнотические ядра и небольшое количество митотических ядер. Через 8-10 дней после введения Ad-RSV-uPA/овальных клеток появляются признаки восстановления печени, включая наличие мультифокальной регенерации, различного размера ядер и намного уменьшенной воспалительной реакции при небольшом количестве дегенерирующих гепатоцитов. К третьей-четвертой неделе инфильтрат рассасывался и печень выглядела нормальной.
В целом, эти исследования демонстрируют, что экспрессия урокиназы в сочетании с клетками-предшественниками индуцирует значительную регенерацию паренхимных клеток печени.
Пример 11
Разделение клеточной популяции посредством центрифугирования в перколле
В этом примере описываются способы обогащения популяции клетками-предшественниками печени, включая обогащение стволовыми клетками, некоммитированными клетками-предшественниками и коммитированными клетками-предшественниками. Вариации этих способов известны специалистам в данной области техники, и они в равной степени пригодны, если они отвечают поставленной цели, а именно - получению обогащенной популяции клеток-предшественников.
По существу одноклеточную суспензию клеток печени в культуральной среде, т.е. в базальной среде Eagle (BME), наносят поверх слоя 15%-ного раствора перколла в BME. С помощью центрифуги Sorvall RT7 и 14 см ротора или другой эквивалентной комбинации ротора и центрифуги градиенты центрифугируют при 600-1200 об/мин, предпочтительно при 750-1000 об/мин, в течение 10 минут. Собирают надосадочную жидкость и вновь центрифугируют ее, но уже при 1200-2000 об/мин, предпочтительно при 1500 об/мин Фракция надосадочной жидкости обогащена клетками-предшественниками, а осадок в пробирке (фракция Ф3) содержит клетки, способные, по меньшей мере, к одному клеточному циклу. Клетки надосадочной жидкости собирают отдельно и снова центрифугируют, при 2000-3000 об/мин, предпочтительно при 2500 об/мин. При этом последнем центрифугировании клетки предшественники часто собираются в верхних слоях перколла, оставляя обломки клеток в более нижних уровнях, а осадок в пробирке содержит клетки, способные к прохождению нескольких митотических циклов. Перколльная фракция пригодна к немедленному использованию, криоконсервации, получению культуры клеток или к дальнейшему обогащению. Дальнейшее обогащение можно осуществлять путем пэннинга, аффинного отбора, FACS-сортинга или любым другим способом, известным в данной области техники и описанным выше. Негативный отбор осуществляют путем удаления клеток, экспрессирующих маркеры CD45, гликофорин А и другие маркеры, упоминаемые ниже. Позитивный отбор осуществляют путем отбора клеток, экспрессирующих маркеры CD14, CD34, CD38, ICAM или другие маркеры, указывающие на экспрессию полноразмерного альфа-фетопротеина, альбумина или их обоих.
Пример 12
Получение клеток-предшественников с помощью элютриации
В этом примере показаны стадии выделения коммитированных и некоммитированных клеток-предшественников печени. Хотя в данной области техники известны многие способы, в данном варианте осуществления изобретения подробно описан один из предпочтительных способов, но при этом подразумевается, что и другие способы получения могут быть равно пригодны, при условии, что они отвечают поставленной цели. Предпочтительные примеры способов получения, не ограничивающие объем настоящего изобретения, описаны в патентах США №№5807686, 5916743, 5672346, 5681559, 5665557, 5672346 и 5663051, которые включены в настоящее описание в качестве ссылок.
Плюрипотентные или коммитированные мелкие клетки печени можно предварительно изолировать с помощью либо перколла, либо других подходящих градиентов плотности, таких как Histopaque, a после центрифугирования клетки дважды промывают средой и ресуспендируют в 10 мл элютриационной среды. Для противоточной элютриации промытые мелкие одноядерные клетки вводят через ответвление на стороне отбора образцов во входной поток центрифуги Beckman J6M/E, оснащенной ротором JE-5 и стандартной камерой. Однако можно использовать и любые другие из множества имеющихся в продаже центрифуг непрерывного действия или аппаратов для отмучивания, в которых предпочтительно используются одноразовые пластиковые вкладыши, включающие камеры для улучшенной сепарации, основанной на плотности, а именно такие устройства, как "Fenwal Models CS 3000" и "Autopheresis С", продаваемые фирмой Baxter International Inc. из Deerfield, IL., или Spectra Apherisis v 7/6, продаваемые фирмой Cobe manufacturing из Lakewood, CO. Выбор приборов остается за специалистами в данной области техники. Перистальтический насос (Cole Palmer Instruments, Chicago, IL) обеспечивает постоянный поток элютриационной среды, которая представляет собой обычный 0,9% физиологический раствор со 100 мг/дл D-глюкозы, 0,3 мМ динатрийэтилендиаминтетрауксусной кислоты (ЭДТА) и 50 мг/дл альбумина бычьей сыворотки, с рН, отрегулированным до 7,2. Перед использованием среду стерилизуют. Клетки подают с общей скоростью 15 мл/мин, при скорости ротора 900 g и при комнатной температуре. После того как собрано 100 мл элюата, расход (скорость подачи) увеличивают до 25 мл/мин. При постоянной скорости ротора скорость подачи последовательно увеличивают до 29 мл/мин, 33 мл/мин и 37 мл/мин, собирая по 200 мл при каждом увеличении скорости. Клетки, остающиеся в камере, собирают, остановив ротор и промывая камеру 100 мл элютриационной среды. Каждую клеточную фракцию промывают и центрифугируют при 300 g в течение 10 минут. Собирают нужные фракции, определяют жизнеспособность клеток путем окрашивания трипановым синим и определяют выход клеток с помощью счетчика клеток (Coulter Electronics, Hialeah, FL).
В альтернативном варианте клетки не разделяют путем сепарации в градиенте плотности, а суспендируют в физиологическом растворе с фосфатным буфером (PBS) с рН 7,4, содержащем 5% фетальной телячьей сыворотки, 0,01% об. ЭДТА и 1, 0 г/л D-глюкозы, и вводят в систему противоточной центрифужной элютриации Beckman при 10°С, при скорости ротора в 1950 об/мин, используя ротор JA-17 и стандартную камеру для разделения (Beckman Instruments), и образцы элюируют при скоростях подачи между 12 и 14 мл/мин.
Полученные клетки в подходящих фракциях, как правило, имеют диаметры от 5 до 15 микрон, предпочтительно от 8, 0 до 9,4 микрон; большинство клеток имели диаметр от 8,3 до 9,2 микрон. Эти диаметры измеряют способами, известными в данной области техники. Если необходимо, осуществляют дальнейший позитивный или негативный отбор, основанный на клеточных маркерах.
Специалистам в данной области техники известны различные антитела, которые можно использовать отдельно или в сочетании с маркерами клеток-предшественников. Выбор их зависит от того, какой тип клеток желают изолировать или обогатить, и включает, не ограничиваясь нижеперечисленным, антитела, специфичные для гематопоэтических и лимфоидных агентов, таких как анти-СD2, анти-СD2R, анти-CD3, анти-СD4, анти-СD5 и анти-CD8, специфичные для Т-клеток; анти-СD6, специфичные для субпопуляции Т-клеток и субпопуляции В-клеток; анти-СD7, специфичные для основной субпопуляции Т-клеток; анти-СD12, анти-СD19 и анти-СD20, анти-CD72, aнти-CDw78, специфичные для В-клеток; анти-СD13 и анти-CD14, специфичные для моноцитов; анти-СD16 и анти-СD56, специфичные для естественных клеток-киллеров; анти-СD41 для тромбоцитов; анти-CD1a, анти-CD1b и анти-CD1c, специфичные для кортикальных тимоцитов и клеток Лангерганса; анти-СD9, специфичные для пре-В-клеток, моноцитов и тромбоцитов; анти-CD10, специфичные для лимфоидных клеток-предшественников, С-А11-клеток и гранулоцитов; анти-CD11a, специфичные для лейкоцитов; анти-CD11b, специфичные для гранулоцитов, моноцитов и естественных клеток-киллеров; анти-CD11c, специфичные для моноцитов, гранулоцитов, естественных клеток-киллеров и волосатоклеточного лейкоза; анти-CD15, специфичные для гранулоцитов; анти-CDw17, специфичные для гранулоцитов, моноцитов и тромбоцитов; анти-СD18, специфичные для лейкоцитов; анти-СD21, специфичные для зрелых В-клеток; анти-СD22, специфичные для цитоплазмы В-клеток и для зрелых В-клеток; анти-CD23, специфичные для активированных В-клеток; анти-СD24, специфичные для В-клеток и гранулоцитов; анти-СD25 и анти-СD26, специфичные для активированных Т- и В-клеток и активированных макрофагов; анти-СD27 и анти-СD28, специфичные для основной популяции Т-клеток; анти-СD30, специфичные для активированных Т- и В-клеток и для клеток Стернберга-Рида; анти-СD31, специфичные для тромбоцитов, моноцитов/макрофагов, гранулоцитов и В-клеток; aнти-CDw32, специфичные для макрофагов, гранулоцитов, В-клеток и эозинофилов; анти-СD33, специфичные для моноцитов, миелоидных клеток-предшественников и для миелоидных лейкозов; анти-СD34, специфичные для гематопоэтических клеток-предшественников; анти-CD35, специфичные для гранулоцитов, моноцитов, В-клеток, некоторых натуральных клеток-киллеров и эритроцитов; анти-СD36, специфичные для моноцитов/макрофагов и тромбоцитов; анти-СD37, специфичные для зрелых В-клеток; анти-СD38, специфичные для плазмацитов, тимоцитов и активированных Т-клеток; анти-СD39, специфичные для зрелых В-клеток; анти-СD40, специфичные для В-клеток и карциномы; анти-СD42 и анти-СD42b, специфичные для тромбоцитов и мегакариоцитов; анти-СD43, специфичные для лейкоцитов, за исключением циркулирующих В-клеток; анти-СD44, специфичные для лейкоцитов и эритроцитов; анти-СD45, специфичные для лейкоцитов; анти-СD45RО, специфичные для Т-клеток, субпопуляции В-клеток, моноцитов и макрофагов; анти-С45RА, специфичные для В-клеток, моноцитов и субпопуляции Т-клеток; анти-СD45RВ, специфичные для В-клеток, субпопуляции Т-клеток, моноцитов, макрофагов и гранулоцитов; aнти-СD46, CD55, CD58 и CD59, специфичные для гемопоэтических и негемопоэтических клеток; анти-CD47, специфичные для всех типов клеток; анти-СD48, специфичные для лейкоцитов и нейтрофйлов анти-СDw49b, специфичные для тромбоцитов, активированных и длительно культивированных Т-клеток; aнти-CDw49d, специфичные для моноцитов, Т-клеток и В-клеток; aнти-CDw49f, специфичные для тромбоцитов и мегакариоцитов; aнти-CDw50 и анти-СDw52, специфичные для лейкоцитов; анти-CD51, специфичные для тромбоцитов; анти-СD53, специфичные для лейкоцитов, включая нормальные и опухолевые плазмоциты; анти-СD54, специфичные для эндотелиальных клеток; aнти-CDw60, специфичные для субпопуляции Т-клеток и тромбоцитов; анти-СD61, специфичные для тромбоцитов и мегакариоцитов; анти-CD62, специфичные для активированных тромбоцитов; анти-СD63, специфичные для активированных тромбоцитов, моноцитов/макрофагов; анти-СD64, специфичные для моноцитов (активированный интерферон гамма); aнти-CDw65, специфичные для гранулоцитов и обладающие различной реактивностью по отношению к моноцитам; анти-СD66 и 67, специфичные для гранулоцитов; анти-CD68, специфичные для моноцитов и макрофагов; анти-СD69, специфичные для активированных В- и Т-клеток, активированных макрофагов и естественных клеток-убийц; aнти-CDw70, специфичые для активированных Т- и В-клеток, клеток Стернберга-Рида и анапластической крупноклеточной лимфомы; анти-СD71, специфичные для активированных Т- и В-клеток, макрофагов, пролиферирующих клеток; анти-СD73, специфичные для субпопуляции В-клеток и субпопуляции Т-клеток; анти-СD74, специфичные для В-клеток и моноцитов/макрофагов; анти-СDw/75, специфичные для зрелых В-клеток; анти-СD76, специфичные для зрелых В-клеток и субпопуляции Т-клеток; анти-СD77, специфичные для В-клеток с фолликулярным центром; антитела к цитокинам и ростовым факторам (например, IL1-IL13, EGF, IGF I и II, TGF-.альфа. и .бета., TNF-.альфа. и .бета., FGF, NGF, CIF, IFN--.альфа. и .бета., CSF's); вирусные антигены, например белки оболочки вируса гепатита В или белки оболочки ВИЧ), гормоны, клеточные или связанные с опухолями антигены или маркеры, адгезивные молекулы, гемостатические молекулы и эндотелиальные клетки. Другие маркеры и процедуры обогащения в равной степени пригодны, такие, как описаны в патенте США №5840502, включенном в настоящее описание в качестве ссылки.
Пример 13
Биореактор
Высокопроизводительный биореактор (HPBR) применяют для культивирования человеческих клеток-предшественников гепатоцитов и их потомства. Этот процесс обеспечивает получение большого количества клеток, пригодных для дальнейшего использования в медицинских целях, или же биореактор сам по себе служит в качестве устройства для получения биологически полезных секретируемых клетками белков и факторов, которые могут включать, не ограничиваясь нижеперечисленным, фактор роста гепатоцитов (HGF), инсулиноподобный ростовой фактор-I и II (IGF-I и II), фактор роста эпидермальных клеток (EGF), фактор трансформации роста типа а и типа b (TGF-a и TGF-бета), фактор роста нервов (NGF), фактор роста фибропластов (EGF), фактор роста тромбоцитного происхождения (PDGF), фактор роста саркомы (SGF), фактор, стимулирующий рост колоний гранулоцитов и макрофагов (GM-CSF), сосудисто-эндотелиальный фактор роста (VEGF), фактор высвобождения пролактина и ростового гормона (GHRF), а также различные гемопоэтические факторы роста, такие как интерлейкины (IL) IL-1, IL-2, IL-3, IL-4, IL-5, EL-6, IL-7, IL-8, IL-10, IL-11 и др., фактор дифференциации эритроидов (EDF) или белок, высвобождающий гормон, стимулирующий фолликулы (FRP), ингибин, фактор пролиферации стволовых клеток (SCPF), а также активные фрагменты, субъединицы, производные и комбинации этих белков, среди многих других, известных в данной области техники. Как правило, в настоящем описании эти клеточные факторы обозначают секретируемый белок, который выбирают из группы, состоящей из цитокина, лимфокина, интерлейкина, стимулирующего колонии фактора, гормона, хемотактического фактора, антихемотактического фактора, фактора коагуляции, тромболитического белка, комплементарного белка, фермента, иммуноглобулина и антигена. Среди таких биологически активных белков специалисты в данной области техники могут выбрать фактор VIII, фактор IX, фактор VII, эритропоэтин, альфа-1-антитрипсин, кальцитонин, ростовой гормон, инсулин, липопротеин низкой плотности, аполипротеин Е, рецептор IL-2 и его антагонисты, супероксиддисмутазу, иммуномодуляторы, паратироидный гормон, интерфероны (IFN альфа, бета или гамма), факторы роста нервов, глюкоцереброзидазу, фактор, стимулирующий колонии, интерлейкины (IL1 до IL15), фактор, стимулирующий колонии гранулоцитов (G-CSF), фактор, стимулирующий колонии макрофагов и гранулоцитов (GM-CSF), фактор, стимулирующий колонии макрофагов (M-CSF), фактор роста фибропластов (FGF), ростовой фактор тромбоцитного происхождения (PDGF), аминозиндеаминазу, инсулиноподобные ростовые факторы (IGF-1 и IGF-2), стимулирующий мегакариоциты лиганд (MPL), громбопоэтин или их комбинации.
Выращивание клеток в биореакторе не ограничивается этим конкретным методом; для этой цели равно пригодны и могут быть легко адаптированы и другие хорошо известные в данной области техники способы, например, опубликованные в патентах США №№6001585, 5998184, 5846817, 5622857, 5571720, 5563068, 5512474, 5443985, 5342781, 5330915, 5320963, 5202254, 4833083 и 4760028, включенных в настоящее описание в качестве ссылок.
Настоящее устройство содержит волокна из целлюлозы 450 10 kD, волокна из полипропилена 540, а подробности о других параметрах можно найти, например, в патенте США №5622857, который включен в настоящее описание в качестве ссылки. Клетки изолируют, как описано выше. Все необходимые материалы получают из фирмы Sigma Chemical Co. или Life Technologies. Среды для прикрепления клеток для длительного культивирования следующие: RPMI 1640 (500 мл); 50 мл (10%) FBS); 4 мМ L-глютамина; 1 × пенициллин/стрептомицин; гентамицин; 15 мМ HEPES; 10 мЕ/мл инсулина; 10 мЕ/мл трансферрина. Систему HPBR промывают средой в течение одного дня перед внесением в биореактор среды для прикрепления клеток. Во внутреннюю кольцевую камеру биореактора HPBR помещают 500 мг предварительно подвергнутых набуханию микроносителей Cytodex 3. Волокна оксигенатора окутывают микроносители, не давая им распределяться по всей ECS (системе контроля влияния окружающей среды). Во внутреннюю кольцевую камеру биореактора помещают также жизнеспособные человеческие печеночные клетки-предшественники, и устройство покачивают и вращают вручную, чтобы добиться равномерного перемешивания клеток с микроносителями. Учитывая, что клетки-предшественники и их потомство имеют величину примерно 10-20 мкм в диаметре, соотношение клеток и микроносителя в инокулюме составляет около 500. Видимая вязкость клеток и микроносителей быстро увеличивается, указывая на то, что прикрепление клеток к микроносителям и друг к другу идет быстро и нормально. Примерно через 2-3 минуты такого перемешивания во внутренней кольцевой камере образуется дискретный гель из клеток и микроносителей. После культивирования до следующего утра при 37°С на среде для прикрепления (в стационарном положении) среды заменяют на среды для длительного культивирования (2 л). Эти объемы ни в коем случае не лимитируют объем настоящего изобретения, поскольку специалист в данной области техники легко может отрегулировать производительность биореактора до желаемого уровня. Гепатоциты культивируют в течение 5 недель, при еженедельном внесении в систему свежей среды. Метаболическую функцию клеток отслеживают путем ежедневного отбора образцов. Спустя 5 недель добиваются выхода >90% жизнеспособных клеток и микроносителей с помощью следующей процедуры: 0,1% коллагеназу в PBS, смешанную с 0,44 мл (0,23 М) ЭДТА, используют для промывки ECS и HPBR инкубируют в течение 10 минут; содержимое ECS вытесняют стерильным воздухом из цилиндра шприца; эту процедуру повторяют со средой для длительного культивирования, а собранные материалы промывают и разделяют.
Биореактор HPBR в равной степени пригоден для культивирования и генетической трансформации клеток (например, для экспрессии гена HGF). Ниже описывается генетическая невирусная методика для “заякоренных” клеток (например, SW 480 Р3; # CCL228 АТСС (Американской коллекции тканевых культур), которую специалисты в данной области техники могут соответствующим образом модифицировать и оптимизировать с помощью культуральных ячеек и чашек. Для HPBR предпочтительно использовать волокна для среды, обладающие свойствами 10 kD. Биореактор работает в основном так же, как описано выше. Для культивирования заякоренных клеток широко используют микроноситель Cytodex 1 (Pharmacia, продаваемый фирмой Sigma Chemical Co). В ECS биореактора HPBR можно инокулировать клетки при различной плотности, в я интервале от 1×104 до 1×1015 клеток или выше, по желанию. Рекомендуемое соотношение клеток к микроносителю в инокулюме составляет около 10, хотя специалисты в данной области техники могут изменить это соотношение, по желанию. Во время проведения эксперимента устройство осторожно вращают со скоростью около 10 движений в минуту (или более). После культивирования клеток примерно в течение суток (или более, в зависимости от конкретных клеток) достигается слияние, оптимальное для получения эффективной трансфекции. Соотношение клеток к микроносителю при инокуляции можно корректировать, чтобы улучшить использование этого интервала времени для повышения терапевтической неэкономической эффективности. В день осуществления трансфекции готовят раствор плазмид ДНК (например, pCMV) и раствор катионного липида (например, LIPOFECTIN Reagent, Life Technologies). Эти реагенты должны быть свободными от сыворотки, даже если полный процесс требует присутствия сыворотки. Смешивают необходимые количества растворов ДНК и липида, а затем вводят эту смесь в ECS устройства. После нескольких часов трансфецирования возобновляют использование сыворотки, если это необходимо, и продолжают культивировать клетки, как и раньше, в течение нескольких дней. Более длительные периоды времени можно использовать при размножении непрерывно трансформируемых клеток. Клетки собирают, как описано выше.
Пример 14
Искусственная печень
В качестве расширения вышеприведенного примера специалисты в данной области техники легко могут адаптировать биореактор, превратив его в систему экстракорпоральной поддержки, выполняющую функции печени. Ксенотрансплантация (трансплантация органов между разными биологическими видами) может помочь преодолеть дефицит донорной печени за счет использования органов животных. Однако потенциальная опасность пересадки людям органов от животных состоит в том, что вирусы, инфицирующие донорных животных, могут инфицировать и реципиентов. Поскольку реципиенты пересаживаемых органов будут вынуждены принимать лекарства, подавляющие иммунную систему и препятствующие отторжению органов, то они могут оказаться не способными бороться с вирусной инфекцией, полученной от животного. В еще более грозном сценарии вирус животного может мутировать в инфицированном хозяине, превратившись в форму, которая может инфецировать контактирующих с ней людей, имеющих нормальную иммунную систему. В результате этого может возникнуть новый патогенный вирус человека. Наиболее часто для трансплантации органов человеку используют органы свиньи и приматов.
Тем не менее ясно, что если будет доступна искусственная печень, основанная на клетках человека, то она будет предпочтительней, чем печень животных.
После желаемого времени культивирования получают зрелые гепатоциты и/или билиарные клетки, происходящие из популяции, обогащенной клетками-предшественниками печени. Обычно получают от 2 до 5 миллиардов; клеток с высокой (выше 80%) жизнеспособностью. Как правило, используемая культуральная среда представляет собой среду Waymouth с добавкой гормонов. Чтобы разместить от 2 до 5 миллиардов клеток, биореактор расширяют до двух герметизирующих сосудов, каждый из которых имеет внутренний диаметр 40 мм и высоту 100 мм. В данной конкретной ситуации используют стеклянные гранулы диаметром примерно 2 мм и общим объемом по 250 мл на герметизирующий сосуд. Среду подают со степенью рециркуляции, составляющей 360 мл/мин. О высокой жизнеспособности гепатоцитов свидетельствует стабильная скорость потребления кислорода. Затем реактор подсоединяют к лишенному печени реципиенту, печень которого была хирургически удалена ввиду ее полного поражения. Таким же образом биореактор подсоединяют к человеку с дисфункциональной печенью. Специалистам в данной области техники известно, как подсоединять биореактор в качестве системы экстракорпоральной поддержки, выполняющей функцию печени, либо известны альтернативные способы, существующие в данной области техники, например, такие, как описанные в патентах США №№6008049, 5981211, 5976870, 5891713, 5827729, 5643794, 5622857, 5605835 и 5270192, включенных в настоящее описание в качестве ссылок. Из этих ссылок очевидно, что донорные клетки искусственной печени необязательно являются клетками человека, и в настоящее время возможно использование таких клеток от других биологических видов. Например, клетки печени свиньи или приматов в равной степени пригодны для использования для человека. Ясно также, что способы и композиции по настоящему изобретению позволяют получать клетки печени человека для использования в клеточной терапии или экстракорпоральной терапии печени, со всеми вытекающими отсюда преимуществами.
Кровь из левой бедренной артерии направляют в гемоконцентратор Minntech. В бедренную артерию вставляют 12-полосную elecath канюлю и подсоединяют к трубопроводу из ПВХ диаметром1/4дюйма, идущему к гемоконцентратору. Гемоконцентратор разделяет кровь на фракцию безклеточного ультрафильрата и фракцию клеток крови. Фракцию клеток крови возвращают в бедренную вену через такой же трубопровод. Ультрафильрат выходит из гемоконцентратора через трубопровод из ПВХ диаметром дюйма и входит в систему гепатоцитного биореактора, со скоростью, которую регулируют до 40 мл/мин, с помощью роллерного насоса. После перфузии через биореактор ультрафильрат возвращают пациенту через левую шейную вену. Чтобы продемонстрировать обеспечение экстракорпорального печеночного метаболизма, в инфильтрат у впуска биореактора вводят два химиката, для которых известно, что они метаболизируются печенью: 7-этоксикумарин и лидокаин. Количество соответствующих метаболитов, 7-ОН-кумарина и моноэтилглицинэксилидида (MEGX), измеряют на выходах биореакторов до возвращения инфильрата пациенту. Наблюдали значительный метаболизм как 7-этоксикумарина, так и лидокаина. Таким образом, полученные результаты демонстрируют возможность применения биореактора в качестве системы поддержки, обеспечивающей экстракорпоральный печеночный метаболизм. Отделение клеток крови от плазмы сводит к минимуму иммунологическую реакцию реципиента на чужеродные гепатоциты. Таким образом, печеночные клетки-предшественники и их потомство можно использовать в биореакторе для обеспечения экстракорпоральной поддержки, обеспечивающей печеночный метаболизм.
Пример 15
Кодируемые экзоном 1 пептиды и их использование в качестве антигенов
Короткие пептиды, соответствующие экзону 1 альфа-фетопротеина, используют для того, чтобы безошибочно распознать альфа-фетопротеин в различных линиях дифференцировки клеток путем оценки экспрессии с помощью специфичных антител. Последовательность кодируемого экзоном 1 пептида следующая:
ПОСЛЕД. №14 MKWVESIFLIFLLNFTESRTLHRNEYGI
Эти аминокислоты можно также представить в алфавитном порядке, в виде ABCDEFGHIJKLMNOPRSTUVWXYZ, так, что буква А из этой цепочки начинается с позиции M, K, W, V, E, S, I, F, L, I, F, L, ,L или N пептида. Пептиды кодируемой экзоном последовательности длиной от четырех до двенадцати аминокислотных остатков конъюгируют с макромолекулой, в результате чего получают антиген. Пептид необязательно связан с макромолекулой с помощью спейсера длиной от двух до восьми атомов углерода. Макромолекула представляет собой альбумин, гемоцианин, казеин, овальбумин или полилизин. Подходящие пептиды включают пептиды, перечисленные в таблице, и
их аналоги, по меньшей мере, с 80%-ной гомологией, или стандартные заместители аминокислот. Ниже приводится пример того, как специалист в данной области техники может осуществлять конструирование, чтобы получить желаемую последовательность и длину пептида в соответствии с конкретными потребностями:


где любой элемент из A-B-C-D-E-F-G-H-I-J-K-L-M- или N может представлять собой неполярные аминокислоты (гидрофобные), такие как глицин Gly G
аланин Ala А
валин Val V
лейцин Leu L
изолейцин Ile I
метионин Met M
фенилаланин Phe F
триптофан Trp W
пролин Pro Р
или полярные (гидрофильные) аминокислоты
серин Ser S
треонин Thr Т
цистеин Cys С
тирозин Туr Y
аспарагин Asn N
глютамин Gin Q
или электрически заряженные (отрицательно)
аспарагиновая кислота Asp D
глютаминовая кислота Glu E
или электрически заряженные (положительно)
лизин Lys К
аргинин Arg R
гистидин His H
или может отсутствовать. Цепочка может состоять из приемлемых заместителей аминокислот или из их солей. Наиболее частыми замещениями аминокислот являются Ala/Ser, Val/Ile, Asp/Glu, Thr/Ser, Ala/Gly, Ala/Thr, Ser/Asn, Ala/Val, Ser/Gly, Tyr/Phe, Ala/Pro, Lys/Arg, Asp/Asn, Leu/Ile, Leu/Val, Ala/Glu, Asp/Gly и наоборот.
Реферат
Изобретение относится к области клеточной биологии. Сущность изобретения - способы выделения и криоконсервации клеток-предшественников из печени человека, включающие обработку ткани печени человека для получения по существу одноклеточной суспензии, содержащей клетки-предшественники и клетки, не являющиеся клетками-предшественниками, одной или более линий клеточной дифференцировки, имеющихся в печени человека. Описаны способы, включающие стадию разделения клеточной популяции, с помощью которой в суспензии уменьшают количество клеток, не являющихся клетками-предшественниками, а также получают разделенную суспензию, обогащенную клетками-предшественниками, экспрессирующими один или более маркеров, связанных с одной или более линиями клеточной дифференцировки. Описан способ отбора из разделенной суспензии тех клеток, которые сами по себе, их потомство или их более зрелые формы экспрессируют один или более маркеров, связанных с линиями клеточной дифференцировки. Среди этих маркероов - CD14, CD34, CD38, CD45 и ICAM. Печеночные клетки-предшественники характеризуются тем, что они имеют размер 6-15 микрон в диаметре, являются диплоидными, имеют характеристики гликофорин А-, CD45-, AFP+++, ALB+, ICAM+ и содержат субпопуляции, варьирующиеся в отношении экспрессии CD14+, CD34++, CD38++, CD117++. Технический результат заключается в том, что клетки полезны для клеточной и генной терапии печени и для получения искусственных органов. 10 н. и 31 з.п. ф-лы, 7 табл., 16 ил.

Комментарии