Вакцины на основе свиного вируса torque teno и способы диагностики инфекций, вызванных этим вирусом - RU2553223C2
Код документа: RU2553223C2
Чертежи



















































































Описание
Настоящая заявка претендует на преимущества предварительной заявки США на патент №61/235,833, поданной 21 августа 2009 г., и предварительной заявки США на патент №61/316,519, поданной 23 марта 2010 г., описания которых включены в данную заявку посредством отсылки.
ОБЛАСТЬ ТЕХНИКИ, К КОТОРОЙ ОТНОСИТСЯ ДАННОЕ ИЗОБРЕТЕНИЕ
Данная заявка относится к вакцинам для защиты от инфекции, вызванной свиным вирусом Torque TeNO (Торкве Тено) (TTV), и инфекций, вызванных инфекционными ДНК-клонами свиного TTV (PTTV), и к их применению. Данное изобретение относится также к диагностике инфекции, вызванной свиным вирусом Torque TeNO (PTTV), особенно инфекции, вызванной различными типами и типоспецифическими вирусами PTTV, и инфекции, вызванной многими штаммами различных генотипов.
УРОВЕНЬ ТЕХНИКИ
Вирус Torque TeNO (TTV) был впервые обнаружен в 1997 г в Японии у пациента с пост-трансфузионным гепатитом не-А и не-Е типа (Nishizawa, Т., Okamoto, H., Konishi, K., Yoshizawa, H., Miyakawa, Y., and Mayumi, M. (1997). A NOvel DNA virus (TTV) associated with elevated transaminase levels in posttransfusion hepatitis of unkNOwn etiology. Biochem Biophys Res Commun 241(1), 92-7).
С тех пор было идентифицировано большое число человеческих штаммов TTV и две группы TTV - родственных вирусов, обозначенных как вирус Torque teNO mini (TTMV) и вирус Torque teNO midi (TTMDV) с высокими показателями распространения в сыворотке и других тканях здоровых людей (HiNO, S., and Miyata, H. (2007). Torque teNO virus (TTV): current status. Rev. Med. Virol. 17(1), 45-57; Okamoto, H. (2009a). History of discoveries and pathogenicity of TT viruses. Curr. Top. Microbiol. ImmuNOl 331, 1-20). Человеческие TTV, TTMV и TTMDV представляют собой сферические вирусы без оболочки, содержащие геномы кольцевой однонитевой ДНК (онДНК) длиной 3,6-3,9, 2,8-2,9 и 3,2 т.н., соответственно, и теперь они классифицируются в новом семействе вирусов Anelloviridae в Intemationa Committee on TaxoNOmy of Viruses (ICTV; http://www.ictvonline.org/virusTaxoNOmy.asp?bhcp=1) (Biagini, P. (2009). Classification of TTV and related viruses (anelloviruses). Curr. Top.Microbiol. ImmuNOl. 331, 21-33). Эти три группы вирусов, относящихся к TTV, проявляют высокую степень гетерогенности, при этом каждая группа состоит из множества геногрупп и генотипов (Biagini, P., Gallian, Р., Cantaloube, J.F., Attoui, H., de Micco, P., and de Lamballerie, X. (2006). Distribution and genetic analysis of TTV and TTMV major phylogenetic groups in French blood doNOrs. J. Med. Virol. 78 (2), 298-304; Jelcic, I., Hotz-Wagenblatt, A., Hunziker, A., Zur Hausen, H., and de Villiers, E. M. (2004). Isolation of multiple TT virus geNOtypes from spleen biopsy tissue from a Hodgkin's disease patient: geNOme reorganization and diversity in the hypervariable region. J. Virol. 78(14),7498-507). Сообщалось о распространении множественных инфекций, вызванных TTV с различными генотипами, а также двойных или тройных инфекций, вызванных TTV, TTMV и TTMDV, у людей, и эти инфекции рассматриваются как обычные события у здоровых людей (Niel, С., Saback, F.L., and Lampe, E. (2000)). Ко-инфекция, вызванная многими штаммами TTV, относящимися к различным генотипам, распространена у здоровых взрослых людей в Бразилии (J. Clin. Microbiol. 38(5), 1926-30; NiNOmiya, M., Takahashi, M., HoshiNO, Y., Ichiyama, K., Simmonds, P., and Okamoto, H. (2009). Analysis of the entire geNOmes of torque teNO midi virus variants in chimpanzees: infrequent cross-species infection between humans and chimpanzees. J. Gen. Virol. 90 (Pt 2), 347-58; Okamoto, H. (2009a). History of discoveries and pathogenicity of TT viruses. Curr. Top.Microbiol. ImmuNOl.331, 1-20; Takayama, S., Miura, Т., Matsuo, S., Taki, M., and Sugii, S. (1999). Prevalence and persistence ofaNOvel DNA TT virus (TTV) infection in Japanese haemophiliacs. Br. J. Haematol. 104 (3), 626-9).
TTV вызывают инфекцию не только у людей, но также и у различных видов животных, включая нечеловеческих приматов, тупай, свиней, скот, кошек, собак и морских львов (Biagini, Р., Uch, R., Belhouchet, M., Attoui, H., Cantaloube, J. F., Brisbarre, N., and de Micco, P. (2007). Circular geNOmes related to anelloviruses identified in human and animal samples by using a combined rolling-circle amplification / sequence-independent single primer amplification approach. J. Gen. Virol. 88(Pt 10), 2696-701; Inami, Т., Obara, Т., Moriyama, M., Arakawa, Y., and Abe, K. (2000). Full-length nucleotide sequence of a simian TT virus isolate obtained from a chimpanzee: evidence for a new TT virus-like species. Virology 277(2), 330-5; Ng, Т. F., Suedmeyer, W. K., Wheeler, E., Gulland, F., and Breitbart, M. (2009). NOvel anellovirus discovered from a mortality event of captive California sea lions. J. Gen. Virol.90 (Pt 5), 1256-61; Okamoto, H. (2009b). TT viruses in animals. Curr. Top.Microbiol. ImmuNOl. 331, 35-52; Okamoto, H., Nishizawa, Т., Takahashi, M., Tawara, A., Peng, Y., Kishimoto, J., and Wang, Y. (2001). GeNOmic and evolutionary characterization of TT virus (TTV) in tupaias and comparison with species-specific TTV in humans and NOn-human primates. J Gen Virol. 82(Pt 9), 2041-50; Okamoto, H., Nishizawa, Т., Tawara, A., Peng, Y., Takahashi, M., Kishimoto, J., Tanaka, Т., Miyakawa, Y., and Mayumi, M. (2000a). Species-specific TT viruses in humans and NOnhuman primates and their phylogenetic relatedness. Virology 277(2), 368-78; Okamoto, H., Takahashi, M., Nishizawa, Т., Tawara, A., Fukai, K., Muramatsu, U., Naito, Y., and Yoshikawa, A. (2002). GeNOmic characterization of TT vimses (TTV) in pigs, cats and dogs and their relatedness with species-specific TTV in primates and tupaias. J, Gen. Virol. 83 (Pt 6), 1291-7). Кроме того, шимпанзе также инфицируются TTMV и TTMDV (NiNOmiya, M., Takahashi, M., HoshiNO, Y., Ichiyama, K., Simmonds, P., and Okamoto, H. (2009). Analysis of the entire geNOmes of torque teNO midi virus variants in chimpanzees: infrequent cross-species infection between humans and chimpanzees. J. Gen. Virol. 90(Pt 2), 347-58; Okamoto et al., 2000a, supra). Хотя размеры геномов идентифицированных штаммов TTV у животных, особенно TTV у животных, не являющихся приматами, сравнительно меньше, чем у штаммов TTV человека, они имеют одну и ту же структуру генома с минимум двумя частично перекрывающимися открытыми рамками считывания (ORF1 и ORF2), транслированными из отрицательной ДНК, а также с коротким отрезком нетранслированного участка (UTR) с высоким содержанием (около 90%) GC (гуанина и цитозина) (Okamoto, 2009b, supra). Аранжировка ORF TTV очень похожа на аранжировку вируса анемии цыплят (CAV), принадлежащего к роду Gyrovirus в семействе Circoviridae, но отличается от аранжировки свиных цирковирусов (PCV) типов 1 (PCV1) и 2 (PCV2), которые тоже классифицируются в том же самом семействе (Davidson, I., and Shulman, L. M. (2008). Unraveling the puzzle of human anello virus infections by comparison with avian infections with the chicken anemia virus. Virus Res. 137(1), 1-15; HiNO, S., and Prasetyo, A.A. (2009). Relationship of Torque teNO virus to chicken anemia virus. Curr. Top Microbiol. ImmuNOl.331, 117-30). Геномы PCV1 и PCV2 являются амбисмысловыми, причем ORF1 кодирована геномной нитью и ORF2 кодирована антигеномной нитью (HiNO and Miyata, 2007, supra). Недавно шаблон для транскрипции и транслированные продукты обоих генотипов 1 и 6 человеческого TTV были идентифицированы путем трансфекции соответствующих инфекционных ДНК - клонов TTV в культивируемые клетки (Mueller, В., Maerz, A., Doberstein, K., Finsterbusch, Т., and Mankertz, A. (2008). Gene expression of the human Torque TeNO Virus isolate P/1C1. Virology 381(1), 36-45; Qiu, J., Kakkola, L., Cheng, F., Ye, C., Soderlund-Venermo, M., Hedman, K., and Pintel, D. J. (2005)). (Mueller, В., Maerz, A., Doberstein, K., Finsterbusch, Т., and Mankertz, A. (2008). Gene expression of the human Torque TeNO Virus isolate P/1C1. Virology 381(1), 36-45; Qiu, J., Kakkola, L., Cheng, F., Ye, C., Soderlund-Venermo, M., Hedman, K., and Pintel, D.J. (2005). Человеческий цирковирус TTV генотипа 6 экспрессирует шесть белков после трансфекции клона с полной длиной (J. Virol. 79(10), 6505-10). Экспрессия по меньшей мере шести белков, обозначенных как ORF1, ORF2, ORF1/1, ORF2/2, ORF1/2 и ORF2/3, из трех или более спланированных мРНК была описана Kakkola, L., Hedman, K., Qiu, J., Pintel, D., and Soderlund-Venermo, M. (2009). Replication of and protein synthesis by TT viruses. Curr. Top Microbiol. ImmuNOl. 331, 53-64; Mueller et al., 2008, supra; Qiu et al., 2005, supra). Соответственно, является вероятным, что, когда станут доступными дополнительные данные, касающиеся животного TTV, предполагаемую структуру генома животного TTV можно будет модифицировать.
Хотя TTV был впервые идентифицирован у пациента с криптогенным гепатитом, последовавшие затем исследования не позволили получить доказательство значительной роли TTV в патогенезе гепатита или других болезней (HiNO and Miyata, 2007, supra; Maggi, F., and Bendinelli, M. (2009). ImmuNObiology of the Torque teNO viruses and other anelloviruses. Curr. Top Microbiol. Immunol. 331, 65-90; Okamoto, 2009a, supra)). Хотя считают, что человеческий TTV не связан непосредственно с болезнью, недавно было установлено, что свиной TTV (PTTV) частично способствует экспериментальной индукции свиного дерматита и синдрома нейропатии (PDNS), соединенных с возникновением репродуктивно/респираторного синдрома у свиней (PRRSV) (Krakowka, S., Hartunian, С., Hamberg, A., Shoup, D., Rings, M., Zhang, Y., Allan, G., and Ellis, J.A. (2008). Evaluation of induction of porcine dermatitis and nephropathy syndrome in gNOtobiotic pigs with negative results for porcine circovirus type 2. Am. J. Vet. Res. 69(12), 1615-22), а также с экспериментальной индукцией мультисистемного синдрома истощения после отъема поросят от свиноматки (PMWS), соединенного с инфекцией, вызванной PCV2 в модели гнобиотической свиньи (Ellis, J.A., Allan, G., and Krakowka, S. (2008). Effect of coinfection with geNOgroup 1 porcine torque teNO vims on porcine circovirus type 2-associated postweaning multisystemic wasting syndrome in gNOtobiotic pigs. Am. J. Vet. Res. 69(12), 1608-14). Эти данные позволили предположить, что свиной вирус TTV является патогенным для свиней. Однако необходимы более глубокие исследования с биологически чистой формой вируса PTTV для полной характеристики болезней и патологических изменений, связанных с инфекцией, вызванной PTTV.
По сравнению с человеческим TTV информация о геноме PTTV очень ограничена. В настоящее время описаны только одна геномная последовательность с полной длиной и две геномные последовательности с почти полной длиной для PTTV у свиней в Японии и в Бразилии, соответственно (Niel, С., Diniz-Mendes, L., and Devalle, S. (2005). Rolling-circle amplification of Torque teNO virus (TTV) complete geNOmes from human and swine sera and identification ofaNOvel swine TTV geNOgroup. J. Gen. Viro.l 86(Pt 5), 1343-7; Okamoto et al., 2002, supra.). Среди трех известных штаммов PTTV были сгруппированы вместе штаммы Sd - TTV31 и TTV - 1р в геногруппе 1 (PTTV1), в то время как TTV - 2р был единственным штаммом, классифицированным в геногруппе 2 (PTTV2) (Niel et al., 2005, supra). Однако классификация в геногруппах представляет собой расплывчатую концепцию в таксономии вирологии и необходима дальнейшая и более точная классификация PTTV, но она может быть сделана только тогда, когда станут доступными другие геномные последовательности с полной длиной новых штаммов PTTV, представляющих собой многие генотипы.
Ранее было показано, что инфекции, вызванные PTTV, широко распространены у свиней в шести странах, включая США, Канаду, Испанию, Китай, Корею и Таиланд (McKeown, N. Е., Fenaux, M., Halbur, P.G., and Meng, X.J. (2004). Molecular characterization of porcine TT virus, an orphan virus, in pigs from six different countries. Vet. Microbiol. 104 (1-2), 113-7).
Вопрос о том, играют ли TTV значительную роль в патогенезе различных заболеваний у свиней или нет, до сих пор остается спорным. На примере модели гнобиотической свиньи было показано, что сама по себе инфекция, вызванная PTTV1, не приводит к развитию каких - либо клинических болезней, но вызывает патологические изменения (Krakowka, S. and Ellis, J.A., 2008. Evaluation of the effects of porcine geNOgroup 1 torque teNO virus in gNOtobiotic swine. Am. J. Vet. Res. 69, 1623-9). У свиней, экспериментально зараженных и PTTV1, и вирусом репродуктивно - респираторного синдрома у свиней (PRRSV), развивались клинический свиной дерматит и синдром нефропатии (PDNS) (Krakowka, S., Hartunian, С., Hamberg, A., Shoup, D., Rings, M., Zhang, Y., Allan, G. and Ellis, J.A., 2008. Evaluation of induction of porcine dermatitis and nephropathy syndrome in gNOtobiotic pigs with negative results for porcine circovirus type 2. Am. J. Vet. Res. 69, 1615-22), в то время, как у свиней, зараженных как PTTV1, так и свиным цирковирусом типа 2 (PCV2), наблюдался хронический мультисистемный синдром истощения после отъема поросят от свиноматки (PMWS) (Ellis et al., 2008, supra). Хотя PCV2 рассматривается как агент, в основном вызывающий клинический PMWS или болезни, ассоциируемые с PCV (PCVAD), в Испании наблюдалось сильное распространение инфекции, вызванной PTTV2, у свиней, страдающих от PMWS с низким содержанием PCV2 или не содержащих PCV2, по сравнению со свиньями без PMWS (Kekarainen et al., 2006, supra). Все эти данные позволяют предположить, что свиные TTV могут служить как ко-факторы, участвующие в запуске и усилении развития болезней у свиней.
Свиной TTV был обнаружен в образцах свиной сыворотки, фекалий, слюны, спермы и тканей у инфицированных свиней, что показывает, что он передается различными путями, включая вертикальную и горизонтальную трансмиссию (Kekarainen et al., 2007, supra; Pozzuto, Т., Mueller, В., Meehan, В., Ringler, S.S., Mclntosh, K.A., Ellis, J.A., Mankertz, A. and Krakowka, S., 2009. In utero transmission of porcine torque teNO viruses. Vet. Microbiol. 137, 375-9; Sibila, M., Martinez-GuiNO, L., Huerta, E., Llorens, A., Mora, M., Grau-Roma, L., Kekarainen, T. and Segales, J., 2009. Swine torque teNO virus (TTV) infection and excretion dynamics in conventional pig farms. Vet. Microbiol. 139, 213-8). Однако в настоящее время обнаружение наличия инфекции, вызванной TTV, основано на применении обычного метода ПЦР. Таким образом, до сих пор не были разработаны ни метод серологического анализа, ни система вирусной культуры. В частности, методы "вложенной ПЦР" с амплификацией консервативных участков в UTR PTTV1 и PTTV2, соответственно, разработанные группой испанских исследователей, нашли широкое распространение (Kekarainen et al., 2006, supra). Так как показатель распространения вируса, по всей видимости, связан со степенью серьезности клинических болезней, как показывает PCVAD, вызванная PCV2 (Opriessnig, Т., Meng, X.J. and Halbur, P.G., 2007. Porcine circoviros type 2 associated disease: update on current termiNOlogy, clinical manifestations, pathogenesis, diagNOsis, and intervention strategies. J. Vet. Diagn. Invest. 19, 591-615), было бы важнее определить вирусную нагрузку свиного TTV методом количественной ПЦР в режиме реального времени, чем наличие ДНК в TTV методом обычной ПЦР. Кроме того, ПЦР в режиме реального времения является более надежным, быстрым и менее дорогим методом по сравнению с методом обычной ПЦР. Недавно были описаны два метода ПЦР в режиме реального времени, основанные на применении пробы TaqMan, для выявления и количественного определения двух видов свиного TTV (Brassard, J., Gagne, M.J., Houde, A., Poitras, E. and Ward, P., 2009. Development of a real-time TaqMan PCR assay for the detection of porcine and bovine Torque teNO virus. J. Appl. Microbiol. NOv 14, 2009, E pub. ahead of print; Gallei, A., Pesch, S., Esking, W.S., Keller, C. and Ohiinger, V.F., 2009. Porcine Torque teNO virus: Determination of viral geNOmic loads by geNOgroup-specific multiplex rt-PCR, detection of frequent multiple infections with geNOgroups 1 or 2, and establishment of viral full-length sequences. Vet. Microbiol. Dec 21, 2009, E pub. ahead of print). Основной недостаток методов, основанных на применении проб, заключается в том, что могут быть получены ложные отрицательные результаты, если пробу - связывающие последовательности содержат мутации (Anderson, T.P., WerNO, A.M., BeyNOn, K.A. and Murdoch, D.R., 2003. Failure to geNOtype herpes simplex virus by real-time PCR assay and melting curve analysis due to sequence variation within probe binding sites. J. din. Microbiol. 41,2135-7).
С учетом высокой степени гетерогенности среди последовательностей известных штаммов свиного TTV, ожидают вариации пробу - связывающих последовательностей в полевых штаммах PTTV. Метод ПЦР в режиме реального времени, основанная на применении красителя SYBR Green является альтернативным методом, позволяющим избежать возникновения этой проблемы несмотря на его довольно низкую специфичность и обеспечивающим универсальный путь обнаружения и количественного определения вариантов свиного TTV. Более того, анализ кривых плавления (МСА) после проведения ПЦР в режиме реального времени, основанной на применении красителя SYBR Green, обеспечивает специфичность реакции и позволяет осуществить мультиплексное обнаружение различных типов вируса (Ririe, K.M., Rasmussen, R.P. and Wittwer, C.T., 1997. Product differentiation by analysis of DNA melting curves during the polymerase chain reaction. Anal. Biochem. 245, 154-60). Методы ПЦР в режиме реального времени, основанные на применении красителя SYBR Green, были успешно применены в отношении различных человеческих и вирусов животных (Gibellini, D., Gardini, F., Vitone, F., Schiavone, P., Furlini, G. and Re, M.C., 2006. Simultaneous detection of HCV and HIV-1 by SYBR Green real time multiplex RT-PCR technique in plasma samples. Mol. Cell Probes 20, 223-9; Martinez, E., Riera, P., Sitja, M., Fang, Y., Oliveira, S. and Maldonado, J., 2008. Simultaneous detection and geNOtyping of porcine reproductive and respiratory syndrome virus (PRRSV) by real-time RT-PCR and amplicon melting curve analysis using SYBR Green. Res. Vet. Sci. 85, 184-93; Mouillesseaux, K.P., Klimpel, K.R. and Dhar, A.K., 2003. Improvement in the specificity and sensitivity of detection for the Taura syndrome virus and yellow head virus of penaeid shrimp by increasing the amplicon size in SYBR Green real-time RT - PCR. J. Virol. Methods 111, 121-7; Wilhelm, S., Zimmermann, P., Selbitz, H.J. and Truyen, U., 2006. Real-time PCR protocol for the detection of porcine parvovirus in field samples. J. Virol. Methods 134, 257-60)
В настоящее время о PTTV-специфическом гуморальном ответе известно мало. Так как методы с применением ПЦР не отражают развития инфекции, вызванной PTTV, у свиней, для оценки преобладания серотипа PTTV и характеристики роли PTTV в развитии болезней у свиней необходимо применять эффективный метод твердофазного иммуноферментного анализа(ELISA).
Таким образом, до сих пор нет субъединичной, инактивированной или живой вакцины от свиных TTV. Желательно и предпочтительно осуществить экспрессию рекомбинантных капсидных белков PTTV из различных генотипов с целью создания субъединичных вакцин и получить инфекционные молекулярные ДНК-клоны PTTV из разных генотипов для распространения биологически чистой формы PTTV в системе клеточной культуры, которая применяется для создания инактивированных или живых вакцин.
РАСКРЫТИЕ ИЗОБРЕТЕНИЯ
Данное изобретение предусматривает молекулу инфекционной нуклеиновой кислоты ("клон инфекционной ДНК") свиного вируса Torque teNO (PTTV), представляющую собой молекулу нуклеиновой кислоты, кодирующую инфекционный PTTV, которая содержит по меньшей мере одну копию геномной последовательности, имеющей степень гомологичности равную по меньшей мере 80% по отношению к геномной последовательности, выбранной из группы, состоящей из генотипов PTTV 1а-VA, PTTV1b-VA, PTTV2b-VA и PTTV2c-VA.
Согласно одному аспекту данного изобретения предусмотрены клоны инфекционной ДНК PTTV по п.1 формулы изобретения, характеризующиеся тем, что геномная последовательность выбрана из последовательностей, описываемых в SEQ ID NO:9, SEQ ID NO:10, SEQ ID NO:11 и SEQ ID NO:12.
Настоящее изобретение предусматривает также биологически функциональную плазмиду или вирусный вектор, содержащие инфекционные геномы PTTV Данное изобретение предусматривает подходящую клетку - хозяина, трансфецированную плазмидой или вирусным вектором клона инфекционной ДНК.
Данное изобретение предусматривает инфекционный PTTV, продуцированный клетками, трансфецированными клонами инфекционной ДНК PTTV. Настоящее изобретение относится также к вирусной вакцине, содержащей нетоксичный физиологически приемлемый носитель и иммуногенное количество члена, выбранного из группы, состоящей из (а) молекулы нуклеиновой кислоты, содержащей по меньшей мере одну копию геномной последовательности, имеющей степень гомологичности равную по меньшей мере 80% по отношению к геномной последовательности, выбранной из группы, состоящей из генотипов PTTV Ia-VA, PTTV1b-VA, PTTV2b-VA и PTTV2c-VA или ее комплементарную нить, (б) биологически функциональной плазмиды или вирусного вектора, содержащих молекулу нуклеиновой кислоты, содержащую по меньшей мере одну копию геномной последовательности, имеющей степень гомологичности равную по меньшей мере 80% по отношению к геномной последовательности, выбранной из группы, состоящей из генотипов PTTV 1а-VA, PTTV1b-VA, PTTV2b-VA и PTTV2c-VA или ее комплементарную нить, и (в) авирулентного инфекционного непатогенного PTTV, который содержит по по меньшей мере одну копию геномной последовательности, имеющей степень гомологичности, равную по меньшей мере 80% по отношению к геномной последовательности, выбранной из группы, состоящей из генотипов PTTV1a-VA, PTTV1b-VA, PTTV2b-VA и PTTV2c-VA.
В соответствии с одним аспектом данного изобретения вакцина содержит живой вирус PTTV, полученный из клонов инфекционного PTTV. Согласно другому аспекту данного изобретения вакцина содержит инактивированный вирус PTTV, полученный из клонов инфекционного PTTV.
Данное изобретение предусматривает очищенные рекомбинантные белки, экспрессированные из генов капсида ORF1 генотипов PTTV или подтипов PTTV1a-VA, PTTV1b-VA и PTTV2c-VA в бактериальную систему для экспрессии и применение этих рекомбинантных капсидных белков в качестве субъединичной вакцины против инфекций, вызванных PTTV. Согласно одному из вариантов данного изобретения рекомбинантные капсидные белки, применяемые в составе субъединичных вакцин, экспрессированы в системе экспрессии бакуловирусов и в других векторных системах экспрессии.
Согласно еще одному аспекту данного изобретения вакцина дополнительно содержит адъювант.
Данное изобретение предусматривает также способ иммунизации свиньи против вирусной инфекции, вызванной PTTV, включающий введение свинье иммунологически эффективного количества вирусной вакцины.
Согласно еще одному аспекту данного изобретения указанный способ включает введение свинье рекомбинантного субъединичного капсидного белка, молекулы инфекционной нуклеиновой кислоты или живого вируса PTTV.
Согласно другому аспекту данного изобретения указанный способ включает парентеральное, интраназальное, интрадермальное или трансдермальное введение вакцины свинье.
Данное изобретение предусматривает также выделенный полинуклеотид, состоящий из нуклеотидной последовательности PTTV1a-VA, представленной в SEQ ID NO:9.
Данное изобретение предусматривает также выделенный полинуклеотид, состоящий из нуклеотидной последовательности PTTV1b-VA, представленной в SEQ ID NO:10.
Данное изобретение предусматривает также выделенный полинуклеотид, состоящий из нуклеотидной последовательности PTTV2b-VA, представленной в SEQ ID NO:11.
Данное изобретение предусматривает также выделенный полинуклеотид, состоящий из нуклеотидной последовательности PTTV2c-VA, представленной в SEQ ID NO:12.
Настоящее изобретение предусматривает также субъединичную вакцину, содержащую иммуногенный фрагмент полипептидной последовательности или полного белка, транслированный согласно полинуклеотидной последовательности, выбранной из группы, состоящей из of ORF1, ORF2, ORF1/1 и ORF2/2 генотипов PTTV или подтипов PTTV1a-VA, PTTV1b-VA, PTTV2b-VA и PTTV2c-VA, в частности ORF 1, кодирующей капсидный белок.
Согласно еще одному аспекту данного изобретения полинуклеотидная последовательность выбрана из группы, состоящей из ORF1 генотипов PTTV или подтипов PTTV1a-VA, PTTV1b-VA, PTTV2b-VA и PTTV2c-VA.
Согласно другому аспекту данного изобретения полинуклеотидная последовательность представляет собой ORF 1 генотипов PTTV1a.
Согласно еще одному аспекту данного изобретения полинуклеотидная последовательность представляет собой ORF 1 генотипов PTTV1b.
Согласно одному аспекту данного изобретения полипептидная последовательность выбрана из группы, состоящей из последовательностей, представленных в SEQ ID NO:13, SEQ ID NO:14, SEQ ID NO:15, SEQ ID NO:16, SEQ ID NO:17, SEQ ID NO:18, SEQ ID NO:19, SEQ ID NO:20, SEQ ID NO:21, SEQ ID NO:22, SEQ ID NO:23, SEQ ID NO:24, SEQ ID NO:25, SEQ ID NO:26, SEQ ID NO:27 и SEQ ID NO:28.
Согласно другому аспекту данного изобретения полипептидная последовательность представляет собой SEQ ID NO:13. Согласно другому аспекту данного изобретения полипептидная последовательность представляет собой SEQ ID NO:14. Согласно другому аспекту данного изобретения полипептидная последовательность представляет собой SEQ ID NO:16. Согласно одному конкретному варианту данного изобретения полипептидная последовательность представляет собой С-концевой участок (а.к. 310-625) SEQ ID NO:16. Согласно другому аспекту данного изобретения полипептидная последовательность представляет собой SEQ ID NO:20.
Согласно другому аспекту данного изобретения вакцина дополнительно содержит адъювант.
Данное изобретение предусматривает также способ иммунизации свиньи против вирусной инфекции, вызванной PTTV, включающий введение свинье иммунологически эффективного количества вирусной вакцины, содержащей иммуногенный фрагмент полипептидной последовательности или полного белка, транслированный согласно полинуклеотидной последовательности, выбранной из группы, состоящей из of ORF1, ORF 2, ORF1/1 и ORF2/2 генотипов PTTV или подтипов PTTV1a-VA, PTTV1b-VA, PTTV2b-VA и PTTV2c-VA.
Согласно одному аспекту данного изобретения указанный способ включает введение свинье иммуногенного фрагмента или рекомбинантного капсидного белка.
Согласно другому аспекту данного изобретения указанный способ включает парентеральное, интраназальное, интрадермальное или трансдермальное введение вакцины свинье. Согласно еще одному аспекту данного изобретения указанный способ включает введение свинье вакцины в лимфу или внутримышечно.
Настоящее изобретение относится также к способу диагностики инфекции. вызванной PTTV1 и количественного определения вирусной нагрузки PTTV1, включающий экстрагирование ДНК из образца, предположительно инфицированного PTTV1, проведение полимеразной цепной реакции (PCR) с помощью праймеров, содержащих последовательности, представленные в SEQ ID NO:29 и SEQ ID NO:30, и детектирование специфической амплификации PTTV1. Согласно одному из аспектов данного изобретения полимеразная цепная реакция представляет собой ПЦР в режиме реального времени с применением красителя SYBR Green.
Данное изобретение предусматривает также способ диагностики инфекции, вызванной PTTV2, и количественного определения вирусной нагрузки PTTV2, включающий экстрагирование ДНК из образца, предположительно инфицированного PTTV2, проведение полимеразной цепной реакции (PCR) с помощью праймеров, содержащих последовательности, представленные в SEQ ID NO:29, SEQ ID NO:30, SEQ ID NO:31 и SEQ ID NO:32, и детектирование специфической амплификации PTTV2. Согласно одному из аспектов данного изобретения полимеразная цепная реакция представляет собой ПЦР в режиме реального времени с применением красителя SYBR Green.
Данное изобретение предусматривает также способ одновременных детектирования и диагностики инфекции, вызванной PTTV1 и PTTV2, включающий экстрагирование ДНК из образца, предположительно инфицированного PTTV, проведение полимеразной цепной реакции (PCR) с помощью праймеров, содержащих последовательности, представленные в SEQ ID NO:31 и SEQ ID NO:32, и детектирование специфической амплификации PTTV1 и PTTV2. Согласно одному из аспектов данного изобретения полимеразная цепная реакция представляет собой ПЦР в режиме реального времени с применением красителя SYBR Green.
Кроме того, данное изобретение предусматривает также способ одновременного детектирования и диагностики инфекции, вызванной PTTV1a и PTTV1b, включающий экстрагирование ДНК из образца, предположительно инфицированного PTTV1, проведение первой полимеразной цепной реакции (PCR) с помощью праймеров, содержащих последовательности, представленные в SEQ ID NO:33 и SEQ ID NO:34, проведение второй полимеразной цепной реакции (PCR) с помощью праймеров, содержащих последовательности, представленные в SEQ ID NO:35, SEQ ID NO:36, SEQ ID NO:37 и SEQ ID NO:38, и детектирование специфической амплификации PTTV1a и PTTV1b.
Данное изобретение предусматривает также способ диагностики инфекции, вызванной PTTV, включающий иммобилизацию иммуногенного фрагмента полипептидной последовательности, транслированный согласно полинуклеотидной последовательности, выбранной из группы, состоящей из ORF1, ORF2, ORF1/1 и ORF2/2 генотипов PTTV или подтипов PTTV1a-VA, PTTV1b-VA, PTTV2b-VA и PTTV2c-VA; контактирование образца сыворотки свиньи, предположительно инфицированной PTTV, с иммобилизованным иммуногенным фрагментом и детектирование захваченного антитела, специфического к иммуногенному фрагменту.
Согласно одному аспекту данного изобретения полинуклеотидная последовательность выбрана из группы, состоящей из ORF1 генотипов PTTV или подтипов PTTV1a-VA, PTTV1b-VA, PTTV2b-VA и PTTV2c-VA.
Согласно одному аспекту данного изобретения полинуклеотидная последовательность представляет собой ORF1 генотипа PTTV1a-VA вируса PTTV.
Согласно другому аспекту данного изобретения полинуклеотидная последовательность представляет собой ORF1 генотипа PTTV1b-VA вируса PTTV.
Согласно еще одному аспекту данного изобретения полинуклеотидная последовательность представляет собой ORF1 подтипа PTTV2c-VA вируса PTTV.
Согласно другому аспекту данного изобретения полипептидная последовательность выбрана из группы, состоящей из последовательностей, представленных SEQ ID NO:13, SEQ ID NO:14, SEQ ID NO:15, SEQ ID NO:16, SEQ ID NO:17, SEQ ID NO:18, SEQ ID NO:19, SEQ ID NO:20, SEQ ID NO:21, SEQ ID NO:22, SEQ ID NO:23, SEQ ID NO:24, SEQ ID NO:25, SEQ ID NO:26, SEQ ID NO:27 и SEQ ID NO:28.
Согласно одному варианту данного изобретения полипептидная последовательность представлена в SEQ ID NO:13. Согласно другому варианту данного изобретения полипептидная последовательность представлена в SEQ ID NO:14. Согласно одному варианту данного изобретения полипептидная последовательность представлена в SEQ ID NO:16. Согласно одному конкретному варианту данного изобретения полипептидная последовательность представляет собой С-концевой участок (а.к. 310-625) SEQ ID NO:16. Согласно другому аспекту данного изобретения полипептидная последовательность представляет собой SEQ ID NO:20.
Настоящее изобретение предусматривает три стандартизованных метода твердофазного иммуноферментного анализа (ELISA) для диагностики инфекций, вызванных PTTV и детектирования антител в сыворотке свиней, которые инфицированы генотипами PTTV1а-VA, PTTV1b-VA вируса PTTV и всеми известными подтипами PTTV типа 2.
Диагностические тесты ELISA основаны на применении экспрессированной бактериями или экспрессированной бакуловирусами ORF1 капсидного белка генотипов PTTV1a-VA, PTTV1b-VA и PTTV2c-VA вируса PTTV.
Согласно другому аспекту данного изобретения детектирование захваченного антитела осуществляется методом Вестерн-блоттинга. Согласно еще одному аспекту данного изобретения детектирование захваченного антитела осуществляется методом твердофазного иммуноферментного анализа (ELISA).
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
Указанные выше признаки изобретения будут более понятны из следующего подробного описания данного изобретения в сочетании с чертежами, на которых:
Фигуры 1А и 1В представляют собой схематическую диаграмму геномных структур, стратегии геномного клонирования и сборки четырех штаммов свиного вируса TTV группы 1 (типа 1) и группы 2 (типа 2), прототипов американского штамма.
На фигуре 2 представлено PASC (парное сравнение последовательностей), сравнение нуклеотидных последовательностей 121 штамма TTV, которые имеются в базе данных GenBank. Показаны род, вид, типы, подтипы, варианты и соответствующие проценты идентичности нуклеотидных последовательностей.
Фигура 3А иллюстрирует филогенетическое дерево, сконструированное методом объединения соседей, основанным на применении полноразмерных геномных нуклеотидных последовательностей.
Фигура 3В иллюстрирует филогенетические деревья, сконструированные на основе предсказанных аминокислотных последовательностей ORF1 с помощью семи штаммов свиного TTV.
Фигура 3С иллюстрирует филогенетические деревья, сконструированные на основе предсказанных аминокислотных последовательностей ORF1/1 с помощью семи штаммов свиного TTV.
Фигура 3D иллюстрирует филогенетические деревья, сконструированные на основе предсказанных аминокислотных последовательностей ORF2 с помощью семи штаммов свиного TTV.
Фигура 3Е иллюстрирует филогенетические деревья, сконструированные на основе предсказанных аминокислотных последовательностей ORF2/2 с помощью семи штаммов свиного TTV.
На Фигуре 4 показано выравнивание полных аминокислотных последовательностей ORF1 среди семи штаммов TTV.
На Фигуре 5 показано выравнивание полных аминокислотных последовательностей ORF2 среди семи штаммов TTV.
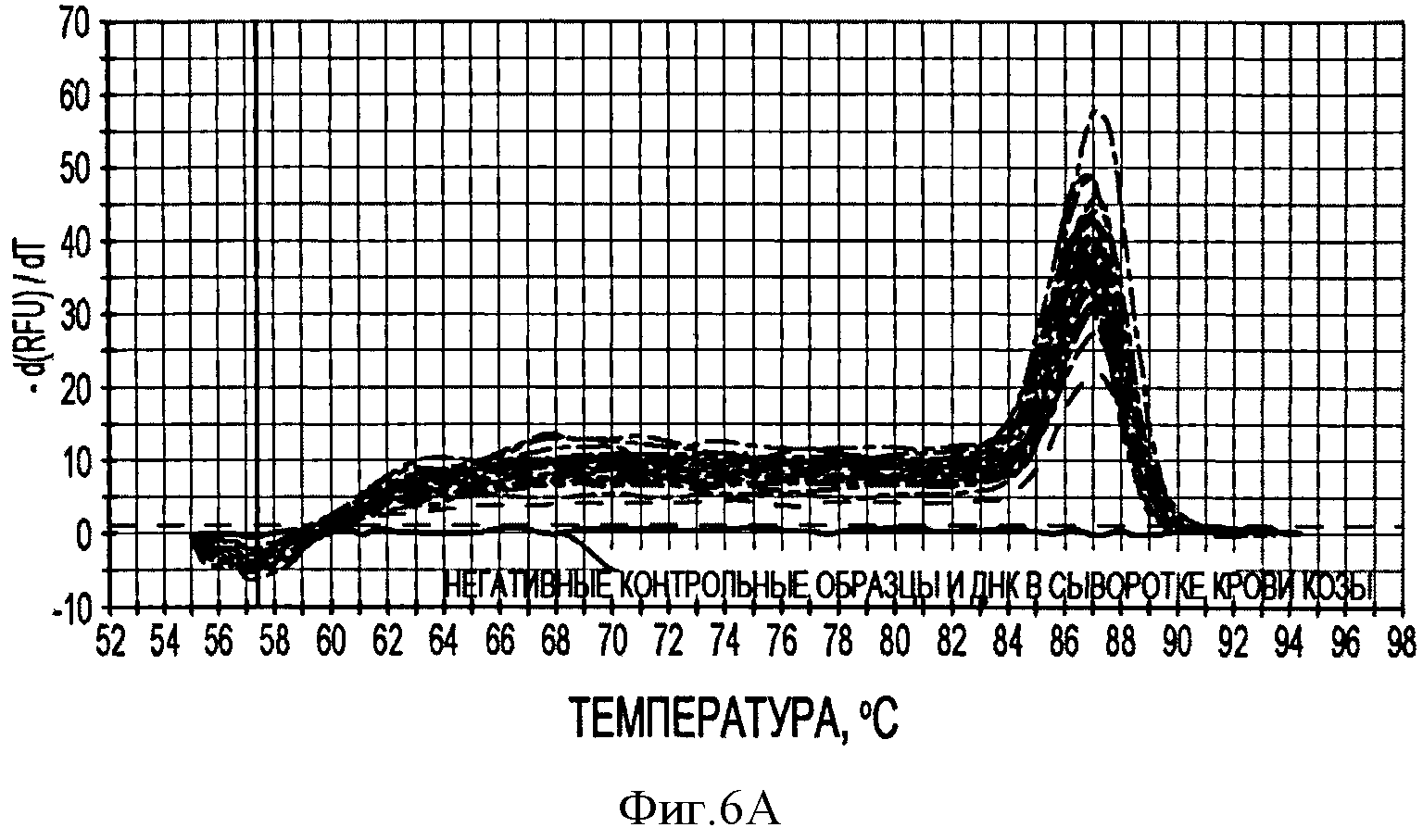
Фигура 6А иллюстрирует кривые плавления продуктов ПЦР PTTV1 в режиме реального времени после 40 циклов амплификации образцов стандартной матрицы (показано голубым цветом) и 20 образцов свиной сыворотки.
Фигура 6В иллюстрирует кривые плавления продуктов ПЦР PTTV2 в режиме реального времени после 40 циклов амплификации образцов стандартной матрицы и 20 образцов свиной сыворотки.
На фигурах 7А-7В показаны результаты анализа кривых плавления (МСА) продуктов дуплексной ПЦР PTTV1/PTTV2 с применением красителя SYBR Green в режиме реального времени.
Фигура 8 представляет выравнивание нуклеотидных последовательностей, расположенных HaN - концевом участке предполагаемой ORF1 для семи штаммов PTTV.
На Фигурах 9А и 9В показаны профили гидрофильности и консервативные участки четырех известных свиных TTV2.
Фигуры 10А и 10В иллюстрируют экспрессию и очистку рекомбинантного капсидного белка ORF1 PTTV2c.
На Фигурах 11А и 11В показаны репрезентативные результаты анализа семи образцов свиной сыворотки методом Вестерн-блоттинга.
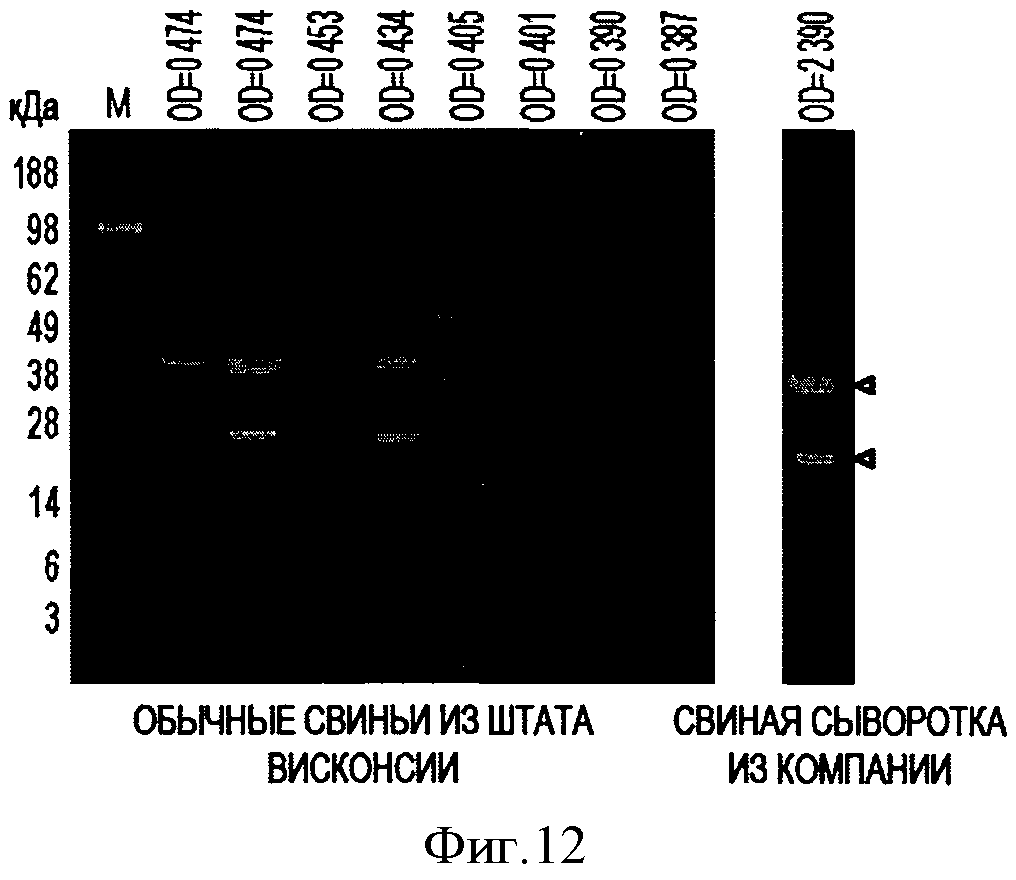
Фигура 12 иллюстрирует согласованность результатов анализа PTTV2-ORF1 методами Вестерн-блоттинга и ELISA.
На Фигуре 13 приведены графики Бокса - Вискера, показывающие зависимость количества антител к PTTV2 в сыворотке свиней от вирусной нагрузки для 138 свиней из разных источников.
Фигура 14А показывает ретроспективную оценку вирусной нагрузки PTTV2.
Фигура 14В отражает количество антител к капсидному белку PTTV2-ORF1 для 10 свиней, выращенных до достижения 2 мес. после прибытия.
Фигуры 15А-15С иллюстрируют стадии экспрессии и очистки рекомбинантного капсидного белка ORF 1 в PTTV1a и PTTV1b и
на Фигуре 16 представлены примеры результатов анализов PTTV1a - ORF1 методом Вестерн-блоттинга в образцах сыворотки, отобранных у свиней на ферме в штате Висконсин.
ОСУЩЕСТВЛЕНИЕ ИЗОБРЕТЕНИЯ
В соответствии с данным изобретением в одном конкретном примере указанные выше четыре новые подтипа свиного вируса TTV были выделены у одного борова в Виргинии.
На Фигуре 1А оба генома PTTV1 и PTTV2 показаны жирным шрифтом и номера и направления четырех предполагаемых ORF (ORF1, ORF2, ORF1/1 и ORF2/2) указаны стрелками. Показаны также участки, обогащенные GC. Пунктирными линиями в кружках А и D показаны участки, использованные для детектирования PTTV1 и PTTV2, соответственно, в образцах сыворотки и спермы методом вложенной ПЦР. Кружки В и С, показанные пунктирными линиями, показывают два перекрывающихся фрагмента ПЦР для геномного клонирования PTTV1, а пунктирные кружки Е и F показывают два перекрывающихся фрагмента ПЦР для геномного клонирования PTTV2. Места положения праймеров, использованных в этом опыте (см. Таблицу 1), также показаны в соответствующих позициях.
Один образец сыворотки, отобранный у борова (SR # 5), дал положительный результат для PTTV1 и PTTV2 в первом раунде ПЦР, что свидетельствует о большей вирусной нагрузке, он был использован для последующего клонирования полных геномов PTTV. Неожиданно оказалось, что первоначальные попытки применения двух наборов праймеров (NG372 / NG373 и NG384 / NG385) в случае обращенной ПЦР для клонирования первого штамма Sd - TTV31 PTTV с целью амплификации вирусной геномной ДНК оказались неудачными (Okamoto et al., 2002, supra). После нескольких попыток продукт ПЦР не был получен.
Основываясь на исходной последовательности участка А PTTV1 и участка D PTTV2, получали две новые пары праймеров (TTVl-If(SEQ ID NO:1)/TTV1-2340R (SEQ ID NO:2) и TTV1-2311F(SEQ ID NO:3)/TTV1-IR(SEQ ID NO:4)) с целью амплификации участков В и С, перекрывающих предполагаемый геном PTTV1, и две дополнительных пары праймеров (TTV2-IF(SEQ ID NO:5)/TTV2-2316R(SEQ ID NO:6) и TTV2-GCF(SEQID NO:7)/TTV2-IR(SEQ ID NO:8)) с целью амплификации участков Е и F, перекрывающих предполагаемый геном PTTV2, соответственно (Фигура 1 А и Таблица 1). Праймеры TTV1-2340R (SEQ ID NO:2) и TTV1-231 IF (SEQ ID NO:3) были получены из общей последовательности в штаммах Sd-TTV31 (Okamoto et al., 2002, supra) и TTV-lp (Niel et al., 2005), которая отсутствует в штамме TTV-2p PTTV2 (Niel et al., 2005, supra), в то время как праймеры TTV2-2316R(SEQID NO:6) и TTV2-GCF(SEQID NO:7) были получены из последовательности штамма TTV - 2р, которая отсутствует в двух штаммах PTTV1. Каждый из полученных четырех разных продуктов ПЦР с ожидаемыми размерами был инсерцирован в клонирующий вектор с тупым концом и полученные рекомбинантные плазмиды были трансформированы в Escherichia coli. Были идентифицированы от восьми до пятнадцати положительных (белого цвета) клонов для каждого конструкта, представляющие фрагменты В, С, Е и F, затем они были секвенированы.


Неожиданно оказалось, что у одной и той же свиньи существуют два типа PTTV в геногруппе 1 и в геногруппе 2, что показало наличие последовательностей в каждом конструкте. Для дифференцировки и сборки четырех штаммов PTTV проводили сравнение последовательностей с тремя известными штаммами PTTV, Sd - TTV31, TTV - 1р и TTV - 2р (Фигуры 1В and 1С).
На Фигуре 1В показаны стадии дифференцировки и сборки полных геномных последовательностей штаммов PTTV 1а - VA и PTTV1b - VA вируса PTTV1 с фрагментами ПЦР В и С, которые затем подвергали клонированию. Инициирующие кодоны ORF1 и ORF2 во фрагменте В, а также терминирующие кодоны ORF1 во фрагменте С отмечены знаками "^" или "*". Соответствующие последовательности двух известных штаммов PTTV1, Sd - TTV31 и TTV - 1р, также показаны. Консервативные последовательности заштрихованы, а пунктиром показаны делеции нуклеотидов.
В случае PTTV1 инициирующий кодон ATG и терминирующий кодон TGA предполагаемой ORF1 расположены во фрагментах В и С, соответственно (Фигура 1В). Расположение кодонов в двух группах PTTV1 было разным, у первого кодона идентично Sd - TTV31 и у второго - идентично TTV - 1р (Фигура 1В). Кроме того, инициирующие кодоны ORF2 в двух группах также располагались в разных местах, что соответствовало ORF1. Более того, филогенетические анализы для четырех разных последовательностей участка В (две по данным секвенирования и две в штаммах Sd - TTV31 и TTV - 1р) и четырех разных последовательностей на участке С подтвердили, что первая последовательность кластеризовалась с Sd - TTV31, а вторая - кластеризовалась с TTV - 1р (эти данные не показаны). Следовательно, мы смогли дифференцировать и собрать две группы библиотек последовательностей из обоих фрагментов В и С в два генома PTTV1 полной длины, которые были обозначены как штаммы PTTV1a-VA (SEQ ID NO:9) and PTTV1b-VA (SEQ ID NO:10), соответственно (см. Фигуру 1 В).
На Фигуре 1С показаны стадии дифференцировки и сборки полных геномных последовательностей штаммов PTTV2b-VA и PTTV2c-VA с фрагментами ПЦР Е и F, которые затем подвергались клонированию. Показана соответствующая последовательность штамма TTV - 2р, а консервативные последовательности заштрихованы. Пунктирными линиями обозначены делеции в нуклеотидах. Соответственно показаны уникальные нуклеотиды с перекрывающимся участком (пунктирные линии) для каждого штамма ("непрерывный" "AG " нуклеотид " в PTTV2b-VA (SEQ ID NO:11) и два единичных нуклеотида "А" и "G" в PTTV2c-VA (SEQ ID NO:12)).
Процесс дифференцировки двух штаммов PTTV2 проходил легче. Уникальный непрерывный "AG " нуклеотид, расположенный на перекрывающемся участке двух ПЦР-фрагментов был общим для двух групп последовательностей из фрагментов Е и F, соответственно (Фигура 1 С). "Собранная" полная геномная последовательность представляла штамм PTTV2 и была обозначена как PTTV2b-VA (SEQ ID NO:11). Подобным образом на основе двух уникальных единичных нуклеотидов "А" и "G", общих для перекрывающегося участка другого набора последовательностей из фрагментов Е и F, соответственно, была собрана полная геномная последовательность второго штамма, обозначенного как PTTV2c - VA (SEQ ID NO:12) (см. Фигуру 1С). Филогенетические анализы с применением четырех последовательностей из фрагментов Е и F вместе с двумя соответствующими последовательностями из TTV - 2р подтвердили эту картину (данные не показаны).
Настоящее изобретение предусматривает получение четырех выделенных генотипов или подтипов свиного вируса TTV, которые ассоциируются с вирусной инфекцией у свиней. Данное изобретение включает, но без ограничения, генотипы или подтипы свиного вируса TTV PTTV1a-VA, PTTV1b-VA, PTTV2b-VA и PTTV2c-VA, при этом эти генотипы или подтипы вируса имеют нуклеотидные последовательности, представленные в SEQ ID NO: 9 (PTTV1a-VA), SEQ ID NO:10 (PTTV1b-VA), SEQ ID NO:11 (PTTV2b-VA) и SEQ ID NO:12 (PTTV2c-VA), их функциональном эквиваленте или в комплементарной нити. Следует иметь в виду, что конкретная нуклеотидная последовательность, полученная из любого свиного TTV, будет иметь небольшие отличия, которые естественно существуют между отдельными вирусами. Эти отличия в последовательностях могут касаться делеций, замещений, инсерций и т.п.
Геномная структура, предложенная для каждого из четырех штаммов PTTV, была подробно проанализирована и приведена в Таблице 2 вместе с данными для трех известных штаммов PTTV, Sd-TTV31, TTV-1р и TTV - 2р. Все четыре американские штаммы PTTV имеют похожий размер геномов, составляющий 2,878 п.о. (PTTV1a-VA SEQ ID NO:9), 2,875 п.о. (PTTV1b-VA SEQ ID NO:10), 2,750 п.о. (PTTV2b-VA SEQ ID NO:11) и 2,803 п.о. (PTTV2c-VA SEQ ID NO:12), соответственно. Оба штамма PTTV1a - VA (SEQ ID NO:9) и Sd - TTV31 имели одну и ту же длину генома. Описанные ранее последовательности в штаммах TTV-1р и TTV-2р все содержат многочисленные неохарактеризованные нуклеотиды на участке UTR, обогащенном GC. После искусственного заполнения этих нуклеотидов консенсусными последовательностями, соответствующими PTTV1 и PTTV2, было показано, что TTV-1p более тесно связан с PTTV1b-VA (SEQ ID NO:10) и что TTV-2p более тесно связан с PTTV2b-VA (SEQ ID NO:11) в геноме, соответственно (данные не приведены).
Собранные геномные последовательности генотипов и подтипов свиного вируса TTV, PTTV1a-VA (SEQ ID NO:9), PTTV1b-VA (SEQ ID NO:10), PTTV2b-VA (SEQ ID NO:11) и PTTV2c-VA (SEQ ID NO:12) были зарегистрированы в Genbank® (Nucleic Acids Research, 2008 Jan, 36 (Database issue): D25-30) под номерами доступа GU 456383, GU 456384, GU456385 и GU456386, соответственно.
В ходе двух недавно проведенных исследований были идентифицированы транскрибированные вирусные мРНК и экспрессия по меньшей мере шести вирусных белков во время репликации человеческого TTV (Mueller et al., 2008, supra; Qiu et al., 2005, supra), что больше, чем предсказанное количество ORF, кодированных человеческим TTV (Okamoto, H., Nishizawa, Т., Tawara, A., Takahashi, M., Kishimoto, J., Sai, Т., and Sugai, Y. (2000b). TT virus mRNAs detected in the bone marrow cells from an infected individual. Biochem. Biophys. Res. Commun. 279 (2), 700-7), поэтому мы включили информацию о новом TTV человека для сравнения с последовательностями PTTV. 5' -концы мРНКислот были картированы в нуклеотид "А", который расположен на 25 нуклеотидов ниже по ходу транскрипции ТАТА-бокса (Mueller et al., 2008, supra). Это исходная точка, ее соседняя последовательность (CGA.K.TGGCTGAGTTTATGCCGC (SEQ ID NO:39); исходная точка подчеркнута) и расстояние до расположенного против направления транскрипции ТАТА-бокса (24 нуклеотида; Таблица 2) являются очень консервативными во всех семи штаммах PTTV, что позволяет предположить, что PTTV и человеческий TTV могут использовать общий 5'-конец мРНК для трансляции.
Вблизи ТАТА-бокса были идентифицированы пять дополнительных полностью консервативных участка во всех семи штаммах PTTV. Два участка длиной 11 нуклеотидов каждый (AGTCCTCATTT (SEQ ID NO:40) и A.K.CCA.K.TCAGA (SEQ ID NO:41)) расположены вверх по течению ТАТА-бокса, в то время как три остальных участка (CTGGGCGGGTGCCGGAG из 17 нуклеотидов (SEQ ID NO:42); CGGAGTCA.K.GGGGC из 14 нуклеотидов (SEQ ID NO:43); TATCGGGCAGG из 11 нуклеотидов (SEQ ID NO:44)) расположены между предложенным 5'-концом мРНК и инициирующим ко доном ORF2. Эти консервативные PTTV-консервативные последовательности могут содержать общие элементы, которые регулируют экспрессию вирусного гена.
Ранее три ORF (ORF 1-3) были предложены в геном трех известных штаммов PTTV, соответственно (Niel et al., 2005, supra, Okamoto et al., 2002, supra).
Четыре штамма PTTV из США, являющиеся прототипами в этом исследовании, имеют эту структуру. Соответствующая ORF3 в человеческом TTV была переименована в ORF2/2, так как она инициирует тот же самый кодон ATG в ORF2 и она остается в той же самой ORF (продлевая ее) после сплайсинга (Фигура 1А) (Mueller et al., 2008, supra, Qiu et al., 2005, supra). Мы следуем номенклатуре человеческого TTV для пересмотра классификации PTTV в этом исследовании. ORF1 / 1 человеческого TTV представляет собой впервые идентифицированный вирусный белок, который кодируется двумя экзонами в ORF1 (Qiu et al., 2005, supra). ORF1/1 и ORF1 имеют общую идентичную N- и С-часть. Противоположная часть ORF1/1 в PTTV легко идентифицируется во всех семи штаммах PTTV.
В человеческом TTV ORF1 и ORF2 кодируются вирусной мРНК с примерно 2,8 т.н. (тысячи нуклеотидов), в то время как ORF1/1 и ORF1/2 кодируются расщепленной вирусной мРНК с примерно 1,2 т.н. (Mueller et al., 2008, supra; Qiu et al., 2005, supra). Так как эти четыре ORF в геномах PTTV были расшифрованы и так как последовательности и положения в предполагаемом доноре сплайсинга и акцепторные сайты в семи штаммах PTTV являются очень консервативными (см. Таблицу 2), считают, что свиной TTV, по всей видимости, также кодирует две соответствующих мРНК.
Многие штаммы человеческого TTV генетически похожи на CAV, кодирующий белок TTV, индуцирующий апоптоз (TAIP), в котором противоположная часть CAV была названа апоптином (de Smit, М. Н., and NOtebom, М. Н. (2009). Apoptosis-inducing proteins in chicken anemia virus and TT virus. Curr Top Microbiol ImmuNOl 331, 131-49). ORF TAIP была внедрена в ORF2. Однако в свином TTV не существует соответствующий TAIP. Проведенное недавно исследование показало, что экспрессия апоптина или TAIP требуется для репликации CAV в культивированных клетках (Prasetyo, A.A., Kamahora, Т., Kuroishi, A., Murakami, K., and HiNO, S. (2009). Репликация вируса анемии цыплят требует наличия апоптина и дополняется VP3 человеческого вируса торкве тено (TTV) (Virology 385(1), 85-92).
Парное сравнение последовательностей (PASC) представляет собой полезный метод, который позволяет построить график зависимости частоты распределения процента идентичности парных последовательностей нуклеотидов от всех доступных геномных последовательностей вирусов в том же самом семействе (Bao, Y., Kapustin, Y., and Tatusova, T. (2008). Virus Classification by Pairwise Sequence Comparison (PASC). In "Encyclopedia of Virology, 5 vols." (B.W.J. Mahy, and М.Н.V. Van Regenmortel, Eds.), Vol.5, pp.342-8. Elsevier, Oxford). Различные пики, генерированные программой PASC, обычно отражают группы родов, видов, типов, подтипов и штаммов (см. Фигуру 2).
В этом исследовании мы провели PASC TTV с использованием 121 полной геномной последовательности человеческих и животных штаммов, относящихся к TTV, доступных в базе данных GenBank (Фигура 2). С учетом предположения, что члены TTV классифицируются в отдельном семействе, Anelloviridae, два пика, соответствующие 36-55% и 55-67% идентичности нуклеотидных последовательностей, представляют группы родов и видов, соответственно (Фигура 2). Соответственно, тип TTV определяется как группа TTV, имеющих 67-85% идентичности нуклеотидных последовательностей, а подтип TTV определяется как группа TTV, имеющих 85-95% идентичности нуклеотидных последовательностей. Штаммы TTV, имеющих более 95% идентичности нуклеотидных последовательностей далее могут быть расклассифицированы на варианты (см. Фигуру 2). Похожая классификация для последовательностей изолятов 103 TTV была предложена Jelcic et al (Jelcic, I., Hotz-Wagenblatt, A., Hunziker, A., Zur Hausen, H., and de Villiers, E. M. (2004). Isolation of multiple TT virus geNOtypes from spleen biopsy tissue from a Hodgkin's disease patient: geNOme reorganization and diversity in the hypervariable region. J Virol 78(14), 7498-507).
Эти предложенные критерии классификации TTV были применены при проведении филогенетических анализов геномных последовательностей 4 прототипов, штаммов из США, и 3 других известных штаммов PTTV. Парное сравнение полных нуклеотидных последовательностей этих штаммов показало, что четыре штамма PTTV1 имеют 54,0-56,4% идентичности нуклеотидных последовательностей по сравнению с тремя штаммами PTTV2 (Таблица 3). Следовательно, ранее указанную в литературе "геногруппу" PTTV, вероятно, следует назвать "видом", а PTTV1 и PTTV2 будут являться видами 1 и 2 свиного TTV, соответственно. Вид 1 PTTV состоит из двух типов вирусов, обозначенных как тип 1а (включая TTV - 1р и PTTV1b-VA (SEQ ID NO:10)), соответственно, так как идентичность нуклеотидных последовательностей в этих двух типах вирусов составляет 69,8-70,7% (см. Таблицу 3). Sd - TTV31 и TTV 1a - VA (SEQ ID NO:9) признаются вариантами штаммов одного и того же вида из-за высокой величины процента идентичности их нуклеотидных последовательностей (95,1%). Однако два штамма типа 1b, TTV - 1р и PTTV1b-VA (SEQ ID NO:10), могут относиться к двум различным подтипам (идентичность нуклеотидных последовательностей составляет 86,4%). Для вида 2 PTTV три штамма, вероятно, следует классифицировать в отдельных подтипах (TTV - 2р для подтипа 2а, PTTV2b-VA SEQ ID NO:11) для подтипа 2b и PTTV2c-VA (SEQ ID NO:12) для подтипа 2с, соответственно, на основе величины процента идентичности их нуклеотидных последовательностей равной 86,5-90,9%. Эта предложенная новая система классификации PTTV отчетливо видна на филогенетическом дереве (см. Фигуру 3).
Филогенетические деревья, построенные на основе предполагаемых аминокислотных последовательностей в ORF1, ORF1/1, ORF2 и ORF2/2 в PTTV, также согласовывались с этой предложенной классификации (см. Фигуры 3В-3Е).
Эти данные были получены с применением программы PASC, а цифры показывают % идентичности нуклеотидных последовательностей.
Уникальные мутации, делеции и/или инсерции рассеяны по всем геномам в различных видах, типах и подтипах PTTV. Например, положение инициирующих и терминирующих кодонов ORF1 и инициирующих кодонов ORF2, показанное на Фигуре 1 В, отличается в типах 1а и 1b PTTV. Два штамма PTTV1b также содержат делецию 2-кодона после инициации ORF2 в отличие от PTTV1 а (см. Фигуру 1В).
Следует отметить, что оба TTV - 2р и PTTV2b - VA харктеризуются делецией 52 т.н., которая находится на расстоянии в 39 т.н. вверх по течению от первой консервативной последовательности длиной 11 т.н (AGTCCTCATTT (SEQ ID NO:40)) в UTR, по сравнению с PTTV2c - VA. Из - за этой делеции размер генома PTTV2b-VA (вероятно, и TTV - 2р) был значительно меньше, чем размер генома PTTV2c-VA (см. Таблицу 2). Ряд клонов субвирусного человеческого TTV был выделен из образцов сыворотки. Они рассматриваются как полные геномы TTV, так как ORF в большинстве этих субвирусных молекул остаются интактными (de Villiers et al., 2009; Leppik et al., 2007). Они имеют переменную длину в UTR и полностью или частично делецируются. Состояние TTV - 2р и PTTV2b-VA напоминает состояние субвирусных молекул TTV у человека, что означает, что подтипы PTTV2a и PTTV2b могут быть субвирусными молекулами, полученными из подтипа PTTV2c. Следует отметить, что 3'-концевая последовательность праймера TTV2-nF при вложенной ПЦР (см. Таблицу 1), который обычно применяется для детектирования PTTV2 в полевых образцах другими группами (Ellis et al., 2008, supra; Kekarainen et al., 2007, supra; Kekarainen et al., 2006, supra; Krakowka et al., 2008, supra) расположена на обеих сторонах делеции. Следовательно, применяемый в настоящее время для детектирования PTTV2 метод вложенной ПЦР, по всей видимости, не является достаточным для идентификации генетически отличающихся различных генетически отличающихся штаммов подтипа PTTV2c.
Источником выделенного вирусного штамма являются образцы сыворотки, фекалий, слюны, спермы и тканей свиней, инфицированных вирусом TTV. Однако предполагается, что метод с применением рекомбинантной ДНК может быть использован для репликации и химического синтеза нуклеотидной последовательности. Следовательно, данное изобретение предусматривает выделенный полинуклеотид, который содержит, но без ограничения, нуклеотидную последовательность, представленную в SEQ ID NO:9, SEQ ID NO:10, SEQ ID NO:11 и SEQ ID NO:12, или ее комплементарной нити; полинуклеотид. который гибридизуется и комплементарен по меньшей мере на 67% нуклеотидной последовательности, представленной в SEQ ID NO:9, SEQ ID NO:10, SEQ ID NO:11 и SEQ ID NO:12, предпочтительно комплементарен на 85% или более предпочтительно комплементарен на 95%; или иммуногенный фрагмент, выбранный из группы, состоящей из аминокислотной последовательности белка ORF1, представленного в SEQ ID NO:13 (PTTV1a-VA), SEQ ID NO:14 (PTTV1b-VA), SEQ ID NO:15 (PTTV2b-VA), SEQ ID NO:16 (PTTV2c-VA), аминокислотной последовательности белка ORF2, представленного в SEQ ID NO:17 (PTTV1a-VA), SEQ ID NO:18 (PTTV1b-VA), SEQ ID NO:19 (PTTV2b-VA), SEQ ID NO:20 (PTTV2c-VA), аминокислотной последовательности белка ORF1/ 1, представленного в SEQ ID NO:21 (PTTV1a-VA), SEQ ID NO:22 (PTTV1b-VA), SEQ ID NO:23 (PTTV2b-VA), SEQ ID NO:24 (PTTV2c-VA), аминокислотной последовательности белка ORF2/2, представленного в SEQ ID NO:25 (PTTV1a-VA), SEQ ID NO:26 (PTTV1b-VA), SEQ ID NO:27 (PTTV2b-VA), SEQ ID NO:28 (PTTV2c-VA).
Иммуногенные и антигенные кодирующие участки могут быть определены методами, известными в уровне техники, и затем они могут быть применены для получения моноклональных или поликлональных антител для скрининга иммунореактивности или для других диагностических целей. Данное изобретение предусматривает также очищенный иммуногенный белок, кодированный выделенными полинуклеотидами. Желательно, чтобы белок был выделенным или рекомбинантным белком ORF1 или белком ORF2, содержащимся в по меньшей мере одном из упомянутых выше выделенных подтипов TTV, более желательно, чтобы такой белок был белком ORF1.
Полагают, что ORF1 свиного TTV кодирует структурный белок, ассоциированный с репликацией (Maggi, F., and Bendinelli, M. (2009). InunuNObiology of the Torque teNO viruses and other anelloviruses. Curr Top Microbiol Immunol 331, 65-90). ORF1 - кодирующие продукты семи штаммов PTTV имеют длину равную 624-635 а. к. и содержат большое количество аргининовых остатков на своем N-конце, которые, как полагают, обладают ДНК-связывающей активностью (см. Фигуру 4). На Фигуре 4 консервативные последовательности заштрихованы. Пунктирными линиями обозначены аминокислотные делеции. Мотивы RCR (тип репликации - репликация по типу катящегося кольца) показаны сплошными линиями. Три HVRs (гипервариабельные области) (PTTV1 - HVRs 1, 2 и 3) в штаммах PTTV1 и две HVRs (PTTV2 - HVRs 1 и 2) в штаммах PTTV2 показаны пунктирными линиями. Границы соединения ORF1/1 указаны стрелками. Предсказанные мотивы репликации по типу катящегося кольца (RCR) (Ilyina, Т.V., and Koonin, E.V. (1992). Conserved sequence motifs in the initiator proteins for rolling circle DNA replication encoded by diverse replicons from eubacteria, eucaryotes and archaebacteria. Nucleic Acids Res. 20(13), 3279-85) находятся в различных положениях в различных типах и подтипах PTTV, которые могут быть тип- или подтип -специфическими. Мотив - III RCR является консервативным в штаммах PTTV типа 1а (положение а. к. 14-17 в PTTV1a - VA SEQ ID NO:13) и в штаммах типа 1b (положение а. к. 379-382 в PTTV1b - VA SEQ ID NO:14), соответственно, в то время как тот же самый консервативный мотив, идентифицированный во всех трех штаммах PTTV2, расположен в положении а.к. 482-485 PTTV2b - VA SEQ ID NO:15 (Фигура 4). Оба PTTV2b - VA SEQ ID NO:15 и PTTV2c - VA SEQ ID NO:16 также содержат консервативный мотив - II RCR (HxQ) в положении а.к. 331-333 в PTTV2b-VA, который отсутствует в TTV-2p (см. Фигуру 4).
Белки ORF в штаммах PTTV видов 1 и 2 имеют очень низкую величину процента идентичности последовательностей, составляющую только 22,4-25,8%, что делает трудной идентификацию очень консервативных аминокислотных последовательностей в двух видах (см. Фигуру 4). Процент идентичности а.к. ORF1 в PTTV, вид 1, штаммы типа 1а и 1b, составляет 50,3-52,7%. В четырех штаммах PTTV1 были идентифицированы три основных гипервариабельных области (HVR), PTTV1 - HVRs 1-3, с довольно большим количеством аминокислотных замещений, в то время как в трех штаммах PTTV2 наблюдались две HVRs (PTTV2 - HVRs 1 и 2) (см. Фигуру 4). Три штамма PTTV2 имеют примерно 20 аминокислотных делеций в соответствующей области PTTV1 - HVR1. Более того, две HVRs PTTV2 расположены в соответствующей области PTTV1 -HVR3 (см. Фигуру 4). Три HVRs расположены только в ORF1, но не в усеченной ORF1/1. Они, вероятно, играют роль в ускользании от иммунологического надзора за хозяином и способствуют возникновению устойчивой инфекции PTTV, о чем свидетельствует изучение человеческого TTV.
Аминокислотные последовательности в ORF2 значительно различаются в четырех штаммах PTTV1 (PTTV1a-VA SEQ ID NO:17; PTTV1b-VA SEQ ID NO:18) и трех штаммах PTTV2 (PTTV2b-VA SEQ ID NO:19; PTTV2c-VA SEQ ID NO:20) (см. Фигуру 5). Однако они содержат общий консервативный протеин-тирозин-фосфатаза-подобный (PTPase) мотив (Wx7Hx3CxCx5H) на N-конце (см. Фигуру 4). Этот мотив также является консервативным во всех штаммах TTV, TTMV и TTMDV человека, а также CAV. Белок ORF2 TTMV или CAV также проявлял активность серин/треонин/фосфатазы (S/Т Ppase) (Peters, M.A., Jackson, D. С., Crabb, В. S., and Browning, G. F. (2002). Chicken anemia virus VP2 is a NOvel dual specificity protein phosphatase. J. Biol. Chem. 277(42), 39566 - 73). Как полагают, двойная специфичность белка ORF2 регулирует транскрипцию гена хозяина, сигнальную трансдукцию и реакцию цитокинов во время репликации вирусов. Недавно анализ мутагенеза двух консервативных основных аминокислотных остатков перед последним гистидиновым остатком мотива в CAV показал, что эти два остатка влияют на репликацию вируса, цитопатологию in vitro и аттенюацию in vivo (Peters, M.A., Crabb, B. S., Washington, E. A., and Browning, G.F. (2006). Site-directed mutagenesis of the VP2 gene of Chicken anemia virus affects virus replication, cytopathology and host-cell MHC class I expression. J. Gen. Virol. 87(Pt 4), 823-31; Peters, M.A., Crabb, B.S., Tivendale, K. A., and Browning, G. F. (2007). Attenuation of chicken anemia virus by site-directed mutagenesis of VP2. J. Gen. Virol, 88(Pt 8), 2168-75). Два основных аминокислотных остатка ("KK") являются консервативными в трех штаммах PTTV2. Однако только первый основной остаток ("R") сохраняется в двух штаммах PTTV2, в то время как оба основных остатка в штаммах PTTV1b замещены (см. Фигуру 5). На Фигуре 5 пунктирные линии показывают аминокислотные делеций. Пять консервативных аминокислот в общем мотиве Wx7Hx3CxCx5H (подчеркнут), идентифицированные в TTV, TTMV и CAV, заштрихованы. Положения двух аминокислотных остатков перед последним гистидиновым остатком указанного мотива, которые, как было показано, влияют на репликацию вируса, цитопатологию вируса и in vivo аттенюацию в CAV, обозначены значком "^".
Суммируя вышесказанное, следует отметить, что настоящее изобретение позволило определить в образце сыворотки одного борова из штата Виргиния полные геномные последовательности четырех штаммов свиного TTV, представляющих различные генотипы или подтипы этого вируса. Данные, полученные в результате данного исследования, ясно показывают, что, как и в случае человеческого TTV, существуют многочисленные виды инфекции, вызванные различными генотипами и подтипами PTTV, вероятно, являющиеся общими для свиней. Мы также получили новую информацию, касающуюся организации геномов, степени вариабельности и характеристик консервативных нуклеотидных и аминокислотных мотивов PTTV, которая позволит усовершенствовать существующий в настоящее время метод детектирования с применением ПЦР, поможет получить реагенты для серологической диагностики и инициировать структурное и функциональное изучение PTTV. Предложена также новая классификация PTTV, основанная на филогенетических и генетических анализах геномных последовательностей семи известных штаммов PTTV.
Данное изобретение предусматривает также способы диагностики инфекции, вызванной свиным TTV, путем детектирования вирусной ДНК в образцах, отобранных у свиней или других млекопитающих, инфицированных свиным TTV. Один предпочтительный вариант данного изобретения относится к способам детектирования последовательностей нуклеиновых кислот в свином TTV у свиней и других видов млекопитающих с помощью олигонуклеотидных праймеров для полимеразной цепной реакции (PCR) с целью последующей диагностики вирусной инфекции или заболевания. Диагностические тесты, которые пригодны для обнаружения наличия или отсутствия последовательности вирусной нуклеиновой кислоты в свином TTV у свиней или других видов млекопитающих, включают выделение вирусной ДНК из образцов, отобранных у свиней, инфицированных свиным TTV, или у свиней, у которых подозревают наличие такой инфекции, и проведение количественной ПЦР в режиме реального времени в присутствии красителя SYBR Green и РТТ VI-специфического (SEQ ID NO:29/SEQ ID NO:30) или PTTV2-специфического (SEQ ID NO:31/SEQ ID NO:32) праймеров.
В соответствии с другим вариантом данного изобретения метод диагностики можно адаптировать для одновременного детектирования PTTV1 и PTTV2 путем применения метода дуплексной ПЦР в режиме реального времени. Более конкретно, метод включает выделение вирусной ДНК из образцов, отобранных у свиней, инфицированных свиным TTV, или у свиней, у которых подозревают наличие такой инфекции, осуществление ПЦР в режиме реального времени с помощью обоих PTTV1 -специфического (SEQ ID NO:29/SEQ ID NO:30) или PTTV2-специфического (SEQ ID NO:31/SEQ ID NO:32) праймеров при проведении той же реакции ПЦР в режиме реального времени. Так как величина Tm у PTTV1 и PTTV2 может быть определена методом МСА, наличие ДНК PTTV1 и PTTV2 может быть определено одновременно.
Согласно еще одному варианту данного изобретения способ диагностики может использовать метод дуплексной вложенной ПЦР. Способ включает выделение вирусной ДНК из образцов, отобранных у свиней, инфицированных свиным TTV, или у свиней, у которых подозревают наличие такой инфекции, осуществление первого раунда ПЦР с помощью одной пары праймеров P1ab-mF (SEQ ID NO:33)/P1ab-mR (SEQ ID NO:34) и проведение второго раунда ПЦР с помощью смеси двух пар праймеров, P1a-nF (SEQ ID NO:35)/P1a-nR (SEQ ID NO:36) для детектирования PTTV1a и P1b-nF (SEQ ID NO:37)/P1b-nR (SEQ ID NO:38) для детектирования PTTV1b и визуализации продуктов ПЦР.
Указанные выше способы диагностики могут быть оптимизированы специалистом в данной области с учетом методов, хорошо известных из уровня техники.
Соответственно, один из вариантов данного изобретения относится к двум новым одноплексным способам анализа путем проведения ПЦР в присутствии красителя SYBR Green в режиме реального времени для количественного определения вирусных нагрузок двух видов свиного TTV, соответственно. PTTV1- и PTTV2-специфические праймеры были получены для нацеливания (таргетирования) на очень консервативные области в шести геномах PTTV1 и четырех геномах PTTV2, соответственно, доступных в настоящее время. Другой вариант данного изобретения объединяет два одноплексных способа анализа в способ дуплексной ПЦР в режиме реального времени с последующим МСА вирусных ампликонов, которые могут быть идентифицированы по их отличающимся температурам плавления, с целью одновременного детектирования двух видов свиного TTV, PTTV1a и PTTV1b. Согласно третьему варианту метод анализа с применением дуплексной вложенной ПЦР для одновременной амплификации вирусных ДНК из двух типов PTTV1 в первом раунде ПЦР и дифференциального детектирования типов 1а и 1b во втором раунде ПЦР был разработан для идентификации двух типов видов свиного TTV, PTTV1a и PTTV1b, в одном образце. Эти анализы представляют собой простые и практичные методы диагностики вид-специфических и тип-специфических свиных TTV.
Последовательности потенциальных праймеров были идентифицированы путем выравнивания множества последовательностей 10 полных геномов доступного свиного TTV. PTTV1-специфические праймеры TTV1F (SEQ ID NO:29) и TTV1R (SEQ ID NO:30) были сконструированы на основе двух консервативных областей генома, расположенных непосредственно перед предполагаемой ORF2 в шести геномах PTTV1, в то время как PTTV2- специфические праймеры TTV2F4 (SEQ ID NO:31) и TTV2R4 (SEQ ID NO:32) были сконструированы на основе двух консервативных областей генома, расположенных сразу же за предполагаемой ORF2/2 в четырех геномах PTTV2 (см. Таблицу 4). Праймеры не проявили склонности к самодимеризации и к кросс-димеризации. Ожидаемые размеры ампликонов составляли 118 п.о. фрагмента из праймеров PTTV1, соответствующих геному PTTV1b-VA и 200 п.о. фрагмента из праймеров PTTV2, соответствующих геному PTTV2c-VA, соответственно.

Соответственно одному конкретному варианту данного изобретения метод ПЦР в режиме реального времени с применением красителя SYBR Green, использующий PTTV1- и РТТУ2-специфические праймеры, может быть применен специально для детектирования ДНК свиного TTV1 и TTV2, соответственно. В случае PTTV1 была построена стандартная кривая в интервале концентраций целевой ДНК в 25 мкл. Для интервала, составляющего 4,4×101-4,4×108 копий, была показана линейная зависимость. Предел минимального детектирования (44 копии) соответствовал пороговому циклу реакции (Ci), равному 33,57. В случае PTTV2 была также построена стандартная кривая и использована для детектирования концентрации ДНК в пределах от 8,6×100 до 8,6×108 копий в 25 мкл реакционной среды. Соответствующий Ci минимального предела детектирования (8,6 копий) составлял 36,53.
В соответствии с другим конкретным вариантом данного изобретения метод дуплексной вложенной ПЦР с применением SYBR Green применяется для одновременного детектирования ДНК свиных TTV1 и TTV2. Разница величин Tm у PTTV1 (87,0°С) и PTTV2 (80,0°С), составляющая 7°, дает возможность отличить один от другого с помощью МСА. Следовательно, два метода одноплексного анализа могут быть соединены в один метод дуплексной ПЦР в режиме реального времени для одновременного детектирования PTTV1 и PTTV2. Положительный образец был образцом, который имел симметричный пик плавления среди Tm для этого продукта. Этот новый метод анализа сначала был подтвержден с использованием 10-кратного разбавления смеси стандартов PTTV1 и PTTV2. Нематричный негативный контроль, использующий стерильную воду в качестве матрицы, показал протекание неспецифической амплификации, вызванной кросс-димеризацией между праймерами PTTV1 и PTTV2, не наблюдаемой при проведении одноплексных анализов (см. Фигуру 7А). Это привело к отчетливому пику плавления между 72,0°С и 76,0°С. На Фигуре 7А показаны пики температур плавления стандарта PTTV1 (красный цвет; Tm=87,0°С), стандарта PTTV2 (зеленый цвет; Tm=80,0°С) и нематричного негативного контроля (вызванного кросс-димеризацией праймеров; черный цвет). На Фигурах 7В-7Е показаны пиковые температуры плавления репрезентативных образцов сыворотки с различными вирусными нагрузками PTTV1 и PTTV2. На Фигуре 7В показан образец №5 сыворотки борова: относительно высокие нагрузки PTTV1 и PTTV2, но PTTV2>PTTV1; Фигура 7С показывает образец №12 сыворотки борова: относительно высокие нагрузки PTTV1 и PTTV2, но PTTV1>PTTV2; Фигура 7D показывает образец №14 сыворотки борова: низкие нагрузки PTTV1 и PTTV2; Фигура 7Е показывает образец №10 сыворотки борова: PTTV1 положительный, но PTTV2 отрицательный. Вирусные нагрузки (единица: геномные копии/мл) PTTV1 и PTTV2 в каждом образце, которые были определены методом одноплексной ПЦР в режиме реального времени, указаны сверху соответствующего пика температуры плавления.
В одном примере, когда для анализа 20 образцов сыворотки, отобранных у взрослых боровов, применяли метод дуплексного анализа в режиме реального времени, образцы со сравнительно высокими вирусными нагрузками обоих PTTV1 и PTTV2 характеризовались двумя различающимися кривыми плавления, соответствующими PTTV1 и PTTV2 без неспецифического пика температуры плавления (Фигуры 7В-7С), в то время как образцы с низкой вирусной нагрузкой или PTTV1, или PTTV2 имели вирус-специфические, а также неспецифические кривые плавления (см. Фигуры 7D-7Е). Хотя два пика температуры плавления для образца №14, были низкими, они рассматривались как позитивные, так как они характеризовались визуально отличающимся и симметричным подъемом и падением соответствующей Tm PTTV1 и PTTV2 (см. Фигуру 7D). В противоположность этому образец №10 рассматривался как позитивный только в отношении PTTV1, так как симметричный пик температуры плавления PTTV2 отсутствовал (см. Фигуру 7Е). Эти результаты согласовывались с результатами двух одноплексных анализов (см. Таблицу 5). Более того, размер и форма пиков плавления качественно отражали соответствующую вирусную нагрузку в детектируемом образце.
Согласно еще одному аспекту данного изобретения способ дуплексной вложенной ПЦР применяется для дифференциального детектирования двух типов свиного TTV, PTTV1 и PTTV2.
Изобретатель данного изобретения продемонстрировал существование двух различных генотипов свиного TTV вида 1, обозначенных как PTTV1 а и PTTV1b. Для того чтобы установить, является ли ко-инфекция, вызванная PTTV1 а и PTTV1b, распространенной болезнью у свиней, был разработан новый способ дуплексной вложенной ПЦР для быстрого определения различия между этими двумя генотипами. Выравнивание геномных последовательностей ДНК свиного TTV позволило идентифицировать консервативную область генома, расположенную в N-концевой части предполагаемой ORF1, кодирующей вирусный капсидный белок (см. Фигуру 8). Эта область содержит также полную ORF2 и неполную UTR вверх по течению. Были сконструированы праймеры P1ab-mF (SEQ ID NO:33)/P1ab-mR (SEQ ID NO:34) для одновременной амплификации ДНК и PTTV1 а, и PTTV1b в первом раунде ПЦР. Для дифференциальной амплификации каждого генотипа во время второго раунда ПЦР была использована смесь PTTV la-специфических праймеров P1a-nF (SEQ ID NO:35)/P1a-nR (SEQ ID NO:36) и PTTV1b-специфических праймеров P1b-nF (SEQ ID NO:37)/P1b-nR (SEQ ID NO:38). Конечные продукты ПЦР для PTTV1a и PTTV1b имели размер 162 п.о. и 96 п.о., соответственно, их можно очень легко отличить друг от друга методом гелевого электрофореза на 1%-ном геле агарозы, окрашенном этидийбромидом. Не ожидают, что этот метод анализа позволит детектировать ДНК PTTV2 из-за специфичности праймеров (см. Фигуру 8). На Фигуре 8 консервативные последовательности показаны точками и заштрихованы. Пунктирными линиями показаны нуклеотидные делеции. Расположение и направления трех пар праймеров, примененных для дуплексной вложенной ПЦР, были отмечены стрелками.
В одном примере 20 образцов сыворотки, отобранных у взрослых боровов, подвергали анализу методом дуплексной вложенной ПЦР и оказались позитивными для PTTV1a и PTTV1b, о чем свидетельствовала визуализация двух полос ожидаемых размеров, с последующим подтверждением продуктов ПЦР секвенированием (данные не показаны). В 19 образцах спермы не были амплифицированы продукты ПЦР, что согласовывалось с результатами обычной вложенной ПЦР для PTTV1 и ПЦР в режиме реального времени, описанными выше.
В ходе ретроспективного исследования (Segales et al., 2009, supra) было установлено, что инфекция, вызванная двумя видами свиного TTV, была у свиней в 1985 г на испанских свиных фермах. Однако вопрос о том, связаны ли свиные TTV с какими-либо болезнями у свиней, остается нерешенным. Так как оба вида свиного TTV широко распространены у домашних свиней, определение вирусных нагрузок TTV, вероятно, является более важным, чем установление наличия ДНК TTV. Было показано, что уровень вирусной нагрузки в образцах сыворотки и спермы является важным маркером для PCVAD при инфекции PCV2 (Opriessnig et al., 2007, supra). Следовательно, наличие методов количественного PTTV-специфического анализа с применением ПЦР в режиме реального времени поможет идентифицирвоать условия потенциального заболевания, связанного со свиными TTV.
Недавно были описаны два способа анализа с применением ПЦР в режиме реального времени, основанные на пробах TaqMan. Способ одноплексного анализа, разработанный канадской группой, не был вид-специфическим и был разработан только для количественного определения общих вирусных нагрузок двух видов PTTV (Brassard et al., 2009, supra). Способ дуплексного анализа, предложенный немецкой группой, позволил осуществить специфическое и одновременное детектирование обоих видов (Gallei et al., 2009, supra). Таргетируемые последовательности праймеров, использованных при проведении этих анализов, были определены путем выравнивания трех геномных последовательностей свиного TTV (Sd-TTV31, TTV-1p и TTV-2p) и были расположены в UTR. В ходе настоящего исследования с помощью 7 дополнительных доступных полных геномных последовательностей PTTV (4 последовательности PTTV1 и 3 последовательности PTTV2) мы проанализировали и снова определили консервативные области в 10 полных геномах PTTV. На основе скорректированного результата такого выравнивания, полученного в ходе указанного исследования, были разработаны два вид-специфических методов одноплексной ПЦР в режиме реального времени в присутствии красителя SYBR Green для количественного определения вирусных нагрузок PTTV1 и PTTV2, соответственно. Праймеры, использованные в наших методах, которые могут увеличить точность количественного определения, были сконструированы для связывания с консервативными геномными областями, отличающимися от областей в известных методах. Наши анализы показали значительную специфичность и чувствительность детектирования 44 геномных копий для PTTV1 и 8,8 геномных копий / 25 мкл среды для PTTV2, в то время как сообщалось о пределе детектирования равном 10 геномных копий при проведении дуплексной ПЦР в режиме реального времени с помощью пробы TaqMan (Gallei et al., 2009, supra). Кроме того, ПЦР в режиме реального времени с красителем SYBR Green является гибким и недорогим методом, который может осуществляться непосредственно без необходимости применения флуоресцентно меченных меток. Наконец, с учетом высокой степени генетического разнообразия свиных TTV результаты анализов с помощью SYBR Green вряд ли подвержены влиянию различных известных вариантов свиного TTV, которые, по всей видимости, содержат мутации в пробу-связывающих последовательностях при проведении анализов с помощью пробы TaqMan.
Несмотря на наличие ДНК TTV все образцы сыворотки, отобранные у здоровых свиней, испытанные в этом исследовании, содержали низкие количества PTTV1 и PTTV2, которые были равны менее 2 х 10 копий/мл. Более того, в трех образцах спермы был обнаружен чрезвычайно низкий титр ДНК PTTV2. Большая часть испытанных образцов сыворотки также были позитивными для ДНК PCV2, что было определено методом обычной вложенной ПЦР (данные не показаны). Многие PCV2 - позитивные свиньи с низкой вирусной нагрузкой, не развивали клинической PCVAD (цирковирусной инфекции). Предложенный порог для развития PCVAD равен 107 или более геномных копий PCV2/мл сыворотки (Opriessnig et al., 2007, supra). Кроме того, ДНК-позитивность спермы по отношению к PCV2 также является исключительным маркером статуса заболевания (Opriessnig et al., 2007, supra; Pal, N., Huang, Y.W., Madson, D.M., Kuster, C., Meng, X.J., Halbur, P.G. and Opriessnig, Т., 2008. Development and validation of a duplex real-time PCR assay for the simultaneous detection and quantification of porcine circovirus type 2 and an internal control on porcine semen samples. J. Virol. Methods 149, 2 IP-25). Положение с вид-специфическими PTTV может быть аналогичной ситуации с PCV2 и для индуцирования заболеваний свиней может потребоваться высокий титр PTTV, составляющий более 107 копий/мл. Вид-специфические методы ПЦР в режиме реального времени, разработанные в этом исследовании, являются простыми и практичными инструментами для будущих исследований связи PTTV с болезнями с использованием большого числа клинических образцов в случае различных заболеваний.
Кроме того, путем сочетания двух видов вид-специфического одноплексного анализа мы разработали и обосновали быстрый, недорогой и надежный метод скрининга для одновременного детектирования и дифференциации двух видов свиного TTV, PTTV1 и PTTV2, состоящий в дуплексной ПЦР в режиме реального времени, основанный на МСА. Хотя этот метод не предназначен для точного количественного определения обоих видов PTTV, он представляет собой более удобный подход, который мог бы заменить обычную вложенную ПЦР при детектировании. По сравнению с ПЦР в режиме реального времени обычный метод вложенной ПЦР для детектирования свиных TTV является длительным (требующим проведения 4 раундов ПЦР), трудоемким и склонным к загрязнению образов, происходящим во время многочисленных раундов ПЦР. Благодаря разнице величин Tm PTTV1 и PTTV2 метод МСА, проводимый после амплификации с применением дуплексной ПЦР, позволяет обеспечить явную специфичность реакции. Другим преимуществом этого дуплексного метода в режиме реального времени является то, что включение стандартов PTTV1 и PTTV2 не является существенным при проведении нужного протокола, что делает этот метод более применимым в любых диагностических лабораториях, снабженных автоматиескими приборами для проведения ПЦР в режиме реального времени.
Были описаны многие случаи инфекции, вызванной свиными TTV с различными генотипами или подтипами одного и того же вида (Gallei et al., 2009, supra). В частности, наше более раннее исследование показало, что вид 1 свиного TTV состоит из двух различных типов, PTTV1 а (включая штаммы Sd-TTV31 и PTTV1 a-VA) и PTTV1b (включая штаммы TTV-1p и PTTV1b-VA). Два недавно описанных изолята PTTV1 с полными геномами, swSTHY-TT27 (GQ120664) из Канады и TTV1 #471819 (GU188045) из Германии, на основе филогенетического анализа (данные не приведены) оба классифицировались как представители типа 1b. Дуплексная вложенная ПЦР, описанная нами, подтвердила, что двойная инфекция, вызванная двумя генотипами PTTV1, встречалась у свиней часто. Этот новый метод анализа до сих пор является первым диагностическим подходом с применением ПЦР к определению различия между инфекциями, вызванными PTTV1a и PTTV1b. Поскольку в настоящее время не известно, один или оба вида инфекции, вызванной PTTV1a и PTTV1b, представляют релевантный фактор, ассоциируемый с заболеваниями, наш дифференциальный метод ПЦР должен иметь большое значение для будущей потенциальной связи этих двух типов PTTV.
В соответствии с еще одним аспектом данного изобретения белки ORF свиного TTV были экспрессированы и использованы при проведении иммунологического анализа для детектирования наличия специфических антител к свиному TTV. Согласно одному варианту данного изобретения три укороченных и меченых гистидином белка ORF1 PTTV1a, PTTV1b и PTTV2 были экспрессированы и очищены в Escherichia coli (E.coli), соответственно. Далее, были разработаны и обоснованы два метода анализа сыворотки, Вестерн-блоттинг и ELISA, основанные на этих рекомбинантных антигенах с использованием образцов свиной сыворотки, полученных из различных источников. В частности, серологическое определение с помощью PTTV1a-, PTTV1b- и PTTV2-специфического метода ELISA обеспечивает точный и простой инструмент для обнаружения связи инфекции, вызванной свиным TTV с заболеваниями.
В соответствии с дальнейшим аспектом данного изобретения белки ORF свиного TTV были экспрессированы и очищены как рекомбинантные капсидные белки ORF1 в системе E.Coli (см. Фигуру 10, Фигуру 15). Эти укороченные и меченые гистидином капсидные белки ORF1 PTTV1a, PTTV1b и PTTV2, были экспрессированы и очищены в Escherichia coli (E.coli), соответственно, и служили в качестве рекомбинантных капсидных субъединичных вакцин от инфекции, вызванной PTTV.
Четыре штамма TTV2, TTV-2p, TTV2#472142, PTTV2b-VA и PTTV2c-VA, содержали доступные к настоящему времени полные геномные последовательности. Хотя с филогенетической точки зрения они классифицируются в трех предполагаемых подтипах, сравнительный анализ профилей гидрофильности ORF1, кодирующей аминокислоты из четырех PTTV2 показал, что они содержали три гидрофильные области, обогащенную аргинином область от а.к. 1-49 на N-конце и две особенные области (I и II), расположенные в середине и в С-концевой части, соответственно (Фигура 9А). С-концевая область, использованная для экспрессии укороченнной ORF1 PTTV2c-VA и соответствующих областей, которые содержатся в других трех штаммах PTTV2, показаны пунктиром. Выравнивания аминокислотных последовательностей показало высокие уровни консервативности последовательностей областей I (а.к. 322-349) и II (а.к. 536-625) в четырех штаммах PTTV2 (Фигура 9В).
Поскольку полагают, что гидрофильные области являются важными для наличия антигенности многих белков, С-концевая область (а.к. 310-625) в ORF1 PTTV2c-VA, SEQ ID NO:16, содержащая два домена, была выбрана для экспрессии белков и была использована как антиген для детектирования PTTV2 - специфического антитела в свиной сыворотке. Согласно одному аспекту данного изобретения экспрессия укороченнной ORF1 PTTV2c была достаточной для детектирования всех подтипов PTTV2 (2а, 2b и 2с; см. также Фигуру 3А).
Согласно одному из вариантов данного изобретения была получена и экспрессирована в Е. coli С-концевая область гена ORF1 PTTV2c, слитая с 8 х His-метками. Рекомбинантный белок был нерастворимым и экспрессировался в телах включения бактерий. На Фигуре 10 А показаны результаты SDS - PAGE неочищенных продуктов 2с - ORF1. На Фигуре 10 В показаны результаты SDS - PAGE очищенных продуктов 2с - ORF1. На Фигуре 10С показаны результаты Вестерн-блоттинга очищенных продуктов 2с - ORF1 с использованием анти - His-меченого mAb. Стрелки с острием белого цвета показывают белок ORF1 ожидаемого размера и его "укороченный" продуктов то время как стрелки с черным острием показывают предполагаемые димеры ожидаемых и укороченных белков. М: белковые маркеры. На Фигуре 10А показано два важных полипептида (стрелки с острием белого цвета), полученные в неочищенном образце 2с - ORF1, по сравнению с контрольным образом. Полоса около 40 кДа согласуется с ожидаемым размером 2с - ORF1, в то время как полипептид с м.в. около 30 кДа был, по всей видимости, укороченным на N-конце продуктом, полученным из первого продукта. После очистки на колонке из никеля SDS - PAGE показал наличие четырех полипептидов, включая две описанные полосы (см. Фигуру 10В). Их также детектировали методом Вестерн-блоттинга, используя mAb против His метки (см. Фигуру 10 С). Две полосы, обозначающие высокий молекулярный вес (стрелки с черным острием) обозначают гомодимеры, образованные двумя полипептидами с м.в. около 40 кДа и около 30 кДа, соответственно, основанные на предсказанных размерах (около 80 кДа и около 60 кДа).
Результаты показали, что очищенная С-концевая PTTV2c - ORF1 была успешно получена и могла быть использована для детектирования антитела свиного TTV2 в свиной сыворотке.
В соответствии с другим вариантом данного изобретения антитела к свиному TTV2 в различных образцов сыворотки могут быть детектированы методом Вестерн-блоттинга с использованием очищенной С-концевой PTTV2c - ORF1. Стрелки с белыми остриями обозначают белок ORF1 с ожидаемым размером и его процессированный продукт. Следует отметить, что только полосы зеленого цвета были признаны позитивными. У обычных свиней (здоровых и больных), свиней породы CD/CD и гнобиотических свиней из разных источников были отобраны более 200 образцов сыворотки. Затем выбирали произвольно образцы для детектирования иммуноглобулиновых антител к PTTV2c - ORF1 с использованием очищенной С-концевой PTTV2c - ORF1 в качестве антигена. На Фигуре 11 А показаны результаты Вестерн-блоттинга выбранных образцов свиной сыворотки обычных свиней, на Фигуре 11 В - для свиней CD/CD и на Фигуре 11С - для гнобиотических свиней. Очищенные продукты PTTV2c - ORF1 применяли в качестве антигенов. В большинстве образцов обычных свиней (Фигура 11А) и свиней CD/CD (Фигура 11В) были детектированным две заметных полосы, около 40 кДа и около 30 кДа, что указывало на наличие у этих свиней сильной инфекции, вызванной PTTV2. Однако у всех гнобиотических свиней из двух разных источников (Blacksburg, VA и Ames, IA) антитела к PTTV2 не были обнаружены (Фигура 11 С). Наблюдались также дополнительные полосы с низким молекулярным весом. Они, вероятно, вызваны неспецифической реактивностью при проведении Вестерн-блоттинга.
В соответствии с еще одним вариантом данного изобретения РТТУ2-специфический анализ ELISA может быть использован как серологический тест для свиного TTV2. Для нескольких образцов, отобранных у обычных свиней на ферме в штате Висконсин были показаны серонегативные результаты (см. Фигуру 12). Эти негативные результаты собирали и применяли как негативный стандарт в развитии РТТУ2-специфического анализа ELISA. Остальные образцы из этого источника были позитивными (Фигура 12, четыре линии слева). Кроме того, свиная сыворотка из коммерческой компании, используемая в клеточной культуре (предполагается, что у свиней нет заболеваний, зарегистрированных в OIE), также имела сильную анти - PTTV2 - ORF2 позитивность (Фигура 12) и применялась в качестве положительного контроля для ELISA. Концентрации очищенного антигена 2с - ORF1, свиной сыворотки и конъюгата IgG определяли путем шахматного титрования для определения низкого сигнала фона и получения самой большой разницы OD405 между позитивным и негативными контрольными образцами. Оптимальное количество антигена составляло 69 нг на лунку и оптимальные результаты ELISA были получены при использовании разведения 1: 100 образцов сыворотки и разведении 1:4000 конъюгатов IgG. Критические величины ELISA находились в пределах от 0,25 до 0,5 в каждом опыте. На Фигуре 4 показан репрезентативный результат, отражающий согласованность результатов Вестерн-блоттинга сыворотки и разработанного метода ELISA.
Для корреляции связи вирусной нагрузки PTTV2 при проведении ПЦР в режиме реального времени и уровня IgG антител к PTTV2 в сыворотке, отобранной у 10 свиней в одном и том же стаде после их прибытия в новое хозяйство и через 2 мес. после прибытия, проводили анализ этой сыворотки. У 9 из 10 свиней через 2 мес. были пониженные вирусные нагрузки (у трех животных вирус вообще не был обнаружен), в то время как титры антитела к PTTV2 были повышены у 9 из 10 свиней (Фигуры 14А-14В). Эти результаты позволяют предположить, что у 10 свиней была инфекция на ранней стадии, вызванная PTTV2, которая вызывала гуморальный ответ и продуцировала прогрессивно IgG антитело к капсидному белку ORF1. IgG антитело к PTTV2- ORF1 было способно нейтрализовывать и даже очищать вирус, показывая, что ORF1 действительно кодирует капсидный вирусный белок и может содержать нейтрализующие эпитопы PTTV2.
Согласно одному из вариантов данного изобретения С-концевые белки PTTV1a - и PTTV1b - ORF1 были экспрессированы и очищены в системе E.coli, соответственно. Электрофорез SDS- PAGE и Вестерн-блоттинг с использованием используя mAb против His метки показали, что оба продукта, 1а- и 1b-ORF1, содержали два полипептида, один с ожидаемым размером (около 40 кДа) и другой в виде предполагаемого гомодимера (около 80 кДа) (см. Фигуры 15А-С). На Фигуре 15А показаны результаты SDS- PAGE неочищенных и очищенных продуктов 1a - ORF1. На Фигуре 15В показаны результаты очищенных продуктов 1b - ORF1 и 1b - ORFlctruc. На Фигуре 15С показаны результаты Вестерн-блоттинга очищенных продуктов 1а - и 1b - ORF1 с использованием mAb против His-метки. Стрелки с острием белого цвета показывают белок ORF1 ожидаемого размера, в то время как стрелки с острием черного цвета показывают предполагаемый димер белков ORF1. По сравнению с экспрессией 2с - ORF1 процессированный полипептид не наблюдался. В качестве сравнительного контроля проводили экспрессию С-концевого процессированного участка 1b - ORF1 (1b - ORF1ctruc), которая привела к получению полипептида с более низким молекулярным весом по сравнению с его С - концевой непроцессированной противоположной частью 1b - ORF1 (см. Фигуру 15В).
В соответствии с одним вариантом данного изобретения очищенные белки С-концевой PTTV1a - и PTTV1b-ORF1 применяли для разработки метода генотип-специфического Вестерн-блоттинга сыворотки и метода ELISA, как описано выше для PTTV2. На Фигуре 16 показаны негативные (колонки 1-2) и позитивные (колонки 3-5) результаты Вестерн-блоттинга и ELISA образцов сыворотки с применением 1a - ORF1 в качестве антигена. При проведении PTTV1a - и PTTV1b-специфического метода ELISA применяли то же самое количество антигена (69 нг), разведение сыворотки 1:100 и разведение конъюгата IgG 1:4000 (результаты не показаны).
Кроме того, данное изобретение предусматривает диагностический реагент для детектирования инфекции, вызванной TTV, который включает моноклональное или поликлональное антитело, очищенное от природного хозяина, например, путем инокулирования свиньи свиным TTV или иммуногенной композицией по изобретению в иммуногенном количестве для продуцирования вирусной инфекции и выделения антитела из сыворотки инфицированной свиньи. Или же у экспериментальных животных могут быть индуцированы антитела к природным или синтетическим полипептидам, полученным или экспрессированным из аминокислотных последовательностей или иммуногенных фрагментов, кодированных нуклеотидной последовательностью выделенного свиного TTV. Например, моноклональные антитела могут быть получены из клеток гибридомы, которые получены из мышей, таких как, например, мыши линии Balb/c, иммунизованных полипептидным антигеном, полученным из нуклеотидной последовательности выделенного свиного TTV. Селекция клеток гибридомы проводится путем выращивания в системе, содержащей гипоксантин, тимидин и амидоптерин, в стандартной культуральной среде, например в модифицированной по способу Дульбекко среде Игла (DMEM) или минимальной поддерживающей среде. Клетки гибридомы, которые продуцируют антитела, могут быть клонированы методами, известными из уровня техники. Затем дискретные колонии, которые образовались, могут быть помещены в отдельные лунки культуральных планшетов для культивирования в подходящей культуральной среде. Идентификация клеток, секретирующих антитела, производится обычными методами скрининга с помощью соответствующего антигена или иммуногена. Культивирование клеток гибридомы in vitro или in vivo путем получения асцитной жидкости у мышей после введения клеток гибридомы приводит к получению желаемого моноклонального антитела известными методами.
Согласно другому альтернативному методу капсидный белок свиного TTV может быть экспрессирован в системе экспрессии на основе бакуловирусов или в системе на основе Е.coli согласно известным методикам. Экспрессированный рекомбинантный капсидный белок свиного TTV может быть использован как антиген для диагностики методом твердофазного иммуноферментного анализа (ELISA). Например, метод ELISA, основанный на применении рекомбинантного капсидного антигена, может быть использован для детектирования антител к свиному TTV у свиней и других млекопитающих. Хотя метод ELISA является предпочтительным, могут применяться другие известные диагностические тесты, такие как иммунофлуоресцентный анализ (IFA), иммунопероксидазный метод (IPA) и др.
Когда это желательно, коммерческий диагностический метод ELISA в соответствии с настоящим изобретением может быть применен для диагностики инфекции у свиней, вызванной свиным TTV. Примеры иллюстрируют применение очищенных белков ORF1 и ORF2 свиного TTV для развития метода ELISA для детектирования антител к TTV у свиней. Сыворотка, отобранная у свиней, инфицированных свиным TTV, и негатиные образцы сыворотки, отобранные у контрольных животных, были применены для подтверждения этого метода. Было показано, что PTTV2-специфические, PTTV1a-специфические и PTTV1b-специфические антитела специфически распознают белки PTTV - ORF. Дальнейшая стандартизация теста методами, известными специалисту в данной области, может оптимизировать коммерциализацию метода диагностики свиного TTV.
Другим аспектом (объектом) настоящего изобретения является уникальная иммуногенная композиция, содержащая выделенный свиной TTV или антигенный белок, кодируемый выделенным полинуклеотидом, описанным выше, и его применение для индукции или выработки антител. Композиция содержит нетоксический физиологически приемлемый носитель и, необязательно, один или более адъювантов. Подходящие носители, например, такие как вода, физиологический раствор, этанол, этиленгликоль, глицерин и т.д., выбирают из обычных эксципиентов, и можно добавлять другие составляющие (co-formulants). Для того чтобы гарантировать физическую совместимость и стабильность конечной композиции, можно проводить стандартные тесты.
Помимо этого, согласно настоящему изобретению предусматриваются молекулярные вакцины против свиного вируса гепатита Torque teNO (TTV) (infectious molecular) и нуклеотидные молекулы свиного вируса гепатита Torque teNO (TTV) (вируса "тонкого ожерелья"), живые вирусы, продуцируемые при использовании нуклеотидной молекулы, и ветеринарные вакцины для защиты свиней от свиной TTV вирусной инфекции или заболевания, вызванного совместной инфекцией свиного TTV и других вирусов. Кроме того, изобретение предусматривает иммуногенные полипептидные продукты экспрессии, которые можно использовать в качестве вакцин.
Молекула новой инфекционной ДНК свиного TTV представляет собой нуклеотидную молекулу, кодирующую по меньшей мере участок инфекционного PTTV1a-VA (SEQ ID NO:9), PTTV1b-VA (SEQ ID NO:10), PTTV2c-VA (SEQ ID NO:11) или PTTV2c-VA (SEQ ID NO:12) генома. Клон инфекционной PTTV ДНК, предпочтительно, содержит по меньшей мере один из ORF1 (открытой рамки считывания), ORF2, ORF1/1 и ORF2/2 генов PTTV1 или PTTV2. Для создания тандемных повторов инфекционных PTTV клонов в единичную молекулу ДНК можно включить (инсерция) множество копий PTTV1a-VA (SEQ ID NO:9), PTTV1b-VA (SEQ ID NO:10), PTTV2c-VA (SEQ ID NO:11) или PTTV2c-VA (SEQ ID NO:12) генома.
Показано, что клонированная геномная ДНК PTTV, в частности PTTV1a-VA, PTTV1b-VA, PTTV2c-VA и тандемных повторов PTTV2b-RR, PTTV2c-RR по данному описанию, является in vitro или in vivo инфекционной, если ее трансфецировать в клетки PK-15 и давать свиньям. Этот новый, легко репродуцируемый патогенный агент сам по себе подходит для разработки соответствующей программы вакцинации для предупреждения PTTV инфекции у свиней.
Согласно другому варианту настоящего изобретения получали три PTTV ДНК клона с одной копией PTTV ДНК генома при использовании прототипов изолятов США PTTV1a-VA, PTTV1b-VA и PTTV2c-VA с помощью "fusion" ПЦР (ПЦР со сшивкой), соответственно. Каждую из полноразмерных геномных ДНК встраивали в клонирующий вектор pSC-В-amp/kan лигированием по тупым концам. Сайт рестрикции BamH I представляет собой уникальный сайт на трех PTTV геномах, который создавали на обоих концах трех геномов с целью содействовать образованию конкатемеров и тем самым имитировать TTV кольцевой геном. Единичные расщепления выбранной плазмидной ДНК каждого клона с помощью BamH I четко давали в результате два разных фрагмента размером 4.3 т.п.о. и 2.8- т.п.о. (Фиг.18А). Фрагменты 4.3 т.п.о. представляли собой каркасный вектор, тогда как фрагменты 2.8 т.п.о. представляли собой встроенную геномную ДНК PTTV. В случае пустого вектора pSC-В-amp/kan, расщепляемого тем же самым ферментом, наблюдается только полоса 4.3 т.п.о. (Фиг.18А). Полученные в результате PTTV клоны обозначают pSC-PTTV1a, pSC-PTTV1b и pSC-PTTV2c, соответственно (Фиг.17А-С).
Далее, две копии генома полноразмерного PTTV2c- VA, образованного при использовании клона pSC-PTTV2c, лигировали в тандемном повторе в вектор pSC-В-amp/kan, получая клон pSC-2PTTV2c- RR (Фиг.17D). Сравнение паттернов единичного расщепления pSC-PTTV2c и pSC-2PTTV2c-RR с помощью Af1 II показало, что последняя плазмида имеет дополнительный фрагмент 2.8 т.п.о., представляющий собой вторую копию PTTV2c генома (Фиг.18В, правая панель). Затем мы использовали ту же самую стратегию клонирования для получения тандем-димерной формы PTTV2b ДНК клона, образованного из TTV клона TTV2-#471942-full (Germany). Дополнительный фрагмент размером 2.8 т.п.о., представляющий собой вторую копию PTTV2b генома, присутствовал в этой конструкции, обозначенной pSC-2PTTV2b-RR (Фиг.17F), которую расщепляли только с помощью Hind III, в сравнении с геномным аналогом с одной копией (Фиг.18В, левая панель), подтверждая успешную конструкцию.
Компетентность в отношении репликации конструированных PTTV инфекционных клонов проверяли с помощью in vitro трансфекции клеток РК-15. ИФА (IFA) с применением продажных кроличьих поликлональных антител против PTTV2c ORF1 подтвердил, что конкатемеры клонов как TTV2-#471942- full, так и pSC-PTTV2c компетентны в отношении репликации, соответственно (Фиг.19А и Фиг.20А). Пассирование трансфецированных клеток не исключает и не ослабляет флуоресцентные сигналы (Фиг.19В и Фиг.20В), это говорит о том, что экспрессия ORF1 белков обусловлена PTTV2 конкатемерами, которые имитируют природные PTTV2b или PTTV2c кольцевые молекулы. Никаких флуоресцентных сигналов не наблюдали в клетках с симулированной ДНК-трансфекцией с применением неиммунной кроличьей сыворотки в качестве антитела для ИФА (IFA) обнаружения (данные не показаны). Также показано, что конкатемеры pSC-PTTV1a клона являются компетентными в отношении репликации с применением антитела против PTTV1a ORF1 (Фиг.21). Позитивные флуоресцентные сигналы были локализованы в ядре трансфецированных или пассированных клеток, это указывает на то, что свиные TTV, по-видимому, реплицируются в ядрах клеток. Это не является неожиданным, так как цирковирус свиней (PCV, ЦВС) имеет аналогичный паттерн экспрессии in vitro.
Прямая трансфекция тандем-димерной формы клона pSC-2PTTV2b-RR или pSC-2PTTV2c-RR в клетках РК-15 приводит к вирусной репликации и продуцирует ORF1 капсидный антиген. ИФА (IFA) с применением антител против PTTV2 ORF1 подтвердил, что оба клона являются компетентными в отношении репликации, а позитивные ORF1 антигены локализованы в ядрах (Фиг.22А и В).
Согласно одному варианту настоящего изобретения для инокуляции свиней можно применять инфекционные клоны свиного TTV, которые затем выявляют иммунный ответ животного-хозяина и стимулируют выработку (продуцирование) нейтрализующих антител. В одном конкретном варианте настоящего изобретения два тандем-димерных PTTV2 клона были инфекционными (контагиозными), когда их инъецировали в лимфатические узлы и мышцы обычных свиней.
Для тестирования in vivo инфицирующей способности (инфекционности) PTTV2 молекулярных клонов обычных свиней инокулируют клоном pSC-2TTV2b-RR или pSC-2TTV2c-RR. Образцы сыворотки берут у животных в 0, 7, 14, 21 и 28 дни после инокуляции (DPI). PTTV2 ДНК обнаруживали у pSC-2TTV2c-RR-инокулированных свиней, начиная с 7 DPI (#92), 14 DPI (#188 и #191) и с 21 DPI (#180), соответственно (Фиг.23А, правая панель). PTTV вирусемия появлялась позже у свиней, инокулированных клоном pSC-2TTV2b-RR: у двух свиней она появлялась на 14 DPI (#189 и #192), у одной на 21 DPI (#181) и у одной на 28 DPI (#193) (Фиг.23А, левая панель). Вирусная нагрузка повышалась в течение этого курса у всех инокулированных свиней, наивысшая вирусная нагрузка наблюдалась у них на 28 DPI перед вскрытием, как определено с помощью PTTV2-специфичной ПЦР в реальном времени (Фиг.23А). Продукты ПЦР в реальном времени, амплифицированные при использовании выбранных свиней, секвенировали и нашли, что они имеют последовательности, идентичные последовательностям соответствующих областей pSC-2TTV2b-RR или pSC-2TTV2c-RR (данные не показаны).
Все инокулированные свиньи были негативны к PTTV2 ORF1 антителам в 0 и 7 DPI. На 14 DPI все четверо pSC-2TTV2b-RR-инокулированных свиней сероконвертировали (изменили профиль антител в сыворотке) в анти-PTTV2 ORF1 IgG, тогда как pSC-2TTV2c-RR-инокулированная группа сероконвертировала на 14 (#92 и #180), 21 (#191) и 28 (#188) DPI, соответственно (Фиг.23В). Результаты показывают, что произошло активное инфицирование свиным вирусом TTV2b или TTV2c.
Вакцины инфекционных вирусных и инфекционных молекулярных ДНК клонов и способы их применения также включены в объем настоящего изобретения. Инокулированных свиней защищают от вирусной инфекции и обусловленных ею заболеваний, вызванных TTV2 инфицированием или коинфицированием. Новый способ защищает свиней, нуждающихся в защите против вирусной инфекции, путем введения свинье иммунологически эффективного количества вакцины по изобретению, например, такой как вакцина, содержащая иммуногенное количество инфекционной PTTV ДНК, плазмиды или вирусного вектора, содержащего инфекционный клон ДНК PTTV, рекомбинантной ДНК PTTV, продуктов экспрессии полипептидов, экспрессируемого в бактериях или в баколовирусах очищенного рекомбинантного ORF1 капсидного белка и т.д. Чтобы обеспечить широкий спектр защиты против вирусных инфекций, свиньям можно одновременно давать другие антигены, такие как PRRSV, PPV, другие инфекционные "свиные" агенты и иммуностимуляторы.
Вакцины содержат, например, инфекционные вирусные и молекулярные ДНК клоны, клонированный PTTV инфекционный ДНК геном в подходящих плазмидах или векторах, например, таких как pSC- В вектор, авирулентный живой вирус, инактивированный вирус, субъединичная вакцина на основе экспрессируемого рекомбинантного капсидного белка, и т.д. в сочетании с нетоксическим физиологически приемлемым носителем и, необязательно, с одним или более адъювантами. Вакцина может также содержать инфекционный TTV2 молекулярный ДНК клон по данному описанию. Инфекционная PTTV ДНК, плазмидная ДНК, содержащая инфекционный вирусный геном, и живые вирусы являются предпочтительными, причем живые вирусы являются наиболее предпочтительными. Авирулентная живая вирусная вакцина по настоящему изобретению имеет преимущество перед традиционными вирусными вакцинами, в которых используются либо ослабленные (аттенюированные), живые вирусы, которые подвергаются риску возвратиться в вирулентное состояние, или клетки убитой культуры распространят целый вирус, который может не позволить индуцировать достаточный иммунный ответ антитела для защиты против вирусного заболевания.
Вакцины и способы их применения также входят в объем настоящего изобретения. Инокуляция млекопитающих защищает против серьезной вирусной инфекции, может также обеспечить защиту от заболевания, связанного с коинфекцией PTTV, такого как синдром дерматита и нефропатии поросят (PDNS), мультисистемный синдром истощения после отъема поросят от свиноматки (PMWS) и другого родственного заболевания. Вакцины содержат, например, инактивированный или ослабленный свиной TTV вирус, нетоксический, физиологически приемлемый носитель и, необязательно, один или более адъювантов.
Адъювант, который можно вводить в сочетании с вакциной по настоящему изобретению, представляет собой вещество, которое повышает иммунологическую реакцию свиньи на вакцину. Адъювант можно вводить одновременно с вакциной и в ту же самую область, что и вакцину, или в различное время, например, в качестве бустер-инъекции. Предпочтительно также вводить адъюванты свинье способом, отличным от способа введения вакцины, или в область, отличную от области введения вакцины. Подходящие адъюванты включают, но без ограничения, гидроксид алюминия (квасцы), иммуностимулирующие комплексы (ISCOMS), неионные блок-полимеры или сополимеры, цитокины (подобные IL-1, IL-2, IL-7, IFN-α, IFN-β, IFN-γ и т.д.), сапонины, монофосфориллипид A (MLA, МФЛ), мурамилдипептиды (MDP) и т.п. Другие подходящие адъюванты включают, например, алюминия калия сульфат, термолабильный или термостабильный энтеротоксин, выделенный из Escherichia coli, холерный токсин или его В-субъединицу, дифтерийный токсин, столбнячный токсин, коклюшный токсин, неполный или полный адъювант Фрейнда и т.д. Адъюванты на основе токсинов, таких как дифтерийный токсин, столбнячный токсин и коклюшный токсин, можно инактивировать перед применением, например, обработкой формальдегидом.
Помимо этого, вакцины могут содержать дополнительные антигены для инициации иммунологической активности инфекционных PTTV ДНК клонов, например, такие как вирус свиного репродуктивно- респираторного синдрома (PRRSV), свиной парвовирус (PPV), другие инфекционные агенты и иммуностимуляторы для свиней.
Новые вакцины по данному изобретению не ограничиваются каким-либо конкретным типом или методом приготовления. Клонированные вирусные вакцины включают, но без ограничения, инфекционные ДНК вакцины (т.е. использующие плазмиды, векторы или другие обычные носители для непосредственной инъекции ДНК свиньям), живые вакцины, модифицированные живые вакцины, инактивированные вакцины, субъединичные вакцины, аттенюированные вакцины, генно-инженерные вакцины и т.д. Эти вакцины готовят стандартными методами, известными в уровне техники.
Другим преимуществом является то, что предпочтительный живой вирус по настоящему изобретению обеспечивает генетически устойчивую вакцину, которую легче приготовить, хранить и доставлять, чем другие типы аттенюированных вакцин.
В другой предпочтительной вакцине по настоящему изобретению используются подходящие плазмиды для доставки непатогенного ДНК-клона свиньям. В отличие от традиционных вакцин, в которых используют целый вирус, передаваемый живой или убитой культурой клеток, данное изобретение предусматривает непосредственную инокуляцию свиней плазмидной ДНК, содержащей инфекционный вирусный геном.
Дополнительные генно-инженерные вакцины, желательные в настоящем изобретении, получают методами, известными в уровне техники. Такие методы включают, но без ограничения, дальнейшую манипуляцию с рекомбинантной ДНК, модификацию или замены аминокислотных последовательностей рекомбинантных белков и т.п.
Генно-инженерные вакцины на основе рекомбинантной ДНК получают, например, идентифицируя альтернативные участки вирусного гена, кодирующие белки, отвечающие за индукцию более сильного иммунного или протективного (защитного) ответа у свиней (например, белки, полученные при использовании ORF1, ORF1/1, ORF2, ORF2/2 и т.д.). Такие идентифицированные гены или иммунодоминантные фрагменты можно клонировать в стандартные векторы для экспрессии белков, такие как бакуловирусный вектор, и использовать для инфицирования соответствующих клеток-хозяев (см., например, O'Reilly et al., "Baculovirus Expression Vectors: A Lab Manual," Freeman & Co., 1992). Клетки- хозяева культивируют с тем, чтобы они экспрессировали заданные вакцинные белки, которые можно очищать до нужной степени чистоты и готовить в виде подходящего вакцинного продукта. Рекомбинантные субъединичные вакцины основаны на экспрессируемых бактериями (Фиг.10, Фиг.15) или экспрессируемых бакуловирусами ORF1 капсидных белках PTTV1a, PTTV1b и PTTV2.
Если клоны сохраняют какие- либо нежелательные естественные свойства вызывать заболевание, возможно также точно указать нуклеотидные последовательности в вирусном геноме, отвечающие за любую остаточную вирулентность, и методами генной инженерии сделать вирус авирулентным, например, методом сайт-направленного мутагенеза. Сайт-направленный мутагенез позволяет добавлять, удалять или заменять один или более нуклеотидов (см., например, Zoller et al., DNA 3: 479-488, 1984). Синтезируют олигонуклеотид, содержащий заданную мутацию, и гибридизуют с участком однонитевой (одноцепочечной) вирусной ДНК. Гибридную молекулу, полученную в результате этой процедуры, используют для трансформации бактерии. Затем выделенную двухнитевую ДНК, содержащую соответствующую мутацию, используют для получения полноразмерной ДНК лигированием к рестрикционному фрагменту последней, и ее далее трансфецируют в подходящую клеточную культуру. Лигирование генома к подходящему вектору для переноса можно проводить любым стандартным методом, известным рядовому специалисту в данной области техники. Трансфекцию вектора в клетки-хозяева для продуцирования вирусного потомства можно осуществлять любыми обычными методами, такими как трансфекция, опосредуемая фосфатом кальция или DEAE-декстраном, электропорация, слияние протопластов и другие общеизвестные методы (см., например, Sambrook et al., "Molecular Cloning: A Laboratory Manual," Cold Spring Harbor Laboratory Press, 1989). Далее клонированный вирус обнаруживает заданную мутацию. Или же можно синтезировать два олигонуклеотида, которые содержат соответствующую мутацию. Их можно гибридизовать с образованием двухнитевой ДНК, которую можно встраивать в вирусную ДНК, получая полноразмерную ДНК.
Иммунологически эффективное количество вакцин по настоящему изобретению вводят свинье, которой необходима защита против вирусной инфекции. Иммунологически эффективное количество, или иммуногенное количество, которым инокулируют свинью, можно легко определить или просто титровать с помощью стандартного тестирования. Эффективное количество представляет собой такое количество, с помощью которого достигается иммунологический ответ на вакцину, достаточный для защиты свиньи, подвергшейся действию (экспонированной с) PTTV вируса. Предпочтительно, свинья защищается в той степени, в которой значительно уменьшаются, становятся менее интенсивными или полностью предупреждаются от одного до всех неблагоприятных физиологических симптомов или эффектов вирусного заболевания.
Вакцину можно вводить в виде разовой дозы или в виде повторных доз. Интервалы доз могут составлять, например, около 1-1000 микрограмм плазмидной ДНК, содержащей инфекционный химерный ДНК- геном (в зависимости от концентрации иммуноактивного компонента вакцины), предпочтительно, 100-200 микрограмм TTV ДНК клона свиньи, но дозы не должны содержать количество вирусного антигена, достаточное для того, чтобы вызвать побочную (патологическую) реакцию или физиологические симптомы вирусной инфекции. В уровне техники известны методы определения или титрования подходящих доз активного антигенного агента с целью установить минимальные эффективные дозы с учетом веса свиньи, концентрации антигена и других стандартных факторов. Предпочтительно, в качестве вакцины используют инфекционный вирусный ДНК-клон, или живой инфекционный вирус можно получать in vitro, а затем живой вирус использовать в качестве вакцины. В этом случае свинье можно давать, например, около 50-10000 TCID50, (доза, инфицирующая 50% тканевой культуры) живых вирусов.
Новые вакцины по изобретению не ограничиваются каким-либо конкретным типом или методом получения. Вакцины включают, но без ограничения, модифицированные живые вакцины, инактивированные вакцины, субъединичные вакцины, аттенюированные вакцины, генно-инженерные вакцины и т.д.
Преимущество живых вакцин заключается в том, что у реципиента вакцины активируются все возможные иммунные реакции, включая системные, местные, гуморальные и клеточные иммунные реакции. К недостаткам живых вирусных вакцин, которые могут возобладать над преимуществами, является вероятность загрязнения живыми случайными вирусными агентами или повышенный риск того, что в поле вирус может восстановить вирулентность.
Для приготовления инактивированных вирусных вакцин рост вирусов и продуцирование вирусов может происходить в культивируемых клеточных линиях свиней, например, но без ограничения, в таких как клетки PK-15. Затем инактивацию вирусов с помощью серийного пассирования оптимизируют по протоколам, хорошо известным рядовым специалистам в данной области техники, или, предпочтительно, в соответствии с методами по данному описанию.
Инактивированные вирусные вакцины можно приготовить обработкой TTV свиньи инактивирующими агентами, такими как формалин или гидрофобные растворители, кислоты и т.д., облучением ультрафиолетовым светом или рентгеновскими лучами, нагреванием и т.д. Инактивацию проводят способом, известным в уровне техники. Например, при химической инактивации соответствующий образец вируса или образец сыворотки, содержащий вирус, в течение достаточного времени обрабатывают инактивирующим агентом, в достаточным количестве или с достаточной концентрацией, при достаточно высоких (или низких, в зависимости от инактивирующего агента) значениях температуры или pH, инактивируя вирус. Инактивацию при нагревании проводят при такой температуре и в течение такого времени, которые достаточны для инактивации вируса. Инактивацию облучением проводят, используя длину световой волны или другой источник энергии в течение времени, достаточного для инактивации вируса. Вирус полагают инактивированным, если он не способен инфицировать клетку, восприимчивую к инфицированию.
Приготовление субъединичных вакцин обычно отличается от приготовления модифицированной живой вакцины или инактивированной вакцины. Перед приготовлением субъединичной вакцины следует идентифицировать протективные (защитные) или антигенные компоненты вакцины. В настоящем изобретении антигенные компоненты PTTV были идентифицированы как ORF1 капсидные белки вирусов PTTV1a, PTTV1b и PTTV2, которые в данном изобретении экспрессировали и очищали в Escherichia coli (E.coli), и другой системе экспрессии, такой как бакуловирусная система экспрессии, для применения в качестве субъединичных рекомбинантных вакцин на основе капсидных белков. Такие протективные или антигенные компоненты включают некоторые аминокислотные сегменты или фрагменты вирусных капсидных белков, которые вызывают особенно сильную протективную или иммунологическую реакцию у свиней; сами единичные или множественные вирусные капсидные белки, их олигомеры и высшего порядка ассоциации вирусных капсидных белков, которые образуют субструктуры вирусов или идентифицируемые части или звенья таких субструктур; олигогликозиды, гликолипиды или гликопротеины, например, такие как липопротеины или липидные группы, ассоциированные с вирусом, присутствующие на или близ поверхности вируса или в вирусных субструктурах, и т.д. Предпочтительно, в качестве антигенного компонента субъединичной вакцины используют ORF1 белок. Могут также использоваться другие белки, например, такие, которые кодируются нуклеотидной последовательностью в ORF2, ORF1/1 и ORF2/2 гене. Эти иммуногенные компоненты легко идентифицируются методами, известными в уровне техники. После идентификации протективные или антигенные участки вируса (т.е. "субъединица") очищаются и/или клонируются методами, известными в уровне техники. Субъединичная вакцина обеспечивает преимущество перед другими вакцинами на основе живого вируса, так как субъединица, такая как высокоочищенные субъединицы вируса, менее токсична, чем целый вирус.
Если субъединичную вакцину получают методом рекомбинантной ДНК, экспрессию клонированной субъединицы, такой как гены ORF1, ORF2. ORF1/1 и ORF2/2, можно осуществлять, например, методом, представленным выше, и можно также оптимизировать методами, известными специалистам в данной области техники (см., например, "Molecular Cloning: A Laboratory Manual," Cold Spring Harbor Laboratory, Cold Spring Harbor, Mass. (1989)). С другой стороны, если применяемая субъединица представляет собой интактный структурный признак вируса, такой как целый капсидный белок, то тогда метод его выделения из вируса можно оптимизировать. В любом случае после оптимизации протокола инактивации протокол очистки субъединицы можно оптимизировать перед получением.
Для приготовления аттенюированных вакцин живой патогенный вирус сначала аттенюируют (делают непатогенным или безвредным) методами, известными в уровне техники, или, предпочтительно, по данному описанию. Например, аттенюированные вирусы можно приготовить методом по настоящему изобретению, который включает новое серийное пассирование на эмбрионах свиней. Аттенюированные (ослабленные) вирусы можно найти в природе, и они могут содержать естественные генные делеции или, в качестве альтернативы, патогенные вирусы можно аттенюировать, осуществляя делеции или мутации в генах. Аттенюированные и инактивированные вирусные вакцины содержат предпочтительные вакцины по настоящему изобретению.
Генно-инженерные вакцины, также желательные в настоящем изобретении, получают методами, известными в уровне техники. Такие методы включают, но без ограничения, применение РНК, рекомбинантной ДНК, рекомбинантных белков, живых вирусов и т.п.
Например, после очистки вирус дикого типа можно выделять из соответствующих клинических биологических образцов, таких как сыворотка, кал, слюна, сперма и ткани, методами, известными в уровне техники, предпочтительно, методами, раскрываемыми в данном описании, используя инфицированных свиней или инфицированные соответствующие линии клеток. ДНК извлекают из биологически чистого вируса или инфекционного агента методами, известными в уровне техники, и очищают методами, известными в уровне техники, предпочтительно, ультрацентрифугированием в градиенте CsCl. кДНК вирусного генома клонируют в соответствующего хозяина методами, известными в уровне техники (Maniatis et al., см. выше), и затем вирусный геном анализируют, определяя области генома, существенные для продуцирования антигенных участков вируса. Далее процедура, как правило, такая же, как для модифицированной живой вакцины или субъединичной вакцины.
Генно-инженерные вакцины на основе метода рекомбинантной ДНК получают, например, идентифицируя участок вирусного гена, который кодирует белки, отвечающие за индукцию более сильного иммунного или протективного ответа у свиней (например, белки, полученные с использованием ORF1, ORF2, ORF1/1 и ORF2/2, и т.д.). Такие идентифицированные гены или иммунодоминантные фрагменты можно клонировать в стандартные векторы для экспрессии белков, такие как бакуловирусный вектор, и использовать для инфицирования соответствующих клеток- хозяев (см., например, O'Reilly et al., "Baculovirus Expression Vectors: A Lab Manual," Freeman & Co., 1992). Клетки-хозяева культивируют с тем, чтобы они экспрессировали заданные вакцинные белки, которые можно очищать до нужной степени чистоты и готовить в виде подходящего вакцинного продукта.
Генно-инженерные белки, применимые в вакцинах, можно экспрессировать, например, в клетках насекомых, клетках дрожжей или клетках млекопитающих. Генно-инженерные белки, которые можно очищать или выделять обычными методами, можно непосредственно инокулировать свиньям или другим млекопитающим для того, чтобы защитить от свиного TTV.
Линию клеток насекомых (подобную sf9, sf21 или HIGH- FIVE) можно трансформировать с помощью вектора для переноса, содержащего полинуклеиновые кислоты, полученные при использовании вируса или скопированные с вирусного генома, который кодирует один или более иммунодоминантных белков вируса. Вектор для переноса включает, например, линеаризованную ДНК бакуловируса и плазмиду, содержащую заданные полинуклеотиды. Линию клеток-хозяев можно совместно трансфицировать с помощью линеаризованной ДНК бакуловируса и плазмиды, чтобы получить рекомбинантный бакуловирус.
Или же ДНК из выделенного свиного TTV, которая кодирует один или более капсидных белков, можно встраивать в живые векторы, такие как поксвирус (вирус группы оспы) или аденовирус, и применять в качестве вакцины.
Иммунологически эффективное количество вакцины по настоящему изобретению вводят свиньям или другим млекопитающим, которым необходима защита против указанной инфекции или синдрома. "Иммунологически эффективное количество" можно легко определить или тестировать с помощью стандартного тестирования. Эффективное количество означает такое количество, с помощью которого достигается иммунологический ответ на вакцину, достаточный для защиты свиньи или другого млекопитающего, подвергшихся действию вируса свиного TTV или коинфекции свиного TTV, которая может вызвать синдром дерматита и нефропатии поросят (PDNS), мультисистемный синдром истощения после отъема поросят от свиноматки (PMWS) или родственное заболевание. Предпочтительно, свинью или млекопитающее другого вида защищают в той степени, в которой значительно уменьшаются, становятся менее интенсивными или полностью предупреждаются от одного до всех неблагоприятных физиологических симптомов или эффектов вирусного заболевания.
Вакцину можно вводить в виде разовой дозы или в виде повторных доз. Дозы могут составлять, например, около 1-1,000 микрограмм вирусного антигена (в зависимости от концентрации иммуноактивного компонента вакцины), но не должны содержать количество вирусного антигена, достаточное для того, чтобы вызвать побочную реакцию или физиологические симптомы вирусной инфекции. В уровне техники известны методы определения или титрования подходящих доз активного антигенного агента с учетом веса птицы или млекопитающего, концентрации антигена и других стандартных факторов.
Вакцину можно вводить свиньям. Вакцину также можно давать людям, таким как свиноводы (работники свиноферм), подвергающиеся повышенному риску инфицирования вирусным агентом. Предполагается, что можно создать вакцину на основе TTV свиньи, чтобы обеспечить общую защиту против свиного и человеческого TTV. Другими словами вакцину на основе свиного TTV можно, предпочтительно, создавать таким образом, чтобы защитить от инфицирования человеческим TTV, за счет использования так называемого "метода Дженнера" (т.е. по методу Эдварда Дженнера можно использовать вакцину вируса коровьей оспы против человеческой натуральной оспы). Желательно, чтобы вакцина вводилась непосредственно свиньям или млекопитающим другого вида, не подвергавшимся воздействию TTV вируса. Вакцину удобно вводить перорально, интрабуккально, интраназально, трансдермально, парентерально и т.д. Парентеральный путь введения включает, но без ограничения, внутримышечный, внутривенный, интраперитонеальный и подкожный пути.
Для введения в виде жидкости вакцину по настоящему изобретению можно приготовить в виде водного раствора, сиропа, эликсира, настойки и т.п. Такие лекарственные формы известны в уровне техники, и их обычно готовят, растворяя антиген и другие обычные добавки в соответствующих системах носителя или растворителя. Подходящие носители или растворители включают, но без ограничения, воду, физиологический солевой раствор, этанол, этиленгликоль, глицерин и т.д. Стандартные добавки представляют собой, например, одобренные красители, корригенты (придающие вкус и аромат), подсластители и противомикробные вещества - консерванты, такие как тимеросал (этилртутьтиосалицилат натрия). Такие растворы можно стабилизировать, например, добавляя частично гидролизованный желатин, сорбит или клеточную культуральную среду, и можно забуферивать обычными методами, используя реагенты, известные в уровне техники, такие как гидрофосфат натрия, дигидрофосфат натрия, гидрофосфат калия, дигидрофосфат калия, их смесь и т.п.
Жидкие лекарственные формы могут включать суспензии и эмульсии, которые содержат суспендирующие или эмульгирующие агенты в сочетании с другими стандартными составляющими. Эти типы жидких лекарственных форм можно приготовить обычными методами. Например, суспензии можно приготовить с помощью коллоидной мельницы. Эмульсии можно приготовить, используя, например, гомогенизатор.
Парентеральные лекарственные формы, созданные для введения в виде инъекции в системы жидкостей организма, требуют соответствующей изотоничности и буферизации pH до уровней, соответствующих уровням жидкостей организма млекопитающего. При необходимости изотоничность можно соответствующим образом корректировать хлоридом натрия или другими солями. Для повышения растворимости ингредиентов в лекарственной форме и устойчивости жидкого препарата можно применять соответствующие растворители, такие как этанол или пропиленгликоль. Другие добавки, которые можно применять в вакцине по настоящему изобретению, включают, но без ограничения, декстрозу, обычные антиоксиданты и обычные хелатирующие агенты, такие как этилендиаминтетрауксусная кислота (ЭДТА). Парентеральные лекарственные формы необходимо также стерилизовать перед применением.
Нижеприведенные примеры демонстрируют некоторые аспекты настоящего изобретения. Однако, понятно, что эти примеры даются только для иллюстрации и не претендуют на то, чтобы быть исчерпывающими в том, что касается условий и объема данного изобретения. Следует понимать, что когда даются типичные условия реакции (например, температура, время реакции и т.д.), то могут также применяться условия как выше, так и нижеуказанных интервалов, хотя, они, как правило, менее подходят. Реакции в примерах проводят при комнатной температуре (от около 23°С до около 28°С) и при атмосферном давлении. Если не указано иначе, в данном описании части и проценты даются как весовые части и весовые проценты, а все температуры указываются в градусах Цельсия.
Пример 1
Экстракция вирусной ДНК, вложенная ПЦР и геномная ПЦР
В исследовании использовали подходящие образцы сыворотки и семенной жидкости от 20 обычных взрослых боровов со свинофермы в Виргинии. Тотальную ДНК выделяли из 20 образцов сыворотки и 19 образцов семенной жидкости, используя мини-набор для выделения ДНК QIA.K.mp DNA mini kit (Qiagen). Для скрининга на позитивные PTTV- содержащие образцы сначала осуществляли амплификацию консервативных областей в UTR PTTV1 и PTTV2 методом "вложенной" ПЦР, используя полимеразу AmpliTag Gold (Applied Biosystems). Две пары праймеров, применяемых для амплификации фрагмента А в PTTV1, представляли собой TTV1- mF (SEQ ID NO: 45)/TTV1-mR (SEQ ID NO:46) (для первого раунда ПЦР) и TTV1-nF (SEQ ID NO:47)/TTV1-nR (SEQ ID NO:48) (для второго раунда ПЦР), тогда как две пары праймеров, применяемых для амплификации фрагмента D в PTTV2, представляли собой TTV2-mF (SEQ ID NO:49)/TTV2-mR (SEQ ID NO:50) (для первого раунда ПЦР) and TTV2-nF (SEQ ID NO:51)/TTV2-nR (SEQ ID NO:52) (для первого раунда ПЦР; Фиг.1А и Таблица 1).
Для того, чтобы амплифицировать полноразмерные геномные последовательности как PTTV1, так и PTTV2, мы сначала осуществляли обращенную геномную ПЦР, используя пару консервативных ген- специфических праймеров TTV1-IF (SEQ ID NO:1)/TTV1-IR (SEQ ID NO:4), локализованных в области А для PTTV1, и другую пару ген-специфических праймеров TTV2-IF (SEQ ID NO:5)/TTV2-IR (SEQ ID NO:8), локализованных в области D для PTTV2, соответственно, со слитой с Геркулазой II ДНК-полимеразой (Stratagene) согласно инструкциям производителя. Не было обнаружено никаких ПЦР-продуктов ожидаемого размера. Затем мы создали новые наборы праймеров для амплификации двух областей, охватывающих полные PTTV1 и PTTV2 геномы, во втором раунде ПЦР, соответственно (Фиг.1А). Пара праймеров, которую использовали для амплификации фрагментов В и С в PTTV1, представляла собой TTV1-IF (SEQ ID NO:1)/TTV1-2340R (SEQ ID NO:2) и TTV1-231 IF (SEQ ID NO:3)/TTV1-IR (SEQ ID NO:4), соответственно, тогда как пара праймеров, используемая для амплификации фрагментов Е и F в PTTV2, представляла собой TTV2-IF (SEQ ID NO:5)/TTV2-2316R (SEQ ID NO:6) и TTV2-GCF (SEQ ID NO:7)/TTV2-IR (SEQ ID NO:8), соответственно (Фиг.1А и Таблица 1). Фрагменты С и F содержат GC- богатые области PTTV1 и PTTV2, соответственно. Амплифицированные ПЦР-продукты по отдельности вырезали, очищали и последовательно клонировали в вектор pSC-B-amp/kan (Stratagene), используя набор для ПЦР-клонирования StrataClone Blunt PCR cloning kit в соответствии с указаниями производителя (Stratagene) с последующим секвенированием ДНК.
Пример 2
Скрининг на образцы, позитивные в отношении свиного TTV, взятые у свиней на ферме в Виргинии
Недавно у свиней в различных географических регионах детектировали ДНК свиного TTV методом "вложенной" ПЦР на основе UTR (нетранслируемой) последовательности японского PTTV1 штамма Sd- TTV31 (McKeown et al., 2004, см. выше). С учетом недавней идентификации PTTV2 два различных набора праймеров для вложенной ПЦР применяли для амплификации области A PTTV1 и области D PTTV2, соответственно (Фиг.1А) (Ellis et al., 2008, см. выше; Kekarainen, Т., Sibila, M., and Segales, J. (2006). Prevalence of swine Torque teNO virus in post-weaning multisystemic wasting syndrome (PMWS)-affected and NOn-PMWS-affected pigs in Spain. J Gen Virol 87(Pt 4), 833-7; Krakowka et al., 2008, supra). Аналогичный метод обнаружения был также применен в настоящем исследовании для идентификации штаммов PTTV от свиней в Соединенных Штатах. Чтобы провести скрининг на образцы, позитивные в отношении отечественных PTTV1- или PTTV2-вирусов, для последующего использования с целью определения полноразмерных геномных последовательностей методом вложенной ПЦР проводят анализ 20 образцов сыворотки (SR#1-20) и 19 образцов семенной жидкости (SM#1-18 и SM#20), взятых у 20 свиней (боровов) на ферме в Виргинии. К нашему удивлению, все 20 образцов сыворотки были позитивны в отношении PTTV1, а 19 были также позитивны в отношении PTTV2 (за исключением SR#18). Напротив, только один образец семенной жидкости (SM#6) был PTTV1-позитивным и 3 образца семенной жидкости (SM#8, 9 и 20) были PTTV2-позитивными. Этот результат соответствовал результатам недавнего исследования в Испании, в котором было показано, что образцы семенной жидкости свиней являются позитивными в отношении PTTV ДНК (Kekarainen, Т., Lopez-Soria, S., and Segales, J. (2007). Detection of swine Torque teNO virus geNOgroups 1 and 2 in boar sera and semen. TheriogeNOlogy 68(7), 966- 71), и таким образом напрашивается мысль о возможной вертикальной передаче PTTV. Однако скорости распространения как PTTV1, так и PTTV2 в семенной жидкости значительно ниже, чем в сыворотке, это говорит о том, что нет прямой ассоциации между присутствием PTTV ДНК в сыворотке и семенной жидкости одной и той же свиньи.
Пример 3
Последовательности и филогенетический анализ
Родовой анализ и выравнивание ДНК- и аминокислотных последовательностей проводили, используя пакет программ Lasergene (DNASTAR Inc., Madison, WI). Геномные последовательности трех известных штаммов PTTV и их соответствующие регистрационные номера в GenBank, применяемые для выравнивания и сравнения, это Sd-TTV31 (АВ076001), TTV - 1p (AY823990) и TTV - 2p (AY823991). Попарное сравнение последовательностей (PASC) осуществляли, используя 121 полноразмерную геномную последовательность штаммов TTV человека и животных из GenBank, с помощью он-лайн программы PASC (http://www.ncbi.nlm.nih.gov/sutils/pasc/viridty.cgi?textpage=overview) (Bao et al., 2008).
Филогенетические деревья строят методом объединения ближайших соседей связывания с применением программы PAUP 4.0 (David Swofford, Smithsonian Institute, Washington, DC, распространяется Sinauer Associate Inc.) на основе полноразмерных геномных последовательностей и предсказанных аминокислотных последовательностей 4 ORF семи штаммов PTTV. Данные были получены посредством 1000-кратной повторной выборки.
Пример 4
Дизайн ПЦР-праймеров для диагностики инфицирования свиным PTTV Анализ и выравнивание последовательностей ДНК осуществляли, применяя пакет программ Lasergene (DNASTAR Inc., Madison, WI). Далее даны полноразмерные геномные последовательности десяти штаммов свиного TTV и их соответствующие регистрационные номера в GenBank, используемые для выравнивания. Вид PTTV1: Sd-TTV31 (АВ076001), PTTV1a - VA (GU456383), TTV - 1p (AY823990), PTTV1b - VA (GU456384), swSTHY - TT27 (GQ120664) и TTV1 #471819 (GU188045). Вид PTTV2: PTTV2b - VA (GU456385), PTTV2c - VA (GU456386), TTV - 2p (AY823991) и TTV2 #472142 (GUI 88 046). Были идентифицированы консервативные последовательности среди 6 PTTV1 и 4 PTTV2 геномов, соответственно, а затем использованы для того, чтобы управлять отбором праймеров для ПЦР в реальном времени с применением программы Beacon Designer (PREMIER Biosoft International, Palo Alto, CA). Праймеры, используемые для дуплексной вложенной ПЦР для PTTV1, были созданы с помощью пакета программ Lasergene.
Пример 5.
Стандартные кривые ПЦР в реальном времени для PTTV1 и PTTV2 Область 2091 п.о., соответствующая ПЦР фрагменту В генома PTTV1b- VA, повторно амплифицировали при использовании того же самого ПЦР-фрагмента с применением праймеров TTV1-IF (5'-CATAGGGTGTA.K.CCA.K.TCAGATTTA.K.GGCGTT-3') и TTV1-2340R (5'-GGTCATCAGACGATCCATCTCCCTCAG- 3'), как описано ранее (Huang et al., 2010). Полученный в результате ампликон очищают экстракцией в геле, используя набор QIAquick Gel Extraction Kit (Qiagen), и количественно определяли на NaNODrop спектрофотометре, который использовали в качестве стандартной матрицы для ПЦР в реальном времени свиного TTV вида 1. Клон полноразмерной ДНК штамма PTTV2c- VA, pSC-PTTV2c, конструировали, собирая ПЦР-фрагменты Е и F из PTTV2c- VA в векторе pSC-В-amp/kan (Huang et al., неопубликованные данные). Плазмиду pSC-PTTV2c (7082 п.о.) использовали в качестве стандартной матрицы для ПЦР в реальном времени свиного TTV вида 2, и концентрацию плазмидной ДНК измеряли с помощью NaNODrop спектрофотометра. Для построения стандартных кривых ПЦР в реальном времени использовали 10-кратные серийные разведения двух матриц, соответственно.
Пример 6
Экстракция вирусной ДНК для ПЦР анализов
Тотальную ДНК выделяют из 20 образцов сыворотки и 19 образцов семенной жидкости, взятых от 20 конвенциональных взрослых свиней (боровов) (без клинических синдромов) со свинофермы в Виргинии, используя мини- набор для выделения ДНК QIA.K.mp DNA mini kit (Qiagen) как описано выше (Huang et al., 2010). Объем образца, используемого для экстракции ДНК, составлял 400 мкл для сыворотки и семенной жидкости, причем последний элюат представлял собой 50 мкл стерильной воды. Все образцы экстрагированной ДНК хранили при -20°С до проведения RT тестирования путем ПЦР в реальном времени. Обнаружение свиных TTV в этих образцах стандартной вложенной ПЦР описано ранее (Huang et al., 2010). В качестве негативного контроля используют тотальную ДНК, экстрагированную из образца сыворотки козы тем же методом.
Пример 7
Количественные ПЦР-анализы в реальном времени с красителем SYBR PTTV1- и PTTV2-специфические ПЦР в реальном времени проводили, соответственно, с применением набора SensiMix SYBR & Fluorescein kit (Quantace Ltd) и прибора MyiQ iCYCLER для ПЦР в реальном времени (BIO-RAD Laboratories). Каждые 25- мкл реакционной смеси содержали 12.5 мкл красителя SYBR green Master Mix, 4 мкл экстрагированной ДНК, 0.5 мкл каждого праймера (10 нМ) и 7.5 мкл стерильной воды. Условия ПЦР для PTTV1 были следующие: 10 мин при 95°С, а затем 40 циклов амплификации (15 сек при 95°С, 30 сек при 59.4°С, 10 сек при 72°С). После этого сразу же определяют температуру плавления, постепенно повышая температуру с 55°С до 95°С, при этом через каждые 0.5°С измеряют флуоресцентный сигнал. Условия ПЦР для PTTV2 были те же, что и для PTTV1, за исключением того, что температура отжига была 56°С. В каждом опыте в качестве позитивного контроля включают стандартные матрицы для PTTV1 и PTTV2. Анализ амплификации и результатов проводят с помощью программы MyiQ System (BIO-RAD Laboratories). Все образцы ставят в двойном повторе на одном и том же планшете.
Пример 8.
Специфичность и чувствительность моноплексных анализов Оптимальные температуры отжига для амплификации в PTTV1- и PTTV2-специфических анализах составляли 59.4°С и 56°С, соответственно, как определено с помощью 10-кратного разведения амплификации с применением градиента температур отжига. Амплификацию продукта 118-п.о. с применением праймеров TTV1F/TTV1R удалось провести только с PTTV1 матрицей, тогда как амплификацию продукта 200-п.о. с использованием матрицы PTTV2 наблюдали только, когда использовали праймеры TTVF4/TTVR4. Ни в одном анализе не наблюдали никаких продуктов перекрестной амплификации, что подтверждает специфичность праймеров и мишеней (данные не показаны).
Стандартную кривую для PTTV1 строили в интервале концентраций целевой ДНК на 25 мкл. Было показано, что линейный интервал охватывает от 4.4×101 до 4.4×108копий. Минимальный предел обнаружения (44 копии) соответствовал пороговому циклу (Ct) 37.57. Предполагалось, что тестируемые образцы с Ct>37.57 находятся ниже предела обнаружения и не поддаются количественному определению. Аналогично строили стандартную кривую PTTV2 и использовали ее для обнаружения концентрации ДНК от 8.6×10° до 8.6×108 копий на 25 мкл реакционной смеси. Пороговый цикл Q, соответствующий минимальному пределу обнаружения (8.6 копий), был 36.53. Все образцы, которые рассматривались как PTTV1- или PTTV2- позитивные, имели число копий ниже соответствующего максимального предела обнаружения. Кривые плавления с применением 10- кратного разведения PTTV1 или PTTV2 стандартной матрицы (Фиг.6А и 6В; синие кривые), так же как 20 образцов сыворотки свиней, дают температуры плавления (Tm) 87.0°С для PTTV1 и 80.0°С для PTTV2, соответственно (Фиг.6А и 6В; красные кривые). Не наблюдается никаких пиков для негативного контроля с применением стерильной воды или ДНК сыворотки козы в качестве матриц (Фиг.6А и 7В; черные линии).
Пример 9
Количественное определение свиного TTV1 и TTV2 в образцах сыворотки или семенной жидкости свиней (боровов)
Пример 10
Анализ PTTV1/PTTV2 методом дуплексной ПЦР в реальном времени
Анализ PTTV1/PTTV2 методом дуплексной ПЦР в реальном времени (RT-ПЦР) осуществляют в ПЦР-системе на 25 мкл, содержащей 12.5 мкл красителя SYBR green Master Mix, 0.5 мкл каждого из PTTV1 праймеров, 0.5 мкл каждого из PTTV2 праймеров, 4 мкл ДНК и 6.5 мкл стерильной воды. Условия дуплексной ПЦР и метод определения температуры плавления были те же, что и в случае PTTV1, за исключением того, что температура отжига составляла 58°С. Пики температур плавления анализируют, чтобы различить PTTV1- и PTTV2-специфические ампликоны.
Пример 11
Дуплексная вложенная ПЦР
Первый раунд ПЦР осуществляли с набором Platinum PCR HiFi Supermix (Invitrogen), используя 4 мкл экстрагированной ДНК в общем объеме 50 мкл. Для ПЦР применяли следующие условия: 30 циклов 94°С по 30 сек, 55°С по 30 сек, 72°С по 30 сек с начальной денатурацией матричной ДНК при 94°С в течение 2 мин. Аликвоту продукта первого раунда ПЦР использовали для второго раунда ПЦР с теми же самыми ПЦР-реагентами и в тех же самых условиях. Одну пару праймеров, P1ab- mF/P1ab- mR применяли в первом раунде ПЦР, тогда как во втором раунде ПЦР применяли смесь двух пар праймеров, P1a-nF/P1a-nR для обнаружения PTTV1a и P1b-nF/P1b-nR для обнаружения PTTV1b (Таблица 1). Продукты амплификации визуализировали гель-электрофорезом в 1% агарозном геле, окрашенном этидия бромидом, и две полосы для каждого типа различали в УФ-лучах.
Пример 12
Конструирование экспрессионных плазмид PTTVI и PTTV2 ORF С-концевые участки ORF1 PTTV1a, PTTV1b и PTTV2c амплифицировали при использовании соответствующих клонов полноразмерной ДНК (pSC-PTTV1a, pSC-PTTV1b и pSC-PTTV2c; описаны в другом месте). Предполагалось, что амплифицированные фрагменты кодируют белковые продукты с 319 а.к. (аминокислотами, а.к.) для PTTV1a (положения ORF1 а.к. 317-635 (SEQ ID NO:13); регистрационный номер в GenBank GU 456383), 318 а.к. для PTTV1b (ORF1 а.к. положения 322-639 (SEQ ID NO:14); регистрационный номер в GenBank GU456384), и 316 а.к. для PTTV2c (ORF1 а.к. положения 310-625 (SEQ ID NO:16); регистрационный номер в GenBank GU456386), соответственно. С-концевой усеченный (процессированный) фрагмент PTTV1b, кодирующий 248 аминокислот (а.к.) (ORF1 а.к. положения 322-569 (SEQ ID NO:14)), также амплифицировали и применяли в качестве контроля для сравнения результатов в SDS-PAGE анализе. Все плазмиды конструировали клонированием ПЦР-продуктов в тройной вектор экспрессии pTriEx1.1-Neo (NOvagen) в клетки Е.coli/бакуловирус/млекопитающих между сайтами рестрикции Ncol и Xhol для получения белков, слитых с 8×His-хвостом на С- конце. Четыре рекомбинантные плазмиды были обозначены pTri - PTTV1a- ORF1, pTri- PTTV1b- ORF1, pTri- PTTV1b-ORF1ctruc и pTri - PTTV2c-ORF1. Все клонированные последовательности были подтверждены секвенированием ДНК.
Пример 13
Экспрессия рекомбинантных белков PTTVI и PTTV2
Компетентные клетки штамма Rosetta 2 (ВЕЗ) pLacI (NOvagen) трансформировали четырьмя экспрессионными плазмидами, соответственно, и бактерии высевали на плашки с LB агаром, содержащие 100 мкг/мл ампициллина, и выращивали в течение ночи при 37°С.Одну выросшую в результате трансформации колонию для каждой конструкции использовали для инокуляции 3 мл LB среды, содержащей 100 мкг/мл ампициллина (LB/amp), и выращивали 6-8 часов при 37°С. Мутную культуру - 3 мл для каждой конструкции - использовали затем для создания исходных бактериальных растворов путем добавления стерилизованного фильтрацией 25%-ного раствора глицерина и замораживания культуры при температуре ниже -80°С. Перед очисткой 10 мкл замороженного исходного бактериального раствора для каждой конструкции использовали для инокуляции 3 мл начальной культуры LB/amp и выращивали 6-8 часов при 37°С. 100 мл стоявшей с вечера (Overnight) среды Express ТВ Media (NOvagen) инокулировали начальной культурой, чтобы индуцировать экспрессию белка, и выращивали 16-18 часов при 37°С.После инкубации полученную в результате самоиндукции культуру центрифугировали при 3400 об/мин в течение 15 минут при 4°С. Полученный супернатант для каждой конструкции отбрасывали, а каждый из бактериальных осадков хранили при -20°С до момента употребления.
Пример 14
Очистка и диализ рекомбинантных белков
Рекомбинантные белки были нерастворимы и экспрессировались (и локализовались) в бактериальных тельцах включения. Каждый из бактериальных осадков (пеллет) обрабатывали реагентом BugBuster для экстракции белков и глизоцимом согласно протоколу производителя, а для разрушения ДНК и РНК добавляли нуклеазу - бензоназу (NOvagen). Затем каждый из осадков телец включения последовательно ресуспендировали в 840 мкл буфера для лизиса (6М гуанидина гидрохлорида, 0.1М фосфата натрия, 0.01М Tris-хлорида, 0.01М имидазола, pH 8.0) и замораживали при -80°С по меньшей мере в течение 30 минут. Затем осадки размораживали, разводили в дополнительном количестве (2.5 мл) буфера для лизиса и осторожно перемешивали при вращательном движении в течение 30 минут при комнатной температуре. Супернатанты лизата собирали центрифугированием с ускорением 15000×g в течение 30 минут при комнатной температуре. В каждый декантированный супернатант добавляли 50%-суспензии Ni-NTA His-bind (NOvagen), и смеси встряхивали в течение 60 минут при комнатной температуре для того, чтобы промотировать связывание his-метки. Смеси лизат/смола загружали в пустую хроматографическую колонку. После начального элюата в колонку добавляли 7 мл буфера для лизиса, оставляли элюироваться. Затем каждую колонку дважды промывали промывочным буфером порциями по 7 мл (8М мочевины, 0.1 М фосфата натрия, 0.15 М хлорида натрия, 0.02М имидазола, pH 8.0). Элюцию белка-мишени (целевого белка) осуществляли, добавляя в колонку 4 раздельных аликвоты элюирующего буфера порциями по 1 мл (8М мочевины, 0.05 М фосфата натрия, 1М хлорида натрия, 0.5 М имидазола, pH 8.0). Четыре фракции элюата анализировали методом SDS-PAGE и окрашиванием кумасси голубым.
Элюаты, содержащие значительные концентрации целевого белка, впрыскивали в кассету для диализа объемом 0.5 мл - 3 мл со срезом (границей пропускания) молекулярной массы 20000 (Pierce). Для диализа использовали серию из 4 буферов для диализа (диализного буфера): диализный буфер 1 (6М мочевины, 0.05 М фосфата натрия, 0.8 М хлорида натрия, 0.3 М имидазола, pH 8.0), диализный буфер 2 (4 М мочевины, 0.033 М фосфата натрия, 0.533 М хлорида натрия, 0.2 М имидазола, pH 8.0), диализный буфер 3 (2.67 М мочевины, 0.022 М фосфата натрия, 0.356 М хлорида натрия, 0.133 М имидазола, pH 8.0) и диализный буфер 4 (1.5 М мочевины, 0.0148 фосфата натрия, 0.237 М хлорида натрия, 0.089 М имидазола, pH 8.0). Кассету для диализа последовательно погружали в каждый диализный буфер и вращали в нем в течение 6 часов при 4°С. По завершении диализа каждый рекомбинантный белок, слитый с His- меткой (хвостом), извлекали из кассеты, определяли количественно на спектрофотометре NaNODrop и замораживали при -80°С.
Пример 15
SDS- PAGE и Вестерн-блот (иммунный блоттинг) с помощью антитела с His-меткой (хвостом)
Метод анализа Вестерн-блот разработали для обнаружения очищенных рекомбинантных белков с использованием анти-6×His- меченного моноклонального антитела (Rockland). Равные объемы каждого из очищенных процессированных (усеченных) ORF1 белков и LDS/10% β-МЕ смешивали и кипятили при 95°С в течение 10 минут. В каждую соответствующую ячейку с 4-12% Bis-Tris полиакриламидным гелем (Invitrogen) добавляли по 10 мкл прокипяченного образца и пропускали ток с напряжением 200 вольт в течение 43 минут в 1×MES подвижном буфере (Invitrogen). Белки переносили на мембрану PVDF (Bio-Rad), используя прибор для полусухого блот-переноса Trans-blot semi-dry и 1 × буфер для переноса (Invitrogen). По завершении переноса PVDF мембрану инкубировали в Odyssey блокирующем буфере (Li-Cor) при комнатной температуре в течение 1 часа. Антитело против 6×His-меченного Mab разводили в соотношении 1:1000 в Odyssey блокирующем буфере / 0.2% tween 20 и переносили на мембрану после удаления предыдущего Odyssey блокирующего буфера. MAb оставляли инкубироваться с мембраной на качалке либо на 2 часа при комнатной температуре, либо на ночь при температуре 4°С, а затем мембрану трижды отмывали забуференным с помощью tris физиологическим раствором / 0.05% tween 20 (TBS- Т, Sigma). Козье антитело против кроличьего IgG IRDye 800 (Li-Cor) разводили в соотношении 1:5000 в Odyssey блокирующем буфере / 0.2% tween 20 / 0.1% SDS. Переносили на свежеотмытую PVDF мембрану и оставляли инкубироваться в течение 1 часа при комнатной температуре при осторожном встряхивании на качалке. Мембрану трижды отмывали TBS-Т, 1 раз TBS и визуализировали с помощью Li-Cor Odyssey.
Пример 16
Вестерн-блот сыворотки
Был разработан Вестерн-блот сыворотки и его применили для идентификации позитивного и негативного сывороточного контроля при проведении ИФА (ELISA). После проведения SDS- PAGE, описанного выше, белки переносили на PVDF мембрану, которую затем инкубировали в Odyssey блокирующем буфере (Li-Cor) при комнатной температуре в течение 1 часа. Отобранный образец сыворотки разводили в соотношении 1:100 в Odyssey блокирующем буфере / 0.2% tween 20 и переносили на мембрану после удаления предыдущего Odyssey блокирующего буфера. Образец сыворотки оставляли на качалке инкубироваться с мембраной в течение 2 часов при комнатной температуре, а затем мембрану трижды отмывали tris-забуференным физиологическим раствором/ 0.05% tween 20 (TBS-Т, Sigma). Козье антитело против IgG свиней IRDye 800 (Rockland) разводили в соотношении 1:2500 в Odyssey блокирующем буфере / 0.2% tween 20/0.1% SDS. Переносили на свежеотмытую PVDF мембрану и оставляли инкубироваться в течение 1 часа при комнатной температуре при осторожном встряхивании на качалке. Мембрану трижды отмывали TBS- Т, 1 раз TBS и визуализировали с помощью Li-Cor Odyssey.
Пример 17
Непрямой PTTV1a; PTTV1b- и PTTV2-специфический анализ ELISA (ИФА) Оптимальные концентрации антигенов, применяемые для иммобилизации на планшетах и разведении антисывороток и конъюгатов, определяли с помощью шахматного титрования. ИФА (ELISA) начинали (инициировали) разведением каждого из очищенных рекомбинантных белков, слитых с His-концом (PTTV1a, PTTV1b и PTTV2c, соответственно), до концентрации 680 нг/мл в 1 × карбонатном буфере для сенсибилизации поверхностей (ССВ) при pH 9.6, и покрывали планшеты ELISA (Greiner) для иммобилизации (100 мкл/лунка). Планшеты закрывали и оставляли инкубироваться при 37°С в течение 2 часов. После иммобилизации разведенные белки удаляли, а каждую лунку отмывали 3 раза по 300 мкл 1 × TBS-T. Затем добавили не содержащий белков блокирующий буфер (Pierce) (300 мкл/лунка) и планшеты оставили инкубироваться при 37°С в течение 1 часа. В то же время в 96- луночном блоке для разведения образцы сыворотки разводили в соотношении 1:100 в 150 мкл не содержащего белков блокирующего буфера. Затем блок удаляли и 100 мкл каждого разведения образца сыворотки переносили в каждую соответствующую лунку на планшетах ELISA. Планшеты оставляли инкубироваться при 37°С в течение 2 часов, после этого каждую лунку отмывали 3 раза по 300 мкл TBS-T. Далее, конъюгированное с HRP антитело против IgG свиней (Rockland) разводили в соотношении 1:4000 в 12 мл не содержащей белка блокирующего буфера и 100 мкл этого разведения добавляли в каждую лунку планшетов. Инкубировали при 37°С в течение 1 часа, а затем каждую лунку отмывали 3 раза по 300 мкл TBS-T. Для проявления ELISA в каждую лунку планшетов добавили по 100 мкл субстрата Sure Blue Reserve 1-Component (KPL). Спустя 20 минут в каждую лунку добавили по 100 мкл IN раствора HCL, чтобы прекратить проявление. Затем планшеты считывали при 450 нм.
Пример 18
Анализ результатов
Образцы сыворотки свиней, используемые в исследовании на клеточных культурах от торговой фирмы (полученных в Новой Зеландии и считающихся свободными от всех OIE (ВОЗЖ) заболеваний), применялась в качестве позитивного контроля в трех протоколах ELISA (ИФА), так как все образцы сыворотки были PTTV1a-, PTTV1b- и PTTV2-позитивными по определению методом Вестерн-блот для сыворотки и показывали высокую OD - оптическую плотность (>2.0). Сначала мы использовали объединенные образцы сыворотки стерильных (безмикробных, гнотобиологических) свиней в качестве негативного контроля, поскольку они были негативными в детекции методом Вестерн-блот. Затем негативные образцы сыворотки стерильных свиней мы сравнивали с некоторыми образцами сыворотки свиней с конвенциональной свинофермы в Висконсине. Они были также негативными в детекции методом Вестерн-блот (иммуноблоттинг) и значения OD соответствовали значениям OD негативной сыворотки стерильных (гнотобиологических) свиней. Эту сыворотку конвенциональных свиней мы объединяли и использовали в качестве негативного контроля. Предельное значение (порог) для каждого анализа ИФА (ELISA) рассчитывали как среднее значение OD негативной контрольной группы (n=4) плюс трехкратная стандартная девиация.
Пример 19.
Конструкция клонов полноразмерной геномной ДНК свиного TTVIa, lb и 2 с ПЦР фрагменты В и С из US (США) изолята PTTV1a- VA (регистрационный №. в GenBank GU456383) повторно амплифицировали при использовании описанных ранее конструкций, а затем собирали в полноразмерную геномную ДНК с сайтом BamH I на обоих концах генома с помощью ПЦР с перекрыванием, используя ДНК полимеразу Herculase II Fusion (Stratagene) на векторе pSC-В-amp/kan (Stratagene). Полученную в результате конструкцию обозначили pSC-PTTV1a (Фиг.17А). Используя ту же самую стратегию, конструировали клон pSC-PTTV1b (Фиг.17В), происходящий из US изолята PTTV1b-VA (регистрационный NO. в GenBank GU456384), и клон pSC-PTTV2c (Фиг.17С), восходящий к US изоляту PTTV2c-VA (регистрационный №в GenBank GU456386) с теми же самыми сайтами рестрикции (ВатН I) на векторе с тем же самым остовом. Плазмида TTV2-#471942-full (Фиг.17Е), содержащая полноразмерную геномную ДНК, получена (происходит) из патогенного изолята свиного TTV2 из Германии. TTV2-#471942 был подарен Dr. Andreas Gallei (BIVI, Germany). На основании филогенетического анализа (данные не показаны) TTV2-#471942 был отнесен к TTV свиней подтипа 2b наряду с US изолятом PTTV1b-VA.
Пример 20
Конструкция тандем-димерных ДНК клонов свиного TTV2b и 2 с Полноразмерный PTTV2c геном вырезали из клона pSC-PTTV2c расщеплением с помощью ВатН I, очищали и лигировали с образованием конкатемеров. Лигированные конкатемеры клонировали в вектор pSC-В-amp/kan, который предварительно расщепляли с помощью BamH I, получали тандем-димерную форму ДНК клона, pSC-2PTTV2c-RR (Фиг.ID). Аналогично, тандем-димерный ДНК клон, pSC-2PTTV2b-RR, получали из клона TTV2-#471942-full, используя EcoR V сайты рестрикции (Фиг.IF).
Пример 21
Получение PTTV1a-, PTTV1b- и PTTV2-специфических политональных антител против ORF1
Продукт, кодирующий ORF1, представляет собой предполагаемый капсидный белок вируса TTV. С целью генерации PTTV1a-, PTTV1b- и PTTV2-специфических анти-ORF1 поликлональных антител для детекции экспрессии PTTV ORF1 белков и для определения инфекционности PTTV ДНК клонов три ORF1 белка из PTTV1a, PTTV1b и PTTV2c экспрессировали в E.coli, очищали, а затем использовали для иммунизации новозеландских белых кроликов, соответственно, в качестве специальной услуги (службы) по получению антител в Rockland ImmuNOchemicals (Gilbertsville, PA). Каждое поликлональное антитело против ORF1 получали с использованием сыворотки иммунизированных кроликов.
Пример 22
In vitro трансфекция PTTV инфекционных клонов
Клетки РК-15 засевали при плотности 2×105 клеток на лунку в 6-луночном планшете и перед трансфекцией выращивали до 60%-70% монослоя. ДНК клоны pSC-2PTTV2b-RR и pSC-2PTTV2c-RR трансфецировали непосредственно в клетки РК-15, соответственно, используя липофектамин LTX (Invitrogen) по протоколу производителя. Соответственно, в случае клонов pSC-PTTV1a, pSC-PTTV2c и TTV2-#471942-full для трансфекции использовали их дотированные конкатемеры, полученные, как описано выше. Клетки культивировали в течение 3-5 дней, а затем применяли иммунофлуоресцентный анализ (IFA) для обнаружения экспрессии ORF1 TTV свиней. Или же трансфецированные клетки пересевали (пассировали) в новые 6-луночные планшеты и продолжали культивировать в течение 3 дней до IFA детекции.
Пример 23
Иммунофлуоресцентный анализ (IFA)
Трнасфецированные или пассированные клетки дважды отмывали в PBS и фиксировали ацетоном. Пятьсот микролитров антител, специфических к PTTV1a или PTTV2, при разведении 1:500 в PBS, прибавляли к клеткам и инкубировали в течение 1 часа при комнатной температуре. Клетки трижды отмывали PBS, а затем прибавляли 500 мкл меченного Texas red или Alexa Fluor 488 козьего антитела против кроличьего IgG (Invitrogen) в разведении 1:200. После инкубации при комнатной температуре в течение 1 часа и отмывки с применением PBS клетки окрашивали с помощью 500 мкл DAPI (KPL, Inc.) в разведении 1:1000 и визуализировали под флуоресцентным микроскопом.
Пример 24
In vivo инокуляция конвенциональных свиней тандем-димерными свиными TTV2 клонами
Изучение инокуляции свиней осуществляли с целью определить инфекционность двух тандем-димерных клонов TTV2 свиней: pSC-2TTV2b-RR и pSC-2TTV2c-RR. Коротко говоря, восемь конвенциональных свиней в возрасте 4 недель, которые были серонегативными и вирусная ДНК-негативными к TTV2 свиней, произвольно делили на две группы по четыре животных в каждой. Каждую группу животных помещали отдельно и держали в условиях, которые отвечали требованиям институционального комитета по уходу за животными и их использованию.
Всем свиньям в каждой группе делали комбинированную инъекцию как в лимфатический узел, так и внутримышечно. Каждой из четырех свиней (№181, 189, 192 и 193) инъецировали по 200 мкг pSC-2TTV2b-RR плазмидной ДНК, тогда как другим четырем свиньям (№92, 180, 188 и 191) инокулировали 200 мкг pSC-2TTV2c-RR клона. У свиней ежедневно проверяли клинические симптомы заболевания всего в течение 28 дней. На 28 день после инокуляции проводили аутопсию всех свиней.
Несмотря на то что настоящее изобретение проиллюстрировано описанием нескольких его вариантов, а иллюстративные варианты описаны детально, у заявителей нет намерения каким- либо образом ограничить объем прилагаемой Формулы изобретения до такой степени. Специалисты в данной области техники легко представят дополнительные модификации. Следовательно, изобретение в его более широких аспектах не ограничивается показанными и описанными специфическими деталями, репрезентативными устройствами и методами и иллюстративными примерами. Соответственно, можно делать отступления от таких деталей без отступления от сущности или объема основной идеи изобретения.
Реферат
Изобретения касаются инфекционной молекулы нуклеиновой кислоты, кодирующей инфекционный вирус Torque teNO свиней (PTTV), которая содержит по меньшей мере одну копию геномной последовательности, выбранной из группы, состоящей из последовательностей, соответствующих генотипам или подтипам PTTV1a-VA, PTTV1b-VA, PTTV2b-VA и PTTV2c-VA, а также биологически функциональной плазмиды или вирусного вектора, содержащего такую инфекционную нуклеотидную геномную последовательность, и клетки-хозяина, содержащей такую плазмиду или вектор. Кроме того, представленные изобретения предусматривают живые, аттенюированные, экспрессируемые при использовании вектора и очищенные рекомбинантные капсидные субъединичные или убитые вирусные вакцины для защиты против PTTV инфекции, а также способы иммунизации свиней против PTTV вирусной инфекции путем введения такой вакцины. Охарактеризованные изобретения могут быть использованы для предотвращения инфекции, вызываемой вирусом Torque teNO свиней. 11 н. и 12 з.п. ф-лы, 53 ил., 5 табл., 24 пр.

Комментарии