Выделенная полинуклеотидная молекула, кодирующая вирус torque teno, молекула рнк и вектор экспрессии - RU2502801C2
Код документа: RU2502801C2
Чертежи
















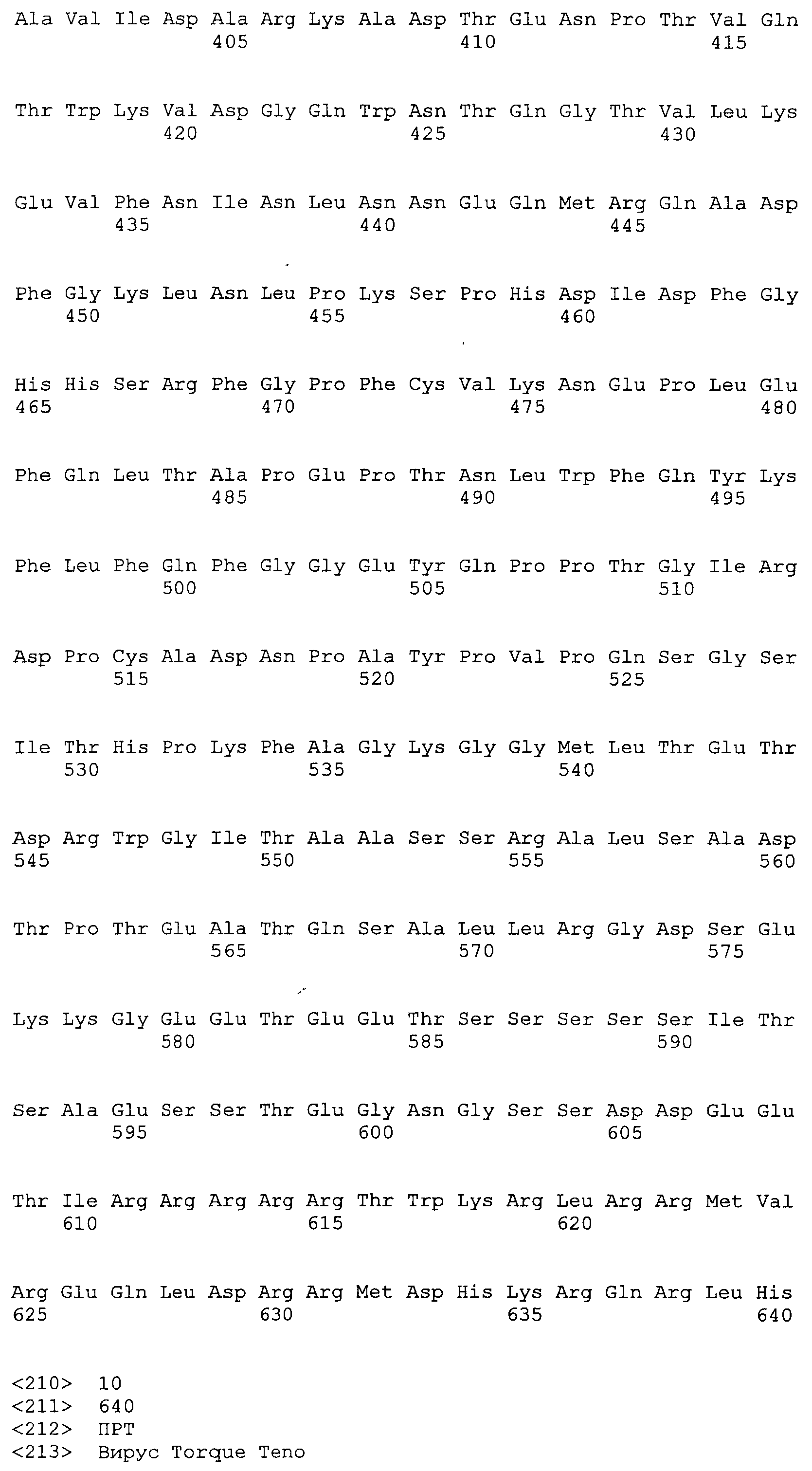


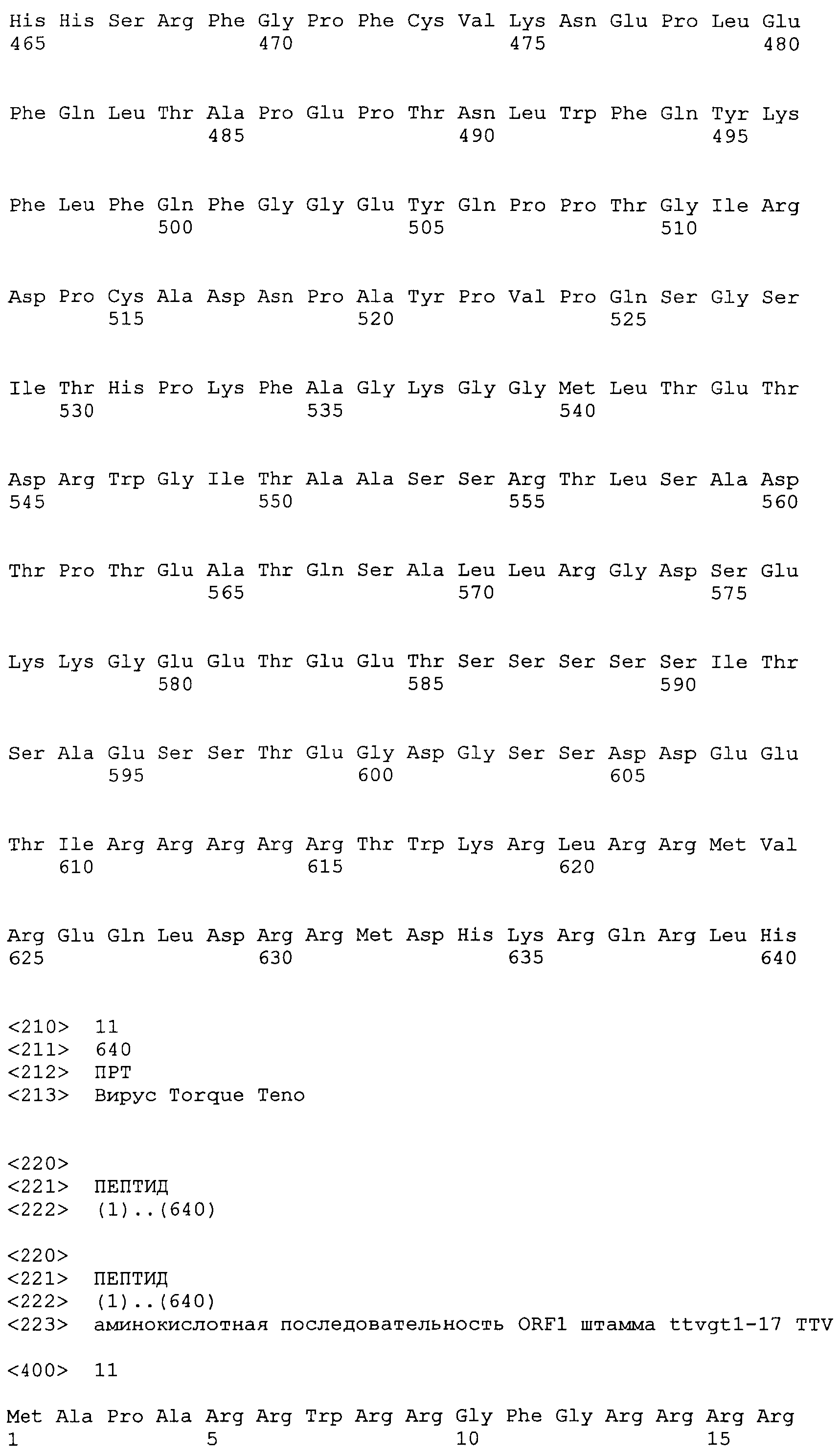


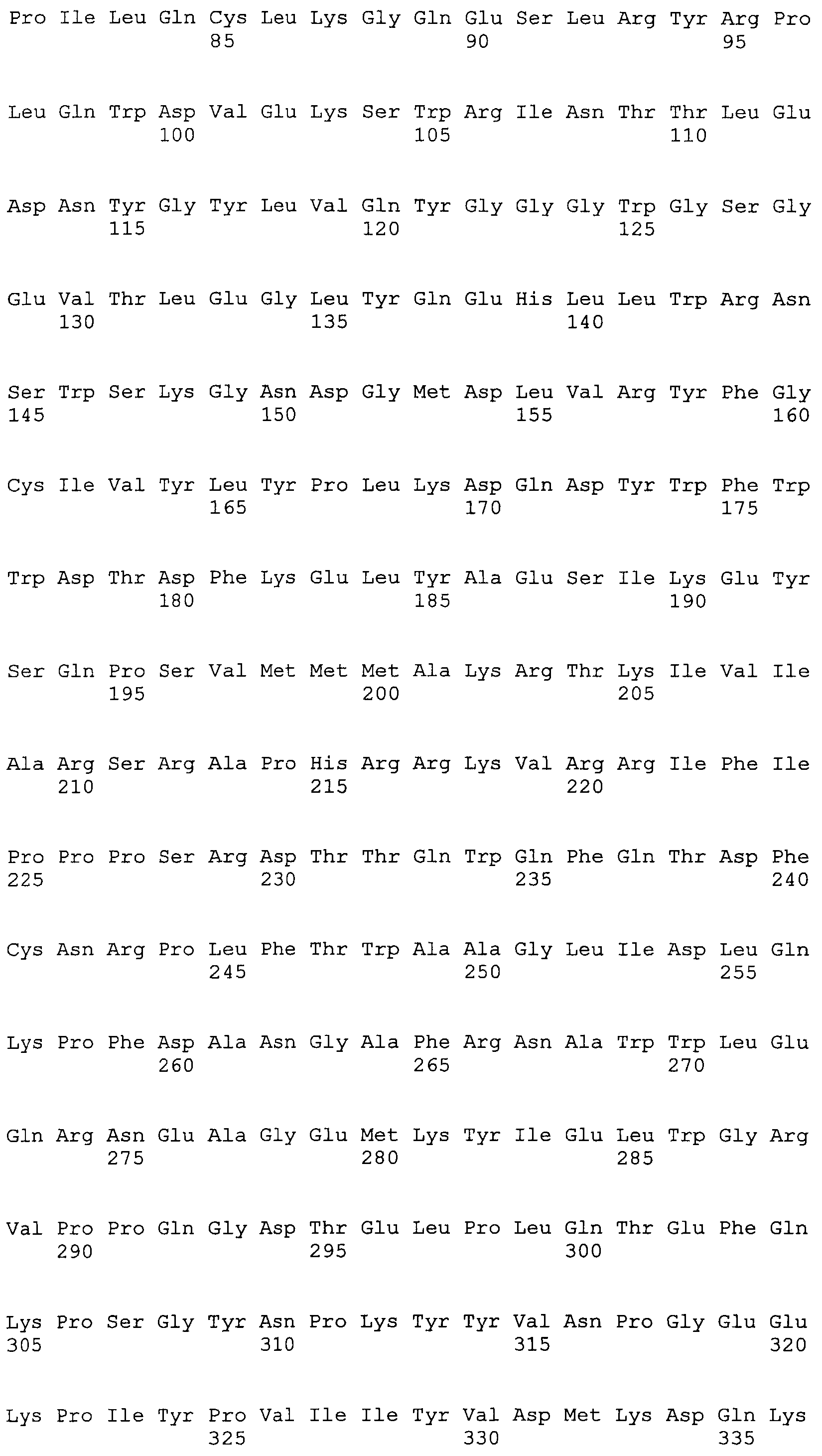


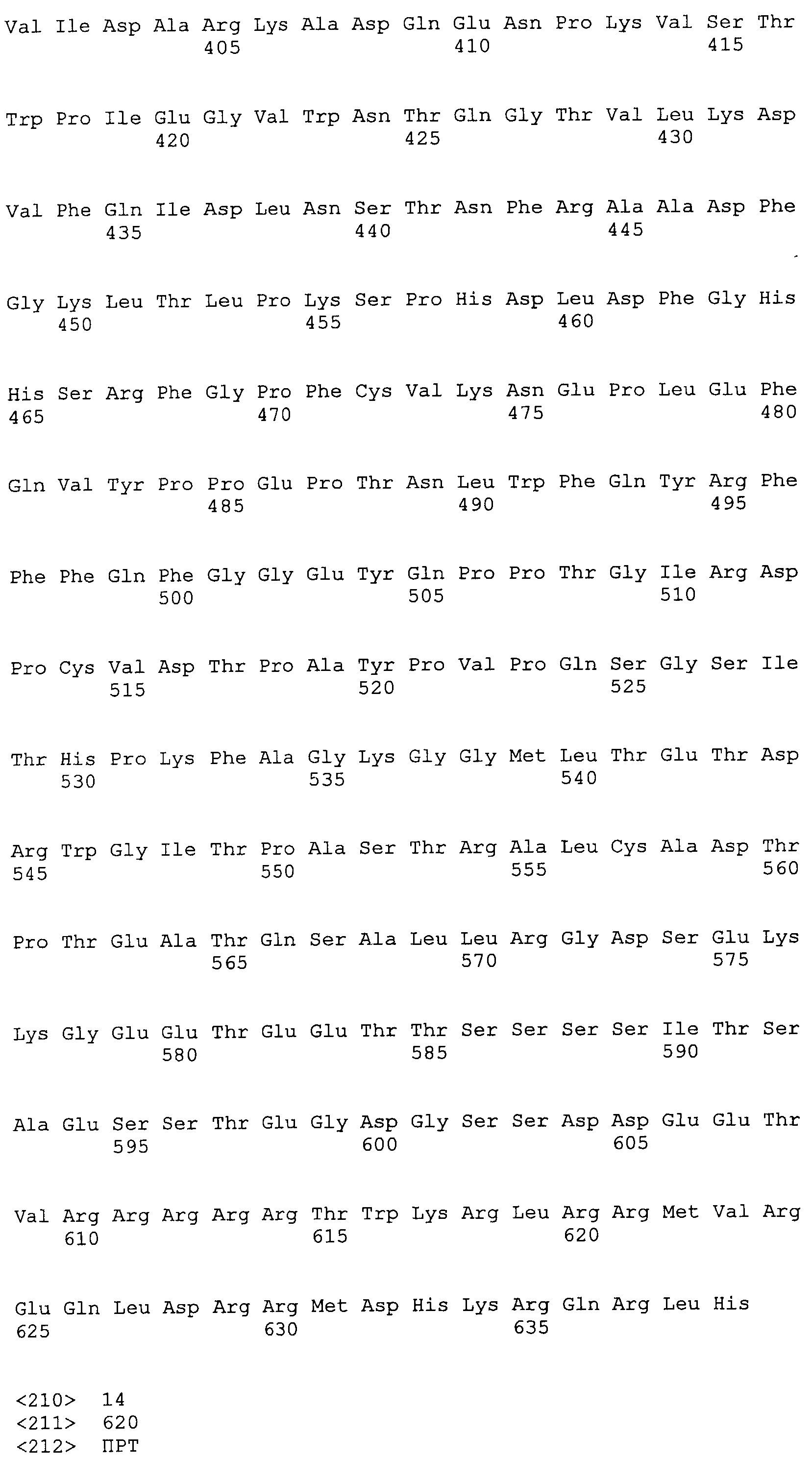



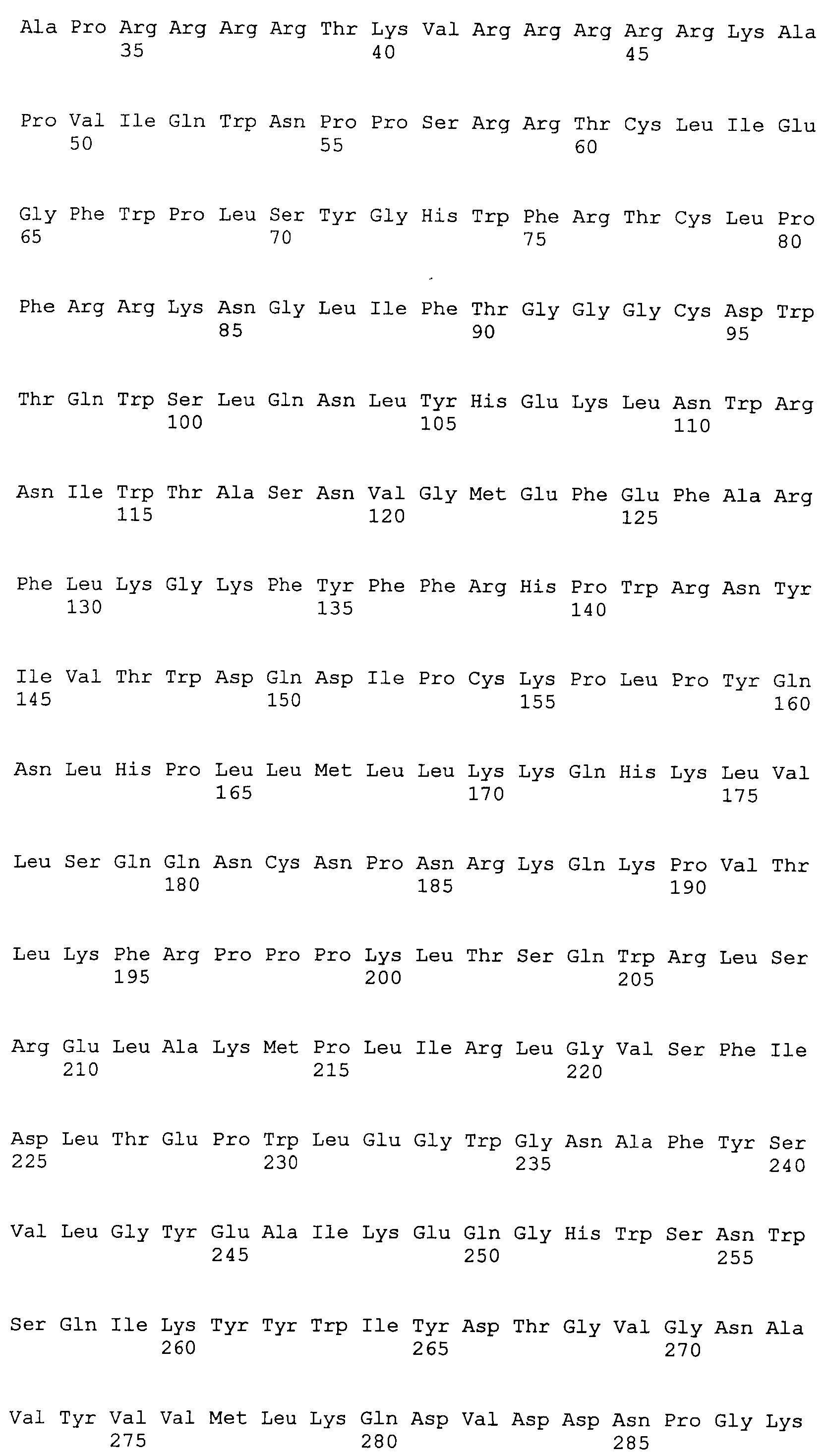
















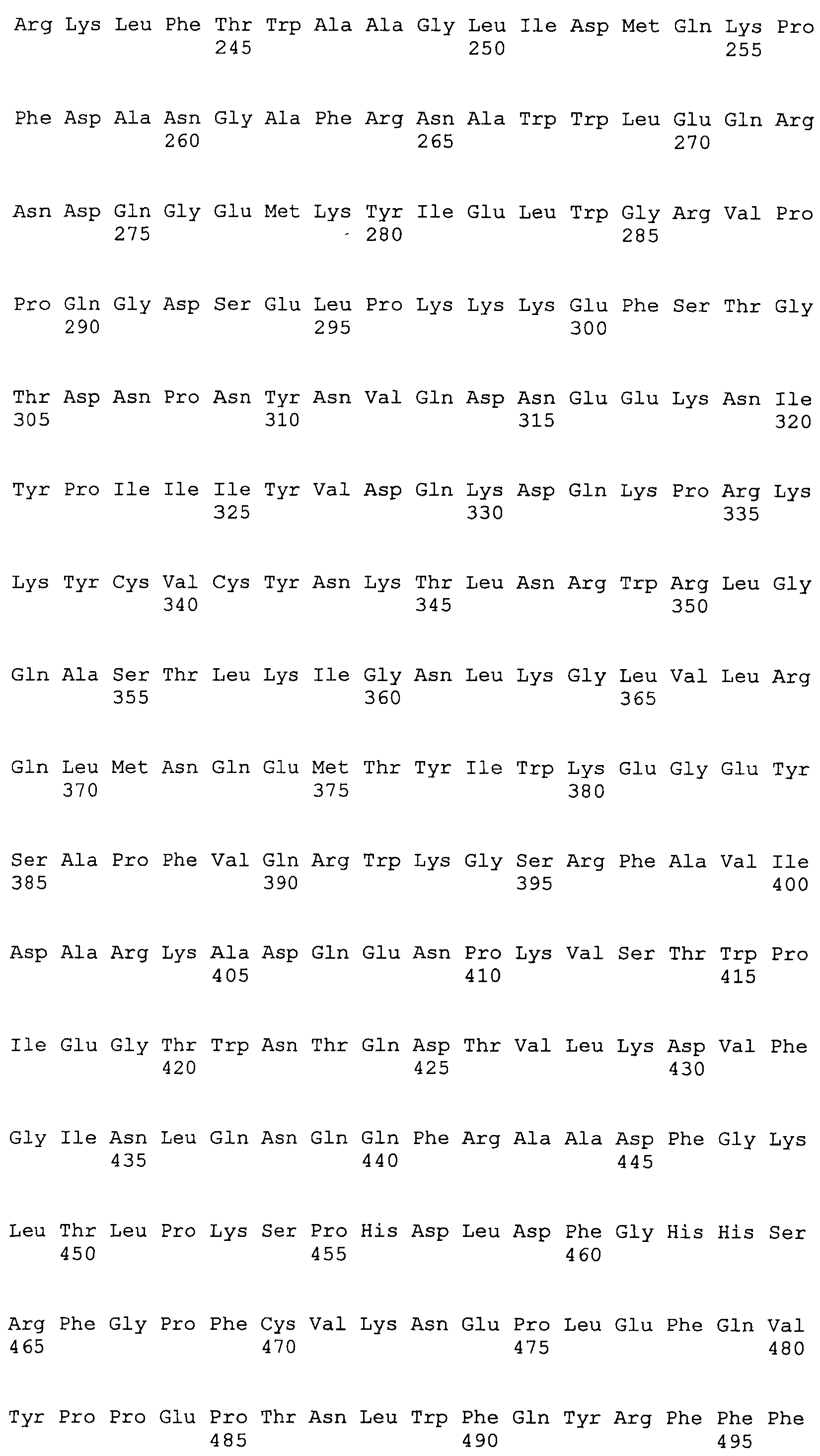











Описание
Настоящей заявкой испрашивается преимущество и приоритет согласно разделу 119 USC (свод законов США) 35 в отношении предварительной заявки на патент Соединенных Штатов 61/196468, поданной 16 октября 2008 года. Для целей национальной стадии Соединенных Штатов все содержание заявки 61/196468 включено сюда посредством ссылки во всей его полноте, как если бы оно было полностью изложенным здесь.
ОБЛАСТЬ ИЗОБРЕТЕНИЯ
Настоящее изобретение направлено на новые нуклеотидные и аминокислотные последовательности вируса Torque teno ("TTV"), включая его новые генотипы, которые все являются полезными при получении вакцин для лечения и предупреждения заболеваний у свиней и других животных. Вакцины, предложенные согласно данному изобретению, являются эффективными против многих генотипов свиного TTV и его изолятов. Диагностические и терапевтические поликлональные и моноклональные антитела также представляют собой отличительный признак настоящего изобретения, как и инфекционные клоны, полезные при распространении вируса и при получении вакцин. Особенно важно то, что раскрыты вакцины, которые содержат в качестве антигена экспрессируемый белок отдельных открытых рамок считывания TTV, в особенности из ORF (открытая рамка считывания) 1 или ORF2, и также фрагменты полноразмерных белков, кодируемых ORF1 и ORF2.
ПРЕДШЕСТВУЮЩИЙ УРОВЕНЬ ТЕХНИКИ
Вирус Torque Teno ("TTV"), также называемый вирусом, передающимся при переливании крови, обычно относят к семейству Circoviridae. Обычно считается, что TTV был впервые получен от людей-пациентов, которым переливали кровь (см., например, Nishizawa et al., Biochem. Biophys. Res. Comm. vol. 241, 1997, pp.92-97). Впоследствии TTV или TTV-подобные вирусы были идентифицированы у других млекопитающих, включая свиней, и были опубликованы данные о многочисленных штаммах или изолятах (см., например, McKeown et al. Vet. Microbiol. vol. 104, 2004, pp. 113-117).
В последующей работе было показано, что TTV и TTV-подобные вирусы являются очень распространенными; однако, патогенез TTV и вклад, который он может вносить в другие болезненные состояния (например состояния, вызванные другими вирусами и бактериями), остаются неясными. Например, инфекции TTV, по-видимому, являются обычными у людей, включая даже здоровых индивидуумов, и такие инфекции часто являются бессимптомными и могут сохраняться в течение многих лет. Кроме того, общая неспособность размножать вирус в культуре клеток и отсутствие каких-либо ясных механистических моделей заболеваний сделали затруднительной какую-либо общую характеристику биологии TTV. Несмотря на то что виремия TTV повышена у пациентов-людей, пораженных другими вирусными заболеваниями (такими как гепатит или ВИЧ/СПИД), также существует большое количество медицинской литературы, свидетельствующей о том, что на самом деле вирусы TTV являются авирулентными, и ожидается подтверждение какой-либо ясной реально существующей связи с известными болезненными состояниями. Смотрите, например, Biagini et al., Vet. Microbiol. vol. 98, 2004, pp.95-101.
В отношении свиней ситуация является похожей. Существует значительное количество работ, свидетельствующих о том, что инфекция TTV ассоциирована с многочисленными заболеваниями, такими как цирковирусная болезнь свиней (и ее различные клинические проявления, такие как мультисистемный синдром истощения после отъема поросят от свиноматки и респираторное заболевание, осложненное поражениями легких) и заболевание, ассоциированное с PRRSV (вирус респираторного и репродуктивного синдрома свиней). Смотрите, например, опубликованные международные заявки на патент WO 2008/150275 и WO 2008/127279. Krakowka et al. также сообщают о заболевании у свиней, которое часто является смертельным, называемом PDNS (синдром свиного дерматита и невропатии), которое описывают как проявление диссеминированного внутрисосудистого коагулирования, и в которое возможно была вовлечена комбинированная инфекция серотипом 1 TTV и вирусом PRRSV (Am. J. Vet Res, vol 69(12), 2008, pp.1615-1622). Заболевание PDNS также коррелировало со свиным цирковирусным заболеванием (в особенности PCV-2), а также с бактериальными инфекциями. Соответственно, хотя и была проведена значительная работа, остается мало работ, которые определенно устанавливают связь инфекции свиным TTV с конкретными патологиями. Тем не менее, стало достаточно очевидным то, что инфекция TTV может усиливать многочисленные болезненные состояния. Соответственно, существует потребность в разных классах реагентов против TTV, таких как высокоаффинные антитела, и, например, пептидные фрагменты TTV или целые вирионы, которые являются сильно иммунизирующими, как для развития нашего понимания общей биологии TTV, так и для вакцинации, прямой или непрямой, против многочисленных болезненных состояний, которым может способствовать TTV.
Таким образом, несмотря на то что существует возможность того, что TTV является основным фактором, вызывающим заболевания у свиней, более вероятным кажется то, что многочисленные заболевания свиней либо требуют присутствия более чем одного вируса, либо то, что первичный эффект определенных «первичных» патогенов усиливается инфекцией TTV. Как утверждается, существует вероятность того, что многочисленные заболевания свиней можно лечить или облегчать введением агентов против TTV пораженным или потенциально пораженным животным. Несмотря на весьма устоявшийся интерес к TTV, эффективные вакцины не появились.
TTV является маленьким безоболочечным вирусом, содержащим одноцепочечную кольцевую ДНК с отрицательной полярностью. Геном включает три главные открытые рамки считывания, ORF1, ORF2 и ORF3, которые перекрываются, и ORF1 кодирует белок капсида (Biagini et al., выше). Что касается их подробного обсуждения, смотрите следующие ссылки, которые включены посредством ссылки: Kakkola et al., Virology, vol. 382 (2008), pp.182-189; Mushahwar et al., Proc. Natl. Acad. Sci. USA, vol 96, (1999) pp.3177-3182; и Т. Kekarainen and J. Segales, "Torque teno virus infection in the pig and its potential role as a model of human infection", The Veterinary Journal, принята 13 декабря 2007 года для публикации в 2008 году.
Несмотря на относительно простой геном, обычно было очень сложно размножать данный вирус в культуре клеток или другими способами in vitro. Настоящее изобретение направлено на рекомбинантные конструкции, посредством которых TTV можно размножать in vitro, включая размножение посредством инфекционных клонов. Более конкретно, изобретение направлено на открытие, согласно которому эффективные вакцины на самом деле могут быть сделаны из TTV, наиболее конкретно, когда антиген TTV представляет собой продукт экспрессии одной ORF или ее фрагмента. В предпочтительном воплощении согласно изобретению предложены вакцины на основе белка ORFI.
КРАТКОЕ ИЗЛОЖЕНИЕ СУЩНОСТИ ИЗОБРЕТЕНИЯ
Согласно настоящему изобретению предложен способ лечения или предупреждения заболевания или расстройства у животного, вызванного инфекцией вирусом torque teno (TTV), включая болезненные состояния, которые непосредственно вызваны TTV, и болезненные состояния, которым способствует TTV или которые усиливает TTV. В предпочтительном примере животное, которое лечат, представляет собой свинью. Болезненные состояния у свиней, которые могут усиливаться посредством TTV, и которые также можно лечить или предупреждать при использовании данного изобретения, включают болезненные состояния, вызванные свиным цирковирусом (PCV) и свиным вирусом репродуктивного и респираторного синдрома (PRRS) или связанные с ними.
Настоящее изобретение также включает вариант введения комбинированной вакцины, то есть бивалентной или мультивалентной комбинации антигенов, которая может включать живые, модифицированные живые или инактивированные антигены против патогена, не являющегося TTV, с подходящим выбором адъюванта.
Частично основываясь на уникальных аминокислотных последовательностях TTV, как здесь раскрыто, согласно настоящему изобретению также предложен диагностический набор для различения между свиньями, вакцинированными вышеописанными вакцинами против TTV, и свиньями, инфицированными полевыми штаммами TTV.
Показательные воплощения изобретения включают выделенную полинуклеотидную последовательность, которая содержит полинуклеотид, выбранный из группы, состоящей из:
(a1) ДНК последовательности TTV13 (SEQ ID NO:1) генотипа 2; ДНК последовательности TTV10 (SEQ ID NO:2) генотипа 2; или ее фрагмента, который кодирует белок капсида TTV или фрагмент указанного белка;
(a2) ДНК последовательности генотипа 1, выбранной из группы, состоящей из ttvg1-7 (SEQ ID NO:4), ttvGT1-17 (SEQ ID NO:5), ttvGT-1-21 (SEQ ID NO:6), ttvgt1-27 (SEQ ID NO:3), ttvgt1-178 (SEQ ID NO:7) или ее фрагмента, который кодирует белок капсида TTV или фрагмент указанного белка;
(б) последовательности, комплементарной любой последовательности из (а);
(в) полинуклеотида, который гибридизуется с последовательностью из (а) или (б) в жестких условиях, определенных как гибридизация с ДНК, связанной с фильтром, в 0,5 М NaHPO4, 7% SDS (додецилсульфат натрия), 1 мМ EDTA (этилендиаминтетрауксусная кислота) при 65°С и промывка в 0,1×SSC (раствор цитрата и хлорида натрия)/0,1% SDS при 68°С.
(г) полинуклеотида, который является по меньшей мере на 70% идентичным полинуклеотиду из (а) или (б);
(д) полинуклеотида, который является по меньшей мере на 80% идентичным полинуклеотиду из (а) или (б);
(е) полинуклеотида, который является по меньшей мере на 90% идентичным полинуклеотиду из (а) или (б); и
(ж) полинуклеотида, который является по меньшей мере на 95% идентичным полинуклеотиду из (а) или (б).
Согласно изобретению дополнительно предложены молекулы полинуклеотидов РНК, которые представляют собой последовательности, комплементарные любой такой полинуклеотидной последовательности ДНК, и векторы и плазмиды для экспрессии любых таких полинуклеотидов РНК или ДНК, и вирус TTV, который экспрессируется с таких нуклеотидных последовательностей, где указанный вирус является живым либо полностью, или частично ослабленным.
Согласно изобретению также предложена ДНК вакцина, которая содержит полинуклеотидную последовательность, как упомянуто выше, и соответствующие нуклеотидные последовательности, которые функционируют в качестве инфекционных клонов.
Согласно изобретению предложен полипептид, кодируемый любой из открытых рамок считывания полинуклеотидов TTV13 (SEQ ID NO:1) генотипа 2 или TTV10 (SEQ ID NO:2) генотипа 2, или полипептид, который является по меньшей мере на 90% идентичным ему, или его фрагменту, включая такой вариант, что дополнительные, в другом случае идентичные аминокислоты, заменены консервативными заменами.
Согласно изобретению также предложен полипептид, кодируемый любой из открытых рамок считывания (все относятся к серотипу 1) полинуклеотидов ORF1 ttvg1-7 (SEQ ID NO:10), ttvGT1-17 (SEQ ID NO:11), ttvGT1-21 (SEQ ID NO:12), ttvgt1-27 (SEQ ID NO:13) и ttvgt1-178 (SEQ ID NO:9), или полипептид, который является по меньшей мере на 90% идентичным ему, или его фрагменту, включая такой вариант, что дополнительные, в другом случае идентичные аминокислоты, заменены консервативными заменами.
Несмотря на продолжающиеся неудачи в попытках предоставить эффективные вакцины против TTV (или ограничить способность TTV усиливать другие заболевания), как сообщалось в данной области техники, согласно настоящему изобретению предложены такие эффективные вакцины, которые предпочтительно содержат полипептид, образующийся в результате экспрессии одной открытой рамки считывания TTV, или их смесь. В предпочтительном воплощении полипептид экспрессируется с ORF1, и предпочтительные смеси включают комбинацию полипептидов ORF1 и ORF2, и ORF1 и ORF3.
В дополнительном предпочтительном воплощении, и используя информацию по основной полипептидной последовательности, раскрытой здесь, дополнительно предложены полипептидные вакцины, где антиген определен (а) первыми 100 N-концевыми аминокислотами белка капсида TTV13 (SEQ ID NO:1) или TTV10 (SEQ ID NO:2); или (б) аминокислотной последовательностью, которая является по меньшей мере на 90 процентов идентичной им; или (в) их аргинин-богатой областью.
КРАТКОЕ ОПИСАНИЕ ГРАФИЧЕСКИХ МАТЕРИАЛОВ
Фиг.1 (панели А и Б) показывает детекцию белка ORF1 иммунологическими способами.
Фиг.2 демонстрирует успешную экспрессию белка кодон-оптимизированной ORF1 TTVg1 в E.coli, с 6-кратной His-меткой для аффинной очистки.
Фиг. 3 представляет карту вектора для конструкции Chromos экспрессионной плазмиды pcTV-TTV1-7 ORF1 (плюс дрожжевая инвертаза), с которой экспрессируется вакцинный белок ORF1 (после интеграции в искусственную хромосому в клетках СНО).
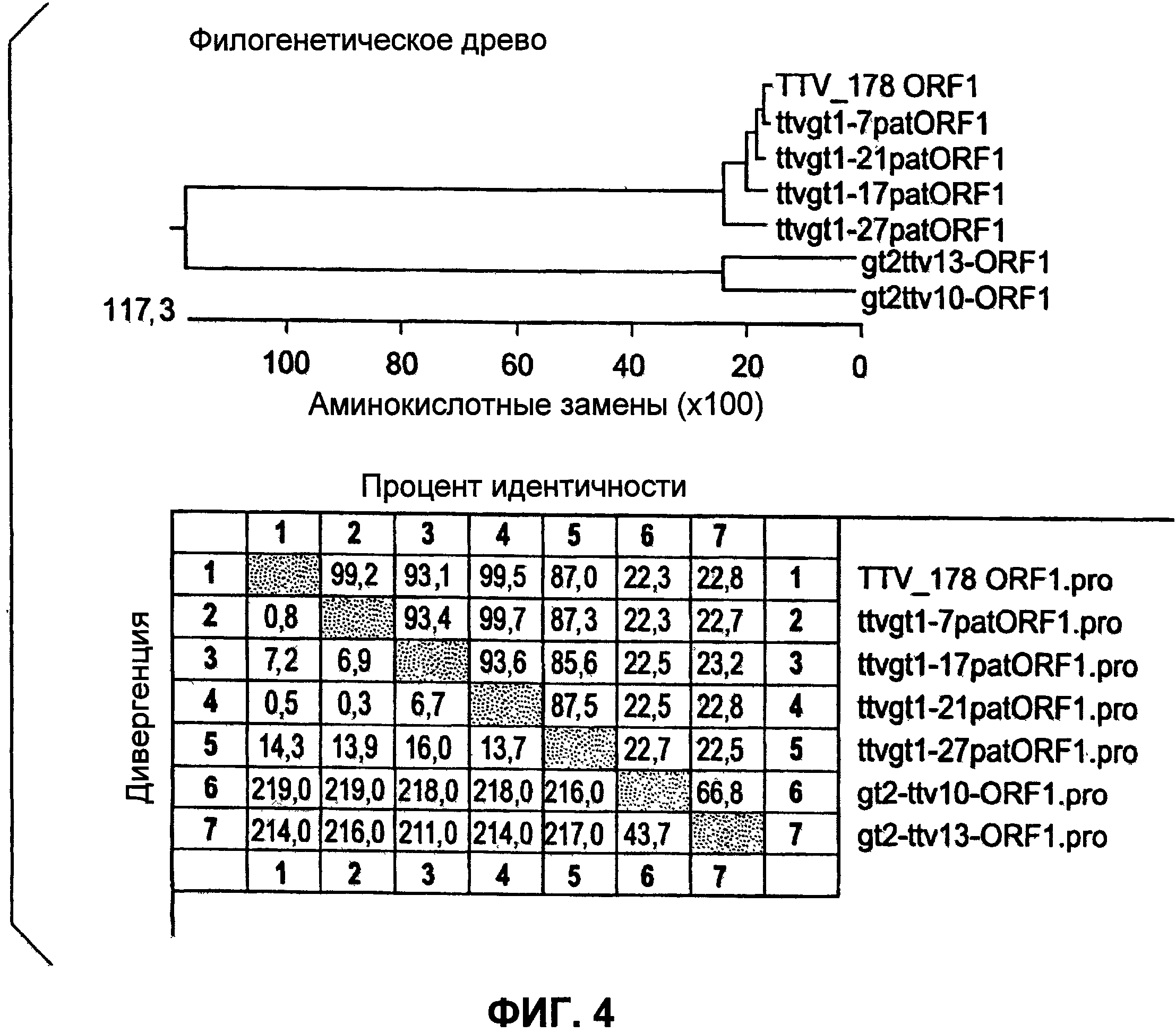
Фиг.4 представляет филогенетическое древо для разных штаммов TTV, включающее компиляцию процентных идентичностей.
Фиг.5 (панели А, Б и В) представляет идентификацию совместных богатых аргинином областей белков ORF1, как они экспрессируются из разных изолятов TTV.
Фиг.6 представляет карту вектора для TTVg1-178 в собранном виде.
Фиг.7 демонстрирует то, что Chromos-экспрессируемая ORF1 g1TTV значительно уменьшала поражения легких по сравнению с зараженными контролями и снижает величину и продолжительность виремии g1TTV, снова по сравнению с зараженными контролями.
КРАТКОЕ ОПИСАНИЕ ПЕРЕЧНЕЙ ПОСЛЕДОВАТЕЛЬНОСТЕЙ
SEQ ID NO:1 представляет последовательность ДНК генотипа gt2 TTV 10.
SEQ ID NO:2 представляет последовательность ДНК генотипа 2 gt2 TTV 13.
SEQ ID NO:3 представляет последовательность ДНК генотипа 1 ttvgt1-27.
SEQ ID NO:4 представляет последовательность ДНК генотипа 1 ttvgt1-7.
SEQ ID NO:5 представляет последовательность ДНК генотипа 1 ttvgt1-17.
SEQ ID NO:6 представляет последовательность ДНК генотипа 1 ttvgt1-21.
SEQ ID NO:7 представляет последовательность ДНК генотипа 1 ttvg1-178.
SEQ ID NO:8 представляет аминокислотную последовательность ORF1 штамма AY823991 TTV.
SEQ ID NO:9 представляет аминокислотную последовательность ORF1 штамма ttvgt1-178 TTV (генотип 1 TTV).
SEQ ID NO:10 представляет аминокислотную последовательность ORF1 штамма ttvgt1-7 TTV.
SEQ ID NO:11 представляет аминокислотную последовательность ORF1 штамма ttvgt1-17 TTV.
SEQ ID NO:12 представляет аминокислотную последовательность ORF1 штамма ttvgt1-21 TTV.
SEQ ID NO:13 представляет аминокислотную последовательность ORF1 штамма ttvgt1-27 TTV.
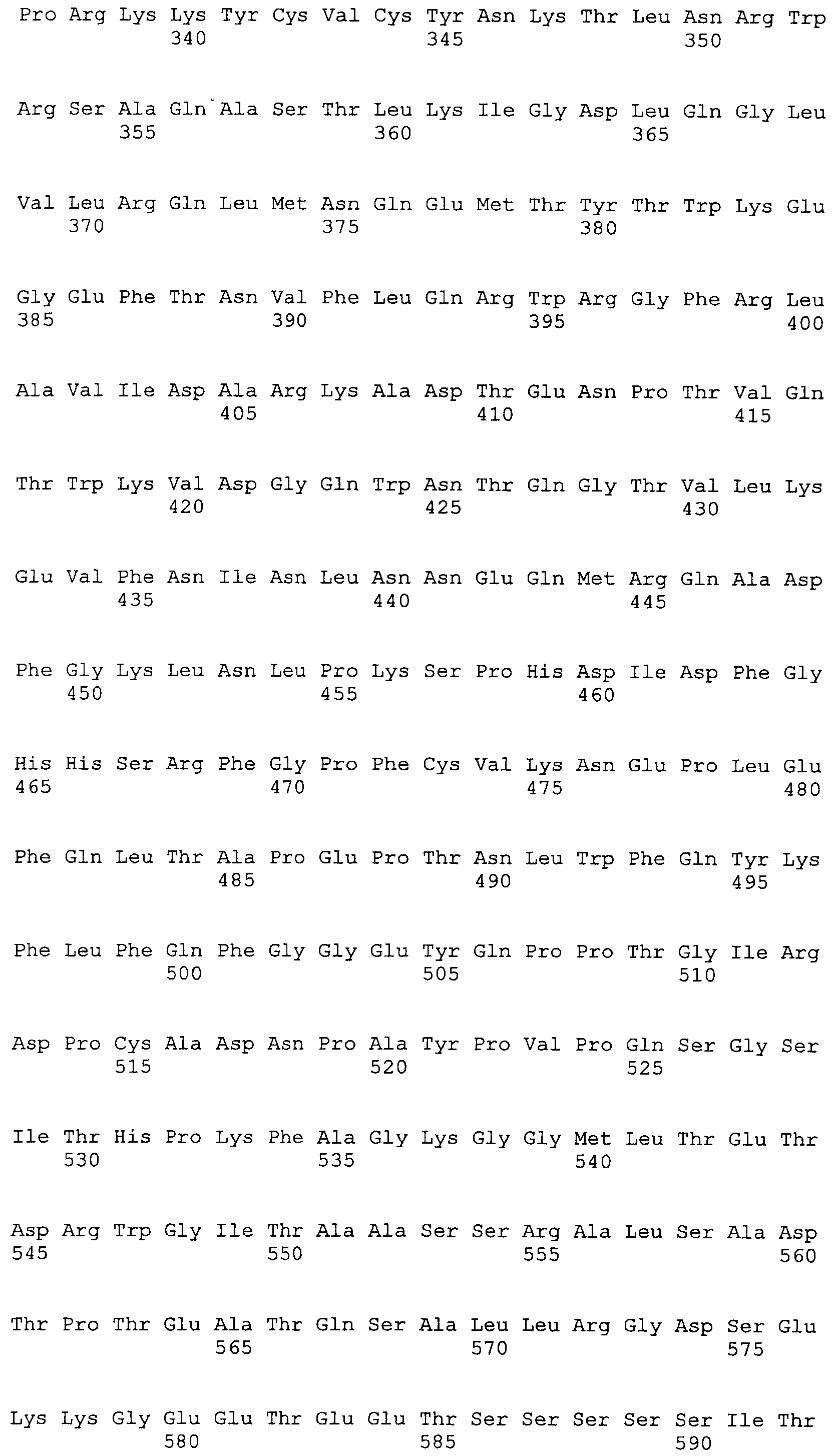
SEQ ID NO:14 представляет аминокислотную последовательность ORF1 штамма gt2 TTV10 TTV (генотип 2).
SEQ ID NO:15 представляет аминокислотную последовательность ORF1 штамма gt2 TTV13 TTV.
SEQ ID NO:16 представляет последовательность ДНК известного штамма AY823991, генотип 2.
SEQ ID NO:17 представляет последовательность ДНК известного штамма AY823990, генотип 1.
SEQ ID NO:18 представляет последовательность 76057-3, кодирующую капсид TTV, кодон-оптимизированную для E.coli, как она клонирована в вектор pUC57 GenScript®.
SEQ ID NO:19 представляет последовательность 76057-4, кодирующую капсид TTV, кодон-оптимизированную для Е.coli, как она клонирована в экспрессионную плазмиду pET101/D-TOPO® от Invitrogen.
SEQ ID NO:20 представляет последовательность 76057-5, кодирующую капсид TTV, кодон-оптимизированную для Saccharomyces cerevisiae, как она клонирована в вектор pUC57 GenScript®.
SEQ ID NO:21 представляет последовательность ДНК для конструкции, которая кодирует ORF1 ttvgt1-7 с экспрессионной меткой дрожжевой инвертазы (YI).
SEQ ID NO:22 представляет пептидную последовательность ttvgt1 (нумерация основана на соответствующей последовательности AY823990) из ORF1 белка капсида, соответствующую остаткам 167-185, которая используется с С-концевой АК (аминокислота) в амидированной форме.
SEQ ID NO:23 представляет пептидную последовательность ttvgt1 (нумерация основана на соответствующей последовательности AY823990) из ORF1 белка капсида, соответствующую остаткам 459-479.
SEQ ID NO:24 представляет пептидную последовательность ttvgt1 (нумерация основана на соответствующей последовательности AY823990) из ORF1 белка капсида, соответствующую остаткам 612-637.
SEQ ID NO:25 представляет аминокислотную последовательность ORF1 штамма AY823990 TTV.
SEQ ID NO:26-29 определяют последовательности праймеров.
В связи с описаниями последовательностей специалист в данной области техники поймет, что для конкретных серотипов широко и взаимозаменяемо применяются многочисленные немного отличающиеся сокращения, например, g1TTV, TTVg1, генотип 1 TTV, серотип 1 TTV, gt1TTV и им подобные. Аналогичная ситуация имеет место для генотипа 2.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Следующие определения и вводные вопросы применяются в описании изобретения.
Термины «свиной» и «свиньи» используются здесь взаимозаменяемо и относятся к любому животному, которое является членом семейства Suidae, такому как, например, свинья. «Млекопитающие» включают любых теплокровных позвоночных класса Mammalia, включая людей.
«Инфекционная молекула ДНК» для целей настоящего изобретения представляет собой молекулу ДНК, которая кодирует необходимые элементы для вирусной репликации, транскрипции и трансляции в функциональный вирион в подходящей клетке-хозяине.
Подобным образом, термин «выделенная полинуклеотидная молекула» относится к композиции вещества, содержащей полинуклеотидную молекулу по настоящему изобретению, очищенную до какой-либо детектируемой степени из ее природного состояния, если таковое существует.
Для целей настоящего изобретения нуклеотидная последовательность второй полинуклеотидной молекулы (либо РНК, либо ДНК) является «гомологичной» нуклеотидной последовательности первой полинуклеотидной молекулы или имеет «идентичность» с указанной первой полинуклеотидной молекулой, когда нуклеотидная последовательность второй полинуклеотидной молекулы кодирует ту же самую полиаминокислоту, что и нуклеотидная последовательность первой полинуклеотидной молекулы на основе вырожденности генетического кода, или когда она кодирует полиаминокислоту, которая является достаточно сходной с полиаминокислотой, кодируемой нуклеотидной последовательностью первой полинуклеотидной молекулы так, чтобы быть полезной при использовании настоящего изобретения. Гомологичные полинуклеотидные последовательности также относятся к смысловым и антисмысловым нитям и, во всех случаях, к комплементарным последовательностям любой такой нити. Для целей настоящего изобретения полинуклеотидная молекула является полезной при использовании настоящего изобретения и, следовательно, гомологичной или имеющей идентичность, когда ее можно использовать в качестве диагностического зонда для детекции присутствия вируса TTV или вирусного полинуклеотида в жидкости или в образце ткани инфицированной свиньи, например, стандартными методиками гибридизации или амплификации. В общем, нуклеотидная последовательность второй полинуклеотидной молекулы является гомологичной нуклеотидной последовательности первой полинуклеотидной молекулы, если она имеет по меньшей мере примерно 70% идентичности нуклеотидной последовательности с нуклеотидной последовательностью первой полинуклеотидной молекулы, как показано на основе алгоритма BLASTN (Национальный центр биотехнологической информации, иначе известный как NCBI (Bethesda, Maryland, США) Национального института здоровья Соединенных Штатов). В конкретном примере расчетов согласно применению настоящего изобретения дана ссылка на BLASTP 2.2.6 [Tatusova ТА and TL Madden, "BLAST 2 sequences-a new tool for comparing protein and nucleotide sequences." (1999) FEMS Microbiol Lett. 174:247-250.]. Вкратце, две аминокислотные последовательности выравнивают для оптимизации показателей выравнивания с использованием штрафа на внесение делеции в выравнивание (gap opening penalty) 10, штрафа на продолжение делеции (gap extension penalty) 0,1 и матрицы подсчета "blosum62" от Henikoff and Henikoff (Proc. Nat. Acad. Sci. USA 89:10915-10919. 1992). Процент идентичности затем рассчитывают как общее число идентичных совпадений × 100/ деленное на длину более длинной последовательности + число пробелов, введенных в данную более длинную последовательность для выравнивания двух последовательностей.
Предпочтительно гомологичная нуклеотидная последовательность имеет по меньшей мере примерно 75% идентичности нуклеотидной последовательности, даже более предпочтительно по меньшей мере примерно 80%, 85%, 90% и 95% идентичности нуклеотидной последовательности. Поскольку генетический код является вырожденным, гомологичная нуклеотидная последовательность может включать любое число «молчащих» замен оснований, т.е. замен нуклеотидов, которые, тем не менее, кодируют ту же самую аминокислоту.
Гомологичная нуклеотидная последовательность может дополнительно содержать немолчащие мутации, т.е. замены, делеции или добавления оснований, приводящие к различиям аминокислот в закодированной полиаминокислоте, пока данная последовательность остается по меньшей мере примерно на 70% идентичной полиаминокислоте, кодируемой первой нуклеотидной последовательностью, или в других отношениях является полезной при использовании настоящего изобретения. В этом отношении могут быть сделаны определенные консервативные аминокислотные замены, которые обычно рассматриваются как не инактивирующие общую функцию белка: такие как, в отношении положительно заряженных аминокислот (и наоборот), лизина, аргинина и гистидина; в отношении отрицательно заряженных аминокислот (и наоборот), аспарагиновой кислоты и глутаминовой кислоты; и в отношении определенных групп нейтрально заряженных аминокислот (и во всех случаях также наоборот) (1) аланина и серина, (2) аспарагина, глутамина и гистидина, (3) цистеина и серина, (4) глицина и пролина, (5) изолейцина, лейцина и валина, (5) метионина, лейцина и изолейцина, (6) фенилаланина, метионина, лейцина и тирозина, (6) серина и треонина, (7) триптофана и тирозина, (8) и, например, тирозина, триптофана и фенилаланина.
Гомологичные нуклеотидные последовательности можно определить сравнением нуклеотидных последовательностей, например, посредством применения BLASTN, как указано выше. В качестве альтернативы, гомологичные нуклеотидные последовательности можно определять гибридизацией в выбранных условиях. Например, нуклеотидная последовательность второй полинуклеотидной молекулы является гомологичной SEQ ID NO:1 (или любой другой конкретной полинуклеотидной последовательности), если она гибридизуется с последовательностью, комплементарной SEQ ID NO:1 при умеренно жестких условиях, например, гибридизация с ДНК, связанной на фильтре, в 0,5 М NaHPO4, 7%-ном додецилсульфате натрия (SDS), 1 мМ EDTA при 65°С и промывка в 0,2×SSC/0,1% SDS при 42°С (см. Ausubel et al. editors, Protocols in Molecular Biology, Wiley and Sons, 1994, pp.6.0.3-6.4.10), или при условиях, которые, в противном случае, приведут к гибридизации последовательностей, которые кодируют вирус TTV, как определено ниже. Модификации условий гибридизации можно определить эмпирически или точно рассчитать на основе длины и процентного содержания пар оснований гуанозин/цитозин (GC) образца. Условия гибридизации можно рассчитать, как описано в Sambrook, et al., (Eds.), Molecular Cloning: A Laboratory Manual. Cold Spring Harbor Laboratory Press: Cold Spring Harbor, New York (1989), pp.9.47-9.51.
В другом воплощении вторая нуклеотидная последовательность является гомологичной SEQ ID NO:1 (или любой другой последовательности по изобретению), если она гибридизуется с последовательностью, комплементарной SEQ ID NO:1 в очень жестких условиях, например, гибридизация с ДНК, связанной на фильтре, в 0,5 М NaHPO4, 7%-ном (SDS), 1 мМ EDTA при 65°С и промывка в 0,1×SSC/0,1% SDS при 68°С, как известно в данной области техники.
Более того, следует понимать, что выделенные полинуклеотидные молекулы и выделенные молекулы РНК по настоящему изобретению включают как синтетические молекулы, так и молекулы, полученные посредством рекомбинантных технологий, таких как клонирование и транскрипция in vitro.
Полипептиды и полинуклеотиды по изобретению
Репрезентативные воплощения изобретения включают выделенную полинуклеотидную последовательность, которая содержит полинуклеотид, выбранный из группы, состоящей из:
(a1) ДНК последовательности TTV13 (SEQ ID NO:1) генотипа 2; ДНК последовательности TTV10 (SEQ ID NO:2) генотипа 2; или их фрагмента, который кодирует белок капсида TTV или фрагмент указанного белка;
(а2) ДНК последовательности генотипа 1, выбранной из группы, состоящей из ttvg1-7 (SEQ ID NO:4), ttvGT1-17 (SEQ ID NO:5), ttvGT1-21 (SEQ ID NO:6), ttvgt1-27 (SEQ ID NO:3), ttvgt1-178 (SEQ ID NO:7) или ее фрагмента, который кодирует белок капсида TTV или фрагмент указанного белка;
(б) последовательности, комплементарной любой последовательности из (а);
(в) полинуклеотида, который гибридизуется с последовательностью из (а) или (б) в жестких условиях, определенных как гибридизация с ДНК, связанной на фильтре, в 0,5 М NaHPO4, 7% SDS, 1 мМ EDTA при 65°С и промывка в 0,1×SSC/0,1% SDS при 68°С.
(г) полинуклеотида, который является по меньшей мере на 70% идентичным полинуклеотиду из (а) или (б);
(д) полинуклеотида, который является по меньшей мере на 80% идентичным полинуклеотиду из (а) или (б);
(е) полинуклеотида, который является по меньшей мере на 90% идентичным полинуклеотиду из (а) или (б); и
(ж) полинуклеотида, который является по меньшей мере на 95% идентичным полинуклеотиду из (а) или (б).
Согласно изобретению также предложен полипептид, кодируемый полинуклеотидами любой из открытых рамок считывания TTV13 (SEQ ID NO:1) генотипа 2 или TTV10 (SEQ ID NO:2) генотипа 2, или полипептид, который является по меньшей мере на 90% идентичным ему или его фрагменту, включая возможность того, что дополнительные, в другом случае идентичные аминокислоты, заменены консервативными заменами.
Согласно изобретению также предложен полипептид, кодируемый полинуклеотидами ORF1 любой из открытых рамок считывания (все серотипа 1) ttvg1-7 (SEQ ID NO:10), ttvGT1-17 (SEQ ID NO:11), ttvGT1-21 (SEQ ID NO:12), ttvgt1-27 (SEQ ID NO:13) и ttvgt1-178 (SEQ ID NO:9), или полипептид, который является по меньшей мере на 90% идентичным ему или его фрагменту, включая такой вариант, что дополнительные, в другом случае идентичные аминокислоты заменены консервативными заменами.
В предпочтительном воплощении данный полипептид экспрессируется с ORF1, и предпочтительные смеси включают комбинацию полипептидов ORF1 и ORF2, и ORF1 и ORF3.
В дополнительном предпочтительном воплощении дополнительно предложены вакцины на основе полипептидов TTV, где антиген определяется:
(а) первыми 300 N-концевыми аминокислотами белка капсида ORF1 TTV13 (SEQ NO:1) или TTV10 (SEQ ID NO:2); или (б) аминокислотной последовательностью, которая является по меньшей мере на 90 процентов идентичной им;
(б) первыми 200 N-концевыми аминокислотами белка капсида ORF1 TTV13 (SEQ NO:1) или TTV10 (SEQ ID NO:2); или (б) аминокислотной последовательностью, которая является по меньшей мере на 90 процентов идентичной им;
(в) первыми 100 N-концевыми аминокислотами белка капсида ORF1 TTV13 (SEQ NO:1) или TTV10 (SEQ ID NO:2); или (б) аминокислотной последовательностью, которая является по меньшей мере на 90 процентов идентичной им;
(г) первыми 300 N-концевыми аминокислотами белка капсида ORF1 любого из (все серотипа 1) ttvg1-7 (SEQ ID NO:10), ttvGT1-17 (SEQ ID NO:11), ttvGT1-21 (SEQ ID NO:12), ttvgt1-27 (SEQ ID NO:13) и ttvgt1-178 (SEQ ID NO:9), или полипептидом, который является по меньшей мере на 90% идентичным им;
(д) первыми 200 N-концевыми аминокислотами белка капсида ORF1 любого из (все серотипа 1) ttvg1-7 (SEQ ID NO:10), ttvGT1-17 (SEQ ID NO:11), ttvGT1-21 (SEQ ID NO:12), ttvgt1-27 (SEQ ID NO:13) и ttvgt1-178 (SEQ ID NO:9), или полипептидом, который является по меньшей мере на 90% идентичным им; и
(е) первыми 100 N-концевыми аминокислотами белка капсида ORF1 любого из (все серотипа 1) ttvg1-7 (SEQ ID NO:10), ttvGT1-17 (SEQ ID NO:11), ttvGT1-21 (SEQ ID NO:12), ttvgt1-27 (SEQ ID NO:13) и ttvgt1-178 (SEQ ID NO:9), или полипептидом, который является по меньшей мере на 90% идентичным им.
Дополнительные генетические манипуляции
Информация по последовательности ДНК и аминокислот, предоставленная настоящим изобретением, также делает возможным систематический анализ структуры и функции вирусных генов и кодируемых ими генных продуктов. Знание полинуклеотида, кодирующего вирусный генный продукт по изобретению, также делает доступными антисмысловые полинуклеотиды, которые распознают и гибридизуются с полинуклеотидами, кодирующими полипептид по изобретению или его фрагмент. Полноразмерные антисмысловые полинуклеотиды и их фрагменты являются полезными в этом отношении. Сотрудник обычной квалификации поймет, что фрагментированные антисмысловые молекулы по данному изобретению включают: (1) молекулы, которые специфически распознают специфичные РНК (как определено путем сравнения с последовательностью ДНК, кодирующей вирусный полипептид по изобретению) и гибридизуются с ними, а также (2) молекулы, которые распознают РНК, кодирующие варианты закодированных белков и гибридизуются с ними. Антисмысловые полинуклеотиды, которые гибридизуются с РНК/ДНК, кодирующими другие пептиды TTV, также являются идентифицируемыми посредством сравнения последовательностей для идентификации характерных или сигнатурных (signature) последовательностей для данного семейства молекул. Такие методики (см. Пример 8), более того, являются полезными в исследовании антигенных доменов в полипептидах TTV и также могут применяться для различения между инфекцией животного-хозяина отдаленно родственными членами Circoviridae, не являющимися TTV.
Пример 4 дает руководство по эффективной оптимизации кодонов для улучшенной экспрессии в дрожжах и Е.coli для конструкций по изобретению.
Вакцинные композиции
Вакцины по настоящему изобретению могут быть изготовлены, следуя общепринятому соглашению по включению приемлемых носителей для животных, включая людей (если это является применимым), таких как стандартные буферы, стабилизаторы, разбавители, консерванты и/или солюбилизаторы, и также могут быть приготовлены так, чтобы способствовать длительному высвобождению. Разбавители включают воду, физиологический раствор, декстрозу, этанол, глицерин и тому подобное. Добавки для изотоничности, среди прочих, включают хлорид натрия, декстрозу, маннит, сорбит и лактозу. Стабилизаторы, среди прочих, включают альбумин. Другие подходящие наполнители и добавки вакцин, включая наполнители и добавки, которые являются особенно полезными при приготовлении модифицированных живых вакцин, известны или будут очевидными специалистам в данной области. Смотрите, например, Remington's Pharmaceutical Science, 18th ed., 1990, Mack Publishing, которая включена сюда посредством ссылки.
Вакцины по настоящему изобретению могут дополнительно содержать один или более чем один дополнительный иммуномодулирующий компонент, такой как, например, среди прочих, адъювант или цитокин. Неограничивающие примеры адъювантов, которые можно использовать в вакцине по настоящему изобретению, включают адъювантную систему RIBI (Ribi Inc., Hamilton, MT), квасцы, минеральные гели, такие как гель на основе гидроксида алюминия, эмульсии типа «масло в воде», эмульсии типа «вода в масле», такие как, например, полный и неполный адъюванты Фрейнда, блоксополимер (CytRx, Atlanta GA), QS-21 (Cambridge Biotech Inc., Cambridge MA), SAF-M (Chiron, Emeryville CA), адъювант AMPHIGEN®, сапонин, Quil А или другие фракции сапонина, монофосфориллипид А, ионные полисахариды и липид-аминный адъювант Avridine. Неограничивающие примеры эмульсий типа «масло в воде», полезных в вакцине по изобретению, включают модифицированные препараты SEAM62 и SEAM 1/2. Модифицированный SEAM62 представляет собой эмульсию типа «масло в воде», содержащую 5% (об./об.) сквалена (Sigma), 1% (об./об.) детергента SPAN® 85 (ICI Surfactants), 0,7% (об./об.) детергента TWEEN® 80 (ICI Surfactants), 2,5% (об./об.) этанола, 200 мкг/мл Quil A, 100 мкг/мл холестерина и 0,5% (об./об.) лецитина. Модифицированный SEAM 1/2 представляет собой эмульсию типа «масло в воде», содержащую 5% (об./об.) сквалена, 1% (об./об.) детергента SPAN® 85, 0,7% (об./об.) детергента Tween 80, 2,5% (об./об.) этанола, 100 мкг/мл Quil А и 50 мкг/мл холестерина. Другие иммуномодулирующие агенты, которые могут быть включены в вакцину, включают, например, один или более чем один интерлейкин, интерферон или другие известные цитокины.
Дополнительные адъювантые системы допускают комбинацию как Т-хелперных, так и В-клеточных эпитопов, что приводит к одному или более чем одному типу ковалентно связанных структур Т-В эпитопов, которые могут быть дополнительно липидированными, как, например, структуры, описанные в WO 2006/084319, WO2004/014957 и WO2004/014956.
В предпочтительном воплощении настоящего изобретения белок ORFI TTV или другие белки TTV или их фрагменты приготовлены с 5% AMPHIGEN®.
Вакцины по настоящему изобретению возможно могут быть приготовлены в виде препаратов для длительного высвобождения вируса, инфекционной молекулы ДНК, плазмиды или вирусного вектора по настоящему изобретению. Примеры таких композиций с длительным высвобождением включают вирус, инфекционную молекулу ДНК, плазмиду или вирусный вектор в комбинации с композитами биосовместимых полимеров, таких как, например, поли(молочная кислота), поли(молочная-со-гликолевая кислота), метилцеллюлоза, гиалуроновая кислота, коллаген и тому подобное. Структура, выбор и применение деградируемых полимеров в носителях для доставки лекарственного средства рассмотрены в нескольких публикациях, включая А. Domb et al., 1992, Polymers for Advanced Technologies 3:279-292, которые включены сюда посредством ссылки. Дополнительное руководство по выбору и использованию полимеров в фармацевтических композициях можно найти в руководствах, известных в данной области, например, М. Chasin and R. Langer (eds), 1990, "Biodegradable Polymers as Drug Delivery Systems" in: Drugs and the Pharmaceutical Sciences. Vol.45, М. Dekker, NY, которая также включена сюда посредством ссылки. Альтернативно или дополнительно, вирус, плазмида или вирусный вектор могут быть микроинкапсулированы для улучшения введения и эффективности. Способы микроинкапсуляции антигенов хорошо известны в данной области и включают методики, описанные, например, в патенте США 3137631; патенте США 3959457; патенте США 4205060; патенте США 4606940; патенте США 4744933; патенте США 5132117 и международной публикации патента WO 95/28227, которые все включены сюда посредством ссылки.
Для обеспечения длительного высвобождения вируса, плазмиды, вирусного белка или вирусного вектора также можно использовать липосомы. Подробности, касающиеся того, как сделать и использовать липосомные композиции, можно найти, наряду с другими источниками, в патенте США 4016100; патенте США 4452747; патенте США 4921706; патенте США 4927637; патенте США 4944948; патенте США 5008050 и в патенте США 5009956, которые все включены сюда посредством ссылки.
Эффективное количество любой из вышеописанных вакцин можно определить традиционными способами, начиная с малой дозы вируса, вирусного белка, плазмиды или вирусного вектора, и затем увеличивая дозировку при мониторинге эффектов. Эффективное количество может быть достигнуто после однократного введения вакцины или после многократных введений вакцины. При определении оптимальной дозы для животного можно принимать во внимание известные факторы. Они включают вид, размер, возраст и общее состояние животного, присутствие других лекарственных средств в животном и тому подобное. Реальную дозировку предпочтительно выбирают после рассмотрения результатов из других исследований на животных (см., например, Примеры 2 и 3 ниже).
Одним способом детекции того, достигнут ли адекватный иммунный ответ, является определение сероконверсии и титра антител у животного после вакцинации. Расписание вакцинации и число повторных иммунизации, если таковые имеются, предпочтительно будут определяться врачом или ветеринаром на основе анализа всех релевантных факторов, некоторые из которых описаны выше.
Величину эффективной дозы вируса, белка, инфекционной молекулы ДНК, плазмиды или вирусного вектора по настоящему изобретению можно определить с использованием известных методик, принимая во внимание факторы, которые может определить обычный специалист в данной области, такие как масса животного, подлежащего вакцинации. Величина дозы вируса по настоящему изобретению в вакцине по настоящему изобретению предпочтительно варьирует от примерно 101 до примерно 109 БОЕ (бляшкообразующая единица), более предпочтительно от примерно 102 до примерно 108 БОЕ и наиболее предпочтительно от примерно 103 до примерно 107 БОЕ. Величина дозы плазмиды по настоящему изобретению в вакцине по настоящему изобретению предпочтительно варьирует от примерно 0,1 мкг до примерно 100 мг, более предпочтительно от примерно 1 мкг до примерно 10 мг, даже более предпочтительно от примерно 10 мкг до примерно 1 мг. Величина дозы инфекционной молекулы ДНК по настоящему изобретению в вакцине по настоящему изобретению предпочтительно варьирует от примерно 0,1 мкг до примерно 100 мг, более предпочтительно от примерно 1 мкг до примерно 10 мг, даже более предпочтительно от примерно 10 мкг до примерно 1 мг. Величина дозы вирусного вектора по настоящему изобретению в вакцине по настоящему изобретению предпочтительно варьирует от примерно 101 БОЕ до примерно 109 БОЕ, более предпочтительно от примерно 102 БОЕ до примерно 108 БОЕ и даже более предпочтительно от примерно 103 до примерно 107 БОЕ. Подходящий объем дозировки варьирует от примерно 0,5 мл до примерно 10 мл и более предпочтительно от примерно 1 мл до примерно 5 мл.
Подходящие дозы вирусного белка или пептидных вакцин при использовании настоящего изобретения обычно варьируют от 1 до 50 микрограммов на дозу, или до больших количеств, что можно определить стандартными способами, причем количество адъюванта подлежит определению общепризнанными способами в отношении каждого такого вещества. В предпочтительном примере изобретения, относящемся к вакцинации свиней, оптимальный целевой возраст для животных составляет примерно от 1 до 21 суток, что во время до отъема от свиноматки также может соответствовать другим запланированным вакцинациям, таким как вакцинация против Mycoplasma hyopneumoniae. Дополнительно, предпочтительная схема вакцинации для племенных свиноматок включала бы аналогичные дозы со схемой ежегодной ревакцинации.
Антитела
В настоящем изобретении также рассматриваются антитела против TTV (например, моноклональные и поликлональные антитела, одноцепочечные антитела, химерные антитела, гуманизированные, человеческие, свиные антитела и антитела с пересаженной CDR, включая соединения, которые включают последовательности CDR, которые специфично распознают полипептид TTV по изобретению). Термин «специфичный в отношении» указывает на то, что вариабельные области антител по изобретению распознают и связываются исключительно с полипептидом TTV (т.е. способны отличить единственный полипептид TTV от родственных полипептидов, несмотря на идентичность, гомологию или сходство последовательностей, обнаруженных в семействе полипептидов) и для которых допускается (возможно) взаимодействие с другими белками (например, с белком A S.aureus или с другими антителами в методиках ELISA (твердофазный иммуноферментный анализ)) через взаимодействия с последовательностями вне вариабельной области данных антител и, в частности, с константной областью молекулы Ab (антитела). Скрининги для определения специфичности связывания антитела по данному изобретению хорошо известны и повседневно практикуются в данной области. Для исчерпывающего обсуждения таких анализов, смотрите Harlow et al. (Eds), Antibodies A Laboratory Manual: Cold Spring Harbor Laboratory; Cold Spring Harbor, NY (1988), Chapter 6. Также рассматриваются антитела, которые распознают и связываются с фрагментами полипептидов TTV по изобретению, при условии, что данные антитела в первую очередь являются специфичными, как определено выше, в отношении полипептида TTV по изобретению, из которого был получен данный фрагмент.
В целях ясности термин «антитело» относится к молекуле иммуноглобулина, которая может связываться с конкретным антигеном в результате иммунного ответа на этот антиген. Иммуноглобулины представляют собой сывороточные белки, состоящие из «легких» и «тяжелых» полипептидных цепей, имеющих «константные» и «вариабельные» области, и подразделяются на классы (например IgA, IgD, IgE, IgG и IgM) на основе состава константных областей. Антитела могут существовать в множестве форм, включая, например, Fv, Fab', F(ab')2, а также в виде одиночных цепей, и включают синтетические полипептиды, которые содержат всю или часть одной или более чем одной последовательности единичной полипептидной цепи антитела.
Диагностические наборы
Согласно настоящему изобретению также предложены диагностические наборы. Набор может иметь ценность для различения между свиньями, инфицированными полевым штаммом вируса TTV естественным путем, и свиньями, вакцинированными любой из описанных здесь вакцин против TTV. Наборы также могут иметь ценность, так как животные, потенциально инфицированные полевыми штаммами вируса TTV, могут быть выявлены до проявления клинических симптомов и удалены из стада или содержаться в изоляции от незараженных или вакцинированных животных. Наборы включают реагенты для анализа образца от свиньи на наличие антител к конкретному компоненту определенного вируса TTV. Диагностические наборы по настоящему изобретению могут включать в качестве компонента пептид или пептиды из ORF1, 2 или 3, которые присутствуют в полевом штамме, но не в интересующей вакцине, и наоборот, и выбор таких подходящих пептидных доменов является возможным путем масштабного секвенирования аминокислот, как предложено в Примерах 1 и 2 описания изобретения. Как известно в данной области, наборы по настоящему изобретению альтернативно могут включать, в виде компонента, пептид, который предоставлен посредством слитого белка. Термин «слитый пептид» или «слитый белок» для целей настоящего изобретения означает одну полипептидную цепь, состоящую по меньшей мере из части белка вируса TTV, предпочтительно ORF1, и гетерологичного пептида или белка.
Примеры
Пример 1. Клонирование полного генома свиного TTV
А. TTV генотипа 2
ДНК очищали из свиной сыворотки с использованием мини-набора для ДНК крови (Qiagen) согласно протоколу изготовителя. ДНК элюировали из колонок в 50 мкл Tris-EDTA буфера. ДНК затем амплифицировали путем амплификации по типу катящегося кольца со случайными праймерами. Коротко, 5 мкл очищенной ДНК и 100 нг случайных гексамеров (Invitrogen) затем добавляли к 71 мкл воды и нагревали при 95°С в течение 3 мин и охлаждали на льду. Затем добавляли один мМ dNTP, 100 нг случайных гексамеров (Invitrogen), 1-кратный буфер полимеразы phi29 и 1 мкл полимеразы phi29 и реакционную смесь инкубировали в течение ночи при 30°С.
Одну пятую общего объема расщепляли EcoRI и подвергали электрофорезу в 0,8%-ном Е-геле (Invitrogen) для детекции присутствия 2,7 т.н. фрагмента. Вещество, расщепленное EcoRI, очищали с использованием набора для очистки продуктов ПЦР Qiagen, следуя протоколу изготовителя, и лигировали в расщепленный EcoRI/обработанный щелочной фосфатазой креветки вектор pGem3zf(+)(Promega). Лигированную ДНК использовали для трансформации химически компетентной Е.coli DH5α. Трансформированные Е.coli подвергали селекции на агаровых чашках с LB (среда Лурия/Бертани)/amp (ампициллин).
Плазмидную ДНК выделяли из трансформированных колоний и расщепляли EcoRI для подтверждения присутствия приблизительно 2,7 т.н. вставки. Отбирали четыре клона (4, 7, 10 и 13) и передавали в ACGT, Inc. для секвенирования. Выравнивание данных по последовательностям показало то, что клоны 10 и 13 демонстрировали гомологию с опубликованной последовательностью TTV и выравнивались ближе к генотипу 2 TTV, чем к генотипу 1. Эти клоны впоследствии называли TTV10 и TTV13. Анализы данных секвенирования для генотипа 2 РАН TTV Выравнивание нуклеотидов TTV13 (SEQ ID NO:2) и TTV10 (SEQ ID NO:1) с опубликованной последовательностью ДНК AY823991 (SEQ ID NO:16) генотипа 2 TTV.




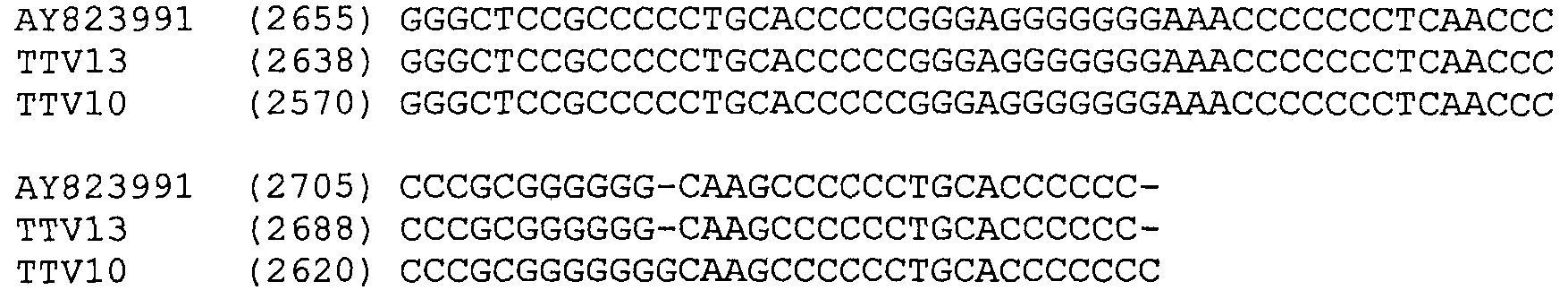
Идентичность нуклеотидов
TTV 13 показывает 92%-ную идентичность при сравнении с ранее опубликованной последовательностью AY823991. Однако TTV10 показывает только 76%-ное сходство либо с AY823991, либо с TTV13 и может рассматриваться как отдельный генотип.
Выравнивание аминокислот ORF1 TTV10 (SEQ ID NO:14) и TTV13 (SEQ ID NO:15) генотипа РАН TTV с ORF1 AY823991 (SEQ ID NO:8)


Выравнивание аминокислот TTV10 TTV13 ORF с опубликованной последовательностью
На уровне аминокислот ORF TTV10 демонстрирует только 65%-ную гомологию с опубликованной последовательностью и может представлять собой уникальный фенотип TTV.
Клонирование ORF1 TTV генотипа 2 для бакуловирусной экспрессии
На основе данных по последовательности, полученных выше, были сконструированы праймеры для клонирования ORF из TTV10 и TTV13 для экспрессии в бакуловирусе с использованием системы Invitrogen Gateway®. Последовательности праймеров представляли собой:
Для ORF TTV13: Ttv13Rev1211: 5' cgt act cga gtc аса gtg ttt tca tcc (SEQ ID NO:26); TTV13For1211: 5' cta ggt acc atg cct tac aga cgc tat (SEQ ID NO:27)
Для ORF TTV10: tt10for1207: 5' cta ggt acc atg cct ttc cac cgc tat (SEQ ID NO:28) и ttvrev1207: cgt act cga gct ata ggg tcc tga at (SEQ ID NO:29)
Поскольку клонирование посредством EcoRI в pGem приводило к прерыванию рамки считывания ORF1, вставка TTV в pGem была выделена расщеплением EcoRI, очищена на геле и вновь замкнута в кольцо с использованием стандартных условий лигирования. После лигирования в течение ночи при 4°С лигазу инактивировали при 65°С и реакционную смесь очищали с использованием набора для очистки QuiQuick (Qiagen), следуя протоколу изготовителя.
ORF13 TTV амплифицировали с помощью ПЦР с использованием геномной ДНК TTV13, вновь замкнутой в кольцо, с ферментом Expand Hi-Fidelity® (Roche), используя вышеописанные прямой и обратный праймеры TTV13 (по 0,15 мкМ каждого), 0,2 мМ dNTP в 1Х буфере для фермента Hi Fidelity. Условия ПЦР представляли собой: 1 цикл в течение 4 мин при 95°С; 35 циклов при 94°С, 15 с денатурация, 55°С, 30 с отжиг и 1,5 мин элонгация при 68°С; и 1 цикл при 72°С, 7 мин элонгация.
Аналогичным образом, ORF10 TTV амплифицировали с помощью ПЦР с использованием геномной ДНК TTV10, вновь замкнутой в кольцо, с ферментом Expand Hi-Fidelity® (Roche), используя вышеописанные прямой и обратный праймеры TTV10 (по 0,15 мкМ каждого), 0,2 мМ dNTP в 1-кратном буфере для фермента Hi Fidelity. Условия ПЦР представляли собой: 1 цикл в течение 4 мин при 95°С; 35 циклов при 94°С, 15 с денатурация, 56°С, 30 с отжиг и 1,5 мин элонгация при 68°С; и 1 цикл при 72°С, 7 мин элонгация.
ПЦР-продукты очищали с использованием набора для очистки продуктов ПЦР QiaQuick (Qiagen), следуя протоколу производителя. Оба ПЦР-продукта, TTV100rf1 и TTV130rf1, и Gateway entry плазмиду, pENTR3C, расщепляли KpnI. Расщепленную ДНК очищали с использованием набора для ПЦР-амплификации QIAquick и затем расщепляли XhoI. После очисток QIAquick, ДНК ORF1 TTV10 или ORF1 TTV13 лигировали в pENTR3C с использованием стандартных методик лигирования. После 2 часов лигирования при комнатной температуре лигированную ДНК использовали для трансформации химически компетентной E.coli DH5α. Трансформированные колонии подвергали селекции с использованием канамицина. Плазмиду очищали из трансформированной E.coli и вставку ДНК ORF1 верифицировали рестрикционным анализом фрагментов.
Затем плазмиды pENTR3C, содержащие ORF1 TTV10 или ORF1 TTV13, вставляли в векторы Invitrogen destination pDEST10 или pDEST20, кодирующие His6X или белок GST (глутатион-S-трансфераза), N-концевой по отношению к рамке считывания Orf1 TTV. Для трансформации E.coli DH10Bac использовали рекомбинантные векторы pDEST, содержащие открытую рамку считывания Orf1 TTV. Рекомбинантную бакмидную ДНК выделяли и использовали для трансфекции клеток SF9, следуя стандартному протоколу. Рекомбинантный бакуловирус, содержащий нативную Orf1, выделяли очисткой бляшек. Подтверждение рекомбинантного бакуловируса проводили с использованием ПЦР.
Нативная конструкция TTVOrf1 для бакуловирусной экспрессии
Стандартную ПЦР использовали для включения сайта рестрикции BamH1 выше по течению от кодона инициации в Orf1 TTV10 или сайта рестрикции XbaI выше по течению от кодона инициации в Orf13 TTV. Эти конструкции клонировали в вектор переноса pFastBac и использовали для трансформации E.coli DH10Bac. Образующиеся рекомбинантные бакмиды затем использовали для трансфекции клеток SF9. Рекомбинантный бакуловирус, содержащий нативную Orf1, выделяли очисткой бляшек. Подтверждение рекомбинантного бакуловируса проводили с использованием ПЦР.
Клонирование ORF1 TTV генотипа 2 для экспрессии в Е.coli
Полноразмерную TTVOrf10 также клонировали в вектор PGex-6p-1 для экспрессии белка, слитого с GST, в бактериальной системе. ORF TTV содержат аминоконец, богатый аргинином. Для определения того, может ли быть увеличена продукция белка в бактериальной экспрессионной системе, богатый аргинином сегмент удаляли из TTVOrf13 по подходящему сайту рестрикции (EcoR1), расположенному по нуклеотиду 368 открытой рамки считывания Orf1 и находящемуся в рамке считывания с кодирующей областью GST pGex-6p-1. Этот клон приводил к удалению 100 аминоконцевых аминокислот, содержащих отрезок, значительно обогащенный аргинином.
Б. Генотип 1 TTV
Общую клеточную ДНК из свиного костного мозга амплифицировали амплификацией по типу катящегося кольца, следуя методикам, описанным выше, за исключением того, что добавляли одноцепочечный связывающий белок для улучшения эффективности реакции амплификации. Продукты амплификации расщепляли EcoR1, очищали с использованием набора для очистки продуктов ПЦР QIAquick (Qiagen) и лигировали в вектор pGem3zf(+), который ранее обрабатывали щелочной фосфатазой креветки. Рекомбинантный вектор, содержащий предположительную геномную ДНК TTV, отбирали на основе расщепления после рестрикции EcoR1 и/или BamH1. Плазмиды, содержащие вставки приблизительно из 2,7 т.н., очищали и представляли в ACGT, Inc. для секвенирования последовательностей ORF1 для подтверждения генотипа. Полный геном, т.е. область, содержащая область с высоким содержанием G/C, не был секвенирован целиком.
Анализы данных по секвенированию для РАН TTV генотипа 1
Выравнивание нуклеотидов РАН TTV7 (SEQ ID NO:4), TTV17 (SEQ ID NO:5), TTV21 (SEQ ID NO:6) и TTV27 (SEQ ID NO:3) с опубликованной последовательностью, AY823990 (SEQ ID NO:17).







Идентичность нуклеотидов между РАН TTV и опубликованной последовательностью
TTVgt1-27 демонстрирует наибольшую гомологию с опубликованной последовательностью, AY823990, демонстрируя 91%-ную идентичность. TTVgt1-7,17 и 21 демонстрируют 85-87%-ную идентичность. TTVgt1-7 и TTVgtI-21 имеют 99%-ную идентичность нуклеотидов.
Выравнивание аминокислот Orf1
Следующее предоставляет сравнение опубликованной последовательности AY823990 (SEQ ID NO:25) с соответствующими аминокислотными последовательностями TTV7 (SEQ ID NO:10), TTV17 (SEQ ID NO:11), TTV21 (SEQ ID NO:12) и TTV27 (SEQ ID NO:13).


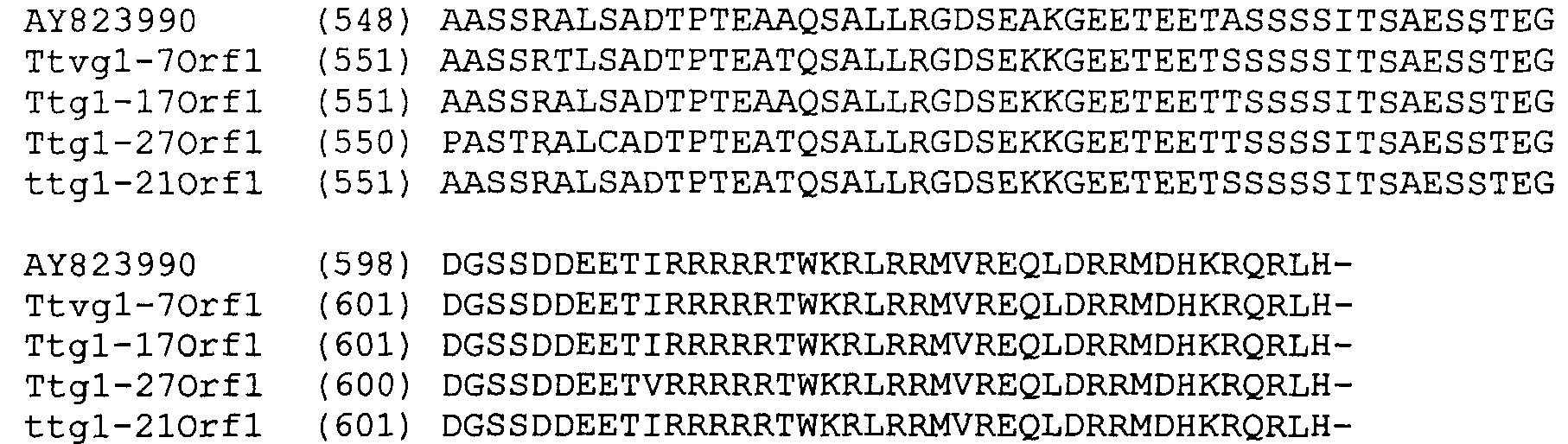
Графики гидрофобности белков демонстрируют 5 областей гидрофильности, которые могут указывать области, экспонированные на поверхности, которые являются потенциально антигенными. Две из этих областей находятся на аминоконце и карбоксиконце, и они обе являются богатыми аргинином и высококонсервативными. Наблюдали высококонсервативную гидрофильную область между аминокислотами 190 и 232, и она может потенциально служить в качестве антигенного сайта. Остальные гидрофильные области между аминокислотами 295 и 316 и между аминокислотами 415 и 470 также могут быть антигенными.
Дополнительно, было определено, что предположительные инициирующие кодоны для ORF1 и кодирующей области являются следующими: нт (нуклеотиды) 517-2435 ttvgt1-27; нт 517-2435 ttvg1-7; нт 517-2436 ttvgt1-17; нт 517-2439 ttvgt1-21; нт 487-2346 ttv10 и нт 477-2363 ttv13. Предположительные инициирующие кодоны для ORF2 и кодирующей области являются следующими: нт 428-646 ttvgt1-27; нт 428-643 ttvg1-7; нт 428-643 ttvgt1-17; нт 428-646 ttvgt1-21; нт 404-610 ttv10 и нт 394-597 ttv13.
Экспрессия белка ORF1 TTV с использованием рекомбинантного бакуловируса
Затем была выполнена серия экспериментов для экспрессии белка ORF1 TTV генотипа 2 с использованием клеток насекомых и рекомбинантного бакуловируса. Оптимизацию экспрессии белка проводили с тремя линиями клеток (SF9, SF21 и Hi Five), разнообразными конфигурациями сред (ExCell 420, SF900 III SFM, Express Five SFM), разными плотностями клеток (5е5, 1е6, 2е6 и 4е6 клеток/мл) и разными множественностями заражения (0,005; 0,1; 0,5; 2,0), и образующиеся культуры контролировали ежесуточно в течение периода семи суток после инфекции.
Процессы контролировали на предмет плотности и жизнеспособности клеток и инфекцию контролировали посредством мониторинга размера клеток и титрования вируса. Экспрессию белка контролировали посредством SDS-PAGE (электрофорез в полиакриламидном геле с додецилсульфатом натрия), анализа геля путем окраски Кумасси и вестерн-блоттинга. Для обеспечения должного контроля на протяжении всех экспериментов были поставлены негативные и позитивные контроли. Несмотря на то, что все эксперименты могли подтвердить экспрессию белка-мишени, оптимальные условия были обнаружены при использовании клеток SF9, поддерживаемых в среде ExCell 420 (Sigma, SAFC) с плотностью клеток 2×106 клеток/мл и MOI (множественность заражения) 0,1, причем данный процесс завершали после трех суток инфекции. Большая часть рекомбинантно экспрессируемого белка может быть локализована в клеточном осадке, хотя некоторое количество остается в образующемся супернатанте.
Подтверждение экспрессии белка с помощью вестерн-блоттинга (метка GST)
Поскольку векторы Invitrogen destination (pDESTIO) содержали белок GST N-концевой по отношению к рамке считывания TTV Orf1, образовывался слитый белок GST-ORF1 приблизительно 95 кДа, который детектировали с использованием имеющегося в продаже антитела кролика против GST (CALBIOCHEM). Считается, что в 95 кДа слитом белке примерно 68 кДа представляет собой ORF1, и 25 кДа представляет собой белок GST. Антител для стандартизированной детекции белка ORF1 TTV не имелось в продаже, что делало необходимым применение антитела против GST.
Продукция кроличьего антитела против ORF1 TTV
Из-за исходного отсутствия в наличии известных реагентов для TTV были предприняты усилия для продукции антител против ORF1 TTV. Следуя оптимизированному протоколу экспрессии для получения рекомбинантного белка ORF1 TTV, образующееся вещество дополнительно очищали с использованием имеющегося в продаже набора для очистки Baculogold GST. Очищенный белок ORF1 TTV10 и TTV13 затем использовали для гипериммунизации кроликов для последующей продукции антител против рекомбинантного белка ORF1.
В отношении детекции белка, дорожки образцов на Фиг.1А были следующими (справа налево)
Образцы
Дорожки 2, 4 и 6 демонстрируют очищенный 95 кДа слитый белок ORF1 TTV13, который позднее использовали для иммунизации кролика, смотрите Фиг.1А.
Детекция нативного ORF1 TTV с использованием кроличьего антитела против белка ORF1
Проводили дополнительные эксперименты по экспрессии с нативным ORF1 TTV рекомбинантным бакуловирусом. Этот рекомбинантный бакуловирус был сконструирован без слитой метки 6xHis или GST и, следовательно, требует специфичного антитела против ORF1 TTV. Поэтому провели постэкспрессионный анализ путем вестерн-блоттинга с использованием кроличьего антитела против ORF1 TTV для подтверждения экспрессии нативного белка и для подтверждения реакционной способности реагента. Вестерн-блоттинг анализ продемонстрировал слабую реакцию в положении, соответствующем приблизительно 69 кДа, что приблизительно представляет собой предсказанный размер ORF1 TTV, а также реакцию с дополнительной полосой в положении, соответствующем приблизительно 49 кДа (см. Фиг.1Б). Белок, соответствующий 49 кДа полосе, является неизвестным. Предполагается, что образование нечеткой полосы в положении, соответствующем 69 кДа, является функцией либо слабой экспрессии белка в конструкции с нативным ORF1 TTV, либо плохого выхода антитела в результате иммунизации кролика. Следует отметить, что в этом конкретном анализе не проводилось очистки антигена или антитела. Дорожка 5 (см. стрелки на Фиг.1Б) демонстрирует уникальную реакцию с ~69 кДа и 49 кДа белком при экспрессии нативного ORF1 TTV с использованием кроличьего поликлонального антитела против ORF1 TTV.
Соответственно, было продемонстрировано связывание антитела с белком капсида в качестве антигена, здесь антиген предоставлял только последовательность TTV и не был меченым.
На Фиг.6Б дорожки, соответствующие образцам, были следующими (справа налево)
Пример 2 - обратное пассирование
Печень отбирали асептически от полученного путем кесарева сечения, не получающего молозива (CDCD) поросенка. Ткань печени тестировали на g1 и g2 TTV в уникальных анализах количественной ПЦР, и подтверждали, что она является позитивной только в отношении g1TTV. Затем получали 10%-ный (масс./об.) гомогенат печени в средах, содержащих антибиотики и противогрибковые вещества. Наконец, гомогенат осветляли центрифугированием, обозначали как g1TTVpO и замораживали при -70°С. Образующийся гомогенат g1TTV тестировали на отсутствие посторонних вирусов, бактерий и микоплазм посредством традиционного тестирования. После удовлетворительного результата тестирования, два миллилитра свежеразмороженного g1TTVp0 интраперитонеально (ИП) инокулировали каждому из шести 11-суточных гнотобиотических поросят. Приблизительно через 12 суток после инокуляции поросят умерщвляли и асептически отбирали костный мозг, селезенку и печень. Посредством количественной ПЦР подтверждали, что каждая полученная в результате печень богата g1TTV и негативна в отношении g2TTV. Затем получали гомогенаты печени из каждой полученной печени, как упомянуто выше, помечали и делили на аликвоты как g1TTVp1 и помещали при -70°С. Дополнительный второй пассаж (g1TTVp2) был создан из g1TTVp1.
Пример 3. Оценка эффективности трех вакцин против вируса Torque Teno (TTV) у молодых свиней
Настоящее исследование проводили для оценки эффективности трех вакцин-кандидатов против TTV, которые вводили в возрасте ~7 суток и вновь в момент отъема (возраст ~21 сутки) с последующим заражением в возрасте ~5 недель.
Это исследование предоставило предварительную оценку иммуногенности у свиней, которым внутримышечно инъецировали композиции TTV. Как упоминалось ранее, TTV является маленьким, безоболочечным вирусом с одноцепочечным кольцевым ДНК геномом отрицательной полярности. Геном включает нетранслируемую область и по меньшей мере три главные перекрывающиеся открытые рамки считывания. Свиной TTV является вездесущим, и ПЦР-детекция вируса в образцах сыворотки, полученных в разных географических регионах, показывает распространенность у свиней, варьирующую от 33 до 100%. McKeown et al., Vet. Microbiol. (2004) 104:113-117. Krakowka et al., AJVR (2008) 69:1623-1629 сообщали о том, что свиньи, инокулированные g1-TTV, не имели клинических симптомов, но после инокуляции у них развивались интерстициальная пневмония, временная атрофия тимуса, мембранозная гломерулонефропатия и умеренные инфильтраты в печень от лимфоцитарных до гистиоцитарных. В настоящем исследовании дано сравнение трех разных вакцинных композиций против TTV и оценивается, можно ли численно или статистически дифференцировать любой из этих композиций-прототипов при сравнении с зараженными контрольными группами.
Материалы и способы
Животные: шесть клинически здоровых гибридных беременных серонегативных по PRRSV и М hyo самок без истории заболевания, вызванного RRRSV или М hyo (или вакцинации против тех же самых организмов), приобретали у Lincoln Trail / Puregenic Pork, Alton, IL и транспортировали в Richland, MI на Ферму исследования здоровья животных Pfizer приблизительно за 3 недели до родов. При необходимости у свиноматок индуцировали опорос в течение периода 2 или 3 суток с использованием инъецируемого простагландина (Lutalyse®). Нормальных поросят от этих свиноматок распределяли для исследования согласно схеме распределения. Свиней рандомизировали для обработки по пометам, и в каждом помете был по меньшей мере один поросенок, предназначенный для каждой обработки.
Содержание: на протяжении фазы вакцинации поросят содержали с их матерью в изоляторах BL-2 без перекрестного вскармливания. Содержание поросят в помете продолжали до наступления времени 2-ой вакцинации. После второй вакцинации поросят переводили в следующее помещение и содержали в двух помещениях (одно помещение содержит NTX (невакцинированные и незараженные контроли) животных, второе помещение - вакцинированных), и каждое помещение содержит 4 или 8 поросят на загон.
Кормление: после опороса свиноматок кормили согласно диете для лактирующих свиноматок по необходимости. Поросята имели доступ к подкормке для молодняка и к заменителю молока до отъема от свиноматки. Сразу после отъема от свиноматки поросят кормили пищей, подходящей для возраста, предлагая им свободный выбор. Вода была в свободном доступе для всех животных.
Распределение/рандомизация. Поросят рандомизировали для обработки по пометам. В каждом помете был по меньшей мере один поросенок, предназначенный для каждой обработки.
Схема исследования
Маскировка: вакцина была замаскирована с использованием числового кода перед вакцинацией. От исследователя, человека, вводящего вакцину, и исследовательского персонала был скрыт тип обработки, и они не имели доступа к маскировочному коду, если информация об обработке не требовалась для ухода за животным.
Исследовательские ветеринарные продукты
Получение материала для заражения: g1TTV пассаж 1 получали из гомогената печени, который давал положительный тест (от 7,6×10е8 до 1,6×10е9 копий ДНК/2 мл) на g1TTV и отрицательный на g2TTV посредством количественной ПЦР. Подходящее число флаконов удаляли из морозильника и размораживали незадолго до заражения. Затем из одного из флаконов удаляли аликвоту и сохраняли для повторного титрования в более позднее время. Маточный раствор для заражения транспортировали на льду к исследовательскому оборудованию и выдерживали на льду на протяжении процедуры заражения. Доза для заражения равна 2,0 мл маточного раствора (2,0 мл внутрибрюшинно). Следовательно, ожидается, что доза, которую доставили каждой свинье, составляет от 7,6×10е8 до 1,6×10е9 копий ДНК/2 мл. После заражения аликвоту маточного раствора для заражения хранили для титрования для подтверждения дозы заражения.
Общие наблюдения за состоянием здоровья: квалифицированный сотрудник ежесуточно следил за животными и записывал общие наблюдения за состоянием здоровья.
Массы тела: всех свиней взвешивали на сутки 0, на сутки заражения (сутки 28) и в момент вскрытия. Записывали все массы.
Вакцинация: приблизительно в 7-суточном возрасте (сутки 0) примерно 10 свиней), распределенных случайным образом, на группу обработки (группы Т01-Т04) вакцинировали, как описано в Таблице 1. Свиньям делали инъекцию IVP в правую сторону шеи однодозовым шприцем (внутримышечная (ВМ) доза 2,0 мл) или 2 мл ВМ контрольную дозу согласно распределению. Вторую дозу того же самого IVP или контроля вводили в левую сторону шеи во время отъема от свиноматки (примерно 21-суточный возраст).
Отбор проб крови: пробу крови отбирали перед сутками 0, на сутки 14 (до вакцинации) и на сутки 28 до заражения (а также на сутки 31, 34, 37 и 40) с использованием 5 мл или 9 мл пробирок для отделения сыворотки (в зависимости от массы тела) у всех свиней для определения статуса g1TTV (qPCR-Pfizer-VMRD Laboratory Sciences). Местный персонал разделял пробы сыворотки на аликвоты, по меньшей мере на три отдельные пробирки, которые хранили при -80°С.
Заражение: в возрасте примерно 5 недель поросятам инокулировали 2,0 мл (ВБ (внутрибрюшинно) или ИН (интраназально)) дозу изолята TTV согласно распределению. В целях маскировки к оборудованию доставляли заражающий материал, идентифицируемый по коду обработки.
Ректальные температуры после заражения записывали один раз в сутки на сутки 28 до заражения, а также на сутки 31, 34, 37 и 40.
Вскрытия: на сутки 40 всех животных умерщвляли и вскрывали. При вскрытии поражения легкого оценивали с использованием следующих способов: 1) числовая оценка в баллах (0, 1, 2, 3); и 2) процентная доля консолидации для каждой доли (левая верхняя (cranial), левая средняя, левая нижняя (caudal), правая верхняя, правая средняя, правая нижняя и добавочная) оценивалась и записывалась как процент наблюдаемой доли с поражениями. Также получали оценку в баллах для печени, почки, тимуса и лимфатических узлов. Пробу крови также отбирали до умерщвления. Ткани отбирали, как показано в следующей таблице:
В том, что касается оценки безопасности и/или эффективности, не было выявлено никаких смешанных вторичных болезненных состояний. Животных вакцинировали и заражали согласно протоколу. В том, что касается критериев результата, использовали уменьшение любого или всех из следующих: ослабленные макроскопические или микроскопические поражения; пониженная виремия, выявленная количественная ПЦР; и пониженная частота возникновения лихорадки, потери массы тела или пониженная смертность. Двухсторонние тесты.
Способ анализа
При вскрытии поражения легкого оценивали с использованием следующих способов: 1) числовая оценка в баллах (0=нет поражений, 1=слабые поражения, 2=умеренные поражения, 3=тяжелые поражения); и 2) процентная доля консолидации для каждой доли (левая верхняя, левая средняя, левая нижняя, правая верхняя, правая средняя, правая нижняя и добавочная) оценивалась и записывалась как процент наблюдаемой доли с поражениями.
Процентную долю всего легкого с поражениями преобразовали и анализировали посредством общей линейной смешанной модели с фиксированными эффектами, обработкой и случайным эффектом помета. Линейные комбинации оценок параметров использовали в априорных сравнениях после тестирования на значимый (Р≤0,10) эффект обработки. Для оценки статистических различий использовали 10% уровень значимости (Р≤0,10).
Данные количественной ПЦР будут преобразованы до анализа посредством подходящего log преобразования. Преобразованные титры будут проанализированы с использованием общей линейной смешанной модели анализа с повторными измерениями. В каждый момент времени будут сделаны попарные сравнения обработок, если эффект обработки или взаимосвязи обработки с моментом времени является значимым (Р≤0,10). Пределы средних значений обработок, 90%-ные доверительные интервалы, минимум и максимум будут рассчитаны и подвергнуты обратному преобразованию для каждого момента времени. Количественные показатели распределения, средние значения, стандартные отклонения и интервалы будут рассчитаны для каждой обработки и суток исследования, перед заражением.
Результаты исследования и обсуждение
Поражения легких
Несмотря на то что наблюдаемый общий процент поражений легких был низким во всех группах обработки, были обнаружены значимые различия. Т01 (Chromos экспрессируемые ORF1 g1TTV) давал значительно меньшие поражения легкого по сравнению как с Т02 (ORF1 g2TTV, экспрессируемый в бакуловирусе), так и с Т04 (зараженные контроли). Поскольку заражающий вирус состоял из инфекционного g1TTV, не может быть удивительным то, что ORF1 генотипа 2 из бакуловируса не давал значительно меньших поражений легкого по сравнению с зараженными контролями. Однако интересно отметить, что он давал хотя и не существенно, но численно действительно меньшие показатели поражения легкого по сравнению с зараженными контролями, тем самым указывая на то, что возможен некоторый уровень перекрестной защиты между разными генотипами TTV при оптимизации дозы и выбора адъюванта. Неожиданным было то, что инактивированный заражающий вирус (Т03, умерщвленный вирус g1TTVp1) не давал перекрестной защиты против живого заражающего вируса g1TTV, о чем свидетельствует отсутствие какого-либо статистического различия между Т03 и Т04. Это неожиданное отсутствие перекрестной защиты дополнительно увеличивает ветеринарное значение новых вакцин по изобретению, таких как ORF1 g1TTV (Т01 Chromos).
Количественная ПЦР g1TTV
Анализ данных по виремии TTV, полученных посредством количественной ПЦР (Фиг.7), показывает, что Т01 (Chromos ORF1 g1TTV) имеет численно меньшие значения TTV по результатам количественной ПЦР по сравнению с Т04 (зараженные контроли). Существует уменьшение величины и продолжительности виремии, которые, наряду с уменьшением поражений легкого, являются индикаторами эффективности. Кроме того, Т02 (ORF1 g2TTV из бакуловируса) демонстрирует численное уменьшение величины и продолжительности виремии по сравнению с Т04 (зараженные контроли), но в течение более короткого периода времени. Это, в сочетании с численно меньшими поражениями легких, указывает на то, что наблюдалась некоторая генотипическая перекрестная защита (вакцина на основе ORF1 g2TTV по сравнению с заражающим вирусом g1TTV). Предполагается, что с оптимизированной дозой и адъювантом может быть реализована эта широкая генотипическая перекрестная защита. Также интересно отметить то, что (Т03) g1TTVp1 KV не давал снижения виремии TTV, по данным количественной ПЦР, по сравнению с зараженными контролями. Это наблюдение в сочетании с данными по поражению легких дополнительно иллюстрирует новое открытие, которое заключается в том, что рекомбинантно экспрессируемый ORF1 g1TTV (Т01) обеспечивает эффективность в качестве вакцины.
Пример 4. Оптимизация кодонов и рекомбинантная экспрессия ORF1 g1TTV в виде полноразмерного белка с 6His меткой и его детекция антителом.
Нуклеотидную последовательность TTVg1 предоставляли в GenScript (Piscataway, Нью-Джерси, США) для оптимизации кодонов и синтеза генов как для E.coli, так и для Saccharomyces cerevisiae. В обоих случаях кодон-оптимизированный ген был клонирован в вектор GenScript pUC57 в качестве продукта. Анализ оптимизации кодонов GenScript OptimumGene™ включает анализ многочисленных параметров, включая отклонение в использовании кодонов, содержание GC, содержание динуклеотида CpG, вторичную структуру мРНК, идентификацию возможных скрытых сайтов сплайсинга, присутствие незрелых сайтов полиА, внутренних chi-сайтов и рибосомных сайтов связывания, негативных CpG-островков, мотивов нестабильности РНК (ARE), сайтов ингибирования (INS), повторяющихся последовательностей разных типов (включая прямые, обращенные и бивалентные (dyad)) и также сайтов рестрикции, которые могут мешать клонированию. Эффективность трансляции можно дополнительно улучшить посредством последовательностей инициации трансляции Козак, последовательностей Шайна-Дальгарно, и увеличить эффективность терминации трансляции посредством терминирующих кодонов.
SEQ ID NO:18-20 предоставляют ген капсида TTV, который был оптимизирован по кодонам как для Escherichia coli (NO:18-19), так и для Saccharomyces cerevisiae (NO:20). Последовательности для Е.coli являются очень похожими, однако для клонирования данного гена в имеющийся в продаже экспрессионный вектор pET101/D-TOPO (Invitrogen) для создания 76057-4 (SEQ ID NO:19) на N-конец должны были быть добавлены дополнительные нуклеотиды СА. Экспрессионный вектор pET101/D-TOPO также имеет С-концевую метку V5 и 6X-His для очистки, несмотря на то, что последовательности для 76057-3 (SEQ ID NO:18) и 76057-4 являются в других отношениях идентичными. Экспрессируемый белок TTVg1 с оптимизированными кодонами имеет размер приблизительно 68 кДа по сравнению с 63 кДа белком из-за добавления защитного пептида из 10 аминокислот на аминоконце и 32 аминокислот, соответствующих эпитопу V5 и 6Х His метке на карбоксиконце (Фиг.2).
Последовательность для 76057-5 (SEQ ID NO:20) была оптимизирована по кодонам для S.cerevisiae и, таким образом, слегка отличается от последовательностей Е.coli. Кроме того, эта последовательность не имеет защитного пептида из 10 аминокислот на N-конце (который был добавлен к последовательности Е.coli), и она также имеет фланкирующие сайты эндонуклеаз рестрикции, NotI на N-конце и AatII на С-конце, для субклонирования данного гена в дрожжевые векторы.
Кроме того, следует отметить, что защитный пептид из десяти аминокислот был добавлен к N-концу последовательности TTVg1 для экспрессии в Е.coli, поскольку было показано, что это увеличивает стабильность белка при слиянии с аминоконцом. Рестрикционные сайты были сконструированы таким образом, чтобы пептид можно было удалить для оценки полноразмерного белка. Экспрессию TTVg1 с оптимизированными кодонами оценивали в векторе pET101/D-TOPO с N-концевым слиянием с защитным пептидом и без N-концевого слияния с защитным пептидом. Последовательность TTVg1 с кодонами, оптимизированными для S.cerevisiae, также субклонировали в вектор pESC-Trp с возможностью для продукции в дрожжах белка, экспрессируемого на поверхности, который можно использовать для вызова антительного ответа in vivo.
Пример 5. Конъюгирование пептида TTV и продукция антител (поликлональных и моноклональных)
Индуцировали выработку кроличьих поликлональных антител против белка GST-ORF1 g2TTV, экспрессированного в бакуловирусе, полученного в Примере 2. Двух кроликов гипериммунизировали, но ответ дал только один кролик. Кроличья антисыворотка перекрестно реагирует с разными препаратами цельного вируса g1 TTV, который размножался в свиньях, и также реагирует против иммунизирующего антигена, ORF1 g2TTV, экспрессируемого в бакуловирусе. Кроличье антитело, однако, не отвечало на ORF1 g2TTV, экспрессируемую в Е.coli, которая имела 100 АК N-концевую богатую аргинином область, удаленную из аминоконца, как описано в Примере 2. Это может свидетельствовать о том, что главный антигенный эпитоп может находиться в 100-аминокислотной области, которая отсутствовала в усеченном ORF1 g2 TTV, и что в этой области существует гомология между g1 и g2 TTV.
Моноклональные антитела можно генерировать против полноразмерного ORF1 g1 TTV или других антигенов g1 TTV. Другие потенциальные иммунизирующие антигены включают цельный вирус g1 TTV, GST-ORF1 g2 TTV (Baculo), ORF1 с усеченной GST g1 TTV (Е.coli) и ORF1 с усеченной GST g2 TTV (Е.coli). Можно генерировать пептидную библиотеку для идентификации линейных эпитопов, которые являются антигенными. Например, чтобы охватить геном TTV, можно использовать 18-мерные пептиды с перекрытием из 10 АК. Данные пептиды затем можно использовать в вестерн-блотах или в ELISA (твердофазный иммуноферментный анализ) для определения их общей реактивности в отношении моноклональных и/или поликлональных антител против ORF1 g1TTV или ORF1 g2TTV так, чтобы можно было дополнительно идентифицировать иммуногенные домены.
Также могут быть индуцированы поликлональные кроличьи антитела против трех пептидов ORF1 g1 TTV, поперечно связанных с KLH (гемоцианин лимфы улитки) и затем подвергнутых скринингу с использованием пептидно-овальбуминовых конъюгатов. Конъюгаты пептид-KLH также можно использовать для продукции моноклональных антител. В этом отношении в одном воплощении вместе могут быть конъюгированы многие копии пептидов ORF1 g1 TTV, включая копии из разных штаммов.
В конкретных примерах сразу после генерации пептидов (СРС Scientific) их затем конъюгировали с KLH или овальбумином (с помощью the Proteos Co). Данные пептиды, конъюгированные с KLH, использовали для иммунизации кроликов, тогда как пептиды, конъюгированные с овальбумином, используются для скрининга сыворотки (т.е. для детекции антител к пептидам, а не к белку-носителю).
Пример 6. Пептидные последовательности для генерации поликлональных антител
Для генерации поликлональных антител выбрали следующие пептидные последовательности из TTVg1 (нумерация основана на AY823990), и они представлены SEQ ID NO:22-24, соответственно.
1. [L167C]TTV(167-185)-NH2: CKDQDYWFWWDTDFKELYA-NH2 (19 ак, pI 4)
2. TTV(459-479): DFGHHSRFGPFCVKNEPLEFQ (21 ак, pI 6.9)
3. [Cys612]-TTV(612-637): CTWKRLRRMVREQLDRRMDHKRQRLH (26 ак, pI 13)
Каждый из трех данных пептидов имеет один остаток цистеина, присутствующий в последовательности, для обеспечения селективного связывания пептида с белком-носителем. В [L167C]TTV(167-185)-NH2 и [Cys612]-TTV(612-637) дополнительный остаток цистеина был добавлен на N-конце, тогда как в TTV(459-479) имеется нативный Cys, присутствующий в положении 470. Дополнительно [L167C]TTV(167-185)-NH2 имеет амидированный С-конец для получения менее кислого пептида. Пептиды были выбраны на основе идентичности последовательностей для разных изолятов TTV. Дополнительно С-концевой фрагмент [Cys612]-TTV(612-637), по-видимому, экспонирован на поверхности. Пептиды были сделаны по заказу твердофазным пептидным синтезом в СРС Scientific и получены с более чем 95% чистотой.
Пример 7. Экспрессия белка ORF1 TTV g1 с использованием системы Chromes
Система Chromes АСЕ представляет собой платформу для экспрессии белка, которая состоит из трех главных компонентов. Первый компонент представляет собой нейтральную, функциональную искусственную хромосому млекопитающего, названную Platform АСЕ, которая находится в генетическом материале модифицированной клеточной линии яичников китайского хомячка (СНО). Второй компонент представляет собой направляющий вектор АСЕ, который представляет собой плазмиду, используемую для загрузки генов-мишеней в платформу АСЕ. Третий элемент представляет собой сайт-специфичную, однонаправленную интегразу, которая катализирует прямую и специфичную загрузку гена-мишени в платформу АСЕ. Дополнительную информацию, касающуюся системы АСЕ, можно найти на вэб-сайте Chromos Molecular Systems, Inc. из Канады или непосредственно связавшись с данной компанией по телефону 604-415-7100, где данная технология доступна по лицензии.
Система Chromos АСЕ имеет целый ряд значительных преимуществ над традиционными платформами продукции белков. Первым из них является скорость. Система Chromos АСЕ обеспечивает быструю, эффективную и воспроизводимую вставку выбранных генов. Вторым преимуществом является экспрессия. Достижимыми являются высокие уровни белков, и они конститутивно экспрессируются в течение продолжительного времени. Третьим преимуществом является стабильность. Система Chromos АСЕ обеспечивает селективную и контролируемую экспрессию белка. Вкратце, рестрикционные сайты были добавлены к обоим концам ДНК g1 ORF1 TTV7 с использованием ПЦР. Дополнительно на 5'-конец отдельного ПЦР-препарата добавляли последовательность дрожжевой инвертазы. Амплифицированные последовательности затем обрабатывали рестрикционными ферментами и субклонировали в плазмиду pCTV927. Последовательность ДНК верифицировали в ACGT Inc. Затем клетки CHk2 (яичников китайского хомячка) трансфицировали данными плазмидами с использованием Lipofectamine 2000 (Invitrogen), и добавляли селективное давление с использованием гигромицина В. Десять одноклеточных клонов анализировали на продукцию белка TTV с использованием SDS-PAGE и вестерн-блоттинга.
Более конкретно, направляющий вектор АСЕ, pCTV-TTWORF1+YI, генерировали следующим образом (см. Фиг.3). Ген TTV70RF1 получали в виде ПЦР-продукта. Праймер конструировали так, чтобы он содержал сигнал секреции дрожжевой инвертазы и рестрикционный сайт EcoRV на 5'-конце гена. Конструировали второй праймер так, чтобы он содержал сайт рестрикции KpnI на 3'-конце гена. Эти последовательности добавляли к гену TTV70RF1 с использованием полимеразной цепной реакции. Модифицированный ген затем субклонировали в направляющий вектор АСЕ, ATVCHS4Hyg, который содержал маркер устойчивости к гигромицину, подходящий для последующей селекции с антибиотиком. Новая плазмида получила название pCTV-TTWORF1+YI.
Плазмиды pCTV-TTWORF1+YI и pSIO343, которые кодировали TTV7ORF1/дрожжевую инвертазу и однонаправленную интегразу лямбда, соответственно, трансфицировали в линию клеток Chk2, которая содержала платформу АСЕ. Трансфицированные клетки называли Chk2-TTV70RF1+YI. Эти клетки высевали в 96-луночные планшеты и отслеживали на предмет образования одноклеточных клонов. В каждый 96-луночный планшет добавляли среды, содержащие гигромицин, для отбора клеточных клонов, которые содержали направляющий вектор АСЕ. Как только идентифицировали одноклеточные клоны, двенадцать из них выращивали в 24-луночных планшетах и затем в 6-луночных планшетах. Наконец, клоны выращивали в суспензионной культуре клеток. Культуру Chk2-TTWORF1+YI #75 использовали для генерации бесклеточного супернатанта для последующего получения экспериментальной вакцины.
На Фиг.7 продемонстрировано то, что Chromos-экспрессируемый ORF1 g1TTV значительно снижал поражения легкого по сравнению с зараженными контролями и снижал численное значение и продолжительность виремии g1TTV, вновь по сравнению с зараженными контролями. Вакцинацию осуществляли на сутки 0 и 14 с заражением на сутки 28. Среднее геометрическое детектированного числа копий g1TTV представляли в экспоненциальной форме, т.е. 1.00Е+00 равно 1, 4,25Е+00 равно 4,25 и 4.42Е+01 равно 44,2.
Пример 8. Сигналы ядерной локализации (NLS)
На Фиг.4 и 5 предложено 7-строчное (7-way) выравнивание аминокислот ORF1 (белки капсида) из 5 вирусов TTV gt1 по настоящему изобретению и двух вирусов TTV gt2 (или gt2-подобных) по изобретению. Естественно, имеется много пробелов и несоответствий, поскольку капсиды gt1 являются только примерно на 22,3-23,2% идентичными капсидам gt2. Однако пять капсидов gt1 являются на 85,6-99,7% идентичными между собой. Два капсида gt2 (TTV10 и TTV13) являются аналогичным образом на 66,8% идентичными.
Два известных типа сигналов NLS (Pat7 и Pat4, см., например, патент США 7544362) были идентифицированы при инспектировании. На Фиг.5 данные сигналы NLS подчеркнуты. Заметьте, что все семь капсидов содержат множественные NLS обоих типов, pat7 и pat4. Некоторые являются консервативными между генотипами, некоторые - в пределах генотипа, и некоторые не являются консервативными. Большинство находятся около N-конца, где они имеют тенденцию формировать перекрывающиеся поли-NLS области. Многие из этих аргинин-богатых мотивов являются по существу иммуногенными у млекопитающих, и содержащие их пептиды являются полезными при генерации антител против TTV.
Пример 9. Фрагменты клонов для конструирования инфекционных клонов
Следующее дает основу для конструирования из перекрывающихся клонов штамма ttvgt1-178 TTV генотипа 1 (см. SEQ ID NO:7), аминокислотная последовательность которого показана как SEQ ID NO:9.
Таким образом, два фрагмента TTV (1900 п.н. и 2200 п.н.), которые совместно охватывают весь кольцевой геном TTV, были по отдельности клонированы в отдельные векторы клонирования pCR 2.1 ТА (Invitrogen). Клонированные фрагменты были следующими: клон 1: от 680s до 2608а=~~1900 п.н. и клон 2: от 1340s до 764а=~2200 п.н.
Для того чтобы осуществить это, были сконструированы ПЦР праймеры с использованием консенсусной последовательности, которая была генерирована из штаммов по настоящему изобретению (ttvgt1-27, -7, -17 и -21) и также из опубликованных последовательностей (AY823990(g1) и AB076001-(Sd-TTV31)). Для амплификации ПЦР-продуктов из ДНК, которая была экстрагирована из образцов гомогената печени свиней, инфицированных заражающим штаммом TTV, были использованы пары праймеров, которые соответствуют последовательности в 680s и 2608а или 1340s и 764а. Эти ПЦР-фрагменты клонировали в вектор pCR2.1-TOPO ТА от Invitrogen с использованием указаний, которые поставляли с данным набором. Затем клоны использовали для генерации последовательностей ДНК, перекрыващих весь геном из 2880 оснований, и обнаружили, что данная последовательность на 86% гомологична опубликованным последовательностям GQ120664.1 и AY823990.1.
Совершенно правильные последовательности теперь будут объединены для конструирования полноразмерного инфекционного клона.
Пример 10. Инфекционный клон для g1TTV
Клонирование фрагментов двухцепочечной ДНК g1TTV. g1TTV представляет собой вирус с одноцепочечной ДНК (оцДНК). Фрагменты g1TTV превращают в двухцепочечную ДНК (дцДНК) с использованием полимеразной цепной реакции (ПЦР). Фрагменты дцДНК g1TTV затем клонируют в векторы клонирования на основе плазмиды pUC и трансформируют в Е.coli. Данные фрагменты g1TTV меньше, чем 1 полноразмерный дцДНК эквивалент генома g1TTV.
Амплификация конкатемеров дцДНК g1TTV. Конкатемеры эквивалентов полноразмерной дцДНК генома g1TTV генерируют с использованием наборов для амплификации с ϕ29 полимеразой (например illustra TempliPhi). Фрагменты полноразмерной дцДНК g1TTV генерируют расщеплением конкатемеров по подходящим сайтам эндонуклеаз рестрикции (РЭ). Эти фрагменты полноразмерной дцДНК g1TTV можно клонировать в плазмидные векторы. В качестве альтернативы, конкатемеры неклонированных фрагментов (образующиеся в результате расщепления РЭ) можно использовать без немедленного кпонирования в последующие молекулярно-биологические конструкции (см. ниже).
Тандемные дупликации генома g1TTV. Затем генерируют плазмидные конструкции, кодирующие тандемные дупликации генома g1TTV. Данные тандемные дупликации в конструкциях больше, чем приблизительно 1,2 копии эквивалентов полноразмерной дцДНК генома g1TTV. Тандемные дупликации в плазмидах генерируют с использованием (1) субклонирования с использованием подходящих сайтов РЭ, (2) ПЦР-сборки тандемных дупликаций или (3) других молекулярно-биологических способов. Матрицами для генерации тандемных дупликаций являются фрагменты дцДНК g1TTV и/или клоны полноразмерной дцДНК g1TTV (полученные амплификацией с полимеразой ф29).
Рекомбинация in vivo и генерация вируса g1TTV. Плазмидные конструкции с тандемными дупликациями не являются идентичными вирусу g1TTV. Конструкции с тандемными дупликациями представляют собой дцДНК, тогда как вирус представляет собой оцДНК; данные конструкции кодируют более 1,2 эквивалентов полноразмерной дцДНК генома g1TTV, тогда как вирус имеет только один полноразмерный эквивалент; данная конструкция содержит прерывающиеся плазмидные последовательности, тогда как данный вирус имеет только вирусные последовательности. Для генерации истинного вируса g1TTV плазмидные конструкции с тандемными дупликациями вводят в свиней (путем инокуляции, инъекции, электропорации или других способов введения) или вводят в клетки культуры ткани (путем трансфекции, электропорации или других способов введения), где плазмидная конструкция рекомбинирует по гомологичным последовательностям с генерацией эквивалента дцДНК единичной длины генома g1TTV. Данный эквивалент дцДНК генома g1TTV является предположительным репликативным промежуточным звеном жизненного цикла вируса g1TTV. Присутствие этого предположительного дцДНК репликативного промежуточного звена будет приводить к продукции истинной оцДНК g1TTV.
Обеспечение генерации вируса g1TTV in vivo путем сотрансфекции конструкций, экспрессирующих ORF g1TTV. Ожидается, что кольцевая дцДНК генома g1TTV была бы способна обеспечивать продукцию вируса. При неожиданном событии, когда дцДНК форма g1TTV не является репликационно компетентной, может потребоваться непосредственная экспрессия ORF g1TTV для инициации репликации g1TTV с дцДНК репликативного промежуточного звена. Могут быть созданы плазмидные конструкции, управляющие транскрипцией ORF g1TTV in vivo, такие как слияние транскрипционных промоторов (например CMV (цитомегаловирус)) с ORF g1TTV. В качестве альтернативы, могут быть созданы плазмидные конструкции, управляющие генерацией транскриптов ORF g1TTV in vitro, такие как слияние транскрипционных промоторов (например Т7) с ORF g1TTV, с последующим применением наборов для транскрипции in vitro. Для получения вируса g1TTV могут быть соинъецированы свиньям или сотрансфицированы в клетки либо плазмиды, экспрессирующие ORF g1TTV, либо РНК-транскрипты, экспрессирующие ORF g1TTV, наряду с плазмидными конструкциями с тандемными дупликациями.
Детекция продукции вируса g1TTV. К настоящему времени цельный вирус g1TTV не может размножаться в клетках культуры ткани. Генерация вируса g1TTV детектируется иммунными реагентами (например антителом α-g1TTV) или молекулярными способами (например количественной ПЦР).
Реферат
Представленная группа изобретений относится к области биотехнологии и касается новых нуклеотидных последовательностей вируса Torque teno (TTV) и векторов, содержащих такие последовательности. Выделенная полинуклеотидная молекула, содержит полинуклеотидную последовательность, выбранную из группы, состоящей из: SEQ ID NO:4, последовательности, комплементарной SEQ ID NO:4 и полинуклеотида, который является, по меньшей мере, на 95% идентичным SEQ ID NO:4.Представленные изобретения могут быть использованы при получении вакцин для предупреждения заболеваний свиней и других животных, вызванных вирусом Torque teno. 3 н. и 1 з.п. ф-лы, 7 ил., 3 табл., 10 пр.
Формула
(a) SEQ ID NO:4;
(б)последовательности, комплементарной указанной в(а); и
(в) полинуклеотида, который является, по меньшей мере, на 95% идентичным полинуклеотиду, указанному в (а) или (б),
где указанный выделенный полинуклеотид или его комплемент кодирует генные продукты вируса Torque teno.

Комментарии