Новый тип частиц-носителей (платформ) для получения активных комплексов - RU2441667C1
Код документа: RU2441667C1
Чертежи










Описание
Область применения изобретения
Настоящее изобретение связано, прежде всего, с получением нового типа биогенных частиц-платформ (носителей) для формирования биологически активных комплексов и их использования в медицине, ветеринарии, растениеводстве, иммунологии и вирусологии. Целью изобретения является создание путем кратковременной термоденатурации спиральных вирусов нового универсального и доступного типа сферических наночастиц (СЧ), платформ-носителей для получения биологически активных комплексов путем внеклеточной сборки СЧ с биологически активными компонентами (белки, в том числе вакцинные белки, эпитопы, ферменты, антитела, антибиотики, лекарственные препараты) на поверхности указанных СЧ.
Настоящее изобретение имеет прямое отношение к производству биологически активных комплексных препаратов путем in vitro сборки вакцинных композиций, состоящих из СЧ-платформ, поверхность которых связана с чужеродными антигенами/эпитипами целевого патогена. В соответствии с этим аспектом настоящего изобретения на основе СЧ были созданы композиции, представляющие собой антигенно активные комплексы сферических частиц-платформ с чужеродными белками или эпитопами, упакованными на поверхности всех сферических частиц-платформ. Таким образом, описанные выше СЧ могут применяться для создания нано- и микрокомпозиций частиц-платформ нового типа с чужеродными целевыми белками, эпитопами, ферментами, антителами, антибиотиками, синтетическими полимерами, металлами и другими объектами. Указанные комплексы могут быть использованы для получения вакцинных и диагностических препаратов для борьбы с вирусными заболеваниями и болезнями иной природы.
Сборка композиций осуществляется за счет уникальной способности СЧ адсорбировать разнообразные целевые белки (ЦБ) с последующей отмывкой комплекса и фиксацией ЦБ на поверхности СЧ с применением формальдегида. В изобретении показана способность СЧ образовывать композиции с различными структурно и функционально неродственными белками. При необходимости рассмотренные СЧ-носители могут образовывать комплексы с металлами, синтетическими полимерами и другими соединениями.
Терминология
Технические и научные термины, использованные в описании изобретения, имеют тот же смысл и значение, которые обычно применяются в соответствующих областях науки и техники. Термины «платформа, носитель» относятся к описываемым в настоящем изобретении сферическим частицам. Термин «сферические наночастицы» (СНЧ) относится к сферическим частицам размером до 100 нм и, в частности, с диаметром, близким к 53 нм (СНЧ, образованные индивидуальными частицами ВТМ). Термин «сферические микрочастицы» (СМЧ) относится к сферическим частицам большего размера (800 нм и более). Термин «сферические частицы» (СЧ) относится к обоим типам сферических частиц платформ-носителей. Термин «мини-СНЧ» относится к СНЧ, имеющим размеры менее 35-40 нм. Термин «частицы неправильной формы» (ЧНФ) относится к подклассу частиц, который включает незрелые частицы неодинакового размера и неправильной формы, полученные при температуре около 90°С. Термины «гетерологичный», «чужеродный», «целевой» (например, «гетерологичные» или «целевые» белки) - это белки, антигенно-неродственные белкам СЧ, использованные в составе комплекса (композиции) с СЧ-носителем. Чужеродные белки обычно (но не обязательно) закодированы не в геноме вируса, из которого получают СЧ, а в геноме другого вируса или альтернативного патогена, отличного от вируса (бактерии, грибы и т.п.). Термин «химерный» геном относится к геному вируса, содержащего ген «слитый» с целым чужеродным геном или его частью. Производные термины: «химерный вирус» и «химерный белок». Термины «антигенная детерминанта», «эпитоп» обозначают антигенно-активные фрагменты/полипептиды, индуцирующие продукцию антител. Термин «вакциноген» соответствует термину «вакцинный белок», т.е. белок, индуцирующий защитную вакцинную реакцию. Термин «композиция» в настоящем изобретении подразумевает комплексы, состоящие из СЧ-носителя и биологически активного компонента (белок/ антиген, эпитоп и др.).
Уровень техники
Известны работы по созданию композиций с использованием вирусов, основанные на конструировании химерных вирусных геномов. В таких случаях в ген белка оболочки (БО) или в другой вирусный ген вставляется ген или фрагмент гена целевого белка (ЦБ). Образуемые при репликации химерного генома химерные вирусные частицы выступают в качестве носителя (платформы), связанной с экспонированным на ее поверхности биологически активным целевым компонентом.
Известно, что геномы нативных частиц ВТМ и ряда других вирусов растений и животных применялись для получения химерных вирусов-вакцин с помощью методов генной инженерии. Частицы химерного рекомбинантного вируса, несущие на своей поверхности чужеродные эпитопы, получают путем слияния гена белка оболочки с чужеродным эпитопом в составе полноразмерного вирусного генома либо путем сборки in vitro вирусоподобных частиц (ВПЧ) из химерных субъединиц типа "БО-чужеродный эпитоп" (Bendahmane, M., Koo, M., Karrer, E., Beachy R.N. 1999. Display ofepitopes on the surface of tobacco mosaic virus: impact of charge and isoelectric point of the epitope on virus-host interactions. J. Molec. Biol. 290, 9-20; Smith M.L., Lindbo J.A., Dillard-Telm S., Brosio P.M., Lasnikk A.B., McCormick A.A., Nguen L.V., Palmer K.E.,2006. Modified tobacco mosaic virus particles as scaffords for display of protein antigens for vaccine applications. Virology 348,475-488; Tailor K.M., Porta C., Lin Т., Johnson J.E., Parker P.J., and Lomonossov G.P. 1999. Protein-dependent processing of peptides presented on the surface of cowpea mosaic virus. Biol. Chem. 380, 387-392; Turpen H.T. et al. VS Patent 5,977,438, Nov. 1999. Production of peptides in plants as viral coat protein fusions; Gleba Yu., Klimyuk V., Marillonnet S. 2007. Viral vectors for expression of proteins in plants. Curr. Opinion In Biotechnology 18,1-8; Denis J. et al. 2007. Immunogenicity of papaya mosaic virus-like particles fused to hepatitis С virus epitope: evidence for the critical function of multimerization, Virology 363, 59-68; McCormick A.A. and Palmer K.E. 2008 Genetically engineered Tobacco mosaic virus as nanoparticle vaccines. Expert Rev Vaccines. 7(1), 33-41; Leclerc D. 2007. Proteosome-Independent histocompatibility complex class 1 cross-presentation mediated by papaya mosaic virus-like particles leads to expansion of specific human Т cells. J.Virol. 81, 1319-1326; Leclerc, D. 2010, Immunogenic affinity-conjugated antigen systems based on Papaya Mosaic Virus and used thereof. US Patent Application Publication, 2010/0047264 A1, Feb.25; Steinmetz N.F., Lin Т., Lomonossoff G.P. and Johnson J.E. 2009. Structure-based engineering of an icosahedral virus for nanomedicine and nanotechnology. Curr. Top. Microbiol. Immunol. 327, 23-58); Leclerc, D. 2010, Immunogenic affinity-conjugated antigen systems based on Papaya Mosaic Virus and used thereof. US Patent Application Publication, 2010/0047264 A1, Feb.25).
При конструировании химерных вирусов методами генетической инженерии в реакции обратной транскрипции на матрице геномной вирусной РНК получают кДНК-копию гена БО. Полученную кДНК размножают с помощью полимеразной цепной реакции (ПЦР). Продукт ПЦР (ген БО) клонируют в бактериальной плазмиде. Аналогичным образом получают кДНК, кодирующую фрагмент целевого белка (ЦБ). Затем обе ДНК объединяют in vitro («сливают»), одновременно добавляя к конструкции ряд элементов, обеспечивающих эффективную экспрессию полученного гена в бактериальных клетках и возможность очистки рекомбинантного белка из лизата. Полученной плазмидой заражают клетки Escherichia coli. В результате экспрессии рекомбинантного гена образуется БО вируса, слитый с ЦБ («фьюжен-белок»), который собирается в вирусоподобные частицы (ВПЧ) непосредственно в клетках бактерий в силу способности БО к самосборке. ВПЧ выделяют из клеточного лизата (обычно с помощью дорогостоящей аффинной хроматографии) и используют по назначению.
Хотя в этом описании опущены многие важные детали, можно видеть, что получение каждого вида рекомбинантного вируса, несущего химерный БО, это сложный, длительный и трудоемкий процесс. Тем не менее, этот подход применяется, так как иным образом зафиксировать ЦБ на интактных вирусных частицах нельзя.
Недостатки применения рекомбинантных химерных вирусов:
1. Создание химерных структур требует применения трудоемких методов генной инженерии и значительного времени (около 5-10 месяцев) для модификации вирусного генома и конструирования молекул химерного вирусного БО, соединенного (слитого) с чужеродными антигенами/эпитопами.
2. Недостатком применения морфологически немодифицированных спиральных химерных вирусов является высокая степень гетерогенности и агрегации в растворе. При рабочих концентрациях 0,1-10,0 мг/мл в суспензии ВТМ и других спиральных вирусов формируются крупные линейные и латеральные агрегаты вирусных частиц (фиг.1) и даже паракристаллические частицы.
3. При накоплении в растении химерные вирусы обычно неспособны заражать его системно и также генетически нестабильны, т.е. химерный вирус ревертируют в вирус дикого типа в процессе репликации. Нередко уже в первом пассаже химерные вирусы теряют инсерции, утрачивают инфекционность или функцию транспорта (Porta С., Spall V.E., Loveland J., Johnson J.T., Parker P.J., Lomonossoff G.P. 1994. Development of cowpea mosaic virus as a highyielding system for the presentation of foreign peptides. Virology, 202, 949-955; Tailor K.M., Porta C., Johnson J.T., Parker P.J., Lomonossoff G.P. 1999. Position-dependent processing of peptides presented on the surface of cowpea mosaic virus. Biol. Chem. 380, 387-392; Bong-Nam Chung, T.Canto, P.Palukaitis 2007, Stability of recombinant plant viruses containing genes of unrelated plant viruses, J. Gen. Virol. 88,1347-1355).
Мы не рассматриваем способы, основанные на сшивании ЦБ и носителя белковой природы с помощью бифункциональных реагентов, поскольку они приводят к формированию агрегатов неконтролируемого размера и состава и, как правило, к существенной инактивации ЦБ как антигена.
Известны также так называемые, аффинно-конъюгированные антигенные системы. Такие системы включают: 1) рекомбинантные вирусы с БО, несущим участок связывания чужеродного целевого белка. В этих случаях ген вирусного белка оболочки следует генетически модифицировать в составе полногеномной копии или в изолированном гене БО введением вставок или делеций для получения афинных участков связывания целевых субстанций белковой природы. Например, с использованием рекомбинантьного ВТМ вводили реактивный лизин в N-концевой участок БО ВТМ для связывания с биотином вирусной частицы. В независимых опытах получали зеленый флуоресцентный белок (целевой белок), ковалентно связанный со стрептавидином. В результате специфического авидин-биотин-взаимодействия получали частицы вируса, декорированного целевым белком-антигеном (ЗФБ) (J.A.Lindbo. O.H.Wooster, Kenneth E. Palmer, K.Y.Owensboro, Mark L., Smith D.C.A. Modified tobacco mosaic virus particles as scaffolds for display of protein antigens for vaccine applicftions. US Patent Pub. No. 2009/0053261 A1, Feb.26, 2009; Lindbo JA, Palmer KE, Owensboro KY, Smith ML. Эта система включает этап аффинной сборки композиций на основе взаимодействия химически модифицированного рекомбинантного вируса-носителя и модифицированного чужеродного антигена. Несмотря на существенную разницу, эта система относительно близка заявляемому изобретению и может быть рассмотрена в качестве прототипа. Аффинно-коньюгированные антигенные системы рассматриваются также в более позднем патенте (Leclerc, D. 2010, Immunogenic affinity-conjugated antigen systems based on Papaya Mosaic Virus and used thereof. US Patent Application Publication, 2010/0047264 A1, Feb.25).
Недостатки применения аффинно-коньюгированных систем: 1) относительно невысокая биологическая активность, 2) сложность и многоступенчатость процедуры, включающей: а) приготовление модифицированного биотином БО вируса, б) получение биотин- либо стрептавидин-меченного целевого белка/антигена с последующей в) обязательной трехстадийной очисткой, то есть отделением биотин-меченного БО от модифицированных стрептавидином молекул ЦБ и выделение комплекса «вирус-биотин-стрептавидин-ЦБ)».
3) Пользование этой системой осложняется генетической нестабильностью и другими трудностями, характерными для накопления химерных вирусов, рассмотренными выше.
4) Другим недостатком аффинно-коньюгированных антигенных систем является отсутствие универсальности - строгая специфичность взаимодействия двух ее компонентов: модифицированной платформы-носителя (БО вируса) и модифицированного целевого белка (например, антигена). В определенных опытах высокая специфичность взаимодействия носителя с целевым белком полезна, облегчая очистку создаваемой композиции от ненужных примесей. Однако в предлагаемом изобретении (то есть при условиях отсутствия примесей за счет применения высокой степени очистки обоих компонентов композиции) специфичность резко ограничила бы возможности носителя (СЧ) одним типом целевого белка/антигена. Между тем преимуществом СЧ является их уникальная способность адсорбировать очень разные белки. Ниже показана способность СЧ.
5. В отличие от прототипа СЧ могут образовывать композиции с различными структурно и функционально неродственными белками. Более того, помимо белков, СЧ способны адсорбировать химические вещества другой природы, например ионы металлов, что в принципе невозможно при использовании способа, заявленного в прототипе. Так, пример 3 в заявке показывает, что СЧ связывают ионы уранила.
Таким образом, важным результатом изобретения является простой быстрый и доступный способ получения универсальных носителей (платформ) для быстрой и простой сборки вне клетки различных видов комплексов и иммуногенных композиций.
Аннотация
Известно, что ВТМ высоко термостабилен (Lauffer, M.A., and Price, W.С. (1940) Thermal denaturation of tobacco mosaic virus. J. Biol. Chem. 133, 1-15), обнаружили, что температурная инактивация ВТМ тесно связана с денатурацией БО. Более 50 лет назад было показано, что при нагревании до 98°С палочки ВТМ преобразуются в шаровидные структуры с объемом, близким к объему исходной палочки вируса (Hart, R.G. (1956) Morphological changes accompanying thermal denaturation of Tobacco mosaic virus. Biochim. Biophys. Acta 20, 388-389). Эти исследования никогда не были продолжены или подтверждены.
В настоящем изобретении мы изучили более детально феномен термоденатурации БО ВТМ, условия образования сферических частиц (СЧ), их свойства и способность служить наноплатформой для образования нанокомплексов. Термическое превращение спиральных частиц в СЧ показано на примере пяти разных тобамовирусов. Кроме того, в настоящем изобретении продемонстрировано, что другие вирусы растений со спиральной структурой (потексвирусы, гордеивирусы) способны при нагревании генерировать СЧ. Аналогичные СЧ образуются также при термической денатурации белка оболочки (БО) ВТМ в отсутствие РНК.
Уникальная способность платформы-носителя СЧ формировать композиции с различными структурно и функционально неродственными белками показана на примере ряда чужеродных белков.
Преимущества СЧ-платформ для создания биологически активных композиций, несущих на своей поверхности чужеродные эпитопы в сравнении с химерными вирусами - вакцинами и вакцинами других типов: 1) Быстрое получение комплексов из СЧ и биологически активных компонентов (например, белков-вакциногенов) на основе «блочной» сборки in vitro; 2) Указанный подход исключает возможность рекомбинации и реверсии патогена; 3) СЧ и иммуногенные комплексы, полученные на основе термоденатурации вирусов растений, биологически безопасны, так как растения и животные не имеют общих патогенов; 4) Процедура получения СЧ-платформ основана на нагревании вируса при 94°С или 98°С, то есть не требует дополнительной стерилизации; 5) Иммуногенные комплексы, полученные на основе СЧ будут антигенно полностью стабильны, так как они генетически инертны; 6) Фитовирусы-доноры СЧ-типа тобамовирусов, потексвирусов и гордеивирусов могут быть выделены простыми процедурами с выходом вируса 2-10 г/кг зараженных листьев, зависимым от вида вируса и растения-хозяина; 7) Важным преимуществом СЧ является их способность адсорбировать на своей поверхности очень разные типы белков, образуя биологически активные композиции.
Предлагаемые СЧ не были описаны в литературе в качестве наноплатформ и являются новым универсальным типом носителей. Это существенно расширяет ассортимент возможных композиций. СЧ уникальны как платформы-носители. Следовательно, любой биологически активный комплекс, основанный на СЧ-платформе (связанной с антигеном, эпитопом, целевым белком или другим материалом), является оригинальным.
Описание изобретения
Основными задачами настоящего изобретения являлись: (1) создание и описание свойств наноплатформ-носителей нового типа на основе термоденатурации и структурной перестройки спиральных вирусных наночастиц и (2) создание методом внеклеточной сборки нанокомпозиций, состоящих из указанных выше СЧ-платформ-носителей, несущих на поверхности чужеродный биологически активный компонент (антиген, эпитоп, фермент и т.д.).
(I) В рассмотренных выше публикациях в качестве платформы применялись рекомбинантные химерные вирусы либо их компоненты. При этом морфология и общая архитектура химерных вирусов воспроизводила морфологию нативного вируса. Химерные геномы при репликации продуцируют химерные вирусные частицы, внешне не отличающиеся от нативных. Химерная форма природной оболочки вируса (химерный капсид) служит в качестве платформы, либо она создается при сборке химерного структурного белка («коровый» нуклеокапсид вируса гепатита В).
В отличие от этого СЧ-платформы, описанные в настоящем изобретении, образованы в результате глубокой денатурации БО и одновременной структурной перестройки исходного спирального вируса. Субъединицы вирусного БО денатурируют при нагревании и в зависимости от концентрации вируса и температуры продуцируют смесь СЧ-гетерогенных по размерам.
В настоящем изобретении разработан метод, позволяющий контролировать размеры указанных СЧ. Показано, что их размеры зависят от концентрации нативного ВТМ, используемого для термоденатурации. Так, средний диаметр СЧ, образуемых нативным ВТМ в концентрации 0,1, 1 и 10 мг/мл, составляет соответственно 50-160, 100-350 и 250-800 нм. Этот феномен позволяет регулировать размеры СЧ (см. фиг.2b, c, d и фиг.3).
В соответствии с другим аспектом настоящего изобретения описан метод, позволяющий получить незрелые промежуточные формы СЧ. Указанные незрелые частицы (НЧ) в избытке формируются при 90°С и представляют собой частицы неправильной формы (ЧНФ) и различных размеров (фиг.2а). Отличительное свойство НЧ - их способность превращаться в зрелые СЧ при нагревании до 94-98°С.
ВТМ можно диссоциировать на белок оболочки и нуклеиновую кислоту с последующей самосборкой вирусных наноструктур in vitro. Самосборка (реполимеризация) низкомолекулярного БО тобамовирусов может осуществляться в отсутствие РНК. Реполимеризации БО протекает ступенчато с образованием серии промежуточных белковых агрегатов возрастающих размеров и заканчивается сборкой вирусоподобных частиц (ВПЧ) (Butler, P.J.G. (1999) Self-assembly of tobacco mosaic virus: the role of intermediate aggregate in generating both specificity and speed. Philos. Trans. R. Soc. 354, 537-550).
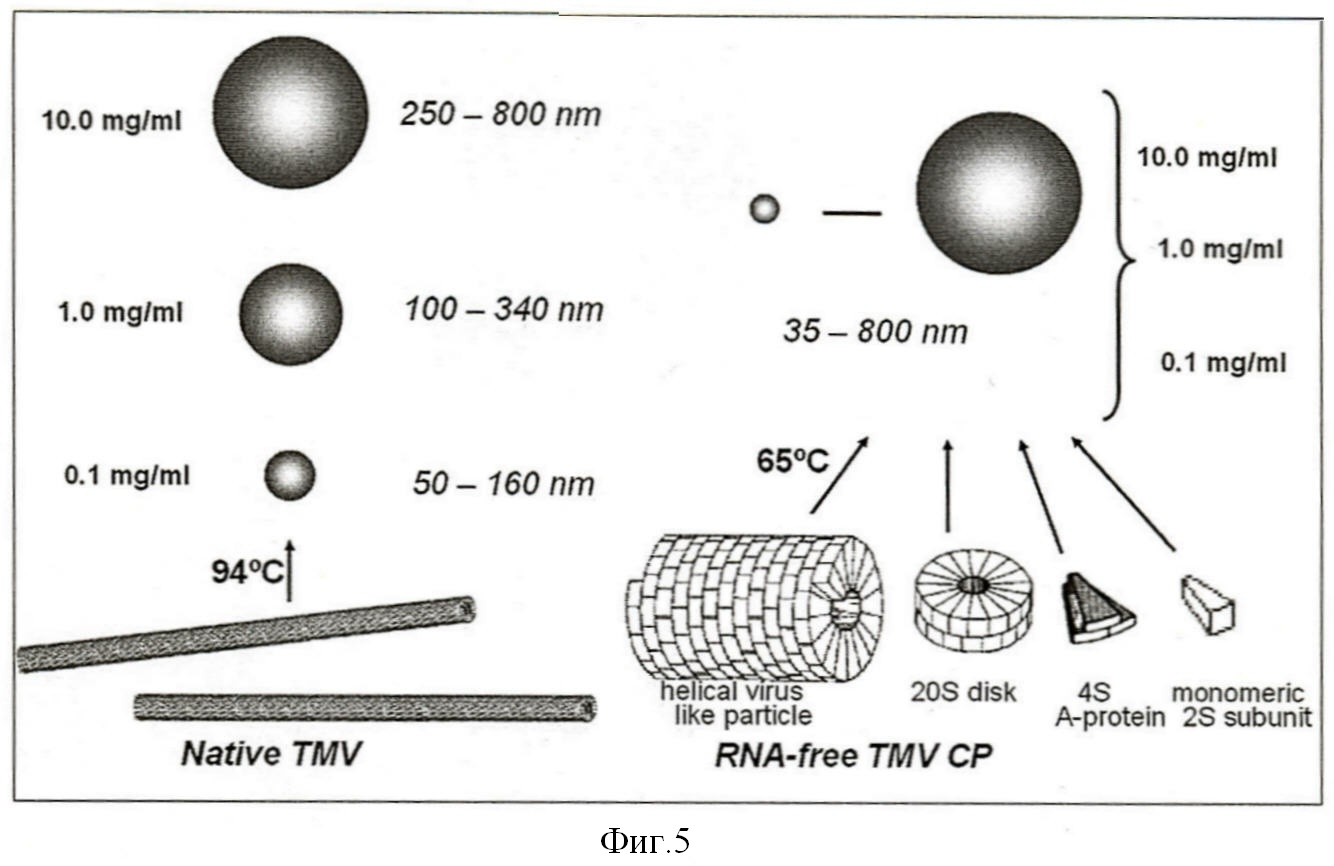
В соответствии с другим аспектом настоящего изобретения предложен метод, позволяющий использовать для получения СЧ не только препараты нативного вируса, но также и препараты разных форм вирусного БО, не содержащие РНК (фиг.4 и Пример 1), включая ВПЧ (фиг.4а), 20S дисковидные агрегаты БО ВТМ (фиг.4b), А-белок, тример субъединиц (фиг.4с), и мономеры БО ВТМ (фиг.4d). Итак, указанные СЧ образуются при термоденатурации нативного вируса и также разных форм БО, включая мелкие агрегаты (тример субъединиц) и даже индивидуальные субъединицы БО. Трансформация свободных от РНК форм БО в СЧ происходит одноступенчато, без образования промежуточных продуктов. Полученные результаты схематически представлены на фиг.5.
Вирусы со спиральной структурой частиц (спиральные вирусы)
Группа тобамовирусов включает 10 основных (наиболее изученных) антигенно-родственных видов палочковидных вирусов со сходной структурой частиц (СМ1, ААВ Descriptions of plant viruses No. 184, 1977, Tobamovirus group; Fauquet CM et al. 2005; Virus taxonomy, Academic Press.). Структурная и функциональная близость белков оболочки группы ВТМ отчетливо проявляется в опытах по комплементации штаммов и видов тобамовирусов. В условиях смешанного заражения формируются «фенотипически смешанные» вирусные частицы, состоящие из белковых субъединиц обоих вирусов-партнеров (Atabekov, JG, Schaskolskaya, ND, Atabekova, TI (1970) Reproduction of temperature-sensitive strains of TMV under restrictive conditions in the presence of temperature-resistant helper strain И.Г.Атабеков, Т.И.Атабекова. Биол.науки, 1972, 8, 116-119. Специфичность белок-белок и белок-РНК взаимодействия при созревании вируса табачной мозаики в условиях смешанной инфекции. Atabekov, J.G., Malyshenko, S.I., Morozov, S.Yu., Taliansky, M.E., Solovyev, A.G., Agranovsky, A.A., Shapka, N.A. (1999) Identification and study of tobacco mosaic virus movement function by complementation tests Philos Trans R Soc LondBBio Sci 354, 629-635.
Известны также более экзотические тобамовирусы, например вирусы кактуса, или австралийские штаммы, мягкие штаммы ВТМ U2 и U5, а также множество условно летальных штаммов ВТМ. Несмотря на различия в спектре растений-хозяев, контролируемых геном транспорта, молекулярная организация частиц тобамовирусов очень близка, так как определяется геном белка оболочки.
В настоящем изобретении для изготовления СЧ использовали:
1. Пять разных тобамовирусов, включая обычный (vulgare) вирус табачной мозаики (ВТМ), вирус мозаики томатов (ВМТом), вирус зеленой крапчатой мозаики огурца (ВЗКМО), вирус растений семейства крестоцветных (крВТМ), вирус мозаики долихоса (Dolichos enation mosaic virus, ВТМ бобовых).
Типовой тобамовирус -ВТМ- палочковидный вирус со спиральной структурой диаметром 18 нм и длиной 300 нм. Оболочка вируса состоит из идентичных белковых субъединиц, упакованных в виде спирали (Klug, A. (1999) The tobacco mosaic virus particle: structure and assembly. Philos. Trans. R. Soc. 354, 531-536). (Klug, 1999; Butler, 1999; Zaitlin and Israel, 1975).
Вирусы группы потексвирусов (вирус Х картофеля, вирус мозаики альтернантеры) (Atabekov et al. 2007. Potato virus X: structure, disassembly, reconstitution, Molec, Plant Pathol. 8, 667-675). Вирус X вирус картофеля (ХВК) - типовой представитель группы потексвирусов и другие потексвирусы. ХВК представляет собой гибкие нитевидные вирионы со спиральной структурой длиной 515 и диаметром 13.5 нм.
Вирус группы гордеивирусов (вирус штриховатой мозаики ячменя. Типовой представитель - вирус штриховатой мозаики ячменя (ВШМЯ) представлен жесткими палочковидными частицами со спиральной структурой.) (Atabekov JG, Novikov VK. Barley stripe mosaic virus, In «Descriptions of Plant Viruses», C.N.I.A.B.B. Coupar Pertshire, 1971.
В соответствии с другим аспектом настоящего изобретения показано, что, помимо тобамовирусов, другие спиральные вирусы растений могут также быть превращены в СЧ. В частности, на фиг.6 и 7 показаны СЧ, полученные при термоденатурации ВШМЯ и ХВК соответственно. Идентичные данные были получены при термоденатурации еще одного потексвируса - вируса мозаики альтернантеры.
(II). Способность СЧ служить универсальной платформой-носителем для сборки комплексов с чужеродными белками
В изобретении существенно упрощен способ получения носителя (платформы) и композиций на его основе. Носитель (СЧ) получают путем кратковременного (10 сек) прогревания суспензии ВТМ при температуре 98°С. Далее смесь СЧ-носителя и целевого белка (ЦБ) инкубируют при комнатной температуре 15 мин для адсорбции ЦБ на СЧ. Затем пробы центрифугируют для отмывания носителя от ЦБ, не связавшегося с частицами. Вся процедура сборки комплекса осуществляется в течение одного часа.
Поверхность СЧ обладает высокой сорбционной способностью в отношении веществ различной химической природы. Это свойство СЧ иллюстрируется данными Таблицы: более 50% ФИТЦ-меченного БО ХВК адсорбируется на СЧ до фиксации комплекса формальдегидом. Все формы СЧ водонерастворимы и могут быть быстро осаждены низкоскоростным центрифугированием (10 мин при 10000 g), т.к. существуют в виде коллоидных растворов или стабильных суспензий (в зависимости от размеров СЧ). В таких же условиях большая часть ЦБ остается связана с поверхностью СЧ (см. Таблицу) и впоследствии фиксируется формальдегидом в составе композиции «СЧ-ЦБ». В отличие от СЧ ФИТЦ-меченный БО ХВК не адсорбируется на нативном ВТМ.
В изобретении показано, что чужеродные белки/антигены способны связываться с поверхностью СЧ-платформ, создавая биологически активные композиции. В соответствии с этим аспектом изобретения представлено схематическое изображение исходного СЧ-носителя и композиции СЧ, связанного с чужеродным антигеном (фиг.8а). На основе СЧ-носителей-наноплатформ в изобретении получена модельная система - активная композиция СЧ с чужеродным белком - зеленым флуоресцентным белком медузы (ЗФБ) (фиг.8б: Пример 3). Комплексы «СЧ-ЗФБ» стабилизировали с применением 0,05% формальдегида (Пример 4). Указанная композиция представляет собой СЧ-платформы, поверхность которых покрыта молекулами ЗФБ (фиг.8а и фиг.8б). Чужеродный белок в составе комплекса с СЧ сохраняет антигенную активность (реагирует со специфическими антителами) активность (фиг.8б).
Другой пример образования композиции СЧ с чужеродным белком представлен на фиг.9 (Пример 5). Фиг.9 иллюстрирует, что поверхность всех СЧ-платформ покрыта молекулами БО ХВК, меченными флуоресцеинизотиоцианатом (ФИТЦ).
Другой пример образования композиции СЧ с чужеродным белком представлен на фиг.10 (Пример 6). Фиг.10 иллюстрирует образование комплекса «СЧ-носитель полиэпитоп А вируса краснухи». Для образования комплекса с СЧ была использована антигенная детерминанта А гликопротеида Е1 вируса краснухи.
Полностью аналогичные результаты были получены при адсорбции на СЧ эпитопов БО вируса оспы слив (ВОС12 и ВОС10), «слитыми» с БО ХВК, эпитопом М2е вируса гриппа, «слитого» с дегидрофолатредуктазой (DHFR) и тетраэпитопом гемагглютинина гриппа А человека.
При использовании СЧ, образованных при нагревании вируса семейства крестоцветных (крВТМ), для получения композиций с чужеродными белками были получены такие же результаты, как в случае использования СЧ, образованных при нагревании ВТМ (vulgare).
Достоинства СЧ как платформ-носителей при создании композиций с биологически активными молекулами.
1. Уникальная способность СЧ адсорбировать на своей поверхности разные чужеродные белки, сильно отличающиеся по структуре и функциональным свойствам, делает этот новый тип платформ-носителей исключительно привлекательным для производства биологически активных композиций.
2. Достоинством применения СЧ-платформ является также доступность вируса-донора СЧ. Вирус-донор СЧ аккумулируется в листьях зараженных растений в очень больших количествах. Выход ВТМ может достигать 10 г на 1 кг свежей листовой массы растений табака (Zaitlin, M. and Israel, H.W. (1975) Tobacco mosaic virus (type strain). C.M.I./A.A.B. Descriptions of Plant Viruses №151).
3. Достоинством применения СЧ в качестве платформы-носителя является простота выделения очищенного вирусного препарата в граммовых количествах; простота и скорость изготовления стерильных СЧ нагреванием очищенного вируса при 94-98°С.
4. Достоинством применения СЧ-платформ является возможность получения СЧ нужного размера при определенной концентрации вируса.
5. Достоинством применения СЧ-платформ является возможность быстрого осаждения при отмывке и переосаждениях СЧ низкоскоростным центрифугированием (10 мин при 10000 g). Это исключает необходимость длительных циклов ультрацентрифугирования, применяемых в работе с рекомбинантными/химерными вирусами.
6. Достоинством указанных СЧ является их исключительно высокая стабильность. В настоящем изобретении показано, что СЧ сохраняют форму, размеры и уровень агрегации: при замораживании (-20°С) и последующем оттаивании; при повторном нагревании до 98°С и охлаждении; при осаждении центрифугированием (10000 g) и ресуспендировании осадка; при хранении в течение, минимум, 6-ти месяцев в условиях 4°С в воде. В процессе термической транзиции «ВТМ-СЧ» не происходит деградации БО СЧ, хотя происходит необратимая денатурация БО. Молекулярная масса БО нативного ВТМ и белка, выделяемого из СЧ, идентичны.
7. Достоинством СЧ-платформ является их биологическая безопасность, что весьма очевидно, так как растения и человек не имеют общих патогенов. Кроме того, получение СЧ сопряжено со стерилизацией препаратов нагреванием до 94-98°С. Препараты СЧ не содержат РНК и структурно отличаются от известных в настоящее время вирусов.
8. Достоинством применения СЧ-платформ является их способность адсорбировать на своей поверхности белковые объекты разной природы и электростатических свойств с образованием композиций.
9. Достоинством применения СЧ-платформ является простота и скорость формирования композиций на основе сборки комплексов вне клетки и последующей их стабилизации формальдегидом.
10. Достоинством применения СЧ-платформ при необходимости получения иммуногенных вакцинных композиций будет являться неизменность антигенной специфичности вследствие их абсолютной генетической инертности.
Предлагаемые СЧ не были описаны в литературе в качестве наноплатформ и являются новым универсальным типом носителей. Это существенно расширяет ассортимент возможных композиций. СЧ уникальны как платформы-носители.
Краткое описание чертежей
Фиг.1 представляет электронные микрофотографии линейно и латерально агрегированных частиц вируса табачной мозаики. Негативное контрастирование 2% уранилацетатом.
Фиг.2 представляет электронные микрофотографии, иллюстрирующие две стадии образования СЧ из ВТМ: (а) незрелые частицы неправильной формы (ЧНФ) и различного размера, являющиеся предшественниками для образования СЧ. ЧНФ образуются при нагревании ВТМ (0,1 мг/мл) до 90°С. Дальнейшее нагревание до 94-98°С приводит к полному превращению ЧНФ в зрелые СЧ (b-d), размер которых определяется исходной концентрацией ВТМ. Концентрация вируса: (b) 0,1 мг/мл; (с) 1,0 мг/мл; (d) 10 мг/мл. Стрелки указывают на «мономеры» СЧ. Окрашивание 2% уранилацетатом.
Фиг.3 иллюстрирует зависимость размера СЧ от концентрации ВТМ, нагреваемого до 98°С. Концентрация нативного ВТМ: (а) 0,1 мг/мл; (b) 1,0 мг/мл; (с) 10 мг/мл. Сканирующая электронная микроскопия.
Фиг.4 представляет электронные микрофотографии гетерогенной смеси СЧ, образующихся при нагревании различных форм белка оболочки ВТМ, не содержащих вирусной РНК: (а) спиральных вирусоподобных частиц (1 мг/мл, 65°С); (b) 20S дисков из белка оболочки (1 мг/мл, 65°С); (с) А белка (0,1 мг/мл, 65°С); (d) индивидуальных субъединиц белка оболочки (0,1 мг/мл, Трис-буфер, pH 14; 98°С). Стрелки указывают на «мини»-СЧ. Окрашивание 2% уранилацетатом.
Фиг.5 схематически изображает образование СЧ из нативного ВТМ и из различных лишенных РНК форм белка оболочки ВТМ. Цифры показывают концентрацию нативного ВТМ (слева) или белка оболочки (справа), нагретых до 94°С или до 65°С соответственно. Размеры СЧ приведены в нанометрах.
Фиг.6 иллюстрирует СЧ, полученные из гордеивируса штриховатой мозаики ячменя нагреванием вируса при 98°С.
Фиг.7 иллюстрирует СЧ, полученные из потексвируса Х картофеля нагреванием вируса при 98°С. Сканирующая электронная микроскопия.
Фиг.8а представляет схематическое изображение связывания модельного зеленого флуоресцентного белка медузы (ЗФБ) с СЧ-платформой; Фото 8б иллюстрирует результаты эксперимента по связыванию флуоресцирующих молекул ЗФБ с поверхностью СЧ-наноплатформы. Размер метки 5 мкм. Флуоресцентная микроскопия.
Фиг.9 иллюстрирует, что поверхность всех СЧ-платформ покрыта молекулами БО ХВК, (а) меченными флуоресцеинизотиоцианатом (ФИТЦ); (б) контроль, проходящий свет. Размер метки 3 мкм. Конфокальная микроскопия.
Фиг.10 иллюстрирует, что тетраэпитоп белка Е1 вируса краснухи, связанный с поверхностью СЧ-платформы, выявляется первичными мышиными антителами к белку Е1 и вторичными куриными антимышиными антителами, конъюгированными с флуорофором Алекса 488 зеленым. Размер метки 3 мкм. Флуоресцентная микроскопия.
ПРИМЕРЫ
Пример 1
Препаративное выделение вирусов и получение различных форм агрегатов БО ВТМ
ВТМ был изолирован из системно-инфицированных листьев Nicotiana tabacum L. cv. Samsun методом дифференциального центрифугирования, как описано ранее (Novikov, V.K. and Atabekov, J.G. (1970). A study of the mechanism controlling the host range of plant virus. I Virus - specific receptors of Chenopodium amaranticolor. Virology 41, 101-107).
Тобамовирус зеленой крапчатой мозаики огурца (ВЗКО) (синонимы: огуречный вирус 3 - ОВ 3, огуречный вирус 4 - OB 4) структурно сходен и антигенно родственен ВТМ, но поражает в основном растения из семейства тыквенных Cucurbitaceae. Для выделения вируса листья растений огурца Cucumis sativus L., зараженные OB 3, 4, гомогенизировали в двух объемах (объем/вес) 0,1 М фосфатного буфера pH 7,8. Гомогенат прогревали 15-20 мин при 58°С, сок отжимали. К экстракту добавляли 1/8 объема от объема гомогената хлороформа и встряхивали в течение 30 мин. После центрифугирования при 4000 об/мин в течение 30 мин водную фазу супернатанта отбирали, добавляли полиэтиленгликоль (ПЭГ 6000) до конечной концентрации 3% и NaCl до 0,2 М и оставляли на ночь при 40°С для формирования осадка. В ряде случаев к супернатанту добавляли 0,5% тритон Х-100. После центрифугирования в течение 15 мин при 15000 об/мин супернатант отбрасывали, а осадок растворяли в 0,02 М Трис-HCl буфере 0,001 М ЭДТА, pH 7,5. Затем центрифугировали 15 мин при 15000 об/мин, супернатант собирали, а экстракцию из осадка повторяли еще 2 раза.
Все полученные супернатанты объединяли и центрифугировали 2 часа при 45000 об/мин (центрифуга Spinco L-50, ротор Ti-50). Иногда для первичного концентрирования осадка к супернатанту добавляли ПЭГ (м.м. 6000) до конечной концентрации 3% и NaCl до 0,2 М и оставляли на ночь для формирования осадка. В этом случае процесс ультрацентрифугирования не проводили. Полученные в обоих случаях осадки растворяли в 0,02 М Трис-HCl буфере, дополненном 0,001 М ЭДТА, pH 7,6, центрифугировали 20 мин при 5000-7000 об/мин, осадок отбрасывали, а в супернатанте спектрофотометрически определяли концентрацию вируса исходя из коэффициента поглощения при l=1 см: Е0,1%260 нм=2,2. Кроме того, в каждом случае контролировали соотношение поглощения раствора вируса при 260 и 280 нм. Если отношение D260/D280 равнялось 1,2, то выделенный раствор считали пригодным для дальнейшего анализа. Полученные препараты вирусных частиц исследовали под электронным микроскопом Hitachi-7 при инструментальном увеличении 20000. Контрастирование проводили 2% уранилацетатом. Препараты ОВ 3, 4 содержали палочковидные частицы длиной 300 нм и шириной 17-18 нм, идентичные ВТМ. При концентрации ПЭГ, равной 1%, и концентрации NaCl, равной 0,2 М, можно осадить частицы длиной 300 нм. В присутствии 2% ПЭГ и 0,2 М NaCl осаждаются частицы промежуточной длины 60-100 нм, а при 3% ПЭГ и 0,5 М NaCl осаждаются частицы длиной около 40 нм. Очищенные препараты ОВ 3, 4 хранили в 0,02 М Трис-HCl (pH 7,6) буфере с добавление 0,001 М ЭДТА при 4°С.
Аналогичные методы применялись для препаративного выделения вируса мозаики томатов (ВМТом), вируса зеленой крапчатости огурца (ВЗКО), вируса крестоцветных ВКР и вируса бобовых (Dolichos enation mosaic).
Вирусный БО был выделен с использованием ацетатного метода (Fraenkel-Conrat, Н. (1957). Degradation of tobacco mosaic virus with acetic acid. Virology 4, 1-4) А белок был получен в 10 мМ Tris-HCl при pH в интервале от 7.8 до 8.0. Диски (дископодобные агрегаты) из БО ВТМ были получены в 50 мМ Na-фосфатном буфере, pH 7.0. Сборка (полимеризация) БО в спиралевидные частицы (ВПЧ) проводилась в 100 мМ Na-фосфатном буфере, pH 5.8-6.0 при комнатной температуре в течение ночи. Полученные препараты агрегатов, дисков и ВПЧ контролировали с помощью ПЕМ.
Пример 2
Получение СЧ и их анализ с помощью методов просвечивающей и сканирующей электронной микроскопии
Исходный раствор вируса табачной мозаики (ВТМ) разводили до нужной концентрации (необходимой для получения СЧ заданного размера) и распределяли по 50 мкл в полипропиленовых тонкостенных пробирках (для ПЦР) на 0,5 мл. Чтобы предотвратить испарения раствора (а следовательно, изменение [увеличение] концентрации вируса во время термической обработки), на поверхность раствора вируса осторожно наносили 30 мкл минерального масла. Далее пробирки помещали в ячейки термоциклера «Терцик» (ДНК-Технология, Россия) и запускали программу, регулирующую температуру в каждой ячейке:
1. В течение 90 секунд ячейка плавно нагревается с 10 до 94°С.
2. Поддержание в ячейке температуры 94°С в течение 10 секунд.
3. Плавное охлаждение ячейки термоциклера в течение 90 секунд до 10°С.
Все СЧ, используемые в работе, получали именно по этой программе. Однако третий этап программы не является обязательным. Необходимым условием получения СЧ является выполнение первых двух пунктов программы. По окончании работы термоциклера пробирки вынимали из прибора, масло осторожно удаляли с поверхности раствора ВТМ. Далее для очистки полученных СЧ пробирки центрифугировали при 1000 g в течение 5 минут. Надосадочную жидкость отбирали, осадок ресуспендировали в 50 мкл воды (Milli-Q). Все операции с пробирками до и после получения шариков проводили при комнатной температуре.
Процесс перехода (превращения) нативного ВТМ в СЧ изучали с помощью ПЕМ и СЕМ. Образцы для микроскопии были приготовлены, как описано ранее (Kaftanova A.S., Kiselev N.A., Novikov V.K., Atabekov J.G. (1975) Structure of products of protein reassembly and reconstitution of potato virus X. Virology 65, 283-287). Цифровое изображение получали при помощи камеры Gatan Erlangshen ES500W с использованием программного обеспечения Gatan Digital Micrograph™. Для СЕМ образец помещали на предметный столик и высушивали на воздухе при комнатной температуре, затем образцы помещали в ионно-напылительную установку IB-3 Ion Coater (Eico, Japan) и ионизировали поверхность напылением золота с палладием. Анализ проводили при помощи сканирующего электронного микроскопа JSM-6380LA (JEOL, Japan) при 80 кВ.
Пример 3
Препарат зеленого флуоресцентного белка (ЗФБ)
Зеленый флуоресцентный белок (ЗФБ), содержащий на N-конце шесть остатков гистидина (His6), а на С-конце 5 остатков аргинина (Arg), был экспрессирован в бактериях и выделен, как описано ранее (Karpova O.V., Ivanov K.I., Rodionova N.P., Dorokhov Yu.L., Atabekov J.G. (1997) Nontranslatability and dissimilar behavior in plants and protoplasts of viral RNA and movement protein complexes formed in vitro. Virology. 31, 230(1), 11-21; Zayakina O.V., Arkhipenko M.V., Kozlovsky S.V, Nikitin N.A., Smimov A.V., Susi P., Rodionova N.P., Karpova O.V. and Atabekov J.G. (2008) Mutagenic analysis of Potato Virus X movement protein (TGBp1) and the coat protein (CP): in vitro TGBp1-CP binding and viral RNA translation activation. Molecular Plant Pathology 9 (1), 37-44). Для получения антигенных комплексов СЧ инкубировали с рекомбинантным белком в соотношении 100 мкг СЧ на 2 мкг белка при комнатной температуре в течение 10 минут. Данное соотношение было определено при последовательном добавлении рекомбинантного белка ЗФБ (50 мкг/мл) к СЧ (100 мкг/мл) до начала агрегации, которая детектировалась методом динамического светорассеивания.
Полученный рекомбинантный ЗФБ, содержащий в С-конце 5 остатков аргинина (Arg), был использован в качестве модельного антигена

Ген рекомбинантного белка сконструирован на основе плазмиды pQE31,
6His отмечены подчеркиванием,
Полужирным - стартовый кодон гена ЗФБ,
Курсивом отмечены 5 остатков Arg.
Пять остатков Arg были добавлены к рекомбинантной молекуле с целью повышения суммарного положительного заряда ЗФБ. Можно было ожидать усиления электростатического взаимодействия между модельным антигеном и СЧ. Для получения антигенных комплексов СЧ инкубировали с ЗФБ в соотношении 50 мкг СЧ на 1 мкг белка в воде, образование комплекса выявляли с помощью флуоресцентной микроскопии.
Пример 4
Образование комплекса «СЧ - зеленый флуоресцентный белок» (СЧ - ЗФБ); флуоресцентная микроскопия
СЧ инкубировали с ЗФБ в воде при комнатной температуре в течение 10 мин. Образование комплекса «СЧ-чужеродный эпитоп» происходило благодаря электростатическому взаимодействию. В ряде экспериментов образованный комплекс стабилизировали 0,05% формальдегидом (10 мин при комнатной температуре). Избыток формальдегида удаляли центрифугированием СЧ (10000 g).
Суспензию полученных комплексов наносили на покровные стекла, предварительно обработанные поли-L-лизином, и инкубировали в течение двух часов при комнатной температуре. Для фиксации образцов их обрабатывали в течение 15 мин 4% параформальдегида при комнатной температуре, затем отмывали водой в течение 5 минут, после чего образцы заключали между покровными и предметными стеклами при использовании фотозащитной добавки 1,4 диазобицикло-[2,2,2]октана (DABCO), инкубировали 30 минут при +4°С. Полученные препараты анализировали при помощи флуоресцентного микроскопа Axiovert 200M (Carl Zeiss, Germany), снабженного интегрированной камерой ORCAII-ERG2 (Hamamatsu, Japan). Образование комплекса СЧ с рекомбинантным ЗФБ продемонстрировано на фиг.8а и 8б.
Пример 5
Образование комплекса «СЧ-ФИТЦ-меченный белок оболочки Х вируса картофеля»
Белок оболочки (БО) Х-вируса картофеля (ХВК) выделяли обработкой вирусной суспензии в Трис-HCl буфере, pH 7.5 нейтральным солевым раствором LiCl, доводя его до конечной концентрации 2 М, помещали на -20°С на ночь, центрифугировали при 10000 g. Супернатант диализовали против тридистилированной воды. Белок после диализа ультрацентрифугировали при 100000 g. К 1 мг БО ХВК с концентрацией 1 мг/мл добавляли 18 мкг флуоресцеина изотиоцианата (ФИТЦ) и инкубировали 24 часа при 4°С, диализовали против воды для освобождения от несвязавшейся флуоресцентной метки. Полученный белок, меченный ФИТЦ, использовали для образования комплекса с СЧ-носителем. Для этого 50 мкг СЧ инкубировали с 1 мкг белка в воде. Комплекс стабилизировали добавлением формальдегида до концентрации 0.05% (10 минут, 20°С). Связывание СЧ с БО фиксировали с помощью флуоресцентного микроскопа (LeicaDRMB), снабженного интегрированной камерой ORCAII-ERG2 (Hamamatsu, Japan).
Образование комплекса СЧ с ФИТЦ-меченным белком оболочки вируса Х картофеля ХВК показано на фиг.9.
Пример 6
Образование комплекса «СЧ-носитель полиэпитоп А вируса краснухи»
Для образования комплекса с СЧ была использована антигенная детерминанта А гликопротеида Е1 вируса краснухи.
Ниже приведена аминокислотная последовательность (32 аминокислотных остатка) эпитопа А гликопротеида Е1:

Область эпитопа А обозначена полужирным шрифтом.
Рекомбинантный белок (мол. масса около 21-22 кД), содержащий на N-конце шесть аминокислотных остатков гистидина (His6) и представляющий собой четыре повтора эпитопа А (полиэпитоп А) Е1 гликопротеида, был сконструирован на базе плазмиды pQE-BT-4A. Полиэпитоп А в составе комплекса с СЧ выявляли методом иммунофлуоресценции.
Комплекс СЧ-полиэпитоп А инкубировали при комнатной температуре 2 часа на покровных стеклах, предварительно обработанных поли-L-лизином. Для фиксации образцов их обрабатывали в течение 15 минут 4% параформальдегида при комнатной температуре, затем проводились три отмывки водой по 5 минут каждая. После отмывки образцы инкубировали в течение 30 минут в растворе, состоящем из 1% бычьего сывороточного альбумина (БСА), фосфатного буфера (PBS, состав: 7 мМ Na2HPO4, 1.5 мМ KH2PO4, pH 7.4, 137 мМ NaCl, 2.7 мМ KCl) и 0.05% твин-20. Далее препараты инкубировали с первичными мышиными антителами к гликопротеиду Е1 вируса краснухи в течение 30 минут во влажной камере в PBS с 0.25% БСА и 0.05% твин-20. Контрольные образцы инкубировали в блокирующем растворе без добавления первичных антител. Несвязавшиеся антитела отмывали раствором для отмывки (PBS с 0.25% БСА и 0.05% твин-20) на качалке 3 раза по 5 минут. Связывание первичных антител с антигенными комплексами детектировалось при помощи вторичных противомышиных антител, конъюгированных с флуорофором Alexa-488 (Molecular Probes, Eugene, OR). Co вторичными антителами инкубацию проводили в течение 30 минут во влажной камере, от несвязавшихся антител отмывались 3 раза по 5 минут в растворе для отмывки и один раз в PBS в течение 5 минут. После этого образцы заключали между покровными и предметными стеклами при использовании фотозащитной добавки 1,4 диазобицикло-[2,2,2]октана (DABCO), инкубировали 30 минут при +4°С. Полученные препараты анализировали при помощи флуоресцентного микроскопа (LeicaDRMB), снабженного интегрированной камерой ORCAII-ERG2 (Hamamatsu, Japan).
Образование комплекса СЧ с полиэпитопом А вируса краснухи продемонстрировано на фиг.10.
Реферат
Группа изобретений относится к биологии, медицине, нанотехнологии и касается получения новых носителей-платформ для образования комплексов с биологически активными соединениями. Предлагаемые носители-платформы имеют сферическую форму и получены путем термической перестройки структуры вируса табачной мозаики (ВТМ) или другого тобамовируса или другого вируса растений со спиральной структурой или их фрагментов. Носители-платформы получены также путем термической перестройки препарата белка оболочки вируса группы ВТМ (тобамовирусы) или другого фитовируса со спиральной структурой или их фрагментов. Предложены также композиции, содержащие в качестве носителя-платформы указанный сферический носитель, связанный с чужеродным белком или иным биологически активным соединением. Преимуществами новых носителей-платформ являются простота и скорость изготовления, возможность получения сферических частиц регулируемых размеров, длительность хранения, отсутствие агрегации и сохранение формы сферических частиц при хранении, центрифугировании и переосаждении, удобство формы сферических частиц для образования комплексов с целевыми соединениями. Важной особенностью новой платформы-носителя является способность адсорбировать на поверхности и формировать композиции с различными структурно и функционально неродственными белками/антигенами. 3 н.п. ф-лы, 10 ил., 1 табл.

Комментарии